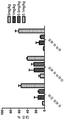
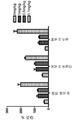
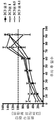
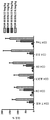
KR20170113704A - 항-인간 cd52 면역글루불린 - Google Patents
항-인간 cd52 면역글루불린 Download PDFInfo
- Publication number
- KR20170113704A KR20170113704A KR1020177026871A KR20177026871A KR20170113704A KR 20170113704 A KR20170113704 A KR 20170113704A KR 1020177026871 A KR1020177026871 A KR 1020177026871A KR 20177026871 A KR20177026871 A KR 20177026871A KR 20170113704 A KR20170113704 A KR 20170113704A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- humanized
- cdrs
- light chain
- heavy chain
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2893—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD52
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Rheumatology (AREA)
- Physics & Mathematics (AREA)
- Mycology (AREA)
- Plant Pathology (AREA)
- Epidemiology (AREA)
- Cardiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- Heart & Thoracic Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Oncology (AREA)
- Neurology (AREA)
Abstract
본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린, 마우스 단클론 항체 및 키메라 항체에 관한 것이다. 본 발명은 또한, 인간화 면역글로불린 경쇄 및 인간화 면역글로불린 중쇄에 관한 것이다. 본 발명은 또한, 인간화 면역글로불린 또는 면역글로불린 경쇄 또는 중쇄를 인코딩하는 서열을 포함하는 단리된 핵산, 재조합 벡터 및 숙주세포, 및 인간화 면역글로불린을 제조하는 방법에 관한 것이다. 인간화 면역글로불린은, 예를 들어, 자가면역 질환, 암, 비호지킨 림프종, 다발성 경화증 및 만성 림프성 백혈병을 치료하기 위한 치료 적용에서 사용될 수 있다.
Description
본 출원은 2009년 5월 13일자 미국 가출원 제61/177,837호를 우선권으로 주장한다. 이 출원의 기술내용은 본 발명에 온전히 참고로 포함된다.
CD52는 다양한 정상 및 악성 림프양 세포(예를 들어, T 및 B 세포) 상에서 풍부하게 (500,000 분자/세포) 발견되는 글리코실화된 글리코실포스파티딜이노시톨 (GPI)-고정 세포 표면 단백질이다 [참조: 예를 들어, Hale et al., J Biol regul Homeost Agents 15:386-391 (2001); Huh et al., Blood 92: Abstract 4199 (1998); Elsner et al., Blood 88:4684-4693 (1996); Gilleece et al., Blood 82:807-812 (1993); Rodig et al., Clin Cancer Res 12:7174-7179 (2006); Ginaldi et al., Leuk Res 22:185-191 (1998)]. CD52는 단핵세포, 대식세포 및 수상돌기세포와 같은 골수양 세포 상에서 더 낮은 레벨로 발현되며, 자연살해 (NK) 세포, 호중구 및 혈액학적 줄기세포 상에서는 거의 발현되지 않는다(Id.). CD52는 또한, 부고환 및 정관 내의 상피세포에 의해서 생산되며, 생식기를 통해서 통과하는 중에 정액에 의해서 획득된다[Hale et al., 2001, supra; Domagala et al., Med Sci Monit 7:325-331 (2001)]. CD52의 정확한 생물학적 기능은 명확하지 않은 채로 남아있지만, 약간의 증거는 이것이 T 세포 이동 및 공동-자극에 연루될 수 있음을 시사한다[Rowan et al., Int Immunol 7:69-77 (1995); Masuyama et al., J Exp Med 189:979-989 (1999); Watanabe et al., Clin Immunol 120:247-259 (2006)].
캠퍼스-1H (Campath-1H®) (알렘투주마브, 캠퍼스 (Campath®), 맙캠퍼스 (MabCampath®))는 강력한 시험관내 세포독성 효과(항체-의존성 세포 매개 세포독성 (ADCC) 및 보체-의존성 세포독성(CDC))를 나타내는 인간화된 항-인간 CD52 모노클로날 항체이다. 캠퍼스(Campath®)는 성숙 CD52 단백질의 카복시 말단 4 개의 아미노산 및 음전하의 GPI 고정자 (anchor)의 일부분으로 구성된 에피토프를 인식한다. 그의 상당한 세포독성 효과로 인하여 캠퍼스 (Campath®)는 생체내에서 CD52 양성 세포를 고갈시킬 수 있으며, 만성 림프구성 백혈병 (CLL)의 제1선 및 3선 치료를 위해서 승인된다. 캠퍼스(Campath®)는 류마티스성 관절염, 혈관염, 근염 및 베게너병(Wegener's disease)을 포함한 몇 가지 자가면역 질환의 치료에 있어서의 그의 유용성에 대해서 평가되었다. 그러나, 캠퍼스(Campath®)의 가장 진행된 연구는 재발 이장성 다발성 경화증(MS)의 치료에 관한 것이다. 이들 연구는 활성 비교물질(Rebif® (즉, 인터페론 베타-1a))에 비해서 재발까지의 시간에 상당한 개선을 나타내었다.
CD52를 표적으로 하는 추가의 치료학적 약제 및 접근방법에 대한 필요성이 존재한다.
발명의 요약
인간화 면역글로불린
본 발명은 인간 CD52 (huCD52)에 대한 결합 특이성을 갖는 인간화 면역글로불린에 관한 것이다. 이들은 마우스 항-인간 CD52 항체의 상보적 결정 영역 (CDR)을 포함할 수 있다. 본 발명의 인간화 면역글로불린은 다른 인간화 면역글로불린, 특히 쥣과 항-인간 CD52 항체의 CDR을 포함하는 다른 인간화 면역글로불린으로부터 상이한 아미노산 서열을 갖는다. 본 발명의 인간화 면역글로불린은 인간화 면역글로불린 Campath®과 상이하다. 일부 구현예에서, 이들은 Campath®의 CDR을 포함하는 인간화 항체에 대해 이점을 제공한다.
본원에 기재된 인간화 면역글로불린은 인간화 중쇄 및 인간화 경쇄를 포함할 수 있다. 하나의 구현예에서, 인간화 면역글로불린은 하기를 포함한다: 서열번호: 3의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 16의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 4의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 17의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 5의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 18의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 6의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 19의 하나 이상의 CDR을 포함하는 중쇄; 서열번호: 7의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 20의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 8의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 21의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 9의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 22의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 10의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 23의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 11의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 24의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 25의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 137의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 또는 서열번호: 13의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 26의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄 서열. 상기 언급한 서열번호에서 CDR은 도 2 및 3에 의해 나타내고, 본원에 제공된 표 1-6에 참조된다.
또 다른 구현예에서, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린은 하기를 포함한다: 서열번호: 27, 서열번호: 28, 서열번호: 29, 서열번호: 30, 서열번호: 31, 서열번호: 32, 서열번호: 33, 서열번호: 34, 서열번호: 35, 서열번호: 36, 서열번호: 37, 서열번호: 38, 서열번호: 39, 서열번호: 40, 서열번호: 41, 서열번호: 42, 서열번호: 43, 서열번호: 44, 서열번호: 45, 서열번호: 46, 서열번호: 47, 및 서열번호: 48 로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR (예를 들어, 모두 3개)를 포함하는 경쇄; 서열번호: 49, 서열번호: 50, 서열번호: 51, 서열번호: 52, 서열번호: 53, 서열번호: 54, 서열번호: 55, 서열번호: 56, 서열번호: 57, 서열번호: 58, 서열번호: 59, 서열번호: 60, 서열번호: 61, 서열번호: 62, 서열번호: 63, 서열번호: 64, 서열번호: 65, 서열번호: 66, 서열번호: 67, 서열번호: 68, 서열번호: 69, 서열번호: 70, 서열번호: 71, 서열번호: 72, 서열번호: 73, 서열번호: 74, 및 서열번호: 294 로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR (예를 들어, 모두 3개)를 포함하는 중쇄; 또는 그와 같은 경쇄 및 그와 같은 중쇄; 여기서, 인간화 면역글로불린은 Campath®이 아니다.
또 다른 구현예에서, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린은 하기를 포함한다: 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12, 또는 서열번호: 13의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄; 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 서열번호: 26, 또는 서열번호: 137 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 또는 그와 같은 경쇄 및 그와 같은 중쇄; 여기서, 인간화 면역글로불린은 Campath®이 아니다.
일부 구현예에서, 인간화 면역글로불린의 프레임워크 영역은 경쇄 CDR 및 중쇄 CDR을 얻은 면역글로불린의 프레임워크 영역에 대해 적어도 50%의 상동성을 갖는다. 예를 들어, 인간화 면역글로불린의 프레임워크 영역은 배선 인간 면역글로불린 서열에 대해 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 심지어 100% 동일할 수 있고. 하나의 구현예에서, 인간화 면역글로불린의 프레임워크 영역은 IgG 인간 항체 가변 영역으로부터 얻거나 유도될 수 있다. 또 하나의 구현예에서, CD52는 야생형 인간 CD52이다. 또 하나의 구현예에서, 인간화 면역글로불린은 인간 CD52에 결합하기 위해 알렘투주맙과 경쟁할 수 있고, 예를 들어, 알렘투주맙이 결합되는 에피토프과 동일하거나 그와 중첩되는 에피토프에 결합할 수 있다.
본 발명은 또한, 본 발명의 인간화 면역글로불린의 인간화 경쇄에 관한 것이다. 하나의 구현예에서, 인간화 경쇄는 서열번호: 27, 서열번호: 28, 서열번호: 29, 서열번호: 30, 서열번호: 31, 서열번호: 32, 서열번호: 33, 서열번호: 34, 서열번호: 35, 서열번호: 36, 서열번호: 37, 서열번호: 38, 서열번호: 39, 서열번호: 40, 서열번호: 41, 서열번호: 42, 서열번호: 43, 서열번호: 44, 서열번호: 45, 서열번호: 46, 서열번호: 47, 및 서열번호: 48 또는 이의 조합으로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함하고, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 인간화 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하고, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
본 발명은 또한, 본 발명의 인간화 면역글로불린의 인간화 중쇄에 관한 것이다. 하나의 구현예에서, 인간화 중쇄는 서열번호: 49, 서열번호: 50, 서열번호: 51, 서열번호: 52, 서열번호: 53, 서열번호: 54, 서열번호: 55, 서열번호: 56, 서열번호: 57, 서열번호: 58, 서열번호: 59, 서열번호: 60, 서열번호: 61, 서열번호: 62, 서열번호: 63, 서열번호: 64, 서열번호: 65, 서열번호: 66, 서열번호: 67, 서열번호: 68, 서열번호: 69, 서열번호: 70, 서열번호: 71, 서열번호: 72, 서열번호: 73, 서열번호: 74, 및 서열번호: 294, 또는 이의 조합으로 이루어진 그룹으로부터 선택되는 Ig 가변 도메인의 하나 이상의 CDR을 포함하고, 여기서, 상기 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
다른 구현예에서, 인간화 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 서열번호: 26, 또는 서열번호: 137의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하고, 여기서, 상기 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
바람직하게는, 본 발명의 인간화 면역글로불린은 본 발명의 인간화 경쇄 및 본 발명의 인간화 중쇄 둘 모두를 포함한다.
다른 구현예에서, 본 발명은 하기를 포함하는 마우스 단클론 항체와 동일한 인간 CD52 상의 에피토프에 결합하고, 또는 그 항체와 경쟁하고, 또는 그 항체와 교차경쟁하는 인간화 면역글로불린을 제공한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역. 다른 구현예에서, 인간화 면역글로불린은 그와 같은 마우스 단클론 항체가 결합하는 에피토프와 중첩하는 인간 CD52 상의 에피토프에 결합한다.
다른 구현예에서, 본 발명은 성숙한 인간 CD52 서열의 적어도 잔기 1을 포함하는 인간 CD52 상의 에피토프 (예를 들어, 서열번호: 104)에 결합하는 인간화 면역글로불린을 제공한다 (여기서, 잔기 1은 성숙한 인간 CD52 서열의 N-말단, 즉, N 말단 글리신 [G] 잔기이다; 참조 도 4). 인간화 면역글로불린은 성숙한 인간 CD52 서열의 적어도 잔기 1, 3, 4 및 5를 포함하는 에피토프에 결합할 수 있다 (이들 잔기들은 각각 글리신 [G], 아스파라긴 [N], 아스파르테이트 [D], 및 트레오닌 [T]이다). 인간화 면역글로불린은 성숙한 인간 CD52 서열의 적어도 잔기 1, 2, 3, 4 및 5를 포함하는 에피토프에 결합할 수 있다 (이들 잔기들은 각각 글리신 [G], 글루타민 [Q], 아스파라긴 [N], 아스파르테이트 [D], 및 트레오닌 [T]이다). 다른 구현예에서, 본 발명은 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 9를 포함하는 인간 CD52 상의 에피토프에 결합하는 인간화 면역글로불린을 제공한다 (이들 잔기들은 각각 글루타민 [Q], 트레오닌 [T], 및 세린 [S]이다). 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 7 (Q), 8 (T) 및 11 (P)을 포함한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 4 (D) 및 11 (P)을 포함한다.
일부 구현예에서, 본 발명은 인간 CD52에 결합하고, 하기를 포함하는 인간화 면역글로불린을 제공한다: 서열번호: 115, 서열번호: 118, 및 서열번호: 121로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 또는 서열번호: 124, 서열번호: 127, 및 서열번호: 130으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄, 또는 그와 같은 경쇄 및 그와 같은 중쇄 모두. 다른 구현예에서, 본 발명은 인간 CD52에 결합하고, 하기를 포함하는 인간화 면역글로불린을 제공한다: 서열번호: 116, 서열번호: 119, 및 서열번호: 122로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 또는 서열번호: 125, 서열번호: 128, 및 서열번호: 131로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄, 또는 그와 같은 경쇄 및 중쇄 모두. 또 추가 구현예에서, 본 발명은 인간 CD52에 결합하고 하기를 포함하는 인간화 면역글로불린을 제공한다: 서열번호: 117, 서열번호: 120, 및 서열번호: 123으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 또는 서열번호: 126, 서열번호: 129, 및 서열번호: 132로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄, 또는 그와 같은 경쇄 및 그와 같은 중쇄 모두.
어떤 구현예에서, 인간화 면역글로불린은 서열번호: 115, 서열번호: 118 및 서열번호: 121의 CDR을 포함하는 경쇄 및 서열번호: 124, 서열번호: 127 및 서열번호: 130의 CDR의 포함하는 중쇄를 포함한다. 다른 구현예에서, 인간화 면역글로불린은 서열번호: 116, 서열번호: 119 및 서열번호: 122의 CDR을 포함하는 경쇄 및 서열번호: 125, 서열번호: 128 및 서열번호: 131의 CDR을 포함하는 중쇄를 포함한다. 다른 구현예에서, 인간화 면역글로불린은 서열번호: 117, 서열번호: 120 및 서열번호: 123의 CDR을 포함하는 경쇄 및 서열번호: 126, 서열번호: 129 및 서열번호: 132의 CDR을 포함하는 중쇄를 포함한다.
본 발명의 인간화 면역글로불린은 인간화 면역글로불린 Campath®과 상이하다.
상기 언급한 서열번호: 115-132의 아미노산 서열은 이하에서 제공되고, 본원에서 제공된 바와 같이 표 1-6에서 보고된 아미노산 서열을 기반으로 한다. 이들 아미노산 서열에서,"X"는 임의의 아미노산을 나타내고, 기호 "/"는, 그 기호에 인접하여 묘사된 아미노산 둘 중 어떤 것 (또는 임의의 것)이 지정된 위치에서 존재할 수 있다는 것을 나타낸다 (예를 들어, K/R은, 리신 또는 아르기닌 잔기가 지정된 위치에서에서 존재한다는 것을 나타내고, 및 F/L/V는, 페닐알라닌, 류신 또는 발린 잔기가 지정된 위치에서 존재한다는 것을 나타낸다).
경쇄 CDR-1 서열
K/RSSQSLL/V/IXS/TN/DGXS/TYLX (서열번호: 115)
K/RSSQSLL/V/IHS/TNGXS/TYLH (서열번호: 116)
RSSQSLVHTNGNS/TYLH (서열번호: 117)
경쇄 CDR-2 서열
XVSXXXS (서열번호: 118)
XVSXRXS (서열번호: 119)
MVSXRFS (서열번호: 120)
경쇄 CDR-3 서열
XQXXH/R/KF/L/V/IXX (서열번호: 121)
SQSXH/R/KF/L/V/IPX (서열번호: 122)
SQSXHVPF/P (서열번호: 123)
중쇄 CDR-1 서열
GFXFXXYW/YMX (서열번호: 124)
GFTFXXYW/YMX (서열번호: 125)
GFTFTDYW/YMS (서열번호: 126)
중쇄 CDR-2 서열
XIRXKXBXYXTXYXXSVKG (서열번호: 127)
XIRXKXNXYTTEYXXSVKG (서열번호: 128)
FIRNKANGYTTEYXXSVKG (서열번호: 129)
중쇄 CDR-3 서열
TXXXY/F/W (서열번호: 130)
TRYXY/F/WFDY (서열번호: 131)
TRYIF/WFDY (서열번호: 132)
본 발명은 또한, 하기에 관한 것이다: 서열번호: 115, 서열번호: 118, 및 서열번호: 121로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄; 서열번호: 116, 서열번호: 119, 및 서열번호: 122로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄; 또는 서열번호: 117, 서열번호: 120, 및 서열번호: 123으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄.
본 발명은 또한, 하기에 관한 것이다: 서열번호: 124, 서열번호: 127, 및 서열번호: 130으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄; 서열번호: 125, 서열번호: 128, 및 서열번호: 131로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄; 또는 서열번호: 126, 서열번호: 129, 및 서열번호: 132로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄.
본 발명의 인간화 경쇄 및 인간화 중쇄는 인간화 면역글로불린 Campath®의 인간화 경쇄 및 인간화 중쇄와 상이하다.
본 발명의 일부 구현예에서, 본 발명의 인간화 면역글로불린 (다르게 정의될 수 있는 방식과는 무관하게, 예를 들어, 또한 CDR 중 하나 이상의 서열에 관해서 및/또는 마우스 단클론 항체 또는 다른 인간화 면역글로불린과의 교차반응에 의해 정의될 수 있지와는 무관하게)은 하기를 나타낸다: (1) 명확한 선호를 갖지 않는 글리코실화된 및 탈글리코실화된 CD52에 대한 결합; (2) 글리코실화된 CD52에 특이적인 결합; (3) 탈글리코실화된 CD52에 특이적인 결합; 또는 (4) 글리코실화된 CD52에 대해 탈글리코실화를 위한 선호되는 결합 . 어떤 구현예에서, 본 발명의 인간화 면역글로불린은 비글리코실화된 또는 탈글리코실화된 인간 CD52에 대해서보다 글리코실화된 인간 CD52에 대해 더 큰 결합 친화도를 갖는다. 사실상, 본 발명의 어떤 구현예에서, 본 발명의 인간화 면역글로불린은 글리코실화된 인간 CD52에 대해 특이적인 결합을 나타낸다. 비글리코실화된 또는 탈글리코실화된 인간 CD52에 대한 결합 친화도는 글리코시다아제를 사용하여, 예를 들어, 엔도글리코시다아제 PNGase-F를 사용하여 탈글리코실화된 성숙한 인간 CD52의 사용으로 측정될 수 있다. 본 발명의 어떤 구현예에서, 본 발명의 인간화 면역글로불린은 N 연결된 카보히드레이트 부분을 포함하는 성숙한 인간 CD52 상의 에피토프에 결합한다. 이 카보히드레이트 부분은 시아일화된(sialylted), 폴리악토사민 함유 코아-푸코실화된 4개의 촉각모양(tetraantennary) N 연결된 올리고사카라이드이다 (Treumann, A. et al., (1995) J. Biol . Chem . 270:6088-6099). 이 에피토프는 또한, 적어도 잔기 1의 성숙한 인간 CD52 서열, 적어도 잔기 3의 성숙한 인간 CD52 서열, 적어도 잔기 1, 3, 4 및 5의 성숙한 인간 CD52 서열, 또는 적어도 잔기 1, 2, 3, 4 및 5의 성숙한 인간 CD52 서열을 포함할 수 있다. 일부 구현예에서, 본 발명의 마우스 또는 키메라 항체는 이들 결합 특징 중 임의의 것을 가질 수 있다.
인간화 면역글로불린, 본 발명의 인간화 경쇄 또는 인간화 중쇄를 인코딩하는 단리된 핵산 분자가 또한, 본원의 다른 곳에서 정의된 바와 같이, 제공된다. 일부 구현예에서, 본 발명은, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 (하나 이상의) 단리된 핵산 분자이고, 여기서, 상기 인간화 경쇄는 하기를 포함한다: 서열번호: 3의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR) 및 서열번호: 16의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 4의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 17의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 5의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 18의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 6의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 19의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 7의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 20의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 8의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 21의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 9의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 22의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 10의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 23의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 11의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 24의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 25의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 137의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 또는 서열번호: 13의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 26의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄 서열.
일부 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 단리된 핵산 분자이고, 여기서, 상기 인간화 면역글로불린은 하기를 포함하는 마우스 단클론 항체와 동일한 인간 CD52 상의 에피토프에 결합한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역. 다른 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 단리된 핵산 분자이고, 여기서, 상기 인간화 면역글로불린은 그와 같은 마우스 단클론 항체가 결합하는 에피토프와 중첩하는 인간 CD52 상의 에피토프에 결합한다.
다른 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 단리된 핵산 분자이고, 여기서, 상기 인간화 면역글로불린은 성숙한 인간 CD52의 적어도 잔기 1을 포함하는 에피토프에 결합하고; 인간화 면역글로불린은 성숙한 인간 CD52의 적어도 잔기 1, 3, 4 및 5를 포함하는 에피토프에 결합하고; 인간화 면역글로불린은 성숙한 인간 CD52의 적어도 잔기 1, 2, 3, 4 및 5를 포함하는 에피토프에 결합하고; 또는 인간화 면역글로불린은 성숙한 인간 CD52의 적어도 잔기 7, 8 및 9를 포함하는 에피토프에 결합한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 11을 포함한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 4 및 11을 포함한다.
다른 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 단리된 핵산 분자이고, 여기서, 상기 인간화 면역글로불린은 하기를 포함한다: 서열번호: 115, 서열번호: 118, 및 서열번호: 121로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 124, 서열번호: 127, 및 서열번호: 130으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄; 서열번호: 116, 서열번호: 119, 및 서열번호: 122로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 125, 서열번호: 128, 및 서열번호: 131로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄; 또는 서열번호: 117, 서열번호: 120, 및 서열번호: 123으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 126, 서열번호: 129, 및 서열번호: 132로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄.
어떤 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 단리된 핵산 분자이고, 여기서, 상기 인간화 면역글로불린은 하기를 포함한다: 서열번호: 115, 서열번호: 118 및 서열번호: 121의 CDR을 포함하는 경쇄 및 서열번호: 124, 서열번호: 127 및 서열번호: 130의 CDR의 포함하는 중쇄; 서열번호: 116, 서열번호: 119 및 서열번호: 122의 CDR을 포함하는 경쇄 및 서열번호: 125, 서열번호: 128 및 서열번호: 131의 CDR을 포함하는 중쇄; 또는 서열번호: 117, 서열번호: 120 및 서열번호: 123의 CDR을 포함하는 경쇄 및 서열번호: 126, 서열번호: 129 및 서열번호: 132의 CDR을 포함하는 중쇄.
본 발명의 하나 이상의 핵산은 인간화 면역글로불린 Campath®을 인코딩하지 않는다.
다른 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 단리된 핵산 분자이고, 여기서, 상기 인간화 면역글로불린은 비글리코실화된 또는 탈글리코실화된 인간 CD52에 대해서보다 글리코실화된 인간 CD52에 대한 더 큰 결합 친화도를 가지며, 예를 들어, 글리코실화된 인간 CD52에 대해 특이적인 결합을 나타낸다. 인간화 면역글로불린은 N 연결된 카보히드레이트 부분을 포함하는 성숙한 인간 CD52 상의 에피토프에 결합할 수 있다. 이 에피토프는 또한, 성숙한 인간 CD52 서열의 적어도 잔기 1, 성숙한 인간 CD52 서열의 적어도 잔기 3, 성숙한 인간 CD52 서열의 적어도 잔기 1, 3, 4 및 5, 또는 성숙한 인간 CD52 서열의 적어도 잔기 1, 2, 3, 4 및 5를 포함할 수 있다.
다른 구현예에서, 본 발명은 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13의 인간화 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄를 인코딩하는 단리된 핵산 분자이고, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 본 발명은 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 서열번호: 26, 또는 서열번호: 137 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 인간화 중쇄를 인코딩하는 단리된 핵산 분자이고, 여기서, 상기 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
다른 구현예에서, 본 발명은 서열번호: 27, 서열번호: 28, 서열번호: 29, 서열번호: 30, 서열번호: 31, 서열번호: 32, 서열번호: 33, 서열번호: 34, 서열번호: 35, 서열번호: 36, 서열번호: 37, 서열번호: 38, 서열번호: 39, 서열번호: 40, 서열번호: 41, 서열번호: 42, 서열번호: 43, 서열번호: 44, 서열번호: 45, 서열번호: 46, 서열번호: 47, 및 서열번호: 48, 또는 이의 조합으로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함하는 인간화 경쇄를 인코딩하는 단린된 핵산 분자이고, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 본 발명은 서열번호: 49, 서열번호: 50, 서열번호: 51, 서열번호: 52, 서열번호: 53, 서열번호: 54, 서열번호: 55, 서열번호: 56, 서열번호: 57, 서열번호: 58, 서열번호: 59, 서열번호: 60, 서열번호: 61, 서열번호: 62, 서열번호: 63, 서열번호: 64, 서열번호: 65, 서열번호: 66, 서열번호: 67, 서열번호: 68, 서열번호: 69, 서열번호: 70, 서열번호: 71, 서열번호: 72, 서열번호: 73, 서열번호: 74, 및 서열번호: 294, 또는 이의 조합으로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함하는 인간화 중쇄를 인코딩하는 단리된 핵산 분자이고, 여기서, 상기 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
다른 구현예에서, 본 발명은 하기를 인코딩하는 단리된 핵산 분자이다: 서열번호: 115, 서열번호: 118, 및 서열번호: 121로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄; 서열번호: 116, 서열번호: 119, 및 서열번호: 122로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄; 또는 서열번호: 117, 서열번호: 120, 및 서열번호: 123으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄.
다른 구현예에서, 본 발명은 하기를 인코딩하는 단리된 핵산 분자이다: 서열번호: 124, 서열번호: 127, 및 서열번호: 130으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄; 서열번호: 125, 서열번호: 128, 및 서열번호: 131로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄; 또는 서열번호: 126, 서열번호: 129, 및 서열번호: 132로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄.
본 발명은 또한, 본 발명의 인간화 면역글로불린 (예를 들어, 인간화 경쇄 및 인간화 중쇄), 인간화 경쇄, 또는 인간화 중쇄를 인코딩하는 핵산을 포함하는 재조합 벡터 (예를 들어, 포유동물 세포 발현 벡터를 포함하는 발현 벡터)에 관한 것이다. 일부 구현예에서, 본 발명은 하기를 포함하는 인간화 면역글로불린을 인코딩하는 핵산을 포함하는 재조합 벡터이다: 서열번호: 3의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 16의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 4의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 17의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 5의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 18의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 6의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 19의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 7의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 20의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 8의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 21의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 9의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 22의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 10의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 23의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 11의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 24의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 25의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 137의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 또는 서열번호: 13의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 26의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄.
다른 구현예에서, 재조합 벡터는 인간화 경쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 인간화 경쇄는 하기로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함한다: 서열번호: 27, 서열번호: 28, 서열번호: 29, 서열번호: 30, 서열번호: 31, 서열번호: 32, 서열번호: 33, 서열번호: 34, 서열번호: 35, 서열번호: 36, 서열번호: 37, 서열번호: 38, 서열번호: 39, 서열번호: 40, 서열번호: 41, 서열번호: 42, 서열번호: 43, 서열번호: 44, 서열번호: 45, 서열번호: 46, 서열번호: 47, 및 서열번호: 48, 또는 이의 조합, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 재조합 벡터는 인간화 중쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 인간화 중쇄는 하기로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함한다: 서열번호: 49, 서열번호: 50, 서열번호: 51, 서열번호: 52, 서열번호: 53, 서열번호: 54, 서열번호: 55, 서열번호: 56, 서열번호: 57, 서열번호: 58, 서열번호: 59, 서열번호: 60, 서열번호: 61, 서열번호: 62, 서열번호: 63, 서열번호: 64, 서열번호: 65, 서열번호: 66, 서열번호: 67, 서열번호: 68, 서열번호: 69, 서열번호: 70, 서열번호: 71, 서열번호: 72, 서열번호: 73, 서열번호: 74, 및 서열번호: 294, 또는 이의 조합, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
일부 구현예에서, 본 발명은 핵산 분자를 포함하는 재조합 벡터, 또는 핵산 분자를 포함하는 한쌍의 재조합 벡터를 제공하고, 이는, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하고, 여기서, 상기 인간화 면역글로불린은 하기를 포함하는 마우스 단클론 항체와 동일한 인간 CD52 상의 에피토프에 결합한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역. 다른 구현예에서, 본 발명은 핵산 분자를 포함하는 재조합 벡터, 또는 핵산 분자를 포함하는 한쌍의 재조합 벡터를 제공하고, 이는, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하고, 여기서, 상기 인간화 면역글로불린은 그와 같은 마우스 단클론 항체가 결합하는 에피토프와 중첩하는 인간 CD52 상의 에피토프에 결합한다.
다른 구현예에서, 재조합 벡터는 핵산 분자를 포함하고, 또는 한쌍의 재조합 벡터는 핵산 분자를 포함하고, 이는, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하고, 여기서, 상기 인간화 면역글로불린은 성숙한 인간 CD52의 적어도 잔기 1을 포함하는 에피토프에 결합하고; 성숙한 인간 CD52의 적어도 잔기 1, 3, 4 및 5를 포함하는 에피토프에 결합하고; 성숙한 인간 CD52의 적어도 잔기 1, 2, 3, 4 및 5를 포함하는 에피토프에 결합하고; 또는 성숙한 인간 CD52의 적어도 잔기 7, 8 및 9를 포함하는 에피토프에 결합한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 11을 포함한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 4 및 11을 포함한다.
일부 구현예에서, 재조합 벡터는 핵산 분자를 포함하고, 또는 한쌍의 재조합 벡터는 핵산 분자를 포함하고, 이는, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하고, 여기서, 상기 인간화 면역글로불린은 하기를 포함한다: 서열번호: 115, 서열번호: 118, 및 서열번호: 121로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 124, 서열번호: 127, 및 서열번호: 130으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄; 서열번호: 116, 서열번호: 119, 및 서열번호: 122로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 125, 서열번호: 128, 및 서열번호: 131 로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄; 또는 서열번호: 117, 서열번호: 120, 및 서열번호: 123으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 126, 서열번호: 129, 및 서열번호: 132로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄.
어떤 구현예에서, 재조합 벡터는 핵산 분자를 포함하고, 또는 한쌍의 재조합 벡터는 핵산 분자를 포함하고, 이는, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하고, 여기서, 상기 인간화 면역글로불린은 하기를 포함한다: 서열번호: 115, 서열번호: 118 및 서열번호: 121의 CDR을 포함하는 경쇄 및 서열번호: 124, 서열번호: 127 및 서열번호: 130의 CDR의 포함하는 중쇄; 서열번호: 116, 서열번호: 119 및 서열번호: 122의 CDR을 포함하는 경쇄 및 서열번호: 125, 서열번호: 128 및 서열번호: 131의 CDR을 포함하는 중쇄; 또는 서열번호: 117, 서열번호: 120 및 서열번호: 123의 CDR을 포함하는 경쇄 및 서열번호: 126, 서열번호: 129 및 서열번호: 132의 CDR을 포함하는 중쇄.
본 발명의 재조합 벡터 또는 벡터 중 하나 이상의 핵산은 인간화 면역글로불린 Campath®을 인코딩하지 않는다.
다른 구현예에서, 재조합 벡터는 핵산 분자를 포함하고, 또는 한쌍의 재조합 벡터는 핵산 분자를 포함하고, 이는, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하고, 여기서, 상기 인간화 면역글로불린은 비글리코실화된 또는 탈글리코실화된 인간 CD52에 대해서보다 글리코실화된 인간 CD52에 대해 더 큰 결합 친화도를 가지며, 예를 들어, 글리코실화된 인간 CD52에 대해 특이적인 결합을 갖는다. 인간화 면역글로불린은 N 연결된 카보히드레이트 부분을 포함하는 성숙한 인간 CD52 상의 에피토프에 결합할 수 있다. 이 에피토프는 또한, 성숙한 인간 CD52 서열의 적어도 잔기 1, 성숙한 인간 CD52 서열의 적어도 잔기 3, 성숙한 인간 CD52 서열의 적어도 잔기 1, 3, 4 및 5, 또는 성숙한 인간 CD52 서열의 적어도 잔기 1, 2, 3, 4 및 5를 포함할 수 있다.
다른 구현예에서, 재조합 벡터는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 인간화 경쇄를 인코딩하는 핵산 분자를 포함하고, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 재조합 벡터는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 서열번호: 26, 또는 서열번호: 137 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 인간화 중쇄를 인코딩하는 핵산 분자를 포함하고, 여기서, 상기 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
다른 구현예에서, 재조합 벡터는 하기를 인코딩하는 핵산 분자를 포함한다: 서열번호: 115, 서열번호: 118, 및 서열번호: 121로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄; 서열번호: 116, 서열번호: 119, 및 서열번호: 122로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄; 또는 서열번호: 117, 서열번호: 120, 및 서열번호: 123으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 경쇄, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 재조합 벡터는 하기를 인코딩하는 핵산 분자를 포함한다: 서열번호: 124, 서열번호: 127, 및 서열번호: 130으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄; 서열번호: 125, 서열번호: 128, 및 서열번호: 131로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄; 또는 서열번호: 126, 서열번호: 129, 및 서열번호: 132로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 인간화 중쇄, 여기서, 상기 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
특정 구현예에서, 본 발명의 재조합 벡터는 발현 벡터, 예컨대 포유동물 세포 발현 벡터이다. 어떤 구현예에서, 벡터는 플라스미드 또는 바이러스 벡터 (예를 들어, 아데노바이러스 또는 AAV 벡터)이다.
본 발명은 또한, 본 발명의 인간화 면역글로불린 (인간화 경쇄 및 인간화 중쇄), 인간화 경쇄 또는 인간화 중쇄를 인코딩하는 (하나 이상의) 핵산 (예를 들어, 재조합)를 포함하는 숙주세포에 관한 것이다. 일부 구현예에서, 숙주세포는 본 발명의 재조합 벡터 (예를 들어, 포유동물 세포 발현 벡터를 포함하는 발현 벡터)를 포함한다.
특정 구현예에서, 숙주세포는 인간화 경쇄 및 인간화 중쇄를 인코딩하는 핵산 (하나 이상의 핵산)을 포함하고, 여기서, 상기 인간화 경쇄 및 인간화 중쇄는 함께 결합하여 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하고, 인간화 면역글로불린은 하기를 포함한다: 서열번호: 3의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 16의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 4의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 17의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 5의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 18의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 6의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 19의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 7의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 20의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 8의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 21의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 9의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 22의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 10의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 23의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 11의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 24의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 25의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 137의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 또는 서열번호: 13의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 26의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄 서열.
일부 구현예에서, 숙주세포는 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 핵산 분자를 포함하고, 여기서, 상기 인간화 면역글로불린은 하기를 포함하는 마우스 단클론 항체와 동일한 인간 CD52 상의 에피토프에 결합한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역. 다른 구현예에서, 숙주세포는 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 핵산 분자를 포함하고, 여기서, 상기 인간화 면역글로불린은 그와 같은 마우스 단클론 항체가 결합하는 에피토프와 중첩하는 인간 CD52 상의 에피토프에 결합한다.
다른 구현예에서, 숙주세포는 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 핵산 분자를 포함하고, 여기서, 상기 인간화 면역글로불린은 성숙한 인간 CD52의 적어도 잔기 1을 포함하는 에피토프에 결합하고; 성숙한 인간 CD52의 적어도 잔기 1, 3, 4 및 5를 포함하는 에피토프에 결합하고; 성숙한 인간 CD52의 적어도 잔기 1, 2, 3, 4 및 5를 포함하는 에피토프에 결합하고; 또는 성숙한 인간 CD52의 적어도 잔기 7, 8 및 9를 포함하는 에피토프에 결합한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 11을 포함한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 4 및 11을 포함한다.
일부 구현예에서, 숙주세포는 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 핵산 분자를 포함하고, 여기서, 상기 인간화 면역글로불린은 하기를 포함한다: 서열번호: 115, 서열번호: 118, 및 서열번호: 121로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 124, 서열번호: 127, 및 서열번호: 130으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄; 서열번호: 116, 서열번호: 119, 및 서열번호: 122로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 125, 서열번호: 128, 및 서열번호: 131로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄; 또는 서열번호: 117, 서열번호: 120, 및 서열번호: 123으로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 경쇄, 및/또는 서열번호: 126, 서열번호: 129, 및 서열번호: 132로 이루어진 그룹으로부터 선택된 하나 이상의 CDR (예를 들어, 모두 3개의 상기 CDR)을 포함하는 중쇄.
일부 구현예에서, 숙주세포는 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 핵산 분자를 포함하고, 여기서, 상기 인간화 면역글로불린은 하기를 포함한다: 서열번호: 115, 서열번호: 118 및 서열번호: 121의 CDR을 포함하는 경쇄 및 서열번호: 124, 서열번호: 127 및 서열번호: 130의 CDR의 포함하는 중쇄; 서열번호: 116, 서열번호: 119 및 서열번호: 122의 CDR을 포함하는 경쇄 및 서열번호: 125, 서열번호: 128 및 서열번호: 131의 CDR을 포함하는 중쇄; 또는 서열번호: 117, 서열번호: 120 및 서열번호: 123의 CDR을 포함하는 경쇄 및 서열번호: 126, 서열번호: 129 및 서열번호: 132의 CDR을 포함하는 중쇄.
다른 구현예에서, 숙주세포는 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린을 형성하도록 함께 결합하는 인간화 중쇄 및 인간화 경쇄를 인코딩하는 하나 이상의 핵산 분자를 포함하고, 여기서, 상기 인간화 면역글로불린은 비글리코실화된 또는 탈글리코실화된 인간 CD52에 대해서보다 글리코실화된 인간 CD52에 대해 더 큰 결합 친화도를 가지며, 예를 들어, 글리코실화된 인간 CD52에 대해 특이적인 결합을 갖는다. 인간화 면역글로불린은 N 연결된 카보히드레이트 부분을 포함하는 성숙한 인간 CD52 상의 에피토프에 결합할 수 있다. 이 에피토프는 또한, 하기를 포함할 수 있다: 성숙한 인간 CD52 서열의 적어도 잔기 1, 성숙한 인간 CD52 서열의 적어도 잔기 3, 성숙한 인간 CD52 서열의 적어도 잔기 1, 3, 4 및 5, 또는 성숙한 인간 CD52 서열의 적어도 잔기 1, 2, 3, 4 및 5.
일부 구현예에서, 숙주세포는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 인간화 경쇄를 인코딩하는 핵산 분자를 포함한다. 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 숙주세포는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 서열번호: 26, 또는 서열번호: 137 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 인간화 중쇄를 인코딩하는 핵산 분자를 포함한다. 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
일부 구현예에서, 숙주세포는 인간화 경쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 인간화 경쇄는 하기로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함한다: 서열번호: 27, 서열번호: 28, 서열번호: 29, 서열번호: 30, 서열번호: 31, 서열번호: 32, 서열번호: 33, 서열번호: 34, 서열번호: 35, 서열번호: 36, 서열번호: 37, 서열번호: 38, 서열번호: 39, 서열번호: 40, 서열번호: 41, 서열번호: 42, 서열번호: 43, 서열번호: 44, 서열번호: 45, 서열번호: 46, 서열번호: 47, 및 서열번호: 48 또는 이의 조합, 여기서, 상기 인간화 경쇄는 Campath®의 인간화 경쇄가 아니다.
다른 구현예에서, 숙주세포는 인간화 중쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 인간화 중쇄는 하기로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함한다: 서열번호: 49, 서열번호: 50, 서열번호: 51, 서열번호: 52, 서열번호: 53, 서열번호: 54, 서열번호: 55, 서열번호: 56, 서열번호: 57, 서열번호: 58, 서열번호: 59, 서열번호: 60, 서열번호: 61, 서열번호: 62, 서열번호: 63, 서열번호: 64, 서열번호: 65, 서열번호: 66, 서열번호: 67, 서열번호: 68, 서열번호: 69, 서열번호: 70, 서열번호: 71, 서열번호: 72, 서열번호: 73,서열번호: 74, 및 서열번호: 294, 또는 이의 조합, 여기서, 상기 인간화 중쇄는 Campath®의 인간화 중쇄가 아니다.
본 발명은 또한, 인간화된 면역글로불린의 발현에 적합한 조건 하에서 본 발명의 숙주세포(예를 들어, 본 발명의 인간화된 면역글로불린(예를 들어, 본 발명의 인간화된 경쇄 및 인간화된 중쇄)을 코드화한 하나 이상의 재조합 핵산을 함유하는 숙주세포)를 유지시킴으로써 인간화된 면역글로불린 쇄가 발현되고 인간화된 면역글로불린이 생산되도록 하는 단계를 포함하여 인간 CD52에 대한 결합 특이성을 갖는 인간화된 면역글로불린을 조제하는 방법에 관한 것이다. 일부의 구체예에서, 상기 방법은 추가로 인간화된 면역글로불린을 정제하거나 분리하는 단계를 추가로 포함한다. 일부의 구체예에서, 상기 방법은 추가로 정제되거나 분리된 인간화된 면역글로불린을 생리학적으로 허용되는 운반체 또는 담체와 조합하여 약제학적 조성물을 생산하는 단계를 추가로 포함한다.
본 발명은 또한, 인간화된 경쇄의 발현에 적합한 조건 하에서 본 발명의 숙주세포(예를 들어, 본 발명의 인간화된 경쇄를 코드화한 하나 또는 그 이상의 재조합 핵산을 함유하는 숙주세포)를 유지시킴으로써 인간화된 경쇄가 발현되고 인간화된 경쇄가 생산되도록 하는 단계를 포함하여 인간 CD52에 대한 결합 특이성을 갖는 인간화된 경쇄를 조제하는 방법에 관한 것이다. 일부의 구체예에서, 상기 방법은 추가로 인간화된 경쇄를 정제하거나 분리하는 단계를 추가로 포함한다.
본 발명은 또한, 인간화된 중쇄의 발현에 적합한 조건 하에서 본 발명의 숙주세포(예를 들어, 본 발명의 인간화된 중쇄를 코드화한 하나 또는 그 이상의 재조합 핵산을 함유하는 숙주세포)를 유지시킴으로써 인간화된 중쇄가 발현되고 인간화된 중쇄가 생산되도록 하는 단계를 포함하여 인간 CD52에 대한 결합 특이성을 갖는 인간화된 중쇄를 조제하는 방법에 관한 것이다. 일부의 구체예에서, 상기 방법은 추가로 인간화된 중쇄를 정제하거나 분리하는 단계를 추가로 포함한다.
본 발명은 추가로, 본 발명의 인간화된 면역글로불린(예를 들어, 본 발명의 인간화된 경쇄 및/또는 본 발명의 인간화된 중쇄) 및 생리학적으로 허용되는 운반체 또는 담체를 포함하는 약제학적 조성물에 관한 것이다. 일부의 구체예에서, 약제학적 조성물은 단위 용량 조성물을 포함한다.
본 발명은 또한, 인간 CD52에 대한 유전자이식 마우스의 림프구를 인간 CD52 유전자이식 마우스와 동일하거나 유사한 세포주(예를 들어, CD51)의 비-유전자이식 마우스에게 투여함으로써 면역된 비-유전자이식 마우스를 생산하는 단계를 포함하여 인간 CD52에 대한 결합 특이성을 갖는 모노클로날 항체를 분비하는 하이브리도마를 생산하는 방법에 관한 것이다. 면역된 비-유전자이식 마우스의 비장세포를 불멸화된 세포와 융합시킴으로써 하이브리도마를 생산한다. 상기 하이브리도마를 이것이 인간 CD52에 대한 결합 특이성을 갖는 모노클로날 항체를 분비하는 조건 하에서 유지시킨다. 일부의 구체예에서는, FACS 분석을 사용하여 인간 CD52에 대한 결합 특이성을 갖는 모노클로날 항체를 분비하는 하이브리도마를 검출한다. 또 다른 구체예에서, 유전자이식 마우스의 세포주와 비-유전자이식 마우스의 세포주는 동일하다. 특정한 구체예에서, 상기 CD52는 야생형 인간 CD52이다. 일부의 구체예에서, 상기 CD52 유전자이식 마우스 및 비-유전자이식 마우스는 CD1 마우스이다. 일부의 구체예에서, 면역화를 위해서 사용된 림프구는 인간 CD52 유전자이식 마우스의 비장으로부터 수득된다. 일부의 구체예에서, 불멸화된 세포는 SP2/0 Ag14 세포 및 NS1 골수종 세포로 구성된 그룹으로부터 선택된다. 본 발명은 또한, 본 발명의 방법에 의해서 생산된 하이브리도마에 관한 것이다. 임의로, 하이브리도마에 의해서 분비된 모노클로날 항체를 수집하고, 더 정제(예를 들어, 실질적으로 정제 및 분리)할 수 있다. 다른 구체예에서, 상기 방법은 추가로 상기 하이브리도마에 의해서 분비된 모노클로날 항체의 뉴클레오타이드 서열을 결정하는 단계를 추가로 포함한다.
본 발명은 또한, 환자에게 본 발명의 인간화된 면역글로불린의 유효량을 투여하는 것을 포함하여 필요한 환자에게서 자가면역 질환(예를 들어, 다발성 경화증 (MS), 류마티스성 관절염 (RA) [참조: 예를 들어, Nature Reviews Drug Discovery 6: 75-92 (2007)], 혈관염 [참조: 예를 들어, Rheumatology 39:229-237 (2000)], 베체트병 (BD) [참조: 예를 들어, Rheumatology 42:1539-1544 (2003)], 루푸스 및 소아지방변증 [Vivas, S., et al., N. Engl . J. Med ., 354(23):2514-2515 (2006)], 혈관염, 건선, 근염, 경피증, 재생불량성 빈혈, 및 대장염)을 치료하는 방법에 관한 것이다.
또 다른 관점에서는, 본 발명의 인간화된 면역글로불린의 유효량을 하나 이상의 면역억제제와 함께 투여하여 필요한 환자를 고형 기관 이식 [Agarwal et al., Transplant Immunol ., 20:6-11 (2008)] 또는 CD34+ 줄기세포 이식[Burt et al., The Lancet, published online January 30, 2009]을 위해서 준비시킬 수 있다.
본 발명은 또한, 환자에게 본 발명의 인간화된 면역글로불린의 유효량을 투여하는 것을 포함하는, 치료가 필요한 환자의 암을 치료하는 방법에 관한 것이다.
본 발명은 또한, 환자에게 본 발명의 인간화된 면역글로불린의 유효량을 투여하는 것을 포함하는, 치료가 필요한 환자의 다발성 경화증을 치료하는 방법에 관한 것이다.
본 발명은 또한, 환자에게 본 발명의 인간화된 면역글로불린의 유효량을 투여하는 것을 포함하는, 치료가 필요한 환자의 만성 림프구성 백혈병을 치료하는 방법에 관한 것이다.
본 발명의 인간화된 면역글로불린의 투여는 인간화된 면역글로불린 그 자체의 투여(예를 들어, 약제학적 조성물로), 인간화된 면역글로불린을 코드화한 하나 이상의 재조합 벡터의 투여, 또는 인간화된 면역글로불린을 코드화한 하나 이상의 핵산 (예를 들어, 하나 또는 그 이상의 재조합 벡터)을 포함하고 인간화된 면역글로불린을 발현하는 숙주세포의 투여를 포함할 수 있다.
본 발명은 또한, 시험관내에서 환자 샘플을 본 발명의 인간화된 면역글로불린으로 시험하는 것을 포함하여, 자가면역 질환(예를 들어, 다발성 경화증, 루푸스, 혈관염), 암(예를 들어, 백혈병 (예를 들어, 만성 림프구성 백혈병) 및 림프종 (예를 들어, 비-호지킨 림프종), 이식(예를 들어, 고형 기관 이식 (예를 들어, 신장 이식) 및 줄기세포 이식)으로 구성된 그룹으로부터 선택된 질병을 진단하는 방법에 관한 것이다.
본 발명은 또한, 자가면역 질환 (예를 들어, 다발성 경화증, 류마티스성 관절염 및 루푸스), 암, 림프구 과증식성 상태(예를 들어, B-세포 만성 림프구성 백혈병과 같은 백혈병 및 비-호지킨 림프종과 같은 림프종을 포함한 T 또는 B 세포 악성종양)와 같은 본 명세서에 기술된 질환 또는 장애를 치료하는데 사용하는 것과 같은 질병의 치료 및/또는 진단에 사용하기 위한 것과 같은 의약으로 사용하기 위한 본 발명의 인간화된 면역글로불린(예를 들어, 본 발명의 인간화된 경쇄 및/또는 본 발명의 인간화된 중쇄를 포함), 본 발명의 재조합 벡터, 또는 본 발명의 숙주세포에 관한 것이다 [참조: 예를 들어, Lundin, J., et al., Blood, 101:4267-4272 (2003); Rodig, SJ., et al., Clinical Cancer Research, 12(23):7174-7179 (2006)]. 본 발명은 또한, 본 명세서에 기술된 질환 또는 장애(예를 들어, 자가면역 질환(예를 들어, 다발성 경화증, 루푸스, 혈관염), 암(예를 들어, 백혈병(예를 들어, 만성 림프구성 백혈병) 및 림프종(예를 들어, 비-호지킨 림프종)), 및 이식(예를 들어, 고형 기관 이식(예를 들어, 신장 이식) 및 줄기 세포 이식))를 치료하기 위한 의약의 제조를 위한 본 발명의 인간화된 면역글로불린, 인간화된 경쇄 또는 인간화된 중쇄, 본 발명의 재조합 벡터 또는 본 발명의 숙주 세포의 용도에 관한 것이다.
본 발명은 추가로, 잔기 36 (Y) 및 46 (L)(카바트 넘버링 (Kabat numbering))이 치환된 인간 Vk2-A18b 유전자를 이용하는 인간 경쇄 골격구조(framework) 부위를 포함하는 인간화된 항-인간 CD52 항체를 제공한다. 일부의 구체예에서, 잔기 36은 V 또는 L이고, 잔기 46은 R이다. 본 발명은 또한, 잔기 47 (W)(카바트 넘버링)이 치환된 인간 VH 3-23 유전자를 이용하는 인간 중쇄 골격구조 부위를 포함하는 인간화된 항-인간 CD52 항체를 제공한다. 일부의 구체예에서는, 잔기 47 (W) 및 49 (S)(카바트 넘버링) 둘 다가 치환된다. 일부의 구체예에서, 잔기 47은 L이고, 잔기 49는 S이다. 다른 구체예에서, 잔기 47은 L이고, 잔기 49는 A이다.
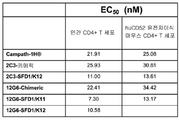
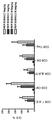
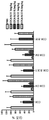
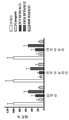
일부의 구체예에서, 본 발명의 인간화된 항-인간 CD52 항체는 실시예 29에 기술된 시험과 같은 세포 결합 시험에서 측정된 것으로서, 캠퍼스-1H(Campath-1H®) 항체에 대한 EC50 값보다 2-배 더 작은 EC50 값을 갖는다. 다양한 구체예에서, 인간화된 항-인간 CD52 항체는 11 nM 또는 그 미만의 EC50 값을 갖는다.
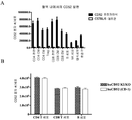
일부의 구체예에서, 본 발명의 인간화된 항-인간 CD52 항체는 캠퍼스-1H (Campath-1H®)로 치료한 인간 환자로부터 유래하는 항-캠퍼스-1H 항체의 존재 하에서 세포 상의 CD52에 결합한다. 즉, 세포 상의 CD52에 대한 본 발명의 인간화된 항-인간 CD52 항체의 결합은 이러한 항-캠퍼스-1H 항체의 존재 하에서 CD52에 대한 캠퍼스-1H 결합에 비해 감소되지 않거나, 이러한 항-캠퍼스-1H 항체의 존재 하에서 CD52에 대한 캠퍼스-1H 결합에 비해 덜 감소된다.
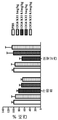
본 발명은 추가로, 본 발명에서 제공된 인간화된 항-인간 CD52 항체의 혈액 및/또는 비장 내에서의 림프구 고갈 프로필을 갖는 인간화된 항-인간 CD52 항체를 제공한다.
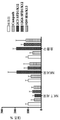
일부의 구체예에서, 본 발명의 인간화된 항-인간 CD52 항체는 대상체의 혈청 내에서 TNF알파, IL-6 및 MCP-1 중의 하나 또는 그 이상의 순환 레벨을 증가시킨다.
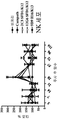
일부의 구체예에서, 본 발명의 인간화된 항-인간 CD52 항체는 적어도 30일, 적어도 50일, 적어도 60일, 적어도 70일, 적어도 80일, 또는 80일을 초과하는 기간 동안 대상체에서 림프구 레벨을 감소시킨다.
일부의 구체예에서, 본 발명의 인간화된 항-인간 CD52 항체는 마우스 EAE 모델에서 임상 스코어에 의해서 측정되는 바와 같이, 질병의 시작을 지연시키고/시키거나 질병의 중증도를 감소시킨다.
일부의 구체예에서, 본 발명의 인간화된 항-인간 CD52 항체는 실시예 69 또는 70에 기술된 시험과 같은 면역원성 시험에서 캠퍼스-1H (Campath-1H®)보다 면역원성이 작다.
마우스
단클론
면역글로불린
본 발명은 또한, 인간 CD52에 대해 결합 특이성을 갖는 마우스 단클론 항체 (마우스 단클론 면역글로불린)에 관한 것이다. 하나의 구현예에서, 본 발명은 하기를 포함하는, 인간 CD52에 대해 결합 특이성을 갖는 마우스 단클론 항체에 관한 것이다: 서열번호: 3을 포함하는 경쇄 및 서열번호: 16을 포함하는 중쇄; 서열번호: 4를 포함하는 경쇄 및 서열번호: 17을 포함하는 중쇄; 서열번호: 5를 포함하는 경쇄 및 서열번호: 18을 포함하는 중쇄; 서열번호: 6을 포함하는 경쇄 및 서열번호: 19를 포함하는 중쇄; 서열번호: 7을 포함하는 경쇄 및 서열번호: 20을 포함하는 중쇄; 서열번호: 8를 포함하는 경쇄 및 서열번호: 21을 포함하는 중쇄; 서열번호: 9를 포함하는 경쇄 및 서열번호: 22을 포함하는 중쇄; 서열번호: 10를 포함하는 경쇄 및 서열번호: 23을 포함하는 중쇄; 서열번호: 11를 포함하는 경쇄 및 서열번호: 24를 포함하는 중쇄; 서열번호: 12를 포함하는 경쇄 및 서열번호: 25을 포함하는 중쇄; 또는 서열번호: 13을 포함하는 경쇄 및 서열번호: 26을 포함하는 중쇄 .
하나의 구현예에서, 인간 CD52에 대해 결합 특이성을 갖는 마우스 단클론 항체는 하기로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역을 포함한다: 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12, 및 서열번호: 13, 또는 selected 로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 및 서열번호: 26, 또는 그와 같은 경쇄 가변 영역 및 그와 같은 중쇄 가변 영역 모두.
본 발명은 또한, 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13 의 가변 영역을 포함하는 마우스 면역글로불린 경쇄에 관한 것이다.
본 발명은 또한, 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 또는 서열번호: 26 의 가변 영역을 포함하는 마우스 면역글로불린 중쇄에 관한 것이다.
바람직하게는, 본 발명의 마우스 단클론 항체는 본 발명의 마우스 항체 경쇄 및 본 발명의 마우스 항체 중쇄 모두를 포함한다. 일부 구현예에서, 본 발명은 하기를 포함하는 마우스 단클론 항체와 동일한 인간 CD52 상의 에피토프에 결합하는 마우스 단클론 면역글로불린을 제공한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역. 다른 구현예에서, 본 발명은 그와 같은 마우스 단클론 항체가 결합하는 에피토프와 중첩하는 인간 CD52 상의 에피토프에 결합하는 마우스 단클론 면역글로불린을 제공한다.
다른 구현예에서, 본 발명은 성숙한 인간 CD52 서열의 적어도 잔기 1을 포함하는 인간 CD52 상의 에피토프에 결합하는 마우스 단클론 면역글로불린을 제공한다. 마우스 단클론 면역글로불린은 성숙한 인간 CD52 서열의 적어도 잔기 1, 3, 4 및 5를 포함하는 에피토프에 결합할 수 있고, 성숙한 인간 CD52 서열의 적어도 잔기 1, 2, 3, 4 및 5를 포함하는 에피토프에 결합할 수 있고, 또는 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 9를 포함하는 에피토프에 결합할 수 있다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 11을 포함한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 4 및 11을 포함한다.
본 발명은 또한, 본 발명의 마우스 단클론 면역글로불린, 마우스 면역글로불린 경쇄 또는 마우스 면역글로불린 중쇄를 인코딩하는 단리된 핵산 분자에 관한 것이다. 일부 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 마우스 단클론 면역글로불린을 형성하도록 함께 결합하는 마우스 면역글로불린 중쇄 및 마우스 면역글로불린 경쇄를 인코딩하는 단리된 핵산 분자에 관한 것이고, 여기서, 상기 마우스 면역글로불린 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하고, 또는 마우스 면역글로불린 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 및 서열번호: 26 로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하고, 또는 그와 같은 경쇄 및 그와 같은 중쇄 모두를 포함한다.
일부 구현예에서, 단리된 핵산은 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12, 및 서열번호: 13로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하는 마우스 면역글로불린 경쇄를 인코딩한다.
다른 구현예에서, 단리된 핵산은 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 및 서열번호: 26로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하는 마우스 면역글로불린 중쇄를 인코딩한다.
본 발명은 또한, 본 발명의 마우스 단클론 면역글로불린 (예를 들어, 마우스 면역글로불린 경쇄 및 마우스 면역글로불린 중쇄), 마우스 면역글로불린 경쇄, 또는 마우스 면역글로불린 중쇄를 인코딩하는 핵산을 포함하는 재조합 벡터 (예를 들어, 포유동물 세포 발현 벡터를 포함하는 발현 벡터)에 관한 것이다. 일부 구현예에서, 본 발명은 핵산을 포함하는 재조합 벡터, 또는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역, 또는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 및 서열번호: 26 로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역, 또는 그와 같은 경쇄 가변 영역과 중쇄 가변 영역 모두를 포함하는 마우스 단클론 면역글로불린을 인코딩하는 핵산을 포함하는 한쌍의 재조합 벡터이다.
다른 구현예에서, 재조합 벡터는 마우스 면역글로불린 경쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 마우스 면역글로불린 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13을 포함한다.
다른 구현예에서, 재조합 벡터는 마우스 면역글로불린 중쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 마우스 면역글로불린 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 또는 서열번호: 26을 포함한다.
다른 구현예에서, 재조합 벡터는 마우스 면역글로불린 경쇄 및 마우스 면역글로불린 중쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 마우스 면역글로불린 경쇄 및 마우스 면역글로불린 중쇄는 인간 CD52에 대해 결합 특이성을 갖는 마우스 단클론 면역글로불린을 형성하도록 함께 결합한다. 하나의 구현예에서, 마우스 면역글로불린 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하고, 마우스 면역글로불린 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 및 서열번호: 26로 이루어진 그룹으로부터 선택되는 가변 영역을 포함한다.
특정 구현예에서, 본 발명의 재조합 벡터는 발현 벡터, 예컨대 포유동물 세포 발현 벡터이다. 어떤 구현예에서, 벡터는 플라스미드 또는 바이러스 벡터 (예를 들어, 아데노바이러스 또는 AAV 벡터)이다.
본 발명은 또한, 본 발명의 마우스 단클론 면역글로불린 (마우스 면역글로불린 경쇄 및 마우스 면역글로불린 중쇄), 마우스 면역글로불린 경쇄 또는 마우스 면역글로불린 중쇄를 인코딩하는 하나 이상의 핵산을 포함하는 숙주세포에 관한 것이다. 예를 들어, 일부 구현예에서, 숙주세포는 본 발명의 재조합 벡터 (예를 들어, 발현 벡터, 포유동물 세포 발현 벡터)를 포함한다.
일부 구현예에서, 숙주세포는 마우스 면역글로불린 경쇄 및 마우스 면역글로불린 중쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 마우스 면역글로불린 경쇄 및 마우스 면역글로불린 중쇄는 인간 CD52에 대해 결합 특이성을 갖는 마우스 단클론 면역글로불린을 형성하도록 함께 결합하고, 마우스 면역글로불린 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 및 서열번호: 13로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하고/하거나 마우스 면역글로불린 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 및 서열번호: 26 로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하고, 또는 이들 모두를 포함한다.
일부 구현예에서, 숙주세포는 마우스 면역글로불린 경쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 마우스 면역글로불린 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역을 포함한다.
일부 구현예에서, 숙주세포는 마우스 면역글로불린 중쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 마우스 면역글로불린 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 및 서열번호: 26 로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역을 포함한다.
본 발명은 또한, 마우스 단클론 면역글로불린의 제조 방법에 관한 것으로서, 상기 방법은 마우스 단클론 면역글로불린의 발현에 적합한 조건 하에서, 본 발명의 숙주세포 (예를 들어, 본 발명의 마우스 단클론 면역글로불린 (예를 들어, 마우스 면역글로불린 경쇄 및 마우스 면역글로불린 중쇄)을 인코딩하는 하나 이상의 재조합 핵산 (예를 들어, 재조합 벡터)를 함유하는 숙주세포)를 유지하고, 이로써 마우스 단클론 면역글로불린 사슬은 발현되고, 마우스 단클론 면역글로불린이 생성되는 것을 포함한다. 일부 구현예에서, 상기 방법은 마우스 단클론 면역글로불린의 정제 또는 단리하는 것을 추가로 포함한다.
본 발명은 또한, 마우스 단클론 면역글로불린의 경쇄를 제조하는 방법에 관한 것으로서, 상기 방법은 상기 마우스 면역글로불린 경쇄의 발현에 적합한 조건 하에서, 본 발명의 마우스 면역글로불린 경쇄를 인코딩하는 핵산을 함유하는 본 발명의 숙주세포를 유지하고, 이로서 경쇄가 발현되는 것을 포함한다. 일부 구현예에서, 상기 방법은 경쇄의 정제 또는 단리하는 것을 추가로 포함한다.
본 발명은 또한, 마우스 단클론 면역글로불린의 경쇄를 제조하는 방법에 관한 것으로서, 상기 방법은, 상기 마우스 면역글로불린 중쇄의 발현에 적합한 조건 하에서, 본 발명의 마우스 면역글로불린 중쇄를 인코딩하는 핵산을 함유하는 본 발명의 숙주세포를 유지하고, 이로써 마우스 면역글로불린 중쇄가 발현되는 것을 포함한다. 일부 구현예에서, 상기 방법은 마우스 면역글로불린 중쇄의 정제 또는 단리하는 것을 추가로 포함한다.
본 발명은 또한, 질환 (예를 들어, 자가면역 질환 (예를 들어, 다발성 경화증, 루푸스, 혈관염), 암 (예를 들어, 백혈병 (예를 들어, 만성 림프성 백혈병), 및 림프종 (예를 들어, 비호지킨 림프종)), 및 이식 (예를 들어, 고형 장기 이식 (예를 들어, 신장 이식) 및 줄기세포 이식)')을 진단하는 방법에 관한 것으로서, 상기 방법은 환자 시료를 실험실 내에서, 본 발명의 마우스 단클론 면역글로불린으로 검정하는 것을 포함한다 (예를 들어, Lundin, J., et al., 혈액, 101:4267-4272 (2003); Rodig, SJ, et al., Clin . 암 res., 12(23);7174-717179 (2006)).
키메라
면역글로불린
본 발명은 또한, 인간 CD52에 대해 결합 특이성을 갖는 키메라 면역글로불린에 관한 것이다. 그와 같은 키메라 면역글로불린은 본 발명의 임의의 마우스 단클론 면역글로불린의 가변 영역을 포함할 수 있다. 하나의 구현예에서, 본 발명의 키메라 면역글로불린은 하기를 포함한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역.
본 발명은 또한, 하기를 포함하는, 인간 CD52에 대해 결합 특이성을 갖는 키메라 항체에 관한 것이다: 서열번호: 3의 경쇄 가변 영역, 서열번호: 4의 경쇄 가변 영역, 서열번호: 5의 경쇄 가변 영역, 서열번호: 6의 경쇄 가변 영역, 서열번호: 7의 경쇄 가변 영역, 서열번호: 8의 경쇄 가변 영역, 서열번호: 9의 경쇄 가변 영역, 서열번호: 10의 경쇄 가변 영역, 서열번호: 11의 경쇄 가변 영역, 서열번호: 12의 경쇄 가변 영역 및 서열번호: 13의 경쇄 가변 영역으로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역 서열, 및/또는 서열번호: 16의 중쇄 가변 영역, 서열번호: 17의 중쇄 가변 영역, 서열번호: 18의 중쇄 가변 영역, 서열번호: 19의 중쇄 가변 영역, 서열번호: 20의 중쇄 가변 영역, 서열번호: 21의 중쇄 가변 영역, 서열번호: 22의 중쇄 가변 영역, 서열번호: 23의 중쇄 가변 영역, 서열번호: 24의 중쇄 가변 영역, 서열번호: 25의 중쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역으로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역 서열.
본 발명은 또한, 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12, 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하는 키메라 경쇄에 관한 것이다.
본 발명은 또한, 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 및 서열번호: 26으로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하는 키메라 중쇄에 관한 것이다.
바람직하게는, 본 발명의 키메라 면역글로불린은 본 발명의 키메라 경쇄 of 본 발명 및 본 발명의 키메라 중쇄 모두를 포함한다.
일부 구현예에서, 본 발명은 하기를 포함하는 마우스 단클론 항체와 동일한 인간 CD52 상의 에피토프에 결합하는 키메라 면역글로불린을 제공한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역. 다른 구현예에서, 키메라 면역글로불린은 그와 같은 마우스 단클론 항체가 결합하는 에피토프와 중첩하는 인간 CD52 상의 에피토프에 결합한다.
다른 구현예에서, 본 발명은 성숙한 인간 CD52 서열의 적어도 잔기 1을 포함하는 인간 CD52 상의 에피토프에 결합하는 키메라 면역글로불린을 제공한다. 키메라 면역글로불린은 성숙한 인간 CD52 서열의 적어도 잔기 1, 3, 4 및 5를 포함하는 에피토프에 결합할 수 있고, 성숙한 인간 CD52 서열의 적어도 잔기 1, 2, 3, 4 및 5를 포함하는 에피토프에 결합할 수 있고, 또는 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 9를 포함하는 인간 CD52 상의 에피토프에 결합할 수 있다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 7, 8 및 11을 포함한다. 일부 구현예에서, 에피토프는 성숙한 인간 CD52 서열의 적어도 잔기 4 및 11을 포함한다.
발명은 또한, 본 발명의 키메라 면역글로불린, 키메라 경쇄 또는 키메라 중쇄를 인코딩하는 단리된 핵산 분자에 관한 것이다. 일부 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 키메라 면역글로불린을 형성하도록 함께 결합하는 키메라 중쇄 및 키메라 경쇄를 인코딩하는 단리된 핵산 분자 (하나 이상의 핵산 분자)이고, 여기서, 상기 키메라 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12, 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하고/하거나 키메라 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 및 서열번호: 26로 이루어진 그룹으로부터 선택되는 가변 영역을 포함한다.
일부 구현예에서, 본 발명은 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13의 가변 영역을 포함하는 키메라 경쇄를 인코딩하는 단리된 핵산 분자이다.
일부 구현예에서, 본 발명은 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 또는 서열번호: 26 의 가변 영역을 포함하는 키메라 중쇄를 인코딩하는 단리된 핵산 분자이다.
본 발명은 또한, 본 발명의 키메라 면역글로불린 (키메라 경쇄 및 키메라 중쇄), 키메라 경쇄, 또는 키메라 중쇄를 인코딩하는 핵산을 포함하는 재조합 벡터 (예를 들어, 발현 벡터, 포유동물 세포 발현 벡터)에 관한 것이다. 일부 구현예에서, 본 발명은 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역; 또는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 및 서열번호: 26 로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역; 또는 그와 같은 경쇄 및 중쇄 모두를 포함하는 키메라 면역글로불린을 인코딩하는 핵산을 포함하는 재조합 벡터 (또는 핵산을 포함하는 한쌍의 재조합 벡터) 이다.
다른 구현예에서, 재조합 벡터는 키메라 경쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 키메라 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13의 가변 영역을 포함한다.
다른 구현예에서, 재조합 벡터는 키메라 중쇄를 인코딩하는 핵산을 포함하고, 여기서, 상기 키메라 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 또는 서열번호: 26의 가변 영역을 포함한다.
특정 구현예에서, 본 발명의 재조합 벡터는 발현 벡터, 예컨대 포유동물 세포 발현 벡터이다. 어떤 구현예에서, 벡터는 플라스미드 또는 바이러스 벡터 (예를 들어, 아데노바이러스 또는 AAV 벡터)이다.
본 발명은 또한, 본 발명의 키메라 면역글로불린 (키메라 경쇄 및 키메라 중쇄), 키메라 경쇄 또는 키메라 중쇄를 인코딩하는 하나 이상의 핵산 (예를 들어, 하나 이상의 재조합 벡터)를 포함하는 숙주세포에 관한 것이다. 예를 들어, 일부 구현예에서, 숙주세포는 본 발명의 재조합 벡터 (예를 들어, 발현 벡터, 포유동물 세포 발현 벡터)를 포함한다.
일부 구현예에서, 숙주세포는 키메라 경쇄 및 키메라 중쇄를 인코딩하는 재조합 핵산 (또는 한쌍의 재조합 핵산)을 포함하고, 여기서, 상기 키메라 경쇄 및 키메라 중쇄는 인간 CD52에 대해 결합 특이성을 갖는 키메라 면역글로불린을 형성하도록 함께 결합하고, 키메라 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 가변 영역을 포함하고; 및/또는 키메라 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 및 서열번호: 26로 이루어진 그룹으로부터 선택되는 가변 영역을 포함한다.
일부 구현예에서, 숙주세포는 키메라 경쇄를 인코딩하는 재조합 핵산을 포함하고, 여기서, 상기 키메라 경쇄는 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12, 및 서열번호: 13 로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역을 포함한다.
일부 구현예에서, 숙주세포는 키메라 중쇄를 인코딩하는 재조합 핵산을 포함하고, 여기서, 상기 키메라 중쇄는 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25 및 서열번호: 26 로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역을 포함한다.
본 발명은 또한, 키메라 면역글로불린의 제조 방법에 관한 것으로서, 이 방법은 키메라 면역글로불린의 발현에 적합한 조건 하에서, 본 발명의 숙주세포 (예를 들어, 본 발명의 키메라 면역글로불린 (예를 들어, 키메라 경쇄 및 키메라 중쇄)를 인코딩하는 하나 이상의 단리된 핵산을 함유하는 숙주세포)를 유지하고, 이로써 키메라 면역글로불린 사슬은 발현되고, 키메라 면역글로불린이 생성되는 것을 포함한다. 일부 구현예에서, 상기 방법은 키메라 면역글로불린의 정제 또는 단리를 추가로 포함한다.
본 발명은 또한, 키메라 경쇄의 제조 방법에 관한 것으로서, 상기 방법은 상기 키메라 경쇄의 발현에 적합한 조건 하에서, 본 발명의 숙주세포 (예를 들어, 본 발명의 키메라 경쇄를 인코딩하는 핵산을 함유하는 숙주세포)를 유지하고, 이로써 키메라 경쇄가 발현되고 키메라 경쇄가 생성되는 것을 포함한다. 일부 구현예에서, 상기 방법은 키메라 경쇄의 정제 또는 단리를 추가로 포함한다.
본 발명은 또한, 키메라 중쇄의 제조 방법에 관한 것으로서, 상기 방법은 상기 키메라 중쇄의 발현에 적합한 조건 하에서, 본 발명의 숙주세포 (예를 들어, 본 발명의 키메라 중쇄를 인코딩하는 핵산을 함유하는 숙주세포)를 유지하고, 이로써 키메라 중쇄가 발현되고 키메라 중쇄가 생성되는 것을 포함한다. 일부 구현예에서, 상기 방법은 키메라 중쇄의 정제 또는 단리를 추가로 포함한다.
본 발명은 또한, 자가면역 질환 (예를 들어, 다발성 경화증, 루푸스, 혈관염), 암 (예를 들어, 백혈병 (예를 들어, 만성 림프성 백혈병), 및 림프종 (예를 들어, 비호지킨 림프종)) 로 이루어진 그룹으로부터 선택되는 질환, 및 이식 (예를 들어, 고형 장기 이식 (예를 들어, 신장 이식) 및 줄기세포 이식'을 진단하는 방법에 관한 것으로서, 상기 방법은 환자 시료를 실험실 내에서, 본 발명의 키메라 면역글로불린으로 검정하는 것을 포함한다.
본 발명의 추가 구현예는 하기와 같이 기재된다. 하나의 양태에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 경쇄 및 중쇄는 하기에서 발견되는 3개의 상보적 결정 영역 (CDR)을 포함한다: 서열번호: 3 및 16 각각; 서열번호: 4 및 17 각각; 서열번호: 5 및 18 각각; 서열번호: 6 및 19 각각; 서열번호: 7 및 20 각각; 서열번호: 8 및 21 각각; 서열번호: 9 및 22 각각; 서열번호: 10 및 23 각각; 서열번호: 11 및 24 각각; 서열번호: 12 및 25 각각; 서열번호: 12 및 137 각각; 또는 서열번호: 13 및 26 각각. 일부 구현예에서, 본 발명은 상기 단클론 항체 또는 항원 결합 부분과 동일한 인간 CD52 상의 에피토프에 결합하는 항체에 관한 것이다. 일부 구현예에서, 본 발명은 상기 단클론 항체 또는 항원 결합 부분과 경쟁하는 항체에 관한 것이다. 일부 구현예에서, 본 발명은 상기 단클론 항체 또는 항원 결합 부분과 교차경쟁하는 항체에 관한 것이다.
일부 구현예에서, 임의의 상기 항체 또는 항원 결합 부분은 서열번호: 104를 포함하는 아미노산 서열에 결합한다. 일부 관련 구현예에서, 상기 항체 또는 이의 부분의 서열번호: 104에의 결합은 서열번호: 104의 잔기들 4, 7, 8, 또는 11의 하나 이상에서 알라닌 치환에 의해 감소될 수 있다.
일부 구현예에서, 항체는 인간화 항체, 마우스 항체, 또는 키메라 항체이다. 어떤 구현예에서, 상기 항체의 중쇄의 프레임워크 영역은 VH3-72 또는 VH3-23 인간 배선 서열을 이용하고, 상기 항체의 경쇄의 프레임워크 영역은 VK2 A18b 인간 배선 서열을 이용한다.
일부 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체는 중쇄 (H)-CDR1, H-CDR2, H-CDR3, 및 경쇄 (L)-CDR1, L-CDR2, 및 L-CDR3을 포함하고, 그의 아미노산 서열은 하기이다: 서열번호: 51, 59, 69, 29, 36, 및 43 각각; 서열번호: 50, 60, 69, 29, 37, 및 43 각각; 서열번호: 50, 61, 68, 29, 38, 및 43 각각; 서열번호: 50, 61, 69, 29, 36, 및 43 각각; 서열번호: 50, 62, 69, 29, 39, 및 43 각각; 서열번호: 52, 61, 70, 30, 40, 및 43 각각; 서열번호: 53, 63, 71, 31, 36, 및 44 각각; 서열번호: 54, 64, 71, 31, 36, 및 45 각각; 서열번호: 55, 63, 72, 31, 36, 및 46 각각; 서열번호: 56, 65, 73, 32, 41, 및 47 각각; 서열번호: 56, 65, 294, 32, 41, 및 47 각각; 또는 서열번호: 56, 66, 74, 33, 41, 및 48 각각.
일부 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 경쇄 및 중쇄는 하기의 아미노산 서열을 포함한다: 서열번호: 3 및 16 각각; 서열번호: 4 및 17 각각; 서열번호: 5 및 18 각각; 서열번호: 6 및 19 각각; 서열번호: 7 및 20 각각; 서열번호: 8 및 21 각각; 서열번호: 9 및 22 각각; 서열번호: 10 및 23 각각; 서열번호: 11 및 24 각각; 서열번호: 12 및 25 각각; 또는 서열번호: 13 및 26 각각.
일부 구현예에서, 본 발명은 단클론 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄 및 경쇄는 하기의 아미노산 서열을 포함한다: 서열번호: 103 및 102 각각; 서열번호: 136 및 138 각각; 서열번호: 137 및 138 각각; 서열번호: 139 및 147 각각; 서열번호: 149 및 155 각각; 서열번호: 149 및 156 각각; 서열번호: 158 및 165 각각; 서열번호: 158 및 166 각각; 서열번호: 159 및 165 각각; 서열번호: 159 및 166 각각; 서열번호: 161 및 166 각각; 또는 서열번호: 163 및 166 각각. 일부 구현예에서, 본 발명은 상기 단클론 항체 또는 항원 결합 부분과 동일한 인간 CD52 상의 에피토프에 결합하는 항체에 관한 것이다. 일부 구현예에서, 본 발명은 상기 단클론 항체 또는 항원 결합 부분과 경쟁하는 항체에 관한 것이다. 일부 구현예에서, 본 발명은 상기 단클론 항체 또는 항원 결합 부분과 교차경쟁하는 항체에 관한 것이다.
어떤 구현예에서, 본 발명은 단클론 인간화 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄 및 경쇄는 신호 서열없이, 서열번호: 272 및 273의 아미노산 서열 각각을 포함한다. 어떤 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄 및 경쇄는 신호 서열없이, 서열번호: 274 및 275의 아미노산 서열 각각을 포함한다. 어떤 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄 및 경쇄는 신호 서열없이, 서열번호: 276 및 278의 아미노산 서열 각각을 포함한다. 어떤 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄 및 경쇄는 신호 서열없이, 서열번호: 277 및 278의 아미노산 서열 각각을 포함한다. 어떤 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄 및 경쇄는 신호 서열없이, 서열번호: 279 및 280의 아미노산 서열 각각을 포함한다. 어떤 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄 및 경쇄는 신호 서열없이, 서열번호: 281 및 282의 아미노산 서열 각각을 포함한다. 본 발명은 또한, 이들 인간화 항체 중 하나와 경쟁 또는 교차경쟁하는 이들 인간화 항체 및 항체 중 하나와 동일한 CD52 상의 에피토프에 결합하는 항체를 제공한다. 관련 구현예에서, 본 발명은 하나의 그와 같은 인간화 항체 및 약제학적으로 허용가능한 담체를 포함하는 조성물을 제공한다.
일부 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 경쇄는 서열번호: 102, 138, 145-148, 153-157, 및 164-168로 이루어진 그룹으로부터 선택되는 아미노산 서열을 포함한다. 어떤 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 경쇄는 신호 서열없이, 서열번호: 273, 275, 278, 280, 및 282로 이루어진 그룹으로부터 선택되는 아미노산 서열을 포함한다. 어떤 구현예에서, 본 발명은 존재하더라도 신호 서열없이, 서열번호: 102, 138, 145-148, 153-157, 164-168, 273, 275, 278, 280, 및 282로 이루어진 그룹으로부터 선택되는 아미노산 서열을 포함하는 항체 경쇄 또는 이의 부분에 관한 것이다.
일부 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄는 서열번호: 103, 136, 137, 139-144, 149-152, 및 158-163으로 이루어진 그룹으로부터 선택되는 아미노산 서열을 포함한다. 어떤 구현예에서, 본 발명은 단클론 항-인간 CD52 항체 또는 이의 항원 결합 부분에 관한 것이고, 여기서, 상기 항체의 중쇄는 신호 서열없이, 서열번호: 272, 274, 276, 277, 279, 및 281로 이루어진 그룹으로부터 선택되는 아미노산 서열을 포함한다. 어떤 구현예에서, 본 발명은 존재하더라도 신호 서열없이, 서열번호: 103, 136, 137, 139-144, 149-152, 158-163, 272, 274, 276, 277, 279, 및 281로 이루어진 그룹으로부터 선택되는 아미노산 서열을 포함하는 항체 중쇄 또는 이의 부분에 관한 것이다.
일부 구현예에서, 임의의 상기 항체는 IgG, IgM, IgA, IgD 또는 IgE 분자일 수 있다. 어떤 구현예에서, 상기 IgG는 IgG1, IgG2, IgG3, 또는 IgG4이다.
일부 구현예에서, 임의의 상기 항원 결합 부분은 단쇄 항체, Fv, Fab, Fab', F(ab')2, Fd, 단쇄 Fv 분자 (scFv), 2특이적 단쇄 Fv 다이머, 디아바디, 도메인 결실 항체 또는 단일 도메인 항체 (dAb)일 수 있다.
본 발명은 또한, 임의의 상기 항체 또는 항원 결합 부분에 관한 것이고, 여기서, 상기 항체 또는 항원 결합 부분은 T 또는 B 림프구, 또는 이들 모두를 고갈시키고; 우선적으로 B 림프구와 비교하여 T 림프구를 고갈시키고; TNF-알파, IL-6, 또는 MCP-1의 순환 혈청 수준을 증가시키고 (예를 들어, 적어도 5%, 적어도 10%, 적어도 50%, 적어도 100% 또는 적어도 200%까지); CD52 발현 세포의 항체 의존성 세포 매개 세포독성 (ADCC)를 매개하고; CD52 발현 세포의 보체 의존성 세포독성 (CDC)을 매개하고; 중화 항체의 존재에도 불구하고 인간 환자에서 인간 CD52를 알렘투주맙에 결합시키고; 및/또는 promotes in 인간 T 및/또는 B 세포에서 세포내 신호전달을 촉진한다 (참고, 예를 들어, Hederer et al., International Immunology 12:505-616 (2000); Watanabe et al., Clinical Immunology 120: 247-259 (2006)).
본 발명은 또한, 임의의 상기 항체의 중쇄 또는 이의 항원 결합 부분, 또는 경쇄 또는 이의 항원 결합 부분을 인코딩하는 단리된 핵산에 관한 것이다. 일부 구현예에서, 상기 단리된 핵산은 신호 펩타이드를 인코딩하는 서열없이 서열번호: 283, 285, 287, 288, 290, 및 292 로 이루어진 그룹으로부터 선택되는 중쇄 뉴클레오티드 서열, 또는 상기 뉴클레오티드 서열; 신호 펩타이드를 인코딩하는 서열없이 서열번호: 284, 286, 289, 291, 및 293 로 이루어진 그룹으로부터 선택되는 경쇄 뉴클레오티드 서열, 또는 상기 뉴클레오티드 서열; 또는 이들 모두 상기 중쇄 뉴클레오티드 서열 및 상기 경쇄 뉴클레오티드 서열을 포함한다. 어떤 구현예에서, 상기 단리된 핵산은 하기로 이루어진 그룹으로부터 선택되는 중쇄 뉴클레오티드 서열 및 경쇄 뉴클레오티드 서열을 포함한다: 서열번호: 283 및 서열번호: 284 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 285 및 서열번호: 286 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 287 및 서열번호: 289 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 288 및 서열번호: 289 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 290 및 서열번호: 291 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 및 서열번호: 292 및 서열번호: 293 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음.
본 발명은 또한, 치료가 필요한 환자를 치료하기 위한 의약의 제조를 위한, 중쇄 뉴클레오티드 서열을 포함하는 단리된 핵산 및 경쇄 뉴클레오티드 서열을 포함하는 단리된 핵산의 용도에 관한 것이고, 여기서, 상기 중쇄 뉴클레오티드 서열 및 경쇄 뉴클레오티드 서열은 하기로 이루어진 그룹으로부터 선택된다: 서열번호: 283 및 서열번호: 284 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 285 및 서열번호: 286 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 287 및 서열번호: 289 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 288 및 서열번호: 289 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 서열번호: 290 및 서열번호: 291 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 및 서열번호: 292 및 서열번호: 293 각각, 모두는 신호 펩타이드를 인코딩하는 서열 없음.
본 발명은 또한, 상기 항체 중의 어떤 것의 (1) 중쇄 또는 그의 항원 결합 부분을 코드화한 핵산 서열, (2) 경쇄 또는 그의 항원 결합 부분을 코드화한 핵산 서열, 또는 (3) 둘 다를 포함하는 재조합 벡터에 관한 것이다. 본 발명은 추가로, 상기 항체 중의 어떤 것의 중쇄 또는 그의 항원 결합 부분을 코드화한 제1 핵산 서열(상기 제1 핵산 서열은 발현 조절 요소에 작동적으로 연결된다) 및 상기 항체의 경쇄 또는 그의 항원 결합 부분을 코드화한 제2 핵산 서열(상기 제2 핵산 서열은 발현 조절 요소에 작동적으로 연결된다)을 포함하는 숙주세포에 관한 것이다. 본 발명은 상기 숙주세포를 항체 또는 그의 일부분의 발현에 적절한 조건 하에서 유지시키는 단계를 포함하여 항-인간 CD52 항체 또는 그의 항원 결합 부분을 제조하는 방법에 관한 것이며, 또한 상기 항체 또는 그의 일부분을 분리하는 단계를 추가로 포함하는 상기의 방법에 관한 것이다.
본 발명은 청구항 1-24 중의 어느 하나에 따르는 모노클로날 항체 또는 그의 항원 결합 부분, 및 약제학적으로 허용되는 운반체 또는 담체를 포함하는 조성물에 관한 것이다.
일부의 구체예에서, 본 발명은 환자에게 상기 항체 중의 어떤 것 또는 항원 결합 부분, 또는 상기 조성물의 유효량을 투여하는 것을 포함하여, 필요한 환자를 치료하는 방법에 관한 것이다. 특정의 구체예에서, 상기 환자는 이식을 받고 있는 중이다.
일부의 구체예에서, 본 발명은 환자에게 상기 항체 중의 어떤 것 또는 항원 결합 부분, 또는 상기 조성물의 유효량을 투여하는 것을 포함하여, 필요한 환자에게서 자가면역 질환을 치료하는 방법에 관한 것이다. 특정의 구체예에서, 자가면역 질환은 예를 들어, 다발성 경화증, 류마티스성 관절염, 또는 전신 홍반성 루푸스이다.
일부의 구체예에서, 본 발명은 환자에게 상기 항체 중의 어떤 것 또는 항원 결합 부분, 또는 상기 조성물의 유효량을 투여하는 것을 포함하여, 필요한 환자에게서 암을 치료하는 방법에 관한 것이다. 특정의 구체예에서, 암은 예를 들어, 비-호지킨 림프종과 같은 림프종; B-세포 만성 림프구성 백혈병과 같은 백혈병; T 세포 악성종양(여기에서, 항체 또는 그의 일부분은 B 세포에 비해 T 세포를 선택적으로 고갈시킨다); 또는 고형 종양이다.
일부의 구체예에서는, 상기 치료방법 중의 어떤 것이라도 환자에게 호중구 또는 NK 세포 자극제를 투여하는 것을 추가로 포함한다. 특정의 구체예에서, 상기 약제는 G-CSF 또는 GM-CSF이다. 일부의 구체예에서는, 상기 치료방법 중의 어떤 것이라도 환자에게 T 조절성 세포 자극제를 투여하는 것을 추가로 포함한다. 특정의 구체예에서, 상기 약제는 라파마이신이다.
일부의 구체예에서, 본 발명은 환자에게 상기 항체 중의 어떤 것 또는 항원 결합 부분의 유효량을 투여하는 것을 포함하여, 필요한 환자에게서 혈관형성을 억제하는 방법에 관한 것이다. 특정의 구체예에서, 환자는 고형 종양을 갖는다. 특정의 구체예에서, 환자는 혈관신생을 갖는다. 특정의 구체예에서, 상기 혈관신생은 눈에 존재한다.
본 발명은 또한, 필요한 환자에게서 자가면역 질환을 치료하기 위한 의약의 제조를 위한 상기 항체 중의 어떤 것 또는 항원 결합 부분의 용도에 관한 것이다. 추가로, 본 발명은 필요한 환자에게서 암을 치료하기 위한 의약의 제조를 위한 상기 항체 중의 어떤 것 또는 항원 결합 부분의 용도에 관한 것이다. 본 발명은 이식이 필요한 환자를 치료하기 위한 의약의 제조를 위한 상기 항체 중의 어떤 것 또는 항원 결합 부분의 용도에 관한 것이다. 본 발명은 필요한 환자에게서 혈관신생을 치료하기 위한 의약의 제조를 위한 상기 항체 중의 어떤 것 또는 항원 결합 부분의 용도에 관한 것이다.
본 발명은 또한, 의약으로서의 상기 항체 중의 어떤 것 또는 항원 결합 부분의 용도에 관한 것이다.
발명의 상세한 설명
CD52는 모든 인간 말초 혈액 림프구 및 단핵세포/매크로파지의 적어도 95% 상에 존재하는 글리코실화된, GPI 고정 세포 표면 풍부한 단백질 (대략 5 x l05 항체 결합 부위/세포)이지만 (Hale G, et al.," The CAMPATH-1 antigen (CD52)," Tissue Antigens, 35:178-327 (1990)), 조혈 줄기세포가 없다. 본 발명은 인간 CD52 또는 이의 부분에 대해 결합 특이성 (예를 들어, 에피토프 특이성)을 갖고, 또는 그것에의 결합에 대해 선택적인 면역글로불린 (항-CD52)에 관한 것이다. 이들 면역글로불린은 CD52에 특이적으로 결합하고, 비-CD52 분자에 특이적으로 결합하지 않는다. 항-CD52 면역글로불린 및 CD52 사이의 특이적 결합은, 예를 들어, CD52+ 세포에 대한 면역글로불린의 결합의 EC50을 유세포 분석기로 측정하여 결정될 수 있다. 특이적 결합은 예를 들어, 0.5 - 10 ㎍/ml의 EC50 범위로 나타낼 수 있다. 본원에 기재된 면역글로불린은 단리된 및/또는 재조합 인간 CD52인 인간 CD52의 모두 또는 일부에 대해, 또는 인간 CD52를 발현시키는 세포의 표면 상에서 결합 특이성을 가질 수 있고. 또한, 면역글로불린은 하기 중 하나 이상의 형태에 대한 결합 특이성을 가질 수 있다: 인간 CD52 (예를 들어, 글리코실화된 인간 CD52; 탈글리코실화된 인간 CD52; 비글리코실화된 인간 CD52; 및 대립유전자 돌연변이체). 하나의 구현예에서, 면역글로불린은 천연 발생적, 외생 또는 야생형 인간 CD52에 대한 결합 특이성을 갖는다. 야생형 인간 CD52의 아미노산 서열은 도 4에 나타나 있다 (서열번호: 104).
본원에 기재된 면역글로불린은 공지된 기술을 사용하여 정제 또는 단리될 수 있다. "정제" 또는 "단리된" 면역글로불린은 기원의 공급원 (예를 들어, 세포의 상청액; 혼합물에서, 예컨대 라이브러리 중 면역글로불린의 혼합물에서) 기원의 공급원의 분자 (예를 들어, 펩타이드)로부터 분리되었고, 본원에 기재된 방법 또는 다른 적당한 방법으로 얻은 면역글로불린을 포함한다. 단리된 면역글로불린은 실실적으로 순수한 (본질적으로 순수한) 면역글로불린, 및 화학 합성, 재조합 기술 및 이의 조합으로 생성된 면역글로불린을 포함한다.
더욱 상세하게는, 본 발명은 면역글로불린의 항-인간 CD52 면역글로불린, 항원 결합 단편 (즉, 부분들), 면역글로불린의 경쇄, 면역글로불린의 중쇄, 및 이들 경쇄 또는 중쇄의 단편에 관한 것이다. 본 발명은 또한, 성숙한 면역글로불린 또는 이의 사슬, 예컨대 글리코실화된 면역글로불린에 관한 것이다. 본 발명은 또한, 미성숙 또는 전구체 면역글로불린 (단백질) 에 관한 것이다. 본 발명은 또한, 이들 미성숙 또는 성숙한 단백질 모두를 인코딩하는 핵산 분자 (예를 들어, 벡터), 그와 같은 핵산을 포함하는 벡터 및 숙주세포, 미성숙 및 성숙한 단백질을 생성하는 방법 및 면역글로불린을 사용하는 방법에 관한 것이다.
본 발명의 면역글로불린은 치료가 필요한 대상체 (예를 들어, 인간 환자)를 치료하여 필요한 바와 같이 대상체의 림프구 및 다른 CD52+ 세포 (예를 들어, CD52+ 암성 세포)를 고갈시키기 위해 사용될 수 있다. 본원에 사용된 바와 같이," 림프구 고갈"은 순환 림프구, 예를 들어, T 세포 및/또는 B 세포의 집단을 감소시켜서, 림프구감소증이 생기는 면역억제의 유형이다. 본 발명의 면역글로불린은 또한, 하기에서 추가로 기재된 바와 같이 혈관신생을 억제하기 위해 사용될 수 있다. 본 발명의 면역글로불린은 또한, 예를 들어, 생체외 적용에서 조혈 줄기세포를 풍부하게 하기 위해 사용될 수 있다 (참고, 예를 들어, Lim et al., J. Hematology & Oncology 1:19 (2008)).
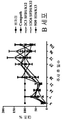
연 발생적 면역글로불린은 일반적인 코어 구조를 가지며, 여기서, 2개의 동일한 경쇄 (약 24 kD) 및 2개의 동일한 중쇄 (약 55 또는 70 kD)는 테트라머를 형성한다. 각 사슬의 아미노 말단부는 가변 (V) 영역으로서 공지되어 있고, 각 사슬의 잔기의 더 보전적 불변 (C) 영역으로부터 구별될 수 있다. 경쇄의 가변 영역 (소위 VL 도메인으로 지칭함) 내에 J 영역으로 공지된 C 말단부가 있다. 중쇄의 가변 영역 (소위 VH 도메인으로 지칭함) 내에, J 영역 외에 D 영역이 있다. 면역글로불린 중 대부분의 아미노산 서열 변이는 항원 결합에 직접 관여하는 초가변 영역 또는 상보적 결정 영역 (CDR)로서 공지된 V 영역에서 3개의 별개의 위치로 한정된다. 아미노 말단으로부터 유래하여, 이들 영역은 CDR1, CDR2 및 CDR3 각각으로 지칭한다. CDR은 더 보존적 프레임워크 영역 (FRs)에 의해 지탱되고 있다. 아미노 말단으로부터 유래하여, 이들 영역은 FR1, FR2, FR3 및 FR4 각각으로 지칭된다. CDR 및 FR 영역의 위치 및 넘버링 시스템은 하기에 의해 정의되었다: Kabat et al. (Kabat, E.A., et al., Sequences of Proteins of Immumological Interest, 제5판, U.S. Department of Health 및 Human Services, U.S. Government Printing Office (1991), Chothia & Lesk, Canonical Structures for the Hypervariable Regions of Immunoglobulins, J. Mol. Biol., 196, 901-917 (1987), 및 IMGT® 넘버링 시스템 (The International ImMunoGeneTics Iinformation Ssystem®, Lefranc, M.-P., The Immunologist 7, 132-136 (1999). 육안검사 및 서열 분석은 CDR 경계를 확인하기 위해 수행될 수 있다. 본 발명에 대해, CDR 서열은 카밧(Kabat) 시스템 및 IMGT 시스템 모두를 사용하여 정의되고; 즉, 상기 2개의 시스템에 의해 정의된 CDR이 완전히 중첩되는 것이 아닐 때, 시스템 모두에 의해 정의된 서열로부터의 모든 잔기들을 포함한다.
인간 면역글로불린은 중쇄의 이소타입에 따라 클래스 및 서브클래스로 나누어질 수 있다. 클래스는 IgG, IgM, IgA, IgD 및 IgE를 포함하고, 여기서, 중쇄는 감마 (γ), 뮤 (μ), 알파 (α), 델타 (δ) 또는 엡실론 (ε) 유형 각각이다. 서브클래스는 IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2를 포함하고, 여기서, 중쇄는 γ1, γ2, γ3, γ4, α1 및 α2 유형 각각이다. 선택된 클래스 또는 서브클래스의 인간 면역글로불린 분자는 카파 (κ) 또는 람다 (λ) 경쇄를 함유할 수 있다. 참고 예를 들면, Celular and Molecular Immunology, Wonsiewicz, M.J., Ed., Chapter 45, pp. 41-50, W. B. Saunders Co., Philadelphia, PA 91991); Nisonoff, A., Introduction to Molecular Immunology, 2nd Ed., Chapter 4, pp. 45-65, Sinauer Associates, Inc., Sunderland, MA (1984).
본원에 사용된 바와 같이, 상호교환적으로 사용된 용어 "면역글로불린" 및 "항체"란, 총 항체 및 항원 결합 단편을 의미한다 (즉," 항원 결합 부분" - 2개의 용어는, 본원에서 달리 지적되지 않으면, 상호교환적으로 사용된다). 항체의 항원 결합 단편은, 예를 들어, 단쇄 항체, Fv 단편, Fab 단편, Fab' 단편, F(ab')2 단편, Fd 단편, 단쇄 Fv 분자 (scFv), 2특이적 단쇄 Fv 다이머 (PCT/US92/09665), 디아바디, 도메인 결실 항체 및 단일 도메인 항체 (dAbs)의 형식일 수 있다. 참고 예를 들면, Nature Biotechnology 22(9):1161-1165 (2004)). 또한, 본 발명 내에 VH 및/또는 VL를 포함하는 항원 결합 분자가 있다. VH의 경우에, 분자는 또한, CH1, 힌지, CH2 및 CH3 영역 중 하나 이상을 포함할 수 있다. 그와 같은 단쇄 항체는 또한, 항체의 용어 "항원 결합 부분" 내에 포함되는 것으로 의도된다.
항체 부분 또는 단편은 효소성 분열 또는 재조합 기술로 생성될 수 있다. 예를 들어, 파파인 또는 펩신 분열은 Fab 또는 F(ab')2 단편 각각을 산출하기 위해 사용될 수 있다. 항체는 또한, 항체 유전자를 사용하여 다양한 끝을 자른 형태로 생성될 수 있고, 여기서, 하나 이상의 종결 코돈은 자연 종결 부위의 상류로 도입되었다. 예를 들어, F(ab')2 단편의 중쇄를 인코딩하는 재조합 구조물은 중쇄의 CH1 도메인 및 힌지 영역을 인코딩하는 DNA 서열을 포함하는 것으로 설계될 수 있다. 바람직한 항원 결합 단편은 야생형 인간 CD52에 대해 결합 특이성을 갖는다.
다른 양태에서, 본 발명은 본 명세서에서 기재된 바와 같이, 항체 또는 이의 부분의 돌연변이체를 제공하고, 여기서, 상기 돌연변이체는 인간 CD52에 특이적으로 결합하지만, (예를 들어, CDR 영역, FR 영역, 또는 불변 도메인에서) 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10개의 아미노산 치환까지 참조 항체 또는 이의 부분과 상이하다. 예를 들어, 돌연변이체 항체는 중쇄, 중쇄 가변 도메인, 경쇄, 또는 경쇄 가변 도메인에서 참조 항체와 적어도 90%, 적어도 91%, 적어도 93%, 적어도 95%, 적어도 97% 또는 적어도 99% 동일하다.
서열 동일성으로도 불리는 폴리펩타이드에 대한 서열 유사성 또는 동일성은 서열 분석 소프트웨어를 사용하여 전형적으로 측정된다. 단백질 분석 소프트웨어는 보존적 아미노산 치환을 포함하는, 다양한 치환, 결실 및 다른 변형에 배당된 유사성을 측정을 사용하여 유사한 서열을 맞춘다. 예를 들어, GCG는 유기체의 상이한 종으로부터의 밀접한 폴리펩타이드, 예컨대 상동의 폴리펩타이드 사이 또는 야생형 단백질 및 이의 뮤테인 사이의 서열 상동성 또는 서열 동일성을 측정하기 위해 디폴트 파라미터와 함께 사용될 수 있는 프로그램, 예컨대 "갭(Gap," 및 "최량적합(Bestfit)"를 함유한다. 참고, 예를 들어, GCG 버젼 6.1. 폴리펩타이드 서열은 또한 프로그램 (GCG 버젼 6.1)인, 디폴트 또는 추천된 파라미터를 사용하는 FASTA를 사용하여 비교될 수 있다. FASTA (예를 들어, FASTA2 및 FASTA3)는 질의(query) 및 검색 서열 사이의 최상의 중첩의 영역의 정렬 및 서열 동일성 %를 제공한다 (Pearson, Methods Enzymol. 183:63-98 (1990); Pearson, Methods Mol. Biol. 132:185-219 (2000)). 본 발명의 서열을, 상이한 유기체로부터의 다수의 서열을 함유하는 데이터 베이스와 비교할 때의 다른 바람직한 알고리듬은디폴트 파라미터를 사용하는 컴퓨터 프로그램 BLAST, 특히 blastp 또는 tblastn이다. 참고, 예를 들어, Altschul et al., J. Mol. Biol. 215:403-410 (1990); Altschul et al., Nucleic Acids Res. 25:3389-402 (1997); 이는 참고로 본 명세서에 통합된다.
본 발명에 따라, 만들어질 수 있는 아미노산 치환의 하나의 유형은 화학적으로 반응할 수 있는 항체 중 하나 이상의 시스테인을, 비제한적으로, 알라닌 또는 세린과 같은 다른 잔기로 변화시키는 것이다. 하나의 구현예에서, 비-정규적인 시스테인의 치환이 있다. 치환은 가변 도메인의 CDR 또는 프레임워크 영역에서 또는 항체의 불변 도메인에서 행해질 수 있다. 일부 구현예에서, 시스테인은 정규적이다. 만들어질 수 있는 아미노산 치환의 다른 유형은 항체 중 잠재적인 단백질가수분해 부위를 제거하는 것이다. 그와 같은 부위는 가변 도메인의 CDR 또는 프레임워크 영역에서 또는 항체의 불변 도메인에서 생길 수 있다. 시스테인 잔기들의 치환 및 단백질가수분해 부위의 제거는 항체 생성물에서 이질성의 위험을 감소시킬 수 있고, 따라서, 그의 동질성은 증가한다. 아미노산 치환의 다른 유형은 아스파라긴-글리신 쌍을 제거하는 것이고, 이는 잔기들의 하나 또는 둘 모두를 변경시켜서, 잠재적인 탈아미드화 부위를 형성한다. 본 발명의 다른 양태에서, 항체는, 예를 들어, PCT 공보 WO98/52976 및 WO00/34317에 기재된 기술을 사용하여 면역원성을 감소시키기 위해 탈면역화될 수 있다.
본 발명에 따른 돌연변이체의 하나로 만들어 질 수 있는 아미노산 치환의 다른 유형은 보존적 아미노산 치환이다. "보존적 아미노산 치환"은, 아미노산 잔기가 유사한 화학 특성 (예를 들어, 변화 또는 소수성)을 갖는 측쇄 R 그룹을 갖는 다른 아미노산 잔기에 의해 치환되는 것이다. 일반적으로, 보존적 아미노산 치환은 단백질의 기능적 특성을 실질적으로 변화시키지 않을 것이다. 2개 이상의 아미노산 서열이 보존적 치환에 의해 서로 상이한 경우에, 서열 동일성 % 또는 유사성의 정도는 치환의 보존적 본성을 교정하는 방향으로 조절될 수 있다. 이 조절을 수행하는 수단은- 당해 분야의 숙련가에게 공지되어 있다. 참고, 예를 들면, Pearson, Methods Mol. Biol. 243:307-31 (1994).
유사한 화학 특성을 갖는 측쇄를 갖는 아미노산 그룹의 예는 하기를 포함한다: 1) 지방족 측쇄: 글리신, 알라닌, 발린, 류신, 및 이소류신; 2) 지방족-히드록실 측쇄: 세린 및 트레오닌; 3) 아미드 함유 측쇄: 아스파라긴 및 글루타민; 4) 방향족 측쇄: 페닐알라닌, 티로신, 및 트립토판; 5) 염기성 측쇄: 리신, 아르기닌, 및 히스티딘; 6) 산성 측쇄: 아스파르트산 및 글루탐산; 및 7) 황 함유 측쇄: 시스테인 및 메티오닌. 바람직한 보존적 아미노산 치환 그룹은 하기이다: 발린-류신-이소류신, 페닐알라닌-티로신, 리신-아르기닌, 알라닌-발린, 글루타메이트-아스파르테이트, 및 아스파라긴-글루타민. 대안적으로, 보존적 교체는 하기에 개시된 PAM250 log와 같은 매트릭스에서 (+) 값을 갖는 어떤 변화이다: Gonnet et al., Science 256:1443-45 (1992). "완만한 보존적" 교체는 PAM250 log와 같은 매트릭스에서 (-)가 아닌 값을 갖는 어떤 변화이다.
어떤 구현예에서, 본 발명의 항체 또는 항원 결합 부분에 대한 아미노산 치환은 하기인 것이다: (1) 단백질가수분해에 대한 민감성을 감소시키고, (2) 산화에 대한 민감성을 감소시키고, (3) 예를 들어, 항체의 ADCC 및 CDC 활성을 향상시키기 위해 단백질 복합체를 형성하기 위한 결합 친화도를 변경시키고, (4) 그와 같은 유사체의 다른 물리화학 또는 기능적 특성을 부여하거나 수정하지만, 인간 CD52에 대한 특이적 결합을 여전히 유지하고, (5) C 말단 리신을 제거하고, 및 (6) 글리코실화 부위를 부가 또는 제거한다.
일 양태에서, 본 발명은 본 발명의 항체의 중쇄 또는 경쇄, 또는 중쇄 또는 경쇄의 가변 도메인 함유 부분인 신규하고 독창적인 폴리펩타이드를 제공한다. 그와 같은 폴리펩타이드가 유용한 것은, 한 쪽 (경 또는 중) 항체 사슬과 파트너를 이루어 CD52 결합 분자를 형성할 수 있기 때문이다.
인간화 면역글로불린
독창적인 마우스 항-인간 CD52 항체의 CDR을 포함하는 인간화 면역글로불린이 본원에 기재되어 있다. 하나의 구현예에서, 인간화 면역글로불린은 인간화 경쇄 및 인간화 중쇄를 포함하고, 이는 항-CD52 항체 (예를 들어, Campath®)의 다른 인간화 버전의 아미노산 서열과 상이한 CDR 아미노산 서열을 갖는다.
용어 "인간화 면역글로불린"은, 본원에 사용된 바와 같이, 공여자 항체 (예를 들어, 쥣과 항-CD52 항체)로도 지칭되는 비-인간 기원의 항-CD52 항체의 하나 이상의 경쇄 CDR (CDR1, CDR2 및 CDR3) 및 하나 이상의 중쇄 CDR (CDR1, CDR2 및 CDR3)을 포함하는 사슬을 포함하는 면역글로불린, 및 인간 기원의 면역글로불린의 적어도 일부 (예를 들어, 프레임워크 변화 유무와 함께 CDR 그라프프된 항체와 같은, 인간 기원의 경쇄 및/또는 중쇄로부터 유래된 프레임워크 영역, 또는 프레임워크 및 불변 영역)를 의미한다. 본 발명의 인간화 면역글로불린은 Campath®에서 존재하는 적어도 하나의 CDR로부터 (예를 들어, 상응하는 CDR로부터) 상이한 적어도 하나의 CDR을 포함한다. 참고, 예를 들어, Cabilly et al., 미국 특허 번호 4,816,567; Cabilly et al., 유럽 특허 번호 0,125,023 B1; Boss et al., 미국 특허 번호 4,816,397; Boss et al., 유럽 특허 번호 0,120,694 B1; Neuberger, M.S. et al., WO 86/01533; Neuberger, M.S. et al., 유럽 특허 번호 0,194,276 B1; Winter, 미국 특허 번호 5,225,539; Winter, 유럽 특허 번호 0,239,400 B1; Padlan, E.A. et al., 유럽 특허 출원 번호 0,519,596 Al. 또한 참조, Ladner et al., 미국 특허 번호 4,946,778; Huston, 미국 특허 번호 5,476,786; 및 Bird, R.E. et al., Science, 242: 423-426 (1988)), 단쇄 항체 관련. 일부 구현예에서, 인간화 면역글로불린은 탈면역화된 항체이다. 참고, 예를 들어, Carr et al., 미국 특허 번호 7,264,806, 잠재적인 T-세포 에피토프의 수를 감소시키기 위해 변형된 탈면역화된 면역글로불린 관련, 이로써 인간에의 투여시 면역 반응을 유도하기 위한 면역글로불린에 대한 경향을 감소시킨다.
특정 구현예에서, 인간화 면역글로불린은 하기 쥣과 단클론 항체: 마우스 8G3.25.3.5, 마우스 4G7.F3, 마우스 9D9.A2, 마우스 11C11.C5, 마우스 3G7.E9, 마우스 5F7.1.1.4, 마우스 12G6.15.1.2, 마우스 23E6.2.2.1, 마우스 2C3.3.8.1, 마우스 7F11.1.9.7, 및 마우스 4B10.1.2.4 중 하나 이상의 하나 이상의 경쇄 CDR 및 하나 이상의 중쇄 CDR을 포함한다 .
또 다른 구현예에서, 인간화 면역글로불린은 Campath®의 친화도와 유사하거나 더 나은 친화도로 인간 CD52에 결합한다. 특정 구현예에서, 본 발명의 인간화 면역글로불린은 본 발명의 쥣과 항-인간 CD52 항체의 결합 특이성을 가지며 (예를 들어, 동일 또는 유사한 에피토프 특이성을 갖는, 인간 CD52에 대한 특이성을 갖는다) 및/또는 동일한 억제 기능을 갖는다. 인간화 면역글로불린은 쥣과 항-인간 CD52 항체 또는 본원에 기재된 인간화 항-인간 CD52 항체의 결합 특이성 및/또는 억제 활성, 및/또는 쥣과 항-인간 CD52 항체 또는 본원에 기재된 인간화 항-인간 CD52 항체의 에피토프 특이성을 가질 수 있다 (예를 들어, 쥣과 항-인간 CD52 항체, 또는 CD52에 결합하기 위한 다른 인간화 항-CD52 항체 (예를 들어, Campath®)와 경쟁할 수 있고/있거나 쥣과 또는 인간화 항-인간 CD52 항체의 억제 기능을 가질 수 있다). 특정 구현예에서, 인간화 면역글로불린은 마우스 항체 8G3, 4G7, 9D9, 11C11, 3G7, 5F7, 12G6, 23E6, 2C3, 7F11, 및 4B10 중 어느 하나의 결합 특이성, 에피토프 특이성 및/또는 억제 활성을 갖는다.
인간 기원 (예를 들어, 프레임워크 영역; 불변 영역)인 인간화 면역글로불린 또는 면역글로불린 사슬의 부분은 임의의 적당한 인간 면역글로불린 또는 면역글로불린 사슬로부터 유래될 수 있다. 예를 들어, 인간화 또는 키메라 항체 중 인간 불변 영역 또는 이의 부분은 인간 κ 또는 λ 경쇄 유전자로부터, 및/또는 대립유전자 돌연변이체를 포함하는 인간 γ (예를 들어, γ1, γ2, γ3, γ4), μ, α (예를 들어, α1, α2), δ 또는 ε 중쇄 유전자로부터 유래될 수 있다. 특정 불변 영역 (예를 들어, IgG1), 돌연변이체 또는 이의 부분은 효과기 기능을 맞게 하기 위해 선택될 수 있다. 예를 들어, 돌연변이화된 불변 영역 (변형)은 Fc 수용체에 대한 결합 및/또는 보체를 고정하는 능력을 최소화하기 위해 면역글로불린 또는 면역글로불린 사슬에 혼입될 수 있다. (참고 예를 들면, Winter et al., GB 2,209,757 B; Morrison et al., WO 89/07142; Morgan et al., WO 94/29351, 1994년 12월 22일). 하나의 구현예에서, 인간 프레임워크는 구조 또는 서열 내에 변이 또는 돌연변이를 갖지 않는다. 특정 구현예에서, 프레임워크는 서열 내에 돌연변이 또는 변이를 갖지 않는 배선 프레임워크 서열이다.
본원에 사용된 바와 같이, 용어 "배선"이란 배아 세포를 통해 부모로부터 자식에서 통과되는 바와 같이, 항체 유전자 및 유전자 조각의 뉴클레오티드 서열 및 아미노산 서열을 의미한다. 이 배선 서열은 B 세포 성숙의 과정 동안에 재조합 및 초고속돌연변이 이벤트에 의해 변형되는 성숙한 B 세포에서 항체를 인코딩하는 뉴클레오티드 서열과 구별된다. 특정 배선을 "이용하는" 항체는 배선 뉴클레오티드 서열 또는 특이적인 아미노산 서열과 아주 밀전하게 정렬하는 뉴클레오티드 또는 아미노산 서열을 갖는다. 그와 같은 항체는 배선 서열과 비교하여 빈번히 돌연변이된다.
다른 구현예에서, 인간 프레임워크는 구조 또는 서열 내에 배선 서열로부터의 최소 변이 또는 돌연변이를 갖는다 (예를 들어, 3, 4, 5, 6, 7, 8, 9, 또는 10개 미만의 억셉터(acceptor) 프레임워크 잔기들은 결합 친화도를 개선하기 위해 공여자 프레임워크 잔기들로 대체되었다, 참고, Queen et al., 미국 특허 번호 5,530,101). 특정 구현예에서, 인간화 면역글로불린 사슬의 프레임워크 내의 아미노산의 제한된 수 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 아미노산)는 인간 CD52에 대한 인간화 면역글로불린 사슬을 포함하는 항체의 친화도를 증가시키기 위해, 억셉터 서열에서보다 공여자 서열(즉," 복귀 돌연변이된")에서의 위치에서 동일한 아미노산이 되도록 선택된다.
(예를 들어, 중쇄 및/또는 경쇄 가변 영역의) 인간 프레임워크 영역은 바람직하게는, 공여자 면역글로불린 (쥣과 항-CD52 항체)의 항원 결합 영역의 유사 또는 동등 영역 (예를 들어, 중쇄 또는 경쇄 가변 영역)에 대한 서열 유사성을 갖는 인간 항체 가변 영역으로부터 얻거나 유래된다. 인간화 면역글로불린의 인간 기원의 부분들에 대한 프레임워크 영역의 다른 공급원은 인간 가변 영역 공통서열을 포함한다 (참고 예를 들면, Kettleborough, C. A. et al., Protein Engineering 4:773-783 (1991); Carter et al., WO 94/04679; Carter 미국 특허 6,407,213)). 예를 들어, 비-인간 부분을 얻기 위해 사용된 항체의 공여자 서열(예를 들어, 가변 영역의 서열)의 영역은 인간화 면역글로불린의 인간 부분들의 특정 공급원, 예를 들어, 프레임워크 영역의 공급원을 선택하기 위해 하기에 기재된 인간 서열과 비교될 수 있다: Kabat, E. A. et al. Sequences of Proteins of Immumological Interest, 제5판, U.S. Department of Health and Human Services, U.S. Government Printing Office (1991).
하나의 구현예에서, 인간화 면역글로불린의 프레임워크 영역 사슬은 비-인간 공여자의 가변 영역과 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90% 또는 적어도 약 95% 총 서열 동일성을 갖는 인간 Ig 가변 영역으로부터 얻거나 유리된다. 특정 구현예에서, 인간화 면역글로불린의 프레임워크 영역 사슬은 비-인간 공여자의 가변 영역 면역글로불린의 프레임워크 영역과 적어도 약 50%, 적어도 약 55%, 적어도 약 60%, 적어도 약 65%, 적어도 약 70%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 또는 적어도 약 95% 총 서열 동일성을 갖는 인간 가변 영역 프레임워크 영역으로부터 얻거나 유리된다.
하나의 구현예에서, 인간화 면역글로불린의 프레임워크 영역 (FR)의 적어도 하나는 인간 기원의 항체의 하나 이상의 사슬로부터 얻거나 유래된다. 따라서, FR은 인간 기원의 하나 이상의 항체 (예를 들어, 인간 면역글로불린 사슬으로부터, 인간 공통서열로부터) 얻거나 유리된 FR1 및/또는 FR2 및/또는 FR3 및/또는 FR4를 포함할 수 있다.
본 발명에 사용하기 위한 면역글로불린 부분들은 그것들이 유래되는 면역글로불린 또는 그의 돌연변이체에 동일 또는 유사한 서열을 갖는다. 그와 같은 돌연변이체는 하나 이상의 잔기들의 부가, 결실 또는 치환 (예를 들어, 보존적 치환)에 의해, 예를 들어, 하나 이상의 부가, 결실 또는 치환에 의해 모체 서열로부터, 3, 4, 5, 6, 7, 8, 9, 또는 10 이하의 잔기에 의해 상이한 돌연변이체를 포함한다. 상기에서 지적한 바와 같이, 본 발명의 인간화 면역글로불린은 본원에 기재된 쥣과 항-CD52 항체 (공여자 항체)의 하나 이상으로부터하나 이상의 CDR을 포함한다. 프레임워크 영역, 예컨대 인간 기원의 프레임워크 영역의 잔기를 공여자 항체의 상응하는 위치로부터의 잔기로 치환하는 것에서의 변화가 생길 수 있다. 프레임워크 영역 중 하나 이상의 아미노산의 결실, 삽입 및 치환을 포함하는 하나 이상의 돌연변이가 만들어 질 수 있다. 필요에 따라, 프레임워크 돌연변이는 인간화 항체 또는 사슬 내에 포함될 수 있고, 돌연변이의 부위는 예를 들어 WO 98/06248에 기재되어 있는 바와 같은 임의의 적당한 방법을 사용하여 선택될 수 있고, 그의 전체 교시는 참고로 통합된다.
일부 경우에 쥣과 항-CD52 항체(들)의 하나 이상의 CDR을 플랭킹(flanking)하는 잔기들은 기여할 수 있고, 일부 경우에, 기능 (예를 들어, 결합)에 직접 또는 간접적으로 중요할 수 있다는 것을 당해 분야의 숙련가는 인식할 것이다. 따라서, 일부 구현예에서, 쥣과 프레임워크 하나 이상의 CDR (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 플랭킹 아미노산)을 플랭킹하는 하나 이상의 아미노산은 인간화 면역글로불린에서 또한 포함된다.
일부 구현예에서, 본 발명의 인간화 항체의 인간 중쇄 프레임워크 영역은 인간 VH3-72 또는 VH3-23 배선 서열을 이용한다. 일부 구현예에서, 본 발명의 인간화 항체의 인간 경쇄 프레임워크 영역은 인간 VK2-A18b 배선 서열을 이용한다. 역 돌연변이는 인간화 항체의 CD52 결합 친화도를 개선하기 위해 하기의 작업예에서 기재된 하나 이상의 잔기들에서 이들 FR 영역에서 임의로 만들어 질 수 있다.
"친화도"는, 결합 상호작용의 기재하고 있는 기술 용어이고, 전형적으로 면역글로불린의 인간 CD52에의 총 세기를 의미한다.
특정 구현예에서, 면역글로불린은 (예를 들어, 유세포 분석기로 측정된 바와 같이) 10 ㎍/ml 미만의 EC50 값으로서 측정된 결합 활성을 갖는다. 또 다른 구현예에서, 면역글로불린은 (예를 들어, 유세포 분석기로 측정된 바와 같이) 5.0 ㎍/ml 미만, 또는 1.0 ㎍/ml 미만의 EC50 값으로서 측정된 결합 활성을 갖는다.
일부 구현예에서, 면역글로불린은 300 nM 내지 1 pM (즉, 3 x 10-7 내지 1×10-12M), 바람직하게는 50 nM 내지 1 pM, 더 바람직하게는 5 nM 내지 1 pM 및 가장 바람직하게는 1 nM 내지 1 pM, 예를 들어, 1×10-7 M 이하, 바람직하게는 1×10-8 M 이하, 더 바람직하게는 1×10-9 M 이하, 유리하게는 1×10-10 M 이하 및 가장 바람직하게는 1×10-11 M 또는 1×10-12 이하의 친화도 (KD; KD=Koff (kd)/Kon (ka)); 및/또는 표면 플라스몬 공명으로 측정된 바와 같이 5 x 10-1 s-1 내지 1×10-7 s-1, 바람직하게는 1×10-2 s-1 내지 1×10-6 s-1, 더 바람직하게는 5 x 10-3 s-1 내지 1×10-5 s-1, 예를 들어 5 x 10-1 s-1 이하, 바람직하게는 1×10-2 s-1 이하, 유리하게는 1×10-3 s-1 이하, 더 바람직하게는 1×10-4 s-1 이하, 더욱 더 바람직하게는 1×10-5 s-1 이하, 및 가장 바람직하게는 1×10-6 s-1 이하의 Koff 속도 상수로 인간 CD52에 결합한다.
당해 분야의 숙련가에게 명백한 바와 같이, 다양한 방법이 본원에 제공되고 당해 분야에 공지된 방법에 따라 생성된 면역글로불린이 필수 특이성 (예를 들어, 결합 특이성, 에피토프 특이성)을 갖는다는 것을 확인하기 위해 사용될 수 있다. 예를 들어, 인간 CD52에 대한 결합 특이성을 갖는 본 발명의 인간화 항-CD52 면역글로불린의 결합 관능기는 임의의 적당한 방법, 예를 들어, 인간화 면역글로불린 및 인간 CD52 (예를 들어, 인간 CD52을 포함하는 막 분획; 인간 CD52 보유 세포, 예컨대 인간 T 세포, 인간 B 세포; 인간 CD52을 인코딩하는 핵산을 포함하는 발현시키는 CHO 세포 또는 재조합 숙주세포; CD52의 아미노산 서열을 갖는 펩타이드 (예를 들어, 합성 펩타이드); 인간 CD52을 포함하는 고형 지지체) 사이의 복합체의 형성을 모니터하는 검정을 사용하여 검출될 수 있다.
특정 쥣과, 키메라, 또는 인간화 단클론 항체와동일한 인간 CD52 상의 에피토프에 결합하거나 특정 쥣과, 키메라, 또는 인간화 단클론 항체가 결합하는 인간 CD52 상의 에피토프와 중첩하는 인간 CD52 상의 에피토프에 결합하는 본 발명의 면역글로불린 (예를 들어, 본 발명의 인간화 면역글로불린)의 능력은, 예를 들어, 경쟁적 결합 검정을 포함하는 당해 분야의 숙련가에게 공지된 다양한 기술을 사용하여 쉽게 결정될 수 있다. 이들은 상기 특정 항체의 표지된 형태의 사용, 및 본 발명의 면역글로불린의 존재 및 부재에서 표지된 항체의 인간 CD52에의 결합의 측정을 수반할 수 있다.
본원에서 사용된 바와 같은 "에피토프"는 면역글로불린에 특이적으로 결합할 수 있는 임의의 단백질을 포함한다. 에피토프 결정기는 일반적으로 분자, 예컨대 아미노산 또는 카보히드레이트 또는 당 측쇄의 화학적 활성인 표면 그룹핑으로 이루어지고, 일반적으로 특이 3차원 구조 특성뿐만 아니라 특히 전하 특성을 갖는다. 에피토프는 "선형" 또는 "구조적"일 수 있다. 선형 에피토프에서, 단백질 및 작용 분자 (예컨대, 항체) 사이의 상호 작용의 모든 지점은 단백질의 기본 아미노산 서열을 따라 선형으로 생길 수 있다. 구조적 에피토프에서, 상호작용의 지점은 하나의 다른 것으로부터 분리된 단백질 상의 아미노산 잔기들을 가로질서 생긴다. 항원 상의 원하는 에피토프가 일단 결정되면, 예를 들어, 본 발명에서 기재된 기술을 사용하여 그 에피토프에 대한 항체를 산출할 수 있다. 대안적으로, 발견 과정 동안에, 항체의 산출 및 특성화는 바람직한 에피토프에 관한 정보를 밝힐 수 있다. 이 정보로부터, 그 다음에, 동일한 에피토프에 결합하기 위한 항체를 경쟁적으로 스크리닝할 수 있다. 이를 달성하기 위한 접근법은 다른 하나와 경쟁적으로 결합하는 항체를 발견하기 위한 경쟁 연구를 수행하는 것이고, 즉, 항체는 항원에 결합하기 위해 경쟁한다.
하나의 구현예에서, 시험 항체가 본 발명의 인간화 항체의 동일한 또는 중첩 에피토프에 결합하는 지를 측정하기 위해, 포화 조건 하에서 본 발명의 항-CD52 항체가 CD52에 결합하는 것을 허용하고, 그 다음, 시험 항체가 CD52에 결합하는 능력을 측정한다. 시험 항체가 참조 항-CD52 항체와 동일한 시간에서 CD52에 결합할 수 있으면, 그 때, 시험 항체는 참조 항-CD52 항체와는 상이한 에피토프에 결합한다. 그러나, 시험 항체가 동일한 시간에 CD52에 결합할 수 없으면, 그 때, 시험 항체는 동일한 에피토프, 중첩 에피토프, 또는 항-CD52 항체에 의해 결합된 에피토프에 근접한 에피토프에 결합한다. 이 실험은 ELISA, RIA, BIACORETM, 또는 유세포 분석기를 사용하여 수행될 수 있다. 항-CD52 항체가 다른 항-CD52 항체와 교차경쟁하는 지를 시험하기 위해, 상기에 기재된 경쟁 방법을 2개의 방향으로 사용할 수 있고, 즉, 참조 항체가 시험 항체를 차단하고, 그 반대인 것을 측정한다. 일부 구현예에서, 실험은 BIACORETM을 사용하여 수행된다.
에피토프 바이닝(binning)은 본 발명의 항체를 특성화하기 위해 또한 사용될 수 있다. 용어 "바이닝"은 항원 결합 특성을 기반으로한 항체를 그룹화하는 방법을 의미한다. 교차경쟁을 기반으로 하는 "바이닝" 항체에 대한 높은 처리 프로세스는 국제 특허 출원 번호 WO 03/48731에 기재되어 있다. "에피토프 바이닝"는 항-CD52 항체 "A"의 비표지된 형태가 CD52의 서열 또는 CD52 양성 세포에 상응하는 합성 펩타이드에 결합하도록하여 조사될 수 있다. 차후에, 표지된 제2 항-CD52 항체 "B"는 부가되고, 대조군 시료에 대해 결합할 수 표지된 항체의 양을 평가할 수 있고, 여기서, 상기 세포 또는 시냅스 펩타이드는 항-CD52 항체 "A"에 미리 노출되지 않았다. 대안적으로, 항-CD52 항체 "A" 및 "B" 모두는 상이한 검출할 수 있는 상이한 형광색소 또는 화학물질로 표지될 수 있고, 표지를 검출할 수 있는 장비를 사용하여 동일한 시간에서 CD52 펩타이드를 차지할 수 있는 표지된 항체 모두의 양을 측정할 수 있고, 또는 유세포 분석기로 CD52 양성 세포를 동시에 차지할 수 있는 항체 모두의 양을 측정할 수 있다. 비아코어(Biacore) 및 옥테트(Octet) 기술로 항체의 미표지된 형태 경쟁적 결합을 조자할 수 있다. 항체의 미표지된 형태의 사용이 바람직한 것은, 일부 항체의 화학 변형이 결합 활성을 손상시키기 때문이다. 하기에 기재된 기술 참조: Jia et al., J. Immunol . Methods 288:91-98 (2004), 이는 또한 에피토프 바이닝을 수행하는데 유용하다.
인간화 면역글로불린의 부분들, 예컨대 경쇄, 중쇄 및 경쇄 및 중쇄의 부분들이 또한 본원에 제공된다. 이들 면역글로불린 부분들은 (예를 들어, 감소 및/또는 분열에 의해) 면역글로불린으로부터 얻거나 유래될 수 있고, 또는 원하는 특성(예를 들어, 인간 CD52에 결합, 서열 유사성)을 갖는 면역글로불린 또는 이의 사슬의 부분을 인코딩하는 핵산에 의해 생성 또는 발현될 수 있다. 예를 들어, 관련 부분의 신규 합성에 의해 제조될 수 있다. 인간 및 비-인간 기원의 원하는 부분들 (예를 들어, 항원 결합 영역, CDR, FR, C 영역)을 포함하는 인간화 면역글로불린은 원하는 인간화 사슬을 인코딩하는 구조물 (예를 들어, cDNA)을 제조하기 위해 시냅스 및/또는 재조합 핵산을 사용하여 생성될 수 있다. 예를 들어, 면역글로불린의 부분 (예를 들어, 사슬의 부분)을 제조하기 위해, 하나 이상의 종결 코돈은 원하는 위치에서 도입될 수 있다. 인간화 가변 영역에 대해 코딩하는 핵산 (예를 들어, DNA) 서열은 존재하는 DNA 서열을 변경시키기 위해 PCR 돌연변이유발 방법을 사용하여 제작될 수 있다 (참고 예를 들면, Kamman, M., et al., Nucl . Acids Res. 17:5404 (1989)). 신규 CDR에 대해 코딩하는 PCR 프라이머는 동일한, 또는 아주 유사한 인간 가변 영역을 기반으로 하는 이전의 인간화 가변 영역의 DNA 탬플릿에 혼성화될 수 있다 (Sato, K., et al., Cancer Search 53:851-856 (1993)). 유사한 DNA 서열이 탬플릿으로서 사용하기에 이용가능하지 않으면, 가변 영역 서열을 인코딩하는 서열을 포함하는 핵산은 시냅스 올리고뉴클레오티드로부터 제작될 수 있다 (참고 예를 들면, Kolbinger, F., Protein Engineering 8:971-980 (1993)). 신호 펩타이드를 인코딩하는 서열은 또한 (예를 들어, 합성시, 벡터에의 삽입시) 핵산에 혼합될 수 있다. 신호 펩타이드 서열이 이용가능하지 않으면 (예를 들어, 전형적으로 존재하지 않으면), 다른 항체로부터의 신호 펩타이드 서열이 사용될 수 있다 (참고, 예를 들어, Kettleborough, C.A., Protein Engineering 4:773-783 (1991)). 이들 방법, 본원에 기재된 방법 또는 다른 적당한 방법을 사용하여, 돌연변이체가 쉽게 생성될 수 있다.
본 발명은 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린에 관한 것이고 인간화 경쇄 및 인간화 중쇄 및/또는 이의 부분을 포함한다. 하나의 구현예에서, 인간화 면역글로불린은 하기를 포함한다: 서열번호: 3의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 16의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 4의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 17의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 5의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 18의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 6의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 19의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 7의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 20의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 8의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 21의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 9의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 22의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 10의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 23의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 11의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 24의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 서열번호: 12의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 25의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄; 또는 서열번호: 13의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄 및 서열번호: 26의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄 서열.
하나의 구현예에서, 본 발명의 인간화 면역글로불린은 중쇄 (H)-CDR1, H-CDR2, H-CDR3, 경쇄 (L)-CDR1, L-CDR2, 및 L-CDR3를 포함하고, 그의 아미노산 서열은 하기이다: a) 서열번호: 51, 59, 69, 29, 36, 및 43 각각; b) 서열번호: 50, 60, 69, 29, 37, 및 43 각각; c) 서열번호: 50, 61, 68, 29, 38, 및 43 각각; d) 서열번호: 50, 61, 69, 29, 36, 및 43 각각; e) 서열번호: 50, 62, 69, 29, 39, 및 43 각각; f) 서열번호: 52, 61, 70, 30, 40, 및 43 각각; g) 서열번호: 53, 63, 71, 31, 36, 및 44 각각; h) 서열번호: 54, 64, 71, 31, 36, 및 45 각각; i) 서열번호: 55, 63, 72, 31, 36, 및 46 각각; j) 서열번호: 56, 65, 73, 32, 41, 및 47 각각; k) 서열번호: 56, 65, 294, 32, 41, 및 47; 또는 l) 서열번호: 56, 66, 74, 33, 41, 및 48 각각.
또 다른 구현예에서, 본 발명의 인간화 면역글로불린은 H-CDR3 및 L-CDR3을 포함하고, 이의 서열은 하기이다: a) 서열번호: 69 및 43 각각; b) 서열번호: 68 및 43 각각; c) 서열번호: 70 및 43 각각; d) 서열번호: 71 및 44 각각; e) 서열번호: 71 및 45 각각; f) 서열번호: 72 및 46 각각; g) 서열번호: 73 및 47 각각; h) 서열번호: 294 및 47 각각; 또는 i) 서열번호: 74 및 48 각각.
또 다른 구현예에서, 인간화 면역글로불린은 인간 CD52에 대해 결합 특이성을 갖지며, 하기를 포함한다: 서열번호: 27, 서열번호: 28, 서열번호: 29, 서열번호: 30, 서열번호: 31, 서열번호: 32, 서열번호: 33, 서열번호: 34, 서열번호: 35, 서열번호: 36, 서열번호: 37, 서열번호: 38, 서열번호: 39, 서열번호: 40, 서열번호: 41, 서열번호: 42, 서열번호: 43, 서열번호: 44, 서열번호: 45, 서열번호: 46, 서열번호: 47, 및 서열번호: 48, 또는 이의 조합으로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함하는 경쇄; 및 서열번호: 49, 서열번호: 50, 서열번호: 51, 서열번호: 52, 서열번호: 53, 서열번호: 54, 서열번호: 55, 서열번호: 56, 서열번호: 57, 서열번호: 58, 서열번호: 59, 서열번호: 60, 서열번호: 61, 서열번호: 62, 서열번호: 63, 서열번호: 64, 서열번호: 65, 서열번호: 66, 서열번호: 67, 서열번호: 68, 서열번호: 69, 서열번호: 70, 서열번호: 71, 서열번호: 72, 서열번호: 73, 서열번호: 74, 및 서열번호: 294, 또는 이의 조합으로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함하는 중쇄, 여기서, 상기 인간화 면역글로불린은 Campath®이 아니다.
또 다른 구현예에서, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린은 하기를 포함한다: 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12 또는 서열번호: 13 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 경쇄, 및 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23, 서열번호: 24, 서열번호: 25, 서열번호: 26, 또는 서열번호: 137 의 하나 이상의 CDR (예를 들어, 모두 3개의 CDR)을 포함하는 중쇄, 여기서, 상기 인간화 면역글로불린은 Campath®이 아니다.
본 발명은 또한, 본원에 기재된 인간화 면역글로불린의 인간화 면역글로불린 경쇄에 관한 것이다. 하나의 구현예에서, 인간화 면역글로불린 경쇄는 하기로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR을 포함한다: 서열번호: 27, 서열번호: 28, 서열번호: 29, 서열번호: 30, 서열번호: 31, 서열번호: 32, 서열번호: 33, 서열번호: 34, 서열번호: 35, 서열번호: 36, 서열번호: 37, 서열번호: 38, 서열번호: 39, 서열번호: 40, 서열번호: 41, 서열번호: 42, 서열번호: 43, 서열번호: 44, 서열번호: 45, 서열번호: 46, 서열번호: 47, 및 서열번호: 48, 및 이의 조합, 여기서, 상기 인간화 면역글로불린 경쇄는 Campath®의 경쇄가 아니다. 예를 들어, 인간화 항체는 L-CDR1, L-CDR2, 및 L-CDR3를 가지며, 이의 아미노산 서열은 하기이다: a) 서열번호: 29, 36, 및 43 각각; b) 서열번호: 29, 37, 및 43 각각; c) 서열번호: 29, 38, 및 43 각각; d) 서열번호: 29, 36, 및 43 각각; e) 서열번호: 29, 39, 및 43 각각; f) 서열번호: 30, 40, 및 43 각각; g) 서열번호: 31, 36, 및 44 각각; h) 서열번호: 31, 36, 및 45 각각; i) 서열번호: 31, 36, 및 46 각각; j) 서열번호: 32, 41, 및 47 각각; 또는 k) 서열번호: 33, 41, 및 48 각각.
본 발명은 또한, 하기로 이루어진 그룹으로부터 선택되는 하나 이상의 CDR 서열을 포함하는 인간화 중쇄에 관한 것이다: 서열번호: 49, 서열번호: 50, 서열번호: 51, 서열번호: 52, 서열번호: 53, 서열번호: 54, 서열번호: 55, 서열번호: 56, 서열번호: 57, 서열번호: 58, 서열번호: 59, 서열번호: 60, 서열번호: 61, 서열번호: 62, 서열번호: 63, 서열번호: 64, 서열번호: 65, 서열번호: 66, 서열번호: 67, 서열번호: 68, 서열번호: 69, 서열번호: 70, 서열번호: 71, 서열번호: 72, 서열번호: 73, 서열번호: 74, 및 서열번호: 294, 또는 이의 조합, 여기서, 상기 인간화 면역글로불린 중쇄는 Campath®의 중쇄가 아니다. 예를 들어, 인간화 항체는 H-CDR1, H-CDR2, 및 H-CDR3을 가지며, 이의 아미노산 서열은 하기이다: a) 서열번호: 51, 59, 및 69 각각; b) 서열번호: 50, 60, 및 69 각각; c) 서열번호: 50, 61, 및 68 각각; d) 서열번호: 50, 61, 및 69 각각; e) 서열번호: 50, 62, 및 69 각각; f) 서열번호: 52, 61, 및 70 각각; g) 서열번호: 53, 63, 및 71 각각; h) 서열번호: 54, 64, 및 71 각각;
i) 서열번호: 55, 63, 및 72 각각; j) 서열번호: 56, 65, 및 73 각각; k) 서열번호: 56, 65, 및 294; 또는 l) 서열번호: 56, 66, 및 74 각각.
하나의 구현예에서, 본 발명의 인간화 항체는 서열번호: 102, 138, 145-148, 153-157, 및 164-168의 하나의 가변 도메인 (VL) 서열을 포함하는 경쇄를 포함한다. 관련 구현예에서, 인간화 항체는 경쇄를 포함하고, 이의 아미노산 서열은 서열번호: 273, 275, 278, 280, 및 282 중 하나를 포함하거나, 그것으로 이루어진다.
하나의 구현예에서, 본 발명의 인간화 항체는 서열번호: 103, 136, 137, 139-144, 149-152, 및 158-163 중 하나의 가변 도메인 (VH) 서열을 포함하는 중쇄를 포함한다. 관련 구현예에서, 인간화 항체는 중쇄를 포함하고, 이의 아미노산 서열은 서열번호: 272, 274, 276, 277, 279, 및 281 중 하나를 포함하거나, 그것으로 이루어진다.
일부 구현예에서, 본 발명의 인간화 항체는 VH 및 VL를 포함하고, 이의 아미노산 서열은 하기를 포함하거나, 그것으로 이루어진다:
a) 서열번호: 103 및 102 각각 (4B10-H1/K1);
b) 서열번호: 136 및 138 각각 (7F11-SFD1/K2);
c) 서열번호: 137 및 138 각각 (7F11-SFD2/K2)
d) 서열번호: 139, 및 서열번호: 145-148 각각 중 하나 (예를 들어, 서열번호: 139 및 146 각각 (2C3-SFD1/K11); 및 서열번호: 139 및 147 각각 (2C3-SFD1/K12));
e) 서열번호: 140, 및 서열번호: 145-148 각각 중 하나;
f) 서열번호: 141, 및 서열번호: 145-148 각각 중 하나;
g) 서열번호: 142, 및 서열번호: 145-148 각각 중 하나;
h) 서열번호: 143, 및 서열번호: 145-148 각각 중 하나;
i) 서열번호: 144, 및 서열번호: 145-148 각각 중 하나;
j) 서열번호: 149, 및 서열번호: 153-157 각각 중 하나 (예를 들어, 서열번호: 149 및 155 각각 (12G6-SFD1/K11); 서열번호: 149 및 156 각각 (12G6-SFD1/K12); 및 서열번호: 149 및 157 각각 (12G6-SFD1/K13));
k) 서열번호: 150, 및 서열번호: 153-157 각각 중 하나;
l) 서열번호: 151, 및 서열번호: 153-157 각각 중 하나;
m) 서열번호: 152, 및 서열번호: 153-157 각각 중 하나;
n) 서열번호: 158, 및 서열번호: 164-168 각각 중 하나 중 하나 (예를 들어, 서열번호: 158 및 165 각각 (9D9-H10/K12); 및 서열번호: 158 및 166 각각 (9D9-H10/K13));
o) 서열번호: 159, 및 서열번호: 164-168 각각 중 하나 (예를 들어, 서열번호: 159 및 165 각각 (9D9-H11/K12); 및 서열번호: 159 및 166 각각 (9D9-H11/K13));
p) 서열번호: 160, 및 서열번호: 164-168 각각 중 하나;
q) 서열번호: 161, 및 서열번호: 164-168 각각 중 하나 (예를 들어, 서열번호: 161 및 166 각각 (9D9-H16/K13));
r) 서열번호: 162, 및 서열번호: 164-168 각각 중 하나; 또는
s) 서열번호: 163, 및 서열번호: 164-168 각각 중 하나 (예를 들어, 서열번호: 163 및 166 각각 (9D9-H18/K13)).
괄호 안에 포함된 항체는 작업 실시예에서 하기에 추가로 기재되어 있다.
하나의 구현예에서, 본 발명의 인간화 항체는 경쇄 (LC) 및 중쇄 (HC)를 포함하고, 이의 아미노산 서열은 하기를 포함하거나 하기로 이루어진다: a) 서열번호: 273 및 272 각각; b) 서열번호: 275 및 274 각각; c) 서열번호: 278 및 276 각각; d) 서열번호: 278 및 277 각각; e) 서열번호: 280 및 279 각각; 또는 f) 서열번호: 282 및 281 각각.
본 발명은 또한, 본원에 예시된 항체와 동일한 에피토프에 결합하고, 또는 그 항체와 경쟁 또는 교차경쟁하는 항-인간 CD52 항체 (종래기술에 공지된 임의의 것 제외)을 제공한다. 이들 항체는, 예를 들어, 인간화, 키메라, 또는 마우스 항체일 수 있다. 예를 들어, 본 발명은 마우스 항체 8G3, 4F7, 9D9, 11C11, 3G7, 5F7, 12G6, 23E6, 2C3, 7F11, 및 4B10 중 하나와 동일한 에피토프에 결합하고, 그 항체와 경쟁하거나 교차경쟁하는 항-인간 CD52 항체, 및 이들 마우스 항체의 인간화 및 키메라 버전을 제공한다. 참조 항체와 동일한 에피토프에 결합하고 경쟁하거나 교차경쟁하는 항체의 능력은 상기에 기재된 바와 같이 측정될 수 있다. 예를 들어, 인간화 항체 2C3-SFD1/K12 및 12G6-SFD1/K12에 의해 결합된 CD52 에피토프는 서열번호: 104에서 잔기들 7, 8, 및 11을 포함하고, 인간화 항체 9D9-H16/K13에 의해 결합된 에피토프는 서열번호: 104에서 잔기들 4 및 11을 포함한다는 것을 발견했다. 따라서, 일부 구현예에서, 본 발명은 인간화 항체와 동일한 에피토프에 결합하고, 그 항체와 경쟁하거나 교차경쟁하는 항-인간 CD52 항체.
필요에 따라, 예를 들어, 진단 또는 검정 목적 (예를 들어, 치료 모니터링을 허용하는 위한 이미지화)을 위해, 인간화 면역글로불린 (예를 들어, 그의 항원 결합 단편)은 검출가능 표지를 포함할 수 있다. 인간화 면역글로불린 또는 그의 항원 결합 단편을 표지화하기 위한 적당한 검출가능 표지 및 방법은 당해 기술에 공지되어 있다. 적당한 검출가능 표지는 예를 들어 하기를 포함한다: 방사성동위원소 (예를 들어, 인듐-111, 테크네튬-99m 또는 요오드-131), 양전자 방출 표지 (예를 들어, 불소-19), 상자성 이온 (예를 들어, 가들리늄 (III), 망간 (II)), 에피토프 표지 (tag), 친화도 표지 (예를 들어, 바이오틴, 아비딘), 스핀 표지, 효소, 형광 그룹 또는 화학발광 그룹. 표지가 이용되지 않을 때, (예를 들어, 인간화 면역글로불린 및 인간 CD52 사이의) 복합체 형성은 표면 플라스몬 공명, ELISA, FACS, 또는 다른 적당한 방법으로 측정될 수 있다.
본 발명에 사용된 항-CD52 항체는 또한, 예를 들어, 화학 반응 또는 유전자 변형을 통해, 다른 부분 (예를 들어, 페길화 부분)에 접합될 수 있고, 이 부분은 항체의 약동학성, 예컨대 반감기을 개선한다. 일부 구현예에서, 본 발명에 사용된 항-CD52 항체는 예를 들어, 화학 접합 또는 유전자 변형을 통해 적당한 사이토킨에 연결될 수 있다 (예를 들어, 항체 코딩 서열에 대한 프레임 내에 사이토킨의 코딩 서열을 매달고, 이로써 항체:사이토킨 융합 단백질을 만든다).
본 발명은 또한, 면역접합체에 관한 것이고, 여기서, 본 발명의 인간화 면역글로불린 (예를 들어, 그의 항원 결합 단편)은 다른 치료제, 예컨대 생리활성 화합물 (예를 들어, 사이토킨, 초항원, 세포독성제 및 독소)에 커플링된다. 예를 들어, 인간 CD52에 대해 결합 특이성을 갖는 인간화 면역글로불린 (예를 들어, 그의 항원 결합 단편)은 생물학적 단백질, 식물성 또는 박테리아 기원의 분자 (또는 이의 유도체), 인터류킨-2 항체 또는 디프테리아 독소 항체에 커플링될 수 있다.
마우스
단클론
면역글로불린
본 명세서에서 기재된 바와 같이, 인간 CD52에 대한 결합 특이성을 갖는 마우스 단클론 면역글로불린이 생성되었다. 본 발명의 인간화 및 키메라 항체는 본 발명의 마우스 단클론 항체로부터 유래될 수 있다. 즉, 일부 구현예에서, 본 발명의 인간화 및 키메라 항-CD52 항체는 본 발명의 마우스 단클론 항체로부터 취한 서열, 예컨대 하나 이상의 CDR 서열을 포함한다. 본 발명의 마우스 단클론 면역글로불린은 공지된 마우스 항-CD52 단클론 항체의 CDR 아미노산 서열로부터 (예를 들어, CF1D12로부터) 상이한 CDR 아미노산 서열을 갖는 경쇄 및 중쇄를 포함한다.
본원에 사용된 바와 같이, 용어 "마우스 단클론 면역글로불린"이란, 쥣과 항-인간 CD52 항체의 경쇄 CDR (L-CDR1, L-CDR2 및 L-CDR3) 및 중쇄 CDR (H-CDR1, H-CDR2 및 H-CDR3), 및 쥣과 기원의 프레임워크 및 불변 영역을 함유하는 면역글로불린을 의미한다. 마우스 단클론 면역글로불린은 예를 들어, 하이브리도마 기술 또는 재조합 방법의 사용에 의해 제조된 단일 특이성의 균일 항체이다.
본 발명은 마우스 단클론 면역글로불린의 항원 결합 단편 (즉, 부분들), 마우스 단클론 면역글로불린의 경쇄, 마우스 단클론 면역글로불린의 중쇄, 및 이들 중쇄 및 경쇄의 단편을 포함하는, 본원에 기재된 마우스 단클론 면역글로불린에 관한 것이다. 특정 구현예에서, 마우스 단클론 항체는 하기이다: 마우스 8G3.25.3.5 (소위 GENZ 8G3.25.3.5 또는 8G3로도 지칭함), 마우스 GMA 4G7.F3 (소위 4G7.F3 또는 4G7 로도 지칭함), 마우스 GMA 9D9.A2 (소위 9D9.A2 또는 9D9 로도 지칭함), 마우스 GMA 11C11.C5 (소위 11C11.C5 또는 11C11 로도 지칭함), 마우스 GMA 3G7.E9 (소위 3G7.E9 또는 3G7 로도 지칭함), 마우스 5F7.1.1.4 (소위 GENZ 5F7.1.1.4 또는 5F7 로도 지칭함), 마우스 12G6.15.1.2 (소위 GENZ 12G6.15.1.2 또는 2G6 로도 지칭함), 마우스 23E6.2.2.1 (소위 GENZ 23E6.2.2.1 또는 23E6 로도 지칭함), 마우스 2C3.3.8.1 (소위 GENZ 2C3.3.8.1 또는 2C3 로도 지칭함), 마우스 7F11.1.9.7 (소위 GENZ 7F11.1.9.7 또는 7F11 로도 지칭함), 또는 마우스 4B10.1.2.4 (소위 GENZ 4B10.1.2.4 또는 4B10 로도 지칭함). 본 발명은 성숙한 마우스 단클론 면역글로불린, 예컨대 중쇄 및 경쇄 신호 펩타이드를 제거하기 위한 절차에 따르는 마우스 단클론 면역글로불린 및/또는 글리코실화된 면역글로불린에 관한 것이다. 본 발명은 또한, 미성숙 또는 전구체 단백질, 예컨대 신호 펩타이드를 포함하는 마우스 면역글로불린 경쇄 또는 마우스 면역글로불린 중쇄에 관한 것이다. 본 발명은 또한, 미성숙 또는 성숙한 단백질을 인코딩하는 핵산 분자 (예를 들어, 벡터), 그와 같은 핵산을 포함하는 숙주세포 및 이들 미성숙 및 성숙한 단백질의 제조 방법에 관한 것이다.
인간 CD52에 대한 결합 특이성을 갖는 마우스 단클론 면역글로불린의 결합 기능은 임의의 적당한 방법을 사용하여, 예를 들어 마우스 단클론 면역글로불린 및 인간 CD52 (예를 들어, 인간 CD52를 포함하는 막 분획, 또는 인간 CD52 보유 세포, 예컨대 인간 T 세포, 인간 B 세포, CHO 세포 또는 재조합 숙주세포, 이는 인간 CD52을 인코딩하는 핵산을 포함함; CD52의 아미노산 서열을 갖는 펩타이드 (예를 들어, 합성 펩타이드)) 사이의 복합체의 형성을 모니터하는 검정을 사용하여 검출될 수 있다.
경쇄, 중쇄 및 경쇄 및 중쇄의 부분들을 포함하는 쥣과 면역글로불린의 부분들이 또한 본원에 제공된다. 이들 면역글로불린 부분들은 (예를 들어, 감소 및/또는 분열에 의해) 면역글로불린으로부터 얻거나 유래될 수 있고, 또는 원하는 특성 (예를 들어, 인간 CD52에 결합함, 서열 유사성)을 갖는 면역글로불린 또는 이의 사슬의 부분을 인코딩하는 핵산이 생성되고 발현될 수 있다. 관련 부분의 신규 합성에 의해 제조될 수 있다. 쥣과 기원의 원하는 부분들 (예를 들어, 항원 결합 영역, CDR, FR, 및/또는 C 영역)을 포함하는 마우스 단클론 면역글로불린의 부분은 원하는 단클론 면역글로불린 사슬을 인코딩하는 구조물 (예를 들어, cDNA)을 제조하기 위해 시냅스 및/또는 재조합 핵산을 사용하여 생성될 수 있다. 사슬의 부분을 제조하기 위해, 하나 이상의 종결 코돈이 원하는 위치에서 도입될 수 있다. 신호 펩타이드를 인코딩하는 서열은 또한, (예를 들어, 합성시, 벡터에의 삽입시) 핵산에 혼입될 수 있다. 천연 신호 펩타이드 서열이 이용가능하지 않으면, 다른 항체로부터의 신호 펩타이드 서열이 사용될 수 있다 (참고, 예를 들어, Kettleborough, C.A., Protein Engineering 4:773-783 (1991)). 이들 방법, 본원에 기재된 방법 또는 다른 적당한 방법을 사용하여, 돌연변이체는 쉽게 생성될 수 있다.
하나의 구현예에서, 본 발명의 마우스 단클론 면역글로불린은 하기를 포함한다: 서열번호: 3을 포함하는 경쇄 및 서열번호: 16을 포함하는 중쇄; 서열번호: 4를 포함하는 경쇄 및 서열번호: 17을 포함하는 중쇄; 서열번호: 5를 포함하는 경쇄 및 서열번호: 18을 포함하는 중쇄; 서열번호: 6을 포함하는 경쇄 및 서열번호: 19를 포함하는 중쇄; 서열번호: 7을 포함하는 경쇄 및 서열번호: 20을 포함하는 중쇄; 서열번호: 8를 포함하는 경쇄 및 서열번호: 21을 포함하는 중쇄; 서열번호: 9를 포함하는 경쇄 및 서열번호: 22을 포함하는 중쇄; 서열번호: 10를 포함하는 경쇄 및 서열번호: 23을 포함하는 중쇄; 서열번호: 11를 포함하는 경쇄 및 서열번호: 24를 포함하는 중쇄; 서열번호: 12를 포함하는 경쇄 및 서열번호: 25을 포함하는 중쇄; 또는 서열번호: 13을 포함하는 경쇄 및 서열번호: 26을 포함하는 중쇄 .
또 다른 구현예에서, 본 발명은 또한, 하기로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역을 포함하는, 인간 CD52에 대해 결합 특이성을 갖는 마우스 단클론 항체에 관한 것이다: 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9; 서열번호: 10; 서열번호: 11, 서열번호: 12, 및 서열번호: 13; 및 selected 로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23; 서열번호: 24, 서열번호: 25 및 서열번호: 26.
필요에 따라, 예를 들어, 진단 또는 검정 목적 (예를 들어, 이미징)을 위해, 마우스 단클론 면역글로불린 (예를 들어, 그의 항원 결합 단편)은 검출가능 표지를 포함할 수 있다. 마우스 단클론 면역글로불린 또는 그의 항원 결합 단편을 표지화하기 위한 적당한 검출가능 표지 및 방법은 당해 기술에 공지되어 있다. 적당한 검출가능 표지는 예를 들어 하기를 포함한다: 방사성동위원소 (예를 들어, 인듐-111, 테크네튬-99m 또는 요오드-131), 양전자 방출 표지 (예를 들어, 불소-19), 상자성 이온 (예를 들어, 가들리늄 (III), 망간 (II)), 에피토프 표지 (tag), 친화도 표지 (예를 들어, 바이오틴, 아비딘), 스핀 표지, 효소, 형광 그룹 또는 화학발광 그룹. 표지가 이용되지 않을 때, (예를 들어, 마우스 단클론 면역글로불린 및 CD52 사이의) 복합체 형성은 표면 플라스몬 공명, ELISA, FACS, 또는 다른 적당한 방법으로 측정될 수 있다. 본 발명의 인간화 항체에 대해 상기 기재된 모든 적당한 방법 및 기술은 또한 본원에서 사용될 수 있다.
키메라
면역글로불린
본 명세서에서 기재된 바와 같이, 인간 CD52에 대한 결합 특이성을 갖는 키메라 면역글로불린이 생성되었다. 키메라 면역글로불린은 인간 CD52에 대한 결합 특이성을 갖는 공지된 키메라 항체의 아미노산 서열과 상이한 아미노산 서열을 갖는 키메라 경쇄 및/또는 키메라 중쇄를 포함한다.
본원에 사용된 바와 같이, 용어 "키메라 면역글로불린"이란 하나의 종으로부터 유래된 항체, 바람직하게는 쥣과 항-인간 CD52 단클론 항체의 상보적 결정 영역 (CDR)을 포함하는 가변 도메인을 함유하는 재조합 단백질을 의미하고, 한편, 상기 항체 분자의 불변 도메인은 상이한 종의 항체로부터, 예를 들어, 인간 항체로부터 유래된다.
본 발명은 키메라 면역글로불린의 항원 결합 단편 (즉, 부분들), 키메라 면역글로불린의 키메라 경쇄 및 키메라 중쇄 및 이들 키메라 경쇄 및 중쇄의 단편을 포함하는 본원에 기재된 키메라 면역글로불린에 관한 것이다. 본 발명은 성숙한 키메라 면역글로불린, 예컨대 중쇄 및 경쇄 신호 펩타이드를 제거하기 위한 절차에 따르는 키메라 면역글로불린 및/또는 글리코실화된 면역글로불린에 관한 것이다. 본 발명은 또한, 미성숙 또는 전구체 단백질, 예컨대 신호 펩타이드를 포함하는 키메라 중쇄에 관한 것이다. 본 발명은 또한, 미성숙 또는 성숙한 단백질을 인코딩하는 핵산 분자 (예를 들어, 벡터), 그와 같은 핵산을 포함하는 숙주세포 및 이들 미성숙 및 성숙한 단백질의 제조 방법에 관한 것이다.
인간 CD52에 대한 결합 특이성을 갖는 키메라 면역글로불린의 결합 기능은 임의의 적당한 방법을 사용하여, 예를 들어 키메라 면역글로불린 및 인간 CD52 (예를 들어, 인간 CD52를 포함하는 막 분획, 또는 인간 CD52 보유 세포, 예컨대 인간 T 세포, 인간 B 세포, CHO 세포 또는 재조합 숙주세포, 이는 인간 CD52을 인코딩하는 핵산을 포함함; CD52의 아미노산 서열을 갖는 펩타이드 (예를 들어, 합성 펩타이드)) 사이의 복합체의 형성을 모니터하는 검정을 사용하여 검출될 수 있다.
경쇄, 중쇄 및 경쇄 및 중쇄의 부분들을 포함하는 쥣과 면역글로불린의 부분들이 또한 본원에 제공된다. 이들 면역글로불린 부분들은 (예를 들어, 감소 및/또는 분열에 의해) 면역글로불린으로부터 얻거나 유래될 수 있고, 또는 원하는 특성 (예를 들어, 인간 CD52에 결합함, 서열 유사성)을 갖는 면역글로불린 또는 이의 사슬의 부분을 인코딩하는 핵산이 생성되고 발현될 수 있다. 부분의 신규 합성에 의해 제조될 수 있다. 인간 또는 비-인간 기원의 원하는 부분들 (예를 들어, 항원 결합 영역, CDR, FR, 및/또는 C 영역)을 포함하는 키메라 면역글로불린의 부분은 원하는 단클론 면역글로불린 사슬을 인코딩하는 구조물 (예를 들어, cDNA)을 제조하기 위해 시냅스 및/또는 재조합 핵산을 사용하여 생성될 수 있다. 사슬의 부분을 제조하기 위해, 하나 이상의 종결 코돈이 원하는 위치에서 도입될 수 있다. 신호 펩타이드를 인코딩하는 서열은 또한, (예를 들어, 합성시, 벡터에의 삽입시) 핵산에 혼입될 수 있다. 천연 신호 펩타이드 서열이 이용가능하지 않으면 (전형적으로 존재하지 않으면), 다른 항체로부터의 신호 펩타이드 서열이 사용될 수 있다 (참고, 예를 들어, Kettleborough, C.A., Protein Engineering 4:773-783 (1991)). 이들 방법, 본원에 기재된 방법 또는 다른 적당한 방법을 사용하여, 돌연변이체는 쉽게 생성될 수 있다.
하나의 구현예에서, 본 발명의 키메라 면역글로불린은 하기를 포함한다: 서열번호: 3의 경쇄 가변 영역 및 서열번호: 16의 중쇄 가변 영역; 서열번호: 4의 경쇄 가변 영역 및 서열번호: 17의 중쇄 가변 영역; 서열번호: 5의 경쇄 가변 영역 및 서열번호: 18의 중쇄 가변 영역; 서열번호: 6의 경쇄 가변 영역 및 서열번호: 19의 중쇄 가변 영역; 서열번호: 7의 경쇄 가변 영역 및 서열번호: 20의 중쇄 가변 영역; 서열번호: 8의 경쇄 가변 영역 및 서열번호: 21의 중쇄 가변 영역; 서열번호: 9의 경쇄 가변 영역 및 서열번호: 22의 중쇄 가변 영역; 서열번호: 10의 경쇄 가변 영역 및 서열번호: 23의 중쇄 가변 영역; 서열번호: 11의 경쇄 가변 영역 및 서열번호: 24의 중쇄 가변 영역; 서열번호: 12의 경쇄 가변 영역 및 서열번호: 25의 중쇄 가변 영역; 또는 서열번호: 13의 경쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역.
본 발명은 또한, 하기로 이루어진 그룹으로부터 선택되는 경쇄 가변 영역 서열을 포함하는, 인간 CD52에 대해 결합 특이성을 갖는 키메라 항체에 관한 것이다: 서열번호: 3의 경쇄 가변 영역, 서열번호: 4의 경쇄 가변 영역, 서열번호: 5의 경쇄 가변 영역, 서열번호: 6의 경쇄 가변 영역, 서열번호: 7의 경쇄 가변 영역, 서열번호: 8의 경쇄 가변 영역, 서열번호: 9의 경쇄 가변 영역, 서열번호: 10의 경쇄 가변 영역, 서열번호: 11의 경쇄 가변 영역, 서열번호: 12의 경쇄 가변 영역 및 서열번호: 13의 경쇄 가변 영역, 및 selected 로 이루어진 그룹으로부터 선택되는 중쇄 가변 영역 서열: 서열번호: 16의 중쇄 가변 영역, 서열번호: 17의 중쇄 가변 영역, 서열번호: 18의 중쇄 가변 영역, 서열번호: 19의 중쇄 가변 영역, 서열번호: 20의 중쇄 가변 영역, 서열번호: 21의 중쇄 가변 영역, 서열번호: 22의 중쇄 가변 영역, 서열번호: 23의 중쇄 가변 영역, 서열번호: 24의 중쇄 가변 영역, 서열번호: 25의 중쇄 가변 영역 및 서열번호: 26의 중쇄 가변 영역.
본 발명은 또한, 하기의 가변 영역을 포함하는 키메라 경쇄에 관한 것이다: 서열번호: 3, 서열번호: 4, 서열번호: 5, 서열번호: 6, 서열번호: 7, 서열번호: 8, 서열번호: 9, 서열번호: 10, 서열번호: 11, 서열번호: 12, 또는 서열번호: 13.
본 발명은 또한, 하기의 가변 영역을 포함하는 키메라 중쇄에 관한 것이다: 서열번호: 16, 서열번호: 17, 서열번호: 18, 서열번호: 19, 서열번호: 20, 서열번호: 21, 서열번호: 22, 서열번호: 23; 서열번호: 24, 서열번호: 25 또는 서열번호: 26
필요에 따라, 예를 들어, 진단 또는 검정 목적 (예를 들어, 이미징)을 위해, 키메라 면역글로불린 (예를 들어, 그의 항원 결합 단편)은 검출가능 표지를 포함할 수 있다. 키메라 면역글로불린 또는 그의 항원 결합 단편을 표지화하기 위한 적당한 검출가능 표지 및 방법은 당해 기술에 공지되어 있다. 적당한 검출가능 표지는 예를 들어 하기를 포함한다: 방사성동위원소 (예를 들어, 인듐-111, 테크네튬-99m 또는 요오드-131), 양전자 방출 표지 (예를 들어, 불소-19), 상자성 이온 (예를 들어, 가들리늄 (III), 망간 (II)), 에피토프 표지 (tag), 친화도 표지 (예를 들어, 바이오틴, 아비딘), 스핀 표지, 효소, 형광 그룹 또는 화학발광 그룹. 표지가 이용되지 않을 때, (예를 들어, 키메라 면역글로불린 및 CD52 사이의) 복합체 형성은 표면 플라스몬 공명, ELISA, FACS, 또는 다른 적당한 방법으로 측정될 수 있다. 본 발명의 인간화 항체에 대해 상기 기재된 모든 적당한 방법 및 기술은 또한 본원에서 사용될 수 있다.
핵산 및 재조합 벡터
본 발명은 또한, 인간화 면역글로불린, 인간화 경쇄, 인간화 중쇄, 마우스 단클론 면역글로불린, 마우스 면역글로불린 경쇄, 마우스 면역글로불린 중쇄, 본 발명의 키메라 면역글로불린, 키메라 경쇄 또는 키메라 중쇄를 인코딩하는 서열을 포함하는 단리된 및/또는 재조합 (예를 들어, 본질적으로 순수한 것을 포함) 핵산에 관한 것이다.
"단리된" 또는 "정제된"으로 본원에서 언급된 핵산은 기원의 공급원의 게놈 DNA 또는 세포 RNA의 핵산으로부터 분리되었던 핵산(예를 들어, 이들은 세포 내에 또는 핵산, 예컨대 라이브러리의 혼합물 내에 존재한다)이고, 및 본질적으로 순수한 핵산, 화학 합성에 의해 생성된 핵산, 생물학적 및 화학적 방법의 조합에 의해 생성된 핵산, 및 단리된 재조합 핵산을 포함하는, 본원에 기재된 방법 또는 다른 적당한 방법에 의해 얻은 핵산을 포함한다. (참고 예를 들면, Daugherty, B.L. et al., Nucleic Acids Res., 19(9): 2471-2476 (1991); Lewis, A.P. 및 J.S. Crowe, Gene, 101: 297-302 (1991)).
"재조합"된 것으로 본원에 언급된 핵산은 인공 재조합의 방법, 예컨대 폴리머라제 사슬 반응 (PCR) 및/또는 제한 효소를 사용하여 벡터로 클로닝에 의존하는 절차에 의해 산출된 핵산을 포함하는, 재조합 DNA 방법론에 의해 생성된 핵산이다. "재조합" 핵산은 또한, 세포의 천연 기전를 통해 일어나는 재조합 이벤트로부터 얻지만, 설계된 핵산의 세포가 가능한 원하는 재조합 이벤트를 허용하고 만들도록 도입된 후 선택되는 것이다.
본 발명은 또한, 더욱 상세하게는, 인간화 면역글로불린, 마우스 면역글로불린 또는 인간 CD52에 대해 결합 특이성을 갖는 키메라 면역글로불린 (예, 비-인간 부분 (예를 들어, CDR)이 쥣과 항-CD52 단클론 항체로부터 유래되는 본 발명의 인간화 면역글로불린; 본 발명의 마우스 면역글로불린; 또는 비-인간 부분 (예를 들어, VH 및 VL)이 쥣과 항-CD52 단클론 항체) 또는 이의 부분 (예를 들어, 항원 결합 부분) (예를 들어, 그의 중쇄 또는 경쇄)으로부터 유래되는 본 발명의 키메라 면역글로불린을 인코딩하는 뉴클레오티드 서열을 포함하는 단리된 및/또는 재조합 핵산에 관한 것이다.
본 발명의 핵산은 인간 CD52에 대한 결합 특이성을 갖는 인간화 면역글로불린, 인간 CD52에 대한 결합 특이성을 갖는 마우스 면역글로불린 및 인간 CD52에 대한 결합 특이성을 갖는 키메라 면역글로불린을 생성하기 위해 사용될 수 있다. 예를 들어, 인간화 면역글로불린을 인코딩하는 핵산 (예를 들어, DNA (예컨대, cDNA), 또는 RNA) 또는 하나 이상의 핵산, 마우스 면역글로불린 또는 본 발명의 키메라 면역글로불린은 적당한 숙수세포에서 서열의 추가 조작 또는 인코딩된 면역글로불린의 생성을 위해 적당한 구조물 (예를 들어, 재조합 벡터)에 혼입될 수 있다.
인간 CD52에 대한 결합 특이성을 갖는 인간화 면역글로불린, 인간 CD52에 대한 결합 특이성을 갖는 마우스 면역글로불린 또는 인간 CD52에 대한 결합 특이성을 갖는 키메라 면역글로불린의 발현에 적당한 구조물 또는 벡터 (예를 들어, 발현 벡터)가 또한 제공된다. 다양한 벡터는 이용가능하고, 이 벡터는 숙주세포에서 단일 복사 또는 다중 복사로 유지되거나 숙주세포'의 염색체(들)에 통합되게 되는 벡터이다. 구조물 또는 벡터는 적당한 숙주세포에 도입될 수 있고, 인간화 면역글로불린, 마우스 면역글로불린 또는 본 발명의 키메라 면역글로불린을 발현시키는 세포는 배양에서 생성 및 유지될 수 있다. 단일 벡터 또는 다중 벡터는 인간화 면역글로불린, 마우스 면역글로불린 또는 인간 CD52에 대한 결합 특이성을 갖는 키메라 면역글로불린의 발현을 위해 사용될 수 있다.
적당한 발현 벡터, 예를 들어 포유동물 세포 발현 벡터는 또한, 하기 중 하나 이상을 비제한적으로 포함하는 수많은 성분을 함유할 수 있다: 복제의 기원; 선택가능 마커 유전자; 하나 이상의 발현 대조군 인자, 예컨대 전사 대조군 인자 (예를 들어, 프로모터, 인핸서, 종결자), 및/또는 하나 이상의 번역 신호; 막 표적화 또는 분비를 위한 신호 서열 또는 선도 서열. 구조물 또는 벡터에서, 신호 펩타이드 서열은 구조물 또는 벡터 또는 다른 공급원에 의해 생성될 수 있다. 예를 들어, 면역글로불린의 전사 및/또는 번역 신호는 발현을 이끌기 위해 사용될 수 있다.
프로모터는 적당한 숙주세포에서 발현을 위해 제공될 수 있다. 프로모터는 구성적 또는 유도성일 수 있다. 예를 들어, 프로모터는 인간화 면역글로불린 또는 면역글로불린 사슬을 인코딩하는 핵산에 작동하능하게 연결될 수 있고, 이로써, 인코딩된 폴리펩타이드의 발현을 이끈다. 원핵세포 (예를 들어, 대장균에 대한 lac, tac, T3, T7 프로모터) 및 진핵세포 (예를 들어, 효소 알콜 데히드로게나아제 (ADH1), SV40, CMV) 숙주에 대한 다양한 적당한 프로모터가 이용가능하다. 당해 분야의 숙련가는 본 발명의 항-CD52 항체 또는 이의 부분을 발현시키기 위한 적당한 프로모터를 선택할 것이다.
또한, 벡터 (예를 들어, 발현 벡터)는 전형적으로 벡터를 운반하는 숙주세포의 선택을 위한 선택가능 마커, 및 복제가능 벡터의 경우에, 복제의 기원을 포함한다. 항생제 또는 약물 저항를 부여하는 생성물의 인코딩하는 유전자는 보통의 선택가능 마커이고 원핵세포 (예를 들어, β-락타마제 유전자 (암피실린 저항), Tet 유전자 (테트라사이실린 저항) 및 진핵생물체 세포 (예를 들어, 네오마이신 (G418 또는 제네티신), gpt (마이코페놀산), 암피실린, 또는 하이그로마이신 저항 유전자)에서 사용될 수 있다. 디하이드로폴레이트 환원효소 마커 유전자는 다양한 숙주에서 메토트렉세이트와의 선택을 허용한다. 숙주의 영양요구성 마커 (예를 들어, LEU2, URA3 , HIS3 )의 유전자 생성물을 인코딩하는 유전자는 종종 효소에서 선택가능 마커로서 사용된다. 바이러스 (예를 들어, 바큘로바이러스) 또는 파아지 벡터, 및 숙주세포, 예컨대 레트로바이러스 벡터의 게놈에 통합될 수 있는 벡터의 사용이 또한 고려된다.
따라서, 본 발명은 본 발명의 인간화 면역글로불린, 인간화 경쇄, 인간화 중쇄, 마우스 면역글로불린, 마우스 면역글로불린 경쇄, 마우스 면역글로불린 중쇄, 키메라 면역글로불린, 키메라 경쇄, 또는 키메라 중쇄를 인코딩하는 단리된 핵산 분자에 관한 것이다. 본 발명은 또한, 면역글로불린 및 그의 사슬 항원 결합 부분을 인코딩하는 단리된 핵산 분자에 관한 것이다. 본 발명의 핵산에 의해 인코딩된 폴리펩타이드 서열은 상기 및 하기 실시예에서 기재되어 있다.
일부 구현예에서, 본 발명의 핵산 및 벡터는 본 발명의 중쇄 (또는 이의 항원 결합 부분) 또는 경쇄 (또는 이의 항원 결합 부분)을 인코딩한다. 중쇄 인코딩 핵산 및 경쇄 인코딩 핵산 모두를 함유하는 숙주세포는 중쇄 및 경쇄 (또는 항체의 항원 결합 부분)를 포함하는 항체를 만들기 위해 사용될 수 있다. 중쇄 인코딩 핵산 및 경쇄 인코딩 핵산은 발현 벡터를 분리하기 위해 위치될 수 있다. 상기 핵산은 또한, 동일 또는 상이한 발현 대조군 하에서 단일 발현 벡터 상에 위치할 수 있다. 참고, 예를 들어, Cabilly 미국 특허 6,331,415; Fang 미국 특허 7,662,623.
인간
CD52
에 대한 특이성을 갖는
면역글로불린을 생성하는 방법
본 발명의 다른 양태는 본 발명의 항-인간 CD52 항체를 제조하는 방법에 관한 것이다. 본 발명의 항체는, 예를 들어 적당한 숙주세포에서 항체를 인코딩하는 하나 이상의 재조합 핵산의 발현에 의해 생성될 수 있다. 숙주세포는 임의의 적당한 방법을 사용하여 생성될 수 있다. 예를 들어, 본원에 기재된발현 구조물 (예를 들어, 하나 이상의 벡터, 예를 들어, 포유동물 세포 발현 벡터)은 적당한 숙주세포에 도입될 수 있고, 수득한 세포는 구조물(들) 또는 벡터(들)의 발현에 적당한 조건 하에서 (예를 들어, 배양에서, 동물에서, 식물에서) 유지될 수 있다. 적당한 숙주세포는 하기를 포함하는 원핵세포일 수 있다: 박테리아 세포, 예컨대 대장균 (예를 들어, 균주 DH5TM (Invitrogen, Carlsbad, CA)), 고초균 및/또는 다른 적당한 박테리아; 진핵생물체 세포, 예컨대 균류 또는 효소 세포 (예를 들어, Pichia pastoris, Aspergillus sp ., Saccharomyces cerevisiae, Schizosaccharomyces pombe, Neurospora crassa), 또는 다른 하등 진핵생물체 세포, 및 고등 진핵생물체의 세포, 예컨대 곤충 세포 (예를 들어, Drosophila Schnieder S2 세포, Sf9 곤충 세포 (WO 94/26087 (O'Connor), TN5B1-4 (HIGH 5) 곤충 세포 (Invitrogen), 포유동물 (예를 들어, COS 세포, 예컨대 COS-1 (ATCC 등록 번호 CRL-1650) 및 COS-7 (ATCC 등록 번호 CRL-1651), CHO (예를 들어, ATCC 등록 번호 CRL-9096), CHO DG44 (Urlaub, G. 및 Chasin, LA., Proc . Natl . Acac . Sci . USA, 77(7):4216-4220 (1980)), 293 (ATCC 등록 번호 CRL-1573), HeLa (ATCC 등록 번호 CCL-2), CV1 (ATCC 등록 번호 CCL-70), WOP (Dailey, L., et al., J. Virol ., 54:739-749 (1985)), 3T3, 293T (Pear, W. S., et al., Proc . Natl . Acad . Sci . U.S.A., 90:8392-8396 (1993)), NS0 세포, SP2/0 세포, HuT 78 세포 등)), 또는 식물 (예를 들어, 담배, 좀개구리밥 (lemna; 개구리밥(duckweed)), 및 조류(algae)). (참고, 예를 들어, Ausubel, F.M. et al., eds. Current Protocols in Molecular Biology, Greene Publishing Associates 및 John Wiley & Sons Inc. (1993)). 일부 구현예에서, 숙주세포는 다세포 유기체 (예를 들어, 식물 또는 동물)의 일부가 아니고, 예를 들어, 단리된 숙주세포이고, 또는 세포 배양의 일부이다.
본 발명은 또한, 본 발명의 핵산, 예를 들어, 벡터 (예를 들어, 발현 벡터)를 포함하는 세포에 관한 것이다. 예를 들어, 인간화 면역글로불린의 중쇄 및 경쇄, 마우스 면역글로불린의 중쇄 및 경쇄, 또는 키메라 면역글로불린의 중쇄 및 경쇄를 인코딩하는 핵산 (즉, 하나 이상의 핵산) (상기 면역글로불린은 인간 CD52에 대한 결합 특이성을 갖는, 또는 그와 같은 핵산(들)을 포함하는 구조물 (즉, 하나 이상의 구조물, 예를 들어, 하나 이상의 벡터)를 갖는다)은, 선택된 숙주세포에 적당한 방법 (예를 들어, 형질전환, 형질도입, 전기천공법, 감염)에 의해 적당한 숙주세포로 도입될 수 있고, 상기 핵산(들) 하나 이상의 발현 대조군 인자 (예를 들어, 벡터에서, 숙주세포 게놈에 통합된 세포에서 처리에 의해 만들어진 구조물에서)에 작동학능하게 연결되거나 연결되게 된다. 숙주세포는 (예를 들어, 인듀서, 적당한 염으로 보충된 적당한 배지, 성장 인자, 항생제, 영양보조물 등의 존재에서) 발현에 적당한 조건 하에서 유지될 수 있다, 이로써 인코딩된 폴리펩타이드(들)이 생성된다. 필요에 따라, 인코딩된 단백질 (예를 들어, 인간화 면역글로불린, 마우스 면역글로불린, 키메라 면역글로불린)은, 예를 들어, 숙주세포, 배양 배지, 또는 밀크(milk)로부터 단리될 수 있다. 이 공정은 이식유전자 동물의 숙주세포 (예를 들어, 젖샘 세포) 또는 식물 (예를 들어, 담배)에서 발현을 포함한다 (참고 예를 들면, WO 92/03918).
융합 단백질이 생성될 수 있고, 그 단백질에서, 면역글로불린 부분 (예를 들어, 인간화 면역글로불린; 면역글로불린 사슬)은 N 말단 위치, C 말단 위치 또는 융합 단백질에 대해 내부에서 비-면역글로불린 부분 (즉, 자연에서 발견되는 면역글로불린에서 생기지 않는 부분)에 연결된다. 예를 들어, 일부 구현예는 면역글로불린 서열(들)을 인코딩하는 핵산의 적당한 발현 벡터, 예컨대 pET 벡터 (예를 들어, pET-15b, Novagen), 파아지 벡터 (예를 들어, pCANTAB 5 E, Pharmacia), 또는 다른 벡터 (예를 들어, pRIT2T 단백질 A 융합 벡터, Pharmacia)에의 삽입에 의해 생성될 수 있다. 수득한 구조물은 발현을 위해 적당한 숙주세포로 도입될 수 있다. 발현시, 일부 융합 단백질은 적당한 친화도 매트릭스에 의해 세포 용해물로부터 단리 또는 정제될 수 있다 (참고, 예를 들어, Current Protocols in Molecular Biology (Ausubel, F.M. et al., Eds., Vol. 2, Suppl. 26, pp. 16.4.1-16.7.8 (1991)).
본 발명은 본원에 제공된 면역글로불린 (예를 들어, 본 발명의 인간화 면역글로불린, 인간화 경쇄 또는 인간화 중쇄, 마우스 면역글로불린, 마우스 경쇄 또는 마우스 중쇄, 키메라 면역글로불린, 키메라 중쇄, 또는 키메라 경쇄)을 인코딩하는 재조합 핵산(들)을 포함하는 숙주세포에 관한 것이다. 본 발명은 또한, 면역글로불린 또는 그의 사슬의 항원 결합 부분을 인코딩하는 재조합 핵산(들)을 포함하는 숙주세포에 관한 것이다. 일부 구현예에서, 숙주세포는 본원에 언급된 본 발명의 재조합 벡터 (예를 들어, 발현 벡터, 포유동물 세포 발현 벡터)를 포함한다.
본 발명은 또한, 본 발명의 면역글로불린 또는 면역글로불린 폴리펩타이드 사슬을 제조하는 방법에 관한 것이다. 하나의 구현예에서, 상기 방법은 본원에 기재된 본 발명의 숙주세포(예를 들어, 면역글로불린 또는 폴리펩타이드 사슬의 발현에 적당한 조건 하에서 면역글로불린 또는 폴리펩타이드 사슬 (예를 들어, 본 발명의 경쇄 및 중쇄, 경쇄만, 또는 중쇄만)를 인코딩하는 하나 이상의 단리된 핵산을 함유하는 숙주세포)를 유지하는 것을 포함한다. 예를 들어 숙주세포는 기질 또는 서스펜션에서 배양될 수 있다. 일부 구현예에서, 상기 방법은 추가로, 면역글로불린 또는 폴리펩타이드 사슬을 정제 또는 단리하는 단계를 포함한다.
본 발명은 또한, 파아지 디스플레이를 통해 면역글로불린을 제조하는 방법에 관한 것이다. 예를 들어, CD52 항원 상의 순수한 항체 파아지 디스플레이 라이브러리를 가려낼 수 있다. 대안적으로, 안내 받은 선택을 통해 면역글로불린을 제조하는 방법이 사용될 수 있다 (미국 특허 출원 공보 US 2006-0251658 A1.) 예를 들어, 공지된 항-CD52 항체의 고정된 중쇄 (및/또는 경쇄) CDR3 영역 주변에서 만들어진 종래의 라이브러리가 만들어질 수 있다. 중쇄 및 경쇄의 CDR1 및 CDR2 영역은 순수한 레퍼토리로부터 유래될 수 있다 (Osburn et al., Methods, 36:61-68 (2005)). 하나의 구현예에서, 항-CD52 ScFvs는 원하는 결합 특성을 갖는 마우스-인간 키메라 항체를 얻기 위해 사용될 수 있는 ScFv 순수한 항체 라이브러리로부터 산출될 수 있다. 이들 라이브러리는 원하는 결합 특성을 갖는 항체에 대해 스크리닝될 수 있다. ScFv 파아지 라이브러리가 사용될 수 있다. 예를 들어, 인간 CD52를 인식하는 ScFvs는 Vaughan et al. (1996)에서 본질적으로 기재되어 있는 재조합 인간 CD52에 대한 일련의 반복된 선택 주기에 따라 scFv 안내된 선택 라이브러리로부터 단리될 수 있다. 간단히, 라이브러리를 갖는 배양에 따라, 상자성 비드, 및 결합된 파아지에 미리 커플링된 고정된 항원은 자력 선별에 의해 회수될 수 있고, 한편, 미결합된 파아지는 세정 제거된다. 그 다음, 결합된 파아지는 Vaughan et al. (1996)에 의해 기재된 바와 같이 구조될 수 있고, 선변 공정이 반복될 수 있다.
특정 구현예에서, 순수한 인간 경쇄 가변 영역의 레퍼토리로 단쇄 포맷으로 융합된 마우스 항-CD52 항체의 중쇄의 전체 가변 도메인으로 이루어진 라이브러리가 제작된다. 선별 후 마우스 중쇄 가변 영역을 보완하는 인간 경쇄 가변 영역의 풀(pool)이 확인된다. 마우스 항-CD52 항체 중쇄 가변 도메인으로부터 순수한 인간 CDR1 및 CDR2 영역 및 고정된 CDR3 영역으로 이루어진 키메라 중쇄 가변 영역에 대한 단쇄 포맷에서 상기 융합된 상기 선택된 인간 경쇄 가변 영역의 레퍼토리로 이루어진 라이브러리가 제작된다. CD52 바인더에 대한 선별 후, 최고의 결합 클론이 선택된다. 6 CDR 영역 중 5개는 그 기원이 인간일 수 있고, 한편 중쇄 가변 영역의 CDR-3은 마우스 중쇄 가변 도메인의 최초 CDR3에 동일할 수 있다.
선별은 제조자의 추천에 따라 Dynabeads M-270 아민 (Dynal)에 커플링된 CD52를 사용하여 수행될 수 있다. 대안적으로, 바이오틴화된 CD52를 사용하는 선별은 제조자의 지침에 따라 1급 아민 특정 시약 석신이미딜-6-(바이오틴아미도) 헥사노에이트를 사용하여 준비될 수 있다 (EZ link NHS LC 바이오틴, Pierce).
선별로부터의 산출은 CD52에 대한 결합에 대한 경쟁하기 위한 원형질막주위 준비에서 존재하는 scFvs의 능력을 측정하는 경쟁 검정일 기반으로 한 높은 처리량 스크린에서 원형질막주위 준비로서 시험될 수 있다.
고처리량 스크린에서 경쟁할 수 있는 시료에 대해 하기에 기재된 DNA 서열화가 수행될 수 있다: Vaughan et al. (1996) 및 Osburn et al. (1996). 클론은 scFvs 또는 IgGs로서 발현 및 정제되고, CD52를 결합시키는 능력에 대해 평가되고, 예를 들어, 검정, 예컨대 항체 의존성 세포 매개 세포독성 (ADCC) 검정 및 보체 의존성 세포독성 (CDC) 검정을 사용하여 CD52 또는 이의 조합을 중화시킨다. 그 다음, 정제된 scFv 제제는 WO 01/66754의 실시예 3에서 기재된 바와 같이 준비될 수 있다. 정제된 scFv 제제의 단백질 농도는 BCA 방법 (Pierce)를 사용하여 결정되었다. 유사한 접근법은 고정된 면역글로불린 중쇄 또는 경쇄 (또는 VH 또는 VL)의 최적 파트너 (반대 사슬)에 대해 스크리닝하기 위해 사용될 수 있다.
특정 구현예에서, 본 발명은 인간 CD52에 대해 결합 특이성을 갖는 단클론 항체를 분비하는 하이브리도마를 생성하는 방법에 관한 것이고, 이 방법은 CD52 이식유전자 마우스의 림프구를 인간 CD52 이식유전자 마우스로서 동일한 균주 (예를 들어, CD1)를 갖는 비-이식유전자 마우스에 투여하는 것을 포함하고, 이로써, 면역화된, 비-이식유전자 마우스를 생성한다. 면역화된, 비-이식유전자 마우스의 비장세포는 불멸화된 세포와 접촉되고, 이로써, 융합된 세포를 생성하고, 융합된 세포는, 인간 CD52에 대한 결합 특이성을 갖는 단클론 항체를 분비하는 하이브리도마가 생성되는 조건 하에서 유지되고, 이로써, 인간 CD52에 대해 결합 특이성을 갖는 단클론 항체를 분비하는 하이브리도마를 생성한다.
독소 부분 또는 독소를 함유하는 면역글로불린
본 발명은 또한, 독소 부분 또는 독소를 포함하는 면역글로불린에 관한 것이다. 적당한 독소 부분은 독소 (예를 들어, 표면 활성 독소, 세포독소)을 포함한다. 독소 부분 또는 독소는 임의의 적당한 방법을 사용하여 면역글로불린에 연결 또는 접합될 수 있다. 예를 들어, 독소 부분 또는 독소는 직접 또는 적당한 링커를 통해 면역글로불린에 공유결합될 수 있다. 적당한 링커는 세포 효소 (예를 들어, 세포 에스테라제, 세포 프로테아제, 예컨대 카뎁신 B)에 대한 분열 부위를 포함하는, 비-절단성 또는 절단성 링커, 예를 들어, pH 절단성 링커 또는 링커를 포함할 수 있다. 그와 같은 절단성 링커는, 면역글로불린이 내면화된 후, 독소 부분 또는 독소를 방출할 수 있는 면역글로불린을 제조하기 위해 사용될 수 있다.
독소 부분 또는 독소를 면역글로불린에 연결 또는 접합하기 위한 다양한 방법이 사용될 수 있다. 선택된 특정 방법은 링커 또는 접합될 독소 부분 또는 독소 및 면역글로불린에 의존할 것이다. 필요에 따라, 말단 관능 그룹을 함유하는 링커는 면역글로불린 및 독소 부분 또는 독소를 연결하기 위해 사용될 수 있다. 일반적으로, 접합은 반응성 관능 그룹을 함유하고 (또는 반응성 관능 그룹을 함유하기 위해 변형된) 독소 부분 또는 독소를 링커와 또는 직접 면역글로불린과 반응시켜서 달성된다. 공유결합은 적당한 조건 하에서 화학 부분 또는 관능 그룹를 함유하고 (또는 함유하기 위해 변형된) 독소 부분 또는 독소를 제2 화학 그룹과 반응시켜서 형성되고, 이로써 공유결합을 형성한다. 필요에 따라, 적당한 반응성 화학 그룹은 임의의 적당한 방법을 사용하여 면역글로불린 또는 링커에 첨가될 수 있다. (참고, 예를 들어, Hermanson, G. T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996).) 많은 적당한 반응성 화학 그룹 조합은 당해 기술분야에서 공지되어 있고, 예를 들어 아민 그룹은 친전자성 그룹, 예컨대 토실레이트, 메실레이트, 할로 (클로로, 브로모, 플루오로, 아이오도), N-하이드록시석신이미딜 에스테르 (NHS) 등과 반응할 수 있다. 티올은 말레이미드, 아이오도아세틸, 아크릴롤릴, 피리딜 디설파이드, 5-티올-2-니트로벤조산 티올 (TNB-티올) 등과 반응할 수 있다. 알데히드 관능 그룹은 아민- 또는 히드라지드 함유 분자와 커플링될 수 있고, 아지드 그룹은 3가 인 그룹과 반응하여 포스포르아미데이트 또는 포스포르이미드 연결을 형성할 수 있다. 활성 그룹을 분자로 도입하기 위한 적당한 방법은 당해 분야에 공지되어 있다 (참조 예를 들어, Hermanson, G. T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996)).
적당한 독소 부분 및 독소는, 예를 들어, 마이탄시노이드 (예를 들어, 마이탄시놀, 예를 들어, DM1, DM4), 탁산, 칼미케아마니신, 듀오카르마이신, 또는 이의 유도체를 포함한다. 마이탄시노이드는, 예를 들어, 마이탄시놀 또는 마이탄시놀 유사체일 수 있다. 마이탄시놀 유사체의 예는 변형된 방향족 고리를 갖는 것들 (예를 들어, C-19-데클로로, C-20-데메톡시, C-20-아실옥시) 및 다른 위치에서 변형을 갖는 것들 (예를 들어, C-9-CH, C-14-알콕시메틸, C-14-하이드록시메틸 또는 아셀옥시메틸, C-15-하이드록시/아실옥시, C-15-메톡시, C-18-N-데메틸, 4,5-데옥시)를 포함한다. 마이탄시놀 및 마이탄시놀 유사체는 예를 들어, 미국 특허 번호 5,208,020 및 6,333,410에서 기재되어 있고, 이의 내용은 참고로 본원에 통합된다. 마이탄시놀은, 예를 들어, N-석신이미딜 3-(2-피리딜디티오)프로프리오네이트 (N-석신이미딜 4-(2-피리딜디티오)펜타노에이트 (또는 SPP)로로 지칭함), 4-석신이미딜-옥시카보닐-a-(2-피리딜디티오)-톨루엔 (SMPT), N-석신이미딜-3-(2-피리딜디티오)부티레이트 (SDPB), 2 이미노티올란, 또는 S-아세틸석신산 무수물을 사용하여 항체 및 항체 단편에 커플링될 수 있다. 탁산은, 예를 들어, 탁솔, 탁소테르, 또는 독창적인 탁산일 수 있다 (참고, 예를 들어, WO 01/38318). 칼미케아마니신은, 예를 들어, 브로모-복합체 칼미케아마니신 (예를 들어, 알파, 베타 또는 감마 브로모-복합체), 아이오도-복합체 칼미케아마니신 (예를 들어, 알파, 베타 또는 감마 아이오도-복합체), 또는 유사체 및 그의 모방체일 수 있다. 브로모-복합체 칼미케아마니신은 I1-BR, I2-BR, I3-BR, I4-BR, J1-BR, J2-BR 및 K1-BR을 포함한다. 아이오도-복합체 칼미케아마니신은 I1-I, I2-I, I3-I, J1-I, J2-I, L1-I 및 K1-BR을 포함한다. 칼미케아마니신 및 돌연변이체, 유사체 및 그의 모방체는, 예를 들어, 미국 특허 번호 4,970,198; 5,264,586; 5,550,246; 5,712,374, 및 5,714,586에서 기재되어 있고, 이들 각각의 내용은 참고로 본원에 통합된다. 듀오카르마이신 유사체 (예를 들어, KW-2189, DC88, DC89 CBI-TMI, 및 이의 유도체)는, 예를 들어, 미국 특허 번호 5,070,092, 미국 특허 번호 5,187,186, 미국 특허 번호 5,641,780, 미국 특허 번호 5,641,780, 미국 특허 번호 4,923,990, 및 미국 특허 번호 5,101,038에서 기재되어 있고, 이들 각각의 내용은 참고로 본원에 통합된다.
다른 독소의 예는 하기를 비제한적으로 포함한다: 대사길항제 (예를 들어, 메토트렉세이트, 6-머캅토퓨린, 6-티오구아닌, 시타라빈, 5-플루오로우라실 데카르바진), 알킬화제 (예를 들어, 메클로르에타민, 티오에파 클로르암부실, CC-1065 (참조 US 특허 번호. 5,475,092, 5,585,499, 5,846,545), 멜팔란, 카르무스틴 (BSNU) 및 로무스틴 (CCNU), 사이클로포스파미드, 부설판, 디브로모만니톨, 스트렙토조토신, 미토마이신 C, 및 시스-디클로로디아민 백금 (II) (DDP) 시스플라틴), 안트라사이클린 (예를 들어, 다우노루비신 (이전에는, 다우노마이신) 및 독소루비신), 항생제 (예를 들어, 닥티노마이신 (이전에는, 악티노마이신), 블레오마이신, 미트라마이신, 미토마이신, 퓨로마이신 안트라마이신 (AMC)), 듀오카르마이신 및 유사체 또는 이의 유도체, 및 세포분열억제 물질(anti-mitotic agent) (예를 들어, 빈크리스틴, 빈블라스틴, 탁솔, 아우리스타틴 (예를 들어, 아우리스타틴 E) 및 마이탄시노이드, 및 유사체 또는 이의 유사체).
독소는 또한, 표면 활성 독소, 예컨대 유리 라디칼 생성기 (예를 들어, 독소 부분 함유 셀레늄)인 독소, 또는 부분을 함유하는 방사성핵종일 수 있다. 부분을 함유하는 적당한 방사성핵종은 예를 들어, 하기를 함유하는 부분을 포함한다: 방사성 요오드 (131I 또는 125I), 이트륨 (90Y), 루테튬 (177Lu), 악티늄 (225Ac), 프라세오디뮴, 아스타틴 (211At), 레늄 (186Re), 비스무트 (212Bi 또는 213Bi), 인듐 (111In), 테크네튬 (99mTc), 인 (32P), 로듐 (188Rh), 황 (35S), 탄소 (14C), 트리튬 (3H), 크로뮴 (51Cr), 염소 (36Cl), 코발트 (57Co 또는 58Co), 철 (59Fe), 셀레늄 (75Se), 또는 갈륨 (67Ga).
독소는 박테리아 공급원, 예를 들어, 디프테리아 독소, 슈도모나스 외독소 (PE) 및 식물 단백질로부터 단백질, 폴리펩타이드 또는 펩타이드일 수 있고, 예를 들어, 리신의 A 사슬 (RTA), 리보솜 불활성 단백질 (RIPs) 겔로닌, 포크위드(pokeweed) 항-바이러스 단백질, 사포린, 및 도데칸드론이 독소로서 사용하기 위해 고려된다.
결합하고, 무능하게 하고, 분해를 촉진하고, 또는 특정 표적 단백질을 산출하는데 책임있는 mRNA의 생성을 방지하기 위해 설계된 핵산의 안티센스 화합물이 또한 독소로서 사용될 수 있다. 안티센스 화합물은 안티센스 RNA 또는 DNA, 단일 또는 이중 가닥, 올리고뉴클레오티드, 또는 이의 유사체를 포함하고, 이는 개체 mRNA 종에 특이적으로 혼성화할 수 있고, 전사 및/또는 mRNA 종의 RNA 프로세싱 및/또는 번역 of 인코딩된 폴리펩타이드의 번역을 방지하고, 이로써, 각각의 인코딩된 폴리펩타이드의 양의 감소에 영향을 미친다. Ching, et al., Proc . Natl . Acad. Sci . U.S.A. 86: 10006-10010 (1989); Broder, et al., Ann. Int . Med. 113: 604-618 (1990); Loreau, et al., FEBS Letters 274: 53-56 (1990). 유용한 안티센스 치료제는 예를 들어: Veglin TM (VasGene) 및 OGX-011 (Oncogenix)를 포함한다.
독소는 또한 광활성제일 수 있다. 적당한 광활성제는 포르피린(porphyrin) 기반 물질, 예컨대 포르파이머(porfimer) 나트륨, 그린(green) 포스피린, 클로린(chlorin) E6, 헤마토포르피린 유도체 자체, 프탈로시아닌(phthalocyanine), 에티오퓨르퓨린(etiopurpurin), 텍사프린(texaphrin) 등을 포함한다.
독소는 세포내 표적에 결합하는 항체 또는 항체 단편일 수 있다. 그와 같은 항체 또는 항체 단편은 한정된 세포 소기관 또는 표적으로 이끌릴 수 있다. 예를 들어, 항체 또는 항체 단편은 erbB2, EGFR, BCR-ABL, p21Ras, Caspase3, Caspase7, Bcl-2, p53, Cyclin E, ATF-1/CREB, HPV16 E7, HP1, 유형 IV 콜라게나아제, 카뎁신 L뿐만 아니라 하기에 기재된 다른 것들로부터 선택되는 세포내 표적에 결합할 수 있다: Kontermann, R.E., Methods, 34:163-170 (2004), 이는 그 전체가 참고로 본원에 통합된다.
치료 방법 및 조성물
본 발명의 항체는 면역억제 및 면역제거에서 유용하다. 항체는 표적 CD52 발현 세포 (예를 들어, T 및 B 세포)를 표적으로 하고 치료가 필요한 대상체에서 그의 집단을 감소(본원에 사용된 바와 같이, 또는 "고갈")시킨다. 림프구 고갈은 다양한 질환 및 상태, 예컨대 염증, 자가면역 질환 및 암 (예를 들어, 림프구 (B 또는 T 세포) 악성종양)를 치료하는데 유용할 수 있다. 참고, 예를 들어, Reiff, A., Hematology, 10(2):79-93 (2005). 본 발명의 항체 또는 항원 결합 부분으로 치료될 수 있는 질환 및 상태의 예는 비제한적으로 하기를 포함한다: 다발성 경화증, 루푸스, 류마티스성 관절염, 이식편대 숙주 질환 (GVHD), 염증성 장질환, 혈관염, 베켓(Behcet) 질환, 베게너(Wegener) 육아종증, 쇼그렌 증후군, 포도막염, 건선, 경피증, 다발성근염, 유형 I (자가면역 기반) 당뇨병, 자가면역 혈구감소증 (예를 들어, 자가면역 호중구감소증, 수혈 의존 불응성 PRCA, 백혈병 및 림프종, 예컨대 큰 질환 및 B-세포 만성 림프성 백혈병을 갖는 비호지킨 림프종.
따라서, 본 발명의 양태는 본 발명의 유효량의 항체를 치료가 필요한 대상체 (예를 들어, 자가면역 질환, 혈액암을 갖는 인간 환자, 또는 이식을 받은 환자)에 투여하여 림프구 고갈 방법 및 염증, 자가면역 질환 또는 암의 치료 방법이다. 항체는 또한, 염증의 개시 또는 자가면역 질환 또는 암의 재발를 방지하기 위해서 예방적으로 투여될 수 있다. 예를 들어, 본 발명의 항체는 이식 (예를 들어, 줄기세포 이식, 동종 T 세포의 자가조직의 주입, 또는 고형 장기 이식)에 대한 환자를 준비시키기 위해 치료계획을 조절하는 일부로서 투여될 수 있다.
본 발명의 일부 항-CD52 항체는 우선적으로, CD52+ 세포의 어떤 집단을 표적으로 한다. 숙련가의 가능한 설명은, 이들 항체가 결합하는 에피토프가 CD52 단백질 상의 하나 이상의 카보히드레이트 그룹를 포함하고, 그와 같은 카보히드레이트 그룹은 하나의 세포 유형 대 다른 유형 상에서 발현된 CD52 상에서 더 우세할 수 있다는 것이다. 예를 들어, 본 발명자들은 항체 7F11, 5F7, 3G7, 및 11C11이 B 세포보다 더 큰 정도로 T 세포를 고갈시킨다는 것을 발견했다. 따라서, 이들 항체의 인간화 및 키메라 버젼은 더 작은 면역억제 부작용으로 T 세포 악성종양을 치료하기 위해 사용될 수 있다.
본 발명의 항체는 CD52 발현 세포를 표적으로 하기 때문에, 항체는 또한, T 세포 및 B 세포 외에 CD52+ 세포 유형을 고갈시키기 위해 사용될 수 있다. 예를 들어, 연구는, 혈관 백혈구 (VLC) 및 Tie2+ 단핵세포-높은 수준의 CD52를 발현시키는 골수성 세포-는 종양 혈관신생을 촉진하고, 항-VEGF 치료에 대한 종양 저항에 기여한다는 것을 보여주었다. Pulaski et al., J. Translational Med . 7:49 (2009). 따라서, 본 발명의 항-CD52 항체는 VLC 및 Tie2+ 단핵세포를 표적으로 하여 종양 혈관신생을 억제하기 위해 사용될 수 있다. 이를 위해, 항-CD52 항체는 신혈관형성의 부위, 예컨대 종양 부위에서 전신으로 또는 국소적으로 투여될 수 있다. 항-CD52 항체 치료법은 진료표준 암 치료, 예컨대 화학요법, 수술, 또는 방사선, 또는 다른 표적 치료법, 예컨대 항-VEGF 항체 치료법과 함께 사용될 수 있다. 항-CD52 항체 치료법은, 예를 들어, 유방암, 폐암, 신경아교종, 직장암, 및 항-VEGF 항체의 임의의 다른 징후를 치료하기 위해 사용될 수 있다. 항-CD52 항체 치료법는 또한, 비-종양 신생혈관형성 상태를 포함하는 다른 신혈광형성에서 사용될 수 있다.
본 발명의 항체는 병용 치료로, 개체 (예를 들어, 인간) 단독 또는 다른 제제 (예를 들어, 면역억제제)와 공동으로 투여될 수 있다. 항체는 추가 제제의 투여 전에, 함께 또는 그 이후에 투여될 수 있다. 일부 구현예에서, 추가 제제는, 예를 들어, 항-염증 화합물, 예컨대 설파살라진(sulfasalazine), 다른 비-스테로이드성 항-염증 화합물, 또는 스테로이드성 항-염증 화합물이다. 일부 구현예에서, 추가 제제는 다른 림프구 고갈 항체, 예컨대 다른 항-CD52 항체, 항-CD20 항체, 항-BAFF 항체, 항-BAFF-R 항체 등이다. 일부 구현예에서, 추가 제제는, 예를 들어, 사이토킨 (예를 들어, IL-7), 항-사이토킨 수용체 항체, 또는 가용성 수용체는 항-CD52 항체에 의해 매개되는 림프구고갈 다름에 일어나는 재구성 프로세스를 왜곡, 조작 및/또는 증대시킨다 (참고, 예를 들어, Sportes et al.," Cytokine Therapies: Ann. N.Y. Acad . Sci . 1182:28-38 (2009)). 또 다른 구현예에서, 합성 펩타이드 모방체는 본 발명의 면역글로불린과 함께 투여될 수 있다.
연구는, 알렘투주맙에 의한 림프구 고갈이 호중구 및 NK 세포에 의해 매개된다는 것을 보여주었다 (Hu et al., Immunology 128:260-270 (2009). 따라서, 병용 치료의 구현예에서, 호중구 및 NK 세포를 자극하는 제제는 항체 치료를 증대하기 위해 항-CD52 항체 치료 전, 동안에 또는 그 후에 환자에게 투여될 수 있다. 호중구 및/또는 NK 세포를 자극하는 것은 비제한적으로 하기를 포함한다: (1) 그의 분리 속도를 증가시킴, (2) 항-CD52 항체의 이소타입에 상응하는 Fc 수용체 (예를 들어, FcγRIIIa 및 FcγRIIIb, FcγRII, FcγRI, 및 FcαRI)의 세포 표면발현을 증가시킴, (3) 순환 세포의 수를 결집 및 증가시킴, (4) 세포를 표적 부위 (예를 들어, 종양, 염증, 또는 조직 손상의 부위)에 보강함, 및 (5) 그의 세포독성 활성을 증가시킴. 호중구 및/또는 NK 세포를 자극하는 제제의 예는 예를 들어 하기를 포함한다: 과립구 단핵세포 콜로니 자극 인자 (GM-CSF) (예를 들어, LEUKINE® 또는 사크그라모스팀(sargramostim) 및 몰그라모스팀(molgramostim)); 과립구 콜로니 자극 인자 (G-CSF) (예를 들어, NEUPOGEN® 또는 필그라스팀(filgrastim), 페길화된 필그라스팀(filgrastim), 및 레노그라스팀(lenograstim)); 인터페론 감마 (예를 들어, ACTIMMUNE®); CXC 케모카인 수용체 4 (CXCR4) 길항제 (예를 들어, MozobilTM 또는 플레릭사포르(plerixafor)); 및 CXC 케모카인 수용체 2 (CXCR2) 효능제. 환자의 호중구 카운트는 최적 치료 효능을 보장하기 위해 주기적으로 모니터될 수 있다. 환자의 호중구 카운트는 또한, 항-CD52 항체 치료의 개시 전에 측정될 수 있다. 자극기의 양은 환자의 호중구 카운트를 기준으로 조정될 수 있다. 고투여량의 자극기는, 환자가 정상 호중구 카운트보다 더 낮은 카운트를 가질 때 사용될 수 있다. 항-CD52 항체에 의한 치료에 의해 일어날 수 있는 호중구감소증의 기간 동안에, 고투여량의 호중구 자극기는 또한, 항-CD52 항체의 효과를 최대화하기 위해 투여될 수 있다.
호중구 및/또는 NK 자극이 항-CD52 항체 치료의 효능을 개선하기 때문에, 병용 치료의 이 구현예는, 유사한 치료 효능을 유지하는 동안에 환자에서 항체를 덜 사용할 수 있게 한다. 치료 효능을 유지하는 동안에 항-CD52 항체를 덜 사용하는 것은 투여된 항체에 대한 환자의 면역 반응뿐만 아니라 2차 자가면역 (항-CD52 항체 치료 동안에 또는 그 후에 일어나는 자가면역)의 발달을 포함하는 항-CD52 항체의 부박용을 감소시키는데 도움을 줄 수 있다. 병용 치료의 이 구현예는 또한, 예를 들어, 환자는 호중구감소증을 가지고 있을 때, 종양학 세팅에서 유용하다.
병용 치료의 또 하나의 구현예에서, 항-CD52 항체 치료를 증대시키기 위해 조절 T 세포의 자극시를 사용할 수 있다. 우리의 데이타는, 항-CD52 항체가 다른 CD4+ T 세포와 비교하여 훨씬 적은 정도로 CD4+CD25+FoxP3+ 조절 T 세포를 고갈시킨다는 것을 보여준다. 조절 T 세포 (" Treg" 또는 억제제 T 세포로도 공지됨)는 접촉 의존성 또는 접촉 비의존성 (예를 들어, 사이토킨 생성) 기전을 통해 다른 림프 세포의 증식 및/또는 기능을 억제할 수 있는 세포이다. 조절 T 세포의 몇 개의 유형이 기재되었고, 그 유형은 γδ T 세포, 천연 킬러(killer) T (NKT) 세포, CD8+T 세포, CD4+T 세포, 및 이중 음성 CD4-CD8-T 세포를 포함한다. 참고, 예를 들어, Bach et al., Immunol . 3:189-98 (2003). CD4+CD25+FoxP3+ 조절 T 세포는 "천연 발생적" 조절 T 세포로 불리며; 그 세포는 CD4, CD25 및 포크헤드 패밀리(forkhead family) 전사 인자 FoxP3 (포크헤드 박스 p3)을 발현시킨다. 따라서, 이 병용 치료의 구현예에서, 림프 고갈에 따르는 면역계의 조성을 왜곡하기 위해 항-CD52 항체 치료의 전, 동안에 또는 그 후에 CD4+CD25+FoxP3+ 조절 T 세포를 자극하는 제제를 투여할 수 있다. 상기 제제는, 예를 들어, T 세포를 활성화시키고, 세포의 집단을 안정화시키고/거나 확대하고, 세포의 순환을 결집시키고 증가시키고, 세포를 표적 부위에 보충한다. 그와 같은 제제의 예는 하기이다: 라파마이신, 활성 또는 latent TGF- β (예를 들어, TGF-β1, TGF-β2, TGF-β3, TGF-β4, 및 TGF-β5), IL-10, IL-4, IFN-α, 비타민 D3, 덱사메타손, 및 마이코페노레이트 모페틸 (mycophenolate mofetil) (참고, 예를 들어, Barrat et al., J. Exp . Med . 195:603-616 (2002); Gregori et al., J Immunol . 167: 1945-1953 (2001); Battaglia et al., Blood 105: 4743-4748 (2005); Battaglia et al., J. Immunol. 177:8338-8347 (2006)).
본 발명에서, 치환을 치료하기 위한 항-CD52 항체의 유효량은 하나 이상의 원하는 임상 결과변수에 치료된 대상체가 도달하도록 도와주는 양이다. 예를 들어, 루푸스에 대해 (이의 징후는 전신 홍반성 루푸스, 루푸스 신장염, 피부 홍반성 루푸스, CNS 루푸스, 심장혈관 징후, 폐 징후, 간장 징후, 혈액 징후, 위장관 징후, 근골격 징후, 신생아 홍반성 루푸스, 어린이 전신 홍반성 루푸스, 약물 유도된 홍반성 루푸스, 항-인지질 증후군, 및 루푸스 징후로 귀결되는 보체 결핍 증후군을 포함한다; 참고, 예를 들어, Robert G. Lahita, Editor, Systemic Lupus Erythematosus, 제4판, Elsevier Academic Press, 2004), 임상 결과변수는 병 걸린 기관계 (예를 들어, 루푸스 신장염에 대한 혈뇨 및/또는 단백뇨)를 모니커하고/하거나 몇 개의 기관계에 걸친 질환 중증도의 복합 스코어를 제공하는 질환 활성 지수를 사용하여 측정될 수 있다 (예를 들어, BILAG, SLAM, SLEDAI, ECLAM). 참고, 예를 들어, Mandl et al., "Monitoring patients with Systemic Lupus Erythematosus" in Systemic Lupus Erythematosus, 제4판, pp. 619-631, R.G. Lahita, Editor, Elsevier Academic Press, (2004).
자가면역 질환의 다른 예에서, 다발성 경화증 (재발-완화형, 2차 진행성, 일차 진행성, 및 진행성 재발형 다발성 경화증 포함 ((Lublin et al., Neurology 46 (4), 907-11 (1996))은, 예를 들어, 시험, 예컨대 자기 공명 영상 (MRI), 스파이널 탭 (spinal tap), 유발 전위 시험, 및 혈액 시료의 실험실 분석의 도움과 함께 증상 및 신견 실험의 히스토리에 의해 진단된다. MS에서, 치료 목표는 재발 빈도 및 중증도를 감소시키고, 질환 진행에서 일어나는 무능을 방지하고 조직 회복을 촉진한다 (Compston 및 Coles, 2008). 따라서, 상기 목표에 일치하는 임상 결과변수를 달성하는데 도움이 되는 항-CD52 항체의 양은 치료를 위한 항체의 유효량이다.
면역원성를 최소화하기 위해, 인간화 항체는 본 발명의 치료 방법 및 조성물에서 인간 환자를 치료하기 위해 사용되는 것이 바람직하다. 반복된 투여가 필요하지 않는 경우에, 본 발명의 마우스:인간 키메라 항체를 인간 환자에 투여하기에 또한 적당할 수 있다.
본 발명의 항체는 Campath-1H® (예를 들어, Campath-1H® 난치 개체)에 대한 중화 항체를 개발한 Campath-1H®으로 이전에 치료한 개체를 치료하기 위해 사용될 수 있다. 예를 들어, 상기 항체는 Campath-1H® (예를 들어, Campath-1H® 치료의 하나 이상의 과정과 함께)로 이전에 치료되었고 추가 Campath-1H® 치료의 효능을 감소시키는 Campath-1H®으로 개발한 자가면역 질환 (예를 들어, 다발성 경화증, 루푸스, 혈관염) 및/또는 암 (예를 들어, 백혈병 (예를 들어, 만성 림프성 백혈병), 림프종 (예를 들어, 비호지킨 림프종))을 갖는 개체를 치료할 수 있었다. 상기 항체는, 본 발명의 인간화 항체 (예를 들어, 인간화 2C3, 12G6, 및 9D9)가 알렘투주맙에 대한 중화 항체의 존재에도 불구하고 인간 CD52에 결합할 수 있다는 것을 보여주었다. 또 다른 구현예에서, 상기 항체는, 본원에 기재된 다른 인간화 항체 중의 하나와 함께 본원에 기재된 특정 인간화 항체로, 치료가 어려운 개체를 치료할 수 있었다.
본 발명의 항체는 건강 보호 제공자에 의해 적당한 것으로 추정되는 임의의 시점에서 단일 단위 복용 또는 다중 복용으로 투여될 수 있다. 복용량은 당해 분야에서 공지된 방법으로 결정될 수 있고, 예를 들어, 개체의 연령, 민감도, 내성 및 전체 행복감에 의존할 수 있다. 다양한 투여 경로가 치료될 질환 또는 상태에 따라 사용될 수 있지만, 하기로 반드시 제한되는 것은 아니다: 비경구 (예를 들어, 정맥내, 동맥내, 근육내, 척수강내, 복강내, 피하 주사), 경구 (예를 들어, 음식물), 국부적으로, 국소, 흡입 (예를 들어, 기도, 비강내 또는 경구 흡입, 비강내 점적약), 또는 직장. 비경구 투여는 하나의 바람직한 투여 방식일 수 있다.
하나의 구현예에서, 본 발명의 항체는 Campath-1H®와 동일한 복용 계획(예를 들어, 만성 림프성 백혈병에 대한 Campath-1H®의 복용 계획)을 사용하여 환자에 투여된다. 또 다른 구현예에서, 본 발명의 항체는 항체의 제1 주기, 그 다음 항체의 적어도 하나의 추가 주기의 투여를 포함하는 계획으로 자가면역 질환 (예를 들어, 다발성 경화증 (MS))를 갖는 환자에 투여되고, 여기서, 각 치료 주기는 연속적인 일에 적용된 1 내지 5 복용을 포함하고, 여기서, 각각의 치료 주기는 적어도 1 - 24개월 (예를 들어, 12개월)에 의해 다음 주기로부터 분리된다. 예를 들어, 하나의 구현예에서, 다발성 경화증을 갖는 환자는 항체의 매 5일 복용을 포함하는 항체의 제1 주기, 그 다음, 항체 치료의 적어도 하나의 추가 주기로 치료되고, 여기서, 치료는 제1 주기 후 12개월에서 일어나고, 연속적인 일에 적용된 항체의 3 복용을 포함한다. 또 다른 구현예에서, MS를 갖는 환자는, 새롭게 한 MS 활성의 증거가 일단 관찰되었다면 단지 재치료된다 (참고, 예를 들어, WO 2008/031626; 이의 지침은 그 전체로 참고로 본원에 통합된다). 일부 구현예에서, MS의 더 진행된 형태 또는 다른 자가면역 질환의 더 진행된 형태를 갖는 환자(예컨대, 혈관염; 참고, 예를 들어, Walsh et al., Ann Rheum Dis 67:1322-1327 (2008))가 치료의 마지막 과정 후에 초기 재발을 경험한다면, 더 빈번한 치료 과정 (예를 들어, 매 4개월, 매 6개월)을 필요로 할 수 있다. 새롭게 한 MS 활성의 증거는 그와 같은 임상의가 이용할 수 있는 임의의 수단을 사용하여 치료 임상의 전문적인 판단일 기반으로 측정될 수 있다. 다양한 기술은, 비제한적으로, 임상 수단 (신경 장애의 재발 또는 진행) 또는 뇌 또는 척수의 자기 공명 영상 (MRI)에 의해 새롭게 한 MS 활성을 진단하기 위해 임상의가 현재 이용가능하다. 의료 실시자에 의해 이해되는 바와 같이, MRI를 통해 탐지된 질환 활성은 T1 (강화된 또는 비-강화된)- 또는 T2 강조 이미지 상의 신규 뇌 또는 척수 병변의 발생에 의해 또는 그와 같은 병변의 부피의 증가에 의해 나타날 수 있다. MS에 대한 진단 방법은 계속해서 진화하기 때문에, 새롭게 한 MS 활성을 탐지할 미래의 추가 방법 (예를 들어, 자화전이율 또는 MR-분광기)이 있을 것으로 예상된다. 새롭게 한 MS 활성을 탐지하기 위해 사용된 특정 진단 방법은 청구된 발명의 제한은 아니다. 어떤 구현예에서, 반복된 MRI는 임의의 소정 환자의 재치료가 필요한지 여부 및 그와 같은 환자의 재치료에 대한 최적 시점을 결정하기 위해 치료 주기 후의 고정 간격으로 수행된다. 일반적으로, 재치료는 질환 재발현 전에 임상적으로 수행되는 것이 바람직하다.
제형은 선택된 투여 경로 (예를 들어, 용액, 에멀젼)에 따라 변할 것이다. 투여될 항체를 포함하는 적당한 조성물은 생리적으로 허용가능한 비히클 또는 담체 내에서 준비될 수 있다. 조성물은 다중 복용을 포함하거나 단일 단위 복용 조성물일 수 있다. 용액 또는 에멀젼에 대해, 적당한 담체는 예를 들어, 염수 및 완충 배지를 포함하는, 수성 또는 알콜성/수성 용액, 에멀젼 또는 서스펜션을 포함한다. 비경구 비히클은 염화나트륨 용액, 링커(Ringer) 덱스트로오스, 덱스트로오스 및 염화나트륨, 락테이트화된 링거 또는 고정 오일을 포함할 수 있다. 정맥내 비히클은 다양한 첨가제, 보존제, 또는 유체, 영양물 또는 전해질 보충물을 포함할 수 있다 (참고, 일반적으로, Remington's Pharmaceutical Sciences, 제17판, Mack Publishing Co., PA, 1985). 흡입에 해애, 화합물은 가용될 수 있고, 투여를 위해 적당한 디스펜서에 적재될 수 있다 (예를 들어, 아토마이저, 네뷸라이저(nebulizer) 또는 가압 에어로졸 디스펜서).
진단 방법 및 조성물
본 발명의 면역글로불린은 또한, 조사 및 진단에서의 적용과 함께 다양한 프로세스에 유용하다. 예를 들어, 상기 면역글로불린은 (예를 들어, 서스펜션 중 예를 들어, 세포, 예컨대 림프구에 대해 친화도 정제 또는 다른 적당한 방법, 예컨대 유세포 분석기에 의해) 인간 CD52 또는 그의 돌연변이체를 검출, 단리 및/또는 정제하고, 인간 CD52 구조 (예를 들어, 형태)를 연구하고 기능화하기 위해 사용될 수 있다. 항체의 면역원성이 관심사항이 아닌 실험실내 적용을 위해, 본 발명의 마우스 및 키메라 항체는 인간화 항체에 부가하여 유용할 것이다.
본 발명의 면역글로불린은 진단 적용 (예를 들어, 실험실내, 생체외)에서 사용될 수 있다. 예를 들어, 본 발명의 인간화 면역글로불린은 (예를 들어, 조직 또는 체액 중 인간 CD52, 예컨대 염증 삼출물, 혈액, 혈청, 내장액, 조직 보유 인간 CD52를 발현시키는 세포 상에서) 시료 중 인간 CD52를 검출 및/또는 측정하기 위해 사용될 수 있다. 시료 (예를 들어, 조직 및/또는 체액)은 개체로부터 얻을 수 있고, 본원에 기재된 면역글로불린은 방법, 예컨대 유세포 분석기 (예를 들어, 서스펜션, 예컨대 림프구 중 세포에 대해), 효소 연결된 면역흡착 검정 (ELISA) (화학발광 검정, 방사성면역검정, 및 면역조직학 포함)을 포함하는, 인간 CD52 발현을 검출 및/또는 측정하기 위한 적당한 면역학적 방법에서 사용될 수 있다.
하나의 구현예에서, 시료 중 인간 CD52를 검출하는 방법이 제공되고, 이 방법은 면역글로불린의 인간 CD52에의 특이적 결합에 적당한 조건 하에서 시료를 본 발명의 면역글로불린과 접촉시키고, 형성된 항체-CD52 복합체를 검출하는 것을 포함한다. 방법의 적용에서, 본원에 기재된 면역글로불린은, 예를 들어, 염증성 장질환 (IBD), 자가면역 질환 (예컨대, 다발성 경화증 및 루푸스), 암 (예컨대, 비호지킨 림프종 및 만성 림프성 백혈병), 또는 다른 상태와 (예를 들어, 염증 생긴 조직 중) 인간 CD52의 증가된 발현 사이의 회합을 검출하기 위해 인간 CD52 반응성 및/또는 발현 (예를 들어, 면역조직학적으로)에 대해 정상 대 염증 생긴 조직 (예를 들어, 인간으로부터)을 분석하기 위해 사용될 수 있다. 따라서, 본 발명의 면역글로불린은, 질환의 존재, 질환 진행 및/또는 질환 예를 들어, 염증 질환 의 치료에서의 항-인간 CD52 치료의 효능이 평가될 수 있다는 것을 통해 정상 및 염증 생긴 조직 중 인간 CD52의 존재의 평가의 면역학적 방법을 허용한다.
또한, 면역글로불린은, 고갈이 어떻게 효과적인지를 평가하기 위해서뿐만 아니라 CD52의 발현에서 임의의 하향조절이 있었는지를 측정하기 위해 고갈 항-CD52 치료 항체로 치료한 후에 조직을 시험하기 위해 사용될 수 있다 (Rawstrom et al., Br. J. Heam ., 107:148-153 (1999)).
다른 식으로 정의되지 않는 한, 본 명세서에서 사용된 모든 기술적 및 과학적 용어는 본 발명이 속하는 기술분야에서 통상적으로 숙련된 전문가에 의해서 통상적으로 이해되는 것과 동일한 의미를 갖는다. 예시적인 방법 및 물질은 이하에 기술되지만, 본 명세서에 기술된 것과 유사하거나 동등한 방법 및 물질이 본 발명의 실시 또는 시험에 사용될 수도 있다. 본 명세서에 언급된 모든 출판물 및 그 밖의 다른 참고문헌은 온전히 참고로 포함된다. 대립되는 경우에는 정의를 포함하는 본 명세서가 통제할 것이다. 다수의 자료가 본 명세서에 인용되어 있지만, 이 인용은 이들 자료 중의 어떤 것이라도 본 기술분야에서의 일반적인 상식의 일부분을 형성한다는 것을 인정하는 것은 아니다. 본 명세서 및 특허청구범위 전체에 걸쳐서 단어 "포함한다 (comprise)", 또는 "포함한다 (comprises)" 또는 "포함하는 (comprising)"와 같은 이형어는 언급된 정수 또는 정수의 그룹을 포함하지만 어떤 다른 정수 또는 정수의 그룹을 배제하지 않음을 의미하는 것으로 이해될 수 있다. 물질, 방법 및 예는 단지 예시적인 것이며, 제한하고자 하는 것은 아니다.
인간 CD52에 대해 결합 특이성을 갖는 본 발명의 항-인간 CD52 항체를 제공함으로써 각종 면역억제 및 면역제거 관련 질환을 효과적으로 치료할 수 있게 되었다.
도 1a-1b는 새로운 항-CD52 모노클로날 항체의 발생의 개략도이다. 일반적 도식은 도 1a에 나타내고, 마우스 항-인간 CD52 항체 클론뿐만 아니라 이들의 이소타입의 명칭은 도 1b에 나타낸다.
도 2는 몇 가지 마우스 항-인간 CD52 카파 경쇄 서열(SEQ ID NOS:1-13)의 아미노산 서열을 정렬한 것이다. 캠퍼스-1G는 인간화된 캠퍼스-1H 항체가 유래하는 랫트 모노클로날 항체이다.
도 3은 몇 가지 마우스 항-인간 CD52 중쇄 서열(SEQ ID NOS:14-26)의 아미노산 서열을 정렬한 것이다.
도 4는 야생형 CD52 및 10 개의 돌연변이체 CD52 단백질(위에서 아래로 SEQ ID NOS: 104-114)을 정렬한 것이다.
도 5a는 CD52 알라닌 주사(scanning) 돌연변이체를 발현하는 세포 상에서 항체 4B10 및 7F11의 FACS-기본 N-말단 결합 프로필을 예시한다.
도 5b는 CD52 알라닌 주사 돌연변이체를 발현하는 세포 상에서 항체 CF1D12, 3G7, 9D9, 5F7, 4G7, 및 11C11의 FACS-기본 중앙 부위 결합 프로필을 예시한다.
도 5c는 CD52 알라닌 주사 돌연변이체를 발현하는 세포 상에서 항체 캠퍼스-1H ("Campath 1H"), 2C3, 12G6, 및 23E6의 FACS-기본 결합 프로필을 예시한다.
도 5d는 키메릭 모노클로날 항체의 패널로 프로브화된 CD52 +/- N 결합 글리코실화의 면역블럿(immunoblots)을 도시한다. "C1H"는 캠퍼스-1H(Campath-1H®)를 의미한다.
도 6은 CHO-K1 CD52 #67 세포 상에서 스크리닝한 다양한 키메릭 항-CD52 항체 상에서의 1.5 시간 CDC 시험의 결과를 나타내는 그래프이다. 그 결과는 키메릭 항체 4B10 및 7F11이 캠퍼스-1H("Campath 1H")와 동등하거나 그보다 우수함을 나타낸다.
도 7은 CHO-K1 CD52 #67 세포 상에서 스크리닝한 CD52에 대한 다양한 키메릭 IgG1 항체 상에서의 14 시간 ADCC 시험의 결과를 나타내는 그래프이다. 그 결과는 키메릭 항체 2C3 및 12G6이 캠퍼스-1H("Campath 1H")와 동등하거나 그보다 우수함을 나타낸다.
도 8a-8c는 규정된 인간 림프구 집단에 대한 다양한 항-CD52 항체 및 캠퍼스-1H ("Campath 1H") 항체의 비교 결합을 예시한다. 이들 도면은 FACS 시험에 의해서 스크리닝된 키메릭 항체의 결합능의 계층(hierarchy)을 나타낸다. 가장 오른쪽까지의 곡선은 최고의 결합능을 나타내는 반면에 왼쪽으로의 곡선은 더 낮은 친화성을 갖는 결합을 나타낸다.
도 9a-9c는 키메릭 항체 7F11, 8G3, 23E6, 12G6, 4B10, 또는 5F7, 또는 캠퍼스-1H ("Cam")를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포 (도 9a), CD8 T 세포 (도 9b) 및 CD19 B 세포 (도 9c)의 레벨을 예시하는 그래프이다.
도 10a-10c는 키메릭 항체 7F11, 8G3, 23E6, 12G6, 4B10, 또는 5F7, 또는 캠퍼스-1H ("Cam")를 투여한지 72 시간 후에 비장 내의 CD4 T 세포 (도 10a), CD8 T 세포 (도 10b) 및 CD19 B 세포(도 10c)의 레벨을 예시하는 그래프이다.
도 11a-11c는 키메릭 항체 2C3, 9D9, 4B10, 3G7, 또는 11C11, 또는 캠퍼스-1H ("Cam")를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포 (도 11a), CD8 T 세포 (도 11b) 및 CD19 B 세포(도 11c)의 레벨을 나타내는 그래프이다.
도 12는 7F11, 4B10, 또는 12G6 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 (Kaplan Meier Survival) 그래프이다.
도 13은 2C3, 8G3, 또는 23E6 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 그래프이다.
도 14는 9D9 또는 4B10 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 그래프이다.
도 15는 2C3 또는 11C11 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 그래프이다.
도 16은 가장 근접한 부합된 인간 배선 서열(SEQ ID NO: 97) 및 인간화된 중쇄 가변 부위 서열(SEQ ID NO: 98)과 함께 마우스 항-인간 CD52 항체 4B10 중쇄 가변 부위(SEQ ID NO: 96) 서열을 정렬한 것이다. 또한, 가장 근접한 부합된 인간 배선 서열(SEQ ID NO: 100) 및 인간화된 경쇄 가변 부위 서열(SEQ ID NO: 101)과 함께 마우스 항-인간 CD52 항체 4B10 경쇄 가변 부위(SEQ ID NO: 99) 서열을 정렬하여 나타낸다.
도 17은 인간화된 4B10 중쇄 (SEQ ID NO: 103) 및 경쇄 (SEQ ID NO: 102) 가변 부위 서열을 나타낸다.
도 18은 인간화된 항체 4B10-H1/K1 ("4B10-Humanized") 및 키메릭 항체 4B10이 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 그래프이다.
도 19는 인간화된 항체 4B10 -H1/K1 ("4B10 Humanized") 및 키메릭 항체 4B10이 CD52를 발현하는 세포 상에서 동등한 ADCC 활성을 매개함을 나타내는 그래프이다.
도 20은 인간화된 항체 4B10 -H1/K1 ("4B10-Humanized") 및 키메릭 항체 4B10이 CD52를 발현하는 세포 상에서 동등한 CDC 활성을 매개함을 나타내는 그래프이다.
도 21은 이형접합성 huCD52 유전자이식 마우스에서 키메릭 항-CD52 항체 (12G6, 7F11 및 4B10), 캠퍼스-1H ("Campath"), 및 인간화된 항-CD52 항체 4B10-H1/K1("4B10 humanized (H1/K1)")의 약력학적 프로필을 예시하는 그래프이다.
도 22A-22c는 키메릭 항체 4B10 또는 인간화된 항체 4B10-H1/K1 "4B10-Hu") 또는 캠퍼스-1H("Campath")를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포 (도 22A), CD8 T 세포 (도 22b) 및 CD19 B 세포(도 22c)의 레벨을 나타내는 그래프이다.
도 23은 항-CD52 모노클로날 항체의 상대적 결합 친화성을 요약하여 나타낸 그래프이다.
도 24는 인간화된 7F11 중쇄 및 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기에 대해서 역돌연변이된 아미노산 잔기는 볼드체로 나타낸다.
도 25는 키메릭 및 인간화된 7F11 항체가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램(histogram)을 나타낸다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 26a는 인간화된 2C3 중쇄 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 도 26b는 인간화된 2C3 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
도 27a는 CD52를 발현하는 세포에 대한 인간화 및 키메릭 2C3 항체의 결합을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다. 도 27b는 인간화된 2C3 항체의 키메릭 및 서브세트가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 28a는 인간화된 12G6 중쇄 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 도 28b는 인간화된 12G6 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
도 29는 인간화된 12G6 항체의 키메릭 및 서브세트가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 30a는 인간화된 9D9 중쇄 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 도 30b는 인간화된 9D9 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
도 31은 인간화된 9D9 항체의 키메릭 및 서브세트가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 32a는 일차 인간 T 세포 및 huCD52 유전자이식 마우스 T 세포에 대한 캠퍼스-1H ("C1H"), 키메릭 2C3 항체, 및 인간화된 2C3-SFD1/K12 항체의 결합 곡선을 나타낸다. 도 32b는 일차 인간 T 세포 및 huCD52 유전자이식 마우스 T 세포에 대한 캠퍼스-1H("C1H"), 키메릭 9D9 항체, 및 인간화된 9D9 항체의 결합 곡선을 나타낸다. 도 32c는 일차 인간 T 세포 및 huCD52 유전자이식 마우스 T 세포에 대한 캠퍼스-1H("C1H"), 키메릭 12G6 항체, 및 인간화된 12G6 항체의 결합 곡선을 나타낸다.
도 33은 huCD52 발현 인간 및 유전자이식 마우스 T 세포에 대한 캠퍼스-1H, 키메릭 2C3 및 12G6 항체, 및 인간화된 2C3 및 12G6 항체의 상대적 결합 효율을 나타내는 표이다.
도 34는 유세포분석에 의한 인간 말초혈액 단핵세포 집단의 규정된 서브세트에 대한 인간화된 항-CD52 캠퍼스-1H, 2C3, 12G6, 및 9D9 항체의 상대적 결합 패턴을 예시한다. 이들 히스토그램은 인간화된 항-CD52 항체 결합이 다양한 CD52 발현 인간 PBMC 서브세트에 대한 캠퍼스-1H의 경우와 동등함을 나타낸다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 35는 키메릭 및 인간화된 7F11 항체가 CD52를 발현하는 세포 상에서 동등한 ADCC 활성을 매개함을 나타내는 그래프이다.
도 36은 키메릭 및 인간화된 7F11 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 37은 키메릭 및 인간화된 2C3 항체가 CD52를 발현하는 세포 상에서 ADCC 활성을 매개함을 나타내는 그래프이다.
도 38은 키메릭 및 인간화된 2C3 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 39는 키메릭 및 인간화된 12G6 항체가 CD52를 발현하는 세포 상에서 ADCC 활성을 매개함을 나타내는 그래프이다.
도 40은 키메릭 및 인간화된 12G6 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 41은 키메릭 및 인간화된 9D9 항체가 CD52를 발현하는 세포 상에서 ADCC 활성을 매개함을 나타내는 그래프이다.
도 42는 키메릭 및 인간화된 9D9 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 43은 일차 T 세포 상에서의 인간화된 항-CD52 항체의 ADCC 활성을 나타내는 그래프이다.
도 44는 일차 T 세포 상에서의 인간화된 항-CD52 항체의 CDC 활성을 나타내는 그래프이다.
도 45는 항-캠퍼스-1H 중화 항체를 함유하는 CAMMS223 시험 인간 혈청 샘플에 의해서 캠퍼스-1H는 중화되지만 다른 항-CD52 항체는 중화되지 않음을 나타내는 그래프이다. 혈청 샘플은 12 개월 (M12) 및 13 개월(M13) 째의 대표적 환자(MS-1)로부터 채취하였다.
도 46a-46e는 캠퍼스-1H("Campath") 및 인간화된 4B10-H1/K1("4B10") 항체를 투여한지 72 시간 후에 혈청 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 47a-47e는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 48a-48e는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 49a 및 49b는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식(repopulation)을 나타낸다, (mg/kg).
도 50a-50e는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 51a-51e는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 52a-52f는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 53a 및 53b는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다, (mg/kg).
도 54a 및 54b는 캠퍼스-1H ("Campath"), 7F11-키메릭 항체, 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다.
도 55는 투여 후의 시간 경과에 따른 혈액 내의 캠퍼스-1H® ("Campath"), 7F11-키메릭 항체 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체의 레벨을 나타낸다.
도 56a-56e는 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 호중구의 레벨을 나타낸다.
도 57a-57e는 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 호중구의 레벨을 나타낸다.
도 58a-58f는 2C3-SFD1/K12 ("2C3") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 59는 2C3-SFD1/K12 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다, (mg/kg).
도 60a-60e는 12G6-SFD1/K11 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 대식세포, 및 호중구의 레벨을 나타낸다.
도 61a-61e는 12G6-SFD1/K11 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 대식세포, 호중구 및 골수양 세포의 레벨을 나타낸다.
도 62a-62f는 12G6-SFD1/K11 ("12G6 hu") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 63은 12G6-SFD1/K11 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다, (mg/kg).
도 64a-64c는 투여 후의 시간 경과에 따른 혈액 내의 2C3-키메릭, 2C3-SFD1/K12, 12G6-키메릭, 12G6-SFD1/K11, 9D9-키메릭, 및 9D9-H10/K12 항체의 레벨을 나타낸다.
도 65a-65e는 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 대식세포, 및 호중구의 레벨을 나타낸다.
도 66a-66e는 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 호중구, 및 대식세포의 레벨을 나타낸다.
도 67a-67f는 9D9-H10/K12 ("9D9") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 68은 9D9-H10/K12 ("9D9") 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다(mg/kg).
도 69a-69d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3"), 12G6-SFD1/K11 ("12G6"), 및 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포 및 NK 세포 서브타입의 레벨을 나타낸다.
도 70a-70d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3"), 12G6-SFD1/K11 ("12G6"), 및 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포 및 NK 세포 서브타입의 레벨을 나타낸다.
도 71a-71f는 캠퍼스-1H, 2C3-SFD1/K12, 12G6-SFD1/K11, 및 9D9-H10/K12 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 72는 9D9-H10/K12 및 9D9-H11/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포의 레벨을 나타낸다.
도 73은 9D9-H10/K12 및 9D9-H11/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포의 레벨을 나타낸다.
도 74a-74d는 12G6-SFD1/K11 ("12G6 K11") 및 12G6-SFD1/K12 ("12G6 K12") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포의 레벨을 나타낸다.
도 75a-75d는 12G6-SFD1/K11 ("12G6 K11") 및 12G6-SFD1/K12 ("12G6 K12") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+B 세포, NK 세포 및 골수양 세포의 레벨을 나타낸다.
도 76은 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포)의 레벨을 나타낸다.
도 77a-77d는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 78은 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포)의 레벨을 나타낸다.
도 79a-79d는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 80a-80f는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 81a 및 81b는 투여 후의 시간 경과에 따른 혈액 내의 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 및 9D9-H18/K13 항체의 레벨을 나타낸다.
도 82a-82f는 캠퍼스-1H ("Campath"), 2C3-SFD1/K11, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 또는 9D9-H18/K13 항체를 투여한 후의 48-시간 과정에 설친 혈액 내의 사이토킨의 레벨을 나타낸다.
도 83a-83e는 캠퍼스-1H ("Campath"), 2C3-SFD1/K11, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 또는 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구, CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포의 레벨을 나타낸다.
도 84a-84g는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한 후의 시간 경과에 따른 순환 CD4+ 및 CD8+ T 세포, 조절성 T 세포, B 세포, NK 세포, 호중구 및 대식세포의 재증식을 나타낸다.
도 85는 비장 내의 huCD52 림프구 세포 집단에 특이적으로 결합하는 FITC-표지된 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3 K12"), 12G6-SFD1/K11 ("12G6 K11"), 12G6-SFD1/K12 ("12G6 K12"), 9D9-H16/K13 ("9D9 H16"), 및 9D9-H18/K13 ("9D9 H18") 항체의 능력을 나타낸다.
도 86a-86e는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 87a-87e는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 88a-88f는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 89a-89d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다.
도 90a-90d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다.
도 91a-91d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 림프절 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다.
도 92a는 huCD52-KI/KO 및 비-유전자이식 대조 마우스에서 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입 상에서의 huCD52 발현 레벨을 나타낸다. 도 92b는 huCD52-KI/KO 및 huCD52 CD1 유전자이식 마우스에서 CD4+ T 세포, CD8+ T 세포, 및 B 세포 상에서의 huCD52 발현 레벨을 나타낸다.
도 93은 다양한 생산 공급원("소규모" 및 "대규모")으로부터의 12G6-SFD1/K12 및 2C3-SFD1/K12 항체의 huCD52에 대한 결합을 캠퍼스-1H 대조군과 비교하여 나타낸 것이다.
도 94는 다양한 생산 공급원("소규모" 및 "대규모")으로부터의 12G6-SFD1/K12 및 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, B220+ B 세포 및 NK 세포)의 레벨을 나타낸다.
도 95는 투여한 후의 시간 경과에 따른 혈액 내의 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체의 레벨을 나타낸다.
도 96은 질병 진행의 시간 경과에 따른 2C3-SFD1/K12 및 12G6-SFD1/K12의 EAE 임상 스코어를 나타낸다.
도 97a 및 97b는 마우스 및 인간 FcRn 분자에 결합하는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3"), His435Ala 2C3-SFD1/K12 ("H435A 2C3") 및 His310Ala/His435Gln 2C3-SFD1/K12 ("H310A/H435Q 2C3")의 능력을 나타낸다.
도 98은 비-유전자이식 마우스에서 2C3-SFD1/K12 ("2C3 unmodified"), 2C3-SFD1/K12-돌연변이체-1 ("2C3-Fc mutant 1") 및 2C3-SFD1/K12-돌연변이체-2 ("2C3-Fc mutant 2")의 생체내 청소율을 나타낸다.
도 99는 huCD52 유전자이식 마우스에서 2C3-SFD1/K12 ("2C3"), 2C3-SFD1/K12-돌연변이체-1 ("2C3-Fc mutant 1") 및 2C3-SFD1/K12-돌연변이체-2 ("2C3-Fc mutant 2")의 생체내 청소율을 나타낸다.
도 100a 및 100b는 2C3-SFD1/K12 ("2C3"), 2C3-SFD1/K12-돌연변이체-1 ("2C3 Fc mutant-1"), 및 2C3-SFD1/K12-돌연변이체-2 ("2C3 Fc mutant-2") 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포)의 레벨을 나타낸다.
도 101a 및 101b는 인간화된 12G6-SFD1/K12 항체 및 알라닌 주사에 의해서 생성된 돌연변이체 펩타이드의 에피토프 특이성을 측정하기 위한 비아코어 (Biacore) T100 시험의 대표적 센서그램(sensorgrams)이다. 도 101a는 12G6-SFD1/K12와 MUT 8 펩타이드 사이에 결합이 없음을 나타내는 반면에 도 101b는 12G6-SFD1/K12와 MUT 9 펩타이드 사이의 결합을 나타낸다.
도 102는 공여체 BMS486에 대한 TCR V 베타 분석을 나타낸다. 캠퍼스-1H 펩타이드 그룹 986-989에 의해서 감작된 (educated) CD4+ T 세포는 단일 V 베타 (Vβ)의 선택적 팽창을 나타내었다.
도 103은 공여체 BMS928에 대한 TCR V 베타 분석을 나타낸다. 12G6-SFD1/K12펩타이드 그룹 1066-67-68 및 1083-84-85에 의해서 감작된 CD4+ T 세포는 단일 V 베타 (Vβ20)의 선택적 팽창을 나타내었다.
도 104a-104j는 캠퍼스-1H 면역원성 평가를 나타낸다. 증식성 반응은 개개의 공여체 A-J에 대한 CPM으로 나타낸다. X 축은 자가유래 CD4+ T 세포를 3회 자극하기 위해서 사용된 펩타이드의 그룹을 도시한다. T 세포의 각각의 그룹은 감작성 항원/펩타이드 그룹 (특이적 반응, 왼쪽 막대 (bar), 백색), 부적절한 DR 결합 펩타이드 (중앙 막대, 줄무늬) 또는 배지(오른쪽 막대, 흑색)로 펄싱된 (pulsed) 자가유래 DCs에 의해 3중으로 시험하였다.
도 105a-105j는 12G6-SFD1/K12 면역원성 평가를 나타낸다. 증식성 반응은 개개의 공여체 A-J에 대한 CPM으로 나타낸다. X 축은 자가유래 CD4+ T 세포를 3회 자극하기 위해서 사용된 펩타이드의 그룹을 도시한다. T 세포의 각각의 그룹은 감작성 펩타이드 그룹 (특이적 반응, 왼쪽 막대, 백색), 부적절한 DR 결합 펩타이드 (중앙 막대, 줄무늬) 또는 배지(오른쪽 막대, 흑색)로 펄싱된 자가유래 DCs에 의해 3중으로 시험하였다. 배지 대조군이 없이 시험한 그룹에서, 왼쪽 막대(백색)는 감작성 펩타이드로 펄싱된 DCs를 나타내며, 오른쪽 막대(줄무늬)는 부적절한 펩타이드로 펄싱된 DCs를 나타낸다.
도 106은 2C3-SFD1(SEQ ID NO: 272)의 전체-길이 인간화된 중쇄 아미노산 서열 및 2C3-K12(SEQ ID NO: 273)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 107은 7F11-SFD1(SEQ ID NO: 274)의 전체-길이 인간화된 중쇄 아미노산 서열 및 7F11-K2(SEQ ID NO: 275)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 108은 9D9-H16 (SEQ ID NO: 276) 및 9D9-H18(SEQ ID NO: 277)의 전체-길이 인간화된 중쇄 아미노산 서열 및 9D9-K13(SEQ ID NO: 278)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 109는 12G6-SFD1(SEQ ID NO: 279)의 전체-길이 인간화된 중쇄 아미노산 서열 및 12G6-K12(SEQ ID NO: 280)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 110은 4B10-H1(SEQ ID NO: 281)의 전체-길이 인간화된 중쇄 아미노산 서열 및 4B10-K1(SEQ ID NO: 282)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 111은 2C3-SFD1(SEQ ID NO: 283)의 전체-길이 인간화된 중쇄 핵산 서열 및 2C3-K12(SEQ ID NO: 284)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 112는 7F11-SFD1(SEQ ID NO: 285)의 전체-길이 인간화된 중쇄 핵산 서열 및 7F11-K2(SEQ ID NO: 286)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 113은 9D9-H16 (SEQ ID NO: 287) 및 9D9-H18(SEQ ID NO: 288)의 전체-길이 인간화된 중쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 114는 9D9-K13(SEQ ID NO: 289)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 115는 12G6-SFD1(SEQ ID NO: 290)의 전체-길이 인간화된 중쇄 핵산 서열 및 12G6-K12(SEQ ID NO: 291)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 116은 4B10-H1(SEQ ID NO: 292)의 전체-길이 인간화된 중쇄 핵산 서열 및 4B10-K1(SEQ ID NO: 293)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 2는 몇 가지 마우스 항-인간 CD52 카파 경쇄 서열(SEQ ID NOS:1-13)의 아미노산 서열을 정렬한 것이다. 캠퍼스-1G는 인간화된 캠퍼스-1H 항체가 유래하는 랫트 모노클로날 항체이다.
도 3은 몇 가지 마우스 항-인간 CD52 중쇄 서열(SEQ ID NOS:14-26)의 아미노산 서열을 정렬한 것이다.
도 4는 야생형 CD52 및 10 개의 돌연변이체 CD52 단백질(위에서 아래로 SEQ ID NOS: 104-114)을 정렬한 것이다.
도 5a는 CD52 알라닌 주사(scanning) 돌연변이체를 발현하는 세포 상에서 항체 4B10 및 7F11의 FACS-기본 N-말단 결합 프로필을 예시한다.
도 5b는 CD52 알라닌 주사 돌연변이체를 발현하는 세포 상에서 항체 CF1D12, 3G7, 9D9, 5F7, 4G7, 및 11C11의 FACS-기본 중앙 부위 결합 프로필을 예시한다.
도 5c는 CD52 알라닌 주사 돌연변이체를 발현하는 세포 상에서 항체 캠퍼스-1H ("Campath 1H"), 2C3, 12G6, 및 23E6의 FACS-기본 결합 프로필을 예시한다.
도 5d는 키메릭 모노클로날 항체의 패널로 프로브화된 CD52 +/- N 결합 글리코실화의 면역블럿(immunoblots)을 도시한다. "C1H"는 캠퍼스-1H(Campath-1H®)를 의미한다.
도 6은 CHO-K1 CD52 #67 세포 상에서 스크리닝한 다양한 키메릭 항-CD52 항체 상에서의 1.5 시간 CDC 시험의 결과를 나타내는 그래프이다. 그 결과는 키메릭 항체 4B10 및 7F11이 캠퍼스-1H("Campath 1H")와 동등하거나 그보다 우수함을 나타낸다.
도 7은 CHO-K1 CD52 #67 세포 상에서 스크리닝한 CD52에 대한 다양한 키메릭 IgG1 항체 상에서의 14 시간 ADCC 시험의 결과를 나타내는 그래프이다. 그 결과는 키메릭 항체 2C3 및 12G6이 캠퍼스-1H("Campath 1H")와 동등하거나 그보다 우수함을 나타낸다.
도 8a-8c는 규정된 인간 림프구 집단에 대한 다양한 항-CD52 항체 및 캠퍼스-1H ("Campath 1H") 항체의 비교 결합을 예시한다. 이들 도면은 FACS 시험에 의해서 스크리닝된 키메릭 항체의 결합능의 계층(hierarchy)을 나타낸다. 가장 오른쪽까지의 곡선은 최고의 결합능을 나타내는 반면에 왼쪽으로의 곡선은 더 낮은 친화성을 갖는 결합을 나타낸다.
도 9a-9c는 키메릭 항체 7F11, 8G3, 23E6, 12G6, 4B10, 또는 5F7, 또는 캠퍼스-1H ("Cam")를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포 (도 9a), CD8 T 세포 (도 9b) 및 CD19 B 세포 (도 9c)의 레벨을 예시하는 그래프이다.
도 10a-10c는 키메릭 항체 7F11, 8G3, 23E6, 12G6, 4B10, 또는 5F7, 또는 캠퍼스-1H ("Cam")를 투여한지 72 시간 후에 비장 내의 CD4 T 세포 (도 10a), CD8 T 세포 (도 10b) 및 CD19 B 세포(도 10c)의 레벨을 예시하는 그래프이다.
도 11a-11c는 키메릭 항체 2C3, 9D9, 4B10, 3G7, 또는 11C11, 또는 캠퍼스-1H ("Cam")를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포 (도 11a), CD8 T 세포 (도 11b) 및 CD19 B 세포(도 11c)의 레벨을 나타내는 그래프이다.
도 12는 7F11, 4B10, 또는 12G6 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 (Kaplan Meier Survival) 그래프이다.
도 13은 2C3, 8G3, 또는 23E6 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 그래프이다.
도 14는 9D9 또는 4B10 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 그래프이다.
도 15는 2C3 또는 11C11 키메릭 모노클로날 항체, 또는 캠퍼스-1H("Campath")로 처리한 후에 생존하는 마우스의 퍼센트를 예시하는 카플란 마이어 생존 그래프이다.
도 16은 가장 근접한 부합된 인간 배선 서열(SEQ ID NO: 97) 및 인간화된 중쇄 가변 부위 서열(SEQ ID NO: 98)과 함께 마우스 항-인간 CD52 항체 4B10 중쇄 가변 부위(SEQ ID NO: 96) 서열을 정렬한 것이다. 또한, 가장 근접한 부합된 인간 배선 서열(SEQ ID NO: 100) 및 인간화된 경쇄 가변 부위 서열(SEQ ID NO: 101)과 함께 마우스 항-인간 CD52 항체 4B10 경쇄 가변 부위(SEQ ID NO: 99) 서열을 정렬하여 나타낸다.
도 17은 인간화된 4B10 중쇄 (SEQ ID NO: 103) 및 경쇄 (SEQ ID NO: 102) 가변 부위 서열을 나타낸다.
도 18은 인간화된 항체 4B10-H1/K1 ("4B10-Humanized") 및 키메릭 항체 4B10이 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 그래프이다.
도 19는 인간화된 항체 4B10 -H1/K1 ("4B10 Humanized") 및 키메릭 항체 4B10이 CD52를 발현하는 세포 상에서 동등한 ADCC 활성을 매개함을 나타내는 그래프이다.
도 20은 인간화된 항체 4B10 -H1/K1 ("4B10-Humanized") 및 키메릭 항체 4B10이 CD52를 발현하는 세포 상에서 동등한 CDC 활성을 매개함을 나타내는 그래프이다.
도 21은 이형접합성 huCD52 유전자이식 마우스에서 키메릭 항-CD52 항체 (12G6, 7F11 및 4B10), 캠퍼스-1H ("Campath"), 및 인간화된 항-CD52 항체 4B10-H1/K1("4B10 humanized (H1/K1)")의 약력학적 프로필을 예시하는 그래프이다.
도 22A-22c는 키메릭 항체 4B10 또는 인간화된 항체 4B10-H1/K1 "4B10-Hu") 또는 캠퍼스-1H("Campath")를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포 (도 22A), CD8 T 세포 (도 22b) 및 CD19 B 세포(도 22c)의 레벨을 나타내는 그래프이다.
도 23은 항-CD52 모노클로날 항체의 상대적 결합 친화성을 요약하여 나타낸 그래프이다.
도 24는 인간화된 7F11 중쇄 및 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기에 대해서 역돌연변이된 아미노산 잔기는 볼드체로 나타낸다.
도 25는 키메릭 및 인간화된 7F11 항체가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램(histogram)을 나타낸다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 26a는 인간화된 2C3 중쇄 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 도 26b는 인간화된 2C3 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
도 27a는 CD52를 발현하는 세포에 대한 인간화 및 키메릭 2C3 항체의 결합을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다. 도 27b는 인간화된 2C3 항체의 키메릭 및 서브세트가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 28a는 인간화된 12G6 중쇄 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 도 28b는 인간화된 12G6 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
도 29는 인간화된 12G6 항체의 키메릭 및 서브세트가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 30a는 인간화된 9D9 중쇄 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 도 30b는 인간화된 9D9 경쇄 (카파) 가변 부위 서열을 나타낸다. 마우스 잔기로 역돌연변이된 아미노산 잔기는 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
도 31은 인간화된 9D9 항체의 키메릭 및 서브세트가 CD52를 발현하는 세포에 동등하게 결합함을 나타내는 히스토그램이다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 32a는 일차 인간 T 세포 및 huCD52 유전자이식 마우스 T 세포에 대한 캠퍼스-1H ("C1H"), 키메릭 2C3 항체, 및 인간화된 2C3-SFD1/K12 항체의 결합 곡선을 나타낸다. 도 32b는 일차 인간 T 세포 및 huCD52 유전자이식 마우스 T 세포에 대한 캠퍼스-1H("C1H"), 키메릭 9D9 항체, 및 인간화된 9D9 항체의 결합 곡선을 나타낸다. 도 32c는 일차 인간 T 세포 및 huCD52 유전자이식 마우스 T 세포에 대한 캠퍼스-1H("C1H"), 키메릭 12G6 항체, 및 인간화된 12G6 항체의 결합 곡선을 나타낸다.
도 33은 huCD52 발현 인간 및 유전자이식 마우스 T 세포에 대한 캠퍼스-1H, 키메릭 2C3 및 12G6 항체, 및 인간화된 2C3 및 12G6 항체의 상대적 결합 효율을 나타내는 표이다.
도 34는 유세포분석에 의한 인간 말초혈액 단핵세포 집단의 규정된 서브세트에 대한 인간화된 항-CD52 캠퍼스-1H, 2C3, 12G6, 및 9D9 항체의 상대적 결합 패턴을 예시한다. 이들 히스토그램은 인간화된 항-CD52 항체 결합이 다양한 CD52 발현 인간 PBMC 서브세트에 대한 캠퍼스-1H의 경우와 동등함을 나타낸다. X 축은 결합된 항-CD52 항체에 의해서 방출된 형광을 나타내는 한편, 각각의 피크의 면적은 총 세포 집단을 나타낸다.
도 35는 키메릭 및 인간화된 7F11 항체가 CD52를 발현하는 세포 상에서 동등한 ADCC 활성을 매개함을 나타내는 그래프이다.
도 36은 키메릭 및 인간화된 7F11 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 37은 키메릭 및 인간화된 2C3 항체가 CD52를 발현하는 세포 상에서 ADCC 활성을 매개함을 나타내는 그래프이다.
도 38은 키메릭 및 인간화된 2C3 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 39는 키메릭 및 인간화된 12G6 항체가 CD52를 발현하는 세포 상에서 ADCC 활성을 매개함을 나타내는 그래프이다.
도 40은 키메릭 및 인간화된 12G6 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 41은 키메릭 및 인간화된 9D9 항체가 CD52를 발현하는 세포 상에서 ADCC 활성을 매개함을 나타내는 그래프이다.
도 42는 키메릭 및 인간화된 9D9 항체가 CD52를 발현하는 세포 상에서 CDC 활성을 매개함을 나타내는 그래프이다.
도 43은 일차 T 세포 상에서의 인간화된 항-CD52 항체의 ADCC 활성을 나타내는 그래프이다.
도 44는 일차 T 세포 상에서의 인간화된 항-CD52 항체의 CDC 활성을 나타내는 그래프이다.
도 45는 항-캠퍼스-1H 중화 항체를 함유하는 CAMMS223 시험 인간 혈청 샘플에 의해서 캠퍼스-1H는 중화되지만 다른 항-CD52 항체는 중화되지 않음을 나타내는 그래프이다. 혈청 샘플은 12 개월 (M12) 및 13 개월(M13) 째의 대표적 환자(MS-1)로부터 채취하였다.
도 46a-46e는 캠퍼스-1H("Campath") 및 인간화된 4B10-H1/K1("4B10") 항체를 투여한지 72 시간 후에 혈청 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 47a-47e는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 48a-48e는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 49a 및 49b는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식(repopulation)을 나타낸다, (mg/kg).
도 50a-50e는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 51a-51e는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 및 호중구의 레벨을 나타낸다.
도 52a-52f는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 53a 및 53b는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다, (mg/kg).
도 54a 및 54b는 캠퍼스-1H ("Campath"), 7F11-키메릭 항체, 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다.
도 55는 투여 후의 시간 경과에 따른 혈액 내의 캠퍼스-1H® ("Campath"), 7F11-키메릭 항체 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체의 레벨을 나타낸다.
도 56a-56e는 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 호중구의 레벨을 나타낸다.
도 57a-57e는 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 호중구의 레벨을 나타낸다.
도 58a-58f는 2C3-SFD1/K12 ("2C3") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 59는 2C3-SFD1/K12 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다, (mg/kg).
도 60a-60e는 12G6-SFD1/K11 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 대식세포, 및 호중구의 레벨을 나타낸다.
도 61a-61e는 12G6-SFD1/K11 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 대식세포, 호중구 및 골수양 세포의 레벨을 나타낸다.
도 62a-62f는 12G6-SFD1/K11 ("12G6 hu") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 63은 12G6-SFD1/K11 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다, (mg/kg).
도 64a-64c는 투여 후의 시간 경과에 따른 혈액 내의 2C3-키메릭, 2C3-SFD1/K12, 12G6-키메릭, 12G6-SFD1/K11, 9D9-키메릭, 및 9D9-H10/K12 항체의 레벨을 나타낸다.
도 65a-65e는 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 대식세포, 및 호중구의 레벨을 나타낸다.
도 66a-66e는 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 골수양 세포, 호중구, 및 대식세포의 레벨을 나타낸다.
도 67a-67f는 9D9-H10/K12 ("9D9") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 68은 9D9-H10/K12 ("9D9") 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다(mg/kg).
도 69a-69d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3"), 12G6-SFD1/K11 ("12G6"), 및 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포 및 NK 세포 서브타입의 레벨을 나타낸다.
도 70a-70d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3"), 12G6-SFD1/K11 ("12G6"), 및 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포 및 NK 세포 서브타입의 레벨을 나타낸다.
도 71a-71f는 캠퍼스-1H, 2C3-SFD1/K12, 12G6-SFD1/K11, 및 9D9-H10/K12 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 72는 9D9-H10/K12 및 9D9-H11/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포의 레벨을 나타낸다.
도 73은 9D9-H10/K12 및 9D9-H11/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포의 레벨을 나타낸다.
도 74a-74d는 12G6-SFD1/K11 ("12G6 K11") 및 12G6-SFD1/K12 ("12G6 K12") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포의 레벨을 나타낸다.
도 75a-75d는 12G6-SFD1/K11 ("12G6 K11") 및 12G6-SFD1/K12 ("12G6 K12") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+B 세포, NK 세포 및 골수양 세포의 레벨을 나타낸다.
도 76은 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포)의 레벨을 나타낸다.
도 77a-77d는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 78은 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포)의 레벨을 나타낸다.
도 79a-79d는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 80a-80f는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 81a 및 81b는 투여 후의 시간 경과에 따른 혈액 내의 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 및 9D9-H18/K13 항체의 레벨을 나타낸다.
도 82a-82f는 캠퍼스-1H ("Campath"), 2C3-SFD1/K11, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 또는 9D9-H18/K13 항체를 투여한 후의 48-시간 과정에 설친 혈액 내의 사이토킨의 레벨을 나타낸다.
도 83a-83e는 캠퍼스-1H ("Campath"), 2C3-SFD1/K11, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 또는 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구, CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포의 레벨을 나타낸다.
도 84a-84g는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한 후의 시간 경과에 따른 순환 CD4+ 및 CD8+ T 세포, 조절성 T 세포, B 세포, NK 세포, 호중구 및 대식세포의 재증식을 나타낸다.
도 85는 비장 내의 huCD52 림프구 세포 집단에 특이적으로 결합하는 FITC-표지된 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3 K12"), 12G6-SFD1/K11 ("12G6 K11"), 12G6-SFD1/K12 ("12G6 K12"), 9D9-H16/K13 ("9D9 H16"), 및 9D9-H18/K13 ("9D9 H18") 항체의 능력을 나타낸다.
도 86a-86e는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 87a-87e는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다.
도 88a-88f는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
도 89a-89d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다.
도 90a-90d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다.
도 91a-91d는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 림프절 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다.
도 92a는 huCD52-KI/KO 및 비-유전자이식 대조 마우스에서 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입 상에서의 huCD52 발현 레벨을 나타낸다. 도 92b는 huCD52-KI/KO 및 huCD52 CD1 유전자이식 마우스에서 CD4+ T 세포, CD8+ T 세포, 및 B 세포 상에서의 huCD52 발현 레벨을 나타낸다.
도 93은 다양한 생산 공급원("소규모" 및 "대규모")으로부터의 12G6-SFD1/K12 및 2C3-SFD1/K12 항체의 huCD52에 대한 결합을 캠퍼스-1H 대조군과 비교하여 나타낸 것이다.
도 94는 다양한 생산 공급원("소규모" 및 "대규모")으로부터의 12G6-SFD1/K12 및 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, B220+ B 세포 및 NK 세포)의 레벨을 나타낸다.
도 95는 투여한 후의 시간 경과에 따른 혈액 내의 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체의 레벨을 나타낸다.
도 96은 질병 진행의 시간 경과에 따른 2C3-SFD1/K12 및 12G6-SFD1/K12의 EAE 임상 스코어를 나타낸다.
도 97a 및 97b는 마우스 및 인간 FcRn 분자에 결합하는 캠퍼스-1H ("Campath"), 2C3-SFD1/K12 ("2C3"), His435Ala 2C3-SFD1/K12 ("H435A 2C3") 및 His310Ala/His435Gln 2C3-SFD1/K12 ("H310A/H435Q 2C3")의 능력을 나타낸다.
도 98은 비-유전자이식 마우스에서 2C3-SFD1/K12 ("2C3 unmodified"), 2C3-SFD1/K12-돌연변이체-1 ("2C3-Fc mutant 1") 및 2C3-SFD1/K12-돌연변이체-2 ("2C3-Fc mutant 2")의 생체내 청소율을 나타낸다.
도 99는 huCD52 유전자이식 마우스에서 2C3-SFD1/K12 ("2C3"), 2C3-SFD1/K12-돌연변이체-1 ("2C3-Fc mutant 1") 및 2C3-SFD1/K12-돌연변이체-2 ("2C3-Fc mutant 2")의 생체내 청소율을 나타낸다.
도 100a 및 100b는 2C3-SFD1/K12 ("2C3"), 2C3-SFD1/K12-돌연변이체-1 ("2C3 Fc mutant-1"), 및 2C3-SFD1/K12-돌연변이체-2 ("2C3 Fc mutant-2") 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포)의 레벨을 나타낸다.
도 101a 및 101b는 인간화된 12G6-SFD1/K12 항체 및 알라닌 주사에 의해서 생성된 돌연변이체 펩타이드의 에피토프 특이성을 측정하기 위한 비아코어 (Biacore) T100 시험의 대표적 센서그램(sensorgrams)이다. 도 101a는 12G6-SFD1/K12와 MUT 8 펩타이드 사이에 결합이 없음을 나타내는 반면에 도 101b는 12G6-SFD1/K12와 MUT 9 펩타이드 사이의 결합을 나타낸다.
도 102는 공여체 BMS486에 대한 TCR V 베타 분석을 나타낸다. 캠퍼스-1H 펩타이드 그룹 986-989에 의해서 감작된 (educated) CD4+ T 세포는 단일 V 베타 (Vβ)의 선택적 팽창을 나타내었다.
도 103은 공여체 BMS928에 대한 TCR V 베타 분석을 나타낸다. 12G6-SFD1/K12펩타이드 그룹 1066-67-68 및 1083-84-85에 의해서 감작된 CD4+ T 세포는 단일 V 베타 (Vβ20)의 선택적 팽창을 나타내었다.
도 104a-104j는 캠퍼스-1H 면역원성 평가를 나타낸다. 증식성 반응은 개개의 공여체 A-J에 대한 CPM으로 나타낸다. X 축은 자가유래 CD4+ T 세포를 3회 자극하기 위해서 사용된 펩타이드의 그룹을 도시한다. T 세포의 각각의 그룹은 감작성 항원/펩타이드 그룹 (특이적 반응, 왼쪽 막대 (bar), 백색), 부적절한 DR 결합 펩타이드 (중앙 막대, 줄무늬) 또는 배지(오른쪽 막대, 흑색)로 펄싱된 (pulsed) 자가유래 DCs에 의해 3중으로 시험하였다.
도 105a-105j는 12G6-SFD1/K12 면역원성 평가를 나타낸다. 증식성 반응은 개개의 공여체 A-J에 대한 CPM으로 나타낸다. X 축은 자가유래 CD4+ T 세포를 3회 자극하기 위해서 사용된 펩타이드의 그룹을 도시한다. T 세포의 각각의 그룹은 감작성 펩타이드 그룹 (특이적 반응, 왼쪽 막대, 백색), 부적절한 DR 결합 펩타이드 (중앙 막대, 줄무늬) 또는 배지(오른쪽 막대, 흑색)로 펄싱된 자가유래 DCs에 의해 3중으로 시험하였다. 배지 대조군이 없이 시험한 그룹에서, 왼쪽 막대(백색)는 감작성 펩타이드로 펄싱된 DCs를 나타내며, 오른쪽 막대(줄무늬)는 부적절한 펩타이드로 펄싱된 DCs를 나타낸다.
도 106은 2C3-SFD1(SEQ ID NO: 272)의 전체-길이 인간화된 중쇄 아미노산 서열 및 2C3-K12(SEQ ID NO: 273)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 107은 7F11-SFD1(SEQ ID NO: 274)의 전체-길이 인간화된 중쇄 아미노산 서열 및 7F11-K2(SEQ ID NO: 275)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 108은 9D9-H16 (SEQ ID NO: 276) 및 9D9-H18(SEQ ID NO: 277)의 전체-길이 인간화된 중쇄 아미노산 서열 및 9D9-K13(SEQ ID NO: 278)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 109는 12G6-SFD1(SEQ ID NO: 279)의 전체-길이 인간화된 중쇄 아미노산 서열 및 12G6-K12(SEQ ID NO: 280)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 110은 4B10-H1(SEQ ID NO: 281)의 전체-길이 인간화된 중쇄 아미노산 서열 및 4B10-K1(SEQ ID NO: 282)의 전체-길이 인간화된 경쇄 아미노산 서열을 나타낸다. 신호 서열은 볼드체이고 이탤릭체이며, CDRs는 밑줄을 긋는다.
도 111은 2C3-SFD1(SEQ ID NO: 283)의 전체-길이 인간화된 중쇄 핵산 서열 및 2C3-K12(SEQ ID NO: 284)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 112는 7F11-SFD1(SEQ ID NO: 285)의 전체-길이 인간화된 중쇄 핵산 서열 및 7F11-K2(SEQ ID NO: 286)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 113은 9D9-H16 (SEQ ID NO: 287) 및 9D9-H18(SEQ ID NO: 288)의 전체-길이 인간화된 중쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 114는 9D9-K13(SEQ ID NO: 289)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 115는 12G6-SFD1(SEQ ID NO: 290)의 전체-길이 인간화된 중쇄 핵산 서열 및 12G6-K12(SEQ ID NO: 291)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
도 116은 4B10-H1(SEQ ID NO: 292)의 전체-길이 인간화된 중쇄 핵산 서열 및 4B10-K1(SEQ ID NO: 293)의 전체-길이 인간화된 경쇄 핵산 서열을 나타낸다. 신호 서열은 밑줄을 긋고, 가변 영역은 볼드체로 나타내며, 불변 부위는 이탤릭체로 나타낸다.
실시예
실시예
1:
마우스 항-인간
CD52
항체의 생성
이하의 실시예에서 마우스 항-인간 CD52 항체는 CD1 세포주 마우스를 CD1 배경을 갖는 인간 CD52 유전자이식 마우스로부터의 비장세포로 면역시킴으로써 생성되었으며 (도 1a), 여기에서 유전자이식 마우스의 마우스 B 및 T 세포의 표면 상에서 인간 CD52의 디스플레이(display)는 유세포분석에 의해서 입증되었다. 유전자이식 마우스는 면역된 마우스와 동일한 배경(CD1)을 갖기 때문에, 유전자이식 마우스로부터의 비장세포는 자연적인 형식의 독특한 비-자기 항원으로서 세포 표면에서 인간 CD52를 나타내었으며, 면역된 비-유전자이식 마우스는 주로 인간 CD52에 대한 항체 반응을 갖추었다.
인간 CD52 유전자이식 마우스로부터 비장세포를 수집하기 위해서, 마우스를 안락사시키고, 비장을 수확하여 시린지를 통과시킴으로써 단일 세포 현탁액을 제조하였다. 그 후, CD1 마우스를 프로인트 완전 보조액(Freund's Complete Adjuvant)이 있거나 없이 마우스당 100 ㎕ 중의 5x106의 수집된 인간 CD52 양성 비장 세포로 복강내 (i.p.) 주사함으로써 면역시켰다. 마우스에게 일차 면역시킨 후 매 2 주일 마다 프로인트 불완전 보조액과 함께 마우스당 100 ㎕ 중의 5x106의 유전자이식 마우스 인간 CD52 양성 비장 세포로 2 회 부스터 용량을 제공하였다(ip).
눈의 출혈은 기준 레벨 반응성을 측정하기 위하여 면역시키기 전에, 및 기준 레벨 반응성을 측정하기 위하여 면역화의 매 라운드의 1 주일 후, 및 항-인간 CD52 특이적 면역반응을 측정하기 위하여 면역화의 매 라운드의 1 주일 후에 모든 마우스로부터 황색-마개를 한 혈청 분리기 튜브 내에 마우스당 100-200 ㎕씩 수집하였다. 모 CHO K1 세포 상에서는 아니지만 인간 CD52 단백질을 발현하도록 조작된 CHO K1 세포 상에서 FACS에 의해서 측정된 것으로서 높은 레벨의 항-인간 CD52 반응성을 갖는 마우스를 희생시키고, 혈액을 수확하고, 비장을 무균 조건 하에서 수집하여 하이브리도마를 생성시켰다. 하이브리도마는 면역시킨 후 3-4일에 융합 파트너로서 비-분비성 마우스 골수종 세포주 SP2/0 Ag14 또는 NS1 골수종 세포를 사용함으로써 생성되었다. 융합된 세포를 하이포크산틴, 아미노프테린 및 티미딘을 함유하는 완전 성장배지 내에 배치하여 하이브리도마를 생성시켰다. 다수의 하이브리도마 상등액을 스크리닝한 후에, 특이적 항-인간 CD52 항체를 생산한 몇 개의 클론을 선택하고, 더 서브클로닝하여 클론성 집단을 유도하였다. 항-인간 CD52 항체를 생산한 하이브리도마 클론은 추가의 발육을 위해서 증량시켰다.
실시예
2:
마우스 항-인간
CD52
항체의
중쇄
및
경쇄의
PCR
분석
다수의 마우스 항-인간 CD52 모노클로날 항체 (도 1b)는 하이브리도마 상등액을 항-인간 CD52 반응성의 존재에 대해서 시험함으로써 확인하였다. 개개의 클론을 선택하고, 마우스 중쇄 및 경쇄 가변 서열은 PCR 클로닝 및 서열결정에 의해서 확인하였다. 경쇄의 서열은 YTH 34.5 HL (즉, 캠퍼스 IG 카파 (랫트)) 및 시약 항체 CF1D12 (CF1D12 카파)(Invitrogen Life Science Technologies)와 비교하여 도 2에 나타낸다. 마찬가지로, 중쇄의 서열은 YTH 34.5 HL 및 시약 항체 CF1D12와 비교하여 도 3에 나타낸다.
총 10 개의 독특한 경쇄 가변 서열 및 11 개의 독특한 중쇄 가변 서열을 확인하였다. 한 개가 캠퍼스 (Campath®) 및 CF1D12를 포함하는 경우에, 7 개의 독특한 CDR-1 부위 (표 1), 8 개의 독특한 CDR-2 부위 (표 2) 및 7 개의 독특한 CDR-3 부위(표 3)가 항-인간 CD52 항체의 경쇄 내에서 확인되었다.
표 1:
표 2:
표 3:
한 개가 캠퍼스 및 CF1D12를 포함하는 경우에, 총 8 개의 독특한 CDR-1 부위 (표 4), 10 개의 독특한 CDR-2 부위 (표 5) 및 8 개의 독특한 CDR-3 부위(표 6)가 항-인간 CD52 항체의 중쇄 내에서 확인되었다.
표 4:
표 5:
표 6:
13 개의 상이한 항-인간 CD52 항체 내의 특정한 경쇄 및 중쇄 CDR 부위의 조합은 표 7에 나타낸다.
표 7:
표 7.1
실시예 3: 마우스/인간 키메릭 IgG1 항체를 생성시키기 위한 마우스 하이브리도마 세포로부터 마우스 IgG 가변 부위 유전자의 클로닝
능동적으로 증식성 및 항체 분비성인 하이브리도마 세포를 사용하여 제조자의 제안된 프로토콜에 따라 트리졸 (Trizol) 시약(Gibco/BRL)을 사용하여 RNA를 분리시켰다. RNA는 나노드롭(Nanodrop)을 사용하여 OD를 측정함으로써 정량화하였으며, RNA의 무결성(integrity)은 이것을 겔 상에 주행시키거나, 생물분석기(bioanalyzer)를 사용함으로써 측정하였다. 총 RNA를 cDNA로 역전사시키고, 중쇄 및 경쇄에 대한 가변 부위는 폴리머라제 연쇄반응(PCR)에 의해서 증폭시켰다. cDNA는 제조자의 프로토콜에 따라 BD 스프린트 파워스크립트 역전사효소 (Sprint PowerScript Reverse Transcriptase) (Clontech) 및 0.5 ㎍/㎕의 올리고(dT) 프라이머 (Invitrogen Cat# Y01212) 및 이하에 숫자로 열거한 10 μM의 역방향 프라이머(중쇄 및 경쇄의 불변 부위 내에 위치함)를 사용하여 생성시켰다. 구체적으로, 번호가 3 (SEQ ID NO: 77), 11 (SEQ ID NO: 85), 19 (SEQ ID NO: 93), 20 (SEQ ID NO: 94) 및 21(SEQ ID NO: 95)인 프라이머가 사용되었다. 중쇄 및 경쇄 가변 부위의 PCR 증폭은 상술한 바와 같이 생성된 cDNA를 사용하여 수행되었다. 1 ㎕의 cDNA를 중쇄 및 경쇄 둘 다에 대한 각각 10 μM의 정방향 프라이머 및 역방향 프라이머와 혼합시키고, 2 ㎕의 MgCl2의 존재 하에서 25 mM의 PCR 슈퍼 믹스(super mix)(Invitrogen)와 혼합시켰다. PCR 프로그램은 다음의 단계로 진행시켰다: 1) 2 분 동안 95 ℃; 2) 30 초 동안 95 ℃; 3) 30 초 동안 56 ℃; 4) 45 초 동안 68 ℃; 5) 단계 2내지 4를 25 회 반복; 6) 10 분 동안 68 ℃, 및 16 ℃에서 유지시킴. PCR 생성물을 약 300-400 bp 크기의 가변 부위 서열 생성물의 존재에 대하여 2% 겔 상에서 분석하고, 적절한 밴드를 제조자의 지침에 따라 pCR2.1-TOPO TA 클로닝 키트 (Invitrogen) 내에 클로닝하고, 클로닝된 서열은 M13 프라이머를 사용하여 확인하였다. 역전사를 위해서, 및 경쇄 및 중쇄 서열의 PCR 증폭을 위해서 사용된 프라이머가 제공된다:
경쇄 프라이머
1) 리드-ML 카파 = 5' ATGGGCWTCAARATGRARWCWCAT 3' (선도 서열 중 정방향 프라이머) (서열번호: 75)
2) FR1-ML 카파 = 5' GAYATTGTGMTRACMCARKMTCAA 3' (프레임워크 1 중 정방향 프라이머) (서열번호: 76)
3) ML 카파 불변 = 5' ACTGGATGGTGGGAAGATGGA 3'(불변 영역 중 역방향 프라이머) (서열번호: 77)
4) VK-MK = 5' GAYATTGTGMTSACMCARWCTMCA 3' (프레임워크 1 중 정방향 프라이머) (서열번호: 78)
5) MKC-불변 = 5' GGATACAGTTGGTGCAGCATC 3' (불변 영역 중 역방향 프라이머) (서열번호: 79)
중쇄 프라이머
6) MH-SP-ALT1 = 5' ATGRASTTSKGGYTMARCTKGRTT 3' (선도 서열 중 정방향 프라이머) (서열번호: 80)
7) MH-SP-ALT2 = 5' ATGRAATGSASCTGGGTYWTYCTCT 3' (선도 서열 중 정방향 프라이머) (서열번호: 81)
8) MH-FR1 = 5' SAGGTSMARCTGCAGSAGTCT 3' (프레임워크 1 중 정방향 프라이머) (서열번호: 82)
9) MH-FR1-1 = 5' SAGGTGMAGCTCSWRSARYCSGGG 3' (프레임워크 1 중 정방향 프라이머) (서열번호: 83)
10) MH-J2 = 5' TGAGGAGACTGTGAGAGTGGTGCC 3' (J 영역 중 역방향 프라이머) (서열번호: 84)
11) MH-감마-const = 5' AYCTCCACACACAGGRRCCAGTGGATAGAC 3' (불변 영역 중 역방향 프라이머) (서열번호: 85)
12) VH MH1 = 5' SARGTNMAGCTGSAGSAGTC 3' (프레임워크 1 중 정방향 프라이머) (서열번호: 86)
13) VH MH2 = 5' SARGTNMAGCTGSAGSAGTCWGG 3' (프레임워크 1 중 정방향 프라이머) (서열번호: 87)
14) VH MH3 = 5' CAGGTTACTCTGAAAGWGTSTG 3' (프레임워크 1 중 정방향 프라이머) (서열번호: 88)
15) VH MH4 = 5' GAGGTCCARCTGCAACARTC 3'(프레임워크 1 중 정방향 프라이머) (서열번호: 89)
16) VH MH5 = 5' CAGGTCCAACTVCAGCARCC 3'(프레임워크 1 중 정방향 프라이머) (서열번호: 90)
17) VH MH6 = 5' GAGGTGAASSTGGTGGAATC 3'(프레임워크 1 중 정방향 프라이머) (서열번호: 91)
18) VH MH7 = 5' GATGTGAACTTGGAAGTGTC 3'(프레임워크 1 중 정방향 프라이머) (서열번호: 92)
19) IgG1 = 5' ATAGACAGATGGGGGTGTCGTTTTGGC 3' (마우스 IgG1 CH1 불변 영역 중 역방향 프라이머) (서열번호: 93)
20) IgG2A = 5' CTTGACCAGGCATCCTAGAGTCA 3' (마우스 IgG2A CH1 불변 영역 중 역방향 프라이머) (서열번호: 94)
21) IgG2B = 5' AGGGGCCAGTGGATAGAGTGATGG 3' (마우스 IgG2B CH1 불변 영역 중 역방향 프라이머) (서열번호: 95)
변성 (degenerate) 프라이머는 중쇄 및 경쇄 둘 다의 골격구조 1 부위의 5' 말단에서 약간의 변성을 초래하였다. 몇 개의 독립적인 중쇄 가변 부위 클론으로부터 및 경쇄 가변 부위 클론으로부터의 공통 (consensus) DNA 서열을 사용하여 아미노산 서열을 유도하였다.
기능적 키메릭 항-CD52 항체는 중쇄 및 경쇄 가변 부위를 각각 DNA 코드화 인간 IgG1 중쇄 (캠퍼스-1H에서 발견되는 것과 동일한 서열) 및 인간 카파 경쇄 불변 부위(캠퍼스-1H에서 발견되는 것과 동일한 서열)에 접합시킴으로써 생산되었다. CD52 항체 경쇄를 코드화한 pCEP4 (Invitrogen) 경쇄 벡터를 생성시키기 위해서, 경쇄 가변 서열은 PCR 증폭시키고, pCEP4 LIC 경쇄 벡터 내로 리가제 독립적 클로닝함으로써 5' 말단에서 인간 카파 신호 서열 및 3' 말단에서 경쇄 불변 부위를 갖도록 처리하였다. 마찬가지로, pCEP4 중쇄 벡터를 생성시키기 위해서 중쇄 서열의 가변 부위는 pCEP4 LIC 중쇄 벡터 내로 리가제 독립적 클로닝함으로써 5' 말단에서 인간 카파 쇄 신호 서열 및 3' 말단에서 CH1, 힌지 (hinge), CH2 및 CH3 부위를 포함하는 중쇄 불변 부위를 갖도록 처리하였다. 중쇄 및 경쇄 둘 다에 대한 불변 부위 아미노산 서열은 캠퍼스 1H 항체에 존재하는 불변 부위의 아미노산 서열과 동일하다.
간략하면, pCEP4 LIC 벡터를 제조자의 추천에 따라 적절한 완충액 중에서 BfuA1(New England Biolabs-NEB)로 분해시키고, 완전한 분해 후에 벡터를 퓨어링크 (PureLink) PCR 정제 키트(Invitrogen)를 사용하여 정제하였다. 그 후, 선형화된 플라스미드를 T4 DNA 폴리머라제(New England Biolabs)로 처리하여 단일-스트랜드 말단을 생성시키고, 이것을 사용하여 가변 부위 단편을 클론화하였다. 중쇄 가변 부위를 클로닝하기 위해서 중쇄 특이적 pCEP4 LIC 벡터가 사용되었으며, 경쇄 가변 부위를 클로닝하기 위해서 경쇄 특이적 pCEP4 LIC 벡터가 사용되었다. 가변 부위 삽입물은 주형으로서 pCR2.1-TOPO 중쇄 가변 부위 함유 플라스미드 또는 pCR2.1-TOPO 경쇄 가변 부위 함유 플라스미드, 및 가변 쇄 특이적 서열 및 벡터 오버행(overhangs)을 함유하는 프라이머를 사용한 PCR에 의해서 생성시켰다. VENT DNA 폴리머라제(New England Biolabs)가 삽입물의 PCR 증폭을 위해서 사용되었다. PCR-증폭된 삽입물을 겔 정제하고, T4 DNA 폴리머라제로 처리하여 단일-스트랜드 말단을 생성시켰다. 중쇄 및 경쇄를 위해서 제조된 벡터 및 각각의 가변 부위 삽입물 단편을 조합하고, 실온에서 10 분 동안 배양하고, 이것을 사용하여 TOPO10 세포(Invitrogen)를 형질전환시키고, 앰피실린 저항성 콜로니를 골라내어 서열을 검증하였다. 골격 내에 삽입된 정확한 중쇄 및 경쇄 서열을 갖는 pCEP4 중쇄 및 pCEP4 경쇄 클론을 증폭시키고, 단백질 생산을 위해서 사용하였다. 중쇄 구조물을 상응하는 경쇄 구조물과 1:1 비로 HEK293 세포 (Invitrogen) 내에 양이온성 지질 리포펙타민 (LipofectamineTM) 2000(Invitrogen)을 사용하여 공동-형질감염시켰다. 조건 배지를 형질감염시킨지 3일 후에 수확하고, 키메릭 항체는 단백질 A 크로마토그래피를 사용하여 정제하였다. 이 크로마토그래피 방법을 위해서, 배지를 단백질 A에 첨가하고, 50 칼럼 용적의 PBS로 세척하였다. 키메릭 항체를 5 칼럼 용적의 12.5 mM 시트르산, pH 3.0으로 용출시켰다. 용출된 항체의 pH를 0.5 M HEPES를 첨가함으로써 중화시켰다. 완충액을 PD-10 겔 여과 칼럼을 사용함으로써 PBS로 교환하였다.
실시예
4:
키메릭
항-인간
CD52
모노클로날
항체의
에피토프
특이성의 분석
클론의 에피토프 특이성은 알라닌 주사 돌연변이유발에 의해서 생성된 인간 CD52의 돌연변이체(도 4)를 발현하도록 처리된 세포주의 패널에 결합하는 키메릭 항체의 능력을 평가함으로써 측정되었다. CD52의 12 아미노산 세포외 부위의 처음 10 개의 아미노산의 항체 치환은 스트라타젠 퀵체인지 (Stratagene QuikChange) II XL 부위-지시된 돌연변이유발 키트를 사용하여 pcDNA3.1 발현 벡터 (Invitrogen) 내의 인간 CD52 cDNA 상에서 수행하였다. 야생형 또는 돌연변이체 CD52 서열을 코드화한 pcDNA3.1 벡터를 서열-검증하고, 리포펙타민을 사용하고, G418을 함유하는 배지 내에서 선택함으로써 CHO 세포 내로 형질감염시켜 야생형 또는 알라닌 돌연변이체 CD52를 발현하는 CHO 세포주를 생성시켰다. 항-인간 CD52 키메릭 항체의 에피토프 특이적 결합은 FACS에 의해서 야생형 및 돌연변이체 CD52 발현 세포에 대한 항체의 결합을 측정함으로써 측정되었다. FACS 분석은 PE-컨주게이트된 염소 항-인간 이차 항체(Jackson ImmunoResearch Labs)를 사용하여 키메릭 항-CD52 항체의 결합을 검출함으로써 수행되었다. 도 5a-5c는 야생형 및 돌연변이체 CD52 발현 세포주에 대한 항-CD52 모노클로날 항체의 평균 형광 강도(MFI)를 나타낸다. 비록 CD52는 매우 짧은 12 아미노산의 GPI 고정된 단백질이지만, FACS 결과는 명백하게 여기에 항체의 3 개 세트가 있음을 규정한다: (1) N-말단 결합 그룹 (예를 들어, 4B10); (2) 중간 결합 그룹 (예를 들어, 4G7, 9D9 및 11C1) 및 (3) C-말단 결합 그룹 (예를 들어, 23E6, 12G6, 및 2C3). 항-인간 CD52 모노클로날 항체의 에피토프 특이성(실시예 2의 말미에 기술된 단축된 명칭에 의해서 확인됨)은 표 8에 요약한다.
표 8:
CD52는 극도로 작은 항원이지만, 비교적 큰 친수성 N 결합된 글리칸 부분뿐만 아니라 소수성 GPI-고정자를 갖는다. 당이 항-CD52 항체에 의해서 인식된 에피토프의 전부 또는 일부를 구성할 수 있는 가능성을 탐색하기 위해서, CHO-CD52 세포로부터 친화성 정제된 CD52의 샘플을 엔도글리코시다제, PNGase-F로 처리하여 항원으로부터 N 결합된 당을 완전히 제거하였다. 그 후, 처리 및 모의-처리된 대조 샘플을 SDS-PAGE에 의해서 분해시키고, 폴리비닐리덴 플루오라이드 (PVDF) 막 (Invitrogen)에 블럿팅하고, 표시된 항-CD52 키메릭 모노클로날 항체 각각의 최종 3 ㎍/ml로 프로브화하고, 이어서 강화된 화학발광 검출을 사용하여 표준 웨스턴 블럿팅 절차에 따라 전개시켰다. 캠퍼스-1H (C1H) 및 이차 항체 단독 (2° Alone)에 의한 블럿은 각각 양성 및 음성 대조군으로 주행시켰으며, 각각의 모노클로날 항체로 프로브화하였다(도 5D). 결과는 글리코실화 대 탈-글리코실화 CD52에 대한 항체들 사이의 상이한 결합 선호도를 나타내었다. 이러한 특정화에 의해 11 개의 항체는 4 가지 타입의 결합 그룹으로 분류되었다:
1.
글리코실화 대 탈-글리코실화된 CD52에 대한 명백한 선호도가 없는 결합을 나타내는 항체 (4G7, 9D9)
2.
글리코실화된 CD52에 대해 특이적인 결합을 나타내는 항체 (7F11, 4B10)
3.
탈-글리코실화된 CD52에 대해 특이적인 결합을 나타내는 항체 (8G3)
4.
글리코실화된 CD52에 비해서 탈-글리코실화된 CD52에 대해서 선택적인 결합을 나타내는 항체 (12G6, 5F7, 23E6, 2C3, 11C11, 3G7)
실시예
5:
키메릭
항-
CD52
항체의
CDC
활성
보체-의존성 세포독성 (CDC) 시험은 이하에 기술된 바와 같이 수행되었다. 간략하면, CD52 단백질(CHO-CD52)을 발현하도록 조작된 CHO K1 세포를 표적세포로 사용하고, 37℃에서 1-2 시간 동안 Na2 51CrO4(New England Nuclear, Boston, MA)로 표지하였다. 세포를 세척하고, 생체외 배지로 재현탁시키고, 2.2 ㎍/ml의 최종 농도로 항-인간 CD52 항체와 혼합시켰다. 인간 보체(Sigma)를 10%의 최종 농도로 실험 웰에 첨가하였다. 1-5-시간 배양한 후에 25 ㎕의 무-세포 상등액을 각각의 웰로부터 수집하고, 마이크로베타 트리룩스 (MicroBeta Trilux) 섬광계수기(Wallac, Gaithersburg, MD)에서 계수하였다. 자발적으로 방출된 51Cr의 양은 표적세포를 단독으로 배지 중에서 배양함으로써 수득되었다. 표적세포로부터의 자발적 방출은 전형적으로 20% 미만이었다. 혼입된 51Cr의 총량은 증류수 내의 1% 트리톤 (Triton) X-100을 첨가함으로써 측정되었으며, 용해 백분율은 다음과 같이 계산하였다: [(샘플 c.p.m. (counts per minute) - 자발적 c.p.m.)/(총 c.p.m.- 자발적 c.p.m.)] X 100.
12 개의 상이한 키메릭 항-CD52 항체(마우스 가변 부위 및 인간 IgG1 불변 부위)는 CHO-CD52 세포 상의 인간 보체를 사용하여 CDC 시험으로 시험하였다. 캠퍼스-1H 인간화된 항체가 양성 대조군으로 사용되었다. 음성 대조군은 캠퍼스-1H 눌 (null) (캠퍼스-1H의 비-세포 결합성 최소 돌연변이체 - H2 루프-중쇄 CDR2 부위에서 2 개의 점돌연변이 (K52bD 및 K53D; Gilliland LK et al., Journal of Immunology, 162:3663-3671 (1999))이었다. 결과는 키메릭 항체가 CD52-발현 세포 상에서 CDC 사멸을 매개할 수 있음을 나타낸다. 키메릭 항체 중의 일부는 캠퍼스 (Campath®)와 동등하거나 그보다 우수한 활발한 사멸을 매개하였다(도 6).
실시예
6:
키메릭
항-
CD52
항체의
ADCC
활성
항체-의존성 세포독성 (ADCC ) 시험은 이하에 기술된 바와 같이 수행되었다. 간략하면, CD52 단백질을 발현하도록 조작된 CHO K1 세포(CHO-CD52)를 표적세포로 사용하고, 37℃에서 1-2 시간 동안 Na2 51CrO4 (New England Nuclear, Boston, MA)로 표지하였다. 세포를 세척하고, 생체외 배지로 재현탁시키고, 1.1 ㎍/ml의 최종 농도로 항-인간 CD52 항체와 혼합시켰다. 인간 PBMC를 효과기 세포로 사용하였으며, 1:100 표적-대-효과기 세포 비로 첨가하였다. 6 시간-밤새 배양한 후에 25 ㎕의 무-세포 상등액을 각각의 웰로부터 수집하고, 마이크로베타 트리룩스 섬광계수기(Wallac, Gaithersburg, MD)에서 계수하였다. 자발적으로 방출된 51Cr의 양은 표적세포를 단독으로 배지 중에서 배양함으로써 수득되었다. 표적세포로부터의 자발적 방출은 전형적으로 20% 미만이었다. 혼입된 51Cr의 총량은 증류수 내의 1% 트리톤 X-100을 첨가함으로써 측정되었으며, 용해 백분율은 다음과 같이 계산하였다: [(샘플 c.p.m. - 자발적 c.p.m.)/(총 c.p.m.- 자발적 c.p.m.)] X 100.
12 개의 상이한 키메릭 항-CD52 항체(마우스 가변 부위 및 인간 IgG1 불변 부위)는 효과기 세포로서 인간 PBMC를 사용하여 ADCC 시험으로 시험하였다. 캠퍼스-1H 인간화된 항체가 양성 대조군으로 사용되었다. 음성 대조군으로는 캠퍼스-1H 눌 (캠퍼스-1H의 비-세포 결합성 최소 돌연변이체 - H2 루프-중쇄 CDR2 부위에서 2 개의 점돌연변이 (K52bD 및 K53D; Gilliland, 1999, supra))이었다. 결과는 키메릭 항체가 CD52-발현 세포 상에서 ADCC 사멸을 매개할 수 있음을 나타낸다. 키메릭 항체 중의 일부는 캠퍼스-1H (Campath-1H®)와 동등하거나 그보다 우수한 활발한 사멸을 매개하였다 (도 7).
실시예
7: 규정된 림프구 집단에 대한
키메릭
항-
CD52
항체의 결합의 평가
이하의 형광색소 컨주게이트된 항체가 유세포분석을 위해서 사용되었다: 항-CD3-FITC, 항-CD27-PE, 항-CD62L-PE Cy5, 항-CD56-PE Cy7, 항-CD16-APC Cy7 (BD Biosciences, San Diego, CA), 항-CD45RA-ECD (Beckman Coulter), 항-CD19-퍼시픽 블루 (Pacific Blue), 항-CD4-APC Cy5.5 및 항-CD8 퍼시픽 오렌지 (pacific orange) (Invitrogen, CA). 마우스 키메릭 항-인간 CD52 항체뿐만 아니라 인간화된 캠퍼스-1H®은 모두 알렉사 플루오르 (Alexa fluor) 647(BD Pharmingen)에 컨주게이트시켰다. 건강한 인간 말초혈액 단핵세포는 냉동보존된 연막으로부터, 또는 상업적 판매자(Bioreclamation, NY, USA)로부터 수득한 정상 공여체의 혈액으로부터 분리된 단핵세포로부터 수득되었다. 단핵세포의 강화를 위해서, 인간 말초혈액을 멸균 포스페이트 완충된 식염수(PBS)로 1:1 희석하고, 피콜-하이파크(Ficoll-hypaque)(GE Healthcare Bio-Sciences, Uppsala, Sweden) 상에 조심스럽게 적층시키고, 실온에서 30 분 동안 원심분리시켰다. 단핵세포의 상간층(interphase layer)을 뽑아내고, 5% 태자소혈청을 함유하는 PBS(FACS 완충액)로 세척하였다. 오염 적혈구(RBCs)를 RBC 용해용액(Sigma, St. Louis, MO, USA)으로 용해시켰다. 세포를 냉 FACS 완충액에 재현탁시키고, 파편은 40 미크론 필터를 사용하여 제거하였다. 10색 (color) 유세포분석을 수행하여 캠퍼스-1H와 비교하여 9 개의 키메릭 항-인간 CD52 항체(4B10, 7F11, 9D9, 5F7, 2C3, 4G7, 23E6, 8G3, 3G7)의 결합능을 평가하였다.
간략하면, FACS 완충액 중의 1 x 106 PBMC의 리플리케이트(replicate)를 9 개의 키메릭 항-인간 CD52 항체 (4B10, 7F11, 9D9, 5F7, 2C3, 4G7, 23E6, 8G3, 3G7) 중의 하나와 함께 CD3, CD27, CD45RA, CD62L, CD56, CD19, CD8, CD4, CD16에 대한 항체의 전-적정된 희석액의 칵테일과 4 ℃에서 30 분 동안 배양하였다. 세포를 세척하고, 1% 파라포름알데히드를 함유하는 PBS 중에 고정시켰다. 염색된 세포의 100,000 이벤트(events)를 BD LSR-II (BD Biosciences, San Jose, CA) 상에서 획득하고, 데이터는 플로우조 (FlowJo) 7.2 버전 소프트웨어(Tree Star, Inc, Oregan, USA)를 사용하여 분석하였다. 별개의 표현형적 특징을 갖는 다수의 서브세트를 B 및 T 림프구 중에서 규정하였으며, CD52는 모든 인간 림프구 상에서 발현되는 것으로 나타났다. 10색 유세포분석을 수행하여 림프구 서브세트를 확인하고, 규정된 서브세트 상의 세포 표면 CD52에 대한 항-CD52 항체의 결합 특징의 유사성 및 차이를 평가하였다. 마커의 조합을 사용하여 B, T 및 NK 세포계에 상응하는 11 개의 표현형적으로 상이한 세포 집단을 림프구 게이트(gate)로부터 일차로 규정하였다. 그 후, CD52 발현을 검출하는 항-CD52 항체의 능력에 상응하는 염색의 강도를 평가하였다. 히스토그램 (도 8a-8c)은 개개 림프구 집단 상에서 각각의 항체에 의한 CD52의 검출 레벨의 비교를 나타낸다. 데이터는 항체가 CD52에 대한 결합에 있어서 상당한 차이를 나타냄을 보여준다. 4B10, 9D9, 7F11 및 캠퍼스-1H에 의한 검출의 레벨은 동등하지만, 4B10은 검사한 세포 서브세트 모두에서 캠퍼스-1H를 포함한 다른 항체보다 일관되게 최고의 검출 레벨을 나타낸다. 반면에, 3G7, 4G7, 8G3 및 23E6 항체에 의한 CD52의 검출 레벨은 상당히 더 낮다. 상기 결과는 다양한 세포 집단 상의 CD52를 인식하는 그들의 능력에 관한 항체 간의 계층을 나타내며, 여기에서는 4B10이 최고이고, 3G7가 최저이다. 흥미롭게도, 이들 차이는 CD4 효과기 상에서는 덜 명백하고, CD52가 비교적 낮은 레벨로 발현되는 것으로 보이는 NK 세포 서브세트 상에서는 더 명백하다. 결합 특징에서의 변화는 키메릭 항체의 특성이 캠퍼스-1H와 상당히 다를 뿐만 아니라 항체들 간의 특성에서의 차이를 반영하는 것임을 시사한다.
실시예 8: 인간 CD52 유전자이식 마우스에서 키메릭 항- CD52 항체의 분석 (7F11, 8G3, 23E6, 12G6, 4B10 및 5F7)
인간 CD52 유전자이식 마우스에게 캠퍼스 (Campath®) 또는 키메릭 항-CD52 항체(7F11, 8G3, 23E6, 12G6, 4B10 및 5F7)를 투여하여 림프구 고갈의 레벨을 검사하였다. 마우스에게 1 mg/kg의 용량의 캠퍼스 또는 키메릭 항-CD52 항체를 100 ㎕ 용적으로 복강내 주사하였다. 3일 후에 마우스를 희생시키고, 혈액 및 비장을 수집하여 B 및 T-세포 고갈의 레벨을 측정하였다. 유세포분석을 이용하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포, 세포독성 T 세포 및 B 세포의 절대수를 평가하였다. 이들 림프구 집단은 다음의 단백질 항원의 그들의 표면 발현에 의해서 규정되었다: CD4 발현은 T 헬퍼세포 집단을 확인하며, CD8 발현은 세포독성 T 세포 집단을 확인하고, CD19 발현은 모든 성숙한 B 세포 집단을 확인한다. 상당한 레벨의 T 및 B-세포 고갈이 12G6 및 4B10 항체 둘 다에 관해서 관찰되었으며, 이것은 캠퍼스에 의해서 관찰된 고갈과 동등하였다. 캠퍼스, 키메릭 12G6 또는 키메릭 4B10 항체에 의한 처리는 이 용량 레벨에서 처리된 마우스의 혈액 및 비장 둘 다에서 T 및 B 세포를 상당히 감소시켰다. 7F11 및 5F7 키메릭 항체는 혈액 및 비장 내에서 상당한 레벨의 T 세포 고갈을 제공하였지만, 두 가지 구획 모두에서 B 세포 고갈에는 덜 효과적이었다. 23E6 항체에 의한 처리는 이 용량에서 중등도 레벨의 고갈을 제공한 반면에 더 낮은 친화성의 8G3 항체에 의해서는 거의 또는 전혀 고갈이 관찰되지 않았다.
도 9a-9c는 키메릭 항체를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포, CD8 T 세포 및 CD19 B 세포의 레벨을 나타낸다. 도 10a-10c는 투여한지 72 시간 후에 비장 내의 CD4 T 세포, CD8 T 세포 및 CD19 B 세포의 레벨을 나타낸다.
실시예 9: 인간 CD52 유전자이식 마우스에서 키메릭 항- CD52 항체의 분석 (2C3, 3G7, 4B10, 9D9, 및 11C11)
인간 CD52 유전자이식 마우스에게 캠퍼스 (Campath®) 또는 키메릭 항-CD52 항체(2C3, 3G7, 4B10, 9D9 및 11C11)를 투여하여 림프구 고갈의 레벨을 검사하였다. 마우스에게 1 mg/kg의 용량의 캠퍼스 또는 키메릭 항-CD52 항체를 100 ㎕ 용적으로 정맥내 주사하였다. 3일 후에 마우스를 희생시키고, 혈액 및 비장을 수집하여 B 및 T-세포 고갈의 레벨을 측정하였다. 유세포분석을 이용하여 huCD52 유전자이식 마우스의 순환 말초혈액 내에 존재하는 총 T 헬퍼세포, 세포독성 T 세포 및 B 세포의 절대수를 평가하였다. 이들 림프구 집단은 다음의 단백질 항원의 그들의 표면 발현에 의해서 규정되었다: CD4 발현은 T 헬퍼세포 집단을 확인하며, CD8 발현은 세포독성 T 세포 집단을 확인하고, CD19 발현은 모든 성숙한 B 세포 집단을 확인한다. 상당한 레벨의 T 및 B-세포 고갈이 혈액 및 비장 둘 다에서 몇 가지 항체에 관해서 관찰되었다. 2C3 및 9D9에 대한 고갈 활성은 캠퍼스에 의해서 관찰된 고갈과 동등하였으며, 여기에서는 CD4 및 CD8 T 세포 및 CD19 B 세포의 상당한 레벨이 고갈되었다. 키메릭 4B10에 의한 처리는 또한, 유전자이식 마우스의 혈액 내에서 림프구의 수의 상당한 감소를 제공하였다. 키메릭 항체인 3G7 또는 11C11 항체에 의한 처리는 혈액 내의 T 세포를 상당히 고갈시킨 반면에, 존재하는 B 세포의 레벨은 이 용량에서 상당한 영향을 받지 않았다.
도 11a-11c는 키메릭 항체를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포, CD8 T 세포 및 CD19 B 세포의 레벨을 나타낸다.
실시예
10: 항-
CD52
항체 (7F11, 4B10 및 12
G6
)의 효능의 분석
40 마리의 SCID 마우스 (n=8/그룹)의 오른쪽 옆구리에 1x106 B104 종양세포를 100 ㎕ 용적으로 주사하였다. 종양세포 주사 후 제11일에 캠퍼스 (Campath®), 7F11, 4B10 또는 12G6 키메릭 항체로 처리를 시작하였다. 항체는 실험의 나머지 기간 전체에 걸쳐서 복강내 주사로 10 mg/kg을 주 1 회 투여하였다. 비처리군의 모든 마우스는 29일의 중앙 생존기간으로 희생을 필요로 하는 점진적으로 성장하는 종양을 발생시켰다. 캠퍼스에 의한 처리는 비처리군에 비해 생존에 있어서 통계학적으로 유의적인 증가를 제공하였다(50일의 중앙 생존기간 (MS) 및 p<0.0001). 키메릭 항-CD52 항체에 의한 처리는 또한 비처리 마우스에 비해 생존에 있어서 통계학적으로 유의적인 증가를 제공하였다(7F11 및 4B10의 경우에 p<0.0001, 및 12G6의 경우에 p=0.0020). 생존율을 기초로 하여, 7F11 및 4B10 항체의 활성은 캠퍼스보다 더 큰 것으로 보인다(캠퍼스의 경우에 50% 생존율에 비해서 7F11의 경우는 63% 생존율 및 4B10의 경우는 75% 생존율). 도 12는 처리 후의 마우스의 생존율 %를 나타낸다.
실시예
11: 항-
CD52
항체 (2
C3
, 8
G3
및 23
E6
)의 효능의 분석
40 마리의 SCID 마우스 (n=8/그룹)의 오른쪽 옆구리에 1x106 B104 종양세포를 100 ㎕ 용적으로 주사하였다. 종양세포 주사 후 제11일에 캠퍼스 (Campath®), 2C3, 8G3 또는 23E6키메릭 항체로 처리를 시작하였다. 항체는 실험의 나머지 기간 전체에 걸쳐서 복강내 주사로 10 mg/kg을 주 1 회 투여하였다. 비처리군의 모든 마우스는 26일의 중앙 생존기간으로 희생을 필요로 하는 점진적으로 성장하는 종양을 발생시켰다. 캠퍼스, 23E6, 및 2C3 항체에 의한 처리는 생존에 있어서 통계학적으로 유의적인 증가를 제공하였다(각각 p=0.0025, p=0.0007, 및 p=0.0002). 도 13은 처리 후의 마우스의 생존율 %를 나타낸다.
실시예 12: 이종이식 종양 모델에서 키메릭 항- CD52 항체의 효능의 분석 (9D9 및 4B10)
40 마리의 SCID 마우스(n=8/그룹)의 오른쪽 옆구리에 1x106 B104 종양세포를 100 ㎕ 용적으로 주사하였다. 종양세포 주사 후 제11일에 캠퍼스 (Campath®), 9D9 또는 4B10 키메릭 항체로 처리를 시작하였다. 항체는 실험의 나머지 기간 전체에 걸쳐서 복강내 주사로 10 mg/kg을 주 1 회 투여하였다. 비처리군의 모든 마우스는 27일의 중앙 생존기간으로 희생을 필요로 하는 점진적으로 성장하는 종양을 발생시켰다. 캠퍼스에 의한 처리는 비처리군에 비해 생존에 있어서 통계학적으로 유의적인 증가를 제공하였다(중앙 생존기간을 달성하지 못하였으며, p<0.0001). 키메릭 항-CD52 항체에 의한 처리는 또한 비처리 마우스에 비해 생존에 있어서 통계학적으로 유의적인 증가를 제공하였다(9D9 및 4B10의 경우에 p<0.0001). 생존곡선의 통계학적 분석은 9D9 키메릭 항체가 이 실험에서 캠퍼스와 동등한 활성 (p=0.0675)을 나타내었음을 보여준다. 도 14는 처리 후의 마우스의 생존율 %를 나타낸다.
실시예 13: 이종이식 종양 모델에서 키메릭 항- CD52 항체의 효능의 분석 (2C3 및 11C11)
40 마리의 SCID 마우스 (n=8/그룹)의 오른쪽 옆구리에 1x106 B104 종양세포를 100 ㎕ 용적으로 주사하였다. 종양세포 주사 후 제11일에 캠퍼스 (Campath®), 2C3 또는 11C11 키메릭 항체로 처리를 시작하였다. 항체는 실험의 나머지 기간 전체에 걸쳐서 복강내 주사로 10 mg/kg을 주 1 회 투여하였다. 비처리군의 모든 마우스는 32일의 중앙 생존기간으로 희생을 필요로 하는 점진적으로 성장하는 종양을 발생시켰다. 캠퍼스에 의한 처리는 비처리군에 비해 생존에 있어서 통계학적으로 유의적인 증가를 제공하였다(중앙 생존기간을 달성하지 못하였으며, p<0.0001). 키메릭 항-CD52 항체에 의한 처리는 또한 비처리 마우스에 비해 생존에 있어서 통계학적으로 유의적인 증가를 제공하였다(2C3의 경우에 p<0.0001 및 11C11의 경우에 p=0.0004). 생존곡선의 통계학적 분석은 2C3 및 11C11 키메릭 항체 둘 다가 캠퍼스와 동등한 활성을 나타내었음을 보여준다(2C3의 경우에 p=0.3173 및 11C11의 경우에 p=0.9703). 도 15는 캠퍼스, 2C3 키메릭 항체 또는 11C11 키메릭 항체에 의한 처리 후의 마우스의 생존율 %를 나타낸다.
실시예
14: 인간화된 항-
CD52
항체 4B10의 생성 및 분석
인간화된 항-인간 CD52 항체 4B10은 마우스 4B10 항체로부터의 CDR 부위를 인간 항체 가변 부위 골격구조 내로 그래프트함으로써 생성되었다. 마우스 4B10 중쇄 및 경쇄 서열은 CDR 그래프트에 적합한 수용기로 작용할 수 있는 인간 배선 중쇄 및 경쇄 골격구조 서열을 확인하기 위하여 웹-기반 서열 정렬에 의해서 평가되었다(도 16). 카바트 및 IMGT®에 의해서 CDR 부위를 규정하는 잔기를 큰 서열 동일성을 갖는 인간 골격구조 부위 내에 중첩시켜 (superimposed) 인간화된 중쇄 및 경쇄 서열을 생성시켰다. 중첩된 4B10 중쇄 및 경쇄 서열의 시각적 검사 및 서열 분석을 수행하여 가장 적합한 수용기 서열을 확인하였다. 큰 유사성을 갖는 모든 배선 서열 중에서 중쇄에 대한 VH3-72 배선 서열 및 경쇄에 대한 VK2-A18b(인간 배선 서열은 문헌 [Tomlinson, IM, et al., EMBO J., 14(18):4628-4638 (1995); Cook, GP., et al., Nature Genetics, 7:162-168 (1994)]에 의해서 간행물에 기술된 웹사이트에서 발견할 수 있다)가 마우스 골격구조 부위에 대한 그들의 높은 정도의 상동성, 서열 유사성으로 인하여 및 CDR 루프 구조의 최소 붕괴를 위해서 CDR 수용기 서열로 선택되었다. 4B10에 대한 중쇄 및 경쇄의 CDR1, 2, 및 3 서열을 각각 VH3-72 및 VK2-A18b 인간 골격구조 부위에 그래프트하여 4B10에 대한 인간화된 중쇄 및 경쇄 서열을 생성시켰다(도 17; 도 110에 예시됨).
실시예
15:
키메릭
및 인간화된 4B10
모노클로날
항체의 결합 활성의 평가
키메릭 및 인간화된 4B10 항체를 실시예 3에 기술된 바와 같이 생산 및 정제하고, 내인성으로 CD52를 발현하는 B 세포주 B104에 결합하는 그들의 능력에 대해 FACS에 의해서 분석하였다. 간략하면, 2 x 105 B104 세포를 5% 태자소혈청 및 5% 염소 혈청을 함유하는 PBS 중에서 항체(0.02 ㎍/ml 내지 16.7 ㎍/ml)와 함께 배양하였다. 결합된 항체를 키메릭 또는 인간화된 항-CD52 항체를 검출한 FITC 표지된 염소 항-인간 이차 항체로 검출하였다. 표지된 세포는 FACS칼리부 시스템(FACSCalibur system) (Becton Dickinson)을 사용하여 분석하였다. 도 18은 2°-단독 샘플의 경우로 표준화된 (나눈) 각각의 샘플의 기하학적 평균 형광강도의 폴드(fold) 증가를 나타낸다. 상기 시험에서 사용된 인간화 및 키메릭 항체의 11 개의 상이한 농도 (X 축 상의 12 번째 점은 2차 단독이다)는 X 축 상에 나타내고, 평균 형광의 기하평균 폴드 증가는 Y 축 상에 나타낸다. 결과는 인간화된 4B10 항체가 CD52 발현 세포에 대해 키메릭 4B10 항체와 마찬가지로 또는 그 보다 약간 더 잘 결합함을 나타낸다.
실시예
16:
키메릭
및 인간화된 4B10
모노클로날
항체의
ADCC
활성의 평가
인간화 및 키메릭 4B10 항체를 CD52-발현 세포의 ADCC 사멸을 매개하는 이들의 능력에 대해서 평가하였다. ADCC 시험은 상기 실시예 6에 기술된 바와 같이 수행되었다. 간략하면, CD52 단백질을 발현하도록 조작된 CHO K1 세포(CHO-CD52)를 표적세포로 사용하고, 37 ℃에서 1-2 시간 동안 Na2 51CrO4(New England Nuclear, Boston, MA)로 표지하였다. 세포를 세척하고, 10% FCS를 갖는 RPMI 1640 배지로 재현탁시키고, 10 ㎍/ml 내지 0.01 ㎍/ml 범위의 다양한 농도로 키메릭 또는 인간화된 4B10 항체와 혼합시켰다. 인간 PBMC를 효과기 세포로 사용하였으며, 1:50 표적-대-효과기 세포 비로 첨가하였다. 6 시간-밤새 배양한 후에 25 ㎕의 무-세포 상등액을 각각의 웰로부터 수집하고, 마이크로베타 트리룩스 섬광계수기(Wallac, Gaithersburg, MD)에서 계수하였다. 자발적으로 방출된 51Cr의 양은 표적세포를 단독으로 배지 중에서 배양함으로써 수득되었다. 표적세포로부터의 자발적 방출은 전형적으로 20% 미만이었다. 혼입된 51Cr의 총량은 증류수 내의 1% 트리톤 X-100을 첨가함으로써 측정되었으며, 용해 백분율은 다음과 같이 계산하였다: [(샘플 c.p.m. - 자발적 c.p.m.)/(총 c.p.m.- 자발적 c.p.m.)] X 100.
도 19는 시험에서 사용된 대조, 키메릭 및 인간화된 4B10 항체의 농도(X 축)를 예시하며, Y 축은 특이적 사멸 %를 나타낸다. 결과는 인간화된 4B10 항체가 키메릭4B10 항체와 동등하거나 약간 더 우수한 ADCC 사멸을 매개하였음을 나타낸다. 대조 IgG1 이소타입 대조군은 시험한 농도에서 단지 낮은 레벨의 배경 사멸만을 나타내었다.
실시예
17:
키메릭
및 인간화된 4B10
모노클로날
항체의
CDC
활성의 평가
인간화 및 키메릭 4B10 항체를 인간 보체의 존재 하에서 내인성으로 CD52를 발현하는 B104 세포 상에서 세포독성 효과를 매개하는 그들의 능력에 대해서 평가하였다. 셀타이터 글로 키트(CellTiter Glo kit) (Promega)를 사용하여 시험에서 잔류하는 생존 세포를 측정하였다. 간략하면, B104 세포(표적세포)를 96 웰 플레이트에 2.5x104 세포/웰로 플레이팅하고, 1 ㎍/ml 내지 25 ㎍/ml 범위의 다양한 농도의 키메릭 또는 인간화된 4B10 항체 및 10%의 최종 농도로 인간 보체와 혼합시켰다. 항체가 없이 보체 단독 및 보체가 없이 항체 단독인 경우를 대조군으로 사용하여 배경을 측정하였다. 37℃에서 3 시간 배양한 후에, 플레이트를 1500 rpm에서 3 분 동안 원심분리하고, 펠릿 내에 존재하는 생존 세포는 셀타이터 글로 시험을 사용하여 측정하였다. 플레이트는 엔비존 (Envision) 장치 상에서 판독하였다. 도 20은 셀타이터 글로 시험을 사용하여 측정된 것으로서 시험에 존재하는 생존 세포를 나타낸다. 또한, 인간화 및 키메릭 4B10 항체의 농도를 증가시키면 생존 세포의 수는 감소한다. 이들 결과는 인간화된 항체가 B104 세포의 CDC 매개된 사멸에 있어서 키메릭 4B10 항체와 마찬가지 또는 그보다 약간 더 잘 작용하였음을 시사한다.
실시예 18: CD52 유전자이식 마우스에서 키메릭 및 인간화된 항- CD52 항체의 약력학적 프로필의 분석 (12G6, 7F11, 키메릭 및 인간화된 4B10)
인간 CD52 유전자이식 마우스에게 캠퍼스 (Campath®), 12G6, 7F11, 및 키메릭 및 인간화된 4B10 항-CD52 항체 중의 하나를 투여하여 림프구 고갈의 레벨을 검사하였다. 마우스에게 1 mg/kg 용량의 이들 항체 중의 하나를 100 ㎕ 용적으로 정맥내 주사하였다. 항-항체 반응의 분석을 위해서, 100 ㎕의 혈액을 항체 주사 후 2 시간, 1, 2, 4, 7, 및 10일에 안와정맥총의 천자를 통해서 혈청 분리관 내로 수집하였다. ELISA 분석을 사용하여 각각의 혈청 샘플 내의 순환 인간 IgG1의 레벨을 측정하였다. 항체의 순환 레벨을 기초로 하여, 캠퍼스, 7F11, 및 4B10의 키메릭 및 인간화된 형태 사이에는 거의 또는 전혀 차이가 없는 것으로 보인다. 12G6 항체는 주사 후에 더 낮은 cmax 값을 나타내었으며, 이것은 이 항체가 더 빠르게 분해될 수 있음을 시사한다. 도 21은 캠퍼스, 12G6 (키메릭), 7F11 (키메릭), 4B10 (키메릭) 및 4B10 (인간화된) 항체의 약력학적 프로필을 나타낸다.
실시예 19: CD52 유전자이식 마우스에서 키메릭 및 인간화된 항- CD52 항체의 고갈 활성의 분석 (키메릭 및 인간화된 4B10)
인간 CD52 유전자이식 마우스에게 캠퍼스 (Campath®) 또는 키메릭 또는 인간화된 4B10 항-인간 CD52 항체를 투여하여 림프구 고갈의 레벨을 검사하였다. 마우스에게 0.1 mg/kg 용량의 캠퍼스 또는 키메릭 또는 인간화된 4B10 항-인간 CD52 항체를 100 ㎕ 용적으로 정맥내 주사하였다. 3일 후에, 마우스를 희생시키고, 혈액과 비장을 수집하여 B 및 T-세포 고갈의 레벨을 측정하였다. 유세포분석을 이용하여 huCD52 유전자이식 마우스의 순환 말초혈액 내에 존재하는 총 T 헬퍼세포, 세포독성 T 세포, 및 B 세포의 절대수를 평가하였다. 이들 림프구 집단은 다음 단백질 항원의 그들의 표면 발현에 의해서 규정되었다: CD4 발현은 T 헬퍼세포 집단을 확인하며, CD8 발현은 세포독성 T 세포 집단을 확인하고, CD19 발현은 모든 성숙한 B 세포 집단을 확인한다. 비장 내에서 고갈 활성의 비교는 캠퍼스 또는 4B10의 키메릭 또는 인간화된 형태의 투여 후에 고갈된 T 세포의 레벨에 차이가 없음을 나타내었다. 사용된 저용량으로 인하여, 단지 보통 정도의 레벨의 B 세포 고갈만이 비장에서 관찰되었다. 각 동물 기준으로, 인간화된 4B10 항체는 림프구 고갈을 매개하는데 있어서 캠퍼스만큼 우수하거나 그보다 약간 더 우수한 것으로 보인다. 도 22a-22c는 키메릭 및 인간화된 항체를 투여한지 72 시간 후에 혈액 내의 CD4 T 세포, CD8 T 세포 및 CD19 B 세포의 레벨을 나타낸다.
실시예
20: 항-인간
CD52
항체의 상대적 결합 효율
선택된 항-CD52 항체의 EC50 값은 CD52를 발현하도록 조작된 CHO 세포를 사용하여 평가하였다. CHO-CD52 세포를 0.25% 트립신 중에서 트립신처리하고, 수집하여 PBS/5% FBS로 세정하였다. 그 후, 세포를 둥근-바닥 96 웰 플레이트 내에 웰당 1E5 세포로 침착시켰다. 일차 항체 염색은 50 ㎍/mL에서 시작하는 각각의 항-CD52 키메릭 항체의 12 점 계열희석액 (1:2)을 사용하여 수행하였다. 이차로는 10 ㎍/mL의 항-인간 Fc 감마의 FITC-컨주게이트된 염소 FAB2 단편(Jackson 109-096-098)이 사용되었다. 세포는 각각의 배양 전 및 후에 빙냉 PBS/5% FBS 중에서 3 회 세척하였다. 세포를 2% 무-메탄올 파라포름알데히드를 함유하는 PBS로 고정시키고, 유세포분석에 의해서 평가하였다. 유세포분석 데이터를 그래프 패드 프리즘 (Graph pad Prizm) 소프트웨어를 사용해서 분석하여 95% 신뢰구간으로 EC50 값을 측정하였다.
결합 데이터(도 23)는 새로운 CD52 항체가 전술한 바와 같이 상이한 에피토프 특이성을 가질 뿐만 아니라 이하에 제시된 표에 나타낸 바와 같이 상이한 결합 특징을 가짐을 나타낸다. 캠퍼스-1H, 7F11, 4B10, 2C3 및 12G6 키메릭 항체는 0.5 내지 2.5 ㎍/ml의 비교적 유사한 EC50 값을 나타내었다. 9D9 키메릭 항체는 대략 5 내지 7 ㎍/ml의 EC50 값을 갖는 약간 상이한 결합 특징을 나타내었다. 4B10 인간화된 항체는 키메릭 4B10 항체의 경우와 유사한 결합 특징을 나타내었으며, 이것은 인간화된 항체가 키메릭 4B10 항체와 같은 결합 특징을 유지하였음을 시사한다.
표 9:
실시예
21: 항-
CD52
항체 클론 7F11의 인간화
항-인간 CD52 항체 클론 7F11의 인간화는 4B10 항체 인간화에 대한 실시예 14에 기술된 바와 같이, 마우스 7F11 항체로부터의 CDR 부위를 인간 항체 가변 부위 골격구조 내에 그래프트함으로써 수행되었다. 7F11의 중쇄 및 경쇄의 CDR-1, CDR-2 및 CDR-3 서열을 각각 VH3-72 및 VK2 A18b 인간 골격구조 부위에 그래프트하였다. 인간 JH6 (WGQGTTVTVSS: SEQ ID NO: 133) 및 JK2 (FGQGTKLEIK: SEQ ID NO: 134) 서열을 각각 인간화된 중쇄 및 경쇄에 대한 C-말단 펩타이드로 선택하여 7F11을 위한 인간화된 중쇄 (7F11-SFD1 및 7F11-SFD2) 및 인간화된 경쇄 (7F11-VK2) 가변 부위 서열을 생성시켰다 (도 24). 2 개의 인간화된 중쇄 가변 부위 서열(7F11-SFD1 및 7F11-SFD2)은 CDR-3 부위 내의 한 개의 아미노산 잔기가 상이하다. 7F11-SFD1 버전은 93 위치(카바트 넘버링 시스템에 의해서 표시됨)에 트레오닌을 갖는 반면에, 7F11-SFD2 버전은 이 위치에 알라닌을 갖는다. 위치 93은 도 24에서 7F11-SFD1 및 7F11-SFD2 둘 다에 대해 밑줄을 그었다.
7F11-SFD1(SEQ ID NO: 274)의 전체-길이 중쇄 아미노산 서열 및 7F11-K2(SEQ ID NO: 275)의 전체-길이 경쇄 아미노산 서열은 도 107에 나타낸다.
실시예
22:
키메릭
및 인간화된 7F11
모노클로날
항체의 결합 활성의 평가
키메릭 및 인간화된 7F11 항체(7F11-SFD1/K2 및 7F11-SFD2/K2)를 실시예 3에 기술된 방법을 사용하여 생성시키고 정제하고, CHO-CD52 세포(인간 CD52를 발현하도록 조작된 CHO 세포)의 표면 상에 발현된 CD52에 결합하는 그들의 능력에 대해 유세포분석에 의해서 분석하였다. 간략하면, 2 x 105 CHO-CD52 세포를 5% 태자소혈청 및 5% 염소 혈청을 함유하는 PBS 중에서 10 ㎍/ml의 항체와 함께 배양하였다. 결합된 항체를 키메릭 또는 인간화된 항-CD52 항체를 검출한 FITC-표지된 염소 항-인간 이차 항체로 검출하였다. 표지된 세포는 FACS칼리부 시스템(Becton Dickinson)을 사용하여 분석하고, 데이터는 플로우조 버전 7.2 소프트웨어(Tree Star, Inc, Oregan, USA)를 사용하여 분석하였다. 도 25의 히스토그램은 키메릭 및 인간화된 7F11 항체에 의해서 검출된 CD52의 레벨을 비교한다. 결과는 인간화된 7F11 항체가 CD52 발현 세포에 대해 키메릭 7F11 항체와 마찬가지로 또는 그 보다 약간 더 잘 결합함을 나타낸다.
실시예
23: 항-
CD52
항체 클론 2
C3
의 인간화
항-인간 CD52 항체 클론 2C3의 인간화는 클론 4B10 항체 인간화에 대한 실시예 14에 기술된 바와 같이, 마우스 2C3 항체로부터의 CDR 부위를 인간 항체 가변 부위 골격구조 내로 그래프트함으로써 수행되었다. 2C3의 중쇄 및 경쇄의 CDR-1, CDR-2 및 CDR-3 서열을 각각 VH3-72 및 VK2 A18b 인간 골격구조 부위에 그래프트하였다. 인간 JH6 (WGQGTTVTVSS: SEQ ID NO: 133) 및 JK5 (FGQGTRLEIK: SEQ ID NO: 135) 서열을 각각 인간화된 중쇄 및 경쇄를 위한 C-말단 펩타이드로 선택하여 2C3에 대한 인간화된 중쇄 (2C3-SFD1) 및 경쇄 (2C3-VK1) 가변 부위 서열을 생성시켰다(도 26a 및 b). 인간화된 클론 4B10 및 7F11과는 달리, CDR-그래프트된 인간화된 2C3 항체에 대한 결합 친화성은 크게 감소되었다. 결합 친화성은, 역돌연변이의 수를 최소로 제한하여 재형성된 항체를 가능한 한 "인간"형으로 유지시켜 면역원성의 가능성을 감소시킬 목적으로 CDR-그래프트된 구조에 역돌연변이를 도입시킴으로써 회복되었다. 단일 또는 다수의 역돌연변이를 인간화된 중쇄 및 경쇄 가변 부위 서열 둘 다에 혼입시켰다. 역돌연변이의 위치 (카바트 넘버링 시스템에 의해서 표시됨)는 이하의 표 10 및 표 11에 나타낸다. 이들 역돌연변이에 의해서 생성된 항체는 회복된 결합 친화성에 대해서 평가하였다. 3 개의 경쇄 변이체 (2C3-VK11로도 불리는 (2C3-VK1(L46R); 2C3-VK12로도 불리는 2C3-VK1(Y36L-L46R); 및 2C3-VK13으로도 불리는 2C3-VK1(M4I-A19V-Y36L-Q45K-L46R)) 및 5 개의 중쇄 변이체 (2C3-VH12로도 불리는 2C3-SFD1(L78V); 2C3-VH15로도 불리는 2C3-SFD1(G49A); 2C3-VH16으로도 불리는 2C3-SFD1(G49A-L78V); 2C3-VH17로도 불리는 2C3-SFD1(L18M-G49A-L78V); 및 2C3-VH19로도 불리는 2C3-SFD1(L18M-G42E-G49A-L78V))가 표준 분자생물학 기술을 사용하여 생성되었다. CDR-그래프트된 중쇄 가변 부위 서열 2C3-SFD1 및 역돌연변이체 2C3-VH12, 2C3-VH15, 2C3-VH16, 2C3-VH17, 및 2C3-VH19의 아미노산 서열은 도 26a에 나타내며, 여기에서 역돌연변이된 아미노산은 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 마찬가지로, 경쇄 서열의 경우에 CDR-그래프트된 가변 부위 서열 2C3-VK1 및 역돌연변이체 2C3-VK11, 2C3-VK12, 및 2C3-VK13은 도 26B에 나타내며, 여기에서 역돌연변이된 아미노산은 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
2C3-SFD1(SEQ ID NO: 272)의 전체-길이 중쇄 아미노산 서열 및 2C3-K12(SEQ ID NO: 273)의 전체-길이 경쇄 아미노산 서열은 도 106에 나타낸다.
표 10:
표 11:
실시예
24:
키메릭
및 인간화된 2
C3
모노클로날
항체의 결합 활성의 평가
키메릭 및 인간화된 2C3 항체는 실시예 3에 기술된 방법을 사용하여 생성시키고 정제하였다. 중쇄 변이체와 경쇄 변이체를 짝지음으로써 생성된 다수의 인간화된 항체, 및 상응하는 키메릭 항체를 실시예 22에 기술된 방법을 사용한 유세포분석에 의해 CHO-CD52 세포의 표면 상에 발현된 CD52에 결합하는 그들의 능력에 대해 분석하였다. 결합 데이터는 중쇄 변이체를 경쇄 변이체 2C3-VK1 또는 2C3-VK11과 짝지음으로써 생성된 클론이 감소된 결합능을 가지는 반면에 중쇄 변이체를 2C3-VK12 또는 2C3-VK13과 짝지음으로써 생성된 클론은 키메릭 2C3 항체와 동등하거나 그 보다 우수한 결합을 나타내었음을 시사한다. 선택된 클론의 대표적인 히스토그램(도 27a)은 키메릭 및 인간화된 2C3 항체에 의해서 검출된 CD52의 레벨을 비교한다. 2C3-SFD1/K1의 결합은 상응하는 키메릭 항체의 결합에 비해서 상당히 감소한다. 경쇄 내의 위치 46(류신을 아르기닌으로)에 단일 마우스 잔기를 혼입시키는 것(2C3-VK11을 제공함)은 중쇄 2C3-SFD1과 짝지어서 항체 2C3-SFD1/K11을 제조한 경우에 결합을 회복하지 못하였다. 또한, 결합은 중쇄 내에 3 개의 역돌연변이를 혼입시켜 (2C3-VH17을 제공함) 항체 2C3-H17/K11을 제조함으로써는 회복되지 않았다. 그러나, 결합은 2C3-SFD1 중쇄를 2 개의 역돌연변이를 갖는 2C3-VK12와 짝지어서 항체 2C3-SFD1/K12를 제조한 경우에는 완전하게 회복되었으며, 이것은 결합 화합성(avidity)을 회복시키기 위해서 특정한 역돌연변이가 혼입되는 것이 필요함을 시사한다. 도 27b는 키메릭 2C3 항체와 동등한 결합을 나타내는 선택된 인간화된 클론의 히스토그램을 나타낸다. 이들 결과는 2C3-VK12 경쇄에서 2 개의 아미노산 잔기의 역돌연변이가 항체 화합성을 완전히 회복시키는데 충분하였음을 나타낸다. 잔기 36 (Y에서 L로) 및 46(L에서 R로)에서의 변화는 거의 모든 중쇄 변이체와 짝짓는 경우에 결합을 회복할 수 있었다. 그 자체로서, 원래의 마우스 항체로부터 유도된 최소의 골격구조 잔기를 가지고 회복된 결합을 나타내는 인간화된 2C3 클론은 2C3-SFD1/K12이다.
실시예
25: 항-
CD52
항체 클론 12
G6
의 인간화
항-인간 CD52 항체 클론 12G6의 인간화는 클론 4B10 항체 인간화에 대한 실시예 14에 기술된 바와 같이, 마우스 12G6 항체의 CDR 부위를 인간 항체 가변 부위 골격부위 내로 그래프트함으로써 수행되었다. 12G6의 중쇄 및 경쇄의 CDR-1, CDR-2 및 CDR-3 서열을 각각 VH3-72 및 VK2 A18b 인간 골격구조 부위로 그래프트하였다. 인간 JH6 (WGQGTTVTVSS: SEQ ID NO: 133) 및 JK2 (FGQGTKLEIK: SEQ ID NO: 134) 서열을 각각 인간화된 중쇄 및 경쇄를 위한 C-말단 펩타이드로 선택하여 12G6에 대한 인간화된 중쇄 (12G6-SFD1) 및 경쇄 (12G6-VK1) 가변 부위 서열을 생성시켰다(도 28a 및 28b). 12G6-SFD1 중쇄 가변 부위와 12G6-VK1 경쇄 가변 부위를 인간화된 12G6-SFD1/K1 항체에서 조합하는 경우에, CD52에 대한 결합 친화성은 크게 감소되었다. 결합 친화성은 CDR 그래프트된 구조에 역돌연변이를 도입시킴으로써 회복되었다. 단일 또는 다수의 역돌연변이가 인간화된 중쇄 및 경쇄 가변 부위 서열 둘 다에 혼입되었다. 이들 역돌연변이의 위치(카바트 넘버링 시스템에 의해서 표시됨)는 이하의 표 12 및 표 13에 나타낸다. 이들 역돌연변이에 의해서 생성된 항체는 회복된 결합 친화성에 대해서 평가하였다. 4 개의 경쇄 변이체 (12G6-VK10으로도 불리는 12G6-VK1(Y36V); 12G6-VK11로도 불리는12G6-VK1(Y36V-Q45K-L46R);12G6-VK12로도 불리는 12G6-VK1(Y36V-L46R); 및 12G6-VK13으로도 불리는 12G6-VK1(L46R)) 및 3 개의 중쇄 변이체 (12G6-VH10으로도 불리는 12G6-SFD1(L78V); 12G6-VH11로도 불리는 12G6-SFD1(G49A); 및 12G6-VH12로도 불리는 12G6-SFD1(G49A-L78V))를 표준 분자생물학 기술을 사용하여 생성시켰다. CDR 그래프트된 중쇄 가변 부위 서열 12G6-SFD1 및 역돌연변이체 12G6-VH10, 12G6-VH11, 및 12G6-VH12에 대한 아미노산 서열은 도 28a에 나타내며, 여기에서 역돌연변이된 아미노산은 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 마찬가지로, 경쇄 서열에 대해서 CDR 그래프트된 가변 부위 서열 12G6-VK1 및 역돌연변이체 12G6-VK10, 12G6-VK11, 12G6-VK12, 및 12G6-VK13은 도 28B에 나타내며, 여기에서 역돌연변이된 아미노산은 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
12G6-SFD1 (SEQ ID NO: 279)의 전체-길이 중쇄 아미노산 서열 및 12G6-K12 (SEQ ID NO: 280)의 전체-길이 경쇄 아미노산 서열은 도 109에 나타낸다.
표 12:
표 13:
실시예
26:
키메릭
및 인간화된 12
G6
모노클로날
항체의 결합 활성의 평가
키메릭 및 인간화된 12G6 항체는 실시예 3에 기술된 방법을 사용하여 생성시키고 정제하였다. 중쇄 변이체와 경쇄 변이체를 짝지음으로써 생성된 다수의 인간화된 항체, 및 상응하는 키메릭 항체를 실시예 22에 기술된 방법을 사용한 유세포분석에 의해 CHO-CD52 세포의 표면 상에 발현된 CD52에 결합하는 그들의 능력에 대해 분석하였다. 결합 데이터는 중쇄 변이체를 경쇄 변이체 12G6-VK1, 12G6-VK10, 또는 12G6-VK13과 짝지음으로써 생성된 클론이 감소된 결합능을 가지는 반면에 중쇄 변이체를12G6-VK11 또는 12G6-VK12와 짝지음으로써 생성된 클론은 상응하는 키메릭 12G6 항체와 동등하거나 그 보다 우수한 결합을 나타내었음을 시사한다. 선택된 클론의 대표적인 히스토그램(도 29)은 키메릭 및 인간화된 12G6 항체에 의해서 검출된 CD52의 레벨을 비교한다. 이들 결과는 12G6 경쇄 가변 부위 (클론 12G6-VK12)에서 2 개의 아미노산 잔기의 역돌연변이가 항체 특이성을 완전히 회복시키는데 충분하였음을 나타낸다. 카바트 넘버링 잔기 36 (Y에서 L로) 및 46(L에서 R로)에서의 변화는 거의 모든 중쇄 변이체와 짝짓는 경우에 결합을 회복할 수 있었다. 그 자체로서, 원래의 마우스 항체로부터 유도된 최소의 골격구조 잔기를 가지고 회복된 결합을 나타내는 인간화된 12G6 클론은 12G6-SFD1/K12이다.
실시예
27: 항-
CD52
항체 클론 9
D9
의 인간화
항-인간 CD52 항체 클론 9D9의 인간화는 클론 4B10 항체 인간화에 대한 실시예 14에 기술된 바와 같이, 마우스 9D9 항체의 CDR 부위를 인간 항체 가변 부위 골격부위 내로 그래프트함으로써 수행되었다. 9D9의 중쇄 및 경쇄의 CDR-1, CDR-2 및 CDR-3 서열을 각각 VH3-23 및 VK2 A18b 인간 골격구조 부위로 그래프트하였다. 인간 JH6 (WGQGTTVTVSS: SEQ ID NO: 133) 및 JK2 (FGQGTKLEIK: SEQ ID NO: 134) 서열을 각각 인간화된 중쇄 및 경쇄를 위한 C-말단 펩타이드로 선택하여 인간화된 중쇄 (9D9-VH10) 및 경쇄 (9D9-VK2) 가변 부위 서열을 생성시켰다(도 30a 및 30b). 9D9-VH10 중쇄와 9D9-VK2 경쇄를 인간화된 9D9-H10/K2 항체에서 조합하는 경우에, CD52에 대한 결합 친화성은 크게 감소되었다. 결합 친화성은 CDR 그래프트된 구조에 역돌연변이를 도입시킴으로써 회복되었다. 단일 또는 다수의 역돌연변이가 인간화된 중쇄 및 경쇄 가변 부위 서열 둘 다에 혼입되었다. 역돌연변이의 위치(카바트 넘버링 시스템에 의해서 표시됨)는 이하의 표 14 및 표 15에 나타낸다. 이들 역돌연변이에 의해서 생성된 항체는 회복된 결합 친화성에 대해서 평가하였다. 4 개의 경쇄 변이체 (9D9-VK12로도 불리는 9D9-VK2(Y36L-Q45K-L46R); 9D9-VK13으로도 불리는 9D9-VK2(Y36L-L46R); 9D9-VK14로도 불리는 9D9-VK2(L46R); 및 9D9-VK15로도 불리는 9D9-VK2(Q45K-L46R)) 및 5 개의 중쇄 변이체 (9D9-VH11로도 불리는 9D9-VH10(W47L-V48T-S49A-N76S-L78V); 9D9-VH15로도 불리는 9D9-VH10(W47L-V48T-S49A); 9D9-VH16으로도 불리는 9D9-VH10(W47L); 9D9-VH17로도 불리는 9D9-VH10(W47L-V48T); 및 9D9-VH18로도 불리는 9D9-VH10(W47L-S49A))를 표준 분자생물학 기술을 사용하여 생성시켰다. CDR 그래프트된 중쇄 가변 부위 서열 9D9-VH10 및 역돌연변이체 9D9-VH11, 9D9-VH15, 9D9-VH16, 9D9-VH17, 및 9D9-VH18에 대한 아미노산 서열은 도 30a에 나타내며, 여기에서 역돌연변이된 아미노산은 밑줄을 긋고, CDRs는 볼드체로 나타낸다. 마찬가지로, 경쇄 서열에 대해서 CDR 그래프트된 가변 부위 서열 9D9-VK2 및 역돌연변이체 9D9-VK12, 9D9-VK13, 9D9-VK14, 및 9D9-VK15는 도 30B에 나타내며, 여기에서 역돌연변이된 아미노산은 밑줄을 긋고, CDRs는 볼드체로 나타낸다.
9D9-H16 (SEQ ID NO: 276) 및 9D9-H18(SEQ ID NO: 277)의 전체-길이 중쇄 아미노산 서열 및 9D9-K13(SEQ ID NO: 278)의 전체-길이 경쇄 아미노산 서열은 도 108에 나타낸다.
표 14:
표 15:
실시예
28:
키메릭
및 인간화된 9
D9
모노클로날
항체의 결합 활성의 평가
키메릭 및 인간화된 9D9 항체는 실시예 3에 기술된 방법을 사용하여 생성시키고 정제하였다. 중쇄 변이체와 경쇄 변이체를 짝지음으로써 생성된 다수의 인간화된 항체, 및 상응하는 키메릭 항체를 실시예 22에 기술된 방법을 사용한 유세포분석에 의해 CHO-CD52 세포(인간 CD52를 발현하도록 조작된 CHO 세포)의 표면 상에 발현된 CD52에 결합하는 그들의 능력에 대해 분석하였다. 결합 데이터는 중쇄 변이체를 경쇄 변이체 9D9-VK2, 9D9-VK14, 또는 9D9-VK15와 짝지음으로써 생성된 클론이 감소된 결합능을 가지는 반면에 9D9-VK12 또는 9D9-VK13 경쇄 변이체를 역돌연변이된 중쇄 변이체 9D9-VH11, 9D9-VH15, 9D9-VH16, 및 9D9-VH18과 짝지음으로써 생성된 클론은 상응하는 키메릭 9D9 항체와 동등하거나 그 보다 우수한 결합을 나타내었음을 시사한다. 경쇄 변이체 9D9-VK12 및 9D9-VK13을 모 CDR 그래프트된 중쇄 9D9-VH10 또는 역돌연변이된 9D9-VH17 서열과 짝지으면, 결합은 상당히 감소하였으며, 이것은 인간화된 9D9 클론의 경우에 중쇄 및 경쇄 서열이 둘 다 결합능을 회복시키기 위해서 역돌연변이에 의해 조작되어야 함을 시사한다. 선택된 클론의 대표적인 히스토그램(도 31)은 키메릭 및 인간화된 9D9 항체에 의해서 검출된 CD52의 레벨을 비교한다. 이들 결과는 9D9 경쇄 가변 부위(클론 9D9-VK13)에서 2 개의 아미노산 잔기의 역돌연변이 (예를 들어, 위치 36에서 Y를 L로, 및 위치 46에서 L을 R로)가 하나의 위치 (예를 들어, 위치 47에서 W를 L로) 또는 2 개의 위치(예를 들어, 위치 47에서 W를 L로 및 위치 49에서 S를 A로)에서 돌연변이된 중쇄와 짝짓는 경우에 항체 특이성을 회복시키기 위해서 필요하였음을 나타낸다. 그 자체로서, 원래의 마우스 항체로부터 유도된 최소의 골격구조 잔기를 가지고 회복된 결합을 나타내는 인간화된 9D9 클론은 9D9-H16/K13 및 9D9-H18/K13이다.
실시예
29: 인간화된 항-인간
CD52
항체의 상대적 결합 효율의 측정
키메릭 및 인간화된 항-CD52 항체의 EC50 값은 상업적 공급원(Bioreclamation, NY, USA)으로부터 획득한 건강한 공여체 PBMCs로부터 분리된 CD4+ T 세포를 사용하여 평가하였다. CD4+ T 세포는 이지셉 키트(EasySep kit) (Stem Cell Technologies)를 사용한 음성 선택 (negative selection)에 의해서 분리되었다. huCD52 유전자이식 CD1 마우스 비장 세포(Stem Cell Technologies) 로부터 분리된 CD4+ T 세포를 또한 CHO-CD52 세포에 대해 상기 실시예 20에 기술된 방법에 따라 사용하였다. 간략하면, 인간 CD4+ T 세포를 건강한 지원자로부터의 50 ml의 말초혈액(Bioreclamation)으로부터 분리하고, huCD52 유전자이식 마우스 CD4+ T 세포는 비장 조직으로부터 분리하였다. 세포를 PBS/5% FBS로 세정하고, 둥근-바닥 96 웰 플레이트 내에 웰당 1 x 105 세포로 침착시켰다. 일차 항체 염색은 100 ㎍/mL로 시작하는 각각의 항-CD52 키메릭 및 인간화된 항체의 8 점 계열 희석액(1:3)을 사용하여 수행하였다. 10 ㎍/mL의 항-인간 Fc 감마의 FITC-컨주게이트된 염소 F(ab')2 단편 (Jackson 109-096-098) 이차 항체로 사용되었다. 세포는 각각의 배양 전 및 후에 빙냉 PBS/5% FBS 중에서 3 회 세척하였다. 세포를 2% 무-메탄올 파라포름알데히드를 함유하는 PBS로 고정시키고, 유세포분석에 의해서 평가하였다. 유세포분석 데이터를 그래프패드 프리즘 소프트웨어를 사용해서 분석하여 95% 신뢰구간으로 EC50 값을 측정하였다. 인간 PBMCs로부터 분리된 CD4+ T 세포에 대한, 그리고, 인간 CD52 유전자이식 마우스의 비장 조직으로부터 분리된 CD4+ T 세포에 대한 항-CD52 항체의 결합을 기초로 하여 결합곡선 (도 32a, 32b, 32c)을 생성시키고, EC50 값을 평가하여 도 33에 나타내었다. 모든 항체는 인간 CD4+ T 세포에 대해서 및 인간 CD52 유전자이식 마우스로부터 분리된 CD4+ T 세포에 대해서 모두 유사한 결합 특징을 나타내었다. 결합 데이터는 인간화된 항체가 그들의 모 키메릭 항체에 비해서 동등하거나 더 우수한 결합 친화성을 가짐을 나타내며, 이것은 결합 친화성이 인간화에 의해서 유지되거나 개선됨을 시사한다. 인간화된 2C3 및 12G6 항체는 이 세포 결합시험에 의해서 측정된 것으로서 캠퍼스-1H 항체보다 적어도 2 배 더 작은 EC50 값을 갖는다.
실시예 30: 규정된 림프구 집단에 대한 인간화된 항- CD52 항체의 결합의 평가
캠퍼스-1H (C1H) 및 인간화된 2C3 (2C3-SFD1/K12), 9D9 (9D9-H16/ K13 및 9D9-H18/K13), 및 12G6 (12G6-SFD1/K11, 12G6-SFD1/K12) 항체를 키메릭 항-CD52 항체에 대해 상기 실시예 7에 기술된 방법을 사용하여, 정상 공여체 PBMCs 내의 다양한 PBMC 서브세트에 대한 그들의 결합에 대해서 평가하였다. 다수의 형광색소 컨주게이트된 항체가 유세포분석을 위해서 사용되었다. 항-CD27-PE, 항-CD19 및 항-CD11c-PE Cy5, 항-CD56 및 항-CD123-PE Cy7, 항-CD16-APC Cy7, 및 CD4-APC는 BD Biosciences (San Diego, CA)로부터 수득하는 한편, 항-CD54RA-ECD 및 항-HLA-DR-ECD는 Beckman Coulter로부터 수득하였다. 항-CD3-퍼시픽 블루, 항-CD8 및 항-CD14-퍼시픽 오렌지, 및 항-CD4-APC cy5.5는 Invitrogen (CA)으로부터 수득하였다. 모든 인간화된 항-인간 CD52 항체(9D9-H18/K13, 9D9-H16/K13, 12G6-SFD1/K11, 12G6-SFD1/K12, 및 2C3-SFD1/K12) 뿐만 아니라 캠퍼스-1H를 FITC에 컨주게이트시켰다. 건강한 인간 말초혈액 단핵세포는 상기 실시예 7에 기술된 바와 같이 냉동보존된 연막으로부터, 또는 상업적 판매자 (Bioreclamation, NY, USA)로부터 수득한 정상 공여체의 혈액으로부터 분리된 단핵세포로부터 수득되었다. 단핵세포의 강화를 위해서, 인간 말초혈액을 멸균 포스페이트 완충된 식염수 (PBS)로 1:1 희석하고, 피콜-하이파크 (GE Healthcare Bio-Sciences, Uppsala, Sweden) 상에 조심스럽게 적층시키고, 실온에서 30 분 동안 원심분리시켰다. 단핵세포의 상간층을 뽑아내고, 5% 태자소혈청을 함유하는 PBS(FACS 완충액)로 세척하였다. 오염 적혈구 (RBCs)를 RBC 용해용액 (Sigma, St. Louis, MO, USA)으로 용해시켰다. 세포를 냉 FACS 완충액에 재현탁시키고, 파편은 40 미크론 필터를 사용하여 제거하였다. 다색 유세포분석을 수행하여 캠퍼스-1H와 비교하여 인간화된 항-인간 CD52 항체 2C3 (2C3-SFD1/K12), 9D9 (9D9-H16/K13 및 9D9-H18/K13) 및 12G6(12G6-SFD1/K11 및 12G6-SFD1/K12)의 결합능을 평가하였다.
간략하면, FACS 완충액 중의 1 x 106 PBMCs의 리플리케이트를 항체의 전-적정된 희석액의 칵테일과 함께 배양하여 림프구 또는 골수양 유도된 세포를 검사하였다. 림프구 칵테일은 CD3, CD27, CD45RA, CD56, CD19, CD8, CD4, 및 CD16에 대한 항체를 포함하였다. 골수양 집단을 규정하는 항체 칵테일은 HLA-DR, CD11c, CD123, CD4, 및 CD14에 대한 항체를 포함하였다. 각각의 칵테일에서, 항-CD52 항체 중의 하나는 10 ㎍/ml 농도로 포함되었다. 세포를 4℃에서 30 분 동안 염색하고, 1% 파라포름알데히드를 함유하는 PBS 중에 고정시켰다. 염색된 세포의 100,000 이벤트를 BD LSR-II 유세포분석기 (BD Biosciences, San Jose, CA) 상에서 획득하고, 데이터는 플로우조 버전 7.2 소프트웨어(Tree Star, Inc, Oregan, USA)를 사용하여 분석하였다. 별개의 표현형적 특징을 갖는 다수의 서브세트를 B 및 T 림프구 중에서 규정하였으며, CD52는 모든 인간 림프구 상에서 발현되는 것으로 나타났다. 다색 유세포분석을 수행하여 림프구 서브세트를 확인하고, 규정된 서브세트 상의 세포 표면 CD52에 대한 인간화된 항-CD52 항체의 결합 특징의 유사성 및 차이를 평가하였다. 마커의 조합을 사용하여 B, T, NK 및 항원 제시 세포계에 상응하는 표현형적으로 상이한 세포 집단을 일차로 규정하였다. 각각의 규정된 세포 집단 상의 CD52 발현을 검출하는 인간화된 항-CD52 항체의 능력에 상응하는 염색의 강도를 평가하고, 캠퍼스-1H의 경우와 비교하였다. 히스토그램(도 34)은 개개 집단 상에서 각각의 항체에 의해 검출된 CD52의 레벨을 비교한다. 결과는 인간화된 항-CD52 항체 모두가 유사한 정도로 세포 표면 CD52에 결합함을 나타낸다. 또한, 세포 표면 CD52의 검출 레벨에 관해서는 캠퍼스-1H와 인간화된 항-CD52 항체 사이에서 차이가 관찰되지 않았다. 분석은 6 개의 상이한 공여체에 대해 수행되었다. 하나의 공여체로부터 유도된 세포를 사용하여 생성된 대표적 데이터는 도 34에 나타낸다. 유사한 결합 패턴이 다른 공여체들로부터 유도된 세포에 의해서 관찰되었다.
실시예
31:
키메릭
및 인간화된 7F11
모노클로날
항체의
ADCC
활성의 평가
인간화 및 키메릭 7F11 항체는 CD52 발현 세포의 ADCC 사멸을 매개하는 그들의 능력에 대해서 평가하였다. ADCC 시험은 상기 실시예 6에 기술된 방법을 사용하여 수행되었다. 간략하면, CD52 단백질을 발현하도록 조작된 CHO K1 세포 (CHO-CD52)가 표적세포로 사용되었다. 표적세포는 37 ℃에서 2-3 시간 동안 Na2 51CrO4 (New England Nuclear, Boston, MA)로 표지하였다. 세포를 세척하고, 10% FCS를 함유하는 RPMI 1640 배지 중에 재현탁시키고, 5 ㎍/ml 내지 0.01 ㎍/ml 범위의 다양한 농도의 IgG 대조 항체, 키메릭 7F11 항체, 또는 인간화된 7F11 항체(7F11-SFD1/K2 또는 7F11-SFD2/K2)와 혼합시켰다. NK 세포 분리 키트(Stem Cell Technologies)를 사용하여 PBMCs로부터 분리된 인간 NK 세포를 효과기 세포로 사용하였으며, 1:5 표적-대-효과기 세포 비로 첨가하였다. 2-6 시간 배양한 후에 25 ㎕의 무-세포 상등액을 각각의 웰로부터 수집하고, 마이크로베타 트리룩스 섬광계수기(Wallac, Gaithersburg, MD)에서 계수하였다. 자발적으로 방출된 51Cr의 양은 표적세포를 단독으로 배지 중에서 배양함으로써 수득되었다. 표적세포로부터의 자발적 방출은 전형적으로 20% 미만이었다. 혼입된 51Cr의 총량은 증류수 내의 1% 트리톤 X-100을 첨가함으로써 측정되었으며, 용해 백분율은 다음과 같이 계산하였다: [(샘플 c.p.m. - 자발적 c.p.m.)/(총 c.p.m. - 자발적 c.p.m.)] X 100. 도 35는 시험에서 사용된 대조 IgG, 키메릭 7F11 항체, 및 인간화된 7F11 항체의 농도 (X 축) 대 특이적 용해 % (Y 축)를 예시한다. 결과는 인간화된 7F11 항체(7F11-SFD1/K2 및 7F11-SFD2/K2)가 키메릭 7F11 항체와 비교하여 동등하거나 약간 더 나은 ADCC 사멸을 매개함을 나타낸다. 대조 IgG1 이소타입은 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예
32:
키메릭
및 인간화된 7F11
모노클로날
항체의
CDC
활성의 평가
인간화 및 키메릭 7F11 항체를 CD52 발현 세포의 보체 의존성 세포독성(CDC)을 매개하는 그들의 능력에 대해서 평가하였다. CDC 시험은 키메릭 항-CD52 항체에 대하여 상기 실시예 5에 기술된 방법을 사용하여 수행되었다. 간략하면, CD52 단백질을 발현하도록 조작된 CHO K1 세포(CHO-CD52)를 표적세포로 사용하였으며, 37℃에서 2-3 시간 동안 Na2 51CrO4 (New England Nuclear, Boston, MA)로 표지하였다. 세포를 세척하고, RPMI 1640 배지 내에 재현탁시키고, 20 ㎍/ml 내지 500 ng/ml 범위의 다양한 농도의 IgG 대조 항체, 키메릭 7F11 항체, 또는 인간화된 7F11 항체(7F11-SFD1/K2 또는 7F11-SFD2/K2)와 혼합시켰다. 인간 보체(Sigma)를 10%의 최종 농도로 실험 웰에 첨가하였다. 1-5-시간 배양한 후에 25 ㎕의 무-세포 상등액을 각각의 웰로부터 수집하고, 마이크로베타 트리룩스 섬광계수기(Wallac, Gaithersburg, MD)에서 계수하였다. 자발적으로 방출된 51Cr의 양은 표적세포를 단독으로 배지 중에서 배양함으로써 수득되었다. 표적세포로부터의 자발적 방출은 전형적으로 20% 미만이었다. 혼입된 51Cr의 총량은 증류수 내의 1% 트리톤 X-100을 첨가함으로써 측정되었으며, 용해 백분율은 다음과 같이 계산하였다: [(샘플 c.p.m. (counts per minute) - 자발적 c.p.m.)/(총 c.p.m. - 자발적 c.p.m.)] X 100. 도 36은 시험에서 사용된 대조 IgG, 키메릭 7F11 항체, 및 인간화된 7F11 항체(7F11-SFD1/K2 및 7F11-SFD2/K2)의 농도 (X 축) 대 특이적 용해 % (Y 축)를 예시한다. 결과는, 키메릭 7F11 항체 및 인간화된 항체 7F11-SFD1/K2가 동등한 사멸을 매개하는 반면에 인간화된 항체 7F11-SFD2/K2는 키메릭 7F11 항체보다 상당히 더 나은 CDC 사멸을 매개하였음을 나타낸다. 대조 IgG1 이소타입 항체는 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예
33:
키메릭
및 인간화된 2
C3
모노클로날
항체의
ADCC
활성의 평가
인간화 및 키메릭 2C3 항체는 CD52 발현 세포의 ADCC 사멸을 매개하는 그들의 능력에 대해서 평가하였다. ADCC 시험은 상기 실시예 6에 기술된 방법을 약간 변형시켜 사용하여 수행되었다. 간략하면, CD4+ T 세포 분리 키트(Stem Cell Technologies)를 사용하여 건강한 공여체 PBMCs로부터 분리된 T 세포가 표적세포로 사용되었다. 표적세포는 37 ℃에서 Na2 51CrO4(New England Nuclear, Boston, MA)로 밤새 표지하였다. 세포를 세척하고, 10% FCS를 함유하는 RPMI 1640 배지 중에 재현탁시키고, 10 ㎍/ml 내지 100 pg/ml 범위의 다양한 농도의 IgG 대조 항체, 키메릭 2C3 항체, 또는 인간화된 2C3 항체(2C3-SFD1/K12)와 혼합시켰다. PBMCs로부터 분리된 인간 NK 세포(Stem Cell Technologies의 NK 세포 분리 키트를 사용)를 효과기 세포로 사용하였으며, 1:5 표적-대-효과기 세포 비로 첨가하였다. 2-6 시간 배양한 후에 25 ㎕의 무-세포 상등액을 각각의 웰로부터 수집하고, 마이크로베타 트리룩스 섬광계수기(Wallac, Gaithersburg, MD)에서 계수하였다. 자발적으로 방출된 51Cr의 양은 표적세포를 단독으로 배지 중에서 배양함으로써 수득되었다. 표적세포로부터의 자발적 방출은 전형적으로 20% 미만이었다. 혼입된 51Cr의 총량은 증류수 내의 1% 트리톤 X-100을 첨가함으로써 측정되었으며, 용해 백분율은 다음과 같이 계산하였다: [(샘플 c.p.m. - 자발적 c.p.m.)/(총 c.p.m. - 자발적 c.p.m.)] X 100. 도 37은 시험에서 사용된 대조 IgG, 키메릭 2C3 항체, 및 인간화된 2C3 항체 (2C3-SFD1/K12)의 농도 (X 축) 대 특이적 용해 %(Y 축)를 예시한다. 결과는 인간화된 2C3 항체 2C3-SFD1/K12가 2C3 키메릭 항체와 동등한 ADCC 사멸을 매개함을 나타낸다. IgG1 이소타입 대조군은 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예
34:
키메릭
및 인간화된 2
C3
모노클로날
항체의
CDC
활성의 평가
인간화 및 키메릭 2C3 항체를 CD52 발현 세포의 보체 의존성 세포독성(CDC)을 매개하는 그들의 능력에 대해서 평가하였다. CDC 시험은 상기 실시예 5에 기술된 방법을 약간 변형시켜 사용하여 수행되었다. 간략하면, 건강한 공여체 PBMCs로부터 분리된 T 세포를 표적세포로 사용하였으며, 37℃에서 Na2 51CrO4(New England Nuclear, Boston, MA)로 밤새 표지하였다. 밤새 표지한 후에 세포를 세척하고, 10% FCS를 함유하는 RPMI 1640 배지 내에 재현탁시키고, 10 ㎍/ml 내지 10 ng/ml 범위의 다양한 농도의 IgG 대조 항체, 키메릭 2C3 항체, 또는 인간화된 2C3 항체(2C3-SFD1/K12)와 혼합시켰다. 인간 보체(Sigma)를 10%의 최종 농도로 실험 웰에 첨가하였다. 1-5-시간 배양한 후에 25 ㎕의 무-세포 상등액을 각각의 웰로부터 수집하고, 마이크로베타 트리룩스 섬광계수기(Wallac, Gaithersburg, MD)에서 계수하였다. 자발적으로 방출된 51Cr의 양은 표적세포를 단독으로 배지 중에서 배양함으로써 수득되었다. 표적세포로부터의 자발적 방출은 전형적으로 20% 미만이었다. 혼입된 51Cr의 총량은 증류수 내의 1% 트리톤 X-100을 첨가함으로써 측정되었으며, 용해 백분율은 다음과 같이 계산하였다: [(샘플 c.p.m. (counts per minute) - 자발적 c.p.m.)/(총 c.p.m. - 자발적 c.p.m.)] X 100. 도 38은 시험에서 사용된 대조 IgG, 키메릭 2C3 항체, 및 인간화된 2C3 항체(2C3-SFD1/K12)의 농도 (X 축) 대 특이적 용해 %(Y 축)를 예시한다. 결과는, 키메릭 2C3 항체 및 인간화된 2C3 항체(2C3-SFD1/K12)가 동등한 용해를 매개하였음을 나타낸다. 대조 IgG1 이소타입 항체는 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예
35:
키메릭
및 인간화된 12
G6
모노클로날
항체의
ADCC
활성의 평가
인간화 및 키메릭 12G6 항체는 CD52 발현 세포의 ADCC 사멸을 매개하는 그들의 능력에 대해서 평가하였다. ADCC 시험은 상기 실시예 31에 기술된 바와 같이 표적세포로서 건강한 공여체 PBMCs로부터 분리된 T 세포를 사용하는 크롬 방출시험에 의해서 수행되었다. 도 39는 시험에서 사용된 대조 IgG, 키메릭 12G6 항체, 및 인간화된 12G6 항체(12G6-SFD1/K11 또는 12G6-SFD1/K12)의 농도 (X 축) 대 특이적 용해 %(Y 축)를 예시한다. 결과는 인간화된 12G6 항체 12G6-SFD1/K11 및 12G6-SFD1/K12가 12G6 키메릭 항체와 비교하여 동등한 ADCC 사멸을 매개하였음을 나타낸다. IgG1 이소타입 대조군은 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예
36:
키메릭
및 인간화된 12
G6
모노클로날
항체의
CDC
활성의 평가
인간화 및 키메릭 12G6 항체는 CD52 발현 세포의 보체 의존성 세포독성 (CDC)을 매개하는 그들의 능력에 대해서 평가하였다. CDC 시험은 상기 실시예 32에 기술된 바와 같이 표적세포로서 건강한 공여체 PBMCs로부터 분리된 T 세포를 사용하는 크롬 방출시험에 의해서 수행되었다. 도 40은 시험에서 사용된 대조 IgG, 키메릭 12G6 항체, 및 인간화된 12G6 항체(12G6-SFD1/K11 및 12G6-SFD1/K12)의 농도 (X 축) 대 특이적 용해 %(Y 축)를 예시한다. 결과는 키메릭 12G6 항체가 인간화된 12G6 항체 (12G6-SFD1/K11 및 12G6-SFD1/K12)와 비교하여 동등한 용해를 매개하였음을 나타낸다. 대조 IgG1 이소타입 항체는 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예
37:
키메릭
및 인간화된 9
D9
모노클로날
항체의
ADCC
활성의 평가
인간화 및 키메릭 9D9 항체는 CD52 발현 세포의 ADCC 사멸을 매개하는 그들의 능력에 대해서 평가하였다. ADCC 시험은 상기 실시예 31에 기술된 바와 같이 표적세포로서 건강한 공여체 PBMCs로부터 분리된 T 세포를 사용하는 크롬 방출시험에 의해서 수행되었다. 도 41은 시험에서 사용된 대조 IgG, 키메릭 9D9 항체, 및 인간화된 9D9 항체(9D9-H10/K13, 9D9-H11/K13, 9D9-H16/K13, 및 9D9-H18/K13)의 농도 (X 축) 대 특이적 용해 % (Y 축)를 예시한다. 결과는 키메릭 및 인간화된 9D9 항체 (9D9-H10/K13는 제외)가 동등한 ADCC 사멸을 매개하였음을 나타낸다. IgG1 이소타입 대조군은 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예
38:
키메릭
및 인간화된 9
D9
모노클로날
항체의
CDC
활성의 평가
인간화 및 키메릭 9D9 항체는 CD52 발현 세포의 보체 의존성 세포독성(CDC)을 매개하는 그들의 능력에 대해서 평가하였다. CDC 시험은 상기 실시예 32에 기술된 바와 같이 표적세포로서 건강한 공여체 PBMCs로부터 분리된 T 세포를 사용하는 크롬 방출시험에 의해서 수행되었다. 도 42는 시험에서 사용된 대조 IgG, 키메릭 9D9 항체, 및 인간화된 9D9 항체 (9D9-H10/K13, 9D9-H11/K13, 9D9-H16/K13, 및 9D9-H18/K13)의 농도(X 축) 대 특이적 용해 % (Y 축)를 예시한다. 결과는 키메릭 9D9 항체가 인간화된 9D9 항체 (9D9-H10/K13은 제외)와 비교하여 동등한 용해를 매개하였음을 나타낸다. 대조 IgG1 이소타입 항체는 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예 39: 일차 T 세포에 대한 캠퍼스-1H 및 인간화된 항- CD52 항체의 ADCC 활성의 평가
캠퍼스-1H (Campath-1H®) 및 인간화된 항-CD52 항체는 CD52 발현 세포의 ADCC 사멸을 매개하는 그들의 능력에 대해서 평가하였다. ADCC 시험은 상기 실시예 31에 기술된 바와 같이 표적세포로서 건강한 공여체 PBMCs로부터 분리된 T 세포를 사용하는 크롬 방출시험에 의해서 수행되었다. 도 43은 시험에서 사용된 대조 IgG, 캠퍼스-1H, 및 인간화된 2C3-SFD1/K12, 9D9-H16/K13, 9D9-H18/K13, 12G6-SFD1/K11, 및 12G6-SFD1/K12 항체의 농도 (X 축) 대 특이적 용해 %(Y 축)를 예시한다. 결과는 상기의 인간화된 2C3, 9D9, 및 12G6 항체가 10 ng/ml를 초과하는 농도에서 캠퍼스-1H와 동등한 ADCC 사멸을 매개하였음을 나타낸다. IgG1 이소타입 대조군은 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예 40: 일차 T 세포에 대한 캠퍼스-1H 및 인간화된 항- CD52 항체의 CDC 활성의 평가
캠퍼스-1H (Campath-1H®) 및 인간화된 항-CD52 항체는 CD52 발현 세포의 보체 의존성 세포독성(CDC)을 매개하는 그들의 능력에 대해서 평가하였다. CDC 시험은 상기 실시예 32에 기술된 바와 같이 표적세포로서 건강한 공여체 PBMCs로부터 분리된 T 세포를 사용하는 크롬 방출시험에 의해서 수행되었다. 도 44는 시험에서 사용된 대조 IgG, 캠퍼스-1H, 및 인간화된 2C3-SFD1/K12, 9D9-H16/K13, 9D9-H18/K13, 12G6-SFD1/K11, 및 12G6-SFD1/K12 항체의 농도 (X 축) 대 특이적 용해 %(Y 축)를 예시한다. 결과는 인간화된 2C3 및 12G6 항체가 캠퍼스-1H와 동등한 CDC 사멸을 매개한 반면에 인간화된 9D9 항체는 그들의 상응하는 키메릭 항체와 유사하게 상당히 감소된 CDC 활성을 나타내었음을 나타낸다. IgG1 이소타입 대조군은 시험한 농도에서 단지 낮은 레벨의 배경 사멸을 나타내었다.
실시예 41: 인간화된 2 C3 , 12 G6 , 및 9 D9 항- CD52 항체 활성을 차단하는 항-캠퍼스-1H 중화 항체를 함유하는 혈청 샘플의 중화능의 평가
캠퍼스-1H(Campath-1H®)에 대한 중화 항체의 존재 하에서 CD52 발현 세포에 결합하는 인간화된 항체의 능력을 평가하기 위해서, 항-CD52 항체(캠퍼스-1H, 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12)를 항-캠퍼스-1H 항체 반응성을 함유하는 인간 혈청과 반응시키고, CD52 발현 라지 (Raji) 세포에 대한 결합에 관해서 평가하였다. CAMMS223 시험 [The CAMMS223 Trial Investigators,"Alemtuzumab vs. interferon Beta-1a in early multiple sclerosis," N Engl J Med 359:1786-1801 (2008)]에 등록된 재발 이장성 다발성 경화증 환자로부터 수득된 혈청 샘플이 시험에 사용되었다. 캠퍼스-1H 항체의 반복 투여는 대부분의 환자에게서 항-캠퍼스-1H 항체 반응의 생성을 제공하였다. 항-캠퍼스-1H 항체 역가는 대부분의 환자에게서 12 개월째에 매우 낮으며, 캠퍼스-1H의 두 번째 사이클의 투여에 의해서 상당히 증가하여 13 개월째에 혈청 내에서 높은 역가의 항-캠퍼스-1H 반응을 제공한다. 항-CD52 항체 중화시험은 CAMMS223 프로토콜 하에서 캠퍼스-1H로 치료한 5 명의 상이한 환자 (MS-1 내지 MS-5)로부터 수득한 12 및 13 개월 혈청 샘플을 사용하여 수행되었다. FITC-컨주게이트된 항-CD52 항체 캠퍼스-1H, 2C3-SFD1/K12, 12G6-SFD1/K12, 및 9D9-H16/K13(실시예 30에서 사용되고, CD52 발현 세포에 결합하는 것으로 나타남)을 사용하여 캠퍼스-1H로 치료된 환자로부터 수득한 혈청의 광범한 희석액의 존재 또는 부재 하에서 인간 CD52를 발현하는 라지 세포를 염색하였다. 간략하면, MS 환자 혈청 샘플 (12 개월 및 13 개월)을 6 배 계열 희석액으로 만들고, 10 ㎍/ml의 FITC-컨주게이트된 항-CD52 항체(캠퍼스-1H, 2C3-SFD1/K12, 12G6-SFD1/K12, 및 9D9-H16/K13)와 함께 37 ℃에서 1 시간 동안 배양하였다. 라지 세포를 HBSS, 5% FBS, 및 0.1% 아지드를 함유하는 염색 완충액(staining buffer)으로 세정한 다음에, 둥근-바닥 96 웰 플레이트 내에 웰당 1 x 105 세포로 침착시켰다. 세포를 염색 완충액 중의 얼음 상에서 30 분 동안 10 ㎍/ml의 인간 IgG Fc 단편으로 차단하였다. 그 후, 세포를 염색 완충액으로 세척하고, 상술한 바와 같이 100 ㎕의 항체-혈청 혼합물에 재현탁시켰다. 얼음 상에서 30 분 후에, 세포를 BD 사이토픽스(Cytofix)로 세척하여 고정시키고, FITC-표지된 항체 코팅된 세포를 FACS칼리부 시스템(Becton Dickinson)을 사용하여 분석하고, 그 후에 데이터는 플로우조 버전 7.2 소프트웨어(Tree Star, Inc, Oregon, USA)를 사용하여 분석하였다. 혈청 내의 항-캠퍼스-1H 중화 항체의 존재 하에서 FITC-컨주게이트된 항-CD52 항체의 결합은 유세포분석에 의해서 평가하고, 억제의 척도로서 대조군에 대비한 결합 %는 (혈청에 의한 MFI/MFI 대조군 (혈청 부재)) X 100으로 계산하였다. 공여체 중의 하나(MS-1)로부터의 대표적인 데이터는 도 45에 나타낸다. X 축은 혈청 희석인자를 나타내고, Y 축은 항체 중화활성의 척도로서 대조 결합 %를 나타낸다. 데이터는 12 개월 혈청 샘플이 캠퍼스-1H 또는 다른 항-CD52 항체에 대해 억제효과를 갖지 않음을 명백하게 입증하며, 이것은 혈청 내에 항-캠퍼스-1H 차단 항체가 적거나 없음을 시사한다. 13 개월 혈청 샘플은 혈청의 1:1000 희석액에서 조차도 캠퍼스-1H 결합의 완전한 억제를 매개하였지만, 시험한 최고의 농도(1:24 희석액)에서 조차도 2C3, 12G6, 및 9D9 인간화된 항-CD52 항체의 억제를 매개하지 않았다. 5 명의 환자 중의 2 명은 >1:1000의 항-캠퍼스-1H 중화 항체 역가를 발생시킨 반면에, 다른 3 명의 환자는 약 1:100 캠퍼스-1H 중화 항체 역가를 가졌다. 비록 환자의 13 개월 혈청 중의 2 개는 캠퍼스-1H에 대해서 >1:1000의 비교적 높은 중화 항체 역가를 가졌지만, 이들 혈청은 인간화된 2C3-SFD1/K12, 12G6-SFD1/K12, 및 9D9-H16 /K13 항체의 결합을 억제하지 않았고, 이것은 캠퍼스-1H로 치료된 환자에게서 항-캠퍼스-1H 항체 반응성이 세포 상에 제시된 것으로서 CD52에 대한 이들 인간화된 항체의 결합을 차단하지 않았음을 시사한다.
실시예 42: huCD52 유전자이식 마우스에서 항- CD52 항체의 고갈 및 재증식의 분석 (4B10-H1/K1)
다양한 용량 레벨의 캠퍼스-1H (Campath-1H®) 및 인간화된 항-CD52 항체 (4B10-H1/K1)의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1, 0.5, 1.0 또는 5.0 mg/kg의 각각의 항체를 정맥내로 주사하였다. 투여한지 2 시간 후에, 혈청을 수집하여 순환 사이토킨의 레벨을 검사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스(N=5)로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 마우스의 서브세트(N=5)를 생존상태로 유지시켜 재증식 동력학을 모니터링하였다. 고갈은 T 세포 구획에서 최대였으며, 여기에서는 CD4+ T 세포가 최대로 고갈되고, 이어서 CD8+ T 세포, B 세포, NK 세포, 및 다른 골수양 세포였다. CD4+ T 세포 구획 내에서는, 천연 CD4+ T 세포가 최대로 고갈되었고, 이어서 CD4+ 중앙 기억 (CM), CD4+ 효과기 기억 (EM), 및 CD4+ 조절 T 세포 (Treg)였다. 유사한 패턴은 CD8+ T 세포에 대해서 관찰되었다(천연>CM>EM). 역으로, 성숙한 B 세포는 미성숙 B 세포보다 더 큰 정도까지 고갈되었다. 4B10-H1/K1 처리된 마우스에 대한 캠퍼스-1H 처리된 마우스의 비교는 검사한 각각의 용량에서 혈액 및 비장 둘 다에서 세포의 유사한 패턴을 나타내었다.
혈청 사이토킨 분석은 TNFα, IL-6 및 MCP-1에 대한 용량 의존적 증가를 나타내었다. 이들 사이토킨의 순환 레벨은 0.5 및 0.1 mg/kg 용량에서 마찬가지로 비처리된 마우스에 비해 증가된 채로 유지되었다. 약간의 상승은 또한 3 개의 최고 용량으로 캠퍼스-1H 처리된 그룹에서의 IL-10에 대해서뿐만 아니라 인간화된 4B10-H1/K1 처리된 그룹의 최고 용량에 대해서 관찰되었다. 순환 IL-12 또는 IFNg (나타내지 않음)의 레벨에서는 상당한 증가가 나타나지 않았다.
1.0 mg/kg 그룹을 제외하고는 투여 후 50-60일까지 캠퍼스-1H 투여 그룹 모두에서 림프구 레벨이 비처리 마우스의 레벨로 반등하였다. 1.0 mg/kg 그룹에서 림프구는 투여 후 80일까지 정상 레벨로 복귀하였다. 유사한 재증식 동력학은 또한 인간화된 4B10-H1/K1 항체 처리된 마우스에 대해서 관찰되었다. 림프구는 0.5 mg/kg 레벨을 제외하고는 4B10-H1/K1 처리된 모든 그룹에서 투여 후 50일 까지 대조 레벨로 반등하였다. 0.5 mg/kg 그룹에서 순환 림프구의 레벨은 모니터링 기간 전체에 걸쳐서 감소된 채로 유지되었다. 총 림프구를 혈액 내의 재증식에 대해서 모니터링하였다.
도 46a-46e는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 47a-47e는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 48a-48e는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다. 도 49a-49b는 캠퍼스-1H ("Campath") 및 인간화된 4B10-H1/K1 ("4B10") 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다.
실시예 43: huCD52 유전자이식 마우스에서 항- CD52 항체의 고갈 및 재증식의 분석 (7F11-SFD1/K2 및 7F11-SFD2/K2)
다양한 용량 레벨의 인간화된 항체(7F11-SFD1/K2 및 7F11-SFD2/K2)의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1, 0.5, 1.0 또는 5.0 mg/kg의 각각의 항체를 정맥내로 주사하였다. 투여한지 2 시간 후에, 혈청을 수집하여 순환 사이토킨의 레벨을 검사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스 (N=5)로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 마우스의 서브세트 (N=5)를 생존상태로 유지시켜 재증식 동력학을 모니터링하였다. 모든 용량의 각각의 인간화된 7F11 항체(7F11-SFD1/K2 및 7F11-SFD2/K2)의 투여는 혈액 내의 T 세포 및 B 세포 둘 다의 상당한 수의 고갈을 야기하였다. 이들 데이터는 또한, 다양한 T 및 B 세포 서브세트가 사용된 항체의 용량에 따라 상이한 정도로 고갈됨을 나타내었다. 천연 T 세포 (CD4 및 CD8 둘 다)는 최대 고갈을 나타내었으며, 다른 세포 집단(기억 및 T reg 세포 포함)은 더 적은 정도로 고갈되었다. B 세포 구획에서는 성숙한 B 세포가 미성숙 B 세포보다 더 쉽게 고갈되었다. 비장에서는 용량 의존적 고갈이 관찰되었으며, 림프구의 상당한 고갈은 5 및 1 mg/kg 용량 레벨에서 관찰되었다. 혈액의 경우와 마찬가지로, 천연 T 세포는 기억 세포보다 더 쉽게 고갈되었다. B 세포는 각각의 인간화된 7F11 클론 (7F11-SFD1/K2 및 7F11-SFD2/K2)에 의해서 T 세포보다 더 적은 정도 고갈되었다. 주사한 어떤 용량에서도 혈액 또는 비장 내의 NK 세포 또는 호중구에 대해서는 고갈이 관찰되지 않았다. 혈청 사이토킨 분석은 TNFα 및 IL-6 둘 다에 대해서 용량 의존적 증가를 나타내었다. 이들 사이토킨의 레벨은 0.5 및 0.1 mg/kg 용량에서 마찬가지로 비처리 마우스에 비해 증가된 채로 유지되었다. 순환 MCP-1의 레벨에서의 용량 의존적 증가가 또한 나타났다.
투여 후 30일까지 0.5 및 0.1 mg/kg 투여 그룹에서의 림프구 레벨은 비처리 마우스의 레벨로 반등하였다. 1.0 및 5.0 mg/kg 그룹에서 림프구는 클론 7F11-SFD1/K2의 경우에는 각각 50 및 80일까지, 및 클론 7F11-SFD2/K2의 1.0 및 5.0 mg/kg 그룹 둘 다의 경우에는 투여 후 80일까지 정상 레벨로 복귀하였다. 총 림프구를 혈액 내의 재증식에 대해서 모니터링하였다.
도 50a-50e는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 51a-51e는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 52a-52f는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다. 도 53a-53b는 인간화된 7F11-SFD1/K2 ("7F11 SFD1") 및 7F11-SFD2/K2 ("7F11 SFD2") 항체를 투여한 후 시간 경과에 따른 순환 림프구의 재증식을 나타낸다.
실시예 44: CD52 유전자이식 마우스에서 7F11 인간화된 항- CD52 항체의 분석 (7F11-SFD1/K2 및 7F11-SFD2/K2)
캠퍼스-1H(Campath-1H®)와 비교한 키메릭 7F11 항체 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 1.0 mg/kg의 각각의 항체를 정맥내로 주사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스(N=5)로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 캠퍼스-1H의 투여는 혈액 및 비장 내에서 T 세포 및 B 세포 둘 다의 상당한 수의 고갈을 야기하였다. 비록 T 세포 고갈의 동등한 레벨이 키메릭 및 인간화된 7F11 항체 (7F11-SFD1/K2 및 7F11-SFD2/K2) 둘 다의 경우에 혈액 내에서 관찰되었지만, B 세포는 더 적은 정도로 고갈되었다. 이러한 관찰결과는 또한 비장에서 명백하였으며, 여기에서는 상당한 T 세포 고갈이 나타났지만 7F11 항체(7F11-SFD1/K2 및 7F11-SFD2/K2)에 의해서는 단지 보통 정도의 레벨의 B 세포 고갈이 달성되었다.
도 54a-54b는 캠퍼스-1H® ("Campath"), 7F11-키메릭 항체, 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다.
실시예 45: CD52 유전자이식 마우스에서 항- CD52 항체의 PK 프로필의 분석 (7F11-SFD1/K2 및 7F11-SFD2/K2)
인간화 과정이 항체의 청소율을 변화시키지 않았음을 확실하게 하기 위해서, 키메릭 7F11 항-CD52 항체 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항-CD52 항체의 약력학적 프로필을 huCD52 유전자이식 마우스에서 측정하였다. 마우스에게 5 mg/kg으로 항체를 정맥내로 주사하고, 투여 후 2 시간부터 시작하여 다양한 시점에 혈액을 수집하였다. 각각의 항체의 순환 레벨은 항-인간 IgG ELISA를 사용하여 평가하였다. 각각의 인간화된 클론에 대해서 투여 후 2 시간에 Cmax에는 약간의 차이가 있었다. 키메릭 7F11 항체 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체에 대한 청소율은 실험의 과정에서 서로, 그리고 캠퍼스-1H®과도 유사하였으며, 이것은 인간화 과정은 항체의 약력학적 프로필을 상당히 변화시키지 않았음을 시사한다.
도 55는 투여 후의 시간 경과에 따른 혈액 내의 캠퍼스-1H® ("Campath"), 7F11-키메릭 항체 및 인간화된 7F11-SFD1/K2 및 7F11-SFD2/K2 항체의 레벨을 나타낸다.
실시예 46: huCD52 유전자이식 마우스에서 항- CD52 항체의 고갈 및 재증식의 분석 (2C3-SFD1/K12)
다양한 용량 레벨의 2C3-SFD1/K12 클론의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1, 0.5, 1.0 또는 5.0 mg/kg의 항체를 정맥내로 주사하였다. 투여한지 2 시간 후에, 혈청을 수집하여 순환 사이토킨의 레벨을 잠재적으로 검사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스 (N=5)로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 마우스의 서브세트(N=5)를 생존상태로 유지시켜 재증식 동력학을 모니터링하였다. 5, 1, 및 0.5 mg/kg 용량에서 2C3-SFD1/K12의 투여는 혈액 내의 T 세포 및 B 세포 둘 다의 상당한 수의 고갈을 야기하였다. 림프구 고갈의 가변적 레벨이 0.1 mg/kg 용량으로 혈액 내에서 관찰되었으며, 여기에서는 CD4+ T 세포 및 B 세포가 CD8+ T 세포보다 더 큰 정도로 고갈되었다. 이들 데이터는 또한, 다양한 T 및 B 세포 서브세트가 사용된 항체의 용량에 따라 상이한 정도로 고갈됨을 나타내었다. 천연 T 세포 (CD4 및 CD8 둘 다)는 더 적은 정도로 고갈된 다른 세포 집단 (기억 및 T reg 세포 포함)에 비해서 최대 고갈을 나타내었다. B 세포 구획에서는 성숙한 B 세포가 미성숙 B 세포보다 더 쉽게 고갈되었다. 비장에서는 용량 의존적 고갈이 관찰되었으며, 림프구의 상당한 고갈은 5 및 1 mg/kg 용량 레벨에서 관찰되었다. 캠퍼스-1H® 와 마찬가지로, 천연 T 세포는 기억 세포보다 더 쉽게 고갈되었다. 고갈이 혈액 내의 NK 세포 및 호중구에 대해서 관찰되었지만, 주사한 어떤 용량에서도 비장 내에서는 고갈이 거의 또는 전혀 관찰되지 않았다. 혈청 사이토킨 분석은 TNFα 및 IL-6 둘 다에 대해서 용량 의존적 증가를 나타내었으며, 여기에서는 5 mg/kg 용량이 각각의 사이토킨의 최고 레벨을 유도하였다. 비처리 마우스와 동등한 레벨은 TNFα에 대해서는 0.5 및 0.1 mg/kg 용량 레벨에서, IL-6에 대해서는 0.1 mg/kg 용량 레벨에서 관찰되었다. 순환 MCP-1의 레벨에서의 용량 의존적 증가가 또한 나타났다.
투여 후 30일까지 0.1 및 0.5 mg/kg 투여 그룹에서의 림프구 레벨은 비처리 마우스의 레벨로 반등하였다. 1.0 및 5.0 mg/kg 그룹에서 림프구는 투여 후 80일까지 정상 레벨로 복귀하였다. 총 림프구를 혈액 내의 재증식에 대해서 모니터링하였다.
도 56a-56e는 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220 B 세포의 레벨을 나타낸다. 도 57a-57e는 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 58a-58f는 2C3-SFD1/K12 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다. 도 59는 2C3-SFD1/K12 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다.
실시예 47: huCD52 유전자이식 마우스에서 항- CD52 항체의 고갈 및 재증식의 분석 (12G6-SFD1/K11)
다양한 용량 레벨의 12G6-SFD1/K11 클론의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1, 0.5, 1.0 또는 5.0 mg/kg의 항체를 정맥내로 주사하였다. 투여한지 2 시간 후에, 혈청을 수집하여 순환 사이토킨의 레벨을 잠재적으로 검사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스 (N=5)로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 마우스의 서브세트(N=5)를 생존상태로 유지시켜 재증식 동력학을 모니터링하였다. 5, 1, 및 0.5 mg/kg 용량에서 12G6-SFD1/K11의 투여는 혈액 내의 T 세포 및 B 세포 둘 다의 상당한 수의 고갈을 야기하였다. 림프구 고갈의 가변적 레벨이 0.1 mg/kg 용량으로 혈액 내에서 관찰되었으며, 여기에서는 CD4+ T 세포 및 B 세포가 CD8+ T 세포보다 더 큰 정도로 고갈되었다. 이들 데이터는 또한, 다양한 T 및 B 세포 서브세트가 사용된 항체의 용량에 따라 상이한 정도로 고갈됨을 나타내었다. 천연 T 세포(CD4 및 CD8 둘 다)는 더 적은 정도로 고갈된 다른 세포 집단(기억 및 T reg 세포 포함)에 비해서 최대 고갈을 나타내었다. B 세포 구획에서는 성숙한 B 세포가 미성숙 B 세포보다 더 쉽게 고갈되었다. 비장에서는 용량 의존적 고갈이 관찰되었으며, 림프구의 상당한 고갈은 5 및 1 mg/kg 용량 레벨에서 관찰되었다. 캠퍼스-1H® 와 마찬가지로, 천연 T 세포는 기억 세포보다 더 쉽게 고갈되었다. 고갈이 혈액 내의 NK 세포 및 호중구에 대해서 관찰되었지만, 주사한 어떤 용량에서도 비장 내에서는 고갈이 거의 또는 전혀 관찰되지 않았다. 혈청 사이토킨 분석은 TNFα 및 IL-6 둘 다에 대해서 용량 의존적 증가를 나타내었으며, 여기에서는 5 mg/kg 용량이 각각의 사이토킨의 최고 레벨을 유도하였다. 비처리 마우스와 동등한 레벨은 TNFα에 대해서는 0.5 및 0.1 mg/kg 용량 레벨에서, IL-6에 대해서는 0.1 mg/kg 용량 레벨에서 관찰되었다. 순환 MCP-1의 레벨에서의 용량 의존적 증가가 또한 나타났다.
투여 후 30일까지 림프구 레벨은 비처리 마우스의 레벨로 반등하였다. 1.0 및 5.0 mg/kg 그룹에서 림프구는 투여 후 80일까지 정상 레벨로 복귀하였다. 총 림프구를 혈액 내의 재증식에 대해서 모니터링하였다.
도 60a-60e는 12G6-SFD1/K11 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 61a-61e는 12G6-SFD1/K11 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 62a-62f는 12G6-SFD1/K11 ("12G6 hu") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다. 도 63은 12G6-SFD1/K11 항체를 투여한 후의 시간 경과에 따른 순환 림프구의 재증식을 나타낸다.
실시예 48: CD52 유전자이식 마우스에서 항- CD52 항체의 PK 프로필의 분석 (2C3-SFD1/K12, 12G6-SFD1/K11 및 9D9-H10/K12)
항-CD52 항체의 약력학적 프로필은 huCD52 유전자이식 마우스에서 측정하였다. 본 실험은 항체의 인간화 및 키메릭 형태를 비교하여 인간화 과정이 항체의 청소율을 변화시키지 않았음을 확실히 하였다. 비교에는 키메릭 2C3, 12G6, 및 9D9 항체 및 인간화된 2C3-SFD1/K12, 12G6-SFD1/K11, 및 9D9-H10/K12 항체가 포함되었다. 마우스에게 5 mg/kg으로 항체를 정맥내로 주사하고, 혈액은 투여한지 2 시간 후에 시작해서 다양한 시점에 수집하였다. 각각의 항체의 순환 레벨은 항-인간 IgG ELISA를 사용하여 평가하였다. 분석된 각각의 키메릭/인간화된 항체 쌍에 대해서, 투여 후 2 시간에 나타난 Cmax에는 약간의 차이가 있었다. 2C3 및 12G6 항체의 경우에는 인간화된 버전(즉, 2C3-SFD1/K12 및 12G6-SFD1/K11)의 Cmax가 약간 더 높은 반면에 키메릭 버전은 9D9 쌍에 대해서 약간 더 높았다. 항체 쌍의 청소율은 실험의 과정에 걸쳐서 유사하였으며, 이것은 인간화 과정이 항체의 약력학적 프로필을 상당히 변화시키지 않았음을 시사한다.
도 64a-64c는 투여 후의 시간 경과에 따른 혈액 내의 2C3-키메릭, 2C3-SFD1/K12, 12G6-키메릭, 12G6-SFD1/K11, 9D9-키메릭, 및 9D9-H10/K12 항체의 레벨을 나타낸다.
실시예 49: huCD52 유전자이식 마우스에서 항- CD52 항체의 고갈 및 재증식의 분석 (9D9-H10/K12)
다양한 용량 레벨의 9D9-H10/K12 클론의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1, 0.5, 1.0 또는 5.0 mg/kg의 항체를 정맥내로 주사하였다. 투여한지 2 시간 후에, 혈청을 수집하여 순환 사이토킨의 레벨을 잠재적으로 검사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스 (N=5)로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 마우스의 서브세트(N=5)를 생존상태로 유지시켜 재증식 동력학을 모니터링하였다. 5, 1, 및 0.5 mg/kg 용량에서 9D9-H10/K12의 투여는 혈액 내의 T 세포 및 B 세포 둘 다의 상당한 수의 고갈을 야기하였다. 단지 보통 정도의 레벨의 림프구 고갈이 0.1 mg/kg 용량으로 혈액 내에서 관찰되었다. 이들 데이터는 또한, 다양한 T 및 B 세포 서브세트가 사용된 항체의 용량에 따라 상이한 정도로 고갈됨을 나타내었다. 천연 T 세포(CD4 및 CD8 둘 다)는 더 적은 정도로 고갈된 다른 세포 집단 (기억 및 T reg 세포 포함)에 비해서 최대 고갈을 나타내었다. B 세포 구획에서는 성숙한 B 세포가 미성숙 B 세포보다 더 쉽게 고갈되었다. 비장에서는 이들 세포의 상당한 고갈이 단지 5 및 1 mg/kg 용량 레벨에서 관찰되었다. 캠퍼스-1H® 와 마찬가지로, 천연 T 세포는 기억 세포보다 더 쉽게 고갈되었다. 고갈이 혈액 내의 NK 세포 및 호중구에 대해서 관찰되었지만, 주사한 어떤 용량에서도 비장 내에서는 고갈이 거의 또는 전혀 관찰되지 않았다. 혈청 사이토킨 분석은 분석한 어떤 용량 레벨에서도 TNFα 또는 IL-6에 대해 상당한 증가를 나타내지 않았다. 그러나, 순환 MCP-1의 레벨에서의 용량 의존적 증가는 나타났다.
본 실험의 재증식 부분은 림프구가 50-80% (용량에 따라) 재증식되었을 때 조기에 종료되었다. 림프구 재증식은 T 및 B 세포 기준이 아니라 총 림프구 수를 기준으로 모니터링되었다.
도 65a-65e는 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 66a-66e는 9D9-H10/K12 ("9D9") 항체를 투여하지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포 및 B220+ B 세포의 레벨을 나타낸다. 도 67a-67f는 9D9-H10/K12 ("9D9") 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다. 도 68은 9D9-H10/K12 ("9D9") 항체를 투여한 후 시간 경과에 따른 순환 림프구의 재증식을 나타낸다.
실시예 50: huCD52 유전자이식 마우스에서 항- CD52 항체의 고갈 및 재증식의 분석 (2C3-SFD1/K12, 12G6-SFD1/K11 및 9D9-H10/K12)
다양한 용량 레벨의 캠퍼스-1H® (Campath-1H®) 및 인간화된 2C3-SFD1/K12, 12G6-SFD1/K11 및 9D9-H10/K12 클론의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1 또는 1.0 mg/kg의 항체를 정맥내로 주사하였다. 투여한지 2 시간 후에, 혈청을 수집하여 순환 사이토킨의 레벨을 잠재적으로 검사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 인간화된 항체(2C3-SFD1/K12, 12G6-SFD1/K11 및 9D9-H10/K12)는 모두 PBS 처리된 동물과 비교할 때, 비장 및 혈액 내에서 림프구의 고갈을 매개하였다. 고갈은 모든 항체에 대해서 비장보다는 혈액 내에서 더 활발하였으며, 고갈은 두 가지 조직 모두에서 용량-의존적이었다. 고갈은 CD4 및 CD8+ T 세포에 대해서 가장 극적이었으며 B 세포 구획에서는 덜 고갈되었다. 다양한 T 및 B 세포 서브세트는 상이한 정도로 고갈되었다. 천연 T 세포(CD4 및 CD8 둘 다)는 더 적은 정도로 고갈된 다른 세포 집단(기억 및 T reg 세포 포함)에 비해서 최대 고갈을 나타내었다. B 세포 구획에서는 성숙한 B 세포가 미성숙 B 세포보다 더 쉽게 고갈되었다. 혈청 사이토킨 분석은 투여한지 2 시간 후에 IL-6, MCP-1 및 TNFα의 레벨에서 상당한 증가를 나타내었다. 증가는 캠퍼스-1H® 를 포함한 모든 항체에 대해서 나타났으며, 용량 의존적이었다 (즉, 0.1 mg/kg 용량보다는 1.0 mg/kg 용량 레벨에 대해서 더 큰 사이토킨 레벨이 나타났다). 캠퍼스-1H® 와 비교하여, 2C3-SFD1/K12 및 12G6-SFD1/K11은 IL-6의 유사한 레벨을 유도한 반면, 9D9-H10/K12는 상당히 더 낮은 정도로 IL-6을 유도하였다. MCP-1의 경우에는, 12G6-SFD1/K11 항체가 더 낮은 레벨을 유도하였으며, 12G6-SFD1/K11 및 9D9-H10/K12는 둘 다 캠퍼스-1H® 에 비해 TNFα 레벨을 저하시켰다.
도 69a-69d는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12 ("2C3"), 12G6-SFD1/K11 ("12G6"), 및 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B 세포) 및 CD4+ T 세포, CD8+ T 세포 및 B220+ B/NK 세포 서브타입의 레벨을 나타낸다. 도 70a-70d는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12 ("2C3"), 12G6-SFD1/K11 ("12G6"), 및 9D9-H10/K12 ("9D9") 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B 세포) 및 CD4+ T 세포, CD8+ T 세포 및 B220+ B/NK 세포 서브타입의 레벨을 나타낸다. 도 71a-71f는 캠퍼스-1H® , 2C3-SFD1/K12, 12G6-SFD1/K11, 및 9D9-H10/K12 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
실시예 51: huCD52 유전자이식 마우스에서 항- huCD52 인간화된 9 D9 클론의 직접 비교 (9D9 H10/K12 및 9D9 H11/K12)
2 개의 인간화된 항-CD52 9D9 클론 (9D9-H10/K12 및 9D9-H11/K12)의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1 또는 1.0 mg/kg의 항체를 정맥내로 주사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B2200+) 및 NK 세포 서브집단의 상대적 수를 측정하였다. 어느 하나의 항체에 의한 처리는 혈액 및 비장 내에서 유사한 림프구 고갈을 야기하였으며, 혈액 내에서의 림프구 고갈이 더 활발하였다. 또한, CD4 및 CD8+ T 세포가 두 가지 조직 모두에서 B 세포 및 NK 세포보다 더 강력하게 고갈되었다. 9D9-H10/K12 클론에 의한 고갈은 9D9-H11/K12 클론에 의한 고갈보다 덜 활발한 것으로 보이지만, 차이는 통계학적으로 유의적인 것은 아니다.
도 72는 9D9-H10/K12 및 9D9-H11/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포의 레벨을 나타낸다. 도 73은 9D9-H10/K12 및 9D9-H11/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포의 레벨을 나타낸다.
실시예 52: huCD52 유전자이식 마우스에서 항- huCD52 인간화된 12 G6 클론의 직접 비교 (12G6-SFD1/K11 및 12G6-SFD1-K12)
2 개의 인간화된 항-CD52 12G6 클론(12G6-SFD1/K11 및 12G6-SFD1/K12)의 고갈 활성은 huCD52 유전자이식 마우스에서 검사하였다. 마우스에게 0.1 또는 1.0 mg/kg의 항체를 정맥내로 주사하였다. 투여한지 2 시간 후에 혈청을 수집하여 순환 사이토킨의 레벨을 잠재적으로 검사하였다. 투여한지 3일 후에, 마우스를 희생시키고, 혈액 및 비장을 각각의 마우스로부터 수집하여 유세포분석을 사용하여 세포 고갈의 레벨을 측정하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B2200+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 12G6-SFD1/K11 항체 또는 12G6-SFD1/K12 항체의 투여는 혈액 내에서 상당한 레벨의 림프구 고갈을 야기하였다. 2 가지 클론의 림프구 고갈 활성에는 차이가 거의 또는 전혀 없는 것으로 보였다. 림프구 고갈의 패턴은 천연 CD4 및 CD8+ T 세포가 기억 T 세포 또는 Treg 세포보다 더 큰 정도로 고갈되도록 하는 것이었다. 골수양 세포 집단은 클론 (12G6-SFD1/K11 또는 12G6-SFD1/K12) 또는 용량과는 무관하게 더 적은 정도로 고갈되었다. 혈청 사이토킨 분석은 본 실험을 위해서 수행되지 않았다.
도 74a-74d는 12G6-SFD1/K11 ("12G6 K11") 및 12G6-SFD1/K12 ("12G6 K12") 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B/NK 세포, 및 골수양 세포의 레벨을 나타낸다. 도 75a-75d는 12G6-SFD1/K11 ("12G6 K11") 및 12G6-SFD1/K12 ("12G6 K12") 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B/NK 세포, 및 골수양 세포의 레벨을 나타낸다.
실시예 53: huCD52 유전자이식 마우스에서 항- huCD52 인간화된 9 D9 클론의 직접 비교 (9D9 H11/K12, 9D9 H16/K13, 및 9D9 H18/K13)
3 개의 인간화된 9D9 항체(9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13)의 고갈 활성은 huCD52 유전자이식 마우스에서 비교하였다. 인간 CD52 유전자이식 마우스를 운반체 대조군으로서 PBS로 처리하거나, 1 mg/kg 또는 0.1 mg/kg의 각각의 항체를 주사하였다. 투여한지 2 시간 후에, 혈청을 수집하여 순환 사이토킨의 레벨을 측정하였다. 3일 후에, 마우스를 희생시키고, 말초혈액 및 비장을 수집하여 유세포분석을 위해서 처리하였다. 샘플을 평가하여 huCD52 유전자이식 마우스의 순환 말초혈액 또는 비장 내에 존재하는 총 T 헬퍼세포 (CD4+), 세포독성 T 세포 (CD8+), B 세포 (B220+) 및 골수양 세포 서브집단의 상대적 수를 측정하였다. 또한, T 및 B 세포 서브세트 분석을 수행하여 종합적 고갈효과를 측정하였다. 모든 9D9 (9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13) 항체는 혈액 및 비장 내에서 림프구 및 골수양 세포 집단의 세포성 고갈을 유사한 정도로 매개하였다. 더 활발한 림프구 및 골수양 세포 고갈은 비장보다는 혈액 내에서 관찰되었다. 9D9 클론(9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13)의 고갈 활성의 비교는 9D9-H16/K13이 가장 활발한 고갈을 야기하였고, 이어서 9D9-H18/K13 및 9D9-H11/K12였음을 나타내었다. 이것은 1 mg/kg 용량에 의해 비장 내의 림프구에 대해서 가장 명백하였으며, 여기에서 9D9-H16/K13 처리는 다른 클론 (9D9-H18/K13 및 9D9-H11/K12)의 경우보다 더 큰 정도의 고갈을 야기하였다. 또한, 고갈의 패턴은 천연 CD4 및 CD8+ T 세포가 기억 T 세포 또는 Treg 세포보다 더 큰 정도로 고갈되고, B 세포 집단이 9D9-H16/K13에 의해서 더 큰 레벨로 고갈되도록 하는 것이었다. 골수양 세포 집단은 항체의 클론 (9D9-H11/K12, 9D9-H16/K13, 또는 9D9-H18/K13) 또는 용량과는 무관하게 항-CD52 처리에 의해서 덜 영향을 받았다. 분석된 사이토킨 중에서, 증가는 IL-6, TNFα 및 MCP-1에서 나타났다. 주사 후에, IL-6 및 MCP-1의 유사한 순환 레벨이 0.1 및 1.0 mg/kg 용량 레벨 둘 다에서 모든 9D9 클론(9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13)에 대해 관찰되었다. 약간의 차이는 순환 TNFα 레벨에 의해서 관찰되었으며, 여기에서 9D9-H16/K13 클론의 주사는 1.0 mg/kg 용량에서 보통 정도의 증가를 야기하였다.
도 76은 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단(CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포)의 레벨을 나타낸다. 도 77a-77d는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B/NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다. 도 78은 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단(CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포)의 레벨을 나타낸다. 도 79a-79d는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B/NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다. 도 80a-80f는 9D9-H11/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 2 시간후의 순환 사이토킨의 레벨을 나타낸다.
실시예 54: CD52 유전자이식 마우스에서 2 C3 , 12 G6 , 및 9 D9 패밀리로부터의 항-CD52 항체의 PK 프로필의 분석
인간화된 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 및 9D9-H18/K13의 약력학적 프로필을 huCD52 유전자이식 마우스에서 측정하였다. 마우스에게 1 mg/kg으로 항체를 정맥내로 주사하고, 혈액을 투여한지 2 시간 후에 시작하여 다양한 시점에서 수집하였다. 각각의 항체의 순환 레벨은 항-인간 Ig ELISA를 사용하여 평가하였다. 계산된 반감기는 다음과 같았다: 2C3-SFD1/K12 79.0 ± 23.9 시간, 12G6-SFD1/K11 49.0 ± 14.4 시간, 12G6-SFD1/K12 75.1 ± 28.5 시간, 9D9-H16/K13 59.8 + 26.6 시간 및 9D9-H18/K13 42.2 + 15.7 시간.
종합적으로, 이들 시험에서의 노출에 대해서는 상당한 동물-간 가변성이 있었다. 2C3-SFD1/K12 및 12G6-SFD1/K12에 대한 말기 소실 반감기(terminal elimination half-life)는 유사하였으며, 그 반면에 12G6-SFD1/K11의 반감기는 더 짧았지만 크게 상이하지는 않았다. 청소율은 2C3-SFD1/K12에 의해서 가장 빨랐으며, 그에 이어서 12G6-SFD1/K11 및 12G6-SFD1/K12였다. 2 개의 12G6 처리는 측정된 시점의 대부분에 대해서 서로 유사하였으며, 그 반면에 2C3-SFD1/K12는 보다 적은 노출 및 더 빠른 청소율을 나타내었다. 9D9-H16/K13 및 9D9-H18/K13은 측정된 모든 PK 파라메터에 대해서 매우 유사하였다.
도 81a-81b는 복용 후 시간 경과에 따른 혈액 중 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 및 9D9-H18/K13 항체의 수준을 보여준다.
표 16:
실시예 55: 항- CD52 항체에 의한 처리에 대한 반응으로 사이토킨 발작 (cytokine storm)의 평가
항-CD52 항체에 의한 처리 후의 혈청 사이토킨의 방출은 huCD52 유전자이식 마우스에서 평가하였다. 동물을 1 mg/kg의 캠퍼스-1H® (Campath-1H®), 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 또는 9D9-H18/K13으로 처리하였다. 동물의 한 그룹은 2C3-SFD1/K12에 의한 주사가 다른 항체에 비해서 더 낮은 레벨의 고갈을 야기할 수 있음을 시사하는 이전의 결과에 비추어서 5 mg/kg의 2C3-SFD1/K12로 처리함으로써 그룹들을 유사한 고갈 레벨을 달성하도록 하는데 필요한 용량을 기초로 표준화하였다. 모든 그룹은 처리한지 1 2, 4, 24, 및 48 시간 후에 출혈시키고, 염증성 사이토킨에 대한 CBA 분석을 수행하였다. 모든 그룹은 또한, 처리한지 3일 후에 희생시키고, 비장을 유세포분석에 의해서 비장 내의 림프구 고갈에 대해서 평가하였다. 각각의 항체에 의한 처리는 캠퍼스-1H® 에 대해서 관찰된 것과 유사한 다양한 표적의 고갈을 야기하였다. 이것은 또한 2C3-SFD1/K12의 경우에도 진실하며, 여기에서는 5 mg/kg 용량이 유사한 고갈을 유발시키기 위해서 사용되었다. 아마도 사이토킨 분석을 위한 혈청을 획득하기 위해서 동물을 반복 출혈시킨 것에 기인하여, 고갈에 있어서의 약간의 가변성이 12G6-SFD1/K12 및 9D9-H16/K13에 의해서 관찰되었다. 그러나, 사이토킨 발현은 12G6 (12G6-SFD1/K11 및 12G6-SFD1/K12) 및 9D9 (9D9-H16/K13 및 9D9-H18/K13) 패밀리 구성원으로부터의 항체의 경우에 감소되었다. 이것은 초기 1 및 2 시간 시점에서 IL-6, MCP-1 및 TNFα의 방출에 대해 가장 현저하였다.
도 82a-82f는 캠퍼스-1H® ("Campath"), 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 또는 9D9-H18/K13 항체를 투여한 후 48-시간 과정에 걸친 혈액 내의 사이토킨의 레벨을 나타낸다. 도 83a-83e는 캠퍼스-1H® ("Campath"), 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 또는 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구, CD4+ T 세포, CD8+ T 세포, B220+ B/NK 세포, 및 골수양 세포의 레벨을 나타낸다.
실시예 56: 항- CD52 항체에 의한 처리 후의 CD52 유전자이식 마우스의 혈액 내에서 재증식 동력학의 평가
혈액 내의 몇 가지 세포 타입의 재증식 동력학은 인간화된 항-CD52 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한 후에 평가하였다. 마우스에게 각각의 항체를 2 mg/kg으로 정맥내로 주사하여 고갈의 활발한 레벨을 보장하였다. 주사 후의 다양한 시점에서 혈액을 유세포분석을 위해서 수집하여 CD4+ 및 CD8+ T 세포, 조절 T 세포, B 세포, NK 세포, 호중구 및 대식세포를 포함한 혈액 내의 순환 림프구의 레벨을 측정하였다. 주사 후 3일에 확인된 각각의 항체에 대한 초기 고갈 활성에서는 차이가 관찰되지 않았다. 마우스를 첫달 동안에는 매주 출혈시키고, 그 후에는 2주에 한번씩 출혈시켜 재증식의 동력학을 모니터링하였다. 림프구 재증식의 동력학은 캠퍼스-1H® 와 비교하여 항-CD52 (2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12) 항체 중의 어떤 것에 대해서도 유사하였다. 57일까지 B 세포는 혈액 내에서 기준선으로 복귀한 반면에, T 세포는 84일까지는 기준선 레벨에 접근하였다. 116일까지는 CD8+ T 세포가 대조 레벨로 복귀하지 않았지만, 모니터링된 모든 다른 세포 타입에 대한 유사한 재증식 동력학이 항-CD52 (2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12) 항체 및 캠퍼스-1H® 각각에 의해서 관찰되었다.
도 84a-84g는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한 후의 시간 경과에 걸친 순환 CD4+ 및 CD8+ T 세포, 조절 T 세포, B 세포, NK 세포, 호중구 및 대식세포의 재증식을 나타낸다.
실시예 57: 항- CD52 항체를 사용한 CD52 유전자이식 마우스에서의 CD52 발현의 평가
huCD52의 발현은 인간화된 항-CD52 항체를 사용해서 평가하여 유사한 염색 패턴이 huCD52 유전자이식 마우스에서 성숙 및 발육 중인 세포 상에서 관찰될 수 있는지 여부를 측정하였다. 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 FITC와 컨주게이트시켜 유세포분석 염색에서 사용하였다. huCD52 유전자이식 마우스로부터의 조직을 수집하여 염색을 위해서 처리하였다. 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체는 캠퍼스-1H® 와 마찬가지로 유전자이식 마우스의 비장으로부터의 huCD52를 발현하는 림프구를 염색시켰다. 염색 패턴은 흉선 및 골수와 같은 다른 림프양 기관에서 발견된 림프구 집단 및 서브세트를 대표하였다.
도 85는 비장 내의 huCD52 림프구 세포 집단에 특이적으로 결합하는 FITC-표지된 캠퍼스-1H® , 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체의 능력을 나타낸다.
실시예 58: huCD52 유전자이식 마우스에서 항- huCD52 에 의한 단일 용량 처리의 직접 비교
몇 가지 인간화된 항-CD52 항체 (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13)의 고갈 활성을 huCD52 유전자이식 마우스에서 비교하였다. 마우스에게 항체를 1 mg/kg으로 정맥내로 주사하였다. 투여한지 2-시간 후에, 사이토킨 분석을 위해서 혈청을 수집하였다. 3일 후에 마우스를 희생시키고, 혈액 및 비장을 수집하여 림프구 고갈의 레벨을 비교하였다. 상당한 레벨의 B 및 T 세포 고갈이 항-CD52 항체 (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13 및 9D9-H18/K13) 모두에 대해서 관찰되었으며, 이것은 캠퍼스-1H® 투여 후에 관찰된 것과 동등하였다. 서브세트 분석은 또한, 혈액이나 비장 내에서 각각의 항체 (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13)에 대한 고갈의 레벨에 있어서 큰 차이가 없음을 나타내었다. 캠퍼스-1H® 의 투여 후에는, IL-6 및 TNFα 둘 다의 순환 레벨에 있어서 현저한 증가가 있었다. 비록 항-CD52 항체 (2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13) 각각의 주사가 캠퍼스-1H® 에 비해서 TNFα의 레벨의 상당한 감소를 야기하였지만, IL-6의 레벨은 유사하였다.
도 86a-86e는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B/NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다. 도 87a-87e는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 72 시간 후에 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포) 및 CD4+ T 세포, CD8+ T 세포, B220+ B/NK 세포, 및 골수양 세포 서브타입의 레벨을 나타낸다. 도 88a-88c는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 12G6-SFD1/K11, 12G6-SFD1/K12, 9D9-H16/K13, 및 9D9-H18/K13 항체를 투여한지 2 시간 후의 순환 사이토킨의 레벨을 나타낸다.
실시예 59: 항- huCD52 항체에 의한 단일 용량 처리 후에 huCD52 유전자이식 마우스에서 림프구의 심층 고갈 (in depth depletion)
광범한 고갈 분석은 항-CD52 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 사용하여 huCD52 유전자이식 마우스에서 수행되었다. 마우스(N=4)에게 각각의 항체의 단일 용량을 1 mg/kg으로 정맥내로 주사하였다. 3일 후에, 마우스를 희생시키고, 혈액, 비장, 림프절 및 흉선을 수집하여 다색 유세포분석을 사용해서 림프구 고갈의 레벨을 비교하였다. 상당한 레벨의 B 및 T 세포 고갈이 항-CD52 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체에 대해서 관찰되었으며, 이것은 검사한 각 조직에서 캠퍼스-1H® 투여 후에 관찰된 것과 동등하였다. 서브세트 분석은 또한, 혈액 또는 비장에서 각각의 항체에 대한 고갈의 레벨에 큰 차이가 없음을 나타내었다. 상당한 레벨의 림프구 고갈은 또한, 마우스의 림프절에서 관찰되었다. 그러나, 특히 중앙 및 효과기 기억 T 세포 서브세트를 검사한 경우에는 항체의 활성에 약간의 가변성이 있는 것으로 보였다. LSR-II 및 CD8 염색에 관한 기술적 문제로 인하여 흉선은 평가될 수 없었다.
도 89a-89d는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다. 도 90a-90d는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 비장 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다. 도 91a-91d는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체를 투여한지 72 시간 후에 림프절 내의 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입의 레벨을 나타낸다.
실시예 60: C57BL /6 배경에서 huCD52 녹-인 (Knock-in)/녹-아웃 (Knock-out) (KI/KO) 유전자이식 마우스의 생성 및 평가
새로운 인간 CD52 녹-인/녹-아웃 마우스 모델을 C57Bl/6 배경에서 생성시켰다. 이 마우스를 생성시키기 위해서, 마우스 CD52 유전자 서열을 인간 CD52 유전자 서열에 의해서 대체시켰다. 표적화 전략은 엑손-인트론 구조를 유지시키면서 인간 서열에 의한 마우스 서열의 치환을 준비하였다. 선택 마커를 사용하여 새로운 유전자 서열을 함유하는 자손을 확인하였다. 최종 대립형질은 선택 마커를 제거하여 인간 CD52 유전자 서열을 남김으로써 생성되었다.
huCD52 KI/KO 마우스 모델의 기본적 특정화는 림프구 상에서의 인간 CD52 발현의 레벨을 측정하는 것을 포함하였다. huCD52-KI/KO 유전자이식 마우스 (N=4) 및 C57BL/6 마우스 (N=2)로부터의 혈액을 hCD52 발현에 대해서 염색하고, CD52 분자/세포의 수를 뱅스랩 단순 세포성 항-인간 항체 시험(Bang's labs Simply Cellular anti-human antibody assay)을 사용하여 세었다. huCD52-KI/KO 유전자이식 마우스로부터의 말초혈액 세포의 염색은 huCD52의 발현이 이들 동물로부터의 대부분의 림프구 상에서 매우 높음을 입증하였다. 발현 레벨은 인간 CD4, CD8, 및 B 세포 집단에서 관찰된 것과 유사하였다. NK 세포 및 대식세포 상에서의 발현 레벨은 T 세포 및 B 세포에 대해서 관찰된 것보다 작았다. huCD52 발현의 증가된 레벨은, 인간 호중구 또는 CD-1 배경의 원래의 유전자이식 마우스 라인으로부터의 유사한 세포에서의 감소된 발현 레벨과는 반대로 이들 마우스의 호중구 상에서 검출되었다. CD52 발현의 유사한 레벨은 원래의 huCD52 CD1 유전자이식 마우스 및 huCD52 KI/KI 마우스로부터의 T 및 B 세포 상에서 관찰되었다.
도 92a는 huCD52-KI/KO 및 비-유전자이식 대조 마우스에서 CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK/골수양 세포 서브타입 상에서의 huCD52 발현 레벨을 나타낸다. 도 92b는 huCD52-KI/KO 및 huCD52 CD1 유전자이식 마우스에서 CD4+ T 세포, CD8+ T 세포, 및 B 세포 상에서의 huCD52 발현 레벨을 나타낸다.
실시예 61: 12 G6 및 2 C3 의 소규모 및 대규모 로트 (lot) 사이의 고갈 특징의 직접 비교
huCD52 KI/KO 유전자이식 마우스에게 12G6-SFD1/K12 또는 2C3-SFD1/K12를 투여하여 고갈 활성을 측정하였다. 또한, 활성은 Genzyme에서 2 가지 상이한 공급원 (소규모 및 대규모 로트)으로부터 생성된 항체를 사용하여 검사하였다. 마우스에게 각각의 항체를 1 mg/kg으로 정맥내로 주사하였다. 주사한지 3일 후에, 마우스를 희생시키고, 혈액을 유세포분석을 위해서 수집하여 순환 CD4+ 및 CD8+ T 세포, B 세포, NK 세포, 호중구 및 대식세포의 레벨을 측정하였다. CD4 T 세포, CD8+ T 세포, B 세포, 및 NK 세포의 고갈에 있어서의 큰 차이는 소규모 및 대규모 로트 유도된 항체 사이에서 관찰되지 않았다.
다양한 로트의 12G6-SFD1/K12 및 2C3-SFD1/K12 항체를 또한 유세포분석에 의해서 평가하여 huCD52-KI/KO 유전자이식 마우스로부터의 비장세포 상에서의 염색의 강도를 비교하였다. 12G6-SFD1/K12 및 2C3-SFD1/K12 항체는 둘 다 분리된 비장세포 상에서 캠퍼스-1H® 와 동일한 정도로 인간 CD52를 인식하는 것으로 보인다. 또한, 항체의 2 가지 공급원 (소규모 및 대규모 로트) 사이에서 인식 레벨에는 차이가 없었다.
도 93a-93b는 캠퍼스-1H® 대조군과 비교한 12G6-SFD1/K12 및 2C3-SFD1/K12 항체(다양한 생산 공급원으로부터)의 huCD52에 대한 결합을 나타낸다. 도 94는 다양한 생산 공급원으로부터의 12G6-SFD1/K12 및 2C3-SFD1/K12 항체를 투여한지 72 시간 후에 혈액 내의 벌크 림프구 집단(CD4+ T 세포, CD8+ T 세포, 및 B220+ B 세포)의 레벨을 나타낸다.
실시예 62: huCD52 - KI /KO 유전자이식 마우스에서 항- CD52 항체에 대한 PK 프로필의 분석
인간화된 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체의 약력학적 프로필을 huCD52 KI/KO 유전자이식 마우스에서 측정하였다. 마우스에게 1 mg/kg으로 항체를 정맥내로 주사하고, 투여한지 2 시간 후부터 시작하여 다양한 시점에 혈액을 수집하였다. 각각의 항체의 순환 레벨을 항-인간 Ig ELISA를 사용하여 평가하였다. 전반적인 청소율은 인간화된 항-CD52 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체 각각에 대해서 유사하였으며, 2C3-SFD1/K12은 잠재적으로 더 빠른 동력학을 나타낸 반면에 12G6-SFD1/K12은 가장 긴 기간 동안 혈청 내에 존재하였다.
도 95a-95b는 투여 후의 시간 경과에 따른 혈액 내의 2C3-SFD1/K12, 9D9-H16/K13 및 12G6-SFD1/K12 항체의 레벨을 나타낸다.
실시예 63: huCD52 - KI /KO 유전자이식 마우스에서 EAE 에 대한 12 G6 및 2 C3 전처리의 평가
실험적 자가면역 뇌척수염 (EAE)의 전반적인 질병 발생빈도 및 중증도를 감소시키는데 대한 항-CD52 항체 처리의 효능을 huCD52 KI/KO 마우스에서 평가하였다. huCD52-KI/KO 마우스를 -5일부터 -1일까지 2C3-SFD1/K12 또는 12G6-SFD1/K12의 과정으로 처리하였다. EAE(다발성 경화증의 모델)는 CFA 내에 유화된 MOG35-55 펩타이드에 의한 면역화, 및 0 및 2일에 백일해 독소에 의한 처리에 의해서 유도되었다. 운반체 처리된 마우스는 주사 후 10일까지 마비의 증상을 나타내기 시작하였으며, 이것은 심각한 진행성 질병으로 발전하였다. 반대로, 2C3-SFD1/K12 또는 12G6-SFD1/K12 항체에 의한 마우스의 전처리는 질병의 시작을 지연시키고, 전반적인 질병 중증도를 감소시켰다.
도 96은 질병 진행의 시간 경과에 따른 2C3-SFD1/K12 및 12G6-SFD1/K12의 EAE 임상 스코어를 나타낸다.
실시예 64: 항- CD52 항체의 약력학적 프로필을 변화시키기 위한 항체의 Fc 변형
항체의 Fc 부위의 변화는 1) Fc 수용체와의 상호작용을 변화시킴으로써 항체의 생물학적 활성에 영향을 미치고/미치거나, 2) FcRn 신생아 수용체와의 상호작용을 변화시킴으로써 항체의 약력학적 프로필을 변화시킨다. FcRn 분자는 혈관 내피 상에서 발현되며, IgG 재순환 (recycling)의 주된 부위인 것으로 믿어진다. FcRn은 항체 Fc 부분에 결합한 다음에 세포 내에 내재화하게 된다. FcRn과의 높은 친화성 상호작용을 갖는 항체는 세포의 표면으로 다시 재순환될 수 있고, 다시 순환계 내로 방출될 수 있다. 더 낮은 친화성 상호작용을 갖는 항체는 세포 내에서 해리하여 궁극적으로 분해한다. FcRn과의 상호작용을 증가시키기 위한 부위 지시된 돌연변이유발은 비변형된 항체에 비해서 더 장기간 동안 순환상태로 유지될 수 있는 항체를 생성시킨다. 역으로, FcRn 결합을 감소시키는 항체의 Fc 부위 내에서의 돌연변이는 항체의 순환 반감기를 단축시킨다. FcRn에 대한 결합을 감소시켜 더 짧은 순환 반감기를 야기하는 것으로 기술된 돌연변이는 His435Ala 단일 돌연변이 및 His310Ala/His435Gln 이중 돌연변이를 포함한다[참조: 예를 들어, Kim et al.,"Mapping the site on human IgG for binding of the MHC class I-related receptor, FcRn," Eur . J. Immunol ., 29:2819-2825 (1999) and Kenanova et al.,"Tailoring the Pharmacokinetics and Positron Emission Tomography Imaging Properties of Anti-Carcinoembryonic Antigen Single-Chain Fv-Fc Antibody Fragments," Cancer. Res. 65(2):622-631 (2005)].
2C3-SFD1/K12 항체를 돌연변이시켜 변화된 PK 프로필을 갖는 His435Ala 2C3-SFD1/K12 ("2C3-SFD1/K12-Modified 1") 및 His310Ala/His435Gln 2C3-SFD1/K12 ("2C3-SFD1/K12-Modified 2") 항체를 생성시켰다. 비아코어 분석을 수행하여 마우스 및 인간 FcRn 분자 둘 다에 대한 감소된 결합을 확인하였다. 캠퍼스-1H® 및 2C3-SFD1/K12 항체는 유사한 동력학으로 마우스 및 인간 FcRn 분자 각각에 결합하였다. 반대로, His435Ala 2C3-SFD1/K12 항체는 낮은 레벨로 마우스 FcRn에 결합하였지만 인간 FcRn에는 결합하지 않았다. His310Ala/His435Gln 2C3-SFD1/K12 항체는 마우스 또는 인간 FcRn 분자에 결합하지 않았으며, 이것은 2C3-SFD1/K12 Fc 부위 내로의 단일 또는 이중 돌연변이의 혼입이 마우스 및 인간 FcRn에 대한 결합에 상당히 영향을 미침을 시사한다.
도 97a-97b는 마우스 및 인간 FcRn 분자에 결합하는 캠퍼스-1H® ("Campath"), 2C3-SFD1/K12 ("2C3"), His435Ala 2C3-SFD1/K12 ("H435A 2C3") 및 His310Ala/His435Gln 2C3-SFD1/K12 ("H310A/H435Q 2C3")의 능력을 나타낸다.
실시예 65: C57Bl /6 마우스에서 정맥내로 투여한 후의 Fc 변형된 항- CD52 항체의 반감기의 평가
Fc 변형을 2C3-SFD1/K12 골격에 혼입시켜 순환상태로 항체를 유지시키는데 책임이 있는 FcRn 수용체에 대한 감소된 결합을 나타낸 2C3-SFD1/K12-돌연변이체-1 및 2C3-SFD1/K12-돌연변이체-2 항체를 생성시켰다. 약력학적 프로필은 2C3-SFD1/K12 항체, 및 감소된 FcRn 결합을 갖는 2C3-SFD1/K12-돌연변이체-1 및 2C3-SFD1/K12-돌연변이체-2 항체에 대해서 측정하였다. C57BL/6 마우스를 사용하여 표적 항원의 부재 하에서의 PK 프로필을 평가하였다 (2C3-SFD1/K12는 인간 CD52에 결합하지만 마우스 CD52와 교차-반응하지 않는다). 마우스에게 1 mg/kg으로 항체를 정맥내로 주사하였다. 다양한 시점에 혈액을 수집하여 ELISA에 의해 마우스 혈청 내의 순환 인간 IgG1의 레벨을 분석하였다. 2C3-SFD1/K12-돌연변이체-1 및 2C3-SFD1/K12-돌연변이체-2 항체는 둘 다 2C3-SFD1/K12 항체보다 더 빠르게 혈액으로부터 청소되었다. 2C3-SFD1/K12는 403 시간의 반감기를 갖는 반면에 2C3-SFD1/K12-변형 1은 51 시간의 반감기를 갖고, 2C3-SFD1/K12-변형 2는 8 시간의 반감기를 가졌다. 2C3-SFD1/K12 및 2C3-SFD1/K12-변형-1에 대한 PK 프로필은 단지 단일상의 소실을 갖는 1-구획 모델과 일치하였다. 대조적으로, 2C3-SFD1/K12-변형-2에 대한 프로필은 2 개의 상이한 소실상(표에서 알파 및 베타로 명시됨)을 갖는 2 구획 모델과 일치하였다. 제1상은 투여 후 48 시간까지 지속하였으며(알파), 제2상(베타, 또한 말기 소실상으로도 불림)은 투여 후 48 시간에 시작하였다.
도 98은 비-유전자이식 마우스에서 2C3-SFD1/K12 ("2C3 unmodified"), 2C3-SFD1/K12-돌연변이체-1 ("2C3-Fc mutant 1") 및 2C3-SFD1/K12-변형 2("2C3-Fc mutant 2")의 생체내 청소를 나타낸다.
표 17:
표 18:
실시예 66: 이형접합성 huCD52 유전자이식 마우스에서 정맥내로 투여한 후의 Fc 변형된 항-CD52 항체의 반감기의 평가
약력학적 프로필은 2C3-SFD1/K12 항체, 및 시험관내에서 감소된 FcRn 결합을 갖는 2C3-SFD1/K12-돌연변이체-1 및 2C3-SFD1/K12-돌연변이체-2 항체에 대해서 측정하였다. huCD52 유전자이식 마우스를 사용하여 2C3-SFD1/K12 항체 표적 항원의 존재 하에서 PK 프로필을 평가하였다. 마우스에게 1 mg/kg으로 항체를 정맥내로 주사하였다. 다양한 시점에 혈액을 수집하여 ELISA에 의해 마우스 혈청 내의 순환 인간 IgG1의 레벨을 측정하였다. 2C3-SFD1/K12-돌연변이체-1 및 2C3-SFD1/K12-돌연변이체-2 항체는 둘 다 2C3-SFD1/K12 항체보다 더 빠르게 혈액으로부터 청소되었다. 2C3-SFD1/K12는 64 시간의 반감기를 갖는 반면에 2C3-SFD1/K12-변형 1은 32 시간의 반감기를 갖고, 2C3-SFD1/K12-변형 2는 6.5 시간의 반감기를 가졌다.
도 99는 huCD52 유전자이식 마우스에서 2C3-SFD1/K12 ("2C3"), 2C3-SFD1/K12 돌연변이체-1 ("2C3-Fc mutant 1") 및 2C3-SFD1/K12 변형 2("2C3-Fc mutant 2")의 생체내 청소를 나타낸다.
표 19:
표 20:
실시예 67: 이형접합성 huCD52 유전자이식 마우스에서 Fc 변형된 항- CD52 항체의 정맥내. 투여 후의 생체내 고갈의 평가
고갈 활성은 huCD52 유전자이식 마우스에서 2C3-SFD1/K12, 2C3-SFD1/K12-돌연변이체-1, 및 2C3-SFD1/K12-돌연변이체-2 항체에 대해서 측정되었다. 마우스를 1 mg/kg의 2C3-SFD1/K12, 2C3-SFD1/K12-돌연변이체-1, 또는 2C3-SFD1/K12-돌연변이체-2 항체로 처리하고, 72 시간 후에 CD4 T 세포, CD8+ T 세포, B 세포, 및 NK 세포의 존재에 대해서 평가하였다. 2C3-SFD1/K12-돌연변이체-1 또는 2C3-SFD1/K12-돌연변이체-2 항체의 투여는 2C3-SFD1/K12 항체의 투여에 비해 혈액 및 비장 내에서 고갈의 감소된 레벨을 제공하였다. 또한, 2C3-SFD1/K12-변형 1은 혈액 및 비장 둘 다에서 2C3-SFD1/K12-변형 2보다 더 큰 고갈을 유발하였다.
도 100a-100b는 2C3-SFD1/K12 ("2C3"), 2C3-SFD1/K12 돌연변이체-1 ("2C3 Fc mutant-1"), 및 2C3-SFD1/K12 돌연변이체-2 ("2C3 Fc mutant-2") 항체를 투여한지 72 시간 후에 혈액 및 비장 내의 벌크 림프구 집단 (CD4+ T 세포, CD8+ T 세포, B220+ B 세포, 및 NK 세포)의 레벨을 나타낸다.
실시예
68: 인간화된 항-
CD52
항체의 상세한
에피토프
특이성
인간화된 12G6-SFD1/K12, 2C3-SFD1/K12, 및 9D9-H16/K13 항체의 상세한 에피토프 특이성은 비아코어 (Biacore) T100 기기를 사용하여 측정하였다. 대조군으로서 클론 097(정제된 항-인간 CD52 항체, Biolegend)의 에피토프 특이성을 동일한 방법을 사용하여 평가하였다. 클론 097의 에피토프 특이성은 펩타이드 ELISA 방법을 사용하여 이전에 특정화되었다[Hale G,"Synthetic peptide mimotype of the CAMPATH-1 (CD52) antigen, a small glycosylphosphatidylinositol-anchored glycoprotein," Immunotechnology, 1:175-187 (1995)]. 이 비아코어 T100 시험에서는 항체를 직접 아민 커플링을 사용하여 비아코어 CM5 시리즈 S 카복시메틸 덱스트란 센서칩 (sensor chips) (GE #BR-1006-68) 상에 고정화시켰다. 카복시메틸 덱스트란 표면을 0.1 M N-하이드록시석신이미드 (NHS) 및 0.4 M N-에틸-N'-(3-디메틸아미노프로필) 카보디이미드 하이드로클로라이드 (EDC)의 1:1 혼합물을 사용하여 활성화시켜 표면이 항체 상의 반응성 아민 그룹에 결합하도록 하였다. IgM 항체는 IgGs에 비해 더 높은 레벨의 비-특이적 결합을 갖는 경향이 있기 때문에, 마우스 IgMκ (mIgMκ) 이소타입 대조군(Biolegend 클론 #MM-30)을 또한 조사하였다. 항체 고정화시킨 후에, 반응성 센서칩 표면을 1 M 에탄올아민 하이드로클로라이드/NaOH pH 8.5를 사용하여 켄칭하였다. 각각의 칩 상의 하나의 유동 셀 (flow cell)은 공 기준 표면이었으며, 후속 유동 셀은 10,000 RU의 항체로 고정화되었다.
인간 CD52 서열을 포함하는 일련의 알라닌-주사 돌연변이체 펩타이드 (MUT 1 - MUT 12 (각각 SEQ ID NOS: 169-180), 표 21) [참조: 예를 들어, Hale G,"Synthetic peptide mimotype of the CAMPATH-1 (CD52) antigen, a small glycosylphosphatidylinositol-anchored glycoprotein," Immunotechnology, 1:175-187 (1995)]를 합성하였다. 이들 돌연변이체 CD52 펩타이드 및 야생형 인간 CD52 펩타이드에 대한 항체 결합을 500 nM, 100 nM, 50 nM, 및 0 nM의 농도에서 시험하였다. 펩타이드를 시험 운전 완충액 (assay running buffer), HBS-EP+ (10 mM HEPES, 150 mM NaCl, 0.05% P20 계면활성제, 3 mM EDTA, pH 7.4)로 희석하였다. 100 nM 샘플의 복제물이 포함되었다. 경쇄 (카파) 특이적 랫트 항-마우스 IgM 항체(Southern Biotech Clone #1B4B1)가 또한 IgM 대조군으로 포함되었다. T100 기기 샘플 챔버 및 시험 온도는 각각 4 ℃ 및 25 ℃로 설정하였다. 인간 CD52 펩타이드 샘플을 50 ㎕/min의 유속으로 5 분 동안 주입하여 결합을 측정하고, HBS-EP+ 중에서 50 ㎕/min의 유속으로 5 분 동안 세척하여 해리를 측정하였다. 항체 표면은 50 ㎕/min 유속으로 10 mM 글리신-HCl pH 2.0의 60 초 주입을 사용하여 잔존하는 결합된 펩타이드를 떼어내었다. 분석은 비아코어 T100 동력학 평가 소프트웨어 v2.0(GE Healthcare)을 사용하여 수행하였다. 데이터는 기준 유동 셀 및 0 nM 농도 공제(이중-기준 공제 (double-reference subtraction))에 의해서 1:1 모델에 적합하였다. 12G6-SFD1/K12 항체 음성 ((-), MUT 8) 및 양성 ((+), MUT 9) 펩타이드 에피토프 인식의 대표적인 센서그램은 각각 도 101a 및 도 101b에 나타낸다. 컴파일된 펩타이드 결합 데이터는 표 21에 요약한다.
클론 097의 이전에 특정화된 결합 특이성[Hale G,"Synthetic peptide mimotype of the CAMPATH-1 (CD52) antigen, a small glycosylphosphatidylinositol-anchored glycoprotein," Immunotechnology, 1:175-187 (1995)]은 ELISA 플레이트를 인간 CD52의 C-말단 부분의 6 개의 잔기를 함유하는 펩타이드로 코팅한 다음에, 고정된 펩타이드에 대한 항체의 결합을 측정함으로써 측정되었다. 각각의 잔기는 모두 20 개의 아미노산에 의해서 치환되었다. 펩타이드는 이 ELISA에서 고체 표면에 부착되었기 때문에, 시험은 펩타이드를 그 위로 유동시키는 표면에 고정된 항체를 사용하는 본 명세서에 기술된 비아코어 T100 시험보다 화합성 효과에 의해서 더 영향을 받을 수 있다. ELISA 시험에서, 인간 CD52의 성숙한 형태의 위치 11 및 12(야생형 잔기는 각각 프롤린 및 세린)에서 알라닌 치환은 펩타이드에 대한 클론 097의 강력한 결합을 감소시키는 것으로 밝혀졌다. 본 발명의 비아코어 T100 시험에서, 위치 11 및 12(뿐만 아니라 위치 7, 8, 9, 및 10)에서의 알라닌 치환은 클론 097의 결합을 저해하는 것으로 밝혀졌다. ELISA 시험의 가정된 화합성 효과는 ELISA에 의해서 측정된 바와 같은 클론 097의 맵핑된 (mapped) 에피토프가 기술된 비아코어 T100 시험에 의해서 측정된 것보다 더 작기 때문인 것 같다.
인간 CD52 펩타이드 서열에 대한 2C3-SFD1/K12 및 12G6-SFD1/K12 인간화된 항체 둘 다의 결합은 위치 7, 8, 및 11에서의 알라닌 치환에 대해서 민감하며, 인간화된 9D9-H16/K13의 결합은 위치 4 및 11에서의 알라닌 치환에 대해 민감하다. 이들 규정된 에피토프 특이성은 실시예 4에서 관찰된 결과(표 8에 요약됨)와 중복된다. 결과들 사이의 약간의 변동은 본 발명에서 결합을 측정하기 위해서 사용된 비아코어 T100 방법이 실시예 4에서 사용된 방법과 상당히 달랐다는 것을 고려하면 놀라운 것이 아니다. 본 경우와는 대조적으로, 실시예 4에서는 조작된 CHO 세포를 사용하여 인간 CD52의 야생형 또는 알라닌-치환된 돌연변이체를 발현시켰다. 이러한 포유동물 세포에서 발현된 인간 CD52는 글리코실화되어 결합에 영향을 미칠 수 있다. 이것은 비아코어 T100 시험에서 사용된 인간 CD52에 대해서는 해당하지 않는다.
표 21:
실시예 69: 캠퍼스-1H® 또는 12 G6 - SFD1 / K12 에 의해서 유도된 CD4 + T 세포 반응의 평가
CD4+ T 세포 증식성 반응은 캠퍼스-1H® (Campath-1H®) 또는 인간화된 12G6-SFD1/K12 항체의 가변 부위로부터 유래하는 서열을 포함하는 중복성 15-mer 펩타이드의 세트로 전부하된 자기 유래 수상돌기세포로 반복해서 시험관내 자극한 후에 평가하였다. 이들 실험은 정상 인간 공여체 T 세포 및 DCs를 이용하였다. 결과는 자기 유래 펩타이드 펄싱된 항원 제시 세포(APC)에 대한 반응으로 증식성 인간 CD4+ T 세포의 트리튬화된 티미딘 혼입을 정량화함으로써 측정되었다.
세포 조제:
PBMCs는 BioMed Supplies (Carlsbad, CA)로부터 획득한 정상 인간 공여체 분리반출 생성물로부터 분리되었다. 공여체 혈액의 HLA 할로타입 스크리닝은 Key Biologics, LLC(Memphis, TN)에 의해서 수행되었다 (표 22). PBMCs는 피콜-파크 (Ficoll-Paque) PLUS 밀도 구배 (GE Healthcare) 및 포스페이트 완충된 식염수(PBS, Invitrogen, Carlsbad, CA)에 의한 일련의 세척을 사용하여 분리되었다. CD4+ T 세포를 제조자의 추천 프로토콜에 따라 다이날 (Dynal) CD4+ 비드-기본 양성 분리 키트(Invitrogen)를 사용하여 PBMC로부터 분리시켰다. 분리된 CD4+ T 세포를 리커버리 (Recovery) 세포 배양 동결 배지(Invitrogen)내에서 동결시키고, 액체 질소 중에서 저장하였다. 수상돌기세포 (DC)는 부착세포를 GM-CSF (Leukine, Bayer, Leverkusin, Germany) 및 IL-4(Peprotech, Rocky Hill, NJ)와 6일 동안 플레이팅함으로써 PBMCs로부터 유도되었다. 이어서 GM-CSF 및 IL-4가 보충된 배지를 플라스크로부터 분리하고, 동결 배지 내에서 동결시킨 다음에 액체 질소 저장 탱크에 옮겼다.
표 22:
펩타이드 :
캠퍼스-1H® 및 12G6-SFD1/K12 펩타이드의 중쇄 및 경쇄 가변 부위를 포함하는 펩타이드는 클리어 (CLEAR) 수지 (Peptides International, Louisville, KY) 상에서 표준 Fmoc-화학을 사용하는 라이닌 심포니 (Rainin Symphony) 자동화 펩타이드 합성기를 사용하여 합성하였다. 아미노산 (EMD Biosciences, San Diego, CA or Anaspec, San Jose, Ca)은 tert-부톡시카보닐 (BOC), tert-부틸 (tBu), 2,2,4,6,7-펜타메틸디하이드로-벤조푸란-5-설포닐 (Pbf), 또는 트리틸 (Trt) 그룹으로 직교하여 보호하였다. 커플링은 6:6:3:12:1의 몰비로 아미노산/HCTU/HOBt/DIEA/수지를 사용하여 수행되었다. DMF 중의 20% 피페리딘 및 2.5% 1,8-디아자비사이클로[5.4.0]운데크-7-엔 (DBU)의 용액을 사용하여 각각의 사이클 중에 아미노 말단으로부터 Fmoc를 제거하였다. 탈보호/수지로부터의 분열은2.5% 물/2.5% TIS/5% 애니솔/90% TFA v/v 비의 15mls/0.1mM 수지의 칵테일을 사용하여 3 시간 동안 수행하였다. 상등액을 디에틸-에테르 중에서 침전시키고 (-80 ℃), 3000 rpm에서 10 분 동안 펠릿화하였다. 에테르를 경사시키고, 펠릿을 다시 세척하였다. 그 후, 조 펩타이드를 동결건조시켰다. 분석용 HPLC (XBridge C18 4.5 x 100mm, Waters Corp., Milford, MA) 및 MALDI-TOF 질량분석법(Synapt, Waters Corp., Milford, MA)을 사용하여 서열을 검증하고, 순도를 평가하였다. 모든 시약은 HPLC 등급이었다(EMD Biosciences, San Diego, Ca or Sigma Aldrich, St. Louis, MO). 동결건조된 펩타이드를 100% DMSO(Sigma)에 재현탁시켰다. 43 개의 캠퍼스-1H® 펩타이드를 각각 그룹 당 3 또는 4 개의 펩타이드를 함유하는 11 개의 선형 그룹(표 23: 위부터 아래로, 경쇄 펩타이드는 서열변호: 187-206으로 표시되고, 중쇄 펩타이드는 서열변호: 207-229로 표시된다)과 조합하였다. 42 개의 12G6-SFD1/K12 펩타이드는 각각 그룹 당 5 또는 6 개의 펩타이드를 함유하는 8 개의 선형 그룹(표 24: 위부터 아래로, 경쇄 펩타이드는 서열변호: 230-250으로 표시되고, 중쇄 펩타이드는 서열변호: 251-271로 표시된다)과 조합하였다.
표 23:
표 24:
시험관내
자극
DC 항원 펄싱 (pulsing) 및 성숙: 펩타이드로 처리하기 전에 DCs를 해동시키고, 세척하여 5% 인간 혈청 (HS, Sigma, St. Louis, MO), 1% 페니실린-스트렙토마이신 (Invitrogen, Carlsbad, CA), 100 ng/ml GM-CSF, 및 20 ng/ml IL-4가 보충된 RPMI (Invitrogen, Carlsbad, CA) 내에 플레이팅하였다. DCs는 6-웰 조직 배양 플레이트 내에 4 ml 배지 중의 2 x 105 세포/ml로 플레이팅하고, 37 ℃에서 1 시간 동안 부착하도록 하였다. 세포 부착 후에 10 ㎍/ml(총 40 ㎍)의 각각의 펩타이드를, 각각의 웰에 첨가된 120 ㎍ 또는 160 ㎍의 총 펩타이드 (캠퍼스-1H® 3-펩타이드 또는 4-펩타이드 그룹), 또는 각각의 웰에 첨가된 200 ㎍ 또는 240 ㎍의 총 펩타이드(12G6-SFD1/K12 5-펩타이드 또는 6-펩타이드 그룹)에 관련한 DCs를 함유하는 웰에 첨가하였다. 40 ㎍의 팬(pan)-DR 결합 에피토프 (PADRE)를 DCs의 하나의 웰에 첨가하였으며, 이것은 대부분의 HLA-DR 분자에 결합할 수 있기 대문에 양성 대조군으로 사용하였다[Alexander J, et al.,"Development of high potency universal DR-restricted helper epitopes by modification of high affinity DR-blocking peptides," Immunity, 1:751-761 (1994)]. 마찬가지로, 40 ㎍씩의 3 개의 HLA-DR 결합 파상풍 독소 펩타이드 (DTIMMEPPYCKGLDIYYKA (SEQ ID NO: 183), SAMLTNLIIFGPGPVLNKNEV (SEQ ID NO: 184), 및 NNFTVSFWLRVPKVSASHLE (SEQ ID NO: 185)) 각각을 DCs의 하나의 웰에 첨가하였다. 유사하게, 열 불활성화된 아데노바이러스를 양성 항원 공급원으로 사용하였으며, 1 ㎍/ml로 DCs의 하나의 웰에 첨가하였다. 마지막으로, DCs의 하나의 그룹은 항원으로 펄싱하지 않고 유지시켜 '눌 (null)' 감작 그룹으로 사용하였다. 다양한 항원으로 펄싱된DCs를 적어도 3 시간 동안 37 ℃에서 배양하였다. 그 후, DCs를 50 ng/ml TNF-α, 10 ng/ml IL-6, 25 ng/ml IL-1베타 (Peprotech, Rocky Hill, NJ) 및 500 ng/ml PGE-2 (Sigma Aldrich, St. Louis, MO)를 함유하는 '성숙화 사이토킨 칵테일 (maturating cytokine cocktail)'로 처리하였다. 그 후, 항원 펄싱된 DCs는 37 ℃에서 밤새 성숙시켰다.
공-배양의 정착: 펩타이드 부하 및 성숙 후에 DCs를 PBS로 2 회 세척하고, 10% HS가 보충된 4 ml RPMI를 보충하였다. 자기 유래 CD4+ T 세포를 해동시키고, 10% HS, 페니실린 및 스트렙토마이신이 보충된 RPMI에 2 x 106 세포/ml로 재현탁시켰다. 그 후, DCs를 8 mls 배지 중에서 10:1 T 세포:DC 비(8 x 106 T 세포:8 x 105 DCs)로 천연 CD4+ T 세포와 함께 배양하였다. 그 후, 공-배양물을 37 ℃에서 7일 동안 배양하였다. 공-배양을 개시한지 약 72 시간 후에, 세포를 25 IU 재조합 IL-2(Peprotech, Rocky Hill, NJ)로 보충하고, 그 후 매 3-4일마다 신선한 배지 중의 25 IU 재조합 IL-2로 보충하였다.
공-배양물의 재자극: 7일 (Stim #2) 및 14일(Stim #3)에, 공-배양물을 상기 절차에 따라 재자극하였다.
증식시험: DCs를 상기 언급한 바와 같이 24-웰 저결합 플레이트 상에서 1 ml 배지 내에서 5 x 105 세포/ml로 플레이팅하고, 항원 펄싱하고, 성숙시켜 U-바닥 시험 플레이트에 세포를 옮기기 쉽도록 하였다. 부적절한 HLA_DR 결합 펩타이드인 CS 378-398(펩타이드 서열 DIEKKIAKMEKASSVFNVVNS (SEQ ID NO: 186))을 음성 대조군으로 사용하였다[Alexander J, et al.,"Development of high potency universal DR-restricted helper epitopes by modification of high affinity DR-blocking peptides," Immunity, 1:751-761 (1994)]. 24 시간 DC 성숙 후에, 세포를 빙냉 PBS 세척액을 사용하여 플레이트로부터 분리시켰다. DCs를 1:1 T 세포:DC 비(2.5 x 104 DC/웰)로 항원 자극된 T 세포와 함께 U-바닥 96 웰 플레이트에 플레이팅하였다. 각각의 T 세포 그룹을 감작성 펩타이드(들)로 펄싱된 DC (특이적 반응) 및 무관한 펩타이드로 펄싱된 DC(비특이적 반응)뿐만 아니라 T 세포 단독 및 DC 단독 대조군을 사용하여 3중으로 시험하였다. 시험은 웰당 1 uCi의 트리튬화된 티미딘(Perkin Elmer, Waltham, MA)을 첨가하기 전에 72 시간 동안 진행시켰다. 세포를 96 웰 플레이트 수확기(Perkin Elmer) 상에서 수확하고, 혼입된 트리튬화된 티미딘의 양을 월락 마이크로베타 트리룩스 계수기 (Wallac Microbeta Trilux counter; Perkin Elmer) 상에서 CPM을 측정함으로써 정량화하였다. 자극지수(stimulation index)는 특이적 CPM을 비특이적 CPM으로 나눔으로써 계산하였다.
T 세포 수용체 ( TCR ) V 베타 사용법: 증식시험의 정착 후의 모든 CD4+ T 세포를 T 세포 수용체 V 베타 쇄 발현의 최종적인 측정을 위해서 동결시켰다. 세포를 해동시키고, IO테스트 베타 마크 키트(IOTest Beta Mark Kit)(Beckman Coulter, France)에서 제조자의 지시에 따라 30 분 동안 24 개의 컨주게이트된 V베타 패밀리 구성원을 인식하는 항체로 염색하였다. PBS로 세척하고, 1% 포름알데히드에 재현탁시킨 후에, 세포를 FACS칼리부 (FACScalibur; Becton Dickinson, Franklin Lakes, NJ) 상에서 분석하였다. 검출된 V-베타 쇄 각각을 발현하는 세포의 백분율은 도 102 및 도 103에 요약된 바와 같이 계산되었다.
캠퍼스-1H® (
Campath
-1H®) 면역원성 평가
캠퍼스-1H® 펩타이드의 면역원성 평가는 BioMedSupply (BMS)로부터의 10 개의 정상 공여체로부터의 PBMCs를 사용하여 상술한 바와 같이 수행되었다. 자극지수에 의해서 나타나는 바와 같은 반응의 요약은 표 25A에 제시된다. 각각의 공여체는 한 칼럼에 열거하고, 각각의 열은 CD4+ T 세포를 자극하기 위해서 사용된 펩타이드의 그룹을 열거한다. 자극지수(SI)는 감작성 펩타이드 그룹에 대한 특이적 면역반응을 무관한 반응으로 나눔으로써 결정된다. SI 값 < 2.0은 열거되지 않는다. 표 25A에 요약된 10 개의 공여체 각각에 대한 증식 데이터는 도 104A-J에 보고된다. 6 개의 공여체는 2.0보다 큰 자극지수를 나타내었으며, 결과적으로 '캠퍼스-1H® 반응체(responder)'로 칭하였다. 반응체 중의 하나인 BMS352로부터의 감작된 CD4+ T 세포는 2 가지 상이한 펩타이드 그룹으로 시험하였을 때 특이적 면역반응을 나타내었다. 7번째 공여체인 BMS486도 또한 '반응체'로 분류되었다. 이 공여체에서는 배경의 1.7 배인 자극지수가 경쇄 펩타이드 그룹 986-989에 의해서 기록되었다. 이 공여체 내에서 감작된 T 세포 배양물에서의 V 베타 상향조절을 평가한 경우에, 986-989 개의 감작된 T 세포가 단일 V 베타, Vβ3의 높은 상향조절을 나타낸 것으로 나타났다 (도 102). 단일 V 베타의 상향조절 및 특이적 증식반응은 BMS486이 캠퍼스-1H® 반응체였음을 나타내었다. 3 개의 비-반응성 공여체인 BMS200, BMS154, 및 BMS167은 증식 데이터 또는 V 베타 상향조절을 나타내지 않았으며, 이것은 펩타이드 특이적 면역반응이 일어나지 않았음을 시사한다. 캠퍼스-1H® 데이터는 70% (7/10) 반응체 비율로 정량화되었다. 면역반응을 유발한 펩타이드 그룹의 총수는 8이었다. 이들 8 개의 면역원성 펩타이드 그룹 중의 3 개는 각각의 공여체에서 3.0 또는 그 이상의 자극지수로 강력한 반응을 유발하였다(표 26).
표 25:
실시예
70: 12
G6
-
SFD1
/
K12
에 의해서 유도된
CD4
+ T 세포 반응의 평가
12G6-SFD1/K12의 가변 부위의 면역원성 평가 및 V 베타 분석은 10 개의 정상 공여체로부터의 세포를 사용하여 캠퍼스-1H® 에 대한 실시예 69에 기술된 바와 같이 수행되었다. 표 25B에 요약된 10 개의 공여체 각각에 대한 증식 데이터는 도 105a-J에 보고한다. 이들 10 개의 공여체 중의 2 개는 또한, 상술한 캠퍼스-1H® 평가에서 사용되었으며 (BMS486 및 BMS484), 한편으로 나머지 8 개의 공여체는 단지 12G6-SFD1/K12 펩타이드로 시험하였다. 한 개의 공여체 BMS484는 3 개의 펩타이드 그룹에 대해 반응하였으며, '12G6-SFD1/K12 반응체'로 분류되었다(표 25b). 2 개의 공여체 BMS927 및 BMS928은 각각 펩타이드의 하나의 그룹에 반응하였으며, 따라서 또한 반응체로 분류되었다. 공여체 BMS928은 중쇄 펩타이드 1066, 1067, 1068, 1083, 1084, 및 1085를 함유하는 그룹에 대해서 2.0의 약한 자극지수를 나타내었다. 이 반응은 증식성 T 세포를 V 베타 사용법에 대해서 분석함으로써 확인되었다. 반응성 BMS928 T 세포는 단일 V 베타, Vβ20의 상향조절을 나타내었다(도 103). 공여체 BMS927은 경쇄 펩타이드의 하나의 그룹에 의해서 감작된 T 세포에서 2.5의 자극지수를 나타내었다. 반응성 BMS927 T 세포의 V 베타 분석은 배경을 초과하는 단일 V 베타 상향조절을 나타내지 않았다. 그러나, 이 공여체는 V 베타 키트가 모든 가능한 V 베타 사용법의 단지 70%만을 나타내기 때문에 '반응체' 카테고리에 남겨둔다. 이들 10 개의 공여체에서 면역원성의 12G6-SFD1/K12 비율은 캠퍼스-1H® 반응체의 비율 (70%)의 절반 미만인 30% (3/10)였다. 총 5 개의 펩타이드 그룹이 반응을 유발한 반면에 이들 5 개의 그룹 중의 어떤 것도 3.0보다 큰 자극지수를 제공하지 않았다(표 26).
표 26:
요약
인간화된 항-CD52 모노클로날 항체 12G6-SFD1/K12의 중쇄 및 경쇄 가변 부위에 관련한 펩타이드는 10 개의 공여체로부터 캠퍼스-1H® (Campath-1H®)의 중쇄 및 경쇄 가변 부위로부터의 펩타이드 (70%)보다 더 적은 면역반응 (30%)을 유도하였다. 12G6-SFD1/K12에 의해서 생성된 CD4+ T 세포 기본 면역반응은 또한 캠퍼스-1H® 유도된 반응보다 더 작은 크기였다.
이하의 표는 본 발명에서 사용된 서열 식별번호(sequence identification numbers)를 열거한다.
표 26:
본 발명에서 인용된 모든 특허, 공개된 출원 및 참고문헌의 내용은 온전히 참고로 포함된다.
본 발명은 그의 실시 구체예에 관하여 특별히 나타내고 기술되었지만 형태 및 상세한 내용에 대한 다양한 변화가 첨부된 특허청구범위에 포함된 발명의 범주를 벗어남이 없이 이루어질 수 있다는 것은 본 기술분야에서 숙련된 전문가에 의해서 이해될 수 있을 것이다.
CDR: 상보적 결정 영역
MS: 다발성 경화증
RA: 류마티스성 관절염
MS: 다발성 경화증
RA: 류마티스성 관절염
SEQUENCE LISTING
<110> GENZYME CORPORATION
<120> ANTI-HUMAN CD52 IMMUNOGLOBULINS
<130> 001662-0029-WO1
<140> PCT/US2010/034704
<141> 2010-05-13
<150> 61/177,837
<151> 2009-05-13
<160> 294
<170> PatentIn version 3.5
<210> 1
<211> 107
<212> PRT
<213> Rattus sp.
<400> 1
Asp Ile Lys Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Leu Asn Cys Lys Ala Ser Gln Asn Ile Asp Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Leu Gly Glu Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Thr Asn Asn Leu Gln Thr Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Ile Ser Arg Pro Arg
85 90 95
Thr Phe Gly Thr Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 2
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 2
Asp Val Val Met Thr Gln Thr Pro Leu Ala Leu Ser Val Thr Ile Gly
1 5 10 15
His Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Asp Gly Arg Thr Tyr Leu Asn Trp Leu Phe Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Asn Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 3
<211> 112
<212> PRT
<213> Mus sp.
<400> 3
Asp Ile Val Leu Thr Gln Ser Thr Leu Ser Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Met Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 4
<211> 112
<212> PRT
<213> Mus sp.
<400> 4
Asp Ile Val Ile Thr Gln Ser Thr Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Met Tyr Leu Val Ser Asn Leu Gly Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Val
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Ile
100 105 110
<210> 5
<211> 112
<212> PRT
<213> Mus sp.
<400> 5
Asp Ile Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Phe Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Ala Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 6
<211> 112
<212> PRT
<213> Mus sp.
<400> 6
Asp Ile Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Ser Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 7
<211> 112
<212> PRT
<213> Mus sp.
<400> 7
Asp Ile Val Met Thr Gln Ser Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Asn Leu Asn Ser Gly Leu Pro
50 55 60
Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 8
<211> 112
<212> PRT
<213> Mus sp.
<400> 8
Asp Ile Val Leu Thr Gln Thr Thr Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Arg Thr Tyr Leu Asn Trp Leu Phe Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Phe Leu Val Ser His Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 9
<211> 111
<212> PRT
<213> Mus sp.
<400> 9
Asp Ile Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Val Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Ser His Phe His Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 10
<211> 111
<212> PRT
<213> Mus sp.
<400> 10
Asp Ile Val Leu Thr Gln Thr Pro Arg Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ala Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Tyr Cys Val Gln Gly
85 90 95
Thr Arg Phe His Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 11
<211> 111
<212> PRT
<213> Mus sp.
<400> 11
Asp Ile Val Ile Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Val Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Thr His Leu His Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 12
<211> 112
<212> PRT
<213> Mus sp.
<400> 12
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Thr
20 25 30
Asn Gly Asn Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Met Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ile Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 13
<211> 113
<212> PRT
<213> Mus sp.
<400> 13
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Thr Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Met Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Phe Cys Ser Gln Ser
85 90 95
Ala His Val Pro Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 14
<211> 121
<212> PRT
<213> Rattus sp.
<400> 14
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Thr Asp Phe
20 25 30
Tyr Met Asn Trp Ile Arg Gln Pro Ala Gly Lys Ala Pro Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asp Lys Ala Lys Gly Tyr Thr Thr Glu Tyr Asn Pro
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Gln Asn Met
65 70 75 80
Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala Glu Asp Thr Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly His Thr Ala Ala Pro Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Val Met Val Thr Val Ser Ser
115 120
<210> 15
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 15
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Val Ala Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr Ala Leu Thr Val
100 105 110
Ser Ser
<210> 16
<211> 114
<212> PRT
<213> Mus sp.
<400> 16
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Val Ser Arg Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Ile
35 40 45
Ala Glu Ile Arg Asn Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Arg
65 70 75 80
Val Phe Leu Gln Met Asn Asn Leu Arg Pro Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Ser Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 17
<211> 114
<212> PRT
<213> Mus sp.
<400> 17
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Val Lys Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Thr Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Ser Leu Asp Tyr Trp Gly Gln Gly Thr Ala Leu Thr Val
100 105 110
Ser Ser
<210> 18
<211> 114
<212> PRT
<213> Mus sp.
<400> 18
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Leu Thr
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Arg
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 19
<211> 114
<212> PRT
<213> Mus sp.
<400> 19
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Arg Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Ser Leu Asp Tyr Trp Gly Gln Gly Ser Thr Leu Thr Val
100 105 110
Ser Ser
<210> 20
<211> 114
<212> PRT
<213> Mus sp.
<400> 20
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Lys Lys Val Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Ser Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu Ser Val
100 105 110
Ser Ser
<210> 21
<211> 114
<212> PRT
<213> Mus sp.
<400> 21
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Val Ser Gly Leu Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Ile
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Gly
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly His Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 22
<211> 114
<212> PRT
<213> Mus sp.
<400> 22
Glu Val Gln Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Val Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ala Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus sp.
<400> 23
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Asn Lys Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ser Pro Asp Lys Gly Leu Glu Cys Ile
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 24
<211> 114
<212> PRT
<213> Mus sp.
<400> 24
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 25
<211> 117
<212> PRT
<213> Mus sp.
<400> 25
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Asn Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Tyr Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Ala Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Thr Arg Tyr Ile Phe Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 26
<211> 117
<212> PRT
<213> Mus sp.
<400> 26
Glu Val Gln Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Ala Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Thr Arg Tyr Ile Trp Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 27
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 27
Lys Ala Ser Gln Asn Ile Asp Lys Tyr Leu Asn
1 5 10
<210> 28
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 28
Lys Ser Ser Gln Ser Leu Leu Glu Ser Asp Gly Arg Thr Tyr Leu Asn
1 5 10 15
<210> 29
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 29
Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 30
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 30
Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Arg Thr Tyr Leu Asn
1 5 10 15
<210> 31
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 31
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 32
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 32
Arg Ser Ser Gln Ser Leu Val His Thr Asn Gly Asn Ser Tyr Leu His
1 5 10 15
<210> 33
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 33
Arg Ser Ser Gln Ser Leu Val His Thr Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 34
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 34
Asn Thr Asn Asn Leu Gln Thr
1 5
<210> 35
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 35
Leu Val Ser Asn Leu Asp Ser
1 5
<210> 36
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 36
Leu Val Ser Lys Leu Asp Ser
1 5
<210> 37
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 37
Leu Val Ser Asn Leu Gly Ser
1 5
<210> 38
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 38
Leu Val Ser Ala Leu Asp Ser
1 5
<210> 39
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 39
Leu Val Ser Asn Leu Asn Ser
1 5
<210> 40
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 40
Leu Val Ser His Leu Asp Ser
1 5
<210> 41
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 41
Met Val Ser Asn Arg Phe Ser
1 5
<210> 42
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 42
Leu Gln His Ile Ser Arg Pro Arg Thr
1 5
<210> 43
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 43
Trp Gln Gly Thr His Phe Pro Trp Thr
1 5
<210> 44
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 44
Val Gln Gly Ser His Phe His Thr
1 5
<210> 45
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 45
Val Gln Gly Thr Arg Phe His Thr
1 5
<210> 46
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 46
Val Gln Gly Thr His Leu His Thr
1 5
<210> 47
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 47
Ser Gln Ser Thr His Val Pro Phe Thr
1 5
<210> 48
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 48
Ser Gln Ser Ala His Val Pro Pro Leu Thr
1 5 10
<210> 49
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 49
Gly Phe Thr Phe Thr Asp Phe Tyr Met Asn
1 5 10
<210> 50
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 50
Gly Phe Thr Phe Ser Asp Ala Trp Met Asp
1 5 10
<210> 51
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 51
Arg Phe Thr Phe Ser Asp Ala Trp Met Asp
1 5 10
<210> 52
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 52
Gly Leu Thr Phe Ser Asp Ala Trp Met Asp
1 5 10
<210> 53
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 53
Gly Phe Pro Phe Ser Asn Tyr Trp Met Asn
1 5 10
<210> 54
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 54
Gly Phe Thr Phe Asn Lys Tyr Trp Met Asn
1 5 10
<210> 55
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 55
Gly Phe Thr Phe Asn Thr Tyr Trp Met Asn
1 5 10
<210> 56
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 56
Gly Phe Thr Phe Thr Asp Tyr Tyr Met Ser
1 5 10
<210> 57
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 57
Phe Ile Arg Asp Lys Ala Lys Gly Tyr Thr Thr Glu Tyr Asn Pro Ser
1 5 10 15
Val Lys Gly
<210> 58
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 58
Glu Ile Arg Asn Lys Ala Lys Asn His Val Ala Tyr Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 59
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 59
Glu Ile Arg Asn Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 60
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 60
Glu Ile Arg Asn Lys Ala Lys Asn His Val Lys Tyr Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 61
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 61
Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 62
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 62
Glu Ile Arg Lys Lys Val Asn Asn His Ala Thr Tyr Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 63
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 63
Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 64
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 64
Gln Ile Arg Leu Lys Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 65
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 65
Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Asn Ala Ser
1 5 10 15
Val Lys Gly
<210> 66
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 66
Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala Ser
1 5 10 15
Val Lys Gly
<210> 67
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 67
Ala Arg Glu Gly His Thr Ala Ala Pro Phe Asp Tyr
1 5 10
<210> 68
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 68
Thr Thr Leu Asp Ser
1 5
<210> 69
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 69
Thr Ser Leu Asp Tyr
1 5
<210> 70
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 70
Thr Gly Leu Asp Tyr
1 5
<210> 71
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 71
Thr Pro Ile Asp Tyr
1 5
<210> 72
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 72
Thr Pro Val Asp Phe
1 5
<210> 73
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 73
Thr Arg Tyr Ile Phe Phe Asp Tyr
1 5
<210> 74
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 74
Thr Arg Tyr Ile Trp Phe Asp Tyr
1 5
<210> 75
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 75
atgggcwtca aratgrarwc wcat 24
<210> 76
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 76
gayattgtgm tracmcarkm tcaa 24
<210> 77
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 77
actggatggt gggaagatgg a 21
<210> 78
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 78
gayattgtgm tsacmcarwc tmca 24
<210> 79
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 79
ggatacagtt ggtgcagcat c 21
<210> 80
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 80
atgrasttsk ggytmarctk grtt 24
<210> 81
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 81
atgraatgsa sctgggtywt yctct 25
<210> 82
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 82
saggtsmarc tgcagsagtc t 21
<210> 83
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 83
saggtgmagc tcswrsaryc sggg 24
<210> 84
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 84
tgaggagact gtgagagtgg tgcc 24
<210> 85
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 85
ayctccacac acaggrrcca gtggatagac 30
<210> 86
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<220>
<221> modified_base
<222> (6)..(6)
<223> a, c, t, g, unknown or other
<400> 86
sargtnmagc tgsagsagtc 20
<210> 87
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<220>
<221> modified_base
<222> (6)..(6)
<223> a, c, t, g, unknown or other
<400> 87
sargtnmagc tgsagsagtc wgg 23
<210> 88
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 88
caggttactc tgaaagwgts tg 22
<210> 89
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 89
gaggtccarc tgcaacartc 20
<210> 90
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 90
caggtccaac tvcagcarcc 20
<210> 91
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 91
gaggtgaass tggtggaatc 20
<210> 92
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 92
gatgtgaact tggaagtgtc 20
<210> 93
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 93
atagacagat gggggtgtcg ttttggc 27
<210> 94
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 94
cttgaccagg catcctagag tca 23
<210> 95
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 95
aggggccagt ggatagagtg atgg 24
<210> 96
<211> 100
<212> PRT
<213> Mus sp.
<400> 96
Glu Val Gln Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ala Leu Ser Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Ala Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Thr Arg
100
<210> 97
<211> 100
<212> PRT
<213> Homo sapiens
<400> 97
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Thr Arg Asn Lys Ala Asn Ser Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg
100
<210> 98
<211> 100
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 98
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg
100
<210> 99
<211> 100
<212> PRT
<213> Mus sp.
<400> 99
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Thr Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Met Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Phe Cys Ser Gln Ser
85 90 95
Ala His Val Pro
100
<210> 100
<211> 100
<212> PRT
<213> Homo sapiens
<400> 100
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Glu Val Ser Ser Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Ile His Leu Pro
100
<210> 101
<211> 100
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 101
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Met Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Ala His Val Pro
100
<210> 102
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 102
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Met Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Ala His Val Pro Pro Leu Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
100 105 110
Lys
<210> 103
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 103
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Tyr Ile Trp Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 104
<211> 12
<212> PRT
<213> Homo sapiens
<400> 104
Gly Gln Asn Asp Thr Ser Gln Thr Ser Ser Pro Ser
1 5 10
<210> 105
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 105
Ala Gln Asn Asp Thr Ser Gln Thr Ser Ser Pro Ser
1 5 10
<210> 106
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 106
Gly Ala Asn Asp Thr Ser Gln Thr Ser Ser Pro Ser
1 5 10
<210> 107
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 107
Gly Gln Ala Asp Thr Ser Gln Thr Ser Ser Pro Ser
1 5 10
<210> 108
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 108
Gly Gln Asn Ala Thr Ser Gln Thr Ser Ser Pro Ser
1 5 10
<210> 109
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 109
Gly Gln Asn Asp Ala Ser Gln Thr Ser Ser Pro Ser
1 5 10
<210> 110
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 110
Gly Gln Asn Asp Thr Ala Gln Thr Ser Ser Pro Ser
1 5 10
<210> 111
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 111
Gly Gln Asn Asp Thr Ser Ala Thr Ser Ser Pro Ser
1 5 10
<210> 112
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 112
Gly Gln Asn Asp Thr Ser Gln Ala Ser Ser Pro Ser
1 5 10
<210> 113
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 113
Gly Gln Asn Asp Thr Ser Gln Thr Ala Ser Pro Ser
1 5 10
<210> 114
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 114
Gly Gln Asn Asp Thr Ser Gln Thr Ser Ala Pro Ser
1 5 10
<210> 115
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys or Arg
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Leu, Val or Ile
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Ser or Thr
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Asn or Asp
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Ser or Thr
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Any amino acid
<400> 115
Xaa Ser Ser Gln Ser Leu Xaa Xaa Xaa Xaa Gly Xaa Xaa Tyr Leu Xaa
1 5 10 15
<210> 116
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys or Arg
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Leu, Val or Ile
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Ser or Thr
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Ser or Thr
<400> 116
Xaa Ser Ser Gln Ser Leu Xaa His Xaa Asn Gly Xaa Xaa Tyr Leu His
1 5 10 15
<210> 117
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Ser or Thr
<400> 117
Arg Ser Ser Gln Ser Leu Val His Thr Asn Gly Asn Xaa Tyr Leu His
1 5 10 15
<210> 118
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (4)..(6)
<223> Any amino acid
<400> 118
Xaa Val Ser Xaa Xaa Xaa Ser
1 5
<210> 119
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Any amino acid
<400> 119
Xaa Val Ser Xaa Arg Xaa Ser
1 5
<210> 120
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<400> 120
Met Val Ser Xaa Arg Phe Ser
1 5
<210> 121
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (5)..(5)
<223> His, Arg or Lys
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Phe, Leu, Val or Ile
<220>
<221> MOD_RES
<222> (7)..(8)
<223> Any amino acid
<400> 121
Xaa Gln Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 122
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (5)..(5)
<223> His, Arg or Lys
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Phe, Leu, Val or Ile
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Any amino acid
<400> 122
Ser Gln Ser Xaa Xaa Xaa Pro Xaa
1 5
<210> 123
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Phe or Pro
<400> 123
Ser Gln Ser Xaa His Val Pro Xaa
1 5
<210> 124
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (5)..(6)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Trp or Tyr
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Any amino acid
<400> 124
Gly Phe Xaa Phe Xaa Xaa Tyr Xaa Met Xaa
1 5 10
<210> 125
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (5)..(6)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Trp or Tyr
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Any amino acid
<400> 125
Gly Phe Thr Phe Xaa Xaa Tyr Xaa Met Xaa
1 5 10
<210> 126
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Trp or Tyr
<400> 126
Gly Phe Thr Phe Thr Asp Tyr Xaa Met Ser
1 5 10
<210> 127
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (14)..(15)
<223> Any amino acid
<400> 127
Xaa Ile Arg Xaa Lys Xaa Asx Xaa Tyr Xaa Thr Xaa Tyr Xaa Xaa Ser
1 5 10 15
Val Lys Gly
<210> 128
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (14)..(15)
<223> Any amino acid
<400> 128
Xaa Ile Arg Xaa Lys Xaa Asn Xaa Tyr Thr Thr Glu Tyr Xaa Xaa Ser
1 5 10 15
Val Lys Gly
<210> 129
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (14)..(15)
<223> Any amino acid
<400> 129
Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Xaa Xaa Ser
1 5 10 15
Val Lys Gly
<210> 130
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (2)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Tyr, Phe or Trp
<400> 130
Thr Xaa Xaa Xaa Xaa
1 5
<210> 131
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (4)..(4)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Tyr, Phe or Trp
<400> 131
Thr Arg Tyr Xaa Xaa Phe Asp Tyr
1 5
<210> 132
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Phe or Trp
<400> 132
Thr Arg Tyr Ile Xaa Phe Asp Tyr
1 5
<210> 133
<211> 11
<212> PRT
<213> Homo sapiens
<400> 133
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
1 5 10
<210> 134
<211> 10
<212> PRT
<213> Homo sapiens
<400> 134
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 135
<211> 10
<212> PRT
<213> Homo sapiens
<400> 135
Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
1 5 10
<210> 136
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 136
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Asn Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg Tyr Ile Phe Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 137
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 137
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Glu Tyr Asn Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Tyr Ile Phe Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 138
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 138
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Thr
20 25 30
Asn Gly Asn Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Met Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 139
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 139
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 140
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 140
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 141
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 141
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 142
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 142
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 143
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 143
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 144
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 144
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Met Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 145
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 145
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Thr His Leu His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 146
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 146
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Thr His Leu His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 147
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 147
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Thr His Leu His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 148
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 148
Asp Ile Val Ile Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Val Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Thr His Leu His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 149
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 149
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 150
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 150
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 151
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 151
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 152
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 152
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 153
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 153
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Ser His Phe His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 154
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 154
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Val Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Ser His Phe His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 155
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 155
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Val Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Ser His Phe His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 156
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 156
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Val Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Ser His Phe His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 157
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 157
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly
85 90 95
Ser His Phe His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 158
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 158
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Thr Thr Val Thr Val Ser
100 105 110
Ser
<210> 159
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 159
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Thr
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 160
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 160
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Thr
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 161
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 161
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ser Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 162
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 162
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Thr
35 40 45
Ser Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 163
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 163
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 164
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 164
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Ala Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 165
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 165
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Ala Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 166
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 166
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Ala Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 167
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 167
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Ala Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 168
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 168
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Ala Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 169
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 169
Ala Gln Asn Asp Thr Ser Gln Thr Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 170
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 170
Gly Ala Asn Asp Thr Ser Gln Thr Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 171
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 171
Gly Gln Ala Asp Thr Ser Gln Thr Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 172
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 172
Gly Gln Asn Ala Thr Ser Gln Thr Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 173
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 173
Gly Gln Asn Asp Ala Ser Gln Thr Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 174
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 174
Gly Gln Asn Asp Thr Ala Gln Thr Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 175
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 175
Gly Gln Asn Asp Thr Ser Ala Thr Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 176
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 176
Gly Gln Asn Asp Thr Ser Gln Ala Ser Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 177
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 177
Gly Gln Asn Asp Thr Ser Gln Thr Ala Ser Pro Ser Ala Asp Cys
1 5 10 15
<210> 178
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 178
Gly Gln Asn Asp Thr Ser Gln Thr Ser Ala Pro Ser Ala Asp Cys
1 5 10 15
<210> 179
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 179
Gly Gln Asn Asp Thr Ser Gln Thr Ser Ser Ala Ser Ala Asp Cys
1 5 10 15
<210> 180
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 180
Gly Gln Asn Asp Thr Ser Gln Thr Ser Ser Pro Ala Ala Asp Cys
1 5 10 15
<210> 181
<211> 15
<212> PRT
<213> Homo sapiens
<400> 181
Gly Gln Asn Asp Thr Ser Gln Thr Ser Ser Ala Ser Ala Asp Cys
1 5 10 15
<210> 182
<211> 15
<212> PRT
<213> Homo sapiens
<400> 182
Gly Gln Asn Asp Thr Ser Gln Thr Ser Ser Pro Ala Ala Asp Cys
1 5 10 15
<210> 183
<211> 19
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Tetanus toxoid peptide
<400> 183
Asp Thr Ile Met Met Glu Pro Pro Tyr Cys Lys Gly Leu Asp Ile Tyr
1 5 10 15
Tyr Lys Ala
<210> 184
<211> 21
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Tetanus toxoid peptide
<400> 184
Ser Ala Met Leu Thr Asn Leu Ile Ile Phe Gly Pro Gly Pro Val Leu
1 5 10 15
Asn Lys Asn Glu Val
20
<210> 185
<211> 20
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Tetanus toxoid peptide
<400> 185
Asn Asn Phe Thr Val Ser Phe Trp Leu Arg Val Pro Lys Val Ser Ala
1 5 10 15
Ser His Leu Glu
20
<210> 186
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 186
Asp Ile Glu Lys Lys Ile Ala Lys Met Glu Lys Ala Ser Ser Val Phe
1 5 10 15
Asn Val Val Asn Ser
20
<210> 187
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 187
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
<210> 188
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 188
Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
1 5 10 15
<210> 189
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 189
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala
1 5 10 15
<210> 190
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 190
Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Ile Asp
1 5 10 15
<210> 191
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 191
Ile Thr Cys Lys Ala Ser Gln Asn Ile Asp Lys Tyr Leu Asn Trp
1 5 10 15
<210> 192
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 192
Ser Gln Asn Ile Asp Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro
1 5 10 15
<210> 193
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 193
Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
1 5 10 15
<210> 194
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 194
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Asn
1 5 10 15
<210> 195
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 195
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Asn Thr Asn Asn Leu Gln
1 5 10 15
<210> 196
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 196
Leu Leu Ile Tyr Asn Thr Asn Asn Leu Gln Thr Gly Val Pro Ser
1 5 10 15
<210> 197
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 197
Thr Asn Asn Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly Ser
1 5 10 15
<210> 198
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 198
Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
1 5 10 15
<210> 199
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 199
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
1 5 10 15
<210> 200
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 200
Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
1 5 10 15
<210> 201
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 201
Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr
1 5 10 15
<210> 202
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 202
Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln
1 5 10 15
<210> 203
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 203
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln His Ile Ser Arg Pro
1 5 10 15
<210> 204
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 204
Tyr Tyr Cys Leu Gln His Ile Ser Arg Pro Arg Thr Phe Gly Gln
1 5 10 15
<210> 205
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 205
His Ile Ser Arg Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu
1 5 10 15
<210> 206
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 206
Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val
1 5 10 15
<210> 207
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 207
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser
1 5 10 15
<210> 208
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 208
Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln Thr Leu Ser Leu
1 5 10 15
<210> 209
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 209
Leu Val Arg Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Ser
1 5 10 15
<210> 210
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 210
Gln Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Thr Phe Thr
1 5 10 15
<210> 211
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 211
Thr Cys Thr Val Ser Gly Phe Thr Phe Thr Asp Phe Tyr Met Asn
1 5 10 15
<210> 212
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 212
Gly Phe Thr Phe Thr Asp Phe Tyr Met Asn Trp Val Arg Gln Pro
1 5 10 15
<210> 213
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 213
Asp Phe Tyr Met Asn Trp Val Arg Gln Pro Pro Gly Arg Gly Leu
1 5 10 15
<210> 214
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 214
Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp Ile Gly Phe
1 5 10 15
<210> 215
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 215
Pro Gly Arg Gly Leu Glu Trp Ile Gly Phe Ile Arg Asp Lys Ala
1 5 10 15
<210> 216
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 216
Glu Trp Ile Gly Phe Ile Arg Asp Lys Ala Lys Gly Tyr Thr Thr
1 5 10 15
<210> 217
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 217
Ile Arg Asp Lys Ala Lys Gly Tyr Thr Thr Glu Tyr Asn Pro Ser
1 5 10 15
<210> 218
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 218
Lys Gly Tyr Thr Thr Glu Tyr Asn Pro Ser Val Lys Gly Arg Val
1 5 10 15
<210> 219
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 219
Glu Tyr Asn Pro Ser Val Lys Gly Arg Val Thr Met Leu Val Asp
1 5 10 15
<210> 220
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 220
Val Lys Gly Arg Val Thr Met Leu Val Asp Thr Ser Lys Asn Gln
1 5 10 15
<210> 221
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 221
Thr Met Leu Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Arg Leu
1 5 10 15
<210> 222
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 222
Thr Ser Lys Asn Gln Phe Ser Leu Arg Leu Ser Ser Val Thr Ala
1 5 10 15
<210> 223
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 223
Phe Ser Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
1 5 10 15
<210> 224
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 224
Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg
1 5 10 15
<210> 225
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 225
Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Glu Gly His Thr Ala
1 5 10 15
<210> 226
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 226
Tyr Tyr Cys Ala Arg Glu Gly His Thr Ala Ala Pro Phe Asp Tyr
1 5 10 15
<210> 227
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 227
Glu Gly His Thr Ala Ala Pro Phe Asp Tyr Trp Gly Gln Gly Ser
1 5 10 15
<210> 228
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 228
Ala Pro Phe Asp Tyr Trp Gly Gln Gly Ser Leu Val Thr Val Ser
1 5 10 15
<210> 229
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 229
Trp Gly Gln Gly Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys
1 5 10 15
<210> 230
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 230
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro
1 5 10 15
<210> 231
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 231
Gln Thr Pro Leu Ser Leu Val Thr Pro Gly Gln Pro Ala Ser
1 5 10
<210> 232
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 232
Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser
1 5 10 15
<210> 233
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 233
Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu
1 5 10 15
<210> 234
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 234
Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Lys
1 5 10 15
<210> 235
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 235
Ser Gln Ser Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn Trp
1 5 10 15
<210> 236
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 236
Tyr Ser Asn Gly Lys Thr Tyr Leu Asn Trp Val Leu Gln Lys Pro
1 5 10 15
<210> 237
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 237
Thr Tyr Leu Asn Trp Val Leu Gln Lys Pro Gly Gln Ser Pro Gln
1 5 10 15
<210> 238
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 238
Val Leu Gln Lys Pro Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu
1 5 10 15
<210> 239
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 239
Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp
1 5 10 15
<210> 240
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 240
Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro Asp
1 5 10 15
<210> 241
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 241
Val Ser Lys Leu Asp Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
1 5 10 15
<210> 242
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 242
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
1 5 10 15
<210> 243
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 243
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
1 5 10 15
<210> 244
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 244
Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
1 5 10 15
<210> 245
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 245
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
1 5 10 15
<210> 246
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 246
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Val Gln
1 5 10 15
<210> 247
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 247
Glu Asp Val Gly Val Tyr Tyr Cys Val Gln Gly Ser His Phe His
1 5 10 15
<210> 248
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 248
Tyr Tyr Cys Val Gln Gly Ser His Phe His Thr Phe Gly Gln Gly
1 5 10 15
<210> 249
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 249
Gly Ser His Phe His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
1 5 10 15
<210> 250
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 250
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala
1 5 10 15
<210> 251
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 251
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
<210> 252
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 252
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu
1 5 10 15
<210> 253
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 253
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser
1 5 10 15
<210> 254
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 254
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser
1 5 10 15
<210> 255
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 255
Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser Asn Tyr Trp Met Asn
1 5 10 15
<210> 256
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 256
Gly Phe Pro Phe Ser Asn Tyr Trp Met Asn Trp Val Arg Gln Ala
1 5 10 15
<210> 257
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 257
Asn Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
1 5 10 15
<210> 258
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 258
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Gln
1 5 10 15
<210> 259
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 259
Pro Gly Lys Gly Leu Glu Trp Val Gly Gln Ile Arg Leu Lys Ser
1 5 10 15
<210> 260
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 260
Glu Trp Val Gly Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr
1 5 10 15
<210> 261
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 261
Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr His Tyr Ala Glu Ser
1 5 10 15
<210> 262
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 262
Asn Asn Tyr Ala Thr His Tyr Ala Glu Ser Val Lys Gly Arg Phe
1 5 10 15
<210> 263
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 263
His Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
1 5 10 15
<210> 264
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 264
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
1 5 10 15
<210> 265
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 265
Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met
1 5 10 15
<210> 266
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 266
Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
1 5 10 15
<210> 267
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 267
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val
1 5 10 15
<210> 268
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 268
Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Thr Pro
1 5 10 15
<210> 269
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 269
Glu Asp Thr Ala Val Tyr Tyr Cys Thr Pro Ile Asp Tyr Trp Gly
1 5 10 15
<210> 270
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 270
Tyr Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr Thr Val
1 5 10 15
<210> 271
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 271
Ile Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
1 5 10 15
<210> 272
<211> 464
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 272
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
20 25 30
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
35 40 45
Phe Asn Thr Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
50 55 60
Leu Glu Trp Val Gly Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr
65 70 75 80
His Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp
85 90 95
Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Thr Pro Val Asp Phe Trp Gly Gln Gly Thr
115 120 125
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
130 135 140
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
145 150 155 160
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
165 170 175
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
180 185 190
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
195 200 205
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
210 215 220
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
225 230 235 240
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
245 250 255
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
260 265 270
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
275 280 285
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
290 295 300
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
305 310 315 320
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
325 330 335
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
340 345 350
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
355 360 365
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
370 375 380
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
385 390 395 400
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
405 410 415
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
420 425 430
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
435 440 445
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 273
<211> 238
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 273
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser
20 25 30
Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Val Gln Gly Thr His Leu His Thr Phe Gly Gln Gly Thr Arg Leu
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 274
<211> 467
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 274
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
20 25 30
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
35 40 45
Phe Thr Asp Tyr Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
50 55 60
Leu Glu Trp Val Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr
65 70 75 80
Glu Tyr Asn Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp
85 90 95
Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Thr Arg Tyr Ile Phe Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 275
<211> 239
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 275
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser
20 25 30
Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
35 40 45
Leu Val His Thr Asn Gly Asn Ser Tyr Leu His Trp Tyr Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Met Val Ser Asn Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Ser Gln Ser Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys
115 120 125
Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
130 135 140
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
145 150 155 160
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
165 170 175
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
195 200 205
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
210 215 220
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 276
<211> 464
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 276
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val
20 25 30
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
35 40 45
Phe Ser Asp Ala Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly
50 55 60
Leu Glu Leu Val Ser Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr
65 70 75 80
Tyr Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
85 90 95
Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr
115 120 125
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
130 135 140
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
145 150 155 160
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
165 170 175
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
180 185 190
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
195 200 205
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
210 215 220
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
225 230 235 240
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
245 250 255
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
260 265 270
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
275 280 285
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
290 295 300
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
305 310 315 320
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
325 330 335
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
340 345 350
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
355 360 365
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
370 375 380
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
385 390 395 400
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
405 410 415
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
420 425 430
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
435 440 445
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 277
<211> 464
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 277
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val
20 25 30
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
35 40 45
Phe Ser Asp Ala Trp Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly
50 55 60
Leu Glu Leu Val Ala Glu Ile Arg Asn Lys Ala Lys Asn His Ala Thr
65 70 75 80
Tyr Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
85 90 95
Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Thr Thr Leu Asp Ser Trp Gly Gln Gly Thr
115 120 125
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
130 135 140
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
145 150 155 160
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
165 170 175
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
180 185 190
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
195 200 205
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
210 215 220
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
225 230 235 240
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
245 250 255
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
260 265 270
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
275 280 285
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
290 295 300
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
305 310 315 320
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
325 330 335
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
340 345 350
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
355 360 365
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
370 375 380
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
385 390 395 400
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
405 410 415
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
420 425 430
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
435 440 445
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 278
<211> 239
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 278
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser
20 25 30
Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu Val Ser Ala Leu Asp
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Trp Gln Gly Thr His Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys
115 120 125
Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
130 135 140
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
145 150 155 160
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
165 170 175
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
195 200 205
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
210 215 220
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 279
<211> 464
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 279
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
20 25 30
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro
35 40 45
Phe Ser Asn Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
50 55 60
Leu Glu Trp Val Gly Gln Ile Arg Leu Lys Ser Asn Asn Tyr Ala Thr
65 70 75 80
His Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp
85 90 95
Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Thr Pro Ile Asp Tyr Trp Gly Gln Gly Thr
115 120 125
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
130 135 140
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
145 150 155 160
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
165 170 175
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
180 185 190
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
195 200 205
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
210 215 220
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
225 230 235 240
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
245 250 255
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
260 265 270
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
275 280 285
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
290 295 300
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
305 310 315 320
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
325 330 335
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
340 345 350
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
355 360 365
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
370 375 380
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
385 390 395 400
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
405 410 415
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
420 425 430
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
435 440 445
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 280
<211> 238
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 280
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser
20 25 30
Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn Trp Val Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Val Gln Gly Ser His Phe His Thr Phe Gly Gln Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 281
<211> 467
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 281
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
20 25 30
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
35 40 45
Phe Ser Asp Tyr Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
50 55 60
Leu Glu Trp Val Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr
65 70 75 80
Glu Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp
85 90 95
Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Tyr Ile Trp Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 282
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 282
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser
20 25 30
Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
35 40 45
Leu Val His Thr Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Met Val Ser Asn Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Ser Gln Ser Ala His Val Pro Pro Leu Thr Phe Gly Gln Gly Thr
115 120 125
Arg Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
<210> 283
<211> 1395
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 283
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gaggtacagc tggtggagtc gggaggaggc ttggtacagc ctgggggttc tctgagactc 120
tcctgtgcag cttctggatt cactttcaat acctactgga tgaactgggt ccgccaggct 180
ccagggaagg gacttgagtg ggtgggtcaa attagattga aatctaataa ttatgcaaca 240
cattatgcgg agtctgtgaa agggcggttc accatctcca gagatgattc caaaaacagc 300
ctctatcttc aaatgaattc cctgaaaact gaagacactg ccgtttatta ctgtacccca 360
gttgactttt ggggccaagg caccactgtc acagtctcct cagcctccac caagggccca 420
tcggtcttcc ccctggcacc ctcctccaag agcacctctg ggggtacagc ggccctgggc 480
tgcctggtca aggactactt ccccgaaccg gtgacggtgt cgtggaactc aggcgccctg 540
accagcggcg tgcacacctt cccggctgtc ctacagtcct caggactcta ctccctcagc 600
agcgtggtga ccgtgccctc cagcagcttg ggcacccaga cctacatctg caacgtgaat 660
cacaagccca gcaacaccaa ggtggacaag aaagttgagc ccaaatcttg tgacaaaact 720
cacacatgcc caccgtgccc agcacctgaa ctcctggggg gaccgtcagt cttcctcttc 780
cccccaaaac ccaaggacac cctcatgatc tcccggaccc ctgaggtcac atgcgtggtg 840
gtggacgtga gccacgaaga ccctgaggtc aagttcaact ggtacgtgga cggcgtggag 900
gtgcataatg ccaagacaaa gccgcgggag gagcagtaca acagcacgta ccgtgtggtc 960
agcgtcctca ccgtcctgca ccaggactgg ctgaatggca aggagtacaa gtgcaaggtc 1020
tccaacaaag ccctcccagc ccccatcgag aaaaccatct ccaaagccaa agggcagccc 1080
cgagaaccac aggtgtacac cctgccccca tcccgggatg agctgaccaa gaaccaggtc 1140
agcctgacat gcctggtcaa aggcttctat cccagcgaca tcgccgtgga gtgggagagc 1200
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1260
ttcttcctct acagcaagct caccgtggac aagtccaggt ggcagcaggg gaacgtcttc 1320
tcatgctccg tgatgcatga ggctctgcac aaccactaca cgcagaagag cctctccctg 1380
tctccgggta aatga 1395
<210> 284
<211> 717
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 284
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gacattgtga tgacccagac tccactcagt ttgtcagtta cccctggaca accagcctca 120
atctcttgca agtcaagtca gagcctctta tatagtaatg gaaaaaccta tttgaactgg 180
ttattacaga agccaggcca gtctccacag cgcctaatct atctggtgtc taaattggac 240
tctggagtcc ctgacaggtt cagtggcagt ggatcaggaa cagattttac actgaaaatc 300
agcagagtgg aggctgagga tgtgggagtt tattactgcg tgcaaggtac acatctgcac 360
acgttcggtc aagggaccag gctggagata aaacgaactg tggcagcacc aagcgtcttc 420
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 480
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 540
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 600
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 660
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttag 717
<210> 285
<211> 1404
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 285
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gaggtacagc tggtggagtc gggaggaggc ttggtacagc ctgggggttc tctgagactc 120
tcctgtgcag cttctggctt cacattcacc gactattaca tgagctgggt ccgccaggct 180
ccagggaagg gacttgagtg ggtgggtttc ataaggaaca aggctaacgg ttatacaacc 240
gagtacaacg cttccgttaa aggccggttc accatctcca gagatgattc caaaaacagc 300
ctctatcttc aaatgaattc cctgaaaact gaagacactg ccgtttatta ctgtaccagg 360
tatatctttt tcgattactg gggccaaggc accactgtca cagtctcctc agcctccacc 420
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggtacagcg 480
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 540
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 600
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc 660
aacgtgaatc acaagcccag caacaccaag gtggacaaga aagttgagcc caaatcttgt 720
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 780
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 840
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 900
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 960
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 1020
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 1080
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggatga gctgaccaag 1140
aaccaggtca gcctgacatg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 1200
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1260
gacggctcct tcttcctcta cagcaagctc accgtggaca agtccaggtg gcagcagggg 1320
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1380
ctctccctgt ctccgggtaa atga 1404
<210> 286
<211> 720
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 286
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gatattgtaa tgacccaaac acccctctct ctttcagtca cacctggaca gccagcgtcc 120
atctcctgca ggtcctcaca gagtctcgtg cacaccaatg gcaattccta cctgcattgg 180
tacctgcaga agcccgggca gagcccccag ttgctgatct atatggtgtc taatcggttc 240
tccggagtcc ccgacagatt ttctggttca gggtctggaa ctgattttac actgaagatt 300
agtcgggtcg aggccgagga tgtaggcgtg tattactgct cacaaagcac acatgtgccg 360
ttcactttcg gccaaggaac aaagctcgaa atcaagcgaa ctgtggcagc accaagcgtc 420
ttcatcttcc cgccatctga tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg 480
ctgaataact tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 540
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac ctacagcctc 600
agcagcaccc tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 660
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg agagtgttag 720
<210> 287
<211> 1395
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<220>
<221> modified_base
<222> (1398)..(1398)
<223> a, c, t, g, unknown or other
<400> 287
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gaggtacagc ttcttgaaag tggaggtggc cttgtccaac ccggagggtc attgcggttg 120
agctgtgcgg caagtggctt caccttctct gacgcttgga tggactgggt gagacaagcc 180
cccggtaagg gactggagtt ggtttctgaa atcaggaaca aggccaagaa ccatgcaaca 240
tattatgccg aaagtgtgaa gggaaggttc acaatcagta gagataacag caagaacaca 300
ctgtacctcc agatgaacag cctcagagct gaggacaccg ccgtctatta ttgtaccact 360
ctcgattcat gggggcaggg taccaccgtt acagtcagca gcgcctccac caagggccca 420
tcggtcttcc ccctggcacc ctcctccaag agcacctctg ggggtacagc ggccctgggc 480
tgcctggtca aggactactt ccccgaaccg gtgacggtgt cgtggaactc aggcgccctg 540
accagcggcg tgcacacctt cccggctgtc ctacagtcct caggactcta ctccctcagc 600
agcgtggtga ccgtgccctc cagcagcttg ggcacccaga cctacatctg caacgtgaat 660
cacaagccca gcaacaccaa ggtggacaag aaagttgagc ccaaatcttg tgacaaaact 720
cacacatgcc caccgtgccc agcacctgaa ctcctggggg gaccgtcagt cttcctcttc 780
cccccaaaac ccaaggacac cctcatgatc tcccggaccc ctgaggtcac atgcgtggtg 840
gtggacgtga gccacgaaga ccctgaggtc aagttcaact ggtacgtgga cggcgtggag 900
gtgcataatg ccaagacaaa gccgcgggag gagcagtaca acagcacgta ccgtgtggtc 960
agcgtcctca ccgtcctgca ccaggactgg ctgaatggca aggagtacaa gtgcaaggtc 1020
tccaacaaag ccctcccagc ccccatcgag aaaaccatct ccaaagccaa agggcagccc 1080
cgagaaccac aggtgtacac cctgccccca tcccgggatg agctgaccaa gaaccaggtc 1140
agcctgacat gcctggtcaa aggcttctat cccagcgaca tcgccgtgga gtgggagagc 1200
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1260
ttcttcctct acagcaagct caccgtggac aagtccaggt ggcagcaggg gaacgtcttc 1320
tcatgctccg tgatgcatga ggctctgcac aaccactaca cgcagaagag cctctccctg 1380
tctccgggta aatga 1395
<210> 288
<211> 1395
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<220>
<221> modified_base
<222> (1398)..(1398)
<223> a, c, t, g, unknown or other
<400> 288
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gaggtacagc ttcttgaaag tggaggtggc cttgtccaac ccggagggtc attgcggttg 120
agctgtgcgg caagtggctt caccttctct gacgcttgga tggactgggt gagacaagcc 180
cccggtaagg gactggagtt ggttgctgaa atcaggaaca aggccaagaa ccatgcaaca 240
tattatgccg aaagtgtgaa gggaaggttc acaatcagta gagataacag caagaacaca 300
ctgtacctcc agatgaacag cctcagagct gaggacaccg ccgtctatta ttgtaccact 360
ctcgattcat gggggcaggg taccaccgtt acagtcagca gcgcctccac caagggccca 420
tcggtcttcc ccctggcacc ctcctccaag agcacctctg ggggtacagc ggccctgggc 480
tgcctggtca aggactactt ccccgaaccg gtgacggtgt cgtggaactc aggcgccctg 540
accagcggcg tgcacacctt cccggctgtc ctacagtcct caggactcta ctccctcagc 600
agcgtggtga ccgtgccctc cagcagcttg ggcacccaga cctacatctg caacgtgaat 660
cacaagccca gcaacaccaa ggtggacaag aaagttgagc ccaaatcttg tgacaaaact 720
cacacatgcc caccgtgccc agcacctgaa ctcctggggg gaccgtcagt cttcctcttc 780
cccccaaaac ccaaggacac cctcatgatc tcccggaccc ctgaggtcac atgcgtggtg 840
gtggacgtga gccacgaaga ccctgaggtc aagttcaact ggtacgtgga cggcgtggag 900
gtgcataatg ccaagacaaa gccgcgggag gagcagtaca acagcacgta ccgtgtggtc 960
agcgtcctca ccgtcctgca ccaggactgg ctgaatggca aggagtacaa gtgcaaggtc 1020
tccaacaaag ccctcccagc ccccatcgag aaaaccatct ccaaagccaa agggcagccc 1080
cgagaaccac aggtgtacac cctgccccca tcccgggatg agctgaccaa gaaccaggtc 1140
agcctgacat gcctggtcaa aggcttctat cccagcgaca tcgccgtgga gtgggagagc 1200
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1260
ttcttcctct acagcaagct caccgtggac aagtccaggt ggcagcaggg gaacgtcttc 1320
tcatgctccg tgatgcatga ggctctgcac aaccactaca cgcagaagag cctctccctg 1380
tctccgggta aatga 1395
<210> 289
<211> 720
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 289
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gatatcgtga tgacacaaac tcccctgtct ctgtctgtaa ctccaggtca gcccgcgagt 120
atttcatgta agagcagcca atccctgctg gacagcgacg ggaagaccta cctgaactgg 180
ttactccaaa agccaggaca aagtccccaa cgccttattt acctggtgtc agccctggac 240
tctggcgtgc ccgatcgatt tagcggcagc gggagtggca cagatttcac cctgaaaata 300
tcccgcgtcg aggccgaaga tgtgggcgtg tactactgct ggcagggcac acatttcccc 360
tggacatttg gtcaggggac aaagctggaa attaaacgaa ctgtggcagc accaagcgtc 420
ttcatcttcc cgccatctga tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg 480
ctgaataact tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 540
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac ctacagcctc 600
agcagcaccc tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 660
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg agagtgttag 720
<210> 290
<211> 1395
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 290
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gaggtacagc tggtggagtc gggaggaggc ttggtacagc ctgggggttc tctgagactc 120
tcctgtgcag cttctggatt cccattcagt aactactgga tgaactgggt ccgccaggct 180
ccagggaagg gacttgagtg ggtgggtcaa attagattga aatctaataa ttatgcaaca 240
cattatgcgg agtctgtgaa agggcggttc accatctcca gagatgattc caaaaacagc 300
ctctatcttc aaatgaattc cctgaaaact gaagacactg ccgtttatta ctgtacccca 360
attgactatt ggggccaagg caccactgtc acagtctcct cagcctccac caagggccca 420
tcggtcttcc ccctggcacc ctcctccaag agcacctctg ggggtacagc ggccctgggc 480
tgcctggtca aggactactt ccccgaaccg gtgacggtgt cgtggaactc aggcgccctg 540
accagcggcg tgcacacctt cccggctgtc ctacagtcct caggactcta ctccctcagc 600
agcgtggtga ccgtgccctc cagcagcttg ggcacccaga cctacatctg caacgtgaat 660
cacaagccca gcaacaccaa ggtggacaag aaagttgagc ccaaatcttg tgacaaaact 720
cacacatgcc caccgtgccc agcacctgaa ctcctggggg gaccgtcagt cttcctcttc 780
cccccaaaac ccaaggacac cctcatgatc tcccggaccc ctgaggtcac atgcgtggtg 840
gtggacgtga gccacgaaga ccctgaggtc aagttcaact ggtacgtgga cggcgtggag 900
gtgcataatg ccaagacaaa gccgcgggag gagcagtaca acagcacgta ccgtgtggtc 960
agcgtcctca ccgtcctgca ccaggactgg ctgaatggca aggagtacaa gtgcaaggtc 1020
tccaacaaag ccctcccagc ccccatcgag aaaaccatct ccaaagccaa agggcagccc 1080
cgagaaccac aggtgtacac cctgccccca tcccgggatg agctgaccaa gaaccaggtc 1140
agcctgacat gcctggtcaa aggcttctat cccagcgaca tcgccgtgga gtgggagagc 1200
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1260
ttcttcctct acagcaagct caccgtggac aagtccaggt ggcagcaggg gaacgtcttc 1320
tcatgctccg tgatgcatga ggctctgcac aaccactaca cgcagaagag cctctccctg 1380
tctccgggta aatga 1395
<210> 291
<211> 717
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 291
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gacattgtga tgacccagac tccactcagt ttgtcagtta cccctgggca accagcctct 120
atctcttgca agtcaagtca gagcctctta tatagtaatg gaaaaaccta tttgaactgg 180
gttttacaga agccaggcca gtctccacag cgcctaatct atctggtgtc taaactggac 240
tctggagtcc ctgacaggtt ctctggcagt ggatcaggaa cagattttac actgaaaatc 300
agcagagtgg aggctgagga tgtgggagtt tattactgcg tgcaaggttc acattttcac 360
acgttcggtc aagggaccaa gctggagatt aaacgaactg tggcagcacc aagcgtcttc 420
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 480
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 540
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 600
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 660
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttag 717
<210> 292
<211> 1404
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 292
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gaggtacagc tggtggagtc gggaggaggc ttggtacagc ctgggggttc tctgagactc 120
tcctgtgcag cttctggatt caccttttct gattactaca tgagctgggt ccgccaggct 180
ccagggaagg gacttgagtg ggtgggtttt attagaaaca aagctaatgg ttacacaaca 240
gagtacagtg catctgtgaa gggtcggttc accatctcca gagatgattc caaaaacagc 300
ctctatcttc aaatgaattc cctgaaaact gaagacactg ccgtttatta ctgtgcaaga 360
tatatctggt ttgactactg gggccaaggc accactgtca cagtctcctc agcctccacc 420
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggtacagcg 480
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 540
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 600
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc 660
aacgtgaatc acaagcccag caacaccaag gtggacaaga aagttgagcc caaatcttgt 720
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 780
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 840
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 900
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 960
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 1020
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 1080
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggatga gctgaccaag 1140
aaccaggtca gcctgacatg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 1200
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1260
gacggctcct tcttcctcta cagcaagctc accgtggaca agtccaggtg gcagcagggg 1320
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1380
ctctccctgt ctccgggtaa atga 1404
<210> 293
<211> 723
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 293
atggaagccc cagcgcagct tctcttcctc ctgctactct ggctccctga taccaccgga 60
gacattgtga tgacccaaac tccactctcc ctgtctgtca ctcctggaca accagcctcc 120
atctcttgca gatctagtca gagccttgta cacactaatg gaaacaccta tttacattgg 180
tacctgcaga agccaggcca gtctccacag ctcctgattt atatggtttc caaccgattt 240
tctggggtcc cagacaggtt cagtggcagt ggatcaggga cagatttcac actcaagatc 300
agcagagtgg aggctgagga tgtgggagtt tattactgct ctcaaagtgc acatgttcct 360
ccgctcacgt tcggtcaagg gaccaggctg gagattaaac gaactgtggc agcaccaagc 420
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 480
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 540
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 600
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 660
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 720
tag 723
<210> 294
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 294
Ala Arg Tyr Ile Phe Phe Asp Tyr
1 5
Claims (1)
- 치료가 필요한 환자를 치료하기 위한 의약의 제조를 위한, 중쇄 뉴클레오티드 서열을 포함하는 단리된 핵산 및 경쇄 뉴클레오티드 서열을 포함하는 단리된 핵산의 용도로서, 상기 중쇄 뉴클레오티드 서열 및 경쇄 뉴클레오티드 서열은 하기로 이루어진 그룹으로부터 선택되는 용도:
a) 서열번호: 283 및 서열번호: 284 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음;
b) 서열번호: 285 및 서열번호: 286 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음;
c) 서열번호: 287 및 서열번호: 289 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음;
d) 서열번호: 288 및 서열번호: 289 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음;
e) 서열번호: 290 및 서열번호: 291, 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음; 및
f) 서열번호: 292 및 서열번호: 293, 각각, 모두는 신호 펩타이드를 인코딩하는 서열없음.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17783709P | 2009-05-13 | 2009-05-13 | |
| US61/177,837 | 2009-05-13 | ||
| PCT/US2010/034704 WO2010132659A2 (en) | 2009-05-13 | 2010-05-13 | Anti-human cd52 immunoglobulins |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167022759A Division KR20160103160A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170113704A true KR20170113704A (ko) | 2017-10-12 |
Family
ID=43085579
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167022759A KR20160103160A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
| KR1020177026871A KR20170113704A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
| KR1020157036932A KR20160005143A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
| KR1020147020065A KR20140102764A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
| KR1020117029662A KR101537840B1 (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167022759A KR20160103160A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157036932A KR20160005143A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
| KR1020147020065A KR20140102764A (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
| KR1020117029662A KR101537840B1 (ko) | 2009-05-13 | 2010-05-13 | 항-인간 cd52 면역글루불린 |
Country Status (19)
| Country | Link |
|---|---|
| US (5) | US8617554B2 (ko) |
| EP (3) | EP2998405B1 (ko) |
| JP (4) | JP5894912B2 (ko) |
| KR (5) | KR20160103160A (ko) |
| CN (3) | CN110016081A (ko) |
| AR (1) | AR076770A1 (ko) |
| AU (1) | AU2010249003B2 (ko) |
| BR (1) | BRPI1013085A2 (ko) |
| CA (2) | CA2939492C (ko) |
| HK (2) | HK1222682A1 (ko) |
| IL (2) | IL216141B (ko) |
| MX (1) | MX2011012047A (ko) |
| MY (1) | MY160126A (ko) |
| NZ (2) | NZ621170A (ko) |
| RU (2) | RU2016142225A (ko) |
| SG (2) | SG10201608169QA (ko) |
| TW (3) | TW201825115A (ko) |
| WO (1) | WO2010132659A2 (ko) |
| ZA (1) | ZA201108077B (ko) |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2722184A1 (en) | 2008-04-25 | 2009-10-29 | Duke University | Regulatory b cells and their uses |
| MX342907B (es) | 2009-05-13 | 2016-10-17 | Genzyme Corp * | El uso de un anticuerpo anti-cd52 monoclonal para el tratamiento de lupus. |
| RU2016142225A (ru) | 2009-05-13 | 2018-12-18 | Джензим Корпорейшн | Иммуноглобулины к cd52 человека |
| US9814740B2 (en) * | 2010-12-21 | 2017-11-14 | Duke University | Methods and compositions combining immunotherapy with monocyte activation |
| WO2012144208A1 (ja) | 2011-04-18 | 2012-10-26 | 国立大学法人東京大学 | 抗itm2a抗体を用いる癌の診断および治療 |
| GB201109238D0 (en) * | 2011-06-01 | 2011-07-13 | Antitope Ltd | Antibodies |
| SG11201401518TA (en) | 2011-10-28 | 2014-05-29 | Teva Pharmaceuticals Australia Pty Ltd | Polypeptide constructs and uses thereof |
| WO2013185165A1 (en) * | 2012-06-14 | 2013-12-19 | The Walter And Eliza Hall Institute Of Medical Research | Cd-52 antibodies and their use in determining and enhancing an immune response in a subject |
| US10017739B2 (en) | 2012-09-06 | 2018-07-10 | Duke University | Methods of expanding and assessing B cells and using expanded B cells to treat disease |
| US20150299315A1 (en) * | 2012-10-22 | 2015-10-22 | Becton, Dickinson And Company | Non-b-lineage cells capable of producing antibody |
| WO2014165282A1 (en) | 2013-03-12 | 2014-10-09 | Institute of Arthritis Research, LLC | Immunologically active polypeptide |
| EP2970453B1 (en) | 2013-03-13 | 2019-12-04 | Prothena Biosciences Limited | Tau immunotherapy |
| AR095199A1 (es) * | 2013-03-15 | 2015-09-30 | Genzyme Corp | Anticuerpos anti-cd52 |
| KR102042174B1 (ko) | 2013-03-29 | 2019-11-08 | 삼성전자주식회사 | 인간화 및 친화도 성숙된 항 c-Met 항체 및 그의 용도 |
| KR102060540B1 (ko) * | 2013-04-03 | 2019-12-31 | 삼성전자주식회사 | 항 c-Met 항체 및 항 Ang2 항체를 포함하는 병용 투여용 약학 조성물 |
| WO2014169078A2 (en) | 2013-04-09 | 2014-10-16 | Boston Biomedical, Inc. | Methods for treating cancer |
| KR102186363B1 (ko) * | 2013-09-06 | 2020-12-04 | 삼성전자주식회사 | c-Met 저해제 및 베타-카테닌 저해제를 포함하는 병용 투여용 약학 조성물 |
| KR102192591B1 (ko) * | 2013-09-09 | 2020-12-18 | 삼성전자주식회사 | c-Met 저해제 및 c-Myc 저해제를 포함하는 병용 투여용 약학 조성물 |
| EA201792623A1 (ru) | 2015-06-03 | 2018-04-30 | Бостон Биомедикал, Инк. | Композиции, содержащие ингибитор стволовости рака и иммунотерапевтический агент, для применения в лечении рака |
| CU24538B1 (es) | 2016-05-02 | 2021-08-06 | Prothena Biosciences Ltd | Anticuerpos monoclonales que compiten por unirse a tau humano con el anticuerpo 16g7 |
| WO2017191559A1 (en) | 2016-05-02 | 2017-11-09 | Prothena Biosciences Limited | Tau immunotherapy |
| CU24537B1 (es) | 2016-05-02 | 2021-07-02 | Prothena Biosciences Ltd | Anticuerpos monoclonales que compiten por unirse a tau humano con el anticuerpo 3d6 |
| US11299469B2 (en) | 2016-11-29 | 2022-04-12 | Sumitomo Dainippon Pharma Oncology, Inc. | Naphthofuran derivatives, preparation, and methods of use thereof |
| EP3554515A4 (en) | 2016-12-15 | 2020-08-26 | Duke University | B10 REGULATORY CELL DEPLETION ANTIBODIES AND METHODS AND THEIR USE IN COMBINATION WITH IMMUNITY CHECKPOINT INHIBITORS |
| TW201841653A (zh) * | 2017-04-21 | 2018-12-01 | 美商建新公司 | 以抗-cd52抗體治療多發性硬化症 |
| IL270375B1 (en) | 2017-05-02 | 2024-08-01 | Prothena Biosciences Ltd | Antibodies that recognize tau |
| CA3062656A1 (en) | 2017-05-17 | 2018-11-22 | Boston Biomedical, Inc. | Methods for treating cancer |
| GB201710836D0 (en) * | 2017-07-05 | 2017-08-16 | Ucl Business Plc | ROR1 Car T-Cells |
| CN111868076A (zh) * | 2017-12-20 | 2020-10-30 | 放射免疫治疗公司 | 抗中心蛋白-1抗体及其制备方法和用途 |
| SI3898668T1 (sl) * | 2018-12-19 | 2024-02-29 | Humabs Biomed Sa | Protitelesa, ki nevtralizirajo virus hepatitisa B in njihove uporabe |
| CU20210073A7 (es) | 2019-03-03 | 2022-04-07 | Prothena Biosciences Ltd | Anticuerpos que se unen dentro de la región de unión a microtúbulos de tau definida por cdrs |
| CN109929835A (zh) * | 2019-03-27 | 2019-06-25 | 中国人民解放军第四军医大学 | 一种鼠单克隆抗体功能轻链可变区基因的扩增方法 |
| TWI800824B (zh) * | 2020-05-08 | 2023-05-01 | 大陸商亘喜生物科技(上海)有限公司 | 一種抗cd19抗體的抗體及其製備和應用 |
| EP4263600A1 (en) | 2020-12-18 | 2023-10-25 | Century Therapeutics, Inc. | Chimeric antigen receptor systems with adaptable receptor specificity |
Family Cites Families (75)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US6054561A (en) | 1984-02-08 | 2000-04-25 | Chiron Corporation | Antigen-binding sites of antibody molecules specific for cancer antigens |
| GB8422238D0 (en) | 1984-09-03 | 1984-10-10 | Neuberger M S | Chimeric proteins |
| US4970198A (en) | 1985-10-17 | 1990-11-13 | American Cyanamid Company | Antitumor antibiotics (LL-E33288 complex) |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| WO1987006265A1 (en) | 1986-04-17 | 1987-10-22 | Kyowa Hakko Kogyo Co., Ltd. | Novel compounds dc-88a and dc-89a1 and process for their preparation |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| WO1988007089A1 (en) | 1987-03-18 | 1988-09-22 | Medical Research Council | Altered antibodies |
| DE3856559T2 (de) | 1987-05-21 | 2004-04-29 | Micromet Ag | Multifunktionelle Proteine mit vorbestimmter Zielsetzung |
| JP3095168B2 (ja) | 1988-02-05 | 2000-10-03 | エル. モリソン,シェリー | ドメイン‐変性不変部を有する抗体 |
| CA1339198C (en) * | 1988-02-12 | 1997-08-05 | Gregory Paul Winter | Antibodies to the antigen campath-1 |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| JP2598116B2 (ja) | 1988-12-28 | 1997-04-09 | 協和醗酵工業株式会社 | 新規物質dc113 |
| US5187186A (en) | 1989-07-03 | 1993-02-16 | Kyowa Hakko Kogyo Co., Ltd. | Pyrroloindole derivatives |
| JP2510335B2 (ja) | 1989-07-03 | 1996-06-26 | 協和醗酵工業株式会社 | Dc―88a誘導体 |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| ATE158021T1 (de) | 1990-08-29 | 1997-09-15 | Genpharm Int | Produktion und nützung nicht-menschliche transgentiere zur produktion heterologe antikörper |
| GB9022543D0 (en) | 1990-10-17 | 1990-11-28 | Wellcome Found | Antibody production |
| GB9022547D0 (en) | 1990-10-17 | 1990-11-28 | Wellcome Found | Purified immunoglobulin |
| GB9108056D0 (en) * | 1991-04-16 | 1991-06-05 | Hale Geoffrey | Synthetic antigen |
| DE69233482T2 (de) | 1991-05-17 | 2006-01-12 | Merck & Co., Inc. | Verfahren zur Verminderung der Immunogenität der variablen Antikörperdomänen |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| WO1992022653A1 (en) | 1991-06-14 | 1992-12-23 | Genentech, Inc. | Method for making humanized antibodies |
| US5264586A (en) | 1991-07-17 | 1993-11-23 | The Scripps Research Institute | Analogs of calicheamicin gamma1I, method of making and using the same |
| US5269388A (en) | 1991-11-12 | 1993-12-14 | Stress-Tek, Inc. | Weighing bed |
| GB9125768D0 (en) * | 1991-12-04 | 1992-02-05 | Hale Geoffrey | Therapeutic method |
| EP0563475B1 (en) | 1992-03-25 | 2000-05-31 | Immunogen Inc | Cell binding agent conjugates of derivatives of CC-1065 |
| WO1994026087A2 (en) | 1993-05-14 | 1994-11-24 | Connor Kim C O | Recombinant protein production and insect cell culture and process |
| CA2163345A1 (en) | 1993-06-16 | 1994-12-22 | Susan Adrienne Morgan | Antibodies |
| US7119248B1 (en) | 1994-04-12 | 2006-10-10 | Miltenyi Biotec Gmbh | Antibodies against epitopes with homology to self antigens, methods of preparation and applications thereof |
| DE69533277T2 (de) | 1994-04-22 | 2005-07-21 | Kyowa Hakko Kogyo Co., Ltd. | Dc-89 derivat |
| US5550246A (en) | 1994-09-07 | 1996-08-27 | The Scripps Research Institute | Calicheamicin mimics |
| US5714586A (en) | 1995-06-07 | 1998-02-03 | American Cyanamid Company | Methods for the preparation of monomeric calicheamicin derivative/carrier conjugates |
| US5712374A (en) | 1995-06-07 | 1998-01-27 | American Cyanamid Company | Method for the preparation of substantiallly monomeric calicheamicin derivative/carrier conjugates |
| GB9603507D0 (en) | 1996-02-20 | 1996-04-17 | Isis Innovation | Antibody variants |
| US7147851B1 (en) | 1996-08-15 | 2006-12-12 | Millennium Pharmaceuticals, Inc. | Humanized immunoglobulin reactive with α4β7 integrin |
| JP2002512624A (ja) | 1997-05-21 | 2002-04-23 | バイオベーション リミテッド | 非免疫原性タンパク質の製造方法 |
| EP1051432B1 (en) | 1998-12-08 | 2007-01-24 | Biovation Limited | Method for reducing immunogenicity of proteins |
| ATE349438T1 (de) | 1999-11-24 | 2007-01-15 | Immunogen Inc | Cytotoxische wirkstoffe enthaltend taxane und deren therapeutische anwendung |
| JP5198704B2 (ja) | 2000-03-03 | 2013-05-15 | メディミューン リミティド | エオタキシンに対するヒト抗体及びそれらの使用 |
| US6333410B1 (en) | 2000-08-18 | 2001-12-25 | Immunogen, Inc. | Process for the preparation and purification of thiol-containing maytansinoids |
| US7465790B2 (en) | 2000-10-09 | 2008-12-16 | Isis Innovation, Inc. | Therapeutic antibodies |
| US20020132983A1 (en) | 2000-11-30 | 2002-09-19 | Junghans Richard P. | Antibodies as chimeric effector cell receptors against tumor antigens |
| US7771951B2 (en) | 2001-12-03 | 2010-08-10 | Amgen Fremont Inc. | Antibody categorization based on binding characteristics |
| US20040110226A1 (en) * | 2002-03-01 | 2004-06-10 | Xencor | Antibody optimization |
| US20050191632A1 (en) | 2002-11-01 | 2005-09-01 | John Byrd | Cytogenetic abnormalities that are predictive of response to therapy for chronic lymphocytic leukemia |
| CN1225480C (zh) * | 2002-12-18 | 2005-11-02 | 马菁 | 抗cd52单克隆抗体、其编码序列及应用 |
| US7534427B2 (en) | 2002-12-31 | 2009-05-19 | Immunomedics, Inc. | Immunotherapy of B cell malignancies and autoimmune diseases using unconjugated antibodies and conjugated antibodies and antibody combinations and fusion proteins |
| AU2004226492A1 (en) * | 2003-03-31 | 2004-10-14 | Kirin Beer Kabushiki Kaisha | Method of inducing differentiation and proliferating regulatory T cell by anti-CD52 antibody and medicinal composition therefor |
| EP1636360A4 (en) | 2003-06-03 | 2006-11-08 | Cell Genesys Inc | COMPOSITIONS AND METHODS FOR ENHANCED EXPRESSION OF RECOMBINANT POLYPEPTIDES FROM A SINGLE VECTOR USING A PEPTIDE CLEAVAGE SITE |
| BRPI0416141B8 (pt) | 2003-11-01 | 2021-05-25 | Biovation Ltd | anticorpo anti-cd52 modificado, composição farmacêutica, vetores de expressão, e método para preparar uma imunoglobulina |
| US20060204496A1 (en) * | 2003-11-28 | 2006-09-14 | Tetsuo Kojima | Agonist antibody against heteroreceptor |
| ITRM20030601A1 (it) | 2003-12-24 | 2005-06-25 | Lay Line Genomics Spa | Metodo per l'umanizzazione di anticorpi e anticorpi umanizzati con esso ottenuti. |
| EP1786836A2 (en) * | 2004-09-02 | 2007-05-23 | Genentech, Inc. | Anti-fc-gamma riib receptor antibody and uses therefor |
| US7655229B2 (en) | 2004-09-02 | 2010-02-02 | Chan Andrew C | Anti-FC-gamma RIIB receptor antibody and uses therefor |
| LT1850873T (lt) | 2005-02-08 | 2019-04-10 | Genzyme Corporation | Antikūnas prieš tgf beta |
| AP2007004250A0 (en) * | 2005-05-24 | 2007-12-31 | Avestha Gengraine Tech Pvt Ltd | Recombinant method for the production of a monoclonal antibody to cd52 for the treatment of chronic lymphocytic leukemia |
| EA018255B1 (ru) | 2005-05-27 | 2013-06-28 | Байоджен Айдек Ма Инк. | Белки, связывающие tweak, и их применение |
| ES2382164T3 (es) * | 2005-12-30 | 2012-06-05 | Merck Patent Gmbh | Anticuerpos anti-IL-6 que impiden la unión de la IL-6 en complejo con el IL-6R( ) a la GP130 |
| EP2012814B1 (en) * | 2006-04-12 | 2013-05-22 | Genzyme Corporation | Methods of treating autoimmune diseases |
| PL2066352T3 (pl) | 2006-09-13 | 2016-05-31 | Alcafleu Man Gmbh & Co Kg | Leczenie stwardnienia rozsianego (MS) z zastosowaniem Campath-1H |
| WO2008106131A2 (en) | 2007-02-28 | 2008-09-04 | Schering Corporation | Combination therapy for treatment of immune disorders |
| US20100178293A1 (en) * | 2007-06-22 | 2010-07-15 | Olaf Weber | Use of antibodies against the cd52 antigen for the treatment of neurological disorders, particularly transmissible spongiform encephalopathy and alzheimer's disease |
| RU2016142225A (ru) | 2009-05-13 | 2018-12-18 | Джензим Корпорейшн | Иммуноглобулины к cd52 человека |
| MX342907B (es) | 2009-05-13 | 2016-10-17 | Genzyme Corp * | El uso de un anticuerpo anti-cd52 monoclonal para el tratamiento de lupus. |
| WO2010132697A2 (en) | 2009-05-13 | 2010-11-18 | Genzyme Corporation | Methods and compositions for treatment |
| HUE038277T2 (hu) | 2009-07-15 | 2018-10-29 | Aimm Therapeutics Bv | Gram-pozitív baktériumokra specifikus kötõvegyületek |
| KR102024922B1 (ko) | 2010-07-16 | 2019-09-25 | 아디맵 엘엘씨 | 항체 라이브러리 |
| ITMI20110376A1 (it) | 2011-03-10 | 2012-09-11 | Wilic Sarl | Aerogeneratore raffreddato a fluido |
| GB201109238D0 (en) | 2011-06-01 | 2011-07-13 | Antitope Ltd | Antibodies |
| AR095199A1 (es) | 2013-03-15 | 2015-09-30 | Genzyme Corp | Anticuerpos anti-cd52 |
| AU2015330869B2 (en) | 2014-10-09 | 2021-07-08 | Genzyme Corporation | Glycoengineered antibody drug conjugates |
| TW201841653A (zh) | 2017-04-21 | 2018-12-01 | 美商建新公司 | 以抗-cd52抗體治療多發性硬化症 |
-
2010
- 2010-05-13 RU RU2016142225A patent/RU2016142225A/ru not_active Application Discontinuation
- 2010-05-13 KR KR1020167022759A patent/KR20160103160A/ko not_active Application Discontinuation
- 2010-05-13 CN CN201910228216.6A patent/CN110016081A/zh active Pending
- 2010-05-13 KR KR1020177026871A patent/KR20170113704A/ko not_active Application Discontinuation
- 2010-05-13 TW TW106123171A patent/TW201825115A/zh unknown
- 2010-05-13 KR KR1020157036932A patent/KR20160005143A/ko not_active Application Discontinuation
- 2010-05-13 SG SG10201608169QA patent/SG10201608169QA/en unknown
- 2010-05-13 NZ NZ621170A patent/NZ621170A/en not_active IP Right Cessation
- 2010-05-13 CA CA2939492A patent/CA2939492C/en active Active
- 2010-05-13 AU AU2010249003A patent/AU2010249003B2/en not_active Ceased
- 2010-05-13 MY MYPI2011005455A patent/MY160126A/en unknown
- 2010-05-13 AR ARP100101677A patent/AR076770A1/es not_active Application Discontinuation
- 2010-05-13 TW TW099115371A patent/TWI529247B/zh not_active IP Right Cessation
- 2010-05-13 TW TW104144762A patent/TWI614267B/zh not_active IP Right Cessation
- 2010-05-13 RU RU2011150516/10A patent/RU2603743C2/ru not_active IP Right Cessation
- 2010-05-13 KR KR1020147020065A patent/KR20140102764A/ko not_active Application Discontinuation
- 2010-05-13 US US13/320,019 patent/US8617554B2/en active Active
- 2010-05-13 SG SG2011083847A patent/SG176060A1/en unknown
- 2010-05-13 EP EP15191351.4A patent/EP2998405B1/en active Active
- 2010-05-13 BR BRPI1013085-3A patent/BRPI1013085A2/pt not_active IP Right Cessation
- 2010-05-13 WO PCT/US2010/034704 patent/WO2010132659A2/en active Application Filing
- 2010-05-13 CA CA2761800A patent/CA2761800C/en active Active
- 2010-05-13 EP EP19214547.2A patent/EP3683317A3/en not_active Withdrawn
- 2010-05-13 CN CN201410379748.7A patent/CN104231084B/zh active Active
- 2010-05-13 MX MX2011012047A patent/MX2011012047A/es active IP Right Grant
- 2010-05-13 KR KR1020117029662A patent/KR101537840B1/ko active IP Right Grant
- 2010-05-13 EP EP10775530A patent/EP2429582A4/en not_active Withdrawn
- 2010-05-13 JP JP2012511010A patent/JP5894912B2/ja active Active
- 2010-05-13 NZ NZ596384A patent/NZ596384A/en not_active IP Right Cessation
- 2010-05-13 CN CN2010800312662A patent/CN102459628A/zh active Pending
-
2011
- 2011-11-03 IL IL216141A patent/IL216141B/en not_active IP Right Cessation
- 2011-11-03 ZA ZA2011/08077A patent/ZA201108077B/en unknown
-
2012
- 2012-09-10 HK HK16110806.5A patent/HK1222682A1/zh unknown
-
2013
- 2013-11-26 US US14/091,083 patent/US20140341910A1/en not_active Abandoned
-
2014
- 2014-07-16 JP JP2014145770A patent/JP2014195474A/ja not_active Withdrawn
-
2015
- 2015-06-18 HK HK15105820.8A patent/HK1205152A1/xx unknown
- 2015-09-24 US US14/864,736 patent/US20160208010A1/en not_active Abandoned
-
2016
- 2016-02-10 JP JP2016023418A patent/JP2016093194A/ja not_active Withdrawn
-
2017
- 2017-12-01 JP JP2017231850A patent/JP2018029624A/ja not_active Withdrawn
-
2018
- 2018-10-28 IL IL262639A patent/IL262639A/en unknown
-
2019
- 2019-04-10 US US16/380,389 patent/US20200040091A1/en not_active Abandoned
-
2021
- 2021-03-03 US US17/191,440 patent/US11945874B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101537840B1 (ko) | 항-인간 cd52 면역글루불린 | |
| US7981416B2 (en) | Humanized immunomodulatory monoclonal antibodies for the treatment of immunodeficiency | |
| CN110621697B (zh) | 拮抗性cd40单克隆抗体及其用途 | |
| WO2007102200A1 (ja) | 抗cd20モノクローナル抗体 | |
| AU2017202364B2 (en) | Anti-human CD52 immunoglobulins | |
| KR102713355B1 (ko) | 길항작용 cd40 모노클로날 항체 및 그의 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |