KR20140100571A - Cd138을 타겟팅하는 면역접합체의 용도 - Google Patents
Cd138을 타겟팅하는 면역접합체의 용도 Download PDFInfo
- Publication number
- KR20140100571A KR20140100571A KR1020147018841A KR20147018841A KR20140100571A KR 20140100571 A KR20140100571 A KR 20140100571A KR 1020147018841 A KR1020147018841 A KR 1020147018841A KR 20147018841 A KR20147018841 A KR 20147018841A KR 20140100571 A KR20140100571 A KR 20140100571A
- Authority
- KR
- South Korea
- Prior art keywords
- immunoconjugate
- dose
- administered
- antibody
- cancer
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6807—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug or compound being a sugar, nucleoside, nucleotide, nucleic acid, e.g. RNA antisense
- A61K47/6809—Antibiotics, e.g. antitumor antibiotics anthracyclins, adriamycin, doxorubicin or daunomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Abstract
본 발명은, CD138을 발현하는 타겟 세포와 관련된 질환의 치료 방법으로서, CD138 발현 세포를 타겟팅하는 하나 이상의 조작된 타겟팅 항체와 하나 이상의 작동자 분자를 포함하되, 상기 조작된 타겟팅 항체에 상기 작동자 분자가 기능적으로 부착되어 형성된 면역접합체를, 이를 필요로 하는 개체, 특히 인간 개체에게 투여하는 단계를 포함하며, 바람직하게는 상기 조작된 타겟팅 항체의 적어도 일부는 IgG4 이소형 특성을 부여하며, 상기 면역접합체는 2회 이상의 투약을 포함하는 다회 투약 용법으로 투여되되, 활성 치료 사이클 동안에 투여되는 총 용량이 총 최대 허용 용량 (AMTD)이거나 또는 AMTD의 일부이며, 상기 AMTD 및/또는 상기 AMTD의 일부인 용량은 면역접합체를 복수의 단회 투약 용법의 일부로서 투여하는 것을 포함하여 단회 투약으로 투여하는 경우에 용량 제한 독성 (DLT)을 야기하는 용량 보다 높거나, 및/또는 상기 활성 치료 사이클에서 복수의 단회 투약 용법의 일부로서 투여하는 것을 포함하여 단회 투약으로서 면역접합체를 투여하는 경우의 최대 허용 용량 (MTD) 보다 높은 것을 특징으로 하는, 치료 방법을 제공한다.
Description
본 발명은 CD138을 발현하는 세포를 타겟으로 하도록 설계된 면역접합체의 투여를 포함하는, 특히 인간 개체에 적용되는 방법 및 치료 요법에 관한 것이다. 또한, 본 발명은 항암 조합물, 이를 포함하는 약학 조성물, 및 CD138을 발현하는 타겟 세포를 가진 암의 치료에 있어서의 이의 용도에 관한 것이다. 본 발명은, 특히, 상기 조합물의 전체 구성 성분들 중 일부를 사용하는 치료에 비해, 치료시 상승적인 효과나 또는 예측하지 못한 부가적인 효과를 나타내는, 항암 조합물에 관한 것이다.
CD138은 세포외 매트릭스의 수용체로서 작용하는 것으로서, 다발성 골수종 (MM: multiple myeloma) 세포에서 과다 발현되며, MM 세포의 발생 및/또는 증식에 영향을 미치는 것으로 알려져 있다. 또한, CD138은, 몇몇 예로서, 난소암, 자궁경부암 (Numa et al., 2002), 자궁 내막암 (Choi et al., 2007), 신장암, 담낭암, 방광 이행 세포암 (transitional cell bladder carcinoma), 위암 (Wiksten et al. 2008), 전립선 선암종 (Zellweger et al., 2003), 유방암 (Loussouarn et al., 2008), 비-소세포 폐암 (Shah et al., 2004), 편평 세포 폐암 (Toyoshima et al., 2001), 대장암 세포, 호지킨스 림프종, 비-호지킨스 림프종, 결장직장암 (Hashimoto et al, 2008), 간암 (Li et al., 2005), 만성 림프구성 백혈병 (CLL), 췌장암 (Conejo et al., 2000), 및 두경부암 (Anttonen et al., 1999) 세포들에서 발현된다.
본 발명을 설명하기 위해, 특히, 실시에 대한 부가적인 상세한 내용을 제공하기 위해, 본원에 인용되는 특허 등의 간행물 및 그외 자료들은 원용에 의해 본 명세서에 포함된다. 편의상, 간행물들은 후술하는 내용에서 저자 및 발행일로 언급하거나, 및/또는 첨부된 참고문헌 목록에 저자의 알파벳 순으로 열거한다.
타손 등 (2004)은 MM 세포의 표면에 발현되는 CD138 항원에 대한 뮤라인 IgG1 항체 B-B4의 우수한 결합성을 보고하였다. 또한, Tassone 등은, 다발성 골수종 세포에 대한 작동자 분자로서 메이탄시노이드 DM1을 포함하는, 면역접합체 B-B4-DM1의 우수한 세포독성 활성을 보고하였다 (미국 특허 공개번호 20070183971).
이케다 등 (2008 및 2009)은 B-B4를 기본으로 한 면역접합체 BT062를 이용하여 시험관내에서 그리고 이종 모델에서 기대할만한 결과들을 보고하였다.
타손 등과 이케다 등은 효과적인 MM 치료법과 이러한 치료에 사용할 수 있는 물질의 조성물을 제공하는데 기여하였지만, 당해 기술 분야에서는 아직 다수의 과제들이 남아 있는 실정이다.
면역접합체, 특히 예컨대, 종양 세포와 같은 타겟 세포에서 발현될 뿐만 아니라 유기체에서 중요한 기능을 수행하는 비-타겟 세포에서도 발현되는 항원에 결합하는 타겟팅 물질에 기능적으로 부착되는 고독성의 작동자 분자를 가진 면역접합체를 사용하는 것은 타겟 세포를 파괴하는데 효과적인 것으로 입증되었지만, 비-타겟 세포에 대한 이의 독성으로 인해 대부분 실패하였다. 실제, 많은 면역접합체들이 효능과 독성 (치료학적 윈도우) 간에 균형을 찾을 수 없어 임상 실험 중에 중단되어야 했으며, 면역접합체가 질환 퇴치 측면에서 유용성을 부여할 수 있는 농도에서는, 독성이 허용불가한 수준이 된다. 따라서, 특히 고독성의 작동자 분자를 사용하는 경우에 흔히 문제가 되는 것은, 면역접합체의 타겟팅 물질이 실제로 작동자를 타겟으로 가져가서 작동자가 타겟에서 방출될 수 있도록 할 수 있는지 뿐만 아니라, 이의 타겟 세포에 대한 방식으로, 동일한 면역접합체가 유기체의 생존에 필수적인 세포나 기관을 허용불가한 수준으로 파괴 또는 공격할 것인지에 대한 것이다.
미국 특허 공개공보 20110123554는 질환을 퇴치하기 위해 CD138을 타겟팅하는 면역접합체를 특히 허용가능한 양으로 투여하는 것을 포함하는, 방법과 치료 용법을 개시하였다. 그러나, 이들 결과는, 면역접합체가 용인가능한 수준이어서 효과적일 수 있지만, 더욱 개선된 치료 용법들이 필요하다는 것을 보여주었다.
MM과 같이, CD138 발현과 관련있는 형질세포 증식성 장애 (plasmaproliferative disorder) 등의, CD138 발현과 관련있는 질환에 대한 적합한 치료 요법이 특히 요구되고 있다. 특히, 질환을 퇴치하기 위해, 효능과 독성이 균형이 잡힌 수준으로 면역접합체를 허용가능한 특정 양으로만 사용하거나, 및/또는 면역접합체를 대상 장애에 대해 유효한 것으로 공지된 세포독성 물질과 조합함으로써, CD138을 또한 발현하는 비-종양 세포에 대한 독성은 임상적으로 허용가능한 수준으로 유지되게 하는 치료 용법들이 요구되고 있다. 또한, 질환의 다른 증상들을 완화하기 위해 사용되는 약물의 필요성과, 가장 최근의 치료법으로 소정의 정도의 질병 구제를 달성한 후에는, 환자의 건강을 무-질병 상태 (disease-free state) 또는 제한된-질병 상태 (limited-disease state)로 유지하기 위한 유지 요법 (maintenance therapy)의 필요성을 줄여 줄 수 있는 치료 용법이 요구되고 있다.
Abdelkefi et al.; "Single autologous stem-cell transplantation followed by maintenance therapy with thalidomide is superior to double autologous transplantaion in multiple myeloma: results of a multicenter randomized clinical trial;" Blood; 111; 2008; pp.: 1805-1810.
Akkina et al.; "Modeling human lymphoid precursor cell gene therapy in the SCID-hu mouse;" Blood; 84; 1994; pp.: 1393-1398.
Armour et al.; "Recombinant human IgG molecules lacking Fcgamma receptor I binding and monocyte triggering activities;" Eur J Immunol; 29(8); 1999; pp.: 2613-24.
Anderson et al.; "Multiple Myeloma: New Insights and Therapeutic Approaches; Hematology; 2000; pp.: 147-165.
Anderson et al; "Multiple Myeloma; Hematology Am Soc Hematol Educ Program; 2002; pp.: 214-40.
Anttonen et al.: "Syndecan-1 expression has prognostic significance in head and neck carcinoma;" Br J of Cancer 79 (3/4), 1999, pp.: 558-564.
Anttonen et al.; "High syndecan-1 expression is associated with favourable outcome in squamous cell lung carcinoma treated with radical surgery;" Lung Cancer; 32(3); June 2001; pp.: 297-305.
Aref et al.: "Syndecan-1 in multiple myeloma: relationship to conventional prognostic factors;" Hematology; 8; 2003; pp.:221-228.
Barbareschi et al.; "High syndecan-1 expression in breast carcinoma is related to an aggressive phenotype and to poorer prognosis;" Cancer; 98(3); August 1, 2003; pp.: 474-83.
Bartlett et al., "A phase 1 multidose study of SGN-30 immunotherapy in patients with refractory or recurrent CD30+ hematologic malignancies," Blood, vol. 111, 2008, pp.: 1848-1854.
Bataille et al.; "The phenotype of normal, reactive and malignant plasma cells. Identification of "many and multiple myelomas" and of new targets for myeloma therapy;" Haematologica; 91(9); September 2006; pp.: 1234-40.
Bayer-Garner et al.; "Syndecan-1 (CD138) immunoreactivity in bone marrow biopsies of multiple myeloma: shed syndecan-1 accumulates in fibrotic regions;" Mod Pathol.; 14(10); October 2001; pp.: 1052-8.
Beeram et al.; "A phase I study of trastuzumab-DM1 (T-DM1), a first-in-class HER2 antibody-drug conjugate (ADC), in patients (pts) with advanced HER2+ breast cancer (BC);" ASCO Meeting; Abstracts; May 20, 2008; pp.: 1028.
Berenson et al.; "New drugs in multiple myeloma;" Curr Opin Support Palliat Care; 2(3); September 2008; pp.: 204-10.
Bernfield et al.; "Biology of the syndecans: a family of transmembrane heparan sulfate proteoglycans;" Annu Rev Cell Biol; 8; 1992; pp.: 365-393.
Beste et al.; "Small antibody-like proteins with prescribed ligand specificities derived from the lipocalin fold;" Proc. Natl. Acad. Sci. USA; 96; 1999; pp.: 1898-1903.
Bhattacharyya et al.; "Maytansine binding to the vinblastine sites of tubulin;" FEBS Lett.; 75; 1977; pp.: 159-162.
Bisping et al., "Targeting receptor kinases by a novel indolinone derivative in multiple myeloma: abrogation of stroma-derived interleukin-6 secretion and induction of apoptosis in cytogenetically defined subgroups;" Blood; 107(5); March 1, 2006; pp.: 2079-89.
Bissery et al., "Experimental Antitumor Activity of Taxotere (RP 56976, NSC 628503), a Taxol Analogue", Cancer Research 51, 1991, PP.: 4845-4852.
Blade et al.; "Advances in therapy of multiple myeloma;" Curr Opin Oncol; 20(6); November 2008; pp.: 697-704.
Blum et al.; "Maytansine: A Phase I study of an ansa macrolide with antitumor activity;" Cancer Treat Rep; 62; 1978; pp.: 435-438.
Brand et al.; "Management of high risk metastatic prostate cancer: the case for novel therapies;" J Urol Dec; 176 (6Pt 2); 2006; pp.: S76-80.
Blattler et al.; "Drugs to Enhance the Therapeutic Potency of Anticancer Antibodies: Antibody-Drug Conjugates as Tumor-Activated Prodrugs;" Ojima, I., Vite, G.D. and Altmann, K.-H., Editors; Anticancer Agents-Frontiers in Cancer Chemotherapy, American Chemical Society, Washington, DC, 2001; 2001; pp.: 317-338.
Bross et al.; "Approval summary: gemtuzumab ozogamicin in relapsed acute myeloid leukemia;" Clin Cancer Res; 7; 2001; pp.: 1490-1496.
Burris et al.; "A Phase I study of a first-in-class HER2 antibody-drug conjugate in subjects with HER2-overexpressing metastatic breast cancer;" 29th Annual San Antonio Breast Cancer Symposium (SABCS); Poster Abstract #2070; 2006.
Cabanillas et al., "Phase I study of maytansine using a 3 day schedule;" Cancer Treat Rep; 62; 1978; pp.: 425-428.
Carbone et al.; "AIDS-related plasma- blastic lymphomas of the oral cavity and jaws: a diagnostic dilemma.Ann;" Otol. Rhinol. Laryngol; 108; 1999; pp.: 95-99.
Carlsson et al., "Protein thiolation and reversible protein-protein conjugation. N-succinimidyl-3-(2-pyridyldithio) propionate, a new heterobifunctional reagent;" Biochem J; 173; 1978; pp.: 723-737.
Carter P; "Improving the efficacy of antibody-based cancer therapies;" Nat Rev Cancer; 1; 2001; pp.:118-129.
Carter and Senter, "Antibody-Drug Conjugates", The Cancer Journal, Vol. 14(3), 2008, pp.: 154-169
Chabner et al.; "Initial clinical trials of maytansine, an antitumor plant alkaloid;" Cancer Treat Rep; 62; 1978; pp.: 429-433.
Chanan-Khan et al.; "Phase I Study of huN901-DM1 (BB-10901) in Patients with Relapsed and Relapsed/Refractory CD56-Positive Multiple Myeloma;" Blood; 108(11); Abstract #1174 (ASH Meeting); November 16, 2007.
Chanan-Khan et al.; "Phase I Study of IMGN901 in Patients with Relapsed and Relapsed/Refractory CD56-Positive Multiple Myeloma;" Blood (ASH Annual Meeting Abstracts); 112; November 2008; pp.: 3689.
Chari et al.; "Immunoconjugates containing novel maytansinoids: promising anticancer drugs;" Cancer Res; 52; 1992; pp.: 127-131.
Chari et al.; "Enhancement of the selectivity and antitumor efficacy of a CC-1065 analogue through immunoconjugate formation;" Cancer Res.; 55; 1995; pp.: 4079-4084.
Charnaux et al.; "RANTES (CCL5) induces a CCR5-dependent accelerated shedding of syndecan-1 (CD138) and syndecan-4 from HeLa cells and forms complexes with the shed ectodomains of these proteoglycans as well as with those of CD44;" Glycobiology; 15(2); 2005; pp.: 119-130.
Chen et al.; "Engraftment of human hematopoietic precursor cells with secondary transfer potential in SCID-hu mice;" Blood; 84; 1994; pp.: 2497-2505.
Chilosi et al.; "CD138/syndecan-1: a useful immunohistochemical marker of normal and neoplastic plasma cells on routine trephine bone marrow biopsies;" Mod Pathol.; 12; 1999; pp.: 1101-1106.
Choi et al.; "Syndecan-1, a key regulator of cell viability in endometrial cancer;" Int J Cancer 121(4); 2007; pp.: 741-50.
Chou and Talalay; "Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs on enzyme inhibitors;" Adv. Enzyme Regul. 22; 1984, pp.:27-55.
Clement et al.; "B-B2 and B-B4, two new mAb against secreting plasma cells;" Leucocyte Typing V; Oxford Press.; 1; 1995; pp.: 714-715.
Coiffier et al., "Phase I/II study of the anti-CD19 maytansinoid immunoconjugate SAR3419 administered weekly to patients with relapsed/refractory B-cell non-Hodgkin's lymphoma (NHL)," 2011 ASCO Annual Meeting, Chicago, Illinois, June 2011, Unpublished conference proceedings, 2011.
Conejo et al.; "Syndecan-1 expression is up-regulated in pancreatic but not in other gastrointestinal cancers;" Int J Cancer; 88(1); 2000 Oct 1; pp.:12-20.
Couturier et al.; "Validation of 213Bi-alpha radioimmunotherapy for multiple myeloma;" Clinical Cancer Research 5(10 Suppl.); Oct 1999; pp.: 3165s-3170s.
Davies EJ et al.; "Distribution and Clinical Significance of Heparan Sulfate Proteoglycans;" Ovarian Cancer Clin Cancer Res; 10(15); 2004; pp.: 5178-86.
DeGeorge et al.; "Regulatory considerations for preclinical development of anticancer drugs;" Cancer Chemother Pharmacol; 41(3); 1998; p.: 173-85.
Dmoszynska A.; "Diagnosis and the current trends in multiple myeloma therapy;" Pol Arch Med Wewn; 118(10); October 2008; pp.: 563-6.
Dhodapkar et al.; "Syndecan-1 is a multifunctional regulator of myeloma pathobiology: control of tumor cell survival, growth, and bone cell differentiation;" Blood; 91; 1998; pp.: 2679-2688.
Dimopoulos et al.; "The role of novel drugs in multiple myeloma;" Annals of Oncology19 (Supplement 7); 2008; pp.: vii121-127.
Dore et al.; "Identification and location on syndecan-1 core protein of the epitopes of B-B2 and B-B4 monoclonal antibodies;" FEBS Lett; 26; 1998; pp.: 67-70.
Dowell et al.; "Pharmacokinetics of gemtuzumab ozogamicin, an antibody-targeted chemotherapy agent for the treatment of patients with acute myeloid leukemia in first relapse;" J Clin Pharmacol; 41; 2001; pp.: 1206-1214.
Durie et al.; "Myeloma management guidelines: a consensus report from the Scientific Advisors of the International Myeloma Foundation;" Hematol J, 4(6); 2003; pp.: 379-98.
Durie et al.; "International uniform response criteria for multiple myeloma;" Leukemia; 20(12); December 2006; pp.: 2220.
Eagan et al.; "Early clinical study of an intermittent schedule for maytansine (NSC-153858): brief communication;" J Natl Cancer Insti (Bethesda); 60; 1978; pp. 93-96.
Edinger et al.; "Noninvasive assessment of tumor cell proliferation in animal models;" Neoplasia; 1; 1999; pp.:303-310.
Facon et al.; "Superiority of melphalan-prednisone (MP) + thalidomide (THAL) over MP and autologous stem cell transplantation in the treatment of newly diagnosed elderly patients with multiple myeloma;" J. Clin. Oncol.; 24(Suppl. 18); Abstract 1; 2006.
Fossella et al.; "Phase II Trial of BB-10901 (huN901-DM1) given weekly for four consecutive weeks every 6 weeks in patients with relapsed SCLC and CD56-positive small cell carcinoma;" J Clin Onco, ASCO Annual Meeting Proceedings; 23(16S), Part I of II; June 1, 2005; 7159; Supplement.
Galsky et al.; "Phase I Trial of the Prostate-Specific Membrane Antigen' directed Immunoconjugate MLN2704 in Patients With Progressive Metastatic Castration-Resistant Prostate Cancer;" Journal of Clinical Oncology; May 1, 2008; pp.: 2147-2154.
Gattei et al.; "Characterization of Anti-CD138 monoclonal antibodies as tools for investigating the molecular polymorphism of syndecan-1 in human lymphoma cells;" Br J Haematol.; 104; 1999; pp.: 152-162.
Ghobrial et al.; "Emerging drugs in multiple myeloma;" Expert Opin Emerg Drugs; 12(1); March 2007; pp.: 155-63.
Giles et al.; "Phase I study of AVE9633, an AntiCD33-Maytansinoid Immunoconjugate, Administered as an Intravenous Infusion in Patients with Refractory/Relapsed CD33-Positive Acute Myeloid Leukemia (AML);" Blood; 108(11); November 16, 2006.
Greipp et al.; "International staging system for multiple myeloma," J Clin Oncol; 23(15); Mary 20, 2005; pp.:3412-20.
Greipp and Lust; "Pathogenetic relation between monoclonal gammopathies of undetermined significance and multiple myeloma;" Stem Cells. Aug. 13 Suppl 2; 1995; pp.:10-21.
Gunaratnum et al.; "G-quadruplex compounds and cis-platin act synergistically to inhibit cancer cell growth in vitro and in vivo;" Biochemical Pharmacology; 78; 2009; pp.: 115-122.
Hamann et al.; "An anti-CD33 antibody-calicheamicin conjugate for treatment of acute myeloid leukemia;" Choice of linker; Bioconjug Chem; 13; 2002; pp.: 40-46.
Han et al.; "New insights into syndecan-2 expression and tumourigenic activity in colon carcinoma cells;" J Mol Histol; 35(3); 2004; pp.: 319-26.
Hashimoto et al.; "Colorectal Association of loss of epithelial syndecan-1 with stage and local metastasis of colorectal adenocarcinomas: an immunohistochemical study of clinically annotated tumors;"BMC Cancer 8; 2008; p.185.
Helft et al.; "A phase I study of cantuzumab mertansine administered as a single intravenous infusion once weekly in patients with advanced solid tumors;" Clin Cancer Res; 10(13); 2004 Jul 1; pp.: 4363-8.
Hideshima et al.; "Perifosine, an oral bioactive novel alkylphospholipid, inhibits Akt and induces in vitro and in vivo cytotoxicity in human multiple myeloma cells;" Blood; 107(10); 2006; pp.: 4053-62.
Hideshima et al.; "Understanding multiple myeloma pathogenesis in the bone marrow to identify new therapeutic targets;" Nat Rev Cancer; 7(8); 2007; pp.: 585-98.
Hiroshi et al.; "The Monoclonal Antibody nBT062 Conjugated to Cytotoxic Maytansinoids Has Potent and Selective Cytotoxicity against CD138 Positive Multiple Myeloma Cells in Vitro and in Vivo;" Blood; (ASH Annual Meeting Abstracts); 112; November 2008; p.: 1716.
Holden et al.; "A phase I study of weekly dosing of trastuzumab-DM1 (T-DM1) in patients (pts) with advanced HER2+ breast cancer (BC);" ASCO Meeting Abstracts; May 20, 2008; p.: 1029.
Horvathova et al.; In: al. SFSe, ed. Leucocyte Typing V.; Oxford: Oxford University Press; 1995; pp.: 713-714.
Huang et al.; "Validation and reduction of FACT/GOG-Ntx subscale for platinum/paclitaxel-induced neurologic symptoms: a gynecologic oncology group study;" Int J Gynecol Cancer; 17; 2007; pp.: 387-93.
Hwang et al.; "New Frontiers in the Treatment of Multiple Myeloma;" Scientific World Journal; 6; December 6, 2006; pp.: 1475-503.
Ikeda et al.; "The monoclonal antibody nBT062 conjugated to maytansinoids has potent and selective cytotoxicity against CD138 positive multiple myeloma cells in vitro and in vivo;" Clin. Cancer Research; 15(12); 2009.
Ishitsuka et al.; "Targeting CD56 by the maytansinoid immunoconjugate IMGN901 (huN901-DM1): a potential therapeutic modality implication against natural killer/T cell malignancy;" Br. J. Haematol; 141(1); April 2008; pp.:129-31.
Issell et al.; "Maytansine;"Cancer Treat Rev; 5; 1978; pp.: 199-207.
Jemal et al.; "Cancer statistics;" CA Cancer J Clin; 58; 2008; pp.: 71-96.
Johnson et al.; "Novel and Targeted Agents for Small Cell Lung Cancer;" ASCO Educational Book; January 1, 2008; pp.: 363-367.
Kovtun et al.; "Antibody-drug conjugates designed to eradicate tumors with homogeneous and heterogeneous expression of the target antigen;" Cancer Res; 66(6); 2006; pp.: 3214-21.
Kuesters et al.; "Correlation of ErbB2 Gene Status, mRNA and Protein Expression in a Panel of >100 Human Tumor Xenografts of Different Origin; Onkologie; 29; 2006; pp:249-256
Krebs et al.; "High-throughput generation and engineering of recombinant human antibodies;" J. Immunol. Methods; 254; 2001; pp.: 67-74.
Krop et al.; "A Phase I Study of Trastuzumab-DM1, a First-in-Class HER2 Antibody-Drug Conjugate (ADC), in patients with HER2+ Metastatic Breast Cancer;" 14th European Cancer Conference (ECCO 14); Poster #2118; 2007.
Kupchan et al.; "Structural requirements for antileukemic activity among the naturally occurring and semisynthetic maytansinoids;" J Med Chem; 21; 1978; pp.:31-37.
Kyle; " Benign monoclonal gammopathy-after 20 to 35 years of follow-up;" Mayo Clin Proceedings 68(1); 1993; pp.:26-36.
Kyle et al.; "Multiple myeloma;" N Engl J Med; 351(18); October 28, 2004; pp.:1860-73.
Kyle et al.; "Criteria for diagnosis, staging, risk stratification dn response assessment of multiple myeloma;" Leukemia; 23; 2009; pp.: 3-9.
Kyoizumi et al.; "Implantation and maintenance of functional human bone marrow in SCID-hu mice;" Blood; 79; 1992; pp.:1704-1711.
Kyoizumi et al.; "Preclinical analysis of cytokine therapy in the SCID-hu mouse;" Blood; 81; 1993; pp.:1479-1488.
Lambert JM; "Drug-conjugated monoclonal antibodies for the treatment of cancer;" Current Opinion in Pharmacology; 5; 2005; pp.: 543-549.
Langford et al.; "Multiple heparan sulfate chains are required for optimal syndecan-1 function;" J Biol Chem; 273(45); November 6, 1998; pp.: 29965-71.
Legrand et al.; "An open label, dose escalation study of AVE9633 administered as a single agent by intravenous (IV) infusion weekly for 2 weeks in a 4-week cycle to patients with relapsed or refractory CD33-positive Acute Myeloid Leukemia (AML);" Blood; 118(11); November 16, 2007.
Li et al.; "Clinicopathological significance of expression of paxillin, syndecan-1 and EMMPRIN in hepatocellular carcinoma;" World J Gastroenterol. 11(10); 2005; pp.:1445-51.
Liu et al.; "Eradication of large colon tumor xenografts by targeted delivery of maytansinoids;" Proc Natl Acad Sci U S A; 93; 1996; pp.:8618-8623.
Loussouarn et al.; "Prognostic impact of syndecan-1 expression in invasive ductal breast carcinomas;" Br J Cancer; 28; 2008; pp.: 1993-1998
Lorigan et al.; "Phase I trial of BB-10901 (huN901-DM1) given daily by IV infusion for three consecutive days every three weeks in patients with SCLC and other CD56-positive solid tumors;" European Journal of Cancer Supplements; 4(12); 2006; pp.: 195.
Ludwig et al.; "Supportive care in multiple myelom Best Practice & Research Clinical Haematology;" 20; Issue 4; 2007; pp.:817-835.
McCann et al.; "Phase II trial of huN901-DM1 in patients with relapsed small cell lung cancer (SCLC) and CD56-positive small cell carcinoma;" J Clin Onco; ASCO Annual Meeting Proceedings Part 1; 25(18S); 2007 June 20; Supplement; p.:18084.
Mateos et al.; "Bortezomib plus melphalan and prednisone in elderly untreated patients with multiple myeloma: results of a multicenter phase 1/2 study;" Blood; 108; 2006; pp.: 2165-2172.
McCune et al.; "The SCID-hu mouse: murine model for the analysis of human hematolymphoid differentiation and function;" Science; 241; 1998; pp.: 1632-1639.
Mennerich et al.; "Shift of syndecan-1 expression from epithelial to stromal cells during progression of solid tumours;" Eur J Cancer; 40(9); June 2004; pp.: 1373-82.
Milowsky et al.; "Phase I/II trial of the prostate-specific membrane antigen (PSMA)-targeted immunoconjugate MLN2704 in patients (pts) with progressive metastatic castration resistant prostate cancer (CRPC);" J Clin Onco; ASCO Annual Meeting Proceedings Part I; 24(18S); 2006 p.: 4500.
Mita et al.; "A phase I study of a CanAg-targeted immunoconjugate, huC242-DM4, in subjects with CanAg-expressing solid tumors;" J Clin Onco; ASCO Annual Meeting Proceedings Part 1; 25(18S); 2007 June 20; Supplement; p.: 3062.
Mitsogiannis et al; "Plasmacytoid transitional cell carcinoma of the urinary bladder;" Urology66(1); 2005; p. 194.
Morgan et al.; "Advances in oral therapy for multiple myeloma;" Lancet Oncol; 7(4); April 2006; pp.:316-25.
Mosmann T.; "Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays;" J Immunol Methods; 65; 1983 pp.:55-63.
Munshi et al.; "Plasma cell disorders;" In: Braunwald E, Fauci AS, Kasper DL, Hauser SL, Longo DL, Jameson JL, editors; Harrison's Principles of Internal Medicine; 16th ed; New York : McGraw-Hill Medical Publishing Division; 2008. pp.: 700-707.
Namikawa et al.; "Growth of human myeloid leukemias in the human marrow environment of SCID-hu mice;" Blood; 82; 1993; pp.:2526-2536.
NCCN Guidelines; "NCCN Clinical Practice Guidelines in Oncology;" Multiple Myeloma V.2.2009; National Comprehensive Cancer Network; November 9, 2008; available at www.nccn.org.
Ning et al.; "Liposomal doxorubicin in combination with bortezomib for relapsed or refractory multiple myeloma;" Oncology (Williston Park); 21(12); November 277; pp.:1503-8.
Numa et al.;"Syndecan-1 expression in cancer of the uterine cervix: association with lymph node metastasis; Int J Oncol. 20(1); pp.:2002 39-43.
Ocio et al., "New drugs in multiple myeloma: mechanisms of action and phase I/II clinical findings;" Lancelt Oncol: 9(12); December 2008; pp.:1157-65.
O'Connell et al.; "CD138 (Syndecan-1), a Plasma Cell Marker Immunohistochemical Profile in Hematopoietic and Nonhematopoietic Neoplasms;" Am J Clin Pathol; 121; 2004; pp.:254-263.
Ojima et al.; "Tumor-specific novel taxoid-monoclonal antibody conjugates;" J. Med. Chem.; 45; 2002; pp. 5620-5623.
Oken et al.; "Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group;" Am J Clin Oncol; 5; 1982; pp.: 649-655.
Olafsen et al.; "Covalent disulfide-linked anti-CEA diabody allows site-specific conjugation and radiolabeling for tumor targeting applications;" Prot. Eng. Design & Selection 17; 1; 2004; pp.:21-27.
Orosz et al.; "Syndecan-1 expression in different soft tissue tumours;" Anticancer Res; 21(1B); 2001; pp.:733-7.
Padlan, EA; "A possible procedure for reducing the immunogenicity of antibody variable domains while preserving their ligand-binding properties;" Mol. Immunol.; 28; 1991; pp.: 489-498.
Palacios et al.; "B-B4 monoclonal antibody and identification of human bone marrow plasma cells;" Br J Haematol; 96(3); March 1997; pp.:655-657.
Palumbo et al.; "Oral revlimid plus melphalan and prednisone (R-MP) for newly diagnosed multiple myeloma: results of a multicenter Phase I/II study;" Blood; 108; (ASH Annual Meeting Abstracts); Abstract 800; 2006.
Palumbo et al.; "Treatment of newly diagnosed myeloma;" Leukemia; 23; November 13, 2008; pp.: 449-456.
Patriarca et al.; "Considerations in the treatment of multiple myeloma: a consensus statement from Italian experts;" Eur J Haematol; 82(2); February 2009; pp.:93-105.
Payne G.; "Progress in immunoconjugate cancer therapeutics;" Cancer Cell; 3; 2003; pp.:207-212.
Pegram et al.; "Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neu-overexpressing metastatic breast cancer refractory to chemotherapy treatment;" J. Clin. Oncol.; 16; 1998; pp.: 2659-2671.
Podar et al.; "Bone marrow microenvironment and the identification of new targets for myeloma therapy;" Leukemia; 23(1); January 2009; pp.: 10-24.
Qin et al.; "The pharmacokinetics and pharmacodynamics of IMGN242 (huC242-DM4) in patients with CanAg-expressing solid tumors;" Journal of Clinical Oncology, 2008 ASCO Annual Meeting Proceedings (Post-Meeting Edition); 26(15S); May 20, 2008; Supplement; p.: 3066.
Quach et al.: "Mechanism of action of immunomodulatory drugs (ImiDS) in multiple myeloma," Leukemia; 24; 2010; pp.: 22-32.
Raje et al.; "Therapeutic use of immunomodulatory drugs in the treatment of multiple myeloma;" Expert Rev Anticancer Ther; 6(9); September 2006; pp.: 1239-47.
Rajkumar et al.; "Combination therapy with lenalidomide plus dexamethasone (Rev/Dex) for newly diagnosed myeloma;" Blood; December 15, 2005; 106(13); pp.: 4050-4053.
Rajkumar et al.; "Phase III clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma: A clinical trial coordinated by the Eastern cooperative Oncology Group;" J Clin Oncol 2006; 24; pp.: 431-436.
Rajkumar et al.; "A Randomized Trial of Lenalidomide Plus High-Dose Dexamethasone (RD) Versus Lenalidomide Plus Low-Dose Dexamethasone (Rd) in Newly Diagnosed Multiple Myeloma (E4A03): A Trial Coordinated by the Eastern Cooperative Oncology Group;" Blood; 110; 2007; p.: 74.
Rawstron et al.; "Circulating plasma cells in multiple myeloma: characterization and correlation with disease stage;" Br J Haematol; 97; 1997; pp.: 46-55.
Remillard et al.; "Antimitotic activity of the potent tumor inhibitor maytansine;" Science; 198; 1975; pp.:1002-1005.
Richardson et al.; "New treatments for multiple myeloma;" Oncology (Williston Park); 19(14); December 2005; pp.:1781-92.
Richardson et al.; "Lenalidomide in multiple myeloma;" Expert Rev Anticancer Ther, 6(8); August 2006; pp.:1165-73.
Richardson et al.; "New Drugs for Myeloma;" Oncologist Jun; 12(6); 2007; pp.:664-89.
Richardson et al.; "Lenalodomide, bortezomib, and dexamethasone as front-line-therapy for patients with multiple myeloma (MM): preliminary results of a phase I/II study;" Blood; 110; 2007; p.: 63a.
Riechelmann et al.; "Phase I trial with the CD44v6-targeting immunoconjugate bivatuzumab mertansine in head and neck squamous cell carcinoma;" Oral Oncol; 44(9); September 2008; pp.:823-9.
Roh et al.; "Syndecan-1 expression in gallbladder cancer and its prognostic significance;" Eur Surg Res. 41(2); 2008; pp.:245-50.
Roguska et al.; "Humanization of murine monoclonal antibodies through variable domain resurfacing;" Proc Natl Acad Sci U S A; 91; 1994; pp.:969-973.
Ross et al.; "Prostate stem cell antigen as therapy target: tissue expression and in vivo efficacy of an immunoconjugate;" Cancer Res.; May 1, 2002; 62(9) pp.:2546-53.
Ross et al.; "Anticancer Antibodies;" Am J Clin Path; 119; April 17, 2003; pp.: 472-485.
Rowinsky et al.; "SB-408075, a tumor-activated immunoconjugate targeting the C242 CanAg antigen with a potent maytansinoid payload: phase I, pharmacokinetic (PK), and biological studies;" Proc Am Soc Clin Oncol 21: Abstract #118; 2002.
Rupp et al.; "Safety and pharmacokinetics of bivatuzumab mertansine in patients with CD44v6-positive metastatic breast cancer: final results of a phase I study;" Anticancer Drugs; 18(4); April 2007; pp.:477-485.
Salfeld, "Isotype selection in antibody engineering", Nat. Biotechnol. 25 (12), 2007, pp. 1369-1372.
Sanderson et al.; "B lymphocytes express and lose syndecan at specific stages of differentiation;" Cell Regul.; 1989; 1; pp.:27-35.
Sandhu et al.; "Human hematopoiesis in SCID mice implanted with human adult cancellous bone;" Blood; 88; 1996; pp.:1973-1982.
Sankhala et al.; "A phase I and pharmacokinetic study of a CanAg-targeted immunoconjugate, HuC242-DM4, in patients with CanAg-expressing solid tumors;" AACR-NCI-EORTC "Molecular Targets and Cancer Therapeutics" International Conference; Abstract #B70; 2007.
Sasaki et al.; "Bisphosphonate risedronate reduces metastatic human breast cancer burden in bone in nude mice;" Cancer Res.; 55; 1995; pp.: 3551-3557.
Sauter et al.; "Pharmacokinetics, immunogenicity and safety of bivatuzumab mertansine, a novel CD44v6-targeting immunoconjugate, in patients with squamous cell carcinoma of the head and neck;" Int J Oncol.; 30(4); April 2007; pp.: 927-35.
Schneider et al.; "Two subsets of peripheral blood plasma cells defined by differential expression of CD45 antigen;" Br J Haematol; 97; 1997; pp.: 56-64.
Schuurman, et al.; "Normal human immunoglobulin G4 is bispecific: it has two different antigen-combining sites;" Immunology; 97; 1999; pp.: 693-698.
Sebestyen et al.; "Syndecan-1 (CD138) expression in human non-Hodgkin lymphomas. Br J Haematol;" 104(2); 1999; pp.: 412-9.
Seftalioglu et al.; "Syndecan-1/CD138 expression in normal myeloid, acute lymphoblastic and myeloblastic leukemia cells;" Acta Histochem; 105; 2003; pp.:213-221.
Seftalioglu et al.; "Syndecan-1 (CD138) expression in acute myeloblastic leukemia cells--an immuno electron microscopic study;" Acta Oncol; 42; 2003; pp.:71-74.
enter et al.; "Cures and regressions of established tumors with monoclonal antibody auristatin conjugates;" Abstract #2062, American Assoication for Cancer Res. (San Francisco, CA: American Association for Cancer Res.); 2007; p.: 414.
Shah et al.; "Expression of syndecan-1 and expression of epidermal growth factor receptor are associated with survival in patients with nonsmall cell lung carcinoma;" Cancer 101(7); 2004 ; pp.:1632-8.
Shields et al.; "High resolution mapping of the binding site on human IgG1 for Fc gamma RI, Fc gamma RII, Fc gamma RIII, and FcRn and design of IgG1 variants with improved binding to the Fc gamma R.;" J Biol Chem; 276(9); 2001; pp.:6591-604.
Sievers et al.; "Efficacy and safety of gemtuzumab ozogamicin in patients with CD33-positive acute myeloid leukemia in first relapse;" J. Clin. Oncol.; 19; 2001; pp. 3244-3254.
Sievers et al.; "Mylotarg: antibody-targeted chemotherapy comes of age;" Curr. Opin. Oncol.; 13; 2001; pp. 522-527.
Smith R.; "Single chain antibody variable region fragments;" available at www.stanford.edu/ ~smithr/science/scfv.html (last updated on May, 2001).
Strobeck M; "Multiple Myeloma therapies;" Nature Reviews Drug Discovery; 6(3); March 2007; pp.: 181-82.
Studnicka et al.; "Human-engineered monoclonal antibodies retain full specific binding activity by preserving non-CDR complementarity-modulating residues;" Protein Eng.; 7(6); 1994 pp.: 805-814.
Tai et al; "Immunomodulatory drug lenalidomide (CC-5013, IMiD3) augments anti-CD40 SGN-40-induced cytotoxicity in human multiple myeloma: clinical implications;" Cancer Res. 2005 Dec 15; 65(24):11712-20.
Takimoto et al.; "Principles of oncologic pharmacotherapy;" Cancer Management: A multidisciplinary Approach; 11th Edition; Chapter 3; 2008; April 15, 2009; available at http://www.cancernetwork.com/display/article/10165/1402628.
Tassone et al.; "Cytotoxic activity of the maytansinoid immunoconjugate B-B4-DM1 against CD138+ multiple myeloma cells;" Blood; 104(12); 2004; pp.: 3688-3696.
Terpos et al.; "European Myeloma NetworkThe use of bisphosphonates in multiple myeloma: recommendations of an expert panel on behalf of the European Myeloma Network;" Ann Oncol. 20(8); 2009; pp.:1303-17.
Tijink et al.; " A phase I dose escalation study with anti-CD44v6 bivatuzumab mertansine in patients with incurable squamous cell carcinoma of the head and neck or esophagus;" Clin Cancer Res; 12(20 Pt 1); October 15, 2006; pp.:6064-72.
Tolcher et al.; "A Phase I study of huC242-DM4 to assess the safety and pharmacokinetics of huC242-DM4 administered as a single intravenous infusion once every three weeks to subjects with solid tumors;" European Journal of Cancer Supplements;12(4); 2006 p.: 66.
Tolcher et al.; "Cantuzumab mertansine, a maytansinoid immunoconjugate directed to the CanAg antigen: a phase I, pharmacokinetic, and biologic correlative study;" J Clin Oncol; 21; 2003; pp.: 211-222.
Tomayko et al., "Determination of subcutaneous tumor size in athymic (nude) mice;" Cancer Chemother. Pharmacol, 24; 1989; pp.: 148.
Toyoshima et al.; "Expression of syndecan-1 is common in human lung cancers independent of expression of epidermal growth factor receptor;" Lung Cancer 31(2-3); 2001; pp.:193-202.
Udi, "In vitro analyse von Standard und innovativen anti-Multiplen Myelom (MM)-Therapien auf MM-Zelllinien und deren Interaktion mit dem Knochenmark (KM)-Milieu," Diss. Medical University Clinic and Polyclinic, Albert-Ludwigs-University Freiburg, Freiburg, Germany, 2010.
Urashima et al; "The development of a model for the homing of multiple myeloma cells to human bone marrow;" Blood; 90; 1997; pp.: 754-765.
Vogel, CW; "Preparation of immunoconjugates using antibody oligosaccharide moieties;" Methods in Molecular Biology: Bioconjugation protocols strategies and methods; 283; 2007 pp.: 87-108.
Vooijs et al; "Efficacy and toxicity of plasma-cell-reactive monoclonal antibodies B-B2 and B-B4 and their immunotoxins;" Cancer Immunol Immunother; 42; 1996; pp.: 319-328.
Wang et al.; "Targeted proteasome inhibition by Velcade induces apoptosis in human mesothelioma and breast cancer cell lines;" Cancer Chemother Pharmacol; December 4, 2009.
Ward et al.; "Binding activities of a repertoire of single immunoglobin variable domains secreted from Escherichia coli;" Nature; 341; 1989; pp.:544-546.
Wargalla et al.; "Rate of internalization of an immunotoxin correlates with cytotoxic activity against human tumor cells;" Proc. Natl. Acad. Sci. USA; 86; 1989; pp.:5146-5150.
Weber et al.; "Lenalidomide plus high-dose dexamethasone provides improved overall survival compared to high-dose dexamethasone alone for relapsed or refractory multiple myeloma (MM): results of 2 Phase III studies (MM-009, MM-010) and subgroup analysis of patients with impaired renal function;" Blood; 108; (ASH Annual Meeting Abstracts); Abstract 3547; 2006.
Wiksten et al.; "Comparison of the prognostic value of a panel of tissue tumor markers and established clinicopathological factors in patients with gastric cancer;" Gastric: Anticancer Res. 28(4C); 2008; pp.: 2279-87.
Wijdenes et al.; "A plasmocyte selective mAb (B-B4) recognizes syndecan-1;" Br J Haematol; 94(2) August 1996; pp.:318-23.
Wijdenes et al.; "CD138;" J Biol Regul Homeost Agents; 16(2) April-June 2002; pp.: 152-155.
Witzig et al; "Detection of myeloma cells in the peripheral blood by flow cytometry;" Cytometry; 26; 1996; pp.: 113-120.
Xie et al.; "Pharmacokinetics and biodistribution of the antitumor immunoconjugate, cantuzumab mertansine (huC242-DM1), and its two components in mice;" J Pharmacol Exp Ther.; 308(3); March 2004; pp.:1073-82.
Yang et al.; "Genetically fluorescent melanoma bone and organ metastasis models;" Clin Cancer Res; 5; 1999; pp. :3549-3559.
Yang et al.; "Whole-body optical imaging of green fluorescent protein-expressing tumors and metastases;" Proc Natl Acad Sci U S A; 97; 200; pp.:1206-1211.
Yang et al.; "The syndecan-1 heparan sulfate proteoglycan is a viable target for myeloma therapy;" Blood; 110(6); September 15, 2007 pp.: 2041-8.
Yasui et al.; "Recent advances in the treatment of Multiple Myeloma;" Curr Pharm Biotechnol; 7(5); October 2006; pp.:381-93.
Yoshitake et al.; "Conjugation of glucose oxidase from Aspergillus niger and rabbit antibodies using N-hydroxysuccinimide ester of N-(4-carboxycyclohexylmethyl)-maleimide;" Eur J Biochem; 101; 1979; pp.: 395-399.
Yu et al.; "Antitumor synergy of CV787, a prostate cancer-specific adenovirus, and paclitaxel and docetaxel;" Cancer Research; 61; January 15, 2001; pp.: 517-525.
Zellweger et al.; "Tissue microarray analysis reveals prognostic significance of syndecan-1 expression in prostate cancer;" Prostate 55(1); 2003; pp.:20-9.
본 발명은, 특정 구현예에서, 상기한 요구 뿐만 아니라, 하기 언급되는 내용을 통해 당해 기술 분야의 당업자에게 보다 명확해지는 당해 분야에서 요구되는 그외 요구들을 충족시킨다.
본 발명은,
면역접합체 및 약제학적으로 허용가능한 담체를, 이를 필요로 하는 환자에게, 적어도 3주간 주당 1회로 투여하는 단계를 포함하며,
3주의 기간은 각각 선택적으로 휴지기가 후행되며,
상기 면역접합체가,
CD138 발현 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
하나 이상의 작동자 분자를 포함하며,
상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 상기 면역접합체를 형성하며,
주당 적어도 1회 이상으로 투여되는 면역접합체의 용량은 약 20 mg/m2 - 약 280 mg/m2이고, 예컨대 주당 1회로 약 40 mg/m2 - 약 140 mg/m2의 용량이며,
약학 조성물은 적어도 3주간 단독으로 또는 세포독성 물질과 조합하여 투여되는 것인,
CD138을 발현하는 타겟 세포와 관련된 질환의 치료 방법에 관한 것이다.
또한, 본 발명은,
필요한 개체, 특히 인간 개체에게, CD138 발현 세포를 타겟팅하는 하나 이상의 조작된 타겟팅 항체와 하나 이상의 작동자 분자를 포함하는 면역접합체를 투여하는 단계를 포함하며,
상기 조작된 타겟팅 항체가 상기 작동자 분자에 기능적으로 결합하여 상기 면역접합체를 형성하며,
바람직하게는, 상기 조작된 타겟팅 항체의 적어도 일부는 IgG4 이소형 특성을 부여하며,
상기 면역접합체는, 2회 이상의 투여를 포함하는 다회 투약 용법 (multiple dose regimen)으로 투여되며, 21일로 구성된 활성 치료 사이클과 같은 활성 치료 사이클 동안에 투여되는 총 용량 (aggregate dose)은 총 최대 내성 용량 (AMTD)이거나 또는 AMTD의 일부 (fraction)이며, 상기 AMTD 및/또는 상기 AMTD의 일부인 용량은, 면역접합체를 상기 활성 치료 사이클에서 1회, 바람직하게는 1일에 투여하는 경우에 용량 제한 독성 (DLT)을 형성하는 용량 보다 높거나, 및/또는 면역접합체를 반복적인 단회 투약 (repeated single dose) 등의 단회 투약으로서 투여하는 경우 최대 내성 용량 (MTD) 보다 높은,
CD138을 발현하는 타겟 세포와 관련된 질환의 치료 방법에 관한 것이다.
AMTD는, DLT의 용량을 적어도 20%로 초과하며, MTD를 적어도 30%로 초과할 수 있다. AMTD는 적어도 240 mg/m2, 바람직하게는 300 mg/m2, 더 바람직하게는 360 mg/m2 또는 420 mg/m2일 수 있으며, 상기 DLT를 형성하는 용량은 180 mg/m2 또는 200 mg/m2일 수 있다. AMTD는 적어도 240 mg/m2, 바람직하게는 300 mg/m2, 더 바람직하게는 360 mg/m2 또는 420 mg/m2일 수 있으며, MTD는 적어도 160 mg/m2 또는 적어도 180 mg/m2일 수 있다.
면역접합체는 21일내에 적어도 3번, 바람직하게는 동일한 용량으로 투여할 수 있다.
다회 투약 용법 (multiple dose regimen)은 3주간 지속될 수 있으며, 이후 휴지기가 올 수 있다. 이러한 휴지기 동안에는, 무-진행성 생존 (progression free survival) 또는 안정적인 질환 상태 (stable disease)가 유지될 수 있다. 상기 휴지기 동안에, 개체의 체액내 면역접합체의 수준은 적어도 또는 최대 0.5 ㎍/ml, 1 ㎍/ ml, 2 ㎍/ml, 3 ㎍/ml, 4 ㎍/ml, 5 ㎍/ ml 또는 6 ㎍/ml일 수 있다.
CD138을 발현하는 타겟 세포, 특히 CD138을 발현하는 분리된 타겟 세포, 바람직하게는, 예컨대 본 발명에 따른 면역접합체의 투여를 종료한 후 24시간 이내, 바람직하게는 18시간 이내, 12시간 이내, 8시간 이내 또는 4시간 이내에, 골수 천자액내 골수종 세포 등의 비-고형 종양으로부터 분리된 타겟 세포에서의, "수용체 점유율"은, 일 구현예에서, 60% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상 또는 95% 이상이다. 후속 투여하기 전, 또는 투여를 완료한 후, 각각, 48시간 이후, 72시간 이후, 96시간 (4일) 이후, 120시간 (5일) 이후 또는 144시간 (6일) 이후에, CD138을 발현하는 타겟 세포의 "수용체 점유율"은 70% 이하, 60% 이하, 55% 이하, 50% 이하, 45% 이하, 또는 40% 이하이다.
일 구현예에서, 면역접합체의 투여를 종료한 후 24시간, 18시간, 12시간, 8시간 또는 4시간 경과시 CD138을 발현하는 타겟 세포의 "수용체 점유율"과, 투여 종료 후 48시간 이상, 72시간 이상, 96시간 (4일) 이상, 120시간 (5일) 이상 또는 144시간 (6일) 이상 경과시 상기 타겟 세포의 "수용체 점유율" 차이는, 적어도 5%, 적어도, 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45% 또는 적어도 50%이며, 바람직하게는 10% - 50% 또는 20% - 40%이다.
다른 구현예에서, 면역접합체 투여를 종료한 후 24시간, 바람직하게는 18시간 이내, 12시간 이내, 8시간 이내 또는 4시간 이내에 CD138을 발현하는 타겟 세포의 "수용체 점유율"은, 면역접합체를 상대적으로 낮은 농도, 예를 들어 21일 치료 사이클에서 1회 투여시 면역접합체의 정해진 DLT의 50% 이하, 60% 이하, 70% 이하, 80% 이하이나, 일반적으로 10% 이상, 20% 이상, 30% 이상인 농도로 투여하더라도, 높으며, 즉, 60% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 또는 95% 이상이다. 또 다른 구현예에서, 후속 투여 전의 CD138을 발현하는 타겟 세포의 "수용체 점유율", 또는 투여 종료 후 각각 48시간 이상, 72시간 이상, 96시간 (4일) 이상, 120시간 (5일) 이상 또는 144시간 (6일) 이상 경과시, CD138을 발현하는 타겟 세포의 "수용체 점유율"은, 면역접합체를 상대적으로 높은 농도, 예를 들어 21일 치료 사이클에서 1회 투여시 면역접합체의 정해진 DLT의 50% 이상, 60% 이상, 70% 이상, 80% 이상인 농도로 투여하더라도, 70% 이하, 60% 이하, 55% 이하, 50% 이하, 45% 이하 또는 40% 이하이다.
또한, 본 발명은 21일 동안 환자에게 메이탄시노이드, 특히 DM4를, 2 mg/m2 이상, 3 mg/m2 이상, 4 mg/m2 이상, 5 mg/m2 이상, 6 mg/m2 이상, 7 mg/m2 이상, 8 mg/m2 이상, 9 mg/m2 이상 또는 10 mg/m2 이상으로, 바람직하게는 본원에 언급된 임의의 한가지 방법에 따라 투여하는 것에 관한 것이다.
투여는, 주당 적어도 1회로, 바람직하게는 적어도 3주간 동일 용량으로 투여한 후, 휴지기, 예를 들어 1주일이 후행되는 방식으로 수행될 수 있다. "휴지기"는, 이 문맥에서는, 환자에 대해 확립된 치료 스케줄에 따라, 다음 투여가 이루어져야 하지만 아직 투여하지는 않는, 주어진 시점 이후의 기간을 의미한다. 예를 들어, 1일, 8일 및 15일째의 매주 투여를 포함하는 투여 스케줄에서, 휴지기는 투여하지 않는 22일 이후의 시기이다. 이러한 예에서, 휴지기는 2주의 무-치료 기간을 형성한다. 3주 이상의 기간과 이후의 휴지기는 적어도 28일의 치료 사이클을 규정할 수 있으며, 치료 사이클 2회 또는 3회 이후에, 적어도 안정적인 질환 상태가 달성될 수 있다. 면역접합체는, 예를 들어, 상기 3주간의 기간 동안 3일 마다, 4일 마다, 5일 마다 또는 6일 마다 투여할 수 있다. 적어도 안정적인 질환 상태는 치료 사이클 3회, 4회, 5회, 6회, 7회 동안 유지될 수 있다. 적어도 안정적인 질환 상태에 도달한 후, 면역접합체는 상기 21일 동안 3회 이하 또는 2회 이하로, 바람직하게는 상기 21일 동안 1회의 유지 요법으로서, 바람직하게는 약 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2, 약 100 mg/m2, 약 110 mg/m2, 약 120 mg/m2, 약 130 mg/m2, 약 140 mg/m2, 150 mg/m2, 약 160 mg/m2, 약 170 mg/m2, 약 180 mg/m2, 약 190 mg/m2 및 약 200 mg/m2 등의, 60 mg/m2 - 200 mg/m2의 반복적인 단회 투약로서 투여할 수 있다. 적어도 무-진행성 생존, 안정한 질환 상태 및/또는 마이너 반응이 유지 요법을 수행하는 동안 3달 이상 달성될 수 있다.
적어도 21일간 지속되는 치료 사이클에서 반복적인 다회 투약로서 상기 면역접합체가 투여되어, 각 사이클에서 마지막 투여 후, 개체의 체액에서 면역접합체는 총 유효량과 제1 수준을 형성할 수 있으며, 상기 총 유효량에 해당되는 양을 상기 치료 사이클에서의 단회 투약 또는 반복적인 단회 투약로서 투여되어, 상기 개체의 체액에서 면역접합체의 제2 수준을 형성할 수 있으며, 이때 상기 제1 수준은 상기 제2 수준과 동일하거나 낮으며, 예컨대 상기 제2 수준 보다 10% 이상, 20% 이상 또는 30% 이상 낮을 수 있다.
치료 사이클은 21일간 지속되거나, 및/또는 반복적인 다회 투약은 3번의 등가 투약, 바람직하게는 등간격 투약 (equidistant dose), 더 바람직하게는 1일, 8일 및 15일째의 투여로 구성될 수 있다. 총 유효량은 적어도/최대 200 mg/m2, 약 220 mg/m2, 약 240 mg/m2, 약 260 mg/m2, 약 280 mg/m2, 약 300 mg/m2, 약 360 mg/m2 또는 약 420 mg/m2일 수 있다.
면역접합체 또는 약학 조성물은 21일의 치료 사이클을 적어도 2회 수행하는 동안 투여할 수 있으며, 각 치료 사이클 사이에는 1주일의 휴지기가 존재한다. 투여는, 21일의 치료 사이클을 2회 이상 수행한 후, 계속될 수 있으며, 각 치료 사이클 다음에는 선택적으로 휴지기가 후속되거나 및/또는 면역접합체 또는 약학 조성물이 유지 요법으로서 추가로 후행된다. 유지 요법은, 면역접합체 또는 이를 포함하는 약학 조성물을, (i) 3주 내지 6주 마다 1회, 또는 (ii) 반복적인 다회 투약하는 것을 포함할 수 있으며, 이때 면역접합체의 각각의 개개 용량은, 1차 요법의 개개 용량 보다 약 10 mg/m2, 약 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2, 약 100 mg/m2, 약 110 mg/m2 또는 약 120 mg/m2 적거나, 및/또는 개개 용량을 개개 투여 간격을 초과하지 않는 간격으로, 예를 들어 1, 2, 3, 4, 5, 6, 7일 간격으로 투여할 수 있다. 다회 투약 용법으로서 면역접합체의 임의 투여는, 투여 완료 후 0-2시간에, 적어도 7 ㎍/ml, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 50, 60, 70, 80, 90 또는 100 ㎍/ml의 평균 혈장 수준을 형성할 수 있다.
본 발명의 방법은, 면역접합체 또는 이를 포함하는 약학 조성물의 투여를 종료한 후, 약 1, 2, 3 또는 4시간 등의 0-4시간에, 환자의 체액에서 상기 면역접합체의 기준 수준 또는 효능 혈액 파라미터의 기준 수준을 측정하는 단계, 및 상기 면역접합체의 후속 투여 시, 후속 투여를 종료하고 0-4시간에, 상기 면역접합체나 효능 혈액 파라미터의 후속 수준을 측정하는 단계를 더 포함할 수 있으며, 이때, 상기 기준 수준이 상기 후속 수준 보다 높을 경우, 상기 후속 투여 이후의 치료 사이클에서의 총 용량을 10-50% 또는 20-30% 등의 5-100% 높일 수 있으며, 및/또는 상기 기준 수준이 상기 후속 수준 보다 낮을 경우, 상기 후속 투여 이후의 치료 사이클에서는 총 용량을 10-50% 또는 20-30% 등의 5-100% 낮출 수 있다.
또한, 본 발명의 방법은, 면역접합체 또는 이를 포함하는 약학 조성물의 개개 용량을 투여 완료한 후 0-2시간에, 체액에서 상기 면역접합체의 수준을 측정하는 단계를 추가로 포함할 수 있으며, 이때, 상기 수준이 7 ㎍/ml, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 ㎍/ml 보다 낮으면, 상기 개개 용량을 다음번 치료 사이클에서 적어도 10 mg/m2, 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2 또는 약 100 mg/m2 만큼 높일 수 있다.
또한, 본 발명의 방법은, 면역접합체 또는 이를 포함하는 약학 조성물의 개개 용량을 투여 완료한 후 0-2시간에, 체액내 상기 면역접합체의 수준을 측정하는 단계를 더 포함할 수 있으며, 이때, 상기 수준이 50 ㎍/ml, 60, 70, 80 또는 100 ㎍/ml 보다 높으면, 다음번 치료 사이클에서는 개개 용량을 적어도 10 mg/m2, 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2, 약 100 mg/m2, 약 110 mg/m2 또는 약 120 mg/m2 만큼 낮출 수 있다.
본 발명의 임의 방법에서, 하나 이상, 예로 2 또는 3종의 세포독성 물질을 치료 사이클 동안 1회 또는 주당 적어도 1회로 투여할 수 있다. 상기 세포독성 물질은 레날리도마이드 및/또는 덱사메타손일 수 있다. 약물 조합물을 투여받는 개체는 CD138을 발현하는 세포를 타겟팅하는 항체를 포함하는 면역접합체, 레날리도마이드 및/또는 덱사메타손에 이전에 노출된 적 있거나 또는 노출된 적 없을 수 있다. 상기 개체는 CD138을 발현하는 세포를 타겟팅하는 항체를 포함하는 면역접합체, 레날리도마이드 및/또는 덱사메타손에 노출시 반응을 나타낼 수 있다. CD138을 발현하는 타겟 세포는 CD138을 발현하는 세포를 타겟팅하는 항체를 포함하는 면역접합체, 레날리도마이드 및/또는 덱사메타손에 노출시 불응성일 수 있다. 상기 개체는, 상기 이전 노출된 이후에 재발할 수 있다. 레날리도마이드는, 5 - 35 mg의 용량으로, 바람직하게는, 약 25 mg, 또는 25, 20, 15 또는 10 mg 이하의 용량으로, 더 바람직하게는, 예를 들어 21일 또는 28일의 치료 사이클에서 경구로 매일 1회로 투여할 수 있으며, 및/또는 덱사메타손은 20 - 50 mg의 용량으로, 바람직하게는 약 40 mg, 또는 40 또는 30 mg 이하의 용량으로, 예를 들어 21일 또는 28일의 치료 사이클에서 경구로 매일 1회로, 또는 예를 들어 28일 동안 1-4일, 9-12일, 17-20일에, 또는 1일, 8일, 15일 및 22일에 투여할 수 있다.
개체는 CD138을 발현하는 타겟 세포를 포함하는 고형 종양을 앓을 수 있으며, 고형 종양은 암 호르몬 치료 또는 화학치료에 난치성일 수 있거나, 또는 개체는 호르몬 치료 또는 화학치료 이후에 재발할 수 있으며, 이때, 투여로 적어도 종양 증식 지연 또는 종양 정체 (tumor stasis)가 이루어질 수 있다. 면역접합체는 개개 용량 20 mg/m2 - 160 mg/m2으로 반복적인 다회 투약으로 투여할 수 있다. 고형 종양은 에스트로겐 수용체 네거티브 및/또는 프로게스테론 수용체 네거티브 및/또는 Her2/neu 네거티브, 예컨대 트리플-네거티브 유방암과 같이, 이들 3종 모두를 가진 트리플 네거티브일 수 있다.
또한, 면역접합체 또는 약학 조성물의 투여에 앞서, 다른 타겟팅 물질, 예컨대 CD138 발현 세포를 타겟팅하는 비-접합형 항체의 투여가 선행될 수 있으며, 이때 상기 면역접합체는 상기 비-접합형 항체의 투여를 종료한 후 1-6시간, 바람직하게는 2-4시간 경과시 투여한다. 비-접합형 항체는 개체의 체액내, 특히 개체의 혈장내 면역접합체 10 - 30 ㎍/ml의 수준에 해당되는 용량으로 투여할 수 있다. 투여되는 용량은, 개체에게 면역접합체의 투여를 종료한지 0-2시간 경과시 체액에서의 면역접합체의 이론적인 수치와 실제 수치 간의 대략적인 차이에 해당될 수 있다. 타겟팅 물질은 10 - 40 mg/m2, 바람직하게는 20-30 mg/m2의 용량으로 투여할 수 있다. 그 결과, 면역접합체는, 상기 비-접합형 항체의 투여없이 투여하는 용량 보다 최대 10 mg/m2, 최대 20 mg/m2 또는 최대 30 mg/m2 낮은 개개 용량으로 투여할 수 있다.
또한, 본원에 기술된 본 발명의 치료 방법의 특징들은 의학적 용도 측면에, 예를 들어 하기와 같이 적용된다:
a) 필요한 개체에서, 특히 인간 개체에서, CD138을 발현하는 타겟 세포와 관련된 질환의 치료용 약제를 제조하기 위한 면역접합체의 용도 (또는 필요한 개체에서, 특히 인간 개체에서, CD138을 발현하는 타겟 세포와 관련된 질환을 치료하는데 사용하기 위한 면역접합체)로서,
면역접합체는,
CD138을 발현하는 세포를 타겟팅하는 하나 이상의 조작된 타겟팅 항체, 및
하나 이상의 작동자 분자를 포함하며,
상기 조작된 타겟팅 항체에 상기 작동자 분자가 기능적으로 부착되어 상기 면역접합체를 형성하며,
바람직하게는, 상기 조작된 타겟팅 항체의 적어도 일부가 IgG4 이소형 특성을 부여하며,
상기 면역접합체는 2회 이상의 투여를 포함하는 다중 투여 용법으로 투여되며, 활성 치료 사이클시에 투여되는 총 용량은 총 최대 허용 용량 (AMTD) 또는 AMTD의 분획이며, 상기 AMTD 및/또는 상기 분획은, 면역접합체를 복수의 단회 투여 용법의 일부로서와 같이 단회 투여로 투여하는 경우에는 용량 제한 독성 (DLT)을 발생시키는 용량 보다 많거나, 및/또는 상기 활성 치료 사이클시 복수의 단회 투여 용법의 일부로서와 같이 단회 투여로서 면역접합체를 투여하는 경우에는 최대 허용 용량 (MTD) 보다 많으며;
b) 필요한 환자에서 CD138을 발현하는 타겟 세포와 관련된 질환을 치료하기 위한 약제의 제조에 있어, 면역접합체 및 약제학적으로 허용가능한 담체를 포함하는 약학 조성물의 용도 (또는 필요한 환자에서 CD138을 발현하는 타겟 세포와 관련된 질환을 치료하는데 사용하기 위한, 면역접합체와 약제학적으로 허용가능한 담체를 포함하는 약학 조성물)로서, 면역접합체는 CD138 발현 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및 하나 이상의 작동자 분자를 포함하며, 상기 타겟팅 물질은 상기 작동자 분자에 기능적으로 결합하여 상기 면역접합체를 형성하며,
상기 약학 조성물은 선택적으로 휴지기가 후행되는 활성 치료 사이클에 투여되며,
주당 적어도 1회로 투여되는 상기 면역접합체의 용량은, 약 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2, 약 100 mg/m2, 약 110 mg/m2, 약 1-20 mg/m2, 약 130 mg/m2, 약 140 mg/m2, 약 150 mg/m2 또는 약 160 mg/m2, 약 170 mg/m2, 약 180 mg/m2, 약 190 mg/m2, 약 200 mg/m2, 약 210 mg/m2, 약 220 mg/m2, 약 230 mg/m2, 약 240 mg/m2, 약 250 mg/m2, 약 260 mg/m2, 약 270 mg/m2 또는 약 280 mg/m2이며, 상기 약학 조성물은 단독으로 또는 세포독성 물질과 조합하여, 적어도 3주간 투여된다.
또한, 본 발명은, 면역접합체에 대한 항체와, 별도의 용기에, 항체를 체액에 첨가함으로써 개체로부터 수득되는 체액내 면역접합체의 수준을 측정하는 방법에 대한 설명서를 포함하는, 키트에 관한 것이다. 키트는, CD138 발현 세포를 타겟팅하는 하나 이상의 조작된 타겟팅 항체와 하나 이상의 작동자 분자를 포함하는 면역접합체를 더 포함할 수 있으며, 상기 조작된 타겟팅 항체는 상기 작동자 분자와 기능적으로 결합하여 상기 면역접합체를 형성한다.
조작된 타겟팅 항체는 CD138에 대한 항원 결합 영역 (ABR)과, 추가적인 항체 영역을 포함할 수 있으며, 상기 추가적인 항체 영역의 적어도 일부분은 인간 항체의 것이며, IG4 이소형 특성을 부여한다.
질환은 다발성 골수종, 특히 재발성 또는 난치성 다발성 골수종일 수 있다. 난치성 다발성 골수종은 "원발성 난치성 골수종 (primary refractory myeloma)" 및 "재발성 및 난치성 골수종"을 포함한다.
또한, 타겟 세포 상에 CD138을 발현하는 상기 질환은, 신장 세포암, 자궁내막 암, 자궁경부암, 전립선 선암종, 췌장암, 위암, 방광암, 유방암, 간암, 결장직장암, 대장암, 편평 세포암, 폐암, 특히 편평 세포 폐암, 비-호지킨 림프종, 흉선암, 자궁암, 요로암 (urinary carcinoma) 또는 난소암으로 이루어진 군으로부터 선택될 수 있다.
바람직한 구현예에서, 면역접합체는 CD138을 발현하는 타겟 세포를 동질적으로(homogenously) 타겟팅한다.
특정 구현예에서, 본 발명의 조작된 타겟팅 항체는,
(i) 비-인간 항체의 CD138에 대한 항원 결합 영역(ABR)으로 필수적으로 구성되거나, 또는 (ii) 항원 결합 영역이 비-인간 항체의 것인, CD138에 대한 항원 결합 영역(ABR), 및
추가적인 항체 영역으로서, 이의 적어도 일부분이 인간 항체의 것인, 추가적인 항체 영역을 포함할 수 있다.
상기 ABR는,
(a) 서열번호 1의 아미노산 잔기 99 - 111번을 포함하는, 중쇄 가변부 CDR3, 및
(b) 서열번호 2의 아미노산 잔기 89 - 97번을 포함하는, 경쇄 가변부 CDR3를 각각 포함할 수 있다.
상기 ABR은, 추가로,
(a) 서열번호 1의 아미노산 잔기 31-35 및 51-68을 포함하는 중쇄 가변부 CDR1 및 CDR2, 및/또는
(b) 서열번호 2의 아미노산 잔기 24-34 및 50-56을 포함하는 경쇄 가변부 CDR1 및 CDR2를 각각 포함할 수 있다.
상기 추가적인 항체 영역은,
(a) 서열번호 1의 아미노산 잔기 123 - 448, 및/또는
(b) 서열번호 2의 아미노산 잔기 108 - 214, 각각과,
(i) 조작된 타겟팅 항체의, 항원-의존적인 세포독성 및/또는 보체-의존적인 세포독성을 유지하거나 또는 낮추거나, 및/또는
(ii) 상기 조작된 타겟팅 항체를 안정시하는, 이의 돌연변이를 포함할 수 있다.
항체는, 서열번호 2와의 서열 동일성이 적어도 약 70%, 더 바람직하게는 80%, 85% 또는 90%인 경쇄, 및 서열번호 1과의 서열 동일성이 적어도 약 70%, 더 바람직하게는 80%, 85% 또는 90%인 중쇄를 포함할 수 있다.
상기 작동자 분자는 링커를 통해 상기 조작된 타겟팅 항체에 부착될 수 있다. 링커는 이황화 결합을 포함할 수 있다. 작동자 분자 (예, DM4)는 타겟팅 항체와 작동자 분자 간에 입체 간섭 (sterical hindrance)을 제공할 수 있다. 작동자 분자는 하나 이상의 메이탄시노이드 (예, DM1, DM3 또는 DM4), 탁산 (taxane), 다른 마이크로튜불린 저해제 또는 CC1065와 같은 DNA 타겟팅 물질, 또는 이의 유사체일 수 있다.
면역접합체는 CD138에 결합할 수 있으며, 타겟팅의 편차는 150% 이하, 140% 이하, 130% 이하, 120% 이하, 110% 이하, 100% 이하, 90% 이하, 80% 이하, 70% 이하, 60% 이하 또는 50% 이하이다.
면역접합체는, 본 발명의 특정 구현예에서, 면역글로불린 중쇄 또는 일부의 아미노산 서열을 포함하는 분리된 폴리펩타이드를 포함하는, CD138을 타겟팅하는 타겟팅 물질을 포함하며, 상기 면역글로불린 중쇄 또는 이의 일부는 서열번호 1과 70% 이상의 서열 동일성을 갖는다. 상기 면역글로불린 중쇄 또는 이의 일부의 불변부는 IgG4 이소형 불변부일 수 있다.
면역접합체의 타겟팅 물질은 서열번호 2와의 서열 동일성이 약 70% 이상인 경쇄 서열을 포함할 수 있다. 또한, 면역접합체의 타겟팅 물질은 서열번호 1과의 서열 동일성이 약 70% 이상인 중쇄 서열을 포함할 수 있다.
또한, 본 발명은 종양의 증식 및/또는 종양 세포의 전파를 저해, 지연 및/또는 예방을 위한, 본원에 기술된 면역접합체들 중 임의의 것, 및 1종 이상의 약제학적으로 허용가능한 부형제를 포함하는, 약학 조성물에 관한 것이다.
약학 조성물은 본원에 기술된 세포독성 물질을 포함할 수 있다.
또한, 본 발명은, 별도의 용기에, 한가지 이상의 투약 형태로 약학 조성물과, 별도의 용기에, 이를 필요로 하는 개체에게, 특히 인간 개체에게, 본원에 논의된 반복적인 단회 투약 또는 그외 치료 용법으로 상기 한가지 이상의 투약 형태를 투여하는 방법에 대한 설명서를 포함하는, 키트에 관한 것이다.
구체적으로, 특정 구현예에서, 본 발명은 또한 CD138을 발현하는 타겟 세포와 관련된 질환을 치료하는데 사용하기 위한 본원에 기술된 면역접합체를 제공하며, 상기 면역접합체는 본원에 기술된 스케줄 및/또는 투여량으로 투여한다. 이런 방식으로 사용하기 위한 면역접합체는 약학 조성물에 포함될 수 있다. 또한, 면역접합체 또는 약학 조성물은 키트에 포함될 수 있으며, 키트는 또한 본원에 기술된 세포독성 물질 및/또는 CD138을 타겟팅하는 비-접합형 항체를 별도의 용기에 더 포함한다. 면역접합체/약학 조성물 및 세포독성 물질 및/또는 비-접합형 항체는 본원에 기술된 바와 같이 동시에, 별도로 또는 순차적으로 투여된다. 마찬가지로, 면역접합체/약학 조성물, 세포독성 물질 및/또는 CD138을 타겟팅하는 비-접합형 항체는 본원에 기술된 방식으로 동시, 별도 또는 순차적으로 사용하기 위한 조합된 조제물 형태일 수 있다.
본 발명의 일 측면에서, 본원에 기술된 임의의 면역접합체는, 이의 투여가 유익한 개체 또는 이러한 개체의 세포, 특히 인간 개체에게 투여한다. 또한, 면역접합체는 이러한 장애를 치료하기 위한 약제의 제조에 사용될 수 있다.
CD138을 발현하는 타겟 세포와 관련된 질병을 개체에서 치료하기 위한 약제의 제조에 있어, 면역접합체의 용도로서,
상기 면역접합체는
(i) CD138을 발현하는 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
(ii) 선택적으로 하나 이상의 세포독성 물질과 조합된, 하나 이상의 작동자 분자를 포함하며,
상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 면역접합체를 형성하며,
상기 개체는 면역조절제 및/또는 프로테오좀 저해제 등의 1종 이상의 세포독성 물질을 이용한 치료에 대해 무반응성 (난치성 질환)이거나 또는 반응성이 불량하며, 상기 면역접합체는 개체에게 바람직하게는 정맥내로 투여된다.
CD138을 발현하는 타겟 세포와 관련된 질병을 개체에서 치료하는데 동시, 별도 또는 순차적으로 사용하기 위한, 면역접합체와 부작용 치료제의 조합 조제물로서,
상기 면역접합체는
(i) CD138을 발현하는 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
(ii) 하나 이상의 작동자 분자를 포함하며,
상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 면역접합체를 형성하며,
상기 개체는 면역조절제 및/또는 프로테아좀 저해제 등의 한가지 이상의 세포독성 물질을 이용한 치료에 반응하지 않거나, 반응이 불량하거나 또는 재발하며,
상기 면역접합체는 단독 투여시 면역접합체를 약동학적 당량 5 mg/m2 - 140 mg/m2으로 개체에게 바람직하게는 정맥내로 투여한다.
CD138을 발현하는 타겟 세포와 관련된 질환을 개체에서 치료하는데 동시, 별도 또는 순차적으로 사용하기 위한 조합 조제물의 제조에 있어, 면역접합체와 부작용 치료제의 용도로서,
상기 면역접합체는:
(i) CD138 발현 세포를 타겟팅하는 하나 이상의 타겟팅 물질과,
(ii) 하나 이상의 작동자 분자를 포함하며,
상기 타겟팅 물질은 상기 작동자 분자에 기능적으로 결합되어 면역접합체를 형성하며,
상기 개체는, 면역조절제 및/또는 프로테아좀 저해제 등의 한가지 이상의 세포독성 물질을 이용한 치료에 무반응성이거나, 반응성이 불량하거나 또는 재발하며, 상기 면역접합체는 개체에게, 바람직하게는 정맥내로, 단독 투여시 면역접합체를 약동학적 당량 5 mg/m2 - 840 mg/m2으로 투여한다.
또한, 본 발명은, 1종 이상의 세포독성 물질; 및 CD138 발현 세포를 타겟팅하는 타겟팅 물질과 하나 이상의 작동자 분자를 포함하되, 상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 형성된, 1종 이상의 면역접합체를 포함하는, 항암 조합물에 관한 것으로,
(a) 상기 조합물은 1 이상, 1.1 이상, 1.2 이상, 1.3 이상, 1.4 이상의 시너지 비율 (synergy ratio)을 가지거나, 또는
(b) 상기 조합물은 약 1의 시너지 비율을 가지며, 상기 작동자 분자와 상기 세포독성 물질은 작용 중복 모드 (interfering mode of action)를 나타내며,
상기 항암 조합물은 1종 이상의 세포독성 물질과 1종 이상의 면역접합체를 별도의 용기에 포함하는, 약학 조성물 또는 키트이다.
세포독성 물질은 프로테오좀 저해제, 면역조절제, 항-혈관신생제, DNA 알킬화제, 히스톤 탈아세틸화 효소 또는 이들 2 이상의 혼합물일 수 있다.
세포독성 물질은 보르테조밉 또는 타르필조밉, 탈리도마이드, 레날리도마이드 또는 포말리도마이드, 멜팔란 또는 이들 2 이상의 혼합물일 수 있다.
상기 항암 조합물의 작동자 분자 및 세포독성 물질은 작용 중복 모드를 취할 수 있으며, 이러한 작용 모드는 바람직하게는 마이크로튜불린의 저해 또는 세포 주기의 정지 유도 (멜팔란, 보르테조밉 및 레날리도마이드 또는 탈리도마이드는 세포 주기의 정지를 유도하는 세포독성 물질임)를 포함한다. 다른 예로, 이는 비-중복성 작용 모드 (non-interfering modes of action)를 취할 수도 있다.
항암 조합물이 약학 조성물의 일부인 경우, 약학 조성물은 1종 이상의 약제학적으로 허용가능한 부형제를 포함할 수 있다.
또한, 항암 조합물은, 1종 이상의 세포독성 물질과 1종 이상의 면역접합체를 별도의 용기에 보관하는 키트의 일부일 수 있다.
또한, 본 발명은,
본원에 언급된 항암 조합물, 또는
1종 이상의 세포독성 물질과; CD138 발현 세포를 타겟팅하는 타겟팅 물질 및 하나 이상의 작동자 분자를 포함하되, 상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 형성된 면역접합체를 포함하는, 항암 조합물을,
유효량으로 이를 필요로 하는 환자에게 투여하는 단계를 포함하며,
상기 면역접합체가 상기 세포독성 물질에 대한 환자의 난치성 표현형을 극복하는 것을 특징으로 하는, CD138을 발현하는 타겟 세포와 관련된 질환의 치료 방법에 관한 것이다.
또한, 본 발명은 환자에게 본원에 기술된 항암 조합물을 유효량으로 투여하는 단계를 포함하며, 면역접합체가 난치성 표현형을 극복하는 것을 특징으로 하는, CD138을 발현하는 타겟 세포와 관련된 질병의 치료 방법에 관한 것이다.
또한, 본 발명은,
CD138을 발현하는 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및 하나 이상의 작동자 분자를 포함하되, 상기 타겟팅 물질이 기능적으로 상기 작동자 분자과 결합하여 형성된 면역접합체를, 유효량으로, 비-형질세포 증식성 질환에 걸린 세포나 또는 이를 필요로 하는 개체에게 투여하는 단계를 포함하는, CD138을 발현하는 타겟 세포와 관련된 비-형질세포 증식성 질환의 치료 방법에 관한 것으로,
상기 CD138은, 상기 개체에서 상기 타겟 세포 및 비-타겟 세포 상에서 비슷한 수준으로 발현되거나, 또는 상기 개체에서 CD138을 발현하는 비-타겟 세포 보다 낮은 수준으로 상기 타겟 세포 상에서 발현된다.
상기 CD138을 발현하는 비-타겟 세포는 상피 세포일 수 있다.
또한, 본 발명은,
CD138을 발현하는 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
하나 이상의 작동자 분자를 포함하는 면역접합체로서, 상기 타겟팅 물질이 기능적으로 상기 작동자 분자에 부착되어 형성된 면역접합체를, 유효량으로 비-형질세포 증식성 질환에 걸린 세포 또는 이를 필요로 하는 개체에 투여하는 단계를 포함하는,
CD138을 발현하는 타겟 세포와 관련된 비-형질세포 증식성 질환의 치료 방법에 관한 것으로,
상기 질환의 타겟 세포는 24시간, 2일, 3일, 4일, 5일 또는 6일간의 기간 동안 또는 영구적으로 CD138을 셰딩 (shedding)한다.
상기 질환은 유방암일 수 있다.
CD138을 발현하는 타겟 세포와 관련된 질병을 개체에서 치료하는데 있어 동시, 개별 또는 순차적 사용을 위한, 1종 이상의 세포독성 물질과 1종 이상의 면역접합체의 조합 조제물로서,
상기 면역접합체는
(i) CD138을 발현하는 세포를 타겟팅하는 타겟팅 물질, 및
(ii) 하나 이상의 작동자 분자를 포함하되,
상기 타겟팅 물질은 하나 이상의 작동자 분자에 기능적으로 부착되어 면역접합체를 형성하며,
상기 개체는 난치성 표현형을 가지거나, 치료 후 재발되거나 또는 이전에 치료를 받은 적이 없다.
CD138을 발현하는 타겟 세포와 관련된 질병을 개체에서 치료하는데 있어 동시, 개별 또는 순차적으로 사용하기 위한, 조합 조제물의 제조에 있어서, 1종 이상의 세포독성 물질과 1종 이상의 면역접합체의 용도를 제공하며,
상기 면역접합체는
(i) CD138을 발현하는 세포를 타겟팅하는 타겟팅 물질, 및
(ii) 하나 이상의 작동자 분자를 포함하되,
상기 타겟팅 물질은 하나 이상의 작동자 분자에 기능적으로 부착되어 면역접합체를 형성하며, 상기 개체는 난치성 표현형을 가지거나, 치료 후 재발되거나, 또는 사전 치료를 받은 적이 없다.
바람직한 구현예에서, 1종 이상의 세포독성 물질과 1종 이상의 면역접합체의 조합은, 1 이상, 1.1 이상, 1.2 이상, 1.3 이상 또는 1.4 이상의 시너지 비율을 가진다. 다른 예로, 1종 이상의 세포독성 물질과 1종 이상의 면역접합체의 조합은 약 1의 시너지 비율을 가지며, 작동자 분자와 세포독성 물질은 중복되는 작용 모드를 가진다.
바람직한 구현예에서, 1종 이상의 세포독성 물질과 1종 이상의 면역접합체의 조합은 각 물질의 단독과 비교하여 높은 효능을 가진다. 높은 효능은 각 단일 물질에 대해 긍정적으로 바뀌는, 혈액 파라미터, 예컨대, M-단백질 수준, 유리형 카파 경쇄 및 그외 관련 파라미터에 대한 효능 변화로 정의된다. 특히, 높은 효능은 예컨대 M-단백질 수준의 감소율%, M-단백질 수준의 감소 정도 또는 M-단백질의 감소 기간 정도로 정의될 수 있다.
CD138을 발현하는 타겟 세포와 관련된 비-형질세포 증식성 질환을 개체에서 치료하기 위한 면역접합체로서, 상기 면역접합체는
(i) CD138을 발현하는 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
(ii) 하나 이상의 작동자 분자를 포함하되,
상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 면역접합체를 형성하며,
상기 개체에서, CD138은 비-타겟 세포에서 발현되는 CD138 수준에 상응(등가)하거나 그 미만인 수준으로 타겟 세포 상에서 발현한다.
CD138을 발현하는 타겟 세포와 관련된 비-형질세포 증식성 질환을 개체에서 치료하기 위한 약제의 제조에 있어서의 면역접합체의 용도로서, 상기 면역접합체는
(i) CD138을 발현하는 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
(ii) 하나 이상의 작동자 분자를 포함하되,
상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 면역접합체를 형성하며, 상기 개체에서 CD138은 비-타겟 세포 상에서 발현되는 CD138 수준에 상응(등가)하거나 그 미만인 수준으로 타겟 세포 상에서 발현한다.
또한, 본 발명은 CD138을 발현하는 타겟 세포와 관련된 비-형질세포 증식성 질환의 치료 방법에 관한 것으로,
이를 필요로 하는 개체나 또는 상기 비-형질세포 증식성 질환의 세포에 면역접합체를 유효량으로 투여하는 단계를 포함하며,
상기 면역접합체는
CD138을 발현하는 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
하나 이상의 작동자 분자를 포함하되, 상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 상기 면역접합체를 형성하며, 상기 면역접합체는 적어도 종양의 정체, 바람직하게는 고형 종양의 관해를 유도한다.
이러한 관해는, 상기 종양의 재-증식이 없는 기간이 후속적으로 이어지는 관해일 수 있다 (완전 관해). 기간은 1주 이상, 2주 이상, 3주 이상, 4주 이상, 5주 이상, 6주 이상, 7주 이상, 8주 이상, 9주 이상, 10주 이상, 반년, 1년 또는 그 이상일 수 있다.
고형 종양은 췌장암 또는 유방암일 수 있다.
질병은, 원발성 종양 뿐만 아니라 원발성 종양으로부터 파생된 전이성 종양 이들 2가지 형태의, 신장 세포암, 자궁 내막암, 자궁 경부암, 전립선 선암종, 췌장암, 위암, 방광암, 유방암, 간암, 결장직장암, 대장암, 편평 세포 암, 폐암, 특히 편평 세포 폐암, 비호지킨 림프종, 흉선암, 자궁암, 요로암 또는 난소암일 수 있다.
고형 종양은, 에스트로겐 수용체 음성 및/또는 프로게스테론 수용체 음성 및/또는 Her2/neu 음성인, 유방암일 수 있다. 또한, 본 발명에 따른 고형 종양은 탁산 치료에 반응하지 않거나 반응이 불량하거나, 또는 호르몬 난치성인, 유방암일 수 있다.
골수 세포와 같은 타겟 세포에서의 수용체 점유율은, 면역접합체의 투여를 종료한 지 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 12시간 경과시, 70% 이상, 80% 이상, 90% 이상일 수 있다.
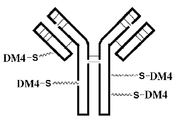
도 1은 작동자 분자가 부착된 nBT062를 개략적으로 도시한 것이다.
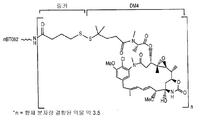
도 2는 BT062의 화학식을 도시한 것이다.
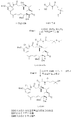
도 3은 안사미톡신 P-3의 메이탄시놀로의 변환을 나타낸 것이다 (입체화학은 단순화를 위해 생략함).
도 4는 DM4의 대표적인 합성 방법을 나타낸 것이다.
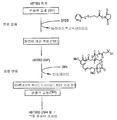
도 5는 항체 접합체(DM4에 nBT062)를 도식적으로 나타낸 것이다.
도 6은 OPM-2 세포에 대한 nBT062-SPDB-DM4, nBT062-SPP-DM1, nBT062-SMCC-DM1 및 nBT062 항체들의 결합성을 분석한 것이다. 다양한 농도로 nBT062와 접합체를 세포에 제공하여, 평균 형광을 FACS 분석으로 측정하였다.
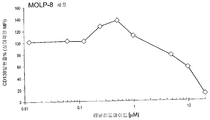
도 7(A)-(D)는 MOLP-8 (CD138+) 및 BJAB (CD138-) 세포에 대한 nBT062-DMx 접합체의 시험관내 세포독성을 나타낸 것이다. 세포를 바닥이 평평한 플레이트에서 배양하고, 5일간 지정된 농도의 면역접합체와 함께 인큐베이션하였다. WST 시약을 다시 3시간 동안 첨가하여, 세포 생존성을 측정하였다. (D)에서, nBT062-SPDB-DM4의 세포독성 활성을 블록킹 항체 (1 μM nBT062)의 존재 또는 부재하에 분석하였다.
도 8은 대조군과 비교하여 BT062를 처리한 마우스에서 이종이식 췌장암의 완전 관해를 도시한 것이다. 완전 관해가 유지되며; 치료하지 않는 관찰 기간 동안에, 종양의 재증식은 관찰되지 않았다.
도 9는 대조군과 비교하여 BT062를 처리한 마우스에서 이종이식 유방암의 완전 관해를 도시한 것이다. 치료하지 않는 관찰 기간 동안에, 종양의 재증식은 관찰되지 않아, 완전 관해가 유지된다.
도 10은 대조군 또는 탁산과 비교하여 2 mg/kg 또는 4 mg/kg BT062 (매주 1회)를 처리한 마우스에서의 이종이식 유방암의 완전 관해를 도시한 것이다. 매주 1회로 1 mg/kg BT-062 투여시, 종양 정체가 달성된다. 이는 최소 유효량으로 정의된다.
도 11은 비히클 대조군과 비교하여 4 mg/kg 및 23.85 mg/kg BT062 (매주 1회)를 처리한 마우스에서의 이종이식 원발성 폐 선암종의 완전 관해를 도시한 것이다.
도 12는 비히클 대조군과 비교하여 4 mg/kg 및 23.85 mg/kg BT062 (매주 1회)를 처리한 마우스에서 이종이식 방광 (전위 세포 (transitional cell)) 암종 (전이 샘플)의 완전 관해를 나타낸 것이다.
도 13은 40 mg/m2 - 120 mg/m2 범위의 투여량에서의 신속한 혈장 소거를 나타내는 반면, 투여량 160 mg/m2으로 예시되는 높은 투여량에서는 예상 수치에 가까운 혈장 소거가 나타남을 도시한 것이다.
도 14는 BT062의 Cmax 측정치를 Cmax 이론치와 비교하여 나타낸 것이다.
도 15 및 16은 지정된 바와 같이 반복적인 단회 투약 용법의 치료 사이클 수회 동안에 Cmax 수치가 일반적으로 유사함을 도시한 것이다.
도 17은 신속한 혈장 소거가 가용성 CD138에 의해 야기되는 완충 작용으로 인한 것이 아님을 명확하게 나타낸 것이다.
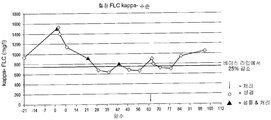
도 18은 지정된 치료 사이클 코스에서 BT062를 여러가지 투여량으로 사용하여 치료한 인간 개체에서의 무진행성 생존율을 도시한 것으로, 각각의 활성 치료 사이클은 21일간 진행하며, 해당 투여량은 각 사이클에서 1일, 8일 및 15일에 투여하였다. 21일간의 각 사이클 다음에 7일간의 휴지기를 갖는다 (28일은 "사이클" 당 21 + 7일임). 알 수 있는 바와 같이, 3달 이상 환자 14명을 대상으로 치료 실험을 진행하였다. 이들 환자들 중 2명에서는 적어도 300일 (약 10개월)간 질병이 더 이상 진행되지 않는 상태로 생존하는 것으로 기록되었다.
도 19는, (A) 3주간 매일 여러가지 용량으로 투여한 다음 1주간 휴지기를 가지는 경우의 Cmax 수치 코스와, (B) 여러가지 투여량으로 투여를 종료한 지 0-2시간 경과시의 Cmax 수치를 도시한 것이다. 또한, Cmax 이론치도 도시한다.
도 20은 3주간 매주 50 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자에서 측정한 혈청 M-단백질 수준을 도시한 것이다. -111일일부터 159일까지를 나타낸다. 화살표는 BT062 처리를 나타낸다.
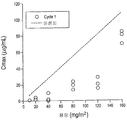
도 21은 3주간 매주 65 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자 (올리고-분비형 다발성 골수종)에서 측정한 람다-카파 FLC (1차 치료 전에 상당히 증가하며, 1일 - 57일까지 급격하게 감소됨) 수준을 도시한 것이다. -83일부터 163일까지를 나타낸다.
도 22는 3주간 매주 80 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자 (올리고-분비형 다발성 골수종)에서 측정한 람다-카파 FLC (1차 치료 전에 강하게 증가하며, 2번의 사이클 동안에는 안정화됨) 수준을 도시한 것이다. -111일부터 85일까지를 나타낸다.
도 23은 3주간 매주 100 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자 (올리고-분비형 다발성 골수종)에서 측정한 람다-카파 FLC (3달간 감소됨) 수준을 도시한 것이다. -83일부터 141일까지를 나타낸다.
도 24는 3주간 매주 3x 120 mg/m2로 투여한 다음 7일간 휴지기를 취한 환자에서 측정한 뇨내 M-단백질 수준을 도시한 것이다. -27일부터 337일까지를 나타낸다.
도 25는 3주간 매주 3x 160 mg/m2로 투여한 다음 7일간 휴지기를 취한 환자에서 측정한 혈청내 M-단백질 수준을 도시한 것이다. 마이너 반응을 보인 -20일부터 57일까지를 나타낸다.
도 26은 3주 간격으로 160 mg/m2로 투여한 환자에서 측정한 카파 FLC 수치를 나타낸 것이다. -21일부터 101일까지를 나타낸다.
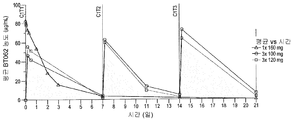
도 27은 동일한 기간 (21일)의 활성 치료 사이클에서, 3번 투여하는 다회 용량 100 mg/m2 및 120 mg/m2과 비교하여, 반복적인 단회 용량 160 mg/m2을 투여한 BT062의 혈장내 수준을 도시한 것이다.
도 28은 BT062를 반복적인 단회 용량 160 mg/m2으로 BT062를 연장 투여하는 동안의 혈청내 M-단백질 수준을 도시한 것으로, 측정가능한 수준의 부작용 수반한 마이너 반응이 나타난다.
도 29는 BT062를 반복적인 단회 용량 160 mg/m2으로 치료한 환자에서의 반복적인 단회 용량 투여시 혈청내 M-단백질 수준과 Cmax 수준을 경시적으로 도시한 것이다 (도 28도 참조함).
도 30은 이종이식 마우스 모델 (MOLP-8 MM 이종이식 모델)에서 평균 종양 체적 (TV)에 대한 조합 요법의 효과를 도시한 것이다. 결과는 BT062와 레날리도마이드 조합물의 효과이다.
도 31은 이종이식 마우스 모델에서 평균 종양 체적 (TV)에 대한 조합 요법의 효과를 도시한 것이다. 결과는, BT062와 벨카드 조합물의 효과를 나타낸다.
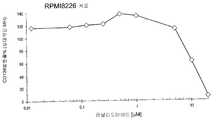
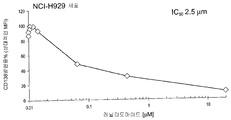
도 32는 여러가지 CD138 발현 세포, 특히 MOLP-A 세포 (A), RPMI8226 세포 (B), NCI-H929 세포 (C) 및 U266 세포 (D)에서의 레날리도마이드의 시험관내 효과를 도시한 것이다. 특히, CD138 발현은 레날리도마이드와 덱사메타손 조합물의 처리에 의해서는 생체내 (L363 MM 이종이식 모델)에서 효과가 없었다 (데이타 도시 안 함).
도 33은 생체내 (L363 MM 이종이식 모델) 약물 조합 실험의 결과를 도시한 것으로, BT062 (2 mg/kg, 4 mg/kg)는 1, 8, 15, 22 및 29일에 정맥내 투여하였으며; 레날리도마이드는 0-4, 7-11, 14-18, 21-25, 28-32일에 경구로 투여하였으며; 덱사메타손은 0, 7, 14, 21 및 28일에 피하로 투여하였다. 레날리도마이드 및 덱사메타손의 단순 조합물과 비교하여, 종양 체적의 상당한 감소를, 특히 4 mg/kg BT062 투여량 스케줄에서 볼 수 있다. 그 결과는 비히클 대조군을 정맥내 투여한 경우와 비교하여 모델에서의 상대적인 종양 체적 평균값에 대한 효과로 나타낸다. X일의 상대적인 종양 체적 중앙값을 도시하며, 이후의 도면들에서 다음과 같이 계산하였다: X일의 개개 종양의 상대적인 체적 (Individual RTV)은 X일 개개 종양의 체적 (Tx)을 0일의 동일 종양의 개개 체적 (T0)으로 나누고 100%을 곱하여 계산하였다. 그룹 종양 체적은 그룹에 속하는 모든 종양의 중앙 또는 평균 (기하학적) RTV로 표시하였다 (그룹 중앙/평균 RTV).
도 34는 3주간 매주 BT062를 80 mg/m2로 투여한 다음 7일간의 휴지기를 수행하는 스케줄의 환자에서 측정한 혈청내 M-단백질 수준을 도시한 것이다. BT062는 레날리도마이드 및 덱스메타손과 조합하여 투여하였다. -13일부터 106일까지를 나타내며, 이때 마이너 반응이 나타난다.
도 35는 BT062 (0.5 mg/kg, 1 mg/kg, 2 mg/kg, 4 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 탁솔 (taxol) (10 mg/kg)을 1, 8, 15 및 22일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 인간 유래 유방암 모델) 결과를 도시한 것이다. BT062는 고농도에서 우수한 결과를 나타낸다. 그 결과는 정맥내 PBS를 투여한 것과 비교하여, 모델에서의 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 일 별 상대적인 중앙 종양 체적 계산은 도 33을 참조한다.
도 36은 BT062 (1 mg/kg, 2 mg/kg, 4 mg/kg, 8 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 도세탁셀 (10 mg/kg)을 0, 7 및 14일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 CD138 IHC 스코어 2-3인 인간 유래 유방암 모델) 결과를 도시한 것이다. BT062는 고농도에서 우수한 결과를 나타낸다. 도세탁셀은 BT062의 고농도에서의 효과와 유사한 효과를 나타내었다. 결과는 정맥내 PBS를 투여한 것과 비교하여, 모델에서의 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 일 별 상대적인 중앙 종양 체적 계산은 도 33을 참조한다.
도 37은 BT062 (1 mg/kg, 2 mg/kg, 3 mg/kg, 4 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 도세탁셀 (10 mg/kg)을 0, 7 및 14일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 CD138 IHC 스코어 2-3인 인간 유래 유방암 모델) 결과를 도시한 것이다. 치료 용법에서는 차이가 관찰되지 않았다. 결과는 정맥내 PBS를 투여한 것과 비교하여, 모델에서의 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 일 별 상대적인 중앙 종양 체적 계산은 도 33을 참조한다.
도 38은 BT062 (1 mg/kg, 2 mg/kg, 4 mg/kg, 8 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 도세탁셀 (10 mg/kg)을 0, 7 및 14일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 인간 유래 전립선암 모델) 결과를 도시한 것이다. BT062는 고농도에서 우수한 결과를 보인다. 결과는 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 도세탁셀은 BT062의 고농도에서의 효과와 유사한 효과를 나타내었으며, 시간 경과에 따라 작은 종양 체적을 유지하였다.
도 2는 BT062의 화학식을 도시한 것이다.
도 3은 안사미톡신 P-3의 메이탄시놀로의 변환을 나타낸 것이다 (입체화학은 단순화를 위해 생략함).
도 4는 DM4의 대표적인 합성 방법을 나타낸 것이다.
도 5는 항체 접합체(DM4에 nBT062)를 도식적으로 나타낸 것이다.
도 6은 OPM-2 세포에 대한 nBT062-SPDB-DM4, nBT062-SPP-DM1, nBT062-SMCC-DM1 및 nBT062 항체들의 결합성을 분석한 것이다. 다양한 농도로 nBT062와 접합체를 세포에 제공하여, 평균 형광을 FACS 분석으로 측정하였다.
도 7(A)-(D)는 MOLP-8 (CD138+) 및 BJAB (CD138-) 세포에 대한 nBT062-DMx 접합체의 시험관내 세포독성을 나타낸 것이다. 세포를 바닥이 평평한 플레이트에서 배양하고, 5일간 지정된 농도의 면역접합체와 함께 인큐베이션하였다. WST 시약을 다시 3시간 동안 첨가하여, 세포 생존성을 측정하였다. (D)에서, nBT062-SPDB-DM4의 세포독성 활성을 블록킹 항체 (1 μM nBT062)의 존재 또는 부재하에 분석하였다.
도 8은 대조군과 비교하여 BT062를 처리한 마우스에서 이종이식 췌장암의 완전 관해를 도시한 것이다. 완전 관해가 유지되며; 치료하지 않는 관찰 기간 동안에, 종양의 재증식은 관찰되지 않았다.
도 9는 대조군과 비교하여 BT062를 처리한 마우스에서 이종이식 유방암의 완전 관해를 도시한 것이다. 치료하지 않는 관찰 기간 동안에, 종양의 재증식은 관찰되지 않아, 완전 관해가 유지된다.
도 10은 대조군 또는 탁산과 비교하여 2 mg/kg 또는 4 mg/kg BT062 (매주 1회)를 처리한 마우스에서의 이종이식 유방암의 완전 관해를 도시한 것이다. 매주 1회로 1 mg/kg BT-062 투여시, 종양 정체가 달성된다. 이는 최소 유효량으로 정의된다.
도 11은 비히클 대조군과 비교하여 4 mg/kg 및 23.85 mg/kg BT062 (매주 1회)를 처리한 마우스에서의 이종이식 원발성 폐 선암종의 완전 관해를 도시한 것이다.
도 12는 비히클 대조군과 비교하여 4 mg/kg 및 23.85 mg/kg BT062 (매주 1회)를 처리한 마우스에서 이종이식 방광 (전위 세포 (transitional cell)) 암종 (전이 샘플)의 완전 관해를 나타낸 것이다.
도 13은 40 mg/m2 - 120 mg/m2 범위의 투여량에서의 신속한 혈장 소거를 나타내는 반면, 투여량 160 mg/m2으로 예시되는 높은 투여량에서는 예상 수치에 가까운 혈장 소거가 나타남을 도시한 것이다.
도 14는 BT062의 Cmax 측정치를 Cmax 이론치와 비교하여 나타낸 것이다.
도 15 및 16은 지정된 바와 같이 반복적인 단회 투약 용법의 치료 사이클 수회 동안에 Cmax 수치가 일반적으로 유사함을 도시한 것이다.
도 17은 신속한 혈장 소거가 가용성 CD138에 의해 야기되는 완충 작용으로 인한 것이 아님을 명확하게 나타낸 것이다.
도 18은 지정된 치료 사이클 코스에서 BT062를 여러가지 투여량으로 사용하여 치료한 인간 개체에서의 무진행성 생존율을 도시한 것으로, 각각의 활성 치료 사이클은 21일간 진행하며, 해당 투여량은 각 사이클에서 1일, 8일 및 15일에 투여하였다. 21일간의 각 사이클 다음에 7일간의 휴지기를 갖는다 (28일은 "사이클" 당 21 + 7일임). 알 수 있는 바와 같이, 3달 이상 환자 14명을 대상으로 치료 실험을 진행하였다. 이들 환자들 중 2명에서는 적어도 300일 (약 10개월)간 질병이 더 이상 진행되지 않는 상태로 생존하는 것으로 기록되었다.
도 19는, (A) 3주간 매일 여러가지 용량으로 투여한 다음 1주간 휴지기를 가지는 경우의 Cmax 수치 코스와, (B) 여러가지 투여량으로 투여를 종료한 지 0-2시간 경과시의 Cmax 수치를 도시한 것이다. 또한, Cmax 이론치도 도시한다.
도 20은 3주간 매주 50 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자에서 측정한 혈청 M-단백질 수준을 도시한 것이다. -111일일부터 159일까지를 나타낸다. 화살표는 BT062 처리를 나타낸다.
도 21은 3주간 매주 65 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자 (올리고-분비형 다발성 골수종)에서 측정한 람다-카파 FLC (1차 치료 전에 상당히 증가하며, 1일 - 57일까지 급격하게 감소됨) 수준을 도시한 것이다. -83일부터 163일까지를 나타낸다.
도 22는 3주간 매주 80 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자 (올리고-분비형 다발성 골수종)에서 측정한 람다-카파 FLC (1차 치료 전에 강하게 증가하며, 2번의 사이클 동안에는 안정화됨) 수준을 도시한 것이다. -111일부터 85일까지를 나타낸다.
도 23은 3주간 매주 100 mg/m2을 투여한 다음 7일간 휴지기를 취한 환자 (올리고-분비형 다발성 골수종)에서 측정한 람다-카파 FLC (3달간 감소됨) 수준을 도시한 것이다. -83일부터 141일까지를 나타낸다.
도 24는 3주간 매주 3x 120 mg/m2로 투여한 다음 7일간 휴지기를 취한 환자에서 측정한 뇨내 M-단백질 수준을 도시한 것이다. -27일부터 337일까지를 나타낸다.
도 25는 3주간 매주 3x 160 mg/m2로 투여한 다음 7일간 휴지기를 취한 환자에서 측정한 혈청내 M-단백질 수준을 도시한 것이다. 마이너 반응을 보인 -20일부터 57일까지를 나타낸다.
도 26은 3주 간격으로 160 mg/m2로 투여한 환자에서 측정한 카파 FLC 수치를 나타낸 것이다. -21일부터 101일까지를 나타낸다.
도 27은 동일한 기간 (21일)의 활성 치료 사이클에서, 3번 투여하는 다회 용량 100 mg/m2 및 120 mg/m2과 비교하여, 반복적인 단회 용량 160 mg/m2을 투여한 BT062의 혈장내 수준을 도시한 것이다.
도 28은 BT062를 반복적인 단회 용량 160 mg/m2으로 BT062를 연장 투여하는 동안의 혈청내 M-단백질 수준을 도시한 것으로, 측정가능한 수준의 부작용 수반한 마이너 반응이 나타난다.
도 29는 BT062를 반복적인 단회 용량 160 mg/m2으로 치료한 환자에서의 반복적인 단회 용량 투여시 혈청내 M-단백질 수준과 Cmax 수준을 경시적으로 도시한 것이다 (도 28도 참조함).
도 30은 이종이식 마우스 모델 (MOLP-8 MM 이종이식 모델)에서 평균 종양 체적 (TV)에 대한 조합 요법의 효과를 도시한 것이다. 결과는 BT062와 레날리도마이드 조합물의 효과이다.
도 31은 이종이식 마우스 모델에서 평균 종양 체적 (TV)에 대한 조합 요법의 효과를 도시한 것이다. 결과는, BT062와 벨카드 조합물의 효과를 나타낸다.
도 32는 여러가지 CD138 발현 세포, 특히 MOLP-A 세포 (A), RPMI8226 세포 (B), NCI-H929 세포 (C) 및 U266 세포 (D)에서의 레날리도마이드의 시험관내 효과를 도시한 것이다. 특히, CD138 발현은 레날리도마이드와 덱사메타손 조합물의 처리에 의해서는 생체내 (L363 MM 이종이식 모델)에서 효과가 없었다 (데이타 도시 안 함).
도 33은 생체내 (L363 MM 이종이식 모델) 약물 조합 실험의 결과를 도시한 것으로, BT062 (2 mg/kg, 4 mg/kg)는 1, 8, 15, 22 및 29일에 정맥내 투여하였으며; 레날리도마이드는 0-4, 7-11, 14-18, 21-25, 28-32일에 경구로 투여하였으며; 덱사메타손은 0, 7, 14, 21 및 28일에 피하로 투여하였다. 레날리도마이드 및 덱사메타손의 단순 조합물과 비교하여, 종양 체적의 상당한 감소를, 특히 4 mg/kg BT062 투여량 스케줄에서 볼 수 있다. 그 결과는 비히클 대조군을 정맥내 투여한 경우와 비교하여 모델에서의 상대적인 종양 체적 평균값에 대한 효과로 나타낸다. X일의 상대적인 종양 체적 중앙값을 도시하며, 이후의 도면들에서 다음과 같이 계산하였다: X일의 개개 종양의 상대적인 체적 (Individual RTV)은 X일 개개 종양의 체적 (Tx)을 0일의 동일 종양의 개개 체적 (T0)으로 나누고 100%을 곱하여 계산하였다. 그룹 종양 체적은 그룹에 속하는 모든 종양의 중앙 또는 평균 (기하학적) RTV로 표시하였다 (그룹 중앙/평균 RTV).
도 34는 3주간 매주 BT062를 80 mg/m2로 투여한 다음 7일간의 휴지기를 수행하는 스케줄의 환자에서 측정한 혈청내 M-단백질 수준을 도시한 것이다. BT062는 레날리도마이드 및 덱스메타손과 조합하여 투여하였다. -13일부터 106일까지를 나타내며, 이때 마이너 반응이 나타난다.
도 35는 BT062 (0.5 mg/kg, 1 mg/kg, 2 mg/kg, 4 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 탁솔 (taxol) (10 mg/kg)을 1, 8, 15 및 22일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 인간 유래 유방암 모델) 결과를 도시한 것이다. BT062는 고농도에서 우수한 결과를 나타낸다. 그 결과는 정맥내 PBS를 투여한 것과 비교하여, 모델에서의 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 일 별 상대적인 중앙 종양 체적 계산은 도 33을 참조한다.
도 36은 BT062 (1 mg/kg, 2 mg/kg, 4 mg/kg, 8 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 도세탁셀 (10 mg/kg)을 0, 7 및 14일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 CD138 IHC 스코어 2-3인 인간 유래 유방암 모델) 결과를 도시한 것이다. BT062는 고농도에서 우수한 결과를 나타낸다. 도세탁셀은 BT062의 고농도에서의 효과와 유사한 효과를 나타내었다. 결과는 정맥내 PBS를 투여한 것과 비교하여, 모델에서의 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 일 별 상대적인 중앙 종양 체적 계산은 도 33을 참조한다.
도 37은 BT062 (1 mg/kg, 2 mg/kg, 3 mg/kg, 4 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 도세탁셀 (10 mg/kg)을 0, 7 및 14일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 CD138 IHC 스코어 2-3인 인간 유래 유방암 모델) 결과를 도시한 것이다. 치료 용법에서는 차이가 관찰되지 않았다. 결과는 정맥내 PBS를 투여한 것과 비교하여, 모델에서의 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 일 별 상대적인 중앙 종양 체적 계산은 도 33을 참조한다.
도 38은 BT062 (1 mg/kg, 2 mg/kg, 4 mg/kg, 8 mg/kg)를 0, 7, 14, 21, 28 및 35일에 정맥내로 투여하고, 도세탁셀 (10 mg/kg)을 0, 7 및 14일에 정맥내로 투여하는, 생체내 (NMRI 누드 마우스에서의 인간 유래 전립선암 모델) 결과를 도시한 것이다. BT062는 고농도에서 우수한 결과를 보인다. 결과는 상대적인 평균 종양 체적에 대한 효과 측면에서 도시한다. 도세탁셀은 BT062의 고농도에서의 효과와 유사한 효과를 나타내었으며, 시간 경과에 따라 작은 종양 체적을 유지하였다.
본 발명은, 필요로 하는 개체에게, 특히 인간 개체 (환자)에게, 본원의 CD138 타겟팅 물질을 포함하는 면역접합체의 투여, 및 면역접합체의 타겟 부위로의 작동자 분자(들)의 전달, 및 타겟 부위, 특히 타겟 세포, 조직 및/또는 장기로의 또는 내로의 작동자(들) 분자의 방출에 관한 것이다. 보다 상세하게는, 본 발명은 그러한 CD138 타겟팅 물질과 타겟팅 물질에 부착된 강력한 작동자 분자를 포함하는, 면역접합체에 관한 것이다. 작동자 분자는, 타겟 부위에서 또는 내에서 면역접합체의 일부인 타겟팅 물질로부터 절단 및/또는 해리에 의해 활성화된다. 면역접합체는 단독으로, 또는 세포독성 물질을 포함한 항암 조합물의 일부분으로서 투여될 수 있으며, 상기 세포독성 물질로는 프로테오좀 저해제 (예, 보르테조밉, 카르필조밉), 면역조절제/항-혈관신생제 (예, 탈리도마이드, 레날리도마이드 또는 포말리도마이드), DNA 알킬화제 (예, 멜팔란) 또는 코르티코스테로이드 (예, 덱사메타손)가 있으나, 이들로 한정되지 않으며, 상기 항암 조합물은 단일 요법에서 단독으로 사용되는 면역접합체, 단일 요법에서 단독으로 사용되는 세포독성 물질 또는 이 둘다에 비해 암 치료 효과에 상승적인 효과나 예상하지 못했던 상가적인 효과를 가진다.
본 발명에 따른 면역접합체는 치료가 필요한 개체나 치료가 필요한 개체로부터 분리된 세포에 투여할 수 있다. 작동자 분자 또는 분자들은 타겟 세포, 조직 및/또는 장기에서 또는 내에서의 절단/해리에 의해 면역접합체로부터 분리될 수 있다.
일 예로, 면역접합체 BT062는 CD138을 발현하는 세포를 nBT062 항체를 통해 타겟팅하며, 작동자 분자로서 DM4를 포함하는 것으로서, 이는 재발성/난치성 다발성 골수종 환자에게 반복적인 단회 투약 용법으로서 40 mg/m2의 양으로 14번 투여되며, 각 치료 사이클의 기간은 21일이며, 사이클의 1, 8 및 15일에 사이클 당 3회로 투여되며, 다음번 활성 치료 사이클을 시작하기 전까지 1주일의 휴지기가 이행된다. 다르게 표현하면, 사이클의 1, 8 및 15일에 3회/사이클로 투여하고 22일에는 투여하지 않고, 이러한 예에서 약 2주간 무치료 기간이 이어져, 치료 사이클은 28일이다. 이러한 예에서, 면역접합체는 종양 세포에 및/또는 내에 잘 결집할 수 있도록 환자에게 정맥내로 투여된다. BT062의 혈장 농도 측정에서, 초기 측정 단계에서 (투여 후 최대 2시간) BT062의 Cmax 값은 이론적으로 계산된 수치 보다 현저하게 낮지만, DLT (용량 제한 독성)은 관찰되지 않는 것으로 나타나, BT062가 무작위적으로 타겟 또는 비-타겟 CD138에 부착하기 보다는 종양 타겟에만 결집됨을 시사해준다. sCD138 (가용성 CD138)로 인해 발생되는 "완충 효과"를 제외시킬 수 있었다 (도 17 참조). 하기에서 80 mg/m2 투여에 대한 문맥이 논의된 경우, 타겟 세포로의 신속한 집결을 검증할 수 있다.
활성 치료 사이클 (active treatment cycle)은 활성 성분, 본원에서는 일반적으로 면역접합체를 정기적으로 투여하는 것으로 정의되며, 임의의 휴지기는 제외한 치료 사이클이다. 활성 치료 사이클은 전형적으로 3주간의 활성 치료를 포함하며, 마지막 투여가 아니라 추가적인 투여가 만료된 그 때를 끝으로 간주한다. 즉, 1일의 용량 120 mg/m2 및 8 및 15일에 모두 용량 65 mg/m2을 포함하는 활성 치료 사이클은 21일째에 종료하는 것으로 간주되며, 기간은 21일로 간주된다. 활성 치료 사이클은 일반적으로 21일간 지속되지만, 적어도 2주 (14일) 내지 4주 (28일) 범위일 수도 있다. 후자의 경우, 활성 치료 사이클 및 "전체 (full)" 또는 "완전 (complete)" 치료 사이클은 동일하다. 활성 치료 사이클 기간 중에, 활성 성분은 정기적으로 투여된다. 이는, 예를 들어, 2 및 3일의 간격, 4일마다, 1, 3, 6, 10, 15일 등과 같이 점점 간격을 늘이는 것을 포함한다. 치료 사이클은 활성 치료 뿐만 아니라 휴지기도 포함할 수 있다. 예를 들어, 상기 예에서, 28일의 치료 사이클에서의 상기 투여 스케줄은 22일에 투여하지 않는 것을 포함하는 것으로 간주될 것이다. 이러한 휴지기를 포함하는 치료 사이클 역시 본원에서 "전체" 또는 "완전" 치료 사이클로 지칭한다. 무치료 기간은 치료가 제공되지 않는 시간을 의미한다. 즉, 상기 예에서, 무치료 기간은 16일에 시작될 것이다. 휴기지의 개시시, 환자에게 면역접합체를 투여하지 않는다. 바람직한 구현예에서, 이 기간에는 어떠한 타입의 치료도 투여하지 않는다. 휴지기는, 예를 들어, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14일간 지속될 수 있거나, 보다 전형적으로는 1주일이다. 무치료 기간은 14, 15, 16, 17, 18, 19, 20, 21일 또는 그 이상 지속될 수 있다.
다른 예로, 면역접합체 BT062는 재발성/난치성 다발성 골수종 환자에게 반복적인 단회 투약으로서 50 mg/m2의 양으로 18번 투여되며, 각 치료 사이클의 기간은 21일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여되며, 1주일의 휴지기가 다음번 치료 사이클을 개시하기 전에 수반된다. 다르게 표현하면, 치료 사이클은 28일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하며 22일에는 투여하지 않는다. 이러한 예에서, 면역접합체는 종양 세포에 및/또는 내에 잘 집결할 수 있도록 환자에게 정맥내 투여된다. 면역접합체로부터 작동자 분자를 분리시키기 위한 추가적인 수단은 제공하지 않는다. 6번의 치료 사이클은 허용성이 양호하며, 6번의 치료 사이클 동안에 적어도 안정적인 질병 상태가 달성될 수 있었으며, 3차 및 5차 치료 사이클을 수행한 이후에는 혈청내 M-단백질의 감소율이 거의 25%였다 (도 20).
다른 예에서, 면역접합체 BT062는 재발성/난치성 다발성 골수종 환자에게 반복적인 단회 투약으로서 65 mg/m2의 양으로 19번 투여되며, 각 치료 사이클의 기간은 28일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하며 22일에는 투여하지 않는다. 무치료 기간은 따라서 다음번 치료 사이클을 개시하기 전까지 14일이다. 이 농도에서, 혈장 수준은 여전히 Cmax 이론치 보다 낮지만 (Cmax 이론치 대대 평균 % = 60%; 표 11a), 보다 낮은 용량, 예컨대 40 mg/m2 또는 50 mg/m2에서 관찰되는 수준까지는 아니었다 (Cmax 이론치 대피 평균 % = 33%; 표 11a). 그러나, 단순히 한번의 치료 사이클을 수행한 후에는 혈청내 FLC 수준의 상당한 감소를 관찰할 수 있었으며, 이는 2달간 유지될 수 있었다 (도 21). 게다가 65 mg/m2 용량 수준에서는 Cmax 이론치 대비 높은 %에도 불구하고, Cmax 이론치에서 부족한 총 혈장 농도 (여기서, 평균 총 17.7 mg/m2, 표 11b)는 보다 낮은 농도 40 mg/m2 또는 50 mg/m2 (평균 총 18.6 mg/m2 및 23.0 mg/m2, 표 11b)에서 관찰한 결과와 비슷하였다. 즉, Cmax 이론치 대비 평균 증가% 10% 이상, 20% 이상, 25% 이상, 바람직하게는 15 - 25%에도 불구하고, Cmax 이론치에서 부족한 총 혈장 농도는 여러가지 농도들에서 유지되었으며, 15-25 mg/m2, 즉 약 20 mg/m2로 유지되었다. 14명의 환자들에서 (실험에서 32명 중 14명), 3달 이상 무진행 생존이 기록되었으며 (도 18), 이 중 4명은 적어도 168일간 무진행 생존하였다. 이 4명 중 1명은 9번의 치료 후 혈청내 M 단백질의 명확한 감소를 나타내었으며 (환자 5번, 도 20을 참조함), 다른 환자에서도 첫 2달 이내에 FLC의 상당한 감소를 관찰할 수 있었다 (환자 19번, 도 24를 참조함). 첫번째 DLT는 140 mg/m2 코호트 (환자 번호 23)에서 관찰되었지만, 이 용량 수준에서는 다른 6명의 환자들에서는 DLT가 관찰되지 않았다. 매주 160 mg/m2 용량을 처리한 4명 중 2명 (환자 번호 30 및 32)에서는, DLT가 관찰되었으며, 이후의 사이클에서는 용량을 140 mg/m2로 낮추었다.
또 다른 실시예에서, 면역접합체 BT062를 80 mg/m2으로 반복적인 다회 투약으로서 15번의 사이클 동안 비-분비형 재발성/난치성 다발성 골수종 환자 (환자 12번, 도 18 참조)에게 투여하였으며, 각 치료 사이클의 기간은 28일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하며 22일에는 투여하지 않았다. 이 예에서, 면역접합체가 종양 세포내 및 종양 세포에 잘 집결할 수 있도록 환자에게 정맥내로 투여하였다. 이 농도에서는, 혈장 수준이 여전히 Cmax 이론치 보다 낮았지만, 저용량, 예컨대 40 mg/m2에서 관찰되는 수준까지는 아니었다 (Cmx 이론치 대비 평균 % = 33%; 표 11a). 80 mg/m2으로 3번, 총 240 mg/m2 (총 용량)을 투여한 후에도, 면역접합체는 허용성이 우수하게 유지되었다. 종양 타겟으로의 신속한 집결을 이 용량에서 검증할 수 있었다. 표 12는 수용체 점유율 (RO) 측정 결과를 나타낸다. 여기서, BT062의 수용체 (CD138)로의 결합을 다발성 골수종 환자에서, 종양 부위로 인해, 골수 내 다발성 골수종 세포에서 측정하였다. 수용체 (CD138)에 결합한 BT062를 항-May 항체 (샘플 1)로 염색하였다. 전체 CD138을 BT062로 수용체 포화한 후 항-May 항체로 측정하였다 (샘플 2). IgG1 이소형과 인큐베이션하여, 샘플에 대한 비-특이 결합을 측정하였다 (샘플 3). 표 12에서 첫번째 행은 투여를 종료한 후 4시간 이내에 측정한 결과를 나타낸다. 알 수 있는 바와 같이, 투여 종료 후 4시간 이내에, 수용체 점유율은 이 경우 99%이다. 환자는 부분 반응을 나타내었다. 투여 기간 (투여 시간)은 투여 방식에 따라 확실한 차이를 보인다.
정맥내 (IV) 투여시 투여 시간 (Administration time)은 일반적으로 mg/min으로 규정된다 (처음 15분간은 1 mg/min이며, 허용된다면, 나머지 기간 동안에는 3 mg/min임, 즉 환자에게 할당되는 용량 수준을 높임). 투여 후 투여 라인을 플러싱하기 위한 시간은 물론 달라진다. 본 실험에서, 10 mg/m2- 200 mg/m2의 용량의 경우, 최단 주입 시간은 18분이었으며, 최장 주입 시간은 3시간 2분이었으며, 평균 1시간 35분이었다. 200 mg/m2를 1 mg/min으로 전부 투여한다면, 투여 시간은 최대 8시간이 될 수 있다. 다른 구현예로, 면역접합체는 1분 안에 IV 볼루스로 투여할 수 있다.
즉, 본 발명에 따른 투여는 투여를 시작한 후 0 내지 8시간 중 임의 시점에, 일반적으로 투여를 개시한 지 0-4시간 이내에, 종종 2시간 이내에 "완료"한다.
도 22는 재발성/난치성 환자에게 투여하는, 동일 투여 스케줄 (반복적인 다회 투여로서 80 mg/m2, 각 치료 사이클의 기간은 28일로서, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하며 22일에는 투여하지 않음)을 수행한 환자 (도 18에서 13)를 나타낸 것이다. 첫번째 치료 일 이전의 상당한 람다-카파의 증가를 2번의 사이클 동안에 안정시킬 수 있었다.
도 18에서 환자 12 (상기와 같이 반복적인 다회 투약으로서 80 mg/m2)는 약 8개월간 부분 반응을 나타내었다.
추가적인 예로, 면역접합체 BT062를 반복적인 다회 투약으로서 100 mg/m2을 재발성/난치성 다발성 골수종 환자에게 6회 투여하였으며, 각 활성 치료 사이클의 기간은 21일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하고, 1주일의 휴지기를 가졌다 (22일에 비-투여는 사실상 2주간의 투여 중단을 의미함). 이런 예에서, 면역접합체가 종양 세포내 및 종양 세포에 잘 집결할 수 있도록 환자에게 정맥내로 투여하였다.
도 23은, 적어도 3달간 무진행 생존을 나타낸 15번 환자 (도 18, 올리고-분비형 MM의 재발형의 난치성임)의 결과를 도시한다.
이 농도에서, 혈장 수준은 첫 2번의 투여를 수행하는 동안에는 Cmax 이론치 보다 조금 낮아 (표 11a), 이 용량으로 매주 투여 시 면역접합체가 축적됨을 나타낸다. 그러나, 반복적인 다회 투약로서 120 mg/m2을 이용한 동일한 실험에서는, 이들 수치가 떨어졌으며, 이는 100 mg/m2 결과가 한명의 환자에서의 일탈일 수 있으며 또한 더 높은 용량에서 유의한 축적이 발생하지 않을 수 있다는 것을 의미한다.
3주 이내에 100 mg/m2, 120 mg/m2 및 대부분의 경우에는 140 mg/m2으로 3회, 즉 각각 총 300 mg/m2, 360 mg/m2 및 420 mg/m2을 투여하였을 때, 면역접합체에 대한 우수한 허용성이 유지되었다. 각 사이클이 3x 100 mg/m2 (300 mg/m2) 또는 3x 120 mg/m2 (360 mg/m2)인 21일간의 사이클을 3회 수행한 후 (12주간, 3 x 300 mg/m2 = 900 mg/m2, 및 12주간 3 x 360 mg/m2 = 1080 mg/m2), 640 mg/m2 (각각 160 mg/m2 씩 21일 사이클을 4회 수행한 경우)과 비교하여, DLT는 관찰되지 않았다.
다른 예로, 면역접합체 BT062를 반복적인 다회 투약으로서 120 mg/m2을 재발성/난치성 다발성 골수종 환자에게 6회 투여하였으며, 각 활성 치료 사이클의 기간은 21일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하고, 1주일의 휴지기를 가졌다. 이런 예에서, 면역접합체가 종양 세포내 및 종양 세포에 잘 집결할 수 있도록 환자에게 정맥내로 투여하였다.
도 24는 여러번의 치료 지연 (x)에도 불구하고 미확인된 마이너 반응을 나타낸, 19번 환자 (올리고-분비형 MM에 대해 재발성이고 난치성인 환자)의 결과를 나타낸다.
이 농도에서, 혈장 농도는 여전히 Cmax 이론치 보다 낮아 (표 11a), 이 용량으로 매주 투여시 이와 관련된 면역접합체의 축적이 시사되지 않았다. 3주간 120 mg/m2으로 3회, 즉 총 360 mg/m2을 투여한 후, 면역접합체의 허용성은 양호하게 우지되었다. 각 사이클에서 3x 120 mg/m2 (360 mg/m2)로 21일간의 사이클을 3회 수행한 이후에, DLT는 관찰되지 않았다.
다른 예로, 면역접합체 BT062를 반복적인 다회 투약으로서 160 mg/m2을 재발성/난치성 다발성 골수종 환자에게 7회 투여하였으며, 각 활성 치료 사이클의 기간은 21일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하고, 1주일의 휴지기를 가졌다. 이런 예에서, 면역접합체가 종양 세포내 및 종양 세포에 잘 집결할 수 있도록 환자에게 정맥내로 투여하였다.
도 25는 도 18에서 알 수 있는 바와 같이, 이 농도에서 DLT를 나타내지 않은 31번 환자 (M-단백질이 25% 이상 감소함, 마이너 반응으로 분류됨)의 결과를 도시한다.
도 18에 나타낸 바와 같이, 환자 4명 중 2명이 DLT를 나타내었지만 (간 효소 증가, 호중구 감소증), 160 mg/m2으로 치료를 재개할 수 있었다. 이 투여 스케줄에서, MAD는 160 mg/m2였지만, (환자 6명 중 1명은) 140 mg/m2이 MTD로 결정되었다.
| 단회 투약 3주 간격 | 단회 투약 3주 간격 | 반복적인 단회 투약 |
| 160 | 200 | 240, 300, 360, 420 |
| 약물-관련 부작용, 예컨대 눈 독성 | DLT | 심각한 약물-관련 독성(지금까지는) 없음, 420에서 DLT 1건 (손발바닥 홍반성 감각 이상) |
표 1: 3주간 전달된 BT062 총량은 상이한 약물 허용성을 나타낸다. 3주간200 mg/m2을 1회 투약한 결과 DLT (타겟 관련 독성)이 나타났다. 3주간 3가지 간격으로 비슷한 총량 (3x80 mg/m2, 3x 100 mg/m2, 3x 120 mg/m2, 3x 140 mg/m2)을 투여한 경우에는, 환자에서 어떠한 약물 관련 심각한 독성이 나타나지 않았다.
또 다른 예에서, 면역접합체 BT062를 반복적인 다회 투약으로서 80 mg/m2을 재발성의 다발성 골수종 환자에게 4번의 사이클로 공동-투여하였으며, 각 치료 사이클의 기간은 28일이며, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하고, 22일에 투여하지 않았다. 동시에, 레날리도마이드를 1일 경구 용량 25 mg으로 1일부터 21일까지 투여하였고, 덱사메타손을 40 mg으로 매주 (1, 8, 15, 22일)에 투여하였다. 이러한 예에서, 면역접합체가 종양 세포내 및 종양 세포에 잘 집결할 수 있도록 환자에게 정맥내로 투여하였다. 2차 치료 사이클과 3차 치료 사이클의 개시가 지연되고, 3차 사이클의 15일에 BT062를 투약하는 것과 3차 사이클의 15일부터 21일까지 레날리도마이드를 투약하는 것을 생략하였음에도 불구하고, 1차 사이클 이후에도 마이너 반응이 유지되었다 (도 34).
다른 예로, 고형 종양은 고형 메스와 조합된 악성 보다 훨씬 빠르게 면역접합체를 포획하기 때문에, 면역접합체 BT062를 췌장암 환자에게 220 mg/m2의 반복적인 다회 투약으로서 공동-투여하며, 각 치료 사이클 기간은 28일로서, 사이클 당 3회로 사이클의 1, 8 및 15일에 투여하고, 22일에는 투여하지 않는다. 동시에, 면역조절제인 레날리도마이드를 1일 경구 용량 10 mg으로 투여한다. 이러한 예에서, 면역접합체가 종양 세포에 및/또는 종양 세포 안에 더 잘 집결할 수 있도록 환자에게 정맥내로 면역접합체를 투여한다. 이러한 투여 후, 4달간, 21일 사이클의 1일에, 면역접합체 160 mg/m2을 반복적인 단회 투약으로 투여하는 유지 치료를 계속한다.
CD138 또는 신데칸-1 (syndecan-1) (또한 SYND1; SYNDECAN; SDC; SCD1; CD138 ANTIGEN, SwissProt accession number: P18827 human로 언급됨)은, 본래 상피 기원의 세포 상에 존재하는 것으로 기술되었으나, 이후에 조혈 세포 상에서도 발견된, 막 당단백질이다 (Sanderson, 1989). CD138은 가용성 분자 (예, 성장 인자들 EGF, FGF, HGF) 및 불용성 분자 (예, 세포외 매트릭스 성분인 콜라겐 및 파이브로넥틴)에 헤파란 설페이트 체인을 통해 결합하여 (Langford, 1998; Yang, 2007), 세포외 매트릭스에 대한 수용체로서 작용하는, 긴 세포외 도메인을 가지고 있다. 또한, CD138은 부착 세포에 의해 발현된 헤파린-결합 분자를 통해 세포 대 세포의 접착을 매개한다. CD138은 골수종 세포의 성장 인자들에 대한 공동-수용체로서의 기능을 가지고 있는 것으로 확인되고 있다 (Bisping, 2006). 형질세포 (plasma cell)에 대한 분화 연구에서, CD138 역시 분화 항원으로서 간주하여야 하는 것으로 밝혀졌다 (Bataille, 2006).
악성 조혈 과정 (malignant hematopoiesis)에서, CD138은 MM 세포, 난소암 세포, 신장암 세포, 담낭암 세포, 유방암 세포, 전립선암 세포, 폐암 세포, 대장암 세포, 호지킨 림프종 세포, 비-호지킨 림프종 세포, 만성 림프성 백혈병 (CLL) (Horvathova, 1995), 급성 림프모구성 백혈병 (ALL), 급성 골수모구성 백혈병 (AML) (Seftalioglu, 2003 (a); Seftalioglu, 2003 (b)), 고형 조직 육종, 대장암 뿐만 아니라 CD138을 발현하는 그외 조혈 악성 종양 및 고형 종양의 대부분에서 다량 발현된다 (Carbone et al., 1999; Sebestyen et al.,1999; Han et al., 2004; Charnaux et al., 2004; O'Connell et al.,2004; Orosz and Kopper, 2001). CD138의 발현은 또한 다른 유형의 위장 악성 종양과도 관련있다 (Conejo et al., 2000). 표 2에 나타낸 바와 같이, CD138 발현/과다발현과 관련있는 다수의 종양 세포주들이 있다.
| 세포주 | 기원 | 민감성 | CD138 발현 | |
| IC50 (nM) | RFI* | 수용체/세포 | ||
| NCI-H929 | MM | 0.38 | 502 | 788,752 |
| PC-3 | 전립선암 | 0.79 | 541 | 195,671 |
| U266 | MM | 1.59 | 617 | 782,987 |
| MOLP-2 | MM | 1.78 | 425 | 161,064 |
| SK-BR-3 | 유방암 | 2.72 | 485 | 444,350 |
| LNCaP | 전립선암 | 7.39 | 179 | 23,388 |
| CAPAN-2 | 췌장암 | 15.51 | 328 | n. d. |
| PANC-1 | 췌장암 | 36.38 | 34 | 18,085 |
| T47D | 유방암 | 89.28 | 217 | 42,264 |
| Jurkat | T세포 림프종 | 39.00 | n. d. | 0 |
표 2: 여러가지 세포주에서의 CD138의 발현. MM의 경우, BT062에 대한 민감성은 CD138의 고 발현성과 상호 관련있는 것으로 확인됨 (RFI= 상대적인 형광 인덱스).
예컨대, 유방암 세포주 및 췌장암 세포주에서 관찰되는 민감성은 실질적으로 MM 세포주에 비해 낮았다. 그렇지만, 실험 섹션에서 기술한 바와 같이, 유방암 및 췌장암 환자 유래의 세포를 이용한 이종이식 마우스 모델에서, 상응하는 MM 이종이식 모델과 비교하여, 단순 비슷한 것이 아니라 상당히 우수한 결과가 달성되었다. 이들 2가지 경우들에서, 완전 관해를 최종적으로 달성할 수 있었지만, 유사한 MM 모델에서는 종양 증식의 현저한 지연은 관찰되었지만 완전 관해는 관찰되지 않았다.
췌장암에서, 초기 종양과 진행성 종양에서는 신데칸-1 mRNA 발현에 차이가 없는 것으로 나타났지만, 유방암에서는, 약하거나 IHC 염색 불량으로 확인되는 바와 같이 경시적으로 CD138이 없어질 수 있는 것으로 보고되었다. CD138의 발현 상실이 보고되었으며, 이는 대개 발현의 변동 (shift), 즉, 주변 기질 상에서의 새로운 발현과 관련있었다 (Loussouarn, 2008). 그 결과, 시간 경과에 따라 CD138 타겟팅 물질에 대한 타겟이 감소됨을 예상할 수 있다.
CD138 발현이 양성인 것으로 확인된 기타 암으로는, 다수의, 난소 선암종, 방광 이행성 세포암, 신장 투명 세포암, 편평 세포 폐암; 및 자궁암 등이 있다 (예로 Davies et al., 2004; Barbareschi et al., 2003; Mennerich et al., 2004; Anttonen et al., 2001; Wijdenes, 2002를 참조함).
활성형 (증상이 있는) 다발성 골수종 및 관련 형질세포 증식성 장애에 대한 치료는 본 발명의 면역접합체를 통해 치료할 수 있는 질환의 예로서 제공될 것이다.
본원에서 형질세포 증식성 장애는 MGUS, SMM, 활성 (증상이 있는) MM, 왈덴스트룀 마크로글로불린혈증, 독립성 골수종 (solitary plasmacytoma), 전신성 AL 아밀로돕시스 및 POEMS 증후군 등의, 형질세포 장애 및/또는 조혈 장애를 의미한다.
다발성 골수종 (MM)은 전형적으로 골수에서 기원하며, 주로 환자의 골격근에서 발생하며, 침범된 특정 부위에 기인한 임상적인 특성과 혈장 단백질들의 형성에 비정상성이 나타나는, 형질세포의 악성 증식을 지칭한다. 이 질환은 일반적으로, 골과 때로는 골격근 이외의 부위에서의 명백한 부종을 야기하는, 다양한 골수(특히 두개골의 골수)내 비정상적인 또는 악성 형질세포의 다수의 미만성 국소(foci) 또는 결정(nodular) 축적이 특징적이다. 방사선 검사에서, 골 병변에는 "펀치-아웃"된 특징적인 외양이 있을 수 있다. 골수종과 관련된 세포들은 전형적으로 비정상적인 단백질을 생산하거나 및/또는 혈청 및 뇨에서 비정상적인 단백질 수준을 형성한다. 이 질환은, 전형적으로, 유의성이 미결정된 단일클론 감마글로불린 병증 (MGUS: monoclonal gammopathy of undetermined significance)에서 무증상의 다발성 골수종 (SMM: smoldering multiple myeloma), 그리고 활성형 다발성 골수종(MM)으로 진행된다. 이 질환의 증상은 다양하지만, 고칼슘혈증, 신부전 (renal insufficiency), 피로, 빈혈, 골 통증, 자연 골절, 감염 횟수 또는 지속 기간 증가, 또는 뇨 색상 또는 냄새 이상이 있을 수 있다. 본 발명이 다발성 골수종을 지칭하는 경우, 이는 유의성 미정의 단일클론 감마글로불린 병증 (MGUS), 무증상 다발성 골수종 (SMM) 및 활성형 다발성 골수종 (MM), 뿐만 아니라 궁극적으로 활성형 MM으로 진행될 수 있는 형질세포의 그외 악성 증식을 지칭한다.
MGUS는 MM 발병 전에 나타나는 임상적으로 양성인 질환 상태로, MM 보다 발생 빈도가 높으며, 50대 이상의 집단에서의 발병률은 1%이고, 70대 이상의 집단에서의 발병률은 3%이다 (Greipp and Lust, 1995). MGUS 환자는 치료적 도움 없이도 안전적인 것으로 관찰될 수 있기 때문에, MGUS 환자를 MM 환자와 구분하는 것이 중요하다.
그러나, MGUS 환자 241명에 대한 장기간의 추적 기간 중에, 환자 59명 (24.5%)이 MM 또는 관련 장애로 발전되었다 (See Kyle et al., 1993).
용어 감마글로불린 병증은 환자의 면역글로불린 합성시 일차적인 교란 (primary disturbance)을 의미한다.
단일클론 감마글로불린 병증은 전형적으로 림프계 세포 또는 형질세포의 단일 클론의 증식 (정상적으로 혈청 단백질 전기영동 (SPEP) 상에서 단일 피크로서 가시화 가능함)과 관련있으며, 환자의 혈청 또는 뇨내 단일클론 면역글로불린의 존재가 특징적인, 일군의 임의의 장애를 지칭한다.
무증상 MM (SMM)은 노년층에서의 유증상성 다발성 골수종 전에 앞서 발생하는 것으로 보고되고 있다. 무증상 다발성 골수종은 흔히 MGUS이 진행된 단계로서 간주되고 있으며, 심지어 진행 시에도, 무증상 다발성 골수종에서는 일반적으로 골 용해성 병변 또는 그외 유증상성 다발성 골수종의 기본적인 특징들이 결여되어 있다.
MM의 임상 증상으로는 빈혈, 고칼슘혈증, 신부전 및 용해성 골 병변을 포함한다. 질병은 유의성 미정의 단일클론성 감마글로불린 병증 (MGUS)에서 무증상 다발성 골수종 (SMM)으로 다시 다발성 골수종 (MM)으로 진행됨에 따른, 질병의 추이와 중증도에 대한 구분을 아래 표 3에 나타낸다. 이 표에는 또한 이러한 질병 상태의 검출, 진단 및 모니터링 방법을 종합하여 개시한다. 이러한 증상과 기법들은 당해 기술 분야의 당업자에게 잘 알려져 있다.
| 표 3 | |||
| MM, SMM 또는 MGUS의 임상 특징 비교 | |||
| 특징 | MM | SMM | MGUS |
| 골수 형질세포 | >=10% | >=10% | <10% |
| 혈청 M-단백질 | >=3 g/dL | >=3 g/dL | <3 g/dL |
| Bence-Jones | >=1 g/24 h | <1 g/24 h | <1 g/24 h |
| 뇨내 단백질 | o | o | o |
| 빈혈 | 일반적으로 존재함 | 가능성 있음 | 없음 |
| 고칼슘혈증, 신부전 | 존재할 수 있음 | 없음 | 없음 |
| 용해성 골 병변 | 일반적으로 존재함 | 없음 | 없음 |
| MM = 다발성 골수종 | |||
| SMM = 무증상 다발성 골수종 | |||
| MGUS = 유의성 미정의 단일클론성 감마글로불린 병증 | |||
| 다발성 골수종의 중증도 및 임상적인 특징에 의해 단계 분류 | |||
| 질병 진행 단계 | |||
| 단계 I (활성 MM) | |||
| 상대적으로 적은 수의 암 세포가 신체 전체에 퍼짐. 혈중 적혈구 세포의 수와 칼슘 양은 정상임. 뼈에서는 종양(형질세포종)은 발견되지 않음. 혈액 또는 뇨내 M-단백질의 양은 극히 적음. 질병의 증상은 없을 수 있음. | |||
| 단계 II (활성 MM) | |||
| 적정 수의 암 세포가 신체 전체에서 발견됨 | |||
| 단계 III (활성 MM) | |||
| 상대적으로 많은 수의 암 세포가 신체 전체에 퍼져 있음. 하기 중 하나 이상의 증상이 있을 수 있음: 적혈구 수 감소로, 빈혈 유발 골 손상으로 인해 혈중 칼슘 양이 매우 높음 4종 이상의 골 종양(형질세포종)이 발견됨. 혈액과 뇨에서 M-단백질이 고농도로 확인됨 |
|||
| MM의 임상적인 특징 고칼슘혈증 신부전 빈혈 |
|||
| 단일클론성 단백질: SPEP (혈청 단백질 전기영동) SPIEP (혈청 단백질 면역전기영동) 뇨 단백질 면역전기영동(Bence - Jones 단백질) |
|||
| MM의 진단 골수 내 형질세포 >10%, 또는 생검 또는 형질세포종 상에서의 응집 |
|||
| 단일클론 단백질: 혈청 M-단백질 >3 g/dl 또는 뇨내 M-단백질 |
|||
활성형 다발성 골수종 (MM)은 전형적으로 환자의 골수에서의 악성 형질세포의 증식으로 임상적으로 확인한다. 이러한 신생물성 형질세포는 면역글로불린을 생산하며, B-림프구로부터 기원한다. 형질세포에 의해 생산되는 면역글로불린은 환자의 혈액 혈청 및/또는 뇨에서 전기영동 검사에 의해 검출할 수 있다.
표 3에서 언급한 바와 같이, 혈청 M-단백질의 측정은 MM의 여러가지 단계를 분석하는 중요한 수단이 된다.
"M-단백질"은 전기영동 겔에 가는 밴드 또는 면역전기영동에서의 비정상적인 호 형태로 통상적으로 가시화되는 단일클론 단백질이다. 이는, 하나의 공통 세포 (common cell)로부터 기원하는 클론 세포들에 의해 생산되는 동질적인 (homogenous) 면역글로불린, 예컨대 단일 클래스 및 서브클래스의 중쇄와 단일 타입의 경쇄가 특징인 단일클론 면역글로불린의 증폭을 의미한다 (또한, M-스파이크, 보다 광의적으로는 파라단백질로도 지칭됨).
"혈청 단백질 전기영동" (SPE 또는 SPEP) 및 "면역고정 전기영동" (IFE)으로 다발성 골수종(MM)을 비롯한 몇가지 형질세포 증식성 장애에서 생성되는, 단일클론 면역글로불린을 검출할 수 있다. 광의의 개체 집단에서는 이러한 검출 결과 중 최대 61%는 임상적인 증상과 연관되어 있지 않아, 유의성 미정의 모노감마글로불린 병증 (MGUS)으로 진단할 수 있다. 그러나, SPE와 IFE는 모든 단일클론 면역글로불린을 검출하지 못하며, 특히 경쇄만 분비된 경우에, 검출하지 못한다.
이러한 "유리형 경쇄 분자 (free light chain molecule)" (FLC)는 λ 및 κ 경쇄를 포함한다. 형질세포는 κ 또는 λ 분자 중 어느 하나와 함께 5가지 중쇄 유형들 중 한가지를 생산한다. 중쇄 합성 대비 유리형 경쇄의 생산율은 통상 약 40%를 초과한다. 형질세포는 무손상(intact) 면역글로불린 분자 뿐만 아니라 유리형 경쇄 (FLC, κ 또는 λ)를 방출하며, 혈청내 경쇄 수준은 합성(κ>λ)과 신장에서의 배출(κ>λ)의 상대적인 비에 의해 결정된다. 단일클론 면역글로불린이 존재하는 경우, κ:λ 비는 수반된 FLC의 클래스에 따라, 정상 범위 보다 높거나 낮을 수 있다. FLC의 혈청내 반감기는 2-6시간인데 반해, IgA는 5일, IgM은 6일, IgG는 21일이다. 따라서, 혈청내 FLC 농도 측정은 무손상 면역글로불린을 측정하기 보다는 치료법에 대한 종양의 반응성을 보다 신속하게 평가할 수 있도록 한다. 이처럼, 혈청내 FLC 측정으로 재발을 조기에 검출할 수 있다.
비-형질세포 증식성 질환 역시 CD138 발현과 관련있다.
췌장암
대부분의 경우 외분비 타입이다. 이러한 외분비 타입의 암 대부분은 관 선암종 (ductal adenocarcinoma)이다 (추가로 드물게는 서브타입은 낭성 종양, 선포 세포의 종양 및 육종을 포함함). 췌장의 내분비 타입의 암은 호르몬을 생산하는 종양이다.
인 시츄 암 (Carcinoma in situ )은 이것이 시작된 곳의 세포 층으로 한정된 경우 암의 초기 단계를 의미한다. 유방암의 경우, 인 시츄는 암 세포가 관 (인 시츄 유관 산피내암) 또는 소엽 (인 시츄 유소엽암)으로 한정되어 있는 것을 의미한다. 이는 유방의 더 깊은 조직까지 증식하거나 또는 신체의 다른 장기로 전파되지 않은 것이며, 때로는 비-침습성 또는 프리(pre)-침습성 유방암으로도 지칭된다.
침습성(침윤성) 암.
췌장의 외분비 세포 및 내분비 세포는 완전히 다른 타입의 종양을 형성한다.
외분비형 종양
지금까지 췌장암에서 가장 흔한 타입이며, 대부분의 췌장 외분비형 종양은 악성이다. 외분비형 췌장암의 약 95%는 선암종 (선암종은 선세포에서 시작되는 암임)이다. 이 암은 일반적으로 췌장의 관에서 시작되지만, 때로는 췌장 효소를 만드는 세포에서 발생되기도 한다 (선포 세포 암종).
외분비형 췌도암에서 발생율이 조금 낮은 타입으로는 선편평 암종 (adenosquamous carcinoma), 편평 세포 암종 및 자이언트 세포 암종이 있다.
내분비형 종양
내분비 췌장암은 드문 편이다. 그룹으로서, 이는 췌장 신경내분비 종양 (NET: neuroendocrine tumor)으로, 또는 때로는 섬 세포 종양으로 알려져 있다. 섬세포 종양에도 몇가지 서브타입들이 존재한다. 각각은 시작되는 호르몬-생성 세포의 타입에 따라 명명된다.
외분비 췌장암의 병기 (stage)를 나타내는데 사용되는 주 체계는 미국 암 학회(ACS)가 제공하는 미국 합동 암 위원회(AJCC)의 TNM 체계이다. 이 TNM 체계에서는 병기 분류를 위해 3가지 주요 정보를 이용한다:
T는 센티미터(cm) 단위로 측정하는 원발성 종양(들)의 크기를 나타내며, 암이 췌장내에 퍼지거나 또는 근처 장기로 퍼졌는지를 나타낸다. TX, T0, T1, T2, T3 및 T4로 구분하며, 숫자가 높을수록 질환이 진행되었음을 나타낸다.
N은 근처 (국부적) 림프절로 전파되었음을 나타낸다. N 카테고리로는 NX, NO 및 N1이 있다.
M은 암이 신체의 다른 장기로 전이(전파)되었는지를 표시한다. (췌장암이 전파되는 대부분의 공통된 부위는 간, 폐 및 복막 - 소화기관 주변 공간임). M 카테고리로는 MX, M0 및 M1이 있다.
T, N 및 M 카테고리를 결정한 후, 이 정보를 조합하여, 병기 분류라 하는 과정인 병기(stage)를 정한다.
0기 (Tis, N0, M0): 종양이 췌도 세포의 상부층으로 국한되어 있고, 보다 깊은 조직으로 침입되지 않았음. 췌장 외부로 퍼지지 않았음. 이 종양은 때로는 인 시츄 췌장암 또는 췌장 상피내 종양 (PanIn III: pancreatic intraepithelial neoplasia III)이라고도 한다.
IA기 (T1, N0, M0): 종양이 췌장으로 국한되며, 크기는 2 cm 미만임. 근처 림프절이나 멀리 전이는 없음.
IB기 (T2, N0, M0): 종양이 췌장으로 국한되며, 크기는 2 cm 보다 큼. 근처 림프절이나 멀리 전이는 없음.
IIA기 (T3, N0, M0): 종양이 췌장 외부로 증식되었지만 큰 혈관으로 전파되지 않았음. 근처 림프절이나 멀리 전이는 없음.
IIB기 (T1-3, N1, M0): 종양이 췌장으로 국한되거나 또는 췌장 외부로 증식되지만, 근처 큰 혈관이나 주요 신경으로 전파되지 않았음. 근처 림프절까지 퍼졌으나, 멀리 전이는 없음.
III기 (T4, 모든 N, M0): 종양이 췌장 외부로 증식되어 근처 큰 혈관이나 주요 신경까지 퍼짐. 근처 림프절까지 퍼지거나 퍼지지 않았을 수 있음. 멀리 전이는 없음.
IV기 (모든 T, 모든 N, M1): 암이 멀리 전이됨.
TNM 체계에 공식적인 부분은 아니지만, 다른 인자들도 예후 (전망) 결정에 중요하다. 암의 등급 (현미경으로 세포의 이상성을 살펴보는 방법)은 때로는 G1에서 G4로도 나타내는데, G1은 암이 거의 정상 세포와 비슷하게 보이며 예후가 양호하다.
수술을 받은 환자의 경우, 중요한 다른 인자는 종양 전체가 제거되었는지 아닌지인 절제 정도이다. 이는, 때로 R0 (눈으로 확인되고 현미경으로 관찰되는 종양들이 모두 제거됨) 내지 R2 (일부 눈으로 확인되는 종양을 제거 못한 경우)로 표시된다.
실무적인 관점에서, 암이 어느 정도까지 퍼졌는지는 대개 수술하지 않고는 정확하게 확인할 수 없다. 이는, 의사들이 대개 보다 단순한 병기 분류 체계, 즉 종양을 수술로 제거할 수 있는지 여부를 기초로 암을 그룹으로 분류하는 방법을 사용하는 이유이다. 이러한 그룹은 절제 가능, 국소 진행성 (절제 불가) 및 전이로 지칭된다. 이 용어들은 외분비형과 내분비형 췌장암 둘다를 설명하는데 사용할 수 있다.
절제 가능: 암이 췌장에만 있다면 (또는 약간 근거리로만 퍼졌다면), 외과의는 종양 전체를 제거할 수 있으며, 이를 절제 가능이라 한다.
국소 진행성 (절제 불가): 암이 먼 장기로 퍼지지 않았지만, 수술로는 완전하게 제거할 수 없는 경우로, 이를 국소 진행성이라 한다. 종종, 암을 제거할 수 없는 이유는 근처에 혈관이 다량 존재하기 때문이다.
전이: 암이 먼 장기로 퍼졌을 때를 전이라고 한다. 수술을 수행할 수도 있지만, 목적은 증상 완화이지 암 치유가 아니다.
신경내분비 췌장암은 외분비형 췌장암처럼 병기를 분류하지 않는다. 대신, 통계 자료에 따라 여러가지 병기로 분류한다: 국소 (오직 췌장에만 존재), 국지적 (근처 림프절 또는 조직으로 퍼짐) 및 원거리 (멀리 떨어진 부위, 예컨대 간으로 퍼짐).
방광암은 현미경으로 암 세포를 관찰한하는 방식으로 분류한다.
이행 세포 암종 (Transitional cell carcinoma) (또한, 요로상피 암 (urothelial carcinoma)이라고도 함)이 지금까지 가장 흔한 방광암 타입이다. 이 그룹에도 서브타입들이 있다. 서브타입은 세포의 형태에 따라, 그리고 다른 장기로 퍼져 침투되는 양상에 따라 명명된다. (이들이 방광내 심부로 증식된 것이 틀림없다면 침습성이라고 하며, 그렇지 않다면 비-침습성이라 함). 이들 종양은 현미경에서의 세포가 어떻게 보이는지에 따라 등급이 분류된다. 세포가 정상 세포와 매우 비슷하게 보이면, 그 암은 저-등급 암이다. 세포가 매우 비정상적으로 보이면, 그 암은 고-등급이다. 등급이 낮을수록 보다 천천히 증식하는 경향이 있으며, 높은 등급의 암 보다 결과가 좋다.
또한, 편평 세포 암 (드문 형: 통상 침습성); 선암종 (드문 형: 거의 대부분이 침습성); 소세포 (희귀)도 정의에 포함된다.
그외 드문 방광암들도 본 정의에 포함된다.
방광암 역시 병기로 분류된다:
0a기 (Ta, N0, M0):
암은 비침습성 유두암 (papillary carcinoma)임. 방광의 중공 센터쪽으로 자라지만 방광벽의 근육 또는 연결 조직까지 침범하진 않았음. 림프절이나 멀리 전이되지 않았음.
0is기 (Tis, N0, M0):
암은 평평하고 비침습성 암으로서, 또한 편평 암종 인 시츄(CIS)라고도 함. 암이 방광의 라이닝 층까지 침범함. 방광의 중공 부분 안으로는 침범하지 않았고, 방광벽의 근육 또는 연결 조직까지 퍼지지 않았음. 림프절이나 멀리 전이되지 않았음.
I기 (T1, N0, M0):
암이 방광의 라이닝층 아래 결합 조직까지 침범하였으나, 방광벽의 얇은 근육층까지는 퍼지지 않았음. 암이 림프절이나 멀리 전이되지 않았음.
II기 (T2, N0, M0):
암이 방광벽의 얇은 근육층까지 침범하였지만, 근육을 완전히 통과하여 방광을 둘러싸고 있는 지방 조직에까지는 퍼지지 않았음. 암이 림프절이나 멀리 전이되지 않았음.
III 기(T3 또는 T4a, N0, M0):
암이 방광을 지나 방광을 둘러싸고 있는 지방 조직층까지 침범함 (T3). 전립선, 자궁 또는 질에 침범하였을 수 있음 (T4a). 골반벽 또는 복벽으로는 침범하지 않았음. 암이 림프절이나 멀리 전이되지 않았음
IV기 (T4b, N0, M0) 또는 (모든 T, N 1 - 3, M0) 또는 (모든 T, 모든 N, M1):
암이 방광벽을 지나 복벽 또는 골반벽까지 퍼졌거나 (T4b) 및/또는 림프절 (N1-3) 및/또는 골, 간 또는 폐 등의 멀리 있는 부위로 전이됨 (M1).
담낭암의 종류
담낭암 10건 중 9건 이상이 선암종이다. 선암종은 체내 넓은 내표면 및 외표면의 안에 라이닝되어 있는(소화계 내부 포함), 샘세포와 유사한 특성을 가지고 있는 세포에서 시작되는 암이다.
특별히 언급할 만한 담낭 선암종의 한가지 종류는 유두형 선암종 (papillary adenocarcinoma) 또는 간단히 유암종 (papillary cancer)이다. 이들 암은 현미경으로 검경하였을 때 손가락과 같은 융기 형태로 세포가 정렬되어 있는 담낭암이다. 일반적으로, 유암종은 거의 간이나 근처 림프절까지 퍼지지 않는다. 이 암은 대부분의 다른 담낭 선암종에 비해 예후 (결과)기 우수한 편이다. 담낭암의 약 6%가 유두형 선암종이다.
선편평 상피암, 편평세포암 및 소세포 암 등의 방광암에서 발전될 수 있는 그외 암 종류가 있지만, 발병율은 드문편이다.
담낭암의 하기 병기는 AJCC의 TNM 체계를 기준으로 구분한다:
0기: Tis, N0, M0: 담낭의 상피층에만 소형 암이 있음. 담낭 외부로 퍼지지 않았음.
IA기: T1 (a 또는 b), N0, M0: 종양이 점막 고유층 (lamina propria) (T1a)또는 근육층 (T1b)까지 침범함. 담낭의 외부로는 퍼지지 않았음.
IB기: T2, N0, M0: 종양이 근육 주변 섬유 조직까지 침범함. 담낭의 외부로는 퍼지지 않았음.
IIA기: T3, N0, M0: 종양이 장막층을 통과하여 퍼지거나 및/또는 직접 간 및/또는 다른 근처 구조물에 침범되었음. 림프절이나 담낭에서 멀리 떨어져 있는 조직이나 장기로 퍼지지 않았음.
IIB기: T1 - T3, N1, M0: 종양이 담낭에서의 증식된 모든 형태와 더불어, 근처 림프절까지 전이됨 (N1). 담낭에서 멀리 떨어져 있는 조직이나 장기로는 전이되지 않았음.
III기: T4, 임의의 N, M0: 종양이 주요 혈관에 침범하였고, 이를 통해 간까지 침범하거나 또는 간 이외의 1곳 이상의 근처 장기에 침범하였음. 림프절에 전이되거나 전이되지 않았을 수 있음. 담낭에서 멀리 떨어져 있는 조직이나 장기에는 전이되지 않았음.
IV기: 모든 T, 모든 N, M1: 종양이 담낭에서 멀리 떨어져 있는 조직이나 장기까지 전이됨.
유방암
선암은 일반적으로 선 조직 (물질을 생산하며 분비하는 조직)에서 시작되는 유형의 암이다. 유방암에서, 유관 및 소엽이 선조직이므로, 이 부위에서 시작되는 암을 보통 선암이라고 한다. 유방암도 몇가지 유형이 있지만, 일부는 매우 희귀한 편이다. 일부 경우, 하나의 유방 종양이 이러한 유형들의 조합을 나타내거나 또는 침습성 암과 인 시츄 암의 혼합을 포함할 수 있다.
유관상피내암 (DCIS: ductal carcinoma in situ, 또한 관상피내암이라고도 함)은 비침습성 유방암의 가장 일반적인 유형이다.
침습성 (또는 침윤성) 유관상피암 (IDC)은 유방암의 가장 흔한 유형이다. 침습성 (또는 침윤성) 유관상피암 (IDC)은 유방의 모유 이동로 (유관)에서 시작되며, 유관의 벽을 파괴하여, 유방의 지방 조직까지 침범한다. 이 지점에서, 림프계 및 혈류를 통해 체내 다른 부위로 퍼질 (전이될) 수도 있다. 침습성 유방암 10종 중 약 8종이 침윤성 유관상피암이다. IDC 환자에서 CD138의 발현이 확인되었다 (Loussouarn et al., 2008).
트리플-네거티브 유방암은 세포에 에스트로겐 수용체와 프로게스테론 수용체가 없으며, 그 표면에 과잉의 HER2 단백질을 가지고 있지 않는, 유방암 (통상 침습성 유관상피암)이다. 트리플-네거티브 유방암은 다른 대부분의 유방암 유형들에 비해 보다 신속하게 증식하여 퍼지는 경향이 있다. 종양 세포에는 특정 수용체가 결여되어 있기 때문에, HER2를 타겟팅하는 호르몬 요법 또는 약물들은 이들 암에 대해 유효하지 않다 (화학요법은 필요에 따라 여전히 유용할 수 있음).
용어 "유방암"에 포함되는 일부 다른 유방암으로는 염증성 유방암, 수질 암종 (medullary carcinoma), 이형성 암종 (metaplastic carcinoma), 점액성 암종 (mucinous carcinoma), 관 암종 (tubular carcinoma), 유두상 암종 (papillary carcinoma), 선상낭포암 (adenoid cystic carcinoma) (선낭성암종 (adenocystic carcinoma)), 엽상 종양 (phyllodes tumor)이 있다.
표준적인 암 치료법은 수술, 방사선 요법 또는 화학요법이다. 호르몬 치료도 때로 사용된다. 호르몬 치료는 전신 요법의 형태이다. 대부분은 신보강제 치료제 (neoadjuvant treatment)로서 사용할 수도 있지만, 수술 후 암 재발 위험성을 낮추는데 도움이 되기 위한 보강 요법으로서 사용된다. 또한, 치료 후 재발되거나 퍼진 암을 치료하는데에도 사용된다. 에스트로겐은 에스트로겐 수용체 (ER-양성 암) 및/또는 프로게스테론 수용체 (PR-양성 암)를 포함하는, 유방암 3건 중 약 2건의 증식을 촉진시킨다. 이 때문에, 에스트로겐 작용을 차단하거나 또는 에스트로겐 수준을 낮추는 몇가지 방법을, ER-양성인 유방암과 PR-양성인 유방암을 치료하는데 사용하고 있다. 그러나, 호르몬 요법은 ER 또는 PR이 결여된 환자에게는 효과가 없다.
또한, 유방암은 다음과 같은 병기 분류 체계를 따른다:
0기: 비전형적인 세포는 유관 또는 소엽의 외부, 모유 생산 기관, 주변 유방조직으로 퍼지지 않았음. 상피내암종 (carcinoma in situ)을 참조하여, 2가지 타입으로 분류된다: 치료 가능성 및 생존성이 매우 높은 최초기 암인 "유관상피내암종" (DCIS), 및 암은 아니지만, 유방암 발병 위험성이 높은 군으로 동정되는 지표가 확인되는 "소엽상피내암종" (LCIS).
I기: 암이 2 cm (약 1 인치) 이상의 크기가 아니며, 주변 림프절 또는 유방암 외부로 전이되지 않았음.
II기: 이 병기는 종양의 크기에 따라, 그리고 림프절로 퍼졌는지 여부에 따라 2개의 카테고리로 분류됨:
II A기의 유방암 - 종양의 크기는 2 cm 미만이며, 겨드랑이 보조 림프절 최대 3개에 전이되었음. 또는, 종양이 2 cm 보다 크게 증식되었지만, 5 cm 이하이며, 주변 림프절로 전이되지 않았음.
II B기의 유방암 - 종양이 2 내지 5 cm 크기로 증식되었고, 겨드랑이 보조 림프절 최대 3개에 전이되었음. 또는, 종양이 5 cm 이상이지만 주변 림프절로는 전이되지 않았음.
III기: 이 병기는 2개의 카테고리로 분류됨:
III A기의 유방암 - 종양의 크기가 2 cm 이상, 5 cm 이하이며, 겨드랑이 보조 림프절 최대 9개에 전이됨.
III B기의 유방암 - 암이 피부, 흉벽, 늑골, 근육 또는 흉벽내 또는 쇄골 위의 림프절 등의 유방 근처 조직으로 전이됨.
IV기: 본 병기에서는, 암이 간, 폐, 뇌, 골격계 또는 쇄골 근처 림프절 등의 다른 장기나 조직까지 전이됨.
폐암
4가지 유형의 신경내분비 폐 종양, 즉, 대세포 신경내분비폐암종 (large cell neuroendocrine carcinoma), 비전형 유암종 (atypical carcinoid tumor), 전형적인 유암종 (typical carcinoid tumor) 및 소세포 폐암이 있다.
유암종 종양은 미만성 신경내분비계 (diffuse neuroendocrine system)의 세포에서 시작되는 종양이다. 전형적인 및 비전형 유암종 종양은 현미경 검경에서 다르게 관찰된다. 전형적인 유암종은 느리게 증식하며, 매우 드물게 폐 외부로 전이되며, 10개의 폐 유암종 중 약 9개가 전형적인 유암종이다.
치료 목적에서, 폐암은, 매우 다르게 치료되는 2가지 유형들, 즉 소세포 폐암 (SCLC) 및 비-소세포 폐암 (NSCLC)으로 구분된다. 암이 2가지 유형의 특징들을 모두 가지고 있는 경우에는, 혼성 소세포/대세포 암으로 지칭된다.
전체 폐암의 약 10% 내지 15%가 소세포 유형이다. SCLC의 다른 이름은 귀리 세포암 (oat cell carcinoma) 및 소세포 미분화 암 (small cell undifferentiated carcinoma)이다.
이 암은 대개 가슴 중앙 근처 기관지에서 시작된다. 암 세포는 작지만, 빠르게 분열하여 큰 종양을 형성하며, 림프절과 체내 전역의 다른 장기로 퍼진다. 수술은 매우 드문 편이며, 치료제 투여만 이루어진다. 치료제로는 광범위로 퍼진 질병을 사멸시키기 위한 약물 등의 세포독성 물질을 포함한다.
NSCLC에는, 3가지 유형, 즉 편평 세포 암종; 선암종; 대세포 (미분화) 암종이 있다.
비-소세포 폐암의 병기 분류
비-소세포 폐암의 병기 분류에 사용되는 체계는 AJCC (American Joint Committee on Cancer) 체계이다. 병기는 로마 숫자로 0 -IV(0 - 4)로 기재된다. 일부 병기들은 다시 A와 B로 나뉜다. 대개, 숫자가 낮을수록 암 전파 정도는 낮아진다. 숫자가 IV(4)기와 같이 높을수록, 더욱 진행된 암을 의미한다.
편평 세포암 (두경부암)에 대해서도 I - IV기 등의 대표적인 병기 분류 체계가 개발되었다. I기 암은 작고, 국소적이며, 통상 치료가능하며, II기 및 III기의 암은 전형적으로 국소 진행된 암이거나, 및/또는 국소 림프절까지 전이되었으며, IV기 암은 통상적으로 전이 (신체의 원위부로 전이됨)되었고 통상 수술이 불가능하다.
본 발명의 내용에서, 치료는, CD138을 발현하는 세포와 관련된 장애의, 진행 예방 또는 서행, 질병 상태의 안정화, 질병의 회복, 또는 한가지 이상의 증상의 완화를 포함한다. 즉, 치료는 장애의 중증도 증가 예방 또는 서행, 또는 장애의 회복을 포함한다. MM의 경우, 일반적으로 II 또는 II기의 활성 MM인 환자들만 1차 요법 (I기 환자 또는 SMM인 환자는 초기에는 3-6개월의 간격으로 관찰함)을 받는데, 본 발명에 따른 치료는, 예컨대 임의의 활성형 병기의 MM의 치료 뿐만 아니라 전통적으로 치료되는 질환 상태 이전의 질환 상태의 치료를 포함한다. 특히, 치료는 또한 어떤 질병 상태에서 그 다음 상태: MM의 경우에, 이는, 예컨대 MGUS에서 SMM으로, 또는 SMM에서 활성형의 MM I기 또는 MM의 다른 기로의 진행의 예방을 포함한다. 외분비형 췌장암의 경우, 예컨대 I기에서 II기로의 진행, AJCC에 의해 확립된 병기들에 포함되는 카테고리에 의해 반영되는 바와 같이, 예컨대 IA -> IB와 같은, 임의의 악화가 포함된다. 그러나, 이 용어는 안정적인 질환 유지 등의 현상 유지, 및 후술되는 바와 같이, 치료받은 환자에서의 특정 반응 도출을 포함한다. 또한, 환자에서, 특히 하기: 암 세포의 수 감소 또는 암 세포의 부재; 종양 크기 감소; 연조직 및 뼈로의 암 전이 등의, 말초 장기로의 암 세포의 침윤 저해 (즉, 어느 수준까지의 서행, 바람직하게는 중지); 종양의 전이 저해 (즉, 어느 수준까지의 서행, 바람직하게는 중지); 종양 증식의 어느 수준까지의 저해; 및/또는 특정 암과 관련된 한가지 이상의 증상의 어느 수준까지의 경감; 이환률 및 사망률의 감소, 및 삶의 품질 개선 - 중 한가지 이상이 관찰가능하거나/하고 측정가능한 수준으로 없어지거나 감소되었다면, 이 환자는 성공적으로 "치료된"것이다. 일반적으로, 환자의 질환 상태에 대한 특정 치료 효능을, MM의 경우에, 환자의 혈청 및/또는 뇨내 M-단백질 수준, 및/또는 환자의 혈청 및/또는 뇨내 FLC의 수준을 측정함으로써, 모니터링할 수 있다. CD138을 발현하는 세포와 관련된 그외 장애의 경우에, 본 발명에 따른 치료의 효능을 평가하기 위해 다른 파라미터를 측정한다. CRP (C-반응성 단백질)는 임상적인 암 모니터링에 대한 비특이적인 염증 파라미터이다. 췌장암의 경우, 단순히 몇몇을 지칭하기 위해, 측정할 수 있는 해당 파라미터로는 CA 19-9 (탄수화물 항원 19.9, 종종 췌장암에서 증가되는 종양 마커임), 빌리루빈 (bilirubin) 또는 CRP이다. 아울러, 소노그래프, CT, MRT 등의 영상화 방법도 사용된다. 두경부암의 경우, 종양 타입에 의존적인 바이오마커들이 사용되며 (예, 메르켈 세포의 경우 NSE (뉴론-특이 에놀라제) 또는 CEA (카시노엠브리오닉 항원)); 유방암의 경우, CA 15-3Her2 발현 및 카드헤린 (Cadherin) 발현이 마커로서 이용될 수 있지만, 치료는 NSE 등의 혈청 마커로 모니터링할 수 있다.
증상을 보이는 개체에서, 질병을 진단하는데, 방광 종양 항원 (BTA) 및 NMP22 검사를 방광경 검사 (방광을 보기 위한 가늘고 빛이 발사되는 관을 이용함)와 함께 실시할 수 있다. 또한, 방광경 검사와 뇨 세포검사 (현미경을 이용하여 뇨에서 암 세포 관찰)가 여전히 진단 및 추적에 표준적인 검사로서 권고되고 있지만, 상기한 검사들도 치료 후 일부 환자를 추적하는데 이용되고 있다. BTA 및 NMP22 검사는 흔히 방광경 검사들 사이에 이용된다. 정상 수치가 나타나면 방광경 검사를 보다 적은 횟수로 수행할 수 있다. 그러나, 이러한 검사가 뇨 세포검사와 방광경 검사를 대체할 수는 없다.
진행성 방광암에서는, CEA, CA 125, CA 19-9 및 TPA (조직 폴리펩타이드 항원) 등의 다른 암들에 사용되는 마커들 중 일부가 증가하므로, 치료 중과 치료 후 환자를 추적하는데 사용할 수 있다. 폐암에서는 확립된 마커가 없으며, CEA나 NSE가 증가할 수도 있다.
골수종 세포 또는 유방암 세포 등의 종양 세포들은 CD138을 셰딩 (shedding)하는 것으로 알려져 있다. 표면 CD138의 소실(loss)은 골수종에서의 예후 불량과 연관 있다. 또한, 두경부암 또는 폐암 등의 다른 종양 증상들에서도 가용성 CD138가 고농도로 검출되었다 (Anttonen et al. 1999). 표면의 신데칸-1의 소실은 EMT (상피 간엽 이행 (epithelial mesenchymal transition))과 관련성이 있는데, 상기 프로세스는 악성 세포의 침습성 및 전이성 단계와 관련된 덜 또는 불충분하게 분화된 세포로의 변환을 지칭한다. 이는, 예컨대 전이성 유방암의 경우에 대해 보고되어 있다 (Loussouarn et al., 2008).
제제, 특히 면역접합체, 또는 본 발명에 따른 면역접합체를 포함하는 약학 조성물의 유효량은, 개체, 특히 인간 개체 (환자)에서 질환 또는 장애를 "치료"하는데 필요한 양이다. MM 등의 암의 경우, 제제의 유효량은 암 세포의 수를 감소시킬 수 있거나; 암의 크기를 축소할 수 있거나; 암 세포의 말초 장기로의 침윤을 저해 (즉, 어느 수준으로의 서행, 바람직하게는 정지)할 수 있거나; 종양 전이를 저해 (즉, 어느 수준으로의 서행, 바람직하게는 정지)할 수 있거나; 및/또는 암과 관련된 한가지 이상의 증상을 어느 정도로 경감시킬 수 있다. 본원의 "치료" 정의 부분을 참조하라.
예컨대 200 mg/m2의 "약동학적 당량"은, 면역접합체를 조합 투여하였을 때, 예컨대 일차적으로 CD138을 발현하는 비-타겟 세포에 대한 잠재적인 부작용 등의, 실제 치료용 물질과 공동-투여하였을 때, 200 mg/m2의 용량에서 관찰되는 동일한 약동성을 발생시키는, 면역접합체의 양을 의미한다. 이러한 당량은 다른 물질에 따라 200 보다 다소 작거나 또는 200 보다 조금 높을 수 있다. 예컨대, 160 이하, 170 이하, 180 이하, 190 이하, 210 이하, 220 이하, 230 이하, 및 240 mg/m2 이하의 유효량이 포함된다. 예컨대, 당해 기술 분야의 당업자는, 코르티코스테로이드 또는 항생제와의 공동-투여시, 피부에 부작용을 발생시키는 경우에도 면역접합체를 약간 고용량으로 사용 가능함을 예상할 것이며, 당해 기술 분야의 당업자라면 쉽게 확인할 수 있다.
약물, 본원에서는 면역접합체 (이의 기능적인 반응을 발생시키는 능력, 즉 효능)의 투여 성공을 평가하기 위해, 투여에 대한 여러가지 "반응들"을 구분한다.
반응들은 대개 효능 혈액 파라미터를 측정함으로써 평가한다. 전형적인 효능 혈액 파라미터는 M-단백질 수준, FLC 수준 또는 특히, 대상 암에서, 면역접합체의 효능을 대상 질환과 연관시키는 그외 마커 (질환 특이 마커)이다. 효능은 소정의 치료가 유익한 변화를 발생시키는 능력을 의미한다.
MM 및 그외 형질세포 증식성 질환의 경우, 반응은 다음과 같이 구분한다:
용어 완전 반응 (CR)은 혈청과 뇨에서의 면역고정 (immunofixation) 음성과 골수내 임의의 연조직 형질세포종의 소멸 및 형질세포 <5%을 의미함;
용어 엄격한 완전 반응 (sCR)은 전술한 CR + 면역조직화학 또는 면역형광에 의한 골수내 클론 세포의 부재를 의미함;
용어 매우 양호한 부분 반응 (VGPR)은 면역고정에서는 혈청과 뇨에서 M-성분이 검출되지만 전기영동에서는 검출되지 않거나, 또는 혈청 M-성분의 > 90% 감소 + 뇨내 M-성분/24시간 <100 mg을 의미함;
용어 부분 반응 (PR)은 혈청 M 단백질 ≥ 50% 감소 및 24시간 뇨 M 단백질의 ≥ 90% 또는 24시간 당 < 200 mg 감소를 의미하며, 만일 혈청 및 뇨 M 단백질을 측정할 수 없다면, M 단백질 기준 대신 FLC 수치가 포함된 경우와 미포함 경우들 간의 차이 ≥ 50% 감소가 요구되며, 만일 혈청과 뇨에서 M 단백질을 측정할 수 없고 혈청내 유리형 경쇄 분석 또한 불가능하다면, M 단백질 대신, 골수 형질세포의 ≥ 50% 감소가 요구되며, 단, 베이스라인 %는 ≥ 30%이며, 상기한 기준 외에도, 베이스라인으로 존재하는 경우, 연조직 형질세포종의 크기 ≥ 50% 감소 요건도 요구된다 (Durie et al., 2006).
용어 마이너 반응(MR)은 본 발명에서 재발성/난치성 골수종 환자와 관련하여, 혈청 M 단백질의 ≥ 25% - < 49% 감소와 200 mg/24h을 초과하는 24h 뇨 M 단백질의 50-89% 감소를 의미하며, 상기한 범위 외에도, 베이스라인으로 존재한다면, 연조직 형질세포종의 크기 25-49% 감소도 요구되며, 용해성 골 병변의 크기 또는 수의 증가가 없어야 한다 (압박 골절 발생은 반응에 고려되지 않는다).
그러나, 공식적으로 분류되진 않지만, 반응에는 혈청내 FLC 수준의 30% 이상, 바람직하게는 40% 이상 또는 50% 이상 감소가 포함된다. 이는 특히 M-단백질을 측정할 수 없는 경우에 유의하다.
용어 안정적인 질환 상태 (SD)는, 본 발명의 형질세포 증식성 질환 측면에서, CR, VGPR, PR 또는 진행성 질환에 대한 기준에 해당되지 않는 것을 지칭하며, 용어 진행성 질환 (PD)은 아래 사항들 중 임의의 한가지 이상에서의, 최소 반응치로부터 25% 증가를 의미한다:
- 혈청내 M-성분 (절대 증가는 ≥ 0.5g/100 ml이어야 함) 및/또는
- 뇨내 M-성분 (절대 증가는 24시간 당 ≥ 200 mg이어야 함) 및/또는
- 혈청과 뇨에서 M-단백질 수준을 측정할 수 없는 환자에 한함: FLC 수준 포함 및 미포함 경우 간의 차이 (절대 증가는 > 100 mg/l이어야 함)
- 골수내 형질세포 비율 (절대 %는 ≥ 10%이어야 함)
- 새로운 골 병변 또는 연조직 형질세포종의 한정된 발생 또는 기존 골 병변이나 연조직 형질세포종 크기의 한정된 증가
- 오직 형질세포 증식성 장애가 원인일 수 있는 고칼슘혈증 발생 (혈청내 칼슘 보정치 > 11.5 mg/100 ml).
용어 재발성 골수종은 한번 이상의 이전 치료 요법을 시술받았지만, 재발성/난치성 골수종의 기준에는 충족되지 않는, 개체의 활성형 MM 형태를 지칭한다.
용어 난치성 골수종은 일반적으로 형질세포의 수가 심지어 치료를 받고 있음에도 불구하고 계속 증가하며, 즉 평가시 투여받은 치료 요법에 적합하지 않은 것으로 입증된, 질환 상태를 의미한다.
용어 재발성/난치성 골수종은 본원에서 구조 요법 중이거나 또는 최근 요법 후 60일 이내에 진행 중인, 질환의 재발을 의미한다.
용어 난치성 표현형은 모든 타입의 난치성 골수종, 즉 난치성 및 재발성/난치성 골수종을 포함한다.
용어 재발성 또는 난치성 골수종은 재발성, 난치성 및 재발성/난치성 골수종을 망라한다.
종양 또는 CD138 타겟 세포는, 예를 들어, 종양이 요법/치료없이도 요법/치료 시의 속도와 동일한 속도로 CD138 타겟 세포가 계속 분열하거나 및/또는 종양이 계속 증식하는 경우, 요법/치료제에 난치성이라고 한다.
종양 증식 지연은 치료 없이도 일정한 종양 증식이 상대적으로 지연된 종양 증식을 지칭한다.
종양 정체는 종양 크기가 더 이상 증가하지 않는 상태를 지칭한다.
관해는 종양의 완전 제거 및 재증식 소멸 (완전 관해) 등의 종양의 크기 감소 (부분 관해)를 지칭한다.
호르몬 요법은 호르몬을 이용한 치료법을 포함한다. 암 호르몬 요법은 타겟 세포와 싸우기 위해 사용된다. 호르몬 요법은, 예를 들어, 유방암 또는 전립선 암의 경우에 사용되며, 에스트로겐 및 프로게스테론, 또는 이들의 유도체의 투여를 포함한다.
화학요법은 항증식성 약물, 예컨대 탁산 또는 표준화된 치료 용법으로 이들 약물들의 조합물을 이용하여 암성 세포를 치료하는 것이다.
유지 요법은 이전 치료 이후에 수행되며, 상기 일차 치료를 종료하였을 때 달성되는 상태를 유지하는 것이 목표인, 요법이다. 예를 들어, 이전 치료로 부분 반응이 형성된다면, 유지 요법은 부분 반응을 유지하도록 설계된다.
하기에서 보다 상세하게 논의되는 임상 실험에서는, 개체에게, 실험을 착수하기 전에는 실패했던, 한가지 이상의 면역조절제 및 프로테오좀 저해제 요법으로 치료하였다. 개체가 이전 요법에서 진행성 질환 (PD)으로 진행되었다면, 질병은 치료 난치성으로 간주하였다.
용어 "으로의 진행", 예컨대 SMM 환자와 관련하여 "활성형 MM"으로의 진행은, 본 발명에서, MM에서 진행성 질환에 대한 IMWG (국제 골수종 연구 그룹) 기준을 토대로 한 진행의 증거 및 근원적인 클론 형질세포 증식성 장애와 관련있는 다음과 같은 한가지 이상의 특징: 새로운 연조직 형질세포종 또는 골 병변의 발생, 고칼슘혈증 (>11 mg/100 ml), 헤모글로빈 감소 ≥ 2g/100 ml, 및 혈청 크레아티닌 수치 ≥ 2 mg/100 ml (Kyle & Rajkumar, 2009)을 의미한다.
무진행 생존은 치료 개시에서부터 어느 쪽이 먼저이더라도 질환 진행 또는 사멸 (사멸 요인과 무관함)까지의 기간이다. 시간 언급없이 "무진행 생존"을 언급하는 경우, 3달 이상의 무진행이 내포된다.
다발성 골수종의 병인은 세포-표면 접착 분자를 통한 골수종 세포의 골수 기질 세포 (BMSC) 뿐만 아니라 세포외 기질 (ECM)과의 결합을 수반한다. 이러한 결합은 촉발하며, 즉 궁극적으로 다발성 골수종 세포의 증식, 약물 내성 및 골수 환경으로의 MM 세포의 이동에 원인이 될 수 있다 (Munshi et al. 2008). 특히, 신데칸-1 (CD138)을 통해 골수종 세포가 ECM에, I형 콜라겐에 접착하게 되면, 매트릭스 메탈로프로테나제 1의 발현이 유발되며, 따라서 골 흡수와 종양 침습이 촉진된다 (Hideshima et al. 2007). 다발성 골수종 세포와 골수 미세환경 간의 상호작용으로 다면발현성 (pleiotropic) 증식 및 항-세포자살 케스케이드의 활성화가 이루어진다.
다발성 골수종 환자와, 또한 골 통증과 관련있는 다른 질환을 앓고 있는 환자의 경우, 이러한 질환과 그외 증상들을 치료하기 위한 다수의 보조적인 치료제들이 있다. 적절한 약제로는, 비스포스포네이트 (예, 파미드로네이트, 졸레드론산)가 있는데, 이는 골 손상을 늦출 수 있다. 이들 제제들은 골용해성 골 병변을 감소시키고 골절을 예방할 수 있는 것으로 확인되었다 (Ludwig et al., 2007). 이는 골절과 유사한 골 합병증 위험성을 줄이고 비정상적으로 높은 혈중 칼슘 수치 (고칼슘혈증)를 떨어뜨리기 위해, 대부분 정맥을 통해 제공된다. 데이타에 따르면, 비스포스포네이트는 MM과 관련된 골 통증을 완화시키는 것으로 시사되었다. 또한, 환자는 뼈가 약하거나 골절되는 경우 수술을 받을 수도 있다.
일 구현예에서, 면역접합체는 골 괴사 등의 골 합병증 및/또는 골 통증을 감소, 특히 허용가능한 수준으로 감소시킨다. 허용가능한 수준으로의 감소는 특히 이러한 통증을 경감시키고 상기 골 합병증 감소가 목적인, 약제의 투여를 정지시킬 수 있는 능력을 수반한다. 파미드로네이트, 졸리드론산 및 클로드로네이트 등의 비스포스포네이트는 일반적으로 MM 환자에서의 골 괴사 등의 골 합병증을 완화시켜, 상기 합병증과 관련있는 골 통증을 완화시키기 위해 투여된다. 통상적인 비스포스포네이트로는, 경구 투여의 경우, FOSOMAX, BONIVA, ACTONEL, DIDRONEL 및 SKELID가 있으며, 정맥내 투여의 경우 BONEFOS, AREDIA 및 ZOMETA가 있다.
골수 기질 구획으로 다발성 골수종 세포가 회귀한 후, 다발성 골수종 세포와 BMSC 간의 접착은 인터루킨-6 (IL-6) 및 인슐린 유사 성장 인자 1 (IGF-1)과 같은 혈관신생과 종양 증식을 촉진시키는 작용을 가지고 있는, 다수의 사이토카인들을 상향 조절되게 한다 (Hideshima et al. 2007). 이들 사이토카인에 의해 개시되는 시그널링 케스케이드는 궁극적으로 기존 치료제에 내성인 MM 세포에서 이루어진다 (Anderson et al. 2000; Hideshima et al. 2006).
정상적인 인간 조혈 구획내에서, CD138 발현은 형질세포에 국한되며 (Wijdenes, 1996; Chilosi, 1999), CD138은 말초 혈액 림프구, 단핵구, 과립구 및 적혈구 상에서는 발현되지 않는다. 특히, CD34+ 줄기 세포 및 선조 세포는 CD138을 발현하지 않으며, 항-CD138 mAb는 조혈 줄기 세포 배양시 콜로니 형성 단위의 수에 영향을 주지 않는다 (Wijdenes, 1996). 비-조혈 구획에서는, CD138은 주로 폐, 간, 피부, 신장 및 장내 단순하고 층화된 상피 상에서 발현된다. 내피 세포 상에서는 약한 염색으로만 확인되었다 (Bernfield, 1992; Vooijs, 1996). CD138은 인간 림프종 세포에서 다형성 형태로도 존재하는 것으로 보고되었다 (Gattei, 1999). 위장관, 피부 및 눈의 CD138 상피 조직들은 독성을 발생시키는 본 발명의 면역접합체에 의해 타겟팅되는 경향이 가장 높은 비-타겟 조직이다.
단일클론 항체들인 B-B4, BC/B-B4, B-B2, DL-101, 1D4, MI15, 1.BB.210, 2Q1484, 5F7, 104-9, 281-2, 특히 B-B4는 CD138에 특이적인 것으로 보고되었다. 이들 중에서, CD138의 무손상 분자와 코어 단백질 둘다에 의해 인지되는, B-B4, 1D4 및 MI15는, 동일하거나 또는 매우 관련성이 높은 에피토프 중 하나를 인지하는 것으로 확인되었다 (Gattei, 1999). 이전의 연구들에서, B-B4는 가용성 CD138이 아닌 막 결합된 형태의 CD138만 인지하는 것으로 보고되었다 (Wijdenes, 2002).
최초의 항-CD138 항체는 Diaclone SAS (Besancon, France) 사에서 표준 하이브리도마 기법을 이용하여 인간 다발성 골수종 세포주 U266을 이용한 면역화에 의해, 뮤라인 모 Mab B-B4로서 제작되었다 (Clement,1995; Wijdenes, 1996). B-B4는 인간 신데칸-1 (CD138) 상의 코어 단백질의 잔기 90-93 사이의 선형 에피토프에 결합한다 (Wijdenes, 1996; Dore, 1998). B-B4는, CD138의 발현 패턴과 일치되게, 형질세포주 RPMI8226과 강하게 반응하지만, 내피 세포와는 반응하지 않는 것으로 확인되었다. 또한, CD138의 발현 패턴과 일치되게, B-B4는 상피 세포주 A431 (각질세포로부터 유래) 및 HepG2 (간세포 유래)와도 반응한다. 면역독소 B-B4-사포린은 또한 형질세포주 RPMI8226에 대해 강한 독성을 나타내며, 실제 유리형 사포린 보다 독성이 훨씬 더 강하다. 그러나, B-B4-사포린은 집락형성 분석법 (clonogenic assay)에서 A431 세포의 생장을 저해하는 효과가 없는 것으로 나타났지만, 테스트한 2종의 상피 세포주에서, B-B4-사포린은 세포주 A431에만 독성을 나타내었다 (Vooijs, 1996). 다른 연구자들도 종양에 대한 MM-관련 항원의 특이성 결여에 대해 보고한 바 있다 (Couturier, 1999).
메이탄시노이드 DM1에 공유 결합된 B-B4는 다발성 골수종 세포주 및 세포들에 대해 선택적인 세포독성과, 인간 다발성 골수종 이종이식 모델로서 SCID 마우스에서 항암 활성을 나타내었다 (Tassone, 2004).
본 발명에서는, 암 세포 뿐만 아니라 고형 종양의 일부를 형성하거나 형성하지 않을 수 있는 전-암성 세포를 포괄하는 것으로 용어 종양 세포를 사용한다.
본 발명에 따른 고형 종양은 낭 또는 액체 영역을 통상적으로 포함하지 않는 비정상적인 조직 덩어리이다. 본 발명에 따른 고형 종양은 CD138을 발현하는 타겟 종양 세포를 포함하며, 따라서 악성 고형 종양이다. 분화된 타입의 고형 종양은 이를 형성하는 세포 타입에 따라 명명된다. 고형 종양의 예는 육종, 암종 및 림프종이다. 조혈 악성은 일반적으로 고형 종양을 형성하지 않는다. 유방암 및 전립선암은 악성 고형 종양의 2가지 예이다.
본 발명에 따른 타겟팅 물질은 타겟 세포에 의해 발현되는 분자와 조합할 수 있으며, 펩타이드 및 비-펩타이드를 포함한다. 특히, 본 발명에 따른 타겟팅 물질은 타겟팅 항체 및 비-면역글로불린 단백질을 기본으로 할 수 있는 비-면역글로불린 타겟 분자를 포함하며, 그 예로는, AFFILIN® 분자, ANTICALINS® 및 AFFIBODIES®가 있으나, 이들로 한정되지 않는다. 비-면역글로불린 타겟팅 분자는 또한 타겟팅 DNA 및 RNA 올리고뉴클레오티드 (앱타머)와 같은 비-펩타이드성 타겟팅 분자, 또한 생리학적 리간드, 특히 대상 항원의 리간드, 예컨대 CD138을 포함한다.
본 발명에 따른 타겟팅 항체는 천연 항체이거나 천연 항체를 기초로 하거나, 또는 합성에 의해 또는 유전자 조작에 의해 제조되며, 대상 세포 또는 세포들 (타겟 세포(들)) 상의 항원에 결합한다. 본 발명에 따른 타겟팅 항체로는, 단일클론 항체, 다클론 항체, 다중특이 항체 (예, 2 특이성 항체) 또는 항체 단편을 포함한다. 상기 타겟팅 항체는, 예컨대 타겟 세포에 대한 이의 친화성을 개선시키거나 (Ross, 2003) 또는 이의 면역원성이 줄어들도록 조작할 수 있다. 타겟팅 항체는 작동자 분자 등의 리포좀 제형에 부착될 수 있다 (Carter, 2001). 항체 단편은 무손상 항체의 일부분, 바람직하게는 무손상 항체의 항원 결합부 또는 가변성 영역을 포함한다. 본 발명에 따른 항체 단편의 예로는, Fab, Fab', F(ab')2, 및 Fv 단편이 있으며, 또한, 다이아바디 (diabody); 도메인 항체 (dAb) (Ward, 1989; 미국 특허 6,005,079); 선형 항체; 단쇄 항체 분자; 및 항체 단편들로부터 형성된 다중특이 항체가 있다. 단쇄 가변 단편 항체 (scFv)에서, 중쇄 및 경쇄 (VH 및 VL)는, 예컨대 2개의 도메인이 기능성 항원 결합 포켓을 조합하는데 충분한 유연성을 지닌 서열 (글리신4세린)n의, 짧은 아미노산 링커에 의해 연결될 수 있다. 다양한 신호 서열의 부가는 타겟팅 항체의 더욱 정확한 타겟팅을 가능하게 할 수 있다. 경쇄 불변 영역 (CL)의 부가는 이황화 결합을 통한 이량화를 가능하게 하여, 안정성 및 항원항체 결합력 (avidity)을 증가시킬 수 있다. scFv를 구축함에 있어서의 가변 영역은, 타겟 대상에 대한 mAb를 이용할 수 있다면, 모 하이브리도마로부터 추출한 mRNA로부터 가변 영역을 클로닝하는 RT-PCR에 의해 수득할 수 있다. 또는, scFv는 파지 디스플레이 기법에 의해 새롭게 제조할 수 있다 (Smith, 2001). 본원에서, 용어 "기능적 단편"은 타겟팅 항체에 대해 사용되는 경우, 언급한 항체에 의해 특이적으로 결합되는 항원에 특이적으로 결합할 수 있는 타겟팅 항체의 일부분을 의미한다. 본 발명에 따른 2중 특이 항체는, 예컨대 타겟 조직에 대해 반응성인 하나 이상의 팔 (arm)과 링커 모이어티에 반응하는 팔을 가질 수 있다 (미국 특허 공개번호 20020006379). 또한, 본 발명에 따른 2중 특이 항체는 타겟 세포 상에서 2개 이상의 항원에 결합할 수 있다 (Carter, 2001). 본 발명에 따른 항체는, 예컨대 티올 기를 도입하기 위해 시스테인 잔기를 도입함으로써 변형시킬 수 있다 (Olafsen, 2004).
본 발명에서, 타겟팅 항체는 임의의 소스로부터 유래될 수 있으며, 낙타 항체, 뮤라인 항체, 인간/마우스 키메라 항체 또는 인간/원숭이 키메라 항체, 특히 nBT062와 같은 인간/마우스 키메라 항체일 수 있으나, 이들로 한정되는 것은 아니다.
인간화 항체는 인간-항체와 비-인간 항체로부터 유래된 서열을 포함하는 항체이며, 또한 이는 본 발명의 범위에 포함된다. 항체를 인간화하는 적합한 방법으로는 CDR-그래프팅 (상보성 결정 영역 그래프팅)(EP 0 239 400; WO 91/09967; 미국 특허 5,530,101; 및 5,585,089), 베니어링 (veneering) 또는 재표면화 (resurfacing)(EP 0 592 106; EP 0 519 596; Padlan, 199; Studnicka et al., 1994; Roguska et al., 1994), 체인 셔플링 (chain shuffling)(미국 특허 5,565,332) 및 DeImmunosationTM(Biovation, LTD)이 있다. CDR-그래프팅에서, 예컨대 mAb B-B4로부터 마우스 상보성 결정 영역(CDR)을 인간 가변 프래임워크에 그래프팅한 다음, 인간 불변 영역과 연결하여, 인간 B-B4 항체 (hB-B4)를 제조한다. CDR-그래프팅에 의해 인간화된 몇가지 항체들이 현재 임상적으로 사용되고 있으며, 그 예로는 MYLOTARG (Sievers et al., 2001) 및 HECEPTIN (Pegram et al, 1998)이 있다.
재표면화 기법은 분자 모델링, 통계적 분석 및 돌연변이 유발을 조합 사용하여, 타겟 숙주의 공지 항체들의 표면과 비슷하도록 항체 가변 영역의 비-CDR 표면을 변형시킨다. 항체 재표면화 전략 및 방법들과, 그외 여러가지 숙주내에서의 항체 면역원성을 낮추기 위한 방법들이, 예컨대 미국 특허 5,639,641에 기술되어 있다. 인간 항체는, 파지 디스플레이 방법 등의 당해 기술 분야에 공지된 다양한 방법들로 제조할 수 있다. 또한, 미국 특허 4,444,887, 4,716,111, 5,545,806, 및 5,814,318; 국제 특허 출원 공개번호 WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735, 및 WO 91/10741을 참조한다.
인간/마우스 키메라 항체 또는 인간/원숭이 키메라 항체, 인간화 항체 또는 예컨대 타겟 세포에 대해 친화성을 개선시키거나 또는 면역원성을 낮추도록 조작된 항체, 또한 항체 단편, 특히, 임의의 비-자연적 변형을 겪은 타겟팅 항체의 기능적 단편, 다이아바디; 도메인 항체; 선형 항체; 단쇄 항체 분자; 및 다중 특이 항체와 같이 임의의 비-자연적인 변형을 거친 타겟팅 항체는, 본원에서 조작된 타겟팅 항체로 언급된다.
키메라 항체는 기본이 되는 비-인간 항체, 예컨대 뮤라인 항체의 항체 결합 영역 (ABR 또는 Fab 영역)을 유지하지만, 임의의 불변 영역은 예컨대 인간 항체에 의해 제공될 수 있다. 통상적으로, 항체의 키메라화 및/또는 불변 영역의 교체는, 항원 결합에 기여하는 항체의 영역이 이러한 교체에 의해 영향을 받지 않기 때문에, 항체의 친화성에 영향이 없을 것이다. 본 발명의 바람직한 구현예에서, 본 발명의 조작된, 특히 키메라화된 항체는 기본이 되는 해당 비-인간 항체 보다 결합 친화성 (KD 값으로 표시됨)이 더 높을 것이다. 특히, nBT062 항체 및 이를 기반으로 한 항체들은 뮤라인 B-B4 보다 항체 친화성이 더 높을 수 있다.
본 발명의 다른 바람직한 구현예에서, 이러한 조작된/키메라 항체를 포함하는 면역접합체는 또한 항체 결합성이 더 높다. 또한, 이들 면역접합체는 임의의 구현예에서, B-B4를 함유하는 대응체 보다 더 높은 종양 크기 감소율 등의 다른 유리한 특징들을 나타낼 수 있다. 바람직한 구현예에서, 조작된, 특히 키메라 타겟팅 항체는 해리 상수 KD (nM)가 1.6 이하, 1.5 이하, 또는 1.4 이하인 결합 친화성을 나타내지만, 이의 뮤라인 대응체의 해리 상수 KD (nM)는 약 1.6 이상이다. 타겟팅 항체와 같은 타겟팅 물질을 포함하는 면역접합체는 해리 상수 KD (nM)가 2.6 이하, 2.5 이하, 2.4 이하, 2.3 이하, 2.2 이하, 2.1 이하, 2.0 이하일 수 있으며, 약 1.9 이하가 바람직하지만, 뮤라인 대응체 항체를 포함하는 면역접합체의 해리 상수 KD (nM)는 약 2.6 이상 (표 12, 재료 및 방법)일 수 있다.
기본 항체 분자는, 가변 영역이 항원에 결합하고, 나머지 불변 영역이 항원 독립적인 반응을 도출할 수 있는, 2중 기능성의 구조체이다. 항체의 주 클래스 IgA, IgD, IgE, IgG 및 IgM은 불변 영역에 의해 결정된다. 이러한 클래스는 서브클래스(이소타입)로 추가로 분류될 수 있다. 예컨대, IgG 클래스에는 불변 영역에 의해 결정되는 4가지 이소타입, 즉 IgG1, IgG2, IgG3 및 IgG4가 있다. 다양한 인간 항체 클래스들 중에서, 오직 인간 IgG1, IgG2, IgG3 및 IgM만 보체 시스템을 효율적으로 활성화시키는 것으로 알려져 있다. 불변 영역은 항원 결합 부위를 형성하진 않지만, 불변 영역과 힌지 영역의 배열이 항원과의 결합을 가능하게 하는 분절 유연성을 분자에게 부여할 수 있다.
여러가지 IgG 이소타입들이 단핵구, B 세포 및 NK 세포와 같은 세포 상에서 Fc 수용체에 결합하며, 그로 인해 세포가 사이토카인을 분비하도록 활성화시킬 수 있다. 또한, 여러가지 이소타입들은 보체를 활성화하여, 국소 또는 전신 염증 반응을 유도할 수 있다. 특히, 여러가지 IgG 이소타입들이 다양한 수준으로 FcγR에 결합할 수 있다. FcγR은 Ig 슈퍼패밀리에 속하는 표면 당단백질의 일종으로, 주로 백혈구에서 발현된다. FcγR 당단백질은 FcγRI (CD64), FcγRII (CD32) 및 FcγRIII (CD16)로 지칭되는 3가지 클래스로 분류된다. IgG1, IgG2 및 IgG3는 다양한 이들 FcγR 당단백질 클래스에 강하게 결합하고, IgG4는 훨씬 약하게 결합한다. 특히, IgG4는 FcγRI의 중간 결합자로서, ADCC (항체 의존적인 세포성 세포독성)를 상대적으로 낮게 유발하거나 또는 심지어 전혀 유발하지 않으며, FcγRIIIA 또는 FcγRIIA에 결합하지 않는다. 또한, IgG4는 저해 수용체인 FcγRIIB의 약한 결합자이다. 또한, IgG4는 오직 보체 고정 (complement fixation)을 약하게 매개하거나 매개하지 않으며, 보체 의존적인 세포독성 (CDC)을 약하게 매개하거나 매개하지 않는다. 본 발명에서, IgG4는 LSEC (liver sinusoidal endothelial cell) 상에서 FcRγII와의 상호작용을 나타내지 않고, Kupffer 세포 (대식 세포) 상에서 FcRγI-III와 상호작용하지 않거나 약하며, 간의 NK 세포 상에서 FcRγIII와 상호작용하지 않기 때문에, IgG4를 간 FcR의 Fc-매개 타겟화를 방지하기 위해 특히 사용할 수 있다. 임의의 CDC를 더욱 감소시키는 특정 돌연변이도 본 발명의 일부분이다. 예컨대, IgG4의 327, 330 및 331 위치의 잔기들은 ADCC (항체 의존적인 세포성 세포독성) 및 CDC (Amour, 1999; Shields, 2001)를 감소시키는 것으로 확인되었다. 항체를 안정화하는 많은 돌연변이들도 본 발명의 일부분이다 (또한, 본원에서는 "안정화 돌연변이"라 함). 이러한 돌연변이로는, 특히, IgG4의 CH2 영역내 루신에서 글루탐산으로의 돌연변이와 IgG4 힌지 코어내에서의 세린에서 프롤린으로의 치환 돌연변이가 있다. 이러한 돌연변이는, 본 발명의 특정 구현예에서, 분자의 2/1 (the amount of half-molecule)을 10% 이하, 5% 이하, 바람직하게는 2% 이하 또는 1% 이하으로 낮춘다. 또한, 이렇게 안정화된 항체의 생체내 반감기는 1, 2, 3, 4 또는 5일 이상 등으로 수일 길어질 것이다 (Schuurman, 1999).
본 발명에서 IgG4 이소형 특징들을 부여하는 조작된 타겟팅 항체를 포함하는 면역접합체를 언급하는 경우, 상기 조작된 타겟팅 항체는 IgG1 이소형의 항체들의 친화성에 비해 Fc 수용체 발현 세포에 대해 상당히 감소된 친화성을 나타냄을 의미한다. 이러한 특징들은 바람직하게는 ABR과는 구분되는, 추가적인 항체 영역에 의해 부여되며, 상기 추가적인 항체 영역은 인간 항체의 전부 또는 일부분이다. 그 결과로 IgG1 이소타입 항체를 이용한 경우에 통상적으로 관찰되는 CDC 또는 ADCC를 유도하는 잠재력과 비교하여, CDC 또는 ADCC를 유도하는 잠재력이, 상당히 감소 (IgG1 이소타입 카운터파트에 비해 90% 이상)되거나 또는 완전히 결여된다. 이러한 특성은 조작된 타겟팅 항체를 이의 비접합된 형태로 이용함으로써 세포 기반의 분석에서 측정할 수 있다. CDC 및 ADCC는 Cancer Immunol. Immunother., 36, 373 (1993)에 기술된 방법 또는 구아바 세포 독성 분석 등의 여러가지 방법들을 통해 측정할 수 있다. IgG4 이소형 특성을 부여하는 조작된 타겟팅 항체의 적어도 일부를 포함하는 면역접합체의 전체적인 이점은, 결합 특이성 개선과 독성 감소이다. 또한, Fc 수용체에 대한 친화성 감소로 인해, 종양 세포의 항원-특이적인 타겟화가 개선되고 그에 따라 CD138 음성 세포에 대한 독성 감소가 이루어진다.
본원에 기술된 타겟팅 항체 등의 타겟팅 물질은 또한, 항원, 특히 CD138에 대한 이의 결합 친화성 측면에서 기술되거나 명시될 수 있다. 타겟팅 항체와 같은 타겟팅 물질의 바람직한 결합 친화성은, 해리 상수 KD (nM) 1.6 이하, 1.5 이하 또는 1.4 이하로 특정된다. 타겟팅 항체 등의 타겟팅 물질을 포함하는 면역접합체의 경우, 해리 상수 KD (nM)는 1.6 이하, 1.5 이하 또는 2.5 이하, 2.4 이하, 2.3 이하, 2.2 이하, 2.1 이하, 2.0 이하, 또는 약 1.9 이하인 것이 바람직하다.
본 발명에 따른 항원 결합 영역 (ABR)은 사용되는 타겟팅 항체 또는 조작된 타겟팅 항체의 타입에 따라 바뀔 것이다. 천연 항체 및 대부분의 키메라 항체와 인간화 항체의 경우, 항원 결합 영역은 경쇄와, 중쇄의 첫번째 2개의 도메인으로 구성된다. 그러나, 경쇄가 없는 중쇄 항체의 경우, 항원 결합 영역은, 예컨대 중쇄의 첫번째 2개의 도메인으로만 이루어질 수 것이며, 단일 폴리펩타이드 체인에서 항체 분자의 경쇄 및 중쇄 가변 도메인이 조합된, 단쇄 항체(ScFv)의 경우에는, ABR은 단지 하나의 폴리펩타이드 분자에 의해 제공된다. FAB 단편은 일반적으로 파파인 절단에 의해 수득되며, 하나의 경쇄와 중쇄의 일부를 가지고 있으므로, 하나의 항원 조합부만 있는 ABR을 포함한다. 한편, 다이아바디는 2개의 항원-결합 영역이 있는 소형 항체 단편이다. 그러나, 본 발명에서, 타겟팅 항체 또는 조작된 타겟팅 항체의 항원 결합 영역은 타겟팅 항체 또는 조작된 타겟팅 항체의 결합 특이성을 주로 결정하는 임의 영역이다.
ABR 또는 다른 타겟팅 항체 영역이, "임의 항체의" 예컨대 인간 또는 비-인간 항체의 것으로 칭해지는 경우, 이는 본원에서, ABR이 대응되는 천연 ABR과 동일하거나 또는 그것을 기초로 함을 의미한다. 천연 ARB의 결합 특이성을 가지고 있다면, ABR은 천연 ABR을 기초로 하는 것이다. 그러나, 이러한 ARB는, 예컨대 점 돌연변이, 부가, 결손 또는 번역 후 수정, 예컨대 당화를 포함할 수도 있다. 이러한 ABR은 특히 천연 ABR의 서열과 70% 이상, 80% 이상, 90% 이상, 바람직하게는 95% 이상, 98% 이상 또는 99% 이상의 서열 동일성을 가질 수 있다.
nBT062 (도 1 참조)는 마우스 인간 키메라 IgG4 mAb, 즉 B-B4의 키메라 버전이다. 이 B-B4의 키메라 버전은 HAMA (인간 항-마우스 항체) 반응을 감소시키고, CD138에 대한 B-B4의 항체 결합 영역의 기능성을 유지하도록 제조되었다. 놀랍게도, 조작된 타겟팅 항체를 포함하는 면역접합체를 이용하여 수득한 결과들은 훨씬 더 균일하였다 (결과의 편차가 줄어듬). nBT062의 제조 프로토콜은 하기에 명시되어 있다. nBT062를 발현하는 중국 햄스터 난소 세포는 2007년 12월 11일에 D-38124 브라운슈바이크 마셰로데르 베그에 소재한 DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH에 기탁하였다. 이의 식별 번호는 DSM ACC2875이다. B-B4를 기반으로 한 CD138 특이적인 키메라 항체는 본원에서 통상 c-B-B4로 칭한다.
중쇄 및 경쇄 둘다의 아미노산 서열을 nBT062에 대한 뉴클레오티드 서열의 번역물로부터 예측하였다. 중쇄 및 경쇄로 예측되는 아미노산 서열은 표 4에 나타낸다. 예상 가변 영역은 굵은 글씨체로 나타내고, CDR 예상 부분은 밑줄 표시한다.
표 4. nBT062의 예상되는 아미노산 서열
| - nBT062 중쇄 예상 서열 (서열번호1): 1 QVQLQQSGSE LMMPGASVKI SCKATGYTFS NYWIE WVKQR PGHGLEWIGE 51 ILPGTGRTIY NEKFKGKA TF TADISSNTVQ MQLSSLTSED SAVYYCAR RD 101 YYGNFYYAMD Y WGQGTSVTV SSASTKGPSV FPLAPCSRST SESTAALGCL 151 VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSSLGT 201 KTYTCNVDHK PSNTKVDKRV ESKYGPPCPS CPAPEFLGGP SVFLFPPKPK 251 DTLMISRTPE VTCVVVDVSQ EDPEVQFNWY VDGVEVHNAK TKPREEQFNS 301 TYRVVSVLTV LHQDWLNGKE YKCKVSNKGL PSSIEKTISK AKGQPREPQV 351 YTLPPSQEEM TKNQVSLTCL VKGFYPSDIA VEWESNGQPE NNYKTTPPVL 401 DSDGSFFLYS RLTVDKSRWQ EGNVFSCSVM HEALHNHYTQKSLSLSLG(K) C-말단의 라이신은 클립핑(clipping)되는 경향이 있으며, 다소 불완전한 클립핑으로 인해 어느 정도는 존재할 수 있다. 괄호내 (K)는 서열번호 1의 일부분이 아니다. - nBT062 경쇄 예상 서열(서열번호 2): 1 DIQMTQSTSS LSASLGDRVT ISC SASQGIN NYLN WYQQKP DGTVELLIY Y 51 TSTLQS GVPS RFSGSGSGTD YSLTISNLEP EDIGTYYC QQ YSKLPRT FGG 101 GTKLEIKRTV AAPSVFIFPP SDEQLKSGTA SVVCLLNNFY PREAKVQWKV 151 DNALQSGNSQ ESVTEQDSKD STYSLSSTLT LSKADYEKHK VYACEVTHQG 201 LSSPVTKSFN RGEC |
표 5. Kabat 및 Chothia의 일반적인 CDR 정의와 BT062의 예상되는 CDR의 비교
| Kabat CDR 정의 nBT062 경쇄 CDR1: 잔기 24-34 CDR1: 잔기 24-34 CDR2: 잔기 50-56 CDR2: 잔기 50-56 CDR3: 잔기 89-97 CDR3: 잔기 89-97 중쇄 CDR1: 잔기 31-35 CDR1: 잔기 31-35 CDR2: 잔기 50-56 CDR2: 잔기 51-68 CDR3: 잔기 95-102 CDR3: 잔기 99-111 Chotia CDR 정의 nBT062 경쇄 CDR1: 잔기 26-32 CDR1: 잔기 24-34 CDR2: 잔기 50-52 CDR2: 잔기 50-56 CDR3: 잔기 91-96 CDR3: 잔기 89-97 중쇄 CDR1: 잔기 26-32 CDR1: 잔기 31-35 CDR2: 잔기 52-56 CDR2: 잔기 51-68 CDR3: 잔기 96-101 CDR3: 잔기 99-111 |
완전한 인간 항체 (fully human antibody)도 사용할 수 있다. 이러한 항체는 파지 디스플레이 방법에 의해 선별할 수 있는데, 이때 CD138 또는 이의 항원 결정기를 이용하여 예컨대 B-B4 가변 영역을 발현하는 파지에 선택적으로 결합시킨다 (Krebs, 2001). 이러한 방법은 유익하게는 친화성 성숙 기법과 함께 사용하여, 항체의 친화성을 향상시킨다. 본원에 언급된 모든 항체는 분리된 항체이다 (미국 특허 공개번호 20090175863 참조).
일 구현예에서, 타겟팅 항체는 비-접합된 형태일 경우, 중등도 또는 불량 수준으로 내재화된다. 중등도의 내재화는 37℃에서 3시간 인큐베이션한 후, 항체 약 30% 내지 약 75%가 내재화된 것이고, 불량한 내재화는 항체의 약 0.01% 내지 최대 약 30%가 내재화된 것이다. 다른 바람직한 구현예에서, 타겟팅 항체, 예컨대 항체들 B-B4, BC/B-B4, B-B2, DL-101, 1D4, MI15, 1.BB.210, 2Q1484, 5F7, 104-9, 281-2, 특히 B-B4는 CD138에 결합한다. SP02/0 골수종 세포를 Balb/c 마우스 비장 세포와 교잡하여 제조한, 하이브리도마 세포를 2007년 12월 11일에 D-38124 브라운슈바이크 마셰로데르 베그에 소재한 DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH에 기탁하였다. 이러한 B-B4 발현 하이브리도마 세포의 식별 번호는 DSM ACC2874이다. 다른 구현예에서, 타겟팅 항체는 실질적으로 비-세포-표면 발현성 CD138에는 결합하지 않는다. 본 발명에서, 특정 항체의 명칭이 "nBT062 타겟팅 항체"와 같이 용어 "타겟팅 항체"와 조합되어 있으면, 이 타겟팅 항체가 항체 nBT062의 결합 특이성을 가지고 있음을 의미한다. 만일 타겟팅 항체가 명시한 항체에 "기본이 되는" 것으로 지칭되어 있다면, 이 타겟팅 항체는 상기 항체의 결합 특이성을 가지며, 타겟팅 항체에 대한 전술한 내용에 부합되는 어떠한 형태도 취할 수 있음을 의미한다. 본 발명의 내용에서, 특정 항원의 명칭이 "CD138 타겟팅 항체"와 같이 용어 "타겟팅 항체"와 조합되어 있다면, 이 타겟팅 항체가 CD138에 대한 결합 특이성이 있다는 것을 의미한다. 본 발명의 내용에서, 예컨대 타겟팅 항체를 "세포-표면에 발현된 CD138을 선택적으로 타겟팅하는"과 같이 무언가를 "선택적으로" 하거나, 또는 무언가에 대해 "선택적인" 것으로 언급되어 있다면, 이는, 제시된 예의 경우에서, 세포-표면에 발현된 CD138에 대해 임의의 다른 세포-표면에 발현된 항원에 비해 유의한 선택성 (즉 CD138-음성 세포에 비해 CD138-양성 세포에 대해 더 강한 친화성)이 있음을 의미한다. 해당 조건에서의 부작용은 이의 선택성으로 인해 실질적으로 줄어들거나 방지될 수 있다.
"비-면역글로불린 타겟팅 물질"은 본 발명에서 비-면역글로불린 단백질로부터 유래된 타겟 분자 뿐만 아니라 비-펩타이드성 타겟 분자를 포함한다. 이러한 정의에 포함되는 소형 비-면역글로불린 단백질은, 특히 표면에서 발현되는 CD138에 대해 특이적인 친화성을 가지도록 제작된다. 이러한 소형 비-면역글로불린 단백질은 10 kDa - 20 kDa과 같이 비교적 저분자량인, AFFILIN 분자 등의 스캐폴드 기반의 조작된 분자를 포함한다. 적합한 스캐폴드로는, 예컨대 감마 결정을 포함한다. 이들 분자는, 천연 상태에서는, 타겟 분자에 대한 특이적인 결합 활성이 없다. 용매 노출된 아미노산의 국소적으로 국한된 랜덤화를 통한 단백질 표면의 조작에 의해, 완전히 새로운 결합 부위가 만들어진다. 전자의 비-결합성 단백질은 이로써 특이적인 결합 단백질로 변형된다. 이러한 분자는 CD138과 같은 타겟에 결합하도록 특이적으로 제작할 수 있으며, 하나 이상의 작동자 분자의 특이적인 전달을 가능하게 할 수 있다 (scil Proteins GmbH at www.scilproteins.com, 2004). 비-면역글로불린 타겟 분자의 다른 종류는 리포칼린으로부터 유래되며, 그 예로, 구조적으로 면역글로불린과 다소 비슷한 ANTICALINS가 있다. 그러나, 리포칼린은 160 - 180개의 아미노산 잔기를 가진 폴리펩타이드 단쇄로 구성된다. 리포칼린의 결합 포켓은 대상 분자를 고친화적이고 고특이적으로 인지하도록, 형태가 바뀔 수 있다(예, Beste et al., 1999). 상표 Affibody®(Affibody AB)로 시판되는 것과 같은 인공 박테리아 수용체도 본 발명의 범위에 포함된다. 이러한 인공 박테리아 수용체 분자는 작고 단순한 단백질이며, 단백질 A (스타필로코커스 아우레우스)의 IgG-결합 도메인들 중 하나의 스캐폴드를 기반으로 한 3중-나선 번들로 구성될 수 있다. 이들 분자들은 다수의 면역글로불린과 비슷한 결합 특성을 가지고 있지만, 실질적으로 더 작고, 분자량은 대게 10 kDa을 넘지 않으며, 또한, 비교적 안정적이다. 적합한 인공 박테리아 수용체 분자는, 예컨대 미국 특허 5,831,012; 6,534,628 및 6,740,734에 기술되어 있다.
다른 "비-면역글로불린 타겟 분자"는 대상 항원의 생리학적 리간드이다. CD138의 생리학적 리간드로는, 예컨대 ADAMTS4 (어그레카나제-1), 항트롬빈-3, bFGF, 카텝신 G, CCL5 (RANTES), CCL7, CCL11, CCL17, CD44, 콜라겐 (1형 콜라겐, 2형 콜라겐, 3형 콜라겐, 4형 콜라겐, 5형 콜라겐, 6형 콜라겐), CXCL1, 엘라스타제, gp120 , HGF [간세포 성장 인자], 라미닌-1, 라미닌-2, 라미닌-5, 미드카인 (midkine), MMP-7, 호중구 엘라스타제 (neutrophil elastase) 및 플레이오트로핀 (pleiotrophin)(HBNF, HBGF-8)이 있으나, 이들로 한정되는 것은 아니다. 비-펩타이드성 타겟 분자로는, CD-138에 결합하는 DNA 및 RNA 올리고뉴클레오티드(앱타머)가 있으나, 이들로 한정되는 것은 아니다.
"작동자 분자"는 본 발명에서 타겟팅 물질, 특히 타겟팅 항체 및/또는 조작된 타겟팅 항체에 부착되며, 바람직한 효과, 예컨대 세포자살 또는 다른 타입의 세포 사멸 또는 타겟 세포나 세포들의 연속적인 세포 주기 정지를 나타내는, 분자 또는 이의 유사체 또는 유도체이다. 본 발명에 따른 작동자 분자는 타겟 세포에서 원하는 효과를 발휘할 수 있는 분자를 포함하며, 저분자량의 세포독성 약물 (1500 Da 이하의 분자량, 바람직하게는 1400 이하, 1200 이하, 1000 이하, 800 이하, 700 이하, 600 이하, 500 이하, 300 이하이나, 일반적으로 120 Da 이상인 분자량) 등의 세포독성 약물을 비제한적인 예로서 포함한다. 이들 세포독성 약물은, 본원에서, 통상적으로 비-단백질성 생물학적 세포독성 약물이며, 투여시, 적어도 5개의 C 원자, 10개의 C 원자, 바람직하게는 12개의 C 원자 이상, 대게 20개의 C 원자 이상, 때로는 30, 40 또는 50개의 C 원자 이상, 통상적으로 벤젠 고리와 같이, 대게 치환된, 고리 구조 하나 이상인, 다른 세포독성 약물을 포함하거나 생산을 유도한다. 그러나, 대게 서로 연결된 고리 구조들도 이들 분자의 일부이다. 이들 비-단백질성 생물학적 세포독성 약물은 DNA (DNA 인터칼레이터)에 인터칼레이션하거나, DNA를 알킬화하거나, 마이크로튜불 형성을 저해하거나, 세포 분열 저해제이거나, 히스톤 데아세틸레이트와 같이 DNA 구조 보전성에 관여하는 효소의 저해제이거나, 또는 세포에 치명적이며 세포 대사를 교란시킬 수 있는 효소의 저해제일 수 있다. 또한, 작동자는 방사핵종, 생물 반응 변형제, 구멍-형성제, 리보뉴클레아제, 세포자살-유발 활성의 세포자살 시그널링 케스케이드의 단백질, 안티센스 올리고뉴클레오티드, 항-전이제, 항산화 물질, 항체 또는 사이토카인 뿐만 아니라 그것의 기능적 유도체 또는 유사체/단편으로 분류할 수 있다.
바람직한 구현예에서, 작동자 분자는, 특히 면역접합체의 타겟팅 항체의 기본이 되는 항체의 천연 형태가 내재화가 불량할 경우에, 면역접합체의 내부 작동자 전달성을 높인다. 다른 바람직한 구현예에서, 작동자는 천연 형태 (native form)에서는 비-선택적이다. 특정 구현예에서, 작동자는 천연 형태로 있을 때 전신 독성 등의 높은 비-선택적인 독성을 가진다. 본 발명의 작동자 분자의 "천연 형태"는 타겟팅 물질에 부착되어 면역접합체를 형성하기 이전의 작동자 분자이다. 다른 바람직한 구현예에서, 작동자 분자의 비-선택적인 독성은 타겟팅 물질에 접합시 실질적으로 없어진다. 다른 바람직한 구현예에서, 작동자 분자는 타겟 세포에 도달하였을 때 타겟 세포에 사멸 또는 계속적인 세포 주기 정지 등의 세포 주기 정지를 야기한다.
본 발명에 따른 작동자 분자는, 아래에서 기술된 항신생물제, 특히 세포내 화학요법제를 포함하나, 이로 한정되는 것은 아니다.
| 작동자 | 분자량 (g/mol [Da] |
| 독소루비신 | 564 |
| 다누루비신 | 528 |
| 빈블라스틴 | 811 |
| 도세탁셀 | 808 |
| 파클리탁셀 | 854 |
| 에포틸론 B | 508 |
| 보리노스타트 | 264 |
| 네오카르지노스타틴 | 660 |
| 칼리케아미신 γ1 | 1368 |
| 에스페라미신 | 1342 |
| 메토트렉세이트 | 454 |
| 실리마린 성분들 | 482 |
| 마소프로콜 | 302 |
| 아미노레불린산 | 132 |
| 밀테포신 | 407 |
| 에피갈로카테킨 갈레이트 (EGCG) | 459 |
| 프소랄렌 | 186 |
| 멜팔란 | 304 |
표 6. 작동자 분자로서 제공될 수 있는 저분자량의 세포독성 약물의 예
저분자량의 세포독성 약물 (상기 분자량 참조)은 바람직하게는 세포분열 저해제, 보다 구체적으로는, 메이탄시노이드, 돌라스타틴 (및 아우리스타틴과 같은 유도체) 및 크리토피신과 같이 튜불린 중합 저해제 등의 튜불린 작용제 및 강력한 탁소이드 (탁산) 약물일 수 있다 (Payne, 2003). 작고 우수한 세포독성 약물에 대한 정의에는, 에포틸론 (예, 이사베필론) 및 콜히친 유도체 (튜불린 간섭제는 아래에서 추가로 논의됨)와 같이 기타 튜불린 간섭제도 포함된다.
메이탄시노이드인 작동자 분자는, 임의 기원의 메이탄시노이드를 포함하며, 비제한적인 예로서 합성 메이탄시놀 및 메이탄시놀 유사체 및 유도체를 포함한다.
메이탄신은 에티오피아의 관목 마이테누스 세라타로부터 최초로 유래된 천연 산물이다 (Remillard, 1975; 미국 특허 3,896,111). 이 약물은 튜불린 중합을 저해하여, 세포 유사 분열 차단 및 세포 사멸을 야기한다 (Remillard, 1975; Bhattacharyya, 1977; Kupchan, 1978). 메이탄신의 세포독성은 빈카 알카로이드 또는 탁솔과 같이 튜불린 중합에 작용하는 임상 사용중인 항암제 보다 200-1000배 높다. 그러나, 메이탄신에 대한 임상 연구에서, 이의 높은 전신 독성으로 인해 적정 약물 농도 (therapeutic window)가 없는 것으로 나타났다. 메이탄신 및 메이탄시노이드는 세포독성이 높지만, 이의 암 요법에서의 임상적인 사용은 대게 종양에 대한 불량한 선택성으로 인한 심각한 전신 부작용으로 매우 제한되고 있다. 메이탄신을 이용한 임상 연구에서, 중추 신경계와 위장계에 심각한 부작용이 있는 것으로 나타났다.
또한, 메이탄시노이드는 트레비아 누디플로라 (Trewia nudiflora)의 종자 조직 등의 다른 식물들에서도 분리되었다 (미국 특허 4,418,064).
또한, 특정 미생물도 메이탄시놀 및 C-3 메이탄시놀 에스테르 등의 메이탄시노이드를 생산한다 (미국 특허 4,151,042).
본 발명은, 예컨대 미국 특허 4,137,230; 4,248,870; 4,256,746; 4,260,608; 4,265,814; 4,294,757; 4,307,016; 4,308,268; 4,308,269; 4,309,428; 4,313,946; 4,315,929; 4,317,821; 4,322,348; 4,331,598; 4,361,650; 4,362,663; 4,364,866; 4,371,533; 4,424,219 및 4,151,042에 개시된, 합성 메이탄시놀 및 메이탄시놀 유사체 등의, 임의 기원의 메이탄시노이드와 관련있다.
바람직한 구현예에서, 메이탄시노이드는 티올-함유성 메이탄시노이드이고, 더 바람직하게는 Chari 등 또는 Chari 등(Chari, 1992)의 미국 특허 6,333,410에 기술된 방법에 따라 제조된다.
DM-1 (N2-데아세틸-N2-(3-머캅토-1-옥소프로필)-메이탄신)은 본 발명에서 바람직한 작동자 분자이다. DM1은 메이탄신 보다 세포 독성이 3 내지 10배 높으며, 이황화 결합(들)을 통해 종양-관련 항원에 대한 단일클론 항체에 연결하여 프로드럭으로 변환한 것이다. 이러한 접합체들 (때로는 "종양 활성화된 프로드럭" (TAP)) 중 일부는 타겟 세포와 조합되어 내재화되면 활성화되어 약물로부터 분리되기 때문에, 혈액 성분에 세포 독성을 나타내지 않는다 (Blattler, 2001). 수종의 항체-DM1 접합체들이 개발되었으며 (Payne, 2003), 임상 실험을 거쳤다. 예컨대, 결장직장암 환자에서는 huC242-DM1 치료가 충분히 허용되었지만, 어떠한 검출가능한 면역 반응을 유도하지 못하였으며, 순환 기간이 길었다 (Tolcher, 2003).
그외 특히 바람직한 메이탄시노이드는 입체 방해하는 티올 결합을 함유하는 측쇄를 포함하며, 그 예로는 "DM3"으로도 불리우는 메이탄시노이드 N2'-데아세틸-N2'-(4-머캅토-1-옥소페닐)메이탄신, 및 "DM4"으로 불리우는 N2'-데아세틸-N2'-(4-메틸-4-머캅토-1-옥소펜틸)메이탄신이 있으나, 이들로 한정되는 것은 아니다. DM4의 합성은 도 3과 도 4에 나타나 있으며, 명세서 도처에 기술되어 있다. DM4는 이의 αC에 메틸기를 가지고 있다는 점에서 DM1 및 DM3와 상이하다. 그 결과, DM4가 링커, 특히 비제한적인 예로서 이황화 결합을 포함하는 링커를 통해 nBT062와 같은 타겟팅 물질에 부착되었을 때, 입체 방해를 형성한다. 입체적으로 방해가 되는 티올기를 가지고 있는 매우 다양한 메이탄시노이드들 (1 또는 2개의 치환기, 특히 알킬 치환기, 예컨대 DM4의 메틸 치환기를 소유)이 2004년 11월 25일자로 공개된 미국 특허 공개번호 2004/0235840에 개시되었으며, 이 특허는 원용에 의해 그 전체가 본 명세서에 포함된다. DM3 및 DM4의 황 원자에 인접한 탄소 상의 메틸기와 같이 알킬기에 의해 생기는 입체 방해는 면역접합체의 세포내 전달율에 영향을 미칠 수 있다. 가변성 알킬 유닛은 따라서 시험관내 및 생체내에서 유효성, 효능 및 안전성/독성에 영향을 미칠 수 있다.
Goldmahker 등의 미국 특허 공개번호 2006/0233814에 보고된 바에 따르면, 약물이 그것의 타겟에서 분리되면, 상기한 입체 방해가 유리형 약물의 알킬화 (예, 메틸화)를 유도한다. 알킬화는 약물의 안정성을 증가시켜, 이른바 방관자 효과 (bystander effect)를 허용할 수 있다. 그러나, 당해 기술 분야의 당업자에게 명확한 바와 같이, 링커를 통해 타겟팅 물질에 작동자가 부착되었을 때 입체 방해를 형성하는 위치에, 알킬기와 같은 치환기를 포함하는 다른 작동자 분자들도 본 발명의 일부이다 (미국 특허 공개 2004/0235840). 바람직하게는, 이러한 방해는 유리형 약물의 알킬화와 같은 화학적 변형을 유도하여 전체 안전성을 증가시킴으로써, 약물이 CD138 발현 종양 세포에 대해 세포 사멸 또는 계속적인 세포 주기 정지를 유도할 수 있게 할 뿐만 아니라, 선택적으로 예컨대 종양을 지탱 또는 보호하는 부속 세포, 특히 통상적으로 CD138을 발현하지 않는 종양 기질의 세포 및 종양 혈관계의 세포가 약물로부터 영향을 받아 이의 지지 기능 또는 보호 기능을 소실 또는 유실되게 할 수 있다.
메이탄신은 국립 암 학회 (NCI) IND #11,857 (1975년 9월 19일에 FDA로부터 승인받음)로부터 지원을 받아 I기 및 II기 임상 실험을 통해 평가되었다. 완전 반응과 부분 반응 둘다가 조혈 악성 종양 환자에서 나타났으며, 광 범위한 고형 종양 환자들에서는 부분 반응이 나타났다 (Blum and Kahlert., 1978, Issell and Crooke, 1978, Chabner et al., 1978, Eagan et al., 1978, Cabanillas et al., 1978). 그러나, 구역질, 구토, 설사, 간 기능검사 결과 상승, 권태감 및 말초 신경병증 등의 유의한 독성들이 기록되었다 (Maytansine IND #11,857, Annual Report, February, 1984; Blum and Kahlert., 1978, Issell and Crooke, 1978, Chabner et al., 1978). 독성 효과로 인해 추가적인 개발은 이루어지지 못하였다.
다른 구현예에서, 작동자 분자는 탁산일 수 있다. 탁산은 튜불린 간섭제의 일종이다 (Payne 2003). 탁산은 튜불린의 탈중합을 저해하여 마이크로튜불의 조합 및 세포 사멸 속도를 높이는, 유사 분열 방추체 독소이다. 본 발명의 범위에 포함되는 탁산은, 예컨대 미국 특허 6,436,931; 6,340,701; 6,706,708 및 미국 특허 공개번호 20040087649; 20040024049 및 20030004210에 기술되어 있다. 다른 탁산류들도, 예컨대 미국 특허 6,002,023, 미국 특허 5,998,656, 미국 특허 5,892,063, 미국 특허 5,763,477, 미국 특허 5,705,508, 미국 특허 5,703,247 및 미국 특허 5,367,086에 기술되어 있다. 본 발명의 바람직한 구현예는 티올 기 또는 다이설파이드 기를 포함하는 고효능의 탁산일 수 있다. 당해 기술 분야의 당업자에게 자명한 바와 같이, 미국 특허 6,596,757에 기술된 페길화된 (PEGylated) 탁산도 본 발명의 범위에 포함된다.
본 발명은, 추가로, DNA에 작용하는 작동자 분자, 보다 구체적으로는, 안트라사이클린 및 유도체 (다우노루비신, 발루비신, 독소루비신, 아클라루비신, 에피루비신, 이다루비신, 암루비신, 피라루비신, 조루비신) 및 안트라세네디온, 예컨대 스트렙토마이세스 유래 물질 (액티노마이신, 미토마이신, 블레오마이신, 액티노마이신) 또는 암사크린 등의, 인터칼레이팅 물질을 포함한다.
작동자 분자는 보다 구체적으로 DNA 알킬화제일 수도 있고, 보다 구체적으로 나이트로겐 머스타드 및 유사체 (예, 사이클로포스파미드, 멜팔란, 데스트라무스틴), 알킬설포네이트, 니트로소유레아, 아지리딘, 하이드라진, 에틸렌 이민 및 그외 트레니몬 및 미토브로니톨 (만니톨 유사체)과 같은 다른 물질일 수도 있다. 특히, 바람직한 DNA 알킬화제는 CC-1065 유사체 또는 유도체 (미국 특허 5,475,092; 5,585,499; 6,716,821) 및 두오카르마이신이다.
CC-1065는 스트렙토마이세스 젤렌시스 (Streptomyces zelensis)의 배양물로부터 분리된 강력한 항종양-항생제로서, 시험관내에서 예외적으로 세포독성인 것으로 확인되었다 (미국 특허 4,169,888). 미국 특허 5,475,092, 5,585,499 및 5,739,350에 기술된, 예컨대 CC-1065 유사체 또는 유도체는, 본 발명의 범위에 포함된다. 당해 기술 분야의 당업자에게 자명한 바와 같이, 미국 특허 5,846,545에 따른 변형된 CC-1065 유사체 또는 유도체, 예컨대 미국 특허 6,756,397에 기술된 CC-1065 유사체 또는 유도체의 프로드럭도 본 발명의 범위에 포함된다. 본 발명의 특정 구현예에서, CC-1065 유사체 또는 유도체는 예컨대 미국 특허 6,534,660에 기술된 바와 같이 합성할 수 있다.
백금 기반의 물질과 같이, 그외 DNA 알킬화 작동자 분자들 (예, 카보플라틴, 네다플라틴, 옥살리플라틴, 트리플라틴, 사트라플라틴)도 추가로 포함된다.
DNA에 작용하는 작동자 분자들 중에서도, 토포이소머라제 I 및 II 저해제, 예컨대 캄프토테카 유래 물질 (벨로테칸, 토포테칸) 및 포도필로톡신 및 유도체 (에토포시드, 테니포시드)도 포함된다.
DNA에 작용하는 작동자 분자의 다른 서브클래스로는, 엽산 유사체 (메토트렉세이트, 디하이드로폴레이트 리덕타제 저해제로 알려져 있음) 또는 아미노프테린과 같은 항대사제가 있다. 또한, 퓨린 또는 피리미딘 대사를 방해하는 대사제, 특히 아데노신 데아미나제 저해제 (펜토스타틴) 또는 할로겐화된/리보뉴클레오티드 리덕타제 저해제 (클라드리빈, 클로파라빈), 티오퓨린 및 티아조푸린도 포함된다. 추가적인 항대사제로, DNA 중합효소 저해제 (시트라빈), 리보뉴클레오티드 리덕타제 저해제 (겜시타빈) 및 하이포메틸화제 (아자시티딘, 데시타빈) 및 리보뉴클레오티드 리덕타제 저해제가 있다. 또한, 시스플라틴과 같이 DNA 가교제도 일반적으로 포함된다.
본 발명에 따른 작동자 분자는, 예컨대 감마 1I, N-아세틸 칼리케아미신 및 칼리케아미신의 그외 유도체를 포함하는 칼리케아마이신 등의 엔다이인 (enediyne) 을 비롯하여, DNA 변형 또는 손상시키는 작동자 분자로서 정의되는, 항종양 항생제일 수 있다. 칼리케아미신은 서열-특이적인 방식으로 DNA의 마이너 그로브에 결합하며, 재정렬 과정을 거쳐 이중 가닥 DNA의 파괴를 유도하는 자유 라디칼을 노출시킴으로써, 세포 자살 및 세포 사멸을 발생시킨다. 본 발명에 사용될 수 있는 칼리케아미신 작동자 분자의 예는 미국 특허 5,053,394에 기술되어 있다. 이 화합물은 겜투주맵 오조가마이신 및 이노투주맵 오조가마이신으로 공개된 단일클론 항체와의 면역접합체 형태로 사용된다.
엔다이인의 서브그룹은 색소단백질 (chromoprotein)인 에스퍼아미신 (esperamycin) 및 네오카르지노스타틴 (neocarzinostatin)으로 구성된다. 특히, 또한 DNA 손상제로서 분류되는, 트라벡테딘 (Trabectedin)은, 항-종양 항생제로 칭해진다. 트라벡테딘은 DNA 벡본 절단을 야기하며, 멍게류 (sea squirt)로부터 분리할 수 있으며 (또한, 엑테인아시딘 743 또는 ET-743으로 알려져 있음), ZELITA와 JOHNSON & JOHNSON에서 상품명 YONDELIS로 시판하고 있다.
바람직한 작동자 분자의 다른 그룹은, 비제한적인 예로서, 세포 대사에 작용하는 독소 등의 물질이다. 특히, 효소 저해제, 예컨대, 비제한적인 예로서, 올라프립 (olaprib) 또는 보다 바람직한 프로테오좀 (예, 보르테조밉) 및 단백질 키나제 저해제, 또는 마소프로콜과 같은 리폭시게나제 저해제도 본 발명의 일부분이다. 또한, 비제한적인 예로서, 엔도텔린 A 수용체 길항제 (예, 아트라센탄)와 같은 수용체 길항제, 또는 에스트론 대사를 방해하는, 테스토락톤과 같은 성 스테로이드도 포함된다. 식물 유래 폴리페놀과 같은 에스트로겐 수용체 상호작용제, 예컨대, 비제한적인 예로서, 이소플라보노이드, 스틸벤, 실리마린, 페닐프로파노이드 글리코시드도 추가로 포함된다.
또한, 광역학 치료 또는 방사선 치료에 사용되는 물질 등의, 세포 대사에 작용하는 물질도 작동자 분자로서 적합하며, 그 예로는, 비제한적인 예로서, 포르피린 유도체, 예컨대, 델타-아미노레불린산이 있다. 에파프록시랄 (Efaproxiral)은, 헤모글로빈-산소 친화성을 낮춤으로써 산소 수준을 높이는, 방사선 감응제 (radiosensitizer)이다. 추가로, 레티노이드 (1세대, 2세대 및 3세대), 특히 트레티노인도 포함되며, 이들 모두 트랜스 레티노익산 (ATRA)이며, 상품명 VESANOID으로 ROCHE가 이러한 처방용으로 판매하고 있는, 급성 전골수구성 백혈병(APML) 치료에 사용되고 있다. 레티노이드는, 예컨대 종양 억제자 유전자의 활성화와 같이 다양한 기능을 발휘하는, 비타민 A과 화학적으로 비슷한 일군의 화합물이다. 현재, 피부암과 염증성 피부 장애의 치료에 사용된다.
다른 바람직한 구현예에서, 작동자 분자는 비제한적인 예로서, 칼슘 시그널링 등의 시그널링 경로에 영향을 미칠 것이다. 그 예로는 비소 삼산화물 또는 트리메틸주석 클로라이드가 있으며, 트리메틸주석 클로라이드는 매우 독성이 높은 유기주석 화합물이다.
또한, 본 발명은, 예컨대 항-다약제 내성 활성 (P-당단백질 저해를 통한)을 포함할 수 있는, 약물 내성 기전에 작용하는, 작동자 분자를 포함한다. 이환식 헤테로방향족 화합물 및 유도체들이 비제한적인 예일 수 있다.
다른 작동자 분자 클래스는 물질, 또는 보다 구체적으로, 세포자살 시그널링 경로를 간섭하는 단백질을 포함할 수 있으며, 그 예로는, 안티센스 올리고뉴클레오티드, 보다 구체적으로, 올리고데옥시뉴클레오티드, 예컨대 만성 림프구성 백혈병, B-세포 림프종 및 유방암 등의 몇가지 타입의 암에 대한 가능한 치료제로서, 실제 연구된 안티센스 올리고데옥시리보뉴클레오티드인, 오블리머센 (INN, 상표 genasense; 또한 오그메로센 (augmerosen) 및 bcl-2 안티센스 올리고데옥시뉴클레오티드 G3139로 알려져 있음)가 있으나, 이로 한정되는 것은 아니다. 이러한 화합물은, Bcl-2의 생산 차단에 의해, 그리고 이를 화학요법에 보다 민감해지게 함으로써, 암 세포를 사멸시킬 수 있는 것으로, 제시되고 있다. 작동자 분자로서 제공될 수 있는, 추가적인 세포자살 유도성 물질 클래스는, 비제한적인 예로서, 세포 주기 조절자와 세포자살에 관여하는 단백질을 간섭할 수 있는, 실리마린 (silymarin)과 같은, 식물성 폴리페놀을 포함한다.
작동자 분자는, 세포자살-유도 활성을 가진 세포자살 신호전달 케스케이드의 단백질 등의 단백질, 예를 들어, Granzyme B, Granzyme A, 카스파제-3, 카스파제-7, 카스파제-8, 카스파제-9, 절단형 (truncated) Bid (tBid), Bax 및 Bak일 수도 있다.
그외 작동자 분자는, 비제한적인 예로서, 아스파라기나제 등의 효소 또는 항신생물성 활성을 가진 효소를 포함할 수 있다.
또한, 본 발명에 따른 약물-작동자 분자는 밀리테포신 (miltefosine) 등의 항-원생동물제일 수 있다.
다른 구현예에서, 작동자 분자는, 비제한적인 예로서, 프소랄렌 (psoralen) 및 이의 하이드록시 대사산물과 같은, 식물성 폴리페놀일 수 있다.
전술한 항종양 활성들 (예, 세포자살 유도, 세포 주기 정지) 또는 유리 라디칼 포착, 금속 킬레이팅 활성, 에스트로겐 수용체 간섭 활성, 항산화제, 약물 대사 효소 간섭과 같은 추가적인 활성을 가지고 있는, 플라보노이드, 탄닌 (프로안토시아니딘), 스틸베노이드, 쿠르쿠미노이드 및 리간드와 같은 식물성 폴리페놀 역시 가능성 있는 작동자 분자이다. 보다 구체적으로, 바람직한 작동자 분자는 항산화 및 세포보호 특성을 가진 금속 킬레이터로서 기능하여, DNA에 인터칼레이션할 수 있는, 프소랄렌과 이의 하이드록시 대사산물이다. 레세르바톨 (reservatol) 및 폴리하이드록시화된 유사체, 및 플라보노이드, 예컨대 카테킨 및 에피카테킨, 보다 구체적으로, 에피갈로카테킨 3-O 갈레이트가 특히 바람직하며, 이들은 항산화제로서 기능할 수 있다.
작동자 분자의 다른 구현예는 독소일 수 있다. 독소는 비제한적인 예로서 디프테리아 독소 또는 외독소 A와 같은 박테리아 독소, 비제한적인 예로서 리신과 같은 식물 독소, 그외 알칼로이드 및 폴리페놀, 미코톡신, 예컨대 알파 아마니틴 또는 보다 구체적으로 아마톡신 및 팔로톡신을 포함할 수 있다. 독소는 박테리아 기원의 독소 뿐만 아니라, 진균, 식물, 척추동물 및 무척추동물 기원의 것이며, 이들 모두 유전적으로 또는 화학적으로 변형될 수 있다. 아울러, 독소는 또한, 비제한적인 예로서 메틸머큐리 등의 환경 독소일 수도 있다. 또한, 독소는, 튜불린과의 상호작용이 입증된, 해양 군소 돌라벨라 아우리쿨라리아 (Dolabella auricularia)로부터 분리된 작은 펩타이드인 돌라스타틴 10 및 12일 수 있다.
또한, 이들의 기전에 따라 작동자 분자의 광의의 분류도 가능하다:
항신생물제 및 면역조절제(ATC code L01), 특히 "세포내 화학치료제"
ATC: 해부학적 치료 화학적 분류 시스템 (WHO)
1) 세포분열 저해제, 또는 마이크로튜불에 작용하는 분자(투불린 결합제), 예컨대 빈카 알카로이드 및 유사체(빈카 알카로이드(빈블라스틴, 빈크리스틴, 빈플루닌, 빈데신, 비노렐빈) 및 탁산(파클리탁셀, 라로탁셀, 도세탁셀), 돌라스타틴)(및 유도체, 예컨대 오리스타틴) 및 크리토피신, 메이탄신 및 콜히친 유도체, 에포틸론(예, 이사베필론)
2) DNA 복제에 작용하는 것
a) 인터칼레이팅 물질, 예를 들어, 안트라사이클린 (다우노루비신, 발루비신, 독소루비신, 아클라루비신, 에피루비신, 이다루비신, 암루비신, 피라루비신, 조루비신) 및 스트렙토마이신 유래 물질 등의 안트라센디온 (액티노마이신, 미토마이신, 블레오마이신, 닥티노마이신) 또는 암사크린
b) 알킬화제, 예를 들어, 니트로겐 머스타드, 니트로소유레아, 알킬설포네이트, 아지리딘, 히드라진 (프로카르바진), 트리아젠, 에폭사이드, 에틸렌 이민, 알트레타민, 미토브로니톨, 두오카르마이신 및 유사체/입체이성체, 트레니몬, 에스트라무스틴, CC-1065
c) 알킬화-유사 물질, 예를 들어, 플라티늄 (예, 카르보플라틴, 네다플라틴, 옥살리플라틴, 트리플라틴, 테트라니트레이트, 사트라플라틴)
d) 토포이소머라제 I 특이 저해제, 예컨대 캄프토테카 (벨로케탄, 토포테칸)
e) 토포이소머라제 II 특이 저해제, 예컨대 포도필로독신 및 유도체 (에토포시드, 테니포시드)
f) 간섭하여 DNA/RNA 합성에 작용하는 항대사제
- 엽산, 예컨대, 디하이드로폴레이트 리덕타제 저해제(예, 아미노프테린, 메토트렉세이트), 티미딜레이트 신타제 저해제
- 퓨린, 예컨대, 아데노신 데아미나제 저해제 (펜토스타틴), 할로겐화된/리보뉴클레오티드 리덕타제 저해제 (클라드리빈, 클로파라빈), 티오퓨린, 티아조푸린
- 피리미딘, 예컨대, DNA 중합효소 저해제 (시타라빈), 리보뉴클레오티드 리덕타제 저해제 (겜시타빈), 하이포메틸화제 (아자시티딘, 데시타빈)
- 데옥시리보뉴클레오티드, 예컨대 리보뉴클레오티드 리덕타제 저해제 하이드록시카바미드
g) 기타 DNA 가교제, 예컨대 플라티늄 기반의 화합물 (예, 시스플라틴)
3) 그외 DNA 간섭 물질, 예를 들어, "항종양/세포독성 항생제", 예컨대 엘사마이신 (Elsamicin) A, 다른 항생제, 예컨대 CC-1065, 및 항생제의 서브클래스, 예컨대 박테리아 유래 엔디인 칼리케아민 또는 색소단백질 엔디인 에스페라마이신 (고도의 독성의 DNA 스플라이싱제) 또는 네오카르지노스타틴 (항생제의 네오카르지노스타틴 그룹의 다른 구성원으로는 마크로모마이신, 액티노산틴, 케드라시딘 및 마두로펩틴이 있음) 또는 트라벡테딘(DNA 벡본 절단)
4) 세포 대사에 작용하는 독소, 예컨대, HSP90 저해제, 로니다미드 (Lonidamide) (호흡 및 당화 둘다의 저해로, 세포 ATP 감소가 유도됨)
a) 효소 저해제, 예를 들어, Olaprib (PARP 저해제), CDK 저해제 (Alvocidib), 프로테오좀 (Bortezomib), 단백질 키나제 저해제, 마소프로콜(Masoprocol) (리폭시에나제 (Lipoxyenase) 저해제)
b) 수용체 길항제, 예컨대 투틴 (tutin) (글리신 수용체 길항제 (식물 독소), 아트라센탄 (Atrasentan), 레티노이드 X 수용체 (벡사로텐 (Bexarotene)), 성 스테로이드, 예컨대 테스토락톤 (testolactone), 에스트로겐 수용체 간섭 물질
c) 광감응제 또는 광역학 요법용 그외 화합물 (포르퍼머 소듐 (Porfirmer Sodium)), 포르피린 유도체, 예컨대 δ-아미노레불린산)
d) 방사선 감응제, 예컨대, 헤모글로빈-산소 친화성을 낮춤으로써 산소 수준을 높이는 에파프록시랄
e) 시그널링, 예컨대 Ca2+ 시그널링 경로에 작용하는 물질, 예컨대 비소 삼산화물 및 트리메틸주석 클로라이드,
f) 대사를 간섭하는 그외 물질, 예컨대 레티노이드 및 유도체 트레티노인 (ATRA),
5) HDAC 저해제 등의, 후성유전성 프로세스에 작용하는 물질 (예, 피부 T-세포 림프종, 급성 골수성 백혈병, 호지킨 림프종 또는 여포성 림프종에 대해 현재 임상적인 개발 중인, 파노비노스타트 (Panobinostat), 보리노스타트 (Vorinostat), 발포르산 (Valporic acid), MGCD0103 (모세티노스타트 (Mocetinostat)),
6) 약물 내성 기전에 작용하는 물질, 예컨대 P-당단백질을 저해하는, 이환식 헤테로방향족 화합물,
7) 세포자살 시그널링/기전을 유발하는 물질, 단백질 및 안티센스 올리고데옥시뉴클레오티드, 예컨대 오블리머센 (Oblimerse)(상표 Genasense)
8) 효소, 예컨대 아스파라기나제
9) 항-원생동물제, 예컨대 밀테포신
10) 식물성 폴리페놀, 예컨대 전술한 항종양 활성들 (예, 세포자살 유도, 세포 주기 정지) 또는 유리 라디칼 포착, 금속 킬레이팅 활성, 에스트로겐 수용체 간섭 활성, 항산화제, 약물 대사 효소 간섭과 같은 추가적인 활성을 가지고 있는, 플라보노이드, 탄닌 (프로안토시아니딘), 스틸베노이드, 쿠르쿠미노이드 및 리그난. 보다 구체적으로, 프소랄렌 및 이의 하이드록시 대사산물, 레세르바톨 (reservatol) 및 폴리하이드록시화된 유도체, 플라보노이드, 예컨대 카테킨 및 에피카테킨, 특히 에피갈로카테킨 3-O 갈레이트
11) 그외 천연 물질 및 유도체, 예컨대 외독소 A, 디프테리아 독소 및 이의 유도체로서, 유도체는 화학적으로 또는 유전적으로 변형될 수 있음.
또한, 작동자 분자는, 물질이 속하는 클래스에 따라, 예컨대 유기 화합물, 방향족 화합물, 금속계 화합물, 세포 대사 관련 단백질, 효소, 펩타이드, 올리고뉴클레오티드, 예컨대 안티센스 뉴클레오티드, 박테리아 독소, 식물 유래 독소 및 폴리페놀, 예컨대 탄닌, 플라보노이드 및 쿠마린, 뿐만 아니라, 테르페노이드, 알카로이드, 항종양 항생제 (예, 엔다이인 항생제), 미코톡신, 무척추동물과 척추동물 유래 독소, 환경 독소로 분류할 수 있다.
본 발명에 따른 면역접합체는, 하나 이상의 타겟팅 물질, 특히 타겟팅 항체 및 하나의 작동자 분자를 포함한다. 상기 면역접합체는, 예컨대 안정화를 위한 추가 분자를 포함할 수도 있다. 면역접합체에서, 용어 "접합체"는 통상적으로 하나 이상의 작동자 분자와 타겟팅 물질의 작동가능한 조합을 나타내는 것이며, 어떤 타입의 작동가능한 조합만을 지칭하는 의도는 아니며, 특히 화학적 "접합"으로만 한정되지 않는다. 타겟팅 물질이 타겟 부위에 결합할 수 있고 부착된 작동자가 의도한 대로 충분히 기능할 수 있는 한, 특히 타겟 부위로 전달되는 한, 모든 부착 형태가 적합할 것이다. 본 발명에 따른 접합 방법으로는, 작동자 분자와 타겟팅 항체의, 작동자 분자 및/또는 타겟팅 항체의 사전 변형없이 또는 사전 변형을 포함한, 직접 부착, 또는 링커를 통한 부착이 있으나, 이들로 한정되는 것은 아니다. 링커는, 예컨대 산 취약성 (acid labile), 광분해성 링커, 효소 절단성 링커, 예컨대 펩티다제에 의해 절단할 수 있는 링커로 기능적으로 분류할 수 있다. 본 발명의 다수의 구현예에서, 절단성 링커가 바람직하다. 이러한 절단성 링커는, 세포 환경, 특히 절단시 해리되는 약물에 유해한 효과를 가지지 않는, 세포내 환경에 존재하는 조건 하에서 절단할 수 있다. 임의의 세포내 구역에서 존재하는 것과 같은, pH 4-5 등의 낮은 pH에서는, 산 취약성 링커가 절단될 것이며, 광분해성 링커는 예컨대 적외선으로 절단될 것이다. 그러나, 대부분의 세포에 존재하는 생리학적 조건에 의해/조건 하에 절단되는 링커가 바람직하며, 본원에서는 생리학적으로 절단가능한 링커로 지칭된다. 즉, 다이설파이드 링커가 본 발명의 다수의 구현예들에서 바람직하다. 이들 링커는 생리 조건 하에서 이루어질 수 있는 다이설파이드 교환을 통해 절단가능할 수 있다. 바람직한 이종 2중 기능의 다이설파이드 링커로는, N-숙신이미딜 3-(2-피리딜다이티오)프로피오네이트(SPDP) (예, Carlsson et al.(1978)), N-숙신이미딜 4-(2-피리딜다이티오)부타노에이트(SPDB) (예, 미국 특허 4,563,304), N-숙신이미딜 4-(2-피리딜다이티오)펜타노에이트(SPP) (예, CAS Registry number 341498-08-6), N-숙신이미딜 4-(N-말레이미도메틸)사이클로헥산-1-카르복실레이트(SMCC) (예, Yoshitake et al., (1979)), 및 N-숙신이미딜 4-메틸-4-[2-(5-니트로-피리딜)-다이티오]펜타노에이트(SMNP) (예, 미국 특허 4,563,304)가 있으나, 이들로 한정되는 것은 아니다. 본 발명의 조성물에 사용하기 가장 바람직한 링커 분자는 SPP, SMCC, 및 SPDB이다.
다른 적합한 링커로는, 비제한적으로, 화합물을 SH-함유성 화합물과 연결할 수 있는 이형의 2가지 기능성 링커인, 설포숙신이미딜 말레이미도메틸 사이클로헥산 카르복실레이트 (SMCC)와 같은 "절단불가능한" 결합을 포함할 수도 있다. 2중 기능성 및 이형의 2가지 기능성 링커 분자, 예컨대, 탄수화물-특이적인 이형의 2가지 기능성 링커 분자, 예컨대 S-(2-티오피리딜)-L-시스테인 하이드라지드 (TPCH) 역시 본 발명의 범위에 포함된다 (Vogel, 2004). 메이탄시노이드와 같은 작동자 분자는 2 단계 반응 프로세스를 통해 타겟팅 항체에 접합할 수 있다. 이는, 제1 단계로서, N-숙신이미딜 피리딜디티오프로피오네이트(SPDP)와 같은 가교 시약을 이용하여 타겟팅 항체에 디티오피리딜 기를 도입하여 타겟팅 항체를 변형하는 단계를 포함한다. 제2 단계에서는, 티올기를 가진 반응성 메이탄시노이드, 예컨대 DM1을 변형된 항체에 부가함으로써, 상기 변형된 항체에 티오피리딜기를 치환하고, 이황화-연결된 세포독성 메이탄시노이드/항체 접합체를 만든다 (미국 특허 5,208,020). 그러나, Chari의 미국 특허 공개번호 20030055226에 기술된 방법과 같은 한-단계 접합 방법도 본 발명의 범위에 포함된다. 본 발명의 일 구현예에서, 동일하거나 상이한 종류의 복수의 작동자 분자들을 타겟팅 항체에 부착시킨다. 본원의 도처에 기술된 바와 같이, 사용되는 링커의 특성은 방관자 사멸에 영향을 미칠 수 있다 (Kovtun et al., 2006). 또한, 면역접합체 제조 방법에 대해 미국 특허 5,208,030; 5,416,064; 6,333,410; 6,441,163; 6,716,821; 6,913,748; 7,276,497 및 미국 출원 2005/0169933을 참조한다.
미국 특허 6,716,821에 기술된 바와 같이, CC-1065 유사체 또는 유도체를, 예컨대 PEG 연결기를 통해 타겟팅 물질에 접합시킬 수 있다.
칼리케아미신 (calicheamicin)을 링커를 통해 (미국 특허 5,877,296 및 미국 특허 5,773,001) 또는 미국 특허 5,712,374 및 미국 특허 5,714,586에 기술된 접합 방법에 따라 타겟팅 항체에 접합시킬 수 있다. 미국 특허 공개번호 20040082764에 칼리케아미신 접합체를 제조하는 다른 바람직한 방법이 기술되어 있다. 본 발명의 면역접합체는 재조합 융합 단백질의 형태를 취할 수 있다.
링커가 이용되거나 또는 이용되지 않는 부착 형태로 작동가능한 조립 (operational association)을, 본원에서는 "기능적 부착 (functional attachment)"이라고 지칭한다.
면역접합체 BT062 1 밀리그램 (mg)은 DM4 분자를 약 3.5개 포함하므로 (DM4 1개는 분자량이 약 800 Da임), 면역접합체 1 mg은 DM4 2800 Da을 포함한다.
BT062의 분자량은 약 150000 Da이다. 따라서, 면역접합체 1 mg은 DM4 분자를 약 1/53 mg 포함한다. 즉, 항체 4 mg/ml은 DM4 분자 약 4/53, 즉 75 ㎍/ml에 해당한다. 면역접합체 160 mg/m2은 DM4 약 2.5 - 3.5, 특히 약 3 mg/m2에 해당한다.
본 발명에서, DM4를 2, 2.5, 3, 3.5 또는 심지어 4 mg/m2 보다 높은 수준으로 DLT 없이, 반복적인 다회 투약을 비롯하여, 반복적인 단회 투약 또는 다회 투약으로서 개체에게 투여할 수 있다.
특정 성분들로 필수적으로 구성된 면역접합체는, 본원에서, 항체/면역접합체가 명시된 성분과 항체의 기본적인 특성에 실질적인 영향을 미치지 않는 추가적인 물질 또는 성분들로 이루어져 있음을 의미한다.
본 발명의 면역접합체들 중 일부는 입체적으로 방해되는 작동자 분자를 가지며, 절단성 링커를 포함한다 (HICL - 방해형 면역접합체, 절단성 링커). CD138에 대한 조작된 타겟팅 항체를 절단가능한 링커 (CL)를 통해 작동자 분자에 부착된 형태로 포함하는 면역접합체의 방해받지 않는 카운터파트 (UI: 무-방해형 면역접합체)를, 본원에서는 UICL로 기재된다. UICL은, 조작된 타겟팅 항체를 포함하나 작동자 분자가 입체적으로 방해되지 않는 HICL와 등가의 면역접합체이다. 한쌍의 HICL/UICL의 예는 BT062 및 nBT062-SPP-DM1이다. 비절단성 링커를 포함하는 이러한 면역접합체의 무-방해형 카운터파트 (UINCL)는, 작동자 분자가 입체적으로 방해되지 않고 비-절단성 링커를 포함하는, 조작된 타겟팅 항체를 포함하는 등가의 면역접합체를 의미한다. BT062 (nBT062-SPDB-DM4)의 경우, nBT062-SMCC-DM1은 비-절단성 링커를 포함하는 상기한 비-방해형 카운터파트 (UNICL)의 일 예일 것이다.
면역접합체의 종양 증식의 저해 활성 (= 종양 증식 저해 활성)은 상대 평가이다. 이는, 활성 100%로 설정된 면역접합체의 최고 수행 활성에 대한 접합체의 상대적인 종양 증식 저해 활성을 나타낸다. 예컨대, 32일간의 종양 증식 지연 (TGD)을 야기하는, 접합체, 즉 BT062의 최고 수행 활성을 100%로 설정한다면, 예컨대, 18일의 종양 증식 지연 (TGD)을 나타내는 nBT062-DM1의 활성은 하기와 같이 계산한다:
종양 증식 저해 활성 = 100 x (TGDnBT062-DM1 / TGDBT062),
보다 일반적으로는:
종양 증식 저해 활성 = 100 x (TGD샘플 / TGD기준).
| TGD* (일) | 활성% ** | |
| PBS | 0 | 0 |
| nBT062-SMCC-DM1 | 18 | 56 |
| BT062 | 32 | 100 |
| nBT062-SPP-DM1 | 13 | 40 |
표 7: 치료군에 450 ㎍/kg을 투여한 SCID 마우스에서 MOLP-8 종양 이종이식에 대한 nBT062-DMx의 종양 증식 지연 (TGD) 및 활성 %.
(*) 치료군에서 미리 정한 크기 (160 mm3)가 되는데 걸리는 평균 시간에서 대조군에서 미리 정한 크기가 되는데 걸리는 평균 시간을 뺀, 종양 증식 지연 일수 (TGD).
(**) 종양 증식 저해 활성 = 100 x (TGD샘플 / TGDBT062). BT062의 활성은 100%로 정해짐.
표 7에 제시된 예에서, BT062는, 무-방해형 카운터파트 (nBT062-SPP-DM1)의 활성 보다 60% 높은 종양 증식 저해 활성과, 비절단성 링커를 포함하는 무-방해형 카운터파트 면역접합체 (nBT062-SMCC-DM1)의 활성 보다 44% 높은 종양 증식 저해 활성을 제공한다.
전술한 바와 같이, 메이탄시노이드와 같은 특정 약물은, 효과적이지만 독성이 높아, 이의 천연적인, 즉 비-접합된 형태에서는 세포를 비-선택적으로 파괴한다. 항체에 세포독성 메이탄시노이드를 연결시킴으로써, 타겟 세포에 도달할 때까지, 약물을 비활성 상태로 유지시킬 수 있다 (Lambert 2005). 몇가지 메이탄시노이드 접합체들이 임상 개발 중에 있다.
CD56-양성의 고형 종양 (소세포 폐암 및 신경분비성 암) 치료에 대해, IMGN901 (huN901-DM1, BB-10901)을 이용한 I상 및 II상 연구들이 수행되었다. 이러한 연구들에서, IMGN901을 6주 마다 연속 4주간 투여하였는데, 일반적으로 충분히 허용적이었다 (Fossella et al., 2005, Lorigan et al., 2006, McCann et al., 2007, Carter and Senter, 2008, Johnson et al. 2008). 면역접합체의 항체 부분, huN901은 현저한 CDC 또는 ADCC 활성을 나타낸다. CD56-양성의 다발성 골수종의 치료에 대해 동일한 면역접합체를 조사하였다. I상에서, 3주 마다 연속 2주간 IMGN901을, 확립된 다발성 골수종 치료에서 실패한, CD56-양성의 다발성 골수종 환자에게 투여하였는데, 임상적인 활성 뿐만 아니라 안전성에 대한 예비 조사 결과가 확인되었다. 18명의 환자들에게 IMGN901 (환자 3명에게, 각각 40, 60, 75, 90, 112, 및 140 mg/m2/week)을 투여한 것으로 기록되었다. 예비 약동학 (PK) 결과는, 투약과 관찰되는 최고 혈청 농도가 대략적인 선형적인 관계인 것으로 보고되었다. 흥미로운 임상적인 활성이 허용가능한 안전성 프로파일과 함께 관찰되었다. 확인된 마이너 반응 (MR)은, 유럽 골수 이식 기준 하에, 3명의 사전에 과다 처리한 환자 (환자 1명 당 60, 90, 및 112 mg/m2/week)들에서 확인되었다. 항구적인 안정적인 질병 상태는 투여량 60, 90, 112 및 140 mg/m2/week에서 확인되었다 (Chanan-Khan et al., 2007, Chanan-Khan et al., 2008). 실험의 확장 단계로, 추가적인 조사를 위해, IMGN901은 75 mg/m2/week의 용량으로 향후 진행될 것이다. 고 용량에서는, 다발성 골수종의 표준 치료 용법인 레날리도마이드 및 덱사메타손과 조합 치료시 말초 신경병증이 보고되었다.
거세-내성 전립선 암 치료에 대해 MLN2704 (huJ591-DM1)가 평가되었다 (Milowsky et al., 2006, Brand and Tolcher 2006). MLN2704의 I상 실험으로, 진행성의 전이성 거세-내성 전립선암 환자를 대상으로, 4주 마다 한번 투여하였을 때, MLN2704의 안전성 프로파일, 약동학성, 면역원성 및 항종양 활성을 평가하였다. 치료 용량의 MLN2704를 반복적으로 안전하게 투여할 수 있다는 결과가 확인되었다 (Galsky et al., 2008). 유사한 실험을 다른 DM1-면역접합체, 즉 두경부암과 그외 고형 종양 상에서 발현되는, CD44v6을 타겟팅하는 비바투주맵 머탄신 (mertansine)으로 수행하였다. 가장 단축된 투약 설계 (매주 투여)로 수행한 임상 실험에서, 피부 케라티노사이트 상의 CD44v6에 결합하여, 환자에 치명적인 결과를 초래하는 심각한 피부 독성을 매개하였으며, 이는 비바투주맵 머탄신의 개발 프로그램의 종료로 이어졌다 (Tijink et al., 2006, Sauter et al., 2007, Rupp et al., 2007, Riechelmann et al., 2008).
CD44v6는, 다양한 암 세포에서 뿐만 아니라 정상적인 피부 조직에서도 발현되며, 암 세포 뿐만 아니라 정상 피부 조직에서도 발현된다는 점에서 CD138과 비슷한 점이 있다. 놀랍게도, BT062가 비바투주맵 머탄신에서 확인되는 바와 같이 유사한 피부 독성과 같이 허용불가한 부작용이 없는 임상적인 효능을 나타낸다는 것이 확인되었다. BT062를 최대 160 mg/m2의 반복적인 단회 투여하면 적어도 안정적인 질환 상태가 유도되며 부작용도 조처가능한 수준임을 보여주는 도 28을 참조한다. 도면은 특히 혈청 M-단백질에 의해 확인되는 마이너 반응을 도시한다 (M-단백질 수준은 ≥ 25%까지 감소됨). 홀드 기간 (hold period, 400 - 421일) 이후에 M-단백질 수준이 증가하지만, 다음 투약을 투여한 후에는 안정화될 수 있었다. 종합적으로, 약 22개월 동안 무진행 생존이 이루어졌으며, 마이너 반응의 지속 기간은 19개월이다. 또한, 20 mg/m2으로 단회 투약을 10회 반복 (6개월 이상 처리), 40 mg/m2으로 단회 투약을 5회 반복, 80 mg/m2으로 단회 투약을 5회 반복, 160 mg/m2으로 단회 투약을 6회 반복, 및 200 mg/m2으로 단회 투약한 후 160 mg/m2으로 단회 투약을 6회 반복 (그래서 총 투여량 1160 mg/m2임)하는 경우가 충분히 허용된다는 것은 사전에 확인된 바 있다 (미국 특허 공개번호 20110123554).
또한, CD138은 정상 혈액 세포와, 파괴로 허용불가한 부작용을 야기하여 본원에서 이후에 논의하는 중증 이상 반응 (SAE)을 일으키게 되는 그외 세포 상에서도 발현된다. 이와는 무관하게, 임의 종류의 CD138을 발현하는 비-암/비-종양 세포에 대한 용량 제한 독성은, 최대 120 mg/m2으로 반복적인 단회 투약 치료 용법에서는 확인되지 않았다. 1, 8 및 15일에 120 mg/m2을 투여하고 1주일의 휴지기를 가지는 경우, 3주 (21일) 동안 총 용량이 360 mg/m2이었다. 즉, 이러한 주당 1회 치료 용법에서의 총 최대 허용 용량 (AMTD)은, BT062의 경우, 단회 투약으로서 본원에서 21일 사이클에서 첫날에만 면역접합체를 투여하는 경우 160 mg/m2인 것으로 기존에 결정된 최대 허용 용량 (MTD) 보다 높다. 실제, AMTD는, BT062의 경우, 3주 (21)의 활성 치료 사이클에서, 예를 들어 사이클의 1일에 예로 1회 단회 투약으로서 면역접합체를 투여하는 경우 200 mg/m2인, 기존에 결정된 용량 제한 독성 (DLT) 보다 50%, 60%, 70%, 80%, 90%, 100% 이상 높은 수준을 비롯하여, 높다. 이는, 면역접합체 단회 투약 (반복적인 단회 투약 포함), 예컨대 3주내에 1회 투여하는 경우와 다회 투약 용법, 예컨대 3주 (21일)간 주당 1회로 3번 투여하는 경우에 DLT 또는 MTD에 차이가 없는, 다른 면역접합체들과는, 상당한 차이이다.
총 최대 허용 용량 (AMTD) 효과는 본원에서 도처에 나타낸 MTD 효과와 동일하다. 그러나, 용어 "총"은 특정 기간, 예를 들어 3주간 (예, 21일)의, 예로, 활성 치료 사이클 이내에 단회 투약 또는 반복적인 단회 투약으로서 투여가 수행되는 것은 아니지만, 상기 특정 기간 동안에, 면역접합체를 일정 간격, 예로 21일 기간에서 1일, 8일 및 15일과 같은 매주 간격으로 투여하는 것을 의미한다. 바람직하게는, 동일한 용량을, 예컨대 7일 간격으로 (예, 1, 8 및 15일에), 3일 간격으로 (예, 1, 4, 7, 10, 13 및 16일에), 4일 간격으로, 5일 간격으로 또는 6일 간격으로 투여한다. 그러나, 본원에서 도처에 기술된 초기 부스터 투여 등의 투여에서의 약간의 변동 역시 본 발명의 범위에 포함된다. 투여 간격은 각 사이클 이후에 늘이거나 단축할 수 있다 (본원의 도처에 논의된 유지 요법을 참조함). 예를 들어, 1차 및 임의의 2차 사이클은 3일 마다 투여하는 것을 포함하는 반면, 이후의 사이클에서는 간격을 예컨대 4, 5, 6, 또는 7일까지 서서히 늘일 수 있다. AMTD의 일부 (fraction)는, 예컨대 AMTD의 약 95%, AMTD의 약 90%, AMTD의 약 85%, 약 80%, 약 75% 약 70%, 약 65%, 약 60%, 약 55%, 약 50%, 약 45%를 포함한다. 예를 들어 이론적인 면역접합체의 AMTD를 100 mg/m2으로 가정하면, 일부는 예컨대 95 mg/m2일 것이다.
이상 반응 (AE)은 NCI-CTCAE version 4.0 (Cancer Therapy Evaluation Program, Common Terminology Criteria for Adverse Events, Version 3.0, DCTD, NCI, NIH, DHHS March 31, 2003), National Cancer Institute, US National Institutes of Health, Publishing Date: August 9, 2006)에 따라 평가할 수 있다. CTCAE v4.03에 나열되지 않은 AE의 경우, 중증도는 하기 기준으로 평가자가 평가한 것이다:
1 등급 (경도)이 치료 필요성이 최소이거나 없으며 환자의 일상 활동을 방해하지 않는 것이고, 2 등급 (중도)은 낮은 수준의 불편성 또는 치료적 조처에 대한 관심을 불러일으키는, 1 등급 및 2등급 AE만 허용가능하다. 중등도의 현상은 개체의 기능에 다소의 간섭을 야기할 수 있다.
3 등급 (중증) 및 4 등급 (치명적)의 AE는 허용불가한 수준으로 간주되며, 실험의 구체적인 DLT 기준으로 규정되지 않는 경우 이러한 현상 발생은 DLT (용량 제한 독성)을 정의한다 (하기 참조).
등급 3 및 4의 AE는 또한 중증 이상 반응 (SAE)로 지칭되며, 림프구 감소증, 백혈구 감소증, 혈소판 감소증, 호중구 감소증, 심정지, 심방 세동, 폐색전 및 심부정맥 혈전증을 포함한다. 다른 실험 특이 기준도 사용할 수 있다 (하기 참조).
용량 제한 독성 (DLT)은, 상기에서 언급한 NCI CTCAE v4.0에 따른 등급 븐류를 이용하여 정한다. 일반적으로, 등급 3 이상의 모든 독성을 DLT라 한다. 적용할 수 있는 추가적인 실험 특이 DLT 기준을 아래에 열거한다:
비혈액:
- 모든 등급의 탈모증은 DLT로 간주되지 않음
- 등급 3-4 최적의 구토 억제제a에도 불구하고, 3일 이상 구역질 및 구토 지속
- 등급 3-4 최적의 항설사제a에도 불구하고, 3일 이상 설사가 지속됨
a. 최적 항설사제 및 구토억제제는 각 조사자가 정하였다.
혈액:
- 등급 4 5일 이상 호중구 감소증 지속.
- 등급 3 또는 이보다 높은 등급 4시간 간격으로 2회 연속 측정시, 101 ℉ 이상의 고온을 수반한 호중구 감소증
- 등급 4 혈소판 감소증
- 등급 3 또는 그 이상의 등급 수혈과 혈소판 수혈이 필요한 혈소판 감소증
- 등급 3 호중구감소증, 등급 3 혈소판 감소증은 DLT로 간주하지 않았음
최대 허용 용량 (MTD)은 단회 투약 또는 반복적인 단회 투약을 시술받은 임의의 개체에서 용량 제한 독성 (DLT)이 나타나는 용량으로서 정의된다. 쉽게 식별할 수 있는 바와 같이, MTD는 본 발명에 따른 매우 다양한 면역접합체를 대상으로 쉽게 결정할 수 있다. 이들 DLT는 1차 또는 이후의 치료 사이클에서 나타날 수 있다. 특히, 단회 투약 또는 반복적인 단회 투약을 투여받은 개체 6명 중 1명은 DLT를 경험한다. 바람직하게는, 1차 사이클에서 DLT을 고려한다.
용량을 증가시키면서, 바람직하게는 1차 사이클에서는 DLT만 고려한다.
실험 특이 이상 반응 (AE)
임상 실험에서 관찰 기간 동안 환자 또는 임상 평가 개체에서 나타나거나 악화되는, 임의의 비우호적인 또는 의도되지 않은 신호, 증상 또는 질환. AE는 하기 중 임의 현상일 수 있다:
- 새로운 질환,
- 치료 중인 또는 동시 발생되는 질환의, 신호 또는 증상, 또는 근원 병태의 악화,
- 실험 약물 또는 비교 약물의 효과나 또는 임상 실험에서의 참여와 무관함
- 상기 인자들 중 한가지 이상의 조합.
일반적으로, 실험 약물과의 인과 관계는 용어 "이상 반응"에 내포되지 않는다.
중증 이상 반응 (SAE)
SAE는 임의 용량에서 하기를 발생시키는 모든 원치않는 의학적 현상 또는 효과:
● 사망
- 사망은 AE의 결과이고, 그 자체가 AE는 아니다. 요인 또는 관련성에 관계없이, 모든 사망은 실험 중인 환자들에서 보고되어야 한다.
● 치명적임
- 치명적은, 환자가 발생한 현상으로 인해 즉각적인 사망 위험성이 있는 경우를 의미한다. 이는, 더 심각해지만 사망으로 이어질 수 있는 현상은 포함하지 않는다.
● 영구적인 또는 현저한 불구 또는 무능 발생
● 기형아 또는 선천성 결함, 또는
● 그외 의학적으로 중대한 병태
- 즉각적으로 치명적이거나 사망 또는 입원이 필요한 것은 아니지만, 환자/개체를 위태롭게 할 수 있거나 또는 상기 열거한 결과들 중 한가지를 예방하기 위한 의학적 개입이 필요할 수 있는, 중대한 의학적인 현상은, 물론 "중증"으로 기록하여야 한다.
이상 반응의 인과성
조사 대상에 대한 AE의 관련성을 지칭한다. 인과성은 하기 기준에 따라 분류된다:
무관함
다른 원인이 합리적인 설명인 것으로 그럴듯하게 간주되는 AE, 예를 들어, 복용한 비-조사 대상, 사고 부상, 근원 또는 동반 질환의 예상된 진행, 약물학적으로 비혼화적인 시간적 관계, 병발성 질환 (intercurrent illness)과 같은 그럴듯한 임상적인 대안.
관련성 있음
조사 대상에 대한 합리적으로 가능한 임상적 및/또는 약물학적 관련성을 배제할 수 없는 AE, 예컨대 그럴듯한 대안이 없음.
HER을 과다 발현하는 전이성 유방암을 치료하기 위해, 트라스투주맵을 면역접합체 형태 (T-DM1)로 사용한 I상 연구를 수행하여, T-DM1의 매주 투여시 또는 3주마다 1회 투여시의 안전성과 약동학적 특성을 조사하였다. 2가지 실험에서, AE 등급 ≥ 2는, T-DM1이 드물고 조처가능하다는 것이다. 객관적인 종양 반응이 MTD나 그 미만의 용량에서 관찰되었다 (Burris et. al., 2006, Krop et al., 2007, Beeram et al., 2008, Holden et al., 2008). HER2-양성의 전이성 유방암에, 3주 마다 1회 투여하는, T-DM1에 대한 II상 실험이 시작되었다 (Beeram et al., 2008, Carter and Senter, 2008, Holden et al., 2008). 제2 세포주인 HER2-양성의 전이성 유방암에 대한 T-DM1의 III상 임상 시험과, 제1, 제2 및 제3 세포주인 HER2-양성의 전이성 유방암에 대한 T-DM1의 II상 임상 시험 평가가 진행 중에 있다. 헤르셉틴을 기본으로한 치료를 진행 중에 있는, HER2-양성의 전이성 유방암에 대한, 퍼투주맵과의 조합 투여에 대한 Ib 상 임상 시험이 계획되고 있다. 결장직장암과 그외 C242를 발현하는 암 상에서 발견되는 항원을 타겟팅하는, huC242 항체의 DM1-접합체인, 칸투주맵 머탄신을 이용한, 3번의 I상 임상 실험이 완료되었다. huC242-DM1을 매주 투여하는 치료와, 3주마다 1회 투여하는 치료는 안전하고 허용적인 것으로 확인되었다 (Rowinsky et al., 2002, Tolcher et al., 2003, Helft et al., 2004).
또한, BT062의 구성 요소인, 티올-함유성 DM4 메이탄시노이드를 이용한 면역접합체에 대해, 4가지의 실험들이 진행중에 있다:
칸투주맵 머탄신의 유사체인 IMGN242 (huC242-DM4)는, CanAg를 발현하는 암에 걸린 개체를 대상으로 I상 실험을 수행하였다 (Tolcher et al., 2006). IMGN242를 3주 마다 1회로 단회 IV 주입으로 18 - 297 mg/m2의 용량으로 개체에게 투여하였다. 용량 제한 독성은 2차 치료 사이클 동안에 223 mg/m2의 용량 수준으로 투여받은 개체 6명 중 2명에서 나타났다. 약물은 168 mg/m2의 수준에서 허용성이 우수하였으며, 어떠한 검출가능한 항체 반응을 유발하지 않았다 (Mita et al., 2007). I 상 실험의 처음 안전성 결과를 기초로, CanAg를 발현하는 위암 세포 치료를 IMGN242 용량 168 mg/m2에서 평가 착수하였다 (Sankhala et al., 2007). 환자 45명에게 IMGN242를 2가지 임상 실험으로 처방하고 있다. 안전성과 철저한 임상적인 약동학(PK)/약력학(PD) 분석을 토대로, II 상 실험을, 혈장내 CanAg 수준이 낮은 환자에게 126 mg/m2을 투여하고 혈장내 CanAg 수준이 높은 환자에게 168 mg/m2를 투여하는 것으로 수정하였다 (Qin et al. 2008).
또한, CD33-양성인 급성 골수성 백혈구 (AML) 환자에 대한 치료 실험으로, DM4가 접합된 huMy9-6 항체 (AVE9633)의 I상 실험이 이루어졌다. 치료 계획은 15 - 260 mg/m2의 용량 범위로, 3주마다 1회씩 IV 주입하는 것이었다. 단회 투약 실험에서, 관련된 골수 억제 또는 반응은 나타나지 않았다 (Giles et al., 2006). AVE9633을 28일 사이클의 1일과 8일에 IV 주입하는 것으로 구성된 치료 계획으로 2차 I상 실험을 진행하였고, 여기서 AVE9633이 충분히 허용적이라는 것이 확인되었고, 또한 4달 이상 지속되는 완전 반응 (불충분한 혈소판 반응, 수혈 의존성)을 보인 개체 1명을 포함하여 항-백혈병 활성의 증거를 제공해준다 (Legrand et al., 2007). 2가지의 다른 DM4-면역접합체들 (SAR3419 및 BIIB015)도 임상 실험에 착수하였다.
SAR3419 (huB4-DM4)는 이황화 결합을 통해 메이탄시노이드 유도체 DM4에 CD19 항원을 특이적으로 타겟팅하는 인간화된 IgG1 단일클론 항체, huB4가 접합된 항체-약물 접합체이다. CD19 분자의 발현은, 프로-B 세포 등의 모든 B 림프구들에서 발견되지만, 혈장 세포로 성숙되는 동안에 없어진다. 또한, CD19 항원은 여포성 수지상 세포 (follicular dendritic cell) 막과 대부분의 안정화된 B 세포주들 상에서 발현된다. SAR3419는, CD19 항원에 결합한 후, 안으로 들어가 DM4를 세포내에 방출한다. I/II상 실험에서, SAR3419는 8-12회로, 정맥내 주입에 의해 매주 CD19를 발현하는 재발성/난치성 B-세포 NHL을 가진 환자에게 투여하였다. 환자 45명을 10 - 70 mg/m2의 7가지 투약 수준으로 등록하였다. 주된 조직학적 결과는 여포성 (18; 41%) 및 미만성 라지 B-세포 (17; 39%)였다. 이전 용법 (prior regimen)의 중앙값은 3 (1-8)이었으며, 환자 19명은 이전에 이식받았다. 환자 28명을 용량 증가 파트로 등록하였다. 70 mg/m2에서 환자 6명 중 1명이 호중구 감소증의 프로토콜에 규정된 용량 제한 독성 (DLT)을 나타내었으며, 환자 2명은 후기에 발병되는 등급 2의 상당한 독성을 나타내었다: 각막 침전물과 관련된 시야 흐림과 좌각차단. 최대 허용 용량 (MTD)은 55 mg/m2로 정해졌지만, 3주 간격으로 1회 투여하는 용법의 MTD는 160 mg/m2였다. MTD 55 mg/m2에서, 환자 22명 중 4명이 6-8회 투약 후 관련성 있는 가역적인 3-4등급을 나타내었다: 눈의 신경 장애, 지각 이상, 호중구 감소증 및 혈소판 감소증. 20 mg/m2 이상의 용량에서는, 환자 38명 중 12 (32%)명은 6 CR/CRu (완전 반응/검증되지 않은 완전 반응) 등의 객관적인 반응을 나타내었으며, 명백한 투약 효과는 없었다. MTD (55 mg/m2)에서, 환자 22명 중 8 (36%)명은 3 CR/CRu 등의 반응을 나타내었다. 반응 기간 (RD)를 평가할 수 있는 환자 9명 중, 4명은 6개월 내지 적어도 12개월의 RD를 나타내었다. 요컨대, 3회 투약하는 3주 (21일) 투약 용법에서의 총 최대 허용 용량 (AMTD)은 단회 투약 (예, 첫날 투여)하는 3주 (21일) 투약 용법에서의 MTD를 초과하지 않는다고 할 수 있다.
| 매주 1회 용법 | 총 농도 (70 kg 및 체표면적 1.9 m2의 경우) | |
| BT062 | MTD 140 mg/m2 | 266 mg |
|
SGN-35
(Batlett et al., 2008) |
최대 1,2 mg/kg | 84 mg |
|
SAR3419
(Coiffer et al., 2011) |
MTD 55 mg/m2 | 110mg |
|
T-DM1
(Holden et al., 2008) |
MTD 2.4 mg/kg | 168 mg |
|
SGN-75 (anti-CD70; MMAF)
(SEATTLE GENETICS) |
실험 0.3 - 0.6 mg/kg (MTD에 도달하지 못함) |
표 8: 반복적인 다회 투약 용법 (매주 1회)으로 투여한 면역접합체들 간의 비교
상기 표에서 알 수 있는 바와 같이, BT062를 매주 1회로 고용량 (적어도, 총량 266 mg)으로 투여할 수 있다. 열거된 다른 면역접합체와는 대조적으로, BT062는 특징적인 약동성을 나타내었다. 특히, BT062는 본원의 도처에 기재된 BT062의 Cmax 관찰치와 이론치 간에 특징적인 차이를 나타낸다.
또한, CD33을 타겟팅하는 밀로타르그 (Mylotarg) 등의, 다른 면역접합체들을 통해, 면역접합체의 활성이 저용량에서는 환자를 치료하는데 충분하지 않을 수 있는 것으로 알려져 있다. 이러한 문제는, 예컨대 CD33을 발현하는 타겟 세포를 민감하게 자극하기 위해 재조합 인간 과립세포 콜로니-자극 인자(rhG-CSF)를 투여함으로써, 완화되었다 (Fianchi et al., Annals of Oncology 2008 19(1):128-134).
전술한 실험들에서, 여러가지 면역접합체, 특히 메이탄시노이드 (예, DM1 또는 DM4)를 포함하는 면역접합체에 대한 반응이 매우 다른 것으로 나타났다. 인간 개체를 대상으로 한 BT062 실험에서, 여러가지 안정적인 질병 상태 용량 (stable disease dose), 특히, 최대 160 mg/m2의 용량에서, CD138을 발현하는 비-암 세포에 대한 허용가능한 수준의 독성 뿐만 아니라, 매주 투여 용법에서는 약 50 mg/m2 이상의 용량들에서 빠른 혈장 소거 (plasma clearance)가 확인되었다.
본원의 면역접합체는 세포독성 물질과 조합하여 투여할 수 있다. 이러한 조합을 본원에서는 항암 조합이라 한다.
약물 조합 파트너의 선택
조합 화학치료 용법을 설계하기 위한 가이드라인 세트가 개발되어 있다 (Takimoto, 2006). 이러한 가이드라인에 따르면, 일반적으로, 특정 조합이 단일 제제 요법 이상으로 조합 화학요법의 가장 중요한 이론적 이점 3가지 중 적어도 1가지를 구현시킬 가능성을 높일 수 있을 것이다:
1.) 비간섭성 용량-제한 독성을 보이는 제제를 이용함으로써 숙주에 대한 독성을 최소화하면서 세포 사멸은 최대화;
2.) 특정 유형의 요법에 내인성 내성을 보이는 종양 세포에 대한 약물 활성 수준의 증가; 및
3.) 새로운 내성 종양 세포의 발생 예방 또는 늦춤.
조합 화학요법 용법에 사용하기 위한 물질의 선택시 고려할 권고되는 원칙은 다음과 같다:
a) 단일 물질로서 완전한 관해를 유도하는 것으로 공지된 약물의 선택,
b) 상가적인 또는 상승적인 세포독성 효과를 가지며 상이한 작용 방식을 가진 약물의 선택,
c) 용량 제한 독성이 다른 약물들의 선택,
d) 교차 내성을 최소화하기 위한, 다른 내성 패턴을 가진 약물들의 선택.
또한, (e) 약물은 그것의 최적 용량과 계획으로 투여되어야 하며, 투여는 일정한 간격으로 수행되어야 하지만, (f) 무치료 기간은 정상 조직의 회복이 가능할 정도로 짧아야 한다 (Takimoto et al, 2009).
상승 효과 또는 단순 상가적인 효과는 여러가지 인자들에 의해 상쇄될 수 있다: 예컨대, 항암 조합의 구성 성분들이 예컨대 서로 결합함으로써 서로를 불활성화할 수 있다. 또한, 항암 조합의 한가지 성분이 다른 성분의 작용 모드를 방해할 수도 있다. 예를 들어, 레날리도마이드는 본 발명의 면역접합체의 타겟인 CD138과 같은 세포 접착 수용체를 하향 조절한다 (Quach et al., 2010, Udi et al, 2010). 프로테아좀 저해제인 보르테조밉은 G2/M 세포 주기를 정지시키는데, 이는 세포분열 저해제에 의해서도 영향을 받는다 (Wang et al., 2009). 즉, 면역접합체의 작동자 분자가 메이탄시노이드인 경우, 보르테조밉과 작동 타겟을 공유할 것이므로, 좋지 않은 것으로 간주된다.
암 치료에 널리 사용되는, 본 발명에 따른 세포독성 물질의 용량, 투여 경로 및 권고되는 용법은 당해 기술 분야에 공지되어 있으며, 의료인을 위한 참조서 (PDR: Physician's Desk Reference)와 같은 문헌 등에 기술되어 있다. PDR에는 다양한 암의 치료에 사용되고 있는 물질의 용량이 기재되어 있다. 유효한 이들 세포독성 물질의 투약 요법과 용량은 치료중인 개개 암, 질병의 수준 및 당해 기술 분야의 의사에게 자명한 그외 인자들에 따라 결정될 것이며, 의사가 정할 수 있다. 의료인을 위한 참조서(PDR) 2006년도 판에는, 탈리도마이드 (p 979-983), 벨카드 (p 2102-2106) 및 멜팔란 (p 976-979)에 대한 작용 기전과 바람직한 처리 용량 및 투약 스케줄이 기재되어 있다. 당해 기술 분야의 당업자는 PDR을 하나 이상의 파라미터들을 이용하여 검토하여, 본 발명의 내용에 따라 사용될 수 있는 화학요법제 및 접합체의 투약 요법과 용량을 정할 수 있다:
이들 파라미터로는 하기를 포함한다:
1. a) 제조사, b) 제품 (회사 또는 약물의 상표명), c) 카테고리 인덱스 (예, "프로테아좀 저해제", "DNA 알킬화제", "멜팔란" 등), d) 일반적인/화학적인 인덱스 (상품명이 아닌 약물의 일반명)에 따른 종합 인덱스.
2. 약물의 색 이미지
3. FDA 표시 요건에 부합되는 상품의 정보, a) 화학물 정보, b) 기능/작용, c) 처방 증상 & 금기. d) 임상 연구, 부작용, 경고가 포함됨.
본 발명에서, 조합물을 사용하는 한가지 목적은 본 발명의 면역접합체의 유효량을 낮추어, 이의 부작용을 감소시키고, 허용가능한 부작용을 수반한 새로운 치료 지평을 여는 것이다. 다른 목적은 벨카드 또는 레날리도마이드 등의 기존에 사용된 세포독성 물질의 유효량을 낮추는 것이며, 바람직하게는 이들 물질들의 부작용을 줄이는 것이다. 마찬가지로, 투여량 포지티브 결과 (dosages Positive consequence)로, 비제한적으로, 치료 연장, 보다 높은 투여량, 그외 적용 스케줄, 치료에 대한 양호한 그리고 지속적인 반응을 포함한다.
레날리도마이드, 멜팔란 (실험 중) 등의 약물에 대해 난치성 표현형을 나타내는 환자는 본 발명에 따른 면역접합체를 사용함으로써 다시 민감하게 만들 수도 있다.
용어 "세포독성 물질"은 화학치료제, 특히 빠르게 분열하는 세포에 통상적으로 사용되는 화학치료제를 비롯하여 "세포독성/암 약물"을 포함하며, 즉 하기 물질들이 있다:
- 알킬화제, 예를 들어, 니트로겐 머스타드 (예, 멜팔란, 사이클로포스파미드, 메클로레타민, 우라머스틴, 클로람부실, 이포스파미드), 또는 니트로소우레아(예, 카르머스틴, 로머스틴, 스트렙토족신) 또는 알킬설포네이트;
- 알킬화제, 예컨대 시스플라틴, 카르보플라틴, 네다플라틴, 옥살리플라틴; 또는 비-고전적인 알킬화제, 예컨대 테트라진, 다카르비진, 프로카르바진, 알트레타민;
- 안트라사이클린, 예컨데 독소루비신 및 리포좀 독소루비신 (DOXIL)
- 알칼로이드, 예컨대 빈크리스틴.
용어 "세포독성 물질"은 또한 탈리도마이드 (또는 유사체), 레날리도마이드 (CC-5013), 포말리도마이드, 액티미드 등의, 이들의 다면적인 면역조절 특성 측면에서 골수종 치료에 사용되는, 면역조절 약물 (ImiD)도 포함한다. 이것은 TNF 알파 생산을 저해함으로써 항-염증 활성을 나타내며, 또한 항-혈관신생 활성과 T 세포 공동 자극 등의 면역조적 특성을 나타내며, 조절성 T 세포에 영향을 미친다 (Quach et al., 2010).
용어 "세포독성 물질"은 또한, 비제한적인 예로서, 덱사메타손 및 프레드니손과 같은 스테로이드 뿐만 아니라, 프로-세포자살 경로의 억제에 의존적인 신생물 세포에서 프로그래밍된 세포 사멸의 활성화를 유도하는, 보르테조밉 (VELCADE) 또는 카르필조밉 등의 프로테오좀 저해제를 포함한다.
추가적인 강력한 세포독성 물질로는, 토포이소머라제 II를 저해하는 에토포시드, 변환시 세포주기를 S기 (DNA의 합성)로 유지되었을 때 DNA를 손상시켜, 특히 암 세포 등의 빠르게 분열하는 세포에 작용하는, 시타라빈을 포함한다. 아울러, 빈카 알칼로이드, 탁산 (작동자 분자에 대한 상기 내용 참조) 등의 마이크로튜불 저해제도 본 발명에 따른 세포독성 물질로 사용할 수 있다.
또한, 소라페닙과 같은 키나제 저해제, 또는 로미뎁신과 같은 HDAC (히스톤 탈아세틸화 효소) 저해제, 뿐만 아니라, 성장 저해제, 항-호르몬제, 항-혈관신생제, 심보호제, 면역자극제, 면역억제제, 혈관신생 저해제, 단백질 티로신 키나제(PTK) 저해제도, 상기한 정의에 포함된다.
또한, 이러한 정의에, 당해 기술 분야에서 인정되는 세포 독성 효과를 가지는 면역접합체 및 항체 등의 항체 기반의 세포독성 물질도 포함된다. 항-CD40이 바람직한 항체이다. 그외 항체로는, 예컨대 AVASTIN (bevacizuab) 또는 MYELOMACIDE (milatuzumab)이 있으나, 이들로 한정되지 않는다.
탈로미드 (α-(N-프탈리미도)글루타리미드; 탈리오미드)는 면역조절제이다. 탈리도마이드의 실험식은 C13H10N2O4이며, 그람 분자량은 258.2이다. 탈리도마이드의 CAS 번호는 50-35-1이다. 이 화합물은, 다양한 방식으로 골수종 세포의 증식 및 생존을 저해하는 능력 및 신생 혈관의 증식을 저해하는 능력 등의 복수의 작용을 하는 것으로 보인다.
레날리도마이드 (REVLIMID)는 TNF 알파의 저해제로서 초기에 개발된 면역조절 화합물 (ImiD)의 제2 세대인 탈리도마이드의 유도체이다. 레날리도미드의 효능은 증식 정지 또는 세포자살, 골수 기질 세포에 대한 골수종 세포의 접착 저지 및 세포 증식 생존 및 골수종 세포의 내성을 촉진시키는 사이토카인의 조절이다 (Morgan et al., 2006). 레날리도마이드는 탈리도마이드에 난치성인 환자에게 유효하다. 면역 세포에 대한 효능 외에도, 레날리도마이드 등의 ImiD는 G0/G1기로의 세포 주기 정지를 유발하는 것으로 추측되었다. 또한, ImiD는 세포 접착 수용체 (VLA-4, VLA-5, CD138)를 하향 조절하는 것으로 추측된다 (Quach et al., 2010; Udi et al, 2010).
CD138의 하향조절은 타겟 세포에 BT062 등의 임의의 CD138 타겟팅 물질의 결합 감소를 야기하는 것으로 예상될 것이다.
프로테오좀 저해제는 다시 서브그룹들로 분류할 수 있다:
a) C-말단 에폭시 케톤 구조를 가지고 있는, 천연적으로 형성되는 펩타이드 유도체들, 베타-락톤 유도체, 아클라시노마이신A, 락타시스틴, 클라스톨락타시스틴; 및
b) 합성 저해제 (변형된 펩타이드 알데하이드, 알파, 베타 에폭시케톤 구조체, 비닐 설폰, 붕산 잔기들, 피나콜에스테르). 본 발명의 바람직한 프로테오좀 저해제는 보르테조밉 (PS 341; VELCADE, 하기 내용 참조)이다. 제안된 기전들 중 한가지 기전은, 프로테오좀 저해로, 프로-세포자살 경로의 억제에 의존적인 신생물 세포에서의 프로그램화된 세포 사멸의 활성화를 허용하는, 프로-세포자살 인자의 분해를 방지할 수 있다는 것이다. 또한, 보르테노밉은 G2/M 세포 주기 정지를 야기한다 (Wang et al., 2009). 따라서, 보르테조밉은, 이러한 세포 주기 단계에서도 작용하는, 메이탄시노이드 DM4의 효능을 가지고 있는, 본 발명의 면역접합체의 일부분인 세포분열 저해제를 간섭할 것이다. 아울러, 세포자살시 발생하는 PARP (폴리(ADP-리보스)중합효소)의 절단은, 또한 DM4와 보르테조밉 양자에 영향을 받는다. 즉, 세포분열 저해제를 포함하는 면역접합체와 보르테조밉 특징을 나타내는 프로테오좀 저해제의 조합은, 상승적인 효과를 수득하기 위한 이전에 기술된 포괄적인 지침에 일치되지 않는다 (Takimoto et al, 2009).
벨카드 (보르테조밉)는 다발성 골수종 치료에 사용되는 프로테오좀 저해제이다. 벨카드는 골수종 세포에 세포 사멸을 야기하는 것으로 작용하거나 및/또는 골 미세환경에 작용함으로써 골수종 세포 증식 및 생존을 저해하도록 간접적으로 작용하는 것으로 생각된다. 특정 이론 또는 작용 방식으로 제한하고자 하는 것은 아니나, 벨카드는 정상적인 세포 프로세스를 파괴하여, 세포자살을 촉진시키는 프로테오좀 저해를 야기한다.
덱사메타손은 항염증제 및 면역억제제로서 작용하는 합성 글루코코르티코이드 스테로이드 호르몬이다. 덱사메타손은, 암 환자에게 투여시, 암 치료제의 부작용을 중화할 수 있다. 또한, 덱사메타손은 단독으로 또는 탈리도마이드, 레날리도마이드, 보르테조밉, 아드리아마이신 또는 빈크리스틴 등의 다른 항암제와 함께 제공될 수 있다.
BT062와 조합하여 사용될 수 있는 치료용 물질로는, 또한 면역조절 물질 (예, 탈리도마이드, 레날리도마이드 및 포말리도마이드), 프로테오좀 저해제 (예, 보르테조밉 및 카르필조밉), 스테로이드 (예, 덱사메타손), 알킬화제 및 고용량 화학요법, 조합물 (예, 멜팔란 및 프레드니손(MP), 빈크리스틴, 독소루비신 (아드리아미신) 및 엑사메타손(VAD)) 및 비스포르포네이트를 포함한다.
현재, 특히 항-골수종 약물들의 다수 조합물들이 임상 실험 중에 있다. 조합 사용의 목적은 통상적으로 예컨대 골수종 세포의 불응 표현형을 치유하기 위한 효능 강화이거나, 또는 조합 파트너들 중 하나 또는 이들의 조합을 낮은 농도로 사용함에 따른 부작용 감소이다. 예컨대, 저용량의 레날리도마이드 + 저용량의 덱사메탄손의 사용시, 독성 감소가 입증되었다 (Rajkumar et al., 2010).
특히 재발성 또는 난치성 다발성 골수종 환자를 대상으로, 몇가지 약물 조합들이 실험 중에 있으며, 조사되었다.
조합한 화학치료제들에 대한 표준 예는 빈크리스틴, 덱사메타손 및 독소루비신으로 구성된 트리플 조합이다 (VAD Regimen).
보르테조밉 (VELCADE)과 같은 프로테오좀 저해제는 멜팔란 및 프레드니손 (VMP) 등의 골수종 약물들과 조합된다. 이 조합으로 인한 완전 반응의 발생율은 16%이고 전체 반응율은 89%에 달한다 (Mateos et al., 2006).
또한, 보르테조밉은 재발성 또는 난치성 환자를 대상으로 리포좀 독소루빈신과의 조합 사용에 대해 승인되었다 (Ning et al., 2007).
보르테조밉은 덱사메타손, 멜팔란, 프레드니손 및/또는 탈리도마이드와 조합 사용에 대해 몇 건이 임상 실험 중에 있다.
또한, 보르테조밉은 리포좀 독소루비신, 사이클로포스파미드 및 덱사메타손과 조합하여, 다발성 골수종 환자를 대상으로 실험 중에 있다. 보리노스타트와의 조합도 현재 보르테조밉에 난치성인 환자를 보르테조밉에 대해 다시 민감해지게 하고자 하는 목적으로 실험 중에 있다.
경구로 투여되는 탈리도마이드는 멜팔란/프레드니손 (MPT) (Facon et al., 2006) 또는 덱사메타손 또는 벤다무스틴 (Ponisch et al., 2008)과 조합 사용되고 있다.
아울러, 덱사메타손과 조합 사용되는, 면역조절 약물인 레날리도마이드 (REVLIMID)는, 덱사메탄손 단독 사용시와 비교하여 종양 진행을 지연시키고 생존율을 높이는 결과를 나타내었다 (Weber et al., 2006). 또한 레날리도마이드와 덱사메타손의 조합은 신규 진단받은 환자에서 조사되었으며 (Rajkumar et al., 2005), 멜팔란/프레드니손의 조합 (RMP)도 조사되었다 (Palumbo et al., 2006)
Lutz 등의 미국 특허 공개번호 2010/0028346은 화학치료제와 특정 면역접합체의 상승적인 효과를 기술하고 있다.
용어 "와 조합하여"는 정확히 동시 투여로 한정되지 않는다. 대신, 상기 용어는 본 발명의 면역접합체와 다른 용법 (예, 방사능 요법) 또는 물질, 특히 상기에서 언급된 세포독성 물질의, 순차적인, 및 이들이 서로 작용하여 본 발명의 면역접합체나 예컨대 다른 물질 또는 물질들 중 한가지만 단독으로 사용하여 치료하였을 때와 비교하여 증가된 이점 (예, 활성 증가, 부작용 감소)을 제공할 수 있는 시간 간격으로 투여하는 것을 포함한다. 면역접합체 및 다른 물질이나 물질들은 상가적으로 (additively) 작용하는 것이 바람직하며, 상승적으로 작용하는 것이 더 바람직하다. 이런 분자들은 의도한 목적에 유효한 양으로 적절하게 제공된다. 숙련된 의료 실무자들은 실험을 통해 또는 물질의 약동학 및 작용 방식을 고려함으로써, 각 치료 물질의 적정 용량 및 용량들과, 적합한 투약 시기 및 방법을 결정할 수 있다. 본원에서, "공동-투여"는 면역접합체와 동시에, 대개 조합된 투약 형태로의 투여를 의미한다.
상승적인 효과는, 면역접합체와 세포독성 물질 등의 2가지 성분의 효과가 엄격한 상가적인 효과를 초과하는 것이다. 이러한 상승적인 효과는 추가로 후술되는 다수의 인자들에 의해 약화될 수도 있다.
상승 작용은 다음과 같이 계산한다 (Yu et al., 2001; Gunaratnam et al., 2009):
RATIO (r) = 예상되는 FTV (조합)/관찰되는 FTV (조합)
FTV: 부분 종양 부피 (Fractional tumor volume) = 평균 종양 체적 (실험군)/평균 종양 체적 (대조군)
비율 > 1이면 상승적인 것으로 보고, r < 1이면 상가적 효과 미만이다.
비율(r)이 1 보다 높으면 본원에서는 "시너지 비율 (SYNERGY RATIO)"로 언급된다.
활성 등급은 조합의 효능에 대한 평가치이다. 이 등급은 Log10 세포 사멸을 근거로 한다
Log
10
세포 사멸 = (T-C) / T
d
x 3.32
상기에서, (T-C) 또는 종양 증식 지연은 치료군(T)과 대조군(C) 종양이 미리 정해진 크기 (600 mm3)가 되는데 소요되는 평균 시간 (일)이다. Td는 대조군 마우스에서의 평균 종양 체적을 기초로 한 종양 더블링 시간이며, 3.32는 세포 더블링 횟수/log 세포증식(log of cell growth)이다 (Bissery et al., 1991). Log10 세포 사멸이 2.8 보다 크면, 조합이 고도 활성임을 의미하며, log10 세포 사멸 2.0 - 2.8은 조합이 고활성이며, log10 세포 사멸 1.3 - 1.9은 조합이 활성이며, log10 세포 사멸 0.7 - 1.2은 조합이 중등도의 활성이며, log10 세포 사멸 0.7 미만은 조합이 비활성임을 의미한다.
당해 기술 분야의 당업자에게 자명한 바와 같이, 면역접합체 nBT062의 바람직한 조작된 타겟팅 항체 부분의 아미노산 서열은, CD138을 타겟팅하는 항체 부분의 기능이 없어지지 않은 범위내에서 변경될 수 있다. 특히, 항원 결합부 (ARB)에서, 서열번호 1의 아미노산 잔기 99-111을 포함하는 중쇄 가변부 CDR3 및 서열번호 2의 아미노산 잔기 89-97을 포함하는 경쇄 가변부 CDR3인 경우에도 적용된다. 유익하게는, 항원 결합부 (ABR)에서는, 각각 서열번호 1의 아미노산 잔기 31-35 및 51-68을 포함하는 중쇄 가변부 CDR1 및 CDR2, 및/또는 (b) 서열번호 2의 아미노산 잔기 24-34 및 50-56을 포함하는 경쇄 가변부 CDR1 및 CDR2가 유지된다.
용어 "서열 동일성"은 뉴클레오티드 서열 또는 아미노산 서열의 동일성 정도이다. 일반적으로, 서열을 매칭 수준이 가장 높게 달성되도록 정렬한다. "동일성"은 자체적으로 당해 기술 분야에서 인정되는 의미를 가지며, 공개된 기법들을 이용하여 계산할 수 있다 (예, Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; 및 Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991). 2종의 폴리뉴클레오티드 또는 폴리펩타이드 서열들 간의 동일성을 측정하기 위한 다수의 방법들이 존재하며, 용어 "동일성"은 당업자들에게 잘 알려져 있다 (Carillo, H. & Lipton, D., SIAM J Applied Math 48:1073 (1988)).
임의의 특정 핵산 분자가, 예컨대 nBT062 핵산 서열 또는 이의 일부와 적어도 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% 또는 99%로 동일한 지는, 일차 서열 정렬을 위한 DNAsis 소프트웨어 (Hitachi Software, San Bruno, Calif.)와 같은 공지의 컴퓨터 프로그램과, 다중 서열 정렬을 위한 ESEE 버전 3.0 DNA/단백질 서열 소프트웨어 (cabot@trog.mbb.sfu.ca)에 의해 편리하게 결정할 수 있다.
아미노산 서열이, 예컨대, 서열번호 1 또는 2나, 또는 이의 일부와 적어도 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% 또는 99% 동일한 지는, BESTFIT 프로그램 (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Madison, Wis. 53711)과 같은 공지의 컴퓨터 프로그램을 이용하여 편리하게 결정할 수 있다. BESTFIT는 Smith and Waterman, Advances in Applied Mathematics 2:482-489 (1981)의 국소 상동성 알고리즘을 이용하여, 2종의 서열 간에 최상의 상동성 세그먼트를 찾는다.
DNAsis, ESEE, BESTFIT 또는 그외 기타 서열 정렬 프로그램을 이용하여, 특정 서열이, 예컨대 본 발명에 따른 참조 서열과 95% 동일한 지를 결정하고자 하는 경우, 동일성%가 참조 핵산 또는 아미노산 서열의 전체 길이에 대해 계산되고, 기준 서열에서 뉴클레오티드 총 수에 최대 5%의 상동성 갭이 허용되도록, 파라미터를 설정한다.
만일, 본원에서, 특정 서열의 잔기들의 조합과의 특정한 서열 동일성이 언급된 경우, 이러한 서열 동일성은 명시한 잔기들의 총 수에 관한 것이다.
전술한 바와 같이, BT062는 링커, 본원에서는 SPDB를 통해 세포 증식 억제제 메이탄시노이드 유도체 DM4가 부착되어 있는, CD138을 타겟팅하는 키메라 항체 nBT062를 포함하는 면역접합체이다. 도 1 및 2에 BT062를 화학적으로 도시한다. nBT062 및 메이탄시노이드 작동자 분자를 포함하는 면역접합체는 흔히 이의 링커 및 메이탄시노이드 작동자 측면에서 특정되며, 예컨대 nBT062-SMCC-DM1은, nBT062, SMCC (티오에스테르 결합을 포함하는 "비절단성" 링커) 및 작동자로서 DM1을 포함하는 면역접합체이다. 보다 일반적으로, nBT062 및 작동자 분자를 포함하는 면역접합체는, 또한, nBT062-링커-작동자 또는 간단하게 nBT062-작동자 (nBT062N, N은 본원에 기술된 임의의 작동자임)로도 기술할 수 있다 (미국 특허 공개번호 20090232810).
일 예로, BT062는 CD138-양성의 다발성 골수종 세포에 결합한다. 타겟 세포에 내재화되거나 및/또는 면역접합체가 분비되면, DM4가 타겟팅 분자로부터 분리되고, 그에 따라 DM4의 본래의 세포독성 효과가 복원된다. 따라서, BT062는 타겟화된 항체 페이로드 (TAP: targeted antibody payload)를 제공하게 되는데, DM4의 nBT062로의 기능적 부착이, 이것이 CD138을 발현하는 타겟 세포에 도달/내재화될 때까지 세포독성 약물은 불활성인 상태로 유지시킨다.
본원에서 논의되는 다발성 골수종 세포와 동물 모델에서, BT062의 세포독성을 조사한 비임상 실험의 결과 데이타에 따르면, BT062는 뮤라인 모델에서 충분히 허용되는 용량에서 매우 유의한 항-골수종 활성을 가지는 것으로 확인되었다.
I상의 오픈-라벨, 용량 증가, 반복적인 단회 투약 실험을 재발성 또는 재발성/난치성 다발성 골수종 환자를 대상으로 수행 중에 있다 (미국 특허 공개번호 20110123554; 국제 특허 공개번호 WO 2010 128087).
본원에 기술된 면역접합체는, 정맥내, 비경구, 경구, 근육내, 강내 (intrathecal) 또는 에어로졸 등의 임의 경로로 투여할 수 있다. 전달 방식은 원하는 효과에 따라 결정될 것이다. 당업자는 본 발명에 따른 특정 치료제의 최상의 투여 경로를 쉽게 알 것이다. 적정 투여량은 투여 경로 및 처방된 치료제에 따라 결정될 것이며, 현행 치료 프로토콜에 비추어 당업자가 쉽게 결정할 수 있다.
본 발명의 면역접합체 및/또는 임의의 다른 세포독성 물질을 활성 성분으로서 포함하는 약학 조성물은, 통상적인 약학 컴파운딩 기법에 따라 제조할 수 있다. 예로, Remington's Pharmaceutical Sciences, 17th Ed. (1985, Mack Publishing Co., Easton, Pa.)를 참조한다. 전형적으로, 유효량의 활성 성분을 약제학적으로 허용가능한 담체와 혼합할 수 있다. 담체는 투여에 적합한 조제 형태에 따라 매우 다양한 형태, 예컨대 정맥내, 경구, 비경구, 강내, 경피 또는 에어로졸 형태를 취할 수 있다.
본 발명의 항암 조합물은 바람직하게는 약학 조성물 형태이거나 또는 다른 용기에 항암 조합물의 성분들이 든 키트 형태일 수 있다. 키트의 성분들은 일반적으로 서로 조합하여 투여되며, 흔히 조합된 투약 형태로 또는 개별 투약 형태로 공동-투여된다. 또한, 이러한 키트들은, 예컨대 다른 성분들, 구성 성분들 또는 조합물을 투여하기 위한 장치, 구성 성분들을 조합하기 위한 장치 및/또는 구성 성분들의 사용 및 투약법에 대한 설명서를 포함할 수 있다.
경구 투여용인 경우, 면역접합체 및/또는 세포독성 물질을 캡슐제, 환제, 정제, 로젠제, 용융제 (melts), 산제, 현탁제 또는 유제 등의 고형 또는 액체 조제물로 제형화할 수 있다. 경구 투약 형태로 조성물을 조제하는 경우, 예컨대, 물, 글리콜, 오일, 알코올, 착향제, 보존제, 착색제, 현탁제 등의 일반적인 임의의 약제학적 매질을 경구 액제 조제물 (예, 현탁제, 엘릭시르제 및 용액제)의 경우 사용할 수 있거나, 또는 경구 고형 조제물 (예, 산제, 캡슐제 및 정제)의 경우에는 전분, 당, 희석제, 과립제, 윤활제, 결합제, 붕해제 등을 사용할 수 있다. 이의 투여 용이성으로 인해, 고형의 약제학적 담체가 분명히 사용되는 경우, 정제 및 캡슐제가 가장 유용한 경구 투약 단위 형태이다. 원하는 경우, 표준 기법으로 정제를 당 코팅하거나 장-코팅할 수 있다. 활성 물질은 위장관을 통과할 수 있도록 안정적이어야 한다. 필요에 따라, 안정적인 통과에 적합한 물질을 사용할 수 있는데, 문헌에 기재된 인지질 또는 렉시틴 유도체 뿐만 아니라 리포좀, 미세입자 (마이크로스피어 및 마크로스피어 포함)를 포함할 수 있다.
비경구 투여용인 경우, 면역접합체 및/또는 세포독성 물질을 약제학적 담체에 용해시켜, 용액제 또는 현탁제로 투여할 수 있다. 적합한 담체의 예로는, 물, 염수, 포스페이트 완충 용액 (PBS), 덱스트로스 용액, 프럭토스 용액, 에탄올 또는 동물성 오일, 식물성 오일 또는 합성 오일이 있다. 또한, 담체는 다른 성분, 예컨대, 보존제, 현탁화제, 가용제, 완충제 등을 포함할 수 있다. 비-접합형 타겟팅 물질 및/또는 면역접합체 및/또는 세포독성 물질을 뇌실내 또는 강내 투여하는 경우, 이는 또한 뇌축수액에 용해시킬 수 있다.
개체에 투여되는 투여량은 개체 (인간 및 인간을 제외한 동물 포함)의 체표면적 당 양으로 명시할 수 있다. 투여량은 상기 개체에게 일정 양으로, 바람직하게는 비제한적인 예로서 약 5 mg/m2 - 약 300 mg/m2, 예로 약 10 mg/m2, 약 20 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 약 80 mg/m2, 약 100 mg/m2, 약 120 mg/m2, 약 140 mg/m2, 약 150 mg/m2, 약 160 mg/m2 내지 약 200 mg/m2으로 일반적으로 21일간 진행하는 (다회) 단회 투약 용법으로 투여할 수 있다. (반복적인) 다회 투약 용법에서, 총 용량을 일반적으로 21일간 진행되는 한 사이클 동안 개체에게 투여할 수 있으며, 총 용량은, 바람직하게는, 약 120 mg/m2 - 약 840 mg/m2, 예로, 약 120 mg/m2, 약 130 mg/m2, 약 140 mg/m2, 약 150 mg/m2, 약 180 mg/m2, 약 195 mg/m2, 약 240 mg/m2, 약 300 mg/m2, 약 360 mg/m2, 약 420 mg/m2, 약 450 mg/m2, 약 480 mg/m2, 600 mg/m2, 720 mg/m2, 약 840 mg/m2일 수 있으나, 이로 한정되는 것은 아니다. 총 용량은, 바람직하게는, 적어도 3번의 개별 투약으로서 투여되며, 투약은 등시적 투약일 수 있으며, 예컨대 예컨대 21일의 기간 동안 매주 1회, 바람직하게는 1, 8 및 15일에, 또는 비-등시적일 수 있다. 투여되는 개개 투여량은 약 3 x 40 mg/m2, 약 3 x 50 mg/m2, 약 3 x 60 mg/m2, 약 3 x 65 mg/m2, 약 3 x 80 mg/m2, 약 3 x 100 mg/m2, 약 3 x 120 mg/m2, 약 3 x 140 mg/m2, 약 3 x 150 mg/m2, 약 3 x 160 mg/m2, 3 x 200 mg/m2, 3 x 240 mg/m2, 약 3 x 280 mg/m2일 수 있다.
면역접합체는 한번에 또는 일련의 처리로 적절하게 투여된다. 다회 투약 용법에서, 이들 양은 매일 1회, 매주 1회, 2주에 1회로 투여할 수 있다. 1회 고투여량으로의 부하 용량 (loading dose), 또는 다른 예로, 짧은 간격으로 서로 투여한 다음 긴 간격으로 투여하는 저용량으로의 부하 용량이 본 발명의 바람직한 구현예이다. 예를 들어, 다회 투약 용법에서, 100 - 160 mg/m2의 임의 수준의 부하 용량을, 40 - 100 mg/m2의 1회 또는 2회의 후속 용량과 조합할 수 있다. 바람직한 구현예에서, 투약 시기는, 앞서 투여한 투여량이 실질적으로 대사되었지만, 개체 시스템에 존재하는 면역접합체의 양이, 종양 증식을 저해, 지연 및/또는 예방하도록, 2차 및/또는 임의의 후속적인 처리 전에 충분한 시간이 경과하게끔, 개체에 따라 조절된다. 예시적으로 "반복적인 다회 투약" 용법은 매주 1회로 면역접합체를 약 10, 20, 40, 50, 60, 65, 80, 100, 120, 140, 160, 180, 200, 220 또는 240 mg/m2 용량으로 투여하는 것이다. 다른 예로, 초기 고 용량 (high initial dose), 예컨대 160 mg/m2 후, 매주, 2주 또는 3주 마다 유지 용량, 예컨대 약 20 mg/m2을 투여할 수 있다. 다른 조합도 당해 기술 분야의 당업자라면 쉽게 정할 수 있다. 그러나, 다른 투약 용법들도 사용할 수 있다. 이러한 치료법의 진행은 공지 기법과 분석으로 쉽게 모니터링할 수 있다. 투여량은 예방 또는 치료 목적으로 투여되는지, 선행된 임의 요법의 코스, 환자의 임상 병력, 환자의 질병 상태, 환자의 종양 크기 (load), 환자의 유전적 기질, 환자의 수반 질환, 1차 처리시의 질환 상태 및 타겟팅 물질/면역접합체에 대한 반응, 환자가 겪는 부작용 및 주치의의 판단에 따라 변경될 수 있다.
면역접합체 용량 X가 다른 용량 Y를 상당히 초과한다고 하는 경우, 전체 (예, 총) 용량 X는 총 (예, 단회) 용량 Y를 적어도 10% (예, 용량 X가 100 mg/m2이면, 용량 X를 상당히 효과하는 용량 Y는 적어도 110 mg/m2임), 바람직하게는, 약 20%, 더 바람직하게는 약 30%, 40%, 50%, 60% 또는 심지어 그 이상으로 초과하는 것을 의미한다.
용어 개개 용량은, 특히 다회 투약 용법에서 사용되는 경우, 1회 투여시 투여되는 한정된 용량을 지칭하는데 사용되며, 예컨대 활성 치료 사이클에서 투여되는 총 용량과 대비될 수 있으며, 총 용량은 상기 치료 사이클 동안에 투여되는 개개 용량들의 합이다. 예를 들어, 21일간 지속되는 활성 치료 사이클에서 개개 용량 100 mg/m2 3회는, 총 용량 300 mg/m2이다.
환자의 체액, 예컨대 환자의 혈장, 혈청 또는 혈장내 면역접합체의 수준은 당해 기술 분야에 잘 알려진 방법으로 측정한다. 혈장 수준은 재료 및 방법에 기술된 바와 같이 여러가지 약동학적 (PK) 분석을 통해 평가할 수 있다. 혈청, 혈장 또는 그외 혈액 유래 체액내 면역접합체의 수준은 일반적으로 해당 투여를 각각 개시한 후 2-4시간에 측정하며, 투여는 바람직하게는 주입 형태이다. 이는, 일반적으로 투여, 특히 주입 완료 후 0-2시간에 해당된다.
본 발명은, 일 구현예에서, 유지 요법에 관한 것이다. 도 28에서 알 수 있는 바와 같이, 21일 마다 1회로 160 mg/m2을 이용한 장기 치료법은 안정한 질환 또는 심지어 마이너 반응을 성공적으로 달성하며, 적어도 무진행 생존을 달성한다. 또한 상기 도는, BT062의 혈장 농도가 경시적으로 증가하는 것을 도시하며, 이는 치료시 종양 크기 (tumor burden) 감소를 의미한다. 이러한 유형의 치료법은 반복적인 다회 투약 용법, 예컨대 매주 투여에 적합하다. 3주 마다 1회로 최대 160 mg/m2을 투여하는 전형적인 유지 치료법 다음으로 반복적인 다회 투약 용법 (3주간 매주 1회)이 수행될 수 있다. 종양 크기에 따라, 용량 감소를 적용할 수 있으며, 이로써, 예컨대 면역접합체 또는 기타 관련 파라미터의 혈장 수준을 유지 치료법의 적정 투약을 결정하는데 제공할 수 있다. 유지는, 개체에서 영구적으로 존재/유지되는 면역접합체의 역치 수준에 의해 달성되며, 그래서 이용가능한 면역접합체의 양은 일정하다. 바람직한 구현예에서, 개체에서의 종양 및/또는 타겟 세포는 계속적으로 면역접합체에 노출되어, 새로운 종양 세포는 증식될 수 없거나, 개체에서 면역접합체의 일정한 존재로 인해 신속하게 파괴되는데, 이는 개체의, 예컨대 혈장내 면역접합체의 특정 측정가능한 수준으로 반영된다.
유지 요법은, 바람직하게는, 투여 빈도를 낮춘다. 그러나, 특히, 예를 들어, 투여하는 면역접합체의 총 양 감소를 초래하는 다른 유지 요법들도 바람직하다. 유지 요법에 대한 구체적인 설계는, 특히 종양 크기에 따라 결정될 것이다. 면역접합체 수준 및/또는 M-단백질, FLC 또는 종양/암 특이 마커 등의 그외 효능 혈액 파라미터들을 개체 (환자)의 혈장, 혈청 및 뇨에서 측정할 수 있으며, 유지 용량과 투약 빈도는 효능 혈액 파라미터의 수준에 따라 또는 수준 변화에 따라 정할 수 있다. 이때 그리고 본 발명의 다른 맥락에서 사용될 수 있는 키트는 마커, 특히 면역접합체, 예컨대 면역접합체의 독소 부분에 대한 항체, 바람직하게는 표지된 항체를 포함하며, 이를 사용하여 개체의 체액에서 면역접합체를 정량할 수 있다. 예를 들어, 표지된 항체의 결합성으로부터 발생되는 신호는 개체의 체액에 존재하는 면역접합체의 양과 연관시킬 수 있다. 반복적인 다회 투약 및 반복적인 단회 투약의 경우, 적합한 개개 용량 수준은, 유지 요법의 경우, 예컨대, 60-160 mg/m2이다.
연장된 무치료 기간이 환자에게 유익할 수 있다. 놀랍게도, 연장된 휴지기 (400-421일) 이후에도, 질환이 여전히 안정적인 상태를 유지할 수 있는 것으로 확인되었다 (도 28 참조).
본 발명은, 일 구현예에서, 바람직하게는 빠른 혈장 소거 (rapid plasma clearance)를 수반한 투약 용법에 관한 것이다. 이 용법은, 일반적으로, 간격 (사이클)을 규정하는 적어도 연속적인 3주 동안 소정의 주에 약 280 mg/m2 이하, 120 mg/m2 이하, 100 mg/m2 이하, 80 mg/m2 이하, 예를 들어, 약 40 mg/m2 이하, 더 바람직하게는 약 20 mg/m2 이하, 보다 더 바람직하게는 약 10 mg/m2 이하를 제공한다. 10 mg/m2 - 280 mg/m2 범위는 평균 1일 용량 약 1.43 mg/m2 - 40 mg/m2에 해당된다. 즉, 평균 1일 용량 약 .4 mg/m2 - 약 17.14 mg/m2, 예로 약 5.7 mg/m2, 약 7.1 mg/m2, 8.58 mg/m2, 9.28 mg/m2, 11.4 mg/m2, 14.28 mg/m2, 17.1 mg/m2, 22.85 mg/m2, 25.7 mg/m2 (180 mg/m2), 28.58 mg/m2, 34.2 mg/m2, 40 mg/m2은 본 발명의 일부분이다. 최대 100 mg/m2의 저용량 투여 스케줄은 초기 제거 단계, 즉, 투여 중인 임의의 시점에서 투여를 종료한 지 최대 2시간까지의, 빠른 혈장 소거와 관련있다. 다른 저용량 용법과 상기 저용량 투약 용법을 구분하는 것은 빠른 혈장 소거이며, 이는 Cmax 측정치가 Cmax 이론치의 바람직하게는 55% 이하, 50% 이하, 40% 이하 또는 35% 이하인 기간으로 정의된다 (표 11).
투여 용법은, 보다 높은 수준에서, 보다 느린 빠른 혈장 소거를 수반하며, 즉, Cmax 이론치의 55%, 대게는 60%, 70%, 80% 또는 90% 이상의 혈장 소거를 수반하며, 이를 본원에서는 중등도 (Cmax 이론치의 50% 이상 내지 < 80%) 또는 느린 혈장 소거 (Cmax 이론치의 80% 이상)로 지칭한다. 이러한 소거에서, 놀랍게도, 혈장내 면역접합체의 상대적으로 높은 농도에도 불구하고, 이러한 투여 용법들이 여전히 DLT을 야기하지 않는다는 것을 확인하였다. CD138을 발현하는 비-타겟 세포, 예컨대 임의의 치료에 타겟이 아닌 상피와 같은 생명 유지에 중요한 장기의 세포 상에서의 CD138의 발현 수준도, 상대적으로 CD138에서 높음에도 불구하고, 그러하다 (CD138 항체인 BB4를 이용한 면역조직화학 분석에서, 상피에 대한 항체의 반응성이 MM 환자의 형질 세포와 매칭되는 것으로 나타남 (미국 특허 공개번호 20070183971)). 면역조직화학적 분석에서 동일한 스코어를 나타낸 (예, 상기 예에서와 같이 3+ (+++)), 타겟 세포와 비타겟 세포 상의 CD138의 발현 수준을 본원에서는 상응하는 발현 수준 (comparable expression level)이라고 지칭하며, 이는 본 발명의 일부이다. 다른 구현예에서, 타겟 세포 상에서의 발현 수준은 실제적으로 일관되게 상피에서의 수준 보다 낮았다 (예, +1(+), +2(++) vs. 상피의 경우 +3(+++)). 일부 종양 타겟 세포들은 혼성형 발현 수준, 예컨대, 일부 세포는 +2의 발현 수준을 보인 반면 일부는 +3의 발현 수준을 보였다. 샘플링 세포 수의 평균 (예, 100개의 임의 샘플링한 세포)은, 이들 대상 종양 타겟 세포가 상피와 상응하거나 또는 그보다 낮은 발현 수준이 기준에 해당되는 지를 결정할 것이다. 이러한 치료 용법들은, 통상적으로, 활성 치료 사이클로 규정되는 적어도 연속적인 3주 동안 매주 40 mg/m2 이상 내지 180 이하, 또는 심지어 280 mg/m2 이하이며, 이는 1일 용량 약 5.71 mg/m2 - 약 25.71 mg/m2 (180), 40 mg/m2 (280)에 해당된다.
8번 환자 (번호는 도 18 참조)와 관련하여, 이 환자는, 놀랍게도, 168일간의 전체 치료 기간을 이행하였으며, 그 동안 141일까지 FLC가 증가되었고, 질환은 진행되지 않았는데, 이는 BT0062 투여 효능을 보여주는 것이며, 6번 환자는 사이클 6회 동안 질환 진행이 관찰되지 않았다 (도 20).
도 19B는 추정컨대 주입하는 동안에 약 20 ㎍/ml으로 일정한 양이 소실됨을 명확하게 보여주다. 이는, 샘플에서 측정한 혈장 수준 (본원에서 Cmax로 정의됨)과 이론적으로 수득가능한 Cmax 값 간의 차이로부터 계산한 것이다. 표 11c에서, 주입을 끝내 후 0 내지 2시간 사이에 측정한 혈장 수준에서의 절대값을 나타내며, 이를 이론적으로 수득가능한 Cmax 혈장 수치와 비교하여 나타낸다 ("Cmax 이론치"는 하기 식으로 계산됨).
Cmax 이론치는 아래 추정 파라미터 (assumed parameter)에 따라 계산함:
환자의 체표면적 1.9 m2
환자 체중 70 Kg
환자의 혈장 부피 40 ml/kg
특정 구현예들에서, 본 발명은 또한 혈장 등의 체액에서 확인되는 효능 혈액 파라미터의 측정 수치에 따라 용량을 조절할 수 있는, 치료 용법에 관한 것이다. 이는, 환자 맞춤형 치료를 가능하게 한다. 예를 들어, BT062의 용량을 주입 등의 투여를 완료한 지 0 내지 4시간 사이에 측정한 혈장 수준에 따라 조정할 수 있다.
도 29에서 알 수 있는 바와 같이, 파라미터 M-단백질 (이의 수준 감소)은 환자의 질환 개선을 표시한다. 동시에, BT062의 혈장 수준 (Camx 수치)은 증가한다. 치료 사이클 횟수가 늘어남에 따라, 종양 하중은 감소되며, 동시에 BT062의 주입을 완료한 지 0-4시간 후 혈장에서 측정한 혈장 수준 ("Cmax 수치")은 증가하므로, M-단백질 수준과 Cmax 간에는 네거티브 상관성이 관찰되었다. Cmax 수치 증가는 종양 부피 감소로 설명될 수 있는데, 이는, 종양 세포가 적게 존재하는 것을 의미하며, M-단백질 수준 감소로 반영된다. 타겟 소스로서 CD138이 적을수록 BT062에 대한 결합 부위는 더 적어질 것이다. 따라서, BT062를 더 많이 혈장에서 검출할 수 있다. 즉, Cmax 수치를 이용하여 치료에 대한 반응을 평가할 수 있다 (Cmax 증가는 효능과 상관성이 있음). 만일, 임의 경우에, Cmax 수치가 이전 주입 시 (또는 효능이 없었던 임의 주입 시)의 Cmax와 비교해 증가, 예컨대 10, 20% 또는 그 이상 증가하는 경우, 이는, 종양에 결합 부위가 더 적게 존재하며, 그래서 종양의 크기가 감소되었음을 의미한다. 이러한 예에서, 용량을 다음 치료 사이클에서는 적게 조정할 수 있다. 이로써, 약물 필요량을 낮출 수 있으며, 독성을 예방할 수 있다.
반복적인 단회 투약은, 투여한 다음 투여하는 것이 앞선 투여와는 독립적으로 것으로 간주되는, 연속적인 투여를 의미한다. 즉, 본원에서, 개체의 혈중 면역접합체의 수준은 각 투여 후 동일한 것으로 간주할 수 있다. 면역접합체가 투여되는 각 시점에, 동량의 면역접합체가 처음에 혈액에 존재하는 것으로 예상한다.
반복적인 단회 투약에서 "단회 투약"의 투여 간격은 면역접합체의 이소형 BT062의 경우에, IgG4에 대해 이론적으로 계산된 반감기에 따라 정해진다.
일반적으로, 치료 항체의 반감기는 주로 항체 특징/이의 구조 특징 (예, Fc 수용체에 대한 결합성) 및 타겟에 의해 좌우된다. 예컨대, Fc 파트의 신생(neonatal) 수용체 FcRn에 대한 결합 친화성은 반감기에 영향을 미친다. 엔도좀내에서 FcRn에 결합함으로써, 항체는 리소좀 분해로부터 벗어나 재순환되어 반감기가 연장된다. IgG4의 경우, 반감기는 15.6 (+/- 4.5)일인 것으로 보고되었다 (Alyanakian et al., 2003; Salfeld et al., 2007). 본원에서 참조한 실험에서, "반복적인 단회 투약"은 3주의 간격으로 투여하는 것을 선택하였다. 그러나, 약 3주, 약 4주, 또한 약 5주 또는 약 6주도 반복적인 단회 투약에서 대체가능한 간격이다. "약"은 3주 문맥에서 +/- 96시간과, 4주 내지 6주 문맥에서 +/- 120 시간을 의미한다.
다회 투약 용법 또는 다회 투약은, 투여 후 투여가 선행되는 투여에 의존적인 것으로 간주되는, 일련의 투여를 지칭한다. 즉, 본 문맥에서, 개체의 혈중 면역접합체의 수준이 2차 및 이후의 투여에서 첫 투여 전에 존재하는 베이스 수준 보다 높을 것으로 예상한다. 면역접합체를 1차 투여한 이후의 각 투여시, 면역접합체의 일정 수준이 혈중에 존재하는 것으로 예상한다. 다회 투약의 개개 "투약들" 간의 투여 간격은, 반복적인 단회 투약에서와 같이, 면역접합체의 이소형, BT062의 경우 IgG4의 이론적으로 계산된 반감기에 따라, 정해진다.
IgG4의 경우, 반감기가 15.6 (+/- 4.5) 일인 것으로 보고되었다 (Alyanakian et al., 2003; Salfeld et al., 2007). 본원에 언급된 실험에서는, 1주일 간격으로 투여하는 "다회 투약"을 선택하였다. 하지만, 보다 짧은 투여 간격, 예컨대 4일 또는 심지어 3일도 선택할 수 있다. 다른 예로, 이보다 긴 간격도 선택할 수 있다. 그러나, 최소, 다회 투약은 21일의 기간 동안 2회 이상의 투여를 의미한다. "약"은 1주일 문맥에서 +/- 32시간, 4일 문맥에서 +/- 18시간, 그리고 3일 문맥에서 +/- 12시간을 의미한다. 반복적인 다회 투약은 간헐적인 휴지기(들) 또는 무치료 기간(들). 예컨대, 앞에 투여한 다회 투약(들)의 효능을 전부 없애지 않는, 연장된 휴지기(들) 또는 무치료 기간(들)을 포함할 수 있는, 후속 치료 사이클들에서 투여되는 다회 투약을 지칭한다.
1차 및 각각의 후속적인 투여를 수행한 이후의 면역접합체의 실제 수준은, 그러나, 투여 중 또는 투여 완료 후 즉각적으로, 특히 투여 완료 후 0-2시간내에, 예컨대 혈장으로부터의 면역접합체의 "소거" ("혈장 소거")에 사실상 의존한다. 40 mg/m2에서, 평균 주입 시간 (median infusion time)은 40분이며, 범위는 23분에서 1시간 30분이다. 120 mg/m2에서는, 평균 주입 시간은 2시간 2분이며, 범위는 1시간 40분에서 2시간 30분이다. 즉, IV 투여시, 특정 구현예들에서, 분당 평균적으로 약 1 mg/m2이 투여되며, 30초 당 약 1 mg/m2 - 120초 당 약 1 mg/m2 의 투여 시간들이 범위에 포함된다. 놀랍게도, BT062는 비슷한 면역접합체들에서 예상되는 이론적 수치 또는 경험하는 수치 보다 상당히 빨리 혈장에서 소거되는 것으로 확인되었다. 이러한 사실은, 단일요법으로서 단독으로, 그리고 효과적인 항암 조합을 제공하기 위해, 다른 관련 물질, 특히 세포독성 물질과 조합하는 면역접합체의 새로운 투약 용법의 설계를 가능하게 한다.
총 유효량은 투약 용법의 기간 동안에, 바람직하게는 동일한 용량으로, 예컨대 21일 투약 용법의 1일, 8일 및 15일, 또는 22일에는 투여하지 않는 28일 투약 용법의 1일, 8일 및 15일에서와 같이 3주간 주당 1회 투여되는 면역접합체의 유효량이다.
치료법의 진행은 공지의 기법 및 분석으로 쉽게 모니터링한다. 투여량은 특히 이것이 예방 또는 치료 목적으로 투여되는 것인지, 임의의 이전 치료법의 코스, 환자의 임상 병력, 환자의 질병 상태, 환자의 종양 크기, 환자의 유전적 소인, 환자의 수반 질환, 1차 치료시의 질환의 병기 및 타겟팅 물질/면역접합체에 대한 반응, 환자에서 나타난 부작용 및 주치의의 판단에 따라 변경할 수 있다.
저용량 용법의 이점은 매우 다양하다. 그러나, 가장 가능성있는 중대한 이점은 부작용 위험성의 최소화이다. 면역접합체는 일반적으로 타겟 세포와 정상 세포를 세심하게 구별할 수 있어, 대부분의 기존 화학치료 약물 보다 독성 부작용이 낮지만, 대다수의 면역접합체들은 여전히 부작용을 완벽하게 없애지 못하였다. 월등한 타겟팅에도 불구하고, 대상 항원은 일반적으로 치료 중에 파괴되어 부작용을 유발할 수 있는 비-암 세포 상에서도 발현된다. CD138의 경우, 항원은 특히 상피 세포 상에서 발현된다. 또한, 면역접합체는 타겟 세포에서 또는 내에서의 진행과 무관한 진행을 체내에서 이행할 수 있으며, 작동자 분자의 일정 비율은 타겟 세포로부터 멀리 떨어진 위치에서 방출되어 독성 부작용을 유도할 수 있다.
본 발명의 면역접합체는 저용량에서 유효하지만, 임상적으로 허용가능한 수준의 독성을 나타내는 것으로 확인되었다 (용량 최대 160 mg/m2을 3주에 1회로 제공함). 최대 적어도 120 mg/m2의 용량, 그러나 임의 경우에서는 160 mg/m2 보다 낮은 용량을 3주 당 1회 (예컨대 1일)로 제공하는 경우, 테스트한 면역접합체들은 인간 개체에서 빠른 혈장 소거를 나타내었다.
표 9와 표 10은 반복적인 단회 투약 요법에서 관찰한 소거 결과를 나타낸다.
| BT062 용량 (mg/m 2 ) | BT062 (㎍/ml)의 인간 혈장 농도 | ||
| Cmax 이론치 |
유효 Cmax
(1차 사이클) 평균 (최소; 최고) |
유효 Cmax (4차 사이클) 평균(최소; 최고) | |
| 10 | 7 | 1.11 | n.a. |
| 20 | 14 | 2.9 (1.66; 4.44) |
7.06 (6.79; 7.34) |
| 40 | 27 | 4.31 (0.97; 9.86) |
2.51 (1.02; 3.68) |
| 80 | 54 | 18.8 (13.4; 23.6) |
14.2 (7.4; 21) |
| 120 | 81 | 21.4 (15.1; 28.7) |
n.a. |
| 160 | 109 | 81.2 (73.7; 85.5) |
77.4 |
| 200 | 136 | 82.0 (68.0; 102.4) |
n.a. |
n.a. 데이타 입수 불가
표 9: 단회 투약/반복적인 단회 투약으로 BT062 (1차 사이클 및 4차 사이클)를 투여받은 환자에서 수득한 혈장에서의, 주입 완료 후 혈장 농도 및 BT062의 유효 Cmax 평균값. 반복적인 투약은 21일로 구성된 사이클로 투여함. Cmax 값은 주입 후 0시간 내지 2시간에 수득하였다. 투여 사이클: 1차 사이클: 1일, 2차 사이클: 22일; 3차 사이클: 43일, 4차 사이클: 64일 등.
| BT062 용량 (mg/m 2 ) | BT062 (㎍/ml)의 인간 혈장내 농도 | ||||
| Cmax 이론치 |
유효 Cmax
(1차 사이클) |
이론 Cmax (n)의 % |
유효 Cmax
(4차 사이클) |
이론 Cmax (n)의 % |
|
| 10 | 7 | 1.1 | 15% (3) | n.a. | n.a. |
| 20 | 14 | 2.9 | 20% (4) | 7.06 | 49% (2) |
| 40 | 27 | 4.31 | 16% (3) | 2.51 | 9% (3) |
| 80 | 54 | 18.8 | 34% (3) | 14.2 | 26% (2) |
| 120 | 81 | 21.4 | 26.5% (3) | n.a. | n.a. |
| 160 | 109 | 81.2 | 74.5% (4) | 77.4 | 71% (1) |
| 200 | 136 | 82.0 | 60% (3) | n.a. | n.a |
n.a. 데이타 입수 불가
n: 환자의 수
표 10: 단회 투약/반복적인 단회 투약으로 BT062 (1차 사이클 및 4차 사이클)를 투여받은 환자에서 수득한 혈장에서의, BT062의 유효 Cmax 평균값. 반복적인 투약은 21일로 구성된 사이클로 투여함. 최고값은 주입 후 첫 2시간 이내에 수득되었다. Cmax 값은 주입 후 0시간 내지 2시간에 수득하였다. 유효 Cmax는 이론적으로 계산한 Camx의 %이다. 투여 사이클: 1차 사이클: 1일, 2차 사이클: 22일; 3차 사이클: 43일, 4차 사이클: 64일 등.
Cmax 이론치는 전술한 바와 같이 계산하였다.
처리한 인간 개체의 혈장에서의 BT062의 반감기가 시노몰구스 원숭이(수일) 및 인간 혈장 생체외 (14)에서 관찰되는 혈장 반감기 보다 현저하게 짧음에도 불구하고, 본 면역접합체는 심지어 20 mg/m2으로 저용량으로 투여한 경우에도 효능을 여전히 나타내었으며, 이는, 종양 타겟팅 및 종양 세포 결합성이 가속화되어, 효능이 증가되었음을 시사해준다.
가속화된 종양 타겟팅은 다발성 골수종 환자들의 골수에서 다발송 골수종 세포의 수용체 (CD138) 점유율을 측정하여 검증할 수 있다. 표 11e에서 볼 수 있는 바와 같이, 여러가지 반복적인 다회 투약 용법에서, 골수내 종양 부위에 대한 수용체 점유율은 면역접합체를 투여 완료한지 4시간 이내에 100%에 가까웠으며, 이는 항체 매개의 가속화된 종양 타겟팅을 뒷받침해준다. 즉, 본 발명은, 타겟 조직 수용체 (CD138)에 대한 조기, 즉, 투여 완료 후 0-12, 0-10, 0-8, 0-6 또는 0-4시간내의 점유율이 70-100%, 바람직하게는 80-100%, 더 바람직하게는 90-100%, 보다 더 바람직하게는 94, 95, 96, 97 또는 98%인 "수용체 점유성" (RO)를 나타내는 면역접합체에 관한 것이다. "수용체는" 여기에서 CD138이며, RO는 하기 식으로 정해진다:
RO= (MFI 샘플 1 - MFI 샘플 3) / (MFI 샘플 2 - MFI 샘플 3)
MFI = 유세포 측정으로 측정한 평균 형광 세기
골수 천자액내 골수종 세포의 샘플들.
샘플 1: 결합된 면역접합체, 여기서 BT062를 항-May(May = 메이탄시노이드) 항체로 염색함.
샘플 2: 총 cD138은 면역접합체로 수용체를 포화한 후 항-May 항체를 이용하여 측정하였음.
샘플 3: IgG1 이소형 항체와 인큐베이션하여 측정한 비특이 결합
전술한 바와 같이, 처리한 MM 환자의 혈장으로부터 특이적으로 빠른 소거가 초기 제거 단계 (이미 주입하는 동안에, 그리고 주입 후 약 0-2시간, 주입 완료)에서 관찰되었으며, 일반적으로 용량 수준 최대 120 mg/m2에서 정상적인 말기 소거 단계가 이어졌으나, 160 mg/m2 및 200 mg/m2 용량 (환자 3명)에서는, 4명의 환자들 모두에서, 소거가 여전히 Cmax 이론치 보다는 낮지만, 보다 전형적인 소거 프로파일이 관찰되었다. 아울러, 초기 제거 단계에서 빠른 혈장 소거가 확인된 투여 용법들 (예, 20, 40, 80 및 120 mg/m2)에서는, 초기 소거 단계에서 빠른 혈장 소거만 관찰된 것은 아니였으며, 반복적인 단회 투약 후 뇨내 M-단백질의 50% 이상 감소로 나타난 반응 (결과는 도시하지 않음) 등의, 반응 (뇨 M-단백질의 감소)이 관찰되었다.
전술한 바와 같이, 데이타는, 초기 제거 단계에서 관찰되는 처리한 MM 환자의 혈장으로부터 빠른 소거는 타겟 세포에서의 높은 수용체 점유성과 관련있을 수 있다는 점을 뒷받침해준다.
놀랍게도, 다회 투약 용법에서, 빠른 혈장 소거는, 반복적인 단회 투약 용법에서 결정된 DLT 160 mg/m2에 실제 가까우며 120 mg/m2 보다 충분히 높은 수준이었던 총 용량에서 발생한다는 것을 확인하였으며, 이는 다회 투약 용법에서는 면역접합체의 독성이 낮기 때문에 강력한 단일요법 또는 조합 요법의 가능성을 열어준다.
표 11a는 3주간 (21일) 지속된 매우 다른 용량으로 투여한 후, 즉 다회 투약 용법 후 Cmax 이론치에 대한 %를 나타낸다. 65 mg/m2 코호트에서 Camx 이론치에 대한 %는 하기 나타낸 보다 저용량 코호트들에서 보다 높다.
| 40 mg/m2 | 50 mg/m2 | 65 mg/m2 | 80 mg/m2 | 100 mg/m2 | 120mg/m2 | |
| C1, D1 | 29% | 24% | 43% | 42% | 61% | 69% |
| C1, D8 | 39% | 29% | 63% | 42% | 81% | 74% |
| C1, D15 | 43% | 31% | 72% | 44% | 89% | 79% |
| C2, D1 | 33% | 26% | 52% | 45% | 94% | 62% |
| C2, D8 | 37% | 40% | 61% | 50% | 102% | 67% |
| C2, D15 | 41% | 35% | 52% | 43% | 111% | 67% |
| C3, D1 | 28% | 30% | 52% | 39% | 109% | |
| C3, D8 | 30% | 29% | 71% | 53% | 121% | |
| C3, D15 | 26% | 35% | 73% | 41% | 142% | |
| C4, D1 | 24% | 24% | 125% | |||
| C4, D8 | 30% | 45% | 123% | |||
| C4, D15 | 35% | 42% | 135% | |||
| 평균 (%) | 33% | 33% | 60% | 44% | 108% | 69% |
| 표준 편차 | 6% | 7% | 11% | 4% | 24% | 6% |
표 11a: Camx 이론치에 대한 %: CX는 사이클의 횟수이며: C1은 1차 사이클이며, 각 사이클은 21일간 지속되며, 그 후 무치료 기간 1주일 (또는 각 사이클은 22일에 투여하지 않는 28일로 간주됨)이 이행된다. DX는 사이클에서 면역접합체를 투여한 일이며; D8는 사이클의 8일째이다. Cmax 이론치에 대한 %는 상기 기술된 바와 같이 계산하였다. 100 mg/m2에서의 높은 표준 편차와 120 mg/m2에서의 상대적으로 낮은 Cmax %는 100 mg/m2에서의 높은 %들이 일탈 (deviation)임을 의미한다.
| Cmax 이론치 대비 부족 농도 [ mg/m 2 ] | ||||||
| 40 mg/m2 | 50 mg/m2 | 65 mg/m2 | 80 mg/m2 | 100 mg/m2 | 120 mg/m2 | |
| C1, D1 | 19,3 | 25,7 | 24,9 | 31,5 | 26,5 | 25,4 |
| C1, D8 | 16,4 | 24,2 | 16,3 | 31,4 | 13,0 | 21,6 |
| C1, D15 | 15,5 | 23,5 | 12,2 | 30,5 | 7,2 | 17,5 |
| C2, D1 | 18,2 | 24,9 | 21,2 | 29,7 | 4,3 | 31,2 |
| C2, D8 | 16,9 | 20,3 | 17,3 | 27,0 | -1,5 | 26,6 |
| C2, D15 | 16,0 | 21,9 | 21,2 | 31,0 | -7,7 | 26,8 |
| C3, D1 | 19,4 | 23,8 | 21,3 | 33,0 | -6,0 | |
| C3, D8 | 19,1 | 24,2 | 12,8 | 25,8 | -14,4 | |
| C3, D15 | 19,9 | 21,9 | 11,7 | 32,1 | -28,4 | |
| C4, D1 | 20,6 | 25,8 | -17,1 | |||
| C4, D8 | 19,0 | 18,8 | -15,8 | |||
| C4, D15 | 17,7 | 19,7 | -24,1 | |||
| 평균 | 18.6 | 23.0 | 17.7 | 29.9 | 6.8 | |
| SD | 1.5 | 2.4 | 4.7 | 1.0 | 13.2 | |
표 11b
| 사이클 당 Camx 이론치에서 부족한 평균 농도 | ||||||
| 40 mg/m2 | 50 mg/m2 | 65 mg/m2 | 80 mg/m2 | 100 mg/m2 | 120 mg/m2 | |
| C1, D1 | 17,1 | 24,5 | 17,8 | 31,1 | 15,6 | 21,5 |
| C1, D8 | ||||||
| C1, D15 | ||||||
| C2, D1 | 17,0 | 22,4 | 19,9 | 29,2 | -1,7 | 28,2 |
| C2, D8 | ||||||
| C2, D15 | ||||||
| C3, D1 | 19,5 | 23,3 | 15,3 | 30,3 | -16,3 | |
| C3, D8 | ||||||
| C3, D15 | ||||||
| C4, D1 | 19,1 | 21,4 | -19,0 | |||
| C4, D8 | ||||||
| C4, D15 | ||||||
표 11c
표 11b 및 11c: CX는 사이클의 횟수이며: C1은 1차 사이클이며, 각 사이클은 21일간 지속되며, 그 후 무치료 기간 1주일 (또는 각 사이클은 22일에 투여하지 않는 28일로 간주됨)이 이행된다. DX는 사이클에서 면역접합체를 투여한 일이며; D8는 사이클의 8일째이다. 11b에는, 절대적인 관점에서, 실제 Cmax를 기초로, Camx 이론치에 도달하기 위해 각 용량 수준에서 부족한 농도 (mg/m2)들을 나타낸다. 11c에서, 투여 당 실제 번호(actual number)들을 나타내며, 우측에는 각 사이클에서의 평균 농도를 나타낸다. 또한, 한번의 사이클에서의 평균 농도 (11c)와 3번의 사이클들의 평균 농도가 비슷하며 일정하다는 것이 주목할 수 있다. 100 mg/m2에서 편차와는 별도로, 부족한 농도 (missing concentration)도 상대적으로 일정하게 유지된다.
| 용량 (mg/m2) | 시간 (일) | 환자 | 혈장 수준/평균(㎍/ml) | SD (㎍/ml) |
| 40 | 투여 전 | 4 | 0 | 0 |
| 40 | 0 (투여일), 2(투여 종료 후 시간) | 4 | 7,78 | 2,23 |
| 40 | 다음번 투약 전 | 4 | 0,69 | 0,33 |
| 40 | 7,2 | 4 | 10,67 | 4,93 |
| 40 | 다음번 투약 전 | 4 | 0,63 | 0,55 |
| 40 | 14,2 | 4 | 11,61 | 5,50 |
| 40 | 다음번 투약 전 | 4 | 0,70 | 0,62 |
| 50 | 투여 전 | 3 | 0 | 0 |
| 50 | 0,2 | 3 | 8,20 | 0,90 |
| 50 | 다음번 투약 전 | 3 | 0,45 | 0,46 |
| 50 | 7,2 | 3 | 9,70 | 3,58 |
| 50 | 다음번 투약 전 | 3 | 0,49 | 0,45 |
| 50 | 14,2 | 3 | 10,43 | 3,47 |
| 50 | 다음번 투약 전 | 2 | 0,38 | 0,53 |
| 65 | 투여 전 | 4 | 0 | 0 |
| 65 | 0,2 | 4 | 19,18 | 8,43 |
| 65 | 다음번 투약 전 | 4 | 1,41 | 0,66 |
| 65 | 7,2 | 4 | 27,83 | 8,95 |
| 65 | 다음번 투약 전 | 4 | 1,63 | 0,66 |
| 65 | 14,2 | 4 | 31,94 | 18,12 |
| 65 | 다음번 투약 전 | 4 | 1,77 | 0,93 |
| 80 | 투여 전 | 3 | 0 | 0 |
| 80 | 0,2 | 3 | 22,81 | 3,20 |
| 80 | 다음번 투약 전 | 3 | 1,30 | 0,53 |
| 80 | 7,2 | 3 | 22,91 | 6,37 |
| 80 | 다음번 투약 전 | 3 | 1,27 | 0,68 |
| 80 | 14,2 | 3 | 23,81 | 6,46 |
| 80 | 다음번 투약 전 | 3 | 1,41 | 0,70 |
| 100 | 투여 전 | 4 | 0 | 0 |
| 100 | 0,2 | 4 | 41,40 | 23,02 |
| 100 | 다음번 투약 전 | 3 | 3,77 | 0,78 |
| 100 | 7,2 | 3 | 54,85 | 24,34 |
| 100 | 다음번 투약 전 | 3 | 4,13 | 1,82 |
| 100 | 14,2 | 3 | 60,70 | 29,81 |
| 100 | 다음번 투약 전 | 3 | 6,04 | 2,63 |
| 120 | 투여 전 | 2 | 0 | 0 |
| 120 | 0,2 | 2 | 56,00 | 32,46 |
| 120 | 다음번 투약 전 | 2 | 2,35 | 2,74 |
| 120 | 7,2 | 2 | 59,85 | 30,96 |
| 120 | 다음번 투약 전 | 2 | 2,50 | 6,68 |
| 120 | 14,2 | 2 | 63,90 | 28,82 |
| 120 | 다음번 투약 전 | 2 | 3,05 | 10,42 |
표 11d는 매주 투여 전과 투여 후 40 - 120 mg/m2의 용량 수준들에서의 면역접합체의 평균 혈장 수준 (㎍/ml)을 나타낸다. 다음번 투여 전 ("다음번 투약 전") 평균 혈장 수준이 약간 증가하기 시작한다. 65 및 80 mg/m2에서, 다음번 투여 전 혈장 수준은 1 ㎍/ml 보다 높게 유지되었다. 100 및 120 mg/m2에서는, 다음번 투여 전 수준은 약 2 - 4 ㎍/ml이며, 즉, 이후의 치료제의 혈장 수준은 1차 사이클에서 보다 다소 높았으며, 이는 다음번 주사 전에 약간 축적됨을 의미하는 것이다.
| 환자 ID | 매주 용량 수준 (mg/m 2 ) | 사이클 회차 | 수용체 점유율 (RO) |
| 12 | 80 | C8D15* | 99 % |
| 12 | 80 | C13D15** | 37 % |
| 12 | 80 | C14D15** | 51 % |
| 22 | 140 | C1D1* | 86 % |
| 23 | 140 | C1D1* | 백그라운드 - 높음 |
| 26 | 140 | C1D1* | 95 % |
| 28 | 140 | C1D8** | 58% |
| 24 | 140 | C1D1* | 94 % |
| 25 | 140 | C1D1* | 98 % |
| 30 | 160 | C1D1* | 98 % |
| 31 | 160 | C1D1* | 76 % |
표 12: 반복적인 다회 투약 용법에서의 수용체 점유율 (RO): 골수 수용체 점유율은 유세포 측정으로 측정하였다. 골수 천자물에서 골수 세포를 CD138 및 CD38로 염색하여 파악하였다 (도시 안 함). 결합된 BT062는 항-May 항체 (샘플 1)로 염색하였다. 총 CD138은 수용체를 BT062로 포화시킨 다음 항-May 항체로 측정하였다 (샘플 2). 샘플에 대한 비특이 결합은 IgG1 이소형 항체와 인큐베이션하여 측정하였다 (샘플 3). CD138 점유율은 하기 식으로 계산하였다.
RO= (MFI 샘플 1 - MFI 샘플 3) / (MFI 샘플 2 - MFI 샘플 3)
MFI = 평균 형광 세기
각 사이클은 28일간 지속되며, 1, 8 및 15일에 지정된 용량을 투여한다. C13D15는, 예를 들어, 13차 사이클에서 15일에 용량을 투여하는 것을 의미한다. 상기 3가지 항목에서, 측정은 다음번 투여하기 직전 (12시간 이내)에 취한 즉, 마지막 투여 후 6일이 지난 이후에 취한 샘플을 토대로 하며, 별표 2개 (**)로 표시한다. 나머지 측정들은 BT062를 투여한 후 바로, 여기에서는 투여를 종료한 지 4, 12 또는 24시간 이내에 행한다 (*). 알 수 있는 바와 같이, RO는 다음번 투여 직전에는 상대적으로 낮았지만, 투여 한 직후에는 높았다.
도 13은 40 mg/m2 - 120 mg/m2 범위로 단회 투여 시 빠른 혈장 소거가 이루어지지만, 이보다 높은 용량에서는, 160 mg/m2 용량으로 예시한 바와 같이 이론적 수치에 가까운 혈장 소거를 나타냄을 도시한다. 도 17은, 빠른 혈장 소거가 가용성 CD138에 의해 유발되는 완충 효과가 원인일 수 없음을 명확하게 보여준다. 도 14는 Cmax 이론치와 비교하여 BT062의 Cmax 측정치를 보여준다.
도 19A 및 표 11a는 다회 투약을 포함하는 투여 스케줄에서의 빠른 혈장 소거를 보여준다. 1, 8 및 15일에 투여하며, 한 사이클 (예, 21)에서 합하면 면역접합체의 반복적인 단회 투약의 DLT에 해당되는 정도의 용량이 되는 (3x50 mg/m2= 150 mg/m2,, vs. 160 mg/m2) 개개 용량들을 포함하는 스케줄에서 알 수 있는 바와 같이, Cmax의 실제 값은 Cmax 이론치의 50% 미만이었으며, 반복적인 단회 투약에서의 DLT에서는 Cmax 실제 값이 Cmax 이론치의 50%를 상회한다.
표 11b는, Cmax 실제 값이 평균적으로 Cmax 이론치의 50%를 이미 초과하는 농도에서, Cmax 이론치에서 부족한 농도가 평균적으로 제공된 실시예들에서, 즉 약 20 ㎍/ml에서 비슷하게 유지됨을 나타낸다 (도 19B도 참조함). 이는, 면역접합체의 특정 부분을 빠르게 "흡수/흡착하는" "싱크"를 나타내는 것일 수 있지만, 용량을 높임에 따라 거의 구별되지 않게 된다. 실제, 100 mg/m2에서는, 이러한 효과는 첫번째 개개 용량을 투여하는 중에만 나타난다. 그러나, 이것은 120 mg/m2에서 재결합하여, 100 mg/m2이 일탈일 가능성을 보여준다. 그러나, 20 ㎍/ml의 싱크는 고차 사이클에서도 관찰된다.
이에, 본 발명은 타겟팅 물질, 바람직하게는, 독성이며 일반적으로 값비싼 작동자 분자를 포함하는 면역접합체 대신, 이 싱크에 공급되는 비-접합형 항체를 이용한 전처리 방법에 관한 것이다. 당해 기술 분야의 당업자들이 이해하는 바와 같이, 싱크는 종양 타겟 세포 뿐만 아니라 다른 조직의 CD138 발현 세포를 포함할 수 있다. 따라서, 본 발명의 일 측면에서, 면역접합체의 일정량 +/-20 ㎍/ml이 주입 직 후 또는 주입 중에 Cmax 이론치에 도달하는데 일관적으로 부족하므로 (도 19B), 상기 싱크 (또한, 본원에서는 "항원 싱크"라고도 함)에 결합에 의해 빠르게 흡착/흡수되는 것으로 간주한다. 이러한 싱크는 상기한 구현예에서 면역접합체에 의해 충진되지 않고, 다른 물질, 바람직하게는 CD138에 결합하는 물질로 충진시킨다. 이러한 구현예에서, 투여 중/ 투여 후에 흡수/흡착되는 면역접합체 보다는, 대안적인 흡수/흡착제, 예컨대, 비-접합형 항체를 투여한다. 면역접합체가 싱크에서 유실되고, 따라서 치료학적 효과에 기여하지 못할 가능성을 가정하면, a) "싱크"과 관련있을 수 있는 독성을 최소화하고, b) 등가의 결과를 달성하기 위해 면역접합체의 필요량을 낮추기 위해, 전처리를 이용할 수 있다.
이러한 전처리는, 비-접합형 항-CD138 항체 또는 이의 단편, 바람직하게는 nBT062를 20 ㎍/ml (+/-) 투여하는 것으로 구성될 수 있으며, 이러한 싱크를 채운다.
다른 면역접합체의 투여 스케줄과 비교하여, 저용량으로 구성된 160 mg/m2의 반복적인 단회 투약에서, 말기 소거 프로파일은 정상에 가까우며, 즉 Cmax 이론치에 가깝다. 그러나, 혈청내 FLC의 빠른 감소는 단지 1회 투여한 후에 관찰할 수 있었으며, 2차, 3차 및 4차 투여 후 부분 반응으로 나타났다 (도 26).
유사체 및 유도체
세포독성 물질 등의 치료제 분야의 당업자는, 본원에 기술된 물질들이 출발 화합물의 특이성 및/또는 활성이 제조되는 화합물에서도 여전히 유지되는 방식으로 변형할 수 있음은, 쉽게 이해할 것이다. 또한, 당업자는, 이들 화합물들 대부분이 본원에 기술되 치료제 대신 사용할 수 있다는 것을 이해할 것이다. 따라서, 본 발명의 치료제는 본원에 기술되 화합물의 유사체 및 유도체를 포함한다.
면역접합체의 사용에 대한 예시를 위해, 일부 비제한적인 용도를 이제 제공하며 예시한다.
재료 및 방법
키메라 항체의 제조(cB-B4: nBT062)
B-B4
기존에 특정화된 뮤라인 항체 B-B4 (Wijdenes et al., Br J Haematol., 94 (1996), 318)를 본 실험에 사용하였다.
B-B4 및 cB-B4 / nBT062의 클로닝 및 발현
표준적인 재조합 DNA 기법들은 텍스트북, 예컨대 J. Sambrook; Molecular Cloning, A Laboratory Manual; 2nd Ed. (1989), Cold Spring Harbor Laboratory Press, USA에 상세하게 기술되거나 또는 키트를 사용하는 경우에는 제조사의 지침서에 권고된 바와 같이 수행하였다. 마우스 가변 영역의 PCR-클로닝과 수정은 표준 PCR 방법으로 수행하였다. 프라이머는 각 사용 결과 섹션에 나타내었다.
cB-B4 / nBT062의 발현
10% FCS, 580 ㎍/ml L-글루타민, 50 Units/ml 페니실린 및 50 ㎍/ml 스트렙토마이신이 보충된 DMEM 배지에서 배양한, 기하급수적으로 증식 중인 COS 세포를 트립신 처리 및 원심분리에 의해 수확하고, PBS로 헹구었다. 세포를 최종 농도 1x107 cells/ml로 PBS에 재현탁하였다. COS 세포 현탁액 700 ㎕를 Gene Pulser 큐벳에 옮기고, 중쇄 및 카파 경쇄 발현 벡터 DNA(각각 10 ㎍ 또는 슈퍼벡터 13 ㎍)와 혼합하였다. 세포에 Bio-Rad Gene Pulser를 이용하여 1900 V 및 25 μF로 전기충격을 가하였다. 형질전환된 세포를, 10% 감마-글루불린 무첨가 FBS, 580 ㎍/ml L-글루타민, 50 Units/ml 페니실린 및 50 ㎍/ml 스트렙토마이신이 첨가된 DMEM에서 72시간 배양한 후, 항체가 함유된 세포 배양 상층액을 회수하였다.
cB-B4 / nBT062의 발현 수준을 측정하기 위한 포착 ELISA
PBS로 희석한 0.4 ㎍/ml 염소 항-인간 IgG 항체 100 ㎕으로, 96 웰 플레이트를 피복하였다 (4℃, 밤새). 플레이트를 200 ㎕/well 세정 완충액 (PBS+0.1% Tween-20)으로 3번 세정하였다. 그런 후, 웰을 PBS 중의 0.2% BSA, 0.02% Tween-20로 블록킹하고, 분비된 항체가 함유된 세포배양 상층액 200 ㎕을 첨가하였다 (37℃에서 1시간 인큐베이션). 웰을 세정 완충액으로 6번 세정한 후, 염소 항-인간 카파 경쇄 퍼옥시다제 접합체를 이용하여 결합된 항체를 검출하였다.
세포 배양 상층액에서의 cB-B4 / nBT062의 정제
Protein A ImmunoPure Plus kit (Pierce, Rockford, IL)를 제조사의 권고안에 따라 사용하여, 형질전환된 CDS 7 세포의 상층액으로부터 cB-B4 항체를 정제하였다.
cB-B4 결합 및 경쟁적 분석
CD138에 대한 B-B4 및 cB-B4의 결합 활성 분석은, 결과 섹션에 기술된 변화를 고려하여 Diaclone (Besancon, France) sCD138 키트를 제조사의 권고안에 따라 사용하여 수행하였다.
RNA 준비 및 cDNA 합성
하이브리도마 B-B4 세포를 배양하고, Qiagen Midi 키트(Hilden, Germany)로 처리하여 제조사의 프로토콜에 따라 RNA를 분리하였다. 아머샴 바이오사이언스(Piscataway, NJ)의 제1 가닥 합성 키트를 제조사의 프로토콜에 따라 사용하여, 약 5 ㎍의 B-B4 RNA로부터 역전사를 수행하여, B-B4 cDNA를 합성하였다.
B-B4 면역글로불린 cDNA 클로닝
면역글로불린 중쇄(IgH) cDNA를, IgH 프라이머 MHV7 (5'-ATGG-GCATC-AAGATGG-AGTCA-CAGA-CCC-AGG-3') [서열번호 3] 및 IgG1 불변 영역 프라이머 MHCG1 (5'-CAG-TGGATA-GACAGAT-GGG-GG-3') [서열번호 4]를 이용하여 PCR로 증폭하였다. 마찬가지로, 면역글로불린 경쇄(IgL)를, 3가지 다른 Igκ 프라이머들 MKV2 (5'-ATG-GAGACA-GACA-CACTC-CTGC-TATGGG-TG-3') [서열번호 5], MKV4 (5'-ATG-AGGGCCC-CTGCTCA-GTTTTTT-GGCT-TCTTG-3') [서열번호 6] 및 MKV9 (5'-ATGG-TATCCAC-ACCTCA-GTTC-CTTG-3') [서열번호 7]를 각각 프라이머 MKC (5'-ACTG-GATGGTGGGA-AGATGG-3') [서열번호 8]과 조합 사용하여, 증폭하였다. 모든 증폭 산물들을 TOPO-TA 클로닝 키트(Invitrogen, Carlsbad, CA)를 제조사의 지침에 따라 사용하여, pCR2.1-TOPO 벡터에 직접 삽입하였다.
상기 연결한 pCR2.1 벡터 구조체로 형질전환된 E. coli TOP10 박테리아(Invitrogen)를 LB-암피실린-Xgal 아가 플레이트에서 선별하였다. 하나의 백색 콜로니로 소규모 배양을 수행하고, 밤새 배양한 다음, QIAprep Spin Miniprep 키트를 제조사의 지침에 따라 사용하여 플라스미드를 분리하였다.
cDNA 서열 결정
BigDye 터미네이션 v3.0 사이클 시퀀싱 레디 반응 키트(ABI, Foster City, CA)를 이용하여 플라스미드의 서열을 분석하였다. 각 선별한 플라스미드는 GeneAmp9600 PCR 장치에서 프라이머 1210 및 1233을 이용한 사이클링을 수행하여, 양쪽 방향으로 서열 분석을 수행하였다. 전기영동 서열 분석을 ABI 캐필러리 시퀀서에서 수행하였다.
RT-PCR의 전체 사이클, 클로닝 및 DNA 서열 분석을 반복 실시하여, 각 면역글로불린 쇄에 대한 3가지의 완전히 독립적인 서열 정보 세트를 수득하였다.
B-B4 Vκ DNA 서열
제1 가닥 합성을 3번의 독립적인 반응으로 수행하였다. 프라이머 MKC 및 MKV2(서열은 상기에 나타냄)로 제조한 PCR 산물을 제조사의 지침에 따라 pCR2.1-TOPO 벡터에 삽입하였다. 각각의 독립적인 RT-PCR 반응으로부터 수득한 클론을 양방향으로 서열분석하였다. MKV2-프라이머로 제조한 산물의 서열이, MOPC-21, SP2 및 Ag8 (Carroll et al., Mol Immunol., 25 (1988), 991; Cabilly et al., Gene, 40 (1985); 157)과 같은 골수종 융합 파트너로부터 기원하는 스테릴(sterile) 카파 전사체와 매우 비슷하였고, 그래서 이를 무시하였다.
MKV4 및 MKV9 프라이머를 MKC와 함께 사용한 PCR 산물들은 서로 비슷하였지만, 리더 서열 프라이머 내부의 워블(wobble) 위치만 달랐다.
B-B4 VH DNA 서열
3번의 독립적인 반응으로 제1 가닥을 합성하였고, PCR 산물을 클로닝하고, 각각의 제1 가닥 산물의 서열을 분석하였다. 5개의 클론들에서, 각각의 제1 가닥을 서열분석하였다.
키메라 cB-B4 발현 벡터의 구축
키메라 발현 벡터의 구축에는, BamHI 제한효소 부위 및 Kozak 서열이 선행되는, VH 및 Vκ에 적합한 리더 서열의 부가를 수반한다. Kozak 컨센서스 서열(consensus sequence)은 가변 영역 서열의 효율적인 번역을 위해 중요하다. 이것은 리보솜이 번역을 시작할 수 있는 정확한 AUG 코돈을 명시하고 있으며, 대부분의 중요한 하나의 염기는 AUG 시작에서 상류 -3 위치에 있는 아데닌(또는 드물게는 구아닌)이다. 리더 서열은 Kabat 데이타베이스(Kabat et al., NIH National Technical Information Service, 1991)에서 가장 비슷한 서열로 선택한다. 이러한 부가 서열은, 정방향(For) 프라이머들 (둘다 5'-AG-AGAAG-CTTGC-CGCCACC-AT-GAT-T-GCCTCTG-CTCAGTT-CCTTGGT-CTCC-3' [서열번호 9] 서열을 가짐; 제한효소 부위는 밑줄친 부분이고, Kozak 서열은 굵은 체로 표시됨) 내부에 코딩되어 있다. 또한, 키메라 발현 벡터의 구축에는, B-B4의 J 영역의 3' 말단과 인접하는, 최대 천연 ApaI 제한효소 부위까지, 인간 감마 불변 영역의 5' 단편 도입을 포함하며, 경쇄의 경우에는, 스플라이스 공여부와 HindIII 부위의 부가를 포함한다. 상기 스플라이스 공여부의 서열은 적절한 불변 영역에 가변 영역을 인-프래임으로 정확하게 부착하고, 따라서 V:C 인트론을 스플라이싱하는데 중요하다. 카파 인트론 + CK는 발현 구조체에서 B-B4 Vκ 서열의 하류에 코딩된다. 마찬가지로, 감마-4 CH는 발현 구조체에서 B-B4 VH 서열의 하류에 코딩된다.
B-B4 VH 및 Vκ 유전자들을 먼저 조심스럽게 분석하여, 임의의 원하지 않는 스플라이스 공여 부위, 스플라이스 수여 부위 (splice acceptor), Kozak 서열과 기능성 전체 항체의 서브클로닝 및/또는 발현을 나중에 방해하게 되는 임의의 기타 서브-클로닝 제한효소 부위의 존재를 확인하였다. Vκ 서열에서 원하지 않는 HindIII 부위가 발견되었으며, 이는 아미노산 서열에 변화를 주지 않으면서 PCR을 통한 부위-특이적인 돌연변이에 의해 반드시 제거하였다. 이를 위해, 올리고뉴클레오티드 프라이머들 BT03 (5'-CAACA-GTA-TAGTA-AGCTC-CCTC-GGACG-TTCG-GTGG-3') [서열번호 10] 및 BT04 (5'-CC-ACC-GAACG-TCCGA-GGGAGC-TTACT-ATACTG-TTG-3') [서열번호 11]를 사용하였고, Stratagene (La Jolla, CA)의 Quickchange Mutagenesis Kit 프로토콜에 따라 돌연변이 유발을 수행하였다.
카파 쇄 키메라 제조용 프라이머
PCR 프라이머 서열과 독립적인, 명백한 B-B4 Vκ 리더 서열을 Kabat 데이타베이스에서 뮤라인 리더 서열과 정렬하였다. B-B4 VH 리더와 매칭율이 가장 높은 것은 VK-10 ARS-A (Sanz et al., PNAS, 84 (1987), 1085)이었다. 이 리더 서열은 시그널P 알고리즘에 의해 정확하게 절단되는 것으로 추정된다 (Nielsen et al., Protein Eng, 10 (1997); 1). 프라이머 CBB4Kfor (상기에 언급됨) 및 g2258(5'-CGCG-GGATC-CACTCA-CGTTTGA-TTTCCAGC-TTGGT-GCCTCC-3' [서열번호 12]; 제한효소 부위는 밑줄 침)을, 이 전체 리더 B-B4 Vκ 영역과, pKN100 발현 벡터에 클로닝하기 위한 HindIII 및 BamHI 말단 제한효소 부위가 포함된, PCR 산물을 제조하도록 설계하였다. 정방향 프라이머, CBB4K는 HindIII 제한효소 부위, Kozak 번역 개시부 및 VK-10 ARS-A 리더 서열을 도입한다. 역방향 프라이머 g2258은 스플라이스 공여 부위와 BamHI 제한효소 부위를 도입한다. 제조되는 단편은 pKN100의 HindIII/BamHI 제한효소 부위에 클로닝하였다.
중쇄 키메라 제조용 프라이머
PCR 프라이머 서열과 무관한, 분명한 B-B4 VH 리더 서열을 Kabat 데이타베이스에서 뮤라인 리더 서열과 정렬하였다. B-B4 VK 리더와 매칭율이 가장 높은 것은 VH17-1A (Sun et al., PNAS, 84 (1987), 214)이었다. 이 리더 서열은 시그널P 알고리즘에 의해 정확하게 절단되는 것으로 추정된다. 프라이머 cBB4Hfor (상기에서 언급됨) 및 g22949 (5'-CGAT-GGGCCCT-TGGTG-GAGGC-TGAGGA-GACGGTG-ACTGA-GGTTCC-3' [서열번호 13]; 제한효소 부위는 밑줄 침)을, VH17-1A 리더, B-B4 VH 영역과, pG4D200 발현 벡터에 클로닝하기 위한 HindIII 및 ApaI 말단 제한효소 부위가 포함된, PCR 산물을 제조하도록 설계하였다. 정방향 프라이머 cBBHFor는 HindIII 제한효소 부위, Kozak 번역 개시부 및 VH17-1A 리더 서열을 도입한다. 역방향 프라이머 g22949는 감마4 C 영역의 5' 말단과 천연 ApaI 제한효소 부위를 도입한다. 제조되는 단편은 pG4D200의 HindIII/ApaI 제한효소 부위에 클로닝하여, 벡터 pG4D200cBB4를 제조하였다.
cBB4 항체 생산
COS 7 세포 바이얼 1개를 해동시키고, 10% Fetal clone I 혈청과 항생제가 보충된 DMEM에서 배양하였다. 1주일 후, 세포 (0.7 ml, 107 세포/ml)에 pG4D200cBB4 + pKN100cBB4 (각각 DNA 10 ㎍)을 전기충격으로 도입하거나, DNA 없이 전기충격을 가하였다. 그런 후, 세포를 8 ml 배양 배지에 접종하여, 4일간 배양하였다. 전기충격은 수차례 반복하였다.
키메라 항체의 검출
샌드위치 ELISA를 사용하여, COS 7 상층액에서 항체 농도를 측정하였다. 일시적으로 형질전환된 COS 7 세포에서 약 6956 ng/ml으로 항체가 분비되었다 (데이타 미기재).
cB-B4의 결합 활성
COS 7 배양 상층액의 cB-B4의 결합 활성을 분석하기 위해, Diaclone sCD138 키트, 고상 샌드위치 ELISA를 사용하였다. sCD138에 특이적인 단일클론 항체를 제공된 마이크로타이터 스트립의 웰에 코팅하였다. 1차 인큐베이션하는 동안에, sCD138 및 바이오틴화된 B-B4 (bio-B-B4) 항체를 비표지 테스트 항체(B-B4 또는 cB-B4)의 연속 희석물과 함께 동시에 인큐베이션하였다.
이 분석에서 bio-B-B4의 농도를, 낮은 농도의 비표지 항체와의 경쟁을 위해, 낮추었다 (그렇지 않으면, COS 7 세포 배양 상층물내 cB-B4 농도는 충분한 경쟁을 형성하기에는 매우 낮음). 이러한 분석의 결과로, 2종의 항체들이 CD138에 동일한 특이성을 가지는 것으로 확인되었다 (데이타 미기재).
cB-B4의 정제
키메라 B-B4를, 단백질 A 이뮤노퓨어 플러스 키트 (Pierce)를 제조사의 권고에 따라 수행하여 COS 7 세포 상층액으로부터 정제하였다 (데이타 미기재).
K
D
-결정: nBT062/ BB4 비교
가용성 CD138의 정제
U-266 세포 배양 상층액으로부터 가용성 CD138 항원을 B-B4와 커플링된 1 ml "HiTrap NHS-활성화된 HP" 컬럼을 이용한 FPLC에 의해 정제하였다. 세포 배양 상층액을 PBS 완충액(pH7.4) 중에 컬럼에 주입하고, 이후 CD138 항원 상에서 50 mM 트리에틸아민(pH11)으로 2 mL 분획으로 용출시켰다. 용출된 CD138을 즉시 375 ㎕ 1 M Tris-HCl, pH 3으로 중화하여, 구조 및/또는 기능적 손상을 방지하였다.
CD138의 바이오틴화
설포-NHS-LC (Pierce)를 이용하여 CD138을 표지하였다. NHS-활성화된 바이오틴은 pH 7-9에서 라이신 잔기와 같이 1급 아미노기와 효과적으로 반응하여, 안정적인 결합을 형성한다.
CD138의 바이오틴화를 위해, CD138 50 ㎕을 단백질 탈염 스핀 컬럼 (Pierce)을 이용하여 탈염하였다. 바이오틴화 시약 (EZ-Link Sulfo NHS-LC-Biotin, Pierce)을 빙냉한 탈이온수에 최종 농도 0.5 mg/mL로 용해하였다. 바이오틴화 시약과 포착 용액을 포착 시약 보다 바이오틴화 시약이 12배 몰 높은 비율로 혼합하고 (50 pmol CD138 : 600 pmol 바이오틴화 시약), 바이얼을 서서히 흔들면서 실온에서 1시간 인큐베이션하였다. 결합되지 않은 바이오틴화 시약을 단백질 탈염 컬럼을 이용하여 제거하였다.
bCD138의 고정
BIACORE 분석에 사용되는 센서칩 (SENSOR CHIP SA, BIACORE AB)을, BIACORE 시스템에서 상호작용 분석을 위해 바이오틴화된 분자에 결합하도록 제작하였다. 표면은, 스트렙타비딘이 미리 고정되어 있는 카르복시메틸화된 덱스트란 매트릭스로 구성되며, 바이오틴화된 리간드의 고-친화성 포착용으로 준비하였다. bCD138의 고정화는, 매뉴얼 주입에 의해 유속 10 ㎕/min으로 센서칩 상에서 수행하였다. 칩의 표면에, 50 mM NaOH 중의 1 M NaCl을 1분간 계속 주입하는 과정을 3번 수행하였다. 그 후, 바이오틴화된 CD138을 1분간 주입하였다.
BIACORE를 이용한 여러가지 항체들의 K
D
- 결정
BIACORE C의 소프트웨어는, 오직 특정 세팅만 바꿀 수 있는 여러가지 실험들에 대한 미리 정해진 마스크, 이른바 "위저드"를 이용한다. BIACORE C는 본래 농도를 측정하기 위해 개발되었기 때문에, 친화성 측정을 수행하기 위해 설계된 위저드는 없다. 그러나, 적합한 세팅으로, "비특이적 결합" 위저드를 사용하여, 친화성 비율 상수를 측정할 수 있으며, 따라서 이를 KD-수치로 사용하였다. 이 위저드로, 2개의 플로우 셀을 측정하였고, BIACORE 런닝 완충액으로 "재생 1"을 수행함으로써, 해리 상을 90s로 설정하였다. "재생 2"는 실제 재생과 등가로, 10 mM 글리신-HCl pH 2.5로 수행하였다. 이 단계 후, 리간드 CD138을 다시 결합 경쟁적인 상태로 두었다. 전체 과정에서, HBS-EP를 런닝 완충액 및 희석 완충액으로서 사용하였다. 여러가지 항체 (~150 kDa)의 CD138 결합을 측정하기 위해, 조합 및 해리를 여러가지 농도 (100, 50, 25 12.5, 6.25 및 3.13 nM)에서 분석하였다. 해리 평형 상수는, 속도 상수 ka 및 kd를 계산하여 정하였다. 그 후에, 분석물의 KD-수치를 BIAevaluation 소프트웨어로 kd 및 ka 지수로 계산하였다. 결과는 표 13에 나타낸다.
| 항체 | 친화성 | |
| KD (nM) | 평균 KD (nM) | |
| nBT062 | 1.4 1.4 1.5 |
1.4 +/- 0.06 |
| B-B4 | 1.7 1.7 1.6 |
1.6 +/- 0.06 |
| nBT062-SPDB-DM4 | 1.9 1.9 1.9 |
1.9 +/- 0.00 |
| B-B4-SPP-DM1 | 2.6 2.7 2.6 |
2.6 +/- 0.06 |
표 13: nBT062 및 B-B4의 KD 수치의 비교 분석. 평균 KD 수치에 대한 표준 편차를 나타내었다.
고찰
각 항체에 대한 평균 KD 수치를 3번의 독립적인 실험들에서 계산하였다. 그 결과, nBT062는 모든 측정 결과들에서 B-B4에 비해 KD 수치가 약간 감소된 것으로 나타났다 (평균 KD 수치는 각각 1.4 및 1.6 nM임).
면역접합체의 제조
nBT062-DM1 및 huC242-DM1
기존에 Chari (Chari et al., Cancer Res. 1 (1992), 127)에 의해 언급된 바와 같이, 티올-함유성 메이탄시노이드 DM1을 미생물 발효 산물 안사미톡신 P-3으로부터 합성하였다. 인간화 C242 (huC242)의 제조 (Roguska et al., PNAS, 91 (1994), 969) 방법은 종래에 개시되어 있다. 항체-약물 접합체를, 종래 방법에 따라 제조하였다 (Liu et al., PNAS, 93 (1996), 8618). 항체 분자 당 평균 3.5개의 DM1 분자가 연결되었다.
nBT062-DM4
BT062는 링커를 통한 이황화 결합을 통해 nBT062 키메라 단일클론 항체에 연결된, 세포독성 메이탄시노이드 약물, DM4로 구성된다. 메이탄시노이드는 튜불린 중합과 마이크로튜불 조합을 저해하는 세포 분열 저해제이다 (Remillard et al., Science 189 (1977), 1002). BT062 (nBT062-DM4)은 도 1 및 2에 화학적 및 도식적으로 나타낸다.
FACS 분석 및 WST 세포독성 분석
FACS 분석
OPM-2 세포는 CD138을 고도로 발현하는 것으로 나타난 형질세포 백혈병 세포주이다. OPM-2 세포를 여러가지 농도(도 6에 기재된 농도)로 nBT062, nBT062-SPDB-DM4, nBT062-SPP-DM1 또는 nBT062-SMCC-DM1과 인큐베이션하였다. 세포를 헹구고, 형광-표지된 2차 항체를 이용한 FACS 분석으로 CD138-결합 항체 또는 접합체를 검출하였다. 이 실험에서, 평균 형광 측정값을 항체 농도에 대해 그래프를 작성하였다.
세포 생존 분석
CD138+ MOLP-8 세포를 바닥이 평평한 플레이트에 웰당 세포 3000개로 접종하였다. CD138- BJAB 대조군 세포는 웰당 세포 1000개로 접종하였다. 세포에 다양한 농도로 (도 7에 기재된 농도) nBT062-SPDB-DM4, nBT062-SPP-DM1 또는 nBT062-SMCC-DM1을 5일간 처리하였다. WST 시약 (수용성 테트라졸륨 염, ROCHE)을 첨가하여, 제조사 (ROCHE)의 지침에 따라 세포 생존성을 측정하였다. 시약은 MOLP-8 세포에서 7.5시간 인큐베이션하고, BJAB 세포에서는 2시간 인큐베이션하였다. 생존 세포의 분획은, 표준 과정을 이용하여 마이크로플레이트 리더에서 측정되는 광학 밀도를 기초로 계산하였다.
고찰
FACS에 의해 nBT062-SPDB-DM4, nBT062-SPP-DM1, nBT062-SMCC-DM1 또는 nBT062의 결합을 분석하였다. 타겟 세포로서 CD138+ OPM-2를 nBT062 또는 면역접합체와 인큐베이션하였고, 세포-결합된 분자를 형광-표지된 2차 항체로 검출하였다. 도 6에서, 세포 결합된 항체의 양의 측정 값으로서의 평균 형광을 여러가지 항체 또는 접합체 농도에 대해 그래프를 작성하였다. 그 결과, nBT062-SPDB-DM4, nBT062-SPP-DM1 및 nBT062-SMCC-DM1이 매우 비슷한 결합 특징을 보이는 것으로 나타났다. 또한, 그 결과, 비접합 항체의 결합 특징들은 접합된 독소에 의해 영향을 받지 않는다는 것이, 명확하게 시사되었다.
세포 생존성 분석에서, CD138+ MOLP-8 타겟 세포 및 CD138- BJAB B-림프모구종 (lymphoblastoma) 대조군 세포에 대한 항체의 세포독성 활성을 분석하였다. 상기 2종의 세포주 모두 바닥이 평평한 플레이트에 접종하고, 면역접합체를 증가된 농도로 첨가하여 인큐베이션하였다. 비접합 항체를 대조군으로 사용하였다. 세포 생존성을 측정하기 위해, WST 시약을 이용함으로써 면역접합체를 첨가한지 5일째에 세포독성 활성을 분석하였다. 도 7(A)-(C)에서, 비히클 대조군으로 처리한 대조군 세포 대비 생존 세포의 비를 면역접합체 농도 증가에 따라 그래프로 작성하였다. 그 결과, MOLP-8 세포에 대한 nBT062-SPDB-DM4, nBT062-SPP-DM1 및 nBT062-SMCC-DM1의 세포독성 활성은 매우 비슷한 것으로 나타났다. 예상한 바와 같이, CD138- BJAB 대조군 세포는 면역접합체에 의해 사멸되지 않았으며, 이는 면역접합체 모두 CD138에 대한 세포 특이적인 결합을 통해 작용함을 의미한다. 경쟁 실험에서, MOLP-8 세포를 더 많은 몰량의 비접합 nBT062와 미리 인큐베이션하였다. 사전 인큐베이션은 nBT062-SPDB-DM4의 세포독성을 실질적으로 차단시켜, 세포 표면상에서의 CD138에 대한 특이적인 결합을 통해 면역접합체가 세포를 사멸시킨다는 또다른 증거를 제공해준다 (도 7 (D)).
인디케이터: 췌장암/유방암 및 그외 암종 - 이종이식 모델
일반적인 실험 설정
CD138 발현 분석 (종양 조직 마이크로어레이 상에서의 면역조직화학적 분석)에서, 후보 종양들을 원발성 종양 콜렉션, 즉 환자 유래 종양들로부터 선택하였다. 이들 종양들은 오리지날 특징들을 유지하기 위해 마우스에서 적은 횟수로 계대 배양되었으며, 모 종양과 비슷한 특징을 나타낸다. 피하 이식 및 종양 확립 (유도 시간 30일) 후, 면역접합체 BT062를 메이탄시노이드 DM4 2가지 농도, 450 ㎍/kg 및 250 ㎍/kg (각각은 연결된 DM4의 분자량 기준임 (DM4 1 mg이 항체 52 mg에 접합됨, 이는 총 분량 53 mg에 해당됨); 450 ㎍/kg DM4 = 23.850 ㎍) 정맥내로 주입하였다. 면역접합체를 10주간 (췌장 종양 이식된 마우스의 처리군) 및 5주간 (유방, 폐 및 방광 종양 이식된 마우스 군) 매주 투여하였다. 이후 무처리 관찰 기간을 추적하여 종양 재증식 가능성을 조사하였다.
실시예 1: 췌장암
췌장 종양 조직 (PAXF 736 (Kuesters et al., 2006)을 NMRI 마우스에 이식(양측)하였다. 이식된 종양은 환자의 원발성 췌장 암종 (분화가 덜 됨, 침윤성 선암종 (외분비형 암종))으로부터 기원하였다. 부작용은 관찰되지 않았다. 이 환자의 종양은 면역조직화학 실험에 의해 CD138 고발현 조직으로 식별되었다. 그러나, CD138은 유세포 측정의 표면 염색에 의해 종양원성 세포주 상에서 결정한 바와 같이, 다발성 골수종 환자에서의 골수종성 형질세포 (myelomatous plasma cell)에 상응하는 수준으로는 발현되지 않았다.
종양의 크기가 약 6-8 mm 직경 (최소 5 mm)에 도달한 후, BT062 처리를 시작하였다. 종양의 직경을 일주일에 2번 측정하였다. 종양 체적은 식: a*b*b/2 ("a"는 최장 축이고, "b"는 이의 수직 축)으로 계산하였다. 비히클 대조군 대비 실험군에서의 종양 체적 저해를, 상대적인 종양 체적 평균 비율(T/C)로서 계산하였다.
특정 일의 종양 저해 (T/C %)는 대조군 대비 테스트군의 평균 RTV (상대적인 종양 체적) 수치의 비율 x 100%로 계산하였다.
T/C (일x) = (실험군의 일x의 상대적인 종양 체적 평균 / 대조군의 일x의 상대적인 종양 체적 평균) x 100%
종양 체적은 이러한 BT062 매주 투여에 의해 현저하게 감소시킬 수 있었다. 도 28에서 볼 수 있는 바와 같이, 용량 의존적인 부분 관해 및 완전 관해가 관찰되었다. 도에서, 23.85 mg/kg 용량에서, 종양 이식 후 28일에 완전 관해를 달성할 수 있었으며, 용량 13.25 mg/kg에서는, 종양 이식 후 35일에는 완전 관해를 달성할 수 있었다. 특히, 52일이 지난, 13.25 mg/kg 투여 용법의 경우 모든 마우스들이 여전히 생존한 (8/8) 반면, 대조군 마우스 8명은 1명으로 감소되었다. T/C 수치 < 10%은 완전 관해 (CR)를 의미한다 (Bissery et al., 1991). 이 기준에 따라, 양쪽 치료군에서 CR이 달성되었는데, 이는 BT062에 의해 달성된 완전 관해를 반영한다.
특히, 무치료 관찰 단계에서, 종양 재증식은 검출되지 않아, 이 모델의 완전 치유가 확인되었다.
| 상대적인 종양 체적 (%) | 53일: 평균 (±) | 범위 | T/C (%) |
| 대조군 | 2055 | 2055 | |
| BT062-DM4; 13.25 mg/kg | 0 (±1.0) | 0 - 3.5 | 0.0 |
| BT062-DM4; 23.85 mg/kg | 0 (±0.01) | 0 - 0.1 | 0.0 |
표 14: 췌장암 이종이식 마우스 모델의 종양 체적
실시예 2: 유방암
NMRI (nude) 마우스에 환자의 원발성 유방 종양 (CD138에 강력한 양성으로서 IHC 분석을 통해 확인됨)을 (양측) 이식하였다. 유방 암종 피부 전이를 M1 단계에서 취하였다. 이것은 헤르셉틴 (중간 수준의 발현을 보이는 낮은 Her2)에 반응하지 않는 종양이다. 이 종양은 에스트로겐 수용체에 음성이고, 프로게스테론 수용체에 음성이므로, 호르몬 요법에 대해 반응하지 않는다. 이식할 종양은 IHC 염색 결과에 따라 선정하였다 (BT062에 의해 검출되는, 강력하고 균질적인 CD138 발현, 호르몬 수용체 에스트로겐과 프로게스테론에 대한 트리플 네거티브 발현); Her2 발현 스코어 2 이하 (이는 헤르셉틴 비반응성으로 간주됨)).
종양의 크기가 약 100 mm3에 도달한 후, BT062 처리를 개시하였다. 종양 체적은 식: a*b*b/2 ("a"는 최장 축이고, "b"는 이의 수직 축)으로 계산하였다. 비히클 대조군 대비 실험군에서의 종양 체적 저해를, 상대적인 종양 체적 평균의 비율 (T/C)로서 계산하였다. BT062는 주입 용량 13.25 mg/kg (1일에 투여함)으로 매주 1회 투여한 다음, 4 mg/kg을 매주 1회 투여하였다. 다른 용량 군에서는, 고용량 23.85 mg/kg을 투여하였다.
종양 체적은 매주 BT062 투여에 따라 현저하게 축소시킬 수 있었다. 용량 의존적인 부분 관해 및 완전 관해가 관찰되었다. 면역접합체는 허용성이 우수하였고, 각 주입 후 체중에 영향을 미치지 않았다. T/C 수치 < 10%은 양쪽 치료군에서 관찰되었는데, 이는 BT062의 투여에 의해 달성되는 완전 관해를 반영한다. 도 9에서 볼 수 있는 바와 같이, 항-종양 효과 (즉, 완전 관해)는 21일 후에 달성되었는데, 이는 BT062에 대한 신속한 반응으로 볼 수 있다. 도 35 및 36에서 알 수 있는 바와 같이, 저용량 용법도 효과적이었다. 도 37에서 볼 수 있는 바와 같이, 도세탁셀 치료제에 대해 무반응성인 마우스 모델은 BT062 처리에도 반응하지 않은 반면, 탁솔에 무반응성인 모델은 BT062 처리에 양호하게 반응하였다 (도 35). 췌장암 모델과 비교해보면, 치료 기간을 절반으로 단축 (10주 대신 5주)하고, 13.25 mg/kg의 저용량을 4 mg/kg으로 축소하여, 비슷한 효과, 즉 완전 관해를 달성하고 종양 재증식 부재를 달성할 수 있었다. IHC 분석에서 CD138 발현 수준이 비슷하였기 때문에, 유방 암종에서의 짧은 치료 기간은 예상하지 못하였다. 따라서, CD138 발현 수준으로부터 처리 기간에 대한 일반적인 권고치를 유추할 수 없다. 21일 후, 양쪽 치료군 뿐만 아니라 대조군의 마우스들 모두 여전히 살아있었다. 무치료 관찰 기간 (면역접합체를 마지막 투여한지 39일째) 중에, 종양의 재증식은 검출되지 않아, 완전 치유가 확증되었다.
| 상대적인 종양 체적 (%) | 평균 (21일) | 범위 | T/C |
| 대조군 (PBS) | 533 (± 149.5) | 339 - 878 | |
| BT062-DM4; 13.25 mg/kg/4 mg/kg | 0 (± 0.02) | 0 - 0.1 | 0.0 |
| BT062-DM4; 23.85 mg/kg | 0 (± 1.75) | 0 - 6.6 | 0.0 |
표 15: 유방 암종 이종이식 마우스 모델에서의 종양 체적
| FFPE 조직 샘플 | 염색 스코어(막) | |
| 0.25 ㎍/mL | 0.05 ㎍/mL | |
| 유방, 종양 전이, -061909-13 |
3 Homo | 2-3 Homo |
| 유방, 종양 미확인, -061909-12 |
2-3 Homo | 1-2 Hetero |
| 유방, 종양 전이, -061909-09 |
3 Hetero | 2 Focal |
| 유방, 종양 원발성, -111904-4 |
3 Hetero | 1-3 Hetero |
| 유방, 종양 원발성, -111904-1 |
3 Hetero | 1 Hetero |
| 정상 피부 샘플 1 | 3 Homo | 3 Homo |
| 정상 피부 샘플 1 | 3 Homo | 3 Homo |
표 16: 유방 암종 세포 대 상피 세포 상에서의 CD138 발현
실시예 3: 방광암
NMRI (nude) 마우스에 방광 종양 (IHC 분석을 통해 CD138에 대해 강력한 양성으로 확인됨), 즉 이행 세포 암종을 이식하였다.
종양의 크기가 대략 100 mm3에 도달하면, BT062 처리를 개시하였다. 종양 체적은 식: a*b*b/2 ("a"는 최장 축이고, "b"는 이의 수직 축)으로 계산하였다. 비히클 대조군 대비 실험군에서의 종양 체적 저해를, 상대적인 종양 체적 평균의 비율(T/C)로서 계산하였다.
종양 체적을 매주 BT062 투여에 의해 현저하게 축소시키고자 하였다. 모든 용량 의존적인 부분 관해와 완전 관해를 추적한다.
실시예 4: 폐암
NMRI(nude) 마우스에 폐 암종 (IHC 분석에서 CD138에 대해 강력한 양성으로 확인됨)을 이식하였다.
종양의 크기가 5 mm 이상에 도달한 후, BT062 처리를 시작하였다. 종양의 직경을 일주일에 2번 측정하였다. 종양 체적은 식: a*b*b/2 ("a"는 최장 축이고, "b"는 이의 수직 축)으로 계산하였다. 비히클 대조군 대비 실험군에서의 종양 체적 저해를, 상대적인 종양 체적 평균의 비율(T/C)로서 계산하였다.
양쪽 용량 군들 (주당 1회로, 4 mg/kg 및 23.85 mg/kg)에서 완전 관해를 달성할 수 있었다. 무치료 기간에서는, 재증식이 관찰되지 않아, 종양의 완전한 퇴치가 확증되었다.
실시예 5:
전이성 종양을 조사하기 위해, NMRI (누드) 마우스에 방광암 (IHC 분석에서 CD138에 대한 강력한 양성으로 확인됨)으로부터 유래된 전이성 환자 조직을 이식하였다.
또한, 이 모델에서는, 양쪽 용량 군들 (주당 1회로, 4 mg/kg 및 23.85 mg/kg)에서 완전 관해를 달성할 수 있었다. 무치료 기간에 재증식이 관찰되지 않아, 종양의 완전 퇴치가 확증되었다.
실시예 6:
저용량에서, 임상적으로 사용되는 약물인 탁솔 (파클리탁셀)과 비교하여 BT062의 효능을 조사하기 위해, NMRI (누드) 마우스에 실시예 2의 유방암을 이식하였다. BT062를 저용량들로 (0.5 mg/kg, 1 mg/kg, 2 mg/kg 및 4 mg/kg) 매주 1회 투여하였다 (도 35). 4 및 2 mg/kg을 매주 1회 투여한 경우, 완전 관해가 관찰되었으며, 무치료 기간에는 재증식이 나타나지 않았다. 탁솔을 처리한 마우스에서는 10 mg/kg에서 약간의 종양 증식 지연만 나타났다. DM4는 BT062 4 mg에 대응되는 양으로 사용하였지만, 종양 반응에 성과는 없었다. 1 mg/kg 농도에서, "종양 정체 (tumor stasis)"를 달성할 수 있었으며, 즉 종양이 증식하지도 않고 체적이 감소되지도 않았다. 이 그룹에서 마우스 7마리 중 2마리는 부분 관해되었고, 7마리 중 3마리는 종양 재증식 없는 완전 관해를 달성하였기 때문에, 이를 또한 최소 유효 용량이라 한다.
또한, 최소 유효 용량은 1 mg/kg 보다 약간 낮고 0.5 mg/kg 보다 높을 수 있다.
실시예 7 및 8:
본 실시예에서는 BT062를 더 낮은 용량에서 조사하였으며, 실시예 6에서와 같이 임상적으로 사용되는 약물인 도세탁셀 (10 mg/kg)과 비교하였다. BT062를 저용량들로 (1 mg/kg, 2 mg/kg, 4 mg/kg 및 8 mg/kg) 매주 한번 투여하였다. 매주 1회 8 mg/kg 용량에서, CD138 IHC 염색에서 2-3 스코어로 평가된 종양을 가지고 있으며 또한 도세탁셀에 반응하는 마우스에서는 치료 중에 완전 관해가 관찰된 반면, IHC 염색에서 스코어가 1-2이고 도세탁셀에 무반응인 종양을 가진 마우스는 BT062에 반응하지 않았다 (도 36 및 37).
실시예 9:
저용량에서, 임상적으로 사용되는 약물인 도세탁셀 (10 mg/kg)과 비교하여 BT062의 효능을 평가하기 위해, NMRI (누드) 마우스에 원발성 췌장암을 이식하였다. 환자 유래 종양은, IHC 분석으로 측정 시 강하지만 비균질적인 CD138 염색성을 나타내었으며, 스코어 3으로 평가되었다. BT062를 저용량으로 (1 mg/kg, 2 mg/kg, 4 mg/kg 및 8 mg/kg) 매주 1회 투여하였다 (도 38). 4 및 8 mg/kg으로 매주 1회 투여시, 완전 관해가 관찰되었으나, 무치료 기간에 재증식이 발생하였는데 이는 종양의 이종성 (heterogeneity)이 원인일 수 있었다. 도세탁셀 처리 마우스에서는 치료 기간 및 무치료 기간 동안에 완전 관해가 나타났다.
BT062를 이용한 인간 실험
본원에서, 인간 개체들은 저용량 용법에 양호하게 반응하였다. 이는, (MYLOTARG와 비교하여) 타겟 세포 상에서의 CD138의 정성적인 발현 또는 정량적 발현에 잠재적인 편차를 보상하는, 임의의 부가적인 치료가 없는 경우에도 동일하였다. 마우스 모델에서, BT062가 마우스에서 잘 허용되는 용량에서 매우 유의한 항골수종 활성을 가지는 것으로, 입증되었지만, 효능은 상대적으로 고용량에서 상당히 우수하였으며 (결과 미기재), 매우 광범위한 비-종양 세포들 상에서 CD138을 발현하는 인간 개체에서는 얼마나 높은 용량이 허용될 지는 의문이다.
I 상 연구 실험
본 실험은, 효능을 검사하고 (양호 및 불량), 재발성 또는 재발성 난치성의 다발성 골수종 환자를 치료함에 있어 BT062의 MTD(최대 허용량)를 결정하기 위해, 수행하였다.
지금까지, 32명의 환자를 모집하였다. 환자 32명 중 적어도 12명은 4차 이상의 치료 사이클 시술에 의해 확인되는 바와 같이 질병 진행의 감퇴를 경험하였다. 이 실험은 여러 곳에서 수행 중에 있으며, 3 또는 4명의 환자로 구성된 그룹들에게 1-31회의 치료 사이클로 여러가지 용량으로 처방하고 있다 (10 mg/m2, 20 mg/m2, 40 mg/m2, 80 mg/m2, 120 mg/m2, 160 mg/m2, 200 mg/m2)(결과 미기재). 당해 기술 분야의 당업자가 인지하는 바와 같이, 더 많은 횟수의 치료 사이클도 가능하며, 본 발명의 범위에, 10 - 50, 10 - 100, 10 - 200 또는 그 이상도 포함된다.
상대적으로 낮은 용량 수준, 즉 20 mg/m2, 40 mg/m2, 80 mg/m2 및 120 mg/m2에서, 질병 진행이 감퇴되었으며, 21일로 이루어진 치료 사이클 10회 동안 2차 용량 수준 20 mg/m2을 처리한 한 명의 환자에서는 질병이 진행되지 않았다. 일부 환자들에서는, 안정적인 질환과 반응, 예컨대 마이너 반응과 부분 반응을 관찰할 수 있었다.
이들 용량 수준에서, 전술한 바와 같이 (표 9 및 10), 혈장에서의 신속한 BT062 소거도 관찰되었다. 이들 저용량 투여 스케줄의 일부 약동학 프로파일들을 도 13에 나타낸다.
또한, 160 mg/m2 및 200 mg/m2의 용량들도 투여하였다. 용량 160 mg/m2는 MTD로 파악되었으며, 이 그룹에서 실험들을 확대하였다. 용량 200 mg/m2는 MAD로 동정되었다.
10 mg/m2, 20 mg/m2, 40 mg/m2, 80 mg/m2, 120 mg/m2, 160 mg/m2, 200 mg/m2의 반복적인 단회 투약 용법을 21일 마다, 즉 1일, 22일, 43일, 64일, 85일, 106일 등에 수행하였다. 질병을 혈액, 임상 증상 및 임상 화학에 대한 의사의 판단에 의해, 그리고 환자의 혈청과 뇨내 M-단백질 수준 (g/dL)과 환자의 혈청내 유리형 경쇄 (FLC) 수준을 경시적으로 측정함으로써, 모니터링하고 있으며, 할 것이다 (결과 미기재).
면역글로불린 평가
IgG 서브그룹 측정 등의 Ig 항체의 양을 스크리닝으로 분석하였다.
M-단백질 정량화 및 혈청내 유리형 경쇄 분석
먼저, 치료제에 대한 반응을 치료 사이클 1-3차의 1일에, 면역전기영동 (IEP) 및 면역고정 전기영동 (IFE)을 이용하여, 혈청과 24시간 뇨 채집물로부터 조사하였다. 3번의 치료 사이클과 그 이후에, 다음번 치료 사이클을 개시하기 전 반응 분석에 결과를 이용하기 위해, 15일 방문시 M-단백질의 정량화를 수행하였다. 일반적인 정량적인 면역글로불린 평가는 M-단백질 정량화와 함께 수행하였다.
M-단백질을 검출할 수 없는 다발성 골수종 (비분비형/올리고분비형 골수종) 개체를 조사하고, 치료제에 대한 초기 반응을 검출할 수 있도록 하기 위해, 혈청 샘플을 이용하여 FLC 분석을 수행하였다. 따라서, 혈청 FLC 분석을 1차 치료 사이클의 1일, 2일 3일 및 8일에, 4차 사이클 4의 2일, 3일, 8일 및 15일에, 또한 이외 모든 치료 사이클들에서는 1일, 8일 및 15일에 수행하였다. M-단백질 및 FLC를 스크리닝 및 종료 방문시에 분석하였다. 1차 사이클의 1일째 평가 결과는 베이스라인 수치로 사용하였다.
| 용량 mg/m 2 | 뇨/혈청 M-단백질 측정 및 FLC 측정 |
| 20 | - 임상 증상 및 혈청 FLC를 토대로 한 첫 7차 사이클 동안의 질환 안정화 - 8차 치료 후 뇨의 M-단백질이 감소함 - 마이너 반응에서의 M-단백질 기준은 8차 치료 후 달성됨 - 뇨내 M-단백질 수준이 베이스라인으로부터 50% 이상 감소됨 - 10차 사이클 후 질병이 진행됨 - 혈청내 M-단백질 0,06 내지 0,1 g/dL (측정불가한 것으로 정의됨) |
| 40 | - 14주간 안정적인 질병 상태 - 1차 치료 후 혈청내 M-단백질이 감소되고, 14주간 안정화됨 - 6차 사이클 개시(105일)시 치료를 유지한 후, 질환이 진행됨 - 뇨내 M-단백질은 스크리닝시 0에서 최대 약 16 mg/24h으로 증가됨 (측정 불가한것으로 정의됨) |
| 160 | - 혈청 FLC 수준이 -21일에서 치료 1일 전까지의 스크리닝 기간 동안에 증가함 - 혈청 FLC 수준은 1차 치료 후 매우 즉각적으로 감소되고, 8일째에는 이미 25% 감소 수준에 근접하였음 - 베이스라인과 비교시, FLC 수준은 1차 사이클 동안에 약 40% 감소하였고, 2차, 3차 및 4차 치료 후에는 50% 이상 감소되었음 - 부분 반응에 대한 FLC 기준이 매우 초기에 달성되었음 - 4차 치료 사이클 종료 후 질병이 진행됨 - 혈청 M-단백질은 측정불가 = 0; 뇨 M-단백질은 베이스라인 140 mg/24h에서부터 2차 치료 전까지 120 mg/24h로 감소됨(측정 불가로 정의됨) => 비-분비성 골수종 |
표 17은 반복적인 단회 투약 용법으로 선택한 환자에서 뇨/혈청 M-단백질 및 혈청 FLC 측정에 대한 관찰 결과를 제공한다.
BT062의 반복적인 단회 투약 용법에서, DLT는 200 mg/m2 용량 그룹으로 치료한 환자의 점막에서 관찰되었다. BT062 (CD138)에 대한 타겟은 점막에서 발현되며, 이들 조직 및 장기에 대한 독성은 타겟과 관련있는 것으로 간주할 수 있다. DLT로 확인된 것은 아니지만 심각한 이상 반응들이 환자의 눈에서 관찰되었다. 그러나, 눈 독성은 SAR3419 또는 IMGN388 등의 CD138을 타겟팅하지 않는 다른 DM4 전합체를 이용하는 경우 나타나는 전형적인 독성이기 때문에, 오히려 작동자 화합물과 관련있는 것으로 보인다. 이러한 눈 독성은, 3차 사이클 수행 후 반복적인 단회 투약 실험 3일내에 환자 1명에서 발생하였으며, 다른 환자의 경우 4차 사이클 수행 후 4일째에 발생하였다. 반복적인 단회 용량 실험에서 최대 투여 용량 군 (160 mg/kg)의 경우, CD138 관련 독성이 첫날 발생하였고, 사이클 반복 후에도 나타났으며, 독성 대부분은 경도 내지 중등도 수준이었다.
| 용량 | 도 | 뇨/혈청 M-단백질 측정 및 FLC 측정 |
| 3 x 50 mg/m 2 | 20 | 6번의 사이클 동안 혈청 M-단백질은 감소함: 6번의 사이클 동안에 적어도 안정적인 질환 상태를 달성할 수 있었음, 혈청 M 단백질은 3차 및 5차 치료 사이클 수행 중/수행 후 거의 25%로 감소됨 |
| 3 x 65 mg/m 2 | 21 | 유리형 람다-카파 경쇄 단회 치료 사이클 직후, 혈청 FLC 수준의 현저한 감소를 관찰할 수 있었음 |
| 3 x 120 mg/m 2 | 24 | 뇨 M-단백질이 감소함 1차 및 사이클 반복 후 뇨 M 단백질이 감소됨, 3차, 7차 및 10차 사이클 후 50% 이상의 감소됨 |
표 18은 반복적인 다회 투약 용법에서 선택한 환자에서의 뇨/혈청 M-단백질 및 혈청 FLC 측정에 대한 관찰 결과를 제시한다.
혈장으로부터 BT062 및 DM4의 측정
BT062를 IV로 투여한 후 단회 투약의 PK 특성을 평가하기 위해, 1차 치료 사이클을 수행하는 동안에 광범위하게 혈장 샘플링을 수행하였다. 동일한 평가는 4차 치료 사이클에서도 수행하였다. 또한, 이보다는 적은 수준으로, 혈장 샘플도 모든 그외 치료 사이클들에서는 1일과 8일째에, 그리고 실험 종료 방문시와 추적 방문시에 입수하였다. 혈장내 BT062의 양은 아래에 기술된 PK ELISA 방법을 통해 측정한다:
실험 내용:
마이크로타이터 플레이트의 웰에 먼저 항-메이탄시노이드 (항-DM4) 항체를 밤새 2-8도씨에서 코팅하고, 분석 완충제 (0.5% BSA/TBS)로 차단한 후 다음날 혈장 샘플과 인큐베이션하였다. 이를 미리 분석 완충제에서 적어도 1:100으로 희석하였다. 샘플에 포함된 BT062 항체는 플레이트에 고정된 항-DM4 항체에 결합된다. 인큐베이션한 후, 비-결합된 물질은 세척하여 제거한다. 그런 다음, HRP-접합된 2차 항체를 첨가하여, BT062 항체에 결합시킨다. 비-결합된 2차 항체는 다시 세척 단계를 통해 제거한다. 이 후, TMB 기질 용액을 모든 웰로 파이펫팅한다.
발색 반응은 샘플을 인큐베이션하는 동안 결합된 BT062의 양과 비례한다. 발색 반응은 정지 용액을 이용하여 정지시키고, 색이 청색에서 노란색으로 바뀌었다. 최종 측정은 450 nm 파장에서 광도계를 이용하여 수행한다.
농도와 광학 밀도 간의 관계를 Magellan V6.6 소프트웨어를 이용하여 평가한다. 임상 실험의 샘플을 측정하는 경우 (다발성 골수종 환자의 혈장 샘플), 각 환자에 대해 "투여 전" 혈장 (BT062 처리 전 혈장)을 1:100으로 희석하여 개별 표준 곡선을 수득하여야 한다. 분석 완충제에서 반드시 1:100으로 희석하는 것 외에도, 임상 검사 샘플을 (BT062의 고 농도로 인해) 추가로 희석할 필요가 있는 경우, 이 희석은 1:100으로 희석한 투여 전 (대상 환자의) 혈장에서 준비하여야 한다. 안정성 검사 (예, 냉동/해동 안정성, 보관 안정성)를 위해, BT062 표준물질과 해당 샘플 또는 공정 대조군을 1:100으로 희석한 헤파린 혈장 풀로 준비한다.
Shed CD138 및 HAPA의 측정
sCD138 수준과 항종양 활성 간의 잠재적인 상관성을 조사하기 위해, shed/가용성 CD138 (sCD138)의 수준을, 모든 투여 전 혈장 샘플에서 평가하였다. 또한, 이러한 측정으로, Cmax 예상치 보다 낮은 수치는 BT062 투여 전에 존재하는 sCD138의 양과 무관하다는 것을 확인할 수 있었다 (도 17). 각각의 치료 사이클에서 1일에 투여 전 혈장 샘플과 종료 방문 및 추적 방문시의 투여 전 혈장 샘플을, BT062 (약물 산물)에 대한 체액성 반응의 존재를 인간 항-산물 항체(HAPA) 평가에 의해 조사하였다.
Shed CD138의 관찰 결과
골수종 환자에서, sCD138을 높은 수준으로 관찰될 수 있으며, 골수종 환자의 예후 인자일 수 있다 (Maisnar et al., 2005).
MGUS 환자와 MM 환자에서는 가용성 CD138 수준이 높고, 동시에 베타2-마이크로글로불린의 수치가 높으며, 골수내 형질세포의 함량이 증가될 수 있다 (Aref et al., 2003).
가용성 CD138을 측정하기 위해 키트를 사용하였다. 놀랍게도, BT062 20 mg/m2로 처리받은 환자 1명 (003-003으로 식별됨)은, 처리 전에는 sCD138을 고수준으로 나타내었음에도 불구하고, 뇨 M-단백질 수준에 대해 마이너 반응이 나타나는 것으로 확인되었다.
가용성(s) CD138 수치는 여러 개체들에서 측정하였다.
| 개체 | sCD138 (ng/mL) |
| 002-003 | 61.3 |
| 001-002 | 196 |
| 002-004 | 56.7 |
| 003-003 | 2583 |
| 평균 | 724.1 |
표 19: 환자 003-003 (반복적인 단회 투약 20 mg/m2)은 sCD138을 매우 높은 수준으로 나타내었다. 그러나, 이 환자는 M-단백질 수준에서 마이너 반응을 나타내었다.
조합 실험
I/IIa 상 다회-투약 단계적 증가 실험에서, 재발성 또는 재발/난치성 다발성 골수종 개체에 대해 BT062를 레날리도마이드와 덱사메타손과 조합하였다.
치료 사이클 1회는 28일로 구성되거나, 또는 활성 치료 21일과 이후의 치료를 진행하지 않는 7일 (휴지기)로 구성된다. BT062를 80 mg/m2 농도로 1, 8 및 15일에 투여하고, 레날리도마이드 (Len) (25 mg)는 1-21일에 매일 1회 투여하였으며,덱사메타손 (Dex) (40 mg)은 1, 8, 15 및 22일에 투여하였다. 모든 사이클에서 BT062의 1일째의 처리는 Len 및 덱사메타손의 1일과 일치되어야 한다. 도 34에서 알 수 있는 바와 같이, 1차 치료 사이클 수행 후 마이너 반응이 관찰되었으며, 2차 사이클과 3차 사이클 개시가 1주일 지연되고 85일에 BT062의 투여를 거르고 Len 투여를 85일부터 91일까지 거르고 Dex 용량을 3차 사이클에서는 20 mg/m2으로 줄였음에도 불구하고, 4차 사이클 개시시 (90일)에 유지되었다. 당해 기술 분야의 당업자에게 자명한 바와 같이, 레날리도마이드, 덱사메타손 또는 BT062 농도는 독성과 효능에 따라 낮출 수 있다. 효능은 체액, 바람직하게는 M-단백질 또는 FLC (MM 질환 타입에 따라 달라짐) 또는 그외 질환 상태를 반영하는 체액이나 골수 유래의 마커 등의 효능 혈액 파라미터를 통해 분석한다.
본원에 개시된 이러한 치료 용법으로, Len/Dex를 조합하면 독성을 나추거나 또는 이 면역접합체와의 조합시 조합 파트너의 투여를 조정, 예컨대 이들의 투여와 관련된 독성을 최소로 낮출 수 있다. 본 용법은 양호한 허용성을 제공하기 때문에, 독성이 낮거나 적어도 독성의 수가 많지 않지만 동일하거나 심지어 보다 우수한 효능을 가진, 다른 약물들과의 조합에도 적용된다.
가능한 항-골수종 후보 약물들에 대해 세포주에서 BT062에 대한 조합 파트너로서 평가하였다:
세포주 실험
이종이식 마우스 모델에서의 조합 실험 전에 세포주 실험을 수행하였다. 여러가지 세포주에서의 상승 효과 측정은, 평균 효능 분석을 이용하여 Chou and Tallay (1984)에 따라 수행하였다. 여기에서, 각 약물과 각 세포주에 대한 세포독성 효능에 대한 IC50 값을 계산한 다음, 각 약물 쌍에 대한 IC50 비율을 측정하였다. 그런 후, 세포를 이들 약물 혼합물 또는 단독 약물 중 어느 한가지의 연속 희석물에 노출시켰다. 실험 데이타를 CompuSyn 소프트웨어 (ComboSyn, Inc., Paramus, NJ)를 이용하여 분석하였다. 각각의 독립적인 실험에서 조합 인덱스(CI)를 각각 계산하고 기록하였다. 분석에서, CI <1, =1 및 >1은 각각 상승 효과, 상가 효과 및 길항 효과이다. 본 방법의 저자인 T.C. Chou (CompuSyn. User's guide, 2004)의 분류에 따라, 상승 효과 및 길항 효과 스케일은 아래와 같다:
조합 인덱스 설명
< 0.1 매우 강력한 상승 효과
0.1-0.3 강력한 상승 효과
0.3-0.7 상승 효과
0.7-0.85 낮은 상승 효과
0.85-0.9 매우 낮은 상승 효과
0.9-1.1 거의 상가 효과
1.1-1.2 매우 낮은 길항 효과
1.2-1.45 낮은 길항 효과
1.45-3.3 길항 효과
3.3-10 강력한 길항 효과
> 10 매우 강력한 길항 효과
| 세포 | RPMI 8226 | MOLP8 | U266 |
| 보르테조밉 | 상가 효과 | 매우 낮은 길항 효과 | 길항 효과 |
| 탈리도마이드 | 상가 효과 - 상승 효과 | 상가 효과 - 매우 낮은 길항 효과 | 길항 효과 |
| 레날리도마이드 | 상승 효과 | 상가 효과 - 상승 효과 | 매우 낮은 내지 낮은 길항 효과 |
| 멜팔란 | 상가 효과 - 상승 효과 | 매우 낮은 내지 낮은 길항 효과 | 상가 효과 - 매우 낮은 상승 효과 |
| 덱사메타손 | 미 결정 | 상가 효과 | 상가 효과 |
표 20: Chou and Talalay (1984)의 방법에 따른 세포주에서 수득한 상승 효과에 대한 평가
본 실시예에서, MOLP 8 세포주가에 BT062와, 보르테조밉, 탈리도마이드, 레날리도마이드, 멜팔란 및 덱사메타손의 조합을 사용하였다.
탈리도마이드 또는 보르테조밉과의 조합은, 상승 효과도 상가 효과도 없었으며, 오히려 길항 효과가 있었다. 이들 세포 배양 실험과는 대조적으로, 보르테조밉과의 조합은 하기 기술한 이종이식 모델에서 상승 효과가 있었다.
가능성 있는 항-골수종 후보 약물을 MOLP8 인간 다발성 골수종 세포를 이용한 이종이식 실험에서 BT062에 대한 조합 파트너로서 분석하였다.
실시예 1
BT062 및 레날리도마이드를 이용한 조합 치료의 항골수종 효과
암컷 SCID 마우스에, MOLP 8 인간 골수종 세포를 피하 접종하였다. BT062를 단독으로 또는 레날리도마이드와 조합한 처리를 종양 접종 후 11일째에 시작하였다. BT062는 단독으로, 또는 100 mg/kg으로 투여하는 레날리도마이드와의 조합으로, 100 ㎍, 200 ㎍ 및 400 ㎍의 농도로 1일 - 5일 및 8일 - 12일에 복막내 투여하였다. 동일한 스케줄과 투여 경로를 이용하여 PBS (Phosphate buffered saline)를 대조군 동물에 투여하였다. 종양 증식은 종양 크기를 측정하여 모니터링하고, 식: 길이 x 폭 x 높이 x ½로 10일, 14일, 18일 및 21일에 계산하였다.
상승 효과는 다음과 같이 계산하였다 (Yu et al., 2001; Gunaratnam et al., 2009):
RATIO (r) = 예상되는 FTV (조합)/관찰되는 FTV (조합)
FTV: 부분 종양 부피 (Fractional tumor volume) = 평균 종양 체적(실험군)/평균 종양 체적(대조군)
비율 > 1이면 상승 효과로 간주하고, r < 1이면 상가적 효과 보다 낮은 것으로 간주한다.
비율(r)이 1 보다 높으면, 본원에서는 "상승효과 비율 (SYNERGY RATIO)"로 언급한다.
표 21에서 알 수 있는 바와 같이, 상승 효과는 BT062 농도 200 ㎍ 및 400㎍에서 28일에 관찰되었다.
| 일 | BT062 100 | 레날리도마이드 | BT062 100 + Len (관찰 결과) | BT062 100 + Len(예상 결과) | 비 (exp/obs) |
| 10 | 0,93 | 1,00 | 0,97 | 0,93 | 0,96 |
| 14 | 0,75 | 0,82 | 0,59 | 0,61 | 1,04 |
| 17 | 0,52 | 0,45 | 0,23 | 0,23 | 1,02 |
| 21 | 0,53 | 0,42 | 0,19 | 0,22 | 1,19 |
| 24 | 0,44 | 0,55 | 0,18 | 0,24 | 1,30 |
| 28 | 0,33 | 0,46 | 0,17 | 0,15 | 0,90 |
| BT062 200 | 레날리도마이드 | BT062 200 + Len (관찰 결과) | BT062 200 + Len(예상 결과) | 비 (exp/obs) | |
| 10 | 1,02 | 1,00 | 1,00 | 1,02 | 1,02 |
| 14 | 0,45 | 0,82 | 0,51 | 0,37 | 0,73 |
| 17 | 0,13 | 0,45 | 0,14 | 0,06 | 0,41 |
| 21 | 0,08 | 0,42 | 0,07 | 0,03 | 0,45 |
| 24 | 0,11 | 0,55 | 0,06 | 0,06 | 1,08 |
| 28 | 0,13 | 0,46 | 0,03 | 0,06 | 1,86 |
| BT062 400 | 레날리도마이드 | BT062 400 + Len (관찰 결과) | BT062 400 + Len(예상 결과) | 비 (exp/obs) | |
| 10 | 0,94 | 1,00 | 0,91 | 0,95 | 1,04 |
| 14 | 0,44 | 0,82 | 0,24 | 0,36 | 1,49 |
| 17 | 0,09 | 0,45 | 0,06 | 0,04 | 0,63 |
| 21 | 0,04 | 0,42 | 0,04 | 0,02 | 0,44 |
| 24 | 0,04 | 0,55 | 0,03 | 0,02 | 0,80 |
| 28 | 0,04 | 0,46 | 0,01 | 0,02 | 1,43 |
표 21: MOLP 8 이종이식에서의 부분 종양 부피. BT062 단독 및 레날리도마이드와의 조합하여, 여러가지 농도로, 종양이 있는 이종이식체에 투여하였다. FTV는 상대적인 종양 체적이다. 상승 효과는 예상되는 FTV 대 관찰되는 FTV의 비율로 정해된다. 비율 >1은 상승 효과를 의미함.
| 물질 | 용량/주입 | 총 용량 | T/C (%) (17일) | 관해 | 종양이 없는 생존체, 77일 | 결과 | |
| 부분 | 완전 | ||||||
| PBS | (0.2 ml) | - | - | 0/6 | 0/6 | 0/6 | |
| BT062 | 100 ㎍/kg | 100 ㎍/kg | 35 | 0/6 | 0/6 | 0/6 | 활성 |
| BT062 | 200 ㎍/kg | 200 ㎍/kg | 14 | 0/6 | 0/6 | 0/6 | 활성 |
| BT062 | 400 ㎍/kg | 400 ㎍/kg | 9 | 4/6 | 1/6 | 0/6 | 고활성 |
| 레날리도마이드 | 100 mg/kg | 1g/kg | 31 | 0/6 | 0/6 | 0/6 | 활성 |
| BT062 | 100 ㎍/kg | 100 ㎍/kg | 19 | 0/6 | 0/6 | 0/6 | 활성 |
| 레날리도마이드 | 100 mg/kg | 1g/kg | |||||
| BT062 | 200 ㎍/kg | 200 ㎍/kg | 12 | 2/6 | 0/6 | 0/6 | 활성 |
| 레날리도마이드 | 100 mg/kg | 1g/kg | |||||
| BT062 | 400 ㎍/kg | 400 ㎍/kg | 6 | 5/6 | 4/6 | 0/6 | 고활성 |
| 레날리도마이드 | 100 mg/kg | 1g/kg | |||||
표 22: 레날리도마이드 BT062 조합: 여러가지 용량에서의 효과
도 30 및 31은 이종이식 마우스 모델에서 평균 종양 체적 (TV)에 대한 조합 요법의 효능을 보여준다. 도 30의 결과는 조합물의 상가적인 효과를 나타낸다. 특히, 조합물은, 레날리도마이드 용량 100 mg/kg과 조합하는 경우, 면역접합체 용량 100 ㎍/kg이 되었다. 상승효과 비율들은 상기 표를 참조한다.
실시예 2
BT062 및 벨카드를 이용한 조합 요법의 항-골수종 효과
벨카드를 MOLP8 다발성 골수종 세포 (IMGN Inc.)를 이용한 이종이식 실험에서 BT062에 대한 잠재적인 다발성 골수종 약물 조합 파트너로서 평가하였다. BT062 단독 또는 벨카드와 조합 처리는, 종양 이식 후 11일째에 개시하였다. BT062는 단독으로, 또는 100 mg/kg으로 투여하는 벨카드와의 조합으로, 100 ㎍, 200 ㎍ 및 400 ㎍의 농도로 1, 4, 8 및 11일에 사용하였다. 동일한 스케줄과 투여 경로를 이용하여 PBS (Phosphate buffered saline)를 대조군 동물에 투여하였다. 종양 증식은 종양 크기를 측정하여 모니터링하고, 식: 길이 x 폭 x 높이 x ½로 10, 14, 17, 21, 24 및 28일에 각각 계산하였다.
상승 효과는 실시예 1의 조합 실험에서와 같이 계산하였다.
표 23에서 볼 수 있는 바와 같이, 상승 효과는 모든 BT062 투약 용법들에서 25일째에 벨카드와 BT062의 조합에서 관찰된다. R 값은 문헌에서 더 높게 보고되었다 (Yu et al., 2001).
| 일 | BT062 100 | 벨카드 | BT062 100 + 벨카드 (관찰 결과) | 예상치 | 비율 (exp/obs) |
| 10 | 1,06 | 1,05 | 1,04 | 1,12 | 1,07 |
| 14 | 0,74 | 0,84 | 0,56 | 0,62 | 1,11 |
| 18 | 0,44 | 0,96 | 0,28 | 0,42 | 1,54 |
| 21 | 0,39 | 0,80 | 0,23 | 0,31 | 1,38 |
| 25 | 0,48 | 0,95 | 0,26 | 0,46 | 1,75 |
| 일 | BT062 200 | 벨카드 | BT062 200 + Vel (관찰 결과) | 예상치 | 비율 (exp/obs) |
| 10 | 1,02 | 1,05 | 1,07 | 1,12 | 1,07 |
| 14 | 0,52 | 0,84 | 0,45 | 0,44 | 0,98 |
| 18 | 0,13 | 0,96 | 0,10 | 0,12 | 1,19 |
| 21 | 0,10 | 0,80 | 0,05 | 0,08 | 1,47 |
| 25 | 0,10 | 0,95 | 0,04 | 0,09 | 2,09 |
| 일 | BT062 400 | 벨카드 | BT062 400 + Vel (관찰 결과) | 예상치 | 상승효과 비율 (exp/obs) |
| 10 | 1,09 | 1,05 | 1,04 | 1,15 | 1,10 |
| 14 | 0,45 | 0,84 | 0,43 | 0,38 | 0,88 |
| 18 | 0,08 | 0,96 | 0,09 | 0,08 | 0,89 |
| 21 | 0,05 | 0,80 | 0,04 | 0,04 | 0,98 |
| 25 | 0,04 | 0,95 | 0,02 | 0,03 | 1,36 |
표 23: 벨카드와의 조합 치료
부분 종양 부피(FTV)는 평균 종양 체적 (실험군) / 상대적인 평균 종양 체적(대조군)이다. 비는 FTV 예상치(조합) 대 FTV 관찰 결과(관찰됨)이다. R이 > 1은 상승 효과, < 1은 상가 효과이다.
| 물질 | 용량/주입 | 치료일(TX 개시일 = 접종 후 10일) | T/C (%) | (T-C), 일 | log 세포 사멸 | 관해 | 종양이 없는 생존체 | 결과 | |
| 부분 | 완전 | ||||||||
| PBS | (0.2 ml) | 1일 | - | - | - | 0/6 | 0/6 | 0/6 | |
| BT062 | 100 ㎍/kg | 1일 | 43 | 5,5 | 0,5 | 0/6 | 0/6 | 0/6 | 비활성 |
| BT062 | 200 ㎍/kg | 1일 | 11 | 14,5 | 1,3 | 1/6 | 0/6 | 0/6 | 활성 |
| BT062 | 400 ㎍/kg | 1일 | 7 | 31,5 | 2,8 | 4/6 | 2/6 | 0/6 | 고활성 |
| 벨카드 | 1 mg/kg | 1, 4, 8, 11일 | 100 | 0,5 | 0,0 | 0/6 | 0/6 | 0/6 | 비활성 |
| BT062 | 100 ㎍/kg | 1일 | 20 | 10.5 | 0.9 | 1/6 | 0/6 | 0/6 | 활성 |
| 벨카드 | 1 mg/kg | 1, 4, 8, 11일 | |||||||
| BT062 | 200㎍/kg | 1일 | 7 | 23.5 | 2.1 | 4/6 | 1/6 | 0/6 | 고활성 |
| 벨카드 | 1 mg/kg | 1, 4, 8, 11일 | |||||||
| BT062 | 400㎍/kg | 1일 | 7 | 36.5 | 3.2 | 6/6 | 0/6 | 0/6 | 고활성 |
표 24: 벨카드 BT062 조합: 여러가지 용량에서의 효과
도 31은 이종이식 마우스 모델에서의 평균 종양 체적 (TV)에 대한 조합 요법의 효과를 나타낸다. 그 결과, 사용 모델에서, 벨카드 단독 처리는 종양 체적에 효능이 없었다. BT062와의 조합은 상승 효과를 제공하였다. 특히, 조합물은, 벨카드 용량 100 mg/kg과 조합하는 경우, 면역접합체 용량 100 ㎍/kg이 되었다. 상승효과 비율에 대해서는 상기 표를 참조한다.
실시예 3: BT062/멜팔란
RPMI 세포를 누드 마우스에 피하 이식하였다. 종양의 총 부피가 약 100 mm3이 되면 마우스를 무작위 분류하였다. BT062를 2가지 농도, 연결된 DM4의 분자량을 기초로 400 ㎍/kg 및 100 ㎍/kg으로 정맥내 주사하였다. PBS를 음성 대조군으로 사용하였다. 그룹 당, 각각에 하나의 종양을 가지고 있는 (한쪽에만 이식) 마우스 8마리를 사용하였다. BT062를 매주 투여한 다음, BT062를 복막내 주사한 후, 1일에 멜팔란을 매주 1회로(3 mg/kg) 투여하였다 (결과 미기재).
실시예 4: BT062/레날리도마이드/덱사메타손에 대한 생체내 약물 조합 실험
24시간 레날리도마이드와 인큐베이션한 후, 시험관내 여러가지 세포주들은 농도 의존적인 CD138 감소를 나타내었지만 (도 32(A) - (D)), 생체내 약물 조합 실험에서는, 조합물 4 mg/kg, 레날리도마이드 20 mg/kg 및 덱사메타손 1.25 mg/kg은 L363 MM 이종이식 모델에서 매우 효과가 우수한 것으로 확인되었다.
이 모델에서, CD138을 매우 활발하게 발현하는 형질세포 골수종 세포주 L363을 NOD/SCID 마우스에 피하 이식하였다. 종양의 크기가 약 100 mm3가 되면 처리를 개시하였다. BT062는, 단독으로 또는 0-4, 7-11, 14-18, 21-25 및 28-32일에 경구로 투여하는 레날리도마이드 및 0, 7, 14, 21 및 28에 복막내로 투여하는 덱사메타손과 조합하여, 2 mg/kg 또는 4 mg/kg의 농도로 1, 8, 15, 22, 29일에 매주 1회 정맥내 주사하였다. 종양 크기를 매주 1회 측정하였다. 4 mg/kg BT062 단독은 종양 증식을 감소시키는 효과가 있었다. 4 mg/kg BT062 + Len/Dex 조합은 종양 증식 저해에 대해 단일 제제 보다 강한 활성을 나타내었다 (Len/Dex 단독; BT062 단독) (도 33).
당업자라면 상기 기술된 내용에 대한 다수의 다른 특징, 변형 및 개선을 자명하게 인지할 것이다. 이러한 다른 특징, 변형 및 개선은 따라서 본 발명의 개요 및 첨부된 청구항에 의해 범위가 정해지는 본 발명의 일부로 간주된다.
SEQUENCE LISTING
<110> Biotest AG
ImmunGen, Inc.
<120> USES OF IMMUNOCONJUGATES TARGETING CD138
<130> 332630WO/CJS
<140>
<141>
<150> 61/722,367
<151> 2012-11-05
<150> 61/568,640
<151> 2011-12-08
<160> 13
<170> PatentIn version 3.5
<210> 1
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> Amino Acid sequence (predicted) of heavy chain of chimeric
human/mouse antibody
<220>
<221> CDR1
<222> (31)..(35)
<220>
<221> CDR2
<222> (51)..(68)
<220>
<221> CDR3
<222> (99)..(111)
<400> 1
Gln Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Met Met Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Thr Gly Arg Thr Ile Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Ala Asp Ile Ser Ser Asn Thr Val Gln
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Tyr Gly Asn Phe Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
<210> 2
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Amino Acid sequence (predicted) of light chain of chimeric
human/mouse antibody
<220>
<221> CDR1
<222> (24)..(34)
<220>
<221> CDR2
<222> (50)..(56)
<220>
<221> CDR3
<222> (89)..(97)
<400> 2
Asp Ile Gln Met Thr Gln Ser Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Ser Ala Ser Gln Gly Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Glu Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Gly Thr Tyr Tyr Cys Gln Gln Tyr Ser Lys Leu Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> IgH primer MHV7
<400> 3
atgggcatca agatggagtc acagacccag g 31
<210> 4
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> IgG1 constant region primer MHCG1
<400> 4
cagtggatag acagatgggg g 21
<210> 5
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Ig kappa primer MKV2
<400> 5
atggagacag acacactcct gctatgggtg 30
<210> 6
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Ig kappa primer MKV4
<400> 6
atgagggccc ctgctcagtt ttttggcttc ttg 33
<210> 7
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Ig kappa primer MKV9
<400> 7
atggtatcca cacctcagtt ccttg 25
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> primer MKC
<400> 8
actggatggt gggaagatgg 20
<210> 9
<211> 50
<212> DNA
<213> Artificial Sequence
<220>
<223> forward (For) primer
<400> 9
agagaagctt gccgccacca tgattgcctc tgctcagttc cttggtctcc 50
<210> 10
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> oligonucleotide primer BT03
<400> 10
caacagtata gtaagctccc tcggacgttc ggtgg 35
<210> 11
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> oligonucleotide primer BT04
<400> 11
ccaccgaacg tccgagggag cttactatac tgttg 35
<210> 12
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> primer g2258
<400> 12
cgcgggatcc actcacgttt gatttccagc ttggtgcctc c 41
<210> 13
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer g22949
<400> 13
cgatgggccc ttggtggagg ctgaggagac ggtgactgag gttcc 45
Claims (42)
- CD138을 발현하는 타겟 세포와 관련된 질환의 치료 방법으로서,
CD138 발현 세포를 타겟팅하는 하나 이상의 조작된 타겟팅 항체와 하나 이상의 작동자 분자를 포함하되, 상기 조작된 타겟팅 항체에 상기 작동자 분자가 기능적으로 부착되어 형성된 면역접합체를, 이를 필요로 하는 개체, 특히 인간 개체에게 투여하는 단계를 포함하며,
바람직하게는 상기 조작된 타겟팅 항체의 적어도 일부는 IgG4 이소형 특성을 부여하며,
상기 면역접합체는 2회 이상의 투약을 포함하는 다회 투약 용법 (multiple dose regimen)으로 투여되되, 활성 치료 사이클 동안에 투여되는 총 용량이 총 최대 허용 용량 (AMTD: aggregate maximum tolerable dose)이거나 또는 AMTD의 일부 (fraction)이며, 상기 AMTD 및/또는 상기 AMTD의 일부인 용량은 면역접합체를 복수의 단회 투약 용법 (multiple single dose regimen)의 일부로서 투여하는 것을 포함하여 단회 투약 (single dose)으로 투여하는 경우에 용량 제한 독성 (DLT)을 야기하는 용량 보다 높거나, 및/또는 상기 활성 치료 사이클에서 복수의 단회 투약 용법의 일부로서 투여하는 것을 포함하여 단회 투약으로서 면역접합체를 투여하는 경우의 최대 허용 용량 (MTD) 보다 높은 것을 특징으로 하는, 치료 방법. - 제1항에 있어서, 상기 면역접합체가 21일의 활성 치료 사이클 (active treatment cycle)에서, 바람직하게는 상기 21일 동안 3회 이상 투여되는 것을 특징으로 하는 치료 방법.
- 제1항 또는 제2항에 있어서, 상기 면역접합체가 동일 용량으로 투여되는 것을 특징으로 하는 치료 방법.
- 제1항 내지 제3항 중 어느 한항에 있어서, 상기 다회 투약 용법이 3주간 지속된 다음 휴지기가 뒷따르는 것을 특징으로 하는 치료 방법.
- 제4항에 있어서, 무진행 생존 (progression free survival) 또는 안정적인 질환 상태가 상기 휴지기 동안에 유지되는 것을 특징으로 하는 치료 방법.
- 제5항에 있어서,
상기 휴지기 동안에, 상기 개체의 체액내 상기 면역접합체의 수준이 적어도 0.5 ㎍/ml, 적어도 1 ㎍/ml, 적어도 2 ㎍/ml, 적어도 3 ㎍/ml, 4 ㎍/ml, 5 ㎍/ml 또는 6 ㎍/ml이거나, 및/또는
상기 면역접합체의 투여를 완료한 지 4 - 24시간 이내에, 분리된 타겟 세포의 CD138 중 80% 이상, 90% 이상 또는 95% 이상이 상기 면역접합체에 의해 점유되는 것을 특징으로 하는 치료 방법. - 제1항 내지 제6항 중 어느 한항에 있어서,
상기 작동자가 메이탄시노이드, 특히 DM4이며,
상기 환자에게 상기 21일 동안 투여되는 메이탄시노이드의 총 양이 2 mg/m2이상, 3 mg/m2 이상, 4 mg/m2 이상, 5 mg/m2 이상, 6 mg/m2 이상, 7 mg/m2 이상, 8 mg/m2 이상, 9 mg/m2 이상 또는 10 mg/m2 이상인 것을 특징으로 하는 치료 방법. - 제1항 내지 제7항 중 어느 한 항에 있어서,
상기 AMTD가,
상기 DLT의 용량을, 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 80%, 적어도 90%, 적어도 100% 또는 적어도 120% 초과하며,
상기 MTD를 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 80%, 적어도 90%, 적어도 100%, 적어도 120% 또는 적어도 140% 초과하는 것을 특징으로 하는 치료 방법. - 제1항 내지 제8항 중 어느 한항에 있어서,
상기 AMTD가 적어도 240 mg/m2, 바람직하게는 300 mg/m2, 바람직하게는 360 mg/m2, 또는 바람직하게는 420 mg/m2이며,
상기 DLT를 야기하는 용량이 200 mg/m2인 것을 특징으로 하는 치료 방법. - 제1항 내지 제9항 중 어느 한항에 있어서,
상기 AMTD가 적어도 240 mg/m2, 바람직하게는 300 mg/m2, 바람직하게는 360 mg/m2, 또는 바람직하게는 420 mg/m2이고,
상기 MTD가 적어도 160 mg/m2 또는 적어도 180 mg/m2인 것을 특징으로 하는 치료 방법. - 제1항 내지 제10항 중 어느 한항에 있어서,
상기 활성 치료 사이클이, 적어도 3주간, 적어도 매주 1회로, 바람직하게는 동일 용량으로 수행되는 상기 투여를 포함하며,
상기 활성 치료 사이클 다음으로 바람직하게는 1주일 이상의 휴지기가 뒷따르며, 이를 합쳐 28일 이상의 치료 사이클로 규정되며,
치료 사이클 1회, 2회 또는 그 이상의 횟수로 수행한 후, 적어도 안정적인 질환 상태가 달성되는 것을 특징으로 하는 치료 방법. - 제11항에 있어서,
상기 면역접합체가 상기 3주 동안 3일, 4일, 5일 또는 6일 간격으로 투여되는 것을 특징으로 하는 치료 방법. - 제11항 또는 제12항에 있어서,
상기 적어도 안정적인 질환 상태가 치료 사이클 3회, 4회, 5회, 6회, 7회 동안에 유지되는 것을 특징으로 하는 치료 방법. - 제13항에 있어서,
적어도 안정적인 질환 상태에 도달한 후, 상기 면역접합체는 상기 활성 치료 사이클 동안에 2회 미만의 유지 요법 (maintenance therapy)으로서, 바람직하게는, 약 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2, 약 100 mg/m2, 약 110 mg/m2, 약 120 mg/m2, 약 130 mg/m2, 약 140 mg/m2, 150 mg/m2, 약 160 mg/m2, 약 170 mg/m2, 약 180 mg/m2, 약 190 mg/m2, 약 200 mg/m2, 약 210 mg/m2, 약 220 mg/m2, 약 230 mg/m2, 약 240 mg/m2, 약 250 mg/m2, 약 260 mg/m2 내지 약 270 mg/m2을 포함하여, 60 mg/m2 - 280 mg/m2의 반복적인 단회 투약으로서 투여되는 것을 특징으로 하는 치료 방법. - 제14항에 있어서,
적어도 무진행 생존, 안정적인 질환 상태 및/또는 마이너 반응 (minor response)이 상기 유지 요법을 수행하는 동안 3달 이상 달성되는 것을 특징으로 하는 치료 방법. - 제1항 내지 제15항 중 어느 한항에 있어서,
상기 활성 치료 사이클에서 반복적인 다회 투약으로서 상기 면역접합체가 투여되는 총 유효량 및 개체의 체액내 상기 면역접합체의 제1 수준을 형성하며,
상기 총 유효량과 등가의 양이, 상기 활성 치료 사이클에서 단회 투약 또는 반복적인 단회 투약으로서 투여되어, 상기 개체의 체액내 상기 면역접합체의 제2 수준을 형성하며,
상기 제1 수준이 상기 제2 수준과 동일하거나 상기 제2 수준 보다 낮으며, 예컨대 상기 제2 수준 보다 10% 이상, 20% 이상 또는 30% 이상 낮은 것을 특징으로 하는 치료 방법. - 제16항에 있어서,
상기 활성 치료 사이클은 21일간 지속되거나, 및/또는 상기 반복적인 단회 투약은 3번의 동일한, 바람직하게는 등간격 투약 (equidistant dose), 더 바람직하게는 1, 8 및 15일의 투여로 구성되는 것을 특징으로 하는 치료 방법. - 제16항 또는 제17항에 있어서,
상기 총 유효량이 200 mg/m2 이상, 약 220 mg/m2 이상, 약 240 mg/m2 이상, 약 260 mg/m2 이상 또는 약 280 mg/m2 이상인 것을 특징으로 하는 치료 방법. - CD138을 발현하는 타겟 세포와 관련된 질환의 치료 방법으로서,
면역접합체 및 약제학적으로 허용가능한 담체를 포함하는 약학 조성물을, 이를 필요로 하는 환자에게, 활성 치료 사이클로 투여하고, 선택적으로 휴지기를 거치는 단계를 포함하며,
상기 면역접합체는,
CD138 발현 세포를 타겟팅하는 하나 이상의 타겟팅 물질, 및
하나 이상의 작동자 분자를 포함하되, 상기 타겟팅 물질에 상기 작동자 분자가 기능적으로 부착되어 상기 면역접합체를 형성하며,
주당 적어도 1회로 투여되는 상기 면역접합체의 용량이 약 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2, 약 100 mg/m2, 약 110 mg/m2, 약 120 mg/m2, 약 130 mg/m2, 약 140 mg/m2, 약 150 mg/m2 또는 약 160 mg/m2, 약 170 mg/m2, 약 180 mg/m2, 약 190 mg/m2, 약 200 mg/m2, 약 210 mg/m2, 약 220 mg/m2, 약 230 mg/m2, 약 240 mg/m2, 약 250 mg/m2, 약 260 mg/m2, 약 270 mg/m2 또는 약 280 mg/m2이며,
상기 약학 조성물은 단독으로 또는 세포독성 물질과 조합하여 적어도 3주간 투여하는 것을 특징으로 하는 치료 방법. - 제19항에 있어서,
상기 활성 치료 사이클이 적어도 21일간 지속되며,
상기 면역접합체가 약 40 mg/m2 - 약 140 mg/m2의 용량으로 주당 1회로 투여되는 것을 특징으로 하는 치료 방법. - 제19항 또는 제20항에 있어서,
상기 투여는, 각각 선택적으로 휴지기가 후행되는, 21일의 치료 사이클을 2회 이상 수행한 이후에, 상기 면역접합체 또는 약학 조성물을 유지 요법으로서 추가로 투여함으로써 계속되는 것을 특징으로 하는 치료 방법. - 제21항에 있어서,
상기 유지 요법은, 상기 면역접합체 또는 이를 포함하는 약학 조성물을, (i) 3주 내지 6주 마다 1회, 또는 (ii) 반복적인 다회 투약으로 투여하는 단계를 포함하며,
상기 면역접합체의 개개 용량 (individual dose)이, 일차 요법의 개개 용량 보다 약 10 mg/m2, 약 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2 또는 약 100 mg/m2 적거나, 및/또는
개개 용량은 개개 투약 간격 보다 긴 간격으로, 예컨대 1, 2, 3, 4, 5, 6, 7일 간격으로 투여되는 것을 특징으로 하는 치료 방법. - 제19항 내지 제22항 중 어느 한항에 있어서,
상기 면역접합체를 다회 투약 용법으로 투여시, 투여 종료 후 0-2시간에, 적어도 7 ㎍/ml, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 50, 60 또는 70 ㎍/ml의 평균 혈장 수준이 형성되는 것을 특징으로 하는 치료 방법. - 제19항 내지 제23항 중 어느 한항에 있어서,
상기 면역접합체 또는 이를 포함하는 약학 조성물의 투여를 종료한 후 약 1, 2 또는 3시간을 포함하여 0-4시간에, 환자의 체액내 상기 면역접합체 또는 효능 혈액 파라미터 (efficacy blood parameter)의 기준 수준 (RL)을 측정하는 단계,
상기 면역접합체를 후속 투여시, 상기 후속 투여를 종료한 후 0-4시간에, 상기 면역접합체 또는 효능 혈액 파라미터의 후속 수준 (SL)을 측정하는 단계,
상기 RL을 상기 SL과 비교하는 단계,
(i) RL > SL로 확인되면, 상기 후속 투여 후, 치료 사이클에서 총 용량을 10-50% 또는 20-30%를 포함하여 5-100% 만큼 높이는 단계, 및/또는
(ii) RL < SL로 확인되면, 상기 후속 투여 후, 치료 사이클에서 총 용량을 10-50% 또는 20-30%를 포함하여 5-100% 만큼 낮추는 단계를 더 포함하는 것을 특징으로 하는 치료 방법. - 제19항 내지 제24항 중 어느 한항에 있어서,
상기 면역접합체 또는 이를 포함하는 약학 조성물의 투여를 완료한 후 0-2시간에, 체액에서 상기 면역접합체의 수준을 측정하는 단계,
상기 면역접합체의 수준이 7 ㎍/m2, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20 ㎍/m2 보다 높은지 또는 낮은지를 결정하는 단계,
상기 수준이 7 ㎍/m2, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20 ㎍/m2 보다 낮은 경우, 다음번 치료 사이클에서는, 개개 용량을, 적어도 10 mg/m2, 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2 또는 약 100 mg/m2 만큼 높이거나, 또는
상기 수준이 7 ㎍/m2, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20 ㎍/m2 보다 높을 경우, 다음번 치료 사이클에서는, 개개 용량을 유지하거나, 또는 적어도 10 mg/m2, 20 mg/m2, 약 30 mg/m2, 약 40 mg/m2, 약 50 mg/m2, 약 60 mg/m2, 약 70 mg/m2, 약 80 mg/m2, 약 90 mg/m2 또는 약 100 mg/m2 만큼 낮추는 단계를 더 포함하는 것을 특징으로 하는 치료 방법. - 제19항 내지 제25항 중 어느 한항에 있어서,
2 또는 3종을 포함하여, 1종 이상의 세포독성 물질을, 치료 사이클에서 1회 또는 주당 적어도 1회 투여하는 단계를 더 포함하는 것을 특징으로 하는 치료 방법. - 제26항에 있어서, 상기 세포독성 물질이 레날리도마이드 (lenalidomide) 및/또는 덱사메타손 (dexamethasone)인 것을 특징으로 하는 치료 방법.
- 제26항 및 하기 임의의 청구항에 있어서,
상기 개체는 CD138을 발현하는 세포를 타겟팅하는 항체를 포함하는 면역접합체, 레날리도마이드 및/또는 덱사메타손에 노출된 적이 없는 것을 특징으로 하는 치료 방법. - 제26항 또는 제27항에 있어서,
상기 개체는 CD138을 발현하는 세포를 타겟팅하는 항체를 포함하는 면역접합체, 레날리도마이드 및/또는 덱사메타손에 노출된 적이 있는 것을 특징으로 하는 치료 방법. - 제29항에 있어서,
상기 개체는 CD138을 발현하는 세포를 타겟팅하는 항체를 포함하는 면역접합체, 레날리도마이드 및/또는 덱사메타손에 대한 노출에 반응성인 것을 특징으로 하는 치료 방법. - 제30항에 있어서,
상기 CD138을 발현하는 타겟 세포는 CD138을 발현하는 세포를 타겟팅하는 항체를 포함하는 면역접합체, 레날리도마이드 및/또는 덱사메타손에 노출시 불응성인 것을 특징으로 하는 치료 방법. - 제29항에 있어서,
상기 개체는 상기 투여 후 질병이 재발되는 것을 특징으로 하는 치료 방법. - 제26항 및 하기 임의의 청구항에 있어서,
상기 레날리도마이드는 5 - 35 mg의 용량, 바람직하게는 약 25 mg의 용량으로, 또는 25 mg 이하, 20 mg 이하, 15 mg 이하 또는 10 mg 이하의 용량으로, 예컨대 경구로, 21일간 매일 1회로 투여되며, 및/또는
상기 덱사메타손은 20 - 50 mg의 용량, 바람직하게는 약 40 mg, 또는 40 mg 이하 또는 30 mg 이하의 용량으로, 예컨대 경구로, 21일간 매일 1회로 투여되는 것을 특징으로 하는 치료 방법. - 제19항 내지 제33항 중 어느 한항에 있어서,
상기 개체는 CD138을 발현하는 타겟 세포를 포함하는 고형 종양을 앓고 있으며, 상기 고형 종양은 암 호르몬 요법 또는 화학요법에 난치성이거나, 또는
상기 개체는 호르몬 요법 또는 화학요법 후 질병이 재발된 환자이며, 상기 투여로 적어도 종양 증식 지연 또는 종양 정체 (tumor stasis)가 이루어지는 것을 특징으로 하는 치료 방법. - 제34항에 있어서,
상기 면역접합체는 개개 용량 20 mg/m2 - 160 mg/m2으로 반복적인 다회 투약 용법으로 투여되는 것을 특징으로 하는 치료 방법. - 제34항에 있어서,
상기 고형 종양이 에스트로겐 수용체에 음성 및/또는 프로게스테론 수용체에 음성 및/또는 Her2/neu에 음성인 것을 특징으로 하는 치료 방법. - 제19항 내지 제36항 중 어느 한항에 있어서,
상기 면역접합체 또는 약학 조성물의 투여 전에 CD138 발현 세포를 타겟팅하는 비-접합형 (unconjugated) 항체의 투여가 선행되며,
상기 면역접합체는 상기 비-접합형 항체의 투여를 완료한 후 1-6시간, 바람직하게는 2-4시간에 투여하는 것을 특징으로 하는 치료 방법. - 제37항에 있어서,
상기 비-접합형 항체는, 개체의 체액, 특히 상기 개체의 혈장내, 면역접합체 10 - 30 ㎍/ml의 수준에 해당되는 용량으로 투여되는 것을 특징으로 하는 치료 방법. - 제38항에 있어서,
상기 투여되는 용량이, 상기 개체에게 상기 면역접합체의 투여를 완료한 후, 0-2시간에, 체액에서의 상기 면역접합체의 이론적인 수준과 실제 수준 간의 차이에 해당되는 것을 특징으로 하는 치료 방법. - 제37항 또는 하기 임의의 청구항에 있어서,
상기 항체는 10 - 40 mg/m2의 용량, 바람직하게는 20 - 30 mg/m2의 용량으로 투여되는 것을 특징으로 하는 치료 방법. - 제37항 또는 하기 임의의 청구항에 있어서,
상기 면역접합체는, 상기 비-접합형 항체를 투여하지 않을 때 투여되는 용량 보다 최대 10 mg/m2 - 30 mg/m2 적은 개개 용량으로 투여되는 것을 특징으로 하는 치료 방법. - 제1항 내지 제41항 중 어느 한항에 따른 면역접합체에 대한 항체; 및
별도의 용기에, 개체의 체액에 상기 항체를 첨가한 다음, 상기 개체로부터 수득한 체액에서 상기 면역접합체의 수준을 확인하는 방법에 대한 설명서를 포함하는, 키트.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161568640P | 2011-12-08 | 2011-12-08 | |
| US61/568,640 | 2011-12-08 | ||
| US201261722367P | 2012-11-05 | 2012-11-05 | |
| US61/722,367 | 2012-11-05 | ||
| PCT/EP2012/074867 WO2013083817A1 (en) | 2011-12-08 | 2012-12-07 | Uses of immunoconjugates targeting cd138 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140100571A true KR20140100571A (ko) | 2014-08-14 |
Family
ID=47326154
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147018841A KR20140100571A (ko) | 2011-12-08 | 2012-12-07 | Cd138을 타겟팅하는 면역접합체의 용도 |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US10117932B2 (ko) |
| EP (1) | EP2788030B1 (ko) |
| JP (1) | JP6218746B2 (ko) |
| KR (1) | KR20140100571A (ko) |
| CN (1) | CN104302324A (ko) |
| AU (1) | AU2012372140B9 (ko) |
| BR (1) | BR112014013694A2 (ko) |
| CA (1) | CA2858133A1 (ko) |
| ES (1) | ES2684950T3 (ko) |
| HK (1) | HK1203053A1 (ko) |
| IL (1) | IL232991A0 (ko) |
| MX (1) | MX358680B (ko) |
| RU (1) | RU2632108C2 (ko) |
| SG (1) | SG11201402887SA (ko) |
| WO (1) | WO2013083817A1 (ko) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI541022B (zh) * | 2013-12-18 | 2016-07-11 | 應克隆公司 | 針對纖維母細胞生長因子受體-3(fgfr3)之化合物及治療方法 |
| WO2015179801A1 (en) | 2014-05-23 | 2015-11-26 | University Of Florida Research Foundation, Inc. | Car based immunotherapy |
| EP3256492A4 (en) * | 2015-02-09 | 2018-07-11 | University of Florida Research Foundation, Inc. | Bi-specific chimeric antigen receptor and uses thereof |
| WO2016134284A1 (en) | 2015-02-19 | 2016-08-25 | University Of Florida Research Foundation, Inc. | Chimeric antigen receptors and uses thereof |
| TW201711702A (zh) * | 2015-06-04 | 2017-04-01 | 應克隆公司 | 使用針對纖維母細胞生長因子受體3(fgfr3)之化合物的療法 |
| WO2017190096A1 (en) | 2016-04-29 | 2017-11-02 | University Of Florida Research Foundation Incorporated | Chimeric antigen receptors and uses thereof |
| WO2019035938A1 (en) | 2017-08-16 | 2019-02-21 | Elstar Therapeutics, Inc. | MULTISPECIFIC MOLECULES BINDING TO BCMA AND USES THEREOF |
| CN111183157A (zh) | 2017-10-02 | 2020-05-19 | 威特拉公司 | Cd138抗体分子及其用途 |
Family Cites Families (103)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3896111A (en) | 1973-02-20 | 1975-07-22 | Research Corp | Ansa macrolides |
| US4151042A (en) | 1977-03-31 | 1979-04-24 | Takeda Chemical Industries, Ltd. | Method for producing maytansinol and its derivatives |
| US4169888A (en) | 1977-10-17 | 1979-10-02 | The Upjohn Company | Composition of matter and process |
| US4137230A (en) | 1977-11-14 | 1979-01-30 | Takeda Chemical Industries, Ltd. | Method for the production of maytansinoids |
| US4265814A (en) | 1978-03-24 | 1981-05-05 | Takeda Chemical Industries | Matansinol 3-n-hexadecanoate |
| US4307016A (en) | 1978-03-24 | 1981-12-22 | Takeda Chemical Industries, Ltd. | Demethyl maytansinoids |
| JPS5562090A (en) | 1978-10-27 | 1980-05-10 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4256746A (en) | 1978-11-14 | 1981-03-17 | Takeda Chemical Industries | Dechloromaytansinoids, their pharmaceutical compositions and method of use |
| JPS55164687A (en) | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS5566585A (en) | 1978-11-14 | 1980-05-20 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55102583A (en) | 1979-01-31 | 1980-08-05 | Takeda Chem Ind Ltd | 20-acyloxy-20-demethylmaytansinoid compound |
| JPS55162791A (en) | 1979-06-05 | 1980-12-18 | Takeda Chem Ind Ltd | Antibiotic c-15003pnd and its preparation |
| JPS55164685A (en) | 1979-06-08 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55164686A (en) | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4309428A (en) | 1979-07-30 | 1982-01-05 | Takeda Chemical Industries, Ltd. | Maytansinoids |
| JPS5645483A (en) | 1979-09-19 | 1981-04-25 | Takeda Chem Ind Ltd | C-15003phm and its preparation |
| JPS5645485A (en) | 1979-09-21 | 1981-04-25 | Takeda Chem Ind Ltd | Production of c-15003pnd |
| EP0028683A1 (en) | 1979-09-21 | 1981-05-20 | Takeda Chemical Industries, Ltd. | Antibiotic C-15003 PHO and production thereof |
| US4444887A (en) | 1979-12-10 | 1984-04-24 | Sloan-Kettering Institute | Process for making human antibody producing B-lymphocytes |
| WO1982001188A1 (en) | 1980-10-08 | 1982-04-15 | Takeda Chemical Industries Ltd | 4,5-deoxymaytansinoide compounds and process for preparing same |
| US4313946A (en) | 1981-01-27 | 1982-02-02 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids from Trewia nudiflora |
| US4315929A (en) | 1981-01-27 | 1982-02-16 | The United States Of America As Represented By The Secretary Of Agriculture | Method of controlling the European corn borer with trewiasine |
| US4563304A (en) | 1981-02-27 | 1986-01-07 | Pharmacia Fine Chemicals Ab | Pyridine compounds modifying proteins, polypeptides or polysaccharides |
| JPS57192389A (en) | 1981-05-20 | 1982-11-26 | Takeda Chem Ind Ltd | Novel maytansinoid |
| US4761111A (en) | 1981-09-18 | 1988-08-02 | Brown Andrew M | Automobile lifting and towing equipment |
| US4716111A (en) | 1982-08-11 | 1987-12-29 | Trustees Of Boston University | Process for producing human antibodies |
| US4418064A (en) | 1982-09-29 | 1983-11-29 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids: treflorine, trenudine, and N-methyltrenudone |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US5034223A (en) | 1986-10-09 | 1991-07-23 | Neorx Corporation | Methods for improved targeting of antibody, antibody fragments, hormones and other targeting agents, and conjugates thereof |
| US5053394A (en) | 1988-09-21 | 1991-10-01 | American Cyanamid Company | Targeted forms of methyltrithio antitumor agents |
| US5612016A (en) | 1988-04-01 | 1997-03-18 | Immunomedics, Inc. | Conjugates of antibodies and bifunctional ligands |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| ES2126553T3 (es) | 1989-08-30 | 1999-04-01 | Aeci Ltd | Dispositivo dosificador y su uso. |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| SG48759A1 (en) | 1990-01-12 | 2002-07-23 | Abgenix Inc | Generation of xenogenic antibodies |
| JPH05508394A (ja) | 1990-04-25 | 1993-11-25 | ファルマシア・アンド・アップジョン・カンパニー | 新規なcc―1065アナログ |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| EP0519596B1 (en) | 1991-05-17 | 2005-02-23 | Merck & Co. Inc. | A method for reducing the immunogenicity of antibody variable domains |
| US5998656A (en) | 1991-09-23 | 1999-12-07 | Florida State University | C10 tricyclic taxanes |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| US6080777A (en) | 1992-01-31 | 2000-06-27 | The Trustees Of Columbia University In The City Of New York | Taxol as a radiation sensitizer |
| US5200534A (en) | 1992-03-13 | 1993-04-06 | University Of Florida | Process for the preparation of taxol and 10-deacetyltaxol |
| CA2076465C (en) | 1992-03-25 | 2002-11-26 | Ravi V. J. Chari | Cell binding agent conjugates of analogues and derivatives of cc-1065 |
| US6005079A (en) | 1992-08-21 | 1999-12-21 | Vrije Universiteit Brussels | Immunoglobulins devoid of light chains |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| US5703247A (en) | 1993-03-11 | 1997-12-30 | Virginia Tech Intellectual Properties, Inc. | 2-Debenzoyl-2-acyl taxol derivatives and methods for making same |
| US5475011A (en) | 1993-03-26 | 1995-12-12 | The Research Foundation Of State University Of New York | Anti-tumor compounds, pharmaceutical compositions, methods for preparation thereof and for treatment |
| US6740734B1 (en) | 1994-01-14 | 2004-05-25 | Biovitrum Ab | Bacterial receptor structures |
| SE9400088D0 (sv) | 1994-01-14 | 1994-01-14 | Kabi Pharmacia Ab | Bacterial receptor structures |
| US5773001A (en) | 1994-06-03 | 1998-06-30 | American Cyanamid Company | Conjugates of methyltrithio antitumor agents and intermediates for their synthesis |
| US5763477A (en) | 1994-07-22 | 1998-06-09 | Dr. Reddy's Research Foundation | Taxane derivatives from 14-β-hydroxy-10 deacetylbaccatin III |
| JPH11501931A (ja) | 1995-03-10 | 1999-02-16 | ハウザー,インコーポレイテッド | セファロマンニンエポキシド、その類似体およびそれらの製造方法 |
| CA2219361C (en) | 1995-04-27 | 2012-02-28 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5712374A (en) | 1995-06-07 | 1998-01-27 | American Cyanamid Company | Method for the preparation of substantiallly monomeric calicheamicin derivative/carrier conjugates |
| US5714586A (en) | 1995-06-07 | 1998-02-03 | American Cyanamid Company | Methods for the preparation of monomeric calicheamicin derivative/carrier conjugates |
| JP2002514895A (ja) | 1995-09-28 | 2002-05-21 | アレクション、ファーマスーティカルズ、インコーポレーテッド | ブタ細胞相互作用タンパク質 |
| US6001358A (en) | 1995-11-07 | 1999-12-14 | Idec Pharmaceuticals Corporation | Humanized antibodies to human gp39, compositions containing thereof |
| US6692742B1 (en) | 1996-06-27 | 2004-02-17 | Chugai Seiyaku Kabushiki Kaisha | Remedies for myeloma to be used together with nitrogen mustard antitumor agents |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| EP2305027B1 (en) | 1996-12-03 | 2014-07-02 | Amgen Fremont Inc. | Transgenic mammals having human Ig loci including plural VH and Vkappa regions and antibodies produced therefrom |
| ATE200679T1 (de) | 1997-04-14 | 2001-05-15 | Micromet Ag | Neues verfahren zur herstellung von anti-humanen antigenrezeptoren und deren verwendungen |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| US6962702B2 (en) | 1998-06-22 | 2005-11-08 | Immunomedics Inc. | Production and use of novel peptide-based agents for use with bi-specific antibodies |
| US6087362A (en) | 1999-03-16 | 2000-07-11 | Pentech Pharmaceuticals, Inc. | Apomorphine and sildenafil composition |
| US6635677B2 (en) | 1999-08-13 | 2003-10-21 | Case Western Reserve University | Methoxyamine combinations in the treatment of cancer |
| EP1229934B1 (en) | 1999-10-01 | 2014-03-05 | Immunogen, Inc. | Compositions and methods for treating cancer using immunoconjugates and chemotherapeutic agents |
| DE60032633T2 (de) | 1999-11-24 | 2007-10-04 | Immunogen Inc., Cambridge | Zytotoxische mittel, die taxane enthalten und ihre therapeutische anwendung |
| US6333410B1 (en) | 2000-08-18 | 2001-12-25 | Immunogen, Inc. | Process for the preparation and purification of thiol-containing maytansinoids |
| US7229960B2 (en) | 2000-11-03 | 2007-06-12 | University Of Vermont And State Agricultural College | Methods and compositions for inhibiting GRB7 |
| US6441163B1 (en) | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| KR20040054669A (ko) | 2001-08-03 | 2004-06-25 | 글리카트 바이오테크놀로지 아게 | 항체 의존적 세포 독성이 증가된 항체 글리코실화 변이체 |
| US20030109682A1 (en) | 2001-09-07 | 2003-06-12 | Daniel Santi | Maytansines and maytansine conjugates |
| US6716821B2 (en) | 2001-12-21 | 2004-04-06 | Immunogen Inc. | Cytotoxic agents bearing a reactive polyethylene glycol moiety, cytotoxic conjugates comprising polyethylene glycol linking groups, and methods of making and using the same |
| US20040002587A1 (en) | 2002-02-20 | 2004-01-01 | Watkins Jeffry D. | Fc region variants |
| US6756397B2 (en) | 2002-04-05 | 2004-06-29 | Immunogen, Inc. | Prodrugs of CC-1065 analogs |
| US6534660B1 (en) | 2002-04-05 | 2003-03-18 | Immunogen, Inc. | CC-1065 analog synthesis |
| EP1507557A4 (en) | 2002-04-23 | 2006-06-14 | Meir Strahilevitz | METHODS AND DEVICES FOR TARGETING A SITE IN A MAMMAL AND DETERMINING CHEMICAL SPECIES FROM A MAMMAL |
| ES2916174T3 (es) | 2002-05-02 | 2022-06-28 | Wyeth Holdings Llc | Conjugados de transportador derivado de caliqueamicina |
| US6596757B1 (en) | 2002-05-14 | 2003-07-22 | Immunogen Inc. | Cytotoxic agents comprising polyethylene glycol-containing taxanes and their therapeutic use |
| US7390898B2 (en) | 2002-08-02 | 2008-06-24 | Immunogen Inc. | Cytotoxic agents containing novel potent taxanes and their therapeutic use |
| JP2006500364A (ja) | 2002-08-16 | 2006-01-05 | イムノージェン インコーポレーテッド | 高い反応性と溶解度を有する架橋剤および小分子薬物の標的化送達用コンジュゲートの調製におけるそれらの使用 |
| US20040126379A1 (en) | 2002-08-21 | 2004-07-01 | Boehringer Ingelheim International Gmbh | Compositions and methods for treating cancer using cytotoxic CD44 antibody immunoconjugates and chemotherapeutic agents |
| EP2264151B1 (en) | 2003-01-22 | 2016-04-20 | Roche Glycart AG | Fusion constructs and use of same to produce antibodies with increased FC receptor binding affinity and effector function |
| EP1627081A4 (en) | 2003-05-02 | 2006-08-16 | Health Research Inc | USE OF JAG2 EXPRESSION IN THE DIAGNOSIS OF PLASMIC CELL DISORDERS |
| US8088387B2 (en) | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| US7276497B2 (en) | 2003-05-20 | 2007-10-02 | Immunogen Inc. | Cytotoxic agents comprising new maytansinoids |
| NZ580855A (en) | 2003-07-21 | 2012-03-30 | Immunogen Inc | A CA6 antigen-specific cytotoxic conjugate and methods of using the same |
| CN114053429A (zh) | 2004-06-01 | 2022-02-18 | 健泰科生物技术公司 | 抗体-药物偶联物和方法 |
| AU2004224925C1 (en) | 2004-08-30 | 2011-07-21 | Biotest Ag | Immunoconjugates targeting syndecan-1 expressing cells and use thereof |
| EA015584B1 (ru) | 2005-03-23 | 2011-10-31 | Генмаб А/С | Антитело к cd38 человека и его применение |
| JP2008538365A (ja) | 2005-04-15 | 2008-10-23 | イミュノジェン・インコーポレーテッド | 腫瘍内の不均一または混合細胞集団を排除する方法 |
| WO2007066109A1 (en) | 2005-12-06 | 2007-06-14 | Domantis Limited | Bispecific ligands with binding specificity to cell surface targets and methods of use therefor |
| BRPI0709843A2 (pt) | 2006-03-28 | 2011-07-26 | Biogen Idec Inc | anticorpos de anti-igf-1r e usos dos mesmos |
| US20100291105A1 (en) | 2006-05-03 | 2010-11-18 | Elke Pogge Von Strandmann | Agent for the treatment of malignant diseases |
| ES2475201T3 (es) | 2007-12-26 | 2014-07-10 | Biotest Ag | Agentes dirigidos contra CD138 y usos de los mismos |
| WO2009080831A1 (en) | 2007-12-26 | 2009-07-02 | Biotest Ag | Method of decreasing cytotoxic side-effects and improving efficacy of immunoconjugates |
| WO2009080832A1 (en) | 2007-12-26 | 2009-07-02 | Biotest Ag | Methods and agents for improving targeting of cd138 expressing tumor cells |
| KR20100097753A (ko) * | 2007-12-26 | 2010-09-03 | 바이오테스트 아게 | Cd138 표적성 면역접합체 및 이의 용도 |
| US8563700B2 (en) | 2008-06-16 | 2013-10-22 | Immunogen, Inc. | Synergistic effects |
| NZ613647A (en) | 2009-05-06 | 2015-02-27 | Biotest Ag | Uses of immunoconjugates targeting cd138 |
-
2012
- 2012-12-07 SG SG11201402887SA patent/SG11201402887SA/en unknown
- 2012-12-07 CA CA2858133A patent/CA2858133A1/en not_active Abandoned
- 2012-12-07 RU RU2014127298A patent/RU2632108C2/ru not_active IP Right Cessation
- 2012-12-07 MX MX2014006770A patent/MX358680B/es active IP Right Grant
- 2012-12-07 WO PCT/EP2012/074867 patent/WO2013083817A1/en active Application Filing
- 2012-12-07 US US13/708,014 patent/US10117932B2/en not_active Expired - Fee Related
- 2012-12-07 CN CN201280069240.6A patent/CN104302324A/zh active Pending
- 2012-12-07 EP EP12798723.8A patent/EP2788030B1/en not_active Not-in-force
- 2012-12-07 KR KR1020147018841A patent/KR20140100571A/ko not_active Application Discontinuation
- 2012-12-07 JP JP2014545298A patent/JP6218746B2/ja not_active Expired - Fee Related
- 2012-12-07 BR BR112014013694A patent/BR112014013694A2/pt not_active Application Discontinuation
- 2012-12-07 AU AU2012372140A patent/AU2012372140B9/en not_active Ceased
- 2012-12-07 ES ES12798723.8T patent/ES2684950T3/es active Active
-
2014
- 2014-06-05 IL IL232991A patent/IL232991A0/en unknown
-
2015
- 2015-04-13 HK HK15103595.6A patent/HK1203053A1/xx not_active IP Right Cessation
-
2018
- 2018-09-24 US US16/139,379 patent/US20190117770A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| HK1203053A1 (en) | 2015-10-16 |
| RU2632108C2 (ru) | 2017-10-02 |
| US10117932B2 (en) | 2018-11-06 |
| MX2014006770A (es) | 2014-10-17 |
| IL232991A0 (en) | 2014-07-31 |
| MX358680B (es) | 2018-08-31 |
| SG11201402887SA (en) | 2014-07-30 |
| RU2014127298A (ru) | 2016-01-27 |
| ES2684950T3 (es) | 2018-10-05 |
| AU2012372140B9 (en) | 2015-10-15 |
| WO2013083817A1 (en) | 2013-06-13 |
| AU2012372140A1 (en) | 2013-09-26 |
| JP6218746B2 (ja) | 2017-10-25 |
| US20140010828A1 (en) | 2014-01-09 |
| NZ626680A (en) | 2016-05-27 |
| JP2015500822A (ja) | 2015-01-08 |
| US20190117770A1 (en) | 2019-04-25 |
| EP2788030B1 (en) | 2018-06-20 |
| CN104302324A (zh) | 2015-01-21 |
| EP2788030A1 (en) | 2014-10-15 |
| CA2858133A1 (en) | 2013-06-13 |
| BR112014013694A2 (pt) | 2017-06-13 |
| AU2012372140B2 (en) | 2015-09-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101725170B1 (ko) | Cd138을 표적으로 하는 면역접합체의 용도 | |
| US20190117770A1 (en) | Uses of immunoconjugates targeting cd138 | |
| TWI450726B (zh) | 用於改良靶定於表現cd138之腫瘤細胞的方法及藥劑 | |
| TWI501778B (zh) | 靶定cd138之免疫綴合物及其用途 | |
| US9011864B2 (en) | Method of decreasing cytotoxic side-effects and improving efficacy of immunoconjugates | |
| EA036882B1 (ru) | Антитела против cd123 и конъюгаты указанных антител | |
| TW200934511A (en) | Agents targeting CD138 and uses thereof | |
| AU2013201618B2 (en) | Uses of immunoconjugates targeting CD138 | |
| NZ626680B2 (en) | Uses of immunoconjugates targeting cd138 | |
| WO2017194568A1 (en) | Treatment regimen using anti-muc1 maytansinoid immunoconjugate antibody for the treatment of tumors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |