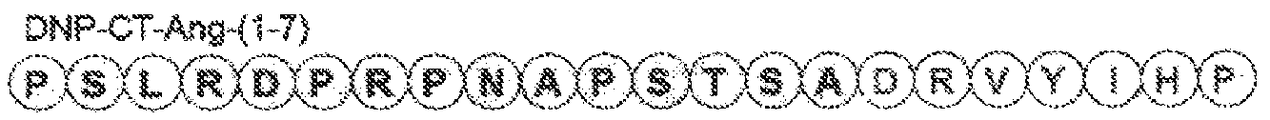KR20140059249A - 나트륨이뇨 폴리펩티드 - Google Patents
나트륨이뇨 폴리펩티드 Download PDFInfo
- Publication number
- KR20140059249A KR20140059249A KR1020147007530A KR20147007530A KR20140059249A KR 20140059249 A KR20140059249 A KR 20140059249A KR 1020147007530 A KR1020147007530 A KR 1020147007530A KR 20147007530 A KR20147007530 A KR 20147007530A KR 20140059249 A KR20140059249 A KR 20140059249A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- sequence
- polypeptide
- set forth
- substitutions
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/58—Atrial natriuretic factor complex; Atriopeptin; Atrial natriuretic peptide [ANP]; Cardionatrin; Cardiodilatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/2242—Atrial natriuretic factor complex: Atriopeptins, atrial natriuretic protein [ANP]; Cardionatrin, Cardiodilatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
Abstract
본원은 나트륨이뇨 폴리펩티드에 관한 방법 및 물질, 및 심혈관 및/또는 신장 병태를 치료하기 위한 나트륨이뇨 폴리펩티드의 용도를 제공한다. 예를 들면, 나트륨이뇨 펩티드(예를 들면, ANP, BNP, CNP, URO 또는 DNP)의 하나 이상의 아미노산 절편(예를 들면, N-말단 꼬리, 고리 구조, C-말단 꼬리 또는 이들의 조합) 및 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7))을 갖는 키메라 폴리펩티드가 제공된다.
Description
관련 출원에 대한 교차참조
본원은 2012년 5월 18일자로 출원된 미국 가출원 제61/648,718호 및 2011년 8월 30일자로 출원된 미국 가출원 제61/529,113호의 이익을 주장한다. 선행 출원들의 개시는 본원의 개시의 일부로서 간주된다(그리고 참고로 본원의 개시에 도입된다).
연방 지원 연구에 대한 진술
본 발명은 국립보건원에 의해 수여된 승인번호 HL036634 및 HL076611 하에서 정부 지원으로 만들어졌다. 정부는 본 발명에 대한 일부 권리를 갖는다.
기술분야
본원은 나트륨이뇨 폴리펩티드에 관한 것이다. 예를 들면, 본원은 나트륨이뇨 폴리펩티드에 관한 방법 및 물질, 및 심혈관 및 신장 병태를 치료하기 위한 나트륨이뇨 폴리펩티드의 용도를 제공한다.
나트륨이뇨 폴리펩티드는 나트륨뇨배설항진(소변 중의 증가된 나트륨 배설)을 야기할 수 있는 폴리펩티드이다. 이러한 폴리펩티드는 뇌, 심장, 신장 및/또는 혈관 조직에 의해 생성될 수 있다. 인간에서 나트륨이뇨 펩티드 패밀리는 심장 호르몬 심방 나트륨이뇨 펩티드(ANP), B형 나트륨이뇨 펩티드(BNP), C형 나트륨이뇨 펩티드(CNP) 및 유로딜라틴(urodilatin)(URO)을 포함한다. 나트륨이뇨 폴리펩티드는 구아닐릴 사이클라제(guanylyl cyclase) 수용체(즉, ANP, BNP 및 URO에 대한 NPR-A; 및 CNP에 대한 NPR-B) 및 제2 메신저 환형 3'5' 구아노신 모노포스페이트(cGMP)를 통해 작용한다(Kuhn, Circ. Res., 93:700-709 (2003); Tawaragi et al., Biochem. Biophys. Res. Commun., 175:645-651 (1991); and Komatsu et al., Endocrinol., 129:1104-1106 (1991)).
요약
본원은 나트륨이뇨 폴리펩티드에 관한 방법 및 물질, 및 심혈관 및/또는 신장 병태를 치료하기 위한 나트륨이뇨 폴리펩티드의 용도를 제공한다. 예를 들면, 본원은 나트륨이뇨 펩티드(예를 들면, ANP, BNP, CNP, URO 또는 덴드로아스피스(Dendroaspis) 나트륨이뇨 펩티드(DNP))의 하나 이상의 아미노산 절편(예를 들면, N-말단 꼬리, 고리 구조, C-말단 꼬리 또는 이들의 조합) 및 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7))을 갖는 키메라 폴리펩티드를 제공한다.
본원에 기재된 바와 같이, 키메라 폴리펩티드는 인간 심장 섬유모세포를 자극하여 cGMP를 생성하는 능력을 갖는 키메라 폴리펩티드를 발생시키는 방식으로 CNP의 고리 구조의 C-말단으로서 부착된 Ang-(1-7) 아미노산 서열을 포함하도록 디자인될 수 있다. 이들 결과는 키메라 폴리펩티드로 하여금 활성, 예컨대, cGMP 생성을 활성화시키는 능력을 나타내게 하는 방식으로 키메라 폴리펩티드가 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7)) 및 나트륨이뇨 펩티드(예를 들면, ANP, BNP, CNP, URO 또는 덴드로아스피스 나트륨이뇨 펩티드(DNP))의 하나 이상의 아미노산 절편(예를 들면, N-말단 꼬리, C-말단 꼬리 또는 이들의 조합)을 포함하도록 디자인될 수 있다는 것을 입증한다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 이뇨 활성, 나트륨이뇨 활성, cGMP를 활성화시키는 능력, 사구체 여과율을 증가시키는 능력, 레닌 생성을 감소시키는 능력, 안지오텐신 생성을 감소시키는 능력, 알도스테론 생성을 감소시키는 능력, 비정상적으로 상승된 심장 충만압을 감소시키는 능력, 신장 혈류를 최적화하는 능력 또는 이들의 조합을 나타낼 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 키메라 나트륨이뇨 폴리펩티드일 수 있다.
일반적으로, 본원의 한 양태는 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 2에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열, (b) 서열번호 3에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 3에 기재된 서열, 및 (c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 가질 수 있다. 상기 폴리펩티드는 서열번호 2에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 3에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다.
또 다른 양태에서, 본원은 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 4에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 4에 기재된 서열, (b) 서열번호 5에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 및 (c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 가질 수 있다. 상기 폴리펩티드는 서열번호 4에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 5에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다.
또 다른 양태에서, 본원은 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 6에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 6에 기재된 서열, (b) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 및 (c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 가질 수 있다. 상기 폴리펩티드는 서열번호 6에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 7에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다.
또 다른 양태에서, 본원은 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 8에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 8에 기재된 서열, (b) 서열번호 9에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 9에 기재된 서열, 및 (c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 가질 수 있다. 상기 폴리펩티드는 서열번호 8에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 9에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다.
또 다른 양태에서, 본원은 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 10에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 10에 기재된 서열, (b) 서열번호 11에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 11에 기재된 서열, 및 (c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 가질 수 있다. 상기 폴리펩티드는 서열번호 10에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 11에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다.
또 다른 양태에서, 본원은 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, (b) 서열번호 2에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열, 및 (c) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 가질 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 2에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 12에 기재된 서열을 포함할 수 있다.
또 다른 양태에서, 본원은 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, (b) 서열번호 5에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 및 (c) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 가질 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 5에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 13에 기재된 서열을 포함할 수 있다.
또 다른 양태에서, 본원은 10개 내지 14개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및 (b) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 12에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조를 결여할 수 있다.
또 다른 양태에서, 본원은 10개 내지 16개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및 (b) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 13에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조를 결여할 수 있다.
또 다른 양태에서, 본원은 19개 내지 25개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및 (b) 서열번호 30에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 30에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 30에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조를 결여할 수 있다.
또 다른 양태에서, 본원은 10개 내지 14개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열, 및 (b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 12에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조를 결여할 수 있다.
또 다른 양태에서, 본원은 10개 내지 16개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열, 및 (b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 13에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조를 결여할 수 있다.
또 다른 양태에서, 본원은 19개 내지 25개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 30에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 30에 기재된 서열, 및 (b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 30에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조를 결여할 수 있다.
또 다른 양태에서, 본원은 20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및 (b) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열을 포함한다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 7에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조에 부착된 C-말단 꼬리를 결여할 수 있다.
또 다른 양태에서, 본원은 20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 36에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 36에 기재된 서열, 및 (b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 36에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조에 부착된 N-말단 꼬리를 결여할 수 있다.
또 다른 양태에서, 본원은 20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및 (b) 서열번호 36에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 36에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 36에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조에 부착된 C-말단 꼬리를 결여할 수 있다.
또 다른 양태에서, 본원은 20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 및 (b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 7에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 고리 구조에 부착된 N-말단 꼬리를 결여할 수 있다.
또 다른 양태에서, 본원은 17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드를 특징으로 한다. 상기 폴리펩티드는 아미노 말단부터 카복시 말단까지 순서대로 (a) 서열번호 2에 기재된 서열, 서열번호 4에 기재된 서열, 서열번호 6에 기재된 서열, 서열번호 8에 기재된 서열, 서열번호 10에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 4에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 6에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 8에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 10에 기재된 서열, (b) 서열번호 3에 기재된 서열, 서열번호 5에 기재된 서열, 서열번호 7에 기재된 서열, 서열번호 9에 기재된 서열, 서열번호 11에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 3에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 9에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 11에 기재된 서열, 및 (c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열을 포함하거나 본질적으로 이들 서열로 구성된다. 상기 폴리펩티드는 cGMP 활성화 성질을 포함할 수 있다. 상기 폴리펩티드는 서열번호 2, 4, 6, 8 또는 10에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 3, 5, 7, 9 또는 11에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58 또는 59에 기재된 서열을 포함할 수 있다. 상기 폴리펩티드는 17개 내지 45개 아미노산 잔기, 17개 내지 40개 아미노산 잔기, 17개 내지 35개 아미노산 잔기, 20개 내지 50개 아미노산 잔기, 25개 내지 50개 아미노산 잔기, 20개 내지 45개 아미노산 잔기, 20개 내지 40개 아미노산 잔기, 20개 내지 35개 아미노산 잔기, 25개 내지 45개 아미노산 잔기, 25개 내지 40개 아미노산 잔기 또는 25개 내지 35개 아미노산 잔기의 길이를 가질 수 있다.
달리 정의되어 있지 않은 한, 본원에서 사용된 모든 기술적 및 과학적 용어들은 본 발명이 속하는 분야에서 통상의 기술을 가진 자에 의해 통상적으로 이해되는 의미와 동일한 의미를 갖는다. 본원에 기재된 방법 및 물질과 유사하거나 동등한 방법 및 물질이 본 발명을 실시하기 위해 사용될 수 있지만, 적합한 방법 및 물질이 하기 기재되어 있다. 본원에서 언급된 모든 문헌, 특허출원, 특허 및 다른 참조문헌은 전체적으로 참고로 도입된다. 모순이 있는 경우, 정의를 포함하는 본 명세서가 좌우할 것이다. 또한, 물질, 방법 및 예는 단지 예시하기 위한 것이고 한정하기 위한 것이 아니다.
본 발명의 하나 이상의 실시양태의 세부사항은 첨부된 도면 및 하기 설명에 기재되어 있다. 본 발명의 다른 특징, 목적 및 이점은 설명 및 도면, 및 특허청구범위로부터 명확해질 것이다.
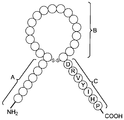
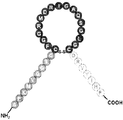
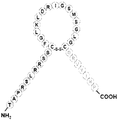
도 1은 몇몇 실시양태에 따라 나트륨이뇨 펩티드의 N-말단 및 고리 구조, 및 안지오텐신 폴리펩티드의 절편의 C-말단을 함유하는 키메라 폴리펩티드의 구조적 개략도이다. 도 1에 나타낸 안지오텐신 폴리펩티드의 아미노산 절편(DRVYIHP; 서열번호 1)은 안지오텐신-(1-7) 또는 Ang-(1-7)로서 지칭될 수 있다. 상기 N-말단 및 고리 구조는 ANP, BNP, CNP, DNP 및 URO를 포함하나 이들로 한정되지 않는 임의의 적절한 나트륨이뇨 펩티드의 서열을 가질 수 있다. "A"는 나트륨이뇨 펩티드의 N-말단의 아미노산 서열을 지칭하고, "B"는 나트륨이뇨 펩티드의 고리 구조의 아미노산 서열을 지칭하고, "C"는 키메라 폴리펩티드의 C-말단을 형성할 수 있는 Ang(1-7)의 아미노산 서열을 지칭한다.
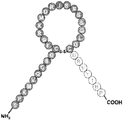
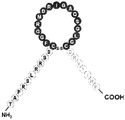
도 2는 몇몇 실시양태에 따른 ANP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 43)의 구조적 개략도이다. 도 2에 나타낸 ANP의 N-말단 절편의 아미노산 서열(SLRRSS; 서열번호 2)은 ANPN-말단으로서 지칭될 수 있는 반면, 도 2에 나타낸 ANP의 고리 구조 절편의 아미노산 서열(CFGGRMDRIGAQ-SGLGC; 서열번호 3)은 ANP고리로서 지칭될 수 있다.
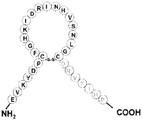
도 3은 몇몇 실시양태에 따라 BNP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 44)의 구조적 개략도이다. 도 3에 나타낸 BNP의 N-말단 절편의 아미노산 서열(SPKMVQGSG; 서열번호 4)은 BNPN-말단으로서 지칭될 수 있는 반면, 도 3에 나타낸 BNP의 고리 구조 절편의 아미노산 서열(CFGRKM-DRISSSSGLGC; 서열번호 5)은 BNP고리로서 지칭될 수 있다. 서열번호 44에 기재된 아미노산 서열을 갖는 키메라 폴리펩티드는 BNP-Ang1-7로서 지칭될 수 있다.
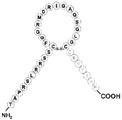
도 4는 몇몇 실시양태에 따라 CNP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 45)의 구조적 개략도이다. 도 4에 나타낸 CNP의 N-말단 절편의 아미노산 서열(GLSKG; 서열번호 6)은 CNPN-말단으로서 지칭될 수 있는 반면, 도 4에 나타낸 CNP의 고리 구조 절편의 아미노산 서열(CFGLKLDRIG-SMSGLGC; 서열번호 7)은 CNP고리로서 지칭될 수 있다. 도 4에 나타낸 키메라 폴리펩티드는 cAng 또는 cANG로서 지칭될 수 있다.
도 5는 몇몇 실시양태에 따라 DNP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 46)의 구조적 개략도이다. 도 5에 나타낸 DNP의 N-말단 절편의 아미노산 서열(EVKYDP; 서열번호 8)은 DNPN-말단으로서 지칭될 수 있는 반면, 도 5에 나타낸 DNP의 고리 구조 절편의 아미노산 서열(CFGHKIDRINHVS-NLGC; 서열번호 9)은 DNP고리로서 지칭될 수 있다.
도 6은 몇몇 실시양태에 따라 URO의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 47)의 구조적 개략도이다. 도 6에 나타낸 URO의 N-말단 절편의 아미노산 서열(TAPRSLRRSS; 서열번호 10)은 URON-말단으로서 지칭될 수 있는 반면, 도 6에 나타낸 URO의 고리 구조 절편의 아미노산 서열(CFGG-RMDRIGAQSGLGC; 서열번호 11)은 URO고리로서 지칭될 수 있다.
도 7은 몇몇 실시양태에 따라 BNP의 N-말단(BNPN-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 48)의 구조적 개략도이다.
도 8은 몇몇 실시양태에 따라 CNP의 N-말단(CNPN-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 49)의 구조적 개략도이다.
도 9는 몇몇 실시양태에 따라 DNP의 N-말단(DNPN-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 50)의 구조적 개략도이다.
도 10은 몇몇 실시양태에 따라 URO의 N-말단(URON-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 51)의 구조적 개략도이다.
도 11은 몇몇 실시양태에 따라 ANP의 N-말단(ANPN-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 52)의 구조적 개략도이다.
도 12는 몇몇 실시양태에 따라 CNP의 N-말단(CNPN-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 53)의 구조적 개략도이다.
도 13은 몇몇 실시양태에 따라 DNP의 N-말단(DNPN-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 54)의 구조적 개략도이다.
도 14는 몇몇 실시양태에 따라 URO의 N-말단(URON-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 55)의 구조적 개략도이다.
도 15는 몇몇 실시양태에 따라 ANP의 N-말단(ANPN-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 56)의 구조적 개략도이다.
도 16은 몇몇 실시양태에 따라 BNP의 N-말단(BNPN-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 57)의 구조적 개략도이다.
도 17은 몇몇 실시양태에 따라 DNP의 N-말단(DNPN-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 58)의 구조적 개략도이다.
도 18은 몇몇 실시양태에 따라 URO의 N-말단(URON-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 59)의 구조적 개략도이다.
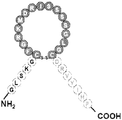
도 19는 몇몇 실시양태에 따라 N-말단 Ang-(1-7), 및 ANP의 고리 구조(ANP고리) 및 C-말단을 함유하는 키메라 폴리펩티드(서열번호 60)의 구조적 개략도이다. 도 19에 나타낸 ANP의 C-말단 절편의 아미노산 서열(NSFRY; 서열번호 12)은 ANPC-말단으로서 지칭될 수 있다.
도 20은 몇몇 실시양태에 따라 N-말단 Ang-(1-7), 및 BNP의 고리 구조(BNP고리) 및 C-말단을 함유하는 키메라 폴리펩티드(서열번호 61)의 구조적 개략도이다. 도 20에 나타낸 BNP의 C-말단 절편의 아미노산 서열(KVLRRH; 서열번호 13)은 BNPC-말단으로서 지칭될 수 있다. 서열번호 61에 기재된 아미노산 서열을 갖는 키메라 폴리펩티드는 Ang1-7BNP로서 지칭될 수 있다.
도 21은 ANP(10-6 M), BNP(10-6 M), CNP(10-6 M) 또는 cANG(10-6, 10-8 또는 10-10 M)에 노출되었을 때 인간 심장 섬유모세포에 의해 생성된 cGMP의 수준(pmol/㎖)을 작도한 그래프이다.
도 22는 단독으로, 또는 A-71915(1 μM; NPR-A 차단제(예를 들면, 문헌(Kumar et al., Hypertension, 29(1 Pt 2):414-21 (1997)) 참조) 또는 NPR-B 항체(1:100 희석)의 존재 하에서 ANP(10-6 M), BNP(10-6 M), CNP(10-6 M) 또는 cANG(10-6 M)에 노출되었을 때 인간 심장 섬유모세포에 의해 생성된 cGMP의 수준(pmol/㎖)을 작도한 그래프이다.
도 23은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 Ang-(1-7) 및 ANP의 C-말단(ANPC-말단)을 함유하는 키메라 폴리펩티드(서열번호 27)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-ANP-CT로서 지칭될 수 있다.
도 24는 몇몇 실시양태에 따라 고리 구조 없이 N-말단 Ang-(1-7) 및 BNP의 C-말단(BNPC-말단)을 함유하는 키메라 폴리펩티드(서열번호 28)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-BNP-CT로서 지칭될 수 있다.
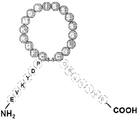
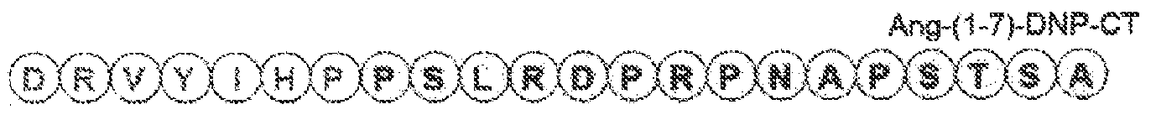
도 25는 몇몇 실시양태에 따라 고리 구조 없이 N-말단 Ang-(1-7) 및 DNP의 C-말단(DNPC-말단)을 함유하는 키메라 폴리펩티드(서열번호 29)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-DNP-CT로서 지칭될 수 있다. 도 25에 나타낸 DNP의 C-말단 절편의 아미노산 서열(PSLRDPRPNAPSTSA; 서열번호 30)은 DNPC-말단으로서 지칭될 수 있다.
도 26은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 절편으로서 ANP의 C-말단(ANPC-말단)에 이어서 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 31)의 구조적 개략도이다. 이 폴리펩티드는 ANP-CT-Ang-(1-7)로서 지칭될 수 있다.
도 27은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 절편으로서 BNP의 C-말단(BNPC-말단)에 이어서 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 32)의 구조적 개략도이다. 이 폴리펩티드는 BNP-CT-Ang-(1-7)로서 지칭될 수 있다.
도 28은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 절편으로서 DNP의 C-말단(DNPC-말단)에 이어서 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 33)의 구조적 개략도이다. 이 폴리펩티드는 DNP-CT-Ang-(1-7)로서 지칭될 수 있다.
도 29는 몇몇 실시양태에 따라 C-말단 꼬리 없이 N-말단 Ang-(1-7) 및 고리 구조(CNP고리)를 함유하는 키메라 폴리펩티드(서열번호 34)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR1로서 지칭될 수 있다.
도 30은 몇몇 실시양태에 따라 N-말단 꼬리 없이 CNP의 역 고리 구조 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 35)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR2로서 지칭될 수 있다. 도 30에 나타낸 CNP의 역 고리 구조 절편의 아미노산 서열(CGLGSMSGIRDLKLGFC; 서열번호 36)은 역-CNP고리로서 지칭될 수 있다.
도 31은 몇몇 실시양태에 따라 C-말단 꼬리 없이 N-말단 Ang-(1-7) 및 역 고리 구조(역-CNP고리)를 함유하는 키메라 폴리펩티드(서열번호 37)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR3으로서 지칭될 수 있다.
도 32는 몇몇 실시양태에 따라 N-말단 꼬리 없이 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 38)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR4로서 지칭될 수 있다.
도 33은 표시된 양(10-6, 10-8 또는 10-10 M)의 BNP(BNP1-32; 도 33A), Ang1-7BNP(도 33B) 또는 BNP-Ang1-7(도 33C)을 사용한 HEK 293 세포의 처리로부터 발생된 cGMP 수준을 작도한 그래프를 함유한다. NPR-A(즉, GC-A)를 발현하도록 HEK 293 세포를 안정하게 형질감염시켰다.
도 34는 표시된 양(10-6, 10-8 또는 10-10 M)의 BNP(BNP1-32; 도 34A), Ang1-7BNP(도 34B) 또는 BNP-Ang1-7(도 34C)을 사용한 HEK 293 세포의 처리로부터 발생된 cGMP 수준을 작도한 그래프를 함유한다. NPR-B(즉, GC-B)를 발현하도록 HEK 293 세포를 안정하게 형질감염시켰다.
도 35는 표시된 양(10-6, 10-8 또는 10-10 M)의 Ang1-7을 사용한 HEK 293 세포의 처리로부터 발생된 cGMP 수준을 작도한 그래프를 함유한다. NPR-A(즉, GC-A)(좌측 그래프) 또는 NPR-B(즉, GC-B)(우측 그래프)를 발현하도록 HEK 293 세포를 안정하게 형질감염시켰다.
도 2는 몇몇 실시양태에 따른 ANP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 43)의 구조적 개략도이다. 도 2에 나타낸 ANP의 N-말단 절편의 아미노산 서열(SLRRSS; 서열번호 2)은 ANPN-말단으로서 지칭될 수 있는 반면, 도 2에 나타낸 ANP의 고리 구조 절편의 아미노산 서열(CFGGRMDRIGAQ-SGLGC; 서열번호 3)은 ANP고리로서 지칭될 수 있다.
도 3은 몇몇 실시양태에 따라 BNP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 44)의 구조적 개략도이다. 도 3에 나타낸 BNP의 N-말단 절편의 아미노산 서열(SPKMVQGSG; 서열번호 4)은 BNPN-말단으로서 지칭될 수 있는 반면, 도 3에 나타낸 BNP의 고리 구조 절편의 아미노산 서열(CFGRKM-DRISSSSGLGC; 서열번호 5)은 BNP고리로서 지칭될 수 있다. 서열번호 44에 기재된 아미노산 서열을 갖는 키메라 폴리펩티드는 BNP-Ang1-7로서 지칭될 수 있다.
도 4는 몇몇 실시양태에 따라 CNP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 45)의 구조적 개략도이다. 도 4에 나타낸 CNP의 N-말단 절편의 아미노산 서열(GLSKG; 서열번호 6)은 CNPN-말단으로서 지칭될 수 있는 반면, 도 4에 나타낸 CNP의 고리 구조 절편의 아미노산 서열(CFGLKLDRIG-SMSGLGC; 서열번호 7)은 CNP고리로서 지칭될 수 있다. 도 4에 나타낸 키메라 폴리펩티드는 cAng 또는 cANG로서 지칭될 수 있다.
도 5는 몇몇 실시양태에 따라 DNP의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 46)의 구조적 개략도이다. 도 5에 나타낸 DNP의 N-말단 절편의 아미노산 서열(EVKYDP; 서열번호 8)은 DNPN-말단으로서 지칭될 수 있는 반면, 도 5에 나타낸 DNP의 고리 구조 절편의 아미노산 서열(CFGHKIDRINHVS-NLGC; 서열번호 9)은 DNP고리로서 지칭될 수 있다.
도 6은 몇몇 실시양태에 따라 URO의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 47)의 구조적 개략도이다. 도 6에 나타낸 URO의 N-말단 절편의 아미노산 서열(TAPRSLRRSS; 서열번호 10)은 URON-말단으로서 지칭될 수 있는 반면, 도 6에 나타낸 URO의 고리 구조 절편의 아미노산 서열(CFGG-RMDRIGAQSGLGC; 서열번호 11)은 URO고리로서 지칭될 수 있다.
도 7은 몇몇 실시양태에 따라 BNP의 N-말단(BNPN-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 48)의 구조적 개략도이다.
도 8은 몇몇 실시양태에 따라 CNP의 N-말단(CNPN-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 49)의 구조적 개략도이다.
도 9는 몇몇 실시양태에 따라 DNP의 N-말단(DNPN-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 50)의 구조적 개략도이다.
도 10은 몇몇 실시양태에 따라 URO의 N-말단(URON-말단), ANP의 고리 구조(ANP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 51)의 구조적 개략도이다.
도 11은 몇몇 실시양태에 따라 ANP의 N-말단(ANPN-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 52)의 구조적 개략도이다.
도 12는 몇몇 실시양태에 따라 CNP의 N-말단(CNPN-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 53)의 구조적 개략도이다.
도 13은 몇몇 실시양태에 따라 DNP의 N-말단(DNPN-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 54)의 구조적 개략도이다.
도 14는 몇몇 실시양태에 따라 URO의 N-말단(URON-말단), BNP의 고리 구조(BNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 55)의 구조적 개략도이다.
도 15는 몇몇 실시양태에 따라 ANP의 N-말단(ANPN-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 56)의 구조적 개략도이다.
도 16은 몇몇 실시양태에 따라 BNP의 N-말단(BNPN-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 57)의 구조적 개략도이다.
도 17은 몇몇 실시양태에 따라 DNP의 N-말단(DNPN-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 58)의 구조적 개략도이다.
도 18은 몇몇 실시양태에 따라 URO의 N-말단(URON-말단), CNP의 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 59)의 구조적 개략도이다.
도 19는 몇몇 실시양태에 따라 N-말단 Ang-(1-7), 및 ANP의 고리 구조(ANP고리) 및 C-말단을 함유하는 키메라 폴리펩티드(서열번호 60)의 구조적 개략도이다. 도 19에 나타낸 ANP의 C-말단 절편의 아미노산 서열(NSFRY; 서열번호 12)은 ANPC-말단으로서 지칭될 수 있다.
도 20은 몇몇 실시양태에 따라 N-말단 Ang-(1-7), 및 BNP의 고리 구조(BNP고리) 및 C-말단을 함유하는 키메라 폴리펩티드(서열번호 61)의 구조적 개략도이다. 도 20에 나타낸 BNP의 C-말단 절편의 아미노산 서열(KVLRRH; 서열번호 13)은 BNPC-말단으로서 지칭될 수 있다. 서열번호 61에 기재된 아미노산 서열을 갖는 키메라 폴리펩티드는 Ang1-7BNP로서 지칭될 수 있다.
도 21은 ANP(10-6 M), BNP(10-6 M), CNP(10-6 M) 또는 cANG(10-6, 10-8 또는 10-10 M)에 노출되었을 때 인간 심장 섬유모세포에 의해 생성된 cGMP의 수준(pmol/㎖)을 작도한 그래프이다.
도 22는 단독으로, 또는 A-71915(1 μM; NPR-A 차단제(예를 들면, 문헌(Kumar et al., Hypertension, 29(1 Pt 2):414-21 (1997)) 참조) 또는 NPR-B 항체(1:100 희석)의 존재 하에서 ANP(10-6 M), BNP(10-6 M), CNP(10-6 M) 또는 cANG(10-6 M)에 노출되었을 때 인간 심장 섬유모세포에 의해 생성된 cGMP의 수준(pmol/㎖)을 작도한 그래프이다.
도 23은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 Ang-(1-7) 및 ANP의 C-말단(ANPC-말단)을 함유하는 키메라 폴리펩티드(서열번호 27)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-ANP-CT로서 지칭될 수 있다.
도 24는 몇몇 실시양태에 따라 고리 구조 없이 N-말단 Ang-(1-7) 및 BNP의 C-말단(BNPC-말단)을 함유하는 키메라 폴리펩티드(서열번호 28)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-BNP-CT로서 지칭될 수 있다.
도 25는 몇몇 실시양태에 따라 고리 구조 없이 N-말단 Ang-(1-7) 및 DNP의 C-말단(DNPC-말단)을 함유하는 키메라 폴리펩티드(서열번호 29)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-DNP-CT로서 지칭될 수 있다. 도 25에 나타낸 DNP의 C-말단 절편의 아미노산 서열(PSLRDPRPNAPSTSA; 서열번호 30)은 DNPC-말단으로서 지칭될 수 있다.
도 26은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 절편으로서 ANP의 C-말단(ANPC-말단)에 이어서 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 31)의 구조적 개략도이다. 이 폴리펩티드는 ANP-CT-Ang-(1-7)로서 지칭될 수 있다.
도 27은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 절편으로서 BNP의 C-말단(BNPC-말단)에 이어서 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 32)의 구조적 개략도이다. 이 폴리펩티드는 BNP-CT-Ang-(1-7)로서 지칭될 수 있다.
도 28은 몇몇 실시양태에 따라 고리 구조 없이 N-말단 절편으로서 DNP의 C-말단(DNPC-말단)에 이어서 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 33)의 구조적 개략도이다. 이 폴리펩티드는 DNP-CT-Ang-(1-7)로서 지칭될 수 있다.
도 29는 몇몇 실시양태에 따라 C-말단 꼬리 없이 N-말단 Ang-(1-7) 및 고리 구조(CNP고리)를 함유하는 키메라 폴리펩티드(서열번호 34)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR1로서 지칭될 수 있다.
도 30은 몇몇 실시양태에 따라 N-말단 꼬리 없이 CNP의 역 고리 구조 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 35)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR2로서 지칭될 수 있다. 도 30에 나타낸 CNP의 역 고리 구조 절편의 아미노산 서열(CGLGSMSGIRDLKLGFC; 서열번호 36)은 역-CNP고리로서 지칭될 수 있다.
도 31은 몇몇 실시양태에 따라 C-말단 꼬리 없이 N-말단 Ang-(1-7) 및 역 고리 구조(역-CNP고리)를 함유하는 키메라 폴리펩티드(서열번호 37)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR3으로서 지칭될 수 있다.
도 32는 몇몇 실시양태에 따라 N-말단 꼬리 없이 고리 구조(CNP고리) 및 C-말단 Ang-(1-7)을 함유하는 키메라 폴리펩티드(서열번호 38)의 구조적 개략도이다. 이 폴리펩티드는 Ang-(1-7)-CNPR4로서 지칭될 수 있다.
도 33은 표시된 양(10-6, 10-8 또는 10-10 M)의 BNP(BNP1-32; 도 33A), Ang1-7BNP(도 33B) 또는 BNP-Ang1-7(도 33C)을 사용한 HEK 293 세포의 처리로부터 발생된 cGMP 수준을 작도한 그래프를 함유한다. NPR-A(즉, GC-A)를 발현하도록 HEK 293 세포를 안정하게 형질감염시켰다.
도 34는 표시된 양(10-6, 10-8 또는 10-10 M)의 BNP(BNP1-32; 도 34A), Ang1-7BNP(도 34B) 또는 BNP-Ang1-7(도 34C)을 사용한 HEK 293 세포의 처리로부터 발생된 cGMP 수준을 작도한 그래프를 함유한다. NPR-B(즉, GC-B)를 발현하도록 HEK 293 세포를 안정하게 형질감염시켰다.
도 35는 표시된 양(10-6, 10-8 또는 10-10 M)의 Ang1-7을 사용한 HEK 293 세포의 처리로부터 발생된 cGMP 수준을 작도한 그래프를 함유한다. NPR-A(즉, GC-A)(좌측 그래프) 또는 NPR-B(즉, GC-B)(우측 그래프)를 발현하도록 HEK 293 세포를 안정하게 형질감염시켰다.
본원은 나트륨이뇨 폴리펩티드에 관한 방법 및 물질, 및 심혈관 및/또는 신장 병태를 치료하기 위한 나트륨이뇨 폴리펩티드의 용도를 제공한다. 예를 들면, 본원은 나트륨이뇨 펩티드(예를 들면, ANP, BNP, CNP, URO 또는 DNP)의 하나 이상의 아미노산 절편(예를 들면, N-말단 꼬리, 고리 구조, 역 고리 구조, C-말단 꼬리, 또는 이들의 조합), 및 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7), Ang-(1-8) 또는 Ang-(1-9))을 갖는 키메라 폴리펩티드를 제공한다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 나트륨이뇨 활성의 증가를 필요로 하는 대상체에서 나트륨이뇨 활성을 증가시키기 위해 사용될 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 혈장 cGMP 수준, 소변 cGMP 배설, 순 신장 cGPM 발생, 소변 유동, 소변 나트륨 배설, 소변 칼륨 배설, 혈구용적률, 혈장 BNP 면역반응성, 신장 혈류 및/또는 혈장 ANP 면역반응성을 증가시키기 위해 사용될 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 신장 혈관 저항성, 나트륨의 근위 및 원위 분획 재흡수, 평균 동맥 혈압, 폐 모세혈관 쐐기압, 우측 심방압, 폐 심방압, 혈장 레닌 활성, 혈장 안지오텐신 II 수준, 혈장 알도스테론 수준, 신장 관류압 및/또는 전신 혈관 저항성을 감소시키기 위해 사용될 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 심장 리모델링 및 허혈-재관류 손상, 특히 급성 심근경색(AMI) 및/또는 급성 심부전(AHF) 후 허혈-재관류 손상의 치료, 억제 및/또는 예방을 위해 사용될 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드는 심근 허혈-재관류 손상을 약화시키는 데에 적용하기에 바람직할 수 있는 혈장 cGMP를 증가시키기 위해 사용될 수 있다(Padilla et al., Cardiovasc. Res., 51:592-600 (2001)).
본원에 기재된 바와 같이, 키메라 폴리펩티드는 나트륨이뇨 펩티드의 하나 이상의 아미노산 절편(예를 들면, N-말단 꼬리, 고리 구조, 역 고리 구조, C 말단 꼬리, 또는 이의 조합) 및 안지오텐신 폴리펩티드의 아미노산 절편을 포함하도록 디자인될 수 있다. 나트륨이뇨 펩티드 또는 "NP"의 예로는 ANP, BNP, CNP, URO 및 DNP가 있으나 이들로 한정되지 않는다. 본원에서 제공된 키메라 폴리펩티드는 안지오텐신 폴리펩티드(예를 들면, 인간 안지오텐신 폴리펩티드)의 임의의 적절한 아미노산 절편을 포함할 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드는 서열번호 1에 기재된 서열을 포함할 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 전장 안지오텐신 폴리펩티드(예를 들면, 전장 인간 안지오텐신 폴리펩티드)를 포함할 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드는 하기 서열을 포함할 수 있다: DRVYIHPFHL(서열번호 14).
본원에서 제공된 키메라 폴리펩티드는 나트륨이뇨 펩티드의 고리 구조를 포함할 수 있다. 고리 구조의 예로는 ANP고리, BNP고리, CNP고리, DNP고리 및 URO고리가 있으나 이들로 한정되지 않는다. 몇몇 경우, 하나 이상(예를 들면, 1개, 2개, 3개, 4개, 5개, 6개 또는 그 이상)의 아미노산 추가, 결실 또는 치환을 갖는 ANP고리, BNP고리, CNP고리, DNP고리 또는 URO고리가 사용될 수 있다. 예를 들면, 2개의 아미노산 치환을 갖는 ANP고리 또는 BNP고리가 본원에서 제공된 키메라 폴리펩티드의 고리 구조로서 사용될 수 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 나트륨이뇨 펩티드의 역 고리 구조를 포함한다. 역 고리 구조의 예로는 역-ANP고리(CGLGSQAGIRDMRGGFC; 서열번호 39), 역-BNP고리(CGLGSSSSIRDMKRGFC; 서열번호 40), 역-CNP고리, 역-DNP고리(CGLNSVHNIRDIKHGFC; 서열번호 41) 및 역-URO고리(CGLGSQAGIRDMRGGFC; 서열번호 42)가 있으나 이들로 한정되지 않는다. 몇몇 경우, 하나 이상(예를 들면, 1개, 2개, 3개, 4개, 5개, 6개, 또는 그 이상)의 아미노산 추가, 결실 또는 치환을 갖는 역-ANP고리, 역-BNP고리, 역-CNP고리, 역-DNP고리 또는 역-URO고리가 사용될 수 있다. 예를 들면, 2개의 아미노산 치환을 갖는 역-ANP고리 또는 역-BNP고리가 본원에서 제공된 키메라 폴리펩티드의 고리 구조로서 사용될 수 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 고리 구조 또는 역 고리 구조를 함유하는 키메라 폴리펩티드에 대한 이러한 고리 구조 또는 역 고리 구조에 대하여 N-말단 부분 또는 C-말단 부분으로서 안지오텐신 폴리펩티드의 임의의 적절한 아미노산 절편을 포함할 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드는 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7))에 이어서 나트륨이뇨 펩티드의 고리 구조 및 임의적으로 C-말단(예를 들면, ANPC-말단, BNPC-말단 또는 DNPC-말단)을 포함할 수 있다. 몇몇 경우, 나트륨이뇨 펩티드의 임의적 N-말단(예를 들면, ANPN-말단 또는 BNPN-말단)에 이어서 나트륨이뇨 펩티드의 고리 구조 및 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7))이 존재할 수 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 고리 또는 역 고리 구조 없이 나트륨이뇨 펩티드의 N-말단(예를 들면, ANPN-말단, BNPN-말단, CNPN-말단, DNPN-말단 또는 URON-말단) 또는 C-말단(예를 들면, ANPC-말단, BNPC-말단 또는 DNPC-말단)에 부착된 N-말단 부분 또는 C-말단 부분으로서 안지오텐신 폴리펩티드의 임의의 적절한 아미노산 절편을 포함할 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드는 고리 또는 역 고리 구조 없이 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7))에 이어서 나트륨이뇨 펩티드의 C-말단(예를 들면, ANPC-말단 또는 BNPC-말단)을 포함할 수 있다. 몇몇 경우, 고리 또는 역 고리 구조 없이 나트륨이뇨 펩티드의 C-말단(예를 들면, ANPC-말단 또는 BNPC-말단)에 이어서 안지오텐신 폴리펩티드의 아미노산 절편(예를 들면, Ang-(1-7))이 존재할 수 있다.
도 1을 참조하건대, 본원에서 제공된 키메라 폴리펩티드는 나트륨이뇨 펩티드의 N-말단 및 고리 구조, 및 C-말단 Ang-(1-7)을 포함할 수 있다. 몇몇 경우, 상기 N-말단 및 고리 구조는 동일한 나트륨이뇨 펩티드(예를 들면, 도 2 내지 6 참조) 또는 상이한 나트륨이뇨 펩티드(예를 들면, 도 7 내지 18 참조)의 N-말단 및 고리 구조일 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드는 도 3에 나타낸 바와 같이 BNPN-말단에 이어서 BNP고리에 이어서 Ang-(1-7)을 가질 수 있거나 도 11에 나타낸 바와 같이 ANPN-말단에 이이서 BNP고리에 이어서 Ang-(1-7)을 가질 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 도 19 및 20에 나타낸 바와 같이 N-말단 Ang-(1-7)에 이어서 나트륨이뇨 펩티드의 고리 구조 및 C 말단을 포함할 수 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드에 포함된 NP의 N-말단, 고리 구조, 역 고리 구조 및/또는 C-말단은 하나 이상의 위치(예를 들면, 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 10개의 위치)에서 변이체(예를 들면, 치환, 추가 또는 결실)을 포함할 수 있다. 이러한 변이체 NP 서열, 예를 들면, 천연 NP 아미노산 서열에 비해 상대적으로 하나 이상의 아미노산 치환을 갖는 변이체 NP 서열을 본원에 기재된 바와 같이 제조하고 변경할 수 있다. 몇몇 경우, (a) 치환 영역에서 펩티드 골격의 구조, (b) 표적 부위에서 분자의 전하 또는 소수성, 또는 (c) 측쇄의 용적을 유지하는 것에 대한 그들의 효과에서 유의하게 상이하지 않은 치환을 선택함으로써 아미노산 치환을 만들 수 있다. 예를 들면, 천연 발생 잔기는 측쇄 성질에 기초하여 하기 군으로 분류될 수 있다: (1) 소수성 아미노산(노르류신, 메티오닌, 알라닌, 발린, 류신 및 이소류신); (2) 중성 친수성 아미노산(시스테인, 세린 및 쓰레오닌); (3) 산성 아미노산(아스파르트산 및 글루탐산); (4) 염기성 아미노산(아스파라긴, 글루타민, 히스티딘, 라이신 및 아르기닌); (5) 쇄 배향에 영향을 미치는 아미노산(글리신 및 프롤린); 및 (6) 방향족 아미노산(트립토판, 티로신 및 페닐알라닌). 이들 군들 내에서 만들어지는 치환은 보존적 치환으로서 간주될 수 있다. 유용한 치환의 비한정적 예로는 발린에 의한 알라닌의 치환, 라이신에 의한 아르기닌의 치환, 글루타민에 의한 아스파라긴의 치환, 글루탐산에 의한 아스파르트산의 치환, 세린에 의한 시스테인의 치환, 아스파라긴에 의한 글루타민의 치환, 아스파르트산에 의한 글루탐산의 치환, 프롤린에 의한 글리신의 치환, 아르기닌에 의한 히스티딘의 치환, 류신에 의한 이소류신의 치환, 이소류신에 의한 류신의 치환, 아르기닌에 의한 라이신의 치환, 류신에 의한 메티오닌의 치환, 류신에 의한 페닐알라닌의 치환, 글리신에 의한 프롤린의 치환, 쓰레오닌에 의한 세린의 치환, 세린에 의한 쓰레오닌의 치환, 티로신에 의한 트립토판의 치환, 페닐알라닌에 의한 티로신의 치환, 및/또는 류신에 의한 발린의 치환이 있으나 이들로 한정되지 않는다.
본원에서 제공된 키메라 폴리펩티드의 제조를 위해 사용될 수 있는 NP 서열의 변이체 N-말단 부분의 예로는 SAPRSLRRSS(서열번호 15), TVPRSLRRSS(서열번호 16), TAGRSLRRSS(서열번호 17), TAPKSLRRSS(서열번호 18), TLRRSS(서열번호 19), SIRRSS(서열번호 20), SLKRSS(서열번호 21) 및 SLRKSS(서열번호 22)가 있으나 이들로 한정되지 않는다. 본원에서 제공된 키메라 폴리펩티드의 제조를 위해 사용될 수 있는 NP 서열의 변이체 C-말단 부분의 예로는 KVLRRR(서열번호 23), KVLRKH(서열번호 24), KVLKRH(서열번호 25) 및 KVIRRH(서열번호 26)가 있으나 이들로 한정되지 않는다.
본원에서 제공된 키메라 폴리펩티드의 제조를 위해 사용된 NP 아미노산 서열 내의 임의의 위치에서 만들어질 수 있는 보존적 치환의 추가 예로는 표 1에 기재된 치환이 있으나 이들로 한정되지 않는다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드의 제조를 위해 사용된 NP 아미노산 서열은 하나 이상의 비보존적 치환을 포함할 수 있다. 비보존적 치환은 전형적으로 전술된 클래스들 중 한 클래스의 구성원을 또 다른 클래스의 구성원으로 교체하는 것을 수반한다. 이러한 제조는 다량의 또는 대안적 실시양태의 이러한 화합물을 제공하는 데에 바람직할 수 있다. 펩티드 변이체의 특이적 활성을 분석함으로써 아미노산 변화가 기능성 폴리펩티드를 발생시키는 지를 용이하게 확인할 수 있다.
본원에서 제공된 키메라 폴리펩티드는 임의의 적절한 서열을 가질 수 있다. 예를 들면, 폴리펩티드는 서열번호 2, 3 및 1에 기재된 서열을 포함할 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 (a) 3개 이하(예를 들면, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 서열번호 1에 기재된 서열과 정렬되는 아미노산 서열, 및 (b) 5개 이하(예를 들면, 4개 이하, 3개 이하, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 ANP고리, BNP고리, CNP고리, DNP고리 또는 URO고리의 서열과 정렬되는 아미노산 서열을 함유할 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 (a) 3개 이하(예를 들면, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 서열번호 1에 기재된 서열과 정렬되는 아미노산 서열에 이어서, (b) 5개 이하(예를 들면, 4개 이하, 3개 이하, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 ANP고리, BNP고리, CNP고리, DNP고리 또는 URO고리의 서열과 정렬되는 아미노산 서열에 이어서, (c) 5개 이하(예를 들면, 4개 이하, 3개 이하, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 ANPC-말단, BNPC-말단 또는 DNPC-말단의 서열과 정렬되는 아미노산 서열을 함유할 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 (a) 5개 이하(예를 들면, 4개 이하, 3개 이하, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 ANPN-말단, BNPN-말단, CNPN-말단, DNPN-말단 또는 URON-말단의 서열과 정렬되는 아미노산 서열에 이어서, (b) 5개 이하(예를 들면, 4개 이하, 3개 이하, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 ANP고리, BNP고리, CNP고리, DNP고리 또는 URO고리의 서열과 정렬되는 아미노산 서열에 이어서, 3개 이하(예를 들면, 2개 이하, 1개 또는 0개)의 아미노산 추가, 결실, 치환 또는 이들의 조합을 갖는 서열번호 1에 기재된 서열과 정렬되는 아미노산 서열을 함유할 수 있다.
본원에서 제공된 폴리펩티드는 임의의 적절한 길이를 가질 수 있다. 예를 들면, 본원에서 제공된 폴리펩티드는 20개 내지 55개(예를 들면, 24개 내지 55개, 24개 내지 45개, 25개 내지 45개, 26개 내지 44개, 27개 내지 43개, 28개 내지 42개, 29개 내지 41개, 30개 내지 40개, 31개 내지 39개, 23개 내지 35개, 25개 내지 30개, 또는 30개 내지 35개) 아미노산 잔기의 길이를 가질 수 있다. 20개 또는 55개 아미노산 잔기의 길이를 갖는 폴리펩티드는 20개 내지 55개 아미노산 잔기의 길이를 갖는 폴리펩티드라는 것이 인식될 것이다.
본원에 기재된 분석들을 포함하나 이들로 한정되지 않는 임의의 적합한 분석을 이용하여 본원에서 제공된 키메라 폴리펩티드뿐만 아니라, (예를 들면, 천연 ANP, BNP, CNP, DNP 또는 URO에 대하여) 보존적 및/또는 비보존적 치환을 갖는 변이체 NP 서열을 함유하는 폴리펩티드, ANP, BNP, CNP, DNP 또는 URO의 단편, 또는 이러한 변이체의 단편도 생물학적 활성에 대해 평가할 수 있다. 예를 들면, 본원에 기재된 변이체 NP 아미노산 서열을 갖는 키메라 폴리펩티드의 활성은 심장 섬유모세포(CF)에 의해 발생된 cGMP 수준에 대한 그의 효과를 측정하거나 CF의 증식을 억제하는 그의 능력을 시험함으로써 시험관내에서 평가될 수 있다. 이러한 실험을 예를 들면, 다른 문헌(Tsuruda et al., Circ. Res. 91:1127-1134 (2002))에 기재된 바와 같이 인간 CF(사이언셀(ScienCell), 미국 캘리포니아주 샌 디에고 소재)에서 수행할 수 있다. 세포를 평가될 폴리펩티드(예를 들면, 10-11 내지 10-6 M)에 노출시킬 수 있고, 경쟁 RIA cGMP 키트(퍼킨-엘머(Perkin-Elmer), 미국 매사추세츠주 보스톤 소재)를 사용하여 샘플을 cGMP에 대해 분석할 수 있다. CF 증식 연구를 위해, 세포를 카디오트로핀(Cardiotrophin)-1로 처리하여 세포 증식을 유도할 수 있다. 평가될 폴리펩티드를 카디오트로핀-1에 의해 자극된 CF에 첨가하여 세포 증식에 대한 그의 효과를 확인할 수 있다. 예를 들면, 비색 브로모데옥시우리딘(BrdU) 세포 증식 ELISA(로슈(Roche), 미국 인디애나주 인디애나폴리스 소재)를 이용하여 세포 증식을 검출하고 측정할 수 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드, (예를 들면, 천연 ANP, BNP, CNP, DNP 또는 URO에 대하여) 보존적 및/또는 비보존적 치환을 갖는 변이체 NP 서열을 함유하는 폴리펩티드, ANP, BNP, CNP, DNP 또는 URO의 단편, 또는 이러한 변이체의 단편은 예를 들면, 동물에서 폐 모세혈관 쐐기압, 우심방압, 평균 심방압, 소변 나트륨 배설, 소변 유동, 근위 및 원위 분획 나트륨 재흡수, 혈장 레닌 활성, 혈장 cGMP 수준, 소변 cGMP 배설, 순 신장 cGMP 발생, 사구체 여과율, 및 좌심실 질량과 같은 인자에 대한 그의 효과를 시험함으로써 생체내에서 평가될 수 있다. 몇몇 경우, 이러한 파라미터들은 유도된 심근경색(예를 들면, 관상 동맥 연결에 의해 유도된 심근경색) 후 평가될 수 있다.
몇몇 실시양태에서, 본원에서 제공된 키메라 폴리펩티드는 시스테인 잔기들 사이의 이황화 결합으로 인해 환형일 수 있다(예를 들면, 도 1 내지 20에 도시된 구조 참조). 몇몇 실시양태에서, 시스테인 잔기 상의 설프하이드릴 기를 대안적 기(예를 들면, -CH2CH2-)로 치환시킬 수 있다. 설프하이드릴 기를 -CH2- 기로 치환시키기 위해, 예를 들면, 시스테인 잔기를 알파-아미노부티르산으로 치환시킬 수 있다. 이러한 환형 유사체 폴리펩티드를 예를 들면, 다른 문헌(Lebl and Hruby, Tetrahedron Lett., 25:2067 (1984); 및 미국 특허 제4,161,521호)에 기재된 바와 같이 발생시킬 수 있다.
몇몇 경우, 세린 또는 쓰레오닌의 OH를 아스파르트산 또는 글루탐산의 카복실 기와 반응시켜 구조 -CH2CO2CH2-를 갖는 가교를 생성함으로써 에스테르 또는 아미드 가교를 형성할 수 있다. 몇몇 경우, 라이신의 측쇄를 아스파르트산 또는 글루탐산과 반응시켜 구조 -CH2C(O)NH(CH)4-를 갖는 가교를 생성함으로써 아미드를 수득할 수 있다. 이들 가교의 합성 방법은 다른 문헌에 기재되어 있다(예를 들면, 문헌(Schiller et al., Biochem. Biophy. Res. Comm., 127:558 (1985)) 및 문헌(Schiller et al. Int. J. Peptide Protein Res., 25:171 (1985)) 참조). 다른 가교 형성 아미노산 잔기 및 반응은 예를 들면, 미국 특허 제4,935,492호에서 제공되어 있다. 몇몇 경우, 다른 문헌에 기재된 바와 같이 비펩티딜 결합을 포함하는 펩티드 유사체를 사용하여 본원에서 제공된 키메라 폴리펩티드의 아미노산 잔기를 연결할 수 있다(예를 들면, 문헌(Spatola et al., Life Sci., 38:1243 (1986)); 문헌(Spatola, Vega Data, 1(3) (1983)); 문헌(Morley, Trends Pharm. Sci., 463-468 (1980)); 문헌(Hudson et al., Int. J. Pept. Prot. Res., 14:177 (1979)); 문헌(Spatola, in Chemistry and Biochemistry of Amino Acid Peptides and Proteins, B. Weinstein, ed., Marcel Dekker, New York, p. 267 (1983)); 문헌(Hann, J. Chem. Soc. Perkin Trans., 1:307 (1982)); 문헌(Almquist et al., J. Med. Chem. 23:1392 (1980)); 문헌(Jennings-White et al., Tetrahedron Lett., 23:2533 (1982)); 유럽 특허출원 제45665호; 문헌(Holladay et al., Tetrahedron Lett., 24:4401 (1983)); 및 문헌(Hruby, Life Sci., 31:189 (1982)) 참조).
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 기준 서열(예를 들면, 서열번호 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 또는 61)에 대해 85%(예를 들면, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 이상의 서열 동일성을 갖는 아미노산 서열을 가질 수 있다. 정렬된 아미노산 서열들(확인된 아미노산 서열과 정렬된 표적 아미노산 서열) 내의 일치된 위치의 수를 확인하고 일치된 위치의 수를 확인된 아미노산 서열(예를 들면, 서열번호 3)의 아미노산 수로 나누고 100을 곱함으로써 % 서열 동일성을 계산한다. 일치된 위치는 동일한 아미노산이 정렬된 아미노산 서열들 내의 동일한 위치에 존재하는 위치를 지칭한다. 임의의 핵산 서열에 대한 % 서열 동일성도 측정할 수 있다.
BLASTN 버전 2.0.14 및 BLASTP 버전 2.0.14을 함유하는 BLASTZ의 독립형 버전으로부터의 BLAST 2 서열(Bl2seq) 프로그램을 이용하여 표적 아미노산 서열을 확인된 아미노산 서열(예를 들면, 서열번호 3)과 비교함으로써 % 서열 동일성을 측정한다. BLASTZ의 이 독립형 버전은 피쉬 앤드 리차드슨(Fish & Richardson)의 웹 사이트(fr.com/blast) 또는 미국 정부의 국립 생물공학 정보 센터 웹 사이트(ncbi.nlm.nih.gov)로부터 전세계 와이드 웹 상에서 입수될 수 있다. Bl2seq 프로그램을 사용하는 방법을 설명하는 설명서는 BLASTZ에 첨부되는 리드미(readme) 파일에서 발견될 수 있다.
Bl2seq는 BLASTN 또는 BLASTP 알고리즘을 이용하여 2개의 서열들 사이의 비교를 수행한다. BLASTN은 핵산 서열의 비교를 위해 사용되는 반면, BLASTP는 아미노산 서열의 비교를 위해 사용된다. 2개의 핵산 서열들을 비교하기 위해, 옵션이 다음과 같이 설정된다: -i는 비교될 제1 핵산 서열을 함유하는 파일(예를 들면, C:\seq1.txt)에 설정되고; -j는 비교될 제2 핵산 서열을 함유하는 파일(예를 들면, C:\seq2.txt)에 설정되고; -p는 blastn에 설정되고; -o는 임의의 원하는 파일명(예를 들면, C:\output.txt)에 설정되고; -q는 -1에 설정되고; -r은 2에 설정되고; 모든 다른 옵션은 그들의 디폴트 설정으로 남겨진다. 하기 명령어가 2개의 서열들 사이의 비교를 함유하는 출력 파일을 발생시킬 것이다: C:\Bl2seq -i c:\seq1.txt -j c:\seq2.txt -p blastn -o c:\output.txt -q -1 -r 2. 표적 서열이 확인된 서열의 임의의 부분과 상동성을 공유하는 경우, 지정된 출력 파일은 상동성 영역을 정렬된 서열들로서 제시할 것이다. 표적 서열이 확인된 서열의 임의의 부분과 상동성을 공유하지 않는 경우, 지정된 출력 파일은 정렬된 서열을 제시하지 않을 것이다.
예를 들면, (1) 표적 서열이 서열번호 3에 기재된 서열과 비교되고, (2) Bl2seq 프로그램이 서열번호 3에 기재된 서열의 영역과 정렬된 표적 서열을 제시하는(이때, 일치의 수는 15임) 경우, 아미노산 표적 서열은 서열번호 3에 대한 88.2(즉, 15 ÷ 17 x 100 = 88.2)의 % 서열 동일성을 갖는다. % 동일성 값은 소수점 첫째 자리까지 반올림된다는 것을 인지한다. 예를 들면, 78.11, 78.12, 78.13 및 78.14는 78.1로 반올림되는 반면, 78.15, 78.16, 78.17, 78.18 및 78.19는 78.2로 반올림된다. 길이 값은 항상 정수일 것이라는 것도 인지한다.
본원에서 제공된 키메라 폴리펩티드는 고체상 합성을 포함하는 임의의 적합한 방법을 이용함으로써 제조될 수 있고, 수동 기법 또는 자동화된 기법(예를 들면, 어플라이드 바이오시스템스(Applied BioSystems)(미국 캘리포니아주 포스터 시티 소재) 펩티드 합성기 또는 바이오서치 인코포레이티드(Biosearch Inc.)(미국 캘리포니아주 샌 라파엘 소재) 자동 펩티드 합성기)을 이용함으로써 발생될 수 있다. 시스테인 잔기들 사이의 이황화 결합은 다른 문헌에 기재된 바와 같이 KCN을 사용한 선형 폴리펩티드의 약한 산화에 의해 도입될 수 있다(미국 특허 제4,757,048호). 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 본원에 기재된 바와 같이 재조합적으로 제조될 수 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 실질적으로 순수한 폴리펩티드일 수 있다. 본원에서 사용된 바와 같이, 폴리펩티드에 대하여 용어 "실질적으로 순수한"은 폴리펩티드가 다른 폴리펩티드, 지질, 탄수화물 및 핵산을 실질적으로 갖지 않는다는 것을 의미한다. 몇몇 경우, 실질적으로 순수한 폴리펩티드는 60% 이상 순수한 폴리펩티드 또는 임의의 화학적으로 합성된 폴리펩티드일 수 있다. 실질적으로 순수한 폴리펩티드는 약 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% 또는 99% 이상 순수할 수 있다. 전형적으로, 실질적으로 순수한 폴리펩티드는 비환원 폴리아크릴아미드 겔 상에서 단일 주요 밴드를 생성할 것이다.
본원에서 제공된 키메라 폴리펩티드의 카복실 기의 염은 상기 폴리펩티드를 1 당량 이상의 원하는 염기, 예컨대, 금속성 수산화물 염기(예를 들면, 수산화나트륨), 금속 탄산염 또는 중탄산염 염기(예를 들면, 탄산나트륨 또는 중탄산나트륨) 또는 아민 염기(예를 들면, 트리에틸아민, 트리에탄올아민 등)와 접촉시킴으로써 제조될 수 있다. 본원에서 제공된 키메라 폴리펩티드의 산 부가 염은 상기 폴리펩티드를 1 당량 이상의 무기산 또는 유기산(예를 들면, 염산)과 접촉시킴으로써 제조될 수 있다.
본원에서 제공된 키메라 폴리펩티드의 카복실 기의 에스테르는 카복실산 또는 전구체를 에스테르로 전환시키는 임의의 적합한 방법을 이용함으로써 제조될 수 있다. 예를 들면, 메리필드(Merrifield) 합성 기법을 이용할 때 본원에서 제공된 키메라 폴리펩티드의 에스테르를 제조하는 한 방법은 수지에 따라 염기성 또는 산성 조건 하에서 원하는 알코올의 존재 하에서 수지로부터 완전한 폴리펩티드를 절단하는 것이다. 그 다음, 폴리펩티드의 C-말단은 유리산의 단리 없이 수지로부터 자유로와졌을 때 직접적으로 에스테르화될 수 있다.
본원에서 제공된 키메라 폴리펩티드의 아미드는 카복실산 기 또는 전구체를 아미드로 전환시키는 기법을 이용함으로써 제조될 수 있다. C-말단 카복실 기에서 아미드를 형성하는 한 방법은 적절한 아민을 사용하여 폴리펩티드를 고체 지지체로부터 절단하거나 알코올의 존재 하에서 절단하여 에스테르를 생성한 후, 원하는 아민을 사용하여 아미노용해를 수행하는 단계를 포함한다.
본원에서 제공된 키메라 폴리펩티드의 아미노 기의 N-아실 유도체는 최종 축합을 위해 N-아실 보호된 아미노산을 사용하거나 보호된 또는 비보호된 폴리펩티드를 아실화함으로써 제조될 수 있다. O-아실 유도체는 예를 들면, 자유 하이드록시 펩티드 또는 펩티드 수지의 아실화에 의해 제조될 수 있다. 아실화는 표준 아실화 시약, 예컨대, 아실 할로겐화물, 무수물, 아실 이미다졸 등을 사용함으로써 수행될 수 있다. 원하는 경우 N-아실화 및 O-아실화 둘다를 함께 수행할 수 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 예를 들면, 중합체, 예컨대, 폴리에틸렌 글리콜(PEG)과의 연결, 또는 또 다른 폴리펩티드, 예컨대, 알부민과의 융합에 의해 변경될 수 있다. 예를 들면, 하나 이상의 PEG 모이어티(moiety)가 라이신 잔기를 통해 본원에서 제공된 키메라 폴리펩티드에 접합될 수 있다. PEG 또는 또 다른 적합한 중합체와의 연결, 또는 알부민 또는 또 다른 적합한 폴리펩티드와의 융합은 비변경된 키메라 폴리펩티드에 비해 증가된 반감기를 갖는 변경된 키메라 폴리펩티드를 발생시킬 수 있다. 특정 기작에 의해 구속받지는 않지만, 증가된 혈청 반감기는 변경된 키메라 폴리펩티드의 감소된 단백질용해성 분해, 면역 인식 또는 세포 소거(scavanging)로부터 비롯될 수 있다. 임의의 적합한 방법을 이용하여 PEG에 연결하거나("PEG화"로서도 지칭됨) 또는 다른 문헌에 기재된 중합체들을 포함하나 이들로 한정되지 않는 다른 중합체에 연결함으로써 키메라 폴리펩티드를 변경시킬 수 있다(미국 특허 제6,884,780호; Cataliotti et al., Trends Cardiovasc. Med., 17:10-14 (2007); Veronese and Mero, BioDrugs, 22:315-329 (2008); Miller et al., Bioconjugate Chem., 17:267-274 (2006); and Veronese and Pasut, Drug Discov. Today, 10:1451-1458 (2005)). 알부민에 융합시켜 키메라 폴리펩티드를 변경시키는 방법의 예로는 다른 문헌에 기재된 방법들이 있으나 이들로 한정되지 않는다(미국 특허 공보 제20040086976호, 및 문헌(Wang et al., Pharm. Res., 21:2105-2111 (2004))).
용어 "심장 리모델링"은 심근경색, 급성 심부전 또는 다른 병태와 함께 일어날 수 있는 심장에 대한 영향을 지칭한다. 이들은 예를 들면, 심장 확장, 근세포 비대증, 및 심섬유증(cardiofibrosis)(즉, 간질 섬유모세포의 증식)을 포함한다. 본원에서 제공된 키메라 폴리펩티드는 심근경색 또는 급성 심부전과 함께 일어나는 심장 리모델링을 억제하거나 예방하기 위해 사용될 수 있다. 몇몇 경우, 감소된 심장 리모델링을 표시하는 파라미터는 하기 파라미터들 중 하나 이상을 포함할 수 있다: 심장 하중감소(즉, 심장내 감소된 압력), 증가된 사구체 여과율(GFR), 감소된 혈장 레닌 활성(PRA), 감소된 수준의 안지오텐신 II, 심장 섬유모세포의 감소된 증식, 감소된 좌심실(LV) 비대증, 감소된 LV 질량(감소된 섬유증 및 비대증을 표시함), 감소된 폐 모세혈관 쐐기압(PCWP; 좌심방압의 간접적인 척도), 감소된 우심방압, 감소된 평균 심방압, 감소된 수준의 알도스테론(항-섬유증 효과를 표시함), 감소된 심실 섬유증, 증가된 박출 계수, 및 감소된 LV 수축말기 직경. 본원에서 제공된 키메라 폴리펩티드가 심장 리모델링을 억제할 수 있거나 감소시킬 수 있는 지를 확인하기 위해, 예를 들면, 당분야에서 공지되어 있고/있거나 본원에 기재되어 있는 방법을 이용하여 이들 파라미터들 중 하나 이상을 (예를 들면, 키메라 폴리펩티드를 사용한 치료 전 및 후) 평가할 수 있다. 본원에서 제공된 키메라 폴리펩티드를 구축하기 위한 인간 아미노산 서열의 사용은 다른 종으로부터의 아미노산 서열의 사용에 비해 단백질 치료제에서 관찰될 수 있는 면역원성의 위험을 최소화할 수 있다(Haller et al., Clin. Pharmacol. Ther., 84:624-7 (2008); and Leader et al., Nat. Rev. Drug Discov., 7:21-39 (2008)).
심근경색(AMI) 또는 급성 심부전(AHF)과 같은 병태는 심장 손상뿐만 아니라 신장 손상도 유발할 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 AMI 및 AHF 후 손상으로부터 신장을 보호할 수 있다. 유리한 신장 작용을 표시하는 파라미터는 예를 들면, 나트륨의 감소된 근위 분획 재흡수(PFRNa), 나트륨의 감소된 원위 분획 재흡수(DFRNa), 증가된 소변 나트륨 배설(UNaV) 및 증가된 소변 유동(UV)을 포함한다. 상기 키메라 폴리펩티드가 신장 보호 효과를 갖는 지를 확인하기 위해 (예를 들면, 키메라 폴리펩티드의 투여 전 및 후) 이들 파라미터들 중 어느 하나 이상을 평가할 수 있다. 이들 파라미터들을 평가하는 방법은 당분야에서 공지되어 있고 본원에도 기재되어 있다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 예를 들면, 심장 리모델링, 예컨대, AMI 또는 AHF 후 일어나는 심장 리모델링을 억제할 수 있거나 감소시킬 수 있다. 심장 리모델링을 억제할 수 있는 키메라 폴리펩티드는 억제되거나 감소된 심장 리모델링을 표시하는 하나 이상의 파라미터를 10% 이상까지 변경시킬 수 있는 키메라 폴리펩티드이다. 특정 키메라 폴리펩티드가 이러한 성질을 갖는 지를 확인하기 위해, 본원에 기재된 분석을 포함하는, 당분야에서 잘 공지되어 있는 분석을 수행할 수 있다. 변이체 NP 서열을 포함하는 키메라 폴리펩티드는 상응하는 야생형 NP 서열의 생물학적 활성의 약 10% 이상(예를 들면, 약 10%, 15%, 20%, 25%, 33%, 40%, 50%, 60%, 67%, 75%, 80%, 85%, 90%, 95% 또는 100% 이상, 또는 100% 초과)의 생물학적 활성을 가질 수 있다.
핵산, 벡터 및 숙주 세포
본원은 본원에서 제공된 키메라 폴리펩티드를 코딩하는 핵산뿐만 아니라, 이 핵산을 함유하는 발현 벡터, 및 상기 핵산 및/또는 발현 벡터를 함유하는 숙주 세포도 제공한다. 본원에서 사용된 바와 같이, 용어 "핵산"은 cDNA, 게놈 DNA 및 합성(예를 들면, 화학적으로 합성된) DNA를 포함하는 RNA 및 DNA 둘다를 지칭한다. 핵산 분자는 이중 가닥 또는 단일 가닥(즉, 센스 또는 안티센스 단일 가닥)일 수 있다. 핵산은 예를 들면, 본원에서 제공된 키메라 폴리펩티드를 코딩하는 cDNA를 포함한다.
"단리된 핵산"은 척추동물 게놈에서 핵산의 한 측면 또는 양 측면을 정상적으로 플랭킹하는 핵산을 포함하는, 척추동물 게놈에 존재하는 다른 핵산 분자로부터 분리되어 있는 핵산이다. 핵산에 대하여 본원에서 사용된 바와 같이, 용어 "단리된"은 임의의 비천연 발생 핵산 서열도 포함하는데, 이는 이러한 비천연 발생 서열이 자연에서 발견되지 않고 천연 발생 게놈에서 바로 인접한 서열을 갖지 않기 때문이다.
단리된 핵산은 예를 들면, DNA 분자일 수 있되, 단, 천연 발생 게놈에서 그 DNA 분자를 바로 플랭킹하는 정상적으로 발견된 핵산 서열들 중 하나는 제거되거나 부재한다. 따라서, 단리된 핵산은 다른 서열과 무관하게 별도의 분자(예를 들면, 화학적으로 합성된 핵산, 또는 PCR 또는 제한 핵산내부분해효소(endonuclease) 처리에 의해 생성된 cDNA 또는 게놈 DNA 단편)로서 존재하는 DNA 분자뿐만 아니라, 벡터, 자율 복제 플라스미드, 바이러스(예를 들면, 레트로바이러스, 렌티바이러스, 아데노바이러스 또는 헤르페스 바이러스), 또는 원핵생물 또는 진핵생물의 게놈 DNA 내로 도입된 DNA도 포함하나 이들로 한정되지 않는다. 또한, 단리된 핵산은 조작된 핵산, 예컨대, 혼성체 또는 융합 핵산의 부분인 DNA 분자를 포함할 수 있다. 예를 들면, cDNA 라이브러리 또는 게놈 라이브러리 내의 수백 내지 수천 개의 다른 핵산들 사이에 존재하는 핵산, 또는 게놈 DNA 제한 절단물을 함유하는 겔 슬라이스는 단리된 핵산으로서 간주되지 않는다.
단리된 핵산 분자는 통상의 분자 클로닝 및 화학적 핵산 합성 기법을 포함하나 이들로 한정되지 않는 표준 기법을 이용함으로써 제조될 수 있다. 예를 들면, 중합효소 연쇄 반응(PCR) 기법을 이용하여 안지오텐신 폴리펩티드 또는 NP를 코딩하는 뉴클레오티드 서열을 함유하는 단리된 핵산을 수득할 수 있다. PCR은 표적 핵산이 효소적으로 증폭되는 절차 또는 기법을 지칭한다. 전형적으로, 관심 있는 영역의 말단 또는 그 너머로부터 수득된 서열 정보를 이용하여, 증폭될 주형의 반대 가닥과 서열 면에서 동일한 올리고뉴클레오티드 프라이머를 디자인한다. PCR은 총 게놈 DNA 또는 총 세포 RNA로부터의 서열을 포함하는 DNA 및 RNA로부터 특정 서열을 증폭하기 위해 이용될 수 있다. 프라이머는 전형적으로 14개 내지 40개 뉴클레오티드의 길이를 갖지만 10개 뉴클레오티드 내지 수백 개 뉴클레오티드의 길이를 가질 수 있다. 일반적인 PCR 기법은 예를 들면, 문헌(PCR Primer: A Laboratory Manual, ed. by Dieffenbach and Dveksler, Cold Spring Harbor Laboratory Press, 1995)에 기재되어 있다. RNA를 주형의 공급원으로서 사용할 때, 역전사효소를 사용하여 상보적 DNA(cDNA) 가닥을 합성할 수 있다. 연결효소 연쇄 반응, 가닥 치환 증폭, 자가 지속 서열 복제 또는 핵산 서열 기초 증폭도 단리된 핵산을 수득하기 위해 이용될 수 있다. 예를 들면, 문헌(Lewis (1992) Genetic Engineering News 12:1; Guatelli et al. (1990) Proc. Natl. Acad. Sci. USA 87:1874-1878; and Weiss (1991) Science 254:1292)을 참조한다.
단리된 핵산은 (예를 들면, 포스포라미다이트 기술을 이용하여 3'에서 5' 방향으로 자동화된 DNA 합성을 이용함으로써) 단일 핵산 분자로서 또는 일련의 올리고뉴클레오티드로서 화학적으로 합성될 수도 있다. 예를 들면, 원하는 서열을 함유하는 한 쌍 이상의 긴 올리고뉴클레오티드(예를 들면, >100개 뉴클레오티드)를 합성할 수 있고, 이때 각각의 쌍은 올리고뉴클레오티드 쌍이 어닐링될 때 이중체가 형성되도록 짧은 상보성 절편(예를 들면, 약 15개 뉴클레오티드)을 함유한다. DNA 중합효소를 사용하여 상기 올리고뉴클레오티드를 연장함으로써 올리고뉴클레오티드 쌍 당 1개의 이중 가닥 핵산 분자를 발생시킨 후, 상기 이중 가닥 핵산 분자를 벡터 내로 연결시킬 수 있다.
단리된 핵산(변이체 NP를 코딩하는 핵산)도 돌연변이유발에 의해 수득될 수 있다. 예를 들면, PCR을 통한 올리고뉴클레오티드 지정 돌연변이유발 및 부위 지정 돌연변이유발을 포함하는 표준 기법을 이용하여 기준 서열을 돌연변이시킬 수 있다. 문헌(Short Protocols in Molecular Biology, Chapter 8, Green Publishing Associates and John Wiley & Sons, edited by Ausubel et al., 1992)을 참조한다. 변이체 NP의 비한정적 예가 본원에서 제공되어 있다.
NP를 코딩하는 핵산 분자 또는 이의 핵산 상보체가 수득될 수 있는 뉴클레오티드 서열의 공급원은 파충류(예를 들면, 뱀) 또는 포유동물(예를 들면, 인간, 래트, 마우스, 개, 소, 말, 양, 염소 또는 고양이) 세포 공급원을 포함하는 임의의 진핵 공급원으로부터의 총 또는 폴리A+ RNA(이것으로부터 cDNA가 당분야에서 공지된 방법에 의해 유도될 수 있음)를 포함한다. 핵산 분자의 다른 공급원은 포유동물 공급원을 포함하는 임의의 진핵 세포 공급원으로부터 유도된 게놈 라이브러리를 포함한다.
천연 NP를 코딩하는 핵산 분자는 예를 들면, 문헌(Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY (1989))에 기재된 바와 같이 표준 방법을 이용함으로써 확인되고 단리될 수 있다. 예를 들면, 역전사효소 PCR(RT-PCR)을 이용하여, 관심 있는 RNA 서열을 함유하는 단리된 RNA(예를 들면, 인간 조직으로부터 단리된 총 RNA)로부터 NP cDNA를 단리하고 클로닝할 수 있다. NP cDNA를 확인하고 단리하고 클로닝하는 다른 방법은 예를 들면, cDNA 라이브러리의 스크리닝을 포함한다.
핵산, 예컨대, 본원에 기재된 핵산을 함유하는 벡터도 제공된다. "벡터"는 또 다른 DNA 절편이 원하는 절편의 복제를 야기하도록 삽입될 수 있는 레플리콘, 예컨대, 플라스미드, 파지 또는 코스미드이다. "발현 벡터"는 하나 이상의 발현 조절 서열을 포함하는 벡터이고, "발현 조절 서열"은 또 다른 DNA 서열의 전사 및/또는 번역을 제어하고 조절하는 DNA 서열이다.
발현 벡터에서, 핵산(예를 들면, 본원에서 제공된 키메라 폴리펩티드를 코딩하는 핵산)은 하나 이상의 발현 조절 서열에 작동가능하게 연결될 수 있다. 본원에서 사용된 바와 같이, "작동가능하게 연결된"은 발현 조절 서열이 관심 있는 코딩 서열의 발현을 효과적으로 조절하도록 게놈 구축물 내로 도입되어 있다는 것을 의미한다. 발현 조절 서열의 예는 프로모터, 인핸서 및 전사 종결 영역을 포함한다. 프로모터는 전형적으로 전사가 시작되는 지점(일반적으로 RNA 중합효소 II에 대한 개시 부위 근처)의 상류 100개 내지 500개의 뉴클레오티드 내에 있는, DNA 분자의 영역으로 구성된 발현 조절 서열이다. 코딩 서열을 프로모터의 조절 하에 두기 위해, 폴리펩티드의 번역 판독 프레임의 번역 개시 부위를 프로모터의 하류 1개 내지 약 50개 뉴클레오티드에 위치시킬 필요가 있다. 인핸서는 시간, 위치 및 수준의 관점에서 발현 특이성을 제공한다. 프로모터와 달리, 인핸서는 전사 부위로부터 다양한 거리에서 위치할 때 작용할 수 있다. 인핸서는 전사 개시 부위로부터 하류에 위치할 수도 있다. RNA 중합효소가 코딩 서열을 mRNA로 전사할 수 있을 때(그 후, 이 mRNA는 상기 코딩 서열에 의해 코딩된 단백질로 번역될 수 있음), 코딩 서열은 세포에서 발현 조절 서열에 "작동가능하게 연결되어" 있고 발현 조절 서열의 "조절 하에" 놓여 있다.
적합한 발현 벡터는 예를 들면, 박테리오파지, 바큘로바이러스, 담배 모자이크 바이러스, 헤르페스 바이러스, 사이토메갈로바이러스, 레트로바이러스, 백시니아 바이러스, 아데노바이러스 및 아데노 관련 바이러스로부터 유도된 플라스미드 및 바이러스 벡터를 포함하나 이들로 한정되지 않는다. 다수의 벡터 및 발현 시스템이 노바겐(Novagen)(미국 위스콘신주 매디슨 소재), 클론텍(Clontech)(미국 캘리포니아주 팔로 알토 소재), 스트라타진(Stratagene)(미국 캘리포니아주 라 졸라 소재) 및 인비트로겐(Invitrogen)/라이프 테크놀로지스(Life Technologies)(미국 캘리포니아주 칼스바드 소재)와 같은 회사로부터 상업적으로 입수될 수 있다.
발현 벡터는 발현된 핵산 서열의 후속 조작(예를 들면, 정제 또는 국소화)을 용이하게 하도록 디자인된 태그 서열을 포함할 수 있다. 태그 서열, 예컨대, 녹색 형광 단백질(GFP), 글루타티온 S-트랜스퍼라제(GST), 폴리히스티딘, c-myc, 헤마글루티닌 또는 Flag™ 태그(코닥(Kodak), 미국 코넥티컷주 뉴 하벤 소재) 서열은 전형적으로 코딩된 폴리펩티드와의 융합체로서 발현된다. 이러한 태그는 카복실 또는 아미노 말단을 포함하는 폴리펩티드 내의 임의의 부위에서 삽입될 수 있다.
본원은 본원에서 제공된 핵산 또는 벡터를 함유하는 숙주 세포도 제공한다. 용어 "숙주 세포"는 재조합 핵산 또는 벡터(예를 들면, 발현 벡터)가 도입될 수 있는 원핵 세포 및 진핵 세포를 포함하기 위한 것이다. 본원에서 사용된 바와 같이, "형질전환된" 및 "형질감염된"은 다수의 기법들 중 하나에 의한 세포 내로의 핵산 분자(예를 들면, 벡터)의 도입을 포괄한다. 특정 기법으로 한정되지 않지만, 이들 다수의 기법들은 당분야에서 잘 확립되어 있다. 숙주 세포를 형질전환하고 형질감염시키기에 적합한 방법은 예를 들면, 문헌(Sambrook et al., Molecular Cloning: A Laboratory Manual (2nd edition), Cold Spring Harbor Laboratory, New York (1989))에서 발견될 수 있다. 예를 들면, 인산칼슘 침전, 전기천공, 열 충격, 지질감염, 미세주입 및 바이러스 매개 핵산 전달을 이용하여 핵산을 세포 내로 도입할 수 있다. 또한, 네이키드 DNA를 다른 문헌에 기재된 바와 같이 생체내 세포에 직접적으로 전달할 수 있다(미국 특허 제5,580,859호 및 제5,589,466호).
폴리펩티드의 검출
본원은 본원에서 제공된 키메라 폴리펩티드를 검출하기 위한 방법 및 물질도 제공한다. 이러한 방법 및 물질을 이용하여, 키메라 폴리펩티드를 치료제로서 제공받은 포유동물 내에서 키메라 폴리펩티드 수준을 모니터링할 수 있다. 예를 들면, 하나 이상의 항체를 사용하여 본원에서 제공된 키메라 폴리펩티드(예를 들면, 도 2 내지 20 및 23 내지 32 중 어느 한 도면에 기재된 키메라 폴리펩티드)를 면역학적으로 검출할 수 있다. 본원에서 사용된 바와 같이, 용어 "항체"는 본원에서 제공된 키메라 폴리펩티드의 에피토프성 결정인자에 결합할 수 있는 온전한 분자 및 이의 단편을 포함한다. 용어 "에피토프"는 항체의 파라토프가 결합하는 항원 상의 항원성 결정인자를 지칭한다. 에피토프성 결정인자는 통상적으로 분자의 화학적 활성 표면 기, 예컨대, 아미노산 또는 당 측쇄로 구성되고, 전형적으로 특정 3차원적 구조 특징뿐만 아니라 특정 전하 특징을 갖는다. 에피토프는 일반적으로 5개 이상의 인접 아미노산(연속 에피토프)을 갖거나, 대안적으로 특정 구조(예를 들면, 입체구조적 에피토프)를 한정하는 비인접 아미노산 세트일 수 있다. 용어 "항체"는 다중클론 항체, 단일클론 항체, 인간화된 또는 키메라 항체, 단일 쇄 Fv 항체 단편, Fab 단편 및 F(ab)2 단편을 포함한다. 다중클론 항체는 면역화된 동물의 혈청에 함유된 항체 분자의 불균질한 집단이다. 단일클론 항체는 항원의 특정 에피토프에 대한 항체의 균질한 집단이다.
본원에서 제공된 키메라 폴리펩티드(예를 들면, 도 2 내지 20 및 23 내지 32 중 어느 한 도면에 기재된 키메라 폴리펩티드)에 대한 특이적 결합 친화성을 갖는 항체 단편은 공지된 기법에 의해 발생될 수 있다. 예를 들면, F(ab')2 단편은 항체 분자의 펩신 절단에 의해 생성될 수 있고, Fab 단편은 F(ab')2 단편의 이황화 가교의 환원에 의해 발생될 수 있다. 몇몇 경우, Fab 발현 라이브러리가 구축될 수 있다. 예를 들면, 문헌(Huse et al., Science, 246:1275 (1989))을 참조한다. 일단 생성되면, 항체 또는 이의 단편은 ELISA 기법, 방사면역분석 및 웨스턴 블롯팅을 포함하는 표준 면역분석 방법에 의해 본원에서 제공된 키메라 폴리펩티드의 인식에 대해 시험될 수 있다. 문헌(Short Protocols in Molecular Biology, Chapter 11, Green Publishing Associates and John Wiley & Sons, Ed. Ausubel et al., 1992)을 참조한다.
면역학적 분석에서, 본원에서 제공된 키메라 폴리펩티드에 대한 특이적 결합 친화성을 갖는 항체 또는 이러한 항체에 결합하는 2차 항체는 직접적으로 또는 간접적으로 표지될 수 있다. 적합한 표지는 방사성핵종(예를 들면, 125I, 131I, 35S, 3H, 32P, 33P 또는 14C), 형광 모이어티(예를 들면, 플루오레세인, FITC, PerCP, 로다민 또는 PE), 발광 모이어티(예를 들면, 인비트로겐(미국 캘리포니아주 칼스바드 소재)에 의해 공급된 Qdot™ 나노입자), 한정된 파장의 광을 흡수하는 화합물, 또는 효소(예를 들면, 알칼리성 포스파타제 또는 호스라디쉬 퍼록시다제)를 포함하나 이들로 한정되지 않는다. 항체는 전술된 분자로 표지된 아비딘 또는 스트렙타비딘으로 검출되는 바이오틴과의 접합에 의해 간접적으로 표지될 수 있다. 표지를 검출하거나 정량하는 방법은 표지의 성질에 의존하고 당분야에서 공지되어 있다. 검출제의 예로는 x-선 필름, 방사성 카운터, 신틸레이션 카운터, 분광광도계, 비색계, 형광계, 발광계 및 밀도계가 있으나 이들로 한정되지 않는다. 당업자에게 공지된 이들 방법들("다층" 분석을 포함함)의 조합을 이용하여 분석의 민감성을 향상시킬 수 있다.
본원에서 제공된 폴리펩티드를 검출하는 면역학적 분석은 샌드위치 분석, 경쟁 분석(경쟁 RIA), 또는 가교 면역분석을 포함하는 다양한 공지된 포맷으로 수행될 수 있다. 예를 들면, 미국 특허 제5,296,347호, 제4,233,402호, 제4,098,876호 및 제4,034,074호를 참조한다. 본원에서 제공된 키메라 폴리펩티드를 검출하는 방법은 일반적으로 생물학적 샘플을 본원에서 제공된 키메라 폴리펩티드에 결합하는 항체와 접촉시키는 단계 및 상기 키메라 폴리펩티드와 상기 항체의 결합을 검출하는 단계를 포함한다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드에 대한 특이적 결합 친화성을 갖는 항체는 당분야에서 공지된 다양한 방법들 중 임의의 방법에 의해 고체 기판 상에 고정된 후 생물학적 샘플에 노출될 수 있다. 키메라 폴리펩티드와 고체 기판 상의 항체의 결합은 결합 시 적절한 기계, 예를 들면, 비아코어 장치(비아코어 인터네셔날 아베(Biacore International AB), 스웨덴 랍스가탄 소재)에 의해 정성적으로 또는 정량적으로 검출될 수 있는 표면 플라스몬 공명의 강도 변화를 야기하는 표면 플라스몬 공명 현상을 이용함으로써 검출될 수 있다. 몇몇 경우, 항체는 전술된 바와 같이 표지될 수 있고 검출될 수 있다. 공지된 양의 본원에서 제공된 키메라 폴리펩티드를 이용하여 표준 곡선을 발생시켜 상기 키메라 폴리펩티드의 수준의 정량을 돕는다.
몇몇 실시양태에서, 포획 항체가 고체 기판 상에 고정되는 "샌드위치" 분석을 이용하여 본원에서 제공된 키메라 폴리펩티드의 존재, 부재 또는 수준을 검출할 수 있다. 생물학적 샘플 중의 관심 있는 임의의 키메라 폴리펩티드가 고정된 항체에 결합할 수 있도록 상기 고체 기판을 상기 샘플과 접촉시킬 수 있다. 상기 키메라 폴리펩티드에 대한 특이적 결합 친화성을 갖는 "검출" 항체를 사용하여 항체에 결합된 키메라 폴리펩티드의 존재, 부재 또는 수준을 측정할 수 있다. 몇몇 실시양태에서, 본원에서 제공된 키메라 폴리펩티드뿐만 아니라 ANP, BNP, CNP, DNP, URO 또는 안지오텐신 폴리펩티드에 대한 결합 친화성을 갖는 포획 항체를 사용할 수 있다. 이 실시양태에서, 본원에서 제공된 특정 키메라 폴리펩티드(예를 들면, 도 2 내지 20 및 23 내지 32 중 어느 한 도면에 기재된 키메라 폴리펩티드)에 대한 특이적 결합 친화성을 갖는 검출 항체를 사용할 수 있다. 샌드위치 분석에서 포획 항체는 검출 항체와 동일한 에피토프(또는 다중클론 항체의 경우 다양한 에피토프들)에 결합하지 않아야 한다는 것이 이해된다. 따라서, 단일클론 항체가 포획 항체로서 사용되는 경우, 검출 항체는 포획 단일클론 항체가 결합하는 에피토프로부터 물리적으로 분리되어 있거나 이러한 에피토프와 부분적으로만 중첩되어 있는 에피토프에 결합하는 또 다른 단일클론 항체, 또는 포획 단일클론 항체가 결합하는 에피토프를 제외한 또는 이러한 에피토프 이외의 에피토프에 결합하는 다중클론 항체일 수 있다. 다중클론 항체가 포획 항체로서 사용되는 경우, 검출 항체는 포획 다중클론 항체가 결합하는 에피토프들 중 임의의 에피토프로부터 물리적으로 분리되어 있거나 이러한 에피토프와 부분적으로 중첩되어 있는 에피토프에 결합하는 단일클론 항체, 또는 포획 다중클론 항체가 결합하는 에피토프를 제외한 또는 이러한 에피토프 이외의 에피토프에 결합하는 다중클론 항체일 수 있다. 샌드위치 분석은 샌드위치 ELISA 분석, 샌드위치 웨스턴 블롯팅 분석, 또는 샌드위치 면역자기 검출 분석으로서 수행될 수 있다.
항체(예를 들면, 포획 항체)가 결합될 수 있는 적합한 고체 기판은 마이크로타이터 플레이트, 튜브, 막, 예컨대, 나일론 또는 니트로셀룰로스 막, 및 비드 또는 입자(예를 들면, 아가로스, 셀룰로스, 유리, 폴리스티렌, 폴리아크릴아미드, 자성 또는 자성화가능한 비드 또는 입자)를 포함하나 이들로 한정되지 않는다. 자동화된 면역분석 시스템이 이용되는 경우 자성 또는 자성화가능한 입자가 특히 유용할 수 있다.
본원에서 제공된 키메라 폴리펩티드에 대한 특이적 결합 친화성을 갖는 항체는 표준 방법을 통해 제조될 수 있다. 예를 들면, 키메라 폴리펩티드는 전술된 바와 같이 재조합적으로 제조될 수 있거나 화학적으로 합성될 수 있고, 토끼, 닭, 마우스, 기니아 피그 또는 래트를 포함하는 숙주 동물을 면역화시키기 위해 사용될 수 있다. 예를 들면, 도 2 내지 20 및 23 내지 32 중 어느 한 도면에 기재된 키메라 폴리펩티드는 동물을 면역화시키기 위해 사용될 수 있다. 면역학적 반응을 증가시키기 위해 사용될 수 있는 다양한 면역보강제는 숙주 종에 의존하고 프로인트 면역보강제(완전 및 불완전), 광물 겔, 예컨대, 수산화알루미늄, 표면 활성 물질, 예컨대, 라이소레시틴, 플루로닉 폴리올, 다가음이온, 펩티드, 오일 유화액, 키홀 림펫 헤모시아닌 및 디니트로페놀을 포함한다. 본원에서 제공된 키메라 폴리펩티드 및 표준 하이브리도마 기술을 이용하여 단일클론 항체를 제조할 수 있다. 구체적으로, 단일클론 항체는 예컨대, 문헌(Kohler et al., Nature, 256:495 (1975))에 기재된 바와 같이 배양물 중의 연속 세포주에 의한 항체 분자의 생성을 제공하는 임의의 기법, 인간 B 세포 하이브리도마 기법(Kosbor et al., Immunology Today, 4:72 (1983); Cole et al., Proc. Natl. Acad. Sci. USA, 80:2026 (1983)), 및 EBV-하이브리도마 기법(Cole et al., "Monoclonal Antibodies and Cancer Therapy," Alan R. Liss, Inc., pp. 77-96 (1983))에 의해 수득될 수 있다. 이러한 항체는 IgG, IgM, IgE, IgA, IgD, 및 이들의 임의의 하위클래스를 포함하는 임의의 면역글로불린 클래스의 항체일 수 있다. 단일클론 항체를 생성하는 하이브리도마는 시험관내에서 및 생체내에서 배양될 수 있다.
몇몇 경우, NP 서열에 대한 항체 또는 안지오텐신 폴리펩티드의 서열에 대한 항체, 또는 이들 두 유형의 항체들의 조합물을 사용하여 본원에서 제공된 키메라 폴리펩티드(예를 들면, 도 2 내지 20 및 23 내지 32 중 어느 한 도면에 기재된 키메라 폴리펩티드)를 검출할 수 있다.
본원에서 제공된 키메라 폴리펩티드를 검출하는 다른 기법은 질량 분광광도측정 기법, 예컨대, 전자분무 이온화(ESI), 및 매트릭스 보조된 레이저 탈착-이온화(MALDI)를 포함한다. 예를 들면, 문헌(Gevaert et al., Electrophoresis, 22:1645-51 (2001); Chaurand et al., J. Am. Soc. Mass Spectrom., 10:91-103 (1999))을 참조한다. 이러한 적용에 유용한 질량 분광계는 어플라이드 바이오시스템스(미국 캘리포니아주 포스터 시티 소재), 브룩커 달트로닉스(Bruker Daltronics)(미국 매사추세츠주 빌레리카 소재); 및 아머샴 파마샤(Amersham Pharmacia)(미국 캘리포니아주 서니베일 소재)로부터 입수될 수 있다.
투여 조성물 및 방법
본원에서 제공된 키메라 폴리펩티드(예를 들면, 예를 들면, 도 2 내지 20 및 23 내지 32 중 어느 한 도면에 기재된 키메라 폴리펩티드), 또는 본원에서 제공된 키메라 폴리펩티드를 코딩하는 핵산은 포유동물(예를 들면, AMI 또는 AHF를 앓고 있거나 AMI 또는 AHF에 대한 위험을 갖는 인간)에게 투여되기 위해 조성물 내로 도입될 수 있다. 치료 조성물을 제제화한 후 투여하는 방법은 당업자에게 잘 공지되어 있다. 투여량은 전형적으로 수일 내지 수개월, 또는 적합한 반응이 달성될 때까지 지속되는 치료 과정과 함께 화합물에 대한 대상체의 반응에 의존한다. 당분야에서 통상의 기술을 가진 자는 최적 투여량, 투약 방법 및 반복률을 관용적으로 결정한다. 최적 투여량은 키메라 폴리펩티드의 상대적인 효능에 따라 달라질 수 있고, 일반적으로 시험관내 및/또는 생체내 동물 모델에서 효과적인 것으로 발견되는 EC50에 기초하여 평가될 수 있다. 본원에서 제공된 키메라 폴리펩티드 또는 본원에서 제공된 핵산을 함유하는 조성물은 매일, 매주 또는 매월 1회 이상, 또는 심지어 보다 덜 빈번하게 제공될 수 있거나, 일정한 시간(예를 들면, 시, 일 또는 주) 동안 연속적으로 투여될 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 재관류 시점에서 또는 재관류 시점쯤에서 적어도 약 0.01 ng 폴리펩티드/체중 kg 내지 약 100 mg 폴리펩티드/체중 kg의 투여량으로 심근경색 환자에게 투여될 수 있거나, 재관류 시점에서 또는 재관류 시점쯤에서 시작되어 1일 내지 7일 동안 연속되는 관주로서 (예를 들면, 약 0.01 ng 폴리펩티드/kg/분 내지 약 0.5 ㎍ 폴리펩티드/kg/분의 투여량으로) 연속적으로 투여될 수 있다.
키메라 폴리펩티드 또는 핵산은 다른 분자, 분자 구조물, 또는 화합물의 혼합물, 예를 들면, 리포좀, 수용체 또는 세포 표적화된 분자, 또는 섭취, 분배 및/또는 흡수를 보조하기 위한 경구, 국소 또는 다른 제제와 혼합될 수 있거나 캡슐화될 수 있거나 접합될 수 있거나 다른 방식으로 회합될 수 있다.
몇몇 실시양태에서, 조성물은 약학적으로 허용가능한 담체와 함께 본원에서 제공된 키메라 폴리펩티드를 함유할 수 있다. 약학적으로 허용가능한 담체는 예를 들면, 약학적으로 허용가능한 용매, 현탁제, 또는 항체를 대상체에게 전달하기 위한 임의의 다른 약리학적 불활성 비히클을 포함한다. 약학적으로 허용가능한 담체는 액체 또는 고체일 수 있고, 주어진 약학 조성물의 하나 이상의 치료 화합물 및 임의의 다른 성분과 조합될 때 원하는 용적, 점조도, 및 다른 적절한 수송 및 화학적 성질을 제공하도록 계획된 투여 방식을 유념하면서 선택될 수 있다. 전형적인 약학적으로 허용가능한 담체는 물; 식염수 용액; 결합제(예를 들면, 폴리비닐피롤리돈 또는 하이드록시프로필 메틸셀룰로스); 충전제(예를 들면, 락토스 또는 덱스트로스 및 다른 당, 젤라틴 또는 황산칼슘); 윤활제(예를 들면, 전분, 폴리에틸렌 글리콜 또는 아세트산나트륨); 붕해제(예를 들면, 전분 또는 나트륨 전분 글리콜레이트); 및 습윤화제(예를 들면, 나트륨 라우릴 설페이트)를 포함하나 이들로 한정되지 않는다.
본원에서 제공된 키메라 폴리펩티드를 함유하는 약학 조성물은 국소 치료가 요구되는 지 아니면 전신 치료가 요구되는 지에 따라 다수의 방법들에 의해 투여될 수 있다. 투여는 예를 들면, 비경구(예를 들면, 피하, 경막내, 심실내, 근육내 또는 복강내 주사에 의해, 또는 정맥내(i.v.) 점적에 의해); 경구; 국소(예를 들면, 경피, 설하, 안 또는 비강내); 또는 폐(예를 들면, 분말 또는 에어로졸의 흡입 또는 통기) 투여일 수 있거나, 이러한 방법들의 조합에 의해 일어날 수 있다. 투여는 (예를 들면, 주사에 의해) 신속할 수 있거나 (예를 들면, 느린 관주 또는 서방출 제제의 투여에 의해) 일정한 시간에 걸쳐 일어날 수 있다.
비경구, 경막내 또는 심실내 투여를 위한 조성물 및 제제는 완충제, 희석제 및 다른 적합한 첨가제(예를 들면, 침투 향상제, 담체 화합물 및 다른 약학적으로 허용가능한 담체)도 함유할 수 있는 멸균 수용액(예를 들면, 멸균 생리학적 식염수)을 포함한다.
경구 투여용 조성물 및 제제는 예를 들면, 산제 또는 과립제, 물 또는 비수성 매질 중의 현탁액 또는 용액, 캡슐, 향낭(sachet) 또는 정제를 포함한다. 이러한 조성물은 증점제, 향미제, 희석제, 유화제, 분산 보조제 또는 결합제도 포함할 수 있다.
약학 조성물은 용액, 유화액, 수성 현탁액 및 리포좀 함유 제제를 포함하나 이들로 한정되지 않는다. 이들 조성물들은 예를 들면, 미리 형성된 액체, 자가 유화 고체 및 자가 유화 반고체를 포함하는 다양한 성분들로부터 발생될 수 있다. 유화액 제제는 이들의 제제화 용이성 및 가용화의 효능, 흡수 및 생체이용성으로 인해 치료 조성물의 경구 전달에 특히 유용하다. 리포좀은 이들이 약물 전달의 관점으로부터 제공하는 이들의 특이성 및 작용 지속으로 인해 특히 유용할 수 있다.
조성물은 약학 조성물에서 통상적으로 발견되는 다른 보조제 성분을 추가로 함유할 수 있다. 따라서, 상기 조성물은 상용가능한 약학적 활성 물질, 예를 들면, 항소양제, 수렴제, 국소 마취제 또는 소염제, 또는 조성물의 다양한 투약 제형을 물리적으로 제제화하는 데에 유용한 추가 물질, 예컨대, 염료, 향미제, 방부제, 항산화제, 유백제, 증점제 및 안정화제도 포함할 수 있다. 나아가, 조성물은 보조제, 예를 들면, 윤활제, 방부제, 안정화제, 습윤화제, 유화제, 삼투압에 영향을 미치기 위한 염, 완충제, 착색제, 향미제, 침투 향상제 및 방향성 물질과 혼합될 수 있다. 그러나, 이러한 물질들은 첨가되었을 때 조성물 내의 다른 성분(예를 들면, 본원에서 제공된 키메라 폴리펩티드)의 생물학적 활성을 과도하게 방해하지 않아야 한다.
몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 지속 방출 투약 제형으로서 제제화될 수 있다. 몇몇 경우, 코팅제, 외피 또는 보호성 매트릭스는 본원에서 제공된 키메라 폴리펩티드들 중 하나 이상을 함유하도록 제제화될 수 있다. 이러한 코팅제, 외피 및 보호성 매트릭스는 유치 장치, 예컨대, 스텐트, 카테터 및 복강 투석 튜빙을 코팅하기 위해 사용될 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드는 중합체성 물질, 리포좀, 미세유화액, 미세입자, 나노입자 또는 왁스 내로 도입될 수 있다.
단위 투약 제형으로 편리하게 제공될 수 있는 본원에 개시된 약학 제제는 약학 산업에서 잘 공지된 통상적인 기법에 따라 제조될 수 있다. 이러한 기법은 활성 성분(예를 들면, 본원에서 제공된 키메라 폴리펩티드)을 원하는 약학 담체(들)와 회합하는 단계를 포함한다. 전형적으로, 상기 제제는 활성 성분을 액체 담체 또는 미분된 고체 담체, 또는 이들 둘다와 균일하고 친밀하게 회합한 후 필요하다면 생성물을 성형함으로써 제조될 수 있다. 제제는 원하는 경우 멸균될 수 있되, 단, 멸균 방법은 제제에 함유된 분자(들)(예를 들면, 본원에서 제공된 키메라 폴리펩티드)의 효능을 방해하지 않아야 한다.
심장 리모델링을 감소시키거나 억제하는 방법
본원은 예를 들면, AHF 및 AMI의 치료를 위한 본원에서 제공된 키메라 폴리펩티드의 용도도 제공한다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드는 예를 들면, 심근경색 후 일어날 수 있는 심장 리모델링을 감소시키거나 억제하기 위해 포유동물(예를 들면, 인간 또는 비인간 포유동물)에게 투여될 수 있다. 몇몇 실시양태에서, 예를 들면, 본원에서 제공된 키메라 폴리펩티드 또는 본원에서 제공된 조성물은 AMI를 갖는 것으로서 진단된 포유동물에게 투여될 수 있다. 상기 키메라 폴리펩티드 또는 조성물은 선택된 약제, 질환, 및 예방이 달성되어야 하는 지 아니면 치료가 달성되어야 하는 지를 포함하나 이들로 한정되지 않는 다양한 인자에 따라 임의의 적합한 투여량으로 투여될 수 있다. 투여는 국소 또는 전신 투여일 수 있다.
몇몇 실시양태에서, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 적어도 약 0.01 ng 폴리펩티드/체중 kg 내지 약 100 mg 폴리펩티드/체중 kg(예를 들면, 약 10 ng 폴리펩티드/체중 kg 내지 약 50 mg 폴리펩티드/체중 kg, 약 20 ng 폴리펩티드/체중 kg 내지 약 10 mg 폴리펩티드/체중 kg, 약 0.1 ng 폴리펩티드/체중 kg 내지 약 20 ng 폴리펩티드/체중 kg, 약 3 ng 폴리펩티드/체중 kg 내지 약 10 ng 폴리펩티드/체중 kg, 또는 약 50 ng 폴리펩티드/체중 kg 내지 약 100 ㎍/체중 kg)의 투여량으로 투여될 수 있지만, 다른 투여량도 유리한 결과를 제공할 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 재관류 시점에서 또는 재관류 시점쯤에서(즉, 폐색된 동맥이 개방되는 시점에서) 시작하여 1일 내지 7일(예를 들면, 1일, 2일, 3일, 4일, 5일, 6일 또는 7일) 동안 계속되는 연속적인 정맥내 관주로서 투여될 수 있다. 이러한 조성물은 예를 들면, 약 0.1 ng 폴리펩티드/kg/분 내지 약 500 ng 폴리펩티드/kg/분(예를 들면, 약 0.5 ng 폴리펩티드/kg/분, 약 1 ng 폴리펩티드/kg/분, 약 2 ng 폴리펩티드/kg/분, 약 3 ng 폴리펩티드/kg/분, 약 5 ng 폴리펩티드/kg/분, 약 7.5 ng 폴리펩티드/kg/분, 약 10 ng 폴리펩티드/kg/분, 약 12.5 ng 폴리펩티드/kg/분, 약 15 ng 폴리펩티드/kg/분, 약 20 ng 폴리펩티드/kg/분, 약 25 ng 폴리펩티드/kg/분, 약 30 ng 폴리펩티드/kg/분, 약 50 ng 폴리펩티드/kg/분, 약 100 ng 폴리펩티드/kg/분, 또는 약 300 ng 폴리펩티드/kg/분)의 투여량으로 투여될 수 있다. 몇몇 실시양태에서, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 하나 이상의 개별 용량으로서, 또는 재관류 약 1시간 전에 시작되는 연속 관주로서 재관류 전에(예를 들면, 재관류 약 1시간 전에) 투여될 수 있다. 예를 들면, 조성물은 재관류 약 1시간, 약 45분, 약 30분 또는 약 15분 전에 시작되어 투여될 수 있다. 몇몇 경우, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 재관류 후에(예를 들면, 재관류 후 약 10시간 이내에) 투여될 수 있고, 하나 이상의 개별 투여량으로서, 또는 재관류 후 약 10시간 이내에 시작되는 연속 관주로서 투여될 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 재관류 후 약 1시간, 약 2시간, 약 3시간, 약 4시간, 약 5시간, 약 6시간, 약 7시간, 약 8시간, 약 9시간 또는 약 10시간에서 투여될 수 있다.
몇몇 실시양태에서, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 제1 시간 동안 제1 경로(예를 들면, 정맥내)를 통해 투여될 수 있고, 그 후 제2 시간 동안 또 다른 경로(예를 들면, 국소 또는 피하)를 통해 투여될 수 있다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물은 1일 내지 7일(예를 들면, 1일, 2일, 3일, 4일, 5일, 6일 또는 7일) 동안 약 0.1 ng 폴리펩티드/kg/분 내지 약 300 ng 폴리펩티드/kg/분(예를 들면, 약 1 ng 폴리펩티드/kg/분 내지 약 15 ng 폴리펩티드/kg/분, 약 3 ng 폴리펩티드/kg/분 내지 약 10 ng 폴리펩티드/kg/분 또는 약 10 ng 폴리펩티드/kg/분 내지 약 30 ng 폴리펩티드/kg/분)의 투여량으로 포유동물(예를 들면, 인간)에게 정맥내 투여될 수 있고, 그 후 5일 내지 30일(예를 들면, 7일, 10일, 14일, 18일, 21일, 24일 또는 27일) 동안 약 10 ng 폴리펩티드/kg/일 내지 약 100 ng 폴리펩티드/kg/일(예를 들면, 약 10 ng 폴리펩티드/kg/일, 약 20 ng 폴리펩티드/kg/일, 약 25 ng 폴리펩티드/kg/일, 약 30 ng 폴리펩티드/kg/일, 약 50 ng 폴리펩티드/kg/일, 또는 약 100 ng 폴리펩티드/kg/일)의 투여량으로 상기 포유동물에게 피하 투여될 수 있다.
본원에서 제공된 방법은 유효량의 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물을 포유동물에게 투여하는 단계를 포함할 수 있다. 본원에서 사용된 바와 같이, 용어 "유효량"은 포유동물 수용자에서 감소된 심장 리모델링 및/또는 신장 보호를 표시하는 하나 이상(예를 들면, 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 10개)의 파라미터를 10%(예를 들면, 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 99% 또는 100%) 이상까지 변화시키기에 충분한 분자 또는 조성물의 양이다. 예를 들면, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물의 유효량은 박출 계수, GFR, 소변 나트륨 배설(UNaV) 또는 소변 유동(UV)을 10% 이상까지 증가시킬 수 있고/있거나, PRA, LV 질량, CF 증식, PCWP, RAP, MAP, 알도스테론 수준, LV 비대증, 심실 섬유증, LV 수축말기 직경, PFRNa 또는 DFRNa를 10% 이상까지 감소시킬 수 있고/있거나, 심장 하중감소를 야기할 수 있는 양이다. 몇몇 실시양태에서 방법은 감소된 심장 리모델링 및/또는 신장 보호를 표시하는 하나 이상의 파라미터를 50% 이상까지 변화시키기에 충분한 양의 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물을 포유동물에게 투여하는 단계를 포함할 수 있다.
몇몇 실시양태에서, 예를 들면, 본원에서 제공된 키메라 폴리펩티드, 또는 본원에서 제공된 키메라 폴리펩티드를 함유하는 조성물의 "유효량"은 상기 키메라 폴리펩티드 또는 조성물의 투여 전의 포유동물, 또는 상기 키메라 폴리펩티드 또는 조성물을 투여받지 않은 포유동물에서의 PRA, MAP, GFR 및 UV의 수준(예를 들면, 이전 심근경색 에피소드에서 관찰된 상기 파라미터의 수준)에 비해 치료받은 포유동물에서 PRA 및 MAP를 10% 이상까지 감소시키고 GFR 및 UV를 10% 이상까지 증가시키는 양일 수 있다.
본 발명은 특허청구범위에 기재된 본 발명의 범위를 한정하지 않는 하기 실시예에 더 기재되어 있을 것이다.
실시예
실시예 1 - cANG는 cGMP 생성을 유도한다.
도 4에 기재된 서열을 갖도록 cANG를 주문 합성하였고 고성능 액체크로마토그래피 및 질량 분광법으로 3080.6 Da의 분자량을 갖는다는 것을 확인하였다. 인간 심장 섬유모세포(CF; 사이언셀, 미국 캘리포니아주 샌 디에고 소재)를 섬유모세포 생장 혈청(FGS), 태아 소 혈청(FBS) 및 페니실린/스트렙토마이신으로 보충된 제조자의 섬유모세포 배지(사이언셀, 미국 캘리포니아주 샌 디에고 소재)에서 배양하였다. 세포를 80% 내지 90% 전면생장률에서 처리하였다. 계대배양 1 내지 4의 세포만을 실험에 사용하였다. 환형 GMP 분석을 수행하기 위해, 상기 세포를 종래 기재된 바와 같이 처리하였다(Huntley et al., J. Cell. Physiol., 209(3):943-9 (2006)). 요약하건대, 20 mmol/ℓ의 N-[2-하이드록시에틸]피페라진-N'[2-에탄설폰산], 0.1%의 소 혈청 알부민 및 0.5 mmol/ℓ의 3-이소부틸-1-메틸잔틴(시그마, 미국 미조리주 세인트 루이스 소재)을 함유하는 행크 균형 염 용액(인비트로겐, 미국 캘리포니아주 칼스바드 소재)에서 세포를 배양하였다. 처리된 세포는 10-6 M, 10-8 M 또는 10-10 M의 NP 또는 cANG를 10분 동안 제공받았다. 세포를 6% TCA에서 용해시키고 10분 동안 초음파처리하였다. 샘플을 4배 부피의 에테르로 4회 에테르 추출하고 건조하고 500 ㎖의 cGMP 분석 완충제에서 재구성하였다.
경쟁 RIA cGMP 키트(퍼킨-엘머, 미국 매사추세츠주 보스톤 소재)를 사용하여 샘플을 분석하였다. 요약하건대, 샘플 및 표준물을 100 ㎖의 항-인간 cGMP 다중클론 항체 및 I125-항원과 함께 18시간 동안 항온처리하였다. 환형 GMP 분석 완충제를 상기 샘플에 첨가하였고, 이들을 2500 rpm에서 20분 동안 원심분리하였다. 자유 분획을 흡입하여 제거하고, 결합된 분획을 카운팅하고 농도를 측정하였다. 샘플을 희석 계수 및 단백질 농도에 대해 보정하였고, 값을 pmoles/㎖로서 표현하였다. 상기 분석은 cGMP에 대해 매우 특이적이었는데, 이는 ANP, BNP, CNP 및 엔도텔린-1과의 교차반응성이 없고 cAMP, GMP, GDP, ATP 및 GTP와의 0.001% 미만의 교차반응성이 있다는 것을 입증한다.
ANP, BNP 및 CNP를 사용한 CF의 처리와 마찬가지로, cANG를 사용한 CF의 처리는 cGMP 생성을 야기하였다(도 20 및 21). 이들 결과는 Ang1-7의 첨가가 수용체 결합 및 cGMP 발생을 방해하지 않는다는 것을 입증한다.
실시예 2 - BNP-Ang1-7 및 Ang1-7BNP는 cGMP 생성을 유도한다.
각각 도 3 및 도 20에 기재된 서열을 갖도록 BNP-Ang1-7 및 Ang1-7BNP를 합성하였다.
리포펙타민(인비트로겐, 미국 뉴욕주 그랜드 아일랜드 소재)을 사용하여 NPR-A(GC-A) 또는 NPR-B(GC-B)를 발현하도록 HEK 293 세포를 안정하게 형질감염시켰다. 형질감염된 세포를 10% 태아 소 혈청, 100 U/㎖의 페니실린, 100 U/㎖의 스트렙토마이신 및 250 ㎍/㎖의 G418로 보충된 둘베코 변경 이글 배지에서 유지하였다. 시약들은 인비트로겐(미국 뉴욕주 그랜드 아일랜드 소재)으로부터 입수되었다.
세포 자극 및 cGMP 분석을 실시하기 위해 하기 실험을 수행하였다. 세포를 6웰 플레이트에서 플레이팅하고 다른 문헌(Tsuruda et al., Circulation Research, 91:1127-1134 (2002))에 기재된 바와 같이 처리하였다. 요약하건대, 20 mmol/ℓ의 N-[2-하이드록시에틸]피페라진-N'[2-에탄설폰산], 0.1%의 소 혈청 알부민 및 0.5 mmol/ℓ의 3-이소부틸-1-메틸잔틴(시그마, 미국 미조리주 세인트 루이스 소재)을 함유하는 행크 균형 염 용액(인비트로겐, 미국 캘리포니아주 칼스바드 소재)에서 세포를 항온처리하였다. 처리된 세포는 10-10 M, 10-8 M 또는 10-6 M의 BNP-Ang1-7 또는 Ang1-7BNP를 10분 동안 제공받았다. 세포를 300 ㎕의 6% TCA에서 용해시키고 10분 동안 초음파처리하였다. 샘플을 4배 부피의 에테르로 4회 에테르 추출하고 건조하고 500 ㎕의 cGMP 분석 완충제에서 재구성하였다. 다른 문헌(Steiner et al., J. Biol. Chem., 247:1106-1113 (1972))에 기재된 바와 같이 경쟁 RIA cGMP 키트(퍼킨-엘머, 미국 매사추세츠주 보스톤 소재)를 사용하여 샘플을 분석하였다. 샘플을 희석 계수 및 단백질 농도에 대해 보정하였고, 값을 pmol cGMP/웰로서 표현하였다. ANP, BNP, CNP 및 엔도텔린-1과의 교차반응성은 없었고, cAMP, GMP, GDP, ATP 및 GTP와의 0.001% 미만의 교차반응성은 있었다.
BNP(도 33A)와 마찬가지로, BNP-Ang1-7 또는 Ang1-7BNP에의 NPR-A+ HEK 293 세포의 노출은 cGMP 생성을 유도하였다(도 33B 및 33C). BNP-Ang1-7 및 Ang1-7BNP 중 어느 것도 NPR-B+ HEK 293 세포에서 cGMP 생성을 유도하지 않았다(도 34B 및 34C). BNP에 노출된 NPR-B+ HEK 293 세포의 경우 최소한의 cGMP 생성이 관찰되었다(도 34A). Ang1-7은 NPR-A+ HEK 293 세포(도 35, 좌측 패널) 또는 NPR-B+ HEK 293 세포(도 35, 우측 패널)와 접촉하였을 때 cGMP 생성을 유도하지 않았다.
이들 결과는 BNP-Ang1-7 및 Ang1-7BNP 둘다가 cGMP 생성을 유도한다는 것을 입증한다. 이들 결과는 Ang1-7을 N-말단 위치 또는 C-말단 위치에서 나트륨이뇨 폴리펩티드 또는 나트륨이뇨 폴리펩티드의 성분(예를 들면, 나트륨이뇨 폴리펩티드의 고리 구조)에 부착시키는 것은 상기 나트륨이뇨 폴리펩티드 또는 나트륨이뇨 폴리펩티드 성분이 그의 나트륨이뇨 폴리펩티드 수용체에 결합하여 cGMP 생성을 유도하는 능력을 방해하지 않는다는 것도 입증한다.
다른 실시양태
본 발명이 이의 상세한 설명과 함께 기재되어 있지만, 상기 설명이 첨부된 특허청구범위에 의해 정의되는 본 발명의 범위를 예시하기 위한 것이고 한정하기 위한 것이 아니라는 것을 이해해야 한다. 다른 양태, 이점 및 변경은 하기 특허청구범위 내에 있다.
SEQUENCE LISTING
<110> Mayo Foundation for Medical Education and Research
<120> NATRIURETIC POLYPEPTIDES
<130> 07039-1021WO1
<150> US 61/648,718
<151> 2012-05-18
<150> US 61/529,113
<151> 2011-08-30
<160> 61
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 7
<212> PRT
<213> Homo sapiens
<400> 1
Asp Arg Val Tyr Ile His Pro
1 5
<210> 2
<211> 6
<212> PRT
<213> Homo sapiens
<400> 2
Ser Leu Arg Arg Ser Ser
1 5
<210> 3
<211> 17
<212> PRT
<213> Homo sapiens
<400> 3
Cys Phe Gly Gly Arg Met Asp Arg Ile Gly Ala Gln Ser Gly Leu Gly
1 5 10 15
Cys
<210> 4
<211> 9
<212> PRT
<213> Homo sapiens
<400> 4
Ser Pro Lys Met Val Gln Gly Ser Gly
1 5
<210> 5
<211> 17
<212> PRT
<213> Homo sapiens
<400> 5
Cys Phe Gly Arg Lys Met Asp Arg Ile Ser Ser Ser Ser Gly Leu Gly
1 5 10 15
Cys
<210> 6
<211> 5
<212> PRT
<213> Homo sapiens
<400> 6
Gly Leu Ser Lys Gly
1 5
<210> 7
<211> 17
<212> PRT
<213> Homo sapiens
<400> 7
Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser Met Ser Gly Leu Gly
1 5 10 15
Cys
<210> 8
<211> 6
<212> PRT
<213> Dendroaspis angusticeps
<400> 8
Glu Val Lys Tyr Asp Pro
1 5
<210> 9
<211> 17
<212> PRT
<213> Dendroaspis angusticeps
<400> 9
Cys Phe Gly His Lys Ile Asp Arg Ile Asn His Val Ser Asn Leu Gly
1 5 10 15
Cys
<210> 10
<211> 10
<212> PRT
<213> Homo sapiens
<400> 10
Thr Ala Pro Arg Ser Leu Arg Arg Ser Ser
1 5 10
<210> 11
<211> 17
<212> PRT
<213> Homo sapiens
<400> 11
Cys Phe Gly Gly Arg Met Asp Arg Ile Gly Ala Gln Ser Gly Leu Gly
1 5 10 15
Cys
<210> 12
<211> 5
<212> PRT
<213> Homo sapiens
<400> 12
Asn Ser Phe Arg Tyr
1 5
<210> 13
<211> 6
<212> PRT
<213> Homo sapiens
<400> 13
Lys Val Leu Arg Arg His
1 5
<210> 14
<211> 10
<212> PRT
<213> Homo sapiens
<400> 14
Asp Arg Val Tyr Ile His Pro Phe His Leu
1 5 10
<210> 15
<220>
<223> synthetic peptide
<400> 15
000
<210> 16
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 16
Thr Val Pro Arg Ser Leu Arg Arg Ser Ser
1 5 10
<210> 17
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 17
Thr Ala Gly Arg Ser Leu Arg Arg Ser Ser
1 5 10
<210> 18
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 18
Thr Ala Pro Lys Ser Leu Arg Arg Ser Ser
1 5 10
<210> 19
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 19
Thr Leu Arg Arg Ser Ser
1 5
<210> 20
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 20
Ser Ile Arg Arg Ser Ser
1 5
<210> 21
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 21
Ser Leu Lys Arg Ser Ser
1 5
<210> 22
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 22
Ser Leu Arg Lys Ser Ser
1 5
<210> 23
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 23
Lys Val Leu Arg Arg Arg
1 5
<210> 24
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 24
Lys Val Leu Arg Lys His
1 5
<210> 25
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 25
Lys Val Leu Lys Arg His
1 5
<210> 26
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 26
Lys Val Ile Arg Arg His
1 5
<210> 27
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 27
Asp Arg Val Tyr Ile His Pro Asn Ser Phe Arg Tyr
1 5 10
<210> 28
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 28
Asp Arg Val Tyr Ile His Pro Lys Val Leu Arg Arg His
1 5 10
<210> 29
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 29
Asp Arg Val Tyr Ile His Pro Pro Ser Leu Arg Asp Pro Arg Pro Asn
1 5 10 15
Ala Pro Ser Thr Ser Ala
20
<210> 30
<211> 15
<212> PRT
<213> Dendroaspis angusticeps
<220>
<223> synthetic peptide
<400> 30
Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala Pro Ser Thr Ser Ala
1 5 10 15
<210> 31
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 31
Asn Ser Phe Arg Tyr Asp Arg Val Tyr Ile His Pro
1 5 10
<210> 32
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 32
Lys Val Leu Arg Arg His Asp Arg Val Tyr Ile His Pro
1 5 10
<210> 33
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 33
Pro Ser Leu Arg Asp Pro Arg Pro Asn Ala Pro Ser Thr Ser Ala Asp
1 5 10 15
Arg Val Tyr Ile His Pro
20
<210> 34
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 34
Asp Arg Val Tyr Ile His Pro Cys Phe Gly Leu Lys Leu Asp Arg Ile
1 5 10 15
Gly Ser Met Ser Gly Leu Gly Cys
20
<210> 35
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 35
Pro His Ile Tyr Val Arg Asp Cys Phe Gly Leu Lys Leu Asp Arg Ile
1 5 10 15
Gly Ser Met Ser Gly Leu Gly Cys
20
<210> 36
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 36
Cys Gly Leu Gly Ser Met Ser Gly Ile Arg Asp Leu Lys Leu Gly Phe
1 5 10 15
Cys
<210> 37
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 37
Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser Met Ser Gly Leu Gly
1 5 10 15
Cys Pro His Ile Tyr Val Arg Asp
20
<210> 38
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 38
Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser Met Ser Gly Leu Gly
1 5 10 15
Cys Asp Arg Val Tyr Ile His Pro
20
<210> 39
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 39
Cys Gly Leu Gly Ser Gln Ala Gly Ile Arg Asp Met Arg Gly Gly Phe
1 5 10 15
Cys
<210> 40
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 40
Cys Gly Leu Gly Ser Ser Ser Ser Ile Arg Asp Met Lys Arg Gly Phe
1 5 10 15
Cys
<210> 41
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 41
Cys Gly Leu Asn Ser Val His Asn Ile Arg Asp Ile Lys His Gly Phe
1 5 10 15
Cys
<210> 42
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 42
Cys Gly Leu Gly Ser Gln Ala Gly Ile Arg Asp Met Arg Gly Gly Phe
1 5 10 15
Cys
<210> 43
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 43
Ser Leu Arg Arg Ser Ser Cys Phe Gly Gly Arg Met Asp Arg Ile Gly
1 5 10 15
Ala Gln Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25 30
<210> 44
<211> 33
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 44
Ser Pro Lys Met Val Gln Gly Ser Gly Cys Phe Gly Arg Lys Met Asp
1 5 10 15
Arg Ile Ser Ser Ser Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His
20 25 30
Pro
<210> 45
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 45
Gly Leu Ser Lys Gly Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly Ser
1 5 10 15
Met Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25
<210> 46
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 46
Glu Val Lys Tyr Asp Pro Cys Phe Gly His Lys Ile Asp Arg Ile Asn
1 5 10 15
His Val Ser Asn Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25 30
<210> 47
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 47
Thr Ala Pro Arg Ser Leu Arg Arg Ser Ser Cys Phe Gly Gly Arg Met
1 5 10 15
Asp Arg Ile Gly Ala Gln Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile
20 25 30
His Pro
<210> 48
<211> 33
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 48
Ser Pro Lys Met Val Gln Gly Ser Gly Cys Phe Gly Gly Arg Met Asp
1 5 10 15
Arg Ile Gly Ala Gln Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His
20 25 30
Pro
<210> 49
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 49
Gly Leu Ser Lys Gly Cys Phe Gly Gly Arg Met Asp Arg Ile Gly Ala
1 5 10 15
Gln Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25
<210> 50
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 50
Glu Val Lys Tyr Asp Pro Cys Phe Gly Gly Arg Met Asp Arg Ile Gly
1 5 10 15
Ala Gln Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25 30
<210> 51
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 51
Thr Ala Pro Arg Ser Leu Arg Arg Ser Ser Cys Phe Gly Gly Arg Met
1 5 10 15
Asp Arg Ile Gly Ala Gln Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile
20 25 30
His Pro
<210> 52
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 52
Ser Leu Arg Arg Ser Ser Cys Phe Gly Arg Lys Met Asp Arg Ile Ser
1 5 10 15
Ser Ser Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25 30
<210> 53
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 53
Gly Leu Ser Lys Gly Cys Phe Gly Arg Lys Met Asp Arg Ile Ser Ser
1 5 10 15
Ser Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25
<210> 54
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 54
Glu Val Lys Tyr Asp Pro Cys Phe Gly Arg Lys Met Asp Arg Ile Ser
1 5 10 15
Ser Ser Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25 30
<210> 55
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 55
Thr Ala Pro Arg Ser Leu Arg Arg Ser Ser Cys Phe Gly Arg Lys Met
1 5 10 15
Asp Arg Ile Ser Ser Ser Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile
20 25 30
His Pro
<210> 56
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 56
Ser Leu Arg Arg Ser Ser Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly
1 5 10 15
Ser Met Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25 30
<210> 57
<211> 33
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 57
Ser Pro Lys Met Val Gln Gly Ser Gly Cys Phe Gly Leu Lys Leu Asp
1 5 10 15
Arg Ile Gly Ser Met Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His
20 25 30
Pro
<210> 58
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 58
Glu Val Lys Tyr Asp Pro Cys Phe Gly Leu Lys Leu Asp Arg Ile Gly
1 5 10 15
Ser Met Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile His Pro
20 25 30
<210> 59
<211> 33
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 59
Thr Ala Pro Arg Ser Leu Arg Arg Ser Ser Cys Phe Gly Leu Lys Leu
1 5 10 15
Asp Arg Ile Gly Ser Met Ser Gly Leu Gly Cys Asp Arg Val Tyr Ile
20 25 30
Pro
<210> 60
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 60
Asp Arg Val Tyr Ile His Pro Cys Phe Gly Gly Arg Met Asp Arg Ile
1 5 10 15
Gly Ala Gln Ser Gly Leu Gly Cys Asn Ser Phe Arg Tyr
20 25
<210> 61
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic peptide
<400> 61
Asp Arg Val Tyr Ile His Pro Cys Phe Gly Arg Lys Met Asp Arg Ile
1 5 10 15
Ser Ser Ser Ser Gly Leu Gly Cys Lys Tyr Leu Arg Arg His
20 25 30
Claims (109)
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 2에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열,
(b) 서열번호 3에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 3에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 2에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열,
(b) 서열번호 3에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 3에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제1항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제1항 또는 제2항에 있어서, 서열번호 2에 기재된 서열을 포함하는 폴리펩티드.
제1항 내지 제3항 중 어느 한 항에 있어서, 서열번호 3에 기재된 서열을 포함하는 폴리펩티드.
제1항 내지 제4항 중 어느 한 항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제1항 내지 제5항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 43에 기재된 서열을 포함하는 폴리펩티드.
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 4에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 4에 기재된 서열,
(b) 서열번호 5에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 4에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 4에 기재된 서열,
(b) 서열번호 5에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제7항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제7항 또는 제8항에 있어서, 서열번호 4에 기재된 서열을 포함하는 폴리펩티드.
제7항 내지 제9항 중 어느 한 항에 있어서, 서열번호 5에 기재된 서열을 포함하는 폴리펩티드.
제7항 내지 제10항 중 어느 한 항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제7항 내지 제11항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 44에 기재된 서열을 포함하는 폴리펩티드.
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 6에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 6에 기재된 서열,
(b) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 6에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 6에 기재된 서열,
(b) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제13항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제13항 또는 제14항에 있어서, 서열번호 6에 기재된 서열을 포함하는 폴리펩티드.
제13항 내지 제15항 중 어느 한 항에 있어서, 서열번호 7에 기재된 서열을 포함하는 폴리펩티드.
제13항 내지 제16항 중 어느 한 항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제13항 내지 제17항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 45에 기재된 서열을 포함하는 폴리펩티드.
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 8에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 8에 기재된 서열,
(b) 서열번호 9에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 9에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 8에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 8에 기재된 서열,
(b) 서열번호 9에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 9에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제19항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제19항 또는 제20항에 있어서, 서열번호 8에 기재된 서열을 포함하는 폴리펩티드.
제19항 내지 제21항 중 어느 한 항에 있어서, 서열번호 9에 기재된 서열을 포함하는 폴리펩티드.
제19항 내지 제22항 중 어느 한 항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제19항 내지 제23항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 46에 기재된 서열을 포함하는 폴리펩티드.
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 10에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 10에 기재된 서열,
(b) 서열번호 11에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 11에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 10에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 10에 기재된 서열,
(b) 서열번호 11에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 11에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제25항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제25항 또는 제26항에 있어서, 서열번호 10에 기재된 서열을 포함하는 폴리펩티드.
제25항 내지 제27항 중 어느 한 항에 있어서, 서열번호 11에 기재된 서열을 포함하는 폴리펩티드.
제25항 내지 제28항 중 어느 한 항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제25항 내지 제29항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 47에 기재된 서열을 포함하는 폴리펩티드.
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열,
(b) 서열번호 2에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열, 및
(c) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열,
(b) 서열번호 2에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열, 및
(c) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열
을 포함하는 폴리펩티드.
제31항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제31항 또는 제32항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제31항 내지 제33항 중 어느 한 항에 있어서, 서열번호 2에 기재된 서열을 포함하는 폴리펩티드.
제31항 내지 제34항 중 어느 한 항에 있어서, 서열번호 12에 기재된 서열을 포함하는 폴리펩티드.
제31항 내지 제35항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 60에 기재된 서열을 포함하는 폴리펩티드.
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열,
(b) 서열번호 5에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 및
(c) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열,
(b) 서열번호 5에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 및
(c) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열
을 포함하는 폴리펩티드.
제37항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제37항 또는 제38항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제37항 내지 제39항 중 어느 한 항에 있어서, 서열번호 5에 기재된 서열을 포함하는 폴리펩티드.
제37항 내지 제40항 중 어느 한 항에 있어서, 서열번호 13에 기재된 서열을 포함하는 폴리펩티드.
제37항 내지 제41항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 61에 기재된 서열을 포함하는 폴리펩티드.
10개 내지 14개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열
을 포함하는 폴리펩티드.
제43항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제43항 또는 제44항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제43항 내지 제45항 중 어느 한 항에 있어서, 서열번호 12에 기재된 서열을 포함하는 폴리펩티드.
제43항 내지 제46항 중 어느 한 항에 있어서, 고리 구조를 결여하는 폴리펩티드.
제43항 내지 제47항 중 어느 한 항에 있어서, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 27에 기재된 서열을 포함하는 폴리펩티드.
10개 내지 16개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열
을 포함하는 폴리펩티드.
제49항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제49항 또는 제50항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제49항 내지 제51항 중 어느 한 항에 있어서, 서열번호 13에 기재된 서열을 포함하는 폴리펩티드.
제49항 내지 제52항 중 어느 한 항에 있어서, 고리 구조를 결여하는 폴리펩티드.
제49항 내지 제53항 중 어느 한 항에 있어서, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 28에 기재된 서열을 포함하는 폴리펩티드.
19개 내지 25개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 30에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 30에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 30에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 30에 기재된 서열
을 포함하는 폴리펩티드.
제55항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제55항 또는 제56항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제55항 내지 제57항 중 어느 한 항에 있어서, 서열번호 30에 기재된 서열을 포함하는 폴리펩티드.
제55항 내지 제58항 중 어느 한 항에 있어서, 고리 구조를 결여하는 폴리펩티드.
제55항 내지 제59항 중 어느 한 항에 있어서, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 29에 기재된 서열을 포함하는 폴리펩티드.
10개 내지 14개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 12에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 12에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제61항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제61항 또는 제62항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제61항 내지 제63항 중 어느 한 항에 있어서, 서열번호 12에 기재된 서열을 포함하는 폴리펩티드.
제61항 내지 제64항 중 어느 한 항에 있어서, 고리 구조를 결여하는 폴리펩티드.
제61항 내지 제65항 중 어느 한 항에 있어서, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 31에 기재된 서열을 포함하는 폴리펩티드.
10개 내지 16개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 13에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 13에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제67항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제67항 또는 제68항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제67항 내지 제69항 중 어느 한 항에 있어서, 서열번호 13에 기재된 서열을 포함하는 폴리펩티드.
제67항 내지 제70항 중 어느 한 항에 있어서, 고리 구조를 결여하는 폴리펩티드.
제67항 내지 제71항 중 어느 한 항에 있어서, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 32에 기재된 서열을 포함하는 폴리펩티드.
19개 내지 25개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 30에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 30에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 30에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 30에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제73항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제73항 또는 제74항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제73항 내지 제75항 중 어느 한 항에 있어서, 서열번호 30에 기재된 서열을 포함하는 폴리펩티드.
제73항 내지 제76항 중 어느 한 항에 있어서, 고리 구조를 결여하는 폴리펩티드.
제73항 내지 제77항 중 어느 한 항에 있어서, 4개 이하의 추가, 결실 또는 치환을 갖는 서열번호 33에 기재된 서열을 포함하는 폴리펩티드.
20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열
을 포함하는 폴리펩티드.
제79항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제79항 또는 제80항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제79항 내지 제81항 중 어느 한 항에 있어서, 서열번호 7에 기재된 서열을 포함하는 폴리펩티드.
제79항 내지 제82항 중 어느 한 항에 있어서, 고리 구조에 부착된 C-말단 꼬리를 결여하는 폴리펩티드.
제79항 내지 제83항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 34에 기재된 서열을 포함하는 폴리펩티드.
20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 36에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 36에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 36에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 36에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제85항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제85항 또는 제86항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제85항 내지 제87항 중 어느 한 항에 있어서, 서열번호 36에 기재된 서열을 포함하는 폴리펩티드.
제85항 내지 제88항 중 어느 한 항에 있어서, 고리 구조에 부착된 N-말단 꼬리를 결여하는 폴리펩티드.
제85항 내지 제89항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 35에 기재된 서열을 포함하는 폴리펩티드.
20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 36에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 36에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열, 및
(b) 서열번호 36에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 36에 기재된 서열
을 포함하는 폴리펩티드.
제91항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제91항 또는 제92항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제91항 내지 제93항 중 어느 한 항에 있어서, 서열번호 36에 기재된 서열을 포함하는 폴리펩티드.
제91항 내지 제94항 중 어느 한 항에 있어서, 고리 구조에 부착된 C-말단 꼬리를 결여하는 폴리펩티드.
제91항 내지 제95항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 37에 기재된 서열을 포함하는 폴리펩티드.
20개 내지 28개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 7에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 및
(b) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제97항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제97항 또는 제98항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제97항 내지 제99항 중 어느 한 항에 있어서, 서열번호 7에 기재된 서열을 포함하는 폴리펩티드.
제97항 내지 제100항 중 어느 한 항에 있어서, 고리 구조에 부착된 N-말단 꼬리를 결여하는 폴리펩티드.
제97항 내지 제101항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 38에 기재된 서열을 포함하는 폴리펩티드.
17개 내지 50개 아미노산 잔기의 길이를 갖는 폴리펩티드로서, 아미노 말단부터 카복시 말단까지 순서대로
(a) 서열번호 2에 기재된 서열, 서열번호 4에 기재된 서열, 서열번호 6에 기재된 서열, 서열번호 8에 기재된 서열, 서열번호 10에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 4에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 6에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 8에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 10에 기재된 서열,
(b) 서열번호 3에 기재된 서열, 서열번호 5에 기재된 서열, 서열번호 7에 기재된 서열, 서열번호 9에 기재된 서열, 서열번호 11에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 3에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 9에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 11에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
(a) 서열번호 2에 기재된 서열, 서열번호 4에 기재된 서열, 서열번호 6에 기재된 서열, 서열번호 8에 기재된 서열, 서열번호 10에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 2에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 4에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 6에 기재된 서열, 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 8에 기재된 서열, 또는 3개 이하의 추가, 결실 또는 치환을 갖는 서열번호 10에 기재된 서열,
(b) 서열번호 3에 기재된 서열, 서열번호 5에 기재된 서열, 서열번호 7에 기재된 서열, 서열번호 9에 기재된 서열, 서열번호 11에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 3에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 5에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 7에 기재된 서열, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 9에 기재된 서열, 또는 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 11에 기재된 서열, 및
(c) 서열번호 1에 기재된 서열, 또는 2개 이하의 추가, 결실 또는 치환을 갖는 서열번호 1에 기재된 서열
을 포함하는 폴리펩티드.
제103항에 있어서, cGMP 활성화 성질을 포함하는 폴리펩티드.
제103항 또는 제104항에 있어서, 서열번호 2, 4, 6, 8 또는 10에 기재된 서열을 포함하는 폴리펩티드.
제103항 내지 제105항 중 어느 한 항에 있어서, 서열번호 3, 5, 7, 9 또는 11에 기재된 서열을 포함하는 폴리펩티드.
제103항 내지 제106항 중 어느 한 항에 있어서, 서열번호 1에 기재된 서열을 포함하는 폴리펩티드.
제103항 내지 제107항 중 어느 한 항에 있어서, 5개 이하의 추가, 결실 또는 치환을 갖는 서열번호 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58 또는 59에 기재된 서열을 포함하는 폴리펩티드.
제103항 내지 제108항 중 어느 한 항에 있어서, 17개 내지 45개 아미노산 잔기, 17개 내지 40개 아미노산 잔기, 17개 내지 35개 아미노산 잔기, 20개 내지 50개 아미노산 잔기, 25개 내지 50개 아미노산 잔기, 20개 내지 45개 아미노산 잔기, 20개 내지 40개 아미노산 잔기, 20개 내지 35개 아미노산 잔기, 25개 내지 45개 아미노산 잔기, 25개 내지 40개 아미노산 잔기, 또는 25개 내지 35개 아미노산 잔기의 길이를 갖는 폴리펩티드.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161529113P | 2011-08-30 | 2011-08-30 | |
| US61/529,113 | 2011-08-30 | ||
| US201261648718P | 2012-05-18 | 2012-05-18 | |
| US61/648,718 | 2012-05-18 | ||
| PCT/US2012/051734 WO2013032784A1 (en) | 2011-08-30 | 2012-08-21 | Natriuretic polypeptides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140059249A true KR20140059249A (ko) | 2014-05-15 |
Family
ID=47756735
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147007530A KR20140059249A (ko) | 2011-08-30 | 2012-08-21 | 나트륨이뇨 폴리펩티드 |
Country Status (6)
| Country | Link |
|---|---|
| US (4) | US9102707B2 (ko) |
| EP (1) | EP2751136B1 (ko) |
| JP (1) | JP2014525439A (ko) |
| KR (1) | KR20140059249A (ko) |
| CN (2) | CN103906761B (ko) |
| WO (1) | WO2013032784A1 (ko) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011005939A2 (en) | 2009-07-09 | 2011-01-13 | Mayo Foundation For Medical Education And Research | Long acting atrial natriuretic peptide (la-anp) and methods for use thereof |
| CN103906761B (zh) | 2011-08-30 | 2016-12-21 | 梅约医学教育与研究基金会 | 利钠多肽 |
| US9611305B2 (en) | 2012-01-06 | 2017-04-04 | Mayo Foundation For Medical Education And Research | Treating cardiovascular or renal diseases |
| MX2015016143A (es) * | 2013-05-24 | 2016-03-31 | Tarix Pharmaceuticals Ltd | Peptidos de angiotensina para tratar el sindrome de marfan y transtornos relacionados. |
| WO2017049140A2 (en) * | 2015-09-18 | 2017-03-23 | Wake Forest University Health Sciences | Angiotensin (1-7) analogs and methods relating thereto |
| SG10202101479PA (en) | 2016-08-18 | 2021-03-30 | Nat Univ Singapore | Peptides with vasodilatory and/or diuretic functions |
| EP3553081A1 (en) * | 2018-04-12 | 2019-10-16 | Bayer Aktiengesellschaft | Atrial natriuretic peptide engrafted antibodies |
| EP3553079A1 (en) * | 2018-04-12 | 2019-10-16 | Bayer Aktiengesellschaft | C-type natriuretic peptide engrafted antibodies |
Family Cites Families (115)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3862925A (en) | 1973-07-05 | 1975-01-28 | American Home Prod | Preparation of somatotropin release inhibiting factor and intermediates therefor |
| US3842067A (en) | 1973-07-27 | 1974-10-15 | American Home Prod | Synthesis of(des-asn5)-srif and intermediates |
| JPS5726506B2 (ko) | 1974-03-08 | 1982-06-04 | ||
| US4034074A (en) | 1974-09-19 | 1977-07-05 | The Board Of Trustees Of Leland Stanford Junior University | Universal reagent 2-site immunoradiometric assay using labelled anti (IgG) |
| US4105602A (en) | 1975-02-10 | 1978-08-08 | Armour Pharmaceutical Company | Synthesis of peptides with parathyroid hormone activity |
| US4161521A (en) | 1975-08-08 | 1979-07-17 | Merck & Co., Inc. | Somatostatin analogs |
| US4051842A (en) | 1975-09-15 | 1977-10-04 | International Medical Corporation | Electrode and interfacing pad for electrical physiological systems |
| DE2626348C3 (de) | 1976-06-11 | 1980-01-31 | Siemens Ag, 1000 Berlin Und 8000 Muenchen | Implantierbare Dosiereinrichtung |
| US4098876A (en) | 1976-10-26 | 1978-07-04 | Corning Glass Works | Reverse sandwich immunoassay |
| US4233402A (en) | 1978-04-05 | 1980-11-11 | Syva Company | Reagents and method employing channeling |
| NO812612L (no) | 1980-08-06 | 1982-02-08 | Ferring Pharma Ltd | Enzym-inhibitorer. |
| US4383529A (en) | 1980-11-03 | 1983-05-17 | Wescor, Inc. | Iontophoretic electrode device, method and gel insert |
| EP0135587B2 (en) | 1983-02-22 | 2002-12-18 | Syngene, Inc. | Defined sequence single strand oligonucleotides incorporating reporter groups, process for the chemical synthesis thereof, and nucleosides useful in such synthesis |
| US4506671A (en) | 1983-03-30 | 1985-03-26 | United States Surgical Corporation | Apparatus for applying two-part surgical fasteners |
| US4496544A (en) | 1983-11-10 | 1985-01-29 | Washington University | Atrial Peptides |
| US5212286A (en) | 1984-04-19 | 1993-05-18 | Scios Nova Inc. | Atrial natriuretic/vasodilator peptide compounds |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| JP2551756B2 (ja) | 1985-05-07 | 1996-11-06 | 武田薬品工業株式会社 | ポリオキシカルボン酸エステルおよびその製造法 |
| US4757048A (en) | 1985-11-05 | 1988-07-12 | Biotechnology Research Associates J.V. | Synthetic analogs of atrial natriuretic peptides |
| US4996143A (en) | 1985-12-23 | 1991-02-26 | Syngene, Inc. | Fluorescent stokes shift probes for polynucleotide hybridization |
| US5560922A (en) | 1986-05-30 | 1996-10-01 | Rutgers, The State University Of New Jersey | Transdermal absorption dosage unit using a polyacrylate adhesive polymer and process |
| US4749688A (en) | 1986-06-20 | 1988-06-07 | Schering Corporation | Use of neutral metalloendopeptidase inhibitors in the treatment of hypertension |
| US6312679B1 (en) | 1986-08-18 | 2001-11-06 | The Dow Chemical Company | Dense star polymer conjugates as dyes |
| US4804650A (en) | 1986-10-28 | 1989-02-14 | Biotechnology Research Associates, J.V. | Analogs of atrial natriuretic peptides |
| US5449751A (en) | 1987-03-02 | 1995-09-12 | Pharma Bissendorf Peptide Gmbh | Cardiodilatin fragment, process for preparing same and use thereof |
| US5691310A (en) | 1987-09-29 | 1997-11-25 | Vesely; David L. | Methods of treatment using proANF peptides |
| US4935492A (en) | 1987-12-24 | 1990-06-19 | California Biotechnology Inc. | Cyclic analogs of atrial natriuretic peptides |
| US5047397A (en) | 1988-08-26 | 1991-09-10 | California Biotechnology Inc. | Linear analogs of atrial natriuretic peptides |
| US5114923A (en) | 1988-05-31 | 1992-05-19 | California Biotechnology Inc. | Recombinant techniques for production of novel natriuretic and vasodilator peptides |
| CA1339210C (en) | 1988-05-31 | 1997-08-05 | John Lewicki | Recombinant techniques for production of novel natriuretic and vasodilator peptides |
| EP0429537A4 (en) | 1988-08-18 | 1991-08-21 | California Biotechnology, Inc. | Atrial natriuretic peptide clearance inhibitors |
| US4938763B1 (en) | 1988-10-03 | 1995-07-04 | Atrix Lab Inc | Biodegradable in-situ forming implants and method of producing the same |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| DE4004430A1 (de) | 1990-02-09 | 1991-08-14 | Schering Ag | Aus polyaldehyden aufgebaute kontrastmittel |
| KR930009516B1 (ko) | 1990-04-27 | 1993-10-06 | 미쓰비시덴키 가부시키가이샤 | 진동검출기 및 그의 고유진동주파수 조정방법 |
| US5202239A (en) | 1990-08-07 | 1993-04-13 | Scios Nova Inc. | Expression of recombinant polypeptides with improved purification |
| US5529914A (en) | 1990-10-15 | 1996-06-25 | The Board Of Regents The Univeristy Of Texas System | Gels for encapsulation of biological materials |
| US5410016A (en) | 1990-10-15 | 1995-04-25 | Board Of Regents, The University Of Texas System | Photopolymerizable biodegradable hydrogels as tissue contacting materials and controlled-release carriers |
| JP2809533B2 (ja) | 1991-01-31 | 1998-10-08 | 壽之 松尾 | Cnp類似体ペプチド |
| US5296347A (en) | 1991-02-08 | 1994-03-22 | Ciba Corning Diagnostics Corp. | Bridge immunoassay |
| US6613332B1 (en) | 1991-06-21 | 2003-09-02 | The University Of Cincinnati | Oral administration of therapeutic proteins |
| CA2113990A1 (en) | 1991-07-26 | 1993-02-18 | Frederick L. Moolten | Cancer therapy utilizing malignant cells |
| EP0533084A1 (en) | 1991-09-16 | 1993-03-24 | Schering Corporation | Pharmaceutical compositions comprising natriuretic peptides or neutral endopeptidase inhibitors for treating and preventing myointimal proliferation |
| CA2123133C (en) | 1991-11-07 | 2005-01-04 | Michael J. Heller | Hybridization of polynucleotides conjugated with chromophores and fluorophores to generate donor-to-donor energy transfer system |
| FR2686899B1 (fr) | 1992-01-31 | 1995-09-01 | Rhone Poulenc Rorer Sa | Nouveaux polypeptides biologiquement actifs, leur preparation et compositions pharmaceutiques les contenant. |
| AU6360394A (en) | 1993-03-03 | 1994-09-26 | Mayo Foundation For Medical Education And Research | Vasonatrin peptide and analogs thereof |
| US5665704A (en) | 1993-11-12 | 1997-09-09 | Genentech, Inc. | Receptor specific atrial natriuretic peptides |
| US5846932A (en) | 1993-11-12 | 1998-12-08 | Genentech, Inc. | Receptor specific atrial natriuretic peptides |
| EP0750630A4 (en) | 1994-03-11 | 1998-01-07 | Ariad Pharma Inc | METHOD AND MATERIALS FOR IDENTIFYING INHIBITORS OF MOLECULAR INTERACTIONS, WHICH ARE BROUGHT BY THE SH3 DOMAINS |
| US5698213A (en) | 1995-03-06 | 1997-12-16 | Ethicon, Inc. | Hydrogels of absorbable polyoxaesters |
| DK0914344T3 (da) | 1996-03-04 | 2005-08-29 | Scios Inc | Assay og reagenser til kvantificering af hBNP |
| WO1998020165A2 (en) | 1996-11-06 | 1998-05-14 | Whitehead Institute For Biomedical Research | Biallelic markers |
| US5848956A (en) | 1997-03-18 | 1998-12-15 | Grettner; Norman L. | Multi-purpose lat sling |
| AU6820898A (en) | 1997-04-04 | 1998-10-30 | Novo Nordisk A/S | Natriuretic peptide derivatives |
| US6013630A (en) | 1997-08-21 | 2000-01-11 | Curagen Corporation | Atrial natriuretic factor mutants and ischemic stroke |
| EP1016867B1 (en) | 1997-09-11 | 2006-01-04 | Shionogi & Co., Ltd. | Immunoassay method for bnp |
| WO1999012576A2 (en) | 1997-09-11 | 1999-03-18 | Musc Foundation For Research Development | Methods and compositions for treating cardiac and renal disorders with atrial natriuretic peptide and tissue kallikrein gene therapy |
| US6165458A (en) | 1997-12-26 | 2000-12-26 | Pharmaderm Laboratories Ltd. | Composition and method for dermal and transdermal administration of a cytokine |
| US6551795B1 (en) | 1998-02-18 | 2003-04-22 | Genome Therapeutics Corporation | Nucleic acid and amino acid sequences relating to pseudomonas aeruginosa for diagnostics and therapeutics |
| US6410044B1 (en) | 1998-03-19 | 2002-06-25 | Surmodics, Inc. | Crosslinkable macromers |
| US6723564B2 (en) | 1998-05-07 | 2004-04-20 | Sequenom, Inc. | IR MALDI mass spectrometry of nucleic acids using liquid matrices |
| US6887481B1 (en) | 1998-12-16 | 2005-05-03 | Agency For Science, Technology And Research | Bacterial-derived molecules and therapeutic and diagnostic uses therefor |
| US6849714B1 (en) | 1999-05-17 | 2005-02-01 | Conjuchem, Inc. | Protection of endogenous therapeutic peptides from peptidase activity through conjugation to blood components |
| US6887470B1 (en) | 1999-09-10 | 2005-05-03 | Conjuchem, Inc. | Protection of endogenous therapeutic peptides from peptidase activity through conjugation to blood components |
| WO2000071576A2 (en) | 1999-05-24 | 2000-11-30 | Mayo Foundation For Medical Education And Research | Adenovirus vectors encoding brain natriuretic peptide |
| US6407211B1 (en) | 1999-12-17 | 2002-06-18 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic peptides |
| JP4237375B2 (ja) | 2000-03-31 | 2009-03-11 | アスビオファーマ株式会社 | 虚血性疾患の処置又は予防に用いる医薬組成物 |
| US20110131679A2 (en) | 2000-04-19 | 2011-06-02 | Thomas La Rosa | Rice Nucleic Acid Molecules and Other Molecules Associated with Plants and Uses Thereof for Plant Improvement |
| US6969480B2 (en) | 2000-05-12 | 2005-11-29 | Matregen Corp. | Method of producing structures using centrifugal forces |
| US6833447B1 (en) | 2000-07-10 | 2004-12-21 | Monsanto Technology, Llc | Myxococcus xanthus genome sequences and uses thereof |
| US6812339B1 (en) | 2000-09-08 | 2004-11-02 | Applera Corporation | Polymorphisms in known genes associated with human disease, methods of detection and uses thereof |
| AU2002224331A1 (en) | 2000-09-22 | 2002-04-02 | Incyte Genomics, Inc. | Transcription factors and zinc finger proteins |
| US7214786B2 (en) | 2000-12-14 | 2007-05-08 | Kovalic David K | Nucleic acid molecules and other molecules associated with plants and uses thereof for plant improvement |
| IL142118A0 (en) | 2001-03-20 | 2002-03-10 | Prochon Biotech Ltd | Method and composition for treatment of skeletal dysplasias |
| EP1569683B1 (en) | 2002-11-26 | 2010-03-03 | Biocon Limited | Modified natriuretic compounds, conjugates, and uses thereof |
| US7648962B2 (en) | 2002-11-26 | 2010-01-19 | Biocon Limited | Natriuretic compounds, conjugates, and uses thereof |
| DK1638443T3 (da) | 2003-06-20 | 2011-02-07 | Mayo Foundation | Isoformer af hjerne-natriuretisk peptid |
| WO2005070446A1 (en) | 2004-01-15 | 2005-08-04 | Scios Inc. | Method for treating cardiac remodeling following myocardial injury |
| WO2005072055A2 (en) | 2004-01-27 | 2005-08-11 | Compugen Usa, Inc. | Novel brain natriuretic peptide variants and methods of use thereof |
| US7332569B2 (en) | 2004-01-27 | 2008-02-19 | Compugen Ltd. | Brain natriuretic peptide spliced variant |
| US7345142B2 (en) | 2004-01-27 | 2008-03-18 | Compugen Ltd. | Nucleotide and amino acid sequences, and assays and methods of use thereof for diagnosis of cardiac disease |
| US8076288B2 (en) | 2004-02-11 | 2011-12-13 | Amylin Pharmaceuticals, Inc. | Hybrid polypeptides having glucose lowering activity |
| US7968085B2 (en) | 2004-07-05 | 2011-06-28 | Ascendis Pharma A/S | Hydrogel formulations |
| AU2005271242B9 (en) | 2004-08-12 | 2012-04-12 | Foresee Pharmaceuticals Co., Ltd. | Pharmaceutical compositions for controlled release delivery of biologically active compounds |
| US7731965B2 (en) | 2005-02-17 | 2010-06-08 | Abbott Lab | Human ring specific BNP antibodies |
| ES2554713T3 (es) | 2005-04-07 | 2015-12-22 | Cardiorentis Ag | Uso de un péptido natriurético para tratar insuficiencia cardiaca |
| US20070042957A1 (en) | 2005-08-19 | 2007-02-22 | Mayo Foundation For Medical Education And Research | Type v phosphodiesterase inhibitors and natriuretic polypeptides |
| WO2007030706A1 (en) | 2005-09-08 | 2007-03-15 | New England Medical Center Hospitals, Inc. | Fragments of the glucagon-like peptide-i and uses thereof |
| WO2007035600A2 (en) | 2005-09-16 | 2007-03-29 | Mayo Foundation For Education And Research | Natriuretic activities |
| US20090035287A1 (en) | 2005-09-26 | 2009-02-05 | Zurit Levine | Atrial natriuretic peptide (anp) splice variants and methods of using same |
| US7795221B2 (en) | 2006-03-30 | 2010-09-14 | Palatin Technologies, Inc. | Linear natriuretic peptide constructs |
| EP2574624A1 (en) | 2006-04-20 | 2013-04-03 | Amgen Inc. | GLP-1 compounds |
| MX2009001459A (es) | 2006-08-08 | 2009-02-19 | Mayo Foundation | Polipeptidos diureticos y natriureticos. |
| CN101600731A (zh) | 2006-09-08 | 2009-12-09 | 梅约医学教育与研究基金会 | 不具备血管舒张活性的促排水和利尿钠多肽 |
| WO2008061355A1 (en) | 2006-11-24 | 2008-05-29 | Matregen Corp. | Glp-1 depot systems, and methods of manufacture and uses thereof |
| WO2008089532A1 (en) | 2007-01-26 | 2008-07-31 | Universidade Federal De Minas Gerais - Ufmg | Pharmaceutical compositions and methods for treating erectile dysfunction |
| WO2008128038A2 (en) | 2007-04-13 | 2008-10-23 | The Scripps Research Institute | Methods and compositions for treating cardiac dysfunctions |
| PT2765139T (pt) | 2007-07-20 | 2017-07-14 | Mayo Foundation | Polipéptidos natriuréticos |
| WO2009036448A2 (en) | 2007-09-15 | 2009-03-19 | Mayo Foundation For Medical Education And Research | Natriuretic peptide receptor-c agonists |
| WO2009086126A2 (en) | 2007-12-21 | 2009-07-09 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides |
| EP2080812A1 (en) | 2008-01-18 | 2009-07-22 | Transmedi SA | Compositions and methods of detecting post-stop peptides |
| CA2727085A1 (en) | 2008-06-06 | 2009-12-10 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic polypeptides and methods for inhibiting cardiac remodeling |
| US8741842B2 (en) * | 2008-07-02 | 2014-06-03 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic polypeptides with unique pharmacologic profiles |
| US8642550B2 (en) | 2008-10-24 | 2014-02-04 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic peptides without hypotensive inducing capability |
| US20100266704A1 (en) | 2008-12-15 | 2010-10-21 | Novartis Ag | Octreotide depot formulation with constantly high exposure levels |
| WO2010078325A2 (en) | 2008-12-29 | 2010-07-08 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides for reducing or preventing restenosis |
| US20120053123A1 (en) | 2009-05-05 | 2012-03-01 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides having mutations within their disulfide rings |
| WO2011005939A2 (en) | 2009-07-09 | 2011-01-13 | Mayo Foundation For Medical Education And Research | Long acting atrial natriuretic peptide (la-anp) and methods for use thereof |
| EP2632477A2 (en) | 2010-10-29 | 2013-09-04 | Nile Therapeutics, Inc. | Methods of treatment with natriuretic peptides |
| EP2678002A2 (en) | 2011-02-25 | 2014-01-01 | Medtronic, Inc. | Therapy for kidney disease and/or heart failure |
| CN103906761B (zh) | 2011-08-30 | 2016-12-21 | 梅约医学教育与研究基金会 | 利钠多肽 |
| US20140066367A1 (en) | 2012-08-31 | 2014-03-06 | Mayo Foundation For Medical Education And Research | Subcutaneous delivery of a long-acting natriuretic peptide |
| US8835601B2 (en) | 2012-12-21 | 2014-09-16 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptide delivery systems |
| WO2014127120A1 (en) | 2013-02-15 | 2014-08-21 | Mayo Foundation For Medical Education And Research | Insulin secreting polypeptides |
| US20140274901A1 (en) | 2013-03-12 | 2014-09-18 | Mayo Foundation For Medical Education And Research | Proanp compositions and methods for treating acute heart failure |
-
2012
- 2012-08-21 CN CN201280052262.1A patent/CN103906761B/zh not_active Expired - Fee Related
- 2012-08-21 JP JP2014528449A patent/JP2014525439A/ja active Pending
- 2012-08-21 KR KR1020147007530A patent/KR20140059249A/ko not_active Application Discontinuation
- 2012-08-21 US US14/003,481 patent/US9102707B2/en active Active
- 2012-08-21 CN CN201611035289.6A patent/CN107090028A/zh not_active Withdrawn
- 2012-08-21 EP EP12828994.9A patent/EP2751136B1/en not_active Not-in-force
- 2012-08-21 WO PCT/US2012/051734 patent/WO2013032784A1/en active Application Filing
-
2015
- 2015-07-02 US US14/791,047 patent/US9441027B2/en active Active
-
2016
- 2016-08-09 US US15/232,429 patent/US9587004B2/en active Active
-
2017
- 2017-01-20 US US15/411,630 patent/US10344068B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US9441027B2 (en) | 2016-09-13 |
| CN103906761B (zh) | 2016-12-21 |
| EP2751136A1 (en) | 2014-07-09 |
| US20170129934A1 (en) | 2017-05-11 |
| EP2751136B1 (en) | 2017-10-18 |
| CN107090028A (zh) | 2017-08-25 |
| JP2014525439A (ja) | 2014-09-29 |
| US9102707B2 (en) | 2015-08-11 |
| US20140005358A1 (en) | 2014-01-02 |
| US10344068B2 (en) | 2019-07-09 |
| US20160362468A1 (en) | 2016-12-15 |
| WO2013032784A1 (en) | 2013-03-07 |
| CN103906761A (zh) | 2014-07-02 |
| US9587004B2 (en) | 2017-03-07 |
| EP2751136A4 (en) | 2015-07-08 |
| US20150299284A1 (en) | 2015-10-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9079973B2 (en) | Natriuretic polypeptides for reducing restenosis | |
| US10344068B2 (en) | Natriuretic polypeptides | |
| US20120053123A1 (en) | Natriuretic polypeptides having mutations within their disulfide rings | |
| DK2765139T3 (en) | NATURURETIC POLYPEPTIDES | |
| JP2774769B2 (ja) | アドレノメデュリン | |
| AU2009256222A1 (en) | Chimeric natriuretic polypeptides and methods for inhibiting cardiac remodeling | |
| JP5485876B2 (ja) | 代謝疾患の治療における治療剤としての非アシル化グレリン | |
| WO2009086126A2 (en) | Natriuretic polypeptides | |
| US11572399B2 (en) | Long-acting GIP peptide analogues | |
| US11897931B2 (en) | MANP analogues | |
| US20140274901A1 (en) | Proanp compositions and methods for treating acute heart failure | |
| DK2956160T3 (en) | INSULIN SECRETING POLYPEPTIDE | |
| US20170333530A1 (en) | Methods and materials for reducing cysts and kidney weight in mammals with polycystic kidney disease | |
| JP2002233386A (ja) | Rfrp含有プロラクチン分泌調節剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Withdrawal due to no request for examination |