KR20140031227A - 지질 나노입자들 및 코르티코스테로이드 또는 비타민 d 유도체를 포함하는 조성물 - Google Patents
지질 나노입자들 및 코르티코스테로이드 또는 비타민 d 유도체를 포함하는 조성물 Download PDFInfo
- Publication number
- KR20140031227A KR20140031227A KR1020137027812A KR20137027812A KR20140031227A KR 20140031227 A KR20140031227 A KR 20140031227A KR 1020137027812 A KR1020137027812 A KR 1020137027812A KR 20137027812 A KR20137027812 A KR 20137027812A KR 20140031227 A KR20140031227 A KR 20140031227A
- Authority
- KR
- South Korea
- Prior art keywords
- lipid
- pharmaceutical composition
- skin
- oil
- weight
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/59—Compounds containing 9, 10- seco- cyclopenta[a]hydrophenanthrene ring systems
- A61K31/593—9,10-Secocholestane derivatives, e.g. cholecalciferol, i.e. vitamin D3
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/5123—Organic compounds, e.g. fats, sugars
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/08—Antiseborrheics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Dermatology (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Nanotechnology (AREA)
- Biomedical Technology (AREA)
- Obesity (AREA)
- Nutrition Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 지질 나노입자들 내에 고체 용액 또는 분산액으로서 혼입된 코르티코스테로이드 및/또는 비타민 D 유도체를, 치료학적 활성 성분으로서, 포함하는 약제학적 조성물에 관한 것으로, 상기 지질 나노입자들은 주위 온도에서 고체이고, 상기 지질 나노입자들은 체온 이상의 융점을 갖는 제1 지질, 임의로 주위 온도에서 오일이고 제1 지질과 혼화성인 제2 지질 및 약제학적으로 허용되는 계면활성제를 포함하고, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, C12 -24 지방산의 글리세릴 모노에스테르, 디에스테르 또는 트리에스테르, C12-24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이다.
Description
본 발명은, 지질 나노입자들 및 활성 성분(들)으로서 코르티코스테로이드 및/또는 비타민 D 유사체를 포함하는 조성물, 상기 지질 나노입자들의 제조방법 및 피부 질환 및 병태의 치료에서의 상기 조성물의 용도에 관한 것이다.
아토피성 피부염(AD)은 전체 아이들 중의 10 내지 20%에서 발생하는 바와 같이 영아 초기에 높은 유병률을 갖는 만성적 재발성 염증성 피부 질환이다[참조: Katoh, J. Dermatol. 36, 2009, pp. 367-376]. 상기 질환은 손상된 표피 장벽 및 피부 감염의 경향을 갖는 소양증, 홍반, 태선화, 구진 및 건조한 피부를 특징으로 한다[참조: Reitamo et al., Textbook of Atopic Dermatitis, 1st Ed., Informa Healthcare, London, 2008]. AD의 발병기전은 면역학적 이상에 크게 기인하였다. 그러나, 몇몇 최근 연구들로부터의 결과들은 피부에서 면역 세포들에의 항원 접근 뿐만 아니라 염증 과정의 동인으로서 AD에서 결함이 있는 피부 장벽의 중요성을 입증한다. AD와 유전적인 필라그린 결함 사이의 매우 뚜렷한 관련성은 피부 장벽 붕괴가 AD 발병기전에서 중요함을 보여주었다[참조: Palmer et al., Nat. Genet. 38, 2006, pp. 441-446; Weidinger et al., J. Allergy Clin. Immunol. 118, 2006, pp. 214-219].
최근에, AD에서 1차 치료는 건조한 피부를 완화시키고 장벽을 회복시키는 것을 도울 수 있는, 보습제들과 조합하여 광범위한 항염증성 및 면역억제 효과를 나타내는 국소적 코르티코스테로이드이다[참조: Reitamo et al., supra]. 높은 오일 함량을 갖는 연고 또는 크림은 종종 이들이 피부를 수화된 채로 유지시키는데 보다 효과적이고, 도포된 약물 물질의 침투를 개선시킬 수 있기 때문에, 피부과 전문의에 의해 자주 선호된다[참조: Wiedersberg et al., Eur. J. Pharm. Biopharm. 68, 2008, pp. 453-466; Reitamo et al., supra]. 그러나, 이들 제형 유형의 미용 허용성은 불량할 수 있고, 이는 AD 환자들 중에서 낮은 순응도를 반영한다[참조: Yentzer et al., J. Drugs Dermatol. 9, 2010, pp. 324-329]. 게다가, 연고 및 크림과 같은 통상적인 비히클로부터의 방출 및 약물 물질의 후속적인 피부 침투(skin penetration)는 매우 제한될 수 있으며, 비특이적 전달을 포함할 수 있고, 예를 들면, 약물 수치들이 너무 낮아서 몇몇 환자들에 있어서 치료학적 효과를 유도하지 않으면서, 다른 환자들에서는 유해 효과를 유도하거나 전신적으로 침투할 수 있다[참조: Korting and Schaefer-Korting, Handbook Exp. Pharmacol., 2010, 435-468]. 장벽 상태가 피부 내로 관통하고 피부를 통과하여 침투하는 약물 물질의 양에 결정적이기 때문에, AD에서 피부 장벽이 손상되었다는 사실은 피부에 약물의 표적화된 전달을 더 복잡하게 만든다[참조: Bronaugh and Stewart, J. Pharm. Sci. 74, 1985, pp. 1062-1066; Moon and Maibach, Exogenous Dermatoses. Environmental Dermatitis(Menne and Maibach, Eds.), CRC, Boca Raton, 1991, pp. 217-226; Simonsen and Fullerton, Skin Pharmacol. Physiol. 20, 2007, pp. 230-236; Wilhelm et al., J. Invest. Dermatol. 97, 1991, pp. 927-932].
피부 약물 전달을 최적화하는 방법은 나노입자 담체들의 사용이다. 특히 지질로 이루어진 미립자 담체들(지질 나노입자, 리포좀, 마이크로- 및 나노에멀젼)은 이들이 폐색성, 피부 침투 개선 및 표적화 성질을 가질 수 있기 때문에 유망하다[참조: Korting and Schaefer-Korting, supra]. 고체 지질 나노입자들(SLN)은 40 내지 1000nm이고, 원칙적으로 o/w 에멀젼과 비슷하지만, 액체 오일은 체온 이상의 융점을 갖는 지질에 의해 대체된다[참조: Muller et al., Adv. Drug Del. Review 54, Suppl. 1, 2002, S131-S155]. 이들 고체 상태 및 작은 크기의 결과로서, SLN은 피부에 도포시 폐색을 유도할 수 있는 강한 접착성을 갖고, 이들은 연고보다 미용적으로 더 허용된다[참조: Jenning et al., Int. J. Pharm. 199, 2000, pp. 167-177; Santos et al., J. Drug Target., 2002, pp. 489-495; Wissing and Muller, Eur. J. Pharm. Biophar. 56, 2003, pp. 67-72]. 폐색성은 경피 수분 손실(TEWL)을 감소시키고, AD와 같은 피부 질환에서 피부 장벽을 물리적으로 회복시키는 것을 도울 수 있다[참조: Keck and Schwabe, J. Biomed. Nanotechnol. 5, 2009, pp. 428-436].
건선은 과다각화증으로 인한 홍반성, 건조, 스케일링 플라크로서 나타나는 만성 염증성 피부 질환이다. 보다 대규모의 병변들이 신체의 다른 부분들, 특히 요천 부위에서 나타날 수 있지만, 상기 플라크는 팔꿈치, 무릎 및 두피에서 가장 자주 발견된다. 경도 내지 중증도 건선의 가장 일반적인 치료는 활성 성분으로서 코르티코스테로이드를 함유하는 조성물의 국소적 도포를 포함한다. 코르티코스테로이드의 도포는, 효과적인 반면, 피부 위축증, 선(striae), 여드름모양 발진, 입주위 피부염, 피부 진균류 및 박테리아의 과성장, 착색 피부의 색소침착저하증 및 장미증과 같은 다수의 유해 효과들을 갖는다는 단점을 갖는다.
그러나, 다년간, 건선의 유리한 비스테로이드성 치료는 칼시포트리올이 용액 중에 존재하는 연고 조성물(LEO 파르마(LEO Pharma)에 의해 다이보넥스(Daivonex®) 또는 도보넥스(Dovonex®) 연고로 시판중임) 또는 크림 조성물(LEO 파르마에 의해 다이보넥스 또는 도보넥스 크림으로 시판중임)로 제형화된 비타민 D 유사체 화합물, 칼시포트리올에 의한 국소적 치료로 이루어졌다. 상기 연고 조성물에서 용매는 개선된 효능을 야기하는, 피부 내로 활성 성분의 개선된 침투의 장점을 갖지만, 또한 피부 자극물로서 작용하는 것으로 알려진 프로필렌 글리콜이다. 따라서, 국소 조성물 중에 프로필렌 글리콜의 포함은 자주 환자들에게 접촉성 피부염을 발달시키는 원인이 되고(한 연구에서 12.5%의 프로필렌 글리콜에 대한 다수의 자극 반응들이 보고되었다[참조: M. Hannuksela et al., Contact Dermatitis 1, 1975, pp. 112-116]) 프로필렌 글리콜이 고농도로 사용되는 경우, 다수의 자극 반응들이 증가하는 것으로 보고되었다[참조: J. Catanzaro and J. Graham Smith, J. Am. Acad. Dermatol. 24, 1991, pp. 90-95]. 특히 프로필렌 글리콜의 존재로부터 야기된, 피부로의 칼시포트리올의 개선된 침투 때문에, 다이보넥스 연고는 다이보넥스 크림보다 건선성 병변의 치료에 보다 더 효과적인 것으로 확인되었지만, 또한 상당수의 건선 환자들에서 피부 자극을 유발하였다.
사람 피부, 특히 바깥층, 각질층은 미생물 병원체들 및 독성 화학물질들의 침투에 대한 효과적인 장벽을 제공한다. 피부의 이러한 성질이 일반적으로 유리한 반면, 피부 질환을 겪는 환자의 피부에 도포된 활성 성분의 다량이, 그렇지 않다면 대부분이, 이의 활성이 발휘되는 피부의 실행가능한 층들로 침투할 수 없다는 점에서 의약(pharmaceutical)의 피부 투여를 복잡하게 만든다. 진피 및 표피로의 활성 성분의 충분한 침투를 보장하기 위하여, 통상적으로 알코올, 예를 들면, 에탄올, 또는 디올, 예를 들면, 프로필렌 글리콜의 형태의 용매의 존재하에, 용해된 상태로 상기 활성 성분을 포함하는 것이 일반적으로 바람직하다. 상기 지시된 바와 같이, 프로필렌 글리콜은 잘 알려진 침투 개선제이고, 즉 각질층으로 침투할 수 있고, 표피 내로 비히클 중의 치료학적으로 활성 성분들과 같은 저분자 성분들을 "끌어당기는" 물질이다. 프로필렌 글리콜은 그 자체로 상당한 피부 자극을 유발할 수 있고, 또한 표피 내로 저분자 및 잠재적으로 자극적인 성분들의 비히클을 "끌어당길" 수 있으며, 이는 프로필렌 글리콜을 포함하는 통상적인 비히클들의 전체적인 자극 효과를 야기한다. 이러한 이유로, 염증성 피부 질환의 치료를 의도하는 조성물 중의 용매로서 프로필렌 글리콜의 존재는 염증성 반응을 악화시킬 수 있다.
본 발명의 목적은, 프로필렌 글리콜과 같은 통상적인 침투 개선제들 또는 잠재적으로 자극성인 기타 부형제들의 부재하에, 통상적인 연고들과 비교하여, 활성 성분들로서 국소 조성물 중에 포함된 코르티코스테로이드 또는 비타민 D 유사체의 피부로의 개선된 침투 및 개선된 생물학적 활성을 갖는 조성물을 제공하는 것이다. 또 다른 목적은 폐색성을 갖지만 개선된 미용적 성질도 갖는, 즉 연고보다는 덜 기름지고 보다 유쾌한 "피부 감촉"을 갖는 조성물을 제공하는 것이다.
여드름은 모발피지샘 모낭의 관 내에 과량의 피지의 존재가 면포(모낭관(follicular duct) 내에 고화된 피지 플러그)의 형성을 야기하는, 증가된 피지 생성 및 피지선으로부터 피지의 방출을 특징으로 하는, 모발피지샘 모낭에 영향을 주는 다인성 질환인 피부 병태이다. 상기 관들의 추가의 폐쇄는, 특히 프로피오니박테리움 아크네스(Propionibacterium acnes)에 의해, 종종 박테리아성 콜로니화의 대상이 되는 농포, 구진 또는 낭종의 형성, 및 국소적 염증을 야기한다. 여드름(acne vulgaris)은 10대들에게서 가장 흔한 피부 장애이지만, 20 내지 40세의 성인의 상당수에서 또한 여드름이 발생한다. 여드름의 치료에 최근 이용가능한 약물은 벤조일 퍼옥사이드, 아젤라산, 국소적 및 전신적 항생제, 예를 들면, 후시딘(Fucidin®), 클린다마이신, 에리트로마이신, 및 테트라사이클린, 레티노이드, 예를 들면, 아다팔렌, 트레티노인, 이소트레티노인, 및 호르몬, 예를 들면, 에스트로겐을 포함한다. 그러나, 최기성, 피부 자극, 광민감화(photosensibilisation) 등을 포함하는 이러한 의약품들의 심각한 결점들이 존재한다. 발병한 개인들에 대한 부정적인 심리사회적 결과, 및 여드름의 국소 치료를 위해 이용가능한 약물들의 상대적으로 제한적인 수 및 이들 약물의 알려진 부작용의 심각성 때문에, 여드름의 적절한 치료를 위한 신규한 약제(medicament)의 제공이 매우 중요하다.
따라서, 본 발명의 추가의 목적은 피부의 모낭에 그 안에 포함된 활성 성분을 표적화 할 수 있는 조성물을 제공하는 것이다. 모낭 표적화는 여드름 및 관련 장애, 예를 들면, 장미증의 치료를 의도하는 조성물의 경우 특히 흥미로운 것이다. 활성 성분을 작용 부위에 직접 표적화하는 것은, 시장에서 최근 치료 선택권보다 우수하게 용인되는 여드름 치료법을 제공하기 위하여, 부작용, 예를 들면, 피부 자극을 감소시키는 추가 장점을 가질 수 있다.
발명의 요약
피부에서 국소적으로 사용이 의도된 약물 물질의 피부 침투는 주요 3 단계들을 포함하는 복합적인 공정이다: 1) 비히클로부터 상기 물질의 방출, 2) 각질층 내로의 침투 및 3) 각질층으로부터 실행가능한 표피 및 진피의 표적 부위로의 분배. 상기 제1 단계는 상기 약물 및 상기 비히클의 물리화학적 성질에 따라 좌우되고, 이는 가공에 의해 최적화될 수 있다. 상기 제2 및 제3 단계들은 보다 복합적이다. 다시, 상기 약물 물질의 물리화학적 성질 및 상기 비히클 내의 약물 포화도는 상기 비히클과 상기 피부 사이의 상기 약물 물질의 분배에 중요하고, 상기 비히클의 최적화에 의해 영향을 받을 수 있다. 그러나 게다가, 상기 피부 내로의 침투에 대한 주요 생물학적 장벽-각질층-의 상태는 피부 질환에 영향을 받는다. 본 발명을 야기하는 연구에서, 지질 나노입자들은 장벽-손상된 피부를 위한 국소적 약물 전달 시스템으로서 이들의 성질들에 대해 평가되었다. 상기 지질 나노입자들은 피부에 친유성 화합물들의 전달에 적합하고 폐색성을 갖는 통상적인 연고 제형과 비교되었다.
최근, 장벽-손상된 피부로의 시험관 내 연구는 SLN이 연고와 비교하여 피부에서 상당히 더 높은 수준의 코르티코스테로이드를 보유할 수 있었음을 보여주었다. 이러한 저장소 효과(reservoir effect)는 시험관 내에서 온전한 피부 및 장벽-손상된 피부 둘다에서 보여졌고, 약물은 각질층에서 구별되어 국소화되었다. 피부 상층에서 약물 물질의 특정한 국소화, 피부 저장소 효과 및 약물을 함유하는 SLN 도포 후 피부에 도포된 약물의 치료학적 효과 사이의 상관관계는 제대로 설명되지 않았다. 본 발명의 목적은 피부를 폐색하거나 장벽-손상된 피부와의 상호작용을 증가시키는 지질 나노입자들의 능력의 결과로서 증가된 약물 효능을 갖는 조성물을 제공하는 것이다.
따라서, 본 발명은 지질 나노입자들 내에 고체 용액 또는 분산액으로서 혼입된 코르티코스테로이드를 치료학적 활성 성분으로서 포함하는 국소 약제학적 조성물에 관한 것으로, 상기 지질 나노입자들은 주위 온도에서 고체이고, 상기 지질 나노입자들은 체온 이상의 융점을 갖는 제1 지질을 약 60 내지 92중량% 포함하고, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, C12 -24 지방산의 글리세릴 모노에스테르, 디에스테르 또는 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 지질 나노입자들은 약제학적으로 허용되는 계면활성제 약 2 내지 25중량%를 추가로 포함한다.
또 다른 측면에서, 본 발명은 지질 나노입자들 내에 고체 용액 또는 분산액으로서 혼입된 비타민 D 유도체를 치료학적 활성 성분으로서 포함하는 국소 약제학적 조성물에 관한 것으로, 상기 지질 나노입자들은 주위 온도에서 고체이고, 상기 지질 나노입자들은 체온 이상의 융점을 갖는 제1 지질을 약 60 내지 92중량% 포함하고, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, 산가가 0.1 이하인 C12 -24 지방산의 글리세릴 모노- 디- 또는 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 지질 나노입자들은 폴록사머 또는 에톡실화된 지방 알코올로 이루어진 그룹으로부터 선택된 약제학적으로 허용되는 계면활성제 약 2 내지 25중량%를 추가로 포함한다.
본 발명은 첨부된 도면에서 추가로 설명된다.
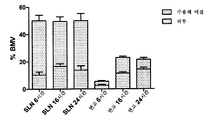
도 1은 24시간 동안 온전한(a) 및 장벽-손상된(b) 피부에 각각 연고 및 3개의 상이한 SLN 중의 BMV를 도포한 후, 상이한 피부 층들 내로 침투된 3H BMV의 상대량을 나타낸다. 결과들은 회수된 3H BMV의 총량에 상대적이다. 평균±SD(n=8).
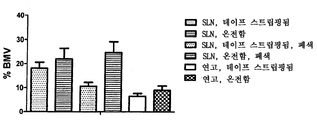
도 2는 6, 16 또는 24시간 동안 온전한(a) 및 장벽-손상된(b) 피부에 각각 연고 및 디스테아레이트 SLN 중의 BMV를 도포한 후, 각각 피부 및 수용체 매질 내로 침투된 3H BMV의 상대량을 나타낸다. 결과들은 회수된 3H BMV의 총량에 상대적이다. 평균±SD(n=6).
도 3은 24시간 동안 각각 디스테아레이트 SLN 및 연고 도포 후, 피부(a) 및 수용체 매질(b) 중의 3H BMV의 상대량을 나타낸다. SLN 노출된 상기 피부는 몇몇 경우 SLN 도포 후 폐색되었다. 결과들은 회수된 3H BMV의 총량에 상대적이다. 평균±SD(n=8).
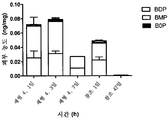
도 4는 연고 중의 BDP와 비교하여 글리세롤디스테아레이트로 구성된 SLN 중의 BDP로 처리된 무모 랫트들의 피부에서 BDP의 피부 농도를 나타낸다. 상기 SLN 조성물은 실시예 1에 나타낸다.
도 5a는 연고 중의 BMV와 SLN 중의 투여된 BMV의 효과를 비교한 연구에서 귀 두께의 AUC를 나타낸다. 평균±SEM(n=10).
5b는 용량 결정-연구(dose finding-study)에서 귀 두께의 AUC를 나타낸다. 평균±SEM(n = 8). 모든 동물들은 AD 표현형을 유도하기 위하여 실시예 3에 기재된 처리 계획에 따라 옥사졸론으로 처리하였다.
도 6a 및 6b는 민감화된 마우스에서 IL-4 및 Il-1β사이토카인 수준들을 나타낸다. 모든 동물들을 AD 표현형을 유도하기 위하여 실시예 3에 기재된 처리 계획에 따라 옥사졸론으로 처리하였다. 평균±SEM(n = 4 내지 10).
도 7a 및 7b는 BMV를 함유하는 연고의 도포와 비교하여, 옥사졸론 처리된 마우스의 귀에 BMV를 함유하는 지질 나노입자들의 도포에 의한 경피 수분 손실(TEWL)의 감소를 나타내는 그래프이다. 도 7a는 연고와 SLN의 비교를 보여준다. 도 7b는 용량-결정 연구로부터의 TEWL 값들을 보여준다.
도 1은 24시간 동안 온전한(a) 및 장벽-손상된(b) 피부에 각각 연고 및 3개의 상이한 SLN 중의 BMV를 도포한 후, 상이한 피부 층들 내로 침투된 3H BMV의 상대량을 나타낸다. 결과들은 회수된 3H BMV의 총량에 상대적이다. 평균±SD(n=8).
도 2는 6, 16 또는 24시간 동안 온전한(a) 및 장벽-손상된(b) 피부에 각각 연고 및 디스테아레이트 SLN 중의 BMV를 도포한 후, 각각 피부 및 수용체 매질 내로 침투된 3H BMV의 상대량을 나타낸다. 결과들은 회수된 3H BMV의 총량에 상대적이다. 평균±SD(n=6).
도 3은 24시간 동안 각각 디스테아레이트 SLN 및 연고 도포 후, 피부(a) 및 수용체 매질(b) 중의 3H BMV의 상대량을 나타낸다. SLN 노출된 상기 피부는 몇몇 경우 SLN 도포 후 폐색되었다. 결과들은 회수된 3H BMV의 총량에 상대적이다. 평균±SD(n=8).
도 4는 연고 중의 BDP와 비교하여 글리세롤디스테아레이트로 구성된 SLN 중의 BDP로 처리된 무모 랫트들의 피부에서 BDP의 피부 농도를 나타낸다. 상기 SLN 조성물은 실시예 1에 나타낸다.
도 5a는 연고 중의 BMV와 SLN 중의 투여된 BMV의 효과를 비교한 연구에서 귀 두께의 AUC를 나타낸다. 평균±SEM(n=10).
5b는 용량 결정-연구(dose finding-study)에서 귀 두께의 AUC를 나타낸다. 평균±SEM(n = 8). 모든 동물들은 AD 표현형을 유도하기 위하여 실시예 3에 기재된 처리 계획에 따라 옥사졸론으로 처리하였다.
도 6a 및 6b는 민감화된 마우스에서 IL-4 및 Il-1β사이토카인 수준들을 나타낸다. 모든 동물들을 AD 표현형을 유도하기 위하여 실시예 3에 기재된 처리 계획에 따라 옥사졸론으로 처리하였다. 평균±SEM(n = 4 내지 10).
도 7a 및 7b는 BMV를 함유하는 연고의 도포와 비교하여, 옥사졸론 처리된 마우스의 귀에 BMV를 함유하는 지질 나노입자들의 도포에 의한 경피 수분 손실(TEWL)의 감소를 나타내는 그래프이다. 도 7a는 연고와 SLN의 비교를 보여준다. 도 7b는 용량-결정 연구로부터의 TEWL 값들을 보여준다.
정의
용어 "지질 나노입자"는 고체 지질 나노입자(SLN) 또는 나노구조 지질 담체(NLC)를 의미하는 것으로 의도된다. SLN은 주위 온도에서 고체인 지질(예를 들면, 장쇄 트리글리세라이드, 지방산 및 왁스) 및 계면활성제로부터 제조된 나노크기의 입자로서, 그 안에 활성 성분이 용해되거나 분산될 수 있다. NLC는 주위 온도에서 고체인 지질 및 주위 온도에서 액체인 지질(오일) 및 계면활성제로부터 제조된 나노크기의 입자로서, 그 안에 활성 성분이 용해되거나 분산될 수 있다. 상기 지질 나노입자의 입자 크기는 약 10 내지 800nm, 예를 들면, 50 내지 600nm 또는 100 내지 500nm의 범위일 수 있다.
용어 "활성 성분"은 비타민 D 유도체 또는 유사체 및 코르티코스테로이드로부터 선택된 치료학적 활성 약물 물질을 나타내는 것으로 의도된다.
용어 "비타민 D 유도체"는 비타민 D3의 생물학적 활성 대사물질, 예를 들면, 칼시트리올, 또는 이러한 대사물질의 전구체, 예를 들면, 알파칼시돌을 나타내는 것으로 의도된다.
용어 "비타민 D 유사체"는 측쇄 변형을 갖는 비타민 D 스캐폴드 및/또는 스캐폴드 그 자체의 변형을 포함하는 합성 화합물을 나타내는 것으로 의도된다. 유사체는 천연적으로 발생하는 비타민 D 화합물의 것들과 필적할 만한 비타민 D 수용체에 대한 생물학적 활성을 나타낸다.
"칼시포트리올"은 화학식
의 비타민 D 유사체이다. 칼시포트리올은 2종의 결정형, 무수물 및 일수화물로 존재하는 것으로 확인되었다. 칼시포트리올 일수화물 및 이의 제조는 제WO 94/15912호에 개시되어 있다.
용어 "코르티코스테로이드"는 콜레스테롤 또는 이의 유도체, 특히 항염증성 효과를 발휘하는 이러한 유도체로부터 부신 피질에서 합성되는 스테로이드 화합물을 나타내는 것으로 의도된다. 코르티코스테로이드의 예는 암시노나이드, 베타메타손, 부데노사이드, 클로베타솔, 클로베타손, 코르티손, 데소나이드, 데속시코르티손, 데속시메타손, 덱사메타손, 디플루코르톨론, 디플로라손, 플루코르티손, 플루메타손, 플루니솔라이드, 플루오시노나이드, 플루오시놀론, 플루오로메톨론, 플루프레드니솔론, 플루란드레놀라이드, 플루티카손, 할시노나이드, 할로베타솔, 하이드로코르티손, 메프레드니손, 메틸프레드니손, 모메타손, 파라메타손, 프레드니카베이트, 프레드니손, 프레드니솔론 및 트리암시놀론 또는 약제학적으로 허용되는 이들의 에스테르 또는 아세토나이드를 포함하지만, 이로써 제한되지는 않는다. 최근 선호되는 코르티코스테로이드의 예는 베타메타손 및 이의 에스테르, 예를 들면, 17-발레레이트 또는 17,21-디프로피오네이트, 또는 클로베타솔 17-프로피오네이트이다.
용어 "저장 안정성" 또는 "저장 안정한"은, 조성물이, 냉장 또는, 바람직하게는, 실온에서 상기 조성물을 상업적으로 실행가능하게 하기에 충분한 시간 기간, 예를 들면, 12개월 이상, 특히 18개월 이상, 바람직하게는 2년 이상 동안 상기 조성물의 저장을 허용하는 화학적 및 물리적 안정성 특징들을 나타냄을 지시하는 것으로 의도된다.
용어 "화학적 안정성" 또는 "화학적으로 안정한"은 실온에서 제품의 저장 수명 동안, 통상적으로 2년 동안, 활성 성분의 10% 이하, 바람직하게는 6% 이하가 분해됨을 의미하는 것으로 의도된다. 실온에서 화학적 안정성의 근사치는 조성물을 40℃에서 가열 찬장에 놓고, 샘플들을 1개월 및 3개월에 채취하고, HPLC로 분해 생성물의 존재를 시험하는 40℃에서의 가속화된 안정성 연구들을 조성물에 수행하여 수득된다. 상기 물질의 약 10% 미만이 40℃에서 3개월 후 분해된 경우, 이는 통상적으로 실온에서 2년의 저장 수명에 상응하는 것으로 간주된다. 조성물에 포함된 활성 성분이 칼시포트리올인 경우, "화학적 안정성"은 통상적으로 칼시포트리올이 시간이 지나면서 완성된 약제학적 제품에서 24-에피 칼시포트리올 또는 칼시포트리올의 기타 분해 생성물들로 뚜렷하게 분해되지 않음을 지시한다.
용어 "물리적 안정성" 또는 "물리적으로 안정한"은 상기 활성 성분이 상기 조성물의 저장 수명 동안 추진제 또는 비히클 상들로부터 침전되지 않음을 의미하는 것으로 의도된다.
용어 "실질적으로 무수"는 상기 연고 조성물 중의 자유수의 함량이 상기 조성물의 약 2중량%, 바람직하게는 약 1중량%를 초과하지 않음을 의미하는 것으로 의도된다.
용어 "중쇄 트리글리세라이드"는 탄소수 6 내지 12의 쇄 길이를 갖는 지방산의 트리글리세라이드 에스테르를 나타내는데 사용된다. 이러한 중쇄 트리글리세라이드의 최근 선호되는 예는, 예를 들면, 상표명 미글리올(Myglyol) 812 하에 사용가능한, 카프릴릭(C8) 및 카프릭(C10) 트리글리세라이드의 혼합물이다.
용어 "반-고체"는 점탄성 거동을 보여주고 특성상 비뉴톤인, 즉 실온에서 낮은 전단 응력에서는 유동하지 않지만 높은 전단 속도에서는 가소성, 의가소성(pseudoplastic) 또는 요변성 유동 거동을 나타내는 조성물 또는 부형제를 나타내는데 사용된다. 반-고체 조성물의 통상적인 예는 연고 및 크림이다.
용어 "폐색하는"은 경피 수분 손실의 감소를 야기하는데 충분한 수화 장벽을 형성하여 피부 수화를 야기하는, 상기 피부 표면상의 지질 층의 제공을 나타내는 것으로 의도된다.
용어 "피부 침투"는 상기 활성 성분의 상기 피부의 상이한 층들, 즉, 각질층, 표피 및 진피로의 확산을 의미하는 것으로 의도된다.
"피부 투과(skin permeation)"는 피부를 통해 체순환 내로 또는, 하기 실시예 2에 기록된 바와 같은 시험관 내 연구의 경우, 실험에서 사용된 프란츠 셀 기구(Franz cell apparatus)의 수용체 유체 내로 활성 성분의 유동을 의미하는 것으로 의도된다.
양태들
본 발명의 조성물에서, 제1 지질은 지질 나노입자들의 약 65 내지 92중량%, 또는 약 70 내지 90중량%, 또는 약 75 내지 85중량%, 또는 약 80중량%를 구성할 수 있고, 계면활성제는 지질 나노입자들의 약 8 내지 22중량%, 예를 들면, 약 10 내지 20중량%를 구성한다. 상기 제1 지질은 바람직하게는 세틸팔미테이트, 밀랍, 스테아릴 팔미테이트, 스테아릴 베헤네이트, 글리세롤 모노스테아레이트, 글리세롤 디스테아레이트, 글리세롤 디베헤네이트, 글리세롤 트리미리스테이트, 글리세롤 트리팔미테이트, 글리세롤 트리스테아레이트, 베헤놀, 스테아르산, 수소화된 팜유, 수소화된 코코-글리세라이드, 수소화된 피마자유 또는 세토스테아릴알코올로 이루어진 그룹으로부터 선택될 수 있다.
본 발명의 조성물에서, 상기 계면활성제는 친수성 계면활성제일 수 있고, 바람직하게는 폴록사머, 예를 들면, 폴록사머 188 또는 폴록사머 407, 폴리소르베이트, 예를 들면, 폴리소르베이트 80, 당 에스테르(예를 들면, 슈크로스 스테아레이트 또는 슈크로스 팔미테이트), 에톡실화된 지방 알코올, 예를 들면, 폴리옥시에틸렌 피마자유 유도체로 이루어진 그룹으로부터 선택될 수 있거나, 친유성 계면활성제, 예를 들면, 인지질, 예를 들면, 대두 포스파티딜콜린 또는 달걀 레시틴일 수 있다.
게다가, 상기 지질 나노입자들은 주위 온도에서 오일이고 제1 지질과 혼화성인 제2 지질, 또는 친유성 유화제(예를 들면, 폴리옥시프로필렌 지방 아실 에테르) 또는 연화제를 상기 지질 나노입자들의 약 1 내지 40%, 예를 들면, 약 10 내지 30중량%, 약 15 내지 15중량%, 또는 약 20중량%로 포함할 수 있다. 상기 제2 지질은 식물성유, 예를 들면, 피마자유, 해바라기유, 홍화유, 달맞이꽃유, 보리지씨유, 참깨유, 옥수수유, 야자핵유, 올리브유, 아보카도유, 아몬드유, 유채씨유, 코코넛유, 면실유, 땅콩유, 대두유, 밀배아유, 포도씨유 또는 호호바유를 포함하는, C6-10 모노글리세라이드, C6-10 디글리세라이드, 이소프로필 미리스테이트 또는 이소프로필 팔미테이트, 중쇄 트리글리세라이드 또는 장쇄 트리글리세라이드로 이루어진 그룹으로부터 선택될 수 있다.
본 발명의 조성물은, 상기 지질 나노입자들이 통상적으로 상기 조성물의 약 1 내지 40중량%, 예를 들면, 약 5 내지 30중량% 또는 약 10 내지 20중량%의 양으로 존재하는, 크림(수중유 에멀젼), 로션, 스프레이 제형 또는 수성 겔일 수 있다. 상기 조성물은 상기 지질들이, 특정한 상황 하에, 네트워크를 형성하여 상기 조성물의 겔화를 야기하거나, 증점제를 함유할 수 있는 수성 상을 추가로 포함한다. 상기 증점제는 카보머, 셀룰로스 유도체, 예를 들면, 하이드록시프로필셀룰로스, 하이드록시프로필메틸셀룰로스, 하이드록시에틸셀룰로스, 히알루론산, 알기네이트, 덱스트란 또는 이들의 유도체로 이루어진 그룹으로부터 선택될 수 있다. 상기 증점제는 통상적으로 상기 조성물의 약 0.1 내지 5중량%, 예를 들면, 약 0.5중량%의 양으로 존재한다. 상기 조성물은 실리콘 오일, 액체 파라핀 및 콜레스테롤 또는 글리세롤, 알란토인, 판테놀, 폴리글리세롤 또는 폴리글리세롤 에스테르로 이루어진 그룹으로부터 선택될 수 있는 연화제를 추가로 포함할 수 있다. 상기 연화제는 상기 조성물의 약 10 내지 50중량%, 약 20 내지 40중량%, 또는 약 30중량%의 양으로 포함될 수 있다.
상기 활성 성분은 상이한 형태들로 상기 조성물 중에 존재할 수 있고, 즉 수성 상에 용해되거나 분산될 수 있거나, 지질/수성 상의 표면 층에 용해되거나 분산될 수 있거나, 상기 지질 나노입자들의 표면상에 또는 코어에 용해되거나 분산될 수 있다. 상기 활성 성분은 아마도 상기 지질 표면과 회합되고, 상기 코어에 효과적으로 혼입되지 않아서, 6시간 후, 0차 방출 프로파일 및 특정한 피부 표적화의 부족을 야기하는 것으로 이전에 확인되었다[참조: L.B. Jensen et al., Int. J. Pharm. 390(1), 2010, pp. 53-60]. 이는 상기 활성 성분 중 일부가 수성 상 중에, 적어도 세틸팔미테이트 및 트리팔미테이트 지질 나노입자들 중에 용해되거나 분산되는 반면, 상기 활성 성분의 주요 부분은 상기 지질 표면에 혼입되거나 이와 회합됨에 따라 본 발명의 발견들과 일치한다. 일반적으로 지질 성분 중의 높은 용해성 및 활성 성분의 보다 효과적인 캡슐화는 극성이 작은 지질에 비해 극성이 큰 지질에 의해 달성될 수 있는 것으로 여겨진다[참조: J. Zhang and E. Smith, J. Pharm. Sci. DOI 10.1002/jps.22329, 2010]. 따라서, 용융된 지질 중의 베타메타손 발레레이트(BMV, 모델 활성 성분)에 의한 용해성 연구들은 다양한 양의 모노글리세라이드를 함유하는 지질들을 사용한 이전 결과들과 상응하는, 지질 극성과 비히클 중의 용해도 사이의 상관관계를 보여주었다[참조: L.B. Jensen et al., supra; V.V. Kumar et al., Int. J. Pharm. 335(1-2), 2007, pp. 167-175]. 지질 극성은 다양한 극성을 갖는 상이한 지질들과 수행된 시험관 내 방출 연구들에서 BMV의 방출을 조절함을 보여주었다[참조: L.B. Jensen et al., supra].
지질 극성의 효과는 또한 지질 나노입자들 내에 제형화된 활성 성분들의 피부 침투와 관련될 수 있고, 이는 피부 지질들과 상기 지질 나노입자들의 변화된 상호작용의 결과일 수 있다. 피부의 것과 가까운 용해도 파라미터를 갖는 성분들은 피부와 우수한 혼화성을 갖고, 지질 용해도 파라미터를 가변시키는 것은 지질 나노입자들로부터 활성 성분의 방출을 조절하고 피부 내로 분배하는 하나의 방식일 수 있다[참조: K.B. Sloan et al., J. Invest. Dermatol. 87(2), 1986, pp. 244-252]. 예로서, BMV의 용해도 파라미터는 12로 추정되고[참조: L.B. Jensen et al., supra] 돼지 피부에 대하여 약 10으로 추정된다[참조: Z. Liron and S. Cohen, J. Pharm. Sci. 73(4), 1984, pp. 538-542]. 상기 사용된 지질들은 8.7 내지 9.5의 용해도 파라미터들을 가졌다. 따라서, 피부의 것과 가장 가까운 9.5의 용해도 파라미터를 갖는, 디스테아레이트로 구성된 지질 나노입자들은 트리팔미테이트 및 세틸팔미테이트 지질 나노입자들보다 피부 지질들과 더 혼화성인 것으로 예상될 것이다. BMV는 이러한 지질에 용해되고, 디스테아레이트 지질 나노입자들은 적용된 다른 지질 나노입자들보다 더 작은 크기였고; 직경은 150.9±0.12nm이었다. 이는 트리팔미테이트 및 세틸팔미테이트 지질 나노입자들과 비교하여 디스테아레이트 지질 나노입자들 중의 BMV의 도포 후 피부 및 특히 각질층 중의 BMV의 더 많은 양을 설명할 수 있다(실시예 2 참조).
크기 차이에 의해 유발되는 침투 프로파일들에서의 어떤 차이들을 최소화하기 위하여, 지질 입자들은 이들의 평균 직경들에서 현저하게 다르지 않아야 한다. 상기 평균 직경은 상기 입자 표면적과 연관성이 있고, 이는 지질 나노입자들의 피부와의 상호작용 및 피부로의 침투 뿐만 아니라 임의의 폐색성에 있어서 중요한 파라미터인 것으로 여겨진다[참조: S. Wissing et al., J. Cosmet. Sci. 52(5), 2001, pp. 313-324; R.H. Muller et al., Adv. Drug Deliv. Rev. 54, Suppl. 1, 2002, S131-S155]. 본 발명의 조성물에서, 상기 지질 나노입자들은 따라서 약 10 내지 800nm, 특히 약 50 내지 600nm, 예를 들면, 100 내지 500nm 범위의 평균 직경을 가질 수 있다. 예시된 BMV 지질 나노입자들(실시예 1 참조)의 평균 직경은 PdI가 0.24 미만인 150 내지 212nm 범위였다. 일반적으로 10nm를 초과하는 입자들은 온전한 피부에 침투하지 않지만 질병에 걸린 피부는 장벽이 손상되었기 때문에 더 큰 크기의 입자들(500 내지 700nm의 직경)에 의해 침투될 수 있는 것으로 여겨진다. 측정된 입자 크기는 입자들이 온전한 피부에 침투할 수 없지만 장벽-손상된 피부에는 입자 침투 경향이 있을 수 있음을 나타낸다. 세틸팔미테이트로 만들어진 지질 나노입자들은 다른 유형의 지질들보다 더 단분산되었고, 이는 세틸팔미테이트가 상이한 결정 구조를 갖는 왁스 유형 지질이기 때문일 수 있다. 지질의 이러한 유형은 우수한 물리적 안정성을 갖는 균질하고 작은 크기의 입자들을 야기하는 것으로 이전에 밝혀졌다[참조: V. Jenning and S. Gohla, Int. J. Pharm. 196(2), 2000, pp. 219-222]. 크기 측정은 SLN이 온전한 피부는 침투할 수 없지만, 장벽 손상된 피부에 있어서 입자 침투가 가능함을 나타내었다. 하기 실시예 2에서 논의된 14C-표지된 지질 입자들 및 3H-표지된 BMV와의 연구들은 BMV/지질의 비율이 상기 피부 층들 아래에서 증가되어 수용체 매질에서 최대에 도달함을 보여주었고, 이러한 이유로 BMV가 지질 나노입자들에 의해 더 깊은 피부 층들에서 표적 세포들에 전달되지 않았고, 이는 오히려 상기 피부의 상층들에서 약물 물질의 약물 저장소로서 역할을 한 것으로 결론이 났다. 지질의 14C-표지으로부터, 또한 지질 입자들은 온전한 피부 및 장벽-손상된 피부 둘다에서 피부 표면 및 각질층에 주로 머무름을 보여주었다. 따라서, 활성 성분은, 피부 내로 추가로 확산되고, 실행가능한 표피 및 진피에서 표적 세포들에 도달하는 입자들로부터 방출되어야 한다.
상기 지질 나노입자들은, 테이프 스트립핑된(stripped) 피부에 의하여 본원에 도시되는 바와 같이 장벽이 강하게 손상된 경우라 하더라도, 상기 피부를 통과하여 침투하지 않음이 유리한 것으로 여겨진다. 상기 지질 입자들이 상기 피부의 표면상에 머무른다는 사실은 또한 지질 나노입자들이 피부 수화를 개선시키고 장벽을 물리적으로 강화시킬 수 있게 할 수 있다. 이는 물리적 피부 장벽 상태가 면역 피부 장벽과 상호작용함에 따라 AD 발병기전과 강하게 관련되는, AD와 같은 피부 질환의 치료에 매우 관련있는 성질이다.
지질 나노입자들은 상기 피부에서 다량의 약물 물질을 달성함에 있어서 연고보다 우수하였다. 이는 도 3에서의 결과들로부터 명확하게 볼 수 있다. 상기 활성 성분의 대부분은 온전한 피부 및 장벽 손상된 피부의 상층에서 발견되었고, 이는 아마도 상기 지질 나노입자들의 큰 표면적 및 접착성과 관련이 있을 것이다. 게다가, 상기 지질 나노입자들 및 활성 성분은 약물 저장소로서 작용할 수 있는 모낭 및 피부 주름으로 침투할 수 있다. 디스테아레이트 지질 나노입자들의 온전한 피부 및 장벽-손상된 피부로의 도포 후, 다량의 상기 활성 성분은 트리팔미테이트 및 세틸팔미테이트와 비교하여 각질층 및 표피에 존재하였고, 이는 지질 극성과 입자 크기의 차이와 관련이 있는 것으로 여겨진다(도 1). 따라서, 상기 피부와 밀접한 상호작용, 상기 피부 지질들과의 융합 및 상기 약물 물질의 조절된 방식으로의 방출은, 이전에 보여준 폐색적인 효과 이외에, 지질 나노입자들의 침투-향상 성질들의 메카니즘일 수 있다[참조: R.H. Muller et al., supra].
세틸팔미테이트 SLN 도포시, 온전한 피부의 표피 및 온전한 피부 및 장벽-손상된 피부에 대한 수용체 매질에서의 BMV의 다량은 상기 상이한 지질 구조, 낮은 극성 및 낮은 BMV 용해도에 기인할 수 있다[참조: J. Zhang and E. Smith, supra; V. Jenning and S. Gohla, supra]. 이는 BMV가 SLN 비히클을 보다 쉽게 떠나고 피부 내로 분배되게 한다.
BMV는 상기 장벽이 온전한 경우, 피부에 매우 효과적으로 보유되지만(도 1a), 장벽이 손상된 경우, 연고와 유사하게 피부를 통과하여 침투하였다(도 1b). 그러나, 상기 활성 성분의 다량이 연고에 비해 장벽-손상된 피부에서 발견되었다. 시험된 지질 나노입자들(실시예 2 참조) 중 가장 바람직한 침투 프로파일은 상기 활성 성분의 가장 높은 용해도를 야기하고, 피부에서 활성 성분의 다량 및 수용체 매질에서 활성 성분의 소량을 보유하는데 우수한 디스테아레이트 지질 나노입자들에 의해 수득되었다. 상기 피부 중의 활성 성분 수준은 온전한 피부 및 장벽-손상된 피부에서 유사하였고, 이는 상기 지질 나노입자들이 상기 온전한 피부 뿐만 아니라 상기 장벽-손상된 피부의 표면에 효과적으로 부착되었음을 나타낸다.
연고와 비교하여, 6, 16 및 24시간 동안 디스테아레이트 SLN 도포 동안, 상기 활성 성분의 더 많은 양이 온전한 피부뿐만 아니라 손상된 피부에서 보유됨이 확인되었다(도 2). 24시간 동안 상기 수용체 매질 중의 최소 증가는 상기 제형의 표면 고갈, 즉 피부 내로 침투할 수 있는 활성 성분의 양에 의해 설명될 수 있다. 상기 활성 성분은 상기 입자들 내로 부분적으로 혼입되고, 입자 표면 층에 부분적으로 혼입되는 것으로 여겨진다. 이러한 구조는 버스트 방출(burst release) 후, 제어 방출에 의해 반영되는 것으로 이전에 보여주었다[참조: E.B. Souto et al., Int. J. Pharm 278(1), 2004, pp. 71-77; V. Jenning et al., J. Control. Release 66(2-3), 2000, pp. 115-126]. 상기 표면 층이 버스트 방출시 고갈되는 경우, 상기 활성 성분은 낮은 방출율로 입자들로부터 상기 피부로 별로 확산되지 않을 수 있다. 상기 보여주는 프로파일에 대한 또 다른 이유는 각각 세틸팔미테이트 및 트리팔미테이트로부터 제조된 SLN에 존재하는, 특히 SLN 내에 혼입된 BMV에 의한 또는 임의의 BMV 결정에 의한 피부 또는 모낭의 포화이다. 모낭 및 한선관을 통한 초기 일시적 션트(shunt) 확산 후, SC를 통한 정상 상태의 확산이 가능할 수 있다[참조: R. J. Scheuplein, Mechanism of percutaneous absorption. II. Transient diffusion and the relative importance of various routes of skin penetration, J Invest Dermatol 48(1)(1967) 79-88]. 이러한 효과는 이들 연구들에서 보여주는 바와 같이 BMV의 일정한 수준에 상응할 수 있다. 따라서, 지질 나노입자들은 피부뿐만 아니라 모낭에서 저장소를 만들어내고, 흡수에 사용할 수 있는 활성 성분의 일정한 양을 유지하는데 사용될 수 있다. 그러나, 입자들과 피부 사이의 교환율은 약물 혼입 때문에 도포 시간에 따라 변할 수 있다. 시간 프로파일 및 수용체 매질 중의 약물 물질의 양은 상기 약물 물질이 상기 입자들의 표면층에서 발견됨을 나타낸다. 따라서, 피부에 도포시, 상기 지질 나노입자들은 2상(biphasic) 방식으로 상기 활성 성분을 전달하는 능력을 갖는다 - 상기 입자들의 표면 및 수성 상으로부터의 버스트 방출에 의해 개시된 후, 상기 지질 입자들과 보다 밀접하게 회합된 약물 물질로부터 각질층 중의 저장소 효과가 이어진다.
장벽-손상된 피부의 폐색시 BMV 침투의 뚜렷한 증가는 상이한 이유들을 가질 수 있다. 먼저, 폐색은 거의 언제나 각질층에서 증가된 물 함량 및 지질 장벽의 방해로 인한 증가된 확산 계수 때문에 피부에 흡수된 약물 물질의 양을 개선시킨다[참조: J.A. Bouwstra et al., J. Recept. Signal Transduct. Res. 21(2-3), 2001, pp. 259-286]. 추가로, 상기 폐색은 상기 지질 나노입자들에 존재하는 계면활성제의 피부 장벽에 대한 침투-개선 효과를 촉진시킬 수 있다. 폐색은 또한 도포 후 물이 증발되지 않도록 함으로써 조성물과 피부 사이의 약물 교환에 영향을 줄 수 있다. 장벽-손상된 피부의 폐색시 수용체 매질로 침투하는 매우 다량의 약물 때문에, 이들 결과들은 또한 상기 활성 성분이 고체 입자 코어에 캡슐화되기보다는 입자 표면과 회합되는 것을 지지한다.
또 다른 연구에서 SLN 내에 혼입된 베타메타손 디프로피오네이트(BDP)는 무모 랫트들의 피부에 도포되고, 상기 피부에 코르티코스테로이드를 보유하는 SLN의 능력이 입증되었다. 연고와 비교시, 뚜렷하게 더 많은 양의 BDP가 각각 1일 및 3일 후 상기 피부에 존재하였고, 제형을 도포한 지 7일 후에 SLN으로 투여시 약물 물질은 여전히 상기 피부에서 검출될 수 있었고, 연고로 투여시 약물 물질을 검출할 수 없었다.
상기 개시된 유형의 지질 나노입자들은
(a) 체온 이상의 융점을 갖는 제1 지질 약 60 내지 92중량%를 포함하는 지질 상(lipid phase) 내에 코르티코스테로이드를 용해시키거나 분산시키는 단계(여기서, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, C12 -24 지방산의 글리세릴 디- 또는 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 제1 지질은 용융된 상태이고, 상기 지질 상은, 주위 온도에서 오일이고 제1 지질과 혼화성인 제2 지질, 또는 친유성 유화제 또는 연화제 약 1 내지 40중량%를 임의로 포함한다);
(b) 상기 단계 (a)에서 수득된 지질 상을 폴록사머, 폴리소르베이트 및 에톡실화된 지방 알코올로 이루어진 그룹으로부터 선택된 약제학적으로 허용되는 계면활성제 0.2 내지 10중량%를 포함하는 수성 상에 분산시켜 에멀젼을 형성하는 단계;
(c) 상기 단계 (b)에서 수득된 에멀젼을 고압 균질기를 사용하여 균질화시켜 코르티코스테로이드를 포함하는 상기 지질 상의 나노입자들을 형성하는 단계, 및
(d) 상기 단계 (c)에서 수득된 균질화된 에멀젼을 냉각시켜 상기 나노입자들을 고화시키는 단계를 포함하는 방법에 의해 제조될 수 있다.
이러한 방법에 의해 제조된 상기 지질 나노입자들의 입자 크기는 약 100 내지 500nm 범위로 측정되었다.
대안적으로, 상기 지질 나노입자들은
(a) 체온 이상의 융점을 갖는 제1 지질 약 60 내지 92중량%를 포함하는 지질 상 내에 코르티코스테로이드를 용해시키거나 분산시키는 단계(여기서, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, C12 -24 지방산의 글리세릴 디- 또는 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 제1 지질은 용융된 상태이고, 상기 지질 상은, 주위 온도에서 오일이고 제1 지질과 혼화성인 제2 지질, 또는 친유성 유화제 또는 연화제 약 1 내지 40중량%를 임의로 포함한다);
(b) 상기 단계 (a)에서 수득된 지질 상을 액체 질소 또는 드라이 아이스에서 고화시키는 단계;
(c) 상기 고화된 지질 상을 약 50 내지 100㎛의 입자 크기로 분쇄하는 단계;
(d) 상기 단계 (c)에서 수득된 분말을 계면활성제 약 0.2 내지 10중량%를 함유하는 차가운 수성 상에 분산시키는 단계, 및
(e) 상기 단계 (d)에서 수득된 분산액을 고압 균질기를 사용하여 실온 이하에서 균질화시켜 상기 지질 나노입자들을 수득하는 단계를 포함하는 방법에 의해 제조될 수 있다.
코르티코스테로이드를 포함하는 지질 나노입자 조성물은 바람직하게는 염증성 피부 질환 또는 병태, 예를 들면, 습진, 아토피성 피부염, 접촉성 피부염, 건선, 피부 노화, 광노화, 여드름, 두드러기 또는 소양증의 치료에 사용될 수 있다.
또 다른 양태에서, 상기 지질 나노입자들은 주위 온도에서 오일이고 제1 지질과 혼화성인 제2 지질, 또는 친유성 유화제 또는 연화제를 추가로 포함한다. 상기 제2 지질의 양은 지질 나노입자들의 약 1 내지 40중량%, 예를 들면, 약 10 내지 35중량%, 또는 약 15 내지 30중량%, 또는 약 20 내지 25중량%이다. 보다 특히, 상기 지질 나노입자들은 상기 제1 지질 약 80 내지 85중량% 및 상기 제2 지질 약 15 내지 20중량%를 포함할 수 있다.
당해 양태에서, 상기 제2 지질은 유리하게는 C6-10 모노글리세라이드, C6-10 디글리세라이드, 중쇄 트리글리세라이드, 예를 들면, 카프릴릭/카프릭 트리글리세라이드, 장쇄 트리글리세라이드, 예를 들면, 피마자유, 이소프로필 미리스테이트 또는 이소프로필 팔미테이트로 이루어진 그룹으로부터 선택될 수 있다.
활성 성분으로서 비타민 D 유도체 또는 유사체를 포함하는 양태에서, 상기 제1 지질은 바람직하게는 세틸팔미테이트, C14 -28 지방 알코올, 수소화된 팜유 및 산가가 0.1 이하인 트리글리세라이드로 이루어진 그룹으로부터 선택될 수 있고, 이는 비타민 D 유도체들의 잘 알려진 산 민감성으로 인하여 비타민 D 유도체들의 화학적 안정성에 해로운 유리 지방산의 낮은 함량을 나타낸다. 이러한 양태에서, 제1 및 제2 지질을 포함하는 지질 나노입자들은, 조성물의 수성 상에서 해로운 성분들에 의한 저하에 덜 노출되는 지질 나노입자들에 상기 약물 화합물이 혼입되도록 하기 때문에, 비타민 D 유도체들의 제형에 특히 바람직한 것으로 확인되었다. 제1 및 제2 지질을 사용하는 것은 지질 나노입자들에서 약물 부하를 증가시키고, 활성 성분이 수성 상에 존재하는 것을 방지할 수 있다. 추가로, 지질 나노입자들이 약물 방출 및 수성 상으로의 분배를 야기하는 저장 동안 다형성 역전의 경향이 있는 구조를 갖는 경우, 안정성은 추가로 증가할 수 있다. 제2 지질은 바람직하게는 이소프로필 미리스테이트, 이소프로필 팔미테이트, 중쇄 트리글리세라이드, 예를 들면, 카프릴/카프릭 트리글리세라이드 또는 장쇄 트리글리세라이드, 예를 들면, 피마자유로부터 선택될 수 있다. 최근 선호되는 양태에서, 상기 제1 지질은 세틸팔미테이트이고, 상기 제2 지질은 카프릴릭/카프릭 트리글리세라이드이다. 비타민 D 유도체는 칼시포트리올, 칼시트리올, 막사칼시톨 및 타칼시톨로부터 선택될 수 있고, 이들은 모두 피부 위에 국소적 도포용으로 잘 알려져 있다.
모낭을 표적으로 하는 약물-함유 지질 나노입자들을 포함하는 조성물은 유리하게는 모낭의 모지선들에 존재하는 피지의 것과 가까운 용해도 파라미터를 갖는 지질들을 포함할 수 있다. 따라서, 모낭과 같은 피지-풍부 영역들로 활성 화합물을 전달함에 있어서 지질 나노입자들에 존재하는 제1 및/또는 제2 지질의 효과는 힐데브란트 용해도 계수에 의해 측정된 바와 같이, 부형제의 용해도 성질에 의해 설명될 수 있는 것으로 나타난다[참조: JH Hildebrand and RL Scott, The Solubility of Non-Electrolytes, Reinhold, New York, 1949]. 모델 피지 조성물들에 대한 힐데브란트 계수(용해도 파라미터 δ)는 피지가 약 7.5-8(cal/cm3)½의 힐데브란트 계수를 갖는 전체적으로 비극성, 오일성 물질임을 보여준다[참조: DW Osborne et al., "The Influence of Skin Surface Lipids on Topical Formulations" in Topical Drug Delivery Formulations, Vol. 42, 1990(Drugs and the Pharmaceutical Science)]. 이는 힐데브란트 계수가 피지의 것과 ±2 단위 내인 지질들이 피지와 혼화성이고, 따라서 모피지선 단위에 활성 화합물들을 전달하기 위해 활성 화합물들을 용해하는 목적에 적합한 것으로 확인되었다. 약물 물질의 방출이 용융뿐만 아니라 피지 및 피부 지질들과의 융합에 의해 개시될 수 있기 때문에, 또 다른 영향 인자는 지질 융점이 될 것이다. 용해도 파라미터가 피지의 것과 가까운 지질들은 세틸팔미테이트, 스테아릴 팔미테이트 및 스테아릴 베헤네이트를 포함할 수 있다.
칼시포트리올은 산성 조건들(수성 조성물에서 또는 비수성 조성물에서 산성 반응 물질들의 존재하에 pH 약 7.0 미만)에 극도로 민감한 물질로 알려져 있고, 이는 칼시포트리올의 빠른 분해에 기인한다. 조성물의 저장 수명 전체에 걸쳐 상기 물질의 적절한 화학적 안정성을 보장하기 위하여, 상기 조성물 중의 하나 이상의 부형제들에 존재할 수 있고 칼시포트리올의 화학적 안정성에 해로운 산성 불순물들을 중화시킬 수 있는 화합물을 포함하는 것이 권고될 수 있다. 상기 산 중화 화합물은 바람직하게는, 상기 조성물 중의 약 0.025 내지 0.1중량%의 양으로 포함되어 상기 조성물의 pH가 7.5 이상이 되도록 할 수 있는 완충액, 예를 들면, 인산염 완충액으로부터 선택될 수 있다. 상기 산 중화 화합물은 또한 지질 앵커링(anchoring)을 포함하는 아민, 즉 수성 상과 지질 나노입자 사이의 경계면에 앵커링된 장쇄 지질을 포함하는 아민일 수 있다. 이러한 아민들의 예는 3급 아민들, 예를 들면, 트리에탄올아민, 트로메타몰, 모노에탄올아민 또는 디에탄올아민이고, 이는 약 0.1 내지 2중량%의 양으로 상기 조성물에 포함될 수 있다.
본 조성물의 당해 양태에서, 지질 나노입자들은 상기 조성물의 1 내지 40중량%, 예를 들면, 약 5 내지 30중량% 또는 약 10 내지 20중량%의 양으로 존재할 수 있다. 상기 조성물은 크림(수중유), 로션, 스프레이 제형 또는 수성 겔일 수 있고, 상기 조성물은 추가로 수성 상을 포함한다. 상기 수성 상은 추가로 지질, 예를 들면, 실리콘 오일, 액체 파라핀 또는 콜레스테롤 및/또는 증점제를 포함할 수 있다. 상기 증점제는 카보머, 또는 셀룰로스 유도체, 예를 들면, 하이드록시프로필셀룰로스, 하이드록시프로필메틸셀룰로스, 하이드록시에틸셀룰로스로부터 선택될 수 있다. 상기 증점제는 통상적으로 상기 조성물의 0.1 내지 5중량%, 특히 약 0.5중량%의 양으로 존재한다. 상기 조성물은 실리콘 오일, 액체 파라핀 및 콜레스테롤로 이루어진 그룹으로부터 선택될 수 있는 연화제를 추가로 포함할 수 있다. 상기 연화제는 상기 조성물의 약 10 내지 50중량%, 또는 약 20 내지 40중량%, 또는 약 30중량%의 양으로 포함될 수 있다.
당해 양태에 따른 조성물은
(a) 체온 이상의 융점을 갖는 제1 지질 약 60 내지 92중량% 및 임의로 실온에서 오일이고 상기 제1 지질과 혼화성인 제2 지질 약 1 내지 40중량%를 포함하는 지질 상 내에 비타민 D 유도체를 용해시키거나 분산시키는 단계(여기서, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, 산가가 0.1 이하인 C12 -24 지방산의 글리세릴 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 제1 지질은 용융된 상태이다);
(b) 상기 단계 (a)에서 수득된 지질 상을 폴록사머 또는 에톡실화된 지방 알코올로부터 선택된 약제학적으로 허용되는 계면활성제 약 0.2 내지 10중량%를 포함하는 수성 상에 분산시키는 단계;
(c) 상기 단계 (b)에서 수득된 에멀젼을 고압 균질기를 사용하여 균질화시켜 상기 비타민 D 유도체를 포함하는 상기 지질 상의 나노입자들을 형성하는 단계 및
(d) 상기 단계 (c)에서 수득된 균질화된 에멀젼을 냉각시켜 상기 나노입자들을 고화시키는 단계를 포함하는 방법에 의해 제조될 수 있다.
이러한 방법에 의해 제조된 상기 지질 나노입자들의 입자 크기는 약 100 내지 500nm 범위로 측정되었다.
대안적으로, 상기 조성물은
(a) 체온 이상의 융점을 갖는 제1 지질 약 60 내지 92중량% 및 임의로 실온에서 오일이고 상기 제1 지질과 혼화성인 제2 지질 약 1 내지 40중량%를 포함하는 지질 상 내에 비타민 D 유도체를 용해시키거나 분산시키는 단계(여기서, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, 산가가 0.1 이하인 C12-24 지방산의 글리세릴 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 제1 지질은 용융된 상태이다);
(b) 상기 단계 (a)에서 수득된 지질 상을 액체 질소에서 또는 드라이 아이스 상에서 고화시키는 단계;
(c) 상기 고화된 지질 상을 약 50 내지 100㎛의 입자 크기로 분쇄하는 단계;
(d) 상기 단계 (c)에서 수득된 분말을 계면활성제 약 0.2 내지 10중량%를 함유하는 차가운 수성 상에 분산시키는 단계, 및
(e) 상기 단계 (d)에서 수득된 분산액을 고압 균질기를 사용하여 실온 이하에서 균질화시켜 상기 지질 나노입자들을 수득하는 단계를 포함하는 방법에 의해 제조될 수 있다.
비타민 D 유도체 또는 유사체를 포함하는 지질 나노입자 조성물은 염증성 또는 과증식성 피부 병태, 예를 들면, 건선, 지루성 건선, 수장 족저 농포증, 피부염, 비늘증, 장미증, 여드름 또는 광선 각화증의 예방 또는 치료에 사용될 수 있다.
문헌에서, 세보사이트(sebocyte)는 비타민 D 수용체(VDR)를 발현시키고, VDR의 발현은 생물학적 활성 비타민 D 대사물질 1α,25-디하이드록시비타민 D3(칼시트리올)에 의한 치료에 의해 유도됨이 기재되어 있다[참조: C. Kramer et al, J. Steroid Biochem. Mol. Biol. 113, 2009, pp. 9-16]. 칼시트리올과 함께 배양된 세보사이트의 항온배양은 전염증성 사이토카인 IL-6 및 IL-8의 감소된 분비를 야기하였다. 따라서 모낭을 표적화하는 경우, 비타민 D 유도체들은 피지선들의 장애들, 예를 들면, 여드름에 대한 치료학적 효과를 발휘할 수 있는 것으로 추정될 수 있다. 추가로, 비타민 D 유도체들은 케라티노사이트의 과다증식을 감소시키는 것으로 알려져 있고, 또한 모낭관의 케라티노사이트에 대한 효과를 발휘하는 것으로 예상될 수 있다.
비타민 D 유사체들, 예를 들면, 칼시포트리올은 여드름의 치료에 사용될 수 있음이 이전에 시사되었고(제WO 91/12807호 참조), 선행 참조에 개시된 조성물은 그 후에 이러한 치료에 효과적이지 않은 것으로 보여졌다. 선행 조성물에서 보여진 효능의 부족은 작용 부위에 표적화되지 않은 활성 성분 때문인 것으로 여겨졌고, 이는 여드름 치료에서 개선된 효능이 상기 비타민 D 유사체가 모낭에 표적화되는 경우에 수득될 수 있는 것으로 최근 여겨졌다.
따라서, 본 발명은 추가로 비타민 D 유도체, 예를 들면, 칼시포트리올을 모낭의 피지선에 표적화하는 방법에 관한 것이고, 상기 방법은 이러한 치료가 필요한 환자의 피부 영역에 상기 기재된 지질 나노입자 조성물의 치료학적 유효량을 도포함을 포함한다. 보다 구체적으로, 치료가 필요한 피부 영역은 여드름과 관련된 면포, 농포, 구진 또는 낭종 또는 관련 질환, 예를 들면, 장미증를 포함한다. 상기 비타민 D 유도체는 바람직하게는 칼시포트리올 또는 칼시포트리올 일수화물이다.
또한, 약제학적으로 허용되는 수성 비히클 중의 활성 성분들로서 코르티코스테로이드 및 비타민 D 유도체 또는 유사체를 포함하는 지질 나노입자 조성물들을 제조하는 것이 예상된다. 당해 양태에서, 상기 조성물은 BHA 및 BHT, 또는 BHA와 BHT의 혼합물로부터 선택될 수 있는 항산화제의 첨가에 의해 안정화될 수 있다.
실시예
실시예
1
본 발명의 조성물
베타메타손-17-발레레이트(BMV)를 함유하는 고체 지질 나노입자들
베타메타손-디프로피오네이트(BDP)를 함유하는 고체 지질 나노입자들
조성물 G
부형제(mg/g)
단위 mg
베타메타손-디프로피오네이트 0.643
글리세롤 디스테아레이트 100
폴리소르베이트 80 20
인산이나트륨 이수화물 10
수산화나트륨(염화수소) 적당량, pH 6.0
정제수 1g이 될 때까지 가함
칼시포트리올 일수화물을 함유하는 지질 나노입자들
칼시포트리올 일수화물 및 베타메타손 디프로피오네이트를 함유하는 지질 나노입자들
상기 지질 나노입자들(조성물 H 내지 L) 내에 혼입된 칼시포트리올은 40℃에서 3개월 저장 후 화학적으로 안정한 것(>90%)으로 측정되었다.
상기 지질 나노입자들(조성물 H 내지 M) 내에 혼입된 칼시포트리올은 25℃에서 18개월 저장 후 화학적으로 안정한 것(>90%)으로 측정되었다.
베타메타손 디프로피오네이트는 조성물 G에서 25℃에서 6개월 저장 후 화학적으로 안정한 것(>90%)으로 측정되었다.
조성물 N의 25℃에서의 안정성 평가는 계속 진행중이다.
상기 지질 나노입자들(조성물 O 내지 Q) 내에 혼입된 칼시포트리올 및 베타메타손 디프로피오네이트는 25℃에서 6개월 저장 후 상기 SLN 중에서 화학적으로 안정한 것(>90%)으로 측정되었다.
제형들의 제조
SLN의 제조는 제EP 605497호에 기재된 바와 같이 뜨거운 고압 균질화에 의해 수행되었다. 간단히 BMV 및 BDP를 갖는 SLN을 위하여, 지질을 80℃에서 용융시키고, BMV 또는 BDP를 교반 동안 상기 용융된 지질에 용해시켰다. 상기 동일한 온도의 수성 폴리소르베이트 80 용액을 상기 지질 혼합물에 가하고, 상기 혼합물을 실버슨 하이 스피드 믹서(Silverson High Speed Mixer) L4RT(제조사: 실버슨 머신스 리미티드(Silverson Machines Ltd., Chesham, United Kingdom))를 사용하여 2분 동안 6000rpm으로 가볍게 균질화시켜 거친 에멀젼을 형성하였다. 상기 에멀젼을 에멀시플렉스(EmulsiFlex) C5(제조사: 아베스틴 인코포레이티드(Avestin Inc., Ottawa, ON, Canada))를 사용하여 고압 균질화시키고, 이때 균질기를 줄라보(Julabo) TW 20 수욕(Seelbach, Germany)에 놓아 온도를 80℃로 유지하였다. 상기 거친 에멀젼을 600bar에서 4회 균질화 주기를 적용하여 가공하였다. 이들 가공 파라미터들은 이들이 작은 평균 입자 크기(≤200nm) 및 낮은 다분산도를 갖는 SLN을 야기하도록 예비 연구들로부터 선택되었다. SLN 분산액들을 빛으로부터 보호하면서 실온에서 냉각시키고, 후속적으로 pH 5.0로 조절하였다. BMV를 갖는 연고는 99%(w/w) 백색 연질 파라핀 및 1%(w/w) 액체 파라핀으로 구성되었고, 절구를 사용하여 상기 연고에 BMV 결정들을 현탁시킴으로써 제조되었다. BMV를 갖는 모든 제형을 사용시까지 빛으로부터 보호하에 5℃에서 저장하였다.
칼시포트리올을 포함하는 고체 지질 나노입자들 및 나노구조로 된 지질 담체들의 제조는 유사한 방식으로 수행되었다. 칼시포트리올을 뜨거운 오일에 용해시키고(NLC의 경우), 상기 혼합물을 상기 용융된 지질에 가하였다. SLN에 있어서, 칼시포트리올을 상기 용융된 지질에 용해시키고, 온도를 교반시키면서 80℃로 유지하였다. 폴록사머/물 용액을 pH 8.0으로 조정하고, 80℃ 온도로 가열하고, 용융된 지질-약물 혼합물에 가하였다. 실버슨 하이 스피드 믹서 L4RT(제조사: 실버슨 머신스 리미티드(Chesham, United Kingdom))를 사용하여 예비-에멀젼들을 제조하였다. 후속적으로 에멀시플렉스 C5(제조사: 아베스틴 인코포레이티드(Ottawa, ON, Canada))를 사용하여 500 내지 800bar 및 3주기를 적용하여 고압 균질화함으로써 SLN 분산액들을 제조하고, 이때 균질기를 줄라보 TW 20 수욕(Seelbach, Germany)에 놓아 온도를 80℃로 유지하였다. 냉각시킨 후, SLN을 완충액, 보존제 및 안정화제와 혼합하고, pH를 8.0 또는 8.5로 조정하였다. 제형이 카보머에 의해 걸쭉해지는 경우, 냉각하면서 실버슨 하이 스피드 믹서 L4RT(제조사: 실버슨 머신스 리미티드(Chesham, United Kingdom))를 사용하여 카보머를 단계적으로 가함으로써 수행한 후, 최종 단계에서 pH를 조정하였다.
제형들의 특성 확인
특성 확인은 제조일 후 0 내지 3일에 수행했고, 제조 후 1주일 내에 생체 내 연구를 개시하였다.
동적 광산란(
DLS
)
SLN의 입자 크기 분석은 633nm 레이저 및 173° 검출 광학이 장착된 제타사이저 나노(Zetasizer Nano) ZS(제조사: 맬버른 인스트루먼츠 리미티드(Malvern Instruments Ltd., Worcestershire, UK) 상에서 DLS에 의해 수행되었다. 측정은 측정 전 정제수로 적절하게 희석된 샘플들(n=3)에 대해 25℃에서 수행했고, 즉 물의 점도를 측정에 사용하였다. 맬버른 DTS v5.10 소프트웨어를 데이타 수집 및 분석에 적용하였다. 입자 크기 분포는 다분산 지수(PdI) 및 평균 유체역학적 직경(Z-평균)으로 기재되었다.
현미경 관찰
지질 중의 BMV의 용해도뿐만 아니라 최종 제형의 외관은, SLN 및 연고 둘다에서, 린캄(Linkam) PE94 히터가 장착된 니콘 이클립스(Nikon Eclipse) 80i 현미경을 사용하여 현미경으로 평가하였고, 둘다 제조사가 DFA 인스트루먼츠(DFA Instruments, Glostrup, Denmark)이다. 수집에 사용한 소프트웨어는 이미지 프로 플러스(Image Pro Plus®)였다.
고압 액체 크로마토그래피(
HPLC
)
SLN 및 연고를 각각 BMV, BDP 및 칼시포트리올 함량에 대해 HPLC로 정량적으로 분석하였다.
SLN
및 연고의 특성 확인
DLS 분석은 용량 결정 연구에서 시험된 4개의 상이한 SLN(BMV 함량만 다름)의 평균 직경이 179.9 내지 193.6nm이고, PdI는 0.179 내지 0.216이었음을 보여주었다. 작은 평균 입자 크기 및 낮은 PdI를 유지하면서 피부 자극을 감소시키는 계면활성제 및 지질 농도의 최적화는 이것이 2.5%(w/w) 디스테아레이트 및 0.4%(w/w) 폴리소르베이트 80의 조성물로 가능하였음을 보여주었다. 이러한 조성물을 갖는 SLN의 Z-평균은 205.4nm이었고, PdI는 0.228이었다. Z-평균 및 PdI 값들 둘다는 계면활성제 및 지질의 농도에 따라 좌우되었다. 지질의 두 농도에 있어서, 계면활성제 농도의 증가는 계면활성제의 특정 수치까지 Z-평균 및 PdI를 감소시켰고, 그 후 입자 크기가 더이상 감소되지 않았다. BMV는 SLN 중의 지질에 용해되었고, 최종 제형에서 약물 결정은 현미경으로 검출되지 않았다. 연고에서, BMV 결정(< 25㎛)은 비히클 전체에 걸쳐 균질하게 분산되었다. HPLC 분석은 SLN 및 연고 중의 BMV의 농도가 상대 표준 편차가 1.4% 미만인 예상된 수치였음을 보여주었다(상대 편차가 10.3%였던 SLN 0.003mg/g의 경우를 제외함). 이는 BMV가 두 제형 유형 모두에서 균질하게 분포되고 화학적으로 안정했음을 설명한다.
실시예 2
피부 침투 연구
피부 샘플 제조
돼지 귀들을 대니쉬 미트 트레이드 칼리지(Danish Meat Trade College, Roskilde, Denmark)로부터 새로 도살된 돼지들로부터 수득하였다. 상기 귀들을 -20℃에서 저장하고, 면도, 및 메스를 사용하여 상기 귀들의 뒷면에서 전층 피부를 제거하기 전에 4℃에서 천천히 해동시켰다. 피하 조직을 메스로 조심스럽게 제거하고, 상기 피부를 사용시(단지 14일 후) -20℃에서 동결 전 적절한 조각으로 잘랐다. 각각의 귀로부터 피부 2 조각을 수득하고, 이들을 온전한 피부 및 장벽-손상된 피부에 대하여 균형을 잡았다.
피부 장벽 손상은 D-스쾀(D-Squame®) 테이프 디스크(제조사: 쿠덤 코포레이션(Cuderm Corp., Dallas, USA)를 사용하여 25회 연속적인 테이프 스트립핑으로 유도하였다. 5초 동안 D-스쾀® 테이프 어플리케이터(제조사: 쿠덤 코포레이션(Dallas, USA))를 사용하여 테이프 상에 225g/cm2 압력을 적용하였다. 테이프 스트립핑시 피부 주름 문제를 극복하기 위해 피부를 늘려주면서, 작은 핀들로 코르크 플레이트에 고정시켰다. 상기 방법은 AD 피부의 장벽 성질을 모의 실험하기 위한 피부 모델을 만들어낸 시몬센 등(Simonsen et al.)으로부터 조정되었다[참조: L. Simonsen and A Fullerton, Skin Pharmacol. Physiol. 20(5), 2007, pp. 230-236]. 신선한 피부 대 냉동되고 해동된 피부의 테이프 스트립핑 효과는 신선한 피부 및 해동된 피부(n=6) 및 테이프 스트립핑 0, 5, 15, 25 및 40회와 비교하여 초기 연구에 의해 검증되었다. 펀치 생검을 채취하고, 10%(w/w) 포르말린에 고정시킨 후, 현미경으로 검사하기 전에 헤마톡실린-에오신으로 염색하였다.
피부 침투 및 투과 연구
BMV 및 지질의 침투 프로파일을 평가하였다. 온전한 피부 및 장벽-손상된 피부로 BMV 및 지질 입자들(디스테아레이트 및 트리팔미테이트)의 침투를 연구하는데 3H-표지된 BMV 및 14C-표지된 지질을 사용하였다.
수용체 매질과 마주보는 진피 면을 갖는 프란츠 유형 확산 셀(Franz type diffusion cell) 상에 상기 피부를 고정하였다(확산 영역 3.14cm2, 수용 용적 10㎖, 일정한 교반, 32℃로 온도 유지). 등장성 아세테이트 완충액 pH 5.5(15mM 아세트산나트륨, 100mM 염화나트륨) 중의 1%(w/w) 메틸-β-사이클로덱스트린 용액을 수용체 매질로서 사용하였다. 등장성 염화나트륨 용액으로 30분 동안 그리고 수용체 매질로 60분 동안 상기 피부를 평형화시킨 후, 상기 수용체 매질을 교체하고, 20mg 제형(6.4mg 제형/cm2)을 스파츌라를 사용하여 상기 피부 표면에 고르게 도포하였다. 도포된 제형의 정확한 양은 도포 전과 도포 후에 스파츌라의 중량측정으로 측정하였다. 항온처리 완료 후, 상기 피부를 분리하고 분석하였다. 모든 연구들을 온전한 피부 또는 장벽-손상된 피부에 대해 수행하고, 제형 도포 시간은 6, 16 및 24시간 내에서 다양하였다. 폐색 상태의 완료를 보장하기 위하여 상기 피부의 윗부분에 유리 플러그를 고정함으로써 폐색을 만들었다. 도포 시간 완료 후, 피부를 코튼 패드로 2회 닦아내어 과잉 제형을 제거하였다. 에틸아세테이트 10㎖를 사용하여 코튼 패드 및 제공 분획(donor compartment)의 뚜껑으로부터 BMV 및 지질을 추출하였다. 헵탄:에탄올(30:70)을 사용하여 연고로부터 BMV를 추출하였다. 피부 손상을 유도할 때와 동일한 기술을 적용하여 D-스쾀 테이프 디스크(제조사: 쿠덤 코포레이션(Dallas, USA))를 사용하여 온전한 피부에 최대 15회 테이프 스트립(strip)에 적용함으로써 각질층을 제거하였다. 장벽 손상된 피부에 있어서, 최대 3회 테이프 스트립핑만을 수행하였다. 두 경우 모두에서, 첫번째 테이프 스트립은 과잉 제형으로서 포함되었다. 각질층을 제거하는 방법은 상이한 제형들과의 예비 연구 및 제형에 24시간 노출 후 상이한 수의 테이프 스트립을 사용한 시험 결과에 의해 확립되었다. 그러나 표피가 각각 15회 또는 3회 미만의 테이프 스트립에서 느슨해지기 시작하는 경우, 테이프 스트립핑을 끝내고, 마지막 스트립을 표피 계수에 포함시켰다. 표피 및 진피를 가열로 분리하였다(60℃ 및 높은 습도에서 5분간 항온처리). 도포 영역으로 둘러싸인 피부(비-도포된 피부로 지정)를 작은 조각들로 자르고, 마찬가지로 분석하여 임의의 측면 침투를 포함하고 완전한 회수를 달성하였다. 테이프 스트립들 및 피부 샘플들에 솔루엔(Soluene®) 350을 가하여 조직을 용해시키고 약물 물질 및 지질을 추출하였다. 50℃에서 24시간 항온처리 후, 하이오닉-플루오르(Hionic-Fluor) 10㎖를 솔루엔 350 샘플들에 가하고, 트리-카브(Tri-Carb) 2100 TR 액체 섬광 분석기(제조사: 팩커드 인스트루먼트 컴파니(Packard Instrument Company, Meriden, USA))에서 액체 섬광으로 분석하였다. 상기 뚜껑 및 상기 코튼 패드로부터의 추출물 및 상기 수용체 매질 중의 함량은 1㎖를 섬광 계수 전에 하이오닉-플루오르 10㎖를 혼합함으로써 분석되었다. 적절한 액체(즉, 에틸아세테이트, 수용체 매질, 헵탄:에탄올(30:70) 및 하이오닉-플루오르와 혼합된 솔루엔 350)를 배경 측정값으로서 사용하였다.
6, 16 및 24시간 비교시, 상이한 피부 층들에서의 BMV의 양은 피부 구조가 24시간 동안 변하여 분리 과정의 효율이 또한 변할 수 있다는 사실을 고려하여 모아졌다.
SLN이 어떻게 약물 물질의 피부 내 및 피부 통과 침투 프로파일에 영향을 미치는지 평가하기 위하여, SLN 지질 성분, 도포 기간 및 폐색 상태의 존재를 가변시키면서 프란츠 확산 셀에서 온전한 돼지 피부 및 장벽-손상된 돼지 피부에 대해 시험관 내 침투 연구를 수행하였다.
디스테아레이트에 대한 BMV의 비율은 피부 깊이에 따라 증가하는 것으로 확인되었고, 즉, 지질보다 BMV가 피부에 더 침투하였다. 과잉 제형에서의 비율은 약 1이었다. 각질층에서, 이는 1 미만으로 감소하고, 후속적으로 표피 및 진피를 통해 증가하여 수용체 매질에서 3.6의 비율에 도달하였다. 디스테아레이트와 비교하여, 트리팔미테이트 프로파일은 살짝 상이했는데, 지질에 대한 BMV 비율에서의 감소가 진피에서 보여지고, 수용체 매질에서의 비율이 디스테아레이트보다 더 낮은 2.7이었다. BMV/지질 비율이 피부 깊이에 따라 증가했다는 사실은 지질 입자들이 피부의 표면상에 또는 피부의 상층들에 주로 머물렀고, BMV가 입자들로부터 방출되어 피부로 침투되었음을 나타낸다. 표 3은 상이한 피부 층들 및 수용체 매질 내로의 지질의 침투 데이타를 보여준다. 온전한 피부 및 장벽-손상된 피부 둘다에 있어서, 디스테아레이트가 트리팔미테이트보다 표피에 더 잘 도달하는 경향이 있었다. 피부가 테이프 스트립핑에 의해 장벽 손상되는 경우, 표피, 진피 및 수용체 매질에 도달하는 지질의 양이 증가함이 보였다. 장벽-손상된 피부에서 지질 침투의 증가(약 3 내지 7배)는 BMV 침투의 증가(약 3 내지 60배)에 비해 매우 낮았고, 이는 BMV가 나노입자들로부터 방출되었고, 피부를 통해 별도로 확산되었음을 강조한다.
24시간 동안 피부 도포 후, SLN과 연고 사이에서 관찰된 주요 차이점은 SLN이 온전한 피부 및 장벽-손상된 피부 둘다에서 피부에 남아있는 상당히 높은 BMV의 총량을 야기한다는 것이었다(도 1). 장벽이 온전한 경우, SLN 중에 투여된 BMV의 많은 양이 각질층에서 발견되었고, 수용체 매질에서는 적게 발견되었다(도 1a). SLN은 더 깊은 피부 층들로 확산될 수 있는 곳으로부터 피부의 상층들로 BMV를 고도로 국한시키고, 연고와 비교하여 SLN이 상당히 더 많은 BMV를 온전한 피부의 각질층으로 더 깊게 침투시키는 것이 명백하였다(p<0.05). 세틸팔미테이트 SLN에 있어서, 더 많은 BMV가 표피에 도달하였다. SLN을 온전한 피부에 도포한 경우, 오직 무시할 수 있는 양의 BMV(<0.9%)가 수용체 매질로 침투한 반면, 연고를 사용한 후, 상당히 더 많이(8.4±4.0%) 온전한 피부로 침투하였다(도 1a). SLN 또는 연고 도포 전 피부의 테이프 스트립핑시, 모든 제형들로부터 수용체 매질로의 BMV 투과는 크게 향상되었다(13.8 내지 21.8%)(도 3b). 연고와 비교하여 SLN 도포시 장벽-손상된 피부에 상당히 더 많은 BMV가 남아있었지만(p<0.05), 유사한 양의 BMV가 수용체 매질로 침투하였다(도 1b). 상기 경향은 트리팔미테이트 및 세틸팔미테이트 SLN과 비교하여 디스테아레이트 SLN 중의 BMV 투여 후 더 많은 BMV가 온전한 피부 및 장벽-손상된 피부 둘다에서 각질층에 남아있다는 것이었다(도 1).
도포 24시간 후 수득된 결과들의 보다 우수한 이해를 달성하기 위하여, 2개의 추가적인 시점, 즉 6 및 16시간을 연구에 포함시켰다. 당해 지질 중의 BMV의 더 높은 용해도로 인하여 이들 연구들에 디스테아레이트를 선택하였다. 각각 6, 16, 및 24시간 도포 후, 연고를 사용한 경우에는 모든 시점에서 상당히 낮은 양의 BMV가 피부에 존재하고(도 2), 디스테아레이트 SLN의 도포는 피부에서 일정하고 상당히 많은 양의 BMV를 야기하는 것으로 나타났다. 장벽-손상된 피부에 있어서 수용체 매질에 침투하는 BMV의 양은 SLN 중에서 투여되는 경우 24시간 내에 작은 정도로만 증가하였다(도 2b).
피부가 SLN 도포 후 24시간 동안 즉시 폐색되는 경우, 수용체 매질로 침투된 BMV의 양은 비-폐색된 상태와 비교하여 상당히 증가하였고, 상기 피부 중의 양은 낮았다(도 3). 폐색시 및 온전한 피부와 대조적으로, 수용체 매질로 침투된 BMV의 증가는 장벽-손상된 피부에 있어서 매우 높았고, 디스테아레이트 SLN이 도포된 경우, 65.6±15.2%이었다(도 3b).
무모
랫트들에서
베타메타손
디프로피오네이트의
생체 내 피부 전달
이소플루란 마취 하에, 제형 100㎕를 랫트의 등에 4x3cm 영역에 도포하였다. 상기 랫트를 (상기 제형이 건조되도록) 2분 동안 놔두고, "생물막", 옵티스킨 필름(Optiskin film)(5.3 x 7.2cm, 제조사: URGO 라보라토리즈(URGO laboratories), France)을 상기 영역 위에 도포하고, 그것의 상부에 픽소물 스트레치(Fixomull strech)(제조사: BSN 메티칼(BSN medical), Germany)를 도포하였다.
상기 랫트들을 투여 후 상이한 시간 간격에 죽이고, 이 시점에서 피부 생검들 및 혈액 샘플을 채취하였다. 죽이기 전에 설하 혈액 샘플들을 각각의 동물로부터 수집하였다. 상기 랫트들은 CO2로 안락사시켰다. 피부 생검들은 상기 도포된 피부 영역으로부터 채취하였다. 상기 피부를 99.9% 에탄올에 담근 티슈로 부드럽게 닦아내었다. 상기 생검들을 중량 측정하고, 정량 분석까지 -80도에서 보관하였다. 정량 분석은 LC-MS/MS로 수행하였다.
도 4는 베타메타손 디프로피오네이트(BDP) 및 이의 대사물질들, 베타메타손(BOP) 및 베타메타손-모노프로피오네이트(BMP)의 더 높은 수치가 연고와 비교할 경우 무모 랫트들의 피부로 SLN 중의 투여에 의해 더 긴 시간 동안 상기 피부에서 수득될 수 있음을 설명한다. 3일째에, 상기 피부에서 약물 물질의 일정하게 높은 수준이 달성되었고, 7일째에 상기 약물 물질이 여전히 상기 피부에 동일한 정도로 남아있었지만, 이는 연고 중에서 투여한 경우에는 검출되지 않을 수 있다. 이들 데이타는 SLN 중의 코르티코스테로이드 BMV가 온전한 돼지 피부 및 장벽-손상된 돼지 피부에 도포되는 경우 시험관 내에서 보여진 저장소 효과를 확증한다.
실시예
3
뮤린
아토피성 피부염 모델에서 피부 전달 시스템으로서
BMV
를 함유하는 지질 나노입자들의 평가
AD
유도
옥사졸론으로의 반복된 접종(challenge)으로 AD 표현형을 유도하였다[참조: Man et al.,, J. Invest. Dermatol. 128, 2008, pp. 79-86]. 마우스를 오른쪽 귀의 각각의 면에 아세톤 중의 0.8%(w/v) 옥사졸론 10㎕를 도포함으로써 민감화시켰다(-7일로 지정). 대조 그룹은 오른쪽 및 왼쪽 쥐의 양면에 아세톤 10㎕로 처리하였다. 민감화시킨지 7일 후(0일로 지정), 상기 마우스를 아세톤 중의 0.4%(w/v) 옥사졸론으로 처음으로 접종하였다. 보다 구체적으로, 상기 마우스는 0일부터 21일까지 격일로 오른쪽 귀의 각각의 면에 0.4%(w/v) 옥사졸론 10㎕를 투여하였다. 상기 옥사졸론을 도포한 동일한 날에, 대조 그룹의 마우스는 각각 왼쪽 귀 및 오른쪽 귀의 각각의 면에 아세톤 10㎕를 투여하였다. 상기 처리는 상기 연구가 21일에 종료될 때까지 1일 1회 치료 계획을 포함하여 10일째에 개시되었다. 하기 판독을 측정하였다: 귀 두께, TEWL, 사이토카인 분석, 상기 귀 피부의 조직학적 평가 및 귀 조직 및 혈청 중의 BMV의 정량적 분석.
SLN
중의 투여될
BMV
에 대한 용량 결정
SLN 중의 BMV에 대한 용량 반응 관계를 확인하기 위해, 그리고 SLN의 효과를 연고와 비교하는 경우 사용되어야 하는 용량을 확립하기 위하여 초기 연구를 수행하였다. SLN 중의 BMV의 3개의 상이한 농도를 당해 연구에 적용하였다. 마우스는 4 내지 8마리의 8개의 그룹으로 나뉘고(총 52마리의 마우스들), 오른쪽 및 왼쪽 귀의 각각의 면에 아세톤 10㎕로 1일 1회 처리하거나 오른쪽 귀의 각각의 면에 플라세보 SLN 5㎕로 1일 1회 처리한, AD 유도되지 않은 마우스의 2개의 아세톤 대조 그룹(n=4)을 포함한다. 다른 그룹들은 옥사졸론에 의해 AD 유도되고, 아세톤 10㎕(n=7), 아세톤 중의 BMV 3.0㎍/귀/일 10㎕(n=6), 플라세보 SLN 5㎕(n=7), SLN 중의 BMV 0.030㎍/귀/일 5㎕(n=8), SLN 중의 BMV 1.20㎍/귀/일 5㎕(n=8) 및 SLN 중의 BMV 12.0㎍/귀/일 5㎕(n=8)로 오른쪽 귀의 각각의 면에 1일 1회 처리된 마우스들로 이루어졌다. 왼쪽 귀는 처리되지 않았다.
SLN
및 연고의 자극 및 효과
마우스 귀 피부 상에서의 SLN 비히클의 자극 효과를 평가하는 연구에서 SLN의 조성을 최적화하였다. 특히, 계면활성제 폴리소르베이트 80의 농도를 평가하였다. 플라세보 제형의 범위는 약 200nm의 평균 입자 크기 및 낮은 입자 다분산도(< 0.25)를 야기하는 계면활성제 및 지질의 최적 수준을 찾도록 제조되었다. 게다가, 당해 조성의 입자들은 건강한 마우스 귀 피부에는 어떠한 자극적 효과도 유도하지 않아야 하고, 지질 혼합물 중에 충분한 BMV 용해도를 제공하여야 한다(>0.012%(w/w)). 이러한 기준들을 만족하는 SLN 비히클의 조성은 2.5%(w/w) 지질 및 0.4%(w/w) 폴리소르베이트 80인 것으로 확인되었다(표 1). 당해 SLN 제형의 효과를 통상적인 파라핀 연고와 비교하였고, 이는 또한 건강한 마우스 귀 피부에 비-자극적인 것으로 보여졌다. BMV 전달에 있어서 SLN을 연고와 비교하기 위하여, 69마리의 마우스들을 4 내지 10마리의 8개의 그룹으로 나누고, 이 중 한 그룹은 AD 유도되지 않은 아세톤 대조 그룹(n=4)이었다. 다른 그룹들의 마우스들은 모두 옥사졸론에 의해 AD 유도되었고, 이들은 아세톤 10㎕(n=8), 아세톤 중의 BMV 3.0㎍/귀/일 10㎕(n=8), 아세톤 중의 BMV 1.20㎍/귀/일 10㎕(n=10), SLN 중의 BMV 1.20㎍/귀/일 5㎕(n=10), 연고 중의 BMV 1.20㎍/귀/일 6㎍(n=10), 플라세보 SLN 5㎕(n=10) 및 플라세보 연고 6㎍(n=9)으로 오른쪽 귀의 각각의 면에 1일 1회 처리되었다. 처리 계획은 그 외에는 용량 결정 연구와 유사하였다. SLN을 피펫으로 도포하고, 높은 점성으로 인해 연고에 있어서는 스파츌라를 사용하였다. 상기 시험된 제형들의 조성은 표 1에 나타나 있다.
귀 두께
피부 염증 정도의 척도로서, 오른쪽 및 왼쪽 귀의 귀 두께를 미투토요 아메릭 컴파니(Mitutoyo Americ Co., Aurora, IL, USA)로부터의 디지털 마이크로미터를 사용하여 측정하고, 이때 내부 대조군으로서 처리되지 않은 귀들의 귀 두께 값을 사용하였다. 상기 연구 전체에 걸쳐 수행된 모든 측정은 개인간 측정 변동성을 최소화하기 위하여 동일한 사람에 의해 수행되었다. 측정은 10, 12, 14, 17, 19 및 21일째에 처리가 적용되기 전에 수행되었다.
경피
수분 손실(
TEWL
)
TEWL은 베이포미터(Vapometer)(제조사: 델핀 테크놀로지스 리미티드(Delfin Technologies Ltd., Kuopio, Finland)를 사용하는 피부 장벽 상태의 지표로서 사용된다. 직경이 4.5mm인 네일 아답터를 사용하여, TEWL은 마우스의 오른쪽 귀 상에 20s로 측정되었다. 측정은 처리를 적용하기 전에 용량-결정 연구에서 -7, 10, 14 및 20일째에 및 SLN을 연고와 비교하는 연구에서 -7, 10, 13, 17 및 20일째에 수행되었다. 각각의 TEWL 측정시 실험실에서 주위 상대 습도 및 온도를 측정하였다.
종점 샘플링
21일째에, 상기 제형의 마지막 도포 2시간 후에, 혈액 및 오른쪽 귀를 모든 동물로부터 샘플링하였다. 아세톤 대조 그룹에서, 양 귀들을 샘플링하였다. 상기 동물들을 이소플루란으로 마취시키고, 모세관을 사용하여 눈으로부터 혈액을 샘플링하였다. 상기 혈액을 2.5㎖ 바큐테이너(Vacutainer®) 바이알에 채우고, 실온에서 30분 동안 정치시킨 다음, 10분 동안 1000G 및 4℃에서 원심분리하였다. 상청액을 1.4㎖ 비-코드 u-바닥 벌크 마이크로닉스(Micronics) 튜브에 옮기고, 정량적 약물 분석까지 -80℃에서 저장하였다. 혈액 샘플링 후, 상기 동물들을 죽이고, 오른쪽 귀를 메스로 잘랐다. 스티에펠(Stiefel®) 생검 펀치(제조사: 오펜바흐 암 마인(Offenbach am Main), Germany)를 사용하여 귀의 중간 부분으로부터 8mm 생검을 조직 분석을 위해 분리하고, 이로부터 3mm 생검을 채취하고, 10%(v/v) 천연적으로 완충된 포름알데히드 중에 보존하였다. 상기 8mm 생검으로부터 남아있는 귀 조직을 2등분으로 자르고, 이 중 하나는 약물 농도를 분석하기 전에 테이프 스트립핑하고, 다른 하나는 사이토카인 분석에 사용하였다. 둘다 액체 질소 중에 스냅-동결시키고, 분석을 수행할 때까지 -80℃에서 저장하였다.
귀 조직에서의 사이토카인 수준
크라이올리스(Cryolys) 냉각기(제조사: 버틴 테크놀로지스(Bertin Technologies, Montigny-le-Bretonneux, France)와 함께 프레셀리스(Precellys®) 24 조직 균질기를 사용하여 귀 조직을 200㎕ 용해 완충액 중에서 균질화시켰다. 상기 용해 완충액은 PBS에 용해된 1mM Na3VO4, 0.4%(v/v) 노닐 페녹시폴리에톡실에탄올(NP40) 및 프로테아제 억제제 컴플리트(Complete™)(제조사: 로슈 디아그노스틱스(Roche Diagnostics, Mannheim, Germany))로 구성되었다. 균질화 후, 상기 샘플을 15 내지 30분의 기간 동안 얼음 위에 놔둔 다음, 마이크로센트리퓨즈(Microcentrifuge) 157 MP(제조사: 올레 디히 인스트루먼트 메이커스(Ole Dich Instrument makers, Hvidovre, Denmark)를 사용하여 4℃ 및 15000G에서 15분 동안 원심분리하였다. 상청액을 MSD® 사이토카인 검정을 수행할 때까지 -80℃에서 유지하였다. 전체 단백질 농도의 측정을 수행하여 사이토카인 측정 전에 샘플의 농도를 표준화하였다. 이는 피어스(Pierce®) BCA 단백질 검정 키트(제조사: 피어스 바이오테크놀로지(Pierce Biotechnology, Rockford, IL, USA))를 사용하여 수행하였다. 플레이트를 빅터(VICTOR™) X3 멀티라벨 플레이트 리더(제조사: 퍼킨 엘머(Perkin Elmer, Skovlunde, Danmark) 상에서 판독하였다. 귀 조직에서 사이토카인들, IFN-γ, IL-1-β, IL-2, IL-4, IL-5, IL-8, IL-10, IL-12 전체 및 TNF-α의 특정 수준은 MSD® 섹터 이미저 6000(제조사: 메소 스케일 디스커버리(Meso Scale Discovery, Gaithersburg, MD, USA))을 사용하여 MSD® 마우스 TH1/TH2 9-플렉스 멀티-스팟® 96-웰 10 스팟 플레이트로 측정되었다. MSD® 검정은 조직 용도에 최적화되었다. 따라서, 상기 플레이트를 1시간 동안 MSD 교정기 블렌드 150㎕로 블록킹시킨 다음, 0.05%(v/v) 폴리소르베이트 20 150㎕로 3회 세척하였다. 희석된 조직 상청액 샘플 25㎕를 상기 플레이트에 가한 다음, 2시간 동안 실온에서 진탕시켰다. 그 다음, 설포-택(SULFO-TAG™) 검출 항체 용액(제조사: 메소 스케일 디스커버리(Gaithersburg, MD, USA)) 25㎕를 가하고, 실온에서 2시간 동안 항온처리하였다. 0.05%(v/v) 폴리소르베이트 20으로 3회 반복 세척한 다음, 최종적으로 밀리큐(MilliQ) 물 중에 1:2로 희석된 판독 완충액 150㎕를 가하고, MSD® 섹터 이미저 6000 상에서 플레이트를 판독하였다.
귀 조직 및 혈청 중의 BMV의 정량적 분석
혈청 및 조직 중의 BMV의 정량적 분석은 질량 분광법(MS)을 사용하여 수행하였다. 5mg/㎖ 프로테이나제 K 용액 300㎕ 및 소화 완충액 pH 8.5(1.58% 트리즈마 하이드로클로라이드, 0.029% EDTA, 0.20% 나트륨 도데실 설페이트, 0.117% 염화나트륨) 1700㎕를 귀 조직 샘플에 가한 다음, 20분 동안 초음파 처리하여 상기 샘플을 균질화하였다. 상기 샘플 50㎕를 깊은 웰 플레이트에 옮기고, 내부 표준 EO1271(20nM)를 함유하는 메탄올 150㎕를 가하여 침전을 유도하였다. 4000rpm에서 30분 동안 10℃에서 원심분리 후, 샘플을 분석하였다. 혈청 샘플 중에서 단백질을 침전시키기 위하여, 아세토니트릴 중의 내부 표준 100㎕를 가하였다. 샘플 및 표준 각각 20㎕를 깊은 웰 플레이트로 옮겼다. 부드럽게 진탕 후, 플레이트를 4000rpm에서 30분 동안 10℃에서 원심분리하였다. 샘플을 UPLC(제조사: 워터스(Waters, Milsford MA, USA)) 및 API5000 질량 분광기(제조사: 어플라이드 바이오시스템스(Applied Biosystems, Carlsbad, CA, USA))가 장착된 LC-MS/MS 시스템 상에서 분석하였다. 데이타 수집 및 분석을 위하여 아날리스트(Analyst)(API5000) 및 워터스 액퀴티(Waters Acquity) 소프트웨어를 적용하였다. 온도는 60℃이고, 유동은 0.5㎖/분이었다. 2.3분 동안 메탄올:1M 암모늄아세테이트:포름산:물(900:2:0.755:100) 및 메탄올:1M 암모늄아세테이트:포름산:물(50:2:0.755:950) 0 내지 100%로부터 이동상을 가변시키면서 유동 구배법을 사용하였다. 검출 한계는 피부 샘플들에 있어서 11.11ng/mg이고, 혈청 샘플들에 있어서 0.001ng/㎖인 것으로 측정되었다.
데이타
분석
모든 데이타는 마이크로소프트 엑셀(Microsoft Excel) 또는 그래프 패드 프리즘 5.0(Graph Pad Prism 5.0)에서 플롯팅되었다. 통계적 분석은 그래프 패드 프리즘 5.0에서 수행되었다. 일원 분산분석(one way ANOVA)(p<0.05) 후, 평균들을 비교하는 뉴먼 쿨스(Newman Keuls) 또는 던넷츠(Dunnets) 다중 비교 시험을 수행하였다.
AD
모델 검증
만성 옥사졸론 모델은 AD에 있어서 잘 검증되고 수용된 모델이다[참조: Man et al., supra]. 실제로, 우리의 동물 모델도 잘 유도된 AD 표현형을 가지고 있음을 보여주었다. 옥사졸론으로 처리된 귀들의 귀 두께는 증가한 반면, 아세톤으로만 처리된 귀들에서는 귀 두께의 변화가 보이지 않았다. 예상대로, 아세톤 중의 BMV에 의한 처리는 옥사졸론 민감화된 마우스에서 귀 두께의 상당한 감소를 유발하였다. 게다가, TEWL 값들은 피부 염증 및 장벽 손상을 확증하는 귀 두께 데이타와 관련이 있다. 따라서, TEWL 값들은 옥사졸론 처리 10일째에 10g/m2*h에서 30-35g/m2*h로 증가하였다. 사이토카인 발현은 옥사졸론으로 민감화된 그룹에서 상향 조절되었고, 아세톤만으로 처리된 마우스에서는 영향을 받지 않았다. 사이토카인 수준은 아세톤 중의 BMV에 의한 처리시 옥사졸론 민감화된 마우스에서 하향 조절되었고, 이는 국소적 코르티코스테로이드 처리의 효율을 확증한다. 조직학적 평가는 또한 옥사졸론 민감화된 마우스의 귀 조직에서 뚜렷한 염증 반응을 명백하게 보여주었고, 대조적으로 아세톤으로만 처리된 마우스들로부터의 피부 샘플들은 염증의 징후를 보이지 않았던 반면, BMV로 처리된 마우스로부터의 피부 샘플들은 약물 처리의 효율과 관련된 염증의 가벼운 징후만을 보여주었다(데이타는 도시되지 않음).
SLN
및 연고 중의
BMV
의 유사한 귀 두께 감소
귀 두께는 피부 염증 정도의 척도로서 사용될 수 있기 때문에 종점들 중 하나로서 선택되었다[참조: Patrick et al., Toxicol. Appl. Pharmacol. 81, 1985, pp. 476-490; Young et al., J. Invest. Dermatol. 82, 1984, pp. 367-371]. 귀 두께 측정의 결과는 BMV를 갖는 SLN 및 연고가 귀 두께에서 유사하고 뚜렷한(P<0.05) 감소를 야기하고, 상기 효과가 아세톤 대조군에서 1.20㎍/귀/일 BMV와 동일한 범위 내에 있음을 보여주었다(도 5a). 이는 BMV가 SLN 비히클로부터 방출되고 피부로 침투하여 연고 및 아세톤 중에 투여된 BMV와 비슷한 효과를 발휘하는데 충분히 높은 양으로 표적 세포들에 도달함을 강하게 나타낸다. 이전에, 시험관 내에서, SLN 중의 BMV가 돼지 피부에 도포되는 경우, 피부에, 그리고 각질층에 구분되어, 남아있는 약물 물질의 총량이 BMV가 연고로 도포된 경우보다 상당히 높았음을 보여주었다(실시예 2 참조). 그러나, 약물 물질은 SLN으로부터 방출되고, 효과를 발휘하기 위하여 각질층으로 침투하며, 이는 본원에서 생체 내에서 확증됨이 중요하다.
용량-결정 연구에서, 처리되지 않은 동물들뿐만 아니라 SLN 플라세보 그룹과 비교하는 경우, 1.20㎍/귀/일 및 12.0㎍/귀/일의 농도로 BMV를 포함하는 SLN의 도포 후 귀 두께에서의 뚜렷한(P<0.05) 감소를 반영하는 귀 두께에 대한 분명한 용량 반응 효과가 존재하였다(도 5b). SLN 중의 BMV 0.03㎍/귀/일로의 처리로부터는 어떠한 효과도 나타나지 않았다.
사이토카인 수준들은
SLN
및 연고 중의
BMV
의 유사한 효과를 입증한다
옥사졸론에 의한 다수의 접종은 사이토카인들의 발현에서 반영되는 주로 Th1 우세한 반응으로부터 Th2 우세한 반응으로 피부 염증에서의 이동을 야기하는 것으로 나타났고, 이는 사람 AD에서 일반적으로 나타난다[참조: Kitagaki et al., J. Invest. Dermatol. 105, 1995, pp. 749-755; Kitagaki et al., J. Immunol. 159, 1997, pp. 2484-2491; Matsumoto et al., Skin Res. Technol. 10, 2004, pp. 122-129].
사이토카인들을 생성하는 Th1 및 Th2 둘다는 당해 연구에서 평가되었다. 용량-결정 연구에서 SLN 중의 BMV의 명백한 용량 반응 효과가 존재하였고, 즉 IL-1β, IL-4, IL-8, IL-10 및 IL-12의 수준이 SLN 중에 적용된 BMV의 용량에 비례하여 감소하였다(데이타는 도시되지 않음). 불행하게도, IL-5 및 TNF-α의 농도는 BMV에 의한 처리시 검출 한계 미만이었고, 이는 이들이 데이타 분석에 포함될 수 없었던 이유이다. 아세톤 대조군과 비교하여, IL-8 및 IL-12 수준들은 SLN 비히클로부터의 자극을 나타내는 옥사졸론에 의해 민감화되지 않은 마우스들에게 플라세보 SLN의 도포 후 뚜렷하게 증가하였다.
SLN 중의 BMV와 연고 중의 BMV의 비교는 두 제형 모두에서 BMV가 IL-1β, IL-4, IL-8, IL-10 및 IL-12 수준을 하향 조절하는 것으로 보여주었고, 이는 또한 상기 용량-결정 연구에서도 보여주었다. 이는 사이토카인들 Il-4 및 IL-1β의 하향조절을 보여주는 도 6a 및 6b에서 예시된다. 사이토카인 조절에 관한 제형들 사이에서 뚜렷한 차이가 존재하지 않았고, 이 점에 있어서 상기 두 제형은 동일하게 효과적임을 의미한다. 그래도, 주지할 것은 플라세보 연고의 도포 후 사이토카인 수준이 플라세보 SLN의 도포 후보다 일반적으로 더 높았고, 이는 연고 비히클이 SLN보다 더 자극적임을 나타낸다는 것이다.
TEWL
은
SLN
또는 연고 중의 투여된
BMV
에 의해
감소된다
TEWL은 피부 장벽 성질의 지표로서 사용될 수 있고[참조: Levin and Maibach, J. Contr.Rel. 103, 2005, pp. 291-299; Proksch et al., J. Dermatol. Sci. 43, 2006, pp. 159-169; Werner and Lindberg, Acta Derm. Venereol. 65, 1985, pp. 102-105], 피부에 도포된 비히클의 폐색성을 평가하기 위하여 사용될 수 있다[참조: Loden, Acta Derm. Venereol. 72, 1992, pp. 327-330]. BMV/귀/일 1.20㎍으로 도포한 연고와 SLN의 비교는 어느 제형으로의 처리든 TEWL 값을 대조군과 비슷한 수준으로 뚜렷하게 감소시킴을 보여주었다(도 7a). 용량-결정 연구에서, SLN 중의 BMV 1.2㎍/귀/일에 의한 처리만이 TEWL 값에서 뚜렷한(P<0.05) 감소를 야기하였다(도 7b). 피부에 도포된 SLN으로 수행된 이전 연구들[참조: Jenning et al., Int. J. Pharm. 199, 2000, pp. 167-177; Santos et al., J. Drug Target. 10, 2002, pp. 489-495; Wissing and Muller, Eur. J. Pharm. Biopharm. 56, 2003, pp. 67-72]과 대조적으로, TEWL은 플라세보 SLN 및 플라세보 연고로부터 어떠한 폐색 효과도 나타내지 않았다. TEWL은 BMV가 포함된 상기 제형들에 의해서만 감소하였다. 상기 폐색 효과가 명백하지 않은 이유는 제형들이 도포된 다음 날 측정이 수행되었기 때문일 수 있다. 이때까지, 특히 마우스들이 이들의 귀를 연속적으로 긁고 세척하였기 때문에, 제형은 폐색을 유도하는데 충분하게 높은 양으로 상기 피부에 존재하지 않았을 수 있다. 따라서, BMV를 포함하는 제형들의 투여 후 TEWL의 감소는 BMV의 치료학적 효과, 특히 혈관수축 효과와 관련된 것으로 여겨지며, 이는 피부 표면으로부터 물의 증발을 감소시킬 수 있다[참조: Kolbe et al., Skin Re. Technol. 7, 2001, pp. 73-77].
SLN
은 피부에서
BMV
의 양을 증가시킨다
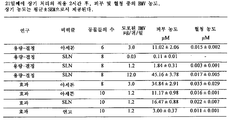
21일째에 마지막 도포 2시간 후, 피부 및 혈청 중의 BMV의 농도를 분석하였다. 연고와 SLN의 비교는 SLN 도포 후 BMV의 피부 농도가 연고 중의 BMV 도포 후보다 뚜렷하게 더 높았음(5배)을 보여주었다. 혈청 중의 BMV의 농도는 SLN, 연고 및 아세톤 대조군 1.20㎍/귀/일과 유사하였다(도 8). 용량-결정 연구는 혈청 중의 BMV 수준이 BMV 12.0㎍/귀/일을 포함하는 SLN 및 아세톤 중의 BMV 3.0㎍/귀/일의 도포 후와 비슷하였음을 보여주었다(도 8). 그러나, 피부 중의 수준은 BMV 12㎍/귀/일을 포함하는 SLN이 아세톤 중의 BMV 3.0㎍/귀/일보다 더 높았다. SLN 0.03㎍/귀/일은 혈청 중에서 측정할 수 없었고, BMV의 매우 낮은 수준이 피부에 존재하였고, 이는 당해 제형이 효과를 나타내지 않았음을 설명한다.
귀 두께에서 보여주는 용량 반응, TEWL 및 귀 조직 사이토카인 수준은 대조군을 포함하여 도포된 상기 상이한 제형들로부터 달성된 상기 피부 농도들과 함께 BMV가 경피적으로 침투되고 국소적 효과를 발휘하였음을 나타낸다. 그러나, 마우스의 귀를 긁고 세척한 경우, 마우스가 BMV를 경구로 섭취할 가능성은 혈청 농도들의 해석에서 배제될 수 없었다. SLN 도포 후 피부에서 더 많은 BMV가 발견되었다는 사실은 연고와 비교하여 피부에 보다 더 강하게 부착되고 피부 저장소를 생성하는 SLN의 능력을 나타내는 것일 수 있다. BMV를 포함하는 SLN을 연고와 비교하는 경우 시험관 내에서 또한 이러한 효과를 볼 수 있었다(실시예 2 참조). 본 연구에서, 임의의 남아있는 각질층 및/또는 실행가능한 표피에 남아있는 약물 물질의 증가된 양을 유발하는 것 이외에, SLN으로부터의 약물 물질은 또한 통상적인 제형 및 아세톤 대조군과 동일한 효과를 생성하는 정도로 표적 부위에 도달하였음을 보여주었다. 유사한 결과는 뮤린 AD 모델에서 SLN 또는 오일 중에 도포된 사이클로스포린 A의 효과를 비교하는 또 다른 생체 내 연구에서 확인되었다. SLN 중의 사이클로스포린 A는 오일보다 더 효과적이었고, 피부의 각질층에서 약물 물질의 양은 SLN의 사용으로 뚜렷하게 증가하였음이 입증되었다[참조: Kim et al., Pharmazie 64, 2009, pp. 510-514]. 습진 환자들에서 수행된 또 다른 연구는 SLN 내에 혼입된 클로베타솔 프로피오네이트에 의한 처리가 피부 저장소 효과를 유도하고, 시판된 크림과 비교하여 효능에서 더 우수하였음을 보여주었다[참조: Kalariya et al., Indian J. Exp. Biol., 2005, pp. 233-240].
실시예
4
피부 침투 및 투과 연구들은 온전한 돼지 귀 피부만을 사용하고, 수용체 매질을 4% BSA로 대체한 것을 제외하고, 실시예 2에 기재된 조성 H, L, J, M, N에 의해 수행되었다. 이들 연구들로부터의 데이타는 지질 나노입자들이 크림과 비교할 때 각질층 및 특히 실행가능한 피부에 칼시포트리올을 보유할 수 있었음을 보여주었다. 게다가, 지질 나노입자들을 도포할 때 약물 물질의 매우 적은 양이 피부를 거쳐 수용체 매질로 침투하였다.
Claims (45)
- 지질 나노입자들 내에 고체 용액 또는 분산액으로서 혼입된 코르티코스테로이드를 치료학적 활성 성분으로서 포함하는 약제학적 조성물로서,
상기 지질 나노입자들은 주위 온도에서 고체이고, 상기 지질 나노입자들은 체온 이상의 융점을 갖는 제1 지질을 약 60 내지 92중량% 포함하고, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, C12 -24 지방산의 글리세릴 모노에스테르, 디에스테르 또는 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 지질 나노입자들은 약제학적으로 허용되는 계면활성제 약 2 내지 25중량%를 추가로 포함하는, 약제학적 조성물. - 제1항에 있어서, 상기 제1 지질이 상기 지질 나노입자들의 약 65 내지 92중량%, 또는 약 70 내지 90중량%, 또는 약 75 내지 85중량%, 또는 약 80중량%를 구성하고, 상기 계면활성제가 상기 약제학적 조성물의 약 8 내지 22중량%, 예를 들면, 약 10 내지 20중량%를 구성하는, 약제학적 조성물.
- 제1항 또는 제2항에 있어서, 상기 제1 지질이 세틸팔미테이트, 밀랍, 스테아릴 팔미테이트, 스테아릴 베헤네이트, 글리세롤 모노스테아레이트, 글리세롤 디스테아레이트, 글리세롤 디베헤네이트, 글리세롤 트리미리스테이트, 글리세롤 트리팔미테이트, 글리세롤 트리스테아레이트, 베헤놀, 스테아르산, 수소화된 팜유, 수소화된 코코-글리세라이드, 수소화된 피마자유 및 세토스테아릴알코올로 이루어진 그룹으로부터 선택되는, 약제학적 조성물.
- 제1항에 있어서, 상기 계면활성제가 폴록사머, 폴리소르베이트, 당 에스테르, 에톡실화된 지방 알코올 또는 인지질로 이루어진 그룹으로부터 선택되는, 약제학적 조성물.
- 제1항 내지 제4항 중의 어느 한 항에 있어서, 주위 온도에서 오일이고 상기 제1 지질과 혼화성인 제2 지질, 또는 친유성 유화제 또는 연화제를 상기 지질 나노입자들의 약 1 내지 40중량%, 예를 들면, 약 10 내지 30중량% 또는 약 15 내지 25중량% 또는 약 20중량%로 추가로 포함하는, 약제학적 조성물.
- 제5항에 있어서, 상기 제2 지질이, C6-10 모노글리세라이드, C6-10 디글리세라이드, 이소프로필 미리스테이트 또는 이소프로필 팔미테이트, 중쇄 트리글리세라이드, 예를 들면, 카프릴릭/카프릭 트리글리세라이드, 또는 식물성유, 예를 들면, 피마자유, 해바라기유, 홍화유, 달맞이꽃유, 보리지씨유, 참깨유, 옥수수유, 야자핵유, 올리브유, 아보카도유, 아몬드유, 유채씨유, 코코넛유, 면실유, 땅콩유, 대두유, 밀배아유, 포도씨유 또는 호호바유를 포함하는 장쇄 트리글리세라이드로 이루어진 그룹으로부터 선택되는, 약제학적 조성물.
- 제5항 또는 제6항에 있어서, 상기 제1 지질이 상기 지질 나노입자들의 약 75 내지 85중량%를 구성하고, 상기 제2 지질이 상기 지질 나노입자들의 약 15 내지 25중량%를 구성하고, 상기 계면활성제가 상기 지질 나노입자들의 약 2 내지 5중량%를 구성하는, 약제학적 조성물.
- 제1항 내지 제7항 중의 어느 한 항에 있어서, 상기 코르티코스테로이드가 암시노나이드, 베타메타손, 부데노사이드, 클로베타솔, 클로베타손, 코르티손, 데소나이드, 데속시코르티손, 데속시메타손, 덱사메타손, 디플루코르톨론, 디플로라손, 플루코르티손, 플루메타손, 플루니솔라이드, 플루오시노나이드, 플루오시놀론, 플루오로메톨론, 플루프레드니솔론, 플루란드레놀라이드, 플루티카손, 할시노나이드, 할로베타솔, 하이드로코르티손, 메프레드니손, 메틸프레드니손, 모메타손, 파라메타손, 프레드니카베이트, 프레드니손, 프레드니솔론 및 트리암시놀론 또는 약제학적으로 허용되는 이들의 에스테르 또는 아세토나이드로 이루어진 그룹으로부터 선택되는, 약제학적 조성물.
- 제8항에 있어서, 상기 코르티코스테로이드가 베타메타손 또는 이의 에스테르, 예를 들면, 베타메타손-17-발레레이트 또는 베타메타손-17,21-디프로피오네이트인, 약제학적 조성물.
- 제1항 내지 9항 중의 어느 한 항에 있어서, 상기 지질 나노입자들이 약 10 내지 800nm, 특히 약 50 내지 600nm, 예를 들면, 100 내지 500nm 범위의 평균(mean/average) 입자 크기/직경을 갖는, 약제학적 조성물.
- 제1항 내지 제10항 중의 어느 한 항에 있어서, 상기 지질 나노입자들이 상기 약제학적 조성물의 약 1 내지 40중량%, 예를 들면, 약 5 내지 30중량% 또는 약 10 내지 20중량%의 양으로 존재하는, 약제학적 조성물.
- 제1항 내지 제11항 중의 어느 한 항에 있어서, 수성 상을 추가로 포함하는, 약제학적 조성물.
- 제12항에 있어서, 상기 수성 상이 증점제를 포함하는, 약제학적 조성물.
- 제13항에 있어서, 상기 증점제가 카보머, 셀룰로스 유도체, 예를 들면, 하이드록시프로필셀룰로스, 하이드록시프로필메틸셀룰로스, 하이드록시에틸셀룰로스, 히알루론산, 알기네이트, 덱스트란 또는 이들의 유도체로 이루어진 그룹으로부터 선택되는, 약제학적 조성물.
- 제13항 또는 제14항에 있어서, 상기 증점제가 상기 약제학적 조성물의 약 0.1 내지 5중량%, 예를 들면, 약 0.5중량%의 양으로 존재하는, 약제학적 조성물.
- (a) 체온 이상의 융점을 갖는 제1 지질 약 60 내지 92중량%를 포함하는 지질 상(lipid phase) 내에 코르티코스테로이드를 용해시키거나 분산시키는 단계(여기서, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, C12 -24 지방산의 글리세릴 디- 또는 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 제1 지질은 용융된 상태이고, 상기 지질 상은, 주위 온도에서 오일이고 상기 제1 지질과 혼화성인 제2 지질, 또는 친유성 유화제 또는 연화제 약 1 내지 40중량%를 임의로 포함한다);
(b) 상기 단계 (a)에서 수득된 지질 상을, 폴록사머, 폴리소르베이트, 당 에스테르 또는 에톡실화된 지방 알코올로 이루어진 그룹으로부터 선택된 약제학적으로 허용되는 계면활성제 0.2 내지 10중량%를 포함하는 수성 상 중에 분산시켜 에멀젼을 형성하는 단계;
(c) 상기 단계 (b)에서 수득된 에멀젼을 고압 균질기를 사용하여 균질화시켜 상기 코르티코스테로이드를 포함하는 상기 지질 상의 나노입자들을 형성하는 단계 및
(d) 상기 단계 (c)에서 수득된 균질화된 에멀젼을 냉각시켜 상기 나노입자들을 고화시키는 단계
를 포함하는, 제1항 내지 제15항 중의 어느 한 항에 따른 조성물의 제조방법. - 제1항 내지 제15항 중의 어느 한 항에 있어서, 염증성 또는 과증식성 피부 질환, 예를 들면, 건선, 습진, 아토피성 피부염, 접촉성 피부염, 피부 노화, 광노화, 여드름, 두드러기 또는 소양증의 예방 또는 치료를 위한, 약제학적 조성물.
- 지질 나노입자들 내에 고체 용액 또는 분산액으로서 혼입된 비타민 D 유도체를, 치료학적 활성 성분으로서, 포함하는 국소 약제학적 조성물로서,
상기 지질 나노입자들은 주위 온도에서 고체이고, 상기 지질 나노입자들은 체온 이상의 융점을 갖는 제1 지질 약 60 내지 92중량%를 포함하고, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, 산가가 0.1 이하인 C12 -24 지방산의 글리세릴 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 지질 나노입자들은 폴록사머 및 에톡실화된 지방 알코올로 이루어진 그룹으로부터 선택된 약제학적으로 허용되는 계면활성제 약 2 내지 22중량%를 추가로 포함하는, 국소 약제학적 조성물. - 제18항에 있어서, 상기 제1 지질이 상기 지질 나노입자들의 약 65 내지 90%, 또는 약 70 내지 85%, 또는 약 75 내지 80중량%를 구성하는, 국소 약제학적 조성물.
- 제18항 또는 제19항에 있어서, 상기 제1 지질이 세틸팔미테이트, C14-28 지방 알코올, 수소화된 팜유 및 산가가 0.1 이하인 트리글리세라이드로 이루어진 그룹으로부터 선택되는, 국소 약제학적 조성물.
- 제18항 내지 제20항 중의 어느 한 항에 있어서, 주위 온도에서 오일이고 상기 제1 지질과 혼화성인 제2 지질을 상기 지질 나노입자의 약 1 내지 40중량%, 또는 약 10 내지 35%, 또는 약 15 내지 30%, 또는 약 20 내지 25중량%로 추가로 포함하는, 국소 약제학적 조성물.
- 제18항 내지 제21항 중의 어느 한 항에 있어서, 상기 제2 지질이 이소프로필 미리스테이트 또는 이소프로필, 팔미테이트 중쇄 트리글리세라이드, 예를 들면, 카프릴릭/카프릭 트리글리세라이드, 또는 장쇄 트리글리세라이드, 예를 들면, 피마자유로 이루어진 그룹으로부터 선택되는, 국소 약제학적 조성물.
- 제18항 내지 제22항 중의 어느 한 항에 있어서, 상기 지질 나노입자들이, 상기 지질 나노입자들을 기준으로 하여, 상기 제1 지질 약 80 내지 85중량%, 상기 제2 지질 15 내지 20중량% 및 상기 계면활성제 약 2 내지 5중량%를 포함하는, 국소 약제학적 조성물.
- 제23항에 있어서, 상기 제1 지질이 세틸팔미테이트이고, 상기 제2 지질이 카프릴릭/카프릭 트리글리세라이드인, 국소 약제학적 조성물.
- 제18항 내지 제24항 중의 어느 한 항에 있어서, 상기 비타민 D 유도체가 칼시포트리올, 칼시트리올, 막사칼시톨 또는 타칼시톨로부터 선택되는, 국소 약제학적 조성물.
- 제25항에 있어서, 상기 비타민 D 유도체가 칼시포트리올 또는 칼시포트리올 일수화물인, 국소 약제학적 조성물.
- 제18항 내지 제26항 중의 어느 한 항에 있어서, 상기 지질 나노입자들이 약 10 내지 800nm, 특히 약 50 내지 600nm, 예를 들면, 약 100 내지 500nm 범위의 평균 입자 크기/직경을 갖는, 국소 약제학적 조성물.
- 제18항 내지 제27항 중의 어느 한 항에 있어서, 상기 지질 나노입자들이 상기 국소 약제학적 조성물의 1 내지 40중량%, 예를 들면, 약 5 내지 30중량% 또는 약 10 내지 20중량%의 양으로 존재하는, 국소 약제학적 조성물.
- 제18항 내지 제28항 중의 어느 한 항에 있어서, 상기 조성물의 pH가 7.5 이상이 되도록 알칼리성 완충액을 추가로 포함하는, 국소 약제학적 조성물.
- 제31항에 있어서, 상기 알칼리성 완충액이 지질 앵커링(anchoring)을 갖는 아민인, 국소 약제학적 조성물.
- 제30항에 있어서, 상기 아민이 트리에탄올아민, 트로메타몰, 모노에탄올아민 또는 디에탄올아민으로부터 선택되는, 국소 약제학적 조성물.
- 제18항 내지 제31항 중의 어느 한 항에 있어서, 수성 상을 추가로 포함하는, 국소 약제학적 조성물.
- 제12항 또는 제32항에 있어서, 상기 수성 상이 연화제, 예를 들면, 실리콘 오일, 액체 파라핀 또는 콜레스테롤을 추가로 포함하는, 국소 약제학적 조성물.
- 제33항에 있어서, 상기 연화제가 상기 국소 약제학적 조성물의 약 10 내지 50중량%, 또는 약 20 내지 40중량%, 또는 약 30중량%의 양으로 포함되는, 국소 약제학적 조성물.
- 제18항 내지 제34항 중의 어느 한 항에 있어서, 증점제를 추가로 포함하는, 국소 약제학적 조성물.
- 제35항에 있어서, 상기 증점제가 카보머, 또는 셀룰로스 유도체, 예를 들면, 하이드록시프로필셀룰로스, 하이드록시프로필메틸셀룰로스, 하이드록시에틸셀룰로스인, 국소 약제학적 조성물.
- 제35항 또는 제36항에 있어서, 상기 증점제가 상기 국소 약제학적 조성물의 0.1 내지 5중량%, 특히 약 0.5중량%의 양으로 존재하는, 국소 약제학적 조성물.
- (a) 체온 이상의 융점을 갖는 제1 지질 약 60 내지 92중량%, 및 임의로 실온에서 오일이고 상기 제1 지질과 혼화성인 제2 지질 약 1 내지 40중량%를 포함하는 지질 상 내에 비타민 D 유도체를 용해시키거나 분산시키는 단계(여기서, 상기 제1 지질은 C12 -24 알코올과 C12 -24 지방산의 에스테르, 산가가 0.1 이하인 C12-24 지방산의 글리세릴 트리에스테르, C12 -24 지방 알코올, 및 콜레스테롤로 이루어진 그룹으로부터 선택되는 왁스이고, 상기 제1 지질은 용융된 상태이다);
(b) 상기 단계 (a)에서 수득된 지질 상을 폴록사머 또는 에톡실화된 지방 알코올로부터 선택된 약제학적으로 허용되는 계면활성제 0.2 내지 10중량%를 포함하는 수성 상에 분산시키는 단계;
(c) 상기 단계 (b)에서 수득된 에멀젼을 고압 균질기를 사용하여 균질화시켜 상기 비타민 D 유도체를 포함하는 상기 지질 상의 나노입자들을 형성하는 단계 및
(d) 상기 단계 (c)에서 수득된 균질화된 에멀젼을 냉각시켜 상기 나노입자들을 고화시키는 단계
를 포함하는, 제18항 내지 제37항 중의 어느 한 항에 따른 조성물의 제조방법. - 제18항 내지 제37항 중의 어느 한 항에 있어서, 염증성 또는 과증식성 피부 병태, 예를 들면, 건선, 지루성 건선, 수장 족저 농포증, 피부염, 비늘증, 장미증, 여드름 또는 광선 각화증의 예방 또는 치료를 위한, 국소 약제학적 조성물.
- 비타민 D 유도체를 모낭의 피지선에 표적화하는 방법으로서, 상기 방법은 이러한 치료가 필요한 환자의 피부 영역에 제18항 내지 제37항 중의 어느 한 항에 따른 지질 나노입자 조성물의 치료학적 유효량을 도포함을 포함하는, 비타민 D 유도체를 모낭의 피지선에 표적화하는 방법.
- 제40항에 있어서, 치료가 필요한 상기 피부 영역은 여드름 또는 장미증과 관련된 면포, 농포, 구진 또는 낭종을 포함하는, 방법.
- 제40항 또는 제41항에 있어서, 상기 비타민 D 유도체가 칼시포트리올 또는 칼시포트리올 일수화물인, 방법.
- 약제학적으로 허용되는 수성 비히클 중의 제1항 내지 제17항 및 제18항 내지 37항 중의 어느 한 항에 따른 지질 나노입자들의 혼합물을 포함하는 약제학적 조성물.
- 제43항에 있어서, 항산화제를 추가로 포함하는, 약제학적 조성물.
- 제44항에 있어서, 상기 항산화제가 BHA 및 BHT, 또는 BHA와 BHT의 혼합물의 그룹으로부터 선택되는, 약제학적 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161467192P | 2011-03-24 | 2011-03-24 | |
| US61/467,192 | 2011-03-24 | ||
| PCT/EP2012/055222 WO2012127037A2 (en) | 2011-03-24 | 2012-03-23 | A composition comprising lipid nanoparticles and a corticosteroid or vitamin d derivative |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140031227A true KR20140031227A (ko) | 2014-03-12 |
Family
ID=45894467
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137027812A KR20140031227A (ko) | 2011-03-24 | 2012-03-23 | 지질 나노입자들 및 코르티코스테로이드 또는 비타민 d 유도체를 포함하는 조성물 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20140079785A1 (ko) |
| EP (1) | EP2688560A2 (ko) |
| JP (1) | JP2014508796A (ko) |
| KR (1) | KR20140031227A (ko) |
| CN (1) | CN103442700B (ko) |
| RU (1) | RU2602171C2 (ko) |
| WO (1) | WO2012127037A2 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180004164A (ko) * | 2015-05-08 | 2018-01-10 | 액티버스 파마 컴퍼니 리미티드 | 글루코코르티코스테로이드의 나노미립자를 함유하는 수성 현탁액제 |
| WO2022203145A1 (ko) * | 2021-03-22 | 2022-09-29 | 주식회사 앱스바이오 | 매스틱검 또는 감마오리자놀로 제조한 지질나노입자 조성물 |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10695432B2 (en) | 2010-10-29 | 2020-06-30 | Infirst Healthcare Limited | Solid solution compositions and use in severe pain |
| US9308213B2 (en) | 2010-10-29 | 2016-04-12 | Infirst Healthcare Limited | Solid solution compositions and use in chronic inflammation |
| US11202831B2 (en) | 2010-10-29 | 2021-12-21 | Infirst Healthcare Limited | Solid solution compositions and use in cardiovascular disease |
| US8895536B2 (en) | 2010-10-29 | 2014-11-25 | Infirst Healthcare Ltd. | Compositions and methods for treating chronic inflammation and inflammatory diseases |
| US11730709B2 (en) | 2010-10-29 | 2023-08-22 | Infirst Healthcare Limited | Compositions and methods for treating severe pain |
| US9744132B2 (en) | 2010-10-29 | 2017-08-29 | Infirst Healthcare Limited | Solid solution compositions and use in chronic inflammation |
| US11224659B2 (en) | 2010-10-29 | 2022-01-18 | Infirst Healthcare Limited | Solid solution compositions and use in severe pain |
| US10695431B2 (en) | 2010-10-29 | 2020-06-30 | Infirst Healthcare Limited | Solid solution compositions and use in cardiovascular disease |
| US9271950B2 (en) | 2010-10-29 | 2016-03-01 | Infirst Healthcare Limited | Compositions for treating chronic inflammation and inflammatory diseases |
| US9504664B2 (en) | 2010-10-29 | 2016-11-29 | Infirst Healthcare Limited | Compositions and methods for treating severe pain |
| JP6389190B2 (ja) * | 2013-01-14 | 2018-09-12 | インファースト ヘルスケア リミテッド | 固溶体組成物および慢性炎症における使用 |
| JP2016520572A (ja) * | 2013-04-24 | 2016-07-14 | ソーク インスティテュート フォー バイオロジカル スタディーズ | ビタミンd受容体/smadゲノム回路は線維化反応を制御する |
| JP2016530219A (ja) | 2013-06-05 | 2016-09-29 | ソーク インスティテュート フォー バイオロジカル スタディーズ | Cxcl12活性に関与する疾患を処置するためのビタミンd受容体アゴニスト |
| EP2821077A1 (en) * | 2013-07-04 | 2015-01-07 | Praxis Biopharma Research Institute | Lipid nanoparticles for wound healing |
| CN103417507B (zh) * | 2013-08-23 | 2015-12-02 | 王显著 | 布地奈德药物组合物 |
| TW201636025A (zh) * | 2015-04-15 | 2016-10-16 | Maruho Kk | 皮膚用之醫藥組成物 |
| CZ307681B6 (cs) * | 2016-02-29 | 2019-02-13 | Ústav makromolekulární chemie AV ČR, v. v. i. | Fotoaktivovatelná nanočástice pro fotodynamické aplikace, způsob její přípravy, farmaceutická kompozice ji obsahující a jejich použití |
| ES2871537T3 (es) * | 2016-05-09 | 2021-10-29 | Astrazeneca Ab | Nanopartículas lipídicas que comprenden agentes antiinflamatorios lipófilos y métodos de uso de las mismas |
| CN106265485A (zh) * | 2016-08-22 | 2017-01-04 | 江苏知原药业有限公司 | 一种稳定性改善的卡泊三醇组合物 |
| WO2019023149A1 (en) | 2017-07-24 | 2019-01-31 | Salk Institute For Biological Studies | USE OF BROMODOMAIN-CONTAINING PROTEIN-9 ANTAGONISTS IN ASSOCIATION WITH VITAMIN D RECEPTOR AGONISTS IN THE TREATMENT OF DIABETES |
| RU2018114533A (ru) * | 2018-04-19 | 2019-10-21 | Общество С Ограниченной Ответственностью "Научно-Исследовательская Компания "Медбиофарм" | Композиция на основе твердых липидных частиц, обладающая свойством направленной доставки для лечения вирусных заболеваний (варианты) |
| CN108904445A (zh) * | 2018-08-06 | 2018-11-30 | 江苏知原药业有限公司 | 钙泊三醇纳米悬浮液 |
| WO2020053609A1 (en) * | 2018-09-11 | 2020-03-19 | Lead Biotherapeutics Ltd. | Mucoadhesive dispersion nanoparticle system and method for production the same |
| WO2020231800A1 (en) * | 2019-05-10 | 2020-11-19 | Encube Ethicals Private Limited | Topical antifungal formulation |
| EP3741378A1 (de) | 2019-05-23 | 2020-11-25 | Dimitrios Tsakouridis | Zusammensetzung zur topischen behandlung und pflege der psoriatischen haut |
| CN111494321A (zh) * | 2020-04-28 | 2020-08-07 | 南通华山药业有限公司 | 一种骨化三醇长循环脂质体及其制备方法 |
| CN111588696A (zh) * | 2020-04-28 | 2020-08-28 | 南通华山药业有限公司 | 一种阿法骨化醇口服脂质体药物及其制备方法与应用 |
| US20210353600A1 (en) * | 2020-05-12 | 2021-11-18 | Chemistryrx | Compositions for treating hair loss |
| RU2749360C1 (ru) * | 2020-10-09 | 2021-06-09 | Федеральное государственное бюджетное военное образовательное учреждение высшего образования "Военно-медицинская академия имени С.М. Кирова" Министерства обороны Российской Федерации (ВМедА) | Способ лечения ладонно-подошвенного пустулеза |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU658608B2 (en) * | 1991-03-25 | 1995-04-27 | Astellas Pharma Europe B.V. | Topical preparation containing a suspension of solid lipid particles |
| DE4131562A1 (de) * | 1991-09-18 | 1993-03-25 | Medac Klinische Spezialpraep | Arzneistofftraeger aus festen lipidteilchen-feste lipidnanosphaeren (sln) |
| US5763426A (en) | 1993-01-15 | 1998-06-09 | Leo Pharmaceutical Products Ltd. | Crystalline form of a vitamin D analogue |
| US5785976A (en) * | 1993-03-05 | 1998-07-28 | Pharmacia & Upjohn Ab | Solid lipid particles, particles of bioactive agents and methods for the manufacture and use thereof |
| ES2245511T3 (es) * | 1998-03-04 | 2006-01-01 | Teijin Limited | Lociones de vitamina d3 activa en forma de emulsion. |
| AU4917900A (en) * | 1999-05-07 | 2000-11-21 | Pharmasol Gmbh | Lipid particles on the basis of mixtures of liquid and solid lipids and method for producing same |
| US8663692B1 (en) * | 1999-05-07 | 2014-03-04 | Pharmasol Gmbh | Lipid particles on the basis of mixtures of liquid and solid lipids and method for producing same |
| US7147841B2 (en) * | 2002-06-17 | 2006-12-12 | Ciba Specialty Chemicals Corporation | Formulation of UV absorbers by incorporation in solid lipid nanoparticles |
| US9006487B2 (en) * | 2005-06-15 | 2015-04-14 | Massachusetts Institute Of Technology | Amine-containing lipids and uses thereof |
| FR2893847B1 (fr) * | 2005-11-30 | 2010-10-29 | Galderma Sa | Composition sous forme de spray comprenant un derive de vitamine d et une phase huileuse |
| KR20110113664A (ko) * | 2006-08-29 | 2011-10-17 | 테바 파마슈티컬 인더스트리즈 리미티드 | 비타민 d 및 코르티코스테로이드를 포함하는 약학 조성물 |
| FR2909284B1 (fr) * | 2006-11-30 | 2012-09-21 | Galderma Sa | Nouvelles compositions sous forme d'onguent sans vaseline comprenant un derive de vitamine d et eventuellement un anti-inflammatoire steroidien |
| US10265265B2 (en) * | 2007-03-15 | 2019-04-23 | Drug Delivery Solutions Limited | Topical composition |
| US8470304B2 (en) * | 2009-08-04 | 2013-06-25 | Avidas Pharmaceuticals Llc | Therapeutic vitamin D sun-protecting formulations and methods for their use |
-
2012
- 2012-03-23 WO PCT/EP2012/055222 patent/WO2012127037A2/en active Application Filing
- 2012-03-23 JP JP2014500411A patent/JP2014508796A/ja not_active Ceased
- 2012-03-23 KR KR1020137027812A patent/KR20140031227A/ko not_active Application Discontinuation
- 2012-03-23 RU RU2013147429/15A patent/RU2602171C2/ru not_active IP Right Cessation
- 2012-03-23 EP EP12710939.5A patent/EP2688560A2/en not_active Withdrawn
- 2012-03-23 US US14/006,890 patent/US20140079785A1/en not_active Abandoned
- 2012-03-23 CN CN201280014897.2A patent/CN103442700B/zh not_active Expired - Fee Related
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180004164A (ko) * | 2015-05-08 | 2018-01-10 | 액티버스 파마 컴퍼니 리미티드 | 글루코코르티코스테로이드의 나노미립자를 함유하는 수성 현탁액제 |
| WO2022203145A1 (ko) * | 2021-03-22 | 2022-09-29 | 주식회사 앱스바이오 | 매스틱검 또는 감마오리자놀로 제조한 지질나노입자 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2012127037A3 (en) | 2012-12-27 |
| RU2013147429A (ru) | 2015-04-27 |
| CN103442700B (zh) | 2016-04-06 |
| RU2602171C2 (ru) | 2016-11-10 |
| WO2012127037A2 (en) | 2012-09-27 |
| CN103442700A (zh) | 2013-12-11 |
| JP2014508796A (ja) | 2014-04-10 |
| US20140079785A1 (en) | 2014-03-20 |
| EP2688560A2 (en) | 2014-01-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2602171C2 (ru) | Композиция, содержащая липидные наночастицы и кортикостероид или производное витамина d | |
| Kandekar et al. | Selective delivery of adapalene to the human hair follicle under finite dose conditions using polymeric micelle nanocarriers | |
| KR101930246B1 (ko) | 국소용 코르티코스테로이드 조성물 | |
| Tamarkin | Foam: a unique delivery vehicle for topically applied formulations | |
| AU744712B2 (en) | Activated vitamin D3 emulsion-type lotions | |
| Jain et al. | Comparative assessment of efficacy and safety potential of multifarious lipid based Tacrolimus loaded nanoformulations | |
| Vanti et al. | Development and optimisation of biopharmaceutical properties of a new microemulgel of cannabidiol for locally-acting dermatological delivery | |
| Şenyiğit et al. | Deoxycholate hydrogels of betamethasone-17-valerate intended for topical use: in vitro and in vivo evaluation | |
| RU2690659C2 (ru) | Композиции для местного применения, содержащие кортикостероид | |
| EP2515865B1 (en) | Cutaneous composition comprising vitamin d analogue and a mixture of solvent and surfactants | |
| US20230248687A1 (en) | Method for therapeutic treatment of rosacea | |
| US20230293543A1 (en) | Fenoldopam topical formulations for treating skin disorders | |
| Barichello et al. | Combined effect of liposomalization and addition of glycerol on the transdermal delivery of isosorbide 5-nitrate in rat skin | |
| KR20230011997A (ko) | 모낭으로 생물활성제를 전달하기 위한 조성물 | |
| JP2022549876A (ja) | 製剤 | |
| US20190091158A1 (en) | Compositions comprising at least one dispersed active principle and lipid microcapsules | |
| Draelos | Stratum Corneum Absorption Kinetics of 2 Potent Topical Corticosteroid Formulations: A Pilot Study | |
| Raposo | Pharmaceutical topical dosage forms as carriers for glucocorticoids |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |