KR20120128129A - 심장 병태의 치료 - Google Patents
심장 병태의 치료 Download PDFInfo
- Publication number
- KR20120128129A KR20120128129A KR1020127021148A KR20127021148A KR20120128129A KR 20120128129 A KR20120128129 A KR 20120128129A KR 1020127021148 A KR1020127021148 A KR 1020127021148A KR 20127021148 A KR20127021148 A KR 20127021148A KR 20120128129 A KR20120128129 A KR 20120128129A
- Authority
- KR
- South Korea
- Prior art keywords
- ser
- lys
- arg
- glu
- asp
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/26—Glucagons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0021—Intradermal administration, e.g. through microneedle arrays, needleless injectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
- C07K14/4705—Regulators; Modulating activity stimulating, promoting or activating activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/605—Glucagons
Abstract
본 발명은 심장 기능장애의 치료에 관한 것이다. 특히, 글루카곤-GLP-1 이중 작용제 화합물로 믿어지는 특정 화합물은 양성 수축촉진 효과를 발휘하여 심장의 에너지 밸런스를 보존함으로써 알려진 수축촉진제, 예를 들어, 도부타민, 노르에피네프린 및 글루카곤보다 우수할 수 있다.
Description
본 발명은 심장 기능장애 치료용 수축촉진제(inotropic agent)로서의 화합물, 대표적으로 글루카곤-GLP-1 이중 작용제(dual agonist) 화합물의 용도에 관한 것이다.
양성 수축촉진제는 혈류역학적 파라미터들을 개선함으로써 심근경색, 심부전 또는 심장성 쇼크 환자의 증상을 완화하고 종말 기관(end organ)을 보호하는데 사용된다. 심장은 수축기 및 확장기 활동을 지탱하기 위해 다량의 화학적 에너지를 요구한다. 따라서, 수축촉진제는 또한 심장 활동량을 증가시켜 심장 에너지 요구량을 증가시킨다. 그러나, 쇠약해지거나 질병에 걸린 심장은 보통 에너지가 부족하고(Ingwall, JS and Weiss, RG. Circ Res. 2004; 95: 135-145), 따라서 수축촉진제를 사용하면 에너지를 고갈시켜 궁극적으로 사망에 이르게된다(Hamad, E et al. American Journal of Cardiovascular Drugs. 2007; 7: 235-248; White, CM. J Clin Pharmacol. 1999; 39: 442-447).
프리프로글루카곤은 158개 아미노산의 전구체 폴리펩티드로서 조직 내에서 분화 프로세싱되어 글루카곤(Glu), 글루카곤-유사 펩티드-1(GLP-1), 글루카곤-유사 펩티드-2(GLP-2) 및 옥신토모둘린(OXM)을 포함하는 다수의 구조적으로 연관된 프로글루카곤-유래 펩티드를 형성한다. 이들 분자는 글루코오스 항상성, 인슐린 분비, 위배출 및 소장의 성장, 그리고 음식 섭취의 조절을 포함하는 광범위한 생리적 기능에 관여한다.
GLP-1의 주된 생물학적 활성 단편은 30개-아미노산으로 생산되며, 프리프로글루카곤의 아미노산 98 내지 127에 상응하는 C-말단 아미드화된 펩티드이다. GLP-1은 프로글루카곤의 분화 프로세싱에 의해 소장 상피 내분비 L-세포에서 생산되며, 음식에 반응하여 창자의 신경내분비 세포에 의해 정상적으로 분비되는 호르몬이다. 이는 오래된 2형 당뇨병을 앓는 대상에서도 베타 세포에 의한 인슐린 방출을 증가시킨다. GLP-1은 내인성 인슐린 분비를 자극하다가 혈당 수준이 떨어지면 자극을 중단하기 때문에 GLP-1 치료는 인슐린 요법에 대해서도 이점을 나타낸다. GLP-1은 인슐린 방출 및 합성을 증가시키고, 글루카곤 방출을 저해하며, 위배출을 감소시켜 정상혈당(euglycemia)을 촉진한다. GLP-1(Holst, JJ. Physiol Rev. 2007; 87: 1409-1439)은 정상 및 허혈 후 랫트 심장(Zhao, T et al. J Pharmacol Exp Ther. 2006; 317: 1106-1113), 적출된 마우스 심장(Ban, K et al. Circulation. 2008; 117: 2340-2350) 및 확장심근병증을 앓으며 의식이 있는 개(Nikolaidis, LA et al. Am J Physiol Heart Circ Physiol. 2005; 289: H2401 -H2408; Nikolaidis, LA et al. Circulation. 2004; 110: 955-961)에서 인슐린-독립적인 방식으로 심장근육의 글루코오스 섭취를 증가시키는 것으로 밝혀졌다.
글루카곤은 프리프로글루카곤의 아미노산 53 내지 81에 상응하는 29개-아미노산 펩티드로서 His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr(화합물 1)의 서열을 가진다. 글루카곤은 간세포 상의 글루카곤 수용체에 결합하여 글리코겐 분해를 통해 글리코겐 형태로 저장된 글루코오스를 간이 방출하도록 함으로써 혈당 수준을 유지할 수 있도록 한다. 이 저장물이 고갈되면, 글루카곤은 간을 자극하여 글루코오스신합성에 의해 추가의 글루코오스를 합성하도록 한다. 이 글루코오스가 혈류 내로 방출되어 저혈당화를 방지한다.
글루카곤은 심장에 대해서 문서에 의해 충분히 입증된 수축 효과를 가진다(Buse, MG et al. J Biol Chem. 1973; 248: 697-706; Farah, A and Tuttle, R. J Pharmacol Exp Ther. 1960; 129: 49-55; Levey, GS and Epstein, SE. Circ Res. 1969; 24: 151-156; Mayer, SE et al. Circ Res. 1970; 26: 225-233).
옥신토모둘린(OXM)은 완전한 29개 아미노산 서열의 글루카곤과 옥타펩티드 카복시말단 연장부분(프리프로글루카곤의 아미노산 82 내지 89로서 Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala(화합물 2)의 서열을 가지며 "개재(intervening) 펩티드 1" 또는 IP-1으로 명명된다; 따라서 인간 옥신토모둘린의 전체 서열은 His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala이다)을 포함하는 37개 아미노산 펩티드이다(화합물 3). OXM은 음식 섭취(ingestion)에 반응하여 그리고 식사 칼로리 함량에 비례하여 혈액 내로 방출된다. OXM은 인간의 식욕을 억제하고 음식 섭취(intake)를 저해하는 것으로 관찰되었다(Cohen et al, Journal of Endocrinology and Metabolism, 88, 4696-4701, 2003; WO 2003/022304). GLP-1과 유사한, 이러한 식욕감퇴 효과에 추가하여, OXM은 또한 다른 메카니즘에 의해 체중에 영향을 미친다. 왜냐하면 옥신토모둘린에 의해 처치된 랫트가 동일한 식이를 한 대조군 랫트에 비해 체중 증가가 적었기 때문이다(Bloom, Endocrinology 2004, 145, 2687).
OXM은 GLP-1 수용체보다 글루카곤 수용체에 대해 2배 더 높은 효능을 나타내면서, 글루카곤 수용체 및 GLP-1 수용체 둘 다를 활성화시키지만, 천연 글루카곤 및 GLP-1이 그들의 각각의 수용체에 대해 나타내는 것보다는 효능이 작다. 글루카곤 역시 GLP-1 수용체에 비해 글루카곤 수용체에 대해 강력한 선호도를 나타내기는 하지만 양쪽 수용체를 모두 활성화시킬 수 있다. 반면에 GLP-1은 글루카곤 수용체를 활성화시킬 수 없다. 옥신토모둘린의 작용 메카니즘은 잘 이해되어 있지 않다. 특히, 호르몬의 효과가 전적으로 글루카곤 수용체 및 GLP-1 수용체를 통해서만 매개되는 것인지, 아니면 하나 이상의 아직 동정되지 않은 수용체를 통하는 것인지 알려져 있지 않다.
옥신토모둘린의 뱀장어 유사체는 뱀장어 심장에 대해 수축 효과를 갖는 것으로 생각되며(Uesaka et al, J Experimental Biol. 2001; 204, 3019-3026), 수축 효과 역시 마우스에서의 옥신토모둘린에 대해 문서로 입증되어 있다(Sowden et al. Am J Phys Regul Integr Comp Physiol. 2007; 292: R962-R970).
본 발명자들은 알려진 수축촉진제, 예를 들어, 도부타민, 노르에피네프린 및 글루카곤보다 심장 에너지 상태에 상당히 적은 효과를 가지면서도 수축촉진제, 더욱 특히 양성 수축촉진제로 작용할 수 있는 특정 화합물을 밝혀냈다. 따라서 이들 화합물은 알려진 수축촉진제에 비해 치료제로서 사용하기에 더욱 적합하다.
임의의 특정 이론에 구애되고자 하는 것은 아니나, 이들 화합물의 유용한 성질은 글루카곤 수용체 및 GLP-1 수용체 둘 다를 활성화시키는 그들의 능력 때문일 수 있다. 따라서, 본 발명의 방법에 사용될 수 있는 화합물은 글루카곤-GLP-1 이중 작용제, 또는 간단히 "이중 작용제"로 지칭될 것이다.
따라서, 본 발명은 심장 질환 또는 심장 기능장애의 치료에 있어서 양성 수축촉진제로서 글루카곤-GLP-1 이중 작용제의 용도를 제공한다.
본 발명은 추가로 심장 질환 또는 심장 기능장애의 치료에 있어서 양성 수축촉진제로 사용하기 위한 글루카곤-GLP-1 이중 작용제를 제공한다.
본 발명은 추가로 심장 질환 또는 심장 기능장애 치료용 의약을 제조하는데 사용하기 위한 글루카곤-GLP-1 이중 작용제를 제공하며, 여기에서 글루카곤-GLP-1 이중 작용제는 양성 수축촉진제로서 사용하기 위해 투여된다.
본 발명은 추가로 심장 질환 또는 심장 기능장애 치료용 의약을 제조함에 있어서 글루카곤-GLP-1 이중 작용제의 용도를 제공하며, 여기에서 글루카곤-GLP-1 이중 작용제는 양성 수축촉진제로서 사용하기 위해 투여된다.
본 발명은 또한 심박수의 부수적인 증가를 유발하지 않고 심장 수축성을 개선할 수 있는 의약을 제조함에 있어서 글루카곤-GLP-1 작용제의 용도를 제공한다.
본 발명은 추가로 글루카곤-GLP-1 이중 작용제를 양성 수축촉진제로서 대상에게 투여함을 포함하는, 대상의 심장 질환 또는 심장 기능장애를 치료하는 방법을 제공한다.
글루카곤-GLP-1 이중 작용제는 당업계에 주지되어 있다.
옥신토모둘린은 천연 발생하는 이중 작용제의 한 예이다. 옥신토모둘린의 유사체가 국제 특허 출원 공개 WO2008/071972호 및 국제 특허 출원 공개 WO2007/100535호에 기재되어 있다.
다른 이중 작용제가 국제 특허 출원 공개 WO2008/101017호에 기재되어 있다. 이들 화합물의 대다수는 길이가 OXM보다 글루카곤에 더욱 유사하여 약 29개 아미노산 길이이므로 글루카곤의 유사체로 간주될 수 있다. 그러나 다른 것들은 더 길다. 상기 문헌에 기재된 임의의 이중 작용제가 본 명세서에 기술한 바와 같은 용도에 적합할 수 있다. 추가의 이중 작용제가 국제 특허 출원 공개 WO2009/155257호 및 국제 특허 출원 공개 WO2009/155258호에 기재되어 있으며, 또한 본 발명의 방법에 사용하기에 적합할 수 있다.
추가의 이중 작용제가 국제 특허 출원 공개 WO2008/152403호, PCT/GB2008/004132, PCT/GB2008/004121, PCT/GB2008/004157, PCT/GB2008/004130 및 유럽 특허 출원 제09251780.4호에 기재되어 있으며, 또한 본 발명의 방법에 사용하기에 적합할 수 있다.
이중 작용제는 하기 화학식의 화합물 또는 그의 약제학적으로 허용되는 염 또는 유도체일 수 있다:
R1-X-Z1-Z2-R2
상기 식에서
R1은 수소, C1 -4 알킬 (예를 들어, 메틸), 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
X는 하기 화학식 I이며:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-X10-Ser-X12-Tyr-Leu-X15-X16-X17-X18-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29
여기에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, 알파,알파-디메틸 이미다졸 아세트산(DMIA), N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, Aib 또는 D-Ser이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X10은 Tyr 또는 Trp이며;
X12는 Lys, Arg, His, Ala, Leu, Dpu, Dpr, Orn, 시트룰린 또는 오르니틴이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Thr, Lys, Arg, His, Glu, Asp, Ala, Gly, Gln, 호모글루탐산 또는 호모시스테인산이고;
X17은 Arg, Lys, His, Glu, Gln, Ala, Leu, Dpu, Dpr, Orn, Cys, 호모시스테인 또는 아세틸 페닐알라닌이며;
X18은 Arg, Lys, His, Tyr, Ala, Ser, Leu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X20는 Gln, Lys, Arg, His, Glu, Asp, Ala, Cys, Orn 또는 시트룰린이며;
X21은 Asp, Glu, Gln, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val, Ile 또는 Leu이며;
X24는 Gln, Lys, Arg, Glu, Asp, Ser, Ala, Leu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Lys, Arg, Glu, Leu, Nle, Cys이거나 존재하지 않으며;
X28은 Asn, Lys, Arg, Glu, Asp, Ser, Ala, Leu, Cys, 시트룰린, Orn이거나 존재하지 않고;
X29은 Thr, Lys, Arg, Glu, Ser, Ala, Gly, Cys, Orn, 호모시스테인, 아세틸 페닐알라닌이거나 존재하지 않으며;
R2는 NH2 또는 OH이고;
Z1은 존재하지 않거나 하기 서열을 가지며:
GlyProSerSerGlyAlaProProProSer;
GlyProSerSerGlyAlaProProProSerCys;
LysArgAsnArgAsnAsnIleAla; 또는
LysArgAsnArg;
Z2는 존재하지 않거나, Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이고;
여기에서,
Z1이 존재하는 경우, X27, X28 및 X29도 존재하며;
Z1이 존재하지 않는 경우, 화합물은 하나 이상의 X1, X2, X3, X10, X12, X15, X16, X17, X18, X20, X21, X23, X24, X27, X28 및 X29 위치에서 인간 글루카곤과 비교하여 치환 또는 결실을 갖고;
여기에서 상기 화합물은 인간 글루카곤보다 높은 GLP-1 수용체 선택성을 가진다.
독립적으로, 존재하는 경우, Z2는 하나 이상의 아미노산 잔기이거나 포함할 수 있다. 예를 들어, Z2는 γ-Glu (isoGlu로도 나타냄), Glu, β-Ala 또는 ε-Lys 잔기, 또는 4-아미노부타노일, 8-아미노옥타노일 또는 8-아미노-3,6-디옥사옥타노일 부위(moiety)일 수 있다.
상기 화합물은 하기 화학식을 나타내거나 그의 약제학적으로 허용되는 염일 수 있다:
R1-X-Z2-R2
상기 식에서,
R1은 수소, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 II의 펩티드를 갖거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Arg-Ala-Arg-Ala-Asp-Asp-Phe-Val-Ala-Trp-Leu-Lys-Glu-Ala(화합물 4), 또는
화학식 I과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 II와 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Lys, Asp, Glu이며;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되고;
위치 20의 잔기가 Gln, His, Lys, Arg, Glu로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 24의 잔기가 Gln, Leu, Glu, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Arg, Glu, Leu으로부터 선택되거나 존재하지 않고;
위치 28의 잔기가 Asn, Ser, Arg, Lys, Ala, Leu, Glu, Asp로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 서열이다.
일부 실시양태에서, X가 화학식 II와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 II와 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, His, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Glu, Lys, Arg으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Arg, Glu, Leu으로부터 선택되고;
위치 28의 잔기가 Asn, Ser, Arg, Lys, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다.
다른 실시양태에서, X는 잔기 27-Lys 및 28-Ser을 포함한다. 이런 경우에, X가 화학식 II와 상이한 경우, 하기 위치들 중 하나 또는 두 개의 위치에서 화학식 II와 추가로 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, His, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Glu, Lys, Arg으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다.
상기 기술된 임의의 실시양태에서, 위치 16 및 20의 잔기가 염 브릿지(salt bridge)를 형성할 수 있다. 적합한 잔기 쌍의 예는 하기를 포함한다:
16-Asp, 20-Lys;
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu; 및
16-Arg, 20-Glu.
상기 정의들과 일치를 이루면서, X가 하나 이상의 하기 잔기 세트를 포함하는 것이 바람직할 수 있다:
16-Arg;
16-Arg, 20-Asp;
16-Arg, 20-Asp, 24-Ala;
16-Arg, 20-Asp, 27-Lys, 28-Ser;
16-Arg, 20-Asp, 29-Ala;
16-Arg, 27-Lys, 28-Ser;
16-Arg, 27-Lys, 28-Ser, 29-Ala;
24-Ala, 27-Lys, 28-Ser;
24-Ala, 27-Lys, 28-Ser, 29-Ala;
24-Ala;
27-Lys;
28-Ser;
20-Glu, 28-Ser, 29-Thr;
24-Glu, 28-Ser, 29-Thr;
27-Glu, 28-Arg;
2-D-Ser, 28-Ser, 29-Thr; 또는
20-His, 28-Ser, 29-Thr.
예를 들어, X는 하기 서열을 가질 수 있다:
HSQGTFTSDYSKYLDRARADDFVAWLKSA; (화합물 5)
HSQGTFTSDYSKYLDRARADDFVAWLKEA; (화합물 6)
HSQGTFTSDYSKYLDRARAEDFVAWLKST; (화합물 7)
HSQGTFTSDYSKYLDRARADDFVEWLKST; (화합물 8)
HSQGTFTSDYSKYLDRARADDFVAWLERA; (화합물 9)
H-DSer-QGTFTSDYSKYLDRARADDFVAWLKST; (화합물 10)
HSQGTFTSDYSKYLDRARAHDFVAWLKST; (화합물 11) 또는
HSQGTFTSDYSKYLDRARADDFVAWLKST (화합물 12).
화학식 II로 정의된 펩티드는 펩티드 서열 X 내에 하나 이상의 분자내 브릿지를 수반할 수 있다. 이들 각 브릿지는 통상 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 적합하게 형성될 수 있다(즉, 아미노산 A 및 아미노산 A+4 사이).
더욱 특히, 브릿지는 잔기 쌍 12 및 16, 16 및 20, 17 및 21, 20 및 24, 또는 24 및 28의 측쇄 사이에 형성될 수 있다. 두 개의 측쇄가 이온 결합 또는 공유 결합을 통해 서로 연결될 수 있다. 따라서, 이들 잔기 쌍은 이온 결합에 의해 염 브릿지를 형성하기 위하여 반대 전하의 측쇄를 포함할 수 있다. 예를 들어, 잔기 중의 하나는 Glu 또는 Asp인 한편, 다른 하나는 Lys 또는 Arg일 수 있다. Lys 및 Glu 및 Lys 및 Asp의 짝짓기는 또한 반응에 의해 락탐환을 형성할 수 있다. 마찬가지로, Tyr 및 Glu 또는 Tyr 및 Asp는 락톤환을 형성할 수 있다.
특히, 위치 16 및 20의 잔기는 분자내 브릿지를 형성할 수 있다. 이들 위치에서의 적합한 잔기 쌍의 예는 하기를 포함한다:
16-Asp, 20-Lys;
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu; 및
16-Arg, 20-Glu.
화합물은 하기 화학식을 나타내거나 그의 약제학적으로 허용되는 염일 수 있다:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 III의 펩티드를 갖거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Leu-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Ile-Glu-Trp-Leu-Glu-Ser-Ala (화합물 13) 또는
화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly, Asp로부터 선택되며;
위치 17의 잔기가 Lys, Leu으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, His, Arg, Glu, Asp로부터 선택되고;
위치 21의 잔기가 Glu이며;
위치 23의 잔기가 Val, Leu으로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Leu으로부터 선택되거나 존재하지 않고;
위치 28의 잔기가 Asn, Arg, Lys, Glu, Ala, Leu, Asp로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이다.
일부 실시양태에서, X가 화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 17의 잔기가 Lys, Leu으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 23의 잔기가 Val, Leu으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys, Arg, Leu으로부터 선택되며;
위치 28의 잔기가 Asn, Arg, Lys, Glu, Ala, Leu으로부터 선택되고;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다.
일부 실시양태에서, X가 화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 17의 잔기가 Lys, Leu으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 23의 잔기가 Val, Leu으로부터 선택된다.
일부 실시양태에서, X가 화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 23의 잔기가 Val, Leu으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Leu으로부터 선택되고;
위치 28의 잔기가 Asn, Arg, Lys, Glu, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다.
상기 정의들과 일치를 이루면서, X가 하나 이상의 하기 잔기 세트를 포함하는 것이 바람직할 수 있다:
20-Lys, 24-Glu;
20-Lys, 24-Glu, 29-Ala;
20-Lys, 23-Ile, 24-Glu;
27-Glu, 28-Ser, 29-Ala;
29-Ala;
20-Gln;
23-Val;
24-Gln;
29-Thr;
27-Met, 28-Asn, 29-Thr;
20-Gln, 23-Val, 24-Gln;
20-Glu, 24-Lys; 또는
28-Arg.
예를 들어, X는 하기 서열을 가질 수 있다:
HSQGTFTSDYSLYLDSRRAQDFIEWLESA; (화합물 14)
HSQGTFTSDYSLYLDSRRAKDFVEWLESA; (화합물 15)
HSQGTFTSDYSLYLDSRRAKDFIQWLESA; (화합물 16)
HSQGTFTSDYSLYLDSRRAKDFIEWLEST; (화합물 17)
HSQGTFTSDYSLYLDSRRAKDFIEWLMNT; (화합물 18)
HSQGTFTSDYSLYLDSRRAQDFVQWLESA; (화합물 19)
HSQGTFTSDYSLYLDSRRAEDFIKWLESA; 또는 (화합물 20)
HSQGTFTSDYSLYLDSRRAKDFIEWLERA. (화합물 21)
화학식 III으로 정의된 펩티드는 펩티드 서열 X 내에 하나 이상의 분자내 브릿지를 수반할 수 있다. 이들 각 브릿지는 통상 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 적절하게 형성될 수 있다(즉, 아미노산 A 및 아미노산 A+4 사이).
더욱 특히, 브릿지는 잔기 쌍 16 및 20, 17 및 21, 20 및 24, 또는 24 및 28의 측쇄 사이에 형성될 수 있다. 두 개의 측쇄가 이온 결합 또는 공유 결합을 통해 서로 연결될 수 있다. 따라서, 이들 잔기 쌍은 이온 결합에 의해 염 브릿지를 형성하기 위하여 반대 전하의 측쇄를 포함할 수 있다. 예를 들어, 잔기 중의 하나는 Glu 또는 Asp인 한편, 다른 하나는 Lys 또는 Arg일 수 있다. Lys 및 Glu 및 Lys 및 Asp의 짝짓기는 또한 반응에 의해 락탐환을 형성할 수 있다. 마찬가지로, Tyr 및 Glu 또는 Tyr 및 Asp는 락톤환을 형성할 수 있다.
특히, 위치 20 및 24의 잔기는 분자내 브릿지를 형성할 수 있다. 이들 위치에서의 적합한 잔기 쌍의 예는 하기를 포함한다:
20-Asp, 24-Lys;
20-Glu, 24-Lys;
20-Asp, 24-Arg;
20-Glu, 24-Arg;
20-Lys, 24-Asp;
20-Arg, 24-Asp;
20-Lys, 24-Glu; 및
20-Arg, 24-Glu.
임의의 특정 이론에 구애되고자 하는 것은 아니나, 이러한 분자내 브릿지는 분자의 알파 나선 구조를 안정화시켜 GLP-1 수용체 및 또한 가능하게는 글루카곤 수용체에서의 효능 및/또는 선택성을 증가시키는 것으로 믿어진다.
화합물은 하기 화학식을 나타내거나 그의 약제학적으로 허용되는 염일 수 있다:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 IV의 펩티드를 갖거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Ile-Glu-Trp-Leu-Leu-Ser-Ala (화합물 22) 또는
화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이하며:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys, Arg으로부터 선택되며;
위치 18의 잔기가 Ala이고;
위치 20의 잔기가 Gln, Arg, Glu, Asp로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 23의 잔기가 Val이며;
위치 24의 잔기가 Gln, Asp, Lys, Arg, Ala으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys으로부터 선택되거나 존재하지 않으며;
위치 28의 잔기가 Asn, Arg, Lys, Ala, Glu, Asp로부터 선택되거나 존재하지 않고;
위치 29의 잔기가 Thr, Arg으로부터 선택되거나 존재하지 않으며;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 서열이다.
일부 실시양태에서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이할 수 있다:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys으로부터 선택되며;
위치 20의 잔기가 Gln, Arg, Glu로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys으로부터 선택되며;
위치 28의 잔기가 Asn, Arg, Ala으로부터 선택된다.
이들 실시양태의 일부에서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 3개 이하의 위치에서 화학식 IV와 상이할 수 있다:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys으로부터 선택되며;
위치 20의 잔기가 Gln, Arg, Glu로부터 선택된다.
대안적 실시양태에서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이할 수 있다:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys으로부터 선택되며;
위치 18의 잔기가 Ala이고;
위치 20의 잔기가 Gln, Arg, Glu로부터 선택된다.
추가의 대안적 실시양태에서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이할 수 있다:
위치 23의 잔기가 Val이며;
위치 24의 잔기가 Gln, Asp, Lys, Arg, Ala으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys으로부터 선택되며;
위치 28의 잔기가 Asn, Arg, Ala으로부터 선택된다.
상기 기술된 임의의 실시양태에서, 위치 16 및 20의 잔기가 염 브릿지를 형성할 수 있다. 적합한 잔기 쌍의 예는 하기를 포함한다:
16-Asp, 20-Lys;
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu;
16-Arg, 20-Glu.
추가로 또는 대안적으로, 위치 20 및 24의 잔기가 염 브릿지를 형성할 수 있다. 적합한 잔기 쌍의 예는 하기를 포함한다:
20-Asp, 24-Lys;
20-Glu, 24-Lys;
20-Asp, 24-Arg;
20-Glu, 24-Arg;
20-Lys, 24-Asp;
20-Arg, 24-Asp;
20-Lys, 24-Glu;
20-Arg, 24-Glu.
상기 정의들과 일치를 이루면서, X가 하나 이상의 하기 잔기 세트를 포함하는 것이 바람직할 수 있다:
20-Lys, 24-Glu;
20-Lys, 23-Ile, 24-Glu;
16-Glu, 20-Lys, 24-Glu;
16-Glu, 20-Lys;
16-Glu, 20-Lys, 29-Ala;
16-Glu, 20-Lys, 23-Ile, 24-Glu;
16-Glu, 20-Lys, 23-Ile, 24-Glu, 29-Ala;
16-Glu, 20-Lys, 24-Glu, 29-Ala;
20-Lys, 23-Ile, 24-Glu, 29-Ala;
27-Leu, 28-Ser, 29-Ala;
29-Ala;
16-Ser;
20-Gln;
23-Val;
24-Gln;
16-Ser, 20-Gln;
16-Asp, 20-Arg, 24-Asp;
16-Lys, 20-Glu;
24-Arg; 또는
28-Arg.
예를 들어, X는 하기 서열을 가질 수 있다:
HSQGTFTSDYSKYLDERRAQDFIEWLLSA; (화합물 23)
HSQGTFTSDYSKYLDERRAKDFVEWLLSA; (화합물 24)
HSQGTFTSDYSKYLDERRAKDFIQWLLSA; (화합물 25)
HSQGTFTSDYSKYLDSRRAQDFIEWLLSA; (화합물 26)
HSQGTFTSDYSKYLDDRRARDFIDWLLSA; (화합물 27)
HSQGTFTSDYSKYLDKRRAEDFIKWLLSA; (화합물 28)
HSQGTFTSDYSKYLDERRAKDFIRWLLSA; (화합물 29)
HSQGTFTSDYSKYLDERRAKDFIEWLLRA; (화합물 30)
HSQGTFTSDYSKYLDSRRAKDFIEWLLSA; (화합물 31)
HSQGTFTSDYSKYLDERAAKDFIEWLLSA; (화합물 32)
HSQGTFTSDYSKYLDERRAKDFIDWLLSA; (화합물 33)
HSQGTFTSDYSKYLDERRAKDFIEWLLAA; (화합물 34) 또는
HSQGTFTSDYSKYLDERRAKDFIEWLLSA (화합물 35).
화학식 IV로 정의된 펩티드는 펩티드 서열 X 내에 하나 이상의 분자내 브릿지를 수반할 수 있다. 이들 각 브릿지는 통상 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 적절하게 형성될 수 있다(즉, 아미노산 A 및 아미노산 A+4 사이).
더욱 특히, 브릿지는 잔기 쌍 12 및 16, 16 및 20, 17 및 21, 20 및 24, 또는 24 및 28의 측쇄 사이에 형성될 수 있다. 두 개의 측쇄가 이온 결합 또는 공유 결합을 통해 서로 연결될 수 있다. 따라서, 이들 잔기 쌍은 이온 결합에 의해 염 브릿지를 형성하기 위하여 반대 전하의 측쇄를 포함할 수 있다. 예를 들어, 잔기 중의 하나는 Glu 또는 Asp인 한편, 다른 하나는 Lys 또는 Arg일 수 있다. Lys 및 Glu 및 Lys 및 Asp의 짝짓기는 또한 반응에 의해 락탐환을 형성할 수 있다. 마찬가지로, Tyr 및 Glu 또는 Tyr 및 Asp는 락톤환을 형성할 수 있다.
특히, 위치 16 및 20, 및/또는 20 및 24의 잔기는 분자내 브릿지를 형성할 수 있다. 이들 위치에서의 적합한 잔기 쌍의 예는 하기를 포함한다:
16-Asp, 20-Lys;
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu;
16-Arg, 20-Glu; 및/또는
20-Asp, 24-Lys;
20-Glu, 24-Lys;
20-Asp, 24-Arg;
20-Glu, 24-Arg;
20-Lys, 24-Asp;
20-Arg, 24-Asp;
20-Lys, 24-Glu;
20-Arg, 24-Glu.
임의의 특정 이론에 구애되고자 하는 것은 아니나, 이러한 분자내 브릿지는 분자의 알파 나선 구조를 안정화시켜 GLP-1 수용체 및 또한 가능하게는 글루카곤 수용체에서의 효능 및/또는 선택성을 증가시키는 것으로 믿어진다.
화합물은 하기 화학식을 나타내거나 그의 약제학적으로 허용되는 염일 수 있다:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 V의 펩티드를 갖거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Lys-Ala-Ala-His-Asp-Phe-Val-Glu-Trp-Leu-Leu-Arg-Ala (화합물 36)
화학식 V와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 V와 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 12의 잔기가 Leu, Arg, Dpu, Dpr, Orn으로부터 선택되며;
위치 16의 잔기가 Arg, His, Lys, Glu, Asp으로부터 선택되고;
위치 17의 잔기가 Arg, Leu, Dpu, Dpr, Orn으로부터 선택되며;
위치 18의 잔기가 Arg, Lys, His, Ser, Tyr으로부터 선택되고;
위치 20의 잔기가 Gln, Lys, Arg, Glu, Asp로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되거나 존재하지 않고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu, Asp으로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이다.
이 측면의 특정 실시양태에서, X가 화학식 V와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 V와 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu로부터 선택되며;
위치 17의 잔기가 Arg, Leu으로부터 선택되고;
위치 18의 잔기가 Arg, Lys, His, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다.
이 측면의 특정 실시양태에서, X가 화학식 V와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 V와 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되며;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu으로부터 선택되고;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다.
상기 화학식 V에 관한 정의들과 일치를 이루면서, X가 하나 이상의 하기 잔기 세트를 포함하는 것이 바람직할 수 있다:
17-Lys, 18-Ala;
17-Leu, 18-Ala;
7-Lys, 18-Ala, 20-His;
17-Leu, 18-Ala, 20-His;
17-Lys, 18-Ala, 24-Glu;
17-Leu, 18-Ala, 24-Glu;
17-Lys, 18-Ala, 27-Leu;
17-Leu, 18-Ala, 27-Leu;
17-Lys, 18-Ala, 29-Ala;
17-Leu, 18-Ala, 29-Ala;
17-Lys, 18-Ala, 27-Leu, 29-Ala;
17-Leu, 18-Ala, 27-Leu, 29-Ala;
17-Lys, 18-Ala, 27-Leu, 28-Arg, 29-Ala;
17-Leu, 18-Ala, 27-Leu, 28-Arg, 29-Ala;
24-Glu, 28-Arg;
24-Glu, 28-Arg, 27-Leu;
24-Glu, 28-Arg, 27-Leu, 29-Ala;
27-Leu, 28-Arg, 29-Ala;
29-Ala;
20-Arg, 24-Arg, 27-Lys, 28-Leu;
17-Arg;
18-Arg;
20-Gln;
24-Gln;
27-Met, 28-Asn, 29-Thr; 또는
24-Lys
및 그의 조합.
예를 들어, X는 하기 서열을 가질 수 있다:
HSQGTFTSDYSKYLDSKAARDFVRWLKLA; (화합물 37)
HSQGTFTSDYSKYLDSRAAHDFVEWLLRA; (화합물 38)
HSQGTFTSDYSKYLDSKRAHDFVEWLLRA; (화합물 39)
HSQGTFTSDYSKYLDSKAAQDFVEWLLRA; (화합물 40)
HSQGTFTSDYSKYLDSKAAHDFVQWLLRA; (화합물 41)
HSQGTFTSDYSKYLDSKAAHDFVEWLMNT; (화합물 42)
HSQGTFTSDYSKYLDS AAHDFVKWLLRA; (화합물 43)
H-DSer-QGTFTSDYSKYLDSKAAHDFVEWLLRA; (화합물 44)
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLRA; (화합물 45)
HSQGTFTSDYSKYLDSKAAKDFVEWLLRA; (화합물 46)
HSQGTFTSDYSKYLDKKAAHDFVEWLLRA (화합물 47) 또는
HSQGTFTSDYSKYLDSKAAHDFVEWLLRA (화합물 48).
대안적인 측면에서, 화합물은 하기 화학식을 나타내거나 그의 약제학적으로 허용되는 염일 수 있다:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 VI의 펩티드를 갖거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Lys-Ala-Ala-His-Asp-Phe-Val-Glu-Trp-Leu-Leu-Arg-Ala (화합물 49), 또는
화학식 VI와 상이한 경우, 하기 위치들 중 5개 이하의 위치에서 화학식 VI와 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu로부터 선택되며;
위치 17의 잔기가 Arg, Leu, Dpu, Dpr, Orn으로부터 선택되고;
위치 20의 잔기가 Gln, Lys, Arg, Glu, Asp로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되거나 존재하지 않고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu, Asp로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이다.
이 측면의 특정 실시양태에서, X가 화학식 VI와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 VI와 상이할 수 있다:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 17의 잔기가 Arg, Leu으로부터 선택되고;
위치 18의 잔기가 Arg, Lys, His, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다.
상기 화학식 VI에 관한 정의들과 일치를 이루면서, X가 제1 측면에 관한 임의의 상기 잔기 세트 또는 하나 이상의 하기 잔기 세트를 포함하는 것이 바람직할 수 있다:
20-Gln, 24-Gln, 27-Met, 28-Asn, 29-Thr; 또는
17-Leu, 20-Gln, 24-Gln, 28-Asn, 29-Thr.
X는 하기 서열을 가질 수 있다:
HSQGTFTSDYSKYLDSKAAQDFVQWLMNT (화합물 50) 또는
HSQGTFTSDYSKYLDSLAAQDFVQWLLNT (화합물 51).
화학식 V 및 VI로 정의된 펩티드는 펩티드 서열 X 내에 하나 이상의 분자내 브릿지를 수반할 수 있다. 이들 각 브릿지는 통상 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 적절하게 형성될 수 있다(즉, 아미노산 A 및 아미노산 A+4 사이).
더욱 특히, 브릿지는 잔기 쌍 12 및 16, 16 및 20, 17 및 21, 20 및 24, 또는 24 및 28의 측쇄 사이에 형성될 수 있다. 두 개의 측쇄가 이온 결합 또는 공유 결합을 통해 서로 연결될 수 있다. 따라서, 이들 잔기 쌍은 이온 결합에 의해 염 브릿지를 형성하기 위하여 반대 전하의 측쇄를 포함할 수 있다. 예를 들어, 잔기 중의 하나는 Glu 또는 Asp인 한편, 다른 하나는 Lys 또는 Arg일 수 있다. Lys 및 Glu 및 Lys 및 Asp의 짝짓기는 또한 반응에 의해 락탐환을 형성할 수 있다. 마찬가지로, Tyr 및 Glu 또는 Tyr 및 Asp는 락톤환을 형성할 수 있다.
특히, 위치 16 및 20의 잔기는 분자내 브릿지를 형성할 수 있다. 이들 위치에서의 적합한 잔기 쌍의 예는 하기를 포함한다:
16-Asp, 20-Lys;
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu; 및
16-Arg, 20-Glu.
임의의 특정 이론에 구애되고자 하는 것은 아니나, 이러한 분자내 브릿지는 분자의 알파 나선 구조를 안정화시켜 GLP-1 수용체 및 또한 가능하게는 글루카곤 수용체에서의 효능 및/또는 선택성을 증가시키는 것으로 믿어진다.
임의의 특정 이론에 구애되고자 하는 것은 아니나, 천연 글루카곤의 위치 17 및 18에서의 아르기닌 잔기는 글루카곤 수용체에 대해 상당한 선택성을 제공하는 것으로 보인다. 위치 18에서의 소수성 잔기(예를 들어, Ala)도 GLP-1 및 글루카곤 수용체 둘 다에서의 효능을 증가시킬 수 있다. 이는 또한 천연 글루카곤과 비교하여 효소적 안정성을 증가시킬 수 있다.
임의의 특정 이론에 구애되고자 하는 것은 아니나, 천연 글루카곤의 위치 27, 28 및 29의 잔기들이 글루카곤 수용체에 대해 상당한 선택성을 제공하는 것으로 보인다. 천연 글루카곤 서열 대비 이들 위치의 하나, 둘 또는 세 개 전부에서의 치환은 잠재적으로 글루카곤 수용체에서의 효능의 유의한 감소 없이 GLP-1 수용체에 대한 선택성 및/또는 효능을 증가시킬 수 있다. 특정 실시예는 위치 27에서 Leu 또는 Lys을 포함하고, 위치 28에서 Arg 또는 Ser을 포함하며, 위치 29에서 Ala을 포함한다.
위치 27에서의 천연-발생 Met 잔기의 치환(예를 들어, Leu, Lys, Arg 또는 Glu에 의해)은 또한 산화 가능성을 감소시키며, 따라서 본 화합물의 화학적 안정성을 증가시킨다.
위치 28에서의 천연-발생 Asn 잔기의 치환(예를 들어, Glu, Ser, Arg, Lys, Ala 또는 Leu에 의해)은 또한 산성 용액에서의 탈아미드화 가능성을 감소시키며, 따라서 화합물의 화학적 안정성을 증가시킨다.
GLP-1 수용체에서의 효능 및/또는 선택성도, 잠재적으로 글루카곤 수용체에서의 효능의 유의적인 손실 없이, 양쪽성 나선 구조를 형성하기 쉬운 잔기의 도입에 의해 증가할 수 있다. 이는 하나 이상의 위치 16, 20, 24 및 28에 하전된 잔기를 도입함으로써 달성될 수 있다. 위치 16 및 20의 잔기 모두 하전되거나, 위치 16, 20 및 28의 잔기 모두 하전되거나, 위치 16, 20, 24 및 28의 잔기 모두 하전될 수 있다. 위치 16 및 20의 하전된 잔기의 존재는 이들이 분자내 브릿지를 형성할 수 있는 경우, 예를 들어, 이들이 위치 16의 Arg 및 위치 20의 Asp 또는 Glu이거나 위치 16의 Glu 및 위치 20의 His 또는 Lys과 같이 정반대로 하전된 아미노산인 경우 특히 바람직할 수 있다.
위치 20 및 24에서 천연-발생 Gln 잔기의 하나 또는 둘 다를 치환하면 산성 용액에서의 탈아미드화 가능성을 감소시키며, 이에 따라 본 화합물의 화학적 안정성을 증가시킨다. 예를 들어, 본 화합물은 위치 20에 Asp 또는 His 및 위치 24에 Ala을 가지고, 임의로 위치 28에 Ser, Glu 또는 Arg을 가질 수 있다.
화합물은 하기 화학식을 나타내거나 그의 약제학적으로 허용되는 염 또는 유도체일 수 있다:
R1-X-Z1-Z2-R2
상기 식에서
R1은 수소, C1 -4 알킬 (예를 들어, 메틸), 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
X는 하기 화학식 VII을 가지며:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-X10-Ser-X12-Tyr-Leu-X15-X16-X17-X18-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29
여기에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, 알파,알파-디메틸 이미다졸 아세트산(DMIA), N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, 아미노이소부티르산 (Aib) 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X10은 Tyr 또는 Trp이며;
X12는 Lys, 시트룰린, Orn 또는 Arg이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X17은 Arg, Gln, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X18은 Arg, Ala, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Gln, Glu, Asp, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X24는 Ala, Gln, Glu, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Arg, 시트룰린, Orn, Lys 또는 Asp이고;
X29은 Thr, Gly, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
R2는 NH2 또는 OH이고;
Z1은 존재하지 않거나 하기 서열을 가지며:
GlyProSerSerGlyAlaProProProSer;
GlyProSerSerGlyAlaProProProSerCys;
LysArgAsnArgAsnAsnIleAla; 또는
LysArgAsnArg;
Z2는 존재하지 않거나, Ala, Leu, Ser, Thr, Tyr, Asn, Gln, Asp, Glu, Lys, Arg, His, Met, Har, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이고;
여기에서,
Z1이 존재하지 않는 경우, 화합물은 하나 이상의 X1, X2, X3, X10, X12, X15, X16, X17, X18, X20, X21, X23, X24, X27, X28 및 X29 위치에서 인간 글루카곤과 비교하여 치환 또는 결실을 갖고;
여기에서 상기 화합물은 인간 글루카곤보다 높은 GLP-1 수용체 선택성을 가지고/가지거나 화합물은 GLP-1 수용체에서 천연 GLP-1 활성의 적어도 20%를 나타낸다.
또한, 특정 실시양태에서, X는 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 24, 27, 28 및 29 중에서 선택된 위치에서 1 내지 3개 아미노산 변형에 의해 화학식 VII과 상이할 수 있다.
화학식 VII에 따른 서열을 갖는 화합물이 국제 특허 출원 공개 WO2008/101017호에 기재되어 있다.
X는 화학식 VII.2를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-X17-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr (화합물 52)
여기에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X17은 Arg, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.3을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-X21-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr (화합물 53)
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X21은 Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.4를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-X21-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr (화합물 54)
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X24는 Gln, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.5를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-X21-Phe-Val-X24-Trp-Leu-X27-Asn-Thr (화합물 55)
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X21은 Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X24는 Gln, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.6를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-X21-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr (화합물 56)
상기 식에서
X21은 Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.7을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-X24-Trp-Leu-X27-Asn-Thr (화합물 57)
상기 식에서
X24는 Gln, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.8을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (화합물 58)
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이다.
X는 화학식 VII.9을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr (화합물 59)
상기 식에서
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.19을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr-X30 (화합물 60)
상기 식에서
X30는 임의의 적합한 아미노산이다.
X는 화학식 VII.20를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29 (화합물 61)
상기 식에서
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X24는 Gln 또는 Glu이고;
X28은 Asn, Asp 또는 Lys이며;
X29은 Thr 또는 Gly이다.
X는 화학식 VII.21을 가질 수 있다:
His-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg- Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (화합물 62)
상기 식에서
X2는 D-Ser, Ala, Gly, N-메틸 Ser 또는 아미노이소부티르산이다.
X는 화학식 VII.22를 가질 수 있다:
His-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg- Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (화합물 63)
상기 식에서
X2는 아미노이소부티르산이다.
X는 화학식 VII.23를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Cys-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr (화합물 64)
상기 식에서
위치 17의 Cys은 PEG화 되어 있고;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.24를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Cys-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr (화합물 65)
상기 식에서
위치 21의 Cys는 PEG화 되어 있고;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.25를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Cys-Trp-Leu-X27-Asn-Thr (화합물 66)
상기 식에서
위치 24의 Cys는 PEG화 되어 있고;
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.30를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser (화합물 67)
상기 식에서
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.31을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala (화합물 68)
상기 식에서
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.32를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr-Lys-Arg-Asn-Arg (화합물 69)
상기 식에서
X27은 Met, Leu 또는 Nle이다.
X는 화학식 VII.33를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29 (화합물 70)
상기 식에서
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이고;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이며;
X20는 Gln 또는 Lys이고;
X24는 Gln 또는 Glu이며;
X28은 Asn, Lys 또는 산성 아미노산이고;
X29은 Thr, Gly 또는 산성 아미노산이다.
X는 화학식 VII.36를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser. (화합물 71)
X는 화학식 VII.37을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Cys-Trp-Leu-Met-Asn-Thr (화합물 72)
상기 식에서 24 2-부티로락톤은 Cys의 티올기를 통해 결합된다.
X는 화학식 VII.38을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Cys-Trp-Leu-Met-Asn-Thr (화합물 73)
상기 식에서 24 카복시메틸기는 Cys의 티올기를 통해 결합된다.
X는 화학식 VII.39을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Arg-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser. (화합물 74)
X는 화학식 VII.40를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-Thr (화합물 75)
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이다.
X는 화학식 VII.41을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-Thr (화합물 76)
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이며;
락탐환은 위치 12 및 16의 측쇄 사이에 존재한다.
X는 화학식 VII.42를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-Thr (화합물 77)
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이며;
락탐환은 위치 16 및 20의 측쇄 사이에 존재한다.
X는 화학식 VII.43를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-X28-Thr (화합물 78)
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이며;
락탐환은 위치 20 및 24의 측쇄 사이에 존재한다.
X는 화학식 VII.44를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-X29 (화합물 79)
상기 식에서
X15은 Glu 또는 Asp이고;
X29은 Glu 또는 Thr이다.
상기 화학식에서 Z1 및 Z2는 통상 존재하지 않는다. 화합물의 C-말단은 아미드화될 수 있다(R2 = NH2).
X는 화학식 VII.45를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29 (화합물 80)
상기 식에서
X12는 Lys 또는 Glu이고;
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이며;
X16은 Ser, Gln, Glu, Lys, 호모글루탐산, 시스테인산 또는 호모시스테인산이고;
X20는 Gln, Glu 또는 Lys이며;
X24는 Gln, Lys 또는 Glu이고;
X28은 Asn, Lys 또는 산성 아미노산이며;
X29은 Thr, Gly 또는 산성 아미노산이다.
X는 화학식 VII.46를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-Asn-Thr (화합물 81)
상기 식에서
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln 또는 Lys이며;
X24는 Gln 또는 Glu이다.
X는 화학식 VII.47을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr. (화합물 82)
X는 화학식 VII.48을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr. (화합물 83)
X는 화학식 VII.49를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr. (화합물 84)
X는 화학식 VII.50를 가질 수 있다:
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly (화합물 85)
X는 화학식 VII.51를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-X21-Phe-Val-X24-Trp-Leu-Met-X28-X29 (화합물 86)
상기 식에서
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Asp, Glu, 호모글루탐산 또는 호모시스테인산이고;
X24는 Gln 또는 Glu이며;
X28은 Asn, Lys 또는 산성 아미노산이고;
X29은 Thr, Gly 또는 산성 아미노산이다.
X는 화학식 VII.52를 가질 수 있다:
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg. (화합물 87)
X는 화학식 VII.53를 가질 수 있다:
His-Ser-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Xl6-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29 (화합물 88)
상기 식에서
X3는 Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln 또는 Lys이며;
X24는 Gln 또는 Glu이고;
X28은 Asn, Lys 또는 산성 아미노산이며;
X29는 Thr 또는 산성 아미노산이다.
X는 화학식 VII.54를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-X17-X18-Ala-Lys-X21-Phe-X23-X24-Trp-Leu-Met-Asn-Thr (화합물 89)
상기 식에서
X17은 Arg 또는 Gln이고;
X18은 Arg 또는 Ala이며;
X21은 Asp 또는 Glu이고;
X23는 Val 또는 Ile이며;
X24는 Gln 또는 Ala이다.
X는 화학식 VII.56을 가질 수 있다:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29 (화합물 90)
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X24는 Ala, Gln, Glu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Lys 또는 Asp이고;
X29은 Thr, Gly, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이다.
X는 화학식 VII.57을 가질 수 있다:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29 (화합물 91)
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이고;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X23는 Val 또는 Ile이고;
X24는 Ala, Gln, Glu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이고;
X28은 Asn, Lys 또는 Asp이며;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고, 여기에서 락탐 브릿지는 위치 12 및 16의 측쇄 사이에 존재한다.
X는 화학식 VII.58을 가질 수 있다:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Lys-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29 (화합물 92)
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X24는 Ala, Gln, Glu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Lys 또는 Asp이고;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며, 여기에서 락탐 브릿지는 위치 16 및 20의 측쇄 사이에 존재한다.
X는 화학식 VII.59를 가질 수 있다:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-Lys-X21-Phe-X23-Glu-Trp-Leu-X27-X28-X29 (화합물 93)
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X23는 Val 또는 Ile이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Lys 또는 Asp이고;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며, 여기에서 락탐 브릿지는 위치 20 및 24의 측쇄 사이에 존재한다.
X는 화학식 VII.60을 가질 수 있다:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-X21-Phe-X23-Glu-Trp-Leu-X27-Lys-X29 (화합물 94)
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X27은 Met, Leu 또는 Nle이고;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며, 여기에서 락탐 브릿지는 위치 24 및 28의 측쇄 사이에 존재한다.
X-Z1은 화학식 VII.61을 가질 수 있다:
X1-X2-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-X18-Ala-Lys-Asp-Phe-Val-X24-Trp-Leu-Met-Asn-X29-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys (화합물 95)
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, Val, Gly, N-메틸 Ser, Aib, N-메틸 Ala 또는 D-Ala이며;
X18은 Ala 또는 Arg이고;
X24는 Ala, Gln 또는 Cys-PEG이며;
X29은 Thr-CONH2, Cys-PEG, 또는 Gly이고;
위치 40은 Cys-PEG이거나 존재하지 않으며;
단, 위치 30 내지 40(Z2)은 위치 29가 Gly인 경우에만 존재한다.
X-Z1은 화학식 VII.62를 가질 수 있다:
X1-X2-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Gln-X18-Ala-Lys-Glu-Phe-Ile-X24-Trp-Leu-Met-Asn-X29-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys (화합물 96)
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, Val, Gly, N-메틸 Ser, Aib, N-메틸 Ala 또는 D-Ala이며;
X18은 Ala 또는 Arg이고;
X24는 Ala, Gln 또는 Cys-PEG이며;
X29은 Thr-CONH2, Cys-PEG 또는 Gly이고;
위치 40은 Cys-PEG이거나 존재하지 않으며;
단, 위치 30 내지 40(Z2)은 위치 29가 Gly인 경우에만 존재한다.
X는 화학식 VII.63을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-X20-X21-Phe-Val-X24-Trp-Leu-X27-Asp-Thr (화합물 97)
상기 식에서
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln 또는 Lys이며;
X21은 Asp, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X24는 Gln, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다.
X-Z1는 화학식 VII.64를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-Gly-Gly-Pro-Ser-Ser-Gly-Pro-Pro-Pro-Ser (화합물 98)
상기 식에서
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이고;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이며;
X20는 Gln 또는 Lys이고;
X24는 Gln 또는 Glu이며;
X28은 Asn, Lys 또는 Asp이다.
X는 화학식 VII.66를 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-X29 (화합물 99)
상기 식에서
X28은 Asp 또는 Asn이고;
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 12 및 16의 측쇄 사이에 존재한다.
X는 화학식 VII.67을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-X29 (화합물 100)
상기 식에서
X28은 Asp 또는 Asn이고;
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 16 및 20의 측쇄 사이에 존재한다.
X는 화학식 VII.68을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-X28-X29 (화합물 101)
상기 식에서
X28은 Asp 또는 Asn이고;
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 20 및 24의 측쇄 사이에 존재한다.
X는 화학식 VII.69을 가질 수 있다:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-X29 (화합물 102)
상기 식에서
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 24 및 28의 측쇄 사이에 존재한다.
본 발명의 방법에 유용할 수 있는 추가의 특이적 화합물은 도 3a-3o: 표 2 및 표 3에 나타낸다.
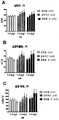
도 1: A: 인슐린-저항성 (IR) JCR: LA 랫트 심장에서의 심박수; B: IR 심장에서의 심장박출량; C: IR 심장에서의 심장 파워에 대한 비히클, 글루카곤 및 글루카곤-GLP1 이중 작용제(화합물 12)의 효과. 수치들은 평균+SEM으로 나타낸다. 기준선과 비교하여 * P < 0.05; ** P < 0.01이다.
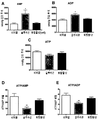
도 2: 비히클 (n=4), 글루카곤 (n=6) 및 글루카곤-GLP1 이중 작용제(화합물 12) (n=5)의 농도를 증가시켜 관류한 후 인슐린-저항성 (IR) JCR: LA 랫트 유래 심장의 에너지 상태. A: 아데노신 모노포스페이트(AMP) 농도. B: 아데노신 디포스페이트(ADP) 농도. C: 아데노신 트리포스페이트(ATP) 농도. D: ATP/AMP 비율. E: ATP/ADP 비율. 수치들은 평균+SEM으로 나타낸다. 비히클과 비교하여 * P < 0.05; ** P < 0.01이다.
도 3a-3o: 본 발명에 따라 유용하게 사용될 수 있는 서열을 갖는 화합물의 표(표 2)를 보여준다.
도 4: 화합물 1 또는 글루카곤-GLP-1 이중 작용제가 주입된 각각의 화합물에 대한 개별 데이터로부터 계산된 박출 활동(stroke work). 투여량은 nmol/kg/분으로 표시되고 각 도면 위에 표시된다. 최대 40%의 박출 활동 증가를 종말점으로 잡았으며, 그 이후에 주입을 중단하였다.
도 5: 화합물 1 또는 글루카곤-GLP-1 이중 작용제가 주입된 각각의 화합물에 대한 개별 데이터로부터 계산된 심박수. 투여량은 nmol/kg/분으로 표시되고 각 도면 위에 표시된다. 최대 40%의 박출 활동 증가(도 4)를 종말점으로 잡았으며, 그 이후에 주입을 중단하였다.
도 6a-6c: 본 발명에 따라 유용하게 사용될 수 있는 서열을 갖는 화합물의 표(표 3)를 보여준다.
도 2: 비히클 (n=4), 글루카곤 (n=6) 및 글루카곤-GLP1 이중 작용제(화합물 12) (n=5)의 농도를 증가시켜 관류한 후 인슐린-저항성 (IR) JCR: LA 랫트 유래 심장의 에너지 상태. A: 아데노신 모노포스페이트(AMP) 농도. B: 아데노신 디포스페이트(ADP) 농도. C: 아데노신 트리포스페이트(ATP) 농도. D: ATP/AMP 비율. E: ATP/ADP 비율. 수치들은 평균+SEM으로 나타낸다. 비히클과 비교하여 * P < 0.05; ** P < 0.01이다.
도 3a-3o: 본 발명에 따라 유용하게 사용될 수 있는 서열을 갖는 화합물의 표(표 2)를 보여준다.
도 4: 화합물 1 또는 글루카곤-GLP-1 이중 작용제가 주입된 각각의 화합물에 대한 개별 데이터로부터 계산된 박출 활동(stroke work). 투여량은 nmol/kg/분으로 표시되고 각 도면 위에 표시된다. 최대 40%의 박출 활동 증가를 종말점으로 잡았으며, 그 이후에 주입을 중단하였다.
도 5: 화합물 1 또는 글루카곤-GLP-1 이중 작용제가 주입된 각각의 화합물에 대한 개별 데이터로부터 계산된 심박수. 투여량은 nmol/kg/분으로 표시되고 각 도면 위에 표시된다. 최대 40%의 박출 활동 증가(도 4)를 종말점으로 잡았으며, 그 이후에 주입을 중단하였다.
도 6a-6c: 본 발명에 따라 유용하게 사용될 수 있는 서열을 갖는 화합물의 표(표 3)를 보여준다.
본 명세서를 통해, 천연 발생 아미노산에 대한 통상의 1문자 및 3문자 코드를 사용하였으며, 또한 기타 아미노산, 예를 들어, Aib(α-아미노이소부티르산), Orn(오르니틴), Dbu(2,4-디아미노부티르산) 및 Dpr(2,3-디아미노프로파노산), Cit(시트룰린), 1Nal(1-나프틸알라닌), Hph(호모페닐알라닌), Hse(호모세린) 및 Orn(오르니틴)에 대해서도 일반적으로 허용되는 3문자 코드를 사용하였다.
본 발명과 관련하여, C1 -6 알킬 및 C1 -4 알킬은 메틸, 에틸, 1-프로필 및 2-프로필을 포함한다.
본 발명과 관련하여, "양성 수축촉진제"의 표현은 심근수축성의 힘과 속도를 증가시키는, 즉, 심근수축성을 개선하는 제제를 나타낸다.
용어 "천연 글루카곤"은 H-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-OH의 서열을 갖는 천연 인간 글루카곤이다.
용어 "옥신토모둘린" 및 "OXM"은 H-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala-OH의 서열을 갖는 천연 인간 옥신토모둘린이다.
본 발명의 화합물의 특정 실시양태에서 아미노산 잔기 X3가 3-(헤테로사이클릴)알라닐[즉, 3-(헤테로사이클릴)-치환된 알라닌 유래의 아미노산 잔기]인 경우, X3는 3-(2-푸릴)알라닐, 3-(4-티아졸릴)알라닐, 3-(3-피리딜)알라닐, 3-(4-피리딜)알라닐, 3-(1-피라졸릴)알라닐, 3-(2-티에닐)알라닐, 3-(3-티에닐)알라닐 및 3-(1,2,4-트리아졸-1-일)알라닐로 구성된 그룹 중에서 선택될 수 있다.
펩티드 서열 X
명확을 기하기 위하여, 상기 정의에서, X 서열은 변화를 허용하는 것으로 언급된 위치에서만 주어진 화학식과 상이한 것으로 일반적으로 의도된다. 본 명세서에 기재된 서열 X 내의 아미노산은 통상 N-말단에서 C-말단 방향으로 1 내지 29까지 연속적으로 번호가 매겨지는 것으로 간주될 수 있다. X 내의 "위치"는 이에 따라 해석되어야 하며, 마찬가지로 천연 인간 글루카곤 및 기타 분자 내에서도 위치가 참조되어야 한다.
본 명세서에 제공된 임의의 화학식에서, 위치 X3의 잔기는 대안적으로 아세트아미도메틸-시스테인, 아세틸디아미노부타노산, 카바모일디아미노프로파노산, 메틸글루타민 및 메티오닌 설폭사이드 중에서 선택될 수 있다.
상기 제시된 특정 화학식에서 위치 X27, X28 및/또는 X29의 잔기는 존재하지 않을 수 있다. 통상, X28이 존재하지 않으면, X29도 존재하지 않는다. X27이 존재하지 않으면, X28 및 X28도 둘 다 존재하지 않는다. 즉, X29이 존재하면 X28도 존재할 것이며, X28 및 X29 중의 어느 하나가 존재하면 X27도 존재할 것이다.
Z1이 존재하지 않는 경우, 펩티드 서열 X는 글루카곤의 유사체로 간주될 수 있다. 이러한 실시양태에서, 펩티드 서열 X는 29개 위치의 하나 이상에서, 예를 들어 29개 위치의 최소 2개에서, 예를 들어, 29개 위치의 최소 3, 4, 5, 6개에서 천연 인간 글루카곤 서열과 상이하다.
특정 실시양태에서, X가 단지 1개 위치에서 인간 글루카곤과 상이하면, 그 위치는 X12, X17 또는 X18일 수 있다.
X12의 잔기는 Ala 또는 Arg일 수 있다.
X17의 잔기는 Glu 또는 Lys일 수 있다.
X18의 잔기는 His, Ser, Ala 또는 Tyr일 수 있다.
따라서 펩티드 X는 하기 서열을 가질 수 있다:
HSQGTFTSDYSAYLDSRRAQDFVQWLMNT; (화합물 103)
HSQGTFTSDYSRYLDSRRAQDFVQWLMNT; (화합물 104)
HSQGTFTSDYSKYLDSERAQDFVQWLMNT; (화합물 106)
HSQGTFTSDYSKYLDSKRAQDFVQWLMNT; (화합물 107)
HSQGTFTSDYSKYLDSRHAQDFVQWLMNT; (화합물 108)
HSQGTFTSDYSKYLDSRSAQDFVQWLMNT; (화합물 109)
HSQGTFTSDYSKYLDSRAAQDFVQWLMNT; (화합물 110) 또는
HSQGTFTSDYSKYLDSRYAQDFVQWLMNT. (화합물 111)
인간 글루카곤과 2 또는 3개 상이점을 갖는 서열은 하기를 포함한다:
HSQGTFTSDYSRYLDSRRAKDFVQWLLNT; (화합물 112)
HSQGTFTSDYSRYLDSRRAQDFVQWLLNT; (화합물 113)
HSQGTFTSDYSRYLDSRRAQDFVQWLLNK; (화합물 114)
HSQGTFTSDYSKYLDSALAQDFVQWLLNT; (화합물 115)
HSQGTFTSDYSKYLDKRRAEDFVQWLMNT; (화합물 116)
HSQGTFTSDYSKYLDK()RRAE()DFVQWLMNT; (화합물 117)
HSQGTFTSDYSRYLDERRAQDFVQWLMNT; (화합물 118)
HSQGTFTSDYSK()YLDE()RRAQDFVQWLMNT; (화합물 119)
HSQGTFTSDYSKYLDSRRAQDFIEWLMNT; (화합물 120) 및
HSQGTFTSDYSKYLDSKAAQDFVQWLMNT; (화합물 121)
HSQGTFTSDYSKYLDSLAAQDFVQWLLNT. (화합물 122)
Z1이 존재하건 존재하지 않건, 펩티드 서열 X가 29개 위치의 최대 10개 위치, 예를 들어, 최대 7, 8, 9 또는 10개 위치에서 인간 글루카곤과 상이한 것이 바람직할 수 있다.
Z
1
Z1은 하기 서열을 가질 수 있다:
천연 엑센딘-4의 C-말단 10개 아미노산을 나타내는, GlyProSerSerGlyAlaProProProSer;
천연 엑센딘-4의 C-말단 10개 아미노산과 추가의 C-말단 Cys 잔기를 나타내는, GlyProSerSerGlyAlaProProProSerCys,
천연 옥신토모둘린의 C-말단 8개 아미노산을 나타내는, LysArgAsnArgAsnAsnIleAla; 또는
LysArgAsnArg.
Z
2
예를 들어, 글루카곤 유사체 펩티드의 입체구조(conformation) 및/또는 이차 구조를 안정화시키기 위하여, 및/또는 글루카곤 유사체 펩티드가 효소적 가수분해에 대해 더욱 저항성을 갖도록 하기 위하여, 예를 들어, 국제 특허 출원 공개 WO99/46283호에 기술된 바와 같이, 화합물은 1-20개 아미노산의 C-말단 펩티드 서열 Z2를 포함할 수 있다.
존재하는 경우, Z2는 1-20개 아미노산 잔기, 예를 들어, 1-15개 범위, 더욱 바람직하게는 1-10개 범위, 특히 1-7개 아미노산 잔기 범위, 예를 들어, 1, 2, 3, 4, 5, 6 또는 7개 아미노산 잔기, 예를 들어, 6개 아미노산 잔기의 펩티드 서열을 나타낸다. 펩티드 서열 Z2 내의 각각의 아미노산 잔기는 독립적으로 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu(2,4-디아미노부티르산), Dpr(2,3-디아미노프로파노산) 및 Orn(오르니틴) 중에서 선택될 수 있다. 바람직하게는, 아미노산 잔기가 Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn 중에서 선택되고, 더욱 바람직하게는 전적으로 Glu, Lys 및 Cys 중에서 선택될 수 있으며, 특히 Lys이다. 상기 아미노산은 D- 또는 L-배치(configuration)를 가질 수 있으나, 바람직하게는 L-배치를 가진다. Z2의 특히 바람직한 서열은 4, 5, 6 또는 7개 연속적인 리신 잔기(즉, Lys3, Lys4, Lys5, Lys6 또는 Lys7), 및 특히 5 또는 6개 연속적인 리신 잔기의 서열이다. 기타 예시적인 Z 서열은 그 내용이 참조로 본 명세서에 포함된 국제 특허 출원 공개 WO01/04156호에서 볼 수 있다. 대안적으로, 서열 Z2의 C-말단 잔기는 Cys 잔기일 수 있다. 이는 화합물의 변형, 예를 들어, 하기 친유성 치환체 또는 중합체성 부위와의 컨쥬게이션을 보조할 수 있다. 이러한 실시양태에서, 서열 Z2는 예를 들어 단지 1개 아미노산 길이(즉, Z2=Cys) 또는 2, 3, 4, 5, 6 또는 더 많은 아미노산 길이일 수 있다. 따라서 다른 아미노산들은 펩티드 X와 말단 Cys 잔기 사이의 스페이서로 작용한다. 이러한 실시양태에서 Z1는 존재하지 않을 수 있다.
일부 실시양태에서, 펩티드 서열 Z2는 인간 OXM의 IP-1 부분의 상응하는 서열(이는 Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala 서열을 갖는다)과 25% 이하의 아미노산 서열 동일성을 갖는다.
다른 폴리펩티드 서열(예를 들어, IP-1)에 대한 소정의 펩티드 또는 폴리펩티드 서열의 "퍼센트(%) 아미노산 서열 동일성"은 두 개의 서열이 서로 정렬되고 필요한 경우 최적의 정렬을 위해 갭(gap)을 도입하였을 때 다른 폴리펩티드의 상응하는 서열 내의 상응하는 아미노산 잔기와 동일한 소정의 펩티드 서열 내의 아미노산 잔기의 퍼센트로서 계산된다. % 동일성 수치는 WU-BLAST-2 (Altschul et al., Methods in Enzymology, 266:460-480 (1996))에 의해 결정될 수 있다. WU-BLAST-2는 여러가지 검색 파라미터를 사용하며, 이들 중의 대부분은 디폴트 수치로 세팅되어 있다. 조정가능한 파라미터들은 하기 수치로 세팅된다: 오버랩 스팬 = 1, 오버랩 분획 = 0.125, 단어 기준점(word threshold)(T) = 11. % 아미노산 서열 동일성 수치는 WU-BLAST-2에 의해 결정된, 필적하는 동일 잔기의 수를 기준 서열의 총 잔기 수로 나누고(정렬 스코어를 최대화하기 위하여 기준 서열 내로 WU-BLAST-2에 의해 도입된 갭은 무시함) 여기에 100을 곱하여 결정한다.
따라서, Z2가 IP-1의 8개 아미노산과 최적으로 정렬되는 경우, 이는 IP-1의 상응하는 아미노산과 2개 이하의 아미노산이 동일하다.
아미노산 변형
본 발명에서 사용하기에 적합한 임의의 화합물에서 하나 이상의 아미노산 측쇄는 친유성 치환체에 컨쥬게이트 될 수 있다. 친유성 치환체는 아미노산 측쇄 내의 원자에 공유적으로 결합될 수 있거나, 대안적으로 스페이서에 의해 아미노산 측쇄와 컨쥬게이트 될 수 있다. 아미노산은 펩티드 X의 부분이거나, 펩티드 Z1 또는 Z2의 부분일 수 있다. 스페이서가 존재하는 경우 이는 화합물의 나머지와 친유성 치환체 사이에 공간을 제공하기 위하여 사용된다.
이론에 구애되고자 하는 것은 아니나, 친유성 치환체는 혈류 중의 알부민과 결합하며 이에 따라 본 발명의 화합물을 효소 분해로부터 보호하여 화합물의 반감기를 증진시킬 수 있는 것으로 생각된다. 따라서 이런 방식으로 변형된 화합물은 만성 치료의 경우에 특히 적합할 수 있다.
친유성 치환체는 에스테르, 설포닐 에스테르, 티오에스테르, 아미드 또는 설폰아미드를 통해 아미노산 측쇄 또는 스페이서에 결합할 수 있다. 따라서 친유성 치환체가 바람직하게는 에스테르, 설포닐 에스테르, 티오에스테르, 아미드 또는 설폰아미드의 부분을 형성하는 S 원자, O 원자, N 원자, 설포닐기 또는 아실기를 포함하는 것이 이해될 것이다. 바람직하게는, 친유성 치환체 내의 아실기가 아미노산 측쇄 또는 스페이서와의 아미드 또는 에스테르의 부분을 형성한다.
친유성 치환체는 4 내지 30개 C 원자를 갖는 탄화수소 쇄를 포함할 수 있다. 바람직하게는, 적어도 8 또는 12개 C 원자, 및 바람직하게는 24개 이하의 C 원자, 또는 20개 이하의 C 원자를 가진다. 탄화수소 쇄는 선형 또는 분지형일 수 있고 포화되거나 포화되지 않을 수 있다. 탄화수소 쇄가 바람직하게는 아미노산 측쇄 또는 스페이서에 결합하는 부분을 형성하는 부위, 예를 들어, 아실기, 설포닐기, N 원자, O 원자 또는 S 원자에 의해 치환되는 것이 이해될 것이다. 가장 바람직하게는, 탄화수소 쇄가 아실에 의해 치환되며, 이에 따라 탄화수소 쇄는 알카노일기, 예를 들어, 팔미토일, 카프로일, 라우로일, 미리스토일 또는 스테아로일의 부분일 수 있다.
특정 실시양태에서, 친유성 치환체는 10 내지 24개 C 원자, 예를 들어, 10 내지 22개 C 원자, 예를 들어, 10 내지 20개 C 원자를 갖는 탄화수소 쇄를 포함할 수 있다. 바람직하게는, 적어도 11개 C 원자, 및 바람직하게는 18개 이하의 C 원자를 가진다. 예를 들어, 탄화수소 쇄는 12, 13, 14, 15, 16, 17 또는 18개 탄소 원자를 함유할 수 있다. 탄화수소 쇄는 선형 또는 분지형일 수 있고 포화되거나 포화되지 않을 수 있다. 상기 논의한 바와 같이, 탄화수소 쇄가 바람직하게는 아미노산 측쇄 또는 스페이서에 결합하는 부분을 형성하는 부위, 예를 들어, 아실기, 설포닐기, N 원자, O 원자 또는 S 원자에 의해 치환되는 것이 이해될 것이다. 가장 바람직하게는, 탄화수소 쇄가 아실에 의해 치환되며, 이에 따라 탄화수소 쇄는 알카노일기, 예를 들어, 도데카노일, 2-부틸옥타노일, 테트라데카노일, 헥사데카노일, 헵타데카노일, 옥타데카노일 또는 에이코사노일기의 부분일 수 있다.
따라서, 친유성 치환체가 하기 화학식을 가질 수 있다:
A는 예를 들어 아실기, 설포닐기, NH, N-알킬, O 원자 또는 S 원자, 바람직하게는 아실일 수 있다. n은 3 내지 29, 바람직하게는 적어도 7 또는 적어도 11, 및 바람직하게는 23 이하, 더욱 바람직하게는 19 이하의 정수이다.
탄화수소 쇄는 추가로 치환될 수 있다. 예를 들어, NH2, OH 및 COOH 중에서 선택된 3개 이하의 치환체에 의해 추가로 치환될 수 있다. 탄화수소 쇄가 추가로 치환된다면, 바람직하게는 오직 한 개의 치환체에 의해 추가로 치환된다. 대안적으로 또는 추가적으로, 탄화수소 쇄는 사이클로알칸 또는 헤테로사이클로알칸, 예를 들어, 하기 나타낸 것을 포함할 수 있다:
바람직하게, 사이클로알칸 또는 헤테로사이클로알칸은 6-원 환이다. 가장 바람직하게, 이는 피페리딘이다.
대안적으로, 친유성 치환체는 부분적으로 또는 완전히 불포화되거나 포화될 수 있는 사이클로펜타노페난트렌 골격에 기초할 수 있다. 골격 내의 탄소 원자는 각각 Me 또는 OH에 의해 치환될 수 있다. 예를 들어, 친유성 치환체는 콜릴, 데옥시콜릴 또는 리토콜릴일 수 있다.
앞에서 언급한 바와 같이, 친유성 치환체는 스페이서에 의해 아미노산 측쇄와 컨쥬게이트 될 수 있다. 존재하는 경우, 스페이서는 친유성 치환체 및 아미노산 측쇄에 결합한다. 스페이서는 독립적으로 에스테르, 설포닐 에스테르, 티오에스테르, 아미드 또는 설폰아미드에 의해 친유성 치환체 및 아미노산 측쇄에 결합할 수 있다. 따라서, 이는 아실, 설포닐, N 원자, O 원자 또는 S 원자 중에서 독립적으로 선택된 2개 부위를 포함할 수 있다. 스페이서는 하기 화학식을 가질 수 있다:
상기 식에서
B 및 D는 각각 독립적으로 아실, 설포닐, NH, N-알킬, O 원자 또는 S 원자, 바람직하게는 아실 및 NH 중에서 선택된다. 바람직하게, n은 1 내지 10, 바람직하게는 1 내지 5의 정수이다. 스페이서는 C1 -6 알킬, 아미노-C1 -6 알킬, 하이드록시-C1-6 알킬 및 카복시 C1 -6 알킬 중에서 선택된 하나 이상의 치환체에 의해 추가로 치환될 수 있다.
대안적으로, 스페이서는 상기 화학식의 반복 단위를 2개 이상 가질 수 있다. B, D 및 n은 각각의 반복 단위에 대해 각각 독립적으로 선택된다. 인접하는 반복 단위는 그들 각각의 B 및 D 부위를 통해 서로 공유적으로 결합할 수 있다. 예를 들어, 인접하는 반복 단위의 B 및 D 부위는 함께 에스테르, 설포닐 에스테르, 티오에스테르, 아미드 또는 설폰아미드를 형성할 수 있다. 스페이서의 각 말단에 있는 유리(free) B 및 D 단위는 상기한 바와 같이 아미노산 측쇄 및 친유성 치환체에 결합한다.
바람직하게, 스페이서는 5개 이하, 4개 이하 또는 3개 이하의 반복 단위를 가진다. 가장 바람직하게, 스페이서는 2개의 반복 단위를 가지거나 단일 단위이다.
스페이서(또는 반복 단위를 가지는 경우, 스페이서의 하나 이상의 반복 단위)는 예를 들어 천연 또는 비천연 아미노산일 수 있다. 작용기화된(functionalized) 측쇄를 갖는 아미노산의 경우 B 및/또는 D가 아미노산 측쇄 내의 부위일 수 있다는 것이 이해될 것이다. 스페이서는 임의의 천연 발생 또는 비천연 아미노산일 수 있다. 예를 들어, 스페이서(또는 반복 단위를 가지는 경우, 스페이서의 하나 이상의 반복 단위)는 Gly, Pro, Ala, Val, Leu, Ile, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, Glu, γ-Glu, ε-Lys, Asp, Ser, Thr, Gaba, Aib, β-Ala(즉, 3-아미노프로파노일), 4-아미노부타노일, 5-아미노펜타노일, 6-아미노헥사노일, 7-아미노헵타노일, 8-아미노옥타노일, 9-아미노노나노일, 10-아미노데카노일 또는 8-아미노-3,6-디옥사옥타노일일 수 있다. 특정 실시양태에서, 스페이서는 Glu, γ-Glu, ε-Lys, β-Ala(즉, 3-아미노프로파노일), 4-아미노부타노일, 8-아미노옥타노일 또는 8-아미노-3,6-디옥사옥타노일 잔기이다.
예를 들어, 스페이서는 γ-Glu, Gaba, β-Ala 및 -Gly 중에서 선택된 단일 아미노산일 수 있다.
친유성 치환체는 화합물 내의 임의의 아미노산 측쇄와 컨쥬게이트 될 수 있다. 바람직하게, 아미노산 측쇄는 스페이서 또는 친유성 치환체와 에스테르, 설포닐 에스테르, 티오에스테르, 아미드 또는 설폰아미드를 형성하기 위하여, 카복시, 하이드록스, 티올, 아미드 또는 아민기를 포함한다. 예를 들어, 친유성 치환체는 Asn, Asp, Glu, Gln, His, Lys, Arg, Ser, Thr, Tyr, Trp, Cys 또는 Dbu, Dpr 또는 Orn 잔기의 측쇄, 예를 들어, Glu, Lys, Ser, Cys, Dbu, Dpr 또는 Orn 잔기의 측쇄와 컨쥬게이트 될 수 있다. 예를 들어, 이는 Lys, Glu 또는 Cys 잔기의 측쇄일 수 있다. 2 이상의 측쇄가 친유성 치환체를 수반하는 경우, 이들은 독립적으로 이들 잔기로부터 선택될 수 있다. 바람직하게, 친유성 치환체는 Lys에 컨쥬게이트 된다. 그러나, 본 명세서에 제공된 화학식에서 Lys로 나타낸 임의의 아미노산은 친유성 치환체가 추가되는 경우 Dbu, Dpr 또는 Orn에 의해 대체될 수 있다.
친유성 치환체 및 스페이서의 예를 하기 화학식으로 나타내었다:
여기에서, 펩티드 X로부터의 Lys 잔기 측쇄는 아미드 결합(linkage)을 통해 γ-Glu 스페이서와 공유적으로 결합한다. 헥사데카노일기는 아미드 결합을 통해 γ-Glu 스페이서와 공유적으로 결합한다. Lys 잔기와 컨쥬게이트된, 친유성 부위와 스페이서의 이 조합은 예를 들어 특정 화합물의 화학식에 나타내는 경우 쇼트-핸드 표기법 K(헥사데카노일-γ-Glu)으로 언급될 수 있다. γ-Glu는 isoGlu로도 지칭될 수 있고, 헥사데카노일기는 팔미토일기로도 지칭될 수 있다. 따라서, 예를 들어, PCT/GB2008/004121에서 사용된 바와 같이 표기법 (헥사데카노일-γ-Glu)가 표기법 (isoGlu(Palm)) 또는 (isoGlu(팔미토일))과 동등하다는 것이 명백하다.
특정 실시양태에서, 위치 16, 17, 18, 20, 24, 27, 28의 하나 이상의 잔기 또는 Z2의 측쇄(들)이 친유성 치환체와 컨쥬게이트된다. 예를 들어, 이러한 잔기의 측쇄 1개가 친유성 치환체와 컨쥬게이트 될 수 있다. 대안적으로, 이러한 잔기의 2개 또는 2개 초과의 측쇄가 친유성 치환체와 컨쥬게이트 될 수 있다.
일부 실시양태에서, Z1이 존재하지 않고 Z2가 단지 1개의 아미노산 잔기로 구성되면, 이는 위치 30으로 간주될 수 있다. 위치 30이 Cys 또는 Lys인 것이 바람직할 수 있다.
예를 들어, 위치 16, 17, 18, 20 및 28의 적어도 하나가 친유성 치환체와 컨쥬게이트 될 수 있다. 이러한 경우에, 위치 30은 존재하지 않을 수 있다. 위치 30이 존재하는 경우, 이는 보통 친유성 치환체와 컨쥬게이트된다.
따라서 화합물은 위치 16, 17, 18, 20, 24, 27, 28 또는 30, 바람직하게는 위치 16, 17 또는 20, 특히 위치 17에서 단지 1개의 친유성 치환체를 가질 수 있다.
대안적으로, 화합물은 각각 위치 16, 17, 18, 20, 24, 27, 28 또는 30의 하나에서 정확히 2개의 친유성 치환체를 가질 수 있다. 바람직하게, 하나 또는 양쪽의 친유성 치환체가 위치 16, 17 또는 20의 하나에 존재한다.
따라서, 화합물은 위치 16 및 17, 16 및 18, 16 및 20, 16 및 24, 16 및 27, 16 및 28 또는 16 및 30에; 17 및 18, 17 및 20, 17 및 24, 17 및 27, 17 및 28 또는 17 및 30에; 18 및 20, 18 및 24, 18 및 27, 18 및 28 또는 18 및 30에; 20 및 24, 20 및 27, 20 및 28 또는 20 및 30에; 24 및 27, 24 및 28 또는 24 및 30에; 27 및 28 또는 27 및 30에; 또는 28 및 30에 친유성 치환체를 가질 수 있다.
추가의 실시양태에서, 화합물은 위치 16, 17, 18, 20, 24, 27, 28 또는 30 중에서 선택된 추가의 위치에 하나 이상의 추가 친유성 치환체(총 3개 이상)를 가질 수 있다. 그러나, 최대 2개 위치가 이 방식으로 유도체화되는 것이 바람직할 수 있다.
친유성 부위와 스페이서의 특정 조합은 도데카노일-γ-Glu, 헥사데카노일-γ-Glu, 헥사데카노일-Glu, 헥사데카노일-[3-아미노프로파노일], 헥사데카노일-[8-아미노옥타노일], 헥사데카노일-ε-Lys, 2-부틸옥타노일-γ-Glu, 옥타데카노일-γ-Glu 및 헥사데카노일-[4-아미노부타노일]이다.
특정 실시양태에서, 펩티드 X는 하기 서열을 가질 수 있다:
HSQGTFTSDYSKYLDKKAAHDFVEWLLRA; (화합물 123)
HSQGTFTSDYSKYLDSKAAKDFVEWLLRA; (화합물 124)
HSQGTFTSDYSKYLDSKAAHDFVEWLKRA; (화합물 125)
HSQGTFTSDYSKYLDSKAAHDFVEWLLKA; (화합물 126)
HSQGTFTSDYSRYLDSKAAHDFVEWLLRA; (화합물 127)
HSQGTFTSDYSLYLDSKAAHDFVEWLLRA; (화합물 128)
HSQGTFTSDYSKYLDSKAAHDFVEWLLRAK; (화합물 129)
HSQGTFTSDYSKYLDSKAAHDFVEWLLSAK (화합물 130)
HSQGTFTSDYSKYLDSKAAHDFVEWLKSA; (화합물 131)
HSQGTFTSDYSKYLDSKAAHDFVKWLLRA; (화합물 132)
HSQGTFTSDYSKYLDSCAAHDFVEWLLRA; (화합물 133)
HSQGTFTSDYSKYLDSCAAHDFVEWLLSA; (화합물 134)
HSQGTFTSDYSKYLDSKAACDFVEWLLRA; (화합물 135)
HSQGTFTSDYSKYLDKSAAHDFVEWLLRA; (화합물 136)
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSA; (화합물 137)
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSAK; (화합물 138)
H-Aib-QGTFTSDYSKYLDSKAARDFVAWLLRA; (화합물 139)
H-Aib-QGTFTSDYSKYLDSKAAKDFVAWLLRA; (화합물 140)
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLKA (화합물 141)
H-Aib-QGTFTSDYSKYLDSKAAKDFVAWLLSA (화합물 142)
H-Aib-QGTFTSDYSKYLDSKAAHDFVAWLLKA; (화합물 143)
H-Aib-QGTFTSDYSKYLDKKAAHDFVAWLLRA; (화합물 144)
H-Aib-QGTFTSDYSRYLDSKAAHDFVEWLLSA; (화합물 145)
H-Aib-QGTFTSDYSKYLDSKAAHDFVKWLLSA; (화합물 146)
H-Aib-QGTFTSDYSLYLDSKAAHDFVEWLLSA; (화합물 147)
H-Aib-QGTFTSDYSKYLDSCAAHDFVEWLLSA; (화합물 148)
H-Aib-QGTFTSDYSKYLDSKAACDFVEWLLRA; (화합물 149)
H-Aib-QGTFTSDYSKYLDK()KAAE()DFVEWLLRA; (화합물 150)
H-Aib-QGTFTSDYSKYLDSKAAHDFVE()WLLK()A (화합물 151)
H-Aib-QGTFTSDYSKYLDSKAAK()DFVE()WLLRA; (화합물 152)
H-Aib-QGTFTSDYSKYLDSK()AAHE()FVEWLLKA; (화합물 153) 또는
H-Aib-QGTFTSDYSKYLDSK()AAKE()FVEWLLRA. (화합물 154)
HSQGTFTSDYSKYLDRARADDFVAWLKSA; (화합물 155)
HSQGTFTSDYSKYLDRARADDFVAWLKEA; (화합물 156)
HSQGTFTSDYSKYLDRARAEDFVAWLKST; (화합물 157)
HSQGTFTSDYSKYLDRARADDFVEWLKST; (화합물 158)
H-DSer-QGTFTSDYSKYLDRARADDFVAWLKST; (화합물 159)
HSQGTFTSDYSKYLDRARAHDFVAWLKST; (화합물 160)
HSQGTFTSDYSKYLDKARADDFVAWLKST; (화합물 161)
HSQGTFTSDYSKYLDRAKADDFVAWLKST; (화합물 162)
HSQGTFTSDYSKYLDRARAKDFVAWLKST, (화합물 163) 또는
HSQGTFTSDYSKYLDRARADDFVKWLKST (화합물 164)
특정 실시양태에서 이들 펩티드는 하기와 같이 "*"로 표시된 위치에서 친유성 치환체를 수반할 수 있다:
HSQGTFTSDYSKYLDS-K*-AAHDFVEWLLRA; (화합물 165)
HSQGTFTSDYSKYLD-K*-KAAHDFVEWLLRA; (화합물 166)
HSQGTFTSDYSKYLDSKAA-K*-DFVEWLLRA; (화합물 167)
HSQGTFTSDYSKYLDSKAAHDFVEWL-K*-RA; (화합물 168)
HSQGTFTSDYSKYLDSKAAHDFVEWLL-K*-A; (화합물 169)
HSQGTFTSDYSRYLDS-K*-AAHDFVEWLLRA; (화합물 170)
HSQGTFTSDYSLYLDS-K*-AAHDFVEWLLRA; (화합물 171)
HSQGTFTSDYSKYLDSKAAHDFVEWLLRA-K*; (화합물 172)
HSQGTFTSDYSKYLDSKAAHDFVEWLLSA-K*; (화합물 173)
HSQGTFTSDYSKYLDSKAAHDFVEWL-K*-SA; (화합물 174)
HSQGTFTSDYSKYLDSKAAHDFV-K*-WLLRA; (화합물 175)
HSQGTFTSDYSKYLDS-C*-AAHDFVEWLLRA; (화합물 176)
HSQGTFTSDYSKYLDS-C*-AAHDFVEWLLSA; (화합물 177)
HSQGTFTSDYSKYLDSKAA-C*-DFVEWLLRA; (화합물 178)
HSQGTFTSDYSKYLD-K*-SAAHDFVEWLLRA; (화합물 179)
H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLSA; (화합물 180)
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSA-K*; (화합물 181)
H-Aib-QGTFTSDYSKYLDS-K*-AARDFVAWLLRA; (화합물 182)
H-Aib-QGTFTSDYSKYLDSKAA-K*-DFVAWLLRA; (화합물 183)
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLL-K*-A; (화합물 184)
H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLKA; (화합물 185)
H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLRA; (화합물 186)
H-Aib-QGTFTSDYSKYLDSKAA-K*-DFVAWLLSA; (화합물 187)
H-Aib-QGTFTSDYSKYLDSKAAHDFVAWLL-K*-A; (화합물 188)
H-Aib-QGTFTSDYSKYLD-K*-KAAHDFVAWLLRA; (화합물 189)
H-Aib-QGTFTSDYSRYLDS-K*-AAHDFVEWLLSA; (화합물 190)
H-Aib-QGTFTSDYSKYLDSKAAHDFV-K*-WLLSA; (화합물 191)
H-Aib-QGTFTSDYSLYLDS-K*-AAHDFVEWLLSA; (화합물 192)
H-Aib-QGTFTSDYSKYLDS-C*-AAHDFVEWLLSA; (화합물 193)
H-Aib-QGTFTSDYSKYLDSKAA-C*-DFVEWLLRA; (화합물 194)
H-Aib-QGTFTSDYSKYLD-S*-KAAHDFVEWLLSA; (화합물 195)
H-Aib-QGTFTSDYSKYLDK()K*AAE()DFVEWLLRA; (화합물 196)
H-Aib-QGTFTSDYSKYLDSK*AAHDFVE()WLLK()A; (화합물 197)
H-Aib-QGTFTSDYSKYLDSK*AAK()DFVE()WLLRA; (화합물 198)
H-Aib-QGTFTSDYSKYLDSK()AAHE()FVEWLLK*A; (화합물 199) 또는
H-Aib-QGTFTSDYSKYLDSK()AAK*E()FVEWLLRA. (화합물 200)
"()"로 표시된 잔기들은 상기 락탐환과 같이 분자내 결합에 참여한다.
특정 실시양태에서, 유도체화된 펩티드 X는 하기 화학식을 갖는다:
HSQGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVEWLLRA; (화합물 201)
HSQGTFTSDYSKYLD-K(헥사데카노일-γ-Glu)-KAAHDFVEWLLRA; (화합물 202)
HSQGTFTSDYSKYLDSKAAHDFVEWL-K(헥사데카노일-γ-Glu)-RA; (화합물 203)
HSQGTFTSDYSKYLDSKAA-K(헥사데카노일-γ-Glu)-DFVEWLLRA; (화합물 204)
HSQGTFTSDYSKYLDSKAAHDFVEWLL-K(헥사데카노일-γ-Glu)-A; (화합물 205)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVEWLLRA; (화합물 206)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AARDFVAWLLRA; (화합물 207)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVEWLLSA; (화합물 208)
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLL-K(헥사데카노일-γ-Glu)-A; (화합물 209)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVE()WLLK()A; (화합물 210)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVEWLLKA; (화합물 211)
HSQGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVEWLLRA; (화합물212)
H-Aib-QGTFTSDYSKYLDSKAA-K(헥사데카노일-γ-Glu)-DFVAWLLRA; (화합물 213)
H-Aib-QGTFTSDYSKYLDS-K(도데카노일-γ-Glu)-AAHDFVEWLLSA; (화합물 214)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-[3-아미노프로파노일])-AAHDFVEWLLSA; (화합물 215)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-[8-아미노옥타노일])-AAHDFVEWLLSA; (화합물 216)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-ε-Lys)-AAHDFVEWLLSA: (화합물 217)
HSQGTFTSDYSKYLDS-K(헥사데카노일)-AAHDFVEWLLSA; (화합물 218)
HSQGTFTSDYSKYLDS-K(옥타데카노일-γ-Glu)-AAHDFVEWLLSA; (화합물 219)
HSQGTFTSDYSKYLDS-K([2-부틸옥타노일]-γ-Glu)-AAHDFVEWLLSA; (화합물 220)
HSQGTFTSDYSKYLDS-K(헥사데카노일-[4-아미노부타노일])-AAHDFVEWLLSA; (화합물 221)
HSQGTFTSDYSKYLDS-K(옥타데카노일-γ-Glu)-AAHDFVEWLLSA; (화합물 222)
HSQGTFTSDYSKYLDS-K(헥사데카노일-E)-AAHDFVEWLLSA; (화합물 223)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일)-AAHDFVEWLLSA; (화합물 224)
H-Aib-QGTFTSDYSKYLDS-K(옥타데카노일-γ-Glu)-AAHDFVEWLLSA; (화합물 225)
H-Aib-QGTFTSDYSKYLDS-K([2-부틸옥타노일]-γ-Glu)-AAHDFVEWLLSA; (화합물 226)
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-[4-아미노부타노일])-AAHDFVEWLLSA; (화합물 227)
HSQGTFTSDYSKYLDRARADDFVAWLK(헥사데카노일-γ-Glu)-SA; (화합물 228)
HSQGTFTSDYSKYLDRARADDFVAWLK(헥사데카노일-γ-Glu)-EA; (화합물 229)
HSQGTFTSDYSKYLDRARAEDFVAWLK(헥사데카노일-γ-Glu)-ST; (화합물 230)
HSQGTFTSDYSKYLDRARADDFVEWLK(헥사데카노일-γ-Glu)-ST; (화합물 231)
H-DSer-QGTFTSDYSKYLDRARADDFVAWLK(헥사데카노일-γ-Glu)-ST; (화합물 232)
HSQGTFTSDYSKYLDRARAHDFVAWLK(헥사데카노일-γ-Glu)-ST; (화합물 233)
HSQGTFTSDYSKYLDRARADDFVAWLK(헥사데카노일-γ-Glu)-ST; (화합물 234)
HSQGTFTSDYSKYLDK(헥사데카노일-γ-Glu)-ARADDFVAWLKST; (화합물 235)
HSQGTFTSDYSKYLDRAK(헥사데카노일-γ-Glu)-ADDFVAWLKST; (화합물 236)
HSQGTFTSDYSKYLDRARAK(헥사데카노일-γ-Glu)-DFVAWLKST; (화합물 237)
HSQGTFTSDYSKYLDRARADDFVK(헥사데카노일-γ-Glu)-WLKST; (화합물 238)
H-Aib-QGTFTSDYSKYLDS-K(옥타데카노일-γ-Glu)-AAHDFVEWLLSA; (화합물 239) 또는
H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-E)-AAHDFVEWLLSA. (화합물 240)
"()"로 표시된 잔기들은 상기 락탐환과 같이 분자내 결합에 참여한다.
대안적으로 또는 추가적으로, 본 발명의 화합물에서 하나 이상의 아미노산 측쇄는 예를 들어 용해도 및/또는 생체내 (예를 들어, 혈장내) 반감기 및/또는 생체이용율을 증가시키기 위하여 중합체성 부위에 컨쥬게이트 될 수 있다. 이러한 변형은 또한 치료제 단백질 및 펩티드의 클리어런스(clearance) (예를 들어, 신장 클리어런스)를 감소시키는 것으로 공지되어 있다.
중합체성 부위는 바람직하게는 수용해성(양쪽성 또는 친수성)이고, 무독성이며 약제학적으로 불활성이다. 적합한 중합체성 부위는 폴리에틸렌 글리콜(PEG), PEG의 호모폴리머 또는 코폴리머, PEG의 모노메틸-치환된 중합체(mPEG) 또는 폴리옥시에틸렌 글리세롤(POG)를 포함한다(예를 들어, Int . J. Hematology 68:1 (1998); Bioconjugate Chem . 6:150 (1995); 및 Crit . Rev . Therap . Drug Carrier Sys. 9:249 (1992) 참조).
기타 적합한 중합체성 부위는 폴리-아미노산, 예를 들어, 폴리-리신, 폴리-아스파르트산 및 폴리-글루탐산을 포함한다(예를 들어, Gombotz, et al. (1995), Bioconjugate Chem., vol. 6: 332-351; Hudecz, et al. (1992), Bioconjugate Chem., vol. 3, 49-57; Tsukada, et al. (1984), J. Natl. Cancer Inst., vol 73,: 721-729; 및 Pratesi, et al. (1985), Br. J. Cancer, vol. 52: 841-848 참조).
중합체성 부위는 직쇄 또는 분지형일 수 있다. 이는 분자량이 500-40,000 Da, 예를 들어 500-5,000 Da, 500-10,000 Da, 1000-5000 Da, 10,000-20,000 Da, 또는 20,000-40,000 Da일 수 있다.
화합물은 2개 이상의 이러한 부위를 포함할 수 있으며, 이 경우에 모든 이러한 부위의 총 분자량은 일반적으로 상기 제공된 범위 내에 들어갈 것이다.
중합체성 부위는 아미노산 측쇄의 아미노, 카복실 또는 티올기와 (공유결합에 의해) 커플링될 수 있다. 바람직한 예는 Cys 잔기의 티올기와 Lys 잔기의 엡실론 아미노기이며, Asp 및 Glu 잔기의 카복실기도 사용될 수 있다.
예를 들어, 중합체성 부위는 하나 이상의 위치 16, 17, 18, 20, 21, 24 또는 29의 잔기의 측쇄 또는 펩티드의 C-말단에 커플링될 수 있다. 예를 들어, 이는 하나 이상의 위치 16, 17, 21 및 24에 커플링될 수 있다.
당업자는 커플링 반응을 수행하는데 사용할 수 있는 적합한 기술을 잘 알고 있을 것이다. 예를 들어, 메톡시기를 수반하는 PEG 부위는 Nektar Therapeutics AL로부터 상업적으로 구입가능한 시약을 사용하여 말레이미도 결합을 통해 Cys 티올기와 커플링될 수 있다(국제 특허 출원 공개 WO2008/101017호, 및 적합한 화학적 세부사항에 대해서는 상기 인용된 문헌 참조).
생물학적 활성
관련 화합물과 GLP-1 또는 글루카곤(Glu) 수용체의 결합이 작용제 활성의 표시로서 사용될 수 있지만, 일반적으로 관련 수용체와 화합물의 결합에 의해 유발된 세포내 신호를 측정하는 생물학적 어세이를 이용하는 것이 바람직하다. 예를 들어, 글루카곤 작용제에 의한 글루카곤 수용체의 활성화는 세포내 사이클릭 AMP(cAMP)의 형성을 자극할 것이다. 유사하게, GLP-1 작용제에 의한 GLP-1 수용체의 활성화는 세포내 cAMP의 형성을 자극할 것이다. 따라서, 이들 두 가지 수용체 중의 하나를 발현하는 적합한 세포에서 cAMP의 생산은 관련 수용체 활성을 감시하는데 사용할 수 있다. 따라서, 각각 한쪽 수용체를 발현하지만 다른 쪽 수용체는 발현하지 않는 적합한 세포 유형 쌍을 이용하면 양쪽 유형의 수용체를 향한 작용제 활성을 결정할 수 있다.
당업자는 적합한 어세이 포맷에 대해 잘 알고 있을 것이며, 하기 실시예가 제공된다. GLP-1 수용체 및/또는 글루카곤 수용체는 실시예에 기술된 수용체 서열을 가질 수 있다. 예를 들어, 어세이에서 일차 수탁 번호 GI:4503947을 갖는 인간 글루카곤 수용체(글루카곤-R) 및/또는 일차 수탁 번호 GI:166795283을 갖는 인간 글루카곤-유사 펩티드 1 수용체(GLP-1R)를 이용할 수 있다.(전구체 단백질의 서열이 참조되는 경우, 물론 어세이가 신호 서열을 포함하지 않는 성숙 단백질을 이용할 수 있는 것으로 이해되어야만 한다).
EC50 수치를 소정의 수용체에서 작용제 효능의 수치적 측정으로 사용할 수 있다. EC50 수치는 특정 어세이에서 화합물의 최대 활성의 절반을 달성하는데 요구되는 화합물 농도의 측정치이다. 따라서, 예를 들어, 특정 어세이에서 글루카곤의 EC50[GLP-1R]보다 낮은 EC50[GLP-1]을 갖는 화합물은 GLP-1R에서 글루카곤보다 높은 효능을 갖는 것으로 간주될 수 있다.
본 명세서에 기술된 화합물들은 통상 Glu-GLP-1(글루카곤-GLP-1) 이중 작용제로서, 이들은 글루카곤 수용체 및 GLP-1 수용체 양쪽에서 cAMP 형성을 자극할 수 있다. 각 수용체의 자극을 독립적인 어세이에서 측정할 수 있으며, 그 후 서로 비교할 수 있다.
소정의 화합물에 대해서 글루카곤 수용체에 대한 EC50 수치(EC50 [글루카곤-R])를 GLP-1 수용체에 대한 EC50 수치(EC50 [GLP-1R])와 비교함으로써 당해 화합물의 상대적인 글루카곤 선택성(%)을 밝힐 수 있다.
상대적 글루카곤-R 선택성 [화합물] = (1/EC50 [글루카곤-R])x100 / (1/EC50 [글루카곤-R] + 1/EC50 [GLP-1R])
상대적 GLP-1R 선택성도 마찬가지로 밝힐 수 있다:
상대적 GLP-1R 선택성 [화합물] = (1/EC50 [GLP-1R])x100 / (1/EC50 [글루카곤-R] + 1/EC50 [GLP-1R])
화합물의 상대적 선택성에 의해 GLP-1 또는 글루카곤 수용체에 대한 그의 효과를 다른 한쪽의 수용체에 대한 그의 효과와 직접적으로 비교할 수 있게 된다. 예를 들어, 화합물의 상대적 GLP-1 선택성이 높을수록 글루카곤 수용체와 비교하여 GLP-1 수용체에 대해 화합물이 더 효과적이다.
하기 어세이를 사용하여 인간 글루카곤에 대한 상대적 GLP-1 선택성이 대략 5%임을 알 수 있었다.
본 발명의 방법에서 사용하기에 적합한 화합물은 보통 인간 글루카곤에 비해 더 높은 상대적 GLP-1R 선택성을 갖는다. 따라서, 특정 수준의 글루카곤-R 작용제 활성의 경우, 화합물은 글루카곤보다 높은 수준의 GLP-1R 작용제 활성(즉, GLP-1 수용체에서의 더 높은 효능)을 나타낼 것이다. 글루카곤 및 GLP-1 수용체에서 특정 화합물의 절대 효능은, 적합한 상대적 GLP-1R 선택성이 달성되는 한, 천연 인간 글루카곤의 효능보다 높거나, 낮거나 대략 동등할 수 있다는 것이 이해될 것이다.
그럼에도 불구하고, 상기 화합물은 인간 글루카곤보다 낮은 EC50 [GLP-1R]을 가질 수 있다. 상기 화합물은 인간 글루카곤보다 10배 미만으로 높은, 인간 글루카곤보다 5배 미만으로 높은, 또는 인간 글루카곤보다 2배 미만으로 높은 EC50 [글루카곤-R]을 유지하는 한편, 글루카곤보다 낮은 EC50[GLP-1-R]을 가질 수 있다.
상기 화합물은 인간 글루카곤보다 2배 미만의 EC50 [글루카곤-R]을 가질 수 있다. 상기 화합물은 인간 글루카곤보다 2배 미만의 EC50 [글루카곤-R]을 가질 수 있고, 인간 글루카곤보다 1/2배 미만의, 인간 글루카곤보다 1/5 미만의, 또는 인간 글루카곤보다 1/10 미만의 EC50 [GLP-1R]을 가질 수 있다.
상기 화합물의 상대적 GLP-1 선택성은 10% 내지 95%일 수 있다. 예를 들어, 화합물은 10-20%, 10-30%, 20-50%, 30-70% 또는 50-80%; 또는 30-50%, 40-60%, 50-70% 또는 75-95%의 상대적 선택성을 나타낼 수 있다.
치료 용도
본 발명의 방법은 심장 기능을 직접적으로 개선하고자 하는 경우, 예를 들어, 심장근육(심근) 자체의 기능장애가 있는 경우의 병태에 적용가능하다. 이러한 병태는 심근경색, 심부전, 심장성 쇼크를 포함한다. 양성 수축촉진제는 심근수축의 강도를 증가시키며, 혈류역학 파라미터를 개선하는데 사용됨으로써 심근경색, 심장성 쇼크 또는 심부전 환자의 종말 기관을 보호하고 증상을 완화시킨다. 알려진 수축촉진제, 예를 들어, 도부타민, 노르에피네프린 및 글루카곤은 심장 에너지 요구량을 증가시키면서 효과를 발휘하고(심장 활동의 증가), 따라서 심장의 에너지 비축분(예를 들어, 총 포스포크레아틴(PCr), 총 ATP, 또는 PCr/ATP, ATP/ADP 또는 ATP/AMP 비율에 의해 측정됨)을 심각하게 격감시킬 수 있다. 부전성 심장 또는 질환에 걸린 심장은 종종 에너지가 부족하므로 수축촉진제의 사용은 에너지 고갈을 초래할 수 있고 결과적으로 부정맥 발병율의 증가 뿐아니라 단기 및 장기 사망률 증가를 초래할 수 있다(Jessup M et al., Circulation 2009;119:1977-2016). 이 때문에, 심부전에 대한 현행 치료지침에서는 양성 수축촉진제가 "난치성 말기 심부전 환자의 증상 완화를 위해 고려되어야만 하는 것"이고(Dickstein K et al., Eur Heart J 2008;29:2388-2442), 이러한 제제는 "적절한 기관 관류가 복원되고/되거나 울혈이 감소하자마자 사용중지되어야만 하는 것"으로 언급하고 있다(Jessup et al., op cit.). 따라서, 수축촉진제는 통상 환자의 상태를 안정시키기 위해서만 투여되며 몇 시간 또는 며칠 후에는 중단된다.
임의의 특정 이론에 의해 구애되고자 하는 것은 아니나, 본 발명의 방법에 사용하기 위한 상기 화합물은 (비록 이들이 상이한 메카니즘, 예를 들어, 별개의 수용체를 통해 유리한 심장 효과를 발휘할 수 있다고 해도) 글루카곤-GLP-1 이중 작용제로 작용하는 것으로 믿어진다. 놀랍게도, 이들은 심장 수축을 증가시키는 동시에 심근성 대사를 개선하고, 특히 심장의 에너지 상태를 보존하거나 상기 논의된 기타 수축촉진제에 비해 더 적은 정도로 고 에너지 포스페이트 비축분을 최소한으로 고갈시키는 것으로 밝혀졌다. 따라서, 이들은 심근 경색, 심부전, 심장성 쇼크 또는 심장의 에너지 상태를 위험에 빠뜨리지 않으면서 심장 수축의 증가가 요구되는 임의의 기타 병태, 즉, 단지 비정상적으로 증가된 심실 확장기 부피로 인하여 조직의 대사 및/또는 그렇게 하도록 허용하는 요구조건에 부응하는 속도로 혈액을 펌핑하지 못하는 심장의 불능을 초래하는 임의의 심장 기능의 비정상을 겪고 있는 개인을 치료하는데 특히 유용하다. 이는 울혈성 심부전, 수축기 기능장애, 확장기 기능장애, 심근경색, 허혈성 심장질환, 당뇨성 심근병증 또는 이의 조합을 포함하지만, 이로 한정되지는 않는다.
심근 에너지 상태는 총 포스포크레아틴(PCr), 총 ATP, 또는 PCr/ATP, ATP/ADP 또는 ATP/AMP 비율을 결정함으로써 감시할 수 있다. 이러한 결정은 생검(예를 들어, Ally A 및 Park G. Rapid determination of creatine, phosphocreatine, purine bases and nucleotides (ATP, ADP, AMP, GTP, GDP) in heart biopsies by gradient ion-pair reversed-phase liquid chromatography. J Chromatogr 1992;575:19-27 참조)에 의해, 자기 공명 분광학(Neubauer S et al., Myocardial phosphocreatine-to-ATP ratio is a predictor of mortality in patients with dilated cardiomyopathy. Circulation 1997;96:2190-2196; Yabe T et al., Quantitative measurements of cardiac phosphorus metabolites in coronary artery disease by 31P magnetic resonance spectroscopy. Circulation 1995;92:15-23)에 의해 이루어질 수 있다.
심근 대사를 개선함과 동시에 양성 수축 촉진 효과를 가짐으로써 본 발명에 따라 사용하기 위한 화합물은 현행 양성 수축촉진제보다 적은 부정맥 및/또는 낮은 사망률을 나타낼 수 있다. 결과적으로, 본 발명의 방법은 덜 심각한 질환을 앓고 있는 환자에 대해 및/또는 심각한 심부전을 앓고 있는 환자에 있어서 현재 권고되고 있는 것보다 더 장기간 동안 사용될 수 있다.
예를 들어, 12 시간, 24 시간, 36 시간 또는 48 시간보다 긴 기간 동안 적합한 화합물로 대상을 치료할 수 있다. 예를 들어 3일, 예를 들어, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일 또는 14일 보다 긴 기간 동안 대상을 치료할 수 있다. 2 주, 3 주 또는 4 주보다 긴 기간 동안 환자를 치료할 수 있다. 1 달, 2 달, 3 달, 4 달, 5 달보다 긴 기간, 즉 만성/평생치료 동안 환자를 치료할 수 있다.
1 주 내지 6 주, 예를 들어, 2 주 내지 6 주, 3 주 내지 6 주, 4 주 내지 6 주 또는 5 주 내지 6 주의 기간 동안 환자를 치료할 수 있다.
1 주 내지 5 주, 예를 들어, 2 주 내지 5 주, 3 주 내지 5 주, 4 주 내지 5 주의 기간 동안 환자를 치료할 수 있다.
1 주 내지 4 주, 예를 들어, 2 주 내지 4 주, 3 주 내지 4 주의 기간 동안 환자를 치료할 수 있다.
1 주 내지 3 주, 예를 들어, 2 주 내지 3 주의 기간 동안 환자를 치료할 수 있다.
예를 들어, 1 주 내지 6 달, 예를 들어, 1 주 내지 5 달, 1 주 내지 4 달, 1 주 내지 3 달, 1 주 내지 2 달 또는 1 주 내지 1 달의 기간 동안 환자를 치료할 수 있다.
2 주 내지 6 달, 예를 들어, 2 주 내지 5 달, 2 주 내지 4 달, 2 주 내지 3 달, 2 주 내지 2 달 또는 2 주 내지 1 달의 기간 동안 환자를 치료할 수 있다.
3 주 내지 6 달, 예를 들어, 3 주 내지 5 달, 3 주 내지 4 달, 3 주 내지 3 달, 3 주 내지 2 달 또는 3 주 내지 1 달의 기간 동안 환자를 치료할 수 있다.
4 주 내지 6 달, 예를 들어, 4 주 내지 5 달, 4 주 내지 4 달, 4 주 내지 3 달, 4 주 내지 2 달 또는 4 주 내지 1 달의 기간 동안 환자를 치료할 수 있다.
1 달 내지 6 달, 예를 들어, 2 달 내지 6 달, 3 달 내지 6 달, 4 달 내지 6 달, 5 달 내지 6 달의 기간 동안 환자를 치료할 수 있다.
1 달 내지 5 달, 예를 들어, 2 달 내지 5 달, 3 달 내지 5 달, 4 달 내지 5 달의 기간 동안 환자를 치료할 수 있다.
1 달 내지 3 달, 예를 들어, 2 달 내지 3 달의 기간 동안 환자를 치료할 수 있다.
1 달 내지 2 달의 기간 동안 환자를 치료할 수 있다.
일부 경우에, 본 발명에 따라, 치료는 연속 주입, 1일 2회 또는 1일 1회의 투여 체제를 포함할 수 있다.
1일 1회, 1일 2회, 1주 1회, 2주 1회 또는 1달 1회와 같은 투여 체제를 포함하는 다른 투여 체제를 고려할 수 있다.
약제학적 조성물
본 발명에 사용하기 위한 화합물 또는 그의 염은 보관 또는 투여용으로 제조되는 약제학적 조성물로서 제형화될 수 있으며, 이는 통상 치료적 유효량의 화합물 또는 그의 염을 약제학적으로 허용되는 담체 내에 포함한다.
투여될 정확한 양은 투여 경로, 치료하고자 하는 포유류의 종류 및 고려되고 있는 특정 포유류의 물리적 특성에 좌우된다. 양을 결정하기 위한 이들 요인 및 그들의 관계는 의약 분야의 당업자에게 주지되어 있다. 투여량 및 투여 방법은 최적의 효과를 달성하기 위하여 조정될 수 있으며, 의약 분야 당업자에게 주지된 체중, 식이, 동시 투약과 같은 요인 및 기타 요인들에 좌우된다. 인간에게 사용하기에 가장 적합한 투여 수준 및 투여 체제는 본 발명에 의해 얻어진 결과에 기초하여 확립될 수 있으며, 적절히 고안된 임상 시험에서 확인될 수 있다.
효과적인 투여량 및 치료 프로토콜은 실험실 동물에서 저 용량으로 시작한 다음 효과를 감시하면서 투여량을 증가시키고, 체계적으로 투여 체제를 변화시키는 통상의 수단을 사용하여 결정할 수 있다. 주어진 대상에서 최적의 투여량을 결정하는 경우 임상의는 수많은 요인들을 고려할 수 있다. 이러한 고려는 당업자에게 공지되어 있다.
용어 "약제학적으로 허용되는 담체"는 임의의 표준 약제학적 담체들을 포함한다. 치료용 약제학적으로 허용되는 담체는 약제학적 분야에 주지되어 있고, 예를 들어, 문헌(Remington's Pharmaceutical Sciences, Mack Publishing Co. (A. R. Gennaro edit. 1985))에 기술되어 있다. 예를 들어, 약산성 또는 생리적 pH의 멸균 식염수 및 포스페이트 완충 식염수를 사용할 수 있다. pH 완충제는 포스페이트, 시트레이트, 아세테이트, 트리스/하이드록시메틸)아미노메탄(TRIS), N-트리스(하이드록시메틸)메틸-3-아미노프로판설폰산(TAPS), 암모늄 비카보네이트, 디에탄올아민, 히스티딘일 수 있고, 바람직한 완충제는 아르기닌, 리신, 아세테이트 또는 이들의 혼합물이다. 이 용어는 인간을 포함한 동물에 사용하기 위한 미국 약전에 열거된 임의의 제제를 추가로 포함한다.
용어 "약제학적으로 허용되는 염"은 이중 작용제 화합물의 염을 지칭한다. 약제학적으로 허용되는 염은 통상 산부가염 및 염기성 염을 포함한다. 약제학적으로 허용되는 산부가염의 예로는 염산염, 시트레이트염 및 아세테이트염을 들 수 있다. 약제학적으로 허용되는 염기성 염의 예는 양이온이 알칼리 금속, 예를 들어 소듐 및 포타슘, 알칼리 토금속, 예를 들어, 칼슘, 및 암모늄 이온 +N(R3)3(R4) (여기에서, R3 및 R4는 독립적으로 임의로 치환된 C1 -6-알킬, 임의로 치환된 C2 -6-알케닐, 임의로 치환된 아릴 또는 임의로 치환된 헤테로아릴을 나타낸다) 중에서 선택된 염을 포함한다. 약제학적으로 허용되는 염의 다른 예는 문헌("Remington's Pharmaceutical Sciences," 17th edition. Ed. Alfonso R. Gennaro (Ed.), Mark Publishing Company, Easton, PA, U.S.A., 1985 and more recent editions, and in the Encyclopaedia of Pharmaceutical Technology)에 기술되어 있다.
"치료"는 유익한 또는 목적하는 임상적 결과를 얻기 위한 접근이다. 본 발명의 목적에서, 유익한 또는 목적하는 임상적 결과는 탐지되건 탐지되지 않건 증상의 경감, 질환 정도의 감소, 안정화된(즉, 악화되지 않는) 질환 상태, 질환 진행의 지연 또는 서행, 질환 상태의 완화 또는 일시적 억제 및 회복(부분적이거나 전체적으로)을 포함하지만 이로 한정되지는 않는다. "치료"는 또한 치료를 받지 않는 경우 기대되는 생존과 비교하여 늘어난 생존을 의미할 수 있다. "치료"는 본 발명을 이용하여 수행된 중재로서, 장애의 발달을 방지하거나 병변을 변경한다. 따라서, "치료"는 치료적 처치 및 예방적 수단 모두를 지칭한다. 치료가 필요한 대상은 장애가 예방되어야 하는 대상 뿐아니라 이미 장애를 가지고 있는 대상을 포함한다.
약제학적 조성물은 단위 투여형일 수 있다. 이러한 형태에서, 조성물은 적합한 양의 활성 성분을 함유하는 단위 투여량으로 분할된다. 단위 투여형은 포장된 제제, 분리된 양의 제제를 함유하는 패키지, 예를 들어, 포장된 정제, 캅셀제 및 바이알 내의 분말 또는 앰플일 수 있다. 단위 투여형은 또한 캅셀제, 카세제, 또는 정제 자체일 수 있거나, 적합한 수의 임의의 이들 포장된 형태일 수 있다. 단일 투여 주사제 형태, 예를 들어, 펜(pen)의 형태로 제공될 수 있다. 조성물은 임의의 적합한 경로 및 투여 수단용으로 제형화될 수 있다. 약제학적으로 허용되는 담체 또는 희석제는 경구, 직장, 비강, 국소(볼 및 설하를 포함), 질 또는 비경구(피하, 근육내, 정맥내, 진피내 및 경피를 포함) 투여에 적합한 제형에 사용되는 것을 포함한다. 제형은 편리하게 단위 투여형으로 제시될 수 있고 약학 분야에 주지된 임의의 방법에 의해 제조될 수 있다.
정맥내, 피하 또는 경피 투여 방식은 특히 본 명세서에 기술된 화합물에 적합할 수 있다.
조합 요법
상기 화합물은 심부전, 당뇨, 비만, 심근경색, 고혈압 또는 저지혈증(hypolipidemia)의 치료제와 함께 조합 요법의 일부로서 투여될 수 있다.
이러한 경우에, 2개의 활성 제제는 함께 또는 별도로 제공될 수 있으며, 동일 약제학적 제형의 일부로서 또는 분리된 제형으로서 제공될 수 있다.
따라서 본 화합물(또는 그의 염)은 메트포르민, 설포닐우레아, 글리니드, DPP-IV 저해제, 글리타존 또는 인슐린을 포함하지만 이로 한정되지는 않는 당뇨병 치료제와 조합하여 사용될 수 있다. 바람직한 실시양태에서 화합물 또는 그의 염은 적절한 혈당 조절을 달성하기 위하여 인슐린, DPP-IV 저해제, 설포닐우레아 또는 메트포르민, 특히 설포닐우레아 또는 메트포르민과 조합하여 사용된다. 훨씬 바람직한 실시양태에서 화합물 또는 그의 염은 적절한 혈당 조절을 달성하기 위하여 인슐린 또는 인슐린 유사체와 조합하여 사용된다. 인슐린 유사체의 예는 란투스TM, 노보라피드TM, 휴말로그TM, 노보믹스TM, 및 악트라판 HMTM을 포함하지만 이로 한정되지는 않는다.
본 화합물 또는 그의 염은 추가로 글루카곤-유사 펩티드 수용체 1 작용제, 펩티드 YY 또는 그의 유사체, 칸나비노이드 수용체 1 길항제, 리파제 저해제, 멜라노코르틴 수용체 4 작용제 또는 멜라닌 농축 호르몬 수용체 1 길항제를 포함하지만 이로 한정되지는 않는 비만치료제와 조합하여 사용될 수 있다.
유사체 화합물 또는 그의 염은 안지오텐신-전환 효소(ACE) 저해제, 안지오텐신 II 수용체 차단제(ARB), 이뇨제, 베타-차단제 또는 칼슘 채널 차단제를 포함하지만 이로 한정되지는 않는 고혈압 치료제와 조합하여 사용될 수 있다.
유사체 화합물 또는 그의 염은 특히 이뇨제, 안지오텐신-전환 효소(ACE) 저해제, 안지오텐신 II 수용체 차단제(ARB), 알도스테론 길항제, 디기탈리스, 급성 이오노트롭스(ionotropes) 및 수축성 확장기(inotropic dilators)를 포함하지만 이로 한정되지는 않는 심근 경색, 심부전 또는 심장성 쇼크 치료제와 조합하여 사용될 수 있다.
유사체 화합물 또는 그의 염은 특히 하이포리피데미아 약물 계통, 예를 들어, 스타틴(HMG-CoA 환원제 저해제), 피브레이트 및 나이아신을 포함하지만 이로 한정되지는 않는 콜레스테롤 강하제(cholesterol lowering agent)와 조합하여 사용될 수 있다.
재조합 발현
본 발명에 사용하기 위한 화합물은 특히 이들이 전체적으로 천연 발생 아미노산으로 구성된 경우 재조합 기술에 의해 발현될 수 있다. 재조합 발현의 경우, 관련 화합물을 암호화하는 핵산은 암호화 서열을 운반하는 클로닝 또는 발현 벡터를 형성하기 위해 보통 적합한 벡터 내에 삽입된다. 적용 목적 및 유형에 따라, 벡터는 플라스미드, 파아지, 코스미드, 미니염색체, 또는 바이러스의 형태일 수 있지만, 또한 단지 일시적으로 특정 세포에서 발현되는 네이키드(naked) DNA도 중요한 벡터이다. 클로닝 및 발현 벡터(플라스미드 벡터)는 자율적 복제를 할 수 있으므로 후속의 클로닝을 위한 고수준의 발현 또는 고수준의 복제를 목적으로 고복제수(high copy number)를 가능케 한다.
일반적인 개요에서, 발현 벡터는 작동성 결합(operable linkage)에 5'→3' 방향으로 하기 특징들을 포함한다: 관련 암호화 핵산의 발현을 촉진하기 위한 프로모터, 임의로 분비(세포외 위상 또는 적용가능한 경우 원형질막 내로)를 가능케 하는 선도(leader) 펩티드 암호화 핵산 서열, 화합물을 암호화하는 핵산 단편, 및 임의로 터미네이터를 암호화하는 핵산 서열. 이들은 선택성 마커 및 복제 오리진과 같은 추가의 특징을 포함할 수 있다. 프로듀서 균주 또는 세포주에서 발현 벡터와 함께 작동하는 경우 벡터가 숙주 세포 게놈 내로 통합될 수 있는 것이 바람직할 수 있다. 당업자는 적합한 벡터에 매우 익숙할 것이며 그들의 특이적 요구사항에 따라 하나를 고안할 수 있다.
본 발명의 벡터는 화합물을 생산하도록 숙주 세포를 형질전환시키는데 사용된다. 이와 같이 형질전환된 세포는 본 발명의 핵산 단편 및 벡터를 전파하는데 사용되거나 본 발명에 따른 펩티드의 재조합체 생산에 사용되는 배양 세포 또는 세포주일 수 있다.
바람직한 숙주 세포는 마이크로 유기체, 예를 들어, 박테리아(예를 들어 에스케리치아종 (예를 들어, 대장균)), 바실러스(예를 들어, 바실러스 서브틸리스), 살모넬라 또는 마이코박테리움(바람직하게 비병원성, 예를 들어, 엠.보비스 BCG), 효모(예를 들어, 사카로마이세스 세레비지에), 및 원생동물이다. 대안적으로, 숙주 세포는 다세포 유기체로부터 유래될 수 있으며, 예컨데 이는 진균 세포, 곤충 세포, 식물 세포 또는 포유류 세포일 수 있다. 클로닝 및/또는 최적화된 발현을 목적으로, 적용가능한 벡터 또는 핵산 단편을 복제할 수 있는 숙주 세포가 바람직하다. 핵산 단편을 발현하는 세포가 본 발명의 실시양태에서 유용하며; 이들은 화합물의 소량 스케일 또는 대량 스케일 제조에 사용될 수 있다. 형질전환된 세포를 사용하여 화합물을 생산하는 경우, 비록 필수적이지는 않지만, 발현 산물이 배양 배지 내로 분비되는 것이 편리하다.
이러한 핵산, 발현 벡터 및 숙주 세포는 본 화합물 자체에 의해 치료될 수 있는, 본 명세서에 언급된 임의의 병태를 치료하는데 사용될 수 있는 것으로 이해될 것이다. 예를 들어, 본 화합물을 암호화하는 핵산, 특히 이러한 핵산을 함유하는 발현 벡터가 대상에게 직접 투여되어 핵산이 흡수되고 대상 자체의 세포에 의해 화합물이 생산되는 것이 적합할 수 있다. 바람직하게는 화합물이 핵산을 함유하는 세포에 의해 분비된다. 유사하게, 화합물을 생산하고 분비할 수 있는 숙주 세포가 대상에게 투여되어 화합물이 인사이투(in situ)로 생산될 수 있다. 숙주 세포가 처리되어(예를 들어, 캡슐화되어) 수령하는 대상에 대한 면역성을 억제하거나 감소시킬 수 있다. 따라서, 본 화합물을 포함하는 치료제 조성물, 본 화합물의 투여, 또는 이러한 화합물의 치료적 용도에 관한 사항은 문맥상 달리 요구되지 않는 한 본 명세서에 기술된 핵산, 발현 벡터 또는 숙주 세포의 동등한 용도에도 참조되는 것으로 해석되어야 한다.
실시예
실시예
1. 활동 심장 모델에서 수축촉진제 효과의 결정
대조군 및 인슐린-저항성 JCR:LA-cp 랫트로부터 적출된 활동 심장(working heart)(Lopaschuk, GD and Barr, RL. Measurements of fatty acid and carbohydrate metabolism in the isolated working rat heart. Molecular and Cellular Biochemistry. 1997; 172: 137-147)에서 심장 기능, 대사 및 에너지 상태에 대한 수축촉진제 화합물 글루카곤 및 글루카곤-GLP-1 이중 작용제(HSQGTFTSDYSKYLDRARADDFVAWLKST의 서열을 갖는 화합물 12)의 효과를 평가하였다. 적출된 활동 심장을 크렙스-헨셀라이트 용액(Krebs-Henseleit solution; 11 mM 글루코오스, 2000 μU/ml 인슐린, 1.25 mM free Ca2 +, 0.8 mM 팔미테이트 및 3% BSA)을 사용한 호기성 관류에 적용하고, 관류 중에 글루카곤 또는 화합물 12의 농도를 증가시키면서(10, 50, 및 100 mM) 관류 완충액에 첨가하였다. 관류 후, 고에너지 포스페이트 뉴클레오티드 농도를 고성능 액체 크로마토그래피(HPLC)로 측정하였다(Ally, A and Park, G. Rapid determination of creatine, phosphocreatine, purine bases and nucleotides (ATP, ADP, AMP, GTP, GDP) in heart biopsies by gradient ion-pair reversed-phase liquid chromatography. Journal of Chromatography. 1992; 575: 19-27).
글루카곤과 화합물 12는 정상(데이터를 나타내지 않음) 및 인슐린-저항성 JCR-LA 랫트에서 심장 기능에 대해 유사한 수축 효과를 나타내었다(도 1). 심장 기능에 대한 유사한 효과 및 이에 따른 심장 에너지 요구량에도 불구하고, 글루카곤과 화합물 12는 인슐린 저항성 심장의 에너지 상태에 대해 통계적으로 유의하게 상이한 효과를 나타내었다(도 2). 구체적으로, 글루카곤에 의한 처리는 통계적으로 유의한 AMP 및 ADP 수준에 있어서의 증가 및 이에 따라 감소된 ATP/AMP 및 ATP/ADP 비율을 유발하였다. 그러나, 화합물 12로 처리한 후에는 심장의 에너지 상태가 비히클이 관류된 심장과 유의하게 상이하지 않았다. GLP-1 작용제 엑센딘-4[1-39]-K6(H-HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAS-K6-NH2)(화합물 241)에 의해서는 아무런 효과도 관찰되지 않았다(데이터를 나타내지 않음).
실시예
2.
GLP
-1 및 글루카곤 수용체에서의 효능 결정
인간 글루카곤 수용체 또는 인간 GLP-1R(구체적인 사항은 상기 참조)을 발현하는 HEK293 세포를 0.01% 폴리-L-리신이 코팅된 96-웰 마이크로타이터 플레이트에 웰당 40,000개 세포로 파종하고 100 ㎕ 성장 배지 중에서 1일간 배양 중에 성장시켰다. 분석일에, 성장 배지를 제거하고 세포를 200㎕ 타이로드(Tyrode) 완충액으로 한번 세척하였다. 농도를 증가시킨 시험 펩티드, 100 μM IBMX 및 6 mM 글루코오스를 함유하는 100 ㎕ 타이로드 완충액에서 15분간 37℃로 세포를 배양하였다. 25 ㎕ 0.5 M HCl을 첨가하여 반응을 중지시키고 얼음위에서 60분간 배양하였다. 퍼킨-엘머사의 플래쉬플레이트? cAMP 키트를 사용하여 cAMP 함량을 산정하였다. 컴퓨터 보조를 받은 곡선 피팅(fitting)에 의해 EC50 수치를 산정하였다.
| 화합물 번호 | 시료 화합물 |
EC
50
(
nM
)
GLP -1R |
EC
50
(
nM
)
GluR |
| 1 | H- HSQGTFTSDYSKYLDSRRAQDFVWLMNT - OH (인간 글루카곤) | 2,0 | 0,1 |
| 12 | H-HSQGTFTSDYSKYLDRARADDFVAWLKST-NH2 | 0.23 | 0.50 |
| 242 | H-HSQGTFTSDYSAYLDSRRAQDFVWLMNT-NH2 | 1,4 | 0,4 |
| 243 | H-HSQGTFTSDYSKYLDSERAQDFVWLMNT-NH2 | 0,6 | 0,06 |
| 244 | H-HSQGTFTSDYSKYLDSRHAQDFVWLMNT-NH2 | 0,5 | 0,05 |
| 245 | H-HSQGTFTSDYSKYLDSRSAQDFVWLMNT-NH2 | 0,1 | 0,05 |
| 246 | H-HSQGTFTSDYSKYLDSRAAQDFVWLMNT-NH2 | 0,3 | 0,05 |
| 247 | H-HSQGTFTSDYSKYLDSRYAQDFVWLMNT-NH2 | 0,3 | 0,1 |
| 248 | H-HSQGTFTSDYSKYLDSRRAQDFVWLESA-NH2 | 0,5 | 0,1 |
| 249 | H-HSQGTFTSDYSKYLDSRRAQDFVWLKSA-NH2 | 0,1 | 0,1 |
| 250 | H-HSQGTFTSDYSKYLDSRRAQDFVWLKRA-NH2 | 0,3 | 0,1 |
| 251 | H-HSQGTFTSDYSKYLDSRRAQDFVWLERA-NH2 | 0,2 | 0,1 |
| 252 | H-HSQGTFTSDYSRYLDSRRAKDFVWLLNT-NH2 | 0,5 | 0,3 |
| 253 | H-HSQGTFTSDYSRYLDSRRAQDFVWLLNT-NH2 | 0,2 | 0,1 |
| 254 | H-HSQGTFTSDYSRYLDSRRAQDFVWLLNK-NH2 | 0,2 | 0,2 |
| 255 | H-HSQGTFTSDYSKYLDSALAQDFVWLLNT-NH2 | 0,24 | 0,1 |
| 256 | H-HSQGTFTSDYSKYLDKRRAEDFVWLMNT-NH2 | 0,2 | 0,07 |
| 257 | H-HSQGTFTSDYSKYLDK()RRAE()DFVWLMNT-NH2 | 0,1 | 0,09 |
| 258 | H-HSQGTFTSDYSRYLDERRAQDFVWLMNT-NH2 | 0,07 | 0,06 |
| 259 | H-HSQGTFTSDYSK()YLDE()RRAQDFVWLMNT-NH2 | 0,04 | 0,03 |
| 120 | H-HSQGTFTSDYSKYLDSRRAQDFIEWLMNT-NH2 | 0,2 | 0,2 |
| 260 | H-HSQGTFTSDYSKYLDSKAAQDFVWLMNT-NH2 | 0,02 | 0,07 |
| 48 | H-HSQGTFTSDYSKYLDSKAAHDFVEWLLRA-NH2 | 0,06 | 0,06 |
| 44 | H-H-DSer-QGTFTSDYSKYLDSKAAHDFVEWLLRA-NH2 | 0,09 | 0,11 |
| 45 | H-H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLRA-NH2 | 0,08 | 0,06 |
| 261 | H-HSQGTFTSDYSKYLDSKAAHDFVE()WLLK()A-NH2 | 0,03 | 0,07 |
| 202 | H-HSQGTFTSDYSKYLD-K(헥사데카노일-γ-Glu)-KAAHDFVEWLLRA-NH2 | 0,20 | 0,13 |
| 262 | H-HSQGTFTSDYSKYLD-S-K(헥사데카노일-γ-Glu)-AAHDFVEWLLRA-NH2 | 0,11 | 0,12 |
| 204 | H-HSQGTFTSDYSKYLDSKAA-K(헥사데카노일-γ-Glu)-DFVEWLLRA-NH2 | 0,10 | 0,04 |
| 203 | H-HSQGTFTSDYSKYLDSKAAHDFVEWL-K(헥사데카노일-γ-Glu)-RA-NH2 | 0,57 | 0,22 |
| 205 | H-HSQGTFTSDYSKYLDSKAAHDFVEWLL-K(헥사데카노일-γ-Glu)-A-NH2 | 0,09 | 0,10 |
| 208 | H-H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVEWLLSA-NH2 | 0,11 | 0,16 |
| 263 | H-H-Aib-QGTFTSDYSKYLDE-K(헥사데카노일-γ-Glu)-RAKDFIEWLLSA-NH2 | 0,10 | 0,16 |
| 207 | H-H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AARDFVAWLLRA-NH2 | 0,12 | 0,17 |
| 213 | H-H-Aib-QGTFTSDYSKYLDSKAA-K(헥사데카노일-γ-Glu)-DFVAWLLRA-NH2 | 0,15 | 0,63 |
| 206 | H-H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVEWLLRA-NH2 | 0,09 | 0,16 |
| 209 | H-H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLL-K(헥사데카노일-γ-Glu)-A-NH2 | 0,27 | 0,27 |
| 210 | H-H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-γ-Glu)-AAHDFVE()WLLK()A-NH2 | 0,08 | 0,26 |
| 214 | H-H-Aib-QGTFTSDYSKYLDS-K(도데카노일-γ-Glu)-AAHDFVEWLLSA-NH2 | 0,14 | 0,78 |
| 215 | H-H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-[3-아미노프로파노일])-AAHDFVEWLLSA-NH2 | 0,23 | 1,87 |
| 216 | H-H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-[8-아미노옥타노일])-AAHDFVEWLLSA-NH2 | 0,24 | 0,46 |
| 217 | H-H-Aib-QGTFTSDYSKYLDS-K(헥사데카노일-ε-Lys)-AAHDFVEWLLSA-NH2 | 0,09 | 0,39 |
괄호 ()는 분자내 락탐환을 나타낸다.
실시예
3. 마취시킨
랫트에서의
생체내
수축 효과의 평가
약 300-400g(Taconic) 무게의 마취된 수컷 스프라그-도울리 랫트에서 수축촉진제 화합물 1과 글루카곤-GLP-1 이중-작용제(화합물 12)의 심장 기능 및 심박수에 대한 효과를 조사하였다.
마취가 완료될 때까지 랫트를 1:2 N2O:O2 중의 5% 이소플루란에 노출시켰다. 체온을 일정하게 유지하며(37.5 ± 0.5℃) 기관내 캐눌라를 통해 인위적으로 동물을 환기시키고(ventilated) 마취 상태를 유지하였다.
약물 투여를 위해 왼쪽 대퇴 정맥으로 카테터를 삽입하고 오른쪽 목동맥을 통해 왼쪽 심실에 압력-부피 카테터를 삽입하였다. 기구를 삽입한 후, 실험 중에 순수한 O2 내에서 이소플루란을 전달하였다. 20분간 안정화시킨 후, 비히클을 주입하는 (7 ㎕/분의 속도) 15분 동안 기준선(baseline) 데이터를 기록하였다. 그 후, 화합물을 주입하였다. 2.5 nmol/kg/분의 투여량(또는 심장박동 또는 맥박 활동이 40% 초과로 증가한다면 더 낮은 투여량)으로 주입한 후, 15분간 비히클을 주입하고 그 후에 동물을 안락사시켰다.
심장 혈류 역학 파라미터에 대한 화합물 1 및 다양한 이중 글루카곤-GLP-1 작용제(화합물 7, 9, 12, 35, 37, 206)의 효과를 마취된 랫트에서 조사하였다. 심장 맥박 활동은 일정 부피의 혈액을 대동맥 내로 분출하기 위하여 심실이 수행할 필요가 있는 활동, 및 이에 따라 심장의 수축 상태의 양호한 대표적 예시를 설명한다. 각 화합물에 대한 주입 투여량의 함수로서 측정된 맥박 활동을 도 4a-d에 나타내었다. 맥박 활동에서 수평선은 40% 증가를 표시하는데, 이는 실험 중에 얻어져야만 하는 최대 증가로서 정의되었다. 화합물 1은 각각 0,1 및 0,2 nmol/kg/분의 주입 속도에서 약 40%로 맥박 활동을 증가시키며(도 4b 및 4c), 그 후 이 화합물의 주입을 중단하였다. 화합물 12 및 화합물 7을 제외한 모든 이중 글루카곤-GLP-1 작용제는 소정의 주입 속도에서 40%로 맥박 활동을 증가시켰다. 아실화되어 좀더 안정한 화합물 206의 경우 맥박 활동이 오랜 기간 증가하였는데, 이는 화합물 주입 중에 계속되었고 최종 비히클 주입에 이르기까지 높게 유지되었다.
동일 실험에서, 혈류 역학 파라미터로부터 심박수를 계산하였으며, 결과를 각 주입 속도에 대한 심박수의 변화를 나타낸 도 5에 도시하였다. 각각의 막대는 상이한 화합물을 나타낸다. 0.1 nmol/kg/분 및 더 높은 투여량에서, 화합물 1은 대조군과 비교하여 심박수에서 유의한 증가를 보였다(도 5b 및 c). 다른 화합물 중의 어느 것도 투여량에 따른 유의한 심박수 변화를 보이지 않았지만, 화합물 35 및 37은 둘 다 0.2 및 0.5 nmol/kg/분에서 심박수를 증가시키는 경향이 있었다(도 5c 및 d).
상기 결과와 관련하여, 글루카곤은 심장 수축성을 증가시키는 것으로 알려져있지만, 부수적인 심박수의 증가는 심근 산소 요구량을 증가시키고, 이는 심장동맥 질환을 앓는 환자의 협심증을 촉진할 수 있어 심부전 환자에게 상당한 위험을 부과한다. 본 실험은 이중 글루카곤-GLP-1 작용제가 글루카곤과 동일한 정도로 심장 수축 상태를 개선할 수 있음을 보여준다. 그러나, 수축성의 증가는 글루카곤 주입의 경우 관찰되는 심박수의 증가와 연관되지 않는 것으로 보인다. 종합하면, 상기 결과는 이중 글루카곤-GLP-1 작용제가 글루카곤에서 관찰되는 심박수의 부수적인 증가를 유발하지 않고 심장 수축성을 개선함으로써 작용함을 나타낸다.
Claims (154)
- 글루카곤-GLP-1 이중 작용제를 양성 수축촉진제(positive inotropic agent)로서 대상에게 투여하는 단계를 포함하는, 대상의 울혈성 심부전, 수축기 기능장애, 확장기 기능장애, 심근경색, 허혈성 심장질환, 당뇨성 심근병증 또는 이의 조합과 같은 심장 질환 또는 심장 기능장애를 치료하는 방법.
- 제1항에 있어서, 12 시간, 24 시간, 36 시간, 48 시간, 3일, 4일, 5일, 6일, 7일, 8일, 9일, 10일, 11일, 12일, 13일 또는 14일, 2 주, 3 주, 4 주, 1 달, 2 달, 3 달, 4 달 또는 5 달보다 긴 기간 동안 상기 대상을 글루카곤-GLP-1 이중 작용제로 치료하는 방법.
- 제1항 또는 제2항에 있어서, 상기 대상을 하기 기간 동안 치료하는 방법:
1 주 내지 6 주, 2 주 내지 6 주, 3 주 내지 6 주, 4 주 내지 6 주, 5 주 내지 6 주, 1 주 내지 5 주, 2 주 내지 5 주, 3 주 내지 5 주, 4 주 내지 5 주;
1 주 내지 4 주, 2 주 내지 4 주, 3 주 내지 4 주;
1 주 내지 3 주, 2 주 내지 3 주;
1 주 내지 6 달, 1 주 내지 5 달, 1 주 내지 4 달, 1 주 내지 3 달, 1 주 내지 2 달, 1 주 내지 1 달;
2 주 내지 6 달, 2 주 내지 5 달, 2 주 내지 4 달, 2 주 내지 3 달, 2 주 내지 2 달, 2 주 내지 1 달;
3 주 내지 6 달, 3 주 내지 5 달, 3 주 내지 4 달, 3 주 내지 3 달, 3 주 내지 2 달, 3 주 내지 1 달;
4 주 내지 6 달, 4 주 내지 5 달, 4 주 내지 4 달, 4 주 내지 3 달, 4 주 내지 2 달, 4 주 내지 1 달;
1 달 내지 6 달, 2 달 내지 6 달, 3 달 내지 6 달, 4 달 내지 6 달, 5 달 내지 6 달;
1 달 내지 5 달, 2 달 내지 5 달, 3 달 내지 5 달, 4 달 내지 5 달;
1 달 내지 3 달, 2 달 내지 3 달, 또는 1 달 내지 2 달의 기간. - 제 1항 내지 제 3항 중 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 정맥내, 피하 또는 경피 경로로 투여되는 방법.
- 제 1항 내지 제 4항 중 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 심부전, 당뇨, 비만, 심근경색, 하이포리피데미아(hypolipidemia) 또는 고혈압 치료제와 조합하여 투여되는 방법.
- 제 1항 내지 제 5항 중 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 하기 화학식의 화합물을 갖는 화합물, 또는 그의 약제학적으로 허용되는 염 또는 유도체인 방법:
R1-X-Z1-Z2-R2
상기 식에서
R1은 수소, C1 -4 알킬 (예를 들어, 메틸), 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
X는 하기 화학식 I이며:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-X10-Ser-X12-Tyr-Leu-X15-X16-X17-X18-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29
여기에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, 알파,알파-디메틸 이미다졸 아세트산(DMIA), N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, Aib 또는 D-Ser이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X10은 Tyr 또는 Trp이며;
X12는 Lys, Arg, His, Ala, Leu, Dpu, Dpr, Orn, 시트룰린 또는 오르니틴이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Thr, Lys, Arg, His, Glu, Asp, Ala, Gly, Gln, 호모글루탐산 또는 호모시스테인산이고;
X17은 Arg, Lys, His, Glu, Gln, Ala, Leu, Dpu, Dpr, Orn, Cys, 호모시스테인 또는 아세틸 페닐알라닌이며;
X18은 Arg, Lys, His, Tyr, Ala, Ser, Leu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X20는 Gln, Lys, Arg, His, Glu, Asp, Ala, Cys, Orn 또는 시트룰린이며;
X21은 Asp, Glu, Gln, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val, Ile 또는 Leu이며;
X24는 Gln, Lys, Arg, Glu, Asp, Ser, Ala, Leu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Lys, Arg, Glu, Leu, Nle, Cys이거나 존재하지 않으며;
X28은 Asn, Lys, Arg, Glu, Asp, Ser, Ala, Leu, Cys, 시트룰린, Orn이거나 존재하지 않고;
X29은 Thr, Lys, Arg, Glu, Ser, Ala, Gly, Cys, Orn, 호모시스테인, 아세틸 페닐알라닌이거나 존재하지 않으며;
R2는 NH2 또는 OH이고;
Z1은 존재하지 않거나 하기 서열을 가지며:
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser;
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys;
Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala; 또는
Lys-Arg-Asn-Arg;
Z2는 존재하지 않거나, Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이고;
여기에서,
Z1이 존재하는 경우, X27, X28 및 X29도 존재하며;
Z1이 존재하지 않는 경우, 상기 화합물은 하나 이상의 X1, X2, X3, X10, X12, X15, X16, X17, X18, X20, X21, X23, X24, X27, X28 및 X29 위치에서 인간 글루카곤과 비교하여 치환 또는 결실을 갖고;
여기에서 상기 화합물은 인간 글루카곤보다 높은 GLP-1 수용체 선택성을 가진다. - 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 하기 화학식을 갖는 화합물, 또는 그의 약제학적으로 허용되는 염인 방법:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 IV의 펩티드를 갖거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Ile-Glu-Trp-Leu-Leu-Ser-Ala, 또는
화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이하며:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys, Arg으로부터 선택되며;
위치 18의 잔기가 Ala이고;
위치 20의 잔기가 Gln, Arg, Glu, Asp로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 23의 잔기가 Val이며;
위치 24의 잔기가 Gln, Asp, Lys, Arg, Ala으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys으로부터 선택되거나 존재하지 않으며;
위치 28의 잔기가 Asn, Arg, Lys, Ala, Glu, Asp로부터 선택되거나 존재하지 않고;
위치 29의 잔기가 Thr, Arg으로부터 선택되거나 존재하지 않으며;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 서열이다. - 제7항에 있어서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이한 방법:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys으로부터 선택되며;
위치 20의 잔기가 Gln, Arg, Glu로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys으로부터 선택되며;
위치 28의 잔기가 Asn, Arg, Ala으로부터 선택된다. - 제7항 또는 제8항에 있어서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 3개 이하의 위치에서 화학식 IV와 상이한 방법:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys으로부터 선택되며;
위치 20의 잔기가 Gln, Arg, Glu로부터 선택된다. - 제7항 내지 제9항 중의 어느 한 항에 있어서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이한 방법:
위치 2의 잔기가 D-Ser, Aib로부터 선택되고;
위치 16의 잔기가 Ser, Asp, Lys으로부터 선택되며;
위치 18의 잔기가 Ala이고;
위치 20의 잔기가 Gln, Arg, Glu로부터 선택된다. - 제7항 내지 제10항 중의 어느 한 항에 있어서, X가 화학식 IV와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 IV와 상이한 방법:
위치 23의 잔기가 Val이며;
위치 24의 잔기가 Gln, Asp, Lys, Arg, Ala으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys으로부터 선택되며;
위치 28의 잔기가 Asn, Arg, Ala으로부터 선택된다. - 제7항 내지 제11항 중의 어느 한 항에 있어서, 하나 이상의 분자내 브릿지(bridge)가 펩티드 서열 X 내에서 형성되는 방법.
- 제12항에 있어서, 각 브릿지가 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 형성되는 방법.
- 제12항 또는 제13항에 있어서, 상기 위치 16 및 20의 잔기가 염 브릿지를 형성하는 방법.
- 제14항에 있어서, 상기 위치 16 및 20의 잔기가 하기에서 선택되는 방법:
16-Asp, 20-Lys;
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu;
16-Arg, 20-Glu. - 제12항 또는 제13항에 있어서, 상기 위치 20 및 24의 잔기가 염 브릿지를 형성하는 방법.
- 제16항에 있어서, 상기 위치 20 및 24의 잔기가 하기에서 선택되는 방법:
20-Asp, 24-Lys;
20-Glu, 24-Lys;
20-Asp, 24-Arg;
20-Glu, 24-Arg;
20-Lys, 24-Asp;
20-Arg, 24-Asp;
20-Lys, 24-Glu;
20-Arg, 24-Glu. - 제7항 내지 제17항 중의 어느 한 항에 있어서, X가 하나 이상의 하기 잔기 세트를 포함하는 방법:
20-Lys, 24-Glu;
20-Lys, 23-Ile, 24-Glu;
16-Glu, 20-Lys;
16-Glu, 20-Lys, 29-Ala;
16-Glu, 20-Lys, 23-Ile, 24-Glu;
16-Glu, 20-Lys, 23-Ile, 24-Glu, 29-Ala;
16-Glu, 20-Lys, 24-Glu, 29-Ala;
20-Lys, 23-Ile, 24-Glu, 29-Ala;
27-Leu, 28-Ser, 29-Ala;
29-Ala;
16-Ser;
20-Gln;
23-Val;
24-Gln;
16-Ser, 20-Gln;
16-Asp, 20-Arg, 24-Asp;
16-Lys, 20-Glu;
24-Arg; 또는
28-Arg. - 제7항 내지 제18항 중의 어느 한 항에 있어서, X가 하기 서열을 갖는 방법:
HSQGTFTSDYSKYLDERRAKDFIEWLLSA.;
HSQGTFTSDYSKYLDERRAQDFIEWLLSA;
HSQGTFTSDYSKYLDERRAKDFVEWLLSA;
HSQGTFTSDYSKYLDERRAKDFIQWLLSA;
HSQGTFTSDYSKYLDSRRAQDFIEWLLSA;
HSQGTFTSDYSKYLDDRRARDFIDWLLSA;
HSQGTFTSDYSKYLDKRRAEDFIKWLLSA;
HSQGTFTSDYSKYLDERRAKDFIRWLLSA;
HSQGTFTSDYSKYLDERRAKDFIEWLLRA;
HSQGTFTSDYSKYLDSRRAKDFIEWLLSA;
HSQGTFTSDYSKYLDERAAKDFIEWLLSA;
HSQGTFTSDYSKYLDERRAKDFIDWLLSA; 또는
HSQGTFTSDYSKYLDERRAKDFIEWLLAA. - 제6항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 하기 화학식을 갖는 화합물 또는 그의 약제학적으로 허용되는 염인 방법:
R1-X-Z2-R2
상기 식에서,
R1은 수소, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 II을 갖는 펩티드이거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Arg-Ala-Arg-Ala-Asp-Asp-Phe-Val-Ala-Trp-Leu-Lys-Glu-Ala 또는
화학식 I과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 II와 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Lys, Asp, Glu이며;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되고;
위치 20의 잔기가 Gln, His, Lys, Arg, Glu로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 24의 잔기가 Gln, Leu, Glu, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Arg, Glu, Leu으로부터 선택되거나 존재하지 않고;
위치 28의 잔기가 Asn, Ser, Arg, Lys, Ala, Leu, Glu, Asp로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 서열이다. - 제20항에 있어서, X가 화학식 II와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 II와 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, His, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Glu, Lys, Arg으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Arg, Glu, Leu으로부터 선택되고;
위치 28의 잔기가 Asn, Ser, Arg, Lys, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다. - 제20항에 있어서, X가 잔기 27-Lys 및 28-Ser을 포함하는 방법.
- 제22항에 있어서, X가 화학식 II와 상이한 경우, 하기 위치들 중 하나 또는 두 개의 위치에서 화학식 II와 추가로 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, His, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Glu, Lys, Arg으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다. - 제20항 내지 제23항 중 어느 한 항에 있어서, 하나 이상의 분자내 브릿지가 펩티드 서열 X 내에서 형성되는 방법.
- 제24항에 있어서, 각 브릿지가 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 형성되는 방법.
- 제24항 또는 제25항에 있어서, 상기 위치 16 및 20의 잔기가 염 브릿지를 형성하는 방법.
- 제26항에 있어서, 상기 염 브릿지가 하기 잔기 쌍 중의 하나 사이에서 형성되는 방법:
16-Asp, 20-Lys;
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu; 및
16-Arg, 20-Glu. - 제20항 내지 제27항 중의 어느 한 항에 있어서, X가 하나 이상의 하기 잔기 세트를 포함하는 방법:
16-Arg;
16-Arg, 20-Asp;
16-Arg, 20-Asp, 24-Ala;
16-Arg, 20-Asp, 27-Lys, 28-Ser;
16-Arg, 20-Asp, 29-Ala;
16-Arg, 27-Lys, 28-Ser;
16-Arg, 27-Lys, 28-Ser, 29-Ala;
24-Ala, 27-Lys, 28-Ser;
24-Ala, 27-Lys, 28-Ser, 29-Ala;
24-Ala;
27-Lys;
28-Ser;
20-Glu, 28-Ser, 29-Thr;
24-Glu, 28-Ser, 29-Thr;
27-Glu, 28-Arg;
2-D-Ser, 28-Ser, 29-Thr; 또는
20-His, 28-Ser, 29-Thr. - 제20항 내지 제28항 중의 어느 한 항에 있어서, X가 하기 서열을 갖는 방법:
HSQGTFTSDYSKYLDRARADDFVAWLKSA;
HSQGTFTSDYSKYLDRARADDFVAWLKEA;
HSQGTFTSDYSKYLDRARAEDFVAWLKST;
HSQGTFTSDYSKYLDRARADDFVEWLKST;
HSQGTFTSDYSKYLDRARADDFVAWLERA;
H-DSer-QGTFTSDYSKYLDRARADDFVAWLKST;
HSQGTFTSDYSKYLDRARAHDFVAWLKST; 또는
HSQGTFTSDYSKYLDRARADDFVAWLKST. - 제1항 내지 제6항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 하기 화학식을 갖는 화합물 또는 그의 약제학적으로 허용되는 염인 방법:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 III을 갖는 펩티드이거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Leu-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Ile-Glu-Trp-Leu-Glu-Ser-Ala 또는
화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly, Asp로부터 선택되며;
위치 17의 잔기가 Lys, Leu으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, His, Arg, Glu, Asp로부터 선택되고;
위치 21의 잔기가 Glu이며;
위치 23의 잔기가 Val, Leu으로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Leu으로부터 선택되거나 존재하지 않고;
위치 28의 잔기가 Asn, Arg, Lys, Glu, Ala, Leu, Asp로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이다. - 제30항에 있어서, X가 화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 17의 잔기가 Lys, Leu으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 23의 잔기가 Val, Leu으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys, Arg, Leu으로부터 선택되며;
위치 28의 잔기가 Asn, Arg, Lys, Glu, Ala, Leu으로부터 선택되고;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다. - 제30항 또는 제31항에 있어서, X가 화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 17의 잔기가 Lys, Leu으로부터 선택되고;
위치 18의 잔기가 Lys, His, Ala, Ser, Tyr으로부터 선택되며;
위치 23의 잔기가 Val, Leu으로부터 선택된다. - 제30항 내지 제32항 중의 어느 한 항에 있어서, X가 화학식 III과 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 III과 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 23의 잔기가 Val, Leu으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Leu으로부터 선택되고;
위치 28의 잔기가 Asn, Arg, Lys, Glu, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다. - 제30항 내지 제33항 중의 어느 한 항에 있어서, X가 하나 이상의 하기 잔기 세트를 포함하는 방법:
20-Lys, 24-Glu;
20-Lys, 24-Glu, 29-Ala;
20-Lys, 23-Ile, 24-Glu;
27-Glu, 28-Ser, 29-Ala;
29-Ala;
20-Gln;
23-Val;
24-Gln;
29-Thr;
27-Met, 28-Asn, 29-Thr;
20-Gln, 23-Val, 24-Gln;
20-Glu, 24-Lys; 또는
28-Arg. - 제30항 내지 제34항 중의 어느 한 항에 있어서, 하나 이상의 분자내 브릿지가 펩티드 서열 X 내에서 형성되는 방법.
- 제35항에 있어서, 각 브릿지가 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 형성되는 방법.
- 제35항 또는 제36항에 있어서, 브릿지가 잔기 쌍 16 및 20, 17 및 21, 20 및 24, 또는 24 및 28의 측쇄 사이에 형성되는 방법.
- 제37항에 있어서, 상기 위치 20 및 24의 잔기가 분자내 브릿지를 형성하는 방법.
- 제38항에 있어서, 상기 위치 20 및 24의 잔기가 하기 중에서 선택되는 방법:
20-Asp, 24-Lys;
20-Glu, 24-Lys;
20-Asp, 24-Arg;
20-Glu, 24-Arg;
20-Lys, 24-Asp;
20-Arg, 24-Asp;
20-Lys, 24-Glu; 및
20-Arg, 24-Glu. - 제30항 내지 제39항 중의 어느 한 항에 있어서, X가 하기 서열을 갖는 방법:
HSQGTFTSDYSLYLDSRRAQDFIEWLESA;
HSQGTFTSDYSLYLDSRRAKDFVEWLESA;
HSQGTFTSDYSLYLDSRRAKDFIQWLESA;
HSQGTFTSDYSLYLDSRRAKDFIEWLEST;
HSQGTFTSDYSLYLDSRRAKDFIEWLMNT;
HSQGTFTSDYSLYLDSRRAQDFVQWLESA;
HSQGTFTSDYSLYLDSRRAEDFIKWLESA; 또는
HSQGTFTSDYSLYLDSRRAKDFIEWLERA. - 제1항 내지 제6항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 하기 화학식을 갖는 화합물 또는 그의 약제학적으로 허용되는 염인 방법:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 V를 갖는 펩티드이거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Lys-Ala-Ala-His-Asp-Phe-Val-Glu-Trp-Leu-Leu-Arg-Ala 또는
화학식 V와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 V와 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 12의 잔기가 Leu, Arg, Dpu, Dpr, Orn으로부터 선택되며;
위치 16의 잔기가 Arg, His, Lys, Glu, Asp으로부터 선택되고;
위치 17의 잔기가 Arg, Leu, Dpu, Dpr, Orn으로부터 선택되며;
위치 18의 잔기가 Arg, Lys, His, Ser, Tyr으로부터 선택되고;
위치 20의 잔기가 Gln, Lys, Arg, Glu, Asp로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되거나 존재하지 않고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu, Asp으로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이다. - 제41항에 있어서, X가 화학식 V와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 V와 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu로부터 선택되며;
위치 17의 잔기가 Arg, Leu으로부터 선택되고;
위치 18의 잔기가 Arg, Lys, His, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다. - 제41항 또는 제42항에 있어서, X가 화학식 V와 상이한 경우, 하기 위치들 중4개 이하의 위치에서 화학식 V와 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg으로부터 선택되고;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되며;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu으로부터 선택되고;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다. - 제41항 내지 제43항 중의 어느 한 항에 있어서, X가 하나 이상의 하기 잔기 세트를 포함하는 방법:
17-Lys, 18-Ala;
17-Leu, 18-Ala;
17-Lys, 18-Ala, 20-His;
17-Leu, 18-Ala, 20-His;
17-Lys, 18-Ala, 24-Glu;
17-Leu, 18-Ala, 24-Glu;
17-Lys, 18-Ala, 27-Leu;
17-Leu, 18-Ala, 27-Leu;
17-Lys, 18-Ala, 29-Ala;
17-Leu, 18-Ala, 29-Ala;
17-Lys, 18-Ala, 27-Leu, 29-Ala;
17-Leu, 18-Ala, 27-Leu, 29-Ala;
17-Lys, 18-Ala, 27-Leu, 28-Arg, 29-Ala;
17-Leu, 18-Ala, 27-Leu, 28-Arg, 29-Ala;
24-Glu, 28-Arg;
24-Glu, 28-Arg, 27-Leu;
24-Glu, 28-Arg, 27-Leu, 29-Ala;
27-Leu, 28-Arg, 29-Ala;
29-Ala;
20-Arg, 24-Arg, 27-Lys, 28-Leu;
17-Arg;
18-Arg;
20-Gln;
24-Gln;
27-Met, 28-Asn, 29-Thr; 또는
24-Lys
및 그의 조합. - 제41항 내지 제45항 중의 어느 한 항에 있어서, X가 하기 서열을 갖는 방법:
HSQGTFTSDYSKYLDSKAARDFVRWLKLA;
HSQGTFTSDYSKYLDSRAAHDFVEWLLRA;
HSQGTFTSDYSKYLDSKRAHDFVEWLLRA;
HSQGTFTSDYSKYLDSKAAQDFVEWLLRA;
HSQGTFTSDYSKYLDSKAAHDFVQWLLRA;
HSQGTFTSDYSKYLDSKAAHDFVEWLMNT;
HSQGTFTSDYSKYLDSKAAHDFVKWLLRA;
H-DSer-QGTFTSDYSKYLDSKAAHDFVEWLLRA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLRA;
HSQGTFTSDYSKYLDSKAAKDFVEWLLRA;
HSQGTFTSDYSKYLDKKAAHDFVEWLLRA 또는
HSQGTFTSDYSKYLDSKAAHDFVEWLLRA. - 제1항 내지 제6항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 하기 화학식을 갖는 화합물 또는 그의 약제학적으로 허용되는 염인 방법:
R1-X-Z2-R2
상기 식에서,
R1은 H, C1 -4 알킬, 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
R2는 OH 또는 NH2이며;
X는 하기 화학식 VI을 갖는 펩티드이거나:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Lys-Ala-Ala-His-Asp-Phe-Val-Glu-Trp-Leu-Leu-Arg-Ala 또는
화학식 VI와 상이한 경우, 하기 위치들 중 5개 이하의 위치에서 화학식 VI와 상이하며:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu로부터 선택되며;
위치 17의 잔기가 Arg, Leu, Dpu, Dpr, Orn으로부터 선택되고;
위치 20의 잔기가 Gln, Lys, Arg, Glu, Asp로부터 선택되며;
위치 21의 잔기가 Glu이고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg, Asp로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되거나 존재하지않고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu, Asp로부터 선택되거나 존재하지 않으며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택되거나 존재하지 않고;
Z2는 존재하지 않거나 Ala, Leu, Ser, Thr, Tyr, Cys, Glu, Lys, Arg, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이다. - 제46항에 있어서, X가 화학식 VI와 상이한 경우, 하기 위치들 중 4개 이하의 위치에서 화학식 VI와 상이한 방법:
위치 2의 잔기가 Aib, D-Ser으로부터 선택되고;
위치 16의 잔기가 Arg, His, Lys, Glu, Gly으로부터 선택되며;
위치 17의 잔기가 Arg, Leu으로부터 선택되고;
위치 18의 잔기가 Arg, Lys, His, Ser, Tyr으로부터 선택되며;
위치 20의 잔기가 Gln, Lys, Arg, Glu로부터 선택되고;
위치 24의 잔기가 Gln, Leu, Ala, Lys, Arg으로부터 선택되며;
위치 27의 잔기가 Met, Cys, Lys, Arg, Glu로부터 선택되고;
위치 28의 잔기가 Asn, Ser, Lys, Glu, Ala, Leu으로부터 선택되며;
위치 29의 잔기가 Thr, Glu, Lys으로부터 선택된다. - 제46항 또는 제47항에 있어서, X가 임의의 하기 잔기 세트를 포함하는 방법:
17-Lys, 18-Ala;
17-Leu, 18-Ala;
17-Lys, 18-Ala, 20-His;
17-Leu, 18-Ala, 20-His;
17-Lys, 18-Ala, 24-Glu;
17-Leu, 18-Ala, 24-Glu;
17-Lys, 18-Ala, 27-Leu;
17-Leu, 18-Ala, 27-Leu;
17-Lys, 18-Ala, 29-Ala;
17-Leu, 18-Ala, 29-Ala;
17-Lys, 18-Ala, 27-Leu, 29-Ala;
17-Leu, 18-Ala, 27-Leu, 29-Ala;
17-Lys, 18-Ala, 27-Leu, 28-Arg, 29-Ala;
17-Leu, 18-Ala, 27-Leu, 28-Arg, 29-Ala;
24-Glu, 28-Arg;
24-Glu, 28-Arg, 27-Leu;
24-Glu, 28-Arg, 27-Leu, 29-Ala;
27-Leu, 28-Arg, 29-Ala;
29-Ala;
20-Arg, 24-Arg, 27-Lys, 28-Leu;
17-Arg;
18-Arg;
20-Gln;
24-Gln;
27-Met, 28-Asn, 29-Thr;
24-Lys; 또는
20-Gln, 24-Gln, 27-Met, 28-Asn, 29-Thr; 또는
17-Leu, 20-Gln, 24-Gln, 28-Asn, 29-Thr. - 제46항 내지 제48항 중의 어느 한 항에 있어서, X가 하기 서열을 갖는 방법:
HSQGTFTSDYSKYLDSKAAQDFVQWLMNT 또는
HSQGTFTSDYSKYLDSLAAQDFVQWLLNT. - 제41항 내지 제49항 중의 어느 한 항에 있어서, 상기 펩티드 X가 하나 이상의 분자내 브릿지를 갖는 방법.
- 제50항에 있어서, 각 브릿지가 X의 선형 서열 내 3개 아미노산에 의해 분리된 X의 2개 아미노산 잔기의 측쇄 사이에 형성되는 방법.
- 제50항 또는 제51항에 있어서, 상기 브릿지가 잔기 쌍 12 및 16, 16 및 20, 17 및 21, 20 및 24, 또는 24 및 28의 측쇄 사이에 형성되는 방법.
- 제52항에 있어서, 상기 위치 16 및 20의 잔기가 하기 중에서 선택되는 방법:
16-Glu, 20-Lys;
16-Asp, 20-Arg;
16-Glu, 20-Arg;
16-Lys, 20-Asp;
16-Arg, 20-Asp;
16-Lys, 20-Glu; 및
16-Arg, 20-Glu. - 제1항 내지 제6항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 하기 화학식을 갖는 화합물 또는 그의 약제학적으로 허용되는 염 또는 유도체인 방법:
R1-X-Z1-Z2-R2
상기 식에서
R1은 수소, C1 -4 알킬 (예를 들어, 메틸), 아세틸, 포르밀, 벤조일 또는 트리플루오로아세틸이고;
X는 하기 화학식 VII을 가지며:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-X10-Ser-X12-Tyr-Leu-X15-X16-X17-X18-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29
여기에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, 알파,알파-디메틸 이미다졸 아세트산(DMIA), N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, 아미노이소부티르산 (Aib) 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X10은 Tyr 또는 Trp이며;
X12는 Lys, 시트룰린, Orn 또는 Arg이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X17은 Arg, Gln, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X18은 Arg, Ala, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Gln, Glu, Asp, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X24는 Ala, Gln, Glu, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Arg, 시트룰린, Orn, Lys 또는 Asp이고;
X29은 Thr, Gly, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
R2는 NH2 또는 OH이고;
Z1은 존재하지 않거나 하기 서열을 가지며:
Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser;
Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser Cys;
Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala; 또는
Lys Arg Asn Arg;
Z2는 존재하지 않거나, Ala, Leu, Ser, Thr, Tyr, Asn, Gln, Asp, Glu, Lys, Arg, His, Met, Har, Dbu, Dpr 및 Orn으로 구성된 그룹 중에서 선택된 1-20개 아미노산 단위의 펩티드 서열이고;
여기에서,
Z1이 존재하지 않는 경우, 상기 화합물이 하나 이상의 X1, X2, X3, X10, X12, X15, X16, X17, X18, X20, X21, X23, X24, X27, X28 및 X29 위치에서 인간 글루카곤과 비교하여 치환 또는 결실을 갖고;
여기에서 상기 화합물이 인간 글루카곤보다 높은 GLP-1 수용체 선택성을 가지고/가지거나 상기 화합물이 GLP-1 수용체에서 천연 GLP-1 활성의 적어도 20%를 나타낸다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 1, 2, 3, 5, 7, 10, 11, 13, 14, 17, 18, 19, 21, 24, 27, 28 및 29 중에서 선택된 위치에서 1 내지 3개 아미노산 변형에 의해 화학식 VII과 상이한 방법.
- 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.2를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-X17-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr
여기에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X17은 Arg, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.3을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-X21-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X21은 Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.4를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-X21-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X24는 Gln, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.5를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-X21-Phe-Val-X24-Trp-Leu-X27-Asn-Thr
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X21은 Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X24는 Gln, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.6를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-X21-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr
상기 식에서
X21은 Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.7을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-X24-Trp-Leu-X27-Asn-Thr
상기 식에서
X24는 Gln, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.8을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr
상기 식에서
X16은 Glu, Gln, 호모글루탐산 또는 호모시스테인산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.9을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr
상기 식에서
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.19을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr-X30
상기 식에서
X30은 임의의 적합한 아미노산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.20를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29
상기 식에서
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X24는 Gln 또는 Glu이고;
X28은 Asn, Asp 또는 Lys이며;
X29은 Thr 또는 Gly이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.21을 갖는 방법:
His-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg- Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr
상기 식에서
X2는 D-Ser, Ala, Gly, N-메틸 Ser 또는 아미노이소부티르산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.22를 갖는 방법:
His-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg- Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr
상기 식에서
X2는 아미노이소부티르산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.23를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Cys-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr
상기 식에서
위치 17의 Cys은 PEG화 되어 있고;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.24를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Cys-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr
상기 식에서
위치 21의 Cys는 PEG화 되어 있고;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.25를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Cys-Trp-Leu-X27-Asn-Thr
상기 식에서
위치 24의 Cys는 PEG화 되어 있고;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.30를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser
상기 식에서
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.31을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala
상기 식에서
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.32를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-X27-Asn-Thr-Lys-Arg-Asn-Arg
상기 식에서
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.33를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29
상기 식에서
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이고;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이며;
X20는 Gln 또는 Lys이고;
X24는 Gln 또는 Glu이며;
X28은 Asn, Lys 또는 산성 아미노산이고;
X29은 Thr, Gly 또는 산성 아미노산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.36를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.37을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Cys-Trp-Leu-Met-Asn-Thr
상기 식에서 24 2-부티로락톤은 Cys의 티올기를 통해 결합된다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.38을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Cys-Trp-Leu-Met-Asn-Thr
상기 식에서 24 카복시메틸기는 Cys의 티올기를 통해 결합된다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.39을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Arg-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.40를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-Thr
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.41을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-Thr
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이며;
락탐환은 위치 12 및 16의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.42를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-Thr
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이며;
락탐환은 위치 16 및 20의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.43를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-X28-Thr
상기 식에서
X15은 Glu 또는 Asp이고;
X28은 Glu 또는 Asp이며;
락탐환은 위치 20 및 24의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.44를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-X29
상기 식에서
X15은 Glu 또는 Asp이고;
X29은 Glu 또는 Thr이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.45를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29
상기 식에서
X12는 Lys 또는 Glu이고;
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이며;
X16은 Ser, Gln, Glu, Lys, 호모글루탐산, 시스테인산 또는 호모시스테인산이고;
X20는 Gln, Glu 또는 Lys이며;
X24는 Gln, Lys 또는 Glu이고;
X28은 Asn, Lys 또는 산성 아미노산이며;
X29은 Thr, Gly 또는 산성 아미노산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.46를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-Asn-Thr
상기 식에서
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln 또는 Lys이며;
X24는 Gln 또는 Glu이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.47을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.48을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.49를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Asn-Thr. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.50를 갖는 방법:
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.51를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-X21-Phe-Val-X24-Trp-Leu-Met-X28-X29
상기 식에서
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Asp, Glu, 호모글루탐산 또는 호모시스테인산이고;
X24는 Gln 또는 Glu이며;
X28은 Asn, Lys 또는 산성 아미노산이고;
X29은 Thr, Gly 또는 산성 아미노산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.52를 갖는 방법:
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.53를 갖는 방법:
His-Ser-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Xl6-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-X29
상기 식에서
X3는 Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln 또는 Lys이며;
X24는 Gln 또는 Glu이고;
X28은 Asn, Lys 또는 산성 아미노산이며;
X29는 Thr 또는 산성 아미노산이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.54를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-X17-X18-Ala-Lys-X21-Phe-X23-X24-Trp-Leu-Met-Asn-Thr
상기 식에서
X17은 Arg 또는 Gln이고;
X18은 Arg 또는 Ala이며;
X21은 Asp 또는 Glu이고;
X23는 Val 또는 Ile이며;
X24는 Gln 또는 Ala이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.56을 갖는 방법:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X24는 Ala, Gln, Glu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Lys 또는 Asp이고;
X29은 Thr, Gly, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.57을 갖는 방법:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-X20-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이고;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X23는 Val 또는 Ile이고;
X24는 Ala, Gln, Glu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이고;
X28은 Asn, Lys 또는 Asp이며;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고, 여기에서 락탐 브릿지는 위치 12 및 16의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.58을 갖는 방법:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-Glu-Arg-Arg-Ala-Lys-X21-Phe-X23-X24-Trp-Leu-X27-X28-X29
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X24는 Ala, Gln, Glu, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Lys 또는 Asp이고;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며, 여기에서 락탐 브릿지는 위치 16 및 20의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.59를 갖는 방법:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-Lys-X21-Phe-X23-Glu-Trp-Leu-X27-X28-X29
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X23는 Val 또는 Ile이고;
X27은 Met, Leu 또는 Nle이며;
X28은 Asn, Lys 또는 Asp이고;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며, 여기에서 락탐 브릿지는 위치 20 및 24의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.60을 갖는 방법:
X1-X2-X3-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-X21-Phe-X23-Glu-Trp-Leu-X27-Lys-X29
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, D-Ala, Val, Gly, N-메틸 Ser, Aib 또는 N-메틸 Ala이며;
X3는 Gln, Glu, Orn 또는 Nle이고;
X15은 Asp, Glu, 시스테인산, 호모글루탐산 또는 호모시스테인산이며;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln, Lys, Arg, Orn 또는 시트룰린이며;
X21은 Gln, Glu, Asp, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X23는 Val 또는 Ile이며;
X27은 Met, Leu 또는 Nle이고;
X29은 Thr, Gly, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며, 여기에서 락탐 브릿지는 위치 24 및 28의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.63을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-X16-Arg-Arg-Ala-X20-X21-Phe-Val-X24-Trp-Leu-X27-Asp-Thr
상기 식에서
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이고;
X20는 Gln 또는 Lys이며;
X21은 Asp, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이고;
X24는 Gln, Lys, Cys, Orn, 호모시스테인 또는 아세틸 페닐알라닌이며;
X27은 Met, Leu 또는 Nle이다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.66를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-X29
상기 식에서
X28은 Asp 또는 Asn이고;
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 12 및 16의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.67을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-Arg-Ala-Lys-Asp-Phe-Val-Gln-Trp-Leu-Met-X28-X29
상기 식에서
X28은 Asp 또는 Asn이고;
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 16 및 20의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.68을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Lys-Asp-Phe-Val-Glu-Trp-Leu-Met-X28-X29
상기 식에서
X28은 Asp 또는 Asn이고;
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 20 및 24의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 화학식 VII.69을 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Glu-Trp-Leu-Met-Lys-X29
상기 식에서
X29은 Thr 또는 Gly이며;
여기에서 락탐환은 위치 24 및 28의 측쇄 사이에 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X가 도 3a-3o: 표 2에 나타낸 서열을 갖는 방법.
- 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X-Z1이 화학식 VII.61을 갖는 방법:
X1-X2-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Arg-X18-Ala-Lys-Asp-Phe-Val-X24-Trp-Leu-Met-Asn-X29-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His, 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, Val, Gly, N-메틸 Ser, Aib, N-메틸 Ala 또는 D-Ala이며;
X18은 Ala 또는 Arg이고;
X24는 Ala, Gln 또는 Cys-PEG이며;
X29은 Thr-CONH2, Cys-PEG 또는 Gly이고;
위치 40은 Cys-PEG이거나 존재하지 않으며;
단, 위치 30 내지 40(Z2)은 위치 29가 Gly인 경우에만 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X-Z1이 화학식 VII.62를 갖는 방법:
X1-X2-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Glu-Gln-X18-Ala-Lys-Glu-Phe-Ile-X24-Trp-Leu-Met-Asn-X29-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-Cys
상기 식에서
X1은 His, D-His, (데스-아미노)His, 하이드록실-His, 아세틸-His, 호모-His, DMIA, N-메틸 His, 알파-메틸 His 또는 이미다졸 아세트산이고;
X2는 Ser, D-Ser, Ala, Val, Gly, N-메틸 Ser, Aib, N-메틸 Ala 또는 D-Ala이며;
X18은 Ala 또는 Arg이고;
X24는 Ala, Gln 또는 Cys-PEG이며;
X29은 Thr-CONH2, Cys-PEG 또는 Gly이고;
위치 40은 Cys-PEG이거나 존재하지 않으며;
단, 위치 30 내지 40(Z2)은 위치 29가 Gly인 경우에만 존재한다. - 제1항 내지 제6항 또는 제54항 중의 어느 한 항에 있어서, X-Z1이 화학식 VII.64를 갖는 방법:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-X15-X16-Arg-Arg-Ala-X20-Asp-Phe-Val-X24-Trp-Leu-Met-X28-Gly-Gly-Pro-Ser-Ser-Gly-Pro-Pro-Pro-Ser
상기 식에서
X15은 Asp, Glu, 호모글루탐산, 시스테인산 또는 호모시스테인산이고;
X16은 Ser, Glu, Gln, 호모글루탐산 또는 호모시스테인산이며;
X20는 Gln 또는 Lys이고;
X24는 Gln 또는 Glu이며;
X28은 Asn, Lys 또는 Asp이다. - 제1항 내지 제107항 중의 어느 한 항에 있어서, 상기 펩티드 서열 X가 29개 위치의 최소 2개 위치, 예를 들어, 최소 3, 4, 5, 6개 위치에서 천연 인간 글루카곤 서열과 상이한 방법.
- 제1항 내지 제6항 중의 어느 한 항에 있어서, X가 단지 위치 X12, X17 또는 X18에서 인간 글루카곤과 상이한 방법.
- 제109항에 있어서, 상기 X12의 잔기가 Ala 또는 Arg인 방법.
- 제109항에 있어서, 상기 X17의 잔기가 Glu 또는 Lys인 방법.
- 제109항에 있어서, 상기 X18의 잔기가 His, Ser, Ala 또는 Tyr인 방법.
- 제109항에 있어서, X가 하기 서열을 갖는 방법:
HSQGTFTSDYSAYLDSRRAQDFVQWLMNT;
HSQGTFTSDYSRYLDSRRAQDFVQWLMNT;
HSQGTFTSDYSKYLDSERAQDFVQWLMNT;
HSQGTFTSDYSKYLDSKRAQDFVQWLMNT;
HSQGTFTSDYSKYLDSRHAQDFVQWLMNT;
HSQGTFTSDYSKYLDSRSAQDFVQWLMNT;
HSQGTFTSDYSKYLDSRAAQDFVQWLMNT; 또는
HSQGTFTSDYSKYLDSRYAQDFVQWLMNT. - 제108항에 있어서, X가 하기 서열을 갖는 방법:
HSQGTFTSDYSRYLDSRRAKDFVQWLLNT;
HSQGTFTSDYSRYLDSRRAQDFVQWLLNT;
HSQGTFTSDYSRYLDSRRAQDFVQWLLNK;
HSQGTFTSDYSKYLDSALAQDFVQWLLNT;
HSQGTFTSDYSKYLDKRRAEDFVQWLMNT;
HSQGTFTSDYSKYLDK()RRAE()DFVQWLMNT;
HSQGTFTSDYSRYLDERRAQDFVQWLMNT;
HSQGTFTSDYSK()YLDE()RRAQDFVQWLMNT;
HSQGTFTSDYSKYLDSRRAQDFIEWLMNT;
HSQGTFTSDYSKYLDSKAAQDFVQWLMNT; 또는
HSQGTFTSDYSKYLDSLAAQDFVQWLMNT. - 제1항 내지 제108항 중의 어느 한 항에 있어서, X가 최대 10개 위치, 예를 들어, 최대 7, 8, 9 또는 10개 위치에서 인간 글루카곤과 상이한 방법.
- 제6항 내지 제115항 중의 어느 한 항에 있어서, Z2가 1-15, 1-10 또는 1-7개 아미노산 잔기, 예를 들어, 1, 2, 3, 4, 5, 6 또는 7개 아미노산 잔기, 예를 들어 6개 아미노산 잔기의 펩티드 서열을 갖는 방법.
- 제116항에 있어서, Z2 내의 각각의 아미노산 잔기가 독립적으로 Glu, Lys 및 Cys 중에서 선택되는 방법.
- 제117항에 있어서, Z2가 Lys3, Lys4, Lys5, Lys6 또는 Lys7 중에서 선택되는 방법.
- 제6항 내지 제115항 중의 어느 한 항에 있어서, Z2가 존재하지 않는 방법.
- 제6항 내지 제104항 또는 제108항 내지 제119항 중의 어느 한 항에 있어서, Z1이 존재하지 않는 방법.
- 제6항 내지 제120항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제의 C-말단이 아미드화된 방법.
- 제6항 내지 제121항 중의 어느 한 항에 있어서, 상기 위치 X3의 잔기가 대안적으로 아세트아미도메틸-시스테인, 세틸디아미노부타노산, 카바모일디아미노프로파노산, 메틸글루타민 및 메티오닌 설폭사이드 중에서 선택되는 방법.
- 제6항 내지 제122항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 작용제의 하나 이상의 아미노산 측쇄들이 친유성 치환체와 컨쥬게이트되어 있는 방법.
- 제123항에 있어서, 상기 친유성 치환체가 아미노산 측쇄 내의 원자에 직접 공유결합되어 있는 방법.
- 제123항 또는 제124항에 있어서, 상기 위치 16, 17, 20, 24, 27, 28의 하나 이상의 잔기 또는 Z2의 하나의 잔기의 측쇄(들)이 친유성 치환체에 컨쥬게이트되어 있는 방법.
- 제125항에 있어서, 상기 위치 16, 17, 20 및 28의 적어도 하나가 친유성 치환체에 컨쥬게이트되어 있는 방법.
- 제122항 내지 제126항 중의 어느 한 항에 있어서, Z1이 존재하지 않고 Z2가 단지 1개의 아미노산 잔기 X30로 구성되어 있는 방법.
- 제127항에 있어서, X30가 Cys 또는 Lys인 방법.
- 제127항 또는 제128항에 있어서, X30가 친유성 치환체에 컨쥬게이트되어 있는 방법.
- 제123항 내지 제129항 중의 어느 한 항에 있어서, 단지 1개의 측쇄가 친유성 치환체에 컨쥬게이트되어 있는 방법.
- 제130항에 있어서, 상기 1개의 측쇄가 위치 16, 17, 18, 20, 24, 27, 28 또는 30, 예를 들어, 위치 16, 17 또는 20, 예를 들어, 위치 17에 존재하는 방법.
- 제123항 내지 제129항 중의 어느 한 항에 있어서, 정확히 2개의 측쇄가 친유성 치환체에 컨쥬게이트되어 있는 방법.
- 제132항에 있어서, 각각의 치환체가 위치 16, 17, 18, 20, 24, 27, 28 또는 30 중의 하나, 예를 들어, 위치 16, 17 또는 20 중의 하나에 존재하는 방법.
- 제123항 내지 제133항 중의 어느 한 항에 있어서, 각각의 친유성 치환체가 스페이서(spacer)에 의해 아미노산 측쇄와 컨쥬게이트되어 있는 친유성 부위를 포함하는 방법.
- 제134항에 있어서, 상기 친유성 부위와 스페이서의 조합이 도데카노일-γ-Glu, 헥사데카노일-γ-Glu, 헥사데카노일-Glu, 헥사데카노일-[3-아미노프로파노일], 헥사데카노일-[8-아미노옥타노일], 헥사데카노일-ε-Lys, 2-부틸옥타노일-γ-Glu, 옥타데카노일-γ-Glu 및 헥사데카노일-[4-아미노부타노일] 중에서 선택되는 방법.
- 제6항 내지 제135항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제의 하나 이상의 아미노산 측쇄가 중합체성 부위에 컨쥬게이트되어 있는 방법.
- 제136항에 있어서, 중합체성 부위가 수용성(양쪽성 또는 친수성), 무독성 및 약제학적으로 불활성인 방법.
- 제136항 또는 제137항에 있어서, 상기 중합체성 부위가 폴리에틸렌 글리콜(PEG), PEG의 호모-폴리머 또는 코-폴리머, PEG의 모노메틸-치환된 중합체(mPEG), 폴리옥시에틸렌 글리세롤(POG) 및 폴리아미노산 중에서 선택되는 방법.
- 제138항에 있어서, 상기 폴리-아미노산이 폴리-리신, 폴리-아스파르트산 및 폴리-글루탐산 중에서 선택되는 방법.
- 제136항 내지 제139항 중의 어느 한 항에 있어서, 상기 중합체성 부위가 직쇄인 방법.
- 제136항 내지 제139항 중의 어느 한 항에 있어서, 상기 중합체성 부위가 분지형(branched)인 방법.
- 제136항 내지 제139항 중의 어느 한 항에 있어서, 상기 중합체성 부위의 분자량이 500-40,000 Da, 500-5,000 Da, 500-10,000 Da, 1000-5000 Da, 10,000-20,000 Da, 또는 20,000-40,000 Da인 방법.
- 제136항 내지 제142항 중의 어느 한 항에 있어서, 상기 글루카곤-GLP-1 이중 작용제가 2개 이상의 중합체성 부위를 포함하는 방법.
- 제143항에 있어서, 모든 중합체성 부위의 총 분자량이 500-40,000 Da, 500-5,000 Da, 500-10,000 Da, 1000-5000 Da, 10,000-20,000 Da, 또는 20,000-40,000 Da인 방법.
- 제136항 내지 제144항 중의 어느 한 항에 있어서, 중합체성 부위가 아미노산 측쇄의 아미노, 카복실 또는 티올기와 공유적으로 커플링되는 방법.
- 제145항에 있어서, 상기 중합체성 부위가 Cys 잔기의 티올기, Lys 잔기의 엡실론 아미노기, 또는 Asp 또는 Glu 잔기의 카복실기와 공유적으로 커플링되는 방법.
- 제136항 내지 제146항 중의 어느 한 항에 있어서, 상기 중합체성 부위가 하나 이상의 위치 16, 17, 20, 21, 24 또는 29의 잔기의 측쇄 또는 펩티드의 C-말단에 커플링되는 방법.
- 제147항에 있어서, 상기 중합체성 부위가 하나 이상의 위치 16, 17, 21 및 24에 커플링되는 방법.
- 심장 질환 또는 심장 기능장애의 치료에 있어서 글루카곤-GLP-1 이중 작용제의 수축촉진제로서의 용도.
- 심장 질환 또는 심장 기능장애 치료용 의약을 제조함에 있어서, 수축촉진제로서 사용하기 위해 투여됨을 특징으로 하는 글루카곤-GLP-1 이중 작용제의 용도.
- 심박수의 부수적인 증가를 유발하지 않고 심장 수축성을 개선할 수 있는 의약을 제조함에 있어서 글루카곤-GLP-1 이중 작용제의 용도.
- 심장 질환 또는 심장 기능장애의 치료에 있어서 수축촉진제로 사용하기 위한 글루카곤-GLP-1 이중 작용제.
- 심장 질환 또는 심장 기능장애 치료용 의약을 제조에 사용하기 위한, 글루카곤-GLP-1 이중 작용제이며, 상기 글루카곤-GLP-1 이중 작용제가 수축촉진제로서 사용하기 위해 투여되는 것을 특징으로 하는 작용제.
- 제149항 내지 제153항 중의 어느 한 항에 따라 사용하기 위한 글루카곤-GLP-1 이중 작용제이며, 상기 글루카곤-GLP-1 이중 작용제가 제6항 내지 제148항 중의 어느 한 항에 정의된 바와 같은 작용제.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US29665710P | 2010-01-20 | 2010-01-20 | |
| US61/296,657 | 2010-01-20 | ||
| PCT/DK2011/050018 WO2011088837A1 (en) | 2010-01-20 | 2011-01-20 | Treatment of cardiac conditions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120128129A true KR20120128129A (ko) | 2012-11-26 |
Family
ID=43928934
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127021148A KR20120128129A (ko) | 2010-01-20 | 2011-01-20 | 심장 병태의 치료 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US20130157953A1 (ko) |
| EP (1) | EP2525809B1 (ko) |
| JP (2) | JP2013517307A (ko) |
| KR (1) | KR20120128129A (ko) |
| CN (1) | CN102892425A (ko) |
| AU (1) | AU2011206979B2 (ko) |
| BR (1) | BR112012018104A2 (ko) |
| CA (1) | CA2786934A1 (ko) |
| CL (1) | CL2012002037A1 (ko) |
| EA (1) | EA026384B1 (ko) |
| IL (1) | IL220876A0 (ko) |
| MX (1) | MX342409B (ko) |
| NZ (1) | NZ601167A (ko) |
| WO (1) | WO2011088837A1 (ko) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0823376A2 (pt) | 2008-12-15 | 2015-06-16 | Zealand Pharma As | Análagos de glucagon |
| EA020596B1 (ru) | 2008-12-15 | 2014-12-30 | Зилэнд Фарма А/С | Аналоги глюкагона |
| MX2011006320A (es) | 2008-12-15 | 2011-09-22 | Zealand Pharma As | Analogos de glucagon. |
| AU2008365555B2 (en) | 2008-12-15 | 2016-01-14 | Zealand Pharma A/S | Glucagon analogues |
| ME02220B (me) | 2009-07-13 | 2016-02-20 | Zealand Pharma As | Analozi acilovanog glukagona |
| TWI523659B (zh) | 2010-04-27 | 2016-03-01 | 西蘭製藥公司 | 肽結合物 |
| UY33462A (es) | 2010-06-23 | 2012-01-31 | Zealand Pharma As | Analogos de glucagon |
| SG186764A1 (en) * | 2010-06-24 | 2013-02-28 | Zealand Pharma As | Glucagon analogues |
| MX2014005351A (es) | 2011-11-03 | 2014-05-28 | Zealand Pharma As | Conjugados de gastrina peptidicos de agonistas de receptor glp-1. |
| CN104144696A (zh) * | 2011-12-23 | 2014-11-12 | 西兰制药公司 | 胰高血糖素类似物 |
| BR112014027348B1 (pt) | 2012-05-03 | 2022-12-20 | Zealand Pharma A/S | Compostos agonistas duplos gip-glp-1 e métodos |
| US10442847B2 (en) | 2012-07-23 | 2019-10-15 | Zealand Pharma A/S | Glucagon analogues |
| TWI608013B (zh) * | 2012-09-17 | 2017-12-11 | 西蘭製藥公司 | 升糖素類似物 |
| AR092873A1 (es) * | 2012-09-26 | 2015-05-06 | Cadila Healthcare Ltd | Peptidos como agonistas triples de los receptores de gip, glp-1 y glugagon |
| UA116217C2 (uk) | 2012-10-09 | 2018-02-26 | Санофі | Пептидна сполука як подвійний агоніст рецепторів glp1-1 та глюкагону |
| MX360816B (es) * | 2012-11-20 | 2018-11-15 | Mederis Diabetes Llc | Productos farmacéuticos peptídicos mejorados para la resistencia a la insulina. |
| WO2014096179A1 (en) * | 2012-12-19 | 2014-06-26 | Novo Nordisk A/S | Novel glp-1 receptor agonists with cholesterol efflux activity |
| EP2934569A1 (en) | 2012-12-21 | 2015-10-28 | Sanofi | Exendin-4 derivatives |
| BR112015025464A2 (pt) | 2013-04-18 | 2017-10-10 | Novo Nordisk As | coagonistas do receptor de glp-1/glucagon estáveis, prolongados para uso médico |
| US9988429B2 (en) * | 2013-10-17 | 2018-06-05 | Zealand Pharma A/S | Glucagon analogues |
| BR112016008115B1 (pt) * | 2013-10-17 | 2024-03-12 | Boehringer Ingelheim International Gmbh | Análogos de glucagon acilados |
| BR112016009995B1 (pt) | 2013-11-06 | 2023-04-18 | Zealand Pharma A/S | Compostos agonistas triplos glucagon-glp-1-gip |
| BR112016009889B1 (pt) * | 2013-11-06 | 2023-11-28 | Zealand Pharma A/S | Análogo do gip, composição farmacêutica compreendendo um análogo do gip, ou um sal farmaceuticamente aceitável do mesmo, e seu uso |
| EP3080152A1 (en) | 2013-12-13 | 2016-10-19 | Sanofi | Non-acylated exendin-4 peptide analogues |
| TW201609799A (zh) | 2013-12-13 | 2016-03-16 | 賽諾菲公司 | 雙重glp-1/gip受體促效劑 |
| WO2015086733A1 (en) | 2013-12-13 | 2015-06-18 | Sanofi | Dual glp-1/glucagon receptor agonists |
| TW201609795A (zh) | 2013-12-13 | 2016-03-16 | 賽諾菲公司 | 作為雙重glp-1/gip受體促效劑的艾塞那肽-4(exendin-4)胜肽類似物 |
| AR098616A1 (es) | 2013-12-18 | 2016-06-01 | Lilly Co Eli | Péptido para el tratamiento de hipoglicemia severa |
| CN103724424B (zh) * | 2013-12-27 | 2015-05-27 | 浙江省农业科学院 | 一种mPEG-SPA-pGLP-2复合物及其制备方法和应用 |
| TW201625669A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 衍生自艾塞那肽-4(Exendin-4)之肽類雙重GLP-1/升糖素受體促效劑 |
| TW201625670A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 衍生自exendin-4之雙重glp-1/升糖素受體促效劑 |
| TW201625668A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 作為胜肽性雙重glp-1/昇糖素受體激動劑之艾塞那肽-4衍生物 |
| US10570184B2 (en) | 2014-06-04 | 2020-02-25 | Novo Nordisk A/S | GLP-1/glucagon receptor co-agonists for medical use |
| US9932381B2 (en) | 2014-06-18 | 2018-04-03 | Sanofi | Exendin-4 derivatives as selective glucagon receptor agonists |
| JP2017536343A (ja) * | 2014-10-10 | 2017-12-07 | ノヴォ ノルディスク アー/エス | 安定したglp−1ベースのglp−1/グルカゴン受容体コアゴニスト |
| BR112017008659A2 (pt) | 2014-10-29 | 2018-01-30 | Zealand Pharma As | ?métodos e compostos de agonista de gip? |
| CN107636009B (zh) | 2014-12-30 | 2021-04-16 | 韩美药品株式会社 | 具有改善的稳定性的胰高血糖素衍生物 |
| KR102418477B1 (ko) * | 2014-12-30 | 2022-07-08 | 한미약품 주식회사 | 글루카곤 유도체 |
| WO2016168388A2 (en) | 2015-04-14 | 2016-10-20 | Palatin Technologies, Inc. | Therapies for obesity, diabetes and related indications |
| US10336802B2 (en) | 2015-04-16 | 2019-07-02 | Zealand Pharma A/S | Acylated glucagon analogue |
| AR105319A1 (es) | 2015-06-05 | 2017-09-27 | Sanofi Sa | Profármacos que comprenden un conjugado agonista dual de glp-1 / glucagón conector ácido hialurónico |
| NZ739250A (en) | 2015-06-30 | 2024-02-23 | Hanmi Pharm Co Ltd | Glucagon derivative and a composition comprising a long acting conjugate of the same |
| TW201706291A (zh) | 2015-07-10 | 2017-02-16 | 賽諾菲公司 | 作為選擇性肽雙重glp-1/升糖素受體促效劑之新毒蜥外泌肽(exendin-4)衍生物 |
| SG11201805586SA (en) | 2015-12-31 | 2018-07-30 | Hanmi Pharmaceutical Co Ltd | Triple glucagon/glp-1/gip receptor agonist |
| EP3888667B1 (en) | 2016-06-09 | 2023-10-25 | AmideBio LLC | Glucagon analog and methods of use thereof |
| NZ750267A (en) | 2016-06-29 | 2023-12-22 | Hanmi Pharm Ind Co Ltd | Glucagon derivative, conjugate thereof, composition comprising same and therapeutic use thereof |
| KR102502040B1 (ko) | 2016-12-09 | 2023-02-24 | 질랜드 파마 에이/에스 | 아실화 glp-1/glp-2 이중 효능제 |
| CN109836503B (zh) * | 2017-11-24 | 2022-09-16 | 浙江道尔生物科技有限公司 | 一种治疗代谢疾病的多重活性蛋白 |
| TWI809515B (zh) * | 2017-12-21 | 2023-07-21 | 美商美國禮來大藥廠 | 腸促胰島素(incretin)類似物及其用途 |
| WO2021083306A1 (zh) * | 2019-10-31 | 2021-05-06 | 东莞市东阳光生物药研发有限公司 | Glp-1/gcg双受体激动剂多肽 |
| EP3842060A1 (en) * | 2019-12-23 | 2021-06-30 | Merck Sharp & Dohme Corp. | Stapled lactam co-agonists of the glucagon and glp-1 receptors |
| CN113621045A (zh) * | 2020-05-09 | 2021-11-09 | 天津药物研究院有限公司 | 具有双受体激动作用的多肽衍生物及其用途 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE69936446T2 (de) * | 1998-02-13 | 2008-03-06 | Amylin Pharmaceuticals, Inc., San Diego | Inotropische und diuretische effekte von exendin und glp-1 |
| US6703359B1 (en) * | 1998-02-13 | 2004-03-09 | Amylin Pharmaceuticals, Inc. | Inotropic and diuretic effects of exendin and GLP-1 |
| IL138214A0 (en) | 1998-03-09 | 2001-10-31 | Zealand Pharmaceuticals As | Pharmacolgically active peptide conjugates having a reduced tendency towards enzymatic hydrolysis |
| EP1076066A1 (en) | 1999-07-12 | 2001-02-14 | Zealand Pharmaceuticals A/S | Peptides for lowering blood glucose levels |
| ATE470448T1 (de) * | 2000-10-20 | 2010-06-15 | Amylin Pharmaceuticals Inc | Behandlung von hypoaktivem myokard und diabetischer herzmyopathie mit einem glp-1 peptid |
| GB0121709D0 (en) | 2001-09-07 | 2001-10-31 | Imp College Innovations Ltd | Food inhibition agent |
| US7192922B2 (en) * | 2002-11-19 | 2007-03-20 | Allegheny-Singer Research Institute | Method of treating left ventricular dysfunction |
| EP2471810A1 (en) | 2006-02-22 | 2012-07-04 | Merck Sharp & Dohme Corporation | Oxyntomodulin derivatives |
| TWI428346B (zh) | 2006-12-13 | 2014-03-01 | Imp Innovations Ltd | 新穎化合物及其等對進食行為影響 |
| KR20150116465A (ko) * | 2007-02-15 | 2015-10-15 | 인디애나 유니버시티 리서치 앤드 테크놀로지 코퍼레이션 | 글루카곤/glp-1 수용체 공동-항진물질 |
| JP5385266B2 (ja) | 2007-06-15 | 2014-01-08 | ジーランド ファーマ アクティーゼルスカブ | グルカゴン類似体 |
| MX2010013454A (es) * | 2008-06-17 | 2011-01-21 | Tion Indiana University Res And Technology Corpora | Co-agonistas de receptor de glucagon/glp-1. |
| CN104447980A (zh) | 2008-06-17 | 2015-03-25 | 印第安纳大学研究及科技有限公司 | 在生理pH缓冲液中具有增强的溶解性和稳定性的胰高血糖素类似物 |
| WO2010107487A2 (en) * | 2009-03-18 | 2010-09-23 | Wu Nian | Lipid-drug conjugates for drug delivery |
| TWI608013B (zh) * | 2012-09-17 | 2017-12-11 | 西蘭製藥公司 | 升糖素類似物 |
-
2011
- 2011-01-20 JP JP2012549249A patent/JP2013517307A/ja not_active Withdrawn
- 2011-01-20 EP EP11704174.9A patent/EP2525809B1/en active Active
- 2011-01-20 US US13/574,197 patent/US20130157953A1/en not_active Abandoned
- 2011-01-20 CN CN201180012769XA patent/CN102892425A/zh active Pending
- 2011-01-20 MX MX2012008440A patent/MX342409B/es active IP Right Grant
- 2011-01-20 WO PCT/DK2011/050018 patent/WO2011088837A1/en active Application Filing
- 2011-01-20 KR KR1020127021148A patent/KR20120128129A/ko active IP Right Grant
- 2011-01-20 EA EA201290540A patent/EA026384B1/ru not_active IP Right Cessation
- 2011-01-20 NZ NZ601167A patent/NZ601167A/en not_active IP Right Cessation
- 2011-01-20 AU AU2011206979A patent/AU2011206979B2/en not_active Ceased
- 2011-01-20 CA CA2786934A patent/CA2786934A1/en not_active Abandoned
- 2011-01-20 BR BR112012018104A patent/BR112012018104A2/pt not_active Application Discontinuation
-
2012
- 2012-07-11 IL IL220876A patent/IL220876A0/en unknown
- 2012-07-20 CL CL2012002037A patent/CL2012002037A1/es unknown
-
2016
- 2016-04-01 JP JP2016074097A patent/JP6200025B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| CA2786934A1 (en) | 2011-07-28 |
| US20130157953A1 (en) | 2013-06-20 |
| WO2011088837A1 (en) | 2011-07-28 |
| CL2012002037A1 (es) | 2012-09-07 |
| JP6200025B2 (ja) | 2017-09-20 |
| MX342409B (es) | 2016-09-28 |
| BR112012018104A2 (pt) | 2017-10-17 |
| IL220876A0 (en) | 2012-09-24 |
| JP2016138127A (ja) | 2016-08-04 |
| JP2013517307A (ja) | 2013-05-16 |
| EA201290540A1 (ru) | 2013-03-29 |
| MX2012008440A (es) | 2012-08-15 |
| EP2525809A1 (en) | 2012-11-28 |
| AU2011206979A1 (en) | 2012-08-02 |
| AU2011206979B2 (en) | 2015-09-10 |
| EA026384B1 (ru) | 2017-04-28 |
| CN102892425A (zh) | 2013-01-23 |
| NZ601167A (en) | 2014-12-24 |
| EP2525809B1 (en) | 2016-08-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6200025B2 (ja) | 心臓病の処置 | |
| JP6849720B2 (ja) | グルカゴン類似体 | |
| US10253081B2 (en) | Glucagon analogues | |
| KR101593406B1 (ko) | 글루카곤 유사체 | |
| JP6054742B2 (ja) | アシル化グルカゴン類似体 | |
| US8642540B2 (en) | Glucagon analogues | |
| US8642541B2 (en) | Glucagon analogues | |
| JP5937582B2 (ja) | グルカゴン類似体 | |
| RU2735762C2 (ru) | Ацилированный аналог глюкагона, его применение и способы получения | |
| KR20140114845A (ko) | 글루카곤 유사체 | |
| KR20150116912A (ko) | 글루카곤 유사체 | |
| SG186764A1 (en) | Glucagon analogues |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| X701 | Decision to grant (after re-examination) |