KR20120012823A - 신경보호 및 퇴행성 신경 질환 치료용 클라블라네이트 제제 - Google Patents
신경보호 및 퇴행성 신경 질환 치료용 클라블라네이트 제제 Download PDFInfo
- Publication number
- KR20120012823A KR20120012823A KR1020117028280A KR20117028280A KR20120012823A KR 20120012823 A KR20120012823 A KR 20120012823A KR 1020117028280 A KR1020117028280 A KR 1020117028280A KR 20117028280 A KR20117028280 A KR 20117028280A KR 20120012823 A KR20120012823 A KR 20120012823A
- Authority
- KR
- South Korea
- Prior art keywords
- clavulanate
- formulation
- tablets
- potassium
- group
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
- A61K9/1694—Processes resulting in granules or microspheres of the matrix type containing more than 5% of excipient
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/397—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having four-membered rings, e.g. azetidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/424—Oxazoles condensed with heterocyclic ring systems, e.g. clavulanic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
- A61K9/2846—Poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Pain & Pain Management (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicines Containing Plant Substances (AREA)
Abstract
본 발명은 대체로 즉시-방출형 또는 연장-방출형 고형 투여형의 약제학적 활성 성분으로 클라블라네이트를 포함하는 안정한 고형 약제학적 조성물의 용도에 관한 것이다. 본 조성물은 퇴행성 신경 질환을 치료하거나, 신경 보호를 제공하거나 또는 신경 세포 손실 또는 사멸을 예방하는 방법에 사용될 수 있다. 전형적인 퇴행성 신경 질환은 파킨슨병, 알츠하이머병, 및 다발성 경화증을 포함한다.
Description
본 발명은 클라블란산, 약제학적으로 허용가능한 클라블란산 염, 염 조성물 및 유도체들을 포함하는 안정한 고형 경구 투여형의 용도에 관한 것이다. 특히, 본 발명은 신경보호 및 퇴행성 신경 질환 치료를 위하여 치료 수준의 클라블라네이트를 얻고, 매일 사용하기 적절한 포타슘 클라블라네이트의 즉시 방출형 조성물 및 연장 방출형 조성물의 용도를 제공한다.
클라블란산이라는 명칭은 클라블란산이 유래되는 스트렙토마이세스 클라불리제러스(Streptomyces clavuligerus) 미생물에서 유래된다. 클라블란산은 아미노산 아르기닌 및 서당 글리세르알데히드 3-포스페이트로부터 생합성적으로 생성된다.
클라블란산은 β-락탐 항생제의 특성이 있는 β-락탐 고리를 공유함에도 불구하고 무시할만한 고유의 항균 활성을 가진다. 그러나, 화학적 구조의 유사성은 분자가 β-락탐 항생제에 대한 내성을 부여하기 위하여, 특정 세균에 의하여 분비된 β-락타마아제의 경쟁적 억제제로 작용할 수 있게 한다. 티카르실린 또는 아목시실린과 같은 어떤 β-락탐 항생제와 함께 공급되면, 클라블란산은 스펙트럼을 확장하고, 항생제의 활성을 증진시킬 수 있다 (AHFS, 1991). 클라블란산이 β-락탐 항생제를 천연적으로 분해하고 불활성화시키는 세균성 β-락타마아제의 비가역적 경쟁적 억제제로 작용하기 때문에, 이러한 시너지 효과가 가능하다(Brown 등, J Antibiot (토쿄), 1976, 29:668-669; Reading and Cole, Antimicrob Agents Chemother. 1977, 11:852-857).
β-락타마아제에 대한 억제 효과에 더하여, 클라블란산은 신경보호에 대한 그리고 불안과 성 기능장애에 효능을 보였다. 여러 기전은 클라블란산의 신경보호와 신경 활성을 제안해왔다. 그 전체가 참조로 삽입된 미국 특허 6,489,319; 6,610,681; 및 6,627,625호에서 Koppel 등은 1 μg/kg 미만으로 i.p.로 투여될 때 클라블란산 그 자체가 불안완화 활성을 가진다는 것을 기재한다. 그 전체가 참조로 삽입된 미국 특허 6,426,342호는 1 μg/kg의 i.p. 투여량의 클라블란산으로 랫트를 처리할 때 클라블란산의 강력한 신경보호 활성을 기재한다. 그 전체가 참조로 삽입된 미국 특허 7,166,626호는 클라블란산 투여로 성 기능 장애를 치료하는 방법을 개시한다. 미국 특허 6,489,319호는 클라블란산이 10 ng 내지 10 μg/kg의 범위의 투여량으로 CNS 활성과 동작을 수정할 수 있다고 보고한다. 따라서, 클라블란산의 독특한 신경 활성 프로파일은, 화합물이 독특한 신경인성 표적의 세트와 상호작용한다는 강한 증거를 제공한다. Rothstein 등은 또한 몇 가지 β-락탐 항생제가 글루타메이트 신경전달물질 운반자를 위한 유전자의 활성에 의하여 신경보호를 제공할 수 있다는 것을 입증하였다(Nature, 2005, 433:73-77). 1928년에 페니실린의 발견으로 처음 확인된 이후, β-락탐 항생제는 가장 널리 사용되는 항생제가 되었고, 정상적인 항균 투여량에서 실질적인 독성 CNS 활성을 나타내지 않았다. 따라서, β-락탐 항생제는 CNS 관련 질병의 치료를 위한 새롭고 안전한 치료제로 사용될 수 있다.
클라블란산 및 이의 유도체 또는 염(클라블라네이트로 통칭됨)을 함유하는 많은 건조 제제의 불안정성은 약제학적으로 허용가능한 담체를 제공하기 위하여 결합제, 활택제, 붕해제 및 또한 건조제, 등을 포함하는 부형제의 복합 제제의 혼입을 필요로 하였다. 이는, 클라블라네이드가 수성 매질에서 고도로 불안정한 고 흡습성 재료라는 사실에 부분적으로 기인한다. 따라서, 제제의 방법들은 제품이 보관 동안 효능을 유지할 수 있으며 또한 지속적으로 만족적인 분해율을 제공할 수 있다는 것을 보증하여야 한다. 이러한 과정은 전체가 참조로 삽입된 WO 92/19227호에 개시되며, 세포-내 및 세포-외 붕해제 모두의 혼입을 지시한다. 전체가 참조로 본 명세서에 삽입된 미국 특허 4,537,887호에 기재된 다른 공정은 조성물 그 자체 내에 식용 건조제의 혼입을 특정한다. 다른 공정은 아목시실린/클라블라네이트 조합을 수용하는 용기 내에 건조제의 혼입을 정당화한다. 이 점에서, 그 전체가 참조로 본 명세서에 삽입된 미국 특허 4,301,149 및 4,441,609호가 특히 두드러진다. 포타슘 클라블라네이트는 유리 산 및 가장 적은 흡습성의 약제학적으로 허용가능한 클라블란산 염 보다 더 안정하며, 따라서 상업적 제제에 가장 자주 사용된다. 그러나, 포타슘 클라블라네이트는 코-아목시실린/클라블라네이트 제제가 낮은 습도 상태 하에서 조차 보관 시 분해되기 쉬운 매우 높은 흡습성이며 가수분해되기 쉽다. 아목시실린의 결정화에서 수분의 존재는, 임의로 분해가 시작될 때 클라블라네이트의 분해를 자극하는 이 투여 형태의 불안정성에 기여할 수 있다.
클라블라네이트는 습기와 열 민감성 때문에 예외적으로 제제화하기 어려운 재료이다. 신경보호 또는 퇴행성 신경 질환 치료를 위하여 제공하기 위하여 경구로 활성이 있는 10 μg 내지 10 mg, 예를 들어, 약 0.1 mg 내지 약 5 mg와 같은 낮은 투여량에서 특히 클라블라네이트 단독으로, 즉 항생제 없이, 안정적인 고형 제제를 개발할 필요가 있다.
본 발명은 즉시 방출형 조성물 또는 연장 방출형 조성물 형태의 클라블라네이트를 함유하는 안정한 경구 투여 조성물을 경구로 투여하는 단계를 포함하는 신경보호를 제공하고 퇴행성 신경 질환을 치료하는 방법이다. 투여 형태는 매일 사용하기에 적합한 클라블란산 또는 이의 유도체와 염, 예를 들면 포타슘 클라블라네이트 또는 클라비테스(Clavitesse)™로부터 제조될 수 있다.
본 발명은 안정한 경구 클라블라네이트 약제학적 조성물 및 이 조성물을 사용하여 신경보호를 제공하고 퇴행성 신경 질환을 치료하는 방법의 개발을 통하여 상기한 단점과 불이익을 극복하고 경감시킨다. 일반적으로 말하여, 본 발명은 약제학적 활성 성분으로서 클라블라네이트를 포함하는 안정한 고형 약제학적 조성물, 및 특히 즉시 방출형 또는 연장 방출형 조성물의 용도에 관한 것이다. 약제학적 조성물은 정제, 캡슐, 알약, 트로키, 또는 분말과 같은 고형 투여 형태로 제공될 수 있다. 고형 약제학적 조성물은 하나 이상의 약제학적으로 허용가능한 부형제의 존재 중의 클라블라네이트를 포함할 수 있는데, 여기서 클라블라네이트는 약 10 μg 내지 약 10 mg 또는, 예를 들면, 약 0.1 mg 내지 약 5 mg의 함량으로 존재한다. 조성물은 투여 시 클라블라네이트의 치료적 유용한 함량을 제공할 수 있다. 클라블라네이트의 예는 클라블란산, 클라블란산 유도체 및 클라블란산의 약제학적으로 허용가능한 염을 포함한다. 클라블라네이트는 조성물의 약 0.01 중량% 내지 약 10중량%의 함량으로 존재할 수 있다. 어떤 구체예에서, 조성물의 수분 함량은 전체 중량의 약 4% 미만이다. 제제는 정제, 캡슐, 알약, 트로키, 또는 분말의 형태이다. 본 발명에 따른 전형적 고형 약제학적 조성물은 3개월 동안 25℃, 60% 상대 습도에서 보관 후 그리고 30℃, 65% 상대 습도에서 보관 후 10% 미만의 수분 함량을 가질 수 있다.
전형적 조성물에서, 클라블라네이트는 포타슘 클라블라네이트이다. 포타슘 클라블라네이트는 예를 들면, 실리콘 디옥사이드 또는 미세결정성 셀룰로오스와의 1 : 1 혼합물로서 또는 분말로서 제공될 수 있다. 전형적 조성물은 투여 후 약 5분 내지 약 30분 내에 정제로부터 80% 보다 많은 클라블라네이트를 방출하는 즉시-방출형(속방형) 조성물이다. 전형적인 구현예에서, 이 조성물은, 포타슘 클라블라네이트 분말이 하나 이상의 약제학적으로 허용가능한 부형제의 존재 하에서 냉동 건조(lyophilize)하는 방법으로 제조된다. 즉시 방출형 조성물의 예에서, 이 조성물은 결합제 또는 희석제의 약 10 중량% 내지 약 20 중량%, 약 45 중량% 내지 약 55 중량%의 충진제, 약 20 중량% 내지 약 40 중량%의 붕해제 및 약 3 중량% 내지 약 6 중량%의 윤활제를 함유할 수 있다. 이러한 구현예에서, 전형적인 결합제 또는 희석제는 말트린(Maltrin) M150이고, 전형적인 충진제는 프로졸브(Prosolve) SMCC 50이고, 전형적인 붕해제는 파마버스트(Pharmaburst) 및/또는 L HPC LH-11 및/또는 악디졸(Acdisol)이고, 그리고 전형적인 윤활제는 스테아르산이다.
다른 전형적인 구현예에서, 조성물은 실리콘 디옥사이드 또는 미세결정성 셀룰로오스와의 1 : 1 혼합물인 포타슘 클라블라네이트가 하나 이상의 약제학적으로 허용가능한 부형제의 존재에서 냉동건조되는 방법으로 제조된다. 즉시 방출형 조성물의 다른 예에서, 이 조성물은 약 50-60%의 충진제, 약 20-30%의 붕해제, 약 0.5-5%의 흐름 증진제/수분 보호제 및/또는 약 3-6%의 윤활제를 함유할 수 있다. 이러한 구현예에서, 전형적 충진제는 프로졸브 SMCC 50이며, 전형적인 붕해제는 파마버스트 및/또는 악디졸이며, 전형적인 흐름 증진제/수분 보호제는 카보실이며, 그리고 전형적인 윤활제는 마그네슘 스테아레이트이다.
다른 구현예에서, 약제학적 조성물은 적어도 약 4 시간 넘게 포타슘 클라블라네이트를 방출하는 연장-방출형(서방형) 조성물이다. 연장 방출형 조성물은 포타슘 클라블라네이트 분말 또는 미세결정성 셀룰로오스와의 1 : 1 혼합물 내 포타슘 클라블라네이트를 하나 이상의 약제학적으로 허용가능한 부형제의 존재하에서 냉동 건조시켜 제조될 수 있다. 전형적인 부형제는 하나 이상의 매트릭스, 충진제, 활택제 및 윤활제를 포함할 수 있다. 연장 방출형 조성물의 예에서, 조성물은 약 20 중량% 내지 약 40 중량%의 매트릭스, 약 50% 내지 약 75 중량%의 충진제, 약 0.1 중량% 내지 약 1 중량%의 활택제 및 약 1% 내지 약 2 중량%의 윤활제를 함유할 수 있다. 이러한 구현예에서, 전형적인 매트릭스는 클루셀(Klucel) LF, 메토셀(Methocel) KlOOLV Prem CR, 유드라짓(Eudragit) SlOO, 카보폴(Carbopol) 971P, 카보폴(Carbopol) 974P, 메타크릴레이트 공중합체 A형, 메타크릴레이트 공중합체 B형, 및 이들의 혼합물이며; 전형적인 충진제는 무수 락토오스, 아비셀(Avicel) PH-112, 아비셀(Avicel) PH-113, 이소말트, 또는 이의 혼합물이며; 전형적인 활택제는 카보실(Carbosil)이며; 그리고 전형적인 윤활제는 마그네슘 스테아레이트 및 탈크 중 적어도 하나 이상이다.
다른 구현예에서, 본 발명의 방법에서 사용하기 위한 고형 약제학적 투여 형은 클라블란산, 클라블란산 유도체 또는 클라블란산의 약제학적으로 허용가능한 염과 같은 클라블라네이트를 제공하고; 클라블라네이트를 하나 이상의 부형제와 혼합하고; 클라블라네이트 및 하나 이상의 부형제의 혼합물을 과립화하고; 그리고 클라블라네이트 및 하나 이상의 부형제의 과립화된 혼합물을 냉동 건조하여 제조된다. 과립화 단계는, 예를 들면 습식 과립화일 수 있다. 전형적인 클라블라네이트는 예를 들면 실리콘 디옥사이드 또는 미세결정성 셀룰로오스와의 1 : 1 혼합물로서의 포타슘 클라블라네이트 또는 포타슘 클라블라네이트 분말 형태의 포타슘 클라블라네이트이다. 전형적인 방법에서, 부형제는 하나 이상의 결합제, 희석제, 충진제, 붕해제, 매트릭스, 충진제, 활택제, 흐름 증진제, 수분 보호제, 및 윤활제이다. 이 방법은 투여 형을 정제 또는 비드로 형성하고, 임의로 지연-방출 중합체로 상기 정제 또는 비드를 코팅하는 단계를 포함할 수 있다. 본 발명은 파킨슨병, 알츠하이머병, 또는 다발성 경화증과 같은 퇴행성 신경 질환의 치료 또는 신경보호에 효과적인 함량의 클라블라네이트를 제공하기 위하여 본 발명에 따른 안정한 고형 약제학적 조성물을 경구로 투여하는 단계를 포함한다.
본 발명의 또 다른 구현예는 경구 투여에 적절한 클라블라네이트의 즉시 및 연장 방출형 제제의 용도에 관한 것이다.
본 발명의 또 다른 구현예는 약제학적 제제를 제조하기 위한 동결 건조(freeze drying) 방법에 관한 것으로, 동결 건조는 수화된 약제학적 조성물을 탈수하는 건조 공정을 포함하는 것이다.
본 발명의 다른 구현예는 클라블라네이트를 함유하는 약제학적 조성물의 제조 공정 및 약제로서의 이들의 용도에 관한 것이다.
다른 구현예에서, 본 발명은 클라블란산, 클라블란산 유도체 또는 클라블란산의 약제학적으로 허용가능한 염과 같은 클라블라네이트의 치료적 유효 함량을 포함하는 안정한 경구 제제를 경구적으로 투여하여 퇴행성 신경 질환을 치료하는 방법이다. 다른 전형적인 구현예는 클라블라네이트를 함유하는 안정한 경구 제제를 경구적으로 투여하는 단계를 포함하는 신경보호를 제공하는 방법이다. 신경보호는 퇴행성 신경 질환으로부터 세포 손실 또는 세포 사멸을 예방하는 것을 포함한다. 또 다른 구현예는 클라블라네이트의 안정한 경구 제제를 경구적으로 투여하는 단계를 포함하는 신경 세포 손실 또는 사멸을 예방하는 방법이다. 본 발명의 방법에 따라 치료될 수 있는 퇴행성 신경 질환의 예는 파킨슨병, 알츠하이머병, 및 다발성 경화증을 포함한다. 치료는, 예를 들면, 발작(seizure) 또는 진전(tremor)의 빈도, 발병 시간, 또는 심각도를 감소시키거나; 기억 손실을 감소시키거나; 또는 신경 세포 사멸을 감소시키는 것을 포함할 수 있다.
본 발명에 따른 전형적인 방법에서, 클라블라네이트는 포타슘 클라블라네이트이다. 안정한 경구 제제는 정제, 캡슐, 알약, 트로키, 용액, 현탁액, 구강 또는 설하 정제, 경구 분해 정제, 얇은 필름 또는 분말의 형태일 수 있다. 제제는 적어도 약 4 시간 이상 동안 클라블라네이트를 방출하는 연장-방출형 조성물; 약 0.5 시간 미만 내에 클라블라네이트를 방출하는 즉시-방출형 조성물; 또는 다른 형태일 수 있다. 어떤 구체예에서, 포타슘 클라블라네이트는 실리콘 디옥사이드 또는 미세결정성 셀룰로오스와의 1 : 1 혼합물로서의 포타슘 클라블라네이트 또는 포타슘 클라블라네이트 분말이다. 본 발명에 유용한 제제는 매트릭스; 충진제; 활택제; 및 윤활제 중 하나 이상을 포함할 수 있다. 매트릭스는, 예를 들면, 메토셀(Methocel) K1OOLV Prem CR, 유드라짓(Eudragit) SlOO, 카보폴(Carbopol) 971P, 카보폴(Carbopol) 974P, 메타크릴레이트 공중합체 A형, 메타크릴레이트 공중합체 B형 또는 이의 혼합물일 수 있다. 충진제는, 예를 들면, 무수 락토오스, 아비셀(Avicel) PH-112, 아비셀(Avicel) PH-113, 이소말트(Isomalt), 또는 이의 혼합물일 수 있다. 활택제는, 예를 들면, 카보실(Carbosil)이고, 전형적인 윤활제는 마그네슘 스테아레이트, 탈크 및 이의 혼합물일 수 있다.
본 발명의 방법에 사용하기 위한 제제를 제조하는 전형적인 방법은 클라블라네이트와 하나 이상의 부형제를 혼합하고; 클라블라네이트 및 하나 이상의 부형제의 혼합물을 과립화하고; 그리고 클라블라네이트 및 하나 이상의 부형제의 과립화된 혼합물을 동결건조하는 단계를 포함한다.
본 발명에 따르면, 제제는 약 0.001 mg/kg/day 내지 약 1.0 mg/kg/day의 클라블라네이트를 제공하는 양으로 투여될 수 있다. 어떤 구체예에서, 제제는 약 0.01 mg/kg/day 내지 약 1.0 mg/kg/day를 제공하는 양으로 투여될 수 있다. 제제는 단일 매일 투여 또는 다회 투여로 투여될 수 있다.
본 발명은 즉시-방출형 또는 연장-방출형 고형 투여 형태의 약제학적으로 활성인 성분으로 클라불라네이트를 포함하는 안정한 고형 약제학적 조성물을 제공하는 것으로, 본 조성물은 퇴행성 신경 질환을 치료하거나, 신경 보호를 제공하거나 또는 신경 세포 손실 또는 사멸을 예방하는 방법에 사용될 수 있다.
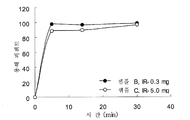
도 1은 클라블라네이트 즉시 방출형 제제, 샘플 B (●) 및 C (○)의 인 비트로 용해 프로파일을 나타낸다.
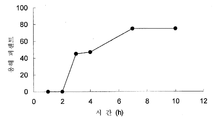
도 2는 클라블라네이트 연장 방출형 제제, 샘플 F의 인 비트로 용해 프로파일을 나타낸다.
도 3은 클라블라네이트 연장-방출형 제제, 샘플 I의 인 비트로 용해 프로파일을 나타낸다.
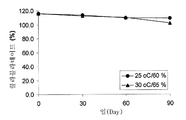
도 4는 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 D (포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1 : 1 혼합물 5 mg/정제)의 안정성을 도시한다.
도 5는 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 E (포타슘 클라블라네이트와 실리콘 디옥사이드의 1 : 1 혼합물 5 mg/정제)의 안정성을 도시한다.
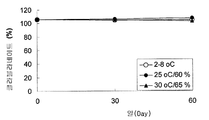
도 6은 2-8℃ (○), 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 F (포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1 : 1 혼합물 5 mg/정제)의 안정성을 도시한다.
도 7은 2-8℃ (○), 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 G (5 mg/정제)의 안정성을 도시한다.
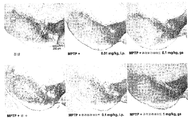
도 8은 흑색질 치밀부(substantia nigra pars compacta: SNpc) 내의 티로신 하이드록실라아제 (TH)에 대한 면역조직화학을 나타낸다. TH-양성 뉴런의 수는 정상 군에 비하여 MPTP (l-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)-염수 군에서 현저하게 감소하였다. TH-양성 뉴런의 수는 MPTP-클라블라네이트 처리군에서는 잘 보존되었다.
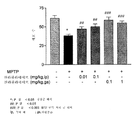
도 9는 MPTP (l-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)-처리 동물에서의 흑색질 치밀부 (SNpc) 뉴런 생존율에 대한 클라블라네이트 치료의 효과를 나타낸다.
도 10은 마우스 PD 모델에서 폴(pole) 테스트를 사용하여 MPTP (l-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)-유도된 신경 독성에 대한 클라블라네이트의 행동 효과를 도시한다.
도 11은 CA3 영역에서 카이네이트(KA) 유도된 해마 신경 독성에 대한 클라블라네이트의 효과를 나타낸다.
도 12는 정상, 카이네이트 + 염수, 및 카이네이트 + 클라블라네이트 치리군의 CA3 영역에서의 크레실 바이올렛 염색 결과를 나타낸다.
도 2는 클라블라네이트 연장 방출형 제제, 샘플 F의 인 비트로 용해 프로파일을 나타낸다.
도 3은 클라블라네이트 연장-방출형 제제, 샘플 I의 인 비트로 용해 프로파일을 나타낸다.
도 4는 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 D (포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1 : 1 혼합물 5 mg/정제)의 안정성을 도시한다.
도 5는 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 E (포타슘 클라블라네이트와 실리콘 디옥사이드의 1 : 1 혼합물 5 mg/정제)의 안정성을 도시한다.
도 6은 2-8℃ (○), 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 F (포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1 : 1 혼합물 5 mg/정제)의 안정성을 도시한다.
도 7은 2-8℃ (○), 25℃/60% 습도 (●) 및 30℃/65% 습도 (▲)에서의 샘플 G (5 mg/정제)의 안정성을 도시한다.
도 8은 흑색질 치밀부(substantia nigra pars compacta: SNpc) 내의 티로신 하이드록실라아제 (TH)에 대한 면역조직화학을 나타낸다. TH-양성 뉴런의 수는 정상 군에 비하여 MPTP (l-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)-염수 군에서 현저하게 감소하였다. TH-양성 뉴런의 수는 MPTP-클라블라네이트 처리군에서는 잘 보존되었다.
도 9는 MPTP (l-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)-처리 동물에서의 흑색질 치밀부 (SNpc) 뉴런 생존율에 대한 클라블라네이트 치료의 효과를 나타낸다.
도 10은 마우스 PD 모델에서 폴(pole) 테스트를 사용하여 MPTP (l-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘)-유도된 신경 독성에 대한 클라블라네이트의 행동 효과를 도시한다.
도 11은 CA3 영역에서 카이네이트(KA) 유도된 해마 신경 독성에 대한 클라블라네이트의 효과를 나타낸다.
도 12는 정상, 카이네이트 + 염수, 및 카이네이트 + 클라블라네이트 치리군의 CA3 영역에서의 크레실 바이올렛 염색 결과를 나타낸다.
본 명세서에서 사용된, 클라블라네이트라는 용어는 클라블란산 (I), 약제학적으로 허용가능한 클라블란산 염, 염 조성물 및 에스테르와 같은 유도체들을 포함한다. 약제학적으로 허용가능한 클라블란산 염의 예는 포타슘 클라블라네이트이다. 포타슘 클라블라네이트는 순수 화합물로서 또는 예를 들면, 클라비테스(Clavitesse)TM, 포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1 : 1의 혼합물 또는 포타슘 클라블라네이트와 실리콘 디옥사이드의 1 : 1 혼합물 (네덜란드의 DSM 안티-인펙티브즈 비. 브이.로부터 구입 가능)로서 제공될 수 있다.
전형적인 유도체는 클라블란산의 활성 에스터, 예를 들면, 아세톡시메틸, 피발로일옥시메틸, β-아세톡시에틸, β-피발로일옥시에틸, l-(시클로헥실카르보닐옥시) 프로피-1-일, 및 (1-아미노에틸) 카르보닐옥시메틸과 같은 아실옥시알킬 기; 에톡시카르보닐옥시메틸 및 알파-에톡시카르보닐옥시에틸과 같은 알콕시카르보닐 옥시알킬기; 에톡시카르보닐 옥시메틸 및 β-에톡시카르보닐옥시 에틸과 같은 디알킬아미노알킬 기; 디알킬아미노알킬 특히 디메틸아미노메틸, 디메틸아미노에틸, 디에틸아미노메틸 또는 디에틸아미노에틸과 같은 디-저급 알킬아미노 알킬 기; 2-(이소부톡시카르보닐) 펜트-2-에닐 및 2-(에톡시카르보닐) 부트-2-에닐과 같은 2-(알콕시카르보닐)-2-알케닐 기; 프탈리딜 및 디메톡시프탈리딜과 같은 락톤 기를 포함한다.
전형적인 염들은 임의의 클라블란산의 약제학적으로 허용가능한 염, 예를 들면, 알루미늄, 나트륨 또는 칼륨과 같은 알칼리 금속염, 칼슘 또는 마그네슘과 같은 알칼리 토금속염, 및 암모늄 또는 치환된 암모늄 염, 예를 들면 트리에틸아민과 같은 저급 알킬아민, 2-히드록시에틸리덴, 비스-(2-히드록시에틸)아민 또는 트리스-(2-히드록시에틸)아민과 같은 히드록시-저급 알킬아민, 디시클로헥실아민과 같은 시클로알킬아민을 갖는 염, 또는 프로카인, 디벤질아민, N,N-디벤질에틸렌디아민, 1-에펜아민, N-메틸몰폴린, N-에틸피페리딘, N-벤질-β-페네틸아민, 디하이드로아비에틸아민, N,N'-비스디하이드로-아비에틸아민, 에틸렌디아민, 또는 피리딘, 콜리딘 또는 퀴놀린과 같은 피리딘 형태의 염기, 또는 다른 아민, 리튬 염 및 은 염을 갖는 염을 포함한다.
본 명세서에서 사용된 "경구 투여"라는 용어는, 치료제 또는 조성물이 삼켜지던지 아니던지에 상관없이, 치료제 또는 조성물을 개체의 입에 두는, 개체로의 치료제 또는 조성물의 전달 형태를 포함한다. 따라서, "경구 투여"는 식도 및 설하 투여를 포함한다. 치료제의 흡수는 입, 식도, 위, 십이지장, 회장(ileum) 및 결장(colon)을 포함하는 위장관의 임의의 부분 또는 부분들에서 일어날 수 있다.
본 명세서에서, 치료제 또는 조성물이 투여될 수 있는 "개체(subject)"는 양 성별과 임의의 연령의 인간 환자를 포함하며, 또한 임의의 비인간 동물, 특히 가축이나 반려 동물, 예를 들면 고양이, 개 또는 말을 포함한다.
"퇴행성 신경 질환"이라는 용어는 신경계의 퇴행, 기능의 전체 또는 부분적 손실, 또는 불규칙적 기능과 관련된 병태, 질환 및/또는 질병을 지칭한다. 따라서, 이러한 식으로 신경계(중추 또는 말초)의 임의의 성분이나 면에 영향을 주는 임의의 병태, 질환 및/또는 질병은 퇴행성 신경 질환으로 여겨질 수 있고, 퇴행성 신경 질환은 인지 질환, 운동 질환, 정신 질환, 통증 질환, 수면 질환 등을 포함하지만 이에 제한되는 것은 아니며, 전형적인 퇴행성 신경 질환은 파킨슨병, 알츠하이머병, 및 다발성 경화증을 포함하지만 이에 제한되는 것은 아니다. 전형적인 운동 질환은 진전, 근실조증, 무도병, 무정위 운동증(athetosis), 틱 장애, 안검 경련(blepharospasm) 및 편무도병(hemiballysmus), 간대성 근경련(myoclonus), 서경(writer's cramp) 및 사경(torticollis), 하지 불안 증후군 및 고정 자세 불능증(asterixis)와 같은 국소성 근긴장이상(focal dystonias)과 같은 다양한 운동 실조증을 포함할 수 있다. 이들 과잉 또는 그렇지 않으면 비정상 불수의적 운동은 속도, 빈도, 주기성 및 진행적 특성에서 현저하게 다양할 수 있다. 이러한 운동은 파킨슨병; 필수 전진, a.k.a. 양성 전진 또는 가족성 전진; 뚜렛 증후군 (Tourette's syndrome)과 같은 틱 장애; (서경을 포함하는) 특발성 근긴장이상, 진행성 핵상마비(progressive supranuclear palsy) 및 윌슨 병과 같은 때때로 중복되는 질환에서 나타날 수 있다.
본 명세서에서 사용된 "치료하다", "치료" 등의 단어는 질병 또는 질병이나 병태의 임의의 증상의 감소, 임의의 감지할만한 임상적으로 현저한 개선, 발병의 지연, 또는 발병의 예방을 지칭한다. 치료는 치유법(cure)을 요구하거나 필요로 하지 않는다.
"신경보호"는 특히 퇴행성 신경 질환이나 신경 질병, 즉 중추 또는 말초 신경계를 포함하는 신경학 또는 신경계에 영향을 주는 질병의 발병을 지연시키거나 예방하는 방법을 지칭한다. 신경보호 또는 신경보호적 효과는 예를 들면 행동적 또는 인지적 변화나 이의 부족에 의하여 경험적으로, 예를 들면 미처리 대조군에 비하여 뉴런의 파괴 또는 뉴런의 사멸의 감소나 부족 또는 보존을 나타내는 것에 의하여 생물학적으로, 또는 신경계의 어느 부분에 대한 부작용의 부족을 측정하는 어느 다른 기준으로 측정될 수 있다. 뉴런 생존이나 감소의 부족이 확인될 수 있는 전형적인 부위는 흑색질 치밀부 (SNpc) 및 해마(hippocampal) CA3 영역을 포함한다.
본 명세서에서 사용된 "부형제(excipient)"라는 용어는, 치료제 자체가 아닌, 경구 투여에 적합한 정제나 캡슐과 같은 별개의 물품으로 조성물의 투여 단위의 형성을 허용하거나 용이하게 하거나, 또는 치료제의 가공, 취급, 보관, 붕해, 분산, 용해, 방출 또는 감각자극 특성을 증진시키기 위하여 약제학적 조성물에 첨가되거나 개체에 치료제를 전달하기 위한 담체나 비이클로서 사용되는 임의의 성분을 의미한다. 부형제는, 예를 들면 희석제, 붕해제, 결합제, 점착제, 습윤제, 중합체, 윤활제, 활택제, 불쾌한 맛이나 냄새를 감추거나 반감시키기 위하여 첨가되는 성분, 향료, 염료, 향, 및 조성물의 외관을 개선하기 위하여 첨가되는 성분을 포함할 수 있으나 이에 제한되는 것은 아니다.
따라서, 본 발명은 경구 투여에 적합한 포타슘 클라블라네이트 또는 클라비테스(Clavitesse)™의 즉시 또는 연장 방출형 제제의 용도에 관한 것이다. 본 발명의 제제는 많은 클라블라네이트의 빠른 방출 제형 또는 많은 클라블라네이트의 느린 방출 (또는 연장 방출형) 제형을 포함한다. 즉시 방출형 제제는, 클라블라네이트의 빠른 방출, 제제 투여 후 약 5 내지 30분 이내에 클라블라네이트의 최대 방출을 얻는 것에 특징이 있는 빠른 방출에 특징이 있다. 연장 방출형 제제는 예를 들면 적어도 약 4시간에 걸쳐 클라블라네이트를 서서히 방출하는 데 특징이 있다. 전형적인 구현예에서, 연장 방출형 제제는 적어도 약 6 시간 또는 적어도 약 8 시간에 걸쳐 클라블라네이트를 방출할 수 있다. 이들 또는 다른 구현예는 초기 투여 후 적어도 약 3 시간, 적어도 약 4 시간, 적어도 약 5 시간, 적어도 약 6 시간, 적어도 약 7 시간, 또는 적어도 약 8 시간 동안 클라블라네이트를 계속 방출할 수 있다. 전형적인 구현예에서, 본 발명은 제제 전체 중량보다는 제제 중의 약제의 총 양을 기준으로, 약 10㎍ 내지 10㎎의 활성 성분 함량 또는 약 0.01% 내지 10%의 활성 성분 전체 중량을 포함하는, 즉시 또는 연장 방출형 제제를 포함하는 정제 또는 캡슐이다.
본 발명에 따른 신경보호 및 퇴행성 신경 질환 치료는 클라블라네이트의 안정한, 고형 제제를 경구적으로 투여하여 이루어질 수 있다. 치료는 개체 생존, 행동학적 테스트, 면역조직학적 평가, 예를 들면 질병의 특정 증상의 지표의 빈도나 강도를 측정하거나 세포 또는 뉴런 생존을 측정하는 등을 포함하는 수많은 방법으로 평가될 수 있다. 동물 모델이나 인간 연구에서, 행동학적 테스트는 예를 들면 속도 및 방향 등과 관련하여 평가되는 것과 같이, 예를 들면 자신의 위치를 파악하는 능력, 운동 장애의 평가와 같은 것을 포함할 수 있다. 행동학적 테스트는 또한 예를 들면 모리스 수중 미로 테스트와 같은 미로 사용을 통한 기억력 시험을 포함할 수 있다. 면역조직학적 평가는 세포 계수 또는 일반적으로 해당 분야에서 알려진 다른 기술로 이어지는 염색된 자유 부유 영역 상에서 실행될 수 있다. 징후적 테스트는 예를 들면 발작 또는 진전과 같은 다양한 증상의 횟수, 빈도 또는 강도를 평가하거나 또는 기억력 보유를 평가하는 것을 포함할 수 있다.
본 발명에 따르면, MPTP (l-메틸-4-페닐-l,2,3,6-테트라하이드로피리딘)-유도 파킨슨병 동물 모델에서, MPTP-염수 군과 비교하여 안정한 고형 클라블라네이트의 경구 투여에 의하여 예비-치료된 군에서 TH(티로신 하이드록실라아제)-양성 뉴런의 수가 보존된다는 것이 발견되었다. 또한, 클라블라네이트로 예비-치료된 동물들은 카이네이트 유도된 해마 세포 사멸에 대한 현저한 신경보호 효과를 나타내었다. 치료된 동물들은 또한 대조군에 비하여 발작의 더 길어진 발병과 가벼운 발작 활성을 나타내었다.
신경보호 또는 퇴행성 신경 질환의 치료를 위한 어떤 구체예에서, 안정한 고형 제제는 약 0.001 mg/kg 내지 약 1.0 mg/kg 클라블라네이트를 제공하는 함량으로 투여될 수 있다. 어떤 구체예에서, 안정한 고형 제제는 약 0.01 mg/kg 내지 약 1.0 mg/kg 클라블라네이트를 제공하는 함량으로 투여될 수 있다. 어떤 구체예에서, 안정한 고형 제제는 약 0.1 mg/kg 내지 약 1.0 mg/kg 클라블라네이트를 제공하는 함량으로 투여될 수 있다. 이러한 투여량은 효능의 평가에 의하여 나타나는 바에 따라 매일 한 번, 매일 두 번, 매일 세 번, 또는 여러 번 투여될 수 있다. 투여 형태는 임의의 적절하고 편리한 단위 함량, 예를 들면, 투여분 당 0.1 mg, 투여분 당 0.5 mg, 투여분 당 1.0 mg, 투여분 당 5 mg, 등으로 투여되기 위하여 제형화될 수 있다. 전형적인 구현예에서, 안정한 고형 제제는 투여분 당 약 5 mg의 클라블라네이트를 포함할 수 있다.
매일의 투여는 단일 투여분으로 투여되거나 또는 하루에 걸쳐 투여될 다회 투여로 나뉠 수 있다. 다회 투여는 하루 당 2회, 3회, 4회, 또는 그 이상 투여일 수 있다. 이해될 수 있는 바와 같이, 연장 방출형 조성물은 비슷한 전체 하루 투여분을 전달하는 동안 취해져야 하는 하루 투여분의 총 회수를 줄이는 수단을 제공할 수 있다. 과소-투여분이나 과잉-투여분이 덜 일반적임을 확신할 수 있기 때문에, 안정한 고형 투여 형태는 본 발명에서 사용하기에 특히 유리하다. 절대적인 면에서 보면, 분해의 매우 작은 양조차 실제 투여되는 클라블라네이트의 비율에서 상대적으로 큰 변화를 일으킬 수 있는 본 발명에서 이는 특히 중요하다. 클라블라네이트의 어떤 이전 용도, 예를 들면 β-락타마아제 억제제로서 항생제와 결합된 보조제제로서의 용도에서, 안정성의 부족이 과잉의 클라블라네이트 사용에 의하여 유도될 수 있어서 분해는 효율성에 적은 효과를 가진다. 그러나, 클라블라네이트가 활성 성분인 본 명세서에 개시된 바와 같은 적용에서, 전문가는 치료 과정에 적절한 예상할 수 있는 예정된 함량으로 클라블라네이트를 투여할 수 있는 것이 더 중요하다. 이는 또한 환자의 적응 및 치료 효율을 더 증가시킬 수 있다.
정제나 캡슐과 같은 약제학적 제제의 경구 투여는 i.v. 또는 i.m.과 같은 비경구적 투여보다 특수한 장점을 가진다. 통증이 있는 주사성 제제로 치료가 요구되는 질병은 경구 투여 형태로 치료될 수 있는 병태보다 더 심각한 것으로 여겨진다. 그러나, 경구 제제의 주요 장점은 자가 투여를 위한 적합성이 유지되는 반면, 비경구 제제는 대부분의 경우, 의사 또는 준의료 담당자에 의하여 투여되어야만 한다. 본 발명에서, 경구 투여는 퇴행성 신경 질환의 적어도 일부 지시자와 관련하여 효율성을 증가시킨 것으로 나타난다.
다양한 약물 성분의 특성, 예를 들면 입자 크기 분포, 벌크 밀도, 유동성, 습윤 거동, 표면적 및 점착 성향 등은 매우 다양하고 정제와 같은 고형 투여 형태의 가공성에 영향을 줄 수 있다. 클라블라네이트는 매우 흡습성이고, 물과 접촉시 결정 상태로부터, 열등한 안정성을 나타내는 무정형 상태로 변한다. 이러한 장애의 조합은 표준 제형이 제조 공정을 극도로 어렵게 만들고, 클라블라네이트 제제의 보관을 다루기 어렵게 하고, 그리고 클라블라네이트 함유 제제의 보관과 제조를 위한 특정 조건을 만들어내었다.
비록 가장 통상적이고 쉽게 취급되는 형태가 극도로 흡습성이면서 수분 민감성이지만, 포타슘 클라블라네이트는 제제화하기 예외적으로 어려운 재료로 남아 있다. 분해는 물 또는 수성 매질의 존재하에서 쉽게 일어난다. 클라블라네이트가 활성 약제학적 성분인 본 명세서에 개시된 바와 같은 적용에서, 전문가는 치료 목적에 적합한 예상가능한 예정된 함량으로 클라블라네이트를 투여할 수 있는 것이 중요하다. 안정한 경구 투여 형태의 투여는 이러한 경우에서 치료적 용도에 바람직하다.
따라서, 클라블라네이트의 특성들을 고려하는 상기한 문제점들을 극복하는 적절하고 강력한 클라블라네이트 제제가, 클라블라네이트가 유일한 활성 성분인 신경 보호 및 퇴행성 신경 질환 치료를 위하여 요구된다. 클라블라네이트 제제가 직면하는 문제점들은, 적은 분해 정도에서조차 개체에 사용될 수 있는 클라블라네이트의 함량에서 극적인 변화를 이끌 수 있는 10 μg 내지 10 mg과 같은 낮은 투여량의 제제의 경우에 특히 도전적이다.
본 발명은 클라블라네이트의 안정한 경구 투여 형태의 제조 및 신경보호와 퇴행성 신경 질환의 치료에 사용하기 위한 이의 용도에 관한 것이다. 본 발명에 따라 사용하기 위한 고형 경구 투여 형태는 고형 경구 투여 형태의 제조에 일반적으로 적합한 첨가제 또는 부형제를 포함할 수 있다. 고형 경구 투여 형태는, 예를 들면, 정제, 캡슐, 정제, 트로키 및 분말을 포함한다. 캡슐의 경우, 고형 경구 투여 형태는 캡슐 내에 비드일 수 있다. 본 발명의 전형적인 구현예에서, 고형 경구 투여 형태는 안정한 고형 정제이다.
정제 제제에 일반적으로 사용되는 정제화 보조제가 사용될 수 있고, 이에 대한 광범위한 문헌이 언급된다. 특히 본 명세서에 참조로 삽입된 Fiedler의 "Lexicon der Hilfstoffe", 4th Edition, ECV Aulendorf 1996를 참조하라. 이들은 비록 다음으로 제한되지는 않으나, 충진제, 결합제, 붕해제, 윤활제, 활택제, 안정화제, 충진제 또는 희석제, 계면활성제, 필름 형성제, 연화제, 색소 등을 포함한다.
충진제는 전분, 예를 들면 감자 전분, 밀 전분, 옥수수 전분, 하이드록시프로필 셀룰로오스, 하이드록시에틸 셀룰로오스, 하이드록시프로필 메틸 셀룰로오스(HPMC) 및 미세결정성 셀룰로오스, 예를 들어, 등록 상표명 아비셀(AVICEL), 필트랙(FILTRAK), 휴에튼(HEWETEN), 프로솔브(Prosolve) SMCC50 또는 파마셀(PHARMACEL)로서 입수가능한 제품을 포함한다. 충진제의 다른 예들은 말토오스, 이소말트, 락토오스(예를 들면 팔마토오스?로서), 슈크로오스, 글루코오스, 만니톨, 솔비톨, 및 칼슘 카보네이트를 포함한다.
결합제는 전분, 당, 셀룰로오스 또는 하이드록시프로필 셀룰로오스와 같은 변성 셀룰로오스, 락토오스, 또는 자일리톨, 솔비톨, 또는 말티톨과 같은 당 알코올을 포함한다. 전형적인 결합제는 말토덱스트린(말트린(Maltrin) M150)이다.
붕해제로서, 카르복시메틸셀룰로오스 칼슘(CMC-Ca), 카르복시메틸셀룰로오스 나트륨(CMC-Na), 가교화 PVP (예: CROSPOVIDONE, POLYPLASDONE 또는 KOLLIDON XL), 알긴산, 소듐 알지네이트 및 구아 검을 들 수 있다. 가교화 PVP (CROSPOVIDONE), 가교화 CMC (Ac-Di-Sol), 카르복시메틸 전분-Na (PIRIMOJEL 및 EXPLOTAB), 파마버스트(Pharmaburst) 및 하이드록시프로필셀룰로오스(L HPC LH-11)는 전형적인 붕해제이다.
매트릭스는 예를 들면, 메토셀(Methocel) KlOO Prem-M 또는 유드라짓(Eudragit) RS PO 분말, 메타크릴 공중합체 (예를 들면, 메타크릴 공중합체 A형, 메타크릴 공중합체 B형, 카보폴(Carbopol)), 및 당업계에 알려진 다른 것을 포함할 수 있다.
활택제의 예는 콜로이드성 실리콘 디옥사이드, 예를 들면 건식 실리카 (카보실, 에어로실), 마그네슘(Mg) 트리실리케이트, 분말화 셀룰로오스와 같은 콜로이드성 실리카, 전분, 탈크 및 삼염기성 칼슘 포스페이트 또는 충진제 또는 결합제와 이들의 조합, 예를 들면, 규산화(silicified) 미세결정성 셀룰로오스 (PROSOLV)를 포함한다. 카보실(Cabosil)은 또한 흐름 증진제/수분 보호제로 작용할 수도 있다.
또한, 충진제나 희석제는 정제 가루 설탕, 압축성 설탕, 덱스트레이트, 덱스트린, 덱스트로오스, 락토오스, 만니톨, 미세결정성 셀룰로오스, 예를 들면 아비셀(Avicel)과 같이 약 0.45 g/cm3의 밀도를 갖는 미세결정성 셀룰로오스, 분말화 셀룰로오스, 솔비톨, 슈크로오스 및 탈크를 포함할 수 있다.
윤활제는 마그네슘 스테아레이트, 알루미늄 스테아레이트, 및 칼슘 스테아레이트, PEG 4000 내지 PEG8000, 탈크, 수소화 캐스터 오일, 글리세롤 에스테르, Na-스테아릴 퓨마레이트, 수소화 면실유 등과 같은 스테아르산 및 이의 염들을 포함한다. 통상적인 윤활제는 스테아르산 및 Mg 스테아레이트이다.
정제 및 캡슐은 차광 및 삼킴성의 목적으로 장용성 코팅 및 다른 방출-제어 코팅을 가지고 추가로 제조될 수 있다. 장용성 코팅의 예는, 예를 들면, 메타크릴산 공중합체, 셀룰로오스 아세테이트(및 그의 숙시네이트와 프탈레이트화물), 스티롤 말레산 공중합체, 폴리메타크릴산/아크릴산 공중합체, 히드록시프로필 메틸 셀룰로오스 프탈레이트, 폴리비닐 아세테이트 프탈레이트, 히드록시에틸 에틸셀룰로오스 프탈레이트, 히드록시프로필 메틸 셀룰로오스 아세테이트 숙시네이트, 셀룰로오스 아세테이트 테트라하이드로프탈레이트, 아크릴 수지, 티멜리테이트, 및 쉘락으로부터 제조되는 화합물을 포함할 수 있다. 장용성 코팅을 위한 전형적인 중합체는 유드라짓(Eudragit)과 같은 메타크릴 공중합체를 포함한다. 장용성 코팅을 위한 다른 적절한 중합체는 당업계에 알려져 있다. 이 코팅은 약제학적으로 허용되는 염료로 착색될 수 있다. 코팅액에서 염료 및 다른 부형제의 함량은 다양할 수 있고, 즉시 또는 연장 방출형 정제의 성능에 영향을 주지 않을 것이다. 코팅액은 일반적으로 하이드록시프로필 셀룰로오스, 하이드록시프로필메틸 셀룰로오스, 셀룰로오스 에스테르 또는 에테르, 아크릴 중합체 또는 중합체의 혼합물과 같이 필름 형성 중합체를 포함한다. 코팅액은 일반적으로 프로필렌 글리콜, 솔비탄 모노올레이트, 소르브산, 티타늄 다이옥사이드와 같은 충진제, 약제학적으로 허용가능한 염료를 추가로 포함하는 수용액이다.
본 발명에 따라 사용하기 위한 고형 안정한 경구 투여형은 활성성분인 클라블라네이트의 치료적 유효량 및 첨가제로서 충진제를 포함한다. 추가적인 첨가제는 결합제, 붕해제, 윤활제, 활택제, 안정화제, 희석제, 계면활성제, 필름 형성제, 색소, 연화제 및 접착 방지제, 등을 포함할 수 있지만 이에 제한되는 것은 아니다.
표 10에 나타난 바와 같이 포타슘 클라블라네이트는 96hr 동안 약 35%의 상대 습도에 노출될 때 상대적으로 낮은 수분 함량(건조 중량 기준 <1%)을 갖는다. 그러나, 조해는 결국 40% 상대 습도를 넘는 어떠한 습도에서도 일어날 수 있을 것 같다. 50% 상대 습도에 노출된 건조 포타슘 클라블라네이트에 의한 수분 흡수는 시간당 약 1.44%의 속도로 일어난다.
클라블라네이트 함유 약제학적 조성물의 제조 동안 냉동 건조 또는 동결 건조의 사용은 클라블라네이트 제형의 안정성을 약 97%로 증가시킨다(표 11 참조).
본 발명에 따라 사용하기 위한 안정한 고형 경구 약제학적 조성물은 약 10 μg 내지 10 mg, 예를 들면, 약 0.1 mg 내지 약 5 mg 범위의 투여량에서 약제학적 활성 성분(API)로서 클라블라네이트를 포함할 수 있다. 전형적인 구현예에서, 클라블라네이트는 클라블라네이트 염, 예를 들면 포타슘 클라블라네이트이다. 10 ng 내지 10 μg/kg 범위의 i.p. 투여량에서 CNS 활성 및 거동을 수정할 수 있다는 것이 보고되었다(미국 특허 6,489,319호 참조).
본 발명에 따르면, 클라블라네이트는 약 10 μg 내지 약 10 mg 클라블라네이트, 예를 들면 약 0.1 mg 내지 약 5 mg 클라블라네이트를 함유하는, 예를 들면, 즉시 방출형 및 연장 방출형 투여 형을 포함하는 많은 투여 형으로 투여될 수 있다. 이러한 투여 형은 신경보호 및 퇴행성 신경 질환과 이의 증상의 치료를 위하여 사용될 수 있다.
즉시 방출형은 본 명세서에 개시된 표준 검사에 의하여 측정된 바와 같이, 약 30분 미만 이내에 바람직하게는 클라블라네이트의 적어도 약 80% (w/v) 용해를 제공한다. 본 발명의 구현예에 따른 즉시 방출형 약제학적 조성물은 고형 투여 형을 취급할 수 없는 환자에게 편리한 투여를 위한 적절한 수용액 (예: 물, 염수, 쥬스) 또는 콜로이드 현탁액 (예: 유아용 조제식 또는 우유)에 빠르게 용해될 수 있다. 이러한 환자들의 예는 유아, 어린이, 및 삼키는 것이 어려움을 경험할 수 있는 성인이다. 전형적인 구현예에서, 적어도 약 80%의 클라블라네이트는 조성물이 수용액에 있는 시간으로부터 약 15분까지 수용액에 용해된다. 다른 구현예에서, 적어도 약 90%의 클라블라네이트는 수용액에 조성물을 노출시킨 후 약 30 분, 또는 약 15 분까지 수용액으로 방출된다. 도 1에 도시된 바와 같이, 본 발명을 실행하는데 유용한 전형적인 즉시 방출형 조성물은 수용액에 노출 후 15분 이내에 90%의 클라블라네이트를 방출한다.
연장 방출형 조성물은 활성성분, 즉 클라블라네이트를 장시간에 걸쳐, 예를 들면 약 8 시간에 걸쳐 또는 약 10 시간에 걸쳐 방출할 수 있다. 연장 방출형 제제는 제제가 위장관에 도달하자마자 활성성분을 방출하기 시작할 수 있고, 서서히 용해가 계속되고 대략 일정한 방식으로 활성 성분을 방출할 수 있다. 이 프로파일은 투여 후 혈류 내에서 활성 성분의 일정한 수준을 제공하기 때문에 바람직하다. 도 2에 도시된 바와 같이, 본 발명을 실행하기에 유용한 전형적인 연장 방출형 조성물은 투여 후 약 8 내지 10 시간까지 클라블라네이트의 실질적인 수준 방출을 제공할 수 있다.
본 발명의 구현예에 따라 사용하기 위한 약제학적 조성물은 중요한 장점을 제공한다. 클라블라네이트는 흡습성이며 물에서 불안정하거나 가수분해되기 때문에, 수분 함량의 조절은 클라블라네이트 함유 조성물의 보관과 제제에서 주요한 문제이다. 안정한 즉시 방출형 또는 연장 방출형 조성물을 제조하기 위한 냉동 건조의 사용은, 특히 클라블라네이트가 냉동 건조 전 부형제와 혼합될 때 예상치 못하게 증진된 안정성을 제공한다.
본 발명으로의 사용을 위한 구현예는: (1) 클라블라네이트와 적어도 하나의 부형제를 혼합하여 클라블라네이트 조성물을 형성하고; (2) 다량의 클라블라네이트 조성물, 예를 들어 클라블라네이트가 냉동된 고체 상태로 전환될 때까지 0℃ 이하에서 냉동하고; 그리고 (3) 밀폐된 용기 내에서 클라블라네이트 조성물을 탈수하는 과정을 포함하는 동결 건조된 클라블라네이트의 조성물이 사용될 수 있다. 분말화된 형태에서 약물을 포함하는 탈수된(동결 건조된) 조성물은 정제로 압축되거나 치수화된 비드로 제조되기 전 다른 부형제와 혼합될 수 있다.
최종 건조 제제의 수분 함량은 낮다. 본 명세서에 사용된 다양한 구현예는 약 10% (중량 기준) 이하, 약 5% 이하, 또는 약 4% 이하, 또는 그 미만의 최종 수분 함량을 가질 수 있다. 본 발명의 이러한 구현예에 따른 건조 제제는 25℃ 및 60% 상대 습도 또는 30℃ 및 65% 상대 습도와 같은 조건에서, 예를 들면, 약 30일, 약 60일 또는 약 90일 동안 안정한 것과 같은 연장된 기간 동안 고도로 안정성있게 보관된다. 적절한 액체로의 희석시, 실질적으로 정해진 처음 투여에서 이는 완전히 강력하다.
본 발명으로 사용하기 위한 제제는 중합체, 예를 들면 유드라짓(Eudragit)과 같은 매트릭스(메타크릴산과 에틸 아크릴레이트의 음이온성 공중합체), 말트린(Maltrin) M50과 같은 결합제/희석제 및/또는 파마버스트(Pharmaburst)와 같은 붕해제, 충진제, 클라블라네이트, 및 다른 부형제(실시예 참조)를 건조 블렌드한 다음, 적절한 과립화가 얻어질 때까지 물을 사용하여 혼합물을 과립화하여 제조될 수 있다. 과립화는 이 분야에 공지된 방법에 의하여 실행된다. 습식 과립은 동결 건조기에서 동결 건조되고, 적절한 크기로 체질되고 분쇄된다. 윤활제는 최종 제제를 얻기 위하여 건조된 과립과 혼합될 수 있다. 클라블라네이트가 흡습성이고 물에서 불안정하기 때문에, 혼합물이 젖은 상태로 있는 시간을 최소화할 필요가 있으며, 예를 들면 칭량과 과립화에서부터 동결 건조까지의 가공 시간은 약 1hr일 수 있다.
본 발명으로 사용하기 위한 조성물은, 예를 들면 정제 또는 캡슐 형태로 경구로 투여된다. 정제는 이 분야에서 알려진 기술로 제조될 수 있고 이러한 기술에 의하여 정제를 형성하기 위하여 필요에 따라 이러한 부형제와 클라블라네이트의 약제학적으로 유용한 함량을 함유할 수 있다. 위약 입자가 클라블라네이트 없이 그러나 동일한 조성으로 제조될 수 있다.
성인 개체에서 신경보호 또는 퇴행성 신경 질환 치료를 위하여 사용될 수 있는 안정한 고형 클라블라네이트 제제의 전형적인 투여량은 일일 약 5 mg 내지 일일 약 100 mg이 될 수 있다. 전형적인 구현예에서, 매일의 투여량은 약 5 mg 내지 약 70 mg, 예를 들면 약 5 mg 내지 약 50 mg 또는 약 7 mg 내지 약 70 mg이다. 다른 전형적인 투여량은 일일 약 10 mg 내지 일일 약 50 mg, 일일 약 5 mg, 일일 7 mg, 일일 10 mg, 일일 20 mg, 일일 25 mg, 또는 일일 35 mg일 수 있다. 이전에 개시된 바와 같이, 일일 투여량은 매일 1회, 매일 2회, 매일 3회 또는 그 이상으로 투여될 수 있다. 이해될 수 있는 바와 같이, 하루 당 더 적은 투여량을 투여하는 것은 연장 방출형 제제의 사용을 일반적으로 요구할 수 있다. 예로서, 10 mg의 매일 투여량은 10 mg의 1회 투여, 5 mg의 2회 투여, 약 3.33 mg의 3회 투여 또는 2.5 mg의 4회 투여로 투여될 수 있다. 다른 투여량이 특정 개인에게 필요한 투여량을 위하여 계산될 수 있다.
본 발명에 따른 투여를 위한 안정한 고형 투여형은 단위 투여형으로 제공될 수 있다. 단위 투여형은 클라블라네이트 활성 재료의 예정된 함량을 함유하는 단일 투여이다. 단위 투여형의 예는, 제한없이, 정제, 약용드롭스(lozenge), 캡슐, 및 분말을 함유하는 패킷을 포함한다. 본 발명에 따른 투여를 위한 단위 투여형은, 예를 들면, 클라블라네이트 0.1 mg, 0.25 mg, 1 mg, 1.5 mg, 2.0 mg, 2.5 mg, 5.0 mg, 7.5 mg, 10 mg 또는 다른 함량을 포함할 수 있다. 단일 투여는 일회 단위 투여형, 다회 단위 투여형 또는 부분 단위 투여형을 포함할 수 있다. 예로서, 5 mg 투여는 2.5 mg 클라블라네이트를 함유하는 두 개의 단위 투여형 각각, 5.0 mg 클라블라네이트를 함유하는 일회 단위 투여형, 10 mg 클라블라네이트를 함유하는 단위 투여형의 절반으로 투여될 수 있다. 다른 단위 투여형을 포함하는 다른 투여 함량이 쉽게 계산될 수 있다.
약물 동력학 연구
본 발명의 제제를 위한 생물학적 이용성 연구는 건강한 개체에게 정제 형태로 즉시 또는 연장된 제제를 투여하고, 24시간에 걸쳐 다른 시간 간격으로 혈장 내에서 클라블라네이트의 수준을 측정하여 결정되었다. 혈장 샘플은 문헌에 개시된 것과 유사한 유효한 고속액체 크로마토그래피 과정을 사용하여 BAS 어낼리틱스 (West Lafayette, Ind.)에 의하여 클라블라네이트에 대하여 분석하였다. 예를 들면, Chu S-Y, 등, "Simultaneous determination of clarithromycin and 14(R)-hydroxyclarithromycin in plasma and urine using high performance liquid chromatography with electrochemical detection (전기화학적 검출과 함께 고속액체크로마토그래피를 사용한 혈장과 소변 내의 클라리스로마이신과 14(R)-하이드록시클라리스로마이신의 동시 결정)", J. Chromatography, 571, pp 199-208(1991) 참조.
실시예
다음의 실시예들은 단지 예시를 목적으로 하는 것으로, 이어지는 청구 범위를 제한하고자 하는 것은 아니다.
실시예 1: 클라블라네이트 정제의 제조
실시예
1
A
- 포타슘
클라블라네이트
분말을 사용한 즉시 방출형
클라블라
네이트 정제의 제조
정제 제조 공정의 예시적 설명: 습식 과립 정제 제제 공정은 과립화 단계에서 물이 포함된 다음 낮은 수분 함량(<3%)의 과립을 얻기 위하여 건조되는 경우에 발견되었다. 건조된 제제는 선행 기술 제제에 비하여 비-흡습성이지만, 이로부터 제조된 정제와 동등한 물리적 특성 (예를 들면, 용해, 붕해, 생물학적 이용성 및 다른 물성)을 유지한다. 정제 제조는 결합제/희석제의 존재 하에서 물과 함께 클라블라네이트를 과립화하여 실시되었다.
샘플 C의 제조를 위하여, 말트린(Maltrin) M150 (130 g)을 정제수에 용해하고, 포타슘 클라블라네이트 (API; 59.5 g)를 첨가하였다. 프로졸브(Prosolve) SMCC-50 (490.5 g), 파마버스트(Pharmaburst) (130.0 g), L HPC LH-11 (120.0 g),악디졸(Acdisol) (20.0 g) 및 스테아르산 (50 g)을 칭량하고 백에서 흔들고 회전시켜 백에서 혼합하였다. 이 혼합물을 호바트(Hobart) 믹서의 보울로 전달하고, API/Maltrin M150 용액을 10분 동안 교반하면서 혼합물에 첨가하였다. 젖은 덩어리가 완성된 후, 호바트 믹서의 보울 내용물을 압출기로 전달하여 압출하였다. 압출물을 타정기(spheronizer)에 넣고 타정된 재료를 백에 수집하여 고어텍스-리오가드 트레이에서 냉동 건조시켰다. 건조된 재료를 스크리닝하여 정제로 압축하거나 치수화된 비드로 제조하였다. 샘플 A 및 B를 샘플 C와 같은 방법으로 제조하였다.
실시예
1
B
-
클라비테스
(
Clavitesse
)
TM
를 사용한 즉시 방출형
클라블라네이트
정제의 제조
샘플 D의 제조를 위하여, 클라비테스(Clavitesse)™ (API; 50.6 g), 프로졸브(Prosolve) SMCC 50 (213.4 g), 파마버스트(Pharmaburst) (100.0 g), 악디졸(Acdisol) (8.0 g), 카보실(Cabosil) (8.0 g) 및 마그네슘 스테아레이트 (20.0 g)를 칭량하여 고어텍스-리오가드 트레이에서 2-8℃에서 밤새 냉동 건조하였다. 다음 날, API, 프로졸브(Prosolve) SMCC 50, 파마버스트(Pharmaburst) 및 악디졸(Acdisol)을 백에서 혼합하고, # 40 메시로 선별하고, V 블렌더에 두고, 7분 동안 혼합하였다. 혼합물을 다시 선별하고 4분 동안 V 블렌더에 혼합하였다. 카보실과 마그네슘 스테아레이트를 선별하고 4분 동안 V 블렌더에서 API를 함유하는 혼합물과 혼합하였다. 블렌드를 고어텍스-리오가드 트레이에서 밤새 냉동건조하였다. 재료를 정제로 압축하고, 정제를 고어텍스-리오가드 트레이에서 냉동 건조하고, 포장하였다. 샘플 E를 샘플 D와 같은 방법으로 제조하였다.
실시예
1C -
클라비테스
(
Clavitesse
)
TM
를 사용한 연장 방출형
클라블라네
이트 정제의 제조
샘플 F의 제조를 위하여, 적절한 함량의 클라비테스(Clavitesse) (API; 41.07 g), 메토셀(Methocel) KlOOLV Prem CR (90.0 g), 이소말트(Isomalt) (83.55 g), 아비셀(Avicel) PH-112 (80.04 g), 카보실(Cabosil) (1.5 g), 탈크 (2.4 g) 및 마그네슘 스테아레이트 (1.5 g)를 칭량하여 고어텍스-리오가드 트레이에서 2-8℃로 밤새 냉동 건조기에서 건조하였다. 각 성분을 선별하여 별도의 백에 수집하였다. API와 메토셀(Methocel) KlOOLV Prem CR을 V 블렌더에 로딩하고, 혼합하여 적절한 체로 선별하고 혼합을 계속하였다. 아비셀(Avicel) PH-112 및 이소말트(Isomalt)를 혼합물에 첨가하고 혼합하였다. 얻어진 혼합물을 선별하고 다시 혼합하였다. 카보실(Cabosil)과 탈크를 혼합하여 혼합물에 첨가하고 혼합하였다. 마그네슘 스테아레이트를 V 블렌더에서 혼합물과 혼합하였다. 최종 블렌드를 고어텍스-리오가드 트레이에서 밤새 냉동 건조하고 정제로 압축하고 치수화된 비드로 제조하였다. 정제를 연장 방출형 코팅을 위하여 더 높은 경도에서 압축하였다. 정제 또는 비드를 지연 방출형 중합체, 유드라짓(Eudragit)으로 코팅하였다.
실시예
1
D
- 포타슘
클라블라네이트
분말을 사용한 연장 방출형
클라블라네이트
정제의 제조
포타슘 클라블라네이트를 사용하여 연장 방출형 정제를 제조하기 위하여, 샘플 G, 포타슘 클라블라네이트 (API; 20.69 g)를 # 60 메시로 선별하고 다른 부형제, 메토셀(Methocel) KlOOLV Prem CR (90.02 g), 이소말트(Isomalt) (83.56 g), 아비셀(Avicel) PH-112 (100.41 g), 카보실(Cabosil) (1.52 g), 탈크 (2.4 g) 및 마그네슘 스테아레이트 (1.5 g)를 # 40 메시를 통하여 선별하였다. 각 성분을 별도의 백에 수집하였다. API와 메토셀(Methocel) KlOOLV Prem CR을 V 블렌더에 로딩하고, 5분 동안 혼합하였다. 혼합물을 선별하고 추가 5분 동안 혼합하였다. 아비셀(Avicel) PH-112 및 이소말트(Isomalt)를 혼합물에 첨가하고 5분 동안 V 블렌더에서 혼합하였다. 얻어진 혼합물을 선별하고 추가로 5분 동안 혼합하였다. 카보실(Cabosil)과 탈크를 혼합하여 혼합물로 첨가한 다음 얻어진 혼합물을 2분 동안 혼합하였다. 최종적으로, 마그네슘 스테아레이트를 V 블렌더에서 3분 동안 혼합물과 혼합하고, 최종 블렌드를 고어텍스-리오가드 트레이에서 밤새 냉동 건조하고 정제로 압축하고 치수화된 비드로 제조하였다. 정제를 연장 방출형 코팅을 위하여 더 높은 경도에서 압축하였다. 정제 또는 비드를 지연 방출형 중합체, 유드라짓(Eudragit)으로 코팅하였다. 샘플 H와 I를 샘플 G와 동일한 방법으로 제조하였다.
실시예 2: 클라블라네이트 분석
제조된 약제학적 조성물의 클라블라네이트 함량을 다음 과정을 사용하여 Waters HPLC (고속액체 크로마토그래피) 시스템(컬럼: μBondapack-NH2 (10 μm) 300 mm x 3.9 mm, 이동상: CH3CN:pH 5.2 KH2PO4 = 65:35, 유속: 1.0 ml/min)으로 측정하였다: 약 10개의 정제를 정확하게 칭량하고 분쇄하고, 100 ml의 물을 첨가하고, 혼합물을 20분 동안 초음파 분해하였다. 물로 희석한 후, 약간의 용액을 여과하고 HPLC로 주입하였다. 주요 피크를 HPLC에 의하여 표준 제법의 크로마토그램에 해당하는 샘플의 보유 시간으로 확인하였다. % 클라블라네이트를 참조 표준의 반응 인자와 비교하여 분석 반응 인자 기준으로 계산하였다.
클라블라네이트 표준 곡선의 선형성을 0.01 mg/ml의 명목상 농도에서 참조 표준의 25, 50, 75, 100, 125, 150%에서 검증하였다. R2는 0.9998이었다. 0.01 mg/ml 클라블라네이트의 명목상 농도에서, RSD 1.4의 비율로 6개의 샘플을 사용하여 정확성을 입증하였다. 정확성은 0.01 mg/ml의 50%, 100%, 및 150%에서 스파이크된 위약 블렌드를 제조하여 3번 반복 분석하였다.
실시예 3: 전형적인 제제 및 특성
다음 실험은 다른 투여량의 즉시 방출형 (IR) 정제 및 연장 방출형 (ER) 정제로 디자인된 정제 제제를 설명한다. 다음의 표는 또한 본 발명의 제제에 따른 정제의 물성을 나타낸다.
실시예
3A - 포타슘
클라블라네이트를
사용하는 즉시 방출형 조성물
즉시 방출형 조성물을 하기의 방법을 사용하여 포타슘 클라블라네이트 분말과 표 1에 기재된 부형제로 제조하였다.
| 성분(mg) | 기능 | 샘플 A 0.1 mg/정제 |
샘플 B 0.3 mg/정제 |
샘플 C 5 mg/정제 |
| 포타슘 클라블라네이트 | API* | 0.1 | 0.357 | 5.95 |
| 말트린 M150 | 결합제/희석제 | 15 | 15 | 13 |
| 프로솔브 SMCC 50 | 충진제 | 50 | 50 | 49.05 |
| 파마버스트 | 붕해제 | 15 | 15 | 13 |
| L HPC LH-11 | 붕해제 | 15 | 15 | 12 |
| 악디솔 | 붕해제 | 0.1 | 0.1 | 2 |
| 스테아르산 | 윤활제 | 4.8 | 4.543 | 5 |
API*: 활성 약제학적 성분
표 2는 포타슘 클라블라네이트 분말을 사용한 즉시 방출형 정제의 특성을 요약하였다. 샘플 C 정제는 2-8℃에서 1주일 후 94.4% 포타슘 클라블라네이트를 함유하는 현저한 안정성을 나타낸다.
| 변수 | 단위 | 샘플 A 0.1 mg/정제 |
샘플 B 0.3 mg/정제 |
샘플 C 5 mg/정제 |
| 중량 | mg | 106 | 106 | 101 |
| 경도 | KP | 5 | 5 | 3-5 |
| 두께 | mm | 0.155 | 0.155 | 3.6-3.8 |
| 붕해 시간 | 초 | 15 | 15 | 20 |
| 분석 | % | 95.3 | 95.3 | 89.4-92.9% |
| 1주 분석 2-8℃ | % | - | - | 94.4 |
| 함량 균일성 | RSD | 2.5 | 2.6 | 1 |
| 용해 | 용해 % | - | 5분 내에 98% | 5분 내에 89% |
| 수분 함량-최종 | % | - | 0.91 | 3.14 |
실시예
3B -
클라비테스
(
Clavitesse
)™를 사용한 즉시 방출형 조성물
5 mg의 클라블라네이트를 포함하는 즉시 방출형 조성물을 표 3에 나타낸 바와 같이 클라비테스(Clavitesse)™를 사용하여 제조하였다.
| 성분(mg) | 기능 | 샘플 D 5 mg/정제 |
샘플 E 5 mg/정제 |
| 포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1:1 혼합물 | API* | 12.65 | - |
| 포타슘 클라블라네이트와 실리콘 디옥사이드의 1:1 혼합물 | API* | - | 12.62 |
| 프로솔브 SMCC 50 | 충진제 | 53.35 | 53.38 |
| 파마버스트 | 붕해제 | 25 | 25 |
| 악디솔 | 붕해제 | 2 | 2 |
| 카보실 | 흐름 증진제/수분 보호제 | 2 | 2 |
| 마그네슘 스테아레이트 | 윤활제 | 5 | 5 |
표 4는 클라비테스TM를 사용하는 즉시 방출형 정제의 특성을 요약하였다.
| 변수 | 단위 | 샘플 D 5 mg/정제 |
샘플 E 5 mg/정제 |
| 중량 | mg | 103-104 | 108 |
| 경도 | KP | 5-7 | 5-7 |
| 붕해 시간 | 분 | <1분 | <2분 |
| 수분 함량 | % | 3.24 | 3.40 |
실시예
3C -
클라비테스
™ 및 포타슘
클라블라네이트
분말을 사용한 연장 방출형 조성물
연장 방출형 조성물들을 표 5-8에 도시된 바와 같이 클라비테스™ 또는 포타슘 클라블라네이트 분말을 사용하여 제조하였다.
| 성분(mg) | 기능 | 샘플 F 5 mg/정제 |
샘플 G 5 mg/정제 |
샘플 H 0.3 mg/정제 |
샘플 I 1.0 mg/정제 |
| 포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1:1 혼합물 | API* | 13.69 | - | ||
| 포타슘 클라블라네이트 | API* | - | 6.894 | 0.357 | 1.19 |
| 클루셀 LF (하이드록시 프로필 셀룰로오스) | 매트릭스 | 6 | - | ||
| 메토셀 K100 Prem M | 매트릭스 | - | 37 | ||
| 유드라짓 RS PO 분말 | 매트릭스 | 20 | - | ||
| 메토셀 K100 LV Prem CR | 매트릭스 | 30.0 | 30.0 | ||
| 무수 락토오스 | 충진제 | 30 | - | ||
| 아비셀 PH-112 | 충진제 | 26.67 | 27.85 | 41.24 | - |
| 아비셀 PH-113 | 충진제 | - | 20 | ||
| 이소말트 | 충진제 | 27.85 | 33.47 | - | 40 |
| 카보실 | 활택제 | 0.5 | 0.5 | 0.8 | 0.5 |
| 마그네슘 스테아레이트 | 윤활제 | 0.5 | 0.5 | 1.6 | 0.5 |
| 탈크 | 윤활제 | 0.8 | 0.8 | - | 0.8 |
| 합계 | 100mg | 100mg | 100mg | 100mg |
API*: 활성 약제학적 성분
| 성분(mg) | 기능 | 샘플 J 5 mg/정제 |
샘플 K 5 mg/정제 |
| 포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1:1 혼합물 | API* | 13.69 | - |
| 포타슘 클라블라네이트 | API* | - | 6.894 |
| 유드라짓 S100 | 매트릭스 | 25.0 | 25.0 |
| 아비셀 PH-112 | 충진제 | 26.67 | 27.85 |
| 이소말트 | 충진제 | 30.34 | 35.96 |
| 에토셀 10cps | 활택제 | 1.5 | 1.5 |
| 아세틸트리부틸 시트레이트 | 윤활제 | 2.0 | 2.0 |
| 탈크 | 윤활제 | 0.8 | 0.8 |
| 합계 | 100mg | 100mg |
API*: 활성 약제학적 성분
| 성분(mg) | 기능 | 샘플 L 5 mg/정제 |
샘플 M 5 mg/정제 |
| 포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1:1 혼합물 | API* | 13.69 | - |
| 포타슘 클라블라네이트 | API* | - | 6.894 |
| 카보폴 971P | 매트릭스 | 20.0 | 20.0 |
| 카보폴 974P | 매트릭스 | 35.0 | 35.0 |
| 팔마토오스 DCL21 | 충진제 | 29.51 | 36.31 |
| 카보실 | 활택제 | 0.5 | 0.5 |
| 마그네슘 스테아레이트 | 윤활제 | 0.5 | 0.5 |
| 탈크 | 윤활제 | 0.8 | 0.8 |
| 합계 | 100mg | 100mg |
API*: 활성 약제학적 성분
| 성분(mg) | 기능 | 샘플 N 5 mg/정제 |
샘플 O 5 mg/정제 |
| 포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1:1 혼합물 | API* | 13.69 | - |
| 포타슘 클라블라네이트 | API* | - | 6.894 |
| 메타크릴레이트 공중합체 A형 | 매트릭스 | 30.0 | 30.0 |
| 메타크릴레이트 공중합체 B형 | 매트릭스 | 25.0 | 25.0 |
| 아비셀 PH-112 | 충진제 | 29.51 | 36.3 |
| 카보실 | 활택제 | 0.5 | 0.5 |
| 마그네슘 스테아레이트 | 윤활제 | 0.5 | 0.5 |
| 탈크 | 윤활제 | 0.8 | 0.8 |
| 합계 | 100mg | 100mg |
API*: 활성 약제학적 성분
표 9는 클라비테스™ 및 포타슘 클라블라네이트 분말을 사용하는 연장 방출형 정제의 특성을 요약하였다.
| 변수 | 단위 | 샘플 F 5 mg/정제 |
샘플 G 5 mg/정제 |
샘플 H 0.3 mg/정제 |
샘플 I 1.0 mg/정제 |
| 중량 | mg | 99.9-102.4 | 92.0-108.3 | 104-105 | 108 |
| 경도 | KP | 9.9-14.0 | - | 7-9 | 10 |
| 분석 | % | 105.9 | 96.2 | 0.756 | 3.44 |
실시예 4: 인 비트로 용해 연구
정제를 500ml의 용매(즉시 방출형 정제를 위해서는 탈이온수; 연장 방출형 정제를 위해서는 처음 2시간 동안 pH 1.2 용액 그 다음 8시간 동안 시트르산염 완충액 pH 7.0)에 두었다. 혼합물을 37℃, 100 rpm에서 회전시키고, 샘플을 주기적으로 수집하여 HPLC에 의하여 용해된 클라블라네이트 함량을 시험하였다.
결과를 도 1-3에 도시하였다. 도 1을 샘플 B와 샘플 C의 클라블라네이트 즉시-방출형 제제의 인 비트로 용해 프로파일을 도시한 그래프이다. 도 1에 도시된 바와 같이, 즉시 방출형 정제에서 90% 이상의 클라블라네이트를 수용액 노출 후 15분 이내에 용해시켰다. 도 2는 샘플 F의 클라블라네이트의 연장-방출형 제제의 인 비트로 용해 프로파일을 도시한 그래프이다. 도 3은 샘플 I의 클라블라네이트의 연장-방출형 제제의 인 비트로 용해 프로파일을 도시한 그래프이다. 도 2 및 3에 도시한 바와 같이, 연장 방출형 정제 내 클라블라네이트의 전체 투여량을 적어도 약 8 내지 10시간의 기간에 걸쳐 부식과 용해 기전을 거쳐 서서히 방출시켰다. 연장 방출형 형태에서의 클라블라네이트의 방출은 pH 1.2 용액에서 검출되지 않았다.
실시예 5: 안정성 시험
고형의 포타슘 클라블라네이트는 수증기 존재 하에서 흡습성이고 불안정하다. 클라블라네이트의 안정성 연구는 크로마토그래피 방법에 의하여 모니터하여 실행되었다. 정적 또는 평형 접근법이 수착 등온선을 생성하는 시도의 다른 상대 습도에서 챔버 내에 샘플을 보관함으로써 연구되었다. 수착 등온선은 대기에서 평형 수분 함량과 상대 습도 (RH) 사이의 정량적 관계를 나타낸다. 표 10은 다른 습도 상태에 노출된 후 포타슘 클라블라네이트 분말 내 수분 함량의 변화를 나타낸다.
| 시간 | % RH | 수분 함량(%) (g H2O/g 습한 고체) |
수분 함량(%) (g H2O/g 건조한 고체) |
| 96hr |
33 | 0.708 | 0.713 |
| 35 | 0.733 | 0.737 | |
| 37 | 0.842 | 0.848 | |
| 39 | 1.264 | 1.280 | |
| 41 | 1.542 | 1.566 | |
| 43 | 3.976 | 4.140 | |
| 45 | 4.778 | 5.018 | |
| 47 | 12.823 | 14.708 |
표 10에 나타난 바와 같이, 포타슘 클라블라네이트는 96hr 동안 상대습도 약 35% 이하에 노출될 때 상대적으로 낮은 수분 함량(건조 중량 기준으로 <1%)을 가진다. 그러나, 약 40% 상대 습도를 넘는 임의의 습도에서 궁극적으로 조해 (deliquescence)가 일어나는 것 같다. 약 50% 상대 습도에 노출된 건조 포타슘 클라블라네이트에 의한 수분 흡수는 시간 당 약 1.44%의 속도로 일어난다.
포타슘 클라블라네이트는 극도로 수분과 열에 민감하여서 제제화하기 예외적으로 어려운 재료이다. 분해는 물과 수성 매질의 존재에서 쉽게 일어난다. 활성 성분 클라블라네이트를 그대로 유지하는 습식 과립화 후 습기를 제거하기에 적절한 조건을 찾기 위하여 여러 방법이 시험되었다. 샘플 C 내의 재료를 습식 과립화하고 회전 타원체화(spheronize)하여 제조하였다. 수분 함유 회전 타원체형 제제를 트레이로 전달하고 수분 제거를 위하여 다른 보관 조건에 두었다.
표 11에 요약된 바와 같이, 69 hr 동안 30℃에서의 보관(보관 1), 75 hr 동안 45℃에서의 보관(보관 2)은 각각 포타슘 클라블라네이트가 45% 및 60%까지 분해되게 하였다. 유동성 베드 시스템에서의 건조는 단지 1.5hr 내에 13%까지 클라블라네이트를 분해되게 하였다. 이들 데이타는 포타슘 클라블라네이트가 또한 온도 민감성임을 제시한다. 냉동 건조는 동결 건조 과정 21시간 후 활성 성분 97%를 보유하였다. 표 11의 결과들은 클라블라네이트의 냉동 건조가 클라블라네이트 제제 내의 수분 함량을 감소시키고 제제의 안정성을 증가시키기 위하여 사용될 수 있다는 것을 나타낸다.
| 방법 | 온도(℃) | 시간(hr) | 클라블라네이트(%) |
| 보관 1 | 30 | 69 | 55 |
| 보관 2 | 45 | 75 | 40 |
| 유동성 베드 | 40 | 1.5 | 87 |
| 동결 건조 | 영하 | 21 | 97 |
클라비테스™로부터 제조된 즉시 방출형 정제, 샘플 D 및 샘플 E의 안정성이 최대 3개월의 기간 동안 평가되었다. 도 4는 25℃/60% 습도 및 30℃/65% 습도에서 샘플 D (포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1:1 혼합물 5 mg/정제)의 안정성을 보여주는 그래프이다. 도 5는 25℃/60% 습도 및 30℃/65% 습도에서 샘플 E (포타슘 클라블라네이트와 실리콘 디옥사이드의 1:1 혼합물 5 mg/정제)의 안정성을 보여주는 그래프이다. 표 4 및 도 4와 5에 나타난 바와 같이, 샘플 D와 샘플 E에 따라 제조된 양쪽 정제는 초기에는 4%-수분 미만을 함유하며, 클라블라네이트에 비하여 상대적으로 높은 습도 조건, 25℃/60% 습도에서 7% 미만이 분해되었다. 클라비테스™로부터 제조된 연장 방출형 정제, 샘플 F 및 샘플 G의 안정성이 최대 2개월의 기간 동안 평가되었다. 도 6은 2-8℃, 25℃/60% 습도, 및 30℃/65% 습도에서 샘플 F (포타슘 클라블라네이트와 미세결정성 셀룰로오스의 1:1 혼합물 5 mg/정제)의 안정성을 보여주는 그래프이다. 도 7은 2-8℃, 25℃/60% 습도 및 30℃/65% 습도에서 샘플 G (5 mg/정제)의 안정성을 보여주는 그래프이다. 표 5 및 도 6과 7에 나타난 바와 같이, 샘플 F와 샘플 G에 따라 제조된 정제들은 초기에는 4%-수분 미만을 함유하며, 클라블라네이트에 비하여 상대적으로 높은 습도 조건, 30℃/65% 습도에서 1.6% 미만이 분해되었다. 따라서, 클라비테스(Clavitesse)™에서 미세결정성 셀룰로오스 또는 실리콘 디옥사이드는 정제 내에 수분을 포획하여 포타슘 클라블라네이트의 안정성을 증가시키는 것에 추가로 기여할 수 있는 것 같다.
실시예 6. 약물 동력학 연구
비글 독의 혈청 내 클라블라네이트의 함량을 LC/MS/MS 방법에 의하여 측정하였다. 분해물의 크로마토그래피 분리를 역상 PLRP-S 중합체 컬럼에서 실행하였다.포타슘 클라블라네이트 및 타조박탐 (기준 화합물)의 보유 시간은 각각 8.51 및 8.54분이었다. 총 크로마토그래피 시행 시간은 25분이었다. M/S 분석은 음성 전기 분무 이온화 모드에서의 다회 반응 모니터링에 의하여 어플라이드 바이오시스템(Applied Biosystems')의 API 2000 삼중-사중극 질량 분광기에 의하여 실행되었다. 질량 스펙트럼 데이타는 어낼리스트(Analyst) 1.4.1 (Applied Biosystems)에 의하여 분석되었다. 약물 동력학 분석은 PK 용액 2.0 (Summit Research Services)을 사용하여 실시되었다.
실시예
6A - 수컷
비글
독에서의 즉시 방출형 (
IR
) 정제의 경구 투여
세 마리의 수컷 비글 독을 치료 사이에 약효 세척(washout) 기간을 갖는 교차 디자인의 연구를 통하여 사용하였다. 개들에게 투여 사이에 24시간 보다 긴 세척 기간을 갖고 경구 경로를 통하여 실시예 3A의 IR 정제로 시험 성분을 제공하였다. 시험 성분 투여 전 밤새 동물들을 단식시키고, 4시간 후-투여량을 공급하였다. 전체 치료 동안, 투여 후 0, 5, 15, 30분, 1, 1.5, 2, 2.5, 3, 4, 6, 9 및 12시간에 혈액 샘플 (1.5ml)을 정맥 주사로 두부 정맥으로부터 헤파린화된 튜브로 뽑아내었다. 10분 동안 3,000rpm에서 원심분리를 통하여 혈장을 얻고, LC-MS/MS 시스템에 의하여 분석하였다. 연관 평균 약물 동력학 변수를 표 12에 나타내었다.
실시예
6B - 수컷
비글
독에 포타슘
클라블라네이트
용액을
IV
투여
세 마리의 수컷 비글 독을 치료 사이에 세척 기간을 갖는 교차 디자인의 연구를 통하여 사용하였다. 개들에게 투여 사이에 24시간 보다 긴 세척 기간을 갖고 정맥내 경로를 통하여 수용액으로서 시험 성분을 제공하였다. 시험 성분 투여 전 밤새 동물들을 단식시키고, 4시간 후-투여량을 공급하였다. 전체 치료 동안, 투여 후 0, 5, 15, 30분, 1, 1.5, 2, 2.5, 3, 4, 6, 9 및 12시간에 혈액 샘플 (1.5ml)을 정맥 주사로 두부 정맥으로부터 헤파린화된 튜브로 뽑아내었다. 10분 동안 3,000rpm에서 원심분리를 통하여 혈장을 얻고, LC-MS/MS 시스템에 의하여 분석하였다. 연관 평균 약물 동력학 변수를 표 12에 나타내었다.
실시예
6C - 수컷
비글
독에 연장 방출형 (
ER
) 정제의 경구 투여
네 마리의 수컷 비글 독을 치료 사이에 세척 기간을 갖는 교차 디자인의 연구를 통하여 사용하였다. 개들에게 투여 사이에 24시간 보다 긴 세척 기간을 갖고 경구 경로를 통하여 실시예 3C의 ER 정제로 시험 성분을 제공하였다. 시험 성분 투여 전 밤새 동물들을 단식시키고, 4시간 후-투여량을 공급하였다. 전체 치료 동안, 투여 후 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 및 12시간에 혈액 샘플 (1.5ml)을 정맥 주사로 두부 정맥으로부터 헤파린화된 튜브로 뽑아내었다. 10분 동안 3,000rpm에서 원심분리를 통하여 혈장을 얻고, LC-MS/MS 시스템에 의하여 분석하였다. 연관 평균 약물 동력학 변수를 표 12에 나타내었다.
| PK 변수* | IV 경구(IR 정제) 경구(ER 정제) | |||||||
| 평균 | SD | 평균 | SD | 평균 | SD | 평균 | SD | |
| 투여량(mg) | 4.2 | - | 3.5 | - | 7.4 | - | 21.6 | - |
| Tmax(hr) | - | - | 1.2 | 0.3 | 1.2 | 0.3 | 2.8 | 1.0 |
| Cmax(ng/ml) | - | - | 125.8 | 80.0 | 413.7 | 127.9 | 821.3 | 492.7 |
| AUC0-t(hr.ng/ml) | 684.4 | 74.6 | 175.6 | 101.8 | 498.4 | 70.8 | 1702.4 | 580.6 |
| CL(1/hr) | 5.8 | 0.7 | - | - | - | - | - | - |
| Vd(l) | 4.4 | 0.5 | - | - | - | - | - | - |
| Vss(l) | 3.8 | 0.4 | - | - | - | - | - | |
| t1 /2(hr) | 0.52 | 0.02 | 0.49 | 0.09 | 0.46 | 0.02 | 1.9 | 1.5 |
| MRTinf(hr) | 0.65 | 0.01 | 1.6 | 0.1 | 1.7 | 0.3 | 3.4 | 1.5 |
| F(%) | 100 | - | 29.9 | 14.7 | 41.4 | 4.7 | 45.4 | 15.5 |
* PK 변수: Tmax: 최대 농도까지의 시간, Cmax: 최대 농도, AUC: 곡선 아래 면적, CL: 정화치(clearance), Vd: 분포 부피, Vss: 정상 상태에서 분포 부피, t1/2: 반감기, MRTinf: 평균 보유 시간, F: 생물 활성도
경구로 제공될 때, 30~41%의 평균 생물 활성도를 가지고, 포타슘 클라블라네이트가 단식된 동물에게 잘 흡수되는 것으로 나타났다. 명확한 최종 반감기는 0.5시간이었다.
실시예 7: 파킨슨 병 동물 모델
과정
클라블라네이트의 신경 보호 효과를 MPTP (l-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘) 유도 파킨슨 병 동물 모델에서 시험하였다. 8주령 수컷 C57BL/6 마우스를 열 마리의 6개 군으로 분리하였다. MPTP 치료 전 세 번(하루에 한 번), 10마리의 동물을 특정 투여량과 투여 경로(2-5군)로 클라블라네이트로 치료한 반면, 나머지 동물들(1군 및 6군)에게는 염수 비이클을 제공하였다(표 13 참조). MPTP를 20 mg/kg의 투여량으로 4번(총 80 mg/kg) 복막내로 제공하였다. MPTP 치료 후 두 번(하루에 한 번), 동물에게 클라블라네이트이나 염수 비이클을 별도 투여하였다. MPTP 치료로 생존한 동물을 7일 후 희생시키고, 이들의 뇌를 흑색질 치밀부 (SNpc) 내 조직학적 변화에 대하여 검사하였다. 실험 동물과 동일한 체중과 연령의 10마리의 미처리 대조군을 희생시키고, 이들의 해마 형태학을 비교를 위한 표준으로 사용하였다.
| 군 | MPTP | 클라블라네이트 투여량 | 투여 경로 |
| 1군 | 예 | 없음(염수 단독) | |
| 2군 | 예 | 0.01mg/kg | 복막내 |
| 3군 | 예 | 0.1mg/kg | 복막내 |
| 4군 | 예 | 0.1mg/kg | 위관(gavage) |
| 5군 | 예 | 1.0mg/kg | 위관 |
| 6군 | 아니오 | 없음(염수 단독) |
행동 시험
장대(pole) 시험을 효율적으로 사용하여 파킨슨 병의 설치류 모델을 평가하였다. 이 시험에서, 금속 장대를 위쪽으로 들어 마우스를 정상에 두고, 아래로 향하여 내려가는 시간을 측정하였다. 운동 손상은 아래를 향하여 내려가는 증가된 시간과 상관관계를 가진다.
선으로 감싼 장대(50-cm 높이, 1-cm 너비) 정상에 마우스를 두었다. 마우스의 우리 내에 장대의 베이스를 두었다. 그 다음 아래로 향하여 장대를 내려가는데 필요한 시간을 기록하였다. MPTP-치료 마우스는 아래를 향하여 장대를 내려오는 시간을 더 늦추는 것으로 알려져 있다. 시험 일에, 동물을 5회 시도를 거쳐 기록하고 5번 시행에 걸친 평균을 계산하였다. 만약 마우스가 장대에서 떨어지거나 어떠한 주어진 시도에서 막대 아래로 내려올 수 없다면 동물의 이전 시도 중 가장 긴 시간을 실패 시행에 대하여 기록하였다.
MPTP-염수 군은 정상 군과 비교하여 운동 활성의 현저한 증가를 나타내었다. 낮은 투여량의 클라블라네이트 처리 군(0.01 mg/kg, i.p. 및 0.1 mg/kg, ga)에서 TH-IR (티로신 하이드록실라아제-면역 반응성) 뉴런의 운동 활성 시간이 현저하게 감소되었다. 그러나, 그 시간은 MPTP 및 고 투여량 클라블라네이트 처리 군과 현저하게 다르지 않았다. 도 10은 마우스 PD 모델에서 장대 시험을 사용하여 MPTP-유도 신경 독성에 대한 클라블라네이트의 행동 효과를 도시한다. 각 컬럼은 평균±S.E.M.을 나타낸다 *: 대조군 대비 P 값 < 0.05, ##: P 값 < 0.01, ###: MPTP 단독 처리 군 대비 P 값 < 0.001. (T-LA, 운동 활성 시간; ga, 위관 공급(gavage).) 표 14는 MPTP-유도 PD 모델의 운동 활성에 대한 클라블라네이트의 행동 효과를 나타낸 것이다.
| T-LA | 정상 | MPTP | MPTP+클라블라네이트 0.1mg/kg ga. |
MPTP+클라블라네이트 1mg/kg ga. |
MPTP+클라블라네이트 0.01mg/kg i.p. |
MPTP+클라블라네이트 0.1mg/kg i.p. |
| 평균 | 9.361 | 13.784 | 5.898 | 10.213 | 7.981 | 13.086 |
| s.e.m | 0.733 | 1.566 | 0.203 | 1.489 | 0.983 | 1.866 |
조직 가공
실험 완료시, 동물을 10 mg/kg 펜토바르비탈 나트륨을 IP 주사하여 마취시킨 다음, 5분의 시간에 거쳐 pH 7.4의 PBS 10ml, 그 다음 PBS 내 4% 파라포름알데히드 50ml를 심장투과로 관류시켰다. 뇌들을 두개골로부터 제거하고, 4시간 동안 동일한 고정용액 내에 함침시켜 후-고정시킨 다음 PBS 중의 30% 슈크로오스로 전달하였다. 상기 슈크로오스 용액에서 평형 유지 후, 관상면 분획(section)을 40 μm의 두께로 냉동 절단을 사용하여 보관 용액 내로 절단하고, 염색 전 4℃에 보관하였다.
티로신 하이드록실라아제(TH) 면역 조직 화학
면역 조직 화학은 유리 부유 분획 상에서 실시되었다. 모든 착색을 5 시리즈의 분획 중 1개 상에서 실시하였다. 배양 시간과 세척은 각 뇌에 대하여 동일하다는 것을 보증하고 동일한 용액의 항체를 동시에 사용하여 모든 분획을 염색하였다. 다음 프로토콜이 사용되었다. 분획을 PBS에서 세정하였다. 내인성 퍼옥시다아제 효소 활성을 PBS 내의 3% 과산화수소에 10분 함침하고, PBS에서 세정 및 재-평형화하여 억제시켰다. PBS 중의 3% 정상 염소 혈청/0.1% Trixon X-100 용액 내에서 1시간 예비 배양 기간 후, 분획은, 상온에서 밤새 1% 정상 염소 혈청/0.1% Triton X-IOO의 1:2,000 희석으로 폴리크로날 항-TH (티로신 하이드록실라아제) 항체 (Chemicon)에서 배양시켰다. 완전히 세정 후, PBS 중의 0.1% Triton X-IOO 내의 비오틴화 항-토끼 항체(Vector, 1:200)를 90분 동안 적용하였다. 그 다음 1시간 동안 PBS 중의 ABC 용액(Vector, 1:100) 적용 전 15분 동안 세정한 다음, PBS에서 완전히 세정하였다. 서양 고추냉이 퍼옥시다아제 라벨이 0.1 μl/ml의 과산화수소를 함유하는 PBS 내 DAB의 0.02% 용액 중에서 3분 배양하여 나타났다. 분획을 상승하는 일련의 알코올에서 탈수되고 비워진 젤라틴-코팅 현미경 슬라이드 상에 배접시키고 히스토마운트 배지를 사용하여 커버 글라스로 덮었다.
데이타의
정량화와 통계 분석
광학 분류 장치, 계수된 요소(뉴런)의 크기 또는 기준 부피에 영향을 받지 않는 세포 계수를 위한 공정한 방법을 사용하여 뉴런을 계수하였다. 이 방법은 컴퓨터-제어 모터 장착 스테이지, 비디오 카메라, 및 스테레오 인베스티게이터 소프트웨어(MicroBrightField, Williston, VT)가 장착된 Zeiss 플라나포크로마트(planapochromat) 대상물을 포함하는 악시오팟(Axiophot) 광현미경(Zeiss, 독일)으로 이루어지는 컴퓨터-연결된 영상 분석 시스템을 사용하여 실시되었다. 세포 계수는 해부학적 표준으로 표준 마우스 아틀라스(Paxinos 및 Franklin, 2004)를 사용하여 SN의 전체 범위를 통하여 매 5번째 분획 중 SNpc 상 뉴런의 수를 계수하여 실행하였다.
스튜던츠 t 검정으로 각 실험 군에 대한 통계 분석을 평가하였다. p<0.05일 때 차이를 유의적인 것으로 간주하였다. 모든 통계 분석은 그래프패드 프리즘 소프트웨어(GraphPad Prism software)를 사용하여 실행되었다.
결과
정상군에서, 많은 TH-면역반응성(IR) 뉴런은 흑색질 치밀부 내에 분포되었고, 일부 TH-IR 뉴런이 흑색질 그물부(substantia nigra pars reticulata)에 분산되어 있었다. MPTP-염수 군은 정상 군에 비하여 TH-IR 뉴런의 유의적인 감소를 나타내었다. 클라블라네이트 처리 군(ip 및 ga)에서, TH-IR 뉴런이 MPTP-유도된 TH-IR 뉴런 손상으로부터 현저하게 보호되었다. 도 8은 흑색질 치밀부 (SNpc) 내의 티로신 하이드록실라아제(TH)에 대한 면역 조직 화학을 도시하였다. TH-양성 뉴런의 수가 정상 군에 비하여 MPTP-염수 군에서 유의적으로 감소하였다. TH-양성 뉴런의 수는 MPTP-클라블라네이트 처리 군에서 잘 보존되었다. 도 9는 MPTP-처리 동물에서 흑색질 치밀부 (SNpc) 뉴런 생존율에 대한 클라블라네이트 치료 효과를 도시한 것이다. MPTP-처리 군에서는 SNpc 내의 TH-양성 뉴런에서 유의적인 감소가 있었다. 양쪽 클라블라네이트-처리 군(ip 및 ga)에서, 위관 공급 처리 뒤에 세포의 더 많은 보호가 있는, SNpc 내 TH-양성 뉴런의 현저한 보호가 있었다. 중앙 및 측면의 SNpc를 분리하는 제3의 두개골 신경의 뿌리쪽 측면 AP-3.16에서 SNpc의 가장 넓은 치수에서 TH-양성 SNpc 뉴런을 양 방향으로 계수하였다. (*: 정상 군 대비 P 값 < 0.05, ##: P 값 < 0.05, ###: MPTP 단독 처리 군 대비 P 값 < 0.001, ip, 복막내; ga, 위관 공급.)
실시예 8: 카이네이트 동물 모델
과정
신경보호제로서, 클라블라네이트를 카이네이트 동물 모델에서 시험하였다. 300~350g 체중이 나가는 30마리 수컷 스프라그 돌리 랫트를 세 군으로 분리하였다. 카이네이트 처리 1시간 전, 7마리 동물은 10 μg/kg의 IP 투여량으로 클라블라네이트로 처리된 반면, 남아 있는 동물에게는 염수 비이클이 제공되었다. 7마리 클라블라네이트 처리 동물과 13마리 염수 비이클 처리 동물에게 20 mg/kg의 투여량으로 카이네이트가 IP로 제공되었다. 다음 60 분에 걸쳐, 동물의 발작 활성을 관찰하였다. 카이네이트 처리 60분 후, 동물에게 클라블라네이트 또는 염수 비이클을 따로 IP 주사 (10 μg/kg)하였다. 카이네이트 처리로 생존한 동물을 7일 후 희생시키고 이들의 뇌를 해마 내 조직학적 변화에 대하여 조사하였다. 실험 동물로서 동일한 체중과 연령의 10마리의 미처리 대조 동물을 희생시켜 이들의 해마 형태를 비교 표준으로 사용하였다.
조직 가공 및
크레실
바이올렛 염색
실험 완료시, 동물을 10 mg/kg 펜토바르비탈 나트륨의 IP 주사로 마취시킨 다음, 5분의 시간에 걸쳐 pH 7.4의 PBS 100ml, 그 다음 PBS 중 4% 파라포름알데히드 250ml를 심장투과로 관류시켰다. 뇌들을 두개골로부터 제거하고, 4시간 동안 동일한 고정용액 내에 함침시켜 후-고정시킨 다음 PBS 중의 30% 슈크로오스로 전달하였다. 상기 슈크로오스 용액의 평형 유지 후, 관상면 분획을 40 μm의 두께로 냉동 절단을 사용하여 보관 용액 내로 절단하고, 염색 전 4℃에 보관하였다. 모든 착색을 5 시리즈의 분획 중 1개 상에서 실시하였다. 각 뇌로부터 나온 한 시리즈의 분획을 다음과 같이 일반적인 뉴런 염색 크레실 바이올렛을 사용하여 염색하였다. 분획을 젤라틴-코팅된 현미경 슬라이드 상에 배접하고 상온에서 밤새 건조시켰다. 그 다음 하강하는 일련의 알코올(90%, 80%, 및 70% 에탄올)에 5분 함침시킨 다음 증류수에 30분 함침시켜 탈수시켰다. 크레실 바이올렛 용액(0.1 M 아세테이트 나트륨 완충액 내 5%, pH 3.5)에 3분 함침시켜 염색을 실시하였다. 자일렌에서 세정하고 히스토마운트 배지를 사용하여 커버 슬립하기 전 염색의 구분 및 탈수를 상승하는 일련의 알코올(70%, 80%, 90%, 95%, 및 100% 에탄올)에서 실시하였다.
데이타의
정량화 및 통계 분석
카이네이트 유도된 뉴런성 손상에 대한 클라블라네이트의 효과를 평가하기 위하여, 컴퓨터-기저 CCD 카메라(Multiscan, Fullerton, CA)가 장착된 영상 분석 시스템을 사용하여 뉴런 수의 측정이 실행되었다. 크레실 바이올렛 양성 뉴런의 수를 동물당 5 분획으로 해마의 1mm 직경으로 계수하였다. 크레실 바이올렛 양성 뉴런의 수를 대조군의 것과 비교하였다. 데이타를 평균±SEM으로 표현하였다. 데이타를 일방 아노바 SPSS 프로그램으로 평가하고, 평균을 던컨의 다중 범위 검정을 사용하여 측정하였다. 통계적 유의성을 P<0.05에서 고려되었다.
결과
클라블라네이트를 제공한 동물은 염수만을 제공한 대조군에 비하여 더 길어진 발작 발병 개시 및 가벼운 발작 활성을 나타내었다. 카이네이트+염수 군 중 각각 6마리가 카이네이트 처리 24시간 내에 사망하였다. 그러나, 클라블라네이트+카이네이트 군은 치사성(fatality)을 나타나지 않았다. 표 15는 발작 등급 척도를 표로 나타낸 것이다(Sperk 등, 1983). 발작율은 카이네이트 처리 60-120분 후에 측정되었다.
클라블라네이트를 제공한 동물들은 카이네이트 유도된 해마 세포 사멸에 현저한 신경보호 효과를 나타내었다. 도 11은 카이네이트(KA) 유도 해마 신경독성에 대한 클라블라네이트의 효과를 나타낸다. CA3 내의 뉴런의 수는 KA 처리된 랫트(KA+염수)에서 현저하게 감소되었다. KA 처리된 랫트에 대한 클라블라네이트 치료는 CA3 영역에 대한 강력한 신경보호 효과를 나타내었다. 카이네이트-염수 처리군에서, 피라미드 세포층(stratum pyramidale) 내 크레실 바이올렛 양성 CA3 세포들은 카이네이트 치료 7일 후 현저하게 감소하였다. 이 군에서, 피라미드 세포층 내의 크레실 바이올렛 양성 뉴런은 정상군 대비 29.7%였다. 클라블라네이트 처리군에서, 88.7%의 피라미드 뉴런이 크레실 바이올렛에 양성이었다. 도 12는 정상, 카이네이트+염수, 및 카이네이트+클라블라네이트 처리 군의 CA3 영역에서 크레실 바이올렛 착색을 나타내었다. KA+염수 군은 정상 군 대비 크레실 바이올렛 양성 뉴런의 현저한 감소를 나타내었다. 클라블라네이트 처리 군에서, 풍부한 크레실 바이올렛 양성 뉴런이 CA3 영역내 피라미드 세포층에서 관찰되었다. 각 컬럼은 평균±S.E.M. (*: 대조군 대비 P 값 < 0.05. #: KA+염수 대비 P 값 < 0.05.)을 나타내었다. 또한, 클라블라네이트 처리 랫트가 카이네이트-염수로 처리된 동물과 비교할 때 CA3 내의 뉴런의 정상 형태를 가지는 것으로 나타났다.
| 군 | 생존율(%) | 발작율 |
| 카이네이트+염수 | 53.8(7/13) | 4 |
| 카이네이트+클라블라네이트 | 100(7/7) | 0-1 |
| 염수 | 100(10/10) | 0 |
본 명세서에서 설명되고 검토된 구현예들은 본 발명을 완성하고 사용하는 발명자에게 공지된 가장 좋은 방법을 이 분야의 기술자에게 개시하기 위한 것이다. 본 명세서의 어떤 것도 본 발명의 범위를 제한하는 것으로 여겨져서는 안된다. 제시된 모든 실시예들은 대표적인 것이며 제한적인 것이 아니다. 상기한 개시 내용에 비추어 이 분야의 기술자에 의하여 이해되는 바와 같이, 상기한 본 발명의 구현예는 본 발명을 벗어남없이 변형되고 변화될 수 있다. 따라서, 특별히 설명되지 않는 한 청구항의 범위 및 이의 균등범위 내에서 본 발명이 실행될 수 있다는 것이 이해될 수 있다.
Claims (19)
- 치료적 유효량의 클라블라네이트를 포함하는 안정한 경구 제제를 경구적으로 투여하는 단계를 포함하는 퇴행성 신경 질환의 치료 방법으로서, 상기 클라블라네이트는 클라블란산, 클라블란산 유도체, 또는 클라블란산의 약제학적으로 허용가능한 염으로 이루어진 군으로부터 선택되는 것인 퇴행성 신경 질환의 치료 방법.
- 치료적 유효량의 클라블라네이트를 포함하는 안정한 경구 제제를 경구적으로 투여하는 단계를 포함하는 신경보호를 제공하는 방법으로서, 상기 클라블라네이트는 클라블란산, 클라블란산 유도체, 또는 클라블란산의 약제학적으로 허용가능한 염으로 이루어진 군으로부터 선택되는 것인 신경보호 제공 방법.
- 치료적 유효량의 클라블라네이트를 포함하는 안정한 경구 제제를 경구적으로 투여하는 단계를 포함하는 신경 세포 손실 또는 사멸을 예방하는 방법으로서, 상기 클라블라네이트는 클라블란산, 클라블란산 유도체, 또는 클라블란산의 약제학적으로 허용가능한 염으로 이루어진 군으로부터 선택되는 것인 신경 세포 손실 또는 사멸 예방 방법.
- 제2항에 있어서, 신경보호는 퇴행성 신경 질환으로부터 세포 손실 또는 세포 사멸을 예방하는 단계를 포함하는 것인 신경보호 제공 방법.
- 제1항 또는 제4항에 있어서, 상기 퇴행성 신경 질환은 파킨슨병, 알츠하이머병, 및 다발성 경화증으로 이루어진 군으로부터 선택되는 것인 방법.
- 제1항 내지 제5항 중 어느 하나의 항에 있어서, 상기 클라블라네이트는 포타슘 클라블라네이트인 방법.
- 제1항 내지 제6항 중 어느 하나의 항에 있어서, 상기 경구 제제는 정제, 캡슐, 알약, 트로키, 용액, 현탁액, 경구 또는 설하 정제, 경구적 분해 정제, 얇은 필름 또는 분말 형태인 방법.
- 제1항 내지 제7항 중 어느 하나의 항에 있어서, 상기 제제는 적어도 약 4시간 동안 클라블라네이트를 방출하는 연장-방출형 조성물인 방법.
- 제1항 내지 제7항 중 어느 하나의 항에 있어서, 상기 제제는 약 0.5시간보다 짧은 시간 내에 클라블라네이트를 방출하는 즉시-방출형 조성물인 방법.
- 제6항에 있어서, 포타슘 클라블라네이트는 실리콘 디옥사이드 또는 미세결정성 셀룰로오스와의 1:1 혼합물로서의 포타슘 클라블라네이트 또는 포타슘 클라블라네이트 분말인 방법.
- 제1항 내지 제10항 중 어느 하나의 항에 있어서, 상기 제제는 클라블라네이트를 하나 이상의 부형제와 혼합하고; 클라블라네이트와 하나 이상의 부형제의 혼합물을 과립화하고; 그리고 클라블라네이트와 하나 이상의 부형제의 과립화된 혼합물을 냉동 건조하는 공정에 의하여 제조되는 것인 방법.
- 제1항 내지 제11항 중 어느 하나의 항에 있어서, 상기 제제는 약 0.001 mg/kg/day 내지 약 1.0 mg/kg/day의 클라블라네이트를 제공하는 함량으로 투여되는 방법.
- 제1항 내지 제12항 중 어느 하나의 항에 있어서, 상기 제제는 일회의 매일 투여로 투여되는 것인 방법.
- 제1항 내지 제13항 중 어느 하나의 항에 있어서, 상기 제제는 다회 투여로 투여되는 것인 방법.
- 제1항 내지 제14항 중 어느 하나의 항에 있어서, 상기 치료는 발작 또는 진전(tremor)의 빈도, 발병 시간 또는 심각도를 감소시키는 것을 포함하는 방법.
- 제1항 내지 제15항 중 어느 하나의 항에 있어서, 상기 치료는 기억 손실을 감소시키는 것을 포함하는 방법.
- 제1항 내지 제16항 중 어느 하나의 항에 있어서, 상기 치료는 신경 세포 사멸을 감소시키는 것을 포함하는 방법.
- 제1항 내지 제17항 중 어느 하나의 항에 있어서, 상기 제제는 매트릭스; 충진제; 활택제(glidant); 및 윤활제 중 하나 이상을 포함하는 것인 방법.
- 제18항에 있어서, 상기 매트릭스는 메토셀(Methocel) KlOOLV Prem CR, 유드라짓(Eudragit) SlOO, 카보폴(Carbopol) 971P, 카보폴 974P, 메타크릴레이트 공중합체 A형 및 메타크릴레이트 공중합체 B형, 및 이의 혼합물로 이루어진 군으로부터 선택되고; 상기 충진제는 무수 락토오스, 아비셀(Avicel) PH-112, 아비셀 PH-113, 이소말트, 및 이의 혼합물로 이루어진 군으로부터 선택되고; 활택제는 카보실(Carbosil)이고; 그리고 윤활제는 하나 이상의 마그네슘 스테아레이트 및 탈크 중 하나 이상인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17384109P | 2009-04-29 | 2009-04-29 | |
| US61/173,841 | 2009-04-29 | ||
| PCT/US2010/032983 WO2010127125A1 (en) | 2009-04-29 | 2010-04-29 | Clavulanate formulation for neuroprotection and treatment of neurodegenerative disorders |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120012823A true KR20120012823A (ko) | 2012-02-10 |
Family
ID=42261971
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117028280A KR20120012823A (ko) | 2009-04-29 | 2010-04-29 | 신경보호 및 퇴행성 신경 질환 치료용 클라블라네이트 제제 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20100255099A1 (ko) |
| EP (1) | EP2424498A1 (ko) |
| JP (1) | JP2012525427A (ko) |
| KR (1) | KR20120012823A (ko) |
| CN (1) | CN102413814A (ko) |
| AU (1) | AU2010242948A1 (ko) |
| BR (1) | BRPI1013901A2 (ko) |
| CA (1) | CA2758029A1 (ko) |
| IL (1) | IL215940A0 (ko) |
| MX (1) | MX2011011459A (ko) |
| WO (1) | WO2010127125A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6627625B1 (en) * | 1999-08-16 | 2003-09-30 | Revaax Pharmaceuticals, Llc | Treatment of behavioral disorders with β-lactam compounds |
| US6426342B2 (en) * | 1999-08-16 | 2002-07-30 | Revaax Pharmaceuticals, Llc | Use of β-lactamase inhibitors as neuroprotectants |
| AU2008317315A1 (en) * | 2007-10-26 | 2009-04-30 | Rexahn Pharmaceuticals, Inc. | Pharmaceutical formulation of clavulanic acid |
| WO2013006808A2 (en) * | 2011-07-06 | 2013-01-10 | Rexahn Pharmaceuticals, Inc. | Clavulanic acid for treatment of restless legs syndrome |
| US8978166B2 (en) * | 2012-08-27 | 2015-03-17 | Well & David Corp. | Multi-function garment |
| EP4275760A3 (en) * | 2014-08-25 | 2024-02-07 | Société des Produits Nestlé S.A. | Egg protein formulations and methods of manufacture thereof |
| CA2988918A1 (en) * | 2015-06-19 | 2016-12-22 | Biotie Therapies, Inc. | Controlled-release tozadenant formulations |
| AU2020257990A1 (en) * | 2019-04-15 | 2021-08-19 | Nanologica Ab | Empty porous particles for use in treatment, prevention and/or postponement of degeneration of neurodegenerative diseases, neurons and glia. |
| CN112843034B (zh) * | 2019-11-26 | 2022-08-23 | 亚瑟瑞智科技管理顾问股份有限公司 | 包含克拉维酸与丙戊酸的组合物及其用途 |
| TWI739220B (zh) * | 2019-11-26 | 2021-09-11 | 亞瑟瑞智科技管理顧問股份有限公司 | 包含克拉維酸與丙戊酸之組合物及其用途 |
Family Cites Families (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4110165A (en) * | 1974-04-20 | 1978-08-29 | Beecham Group Limited | Process for the production of clavulanic acid |
| CA1085392A (en) * | 1976-03-25 | 1980-09-09 | Masayuki Narisada | Arylmalonamido-1-oxadethiacephalosporins |
| US4127118B1 (en) * | 1977-03-16 | 1995-12-19 | Alvaro Latorre | Method of effecting and enhancing an erection |
| US4234579A (en) * | 1977-06-07 | 1980-11-18 | Pfizer Inc. | Penicillanic acid 1,1-dioxides as β-lactamase inhibitors |
| JO984B1 (en) * | 1977-10-11 | 1979-12-01 | بيتشام غروب ليمتد | A dry pharmaceutical compound with a suitable dosage unit for oral administration |
| NZ189022A (en) * | 1977-12-08 | 1981-11-19 | Beecham Group Ltd | Pharmaceutically acceptable particles of clavulanates dispersed in a polymeric binder |
| US4273763A (en) * | 1978-01-23 | 1981-06-16 | Efamol Limited | Pharmaceutical and dietary compositions |
| US4268503A (en) * | 1978-09-14 | 1981-05-19 | Fujisawa Pharmaceutical Co., Ltd. | Antibacterial composition |
| DE3001961C2 (de) * | 1980-01-21 | 1984-08-16 | Didier Engineering Gmbh, 4300 Essen | Anströmboden für einen Wirbelschichtreaktor |
| NZ198241A (en) * | 1980-09-27 | 1983-12-16 | Beecham Group Ltd | Tablet containing amoxycillin and potassium clavulanate |
| US4594247A (en) * | 1981-12-21 | 1986-06-10 | Eli Lilly And Company | Synergistic antibacterial compositions and method of treatment of infections caused by multiple antibiotic-resistant organisms |
| JPS59104389A (ja) * | 1982-12-06 | 1984-06-16 | Shionogi & Co Ltd | オキサセファム誘導体 |
| JPS62106015A (ja) * | 1985-10-31 | 1987-05-16 | Sumitomo Pharmaceut Co Ltd | 抗痴呆薬 |
| US5256652A (en) * | 1987-11-12 | 1993-10-26 | Pharmedic Co. | Topical compositions and methods for treatment of male impotence |
| GB9201639D0 (en) * | 1992-01-25 | 1992-03-11 | Smithkline Beecham Plc | Pharmaceutical formulations |
| GB9215908D0 (en) * | 1992-07-27 | 1992-09-09 | Wellcome Found | Water dispersible tablets |
| US5643909A (en) * | 1993-04-19 | 1997-07-01 | Syntex (U.S.A.) Inc. | 10,11-Methanodibenzosuberane derivatives |
| JP3233407B2 (ja) * | 1993-11-06 | 2001-11-26 | 大鵬薬品工業株式会社 | 結晶性ペニシリン誘導体並びにその製造及び使用 |
| US5827537A (en) * | 1995-05-04 | 1998-10-27 | Smithkline Beecham Corporation | Pharmaceutical thermal infusion process |
| GB9515411D0 (en) * | 1995-07-27 | 1995-09-27 | Pharmacia Spa | N-(4-substituted-benzyl)-2-aminolactam derivatives |
| GB9525697D0 (en) * | 1995-12-15 | 1996-02-14 | Pharmacia Spa | Cephem derivatives |
| DK0939632T3 (da) * | 1996-02-23 | 2006-01-30 | Lilly Co Eli | Non-peptidyl vasopressin V1a antagonister |
| US5905076A (en) * | 1996-04-10 | 1999-05-18 | National Research Council Of Canada | 6-substituted amino-4-oxa-1-azabicyclo 3,2,0! heptan-7-one derivatives as cysteine protease inhibitors |
| US5795877A (en) * | 1996-12-31 | 1998-08-18 | Guilford Pharmaceuticals Inc. | Inhibitors of NAALADase enzyme activity |
| US5977090A (en) * | 1996-09-27 | 1999-11-02 | Guilford Pharmaceuticals Inc. | Pharmaceutical compositions and methods of treating compulsive disorders using NAALADase inhibitors |
| US5863536A (en) * | 1996-12-31 | 1999-01-26 | Guilford Pharmaceuticals Inc. | Phosphoramidate derivatives |
| US5824662A (en) * | 1996-09-27 | 1998-10-20 | Guilford Pharmaceuticals Inc. | Treatment of global and focal ischemia using naaladase inhibitors |
| US6017903A (en) * | 1996-09-27 | 2000-01-25 | Guilford Pharmaceuticals Inc. | Pharmaceutical compositions and methods of treating a glutamate abnormality and effecting a neuronal activity in an animal using NAALADase inhibitors |
| US5672592A (en) * | 1996-06-17 | 1997-09-30 | Guilford Pharmaceuticals Inc. | Certain phosphonomethyl-pentanedioic acid derivatives thereof |
| AU8140898A (en) * | 1997-06-13 | 1998-12-30 | Northwestern University | Inhibitors of beta-lactamases and uses therefor |
| US6015809A (en) * | 1998-08-17 | 2000-01-18 | American Home Products Corporation | Photocyclized rapamycin |
| US6177421B1 (en) * | 1999-05-04 | 2001-01-23 | Fuisz International Ltd. | Amoxicillin and clavulanate composition |
| DK1146864T3 (da) * | 1999-02-04 | 2009-05-11 | Abbott Lab | pH-uafhængig farmaceutisk formulering med forlænget frisætning |
| IE990159A1 (en) * | 1999-02-26 | 2000-09-20 | Fuisz Internat Ltd | Storage Stable Amoxycillin and Clavulanate Suspension Composition. |
| AU770599B2 (en) * | 1999-07-06 | 2004-02-26 | Methylgene Inc. | Sulfonamidomethyl phosphonate inhibitors of beta-lactamase |
| US6489319B2 (en) * | 1999-08-16 | 2002-12-03 | Revaax Pharmaceuticals, Llc | Neurotherapeutic use of carboxypeptidase inhibitors |
| US6426342B2 (en) * | 1999-08-16 | 2002-07-30 | Revaax Pharmaceuticals, Llc | Use of β-lactamase inhibitors as neuroprotectants |
| US6627625B1 (en) * | 1999-08-16 | 2003-09-30 | Revaax Pharmaceuticals, Llc | Treatment of behavioral disorders with β-lactam compounds |
| MY127898A (en) * | 1999-12-22 | 2006-12-29 | Pharmacia Corp | Dual-release compositions of a cyclooxygenase-2 inhibitor |
| US20020013270A1 (en) * | 2000-06-05 | 2002-01-31 | Bolte Ellen R. | Method for treating a mental disorder |
| CA2424462C (en) * | 2000-10-20 | 2010-03-30 | Biochemie Gesellschaft M.B.H. | Clavulanic acid pharmaceutical compositions |
| US7166626B2 (en) * | 2001-06-18 | 2007-01-23 | Revaax Pharmaceuticals, Llc | Therapeutic treatment for sexual dysfunction |
| ATE389402T1 (de) * | 2002-01-10 | 2008-04-15 | Biovail Lab Int Srl | Sedierende nicht-benzodiazepin-formulierungen |
| IL154370A0 (en) * | 2003-02-10 | 2003-09-17 | Chemagis Ltd | Solid amorphous mixtures, processes for the preparation thereof and pharmaceutical compositions containing the same |
| SI21402A (sl) * | 2003-02-12 | 2004-08-31 | LEK farmacevtska dru�ba d.d. | Obloženi delci in farmacevtske oblike |
| BRPI0413908A (pt) * | 2003-08-25 | 2006-10-24 | Revaax Pharmaceuticals Llc | formulação farmacêutica neuroterapêutica em forma de dosagem oral, composto, e, método de tratamento de um distúrbio comportamental ou um distúrbio cognitivo |
| KR101289115B1 (ko) * | 2004-08-13 | 2013-07-23 | 엠에스디 인터내셔널 홀딩즈 게엠베하 | 항생제인 트리아졸 및 코르티코스테로이드를 포함하는약제학적 제형 |
| US20060088591A1 (en) * | 2004-10-22 | 2006-04-27 | Jinghua Yuan | Tablets from a poorly compressible substance |
| SI21912A (sl) * | 2004-12-24 | 2006-06-30 | Lek Farmacevtska Druzba D.D. | Stabilne farmacevtske oblike, ki vsebujejo amoksicilin in klavulansko kislino |
| DE102006007830A1 (de) * | 2006-02-17 | 2007-08-30 | Grünenthal GmbH | Lagerstabile orale Darreichungsform von Amoxicillin und Clavulansäure |
| CN101410109A (zh) * | 2006-03-24 | 2009-04-15 | 万能药生物有限公司 | 抗生素的调节释放组合物及其制备方法 |
| US20080014257A1 (en) * | 2006-07-14 | 2008-01-17 | Par Pharmaceutical, Inc. | Oral dosage forms |
| AU2008317315A1 (en) * | 2007-10-26 | 2009-04-30 | Rexahn Pharmaceuticals, Inc. | Pharmaceutical formulation of clavulanic acid |
-
2010
- 2010-04-29 EP EP10717387A patent/EP2424498A1/en not_active Withdrawn
- 2010-04-29 CN CN2010800184471A patent/CN102413814A/zh active Pending
- 2010-04-29 CA CA2758029A patent/CA2758029A1/en not_active Abandoned
- 2010-04-29 KR KR1020117028280A patent/KR20120012823A/ko not_active Application Discontinuation
- 2010-04-29 JP JP2012508734A patent/JP2012525427A/ja active Pending
- 2010-04-29 AU AU2010242948A patent/AU2010242948A1/en not_active Abandoned
- 2010-04-29 MX MX2011011459A patent/MX2011011459A/es unknown
- 2010-04-29 BR BRPI1013901A patent/BRPI1013901A2/pt not_active IP Right Cessation
- 2010-04-29 WO PCT/US2010/032983 patent/WO2010127125A1/en active Application Filing
- 2010-04-29 US US12/770,304 patent/US20100255099A1/en not_active Abandoned
-
2011
- 2011-10-26 IL IL215940A patent/IL215940A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CN102413814A (zh) | 2012-04-11 |
| MX2011011459A (es) | 2011-11-18 |
| AU2010242948A1 (en) | 2011-11-24 |
| BRPI1013901A2 (pt) | 2019-09-24 |
| US20100255099A1 (en) | 2010-10-07 |
| JP2012525427A (ja) | 2012-10-22 |
| CA2758029A1 (en) | 2011-11-04 |
| EP2424498A1 (en) | 2012-03-07 |
| IL215940A0 (en) | 2012-01-31 |
| WO2010127125A1 (en) | 2010-11-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20120012823A (ko) | 신경보호 및 퇴행성 신경 질환 치료용 클라블라네이트 제제 | |
| US4404183A (en) | Sustained release pharmaceutical composition of solid medical material | |
| US9572781B2 (en) | Orally disintegrating tablet compositions comprising combinations of non-opioid and opioid analgesics | |
| US10441585B2 (en) | Formulations containing nalbuphine and uses thereof | |
| CA2742680C (en) | Pharmaceutical compositions for release control of methylphenidate | |
| ES2560052T3 (es) | Nueva combinación | |
| US20090270358A1 (en) | Pharmaceutical formulation of clavulanic acid | |
| CZ280847B6 (cs) | Peroorálně aplikovatelná forma léku pro léčení centrálních stavů nedostatku dopaminu | |
| US20100291225A1 (en) | Stabilized Sustained Release Composition of Bupropion Hydrochloride and Process For Preparing the Same | |
| MXPA06000529A (es) | Formulaciones farmaceuticas utiles para inhibir la secrecion de acido y metodos para elaborarlas y utilizarlas. | |
| KR20050009983A (ko) | 트라마돌의 서방성 제제 | |
| EP4313155A1 (fr) | Formulation par voie orale d'ivermectine et utilisations | |
| EP3563846B1 (en) | Pharmaceutical composition and method for producing the same | |
| US20050181055A1 (en) | Pharmaceutical compositions of quinapril | |
| JPH0236571B2 (ja) | Jizokuseiseizai | |
| EP4268816A1 (en) | Oral solid preparation | |
| NZ625506B2 (en) | Compositions For Treatment of Heart Failure in Dogs. | |
| KR20080071286A (ko) | 암로디핀 함유 입자 및 그것을 포함하는 구강 내 붕괴정 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |