KR20100134702A - 치료 방법 - Google Patents
치료 방법 Download PDFInfo
- Publication number
- KR20100134702A KR20100134702A KR1020107024046A KR20107024046A KR20100134702A KR 20100134702 A KR20100134702 A KR 20100134702A KR 1020107024046 A KR1020107024046 A KR 1020107024046A KR 20107024046 A KR20107024046 A KR 20107024046A KR 20100134702 A KR20100134702 A KR 20100134702A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- eosinophilic
- asthma
- human
- composition
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/10—Anthelmintics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
- C07K14/5409—IL-5
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Pulmonology (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Hematology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Neurology (AREA)
- Nutrition Science (AREA)
- Dermatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Otolaryngology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 일반적으로 IL-5 및 호산구 과다 생성에 의해 매개되는 병태의 치료 및 진단 방법에 관한 것이며, 더 구체적으로는 mAb, Fab, 키메라 및 인간화 항체에 관한 것이다. 더 구체적으로, 본 발명은 일반적으로 항-IL-5 항체 또는 그의 절편을 이용한 호산구성 기관지염의 치료에 관한 것이다.
Description
본 출원은 2008년 3월 28일 제출된 미국 가출원 제61/040,363호에 대한 유익을 청구하며, 이의 전문은 본원에 참조로 포함된다.
기술분야
본 발명은 일반적으로 IL-5 및 호산구 과다 생성에 의해 매개되는 병태에 대한 치료 및 진단 방법, 및 더 구체적으로는 항-IL-5 항체를 이용한 호산구성 기관지염의 치료에 관한 것이다.
호산구는 폐 조직에서의 과민 반응과 관련된 알레르기성 장애를 비롯한 매우 다양한 염증성 질환 상태의 병인에 연루된 것으로 시사되었다(문헌 [Butterfield et al., In: Immunopharmacology of Eosinophils, H. Smith and R. Cook, Eds., p.151-192, Academic Press, London (1993)]). 주목할 만한 예는 천식으로서, 이는 비특이적 기관지 과민성을 초래하는 가역적인 기도 폐쇄를 특징으로 하는 질환이다. 한편, 이는 기관지 점막 수준에서의 만성 염증 반응의 발생, 및 대식세포, 림프구 및 호산구의 특징적인 침윤에 의존한다. 호산구는 이 질환에 전형적인 점막 손상을 개시함에 있어 중추적 역할을 하는 것으로 보인다(문헌 [Corrigan et al., Immunol . Today, 13:501-507 (1992)]). 만성 천식 환자의 순환계, 기관지 분비물 및 폐 실질에서 활성화된 호산구 수의 증가가 보고되었으며, 각종 폐 기능 시험으로 측정한 상기 질환의 중증도는 혈중 호산구 수와 연관성이 있다(문헌 [Griffen et al., J. Aller . Clin . Immunol ., 67:548-557 (1991)]). 증가된 수의 호산구 (탈과립 과정에서 종종 일어남)는 또한 후기 천식 반응을 겪고 있는 환자의 기관지폐포 세척(BAL)액에서 회수되었고, 스테로이드 요법의 결과로서 보통 일어나는 호산구 수의 감소는 임상 증상의 개선과 관련되고 있다(문헌 [Bousquet et al., N. Eng . J. Med ., 323:1033-1039 (1990)]).
인터루킨 5 (IL-5)는 활성화된 CD4+ T 림프구에 의해 주로 생성되는 동종이량체성 당단백질이다. 사람에서, IL-5는 주로 호산구의 성장과 분화에 대한 제어를 담당한다. IL-5의 수준 증가는 천식 환자의 기관지폐포 세척물에서 검출된다(문헌 [Motojima et al., Allergy, 48:98 (1993)]). IL-5가 유전자 이식된 마우스는 항원 자극 부재시에도 말초 혈액 및 조직에서 뚜렷한 호산구 증가증을 나타내며(문헌 [Dent et al., J. Exp . Med ., 172:1425 (1990)]), 항-쥣과 IL-5 단일클론 항체는 상기 마우스의 혈액 및 조직에서의 호산구 증가증을 경감시킴에 있어(문헌 [Hitoshi et al., Int . Immunol ., 3:135 (1991)]), 그리고 실험 동물에서 기생충 감염 및 알레르겐 투여와 관련된 호산구 증가증을 경감시킴에 있어 효과가 있는 것으로 나타났다(문헌 [Coffman et al., Science, 245:308-310 (1989)], [Sher et al., Proc . Natl. Acad . Sci ., 83:61-65 (1990)], [Chand et al., Eur . J. Pharmacol ., 211:121-123 (1992)]).
호산구성 기관지염인 호산구성 기도 염증은, 코르티코스테로이드를 이용한 치료에 대한 반응을 예측하는 것으로 알려진 천식의 성분이다(문헌 [Hargreave, FE, J Allergy Clin Immunol, 102:S102-5 (1998)]). 이는 객담 호산구 증가증에 의해 확인되는데, 천식이 없는 환자에서도 일어날 수 있다(문헌 [Hargreave, FE and Paramerwaran, K. Eur Respir J, 28:264-7 (2006)]). 천식 환자 (문헌 [Jayaram, et al . Eur Respir J. 27:483-94 (2006)]) 또는 만성 폐쇄성 폐 질환이 있는 환자 (문헌 [Siva, et al . Eur Respir J, 29:906-13 (2007)])에서, 기도내 호산구를 정상화하면 천식 제어가 개선되고, 악화가 예방된다.
코르티코스테로이드가 호산구 수 및 천식 및 호산구성 기관지염의 기타 염증성 성분을 억제함에 있어 극히 효과적이지만, 중증 천식 환자 및 보다 최근에는 경증 내지 중등도 천식 환자 모두에서 이들의 부작용에 대한 우려가 존재한다. 유일한 다른 주요 항-염증 약물 요법인 크로모글리케이트 (크로몰린 나트륨 및 네도크로밀)는 코르티코스테로이드보다 상당히 덜 효과적이며, 이의 정확한 작용 기전은 아직까지 불명이다.
현재, 호산구성 기관지염의 치료에서 프레드니손 감축 효과를 가질 수 있는 탁월한 약물은 전무하다. 따라서, 호산구를 감소시키는 것을 필요로 하는 인간에서 호산구를 감소시키는 본 발명의 방법에 대한 필요성이 존재한다.
발명의 개요
본 발명의 일 실시양태에서는, 호산구성 기관지염을 앓고 있는 인간에게 1종 이상의 항-IL-5 항체를 포함하는 조성물을 투여하는 것을 포함하는, 호산구성 기관지염을 치료하는 방법이 제공된다.
도 1: 연구 설계
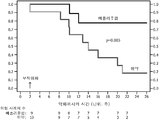
도 2: 무작위화 후 첫번째 악화가 나타날 때까지의 시간.
도 3: 객담내 호산구 (패널 A) 및 혈중 호산구 (패널 B).
도 2: 무작위화 후 첫번째 악화가 나타날 때까지의 시간.
도 3: 객담내 호산구 (패널 A) 및 혈중 호산구 (패널 B).
I.
정의.
본원에서 사용된 바 "항-IL-5 항체"란 임의의 종의 IL-5에 결합하는 임의의 항체, 항체 절편 또는 단쇄 항체를 말한다. 항체 절편에는, 면역글로불린 불변 영역의 전부 또는 일부가 결여된 항체, 예컨대, Fv, Fab, 또는 F(ab)2 등이 있다. 항-IL-5 항체는 쥣과 항체, 키메라 항체, 인간화 항체 또는 완전 인간 항체일 수 있다. 이 항체는 중화 항체일 수도 있다. 항-IL-5 항체에 대한 여러가지 예는 미국 특허 제5,683,892호, 제5,693,323호, 제5,783,184호, 제5,851,525호, 제6,129,913호, 제5,096,071호, 제6,056,957호, 및 제6,451,982호 (이들의 전문은 본원에 참조로 포함됨)에 기재되어 있다. 또한, 인간화 항-IL-5 항체도 다양한 참조문헌에 기재되어 있는데, 그것으로는 렐리주맙(relizumab) (SCH55700) 및 메폴리주맙(mepolizumab) (SB240563)이 있다(문헌 [Greenfeder, et al., Respiratory Research, 2(2):71-79 (2001)]). 메폴리주맙 (SB-240563)은 인간 인터루킨-5 (IL-5)에 특이적인 완전 인간화 단일클론 항체 (IgG1, 카파, mAb)이다. 여타 항-IL-5 항체는 미국 특허 제7,422,742호 및 제7,141,653호에 기재되어 있으며, 이들 또한 본원에 참조로 포함된다.
"중화 항체"란 인간 IL-5가 그의 특이적 수용체에 결합하는 것을 방지하거나 또는 결합이 일어난다면 IL-5가 그의 수용체를 통해 신호전달하는 것을 억제함으로써 IL-5 활성을 억제하는 항체를 말한다. mAb는 B13 세포 생물검정에서 측정한 바 IL-5 활성을 억제함에 있어 90% 효과적이거나, 95% 효과적이거나 또는 100% 효과적이라면, 중화 항체이다. 항체 결합은 비아코어(BIAcore) 광학 바이오센서 (파마시아 바이오센서(Pharmacia Biosensor), 스웨덴 웁살라 소재) 및/또는 ELISA 분석법을 사용하는 것을 비롯한 당업계에 공지된 수많은 분석법에 의해 측정가능하다.
"고 친화도"라는 용어는 항체가 광학 바이오센서 분석으로 측정한 바 인간 IL-5에 대해 3.5 x 10-11 M 이하의 K d 인 것을 특징으로 하는 결합 친화도를 갖는 것을 말한다. IL-5에 대한 Fab 절편의 K d 는 광학 바이오센서로 측정한 바 약 9 x 10-11 M인 것으로 추정될 수 있다.
"인간 IL-5에 대한 결합 특이성"이란 항체가 쥣과 IL-5과 같은 (그러나 이에 제한되는 것은 아님) 임의의 비(非)-인간 IL-5 오르토로그(orthologue)와 비교하여 인간 IL-5에 대해 더 높은 친화도를 갖는 것을 의미한다. 예를 들어, 인간 IL-5에 대해 결합 특이성을 갖는 항체는 인간 IL-5에 대해서는 K d 가 2.2 x 10-11 M 이하이지만, 비(非)-인간 IL-5 오르토로그에 대해서는 K d 가 2.2x10-11 M 초과일 수 있다.
Fv, Fc, Fd, Fab, 또는 F(ab)2라는 용어는 그의 표준적 의미로 사용된다(예컨대, 문헌 [Harlow et al., Antibodies A Laboratory Manual, Cold Spring Harbor Laboratory, (1988)] 참조).
본원에서 사용된 바, "조작 항체"는 선택된 수용자 항체의 경쇄 및/또는 중쇄 가변 도메인의 일부가 선택 에피토프에 대해 특이성을 갖는 하나 이상의 공여자 항체 유래의 유사 부분으로 대체된 변형 항체의 한 종류 즉, 전장 합성 항체 (예컨대, 항체 절편과 반대되는 키메라 또는 인간화 항체)를 기술한다. 예를 들어, 상기와 같은 분자에는 비변형 경쇄 (또는 키메라 경쇄)와 결합된 인간화 중쇄, 또는 그 반대의 것을 특징으로 하는 항체가 포함될 수 있다. 조작 항체는 또한 공여자 항체의 결합 특이성을 유지하도록 하기 위해 수용자 항체 경쇄 및/또는 중쇄 가변 도메인 골격 영역을 코딩하는 핵산 서열을 변경하는 것을 특징으로 할 수도 있다. 이들 항체에서는 수용자 항체로부터의 하나 이상의 CDR (바람직하게는 전부)이 본원에 기재된 공여자 항체로부터의 CDR로 대체되어 있을 수 있다.
"키메라 항체"란 공여자 항체에서 유래한 천연 발생 가변 영역 (경쇄 및 중쇄)을 수용자 항체에서 유래한 경쇄 및 중쇄 불변 영역과 함께 함유하는 조작 항체의 한 종류를 말한다.
"인간화 항체"란 비(非)-인간 공여자 면역글로불린에서 유래한 CDR을 가진 조작 항체의 한 종류로서, 분자의 나머지 면역글로불린-유래 부분은 하나 (또는 그 이상)의 인간 면역글로불린에서 유래한 것인 조작 항체를 말한다. 또한, 골격 지지 잔기들도 결합 친화도를 보존하도록 변경될 수 있다(예컨대, 문헌 [Queen et al., Proc . Natl Acad Sci USA, 86:10029-10032 (1989)], [Hodgson et al., Bio / Technology , 9:421 (1991)] 참조).
"공여자 항체"라는 용어는 가변 영역, CDR, 또는 여타 기능적 절편 또는 이들의 유사체의 핵산 서열을 첫번째 면역글로불린 파트너에 제공하여, 변경된 면역글로불린 코딩 영역 및 결과적인 발현된 변형 항체에 공여자 항체 특유의 항원 특이성 및 중화 활성을 제공하게 되는 항체 (단일클론 또는 재조합)를 말한다. 본 발명에서 사용하기에 적합한 한 공여자 항체는 2B6으로 표기되는 비(非)-인간 중화 단일클론 항체 (즉, 쥣과)이다(미국 특허 제5,683,892호, 제5,693,323호, 제5,783,184호, 제5,851,525호, 및 제6,129,913호 (이들은 전문이 참조로 본원에 포함됨) 참조). 항체 2B6은 적합한 쥣과 IgG 불변 영역 상에 각각 서열번호: 2 및 서열번호: 16인 가변 경쇄 DNA 서열 및 아미노산 서열, 및 각각 서열번호: 1 및 서열번호: 15인 가변 중쇄 DNA 서열 및 아미노산 서열을 갖는, 고 친화도의, 인간-IL-5 특이적인 (즉, 쥣과 IL-5를 인식하지 않는), IgG1 아이소타입의 중화 항체로 정의된다.
"수용자 항체"라는 용어는 그의 중쇄 및/또는 경쇄 골격 영역 및/또는 그의 중쇄 및/또는 경쇄 불변 영역을 코딩하는 핵산 서열의 전부 (또는 임의의 일부분, 그러나 바람직하게는 전부)를 첫번째 면역글로불린 파트너에 제공하는 항체 (단일클론 또는 재조합)로서 공여자 항체와 이종성인 항체를 말한다. 바람직하게는 수용자 항체는 인간 항체이다.
"CDR"은 면역글로불린 중쇄 및 경쇄의 과가변 영역인 항체의 상보성 결정 영역 아미노산 서열로 정의된다. 예컨대, 문헌 [Kabat et al., Sequence s of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987)] 참조. 면역글로불린의 가변부에는 3개의 중쇄 CDR (또는 CDR 영역) 및 3개의 경쇄 CDR (또는 CDR 영역)이 존재한다. 따라서, 본원에서 사용된 "CDR"은 3개의 중쇄 CDR 모두, 또는 3개의 경쇄 CDR 모두 (또는, 적절한 경우, 모든 중쇄 CDR 및 모든 경쇄 CDR 둘 모두)를 지칭한다.
CDR은 항원 또는 에피토프에 대한 항체의 결합을 위한 대다수의 접촉 잔기를 제공한다. 본 발명에서 관심 대상인 CDR은 공여자 항체 가변 중쇄 및 경쇄 서열에서 유래한 것이며, 여기에는 천연 발생 CDR의 유사체도 포함되는데, 이 유사체도 또한 그들이 유래한 공여자 항체와 동일한 항원 결합 특이성 및/또는 중화 능력을 공유 또는 보유한다.
'항원 결합 특이성 또는 중화 능력을 공유하는'이란, 예를 들어, mAb 2B6 (미국 특허 제5,683,892호, 제5,693,323호, 제5,783,184호, 제5,851,525호, 및 제6,129,913호 (본원에 참조로 포함됨) 참조)이 일정 수준의 항원 친화도를 특징으로 할 수 있음에도 불구하고, 적절한 구조적 환경에서 2B6의 핵산 서열에 의해 코딩되는 CDR은 더 낮거나 또는 더 높은 친화도를 가질 수 있는 것을 의미한다. 그러한 환경에서 2B6의 CDR은 그럼에도 불구하고 2B6과 동일한 에피토프(들)를 인식할 것으로 예상된다. 2B6의 대표적인 중쇄 CDR로는 서열번호: 7; 서열번호: 8; 서열번호: 9를 들 수 있으며, 2B6의 대표적인 경쇄 CDR로는 서열번호: 10; 서열번호: 11; 및 서열번호: 12를 들 수 있다.
"기능성 절편"은 해당 절편이 유래한 항체와 동일한 항원 결합 특이성 및/또는 중화 능력을 보유하는 부분적 중쇄 또는 경쇄 가변 서열 (예컨대, 면역글로불린 가변 영역의 아미노 말단 또는 카르복시 말단에서 별로 중대하지 않은 결실이 있는 것)이다.
"유사체"는 1종 이상의 아미노산이 변형된 아미노산 서열로서, 이 때 상기 변형은 화학적인 것이거나 또는 소수의 아미노산 (즉, 10개 이하)의 치환 또는 재배열일 수 있으며, 또한, 상기 변형은 해당 아미노산 서열로 하여금 변형되지 않은 서열의 생물학적 특징, 예컨대, 항원 특이성 및 고 친화도를 보유하도록 허용하는 것이다. 예를 들어, 특정 엔도뉴클레아제 제한 부위가 CDR-코딩 영역 내부에 또는 주위에 형성되는 경우, 치환을 통해, (침묵) 돌연변이가 구축될 수 있다.
유사체는 또한 대립유전자 변이(allelic variation)로서 발생할 수 있다. "대립유전자 변이 또는 변형"은 본 발명의 아미노산 서열 또는 펩티드 서열을 코딩하는 핵산 서열에서의 변경이다. 이러한 변이 또는 변형은 유전 암호에서의 축퇴성에 기인한 것이거나, 또는 목적하는 특징을 나타내도록 의도적으로 조작된 것일 수도 있다. 이러한 변이 또는 변형은 코딩된 임의의 아미노산 서열에서 변경을 야기할 수도 있고 그렇지 않을 수도 있다.
"효과기 인자(effector agent)"라는 용어는 변화된 항체, 및/또는 공여자 항체의 천연 또는 합성 경쇄 또는 중쇄 또는 공여자 항체의 여타의 절편이 통상의 수단에 의해 결합될 수 있는 비(非)-단백질 담체 분자를 말한다. 상기와 같은 비(非)-단백질 담체로는, 진단 분야에서 사용되는 통상의 담체, 예컨대, 폴리스티렌 또는 여타의 플라스틱 비즈, 다당류, 예컨대, 비아코어 [파마시아(Pharmacia)] 시스템에서 사용되는 것, 또는 의학 분야에서 유용한 것으로 인간 및 동물에 투여하기에 안전한 여타의 비(非)-단백질 물질을 들 수 있다. 여타의 효과기 인자로는 중금속 원자를 킬레이트화하는 거대고리 화합물(macrocycle), 또는 방사성동위원소를 들 수 있다. 이러한 효과기 인자는 또한 변형된 항체의 반감기를 증가시키는데 유용한 것일 수 있는데, 예컨대, 폴리에틸렌 글리콜이다.
"폴리펩티드"란 둘 이상의 아미노산이 펩티드 결합 또는 변형된 펩티드 결합 (즉, 펩티드 등입체(isostere))에 의해 서로 연결되어 있는 임의의 펩티드 또는 단백질을 말한다. "폴리펩티드"는 보통 펩티드, 올리고펩티드 또는 올리고머로 지칭되는 짧은 사슬, 및 일반적으로 단백질로 지칭되는 보다 긴 사슬을 모두 지칭한다. 폴리펩티드는 20개 유전자에 의해 코딩되는 아미노산 이외의 아미노산을 함유할 수도 있다. "폴리펩티드"는 번역후 가공과 같은 천연 과정 또는 당업계에 익히 공지된 화학적 변형 기법 중 하나에 의해 변형된 아미노산 서열을 포함한다. 상기와 같은 변형은 기본 교재 및 보다 상세한 논문, 뿐만 아니라 방대한 연구 문헌에 충분히 기재되어 있다. 변형은 펩티드 골격, 아미노산 측쇄 및 아미노 말단 또는 카르복실 말단을 비롯하여 폴리펩티드 내의 어디에서라도 일어날 수 있다. 주어진 폴리펩티드 내에서 동일한 유형의 변형이 여러 부위에 동일 또는 상이한 정도로 존재할 수 있다는 것은 인식될 것이다. 또한, 주어진 폴리펩티드는 다수의 유형의 변형을 함유할 수 있다. 폴리펩티드는 유비퀴틴화의 결과로서 분지형일 수 있고, 이들은 분지화되거나 그렇지 않은 고리형일 수도 있다. 고리형, 분지형 및 분지화된 고리형 폴리펩티드는 번역후 천연 과정으로부터 발생하거나 또는 합성 방법에 의해 만들어질 수도 있다. 변형에는, 아세틸화, 아실화, ADP-리보실화, 아미드화, 플라빈 공유 부착, 헴 잔기 공유 부착, 뉴클레오티드 또는 뉴클레오티드 유도체 공유 부착, 지질 또는 지질 유도체 공유 부착, 포스포티딜이노시톨 공유 부착, 가교 결합, 고리화, 이황화 결합 형성, 탈메틸화, 공유 가교 결합의 형성, 시스테인 형성, 피로글루타메이트 형성, 포르밀화, 감마-카르복실화, 글리코실화, GPI 고정(anchor) 형성, 히드록실화, 요오드화, 메틸화, 미리스토일화, 산화, 단백질분해 가공, 인산화, 프레닐화, 라세미화, 셀레노일화, 황산화, 전이-RNA 매개에 의한 단백질로의 아미노산 부가 (예컨대, 아르기닐화), 및 유비퀴틴화가 있다. 예를 들어, 문헌 [PROTEINS - STRUCTURE AND MOLECULAR PROPERTIES, 2nd Ed., T. E. Creighton, W. H. Freeman and Company, New York, 1993] 및 [Wold, F., Posttranslational Protein Modifications: Perspectives and Prospects, pgs. 1-12 in POSTTRANSLATIONAL COVALENT MODIFICATION OF PROTEINS, B. C. Johnson, Ed., Academic Press, New York, 1983], [Seifter, et al., "Analysis for protein modifications and nonprotein cofactors", Meth. Enzymol. (1990) 182:626-646] 및 [Rattan, et al., "Protein Synthesis: Posttranslational Modifications and Aging", Ann NY Acad Sci (1992) 663:48-62] 참조.
본원에 사용된 바 "변형체"라는 용어는 각각 기준 폴리뉴클레오티드 또는 폴리펩티드와 상이하지만 본질적 특성은 보유하는 폴리뉴클레오티드 또는 폴리펩티드이다. 대표적인 폴리뉴클레오티드 변형체는 또 다른 기준 폴리뉴클레오티드와 뉴클레오티드 서열이 상이한 것이다. 변형체에서의 뉴클레오티드 서열 변화는 기준 폴리뉴클레오티드에 의해 코딩되는 폴리펩티드의 아미노산 서열을 변경시키거나 그렇지 않을 수 있다. 뉴클레오티드 변화는 하기 논의되는 바 기준 서열에 의해 코딩되는 폴리펩티드 내의 아미노산 치환, 부가, 결실, 융합 및 절단을 야기할 수 있다. 대표적인 폴리펩티드 변형체는 또 다른 기준 폴리펩티드와 아미노산 서열이 상이한 것이다. 일반적으로, 차이는, 기준 폴리펩티드와 변형체의 서열이 전체적으로는 매우 유사하고 다수의 영역에서는 동일하도록 제한된다. 변형체 및 기준 폴리펩티드의 아미노산 서열은 하나 이상의 치환, 부가, 결실의 임의 조합에 의해 상이할 수 있다. 치환 또는 삽입된 아미노산 잔기는 유전 암호에 의해 코딩되는 것이거나 또는 그렇지 않은 것일 수 있다. 폴리뉴클레오티드 또는 폴리펩티드 변형체는 대립유전자 변형체와 같은 천연 발생적인 것일 수 있고, 또는 천연적으로 발생하는 것으로 알려지지 않은 변형체일 수도 있다. 폴리뉴클레오티드 및 폴리펩티드의 비(非)-천연 발생 변형체는 돌연변이유발 기법 또는 직접적 합성으로 만들어질 수 있다.
본원에서 사용된 바 "호산구성 기관지염"이란 포유동물이 코르티코스테로이드 치료에 반응성 있는 정량적 객담 세포수 (호산구 > 2%)를 갖는 상태를 말한다. 이는 단독으로 발생하거나 또는 천식과 함께 발생할 수 있고, 또는 일부 환자에서는 만성 폐쇄성 폐 질환 (COPD)과 함께 발생할 수 있다. 전형적으로, 천식 환자와 비교하여, 호산구성 기관지염 환자는 기침 증상만을 경험하며, 폐 기능과 기도 반응성은 모두 정상이다(문헌 [Thomson and Chaudhuri American Journal of Respiratory and Critical Care Medicine 170:4-5 (2004)], 및 [Gibson, et al. Thorax 57:178-182 (2002)]). 대부분의 환자에서 호산구성 기관지염은 흡입 스테로이드를 이용한 치료에 반응하나, 일부에서는 그에 대한 제어를 유지하기 위해 최소 용량의 프레드니손을 필요로 한다. 호산구성 기관지염 및/또는 천식은 이들 병태 중 하나의 증상을 제어하기 위해 환자에 최소한 35 내지 40 mg/일의 프레드니손이 필요한 경우 환자에서 중증인 것으로 간주될 수 있다.
본원에서 사용된 바 "기도 호산구 증가증"이란, 폐 (이에 제한되는 것은 아님)를 비롯한 임의의 기도에서 임의의 양의 호산구를 갖는 임의의 질환 또는 장애를 말한다. 호산구는, 예를 들어, 생검, 객담, 및/또는 장기 세척액에서 또는 이들에 의해 검출될 수 있다. 기도 호산구 증가증과 연관된 질환에는, 이들에 제한되는 것은 아니나 호산구성 천식, 호산구성 COPD, 호산구성 기관지염, 및 리노(rhino) 바이러스 (이에 제한되는 것은 아님)를 비롯한 바이러스 감염과 관련된 기도 호산구 증가증이 있다. (문헌 [Shinohara, et al . Allergol Int . 2008 Dec 1;57(4)]; [Wos, et al . Am J Respir Crit Care Med . 2008]; [Handzel, et al . T cells .J Immunol . 1998 Feb 1;160(3):1279-84.PMID]; [Mercer, et al . Respir Res . 2005; 6:151]; 및 [Saetta, et al. Clin Exp Allerg 1996;26:766-774]).
본원에서 사용된 바 "난치성 천식"은 환자가 하기 개시한 바와 같은 주 진단 기준 중 하나 또는 둘 모두 및 2가지 부 진단 기준을 갖는 상태를 말한다.
주 특징
경도-중등도 지속성 천식의 수준으로의 제어를 달성하기 위해:
1. 연속적 또는 거의 연속적 (≥ 연중 50%) 경구 코르티코스테로이드를 이용한 치료
2. 고-용량의 흡입 코르티코스테로이드를 이용한 치료에 대한 요구성:
부 특징
1. 흡입 코르티코스테로이드에 더하여 제어 약제 (예컨대, 장기 작용성 β-작동제, 테오필린, 또는 류코트리엔 길항제)를 이용한 매일의 치료에 대한 요구성
2. 매일 또는 거의 매일 단기 작용성 β-작동제의 사용을 요하는 천식 증상
3. 지속성 기도 폐쇄 (FEV1 < 80% 예측; 주간 PEF 변동률 > 20%)
4. 천식으로 인한 신속진료실(urgent care) 방문이 연간 1회 이상임
5. 경구 스테로이드 "방출(burst)"이 연간 3회 이상임
6. 경구 또는 흡입 코르티코스테로이드 용량의 ≤25% 감소에 의한 즉각적 악화
7. 과거의 거의 치명적인 천식 사례 이력
_______________________________________________________________________
*는 다른 상태가 배제되고, 악화 요인이 치료되고, 환자가 전반적으로 순응적으로 느낄 것을 필요로 함.
문헌 [Fahy, J. Am. J. Respir. Crit. Care Med., Volume 162, Number 6, December 2000, 2341-2351]
본원에서 사용된 바 "중증 천식"은 난치성 천식 환자를 포함시키는 것을 의도한다. 중증 천식 환자가 반드시 항상 기류 폐쇄를 갖는 것은 아닐 수 있으며, 기도 과민성을 갖거나 갖지 않을 수 있지만 상대적으로 안정한 질환 (치료시)을 바탕으로 하여 갑자기 악화될 수 있다. "중증 천식"은 또한, ATS이외의 다양한 임상 척도, 예컨대 문헌 [Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma (GINA) 2007]에 개시된 지침뿐 아니라 여타의 당업계에 공지된 지침에 의해 정의되는 것으로 당업계에서 이해되고 있다.
본원에서 사용된 바, 호산구를 "감소시키다" 또는 "감소시키는"이란, 1종 이상의 항-IL-5 항체 투여 후 환자의 혈액 및/또는 객담에서 관찰되는 호산구의 양의 감소를 말한다.
본원에서 사용된 바 "공동-투여" 또는 "공동-투여하는"이란, 동일 환자에 둘 이상의 화합물을 투여하는 것을 말한다. 상기와 같은 화합물의 공동-투여는 동시적이거나 또는 거의 동시 (예컨대, 1시간 이내)일 수 있으며, 또는 서로에 대해 수 시간 또는 수 일 이내일 수 있다. 예를 들어, 첫번째 화합물을 주 1회 투여하면서, 두번째 화합물을 매일 공동-투여할 수 있다.
본원에서 사용된 바 "호산구 과다 생성과 관련된 장애"란 호산구의 생성으로 인해 비정형적 증상이 나타날 수 있는 임의의 장애 또는 질환을 의미한다. 호산구 과다 생성과 관련된 장애에는, 이들에 제한되는 것은 아니나, 호산구성 기관지염, 아토피성 천식, 아토피성 피부염, 알레르기성 비염, 비(非)-알레르기성 비염, 천식, 중증 천식, 만성 호산구성 폐렴, 알레르기성 기관지폐 아스페르길루스증, 복강 질환(coeliac disease), 처그-스트라우스(Churg-Strauss) 증후군 (결절성 동맥주위염 + 아토피), 호산구증가 근육통증 증후군, 과호산구 증후군, 삽화성 혈관부종을 비롯한 부종성 반응, 연충 감염, 기생충 감염 및/또는 기생충 감염에 대한 치료와 관련된 호산구 증가증, 온코세르카성(onchocercal) 피부염 및 호산구-관련 위장 장애 (이에 제한되는 것은 아니나, 호산구성 식도염, 호산구성 위염, 호산구성 위장염, 호산구성 장염 및 호산구성 대장염 포함), 미세비용종 및 비용종, 아스피린 불내성 천식 및 폐쇄성 수면 무호흡증이 있다. 호산구-유래 분비 산물 또한 종양에서의 혈관신생 및 결합 조직 형성의 촉진 및 만성 천식, 크론병, 경피증 및 심내막심근 섬유증과 같은 병태에서 관찰되는 섬유증성 반응과 관련성이 있었다(문헌 [Munitz A, Levi-Schaffer F. Allergy 2004; 59: 268-75], [Adamko et al. Allergy 2005; 60: 13-22], [Oldhoff, et al. Allergy 2005; 60: 693-6]).
본 발명의 방법에 의해 유도되는 치료 반응은 인간 IL-5에 대한 항-IL-5 항체의 결합 및 그에 따른 후속적인 호산구 자극의 차단에 의해 일어난다. 따라서, 본 발명의 방법은 호산구성 기관지염을 겪고 있는 사람들에게 매우 바람직하다.
본원에서는 호산구성 기관지염을 앓고 있는 상기 인간에게 1종 이상의 항-IL-5 항체를 포함하는 조성물을 투여하는 것을 포함하는, 호산구성 기관지염을 치료하는 방법이 제공된다. 일부 측면에서, 호산구성 기관지염을 앓고 있는 상기 인간은 스테로이드-의존성 호산구성 기관지염을 갖고 있다. 일부 측면에서, 스테로이드는 프레드니손 및/또는 프레드니솔론이다. 상기 항-IL 항체는 중화 항체일 수 있다. 또 다른 측면에서, 1종 이상의 항-IL-5 항체는 인간화 항체이다. 상기 1종 이상의 항-IL-5 항체는 서열번호: 19를 포함하는 중쇄를 포함하는 것일 수 있다. 상기 1종 이상의 항-IL-5 항체는 서열번호: 21을 포함하는 경쇄를 포함하는 것일 수 있다. 또 다른 측면에서, 인간은 아토피성 천식, 아토피성 피부염, 알레르기성 비염, 비(非)-알레르기성 비염, 천식, 중증 천식, 만성 호산구성 폐렴, 알레르기성 기관지폐 아스페르길루스증, 복강 질환, 처그-스트라우스 증후군, 호산구증가 근육통증 증후군, 과호산구 증후군, 삽화성 혈관부종을 비롯한 부종성 반응, 연충 감염, 기생충 감염 및/또는 기생충 감염의 치료와 관련된 호산구 증가증, 온코세르카성 피부염, 호산구성 식도염, 호산구성 위염, 호산구성 위장염, 호산구성 장염, 호산구성 대장염, 미세비용종, 비용종, 아스피린 불내성 천식, 폐쇄성 수면 무호흡증, 만성 천식, 크론병, 경피증 및 심내막심근 섬유증으로 이루어진 군에서 선택되는, 호산구 과다 생성과 관련된 1종 이상의 추가적 장애를 앓고 있는 인간이다.
또 다른 측면에서, 1종 이상의 항-IL-5 항체를 포함하는 조성물은 정맥내로 투여된다. 1종 이상의 항-IL-5 항체를 포함하는 조성물은 750 mg의 용량으로 투여될 수 있다. 상기 정맥내 용량은 정맥내로 30분에 걸쳐 투여될 수 있다. 또 다른 측면에서, 1종 이상의 항-IL-5 항체를 포함하는 조성물은 약 10분 내지 약 4시간의 시간 범위 또는 더 구체적으로는 약 20분 내지 약 60분의 범위에 걸쳐 정맥내로 투여될 수 있다. 본 발명의 또 다른 측면에서 1종 이상의 항-IL-5 항체를 포함하는 조성물은 피하로 투여되는데, 이는 250 mg의 용량으로일 수 있다. 피하 용량은 인간에 1 내지 3회 또는 그 이상 투여될 수 있다.
또 다른 측면에서, 인간은 상기 스테로이드-의존성 호산구성 기관지염에 대해 프레드니손 및/또는 프레드니솔론을 투여받고 있는 중이며, 상기 프레드니손은 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물을 이용한 치료 후에 스테로이드-의존성 호산구성 기관지염을 앓고 있는 상기 인간에서 적어도 약 90% 감축된다. 스테로이드-의존성 호산구성 기관지염을 앓고 있는 인간은 적어도 상기 1종 이상의 항-IL-5 항체를 포함하는 조성물을 투여받은 후 호산구성 기관지염의 악화가 통계학적으로 유의미하게 감소되는 것을 경험한다. 상기 인간에서 호산구 수준은 정상 범위 내로 감소되며, 상기 정상 범위는 당업계에서 이해되는 것으로서, 기관지 세척(bronchial scrubbing) (이에 제한되는 것은 아님)을 비롯한 다양한 방법에 의해 측정가능하다. 예로서, 정상 범위 내에는, 호산구가 2% 미만인 정량적 객담 세포수가 포함되나, 이에 제한되는 것은 아니다. 상기 호산구 수준은 상기 항-IL-5 항체를 포함하는 조성물의 마지막 용량 투여 후 적어도 8주 동안 정상 범위 내로 유지된다. 호산구 수준은 혈액 및/또는 객담 내에서 감소되어 있을 수 있다.
또 다른 측면에서는, 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물이 제1의 항-IL-5 항체 및 제2의 항-IL-5 항체를 포함하는, 호산구성 기관지염을 가진 인간을 치료하는 방법이 제공된다. 1종 이상의 항-IL-5 항체를 포함하는 조성물은 스테로이드와 함께 공동-투여될 수 있다.
본 발명은 또한, 제1의 항-IL-5 항체 및 제2의 항-IL-5 항체를 포함하는 조성물을 투여하는 것을 포함하는, 호산구성 기관지염을 앓고 있는 인간에서 호산구를 감소시키는 방법을 제공한다. 본원에서는 또한 1종 이상의 항-IL-5 항체가 스테로이드와 함께 공동-투여되는 방법이 제공된다.
본 발명은 또한 호산구성 기관지염의 치료를 위한 약제의 제조에서의 1종 이상의 항-IL-5 항체의 용도를 제공한다. 본 발명은 호산구성 기관지염의 치료를 필요로 하는 환자에 1종 이상의 항-IL-5 항체를 포함하는 조성물을 투여하는 것을 포함하는 호산구성 기관지염의 치료를 위한 항-IL-5 항체 또는 그의 절편의 용도를 제공한다. 또한 본원에서는 호산구성 기관지염을 치료하거나 또는 그에 의해 발생되는 증상을 완화시킬 수 있는, 본원에 기재된 방법 및 용도를 위해 제형화된 제약 조성물이 제공된다. 본 발명은 단독으로 또는 스테로이드와 조합하여 투여되는, 호산구성 기관지염의 치료에서의 사용을 위한 항-IL-5 항체를 제공한다. 본 발명의 항-IL-5 항체는 또한 본원에 기재된 모든 방법 및 용도를 위한 항-IL-항체를 제공한다.
실시예
하기 실시예는 본 발명의 다양한 측면을 예시한다. 실시예 1의 결과는 문헌 [Parameswaran, et al . The New Engl J Med 360(10):985-993 (2009)]에 공개되어 있으며, 이의 전문은 본원에 참조로 포함된다.
실시예 1
본 연구는 26주 이하의 무작위화, 위약 대조, 병행 군 시험이었다. 환자는 2주마다 내방하였고, 제2주에 치료에 대해 무작위화되었다. 제2주, 제6주, 제10주, 제14주 및 제18주에 IL-5에 대한 인간화 단일클론 항체인 메폴리주맙을 750 mg의 용량으로 또는 위약을 30분에 걸쳐 투여하였다. 1일 10 mg 이상의 용량의 프레드니손을 필요로 하는 환자를 제외하고는, 제6주, 제10주, 제14주, 제18주 및 제22주에 프레드니손의 용량을 감소시켰다. 2주마다 측정한 변수는, 주니퍼(Juniper) 천식 조절 질문지 (ACQ), 증상 리커르트(Likert) 점수, FEV1을 측정하기 위한 최대 호기 유량 용적 곡선, 및 살부타몰 200 μg 투여 전 및 투여 15분 후의 느린 폐활량 (VC), 객담 정량적 세포수 및 혈중 호산구였다. 프레드니손 감축의 결과로서, 환자는 임상적 악화를 겪거나 또는 성가신 스테로이드 금단 증상이 나타날 수 있었다. 악화는 1일 4회 이상 흡입의 살부타몰 사용 증가 또는 이틀 연속으로의 야간 또는 각성시 호흡기 증상의 증가에 의해, 또는 무작위 방문시로부터 살부타몰 투여 후 FEV1의 >15% 감소에 의해 또는 기침에 대한 리커르트 점수의 2-포인트 변화에 의해, 또는 조사자에 의해 결정되는 바대로 정의되었다.
폐활량 측정은 미국 흉부 학회 (American Thoracic Society)의 권고에 따라 실시하였고(문헌 [American Thoracic Society, Standardization of Spiromerty, 1994 update, Am J Respir Crit Care Med , 152:1107-1136 (1995)]), 예측값은 크라포(Crapo) 등으로부터 수득하였다(문헌 [Crapo, et al . Am Rev Respir Dis, 123:659-94 (1981)]). 천식 제어는 인증된 천식 조절 질문지를 이용하여 평가하였다(문헌 [Juniper, et al, Eur Respir J, 14:902-7 (1999)]). 또한, 7-포인트 리커르트 척도 (증상 없음 7개, 악화 1개)시의 각 방문 전에 7일 동안 기침, 천명, 흉부 압박감 및 숨가쁨의 증상을 평가하였다(문헌 [Guyatt, et al ., J Chronic Dis , 40:1129-33 (1987)]). 객담은 피찌치니(Pizzichini) 등에 의해 기재된 바와 같이 유도 및 처리하였다(문헌 [Pizzichini, et al . Eur Respir J, 9:1174-1180 (1996)]). 메타콜린에 대한 기도 반응성은 24시간 동안 β-작동제를 보류한 후 콕크로프트(Cockcroft) 등에 의해 기재된 평상 호흡(tidal breathing) 방법을 이용하여 측정하였다(문헌 [Cockcroft, et al . Clin Allergy , 7:235-43 (1977)]).
본 실시예에 있어서 악화는, 이틀 연속의 야간 또는 각성시 호흡기 증상, 알부테롤 사용 후 무작위화시의 표지로부터 FEV1의 15%가 넘는 감소, 또는 전반적인 임상적 악화를 기초로 한 조사자의 재량에 의한 기침에 대한 리커르트 점수의 2-포인트 악화 중 임의의 하나로서 또는, 흉부 압박감의 증상을 제어하기 위해 4회 이상 흡입의 환자-개시 알부테롤 1일 용량의 증가로서 정의되었다. 전반적인 임상적 악화에 있어서, 상기 결정이 이루어진 시점에는 객담-세포수가 치료 의사에 공지되지 않았으며, 그에 따라 악화에 대한 정의에 고려되지 않았다.
악화는, 객담 호중구 증가증이 동반되지 않는다면, 7일 동안 30 mg의 프레드니손을 이용하여 치료되었다. 이 시간 동안에, 환자는 본 연구로부터 철수하고, 제2주 및 제4주에 다시 내방하였다. 악화가 호중구성 기도 염증을 동반한 경우(총 세포수: 객담 1 g당 >15x106; 호중구: >80%), 10일 동안 1일 2회의 500 mg의 아목시실린-클라불란산을 이용하여 치료하였는데, 호중구성 악화가 있는 환자는 본 연구로부터 철수시키지 않았고, 이들에 대해 프레드니손 감축을 위한 프로토콜을 계속하였다.
시료 크기는 각 치료 측(arm)에서 악화를 가진 환자의 비율의 1차 지표(primary outcome)를 기준으로 하였다. 상기 용량을 50%로 감소시켰을 때 위약 투여된 모든 환자가 악화되는 반면, 유사한 용량 감소시 활성 측에서는 4명 이하의 환자가 악화될 것으로 예상하였다. 본 연구에 있어 상기 차이를 검출하는 능력은 90%였다. 군간 정규 분포 데이터의 비교는 독립표본-t 검정을 이용하여 실시되었고, 비(非)-정규 데이터는 치료의도(intention-to treat) 분석에서 중위수 검정(Median test)을 이용하여 비교하였다. 비례 데이터는 피셔의 정확 검정(Fisher's exact test)을 이용하여 분석하였다. 치료 군 간의 누적 확률 및 악화까지의 시간은 콕스의 비례 위험(Cox's proportional hazards) 방법으로 비교하였다. 모든 검정은 양측 검정이었고, 유의성은 95% 수준에서 허용되었으며, 분석은 사회과학을 위한 통계 패키지(Statistical Package for Social Sciences) 13.0 버전 (SPSS, 일리노이주 시카고 소재)을 이용하여 실시하였다.
전신성 및 고용량 흡입 코르티코스테로이드로 만성적으로 치료된 천식 환자에서 하기 채택 기준을 충족하는 환자를 호산구성 기관지염 객담 호산구 증가증을 위한 항-IL5 단일클론 항체 요법 연구에 등록시켰다.
외래 환자로서 추적되었으며, 유도된 객담 호산구 증가증과 관련된 빈번한 악화를 방지하기 위해 (고-용량의 흡입 스테로이드 치료에 더하여) 최소 용량의 프레드니손 치료를 필요로 하는 것으로 나타난 18세 내지 70세의 성인 환자.
스크리닝을 위한 방문 및 기준 시점 방문시에 객담 호산구 증가증 및 증상을 나타내는 환자. 증상은 활동과 수면에 영향을 미칠 수 있으나, 치료 의사의 견해 상으로, 우려할 정도로 심하지는 않아야 함.
흡입 살부타몰 (200 mg), 및 메타콜린 PC20 투여 전 및 후 기관지확장제를 적절히 중단시킨 후의 FEV1을 측정할 것이지만, 프레드니손은 호산구성 기관지염 및 이의 임의의 임상적 경과의 제어를 위해서 필요하고, 기관지염은 이러한 천식의 특징없이도 발생할 수 있기 때문에, 이들이 비정상일 필요는 없음.
본 연구는 하기 및 도 1에 나타난 바와 같이 3개의 순차적인 연구 기간으로 나누어졌다.
기간 1: 6주 이상 동안 동일 용량의 프레드니손 투여시 증상을 나타내는 호산구성 기관지염 (천식이 존재하거나 부재함).
기간 2: 임상적 및 호산구성 악화 또는 성가신 스테로이드 금단 효과가 있을 때까지 4주 간격으로의 표준화된 프레드니손 감축 (및 본 연구 치료 동안 프레드니손이 중단된 경우에는 흡입 스테로이드).
기간 3: 장 세척(washout).
환자는 2주마다 내방하였다. 제2주, 제6주, 제10주, 제14주 및 제18주에 항-IL-5 항체 (메폴리주맙) 750 mg 또는 위약을 정맥 주사하였다. 프레드니손의 용량은 표준 방식으로 감축되었다. 환자 인구통계학적 정보 및 기준 시점 특징을 요약한 것이 표 1에 제시되어 있다.
<표 1>
결과
20명의 환자 중 19명이 본 연구를 끝마쳤다. 활성 약물을 투여받은 1명의 환자는 심부전으로 인해 세번째 주입 후 연구에서 탈퇴하였으나, 분석에서는 포함되었다. 따라서, 주된 분석에서 20명의 환자가 포함되었고, 프로토콜 순응 피험자군(per-protocol) 분석에서는 기준 시점에서 기도 호산구 증가증이 있었던 18명의 환자만이 포함되었다.
1차 지표
악화
위약군 중에서 12차례의 천식 악화가 존재하였다. 9차례는 객담 호산구 증가증과 관련된 것이었고, 3차례는 객담 호중구 증가증과 관련된 것이었으며, 이 중 2차례는 종국에 객담 호산구 증가증과 관련된 악화에 대해 치료받은 환자에서였다. 따라서, 위약군 내의 11명의 환자 중 10명에서는 프레드니손 또는 항생제를 이용한 치료를 초래하게 된 악화가 있었다. 이와 대조적으로, 메폴리주맙 측에서는 2차례의 사례가 있었다(한번은 호중구성 악화였고, 한번의 탈퇴는 유해 사례로 인한 것이었다)(p=0.008). 악화는 7명의 환자 (활성 치료군 중 1명 및 위약군 중 6명)에서 FEV1 및 추가적 기준의 하락, β2-작동제에 의한 구조의 증가 (위약군 중 3명의 환자), 및 야간 증상 (위약군 중 1명의 환자)에 의해 식별하였다. 어떠한 환자에서도 리커르트 척도 단독의 변화 또는 의사의 판단의 변화를 이용하여 악화를 식별하거나 또는 프레드니손 용량 변경을 시작하지 않았다. 악화까지의 시간 중앙값 (기관지염의 유형과 관계없이)은 위약군에서는 12주였고, 메폴리주맙군에서는 20주였다(p=0.003). (도 2).
또한, 메폴리주맙군에서는 호중구성 기관지염과 관련된 악화가 없었던 반면, 위약군에서는 3차례 존재하였다.
프레드니손
용량의 감축
메폴리주맙군에서, 환자에 대한 평균 (±SD) 프레드니손 감축은 프로토콜에 따른 최대 가능한 감축의 83.8%±33.4%였으며, 이에 비해 위약군에서는 47.4%±40.5%였다(p<0.04). 절대항에서, 프레드니손의 평균 용량은 메폴리주맙군에서는 11.9 mg에서 3.9 mg로 감축되었고, 위약군에서는 10.7 mg에서 6.4 mg로 감축되었다(두 군에서 감축 중앙값: 10 mg에서 5 mg으로임)(P=0.11).
사전 명시된(pre-specified) 하위군 분석
위약군에서는 10명의 환자 중 8명에서 객담 호산구 증가증을 동반한 악화가 있었다는 데이터가 그 당시에 검열된 반면, 메폴리주맙을 투여받은 환자 중에서는 아무도 객담 호산구 증가증과 관련된 악화가 나타나지 않았다(P=0.02). 위약군에서 객담 호중구 증가증과 관련된 악화는 3차례 존재하였다. 메폴리주맙군에서는, 통상적인 방문 동안 5차례의 객담 호중구 수의 증가 사건이 있었으나(4명의 환자에서), 그 사건들은 악화를 규정한 척도의 변화와 관련되지 않았으며, 따라서 치료되지 않았다.
메폴리주맙군에서는, 프레드니손 사용의 평균 (±SD) 감축이 프로토콜에 따른 최대 가능한 감축의 94.3%±12.9%였으며, 이에 비해 위약군에서는 47.5%±42.2%였다(p=0.01).
사전 명시된 2차 지표
메폴리주맙의 1회 주입은 객담 (P=0.005) 및 혈액 (P=0.004) 에서의 호산구의 수가 정상 범위 내로 감소된 것과 관련성이 있었다. 이 수준은 메폴리주맙 마지막 주입 후 8주 이하 동안의 프레드니손 용량의 감축 후에 정상 범위 내로 유지되었다(P=0.01). 이와 대조적으로, 위약군에서 프레드니손 용량의 감축은 객담 및 혈액에서의 호산구 수의 유의미한 증가와 관련되었다(도 3 및 표 2A). 다섯번째 주입 4주 후 객담내 림프구의 유의미한 감소를 제외하고는 객담 또는 혈액에서 호산구 이외의 세포 유형에 대한 메폴리주맙의 유의미한 효과는 없었다(P=0.001). 메폴리주맙 치료는 FEV1의 약간의 개선 (평균 300 ml), 천식 증상의 유의미하지 않은 개선, 및 주니퍼 천식 조절 질문지 상의 점수의 유의미한 개선과 관련성이 있었다(P=0.01) (표 2A 및 도 3).
2차 지표
객담 및 혈중 호산구는 메폴리주맙의 1회 주입에 의해 정상 범위 내로 감소되었는데, 이는 프레드니손 용량의 감축 후에도 유지되었고(p<0.05), 메폴리주맙의 마지막 주입 후 8주 이하 동안 유지되었다. 이와 대조적으로, 위약 측에서는 객담 및 혈중 호산구가 프레드니손 감축과 함께 유의미하게 증가하였다(표 2B). 메폴리주맙 치료는 표 2A에 나타난 바와 같이 FEV1, 천식 증상 및 천식 조절 질문지 점수의 개선과 관련성이 있었다.
메폴리주맙으로 치료된 환자에 있어서 치료 전 및 후의 변수들을 요약한 것이 표 2A에 제시되어 있다. 위약으로 치료된 환자에 있어서 치료 전 및 후의 변수들을 요약한 것은 표 2B에 제시되어 있다.
<표 2A>
<표 2B>
안전성
메폴리주맙군에서의 1명의 환자는 상기 약물 3회 주입을 받은 후 숨가쁨 증상이 점차 나타나, 연구에서 제외시켰다. 연구-군 배정을 알지 못한 조사자는 이 환자가 기존에 관상 동맥 질환을 가졌으며, 따라서 숨가쁨 증상은 허혈성 심근증으로 인한 심부전에 기인한 것으로 결론지었다. 상기 환자는 심내막 생검 또는 심장 자기 공명 영상을 거치지 않아, 호산구성 심근증 가능성이 배제되었다. 위약군에서의 1명의 환자는 전체 연구 완료 6개월 후 집에서 갑자기 사망하였다. 부검 결과, 사망 원인은 심실성 빈맥이 원인일 가능성이 있는 급성 심장 정지로 규명되었으며, 천식 악화로 인한 것은 아니었다. 메폴리주맙군에서의 1명의 환자는 프레드니손 용량을 2.5 mg로 감소시켰을 때 통증과 피로가 있다고 보고하였다. 위약군에서의 1명의 환자는 1일당 12.5 mg에서 5 mg로의 프레드니손 감축 동안 부신저하증이 있었다(단시간의 코르티코트로핀 자극 시험에 대한 둔화된 코티솔 반응으로 입증됨). 여타의 심한 유해 사례는 없었다. 메폴리주맙에 기인한 혈중 화학 수치의 유의미한 이상은 없었다.
토의
상기 데이터는, 경구 프레드니손 및 고용량 흡입 코르티코스테로이드를 이용한 치료시에도 계속해서 객담 호산구 증가증을 갖는 희귀한 천식 환자에서, IL-5에 대한 인간화 단일클론 항체를 이용한 치료에 의해서 천식 악화가 일어나지 않으면서 프레드니손 용량의 감축이 가능하게 되는 것을 보여준다. 이러한 결과는 보다 흔한 형태의 천식을 가진 환자에서 유사한 항체를 이용한 이전의 연구들의 부정적 결과와 대조적이며(문헌 [Leckie, et al . Lancet 2000; 356: 2144-8]; [Kips, et al . Am J Respir Crit Care Med 2003; 167: 1655-9]; 및 [Flood-Page, et al . Am J Respir Crit Care Med 2007; 176: 1062-71]), 과호산구 증가증 증후군 (HES) 환자에서의 결과(문헌 [Klion, et al . Blood 2004; 103: 2939-2941]; [Garrett, et al . J Allergy Clin Immunol 2004; 113: 115-119]; 및 [Rothenberg, et al. N Engl J Med 2008; 358: 1215-28]), 및 객담 호산구 증가증을 동반한 천식 (문헌 [Korn, et al . Am J Respir Crit Care Med 2007; 175: A486]) 및 천식을 동반한 HES (문헌 [Hargreave, et al . Clin Exp Allergy ( abstract ) 2004; 34: 1807]) 의 2가지 사례 보고 요약에서와는 일치한다.
본 연구에서 성인 발병 천식이 있는 환자에서, 경구 및 흡입 코르티코스테로이드 치료 하에서 지속된 객담 호산구 증가증은 항-IL-5 치료에 의해 역전되었으며, 이들 환자는 임상적으로 개선되었다. 이와 대조적으로, 이전의 연구들에서는, 객담 호산구가 측정되지 않았거나, 또는 연구 개시 시점에 객담 호산구 증가증이 거의 또는 전혀 없었다(문헌 [Kips, et al . Am J Respir Crit Care Med 2003; 167: 1655-9] 및 [Flood-Page, et al . Am J Respir Crit Care Med 2007; 176: 1062-71]). 선행 연구 중에서 기준 시점 기도 호산구 증가증을 가진 소규모 하위집단의 환자들에 대한 상기 치료의 효과에 대해 보고한 것은 없었다. 따라서, 이전의 임상 시험에서 임상적 유익이 없었던 것은 무작위화된 환자 대부분이 본 발명자들이 연구한, 코르티코스테로이드 치료에도 불구하고 기도 호산구 증가증이 지속된 임상적 표현형을 갖지 않았기 때문이었을 가능성이 있다.
본 연구는 상당한 한계점을 갖는다. 첫째로, 두 치료군 간에 객담 호산구의 출발 비율이 불균형하였는데, 메폴리주맙군은 객담 호산구 수가 더 많았다. 메폴리주맙에 반응하는 환자들은 코르티코스테로이드 치료에도 불구하고 객담 내 호산구 수가 가장 높은 환자들일 가능성이 있다. 둘째로, 본 연구가 상당한 프레드니손-감축 효과를 나타내었지만, 두 치료군에서 임상적으로 더욱 의미있는 최종 프레드니손 용량 지표에서 통계학적으로 유의미한 차이가 없었다. 셋째로, 본 연구는 가변적인 기류 폐쇄로 시사되는 천식에 대한 과거의 객관적인 증거에 의존하였다. 대부분의 환자가 과거에 악화가 빈번하여 유지 용량의 장기 작용성 기관지확장제 투여 상태에 있었거나 또는 기준 시점에서 중등도의 기류 폐쇄를 가졌기 때문에, 본 연구는 기준 시점에서 모든 환자에 대해 알부테롤 가역성 또는 메타콜린 기도 과민성을 다시 시험하지는 않았다. 넷째로, 연구된 환자 중 천식과 지속성 객담 호산구 증가증이 있는 환자는 작은 비율에 불과하며, 본 발명자들의 결과는 대부분의 천식 환자에는 적용되지 않을 것으로 예상된다. 다섯째로, 여러 노력에도 불구하고, 조사자는 객담 세포수에 대해 부분적으로 지각하였기 때문에 치료제 배정에 대해 완전히 알지 못한 채로 있었던 것은 아닐 수 있다. 여섯째로, 본 연구는 다소 규모가 적어서, 임상적으로 지침성 있는 것으로 간주될 수 없다.
요컨대, 정맥내 메폴리주맙은 혈중 및 객담 호산구를 감소시키며, 경구 프레드니손 및 고용량 흡입 스테로이드 치료에도 불구하고 객담 호산구가 있는 천식 환자에서 프레드니손-감축성이 있다. 본 소규모의 예비적(pilot) 연구는 잠재적으로 임상적 지침성이 있으며, 천식에서 항-호산구 약물을 연구하기 위해 기도 호산구 증가증이 있는 대상자들을 선택하는 것의 중요성을 부각시킨다.
SEQUENCE LISTING
<110> HARGREAVE, Fredrick
VENTRESCA, Giampietro
<120> METHODS OF TREATMENT
<130> PU62905
<150>
<151>
<150> US 61/040363
<151> 2008-03-28
<160> 21
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 334
<212> DNA
<213> Murine
<400> 1
acctggcctg gtggcgccct cacagagcct gtccatcact tgcactgtct ctgggttttc 60
attaaccagc tatagtgtac actgggttcg ccagcctcca ggaaagggtc tggagtggct 120
gggagtaata tgggctagtg gaggcacaga ttataattcg gctctcatgt ccagactgag 180
catcagcaaa gacaactcca agagccaagt tttcttaaaa ctgaacagtc tgcaaactga 240
tgacacagcc atgtactact gtgccagaga tcccccttct tccttactac ggcttgacta 300
ctggggccaa ggcaccactc tcacagtctc ctca 334
<210> 2
<211> 315
<212> DNA
<213> Murine
<400> 2
tcctccctga gtgtgtcagc aggagagaag gtcactatga gctgcaagtc cagtcagagt 60
ctgttaaaca gtggaaatca aaagaactac ttggcctggt accagcagaa accagggcag 120
cctcctaaac ttttgatcta cggggcatcc actagggaat ctggggtccc tgatcgcttc 180
acaggcagtg gatctggaac cgatttcact ctttccatca gcagtgtgca ggctgaagac 240
ctggcagttt attactgtca gaatgttcat agttttccat tcacgttcgg ctcggggaca 300
gagttggaaa taaaa 315
<210> 3
<211> 334
<212> DNA
<213> Murine
<400> 3
acctggcctg gtggcgccct cacagagcct gtccatcact tgcactgtct ctgggttttc 60
attaaccagt tatagtgtac actgggttcg ccagcctcca ggaaagggtc tggagtggct 120
gggagtaata tgggctagtg gaggcacaga ttataattcg gctctcatgt ccagactgag 180
catcagcaaa gacaactcca agagccaagt tttcttaaaa ctgaacagtc tgcgaactga 240
tgacacagcc atgtactact gtgccagaga tcccccttct tccttactac ggcttgacta 300
ctggggccaa ggcaccactc tcacagtctc ctca 334
<210> 4
<211> 315
<212> DNA
<213> Murine
<400> 4
tcctccctga gtgtgtcagc aggagagaag gtcactatga gctgcaagtc cagtcagagt 60
ctattaaaca gtggaaatca aaagaactac ttggcctggt accaacagaa accagggcag 120
cctcctaaac ttttgatcta cggggcatcc actagggaat ctggggtccc tgatcgcttc 180
acaggcagtg gatctggaac cgatttcact cttaccatca gcagtgtgca ggctgaagac 240
ctggcagttt attactgtca gaatgatcat agttttccat tcacgttcgg ctcggggaca 300
gagttggaaa taaaa 315
<210> 5
<211> 334
<212> DNA
<213> Murine
<400> 5
acctggcctg gtggcgccct cacagagcct gtccatcact tgcactgtct ctgggttttc 60
attaaccagc tatagtgtac actgggttcg ccagcctcca ggaaagggtc tggagtggct 120
gggagtaatc tgggctagtg gaggcacaga ttataattcg gctctcatgt ccagactgag 180
catcagcaaa gacaactcca agagccaagt tttcttaaaa ctgaacagtc tgcaaactga 240
tgacgcagcc atgtactact gtgccagaga tccccctttt tccttactac ggcttgactt 300
ctggggccaa ggcaccactc tcacagtctc ctca 334
<210> 6
<211> 315
<212> DNA
<213> Murine
<400> 6
tcctctctga gtgtgtcagc aggagagaag gtcactatga gctgcaagtc cagtcagagt 60
ctgttaaaca gtggaaatca aaaaaactac ttggcctggt accagcagaa accagggcag 120
cctcctaaac ttttgatcta cggggcatcc actagggaat ctggggtccc tgatcgcttc 180
acaggcagtg gatctggaac cgatttcact cttaccatca gcagtgtgca ggctgaagac 240
ctggcagttt attactgtca gaatgatcat agttttccat tcacgttcgg ctcggggaca 300
gagttggaaa taaaa 315
<210> 7
<211> 5
<212> PRT
<213> Murine
<400> 7
Ser Tyr Ser Val His
1 5
<210> 8
<211> 16
<212> PRT
<213> Murine
<400> 8
Val Ile Trp Ala Ser Gly Gly Thr Asp Tyr Asn Ser Ala Leu Met Ser
1 5 10 15
<210> 9
<211> 11
<212> PRT
<213> Murine
<400> 9
Asp Pro Pro Ser Ser Leu Leu Arg Leu Asp Tyr
1 5 10
<210> 10
<211> 17
<212> PRT
<213> Murine
<400> 10
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 11
<211> 7
<212> PRT
<213> Murine
<400> 11
Gly Ala Ser Thr Arg Glu Ser
1 5
<210> 12
<211> 9
<212> PRT
<213> Murine
<400> 12
Gln Asn Val His Ser Phe Pro Phe Thr
1 5
<210> 13
<211> 9
<212> PRT
<213> Murine
<400> 13
Gln Asn Asp His Ser Phe Pro Phe Thr
1 5
<210> 14
<211> 11
<212> PRT
<213> Murine
<400> 14
Asp Pro Pro Phe Ser Leu Leu Arg Leu Asp Phe
1 5 10
<210> 15
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Murine/Homo sapiens
<400> 15
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Ser Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Ser Gly Gly Thr Asp Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Leu Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asp Pro Pro Ser Ser Leu Leu Arg Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 16
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Murine/Homo sapiens
<400> 16
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val His Ser Phe Pro Phe Thr Phe Gly Ser Gly Thr Glu Leu Glu Ile
100 105 110
Lys
<210> 17
<211> 60
<212> DNA
<213> Homo sapiens
<400> 17
atggtgttgc agacccaggt cttcatttct ctgttgctct ggatctctgg tgcctacggg 60
<210> 18
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<223> Murine/Homo sapiens - humanized
<400> 18
caggttaccc tgcgtgaatc cggtccggca ctagttaaac cgacccagac cctgacgtta 60
acctgcaccg tctccggttt ctccctgacg agctatagtg tacactgggt ccgtcagccg 120
ccgggtaaag gtctagaatg gctgggtgta atatgggcta gtggaggcac agattataat 180
tcggctctca tgtcccgtct gtcgatatcc aaagacacct cccgtaacca ggttgttctg 240
accatgacta acatggaccc ggttgacacc gctacctact actgcgctcg agatccccct 300
tcttccttac tacggcttga ctactggggt cgtggtaccc cagttaccgt gagctca 357
<210> 19
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Murine/Homo sapiens - humanized
<400> 19
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Ser Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Ser Gly Gly Thr Asp Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Arg Asn Gln Val Val Leu
65 70 75 80
Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Pro Pro Ser Ser Leu Leu Arg Leu Asp Tyr Trp Gly Arg Gly
100 105 110
Thr Pro Val Thr Val Ser Ser
115
<210> 20
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<223> Murine/Homo sapiens - humanized
<400> 20
gatatcgtga tgacccagtc tccagactcg ctagctgtgt ctctgggcga gagggccacc 60
atcaactgca agagctctca gagtctgtta aacagtggaa atcaaaagaa ctacttggcc 120
tggtatcagc agaaacccgg gcagcctcct aagttgctca tttacggggc gtcgactagg 180
gaatctgggg tacctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc 240
atcagcagcc tgcaggctga agatgtggca gtatactact gtcagaatgt tcatagtttt 300
ccattcacgt tcggcggagg gaccaagttg gagatcaaa 339
<210> 21
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Murine/Homo sapiens - humanized
<400> 21
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val His Ser Phe Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
Claims (23)
- 호산구성 기관지염을 앓고 있는 인간에게 1종 이상의 항-IL-5 항체를 포함하는 조성물을 투여하는 것을 포함하는, 호산구성 기관지염을 치료하는 방법.
- 제1항에 있어서, 상기 인간이 스테로이드-의존성 호산구성 기관지염을 가진 인간인 방법.
- 제2항에 있어서, 상기 스테로이드가 프레드니손 및/또는 프레드니솔론인 방법.
- 제1항에 있어서, 상기 호산구성 기관지염이 중증인 방법.
- 제1항에 있어서, 상기 1종 이상의 항-IL-5 항체가 인간 IL-5에 대한 항체인 방법.
- 제5항에 있어서, 상기 1종 이상의 항-IL 항체가 중화 항체인 방법.
- 제1항에 있어서, 상기 1종 이상의 항-IL-5 항체가 인간화 항체인 방법.
- 제1항에 있어서, 상기 1종 이상의 항-IL-5 항체가 서열번호: 19를 포함하는 중쇄를 포함하는 것인 방법.
- 제1항에 있어서, 상기 1종 이상의 항-IL-5 항체가 서열번호: 21을 포함하는 경쇄를 포함하는 것인 방법.
- 제1항에 있어서, 상기 인간이 아토피성 천식, 아토피성 피부염, 알레르기성 비염, 비(非)-알레르기성 비염, 천식, 중증 천식, 만성 호산구성 폐렴, 알레르기성 기관지폐 아스페르길루스증, 복강 질환, 처그-스트라우스 증후군, 호산구증가 근육통증 증후군, 과호산구 증후군, 삽화성 혈관부종을 비롯한 부종성 반응, 연충 감염, 기생충 감염 및/또는 기생충 감염에 대한 치료와 관련된 호산구 증가증, 온코세르카성 피부염, 호산구성 식도염, 호산구성 위염, 호산구성 위장염, 호산구성 장염, 호산구성 대장염, 미세비용종, 비용종, 아스피린 불내성 천식, 폐쇄성 수면 무호흡증, 만성 천식, 크론병, 경피증 및 심내막심근 섬유증으로 이루어진 군에서 선택되는 호산구 과다 생성과 관련된 1종 이상의 추가적 장애를 앓고 있는 인간인 방법.
- 제1항에 있어서, 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물이 정맥내로 투여되는 것인 방법.
- 제11항에 있어서, 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물이 750 mg의 용량으로 투여되는 것인 방법.
- 제11항에 있어서, 상기 정맥내 용량이 정맥내로 30분에 걸쳐 투여되는 것인 방법.
- 제2항에 있어서, 상기 인간이 상기 스테로이드-의존성 호산구성 기관지염에 대해 프레드니손을 투여받고 있는 중이며, 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물을 이용한 치료 후에 스테로이드-의존성 호산구성 기관지염을 앓고 있는 상기 인간에서 상기 프레드니손이 적어도 약 90% 감축되는 것인 방법.
- 제2항에 있어서, 스테로이드-의존성 호산구성 기관지염을 앓고 있는 인간이 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물의 용량을 1회 이상 투여받은 후 호산구성 기관지염의 악화가 통계학적으로 유의미하게 감소되는 것을 경험하게 되는 것인 방법.
- 제1항에 있어서, 상기 인간에서 호산구 수준이 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물의 용량을 1회 이상 투여받은 후 정상 범위 내로 감소되는 것인 방법.
- 제16항에 있어서, 상기 호산구 수준이 항-IL-5 항체를 포함하는 상기 조성물의 마지막 용량 투여 후 적어도 8주 동안 정상 범위 내로 유지되는 것인 방법.
- 제1항에 있어서, 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물이 제1의 항-IL-5 항체 및 제2의 항-IL-5 항체를 포함하는 것인 방법.
- 제1항에 있어서, 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물이 스테로이드와 공동-투여되는 것인 방법.
- 제2항에 있어서, 1종 이상의 항-IL-5 항체를 포함하는 상기 조성물이 위약과 비교하여, 호산구성 기관지염의 악화를 제어하기 위해 환자에 필요한 스테로이드의 양을 통계학적으로 유의미하게 감소시키는 것인 방법.
- 제16항에 있어서, 상기 호산구 수준이 상기 인간의 혈액 및/또는 객담에서 감소되는 것인 방법.
- 제1항에 있어서, 환자가 천식을 또한 앓고 있는 환자인 방법.
- 제22항에 있어서, 천식이 중증인 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4036308P | 2008-03-28 | 2008-03-28 | |
| US61/040,363 | 2008-03-28 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100134702A true KR20100134702A (ko) | 2010-12-23 |
Family
ID=41114741
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107024046A KR20100134702A (ko) | 2008-03-28 | 2009-03-27 | 치료 방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (3) | US9834600B2 (ko) |
| EP (1) | EP2274009B1 (ko) |
| JP (4) | JP5917143B2 (ko) |
| KR (1) | KR20100134702A (ko) |
| CN (1) | CN102026660A (ko) |
| AU (1) | AU2009228163B2 (ko) |
| BR (1) | BRPI0910854A2 (ko) |
| CA (1) | CA2719786A1 (ko) |
| EA (1) | EA201071137A1 (ko) |
| ES (1) | ES2441945T3 (ko) |
| IL (1) | IL208354A0 (ko) |
| MX (1) | MX2010010667A (ko) |
| WO (1) | WO2009120927A2 (ko) |
| ZA (1) | ZA201006648B (ko) |
Families Citing this family (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010521496A (ja) | 2007-03-14 | 2010-06-24 | ノップ ニューロサイエンシーズ、インク. | キラル精製置換ベンゾチアゾールジアミンの合成 |
| BRPI0910854A2 (pt) * | 2008-03-28 | 2015-10-06 | Glaxosmithkline Llc | métodos de tratamento |
| US20110190356A1 (en) | 2008-08-19 | 2011-08-04 | Knopp Neurosciences Inc. | Compositions and Methods of Using (R)- Pramipexole |
| EP2600901B1 (en) | 2010-08-06 | 2019-03-27 | ModernaTX, Inc. | A pharmaceutical formulation comprising engineered nucleic acids and medical use thereof |
| HRP20220796T1 (hr) | 2010-10-01 | 2022-10-14 | ModernaTX, Inc. | Ribonukleinske kiseline koje sadrže n1-metil-pseudouracil i njihove uporabe |
| CA2831613A1 (en) | 2011-03-31 | 2012-10-04 | Moderna Therapeutics, Inc. | Delivery and formulation of engineered nucleic acids |
| US9464124B2 (en) | 2011-09-12 | 2016-10-11 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| EP3492109B1 (en) | 2011-10-03 | 2020-03-04 | ModernaTX, Inc. | Modified nucleosides, nucleotides, and nucleic acids, and uses thereof |
| RS63244B1 (sr) | 2011-12-16 | 2022-06-30 | Modernatx Inc | Kompozicije modifikovane mrna |
| WO2013096816A1 (en) | 2011-12-22 | 2013-06-27 | Biogen Idec Ma Inc. | Improved synthesis of amine substituted 4,5,6,7-tetrahydrobenzothiazole compounds |
| US9303079B2 (en) | 2012-04-02 | 2016-04-05 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| US9572897B2 (en) | 2012-04-02 | 2017-02-21 | Modernatx, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| WO2013151664A1 (en) | 2012-04-02 | 2013-10-10 | modeRNA Therapeutics | Modified polynucleotides for the production of proteins |
| US9283287B2 (en) | 2012-04-02 | 2016-03-15 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of nuclear proteins |
| PL2922554T3 (pl) | 2012-11-26 | 2022-06-20 | Modernatx, Inc. | Na zmodyfikowany na końcach |
| US9662313B2 (en) | 2013-02-28 | 2017-05-30 | Knopp Biosciences Llc | Compositions and methods for treating amyotrophic lateral sclerosis in responders |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| LT3019167T (lt) | 2013-07-12 | 2021-03-25 | Knopp Biosciences Llc | Eozinofilų ir (arba) bazofilų padidintų kiekių gydymas |
| US9468630B2 (en) | 2013-07-12 | 2016-10-18 | Knopp Biosciences Llc | Compositions and methods for treating conditions related to increased eosinophils |
| EP3038467B1 (en) | 2013-08-13 | 2020-07-29 | Knopp Biosciences LLC | Compositions and methods for treating plasma cell disorders and b-cell prolymphocytic disorders |
| AU2014306597B2 (en) | 2013-08-13 | 2018-05-17 | Knopp Biosciences Llc | Compositions and methods for treating chronic urticaria |
| EP3052106A4 (en) | 2013-09-30 | 2017-07-19 | ModernaTX, Inc. | Polynucleotides encoding immune modulating polypeptides |
| SG11201602503TA (en) | 2013-10-03 | 2016-04-28 | Moderna Therapeutics Inc | Polynucleotides encoding low density lipoprotein receptor |
| CN107073114B (zh) | 2014-09-08 | 2022-01-14 | 赛福伦公司 | 使用瑞利珠单抗治疗中度到重度嗜酸细胞性哮喘 |
| AU2016311385C1 (en) | 2015-08-24 | 2019-08-22 | Glaxosmithkline Intellectual Property (No. 2) Limited | Biopharmaceutical compositions |
| MY200912A (en) | 2017-05-26 | 2024-01-23 | Glaxosmithkline Ip Dev Ltd | Biopharmaceutical Compositions and Related Methods |
| CN116419746A (zh) * | 2020-08-05 | 2023-07-11 | 阿瑞泰治疗公司 | 右旋普拉克索用于治疗中度至重度哮喘的用途 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8800397D0 (en) | 1988-01-08 | 1988-02-10 | Sandoz Ltd | Improvements in/relating to organic compounds |
| US5096704A (en) | 1988-11-03 | 1992-03-17 | Schering Corporation | Method of treating eosinophilia |
| ATE98872T1 (de) | 1988-11-03 | 1994-01-15 | Schering Corp | Antagonist fuer interleukin-5 zur verhuetung oder verminderung von eosinophilie. |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| EP0533006A1 (en) | 1991-09-18 | 1993-03-24 | F.Hoffmann-La Roche & Co. Aktiengesellschaft | Chimaeric interleukin 5-receptor/immunoglobulin polypeptides |
| US5910573A (en) | 1992-01-23 | 1999-06-08 | Merck Patent Gesellschaft Mit Beschrankter Haftung | Monomeric and dimeric antibody-fragment fusion proteins |
| EP0625201A1 (en) | 1992-02-06 | 1994-11-23 | Schering Corporation | Design, cloning and expression of humanized monoclonal antibodies against human interleukin-5 |
| JPH06141885A (ja) | 1992-11-05 | 1994-05-24 | Chemo Sero Therapeut Res Inst | モノクローナル抗体 |
| WO1995014040A1 (en) | 1993-11-19 | 1995-05-26 | Baylor College Of Medicine | Monoclonal antibodies specific for human interleukin-5 |
| GB9412230D0 (en) | 1994-06-17 | 1994-08-10 | Celltech Ltd | Interleukin-5 specific recombiant antibodies |
| US7399837B2 (en) | 1995-12-22 | 2008-07-15 | Smithkline Beecham Corporation | Recombinant IL-5 antagonists useful in treatment of IL-5 mediated disorders |
| NZ301916A (en) | 1994-12-23 | 1999-05-28 | Smithkline Beecham Corp | Monoclonal antibodies to il-5 for use as antagonists to il-5 related disorders |
| US5693323A (en) * | 1994-12-23 | 1997-12-02 | Smithkline Beecham Corporation | Recombinant IL-5 antagonists useful in treatment of IL-5 mediated disorders |
| US5783184A (en) | 1994-12-23 | 1998-07-21 | Smithkline Beecham Corporation | Method for treatment and diagnosis of IL-5 mediated disorders |
| US6248723B1 (en) | 1997-06-10 | 2001-06-19 | National Jewish Medical And Research Center | Method for treatment of inflammatory disease |
| JP2001520188A (ja) | 1997-10-22 | 2001-10-30 | ポニカウ,ジェンス | 粘膜組織の炎症を治療および予防するための方法ならびに物質 |
| WO2001012646A1 (en) | 1999-08-19 | 2001-02-22 | Smithkline Beecham Corporation | Sialoadhesin factor-1 agonist and antagonist antibodies |
| US20030017169A1 (en) | 2000-12-29 | 2003-01-23 | Sidney Pestka | Controlled release systems for polymers |
| ES2327830T3 (es) | 2002-03-29 | 2009-11-04 | Schering Corporation | Anticuerpos monoclonales humanos anti-interleuquina-5 y metodos y composiciones que los contienen. |
| US7339507B1 (en) * | 2006-09-13 | 2008-03-04 | Jiun-In Guo | Device for video decoding |
| JP5345945B2 (ja) | 2006-12-11 | 2013-11-20 | ブラッコ・イメージング・ソシエタ・ペル・アチオニ | フィブリン結合ペプチドおよびそのコンジュゲート |
| ES2492943T3 (es) | 2007-04-30 | 2014-09-10 | Glaxosmithkline Llc | Procedimientos de administración de anticuerpos anti-IL5 |
| US20090035216A1 (en) | 2007-08-03 | 2009-02-05 | Biomonitor Aps | Method for determining in vivo biopharmaceutical concentration or bioavailability |
| BRPI0910854A2 (pt) | 2008-03-28 | 2015-10-06 | Glaxosmithkline Llc | métodos de tratamento |
| US8926631B2 (en) | 2010-08-06 | 2015-01-06 | MoMelan Technologies, Inc. | Methods for preparing a skin graft without culturing or use of biologics |
| WO2012109429A2 (en) | 2011-02-09 | 2012-08-16 | Glaxosmithkline Llc | Lyophilized formulations |
-
2009
- 2009-03-27 BR BRPI0910854A patent/BRPI0910854A2/pt not_active IP Right Cessation
- 2009-03-27 MX MX2010010667A patent/MX2010010667A/es not_active Application Discontinuation
- 2009-03-27 US US12/935,038 patent/US9834600B2/en active Active
- 2009-03-27 CA CA2719786A patent/CA2719786A1/en not_active Abandoned
- 2009-03-27 CN CN2009801176573A patent/CN102026660A/zh active Pending
- 2009-03-27 JP JP2011502090A patent/JP5917143B2/ja active Active
- 2009-03-27 AU AU2009228163A patent/AU2009228163B2/en not_active Ceased
- 2009-03-27 ES ES09725345.4T patent/ES2441945T3/es active Active
- 2009-03-27 EP EP09725345.4A patent/EP2274009B1/en not_active Revoked
- 2009-03-27 WO PCT/US2009/038509 patent/WO2009120927A2/en active Application Filing
- 2009-03-27 EA EA201071137A patent/EA201071137A1/ru unknown
- 2009-03-27 KR KR1020107024046A patent/KR20100134702A/ko not_active Application Discontinuation
-
2010
- 2010-09-16 ZA ZA2010/06648A patent/ZA201006648B/en unknown
- 2010-09-21 IL IL208354A patent/IL208354A0/en unknown
-
2014
- 2014-08-01 JP JP2014158170A patent/JP6069267B2/ja active Active
-
2016
- 2016-11-01 JP JP2016214438A patent/JP6457463B2/ja active Active
-
2017
- 2017-11-06 US US15/804,104 patent/US20180057582A1/en not_active Abandoned
-
2018
- 2018-12-20 JP JP2018238018A patent/JP2019065029A/ja active Pending
-
2019
- 2019-09-19 US US16/575,903 patent/US11325972B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| CN102026660A (zh) | 2011-04-20 |
| US20200071395A1 (en) | 2020-03-05 |
| WO2009120927A3 (en) | 2009-12-30 |
| EA201071137A1 (ru) | 2011-04-29 |
| US9834600B2 (en) | 2017-12-05 |
| EP2274009A4 (en) | 2012-01-25 |
| AU2009228163B2 (en) | 2012-08-30 |
| JP2019065029A (ja) | 2019-04-25 |
| JP5917143B2 (ja) | 2016-05-11 |
| JP2014240408A (ja) | 2014-12-25 |
| JP6069267B2 (ja) | 2017-02-01 |
| JP2011516422A (ja) | 2011-05-26 |
| ES2441945T3 (es) | 2014-02-07 |
| US20110020339A1 (en) | 2011-01-27 |
| US20180057582A1 (en) | 2018-03-01 |
| EP2274009B1 (en) | 2013-11-13 |
| WO2009120927A2 (en) | 2009-10-01 |
| CA2719786A1 (en) | 2009-10-01 |
| US11325972B2 (en) | 2022-05-10 |
| AU2009228163A1 (en) | 2009-10-01 |
| MX2010010667A (es) | 2010-11-09 |
| ZA201006648B (en) | 2011-07-27 |
| BRPI0910854A2 (pt) | 2015-10-06 |
| JP6457463B2 (ja) | 2019-01-23 |
| JP2017048224A (ja) | 2017-03-09 |
| IL208354A0 (en) | 2010-12-30 |
| EP2274009A2 (en) | 2011-01-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11325972B2 (en) | Methods of treatment of eosinophilic bronchitis with an anti-IL-5 antibody | |
| EP2152290B1 (en) | Methods for administering anti-il-5 antibodies | |
| JPH11510172A (ja) | アレルギー性喘息の治療法 | |
| CN116327922A (zh) | 生物医药组合物 | |
| US20220220209A1 (en) | Method of treating neutrophilic conditions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |