KR20060022649A - 키나아제 억제제로서 유용한 아릴 치환 피라졸-아미드화합물 - Google Patents
키나아제 억제제로서 유용한 아릴 치환 피라졸-아미드화합물 Download PDFInfo
- Publication number
- KR20060022649A KR20060022649A KR1020057020642A KR20057020642A KR20060022649A KR 20060022649 A KR20060022649 A KR 20060022649A KR 1020057020642 A KR1020057020642 A KR 1020057020642A KR 20057020642 A KR20057020642 A KR 20057020642A KR 20060022649 A KR20060022649 A KR 20060022649A
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- compound
- formula
- substituted
- compounds
- Prior art date
Links
- 0 Cc(c(NC(c1c(*)[n](C)nc1)=O)c1)ccc1C(N*)=O Chemical compound Cc(c(NC(c1c(*)[n](C)nc1)=O)c1)ccc1C(N*)=O 0.000 description 6
- PQDAWSZVBAZGAE-UHFFFAOYSA-N Cc([n](-c1cc(F)ccc1F)nc1)c1C(O)=O Chemical compound Cc([n](-c1cc(F)ccc1F)nc1)c1C(O)=O PQDAWSZVBAZGAE-UHFFFAOYSA-N 0.000 description 1
- GCLLFHYYDIYJAS-UHFFFAOYSA-N Cc(c(NC(c1c(N)[n](-c2ccccc2)nc1)=C)c1)ccc1C(NC1CC1)=O Chemical compound Cc(c(NC(c1c(N)[n](-c2ccccc2)nc1)=C)c1)ccc1C(NC1CC1)=O GCLLFHYYDIYJAS-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/18—One oxygen or sulfur atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/06—Antigout agents, e.g. antihyperuricemic or uricosuric agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/38—Nitrogen atoms
- C07D231/40—Acylated on said nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Rheumatology (AREA)
- Immunology (AREA)
- Physical Education & Sports Medicine (AREA)
- Pain & Pain Management (AREA)
- Pulmonology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Neurology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Transplantation (AREA)
- Vascular Medicine (AREA)
- Biomedical Technology (AREA)
- Cardiology (AREA)
- Neurosurgery (AREA)
- Emergency Medicine (AREA)
- Urology & Nephrology (AREA)
- Heart & Thoracic Surgery (AREA)
- Dermatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
본 발명은 하기 화학식 I을 갖는 화합물, 및 그들의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물에 관한 것이다.
<화학식 I>
상기 식 중, Q는 임의적으로 치환된 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐 고리이고, R2는 본 명세서에 정의된 알킬 또는 아미노기이고, Z는 임의적으로 치환된 옥사디아졸릴 또는 -C(=O)NR6(여기서, R6은 저급 알킬 또는 시클로프로필)이다. 놀랍게도, 본 화합물은 환자의 p38 키나아제 관련 증상 및(또는) 염증 장애 또는 증상 치료용 약물 제조에 유리하다.
p38 키나아제 억제제, 아릴 치환 피라졸 아미드
Description
관련 출원
본 출원은 2003년 5월 1일 출원된 US 특허 출원 제 60/467,029호의 35 USC § 119 하의 우선권의 이익을 청구하며, 이의 전문은 본 명세서에 참고 문헌으로 인용된다. 본 출원은 본 명세서에 참고 문헌으로 인용되는 US 특허 출원 제 호, 및 제 호에 관련되며, 상기 양쪽 출원들은 또한 본 발명의 양수인에게 양도되고 동시에 출원된 것이며, 2003년 5월 1일 출원된 US 특허 출원 제 60/467,029호의 우선권의 이익을 청구한다.
본 발명은 p38 키나아제 관련 증상 치료에 유용한 피라졸 유도 화합물에 관한 것이다. 또한, 본 발명은 p38 키나아제 관련 증상 치료에 유용한 본 발명에 따른 하나 이상의 화합물을 함유하는 제약 조성물, 및 포유류에서 p38 키나아제의 활성을 억제시키는 방법에 관한 것이다.
IL-1, IL-6, IL-8 및 TNF-α를 비롯한 다수의 시토카인들은 염증 반응에 참여한다. 시토카인, 예를 들면 IL-1 및 TNF-α의 과잉생산은 염증성 장 질환, 류머 티스성 관절염, 건선, 다발 경화증, 내독소성 쇼크, 골다공증, 알츠하미머병 및 울혈성 심부전증 등을 비롯한 다양한 질환과 관련되어 있다(문헌[Henry et al., Drugs Fut ., Vol. 24 (1999), pp. 1345-54]; [Salituro et al., Curr . Med . Chem ., Vol. 6 (1999), pp. 807-823]). 인간 환자에서의 증거는 시토카인의 단백질 길항제가 예를 들면, TNF-α에 대한 단일클론 항체(엔브렐(Enbrel))(문헌[Rankin et al., Br. J. Rheumatol ., Vol. 34 (1995), pp. 334-42]) 및 가용성 TNF-α 수용체-Fc 융합 단백질(에타너셉트(Etanercept))(문헌[Moreland et al., Ann. Intern. Med., Vol. 130 (1999), pp. 478-86])이 만성 염증 질환의 치료에 유효함을 보여준다.
TNF-α의 생합성은 외부 자극, 예를 들면, 미토겐, 감염성 유기체 또는 외상에 대응하여 많은 세포 유형들에서 발생한다. TNF-α 생산의 중요한 매개체는 인산화에 의해 그들의 기질을 활성화시키는 Ser/Thr 단백질 키나아제 족인 미토겐-활성화 단백질(MAP) 키나아제를 포함한다. MAP 키나아제는 염증전 시토카인, 내독소, 자외선 및 삼투압 쇼크를 포함하지만 이에 한정되지 않는 다양한 스트레스 자극에 대응하여 활성화된다.
한 중요한 MAP 키나아제는 시토카인 억제성 항염증성 약물 결합 단백질(CSBP) 또는 IK로도 알려진 p38 키나아제이다. p38의 활성화는 Thr-Gly-Tyr 모티프 특징의 p38 이소자임 내 트레오닌 및 타이로신에 대한 상류 MAP 키나아제 키나아제(MKK3 및 MKK6)에 의한 이중 인산화를 필요로 한다. p38의 이성형(isoform)으로 4 가지, 즉 p38-α, p38β, p38γ 및 p38δ가 공지되어 있다. 상기 α 및 β 이 성형은 염증 세포에서 발현되며, TNF-α 생산의 핵심 매개체이다. 세포 중 p38α 및 p38β 효소를 억제하면 TNF-α 발현 수준이 감소된다. 또한, p38α 및 p38β 억제제를 염증 질환의 동물 모델에 투여한 경우 이러한 억제제들이 상기 질환들의 치료에 유효함이 입증되었다. 본 발명은 키나아제 억제제, 특히 p38α 및 p38β 키나아제 억제제로서 유용한 피라졸 유도 화합물을 제공한다.
발명의 설명
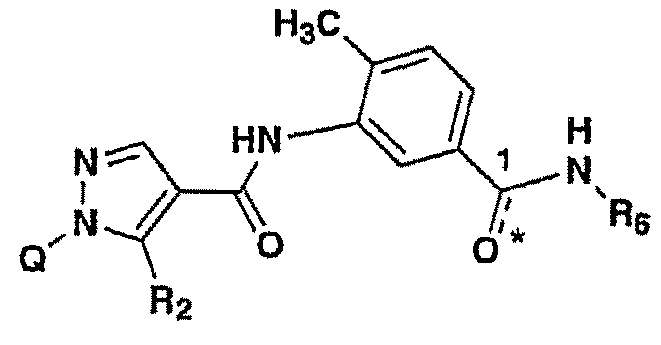
본 발명은 p38 키나아제 억제제로서 유리한 하기 화학식 I을 갖는 화합물, 및 그들의 제약상 허용되는 염, 전구약(prodrug), 용매화물, 이성체 및(또는) 수화물에 관한 것이다.
상기 식 중, Q는 임의적으로 치환된 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐 고리이고;
산소 원자 O*와 인접한 탄소 원자 C1 사이의 결합은, (i) 이중 결합이 되어 카르보닐기 [C(=O)]를 형성하며, 여기서 R6은 C1 - 6알킬 또는 시클로프로필이거나; 또는 (ii) 단일 결합이며, 단일 결합인 경우에는 상기 산소 원자 O*가 기 R6에 추가로 결합하여, R6 및 인접한 질소 원자와 함께, C1 및 인접한 질소 원자 사이의 결합이 이중 결합인 임의적으로 치환된 옥사디아졸릴 고리를 형성하며;
R2는 C1 - 6알킬, 아미노, 알킬아미노, 치환된 알킬아미노, 시클로아미노, 치환된 시클로아미; 및 아미노, 알킬아미노, 치환된 알킬아미노, 시클로아미노 및(또는) 치환된 시클로아미노 중 하나 또는 2 개로 치환된 C1 - 6알킬로부터 선택된다.
따라서, 본 발명의 한 태양은 하기 화학식 Ia를 갖는 화합물, 및 그들의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물에 관한 것이다.
상기 식 중, R6는 C1 - 6알킬 또는 시클로프로필이고, R2는 앞서 정의한 바와 같고, Q는 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐이고, R9, R10 및 R11은 아릴 및(또는) 헤테로아릴에 대해 본 명세서에서 정의한 임의적 치환체이다.
본 발명의 또다른 태양은 하기 화학식 Ib를 갖는 화합물, 및 그들의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물에 관한 것이다.
상기 식 중, R2는 앞서 정의한 바와 같고, Q는 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐이고, R9, R10, R11 및 R13은 아릴 및(또는) 헤테로아릴에 대해 본 명세서에서 정의한 임의적 치환체이다.
본 발명의 또다른 태양에 따르면, 포유류에서 p38 키나아제를 조절하는 데 유용한 약물 제조에 화학식 I의 화합물을 사용하는 방법이 제공된다. 본 발명의 또다른 태양에 따르면, 화학식 I 및(또는) 화학식 Ia 및(또는) Ib에 따른 하나 이상의 화합물, 및 제약상 허용되는 담체 또는 희석제를 포함하는 제약 조성물이 제공된다. 본 발명의 또다른 태양에 따르면, 청구항 1에 따른 화합물 및(또는) 화학식 I 및(또는) 화학식 Ia 및(또는) 화학식 Ib에 따른 하나 이상의 화합물, 및 제약상 허용되는 담체 또는 희석제의 염증 장애 또는 증상 치료용 제약 조성물 제조 용도가 제공된다.
정의
하기는 본 명세서 및 청구 범위에 사용된 용어의 정의이다. 본 명세서의 한 군 또는 용어에 대해 제공된 최초의 정의는 달리 언급이 없으면 본 명세서 및 청구 범위 전체에 걸쳐 군 또는 용어에 개별적으로 또는 또다른 군의 일부로서 적용된 다.
용어 "알킬" 및 "알크"는 1 내지 12 개의 탄소 원자, 바람직하게는 1 내지 6 개의 탄소 원자를 함유하는 직쇄 또는 분지쇄 알칸(탄화수소) 라디칼을 지칭한다. 예시적인 "알킬"기는 메틸, 에틸, 프로필, 이소프로필, 1-메틸프로필, n-부틸, t-부틸, 이소부틸, 펜틸, 헥실, 이소헥실, 헵틸, 디메틸펜틸, 디에틸펜틸, 옥틸, 2,2,4-트리메틸펜틸, 노닐, 데실, 운데실, 도데실 등을 포함한다. 용어 "C1-C4 알킬"은 1 내지 4 개의 탄소 원자를 함유하는 직쇄 또는 분지쇄 알칸(탄화수소) 라디칼, 예를 들면 메틸, 에틸, 프로필, 이소프로필, n-부틸, t-부틸 및 이소부틸을 지칭한다. 저급 알킬은 "C1-C4 알킬"이다. 알킬, 저급 알킬 (또는 C1-C4알킬)이 또다른 언급된 기 뒤에 접미사로 사용되는 예를 들면, "히드록시알킬" 또는 히드록실(저급 알킬)의 경우, 알킬의 직쇄 또는 분지쇄 상의 임의의 부착점에서 1, 2, 또는 3 개의 다른 구체적으로 언급된 기(들)에 결합된 알킬 또는 저급 알킬(C1-C4알킬)을 지칭하는 것으로 의도된다. 추가의 예로서, 아릴알킬은 기, 예를 들면 벤질 또는 페닐에틸을 포함한다. 용어 "치환된"이 "치환된 아릴알킬" 또는 "치환된 알콕시알킬"과 같이 기에 사용된 경우, 알킬 잔기, 다른 언급된 잔기, 또는 양쪽 모두가 본 명세서에 언급된 것들로부터 적합하게 선택된 기로 치환될 수 있으며, 예를 들면 알킬 잔기의 경우, 기는 치환된 알킬에 대해 이하 언급되는 것들로부터 선택될 수 있고, 다른 구체적으로 언급된 기의 경우, 그 기에 대해 이하 언급되는 것들로부터 선택될 수 있다는 점이 이해되어야 한다.
"치환된 알킬"은 앞서 정의한 바와 같이 직쇄 및(또는) 분지쇄 상의 임의의 이용가능한 부착점에서 하나 이상의 치환체, 바람직하게는 1 내지 4 개의 치환체, 더욱 바람직하게는 1 내지 2 개의 치환체로 치환된 알킬기를 지칭한다. 예시적인 치환체는 하나 이상의 할로겐, 할로알킬(단일 할로 치환체 또는 다중 할로 치환체(후자의 경우, 예를 들면, -CHCl2 및(또는) CF3를 비롯한 퍼플루오로알킬기와 같은 기를 형성함)), 할로알콕실(예를 들면, 트리플루오로메톡시), 시아노, 니트로, 알케닐, 알키닐, 시클로알킬, 헤테로시클, 헤테로아릴, 아릴, ORa, SRa, S(=O)Re, S(=O)2Re, P(=O)2Re, S(=O)2ORe, P(=O)2ORe, P(=O)(OR)2, NRbRc, NRbS(=O)2Re, NRbP(=0)2Re, S(=O)2NRbRc, P(=O)2NRbRc, C(=O)ORa, C(=O)Ra, C(=O)NRbRc, OC(=O)Ra, C(=O)ONRbRc, OC(=O)NRbRc, NRbC(=O)ORa, NRdC(=O)NRbRc, NRdS(=O)2NRbRc, NRdP(=O)2NRbRc, NRbC(=O)Ra 및(또는) NRbP(=O)2Re(여기서, Ra, Rb, Rc Rd 및 Re는 수소, 알킬, 알케닐, 아미노알킬, 알킬아미노알킬, 시클로알킬(알킬), 아릴(알킬), 헤테로시클로(알킬), 헤테로아릴(알킬), 시클로알킬, 아릴, 헤테로시클로 및(또는) 헤테로아릴로부터 선택되며, 단 Re는 수소가 아니고, 또한 Rb 및 Rc는 동일한 질소 원자에 부착된 경우, 함께 연결되어 시클로아미노기를 형성함) 중 하나 이상을 포함할 수 있으나 이에 한정되지 않는다. 알킬 및(또는) 시클릭 잔기 상의 Ra, Rb, Rc Rd 및 Re는 저급 알킬, 저급 알케닐, Rf(여기서, Rf는 시아노, 할로겐, 할로C1-C4알 킬, 할로C1-C4알콕시, 케토(=O)(원자가가 허용되는 경우), 니트로, OH, O(C1-C4알킬), SH, S(C1-C4알킬), S(=O)(C1-C4알킬), S(=O)2(C1-C4알킬), NH2, NH(C1-C4알킬), N(C1-C4알킬)2, NH(시클로알킬), NH(페닐), 페닐, 벤질, 페녹시, 벤질옥시, NHS(=O)2(알킬), S(=O)2NH2, S(=O)2NH(C1-C4알킬), S(=O)2N(C1-C4알킬)2, S(=O)2NH(시클로알킬), S(=O)2NH(페닐), C(=O)OH, C(=O)O(C1-C4알킬), C(=O)H, C(=O)(C1-C4알킬), C(=O)NH2, C(=O)NH(C1-C4알킬), C(=O)N(C1-C4알킬)2, C(=O)NH(시클로알킬), C(=O)NH(페닐), C(=O)ONH2, C(=O)ONH(C1-C4알킬), C(=O)ON(C1-C4알킬)2, C(=O)ONH(시클로알킬), C(=O)ONH(페닐), NHC(=O)OC1-C4알킬, N(C1-C4알킬)C(=O)O(C1-C4알킬), NHC(=O)NH2, NHC(=O)NH(C1-C4알킬), NHC(=O)N(C1-C4알킬)2, NHC(=O)NH(시클로알킬), NHC(=O)NH(페닐), NHC(=O)H 및(또는) NHC(=O)(C1-C4알킬 중 하나 이상으로부터 선택됨) 및 하나 또는 2 개의 Rf로 치환된 저급 알킬 또는 저급 알케닐로부터 선택된 1 내지 3 개, 바람직하게는 2 개 이하(0 내지 2 개)의 기로 또한 임의적으로 치환될 수 있다.
용어 "알케닐"은 2 내지 12 개의 탄소 원자 및 하나 이상의 탄소-탄소 이중 결합을 함유하는 직쇄 또는 분지쇄 탄화수소 라디칼을 지칭한다. 예시적인 이러한 기는 에테닐 및 알릴을 포함한다. 저급 알케닐은 2 내지 4 개의 탄소 원자로 된 알케닐기를 의미한다. "치환된 알케닐"은 임의의 이용가능한 부착점에서 하나 이 상의 치환체, 바람직하게는 1 내지 4 개의 치환체, 더욱 바람직하게는 1 내지 2 개의 치환체로 치환된 알케닐기를 지칭한다. 예시적인 치환체는 알킬, 치환된 알킬, 및 치환된 알킬기에 대한 예시적인 치환체로서 앞서 언급한 기를 포함할 수 있으나 이에 한정되지 않는다.
용어 "알키닐"은 2 내지 12 개의 탄소 원자 및 하나 이상의 탄소-대-탄소 삼중 결합을 함유하는 직쇄 또는 분지쇄 탄화수소 라디칼을 지칭한다. 예시적인 이러한 기는 에티닐을 포함한다. "치환된 알키닐"은 임의의 이용가능한 부착점에서 하나 이상의 치환체, 바람직하게는 1 내지 4 개의 치환체, 더욱 바람직하게는 1 내지 2 개의 치환체로 치환된 알키닐기를 지칭한다. 예시적인 치환체는 알킬, 치환된 알킬, 및 치환된 알킬기에 대한 예시적인 치환체로서 앞서 언급한 기를 포함하나 이에 한정되지 않는다.
용어 "알콕시"는 ORg(여기서, Rg는 알킬, 알케닐 또는 시클로알킬로부터 선택됨)를 지칭한다. C1-C4알콕시는 알콕시기 ORg'(여기서, Rg'는 C1-C4알킬 또는 C3-C4시클로알킬임)이다. 치환된 알콕시기는 알킬, 알케닐 및(또는) 시클로알킬 잔기 중 하나 이상이 치환된 알케닐기에 대해 앞서 언급한 것들로부터 선택된 하나 이상, 바람직하게는 1 내지 4 개, 더욱 바람직하게는 1 내지 2 개의 기로 치환된 앞서 정의한 알콕시기이다.
용어 "아미노"는 NH2를 지칭하고, 알킬아미노는 수소 원자의 한쪽 또는 양쪽이 알킬, 알케닐 및(또는) 시클로알킬로부터 선택된 기로 대체된 아미노기를 지칭 한다. 따라서, 알킬아미노는 기 NRhRi(여기서, Rh 및 Ri는 수소, 알킬, 알케닐 및(또는) 시클로알킬로부터 선택되며, 단 Rh 및 Ri 양쪽 모두가 수소는 아님)를 지칭한다. "아미노알킬"은 앞서 정의한 바와 같이 아미노기로 치환된 알킬기를 지칭하고, "알킬아미노알킬"은 앞서 정의한 바와 같이 하나 이상의 알킬아미노기로 치환된 알킬기를 지칭한다. 치환된 알킬아미노기는 알킬, 알케닐 및(또는) 시클로알킬 잔기 중 하나 이상이 언급된 잔기에 대해 본 명세서에 언급된 것들로부터 적절하게 선택된 하나 이상, 바람직하게는 1 내지 4 개, 더욱 바람직하게는 1 내지 2 개의 기로 치환된 알킬아미노기이다. 따라서, 예를 들면, 임의적으로 치환된 알킬아미노기는 기 -NR'R"(여기서, R' 및 R"는 수소, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 시클로알킬 및 치환된 시클로알킬로부터 선택되고, 단 R' 및 R" 양쪽 모두가 수소는 아니며, 이 경우 기는 아미노이고 임의적으로 치환된 알킬아미노가 아님)를 지칭한다.
시클로아미노기는 기 -NR'R"(여기서, R' 및 R"는 연결되어 모노시클릭 헤테로시클로 고리, 예를 들면, N-모르폴리닐, N-피페리디닐, N-피페라지닐 등을 형성함)를 지칭한다. "치환된 시클로아미노"는 치환된 헤테로시클로기에 대해 이하 언급된 것들로부터 선택된 하나 이상, 바람직하게는 1 내지 4 개, 더욱 바람직하게는 1 내지 2 개의 치환체를 갖는 시클로아미노기이다.
용어 "알킬티오"는 기 SRg(여기서, Rg는 알킬, 알케닐 및 시클로알킬로부터 선택됨)를 지칭한다. C1-C4알킬티오는 알킬티오기 SRg'(여기서, Rg'는 C1-C4알킬 또 는 C3-C4시클로알킬임)이다. 치환된 알킬티오기는 알킬, 알케닐 및(또는) 시클로알킬 잔기 중 하나 이상이 치환된 알케닐기에 대해 앞서 언급한 것들로부터 선택된 하나 이상, 바람직하게는 1 내지 4 개, 더욱 바람직하게는 1 내지 2 개의 기로 치환된 알킬티오기이다.
용어 "아릴"은 페닐 및 나프틸을 비롯하여 1 내지 3 개의 방향족 고리를 갖는 시클릭 방향족 탄화수소기를 지칭한다. 아릴기는 헤테로시클로, 시클로알킬 또는 헤테로아릴 고리인 두번째 또는 세번째 고리에 융합된 것일 수 있고, 단 이 경우 부착점은 고리계의 아릴부가 된다. 따라서, 예시적인 아릴기는 하기 등을 포함한다.
"치환된 아릴"은 아릴 고리 및(또는) 여기에 융합된 임의의 추가의 고리의 임의의 부착점에서 하나 이상, 바람직하게는 1 내지 3 개, 더욱 바람직하게는 1 내 지 2 개의 치환체에 의해 치환된 아릴기를 지칭한다. 예시적인 치환체는 알킬, 치환된 알킬, 및 원자가가 허용되는 경우 치환된 알킬기에 대한 예시적인 치환체로서 앞서 언급한 기를 포함하나 이에 한정되지 않는다.
용어 "시클로알킬"은 1 내지 3 개의 고리 및 고리 당 3 내지 8 개의 탄소를 함유하는 완전 포화 및 부분 불포화된 시클릭 탄화수소기를 지칭한다. 예시적인 이러한 기는 시클로프로필, 시클로부틸, 시클로펜틸, 시클로헥실, 시클로헵틸, 시클로부테닐, 시클로펜테닐, 시클로헥세닐 등을 포함한다. 시클로알킬 고리는 이하 예시하는 바와 같이 카르보닐기(C=O)로 대체된 탄소 고리 원자를 가질 수 있다. 시클로알킬기는, 헤테로시클로, 헤테로아릴, 또는 아릴기인 여기에 융합된 두번째 또는 세번째 고리를 갖는 고리를 포함하며, 단 이러한 경우 부착점은 고리계의 시클로알킬부이다. 또한, 용어 "시클로알킬"은 스피로 고리가 헤테로시클로 또는 카르보시클릭 고리인 스피로 방식으로 고리 또는 고리계에 부착된 두번째 또는 세번째 고리를 갖는 고리를 포함한다. "치환된 시클로알킬"은 앞서 정의한 바와 같이 시클로알킬 고리, 및 원자가가 허용되는 경우 여기에 융합되거나 또는 부착된 임의의 고리 상의 임의의 이용가능한 부착점에서 하나 이상의 치환체, 바람직하게는 1 내지 4 개의 치환체, 더욱 바람직하게는 1 내지 2 개의 치환체를 갖는 시클로알킬기를 지칭한다. 예시적인 치환체는 알킬, 치환된 알킬, 및 치환된 알킬기에 대한 예시적인 치환체로서 앞서 언급한 기를 포함하나 이에 한정되지 않는다.
따라서, 예로서 시클로알킬 고리의 비제한적 예는 하기 등을 포함할 수 있다.
용어 "헤테로시클," "헤테로시클릭" 및 "헤테로시클로"는 하나 이상의 탄소 원자 함유 고리에 하나 이상의 헤테로원자를 갖는 완전 포화 또는 부분 불포화된 비방향족 시클릭기(예를 들면, 4 내지 7원 모노시클릭, 7 내지 11원 바이시클릭, 또는 10 내지 16원 트리시클릭 고리계)를 지칭한다. 헤테로원자를 함유하는 헤테로시클릭기의 각 고리는 질소 원자, 산소 원자 및(또는) 황 원자로부터 선택된 1, 2, 3, 또는 4 개의 헤테로원자를 가질 수 있으며, 여기서 상기 질소 및(또는) 황 헤테로원자는 임의적으로 산화될 수 있고 질소 헤테로원자는 임의적으로 4급화될 수 있다. 헤테로시클로 고리는 앞서 시클로알킬기에 대해 설명한 바와 같이 카르보닐기(C=O)로 대체된 탄소 고리 원자를 가질 수 있다. 헤테로시클릭기는 고리 또는 고리계의 임의의 질소 원자 또는 탄소 원자에서 분자의 잔여부에 부착될 수 있다. 또한, 헤테로시클로기는 스피로 또는 융합된 방식으로 여기에 부착된 두번째 또는 세번째 고리를 가질 수 있으며, 단 부착점은 헤테로시클로기이다. 부착된 스피로 고리는 카르보시클릭 또는 헤테로시클릭 고리일 수 있고, 두번째 및(또는) 세번째 융합된 고리는 시클로알킬, 아릴 또는 헤테로아릴 고리일 수 있다. 예시적인 모노시클릭 헤테로시클릭기는 아제티디닐, 피롤리디닐, 피라졸리닐, 이미다졸리디 닐, 옥사졸리디닐, 피페리디닐, 피페라지닐, 모르폴리닐, 테트라히드로푸릴, 테트라히드로피라닐, 티아모르폴리닐 등을 포함한다.
예시적인 바이시클릭 헤테로시클릭기는 인돌리닐, 이소인돌리닐, 퀴누클리디닐, 벤조피롤리디닐, 벤조피라졸리닐, 벤조이미다졸리디닐, 벤조피페리디닐, 벤조피페라지닐, 테트라히드로이소퀴놀리닐, 테트라히드로퀴놀리닐, 디히드로이소인돌릴 등을 포함한다.
"치환된 헤테로시클," "치환된 헤테로시클릭," 및 "치환된 헤테로시클로"는 헤테로시클로 고리 및(또는) 스피로 방식으로 여기에 부착되거나 또는 융합된 임의의 고리에 대해 임의의 이용가능한 부착점에서 하나 이상의 치환체, 바람직하게는 1 내지 4 개의 치환체, 더욱 바람직하게는 1 내지 2 개의 치환체로 치환된 헤테로시클, 헤테로시클릭 또는 헤테로시클로기를 지칭한다. 예시적인 치환체는 알킬, 치환된 알킬, 및 치환된 알킬기에 대한 예시적인 치환체로서 앞서 언급한 기를 포함하나 이에 한정되지 않는다.
용어 "헤테로아릴"은 하나 이상의 탄소 원자 함유 고리에서 하나 이상의 헤테로원자를 갖는 방향족 시클릭기(예를 들면, 5 내지 6원 모노시클릭, 7 내지 11원 바이시클릭, 또는 10 내지 16원 트리시클릭 고리계)를 지칭한다. 헤테로원자를 함유하는 헤테로아릴기의 각 고리는 질소 원자, 산소 원자 및(또는) 황 원자로부터 선택된 1, 2, 3, 또는 4 개의 헤테로원자를 가질 수 있고, 여기서 상기 질소 및(또는) 황 헤테로원자는 임의적으로 산화될 수 있고 질소 헤테로원자는 임의적으로 4급화될 수 있다. (용어 "헤테로아릴륨"은 4급 질소 원자를 가져 양성 전하를 갖는 헤테로아릴기를 지칭한다.) 헤테로아릴기는 고리 또는 고리계의 임의의 질소 원자 또는 탄소 원자에서 분자의 잔여부에 부착될 수 있다. 또한, 헤테로아릴기는 여기에 융합된 두번째 또는 세번째 카르보시클릭(시클로알킬 또는 아릴) 또는 헤테로시클릭 고리를 가질 수 있으며, 단 부착점은 헤테로아릴기이다.
예시적인 모노시클릭 헤테로아릴기는 피라졸릴, 이미다졸릴, 트리아졸릴, 옥사졸릴, 푸릴, 티아졸릴, 이속사졸릴, 티아졸릴, 피리딜[즉, ], 피리다지닐[즉, ], 피리미디닐[즉, ], 피라지닐[즉, ], 트리아지닐 등을 포함한다. 예를 들면, 피리드-2-일, 피리다진-3-일과 같이 구체적인 부착점이 언급되지 않는다면, 이러한 헤테로아릴기는 임의의 이용가능한 부착점에서 또다른 잔기에 결합할 수 있는 것으로 의도된다.
예시적인 바이시클릭 헤테로아릴기는 벤조티아졸릴, 벤족사졸릴, 벤족사디아졸릴, 벤조티에닐, 퀴놀리닐, 크로메닐, 인돌릴, 인다졸릴, 이소퀴놀리닐, 벤즈이미다졸릴, 벤조피라닐, 벤조푸릴, 벤조푸라자닐, 벤조피라닐, 키놀리닐, 퀴녹살리닐, 피롤로피리딜, 푸로피리디닐(예를 들면, 푸로[2,3-c]피리디닐, 푸로[3,2-b]피리디닐] 또는 푸로[2,3-b]피리디닐), 트리아지닐아제피닐 등을 포함한다.
"치환된 헤테로아릴"은 헤테로아릴 고리 및(또는) 여기에 융합된 임의의 고리에 대한 임의의 이용가능한 부착점에서 원자가에 따라, 하나 이상, 바람직하게는 1 내지 3 개, 더욱 바람직하게는 1 내지 2 개의 치환체로 치환된 헤테로아릴기를 지칭한다. 예시적인 치환체는 알킬, 치환된 알킬, 및 치환된 알킬기에 대한 예시적인 치환체로서 앞서 언급한 기를 포함하나 이에 한정되지 않는다.
임의적으로 치환된, 구체적으로 언급된 아릴, 헤테로아릴, 시클로알킬 또는 헤테로시클로 고리가 언급되는 경우, 임의적인 치환체는 구체적으로 언급된 기가 구성원인 고리류에 대해 앞서 언급한 군으로부터 원자가에 따라 선택될 수 있다. 예를 들면, "임의적으로 치환된 페닐"은 비치환된 페닐 고리, 및 아릴기에 대해 앞서 언급한 것들로부터 선택된 하나 이상의 치환체를 함유하는 페닐 고리를 포함한다. "임의적으로-치환된 피리딜, 피리다지닐, 피리미디닐 및 피라지닐"은 비치환된 피리딜, 피리다지닐, 피리미디닐 및 피라지닐 고리, 및 헤테로아릴기에 대해 앞서 언급한 것들로부터 선택된 하나 이상의 치환체를 함유하는 고리를 포함한다.
용어 "4급 질소"는, 예를 들면, 테트라알킬암모늄기(예를 들면, 테트라메틸암모늄, N-메틸피리디늄) 중의 양하전된 질소, 양자화된 암모늄 종(예를 들면, 트리메틸-히드로암모늄, N-히드로피리디늄) 중의 양하전된 질소, 아민 N-옥시드(예를 들면, N-메틸-모르폴린-N-옥시드, 피리딘-N-옥시드) 중의 양하전된 질소, 및 N-아미노-암모늄기(예를 들면, N-아미노피리디늄) 중의 양하전된 질소를 비롯한 4가 양하전된 질소 원자를 지칭한다.
용어 "할로겐" 또는 "할로"는 염소, 브롬, 불소 및(또는) 요오드를 지칭한다.
용어 할로알킬은, 예를 들면, 트리클로로메틸 또는 트리플루오로메틸(CCl3 또는 CF3)을 비롯한 퍼플루오로알킬기와 같은 기를 형성하는 단일 할로 치환체 또는 다중 할로 치환체를 갖는 알킬기를 지칭한다. 할로C1-C4알킬은 하나 이상의 할로 치환체를 갖는 C1-C4알킬을 지칭한다.
용어 할로알콕시는 앞서 정의한 바와 같이 알킬 잔기가, 예를 들면, 트리플루오로메톡시와 같은 기를 형성하는 단일 할로 치환체 또는 다중 할로 치환체를 갖는 알콕시기를 지칭한다. 할로C1-C4알콕시는 하나 이상의 할로 치환체를 갖는 C1-C4알콕시를 지칭한다.
용어 "포화된"이 본 명세서에 사용된 경우 완전히 포화된 및 부분적으로 포화된 잔기를 지칭하고, 반대로, "불포화된"은 완전히 불포화된 및 부분적으로 불포화된 잔기를 지칭하는 것으로 의도된다.
관능기가 "보호된"으로 명명되는 경우, 이는 상기 기가 보호된 부위에서 원치않는 부반응을 완화시키고, 특히 방지하는 변형된 형태인 것을 의미한다. 본 명세서에 기재된 방법 및 화합물에 적합한 보호기는 표준 교본, 예를 들면 문헌[Greene, T. W. et al., Protective Groups in Organic Synthesis, Wiley, N.Y. (1999)]에 기재된 것들을 포함하나 이에 한정되지 않는다.
p38 활성을 억제하는 청구된 화합물의 능력에 대해 본 명세서에 사용된 용어 "선택적"은 p38α/β 키나아제 억제에 대한 효소 분석에서 측정할 때 본 화합물이 인간 키놈(kinome) 전체의 족 내에 속하는 다수의 다른 키나아제를 억제하는 화합물의 활성보다 현저히 큰 활성 수준을 갖는 것을 의미한다. 용어 "현저히 큰 활성"은 다른 키나아제를 억제하는 화합물의 활성, 예를 들면 약 25 개 이상의 다른 키나아제, 다른 예에서 약 50 개 이상의 다른 키나아제, 또다른 예에서 약 100 개 이상의 다른 키나아제를 억제하는 화합물의 활성에 비해 약 500배 이상 큰 p38α/β 효소 억제 활성을 갖는 하나 이상의 화합물의 활성을 포함한다. 따라서, 한 실시양태에 따른 본 명세서에 정의된 선택적 p38 억제제는 다수의 다른 키나아제 중 임의의 하나를 억제하는 것보다 500 배 이상으로 p38 키나아제의α-이성형, p38 키나아제의 β-이성형 및(또는) p38 키나아제의 α 및 β 형태 양쪽 모두를 억제할 것이다. 따라서, 예를 들면, 25 개의 다른 키나아제 샘플과의 비교를 포함하는 실시양태의 경우, p38 선택적 화합물은 개별적으로 고려한 25 개의 다른 각각의 키나아제들 중 임의의 하나(예를 들면, 일대일 비교)에 비해 500배 큰 p38α/β 키나아제 억제 활성을 가질 것이다. 본 발명의 또다른 실시양태에서, 다른 키나아제, 예를 들면, 약 25 개 이상, 약 50 개 이상, 및 또다른 예에서, 약 100 개 이상의 다른 키나아제에 비해 p38α/β 키나아제를 억제하는 활성이 약 1,000배 이상 큰 화합물이 제공된다. 또한 본 발명의 또다른 실시양태에서, 다른 키나아제, 예를 들면, 약 25 개 이상, 약 50 개 이상, 및 또다른 예에서, 약 100 개 이상의 다른 키나아제에 비해 p38α/β 키나아제를 억제하는 활성이 약 5,000배 이상 큰 화합물이 제공된다. 본 명세서에 사용된 용어 "매우 선택적"은 본 화합물이 30 개 이상의 다른 키나아제, 더욱 바람직하게는 약 50 개 이상의 다른 키나아제에 비해 p38α/β 키나아제를 억제하는 활성이 약 10,000배 이상 큰 것을 의미한다. 본 명세서에서 "다른 키나아제"를 언급하는 경우, 본 출원인은 p38α/β 키나아제 외에 당 분야에 공지된 키나아제를 지칭하는 것을 의도한다. 예를 들면, p38α/β 키나아제 외에 공지된 다양한 키나아제 및 키나아제 족들은 WO 02/062804, 및 본 명세서에 참고 문헌으로 인용되는 마닝(Manning), G. 등의 문헌[The Protein Kinase Complement of the Human Genome, Science (Washington, DC, United States)(2002), 298(5600), pp. 1912-1916, 1933-1934]에 나타나 있다. 따라서, 상기 문헌에 나타나 있는 "다른 키나아제"는 하기 키나아제 및(또는) 키나아제 족: CaMK1, CaMK2, CDK, DAPK, EMT, FGF, FMS, GSK3, LCK, PDGF-R, PKA, PCK, RAF, RIPK, LIMK-1, SYK, Met, PAK-4, PAK-5, ZC-1, STLK-2, DDR-2, 오로라(Aurora) 1, 오로라 2, Bub-1, PLK, Chk1, Chk2, HER2, JAK, raf1, MEK1, EGF-R, RSK/RSK, IGF-R, IRAK, VEGF-R, P13K, PDK, HIPK, STKR, BRD, Wnk, NKF3, NKF4, NKF5, 윌(weel) 키나아제, Src, Abl, ILK, MK-2, IKK-2, PIPK, Cdc7, Ste11, Ste20, Ste7, Tec, Trk 및(또는) Nek 등으로부터 선택된 하나 이상의 키나아제를 포함할 수 있으나 이에 한정되지 않는다. 상기는 다른 키나아제들의 예시적인 비제한적인 목록이다. 마닝은 518 개의 단백질 키나아제를 동정하였으며, 본 출원인은 p38 키나아제 외에 이러한 518 개의 단백질 키나아제 중 각각을 본 명세서에 사용된 용어 "다른 키나아제"의 정의에 포함하는 것을 의도한다.
선택성을 결정하는 활성도를 측정하는 데 사용될 수 있는 당 분야에 공지된 많은 효소 분석들이 있다. 본 출원인은 하기에 특정한 효소 분석을 기재하였으나 이는 본 명세서의 선택성의 정의에 대해 이러한 구체적인 분석의 사용으로 한정하기 위한 것이 아니다.
달리 언급이 없으면, 불만족스러운 원자가를 갖는 헤테로원자는 원자가를 만족시키기에 충분한 수소 원자를 갖는 것으로 이해되며, 이는 당업자에게 자명할 것이다.
화학식 I의 화합물은 염을 형성할 수 있으며 이 역시 본 발명의 범위 내에 속한다. 본 명세서에서 화학식 I의 화합물을 언급하는 경우 달리 언급이 없으면 그의 염에 대한 것도 포함하는 것으로 이해된다. 본 명세서에 사용된 용어 "염(들)"은 무기 및(또는) 유기산 및 염기로 형성된 산성염 및(또는) 염기성염을 나타낸다. 또한, 화학식 I의 화합물이, 예를 들면, 피리딘 또는 이미다졸이나 이에 한정되지 않는 염기성 잔기, 및, 예를 들면, 카르복실산이나 이에 한정되지 않는 산성 잔기 양쪽 모두를 함유하는 경우, 쯔비터 이온("내부염")이 형성될 수 있고, 본 명세서에 사용된 용어 "염(들)" 내에 포함된다. 비록 다른 염들도, 예를 들면, 제조 중에 사용될 수 있는 단리 또는 정제 단계에서 유용할 수 있지만 제약상 허용되는(즉, 비독성, 생리학상 허용되는) 염이 바람직하다. 화학식 I의 화합물의 염은 예를 들면, 매질, 예를 들면, 염이 침전하는 매질 또는 수성 매질 중에서 화합물 I을 소정의 양의 산 또는 염기와, 예를 들면, 등가량으로 반응시킨 후 동결건조시킴으로써 형성될 수 있다.
예를 들면, 아민 또는 피리딘 또는 이미다졸 고리이나 이에 한정되지 않는 염기성 잔기를 함유하는 화학식 I의 화합물은 다양한 유기 및 무기산과 염을 형성할 수 있다. 예시적인 산 부가염은 아세테이트(예를 들면, 아세트산 또는 트리할로아세트산, 예를 들면 트리플루오로아세트산으로 형성된 것들), 아디페이트, 알기네이트, 아스코르베이트, 아스파르테이트, 벤조에이트, 벤젠술포네이트, 비스술페이트, 보레이트, 부티레이트, 시트레이트, 캄포레이트, 캄포르술포네이트, 시클로펜탄프로피오네이트, 디글루코네이트, 도데실술페이트, 에탄술포네이트, 푸마레이트, 글루코헵타노에이트, 글리세로포스페이트, 헤미술페이트, 헵타노에이트, 헥사노에이트, 히드로클로라이드, 히드로브로마이드, 히드로요오다이드, 히드록시에탄술포네이트(예를 들면, 2-히드록시에탄술포네이트), 락테이트, 말레에이트, 메탄술포네이트, 나프탈렌술포네이트(예를 들면, 2-나프탈렌술포네이트), 니코티네이트, 니트레이트, 옥살레이트, 펙티네이트, 퍼술페이트, 페닐프로피오네이트(예를 들면, 3-페닐프로피오네이트), 포스페이트, 피크레이트, 피발레이트, 프로피오네이트, 살리실레이트, 숙시네이트, 술페이트(예를 들면, 황산으로 형성된 것들), 술포네이트(예를 들면, 본 명세서에 언급된 것들), 타르트레이트, 티오시아네이트, 톨루엔술포네이트, 예를 들면 토실레이트, 운데카노에이트 등을 포함한다.
예를 들면, 카르복실산이나 이에 한정되지 않는 산성 잔기를 함유하는 화학식 I의 화합물은 다양한 유기 및 무기 염기와 염을 형성할 수 있다. 예시적인 염기성염은 암모늄염; 알칼리 금속염, 예를 들면 나트륨염, 리튬염 및 칼륨염; 알칼리 토금속염, 예를 들면 칼슘염 및 마그네슘염; 유기 염기(예를 들면, 유기 아민) 와의 염, 예를 들면 벤자틴, 디시클로헥실아민, 히드라바민(N,N-비스(데히드로아비에틸) 에틸렌디아민과 형성됨), N-메틸-D-글루카민, N-메틸-D-글리카미드, t-부틸 아민; 및 아미노산과의 염, 예를 들면 아르기닌, 리신 등을 포함한다. 염기성 질소 함유기는 저급 알킬 할라이드(예를 들면, 메틸, 에틸, 프로필 및 부틸 클로라이드, 브로마이드 및 요오다이드), 디알킬 술페이트(예를 들면, 디메틸, 디에틸, 디부틸 및 디아밀 술페이트), 장쇄 할라이드(예를 들면 데실, 라우릴, 미리스틸 및 스테아릴 클로라이드, 브로마이드 및 요오다이드), 아르알킬 할라이드(예를 들면, 벤질 및 펜에틸 브로마이드) 등과 같은 제제를 사용하여 4급화될 수 있다.
본 발명의 화합물의 전구약 및 용매화물도 본 명세서에서 고려된다. 본 명세서에 사용된 용어 "전구약"은 대상체에 투여시, 대사 또는 화학적 과정에 의해 화학적으로 전환되어 화학식 I의 화합물, 또는 그의 염 및(또는) 용매화물을 생성하는 화합물을 나타낸다. 화학식 I의 화합물의 용매화물은, 예를 들면, 수화물을 포함한다.
화학식 I의 화합물 및 그의 염은 그들의 토토머형(예를 들면, 아미드 또는 이미노 에테르)으로 존재할 수 있다. 본 명세서에서는 이러한 모든 토토머형들을 본 발명의 일부로 고려한다.
거울상 이성체 및 부분입체 이성체를 비롯한 본 화합물의 모든 입체이성체(예를 들면, 다양한 치환체 상의 비대칭 탄소로 인해 존재할 수 있는 것들)가 본 발명의 범위 내에서 고려된다. 본 발명의 화합물의 개개의 입체이성체는, 예를 들면, 실질적으로 다른 이성체(예를 들면, 구체화된 활성을 갖는 순수 또는 실질적으 로 순수한 광학 이성체)가 없을 수 있거나, 또는, 예를 들면, 라세미체로서 또는 기타의 또는 다른 선택된 입체이성체와 함께 혼합될 수 있다. 본 발명의 키랄 중심은 IUPAC 1974 권고(Recommendations)에 의해 정의된 바와 같이 S 또는 R 배위를 가질 수 있다. 라세미 형태는 물리적 방법, 예를 들면, 분별 결정, 부분입체 유도체의 분리 또는 결정화 또는 키랄 컬럼 크로마토그래피에 의한 분리에 의해 분해될 수 있다. 개개의 광학 이성체는 통상적인 방법, 예를 들면, 광학적 활성 산과의 염 형성 후 결정화를 포함하나 이에 한정되지 않는 임의의 적합한 방법에 의해 라세미체로부터 얻을 수 있다.
본 발명의 화합물의 모든 구조적 이성체는 혼합물 또는 순수 또는 실질적으로 순수 형태로 고려된다. 본 발명의 화합물의 정의는 시클릭 탄화수소 또는 헤테로시클로 고리의 시스 및 트란스 이성체, 뿐만 아니라 시스(Z) 및 트란스(E) 알켄 이성체 양쪽 모두를 포괄한다.
본 명세서에서 화학식 I의 화합물을 언급하는 경우, 화학식 I의 화합물, 또는 그의 염, 전구약, 용매화물 또는 이성체가 생성되거나 또는 형성되는 방식에 한정이 없이, 예를 들면, 하나 이상의 부형제 또는 불순물과 함께, 순수 형태, 단리된 형태, 조 형태로 존재하든, 고체 또는 액체 형태로 존재하든, 환자에게 투여 전 제약 제제, 환자에게 투여 후 환자의 신체에서의 형태 등으로 존재하든 간에 각각의 화학식 I의 화합물, 및 각각의 그의 염, 전구약, 용매화물, 또는 이성체 단독, 또는 다른 화학식 I의 화합물, 화학식 I의 화합물의 다른 염, 전구약, 용매화물 또는 이성체와의 조합물, 또는 화학식 I 이외의 화합물과의 조합물을 지칭하는 것으 로 한다.
명세서 전체에서, 기 및 그의 치환체는 안정한 잔기 및 화합물을 제공하도록 선택될 수 있다.
별법의 실시양태
본 발명의 화합물의 별법의 부류들 및(또는) 하위부류들은 화학식 Ia, Ib 및(또는) Ic의 화합물 및(또는) 그들의 제약상 허용되는 염, 수화물, 이성체, 전구약 및(또는) 용매화물을 포함한다. 본 발명의 한 태양에 따르면, 화학식 Ia를 갖는 화합물, 및 그들의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물이 제공된다.
<화학식 Ia>
상기 식 중, R6은 C1 - 6알킬 또는 시클로프로필이고;
R2는 C1 - 6알킬, NR7R8, 및 기 NR7R8로 치환된 C1 - 4알킬로부터 선택되고;
R7 및 R8은 독립적으로 수소, C1 - 6알킬, 및 C3 -6시클로알킬로부터 선택되고, 상기 기 R7 및 R8 각각은 또한 임의적으로 OH, O(C1 - 4알킬), 헤테로아릴, 헤테로시클로, NH2, NH(C1 - 4알킬) 및(또는) N(C1 - 4알킬)2 중 하나 또는 2 개로 치환되거나, 또는 R7 및 R8은 부착된 질소 원자와 함께 시클로아미노기를 형성하고;
Q는 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐이고;
R9, R10 및 R11은 아릴 및(또는) 헤테로아릴기에 대해 본 명세서에서 정의한 임의적 치환체이다.
본 발명의 또다른 태양에 따르면, R7 및 R8이 독립적으로 수소, C1 - 6알킬 및 C3-6시클로알킬로부터 선택되고, 상기 R7 및 R8 각각은 또한 임의적으로 OH, O(C1-4알킬), 이미다졸릴, 피리딜, 테트라히드로푸릴, NH2, NH(C1 - 4알킬), N(C1 - 4알킬)2 및 N-모르폴리닐 중 하나 또는 2 개로 치환되거나, 또는 R7 및 R8은 부착된 질소 원자와 함께 모르폴리닐, 피페리디닐 또는 피페라지닐 고리를 형성하고;
Q가 페닐 또는 피리딜이고, R9, R10 및 R11이 아릴 및(또는) 헤테로아릴기에 대해 본 명세서에서 정의한 임의적 치환체인 화학식 Ia의 화합물, 및 그들의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물이 제공된다.
또다른 실시양태에서, R9, R10 및 R11이 수소, C1 - 4알킬, O(C1 - 4알킬), 할로겐,할로C1-4알킬, 시아노, S02(C1 - 4알킬) 및(또는) 니트로로부터 선택된 화학식 Ia의 화합물이 제공된다.
또한 또다른 실시양태에서, R2가 메틸, 에틸, 프로필, 부틸, 또는 NR7R8이고, R7이 수소 또는 C1 - 4알킬이고, R8이 수소, C1 - 4알킬, C3 - 6시클로알킬, 또는 OH, 메톡 시, 피리딜, 테트라히드로푸릴, NH2, NHC1 - 4알킬, N(C1 - 4알킬)2, 이미다졸릴 및 N-모르폴리닐로 치환된 C1 - 4알킬이거나; 또는 R7 및 R8이 합쳐져 모르폴리닐, 피페리디닐 또는 피페라지닐을 형성하는 화학식 Ia의 화합물이 제공된다.
본 발명의 또다른 실시양태에 따르면, 고리 Q가 기 (여기서, R10은 할로겐, 시아노 또는 트리플루오로메틸이고, X는 CH 또는 N임)인 상기 화학식 I 및(또는) Ia를 갖는 화합물 및(또는) 그의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물이 제공된다.
또한 또다른 실시양태에서, 하기 화학식 Ic를 갖는 화합물, 및 그들의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물이 제공된다
상기 식 중, R2는 앞서 정의한 바와 같고, Q는 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐이고, R9, R10 및 R11은 아릴 및(또는) 헤테로아릴에 대해 본 명세서에서 정의한 임의적 치환체이다.
또한 또다른 실시양태에서, R9, R10 및 R11이 수소, C1 - 4알킬, O(C1 - 4알킬), 할 로겐, 할로C1 - 4알킬, 시아노, SO2(C1 - 4알킬) 및(또는) 니트로로부터 선택되고; R2가 C1-4알킬, N-모르폴리닐, NH2 및(또는) NR7R8(여기서, R7은 수소 또는 C1 - 4알킬이고, R8은 C1 - 4알킬, C3 - 6시클로알킬, 또는 OH, 메톡시, 피리딜, 테트라히드로푸릴, N(CH3)2, 이미다졸릴 및(또는) N-모르폴리닐로 치환된 C1 - 4알킬임)로부터 선택되는 상기 화학식 Ia 및(또는) 화학식 Ic를 갖는 화합물이 제공된다.
본 발명의 또다른 태양은 하기 화학식 Ib를 갖는 화합물, 및 그들의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물에 관한 것이다.
<화학식 Ib>
상기 식 중, R2는 앞서 정의한 바와 같고, Q는 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐이고, R9, R10, R11 및 R13은 아릴 및(또는) 헤테로아릴기에 대해 본 명세서에서 정의한 임의적 치환체이다.
또다른 실시양태에서, R13이 저급 알킬 또는 페닐, 더욱 바람직하게는 메틸인 화학식 Ib의 화합물이 제공된다.
또다른 실시양태에서, R9, R10 및 R11이 수소, C1 - 4알킬, O(C1 - 4알킬), 할로겐, 할로C1-4알킬, 시아노, SO2(C1 - 4알킬) 및(또는) 니트로로부터 선택되고; R2가 C1-4알킬, N-모르폴리닐, NH2 및(또는) NR7R8(여기서, R7은 수소 또는 C1 - 4알킬이고, R8은 C1-4알킬, C3 - 6시클로알킬, 또는 OH, 메톡시, 피리딜, 테트라히드로푸릴, N(CH3)2, 이미다졸릴 및(또는) N-모르폴리닐로 치환된 C1 - 4알킬임)로부터 선택되는 화학식 Ib를 갖는 화합물이 제공된다.
또다른 실시양태에서, 하기 화학식을 갖는 화합물이 제공된다.
상기 식 중, R2 및 R6는 화학식 Ia의 화합물에 대해 앞서 정의한 바와 같고, Q는 하기로부터 선택될 수 있다:
상기 식 중, R30, R31, R32, R33 및 R34는 수소, 할로겐, 시아노, 트리플루오로메틸, 트리플루오로메톡시, C1 - 4알킬, O(C1 - 4알킬), 니트로 및(또는) SO2CH3로부터 선택된다.
또한 또다른 실시양태에서, 하기 화학식을 갖는 화합물이 제공된다.
상기 식 중, R2, R6 및 R13은 화학식 Ib의 화합물에 대해 앞서 정의한 바와 같고, Q는 하기로부터 선택될 수 있다:
상기 식 중, R30, R31, R32, R33 및 R34는 수소, 할로겐, 시아노, 트리플루오로메틸, 트리플루오로메톡시, C1 - 4알킬, O(C1 - 4알킬), 니트로 및(또는) SO2CH3로부터 선택된다.
화학식 Ia, Ib 및(또는) Ic의 화합물에서, 또다른 실시양태는 R2가 저급 알킬 또는 아미노, 더욱 바람직하게는 메틸 또는 아미노인 화합물을 포함한다.
당업자는, 하기 반응식 및 실시예에 나타낸 다양한 화합물 및 그의 잔기를 포함하나 이에 한정되지 않는 본 명세서의 개시내용을 참고함으로써 추가의 실시양태를 명확히 이해할 것이다.
유용성
본 발명의 화합물은 p38 키나아제, 특히 이성형 p38α 및 p38β의 억제제이 다. 따라서, 화학식 I의 화합물은 p38 키나아제 활성과 관련된 증상을 치료하는 데 유용성을 갖는다. 이러한 증상은 시토카인 수치가 p38을 통한 세포내 신호 전달의 결과로 조절되는 질환 또는 장애, 특히 시토카인 IL-1, IL-4, IL-8 및 TNF-α의 과잉생산과 관련된 질환을 포함한다. 본 명세서에 사용된 용어 "치료(하는)" 또는 "치료"는 질환 상태 및(또는) 그의 증상에 대한 대응 및(또는) 예방 수단, 예를 들면, 질환 또는 장애의 발병을 억제하거나 지연시키고, 증상 또는 질환 상태의 전부 또는 일부를 감소시키고(감소시키거나) 질환 및(또는) 그의 증상을 경감, 완화 또는 치유하기 위해 디자인된 수단을 포함한다. 본 명세서에서 "p-38α/β 키나아제"의 억제가 언급되는 경우, p38α 및 p38β 키나아제 양쪽 모두가 억제되는 것을 의미한다.
화학식 I의 화합물은 p-38α/β 키나아제 억제제로서의 활성의 측면에서 염증 질환, 자가면역 질환, 파괴성 골 장애, 증식성 장애, 혈관신생 장애, 감염성 질환, 신경퇴행성 질환, 바이러스성 질환 및 허혈성 관류 손상 상태를 치료하는 데 유용하다.
더욱 구체적으로, 본 발명의 화합물은 관절염(예를 들면, 류머티스성 관절염, 라임병 관절염, 골관절염, 외상성 관절염, 풍진 관절염, 건성성 관절염, 통풍성 관절염, 및 다른 관절염 증상), 사구체신염, 췌장염(급성 또는 만성), 당뇨병, 당뇨병성 망막증, 황반 변성, 결막염, 재생불량성 빈혈, 혈소판 감소증, 위염, 만성 갑상선염, 만성 활동성 간염, 다발 경화증, 염증성 장 질환, 궤양성 직장염, 크론병, 악액질(감염, 암 또는 심장 질환에 파생하는 악액질 포함), 치주 질환, 알츠 하미머병, 파킨슨병, 켈로이드 형성, 폐 사르코이도시스, 근 무력증, 내독소에 의해 유발된 염증 반응, 라이터 증후군, 통풍, 급성 활액막염, 대량 호중구 침윤으로 특성화된 질환, 강직성 척추염, 감기, 뇌 말라리아, 규페증, 골 흡수 질환, 고열, 감염에 의한 근육통, 골다공증, 다중 골수종 관련 골 장애, 외상성 손상에 의해 유발되는 신경퇴행성 질환 및 외상성 뇌 손상을 포함하나 이에 한정되지 않는 염증 질환을 치료하는 데 사용될 수 있다.
또한, 본 발명의 화합물은 급성 또는 만성 이식체 대 숙주 반응(예를 들면, 췌장 섬 이인자형 이식편), 급성 또는 만성 이식 거부(예를 들면, 신장, 간, 심장, 폐, 췌장, 골수, 각막, 소장, 피부 이인자형 이식편, 피부 동종이식편, 이종이식편 및(또는) 이러한 장기로부터 유래한 세포), 및 반흔 조직 형성, 습진, 아토피성 피부염, 접촉 피부염, 두드러기, 경피증, 스클레라클러마(scleraclerma) 및 건선을 포함하나 이에 한정되지 않는 피부 증상을 치료하는 데 사용될 수 있다.
또한, 본 발명의 화합물은 천식, 급성 호흡 곤란 증후군, 건초열, 알러지성 비염, 및 임의의 만성 폐 염증 질환, 예를 들면, 만성 폐쇄성 폐질환을 비롯한 알러지 및 호흡 증상을 치료하는 데 사용될 수 있다. 또한, 상기 화합물은 천식 및 알러지에서의 스테로이드 내성을 치료하는 데 사용될 수 있다.
또한, 본 발명의 화합물은 전신성 홍반성 루푸스, 애디슨병, 자가면역 다선 질환(자가면역 다선 증후군으로도 알려짐) 및 그레이브병을 포함하나 이에 한정되지 않는 자가면역 질환과 관련된 염증을 치료하는 데 사용될 수 있다. 본 발명의 화합물은 감염성 질환, 예를 들면, 패혈증, 패혈성 쇼크, 세균성 이질 및 헬리코박 터 피롤리에 사용될 수 있다.
본 화합물은 단순성 포진 유형 1(HSV-1), 단순성 포진 유형 2(HSV-2), 거대 세포 바이러스, 엡스타인-바르, 인간 면역결핍 바이러스(HIV), 급성 간염 감염(간염 A, 간염 B 및 간염 C 포함), HIV 감염 및 CMV 망막염, AIDS, ARC 또는 악성종양 및 포진을 비롯한 바이러스성 질환을 치료하는 데 사용될 수 있다.
또한, 본 발명의 화합물은 충실성 종양, 안구 신혈관화 및 영아 혈관종을 비롯한 혈관신생 장애를 치료하는 데 사용될 수 있다.
또한, 본 발명의 p38 억제제는 유발성 전염증성(pro-inflammatory) 단백질, 예를 들면, 시클로옥시게나아제-2(COX-2)로도 불리는 프로스타글라딘 엔도퍼옥시드 신테아제-2(PGHS-2)의 발현을 억제한다. 따라서, 본 발명의 화합물로 치료될 수 있는 추가의 증상들은 부종, 진통 및 통증, 예를 들면, 신경근육통, 두통, 암 또는 수술에 의해 유발된 통증, 치통 및 관절염 통증을 포함한다. 또한, 본 발명의 화합물은 그들의 COX-2 억제 활성의 측면에서, 상피 암 및 선암을 포함하나 이에 한정되지 않는 암을 치료하는 데 사용될 수 있다.
또한, 본 발명의 화합물은 혈관 폐색, 뇌경색, 뇌졸중, 및 관련된 뇌 혈관 질환(뇌혈관 사고, 일과성 허혈성 발작 포함)으로부터 유래하는 허혈을 포함하는 허혈을 치료하는 데 유용하다. 따라서, 본 화합물은 심근 경색, 관상 동맥 질환, 비-Q파 MI, 울혈성 심부전증, 심실 비대, 심장 부정맥, 불안정성 협심증, 만성 안정성 협심증, 프린즈메탈 협심증, 고혈압, 간헐성 파행, 무통성 허혈, 심장 비대, 및 말초 동맥 폐색성 질환(예를 들면, 말초 동맥 질환, 심한 하지 허혈, 절단의 예 방, 및 심혈관 이환, 예를 들면 MI, 뇌졸중 또는 사망의 예방)을 치료하는 데 사용될 수 있다.
또한, 본 발명의 화합물은 허혈 치료 활성의 측면에서 혈전증으로부터 유발되는 증상 또는 예후, 죽상동맥경화, 말초 동맥 질환, 및 하기 중 하나 이상과 관련되고(관련되거나) 이에 의해 유발되는 혈전성 또는 혈전 색전성 증상 또는 예후를 치료하는 데 유용할 수 있다: 혈전 색전성 뇌졸중(심방 세동으로부터 또는 심실 또는 대동맥 벽혈전으로부터 유래하는 것 포함), 정맥 혈전증(심부 정맥 혈전증 포함), 동맥 혈전증, 뇌 혈전증, 폐 색전증, 뇌 색전증, 혈전성향증(예를 들면, 제 5 응고인자 레이든(Factor V Leiden) 및 호모시스티네니미아(homocystinenimia)), 응고 증후군 및 응고장애(예를 들면, 파종성 혈관내 응고증), 재협착(예를 들면, 내인성 또는 외인성으로 유발된 동맥 손상 후), 심방 세동, 및 심실 확장(확장성 심근증 및 심부전증 포함). 또한, 본 발명의 화합물은 죽상경화성 질환 및 장애, 예를 들면, 죽상경화성 혈관 질환, 죽상경화판 파열, 죽상경화판 형성, 이식 죽상동맥경화, 및 혈관 개조 죽상동맥경화의 증상 또는 예후를 치료하는 데 사용될 수 있다. 또한, 본 발명의 화합물은 암, 수술, 염증, 전신 감염, 인공 표면(예를 들면, 스텐트, 인공폐, 단락, 혈관 저장통(access port), 혈관 이식체, 인공 밸브 등), 심혈관 중재술, 예를 들면, 관상동맥 확장술(PTCA), 부동, 투약(예를 들면, 경구 피임약, 호르몬 대체 요법 및 헤파린), 임신 및 태아 손실, 및 망막증, 신장병 및 신경질환을 비롯한 당뇨 합병증과 관련된 혈전성 또는 혈전 색전성 상태의 증상 또는 예후를 치료하는 데 사용될 수 있다.
본 발명의 화합물은 조직의 보존, 예를 들면, 장기 이식 및 외과적 수술에 관련된 조직의 보존에 사용될 수 있다. 본 화합물은 허혈 증상과 관련된 다른 조직 또는 근육에서의 질환 또는 장애를 치료하고(치료하거나) 조직 및 근육의 강도 또는 안정성을 강화시키는 데 사용될 수 있다. 예를 들면, 본 화합물은 근육 세포 손상 및 괴사를 치료하고(치료하거나) 운동선수의 성적(athletes' performance)을 향상시키는 데 사용될 수 있다.
본 발명의 화합물을 사용하여 치료될 수 있는 추가의 질환 및 장애는 과민성 대장 증후군, 백혈병, CNS 장애(뇌 허혈, 예를 들면 뇌경색, 뇌 부종 등과 관련됨), 및 평활근 세포, 혈관사이 세포 및 혈관아세포의 증식과 관련된 질환을 포함한다. 이러한 질환은 신장 섬유증, 간 섬유증, 전립선 비대 및 폐 섬유증을 포함한다.
또한, 본 발명의 화합물은 수의학적 바이러스성 감염, 예를 들면, 말 감염성 빈혈 바이러스를 포함하나 이에 한정되지 않는 렌티바이러스 감염; 또는 고양이 면역결핍 바이러스, 우태 면역결핍 바이러스, 및 개 면역결핍 바이러스를 포함하는 레트로 바이러스 감염을 치료하는 데 사용될 수 있다.
용어 "p38 관련 증상" 또는 "p38 관련 질환 또는 장애"가 본 명세서에 사용된 경우, 각각은 앞서 반복하여 상세히 설명한 모든 증상, 뿐만 아니라 p38 키나아제 활성에 의해 조절되는 임의의 다른 증상을 포함하는 것으로 의도된다.
따라서, 본 발명은 유효량의 하나 이상의 화학식 I의 화합물, 또는 그의 제약상 허용되는 염, 수화물, 또는 전구약을 치료를 필요로 하는 대상체에게 투여하 는 것을 포함하는 이러한 증상을 치료하는 방법을 제공한다. p38 키나아제 관련 증상을 치료하는 방법은 화학식 I의 화합물을 단독으로 또는 서로 및(또는) 다른 적합한 치료제, 예를 들면, 항염증 약물, 항생제, 항바이러스제, 항산화제, 콜레스테롤/지질 저하제, 항증식제를 비롯한 항종양제, 및 허혈 치료에 사용되는 제제와 함께 투여하는 것을 포함할 수 있다.
본 발명의 화합물과 함께 사용될 수 있는 적합한 다른 항염증제의 예는 아스피린, 크로몰린, 네도크로밀(nedocromil), 테오필린(theophyline), 질루톤(zileuton), 자피르루카스트(zafirlukast), 몬테루카스트(monteleukast), 프란루카스트(pranleukast), 인도메타신(indomethacin) 및 리폭시게나아제 억제제; 비스테로이드성 항염증제(NSAID)(예를 들면, 이부프로펜 및 나프록신); TNF-α 억제제(예를 들면, 테니답(tenidap) 및 라파마이신(rapamycin) 또는 그의 유도체), 또는 TNF-α 길항제(예를 들면, 인플릭시맙(infliximab), 엔브렐(enbrel), D2E7, OR1384), 시토카인 조절제(예를 들면 TNF-α 전환 효소 [TACE] 억제제, 인터루킨-1 전환 효소(ICE) 억제제, 인터루킨-1 수용체 길항제), 프레드니손(prednisone), 덱사메타손(dexamethasone), 엔브렐(Enbrel)(등록상표), 시클로옥시게나아제 억제제(즉, COX-1 및(또는) COX-2 억제제, 예를 들면, 나프록센(Naproxen)(등록상표), 셀레브렉스(Celebrex)(등록상표), 또는 비옥스(Vioxx)(등록상표)), CTLA4-Ig 작용제/길항제(LEA29Y), CD40 리간드 길항제, IMPDH 억제제(예를 들면, 미코페놀레이트[셀셉트(CellCept)(등록상표)] 및 VX-497), 인테그린(integrin) 길항제, 알파-4 베타-7 인테그린 길항제, 세포 유착 억제제, 인터페론 감마 길항제, ICAM-1, 프로스타글 라딘 합성 억제제, 부데소니드(budesonide), 클로파지민(clofazimine), CNI-1493, CD4 길항제(예를 들면, 프릴리지맙(priliximab)), 다른 p38 미토겐 활성화 단백질 키나아제 억제제, 단백질 타이로신 키나아제(PTK) 억제제, IKK 억제제, 과민성 대장 증후군 치료제(예를 들면, 젤마크(Zelmac)(등록상표), 젤노름(Zelnorm)(등록상표), 및 막시(Maxi)-K(등록상표) 개방제, 예를 들면 미국 특허 제 6,184,231 B1호에 개시된 것들), 또는 다른 NF-κB 억제제(예를 들면, 미국 특허 제 4,200,750호에 기재된 칼포스틴(calphostin), CSAID 및 퀴녹살린); 코르티코스테로이드(예를 들면, 베클로메타손(beclomethasone), 트리암시놀론(triamcinolone), 부데소니드, 플루티카손(fluticasone), 플루티솔리드(flunisolide), 덱사메타손, 프레드니손 및 덱사메타손); 해리된 스테로이드; 케모킨 수용체 조절제(CCR1, CCR2, CCR3, CCR4 및 CXCR2 수용체 길항제 포함); 분비성 및 시토졸성 포스포리파아제 A2 억제제, VLA4 길항제, 글루코코르티코이드, 살리실레이트, 일산화질소 및 다른 면역억제제, 및 핵 전위 억제제, 예를 들면 데옥시스페르구알린(DSG)을 포함한다.
통증 치료를 위해, 본 발명의 화합물을 아스피린, NSAID, 또는 5-HT 1 수용체 작용제, 예를 들면, 부스피론, 수미트립탄(sumitriptan), 엘레트립탄(eletriptan) 또는 리자트립탄(rizatriptan)과 병용할 수 있다.
본 발명의 화합물과 함께 사용할 수 있는 적합한 항생제의 예는 β-락탐(예를 들면, 페니실린, 세팔로스포린 및 카르보페남); β-락탐 및 락타마아제 억제제(예를 들면, 오가멘틴(augamentin)); 아미노글루코시드(예를 들면, 토브라마이신(tobramycin) 및 스트렙토마이신); 마크로라이드(macrolide)(예를 들면, 에리트로 마이신 및 아지트로마이신); 퀴놀론(예를 들면, 시프로(cipro) 및 테퀸(tequin)); 펩티드 및 뎁토펩티드(예를 들면, 반코마이신, 시너시드 및 답토마이신); 대사체계 항생제(예를 들면, 술폰아미드 및 트리메토프림); 다환계(예를 들면, 테트라사이클린 및 리팜핀(rifampin)); 단백질 합성 억제제(예를 들면, 지복스(zyvox), 클로로페니콜, 클린다마이신 등); 및 니트로계 항생제(예를 들면, 니트로푸란 및 니트로이미다졸)를 포함한다.
본 발명의 화합물과 함께 사용하기 적합한 항바이러스제의 예는 뉴클레오시드계 억제제, 프로테아제계 억제제 및 바이러스 조립 억제제를 포함한다.
본 발명의 화합물과 병용하기 적합한 항골다공증제의 예는 알렌드로네이트(alendronate), 리제드로네이트(risedronate), PTH, PTH 단편, 락록시펜, 칼시토닌, RANK 리간드 길항제, 칼슘 감지 수용체 길항제, TRAP 억제제, 선택적 에스트로겐 수용체 조절제(SERM) 및 AP-1 억제제를 포함한다.
본 발명의 화합물과 병용하기 적합한 항산화제의 예는 지질 과산화 억제제, 예를 들면, 프로부콜(probucol), BO-653, 비타민 A, 비타민 E, AGI-1067 및 α-리포산을 포함한다.
또한, 본 발명의 화합물은 스테로이드 또는 비스테로이드성 프로게스테론 수용체 작용제("PRA"), 예를 들면, 레보노르게스트렐(levonorgestrel), 메드록시프로게스테론 아세테이트(MPA)와 병용된다.
또한, 본 발명의 화합물은 항당뇨제, 예를 들면, 바이구아니드(예를 들면, 메트포르민(metformin)), 글루코시다아제 억제제(예를 들면 아카보오스 (acarbose)), 인슐린(인슐린 분비촉진제 또는 인슐린 감작제 포함), 메글리티니드(meglitinide)(예를 들면 레파글리니드(repaglinide)), 술포닐우레아(예를 들면, 글리메피리드(glimepiride), 글리부리드(glyburide) 및 글리피지드(glipizide)), 바이구아니드/글리부리드 조합물(예를 들면, 글루코반스(glucovance)), 티오졸리딘디온(예를 들면 트로글리타존(troglitazone), 로시글리타존(rosiglitazone) 및 피오글리타존(pioglitazone)), PPAR-알파 작용제, PPAR-감마 작용제, PPAR알파/감마 이중 작용제, SGLT2 억제제, 지방산 결합 단백질(aP2) 억제제, 예를 들면 2000년 3월 6일 출원되고 본 양수인에게 양도된 미국 특허 출원 제 09/519,079호에 개시된 것들, 글루카곤 유사 펩티드-1(GLP-1), 글루카곤 포스포릴라아제 및 디펩티딜 펩티다아제 IV(DP4) 억제제와 병용될 수 있다.
또한, 본 화합물은 치료적 이익을 위해 세포 내 cAMP 또는 cGMP 수치를 상승시키는 제제와 함께 사용될 수 있다. 예를 들면, 본 발명의 화합물은 PDE1 억제제(예를 들면, 문헌[Journal of Medicinal Chemistry, Vol. 40, pp. 2196-2210 [1997]]에 기재된 것들), PDE2 억제제, PDE3 억제제(예를 들면, 레비지논, 피모벤단(pimobendan) 또는 올프리논(olprinone)), PDE4 억제제(예를 들면, 롤리프람(rolipram), 실로밀라스트(cilomilast) 또는 피클라밀라스트(piclamilast)), PDE7 억제제, 또는 다른 PDE 억제제, 예를 들면 디피리다몰, 실로스타졸(cilostazol), 실데나필(sildenafil), 덴부틸린, 테오필린(1,2-디메틸크산틴), 아리플로(ARIFLO)(상표명)(즉, 시스-4-시아노-4-[3-(시클로펜틸옥시)-4-메톡시페닐]시클로헥산-1-카르복실산), 아로필린(arofyline), 로플루밀라스트(roflumilast), C-11294A, CDC- 801, BAY-19-8004, 시팜필린(cipamfylline), SCH351591, YM-976, PD-189659, 메시오프람(mesiopram), 푸마펜트린(pumafentrine), CDC-998, IC-485 및 KW-4490을 비롯한 포스포디에스테라아제 억제제와 병용되는 경우 유리한 효과를 제공할 수 있다.
또한, 본발명의 화합물은 항암 요법 및 화학요법, 예를 들면, 탁솔 및(또는) 시스플라틴과의 병용에도 유용하다. 본 화합물은 항종양제, 예를 들면 파클리탁셀(paclitaxel), 아드리아마이신(adriamycin), 에피틸론(epithilones), 시스플라틴(cisplatin) 및 카르보플라틴(carboplatin)과 병용할 수 있다.
본 발명의 화합물은 허혈 치료의 유용성의 측면에서, 에프라펩틴(efrapeptin), 올리고마이신(oligomycin), 오토베르틴(autovertin) B, 아지드, 및 2001년 12월 10일 출원되고 본 양수인에게 양도된 US 특허 출원 제 10/315,818호에 기재된 화합물을 비롯한 F1F0-ATPase 억제제; -알파- 또는 베타- 아드레날린 작동 차단제(예를 들면, 프로프라놀올(propranolol), 나돌올(nadolol), 카르베딜올(carvedilol) 및 프라조신(prazosin)), 또는 β-아드레날린 작용제(예를 들면, 알부테롤(albuterol), 테르부탈린(terbutaline), 포르모테롤(formoterol), 살메테롤(salmeterol), 비톨테롤(bitolterol), 필부테롤(pilbuterol) 및 페노테롤(fenoterol)), 항협심증 약제, 예를 들면, 니트레이트, 예를 들면 소듐 니트레이트, 니트로글리세린, 이소소르비드 모노니트레이트, 이소소르비드 디니트레이트 및 니트로바소딜라터(nitrovasodilator); 클래스 I 제제(예를 들면, 프로파레논 (propafenone)), 클래스 II 제제(프로프라놀올), 클래스 III 제제(예를 들면, 소탈올(sotalol), 도페틸리드(dofetilide), 아미오다론(amiodarone), 아지밀리드(azimilide) 및 이부틸리드(ibutilide)), 클래스 IV 제제(예를 들면, 딜티아젬(diltiazem) 및 버라파밀(verapamil))을 비롯한 항부정맥 약제; K+ 채널 조절제, 예를 들면 IAch 억제제 및 K+ 채널 개방제의 Kν1 아족의 억제제, 예를 들면 IKur 억제제(예를 들면, 2000년 12월 5일 출원된 미국 특허 출원 제 09/729,731호에 개시된 화합물); 및 간극 연접(gap-junction) 조절제, 예를 들면, 커넥션(connexions); 아스피린, 와르파린(warfarin), 시멜라그트란(ximelagtran), 저분자량 헤파린(예를 들면, 러브녹스(lovenox), 에녹사파레인(enoxaparain) 및 달테파린(dalteparin))을 비롯한 항응고제 또는 항혈전제; 항혈소판 제제, 예를 들면, GPIIb/GPⅢa 차단제(예를 들면, 아브식시맵(abciximab), 엡티피바티드(eptifibatide) 및 티로피반(tirofiban)); 트롬복산 수용체 길항제(예를 들면, 이페트로반(ifetroban)); P2Y1 및 P2Y12 길항제(예를 들면, 클로피도그렐(clopidogrel), 티클로피딘(ticlopidine), CS-747, 및 아스피린/클로피도그렐 조합물); 및 인자(Factor) Xa 억제제(예를 들면, 폰다프리눅스(fondaprinux)); 및 이뇨제, 예를 들면, 나트륨-수소 교환 억제제, 클로로티아지드, 히드로클로로티아지드, 플루메티아지드, 히드로플루메티아지드, 벤드로플루메티아지드, 메틸클로로티아지드, 트리클로로메티아지드, 폴리티아지드, 벤즈티아지드, 에타크린산 트리크리나펜, 클로르탈리돈, 푸로세미드, 무솔리 민(musolimine), 부메타니드(bumetanide), 트리암트레넨(triamtrenene) 및 아밀로리드(amiloride)와 병용될 수 있다.
또한, 본 발명의 화합물은 HMG-CoA 리덕타아제 억제제(예를 들면, 프라바스타틴(pravastatin), 심바스타틴(simvastatin), 아토르바스타틴(atorvastatin), 플루바스타틴(fluvastatin), 세리바스타틴(cerivastatin), AZ4522, 이타바스타틴(itavastatin) [닛산/코와(Nissan/Kowa)]), ZD-4522(a.k.a. 로수바스타틴(rosuvastatin), 아타바스타틴(atavastatin) 또는 비사스타틴(visastatin), 프라바콜(pravachol), 스쿠알렌 신테타아제 억제제, 피브레이트, 담즙산 제거제 (예를 들면, 퀘스트란(questran)), 니아신 및 니아신/스타틴 조합물, 리포옥시게나아제 억제제, 회장 Na+/담즙산 보조전달제 억제제, ACAT1 억제제, ACAT2 억제제, 이중 ACAT1/2 억제제, 마이크로솜성(microsomal) 트리글리세리드 수송 단백질 억제제(예를 들면, 미국 특허 제 5,739,135호, 제 5,712,279호 및 제 5,760,246호에 개시됨), 콜레스테롤 흡수 억제제(예를 들면, 제티아(Zetia)(등록상표)), 콜레스테롤 에스테르 전달 단백질 억제제(예를 들면, CP-529414), PPAR-델타 작용제, PPAR-알파 작용제, 이중 PPAR-알파/델타 작용제, LXR-알파 작용제, LXR-베타 작용제, LXR 이중 알파/베타 작용제 및 SCAP 조절제를 비롯한 지질 프로파일 조절제 및 항죽상경화성 제제와 병용될 수 있다.
본 발명의 화합물과 다른 치료제와의 병용으로 부가의 상승 효과를 얻을 수 있다. 이러한 병용은 투여 효능을 증가시키거나 또는 투여량을 감소시켜 가능한 부작용을 줄이는 데 유리할 수 있다.
상기 다른 치료제들은 본 발명의 화합물과 병용된 경우, 예를 들면, 의사 처방 참고집(Physicians' Desk Reference; PDR)에 지시된 양 또는 당업자에 의해 다른 방식으로 결정된 양으로 사용될 수 있다. 본 발명의 방법에서, 이러한 다른 치료제(들)는 본 발명의 화합물의 투여 전, 투여와 동시에 또는 투여 후 투여될 수 있다.
또한 본 발명은 상기와 같이 TNF-α, IL-1 및(또는) IL-8 매개 상태를 비롯한 p38-키나아제 관련 증상을 치료할 수 있는 제약 조성물을 제공한다. 본 발명의 조성물은 상기와 같이 다른 치료제들을 함유할 수 있다. 제약 조성물은 통상적인 고체 또는 액체 비히클 또는 희석제, 및 기술, 예를 들면, 제약 제제 분야에 공지된 것들에 따른 원하는 투여 방식에 적합한 유형의 제약상 첨가제(예를 들면, 부형제, 결합제, 방부제, 안정화제, 향미제 등)를 사용하여 제제화될 수 있다.
화학식 I의 화합물은 치료될 증상에 적합한 임의의 수단에 의해 투여될 수 있으며, 이는 부위 특이적 치료의 필요성 또는 전달될 약물의 양에 따라 좌우될 수 있다. 비록 다른 전달 방식들이 고려될 수 있지만, 일반적으로, 피부 관련 질환에 대해서는 국소 투여가 바람직하며, 암 또는 암 이전 증상에 대해서는 전신 치료가 바람직하다. 예를 들면, 본 화합물은 경구(예를 들면, 정제, 캡슐, 과립, 분말, 또는 시럽을 비롯한 액체 제제의 형태); 국소(예를 들면, 용액, 현탁액, 겔 또는 연고의 형태); 설하; 볼(buccal); 비경구(예를 들면, 피하, 정맥내, 근육내 또는 복장내 주사 또는 주입 기술(예를 들면, 멸균 주사성 수용액 또는 비수용액 또는 현탁액으로)에 의함); 비강(예를 들면, 흡입 스프레이에 의함); 국소(예를 들면, 크림 또는 연고의 형태); 직장(예를 들면, 좌약의 형태); 또는 리포좀으로 전달될 수 있다. 비독성의 제약상 허용되는 비히클 또는 희석제를 함유하는 투여량 단위 제제를 투여할 수 있다. 본 화합물은 즉시 방출 또는 연장 방출에 적합한 형태로 투여될 수 있다. 즉시 방출 또는 연장 방출은 적합한 제약 조성물을 사용하여, 또는 특히 연장 방출의 경우 장치, 예를 들면, 피하 임플란트 또는 삼투압 펌프를 사용하여 달성될 수 있다.
국소 투여에 대한 예시적인 조성물은 국소 담체, 예를 들면, 폴사스티베이스(PLASTEBASE)(등록상표)(폴리에틸렌으로 겔화된 광유)를 포함한다.
경구 투여에 대한 예시적인 조성물은, 예를 들면, 벌크 제공용 미세결정성 셀룰로오스, 현탁제로서의 알긴산 또는 소듐 알기네이트, 점도 향상제로서의 메틸셀룰로오스, 및 감미제 또는 향미제, 예를 들면 당업계에 공지된 것들을 함유할 수 있는 현탁액; 및 예를 들면, 미세결정성 셀룰로오스, 제2 인산디칼슘, 전분, 마그네슘 스테아레이트 및(또는) 락토오스를 함유할 수 있는 즉시 방출 정제, 및(또는) 다른 부형제, 결합제, 연장제, 붕해제, 희석제 및 윤활제, 예를 들면, 당업계에 공지된 것들을 포함한다. 또한, 본 발명의 화합물은, 예를 들면, 성형, 압축 또는 냉동건조 정제를 사용하여 설하 및(또는) 볼 투여에 의해 경구로 전달될 수 있다. 예시적인 조성물은 속용형 희석제, 예를 들면, 만니톨, 락토오스, 슈크로오스 및(또는) 시클로덱스트린을 포함할 수 있다. 또한, 고 분자량 부형제, 예를 들면, 셀룰로오스(아비셀(AVICEL)(등록상표)) 또는 폴리에틸렌 글리콜(PEG); 점막 유착을 돕는 부형제, 예를 들면, 히드록시프로필 셀룰로오스(HPC), 히드록시프로필 메틸 셀룰로오스(HPMC), 소듐 카르복시메틸 셀룰로오스(SCMC) 및(또는) 말레산 무수물 공중합체(예를 들면, 간트레즈(GANTREZ)(등록상표)); 및 방출 제어제, 예를 들면, 폴리아크릴성 공중합체(예를 들면, 카르보폴(CARBOPOL)934(등록상표))도 이러한 제제에 포함될 수 있다. 또한, 윤활제, 유동화제, 향미제, 착색제 및 안정화제도 제작 및 사용의 편의를 위해 첨가될 수 있다.
비강 에어로졸 또는 흡입 투여에 대한 예시적인 조성물은, 예를 들면, 벤질 알코올 또는 다른 적합한 방부제를 함유할 수 있는 용액, 흡수 및(또는) 생체이용율을 증진시키는 흡수 촉진제, 및(또는) 다른 가용화제 또는 분산제, 예를 들면, 당업계에 공지된 것들을 포함한다.
비경구 투여에 대한 예시적인 조성물은, 예를 들면, 적합한 비독성의 비경구적으로 허용되는 희석제 또는 용매, 예를 들면, 만니톨, 1,3-부탄디올, 물, 링거(Ringer) 용액, 등장성 염화나트륨 용액, 또는 합성 모노- 또는 디글리세리드를 비롯한 다른 적합한 분산제 또는 습윤화제 및 현탁제, 및 올레산을 비롯한 지방산을 함유할 수 있는 주사성 용액 또는 현탁액을 포함한다.
직장 투여에 대한 예시적인 조성물은, 예를 들면, 상온에서 고체이지만 직장 강에서 액화되고(되거나) 용해되어 약물을 방출하는 적합한 비자극성 부형제, 예를 들면, 코코아 버터, 합성 글리세리드 에스테르 또는 폴리에틸렌 글리콜을 함유할 수 있는 좌약을 포함한다.
본 발명의 화합물의 유효량은 당업자에 의해 결정될 수 있고, 포유류의 경 우, 체중 1 kg 당 하루 당 활성 화합물 약 0.05 내지 100 mg의 예시적인 투여량을 포함하며, 여기서 이는 단일 투여 또는 개개의 분할 투여의 형태, 예를 들면, 하루 1 내지 4 회로 투여될 수 있다. 임의의 특정 대상체에 대한 구체적인 투여량 및 투여 빈도는 변할 수 있고, 사용되는 특이적 화합물의 활성, 대사 안정성 및 화합물의 작용 기간, 종, 연령, 체중, 일반적인 건강 상태, 대상체의 성별 및 식이요법, 투여 방식 및 시간, 배설율, 약물 조합, 및 특정 증상의 심도를 비롯한 다양한 인자에 따라 좌우될 것이라는 점이 이해될 것이다. 치료에 바람직한 대상체는 동물, 가장 바람직하게는 포유류 종, 예를 들면, 인간, 및 가축류, 예를 들면, 개, 고양이, 말 등을 포함한다. 따라서, 본 명세서에서 용어 "환자"가 사용된 경우, 이 용어는 p38 효소 수치의 매개에 의해 영향을 받는 모든 대상체, 가장 바람직하게는 포유류 종을 포함하는 것으로 의도된다.
p38α/β 효소 및 TNF-α의 억제제로서 하기 분석 또는 당 분야에 통상의 수준 내의 그의 변형을 사용하여 화학식 I의 범위 내의 화합물의 활성에 대해 시험할 수 있다. 본 명세서의 실시예에 기재된 화합물은 놀랍게도 키나아제 억제제, 특히 p38α/β 효소의 억제제로서 유리한 활성을 나타내었다.
생물학적 분석
p38
키나아제의
생성
PCR에 의해 인간 p38α, β 및 γ 이소자임의 cDNA를 클로닝하였다. 이들 cDNA를 pGEX 발현 벡터(파마시아(Pharmacia))에서 서브클로닝할 수 있다. GST-p38 융합 단백질을 대장균에서 발현시키고, 글루타티온 아가로오스를 사용하여 친화성 크로마토그래피에 의해 세균 펠릿으로부터 정제하였다. p38 융합 단백질을 내재적(constitutively) 활성 MKK6와 인큐베이션함으로써 활성화시켰다. 활성 p38을 친화성 크로마토그래피에 의해 MKK6로부터 분리시켰다. 내재적 활성 MKK6를 레인게우드(Raingeaud) 등의 문헌[Mol. Cell. Biol., 1247-1255 (1996)]에 따라 생성하였다.
LPS
자극된
PBMC
에 의한
TNF
-α 제조
헤파린화된 인간 전혈을 건강한 지원자들로부터 얻었다. 말초혈 단핵 세포(PBMC)를 피콜-히파크(Ficoll-Hypaque) 밀도 구배 원심분리에 의해 인간 전혈로부터 정제하고, 분석 매질(10 % 우태 혈청을 함유하는 RPMI 매질) 중 5 x 106/ml의 농도에서 재현탁시켰다. 50 ㎕의 세포 현탁액을 96 웰 조직 배양 플레이트에서 5 분 동안동안 RT에서 50 ㎕의 시험 화합물(0.2 % DMSO를 함유하는 분석 매질 중 4배 농도)과 인큐베이션하였다. 그 다음, 100 ㎕의 LPS(200 ng/ml 저장액)를 세포 현탁액에 첨가하고, 플레이트를 6 시간 동안 37 ℃에서 인큐베이션하였다. 인큐베이션 후, 배양 매질을 수집하고, -20 ℃에서 저장하였다. 매질 중 TNF-α 농도를 표준 ELISA 키트(파민젠(Pharmingen)-캘리포니아주 샌디에고)를 사용하여 정량화한다. TNF-α의 농도 및 시험 화합물에 대한 IC50 값(LPS 자극된 TNF-α 제조를 50 % 억제한 화합물의 농도)을 선형 회귀 분석에 의해 계산하였다.
p38
분석
분석을 V형 바닥 96 웰 플레이트에서 수행하였다. 최종 분석 부피는 분석 완충제(50 mM Tris pH 7.5, 10 mM MgCl2, 50 mM NaCl 및 1 mM DTT) 중에 효소, 기질(MBP 및 ATP) 및 시험 화합물을 20 ㎕씩 첨가함으로써 제조되어, 60 ㎕였다. 세균으로 발현된 활성화된 p38을 기질과 반응을 개시하기 전 10 분 동안 시험 화합물과 예비인큐베이션하였다. 반응을 25 ℃에서 45 분 동안 인큐베이션하고, 5 ㎕의 0.5 M EDTA를 각각의 샘플에 첨가함으로써 종결시켰다. 반응 혼합물을 스카트론 마이크로96 셀 하베스터(Skatron Micro96 Cell Harvester)(스카트론, 인크.(Skatron,Inc.))를 사용하여 예비습윤된 필터메트로 흡입시킨 다음, PBS로 세척하였다. 그 다음, 필터메트를 마이크로파 오븐에서 1 분 동안 건조시키고, 멜틸렉스(MeltilLex) A 섬광 왁스(왈락(Wallac))로 처리하고, 마이크로베타(Microbeta) 섬광 계수기 모델 1450(왈락)로 수를 세었다. 억제 데이터를 프리즘(Prizm)(그래프패드소프트웨어(GraphPadSoftware))을 사용하여 비선형 최소 제곱 회귀에 의해 분석하였다. 분석에서의 반응물의 최종 농도는 ATP 1 μM; [γ-33P]ATP, 3 nM; MBP(시그마(Sigma), #M1891), 2 ㎍/웰; p38, 10 nM; 및 DMSO, 0.3 %였다.
LPS
자극된 마우스에 의한
TNF
-α 생산
멸균 염수 중에 현탁된 50 ㎍/kg 지질다당류(LPS; 대장균 세포주 0111: B4, 시그마)를 마우스(Balb/c 여성, 6-8 주의 연령, Harlan Labs; n= 8/치료군)에 복막내 주사하였다. 90 분 후에, 마우스를 CO2:O2 흡입에 의해 안정시키고, 혈액 샘플을 얻었다. 혈청을 분리하고, 시판되는 ELISA 분석에 의해 제조자의 지시(미네소타주 미니아폴리스 소재의 알앤디 시스템스(R & D Systems))에 따라 TNF-α 농도를 분석하였다.
LPS 주사 전에 시험 화합물을 다양한 시간에서 경구 투여하였다. 본 화합물을 다양한 비히클 또는 가용화제 중의 용액 또는 현탁액으로 투여하였다.
약어
하기 제조 방법 및 실시예를 비롯한 본 명세서에서는 편의상 하기 약어들을 사용한다.
Ph = 페닐
Bz = 벤질
t-Bu = 3급 부틸
Me = 메틸
Et = 에틸
Pr = 프로필
n-프로필 또는 n-Pr= 직쇄 프로필
이소-P, iPr, 이소-Pr = 이소프로필
MeOH = 메탄올
EtOH = 에탄올
EtOAc = 에틸 아세테이트
Boc = tert-부틸옥시카르보닐
BOP = 벤조트리아졸-1-일옥시-트리스(디메틸아미노)-포스포늄 헥사플루오로포스페이트
DCM = 디클로로메탄
DCE= 1,2-디클로로에탄
DIPEA = 디이소프로필에틸아민
DMF = N,N-디메틸 포름아미드
DMF-DMA = N,N-디메틸 포름아미드 디메틸 아세탈
DMSO = 디메틸 술폭시드
DPPA = 디페닐포스포릴 아지드
EDC 또는 EDCI = 1-(3-디메틸아미노프로필)-3-에틸카르보디이미드 히드로클로라이드
HATU = O-(7-아자벤조트리아졸-1-일-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트
HOBt = 1-히드록시벤조트리아졸 히드레이트
IPA = 이소프로판올 (이소프로필 알코올)
KOH = 수산화칼륨
K2CO3 = 탄산칼륨
POCl3 = 옥시염화인
m-CPBA = m-클로로퍼벤조산
NaH = 수소화나트륨
NaOH = 수산화나트륨
p-TsOH = p-톨루엔술폰산
Pd = 팔라듐
Pd/C = 탄소상 팔라듐
TFA = 트리플루오로아세트산
THF = 테트라히드로푸란
min = 분
h 또는 hr = 시
L = 리터
mL = 밀리리터
㎕ = 마이크로리터
g = 그램
mg = 밀리그램
mol = 몰
mmol = 밀리몰
meq = 밀리등가량
RT 또는 rt = 실온
ret. t. = HPLC 체류 시간(분)
sat 또는 sat'd = 포화된
aq. = 수성
TLC = 박층 크로마토그래피
HPLC = 고성능 액체 크로마토그래피
RP HPLC = 역상 HPLC
Prep HPLC = 분취용 역상 HPLC
LC/MS = 고성능 액체 크로마토그래피/질량 분석법
MS = 질량 분석법
NMR = 핵자기 공명
mp = 융점
HPLC
조건:
YMC S5 ODS 4.6 x 50 mm 발리스틱(Ballistic) 컬럼, 4 mL/분 유량, 4 분 선형 구배 용출(출발 용매 %B = 0; 최종 용매 %B = 100), 용매 A = 10 % MeOH/ 90 % H20 / 0.2 % H3PO4. 용매 B = 90 % MeOH / 10 % H20 / 0.2 % H3PO4.
위첨자 a가 사용된 경우, 이는 하기 상태를 나타내는 것으로 의도된다.
컬럼: 페노메넥스(Phenomenex) 4.6 × 30 mm; 유량: 5 mL/분; 구배 시간: 2 분과 1 분 보유; 검출 파장: 220 nm; 출발 용매:10 % MeOH-90 % H20-0.1 % TFA; 및 최종 용매: 90 % MeOH-10 % H20-0.1 % TFA.
옥사디아졸릴 실시예(실시예 82-88)의 경우, 4 mL/분의 유량 및 4 분의 총 구배 용출 시간을 갖는 YMC S5 ODS 4.6 mm × 50 mm 발리스틱 크로마토그래피 컬럼을 사용하여 HPLC 체류 시간을 측정하였다. 상기 용출 구배는 100 %의 용매 A를 사용하고, 4 분의 용출 시간에 걸쳐 점진적으로 100 %의 용매 B로 증가시켰다(용매 A = 10 % 메탄올/90 % 물/0.2 % 인산 및 용매 B = 90 % 메탄올/10 % 물/0.2 % 인산). 용출된 생성물을 220 nm의 파장에서 uv 검출기를 사용하여 검출하였다.
마이크로파 화학: 퍼스널 케미스트리(Personal Chemistry)로부터 상업적으로 입수가능한 스미스 신테사이저(Smith Synthesizer)를 사용하여 마이크로파 반응을 수행하였다. 이 반응기는 반응 온도 및 시간 및 초과 대기압을 정밀하게 조절할 수 있게 한다.
제조 방법
화학식 I의 화합물은 하기 반응식 및 당업자의 지식에 따라 제조될 수 있다. 반응식 중의 변수(예를 들면, Q, R2-R11)는 하기 청구 범위에 정의되어 있다. 용매, 온도, 압력 및 다른 반응 조건은 당업자에 의해 용이하게 선택될 수 있다.
상기 구조 (Id)를 갖는 화학식 I의 화합물은 상기 반응식 1에 따라 제조될 수 있다. 치환된 피라졸(1-1)은 상업적으로 입수가능하거나 또는 문헌 절차에 따라 및(또는) 본 명세서에 기재된 바와 같이 제조될 수 있다. 예를 들면, 문헌[Europ. J. Org. Chem., 17, 2913-2920 (2002)]; [WO01/46172]; [Heterocycles, 53, 2775-2780 (2000)]; [J. Heterocyclic Chem., 37, 175-180 (2000)]; [Nippon Kagaku Kaishi, 10, 1144-1147 (1992)]; [Pakistan J. Scientific and Industrial Research, 30, 1-4 (1987)]; [J. Heterocyclic Chem., 16, 657-660 (1979)]; [J. Org. Chem., 21, 1240 (1956)], 및 [Joule et. al., Heterocyclic Chemistry, 3d edition, Chapter 22]을 참고할 수 있다. 상기 참고 문헌 각각은 치환된 피라졸(1-1)의 제조 방법 및(또는) 본 명세서의 화학식 I의 화합물의 제조에 유용한 다른 출발 물질 및(또는) 반응 조건을 개시하는 정도로 본 명세서에 참고 문헌으로 인용된다.
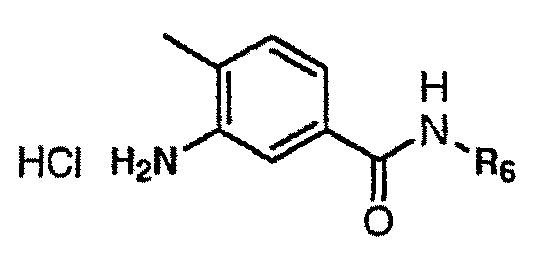
(1-1)의 가수분해는 대응하는 피라졸산(1-2)을 제공하고, 이는 아닐린(1-4) 또는 그의 염 형태(예를 들면, HCl)와 커플링하여 표준 아미드 커플링 조건 하에서 화합물(Id)을 제공할 수 있다. 별법으로, (1-2)의 카르복실산 잔기는 산 클로라이드(1-3)로 전환될 수 있고, 이는 용매, 예를 들면, DCM 중에서 DIPEA (또는 다른 염기)의 존재 하에서 벤즈아미드(1-4)와 직접 반응하여 (Id)를 제공한다. 벤즈아미드 화합물은 상업적으로 입수가능하고(하거나) 문헌에 기재된 방법을 적용하거나 또는 하기 반응식 1a 및 1b에 기재한 바와 같이 제조될 수 있다.
화합물(1-4)은 상기 반응식 1a에 개설된 바와 같이 1) CH2Cl2 중의 아민 H2N- R6 및 3-니트로-벤조일 클로라이드(1a-1)(이는 상업적으로 입수가능하거나 또는 당업자에 의해 제조될 수 있음)를 반응시켜 니트로 중간체(1a-2)를 얻고; 2) (1a-2)를 조건, 예를 들면 수소 기체 및 촉매 하에서 용매 중에서 환원시켜 아닐린(1-4)을 수득함으로써 제조될 수 있다. 그의 염 형태는 (1-4)를 적합한 산(예를 들면, HCl)과 반응시킴으로써 제조될 수 있다.
별법으로, 화합물(1-4)은 상기 반응식 1b에 개설된 바와 같이, 3-아미노-벤조산(lb-1)(이는 상업적으로 입수가능하거나 또는 당업자에 의해 제조될 수 있음)을 적합한 용매 중에서 커플링제, 예를 들면, EDC/HOBt의 존재 하에서 아민 H2N-R6와 반응시킴으로써 제조될 수 있다. 그의 염 형태는 (1-4)를 적합한 산(예를 들면, HCl)과 반응시킴으로써 제조될 수 있다.
화학식 (Ie)를 갖는 화합물은 상기 반응식 2에 도시된 바와 같이 제조될 수 있다. 아닐린(1-4)과 리튬 아세토아세테이트의 BOP 커플링으로 화합물(2-1)을 얻고, 이를 DMF-DMA와 반응시켜 화합물(2-2)을 제공할 수 있다. 그 다음, 화합물(2-2)을 히드라진과 반응시켜 화합물(Ie)을 얻을 수 있다.
할로(중간체), 아미노, 또는 C5(첨부된 청구 범위에 언급된 R2 위치)에서 알킬아미노 치환을 함유하는 피라졸은 상기 반응식 3에 따라 제조될 수 있다. 화합물(3-1)(예를 들면, 2-에톡시메틸렌-말로노니트릴 또는 2-시아노-3-에톡시-아크릴산 에틸 에스테르)과 히드라진의 반응으로 피라졸(3-2)을 얻으며, 여기서 C4 위치는 전자 끄는 기(EWG), 예를 들면, 니트릴, 메틸 또는 에틸 에스테르에 의해 치환된다. C5-아미노기의 C5-브로모기로의 전환은 tBuONO 및 브롬화구리(II)와의 반응을 통해 달성될 수 있다. 에스테르 또는 니트릴을 카르복실산으로 가수분해 한 후, 예를 들면, HATU 및 아닐린(1-4)과의 반응을 통해 아미드 결합을 형성함으로써 화합물(3-5)을 얻는다. 브로마이드를 친핵성 물질(탄소, 산소, 황, 특히 질소계 친핵성 물질)로 치환할 수 있다. 승온 및 승압에서, 마이크로파 조사 하에서 화합물(3-5)을 EtOH 중의 1차 또는 2차 아민과 반응시켜 아미노 치환된 피라졸(If)을 얻는다.
별법으로, C5-아미노 치환된 피라졸을 상기 반응식 4에 도시된 바와 같이 제조할 수 있다. 아미노피라졸(4-1)(일반적으로 상기 반응식 3에 따라 제조됨)을 적합한 염기(예를 들면, NaH)의 존재 하에서 알킬 할라이드(예를 들면, 에틸 브로마이드)와 반응시킴으로써 모노알킬화 또는 비스-알킬화하여 (4-2) 또는 (4-3)을 얻을 수 있다. 에스테르를 가수분해한 후, 예를 들면, (1-4)와의 HATU 커플링을 통해 아미드 결합을 형성하여 C5-알킬아미노 치환된 피라졸(If) 또는 (If-1)을 얻는다.
상기 반응식 5에 도시된 바와 같이, 화학식(Ig)의 화합물은 상업적으로 입수가능한 화합물(5-1)로부터 제조될 수 있다. 화합물(5-1)을 유기 용매, 예를 들면, DCE 중에서, 염기, 예를 들면, 트리에틸아민의 존재 하에서 tert-부틸 카르바제이트와 반응시켜 화합물(5-2)을 얻을 수 있다. 화합물(5-2)을 산, 예를 들면, TFA와 반응시키고, 염기, 예를 들면, 수성 탄산나트륨으로 중화시켜 화합물(5-3)을 얻을 수 있다. 옥사디아졸의 형성은 트리에틸 오르토아세테이트 중에서 화합물(5-3)을 가열시켜 화합물(5-4)을 제공함으로써 달성될 수 있으며, 이를 용매, 예를 들면, EtOH 중에서 적합한 촉매, 예를 들면, 탄소 상 팔라듐의 존재 하에서 수소로 환원시켜 화합물(5-5)을 제공할 수 있다. 그 다음, 화합물(5-5)을 용매, 예를 들면, DMF 중에서 카르복실산(6)으로 커플링하여 화합물(Ig)을 제공할 수 있다. 상기로부터, 반응식 1-4 및 6-8에서, 화학식(5-5)의 옥사디아졸릴 치환 아닐린 화합물이 반응식 1, 3 및 4에서와 같이 화학식(1-4)의 아닐린에 대해 치환되고 카르복실산 피라졸과 반응할 수 있고(있거나) 반응식 2 및 8에 도시된 바와 같이 처리되어 화학식 I의 화합물 및(또는) 그의 전구체를 제공할 수 있다는 점이 이해되어야 한다.
상기 반응식 6은 화학식(Ie)의 화합물(여기서, R2는 알킬, 아미노알킬, 또는 치환된 아미노알킬임)의 제조 방법을 도시한다. 에틸 아세토아세테이트(6-1), 예를 들면, 에틸 3-옥소부타노에이트는 용매 중에서 메탄아민, 예를 들면, 디메톡시-N-N-디메틸메탄아민(6-2)과 반응하여 중간체 화합물(6-3)을 제공할 수 있으며, 여기서 적합한 히드라진, 예를 들면, 페닐히드라진, 피리딜히드라진 등과 반응한 후 수산화나트륨을 첨가한 경우, 화학식(6-4)의 중간체 나트륨염을 제공한다. 나트륨염의 산, 예를 들면, HCl과의 반응은 화학식(6-5)의 카르복실산을 제공한다. 그 다음, 카르복실산은 용매, 예를 들면, DCM 중에서 염화술퍼릴(또한, 반응식 1 참조)과의 반응시 산 클로라이드로 전환되어 화합물(6-6)을 제공할 수 있으며, 이는 염기, 예를 들면, DIPEA의 존재 하에서 용매, 예를 들면, DCM 중에서 벤즈아미드 히드로클로라이드(1-4) (또는 별법으로, 반응식 5에서와 같이 화합물 5-5)와 반응하여 화학식 (Ie)를 갖는 화합물을 제공한다. (또한 하기 실시예 11-12 참조).
반응식 7은 반응식 6의 일반도 다음 별법의 방법을 나타내며, R2는 직접 연결된 아민기이며, 즉, 시아노 화합물 7-1은 용매 중에서 메탄아민, 예를 들면, 디메톡시-N-N-디메틸메탄아민(6-2)과 반응한 후, 용매, 예를 들면, 에탄올 중에서 적합한 히드라진, 예를 들면, 페닐히드라진, 피리딜히드라진 등과 반응한 후 수산화나트륨을 첨가하여 화학식(7-2)의 중간체 나트륨염을 제공한다. 화합물(7-2)의 아미노기는 당 분야에 공지된 원리를 사용하여 추가로 알킬아민 또는 치환된 아민기 R2가 되고(되거나) 화합물(7-2)는 본 명세서에 개시된 다른 반응식 및 방법에 혼입될 수 있다. 당업자는 화합물(7-2)의 아민에 대한 아민 보호기의 사용이 제공된 다른 반응물들에 적합할 수 있을지 여부를 숙지할 것이다.
디케텐(8-1)(여기서, R2a는 수소, 알킬, 시클로아미노, 아미노알킬(바람직하게는, 수소임)) 및 3-아미노-N-시클로프로필-4-메틸벤즈아미드 히드로클로라이드를 DCM 중에서 RT에서 DIPEA와 반응시켜 화합물(8-3)을 얻을 수 있다. RT에서 DMF-DMA를 첨가하고, DCM을 제거하여 화합물(8-4)을 얻고, 여기서 용매, 예를 들면, EtOH 중에서 적합한 히드라진(QNHNH2), 예를 들면, 임의적으로 치환된 페닐히드라진, 피리딜히드라진 등과 반응하여 화학식(Ih)의 화합물(여기서, R2a는 앞서 정의한 바와 같고, 바람직하게는 수소임)을 얻는다.
또한, 다른 화학식 I의 화합물은 일반적으로 당업자에게 공지된 절차를 사용하여 제조될 수 있다. 특히, 하기 실시예는 본 발명의 화합물의 제조에 대한 추가의 방법을 제공한다. 지금 본 발명은 본 발명의 비제한적인 예시적 실시양태인 하기 실시예에 의해 추가로 설명될 것이다. HPLC 정제를 완충제 용액으로서 물 MeOH 혼합물 및 TFA를 사용하여 C18 역상(RP) 컬럼 상에서 수행하였다. 이들 실시예는 예시를 위한 것이지 이로써 제한하기 위한 것이 아니다. 첨부된 청구 범위에 의해 정의된 본 발명의 기술 사상 및 범위에 속하는 다른 실시양태들이 존재할 수 있다.
실시예
1
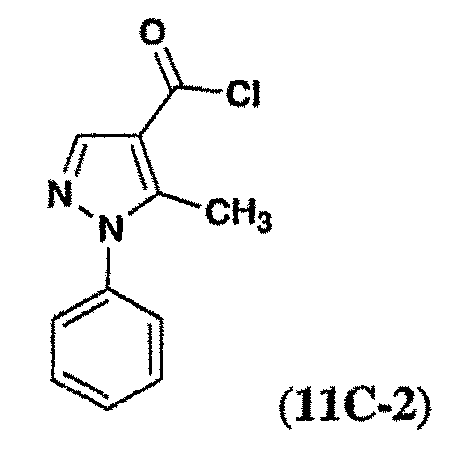
단계 A: 5-아미노-1-페닐-피라졸-4-카르복실산 클로라이드
티오닐 클로라이드(10 mL) 중의 5-아미노-1-페닐-피라졸-4-카르복실산(1.27 g, 6.24 mmol)의 현탁액을 rt에서 1.75 h 동안 교반하였다. 혼합물을 감압 하에서 농축시키고, 진공에서 건조시켜 상기 산 클로라이드 1A(1.38 g, 100 % 수율)를 황색 고체로 얻었다.
단계 B:
화합물 1A(40 mg, 0.15 mmol)를 0 ℃에서 DCM(1.5 mL) 및 피리딘(100 ㎕) 중의 3-시클로프로필카르복사미도-6-메틸아닐린(36 mg, 0.19 mmol)의 교반된 용액에 첨가하였다. 첨가 후 냉각조를 제거하고, 용액을 rt에서 15 분 동안 교반하였다. 반응 혼합물을 농축시키고, 잔류물을 잔류물을 0.5 N aq. HCl 용액(8 mL)으로 희석하였다. 침전물을 몇 분 동안 초음파 처리하고, 여과시켰다. 고체를 0.5 N aq. HCl 용액, satd. aq. NaHCO3 용액, 물로 세척하고, 진공에서 건조시켜 실시예 1(61 mg, 90 % 수율)을 백색 고체로 얻었다. LC/MS: 376.13 (M+H)+.
실시예
2
단계 A:
에틸(에톡시메틸렌)-시아노아세테이트(2.24 g, 13.3 mmol)를 무수 EtOH(16 mL) 중의 2-플루오로페닐히드라진 히드로클로라이드(1.96 g, 12.05 mmol) 및 트리에틸 아민(1.68 mL, 12.05 mmol)의 교반된 현탁액에 조금씩 첨가하였다. 혼합물을 50 분 동안 교반하고, 물로 희석하고, EtOAc로 추출하였다. 유기 추출물을 합치고, 물, 염수로 세척하고, 건조시키고(Na2SO4), 여과시키고, 감압 하에서 및 진공에서 농축하여 상기 화합물 2A(3.06 g, 정량적 수득량)를 밝은 황갈색 고체로 얻었 다. HPLC 체류 시간: 1.34 분. LC/MS: 250.13 (M+H)+.
단계 B:
2.5 N aq. NaOH 용액(31 mL) 및 THF:MeOH(64 mL, 1:1) 중의 에틸-5-아미노-1-(2-플루오로페닐)-피라졸-4-카르복실레이트 2A(3.06 g, 12.28 mmol)의 용액을 60 ℃로 8 h 동안 가열하였다. 혼합물을 감압 하에서 농축시키고, 0 ℃에서 6 N aq. HCl 용액으로 산화시켰다. 침전된 고체를 여과에 의해 수집하고, 물 및 DCM으로 세척하고, 건조시켜서 산 2B(1.72 g, 63 %)를 얻었다. 추가의 산 2B(160 mg, 6 %)는 여액으로부터 DCM을 사용하여 추출성 워크업(work up)에 의해 얻을 수 있다. HPLC 체류 시간: 0.85a 분 LC/MS: 222.08 (M+H)+.
단계 C:
티오닐 클로라이드(3.7 mL) 중의 카르복실산 2B(0.5 g, 2.26 mmol)의 용액을 RT에서 2 h 동안 교반하였다. 혼합물을 감압 하에서 및 진공에서 농축시켜 산 클로라이드 2C(624 mg, 100 % 수율)를 오렌지색 고체로 얻었다. HPLC 체류 시간 :1.11a 분.; LC/MS: 대응하는 메틸 에스테르에 대해 236.11 (M+H)+.
단계 D:
5-아미노-1-(2-플루오로페닐)-피라졸-4-카르복실산 클로라이드 2C(40 mg, 0.14 mmol)를 0 ℃에서 DCM(1.5 mL) 및 피리딘(100 ㎕) 중의 3-메틸카르복사미도-6-메틸아닐린(31 mg, 0.19 mmol)의 교반된 용액에 첨가하였다. 첨가 후 냉각조를 제거하고, 용액을 rt에서 45 분 동안 교반하고, 반응 혼합물을 농축시키고, 잔류물을 0.5 N aq. HCl 용액(8 mL)으로 희석시켰다. 침전된 고체를 몇 분 동안 초음파 처리하고, 여과시켰다. 이 고체를 0.5 N aq. HCl 용액, satd. aq. NaHCO3 용액, 물로 세척하고, 진공에서 건조시켜 상기 실시예 2(33 mg, 65 % 수율)를 밝은 황갈색 분말로 얻었다. HPLC 체류 시간: 1.20a 분 LC/MS: 368.16 (M+H)+.
실시예
3
단계 A: 5-아미노-1-페닐-4-카르보에톡시피라졸
페닐 히드라진(21.2 gm, 0.19 몰), 에틸 (에톡시메틸렌)시아노아세테이트(35 gm 0.21 몰), 및 무수 EtOH(200 ml)를 1 hr 동안 환류시켰다. 반응 부피를 반으로 감소시키고, 얼음 중에서 냉각시키고, 원하는 생성물을 여과에 의해 수집하였다. 여액 부피를 추가로 120 ml로 감소시키고, 냉각시킨 다음, 여과시켜 추가의 고체를 수집하였다. 상기 황색 고체를 합쳐 화합물 3A(41.6 gm, 94 % 수율)를 제공하였다.
단계 B: 5-아미노-페닐피라졸-4-카르복실산
화합물 3A(41 gm), THF(50 ml), MeOH(150 ml) 및 3N NaOH(100 ml)를 합치고, 4 hr 동안 환류시켰다. 대부분의 용매를 증발에 의해 제거하고, 잔여부를 1 N HCl(300 ml)로 중화시켰다. 크림색의 고체 생성물을 여과에 의해 수집하고, 세척하고, 건조시켜 화합물 3B(38 gm, 정량적 수득량)를 얻었다.
단계 C: 실시예 3
화합물 3B(7.42 gm, 36.8 mmole), 티오닐 클로라이드(5.22 gm, 1.2 eq), THF(50 ml) 및 DMF(10 방울)를 잠시 동안 환류시켰다. 흐린 반응 용액을 매질 유리 프릿을 통해 여과하고, 증발시키고, 잔류물을 9:1 헥산:디에틸 에테르(30 ml)를 사용하여 배산시켜 황색 고체 생성물을 얻었다. 이를 THF(100 ml)에 재용해시키 고, 0 ℃에서 THF 중의 3-아미노-4-메틸메틸벤즈아미드(6.0 gm) 및 피리딘(5.78 gm, 2 eq)을 함유하는 제 2 반응 용액에 천천히 첨가하였다. 반응을 밤새 교반하고, 이 시간 동안 이는 rt에 도달하였다. 반응물을 증발시키고, 고체 잔류물을 1 N HCl(2 X 50 ml), 1 N NaOH(2 X 50 ml)로 세척하고, 건조시켜 상기 실시예 3(10.2 gm, 79.8 % 수율)을 제공하였다. (M+H)+ 350.13, HPLC 체류 시간 = 1.24a.
실시예
4
단계 A:
에틸(에톡시메틸렌)시아노아세테이트(17.2 g, 101 mmol) 및 4-플루오로페닐히드라진 히드로클로라이드(15 g, 92 mmol)를 무수 EtOH(150 mL) 중에서 RT에서 혼합시키고, 트리에틸아민(13 mL, 92 mmol)을 주사기를 통해 적가하여 도입시켰다. 혼합물을 밤새 교반하고, 에테르로 희석시키고, 여과시켰다. 여액을 EtOAc(500 mL)로 희석시키고, 물(100 mL × 3), 염수로 세척하고, Na2SO4로 건조시키고, 여과 시키고, 감압 하에서 농축시켜 22.5 g(98 %)의 화합물 4A를 갈색 오일로 얻었다. HPLC 체류 시간: 2.73 분.(광역). LC/MS: 250.48 (M+H)+.
단계 B:
무수 EtOH(200 mL) 및 3 N aq. NaOH 용액(75 mL, 226 mmol) 중의 화합물 4A(22.5 g, 90.4 mmol)의 용액을 2 h 동안 환류시켰다. 혼합물을 감압 하에서 농축시키고, 물(200 mL) 중에서 취하고, DCM(100 mL × 3)으로 세척하였다. 수층을 6 N aq. HCl 용액으로 산화시키고, 침전된 고체를 여과에 의해 수집하고, 물로 세척하고, 건조시켜서 산 4B(11.6 g, 58 %)를 얻었다. HPLC 체류 시간: 1.92 분 LC/MS: 222.08 (M+H)+.
단계 C: 실시예 4
DCM 중의 카르복실산(5.5 g, 24.9 mmol)의 슬러리에 티오닐 클로라이드(2.35 mL, 32.3 mmol)를 첨가하였다. 10 분 후, DMF(3 방울)를 첨가한 다음, 용액을 RT에서 2 h 동안 교반하였다. 혼합물을 감압 하에서 농축시켜 황색 고체를 얻었다. 고체를 DCM(50 mL) 중에서 슬러리화하고, 0 ℃로 냉각시키고, 여기에 3-메틸카르복사미도-6-메틸아닐린(5.11 g, 31.1 mmol)를 고체로 첨가한 후, 15 분 동안 DCM(25 mL) 중의 피리딘(6.0 mL, 74.7 mmol)의 용액을 적가하였다. 첨가가 완결된 후에 냉각조를 제거하고, 용액을 rt에서 30 분 동안 교반하였다. 반응 혼합물을 농축시키고, 잔류물을 물(20 mL) 및 1N aq. HCl(50 mL)로 처리하였다. 생성되는 슬러리를 몇 분 동안 초음파처리하고, 여과시키고, 1 N aq. HCl 용액, 물로 세척하고, 진공에서 건조시켜 대략 9 g의 a 황색 고체를 얻었다. 상기 고체를 고온 EtOAc, 고온 에테르를 사용하여 배산시킨 다음, 아세토니트릴로 세척하고, 목탄을 사용하여 MeOH 중에서 탈색시켰다. 여액을 농축시키고, 생성되는 고체를 MeOH/아세토니트릴로 재결정화하여 상기 실시예 4를 백색 고체로 얻었다(6.27 g, 69 % 수율). HPLC 체류 시간: 2.58 분. LC/MS: 368.24 (M+H)+.
실시예
5 내지 9
상기 화학식(여기서, 변수 Q 및 R6은 표 1에 나타낸 값들을 가짐)을 갖는 실시예 5 내지 9를 실시예 1 내지 4의 제조에 기재된 절차를 따라 제조하였다. 출발 물질은 상업적으로 입수가능하거나, 본 명세서의 반응식에 따라 또는 당 분야에 공지된 절차를 사용하여 제조될 수 있다.
실시예
10
단계 A:
에틸 아세토아세테이트(100 g, 769 mmol)에 p-TsOH(333 mg, 1.75 mmol) 및 DMF-DMA(153 mL, 1150 mmol)를 첨가하였다. 용액을 100 ℃에서 2.5 hr 동안 가열한 다음, RT로 냉각시켰다. 증류 장치를 장착하고, 생성물을 진공 하에서 분별 증류에 의해 정제하여 (10A)(92.7 g, 66 %)를 황색 오일로 얻었다.
단계 B:
EtOH(5 mL) 중의 (10A)(0.424 g, 2.3 mmol)의 용액에 피리딘-2-일-히드라진(0.25 g, 2.3 mmol)을 첨가하였다. 용액을 3h 동안 65 ℃로 가열한 다음, aq NaOH(1 N, 6.9 mL, 6.9 mmol)를 첨가하고, 반응을 밤새 RT로 냉각시켰다. EtOH를 증발시키고, 생성되는 수용액을 대략 pH 3으로 산화시켰다. 생성되는 침전물을 여과에 의해 수집하고, 공기 건조시켜 (10B)를 밝은 황갈색 고체(0.38 g, 81 %)로 얻었다. HPLC 체류 시간 (분): 1.92, MW: 203.2, LCMS [M+H]+= 204.0.
단계 C:
NMP(1.0 mL) 중의 (10B)(0.041 g, 0.201 mmol)의 용액에 BOP(0.117 g, 0.265 mmol), DIPEA(0.115 mL, 0.66 mmol) 및 3-아미노-N-시클로프로필-4-메틸-벤즈아미드 히드로클로라이드(0.050 g, 0.22 mmol)를 첨가하였다. 용액을 50 ℃로 가열하고, 밤새 교반하였다. 반응을 추가의 4hr 동안 80 ℃로 가열하였다. 용액을 RT로 냉각시키고, 물(2 mL)을 첨가하였다. 생성물을 EtOAc로 추출하여 조 잔류물을 얻고, 이를 분취용 HPLC에 의해 추가 정제하여 (10)을 회백색 고체(0.032 g, 42 %)로 얻었다. HPLC 체류 시간 (분): 3.02, MW: 375.4, LCMS [M+H]+= 376.1.
실시예
10A:
실시예
10의 화합물에 대한 별법의 제조
1-(2-피리딜)-5-메틸피라졸-4-카르복실산(1.6 gm, 7.9 mmol) 및 티오닐 클로라이드(10 ml)를 RT에서 1 hr 동안 교반하였다. 반응물을 증발시키고, 잔류물을 THF(75 ml)에 재용해시켰다. 이에 3-아미노-4-메틸시클로프로필벤즈아미드(1.64 gm, 1.1 eq.) 및 THF(25 ml)를 함유하는 용액을 첨가하고, 반응을 밤새 RT에서 교반하였다. 반응물을 증발시키고, 9:1 메틸렌 클로라이드:MeOH(100 ml) 및 1 N NaOH(2 X 50 ml) 사이에, 그 다음, 1 N HCl(2 X 50 ml)에 분배시키고, 황산나트륨으로 건조시키고, 여과하고, 증발시키고, 크로마토그래피(실리카 겔, 97.5 메틸렌 클로라이드:2.5 MeOH)하여 실시예 10의 순수 생성물을 백색 고체(233 mg)로 얻었다.
실시예
11
단계 A:
5-메틸-1-페닐-1H-피라졸-4-카르복실산(0.10 g, 0.495 mmol)[(10B)의 방식과 유사한 방식으로 제조함]을 RT에서 SOCl2(2 mL)에 용해시켰다. RT에서 30 분. 동안 교반한 후, SOCl2를 증발시키고, 백색 고체로서 남은 생성물(11A)을 추가 정제 없이 바로 사용하였다.
단계 B:
DCM(2 mL) 중의 화합물(11A)의 용액에 DIPEA(0.345 mL, 1.98 mmol) 및 3-아미노-N-시클로프로필-4-메틸-벤즈아미드 히드로클로라이드(0.123 g, 0.544 mmol)를 첨가하였다. 반응을 RT에서 밤새 교반하였다. 물(4 mL)을 첨가하여 반응을 켄칭시키고, 수상을 DCM(3×3 mL)으로 추출하였다. 증발시킨 후, 유기 잔류물을 분취용 HPLC에 의해 정제하여 상기 실시예(11)를 백색 고체(0.139 g, 75 %)로 얻었다. HPLC 체류 시간 (분): 2.87, MW: 374.5, LCMS [M+H]+= 375.2.
실시예
11A-
실시예
11 제조의 별법의 절차
단계 A: 소듐 5-메틸-1-페닐-1H-피라졸-4-카르복실레이트
EtOH(200 mL) 중의 에틸 3-옥소부타노에이트(130.14 g, 1 mol) 및 디메톡시-N,N-디메틸메탄아민(119.16 g, 1 mol)의 용액을 60 ℃에서 1 h 동안 교반한 다음, RT로 냉각시켰다. 페닐히드라진(98.33 mL, 1 mol)을 용액에 첨가하고, 온도를 60 ℃ 아래로 유지시켰다. 첨가를 완결한 후, 혼합물을 60 ℃에서 1 h 동안 교반하였다. EtOH를 감압 하에서 제거하고, 잔류물을 EtOAc(1 L) 중에 용해시킨 다음, 1N HCl(50 mL), NaHCO3(100 mL), H2O 및 염수로 세척하였다. 유기 용매를 감압 하에서 제거하고, 잔류물을 EtOH(460 mL) 중에 용해시켰다. NaOH(80 g)의 수용액(100 mL)을 첨가하고, 혼합물을 65 ℃에서 2h 동안 교반하였다. 용액을 RT로 냉각시킨 후, 침전물을 여과를 사용하여 수집하고, 이소프로필 알코올로 세척하여 상기 백색 나트륨염을 얻었다. 수율 81 %.
단계 B: 5-메틸-1-페닐-1H-피라졸-4-카르복실산
단계 A(11A-2)로부터의 염을 1N HCl(500 ml) 용액 중에서 20 분 동안 교반하였다. 침전물을 여과를 사용하여 수집하고, 건조시켜 상기 산을 백색 고체(162 g, 98 % 수율)로 얻었다.
단계 C: 5-메틸-1-페닐-1H-피라졸-4-카르보닐 클로라이드
DCM(200 mL) 및 DMF(730 mg, 0.01 mol) 중의 단계 B(11B-2)로부터의 5-메틸-1-페닐-1H-피라졸-4-카르복실산(20.2 g, 0.1 mol)의 용액에 RT에서 술퍼릴 디클로라이드(8.73 mL, 0.12 mol)를 첨가하였다. 혼합물을 36 ℃에서 2h 동안 교반하였다. 용액을 감압 하에서 농축시키고, DCM(200 mL)을 백색 고체 잔류물에 첨가하여 상기 대응하는 아실 클로라이드의 현탁액을 형성하였다. 수율: 98 %.
단계 D: N-(5-(시클로프로필카르바모일)-2-메틸페닐)-5-메틸-1-페닐-1H-피라졸-4-카르복사미드(실시예 11)
DCM(300 mL) 중의 3-아미노-N-시클로프로필-4-메틸벤즈아미드 히드로클로라이드(22.6 g, 0.1 mol)의 용액에 DIPEA(41.9 mL, 0.24 mol)를 첨가하였다. 용액을 5 분. 동안 교반한 다음, 0 ℃로 냉각시키고, 단계 B로부터의 현탁액을 첨가하였다. 혼합물을 2h 동안 RT에서 교반하고, 물(200 mL)을 사용하여 켄칭하였다. 침전물을 수집하고, 물 및 DCM으로 세척한 다음, EtOH(100 mL) 및 물(100 mol) 중에서 교반하였다. 고체를 수집하고, 수중 50 % EtOH로 세척하고, 95 % EtOH 중에서 재결정화에 의해 추가 정제하여 실시예 11을 백색 고체(95 % 수율)로 얻었다.
실시예
11B-
실시예
11 제조의 별법의 절차
DCM(200 mL) 중의 3-아미노-N-시클로프로필-4-메틸벤즈아미드 히드로클로라이드(22.6 g, 0.1 mmol) 및 DIPEA (19.2 mL, 0.11 mmol)의 혼합물에 디케텐(11.6 mL, 0.15 mmol)을 첨가하고, 생성되는 용액을 RT에서 30 분 동안 교반하였다. DMF-DMA(20 mL, 0.15 mol)를 첨가하고, 용액을 RT에서 5분 동안 교반하였다. DCM을 감압 하에서 제거하였다. 잔류물을 EtOH(100 mL) 중에 용해시키고, 페닐히드라진(11.8 mL, 0.12 mol)을 첨가하였다. 용액을 1.2 시간 동안 환류시켰다. 침전물을 RT에서 수집하고, EtOH(100 mL) 중에서 재결정화에 의해 정제하여 실시예 11(28 g)을 76 % 수율의 백색 결정으로 얻었다.
실시예
12
단계 A:
EtOH(250 mL) 중의 화합물 10A(64.26 g, 0.347 mmol)(상기 실시예 10 참조)의 용액에 RT에서 1,5-디플루오로페닐히드라진(50 g, 0.347 mmol)을 수회 조금씩 첨가하였다. 내부 온도가 55 ℃에 도달하게 하면서 발열 반응을 모니터링하여 용액이 비등하는 것을 방지하였다. 그 다음, 반응물을 유조에서 65 ℃의 내부 온도로 가열하고, 밤새 교반하였다. RT로 냉각시킨 후, EtOH를 증발시키고, 생성되는 갈색 고체를 EtOAc(300 mL) 중에서 취하고, 1 N HCl(150 mL) 및 포화 aq. NaHCO3(150 mL)로 세척하였다. 두 수상을 순차적으로 EtOAc(50 mL)로 역추출하였다. 합한 유기상을 염수(150 mL)로 세척하고, Na2SO4로 건조시키고, 여과시키고, 농축시켜 에스테르 12A를 황갈색 고체로 얻었다.
단계 B:
에스테르 12A를 EtOH(160 mL) 중에서 취하고, 수(35 mL) 중 NaOH(28 g, 0.694 mmol)의 용액을 첨가하였다. 이 용액을 RT에서 4 일 동안 교반하였다. HPLC 분석에 의해 반응이 미완결되었음을 알게 되어, 2-3 h 동안 온도를 환류 바로 아래(65-70 ℃)로 하였다. 반응을 0 ℃로 냉각시키고, 생성되는 고체를 여과에 의해 수집하였다. 고체를 더 이상 색이 용출되지 않을 때까지 차가운 얼음 IPA로 세척하였다. 나트륨염 12B를 회백색 고체(76.14 g, 2 단계에 걸쳐 84.4 %)로 얻었다. 이를 공기 건조시킨 다음, 다음 단계에서 바로 사용하였다.
단계 C: 1-(2,5-디플루오로-페닐)-5-메틸-1H-피라졸-4-카르복실산
나트륨염 12B(76.1 g)을 1N HCl(500 mL)의 교반된 용액에 조금씩 첨가하였다. 1-2 h 후, 생성물을 여과에 의해 수집하고, 차가운 얼음 묽은 HCl(0.1 N)로 세척하여 1-(2,5-디플루오로-페닐)-5-메틸-1H-피라졸-4-카르복실산(12C)을 백색 고체(69.3 g, 99.4 %)로 얻었다. HPLC 체류 시간: 2.10 분; LCMS MH+ = 239.09.
단계 D:
DCM(700 mL) 중의 화합물 12C(68 g, 0.285 mmol) 및 DMF(2.1 mL)의 용액에 SOCl2(24.9 mL, 0.343 mmol)를 천천히 10-15 분 동안 첨가하였다. 반응을 RT에서 밤새 교반한 다음, 1-2 h 동안 환류시켰다. 추가의 SOCl2(5 mL)를 첨가하고, 4 h 동안 계속 가열하였다. HPLC 분석 결과 약간의 s.m.이 잔류함을 알 수 있었다. 추가의 SOCl2(5 mL) 및 DMF(1 mL)를 첨가하고, 2-3 h 동안 계속 가열하였다. 반응물을 농축시켜 화합물 12D를 회백색 고체로 얻어 다음 반응에 바로 사용하였다.
단계 E: 실시예 12
화합물 12D를 DCM(1 L) 중에서 현탁시키고, 3-아미노-N-시클로프로필-4-메틸-벤즈아미드 히드로클로라이드염(70.94 g, 0.343 mmol) 및 DIPEA(119.1 mL, 0.654 mmol)를 첨가하였다. 반응은 초기에는 발열성이어서 용액을 비등시켰다. RT에서 밤새 교반한 후, 백색 침전물이 형성되었다. 물(400 ml)을 첨가하고, 혼합물을 격렬하게 진탕시켰다. 고체를 수집하고, 물(300 mL) 및 DCM으로 세척하여 회백색 고체를 얻었다. 고체를 비등하는 EtOH(600 mL) 중에 용해시키고, 고온수(400 mL)를 포화 aq. NaHCO3(100 mL)와 함께 첨가하였다. 냉각시킨 후, 생성되는 침전물을 여과에 의해 수집하고, 차가운 얼음 1:1 EtOH:물로 세척하여 실시예 12의 생성물을 백색 결정성 고체(93.36 g, 2 단계에 걸쳐 79.8 %)로 얻었다. HPLC 체류 시간: 2.63 분; LCMS MH+= 411.13; HRMS 관측 질량 411.1641 계산 질량 411.1633 원소 분석: C22H20N4O2F2에 대한 이론치: C 64.38, H 4.91, N 13.65, F 9.25 KF: < 0.1 %, Cl: < 0.05 % 시험으로부터의 관측/실험값: C 64.17, H 4.77, N 13.64, F 9.37.
실시예
13-38
상기 화학식(여기서, 변수 Q, R2 및 R6은 표 2에 나타낸 값들을 가짐)을 갖는 실시예 13-38을 실시예 10 내지 12의 제조에 기재된 절차를 따라 제조하였다. 출발 물질은 상업적으로 입수가능하거나, 본 명세서의 반응식에 따라 또는 당 분야에 공지된 절차를 사용하여 제조될 수 있다.
실시예
39
단계 A:
DMF(1 mL) 중의 리튬 아세토아세테이트(90 %, 0.066 g, 0.611 mmol), BOP(0.270 g, 0.611 mmol) 및 DIPEA(0.106 mL, 0.611 mmol)의 용액에 3-아미노-N-시클로프로필-4-메틸-벤즈아미드 히드로클로라이드(0.115 g, 0.51 mmol)를 첨가하였다. 용액을 RT에서 밤새 교반하고, 물(4 mL)을 첨가하고, 생성물을 EtOAc로 추출하였다. 증발시킨 후, 유기 잔류물을 플레시 크로마토그래피(실리카 겔, 헥산 중 50-100 % EtOAC)에 의해 정제하여 (39A)를 백색 반고형물(0.049 g, 35 %)로 얻었다. HPLC 체류 시간 (분): 1.69, MW: 274.3, LCMS [M+H]+= 275.1.
단계 B:
DMF(0.5 mL) 중의 (39A)(0.050 g, 0.18 mmol)의 용액에 DMF-DMA(2 mL) 및 p-TsOH(0.005 g)를 첨가하였다. 반응을 RT에서 2 hr 동안 교반한 다음, 과량의 DMF-DMA를 감압 하에서 증발시켰다. (39B)의 생성되는 DMF 용액을 추가 정제 없이 후속 반응에 사용하였다.
단계 C:
(39B)의 조 DMF 용액에 EtOH(1 mL) 및 2-메톡시페닐히드라진(0.377 g, 2.73 mmol)을 첨가하였다. 용액을 RT에서 45 분 동안 교반한 다음, 60 ℃로 1.5 hr 동안 교반하였다. 분취용 HPLC에 의해 정제하여 상기 실시예 39를 밝은 황갈색 고체(0.0085 g, 12 %)로 얻었다. HPLC 체류 시간 (분): 2.79, MW: 404.5, LCMS [M+H]+= 405.2.
실시예
40-51
상기 화학식(여기서, 변수 Q는 하기 표 3에 나타낸 값을 가짐)을 갖는 실시예 40-51을 실시예 39의 제조에 기재된 절차를 따라 제조하였다. 출발 물질은 상업적으로 입수가능하거나, 본 명세서의 반응식에 따라 또는 당 분야에 공지된 절차를 사용하여 제조될 수 있다.
실시예
52
단계 A:
아세토니트릴(2 mL) 중의 5-아미노-1-페닐-1H-피라졸-4-카르복실산 에틸 에스테르(0.25 g, 1.05 mmol) 및 브롬화구리(II)(0.281 g, 1.26 mmol)의 용액에 0 ℃에서 tert-부틸니트리트(0.167 mL, 1.26 mmol)를 적가하였다. 반응물을 RT로 2 hr에 걸쳐 가온한 다음, 밤새 RT에서 교반하였다. EtOAC(8 mL)를 사용하여 반응물이 층을 형성하게 하고, 1N aq. HCl(2×3 mL), 물(1×3 mL), 염수(1×3 mL)로 세척하였다. 유기 상을 MgSO4로 건조시키고, 여과시키고, 증발시켜 (52A)를 황색 고체(0.304 g, 98 %, 85 % AP HPLC)로 얻었다. HPLC 체류 시간 (분): 3.62, MW: 295.13, LCMS [M+H]+= 295.3.
단계 B:
THF(1 mL) 중의 화합물(52A)(0.025 g, 0.085 mmol)의 용액에 0 ℃에서 aq. NaOH(1 N, 0.25 mL, 0.25 mmol)를 첨가하였다. 용액을 RT로 밤새 가온시킨 다음, 3-4 hr 동안 50 ℃로 가열하였다. THF를 증발시키고, 수용액을 대략 pH 3으로 산화시켰다. 생성되는 침전물을 여과에 의해 수집하고, 공기 건조시켜 (52B)를 회백색 고체(0.015 g, 64 %)로 얻었다. HPLC 체류 시간 (분): 2.54, LCMS [M+H]+= 267.1, 269.1.
단계 C:
DMF(2 mL) 중의 (52B)(0.109 g, 0.41 mmol)의 용액에 HATU(0.233 g, 0.613 mmol), DIPEA(0.276 mL, 1.52 mmol) 및 3-아미노-N-시클로프로필-4-메틸-벤즈아미드 히드로클로라이드(0.12 g, 0.530 mmol)를 첨가하였다. 용액을 65 ℃에서 4 hr 동안 교반하였다. RT로 냉각시킨 후, 물(8 mL)을 첨가하고, 생성되는 침전물을 여과에 의해 수집하고, 공기 건조시켜 52C를 황갈색 고체(0.112 g, 63 %)로 얻었다. HPLC 체류 시간 (분): 2.92, MW: 439.3, LCMS [M+H]+= 439.1.
단계 D:
EtOH(1 mL) 중의 (52C)(0.020 g, 0.455 mmol)의 용액에 과량의 에틸아민(H20 중의 70 중량%, 1 mL)을 첨가하였다. 용액을 압력 마개로 캡핑된 퍼스널 케미스트리 스미스 신테사이즈 마이크로웨이브(Smith Synthesize Microwavw) 반응기 바이알에 위치시키고, 자동화 마이크로파 반응기에서 150 ℃에서 2h 동안 가열하였다. 용매를 증발시키고, 잔류물을 분취용 HPLC에 의해 정제하여 실시예 52(0.0098 g, 53 %)을 회백색 고체로 얻었다. HPLC 체류 시간 (분): 3.59, MW: 403.5, LCMS [M+H]+= 404.2.
실시예
53-74
상기 화학식(여기서, 변수 R2는 하기 표 4에 나타낸 값을 가짐)을 갖는 실시예 53-74를 실시예 52의 제조에 기재된 절차를 따라 제조하였다. 출발 물질은 상업적으로 입수가능하거나, 본 명세서의 반응식에 따라 또는 당 분야에 공지된 절차를 사용하여 제조될 수 있다.
실시예
75
단계 A:
MeOH(30 mL) 중의 피리딘-2-일-히드라진(5.0 g, 45.9 mmol)의 용액에 RT에서2-에톡시메틸렌-말로노니트릴(5.5 g, 50.5 mmol)을 수회 조금씩 첨가하였다. 혼합물을 3h 동안 가열하여 환류시킨 다음, -20 ℃로 냉각시키고, 밤새 저장하였다. 생성되는 침전물을 여과에 의해 수집하고, 공기 건조시켜 (75A)를 황색 고체(7.16 g, 84 %)로 얻었다. HPLC 체류 시간 (분): 2.24, MW:185.2, LCMS [M+H]+= 186.1.
단계 B:
DMF(10 mL) 중의 화합물(75A)(2.0 g, 10.7 mmol)의 용액에 0 ℃에서 NaH(60 %, 11.9 g, 11.9 mmol)를 조금씩 첨가하였다. 기체 방출이 멈출 때까지 계속 교반하고, 이 때 EtBr(0.888 mL, 11.9 mmol)을 적가하였다. 1 hr 동안 0 ℃에서 계속 교반한 다음, 반응물을 rt로 가온하고, 물을 사용하여 켄칭하였다. 생성되는 침전물을 여과에 의해 수집하고, 공기 건조시켜 (75B)를 황색 고체(1.47 g, 64 %)로 얻었다. HPLC 체류 시간 (분): 2.97, MW 213.2, LCMS [M+H]+= 214.1.
단계 C:
(75B)(1.47 g, 6.9 mmol), MeOH(15 mL), 물(10 mL) 및 aq. NaOH(30N, 35 mL)의 용액을 밤새 가열하며 환류시켰다. MeOH를 산성화하고, 생성되는 용액의 pH를 3-6으로 조정하였다. 생성되는 침전물을 여과에 의해 수집하고, 공기 건조시켜(75C)를 연한 황색 고체(1.19 g, 69 %)로 얻었다. HPLC 체류 시간 (분): 2.25, MW: 204.2, LCMS [M+H]+= 205.2.
단계 D:
DMF(0.5 mL) 중의 (75C)(0.05 g, 0.22 mmol)의 용액에 HATU(0.11 g, 0.29 mmol) 및 DIPEA(0.122 mL, 0.7 mmol)를 첨가하였다. RT에서 45 분 동안 교반한 후, 3-아미노-N-시클로프로필-4-메틸-벤즈아미드 히드로클로라이드(0.059 g, 0.26 mmol)를 첨가하였다. 용액을 65 ℃로 가열하고, 밤새 교반하였다. 반응물을 추가의 2 hr 동안 85 ℃로 가열하였다. 물(2 mL)을 첨가하고, 생성물을 EtOAc로 추출하여 조 잔류물을 얻었고, 이를 분취용 HPLC에 의해 추가 정제하여 (75)를 연한 황색 고체(0.023 g, 26 %)로 얻었다. HPLC 체류 시간 (분): 2.90, MW: 404.5, LCMS [M+H]+= 405.1.
실시예
76
단계 A: 에틸 5-(메틸아미노)-1-페닐-1H-피라졸-4-카르복실레이트
0 ℃에서 DMF(100 mL) 중의 에틸 5-아미노-1-페닐-1H-피라졸-4-카르복실레이트(15 g, 65 mmol)의 용액에 NaH(60 %, 2.85 g, 71.5 mmol)를 수회 조금씩 첨가하였다. 0 ℃에서 1 h 동안 교반한 후, 요오도메탄(4.45 mL, 71.5 mmol)을 적가하였다. 용액을 추가의 2 h 동안 0 ℃에서 교반한 다음, 점진적으로 RT로 가온시켰다. 반응을 물을 사용하여 켄칭하여 백색 침전물을 형성시키고, 이를 여과에 의해 수집하고, 공기 건조시켰다. 화합물 76A를 얻고(11.8 g), 추가 정제없이 사용하였다. HPLC 체류 시간 (분): 2.70, MW: 245.3, LCMS [M+H]+ = 246.3
단계 B: 5-(메틸아미노)-1-페닐-1H-피라졸-4-카르복실산
(76A)(11.8 g, 48.2 mmol), EtOH(50 mL), 물(50 mL) 및 aq. NaOH(3N, 48 mL)의 용액을 밤새 가열하여 환류시켰다. 0 ℃로 냉각시킨 후, 용액을 1N HCl로 조심스럽게 산화시켰다. 생성되는 침전물을 여과에 의해 수집하고, 공기 건조시켜 화합물(76B)을 백색 고체(10.4 g, 69 %)로 얻었다. HPLC 체류 시간 (분):1.99, MW: 217.2, LCMS [M+H]+ = 218.3
단계 D: 실시예 76
RT에서 티오닐 클로라이드(40 mL)에 (76B)(0.970 g, 4.47 mmol)를 수회 조금씩 첨가하였다. RT에서 30 분 동안 교반한 후, 티오닐 클로라이드를 증발시켜 건조시켰다. 잔류물을 DCE(8 mL) 중에 용해시키고, 3-아미노-N-시클로프로필-4-메틸벤즈아미드 히드로클로라이드(1.11 g, 4.91 mmol)에 용해시킨 후, DIPEA(2.33 mL, 13.4 mmol)를 첨가하였다. 반응물을 RT에서 2 일 동안 교반한 다음, 물(2 mL) 및 aq. NaOH(1 N, 2 mL)를 첨가하여 켄칭시켜 침전물을 형성하였다. 용액을 원심분리하고, 수층을 피펫을 사용하여 제거하였다. 물의 추가의 엘리콧(aliquot)(5 mL)을 첨가하고, 슬러리를 몇 분 동안 교반하고, 또다시 원심분리하였다. 수층을 제거한 후, 초기 고체를 여과에 의해 수집하였다. RT에서 2-3 h 동안 이 고체를 10 % EtOH/90 % 수 중에서 슬러리화한 다음, 여과에 의해 수집하고, 공기 건조시켜 실시예 76을 백색 고체(0.753 g)로 얻었다. HPLC 체류 시간 (분): 2.68, MW: 389.5, LCMS [M+H]+= 390.2
실시예
77-80
상기 화학식(여기서, 변수 Q, R6 및 R8은 하기 표 5에 나타낸 값을 가짐)을 갖는 실시예 77-80을 실시예 75 및 76의 제조에 기재된 절차를 따라 제조하였다. 출발 물질은 상업적으로 입수가능하거나, 본 명세서의 반응식에 따라 또는 당 분야에 공지된 절차를 사용하여 제조될 수 있다.
실시예
81
단계 A:
2-클로로-3-트리플루오로메틸피리딘(21 g, 116 mmol), 히드라진 일수화물(70 mL), 및 EtOH(40 mL)의 용액을 천천히 90 ℃로 가열하고, 이 온도에서 3 h 동안 유지시켰다. rt로 냉각시킨 후, 혼합물을 회전 증발기에서 농축시켜 진한 슬러리를 제공하였다. 이 물질을 DCM(350 mL) 중에 용해시키고, 생성되는 층을 분리하였다. 수층을 추가의 DCM(2 × 75 mL)으로 추출하고, 합한 유기 추출물을 물(4 x 100 mL) 및 염수(100 mL)로 세척하였다. 무수 황산나트륨으로 건조시킨 후, 추출물을 여과하고, 진공에서 농축시켜 16.6 g(81 %)의 밝은 회색 고체를 얻었다. 이 물질을 임의의 추가 정제 없이 사용하였다. HPLC 체류 시간: 0.29 분.
단계 B:
에틸아세토아세테이트(100 mL), DMF-DMA(130 mL) 및 p-톨루엔 술폰산(350 mg)의 혼합물을 100 ℃에서 4 h 동안 교반한 다음, RT에서 3 일 동안 정치시켰다. 진공에서 증류하여 107 g의 황색 액체를 얻었다. (bp = 110-120 ℃/6 mm Hg). bp(문헌값 = 265 ℃/720 mm Hg).
단계 C:
EtOH(250 mL) 중의 화합물 81A(16.6 g, 94 mmol) 및 화합물 81B(19.1 g, 103 mmol)의 용액을 5 h 동안 환류 하에 가열한 다음, rt로 냉각시켰다. 이 혼합물에 3 N aq NaOH(55 mL)를 첨가하고, 생성되는 용액을 85 ℃에서 추가의 3.5 h 동안 가열하였다. RT로 냉각시킨 후, EtOH를 회전 증발기에서 제거하고, 혼합물을 물로 희석시켜 ~350 mL의 총 부피를 얻었다. 이 혼합물을 DCM/메탄올(4 × 100 mL)의 9:1 혼합물로 추출하고, 합한 추출물을 염수(150 mL)로 세척한 다음, 무수 황산나트륨으로 건조시켰다. 진공에서 여과 및 농축시켜 ~ 24 g의 회백색 고체를 얻었다. 고체를 가온된 디에틸 에테르(~350 mL) 중에 용해시키고, ~75 mL로 농축시켰다. 잔여 디에틸 에테르를 고체로부터 따라내었다. 이 방법을 2 회 더 반복하고, 생성되는 고체를 진공에서 건조시켜 20.5 g(81 %)의 화합물 81C를 회백색 고체로 얻었다. HPLC 체류 시간: 2.13 분 LCMS [M+H]+ = 272.5.
단계 D: 실시예 81
rt에서 DCM(70 mL) 중의 화합물 81C(10.0 g, 37 mmol)의 혼합물에 DMF(0.29 mL, 3.7 mmol) 및 티오닐 클로라이드(3.5 mL, 48 mmol)를 연속적으로 첨가하고, 생성되는 용액을 RT에서 3 h 동안 교반하였다. 진공에서 농축시켜 10.7 g의 투명한 황색 오일을 얻었다. 이 물질을 DCM(32 mL) 중에 용해시키고, DCM(70 mL) 중의 3-아미노-N-시클로프로필-4-메틸벤즈아미드 히드로클로라이드(10.0 g, 44 mmol) 및 디이소프로필아민(16 mL, 92 mmol)의 균질한 혼합물에 0 ℃에서 천천히 첨가하였다. 생성되는 혼합물을 rt로 가온하고, 16 h 동안 교반하였다. 반응 혼합물을 DCM(250 mL)으로 희석시키고, 용액을 0.25 N aq HCl(4 x 200 mL), 물(150 mL) 및 염수(150 mL)로 연속적으로 세척한 다음, 무수 황산나트륨으로 건조시키고, 여과시키고, 진공에서 농축시켜 연한 황색 고체를 얻었다. 고체를 고온 디에틸 에테르(250 mL)를 사용하여 3 회 배산시키고, 생성되는 고체를 진공에서 건조시켜 14 g의 회백색 고체를 얻었다. 고온 MeOH/물(1:1, 200 mL)로부터 재결정화하여 12.6 g(77 %)의 실시예 81을 회백색 고체로 얻었다. HPLC 체류 시간: 2.76 분 LCMS [M+H]+ = 476.4.
실시예
82
단계 A:
DCE(100 mL) 중의 tert-부틸 카르바제이트(2.6 g, 20 mmol) 및 트리에틸아민(3.1 mL, 22 mmol)의 rt 용액에 DCE(25 mL) 중의 4-메틸-3-니트로벤조일 클로라이드의 용액을 30 분 동안 첨가하였다. 첨가를 완결한 후 생성되는 흐린 혼합물을 rt에서 2h 동안 교반한 다음, 혼합물을 10 % 수성 시트르산(2 × 75 mL) 및 염수(100 mL)로 연속적으로 세척한 다음, 무수 황산나트륨으로 건조시켰다. 용액을 EtOAc(100 mL)로 희석시키고, 여과시키고, 진공에서 농축시켜 대략 50 mL의 부피를 얻었다. 혼합물을 헥산(50 mL)으로 희석시키고, 수 분 동안 초음파 처리하고, 생성되는 침전된 고체를 진공 여과에 의해 수집하고, 진공에서 건조시켜 4.7 g(74 %)의 화합물(82A)을 백색 고체로 얻었다. HPLC tR = 2.54 분
단계 B:
0 ℃에서 화합물 82A(4.4 g, 15 mmol)를 고체로서 트리플루오로아세트산(45 mL)에 조금씩 첨가하고, 혼합물을 이 온도에서 30 분 동안 교반하고, rt에서 추가의 30 분 동안 교반하였다. 그 다음, 혼합물을 진공에서 농축시키고, 생성되는 백색 고체를 2N aq 탄산나트륨(200 mL) 및 EtOAc(200 mL) 사이에 분배시켰다. 층을 분리하고, 수성부를 추가의 EtOAc(5 × 100 mL)로 추출하고, 합한 추출물을 염수(100 mL)로 세척하고, 무수 황산나트륨으로 건조시키고, 여과시키고, 진공에서 농축시켜 2.96 g(99 %)의 화합물(82B)을 백색 고체로 얻었다. HPLC tR = 1.05 분
단계 C:
트리에틸 오르토아세테이트(50 mL) 중의 화합물 82B(2.9 g, 15 mmol)의 현탁액을 100 ℃로 가열하여 투명한 용액을 생성하였다. 이 온도에서 2 h 동안 가열시킨 후, 혼합물을 추가의 시간 동안 130 ℃로 가열한 다음, RT로 냉각시키고, 이질적으로 진공에서 농축시켰다. 생성되는 잔류물을 EtOAc(250 mL) 중에 용해시키고, 물(100 mL) 및 염수(75 mL)로 세척한 다음, 무수 황산나트륨으로 건조시키고, 여과시키고, 진공에서 농축시켜 3.2 g의 화합물 82C를 밝은 황색 고체로 얻었다. HPLC tR = 2.45 분
단계 D:
EtOH(40 mL) 중의 화합물 82C(0.37 g)의 현탁액에 5 % Pd/C(35 mg)를 첨가하고, 수소 분위기 하에서 RT에서 2h 동안 혼합물을 교반하였다. 셀라이트(Celite)를 통해 혼합물을 여과하고, 생성되는 투명한 여액을 진공에서 농축시키고, 잔류물을 메탄올을 사용하여 배산시켰다. 수집된 고체를 여과시키고 건조시켜 220 mg의 화합물 82D를 회백색 고체로 얻었다. HPLC tR = 1.19분
단계 E: 실시예 82
무수 DMF(0.4 mL) 중의 5-메틸-1-페닐-1H-피라졸-4-카르복실산(28 mg, 0.14 mmol), 1-[3-(디메틸아미노)프로필]-3-에틸카르보디이미드 히드로클로라이드(33 mg, 0.17 mmol) 및 1-히드록시벤조트리아졸(23 mg, 0.17 mmol)의 혼합물을 RT에서 1.5 h 동안 반응시켰다. 이 때, 아닐린(82D)을 고체로 첨가한 후, DIPEA(36 ㎕, 0.20 mmol)를 첨가하였다. 그 다음, 생성되는 혼합물을 60 ℃에서 16 h 동안 가열한 다음, 용액을 물(0.4 mL)로 희석시키고, RT로 냉각시켰다. 생성되는 고체를 진공 여과에 의해 수집하고, 진공에서 건조시켜 33 mg의 표제의 화합물을 황갈색 고체로 얻었다. HPLC 체류 시간: 2.78 분 LCMS MH+(m/z) 374.
실시예
83-88
상기 화학식(여기서, 변수 Q 및 R2는 하기 표 6에 나타낸 값을 가짐)을 갖는 실시예 83-88을 실시예 82의 제조에 기재된 절차를 따라 제조하였다. 출발 물질은 상업적으로 입수가능하거나, 본 명세서의 반응식에 따라 또는 당 분야에 공지된 절차를 사용하여 제조될 수 있다.
Claims (13)
- 하기 화학식 I을 갖는 화합물, 또는 그의 제약상 허용되는 염, 전구약(prodrug), 용매화물, 이성체 및(또는) 수화물.<화학식 I>상기 식 중, Q는 임의적으로 치환된 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐 고리이고;산소 원자 O*와 인접한 탄소 원자 C1 사이의 결합은, (i) 이중 결합이 되어 카르보닐기 [C(=O)]를 형성하며, 여기서 R6은 C1 - 6알킬 또는 시클로프로필이거나; 또는 (ii) 단일 결합이며, 단일 결합인 경우에는 상기 산소 원자 O*가 기 R6에 추가로 결합하며, R6 및 인접한 질소 원자와 함께, C1 및 인접한 질소 원자 사이의 결합이 이중 결합인 임의적으로 치환된 옥사디아졸릴 고리를 형성하며;R2는 C1 - 6알킬, 아미노, 알킬아미노, 치환된 알킬아미노, 시클로아미노, 치환된 시클로아미노; 및 아미노, 알킬아미노, 치환된 알킬아미노, 시클로아미노 및(또는) 치환된 시클로아미노 중 하나 또는 2 개로 치환된 C1 - 6알킬로부터 선택된다.
- 제 1 항에 있어서, 상기 R2가 C1 - 6알킬, NR7R8, 및 기 NR7R8로 치환된 C1-6알킬로부터 선택되며,R7 및 R8이 독립적으로 수소, C1 - 6알킬, 및 C3 - 6시클로알킬로부터 선택되고, 상기 기 R7 및 R8 각각은 또한 임의적으로 OH, O(C1 - 4알킬), 이미다졸릴, 피리딜, 페닐, 테트라히드로푸릴, NH2, NH(C1 - 4알킬), N(C1 - 4알킬)2 및 N-모르폴리닐 중 하나 또는 2 개로 치환되거나, 또는 R7 및 R8은 부착된 질소 원자와 함께 모르폴리닐, 피페리디닐 또는 피페라지닐 고리를 형성하는 화합물; 및(또는) 그의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물.
- 제 1 항에 있어서, 하기 화학식을 갖는 화합물 및(또는) 그의 제약상 허용되는 염, 전구약, 용매화물, 이성체 및(또는) 수화물.상기 식 중, Q는 페닐, 피리딜, 피리다지닐, 피리미디닐 또는 피라지닐 고리이고,R9, R10 및 R11은 각각 독립적으로 수소, C1 - 4알킬, O(C1 - 4알킬), 할로겐, 할로 C1-4알킬, 시아노, SO2(C1 - 4알킬) 및(또는) 니트로로부터 선택되고;R2는 C1 - 4알킬, NR7R8, 및 기 NR7R8로 치환된 C1 - 4알킬로부터 선택되고,R7 및 R8은 독립적으로 수소, C1 - 6알킬, 및 C3 - 6시클로알킬로부터 선택되고, 상기 R7 및 R8 각각은 또한 임의적으로 OH, O(C1 - 4알킬), 이미다졸릴, 피리딜, 페닐, 테트라히드로푸릴, NH2, NH(C1 - 4알킬), N(C1 - 4알킬)2 및 N-모르폴리닐 중 하나 또는 2 개로 치환되거나, 또는 R7 및 R8은 부착된 질소 원자와 함께 모르폴리닐, 피페리디닐 또는 피페라지닐 고리를 형성한다.
- 제 6 항에 있어서, 상기 R2가 C1 - 4알킬 또는 NR7R8(여기서, R7은 수소 또는 C1- 4알킬이고, R8은 수소, C1 - 4알킬, C3 - 6시클로알킬, 또는 OH, 메톡시, 피리딜, 테트라히드로푸릴, NH2, NHC1 - 4알킬, N(C1 - 4알킬)2, 이미다졸릴 및 N-모르폴리닐로 치환된 C1-4알킬이거나, 또는 R7 및 R8은 합쳐져 모르폴리닐, 피페리디닐 또는 피페라지닐을 형성함)인 화합물.
- 제 1 항 내지 제 8 항 중 어느 한 항에 따른 하나 이상의 화합물 및 제약상 허용되는 담체 또는 희석제를 포함하는 제약 조성물.
- 제 1 항 내지 제 8 항 중 어느 한 항에 따른 화합물의 염증 장애 치료약 제조 용도.
- 제 9 항에 있어서, 상기 염증 장애가 천식, 성인 호흡 곤란 증후군, 만성 폐쇄성 폐질환, 만성 폐 염증 질환, 당뇨병, 염증성 장 질환, 골다공증, 건선, 이식체 대 숙주 거부 반응, 죽상동맥경화증, 통증, 및 류마티스성 관절염, 건성성 관절염, 외상성 관절염, 풍진 관절염, 통풍성 관절염 및 골관절염을 비롯한 관절염으로 이루어진 군으로부터 선택된 것인 화합물의 용도.
- 제 1 항 내지 제 8 항 중 어느 한 항에 따른 화합물의 포유류의 p38 키나아제 활성 조절 약물 제조 용도.
- 아세토아세테이트 화합물, 예를 들면 에틸 3-옥소부타노에이트를 용매 및 화학식 QNHNH2(여기서, Q는 제 1 항에 정의된 바와 같음)를 갖는 적합한 히드라진의 존재 하에서 메탄아민, 예를 들면 디메톡시-N-N-디메틸메탄아민과 반응시킨 후, NaOH를 첨가하여 하기 화학식 7-4를 갖는 나트륨염 화합물을 제공하고, 상기 나트륨염(7-4)을 산과 반응시켜 하기 화학식 7-5를 갖는 카르복실산을 제공한 다음, 상기 카르복실산을 티오닐 클로라이드와의 반응으로 산 클로라이드로 전환시켜 하기 화학식 7-6의 화합물을 제공한 다음, 상기 산 클로라이드를 하기 화학식 1-4를 갖는 벤즈아미드 히드로클로라이드와 반응시켜 하기 화학식 Ie를 갖는 화합물을 제공하는 것을 포함하는 하기 화학식 Ie를 갖는 화합물 제조 방법.상기 식 중, R6은 알킬 또는 시클로프로필이고, Q는 제 1 항에 정의된 바와 같고, R2는 알킬 또는 아미노알킬이다.
- 하기 화학식 8-1을 갖는 디케텐을 하기 화학식 8-2를 갖는 벤즈아미드 히드로클로라이드 화합물과 DIPEA를 사용하여 용매 중에서 반응시켜 하기 화학식 8-3을 갖는 화합물을 제공한 다음, DMF-DMA를 첨가하고, DCM을 제거하여 하기 화학식 8-4를 갖는 화합물을 제공하고, 용매, 예를 들면 EtOH 중에서 히드라진(QNHNH2), 예를 들면 페닐히드라진과 반응시켜 하기 화학식 Ih의 화합물을 제공하는 것을 포함하는 하기 화학식 Ih를 갖는 화합물 제조 방법.상기 식 중, Q는 제 1 항에 정의된 바와 같고, R6은 알킬 또는 시클로프로필이고, R2a는 수소, 알킬, 시클로아미노 또는 아미노알킬이다.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US46702903P | 2003-05-01 | 2003-05-01 | |
| US60/467,029 | 2003-05-01 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20060022649A true KR20060022649A (ko) | 2006-03-10 |
Family
ID=33435012
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020057020642A KR20060022649A (ko) | 2003-05-01 | 2004-05-03 | 키나아제 억제제로서 유용한 아릴 치환 피라졸-아미드화합물 |
Country Status (27)
| Country | Link |
|---|---|
| US (8) | US7396935B2 (ko) |
| EP (5) | EP2385041B1 (ko) |
| JP (1) | JP4601611B2 (ko) |
| KR (1) | KR20060022649A (ko) |
| CN (1) | CN1816529A (ko) |
| AT (2) | ATE482200T1 (ko) |
| AU (1) | AU2004236240C1 (ko) |
| BR (1) | BRPI0409949A (ko) |
| CA (1) | CA2524321A1 (ko) |
| CO (1) | CO5640039A2 (ko) |
| DE (1) | DE602004029242D1 (ko) |
| DK (1) | DK1618092T3 (ko) |
| ES (3) | ES2350837T3 (ko) |
| GE (1) | GEP20074236B (ko) |
| HR (1) | HRP20100670T1 (ko) |
| IS (1) | IS8101A (ko) |
| MX (1) | MXPA05011666A (ko) |
| NO (1) | NO20054970L (ko) |
| NZ (1) | NZ543375A (ko) |
| PL (1) | PL1618092T3 (ko) |
| PT (1) | PT1618092E (ko) |
| RS (1) | RS20050789A (ko) |
| RU (1) | RU2342365C2 (ko) |
| SI (1) | SI1618092T1 (ko) |
| UA (1) | UA81668C2 (ko) |
| WO (3) | WO2004099156A1 (ko) |
| ZA (1) | ZA200508830B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210094161A (ko) * | 2015-12-16 | 2021-07-28 | 닛뽕소다 가부시키가이샤 | 아릴아졸 화합물 및 유해 생물 방제제 |
Families Citing this family (91)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5859031A (en) * | 1995-06-07 | 1999-01-12 | Gpi Nil Holdings, Inc. | Small molecule inhibitors of rotamase enzyme activity |
| US7078419B2 (en) * | 2003-03-10 | 2006-07-18 | Boehringer Ingelheim Pharmaceuticals, Inc. | Cytokine inhibitors |
| ATE482200T1 (de) * | 2003-05-01 | 2010-10-15 | Bristol Myers Squibb Co | Als kinaseinhibitoren geeignete arylsubstituierte pyrazolamidverbindungen |
| AU2004261459B2 (en) | 2003-07-22 | 2008-06-26 | Astex Therapeutics Limited | 3, 4-disubstituted 1H-pyrazole compounds and their use as cyclin dependent kinases (CDK) and glycogen synthase kinase-3 (GSK-3) modulators |
| EP1692116B1 (en) * | 2003-12-03 | 2011-03-09 | Boehringer Ingelheim Pharmaceuticals Inc. | 1,2,3-triazole amide derivatives as inhibitors of cytokine production |
| EP1694686A1 (en) * | 2003-12-19 | 2006-08-30 | Takeda San Diego, Inc. | Kinase inhibitors |
| WO2005090333A1 (en) * | 2004-03-09 | 2005-09-29 | Boehringer Ingelheim Pharmaceuticals, Inc. | 3-‘4-heterocyclyl -1,2,3,-triazol-1-yl!-n-aryl-benzamides as inhibitors of the cytokines production for the treatment of chronic inflammatory diseases |
| WO2005105788A1 (en) * | 2004-04-23 | 2005-11-10 | Takeda San Diego, Inc. | Indole derivatives and use thereof as kinase inhibitors |
| JP4865702B2 (ja) * | 2004-05-03 | 2012-02-01 | ベーリンガー インゲルハイム ファーマシューティカルズ インコーポレイテッド | サイトカイン阻害剤 |
| US7485657B2 (en) * | 2004-05-12 | 2009-02-03 | Boehringer Ingelheim Pharmaceuticals, Inc. | Anti-cytokine heterocyclic compounds |
| US7550598B2 (en) * | 2004-08-18 | 2009-06-23 | Takeda Pharmaceutical Company Limited | Kinase inhibitors |
| MX2007004403A (es) | 2004-10-12 | 2007-04-27 | Astrazeneca Ab | Derivados de quinazolina. |
| JP2008516973A (ja) * | 2004-10-15 | 2008-05-22 | タケダ サン ディエゴ インコーポレイテッド | キナーゼ阻害剤 |
| US7531560B2 (en) * | 2004-11-10 | 2009-05-12 | Boehringer Ingelheim Pharmaceuticals, Inc. | Anti-cytokine heterocyclic compounds |
| US8404718B2 (en) | 2005-01-21 | 2013-03-26 | Astex Therapeutics Limited | Combinations of pyrazole kinase inhibitors |
| EP1911751A4 (en) | 2005-06-21 | 2010-10-20 | Mitsui Chemicals Agro Inc | AMIDE DERIVATIVE AND PESTICIDE CONTAINING SUCH A COMPOUND |
| US8119655B2 (en) | 2005-10-07 | 2012-02-21 | Takeda Pharmaceutical Company Limited | Kinase inhibitors |
| WO2007052843A1 (ja) * | 2005-11-04 | 2007-05-10 | Takeda Pharmaceutical Company Limited | 複素環アミド化合物およびその用途 |
| AU2006328186A1 (en) * | 2005-12-22 | 2007-06-28 | Astrazeneca Ab | Chemical compounds |
| UY30183A1 (es) | 2006-03-02 | 2007-10-31 | Astrazeneca Ab | Derivados de quinolina |
| HUE026011T2 (en) | 2006-03-22 | 2016-05-30 | Hoffmann La Roche | Pyrazoles as 11-beta-HSD-1 |
| US20100120717A1 (en) | 2006-10-09 | 2010-05-13 | Brown Jason W | Kinase inhibitors |
| EP2223925A1 (en) * | 2006-10-09 | 2010-09-01 | Takeda Pharmaceutical Company Limited | Kinase inhibitors |
| AU2007308154A1 (en) | 2006-10-10 | 2008-04-17 | Amgen Inc. | N-aryl pyrazole compounds for use against diabetes |
| CN101616667A (zh) * | 2006-10-27 | 2009-12-30 | 百时美施贵宝公司 | 可用作激酶抑制剂的杂环酰胺化合物 |
| CA2667927A1 (en) * | 2006-10-30 | 2008-05-08 | Novartis Ag | 3-amino-pyrazole-4-carboxamide derivatives useful as inhibitors of protein kinases |
| JP2010514685A (ja) * | 2006-12-20 | 2010-05-06 | ブリストル−マイヤーズ スクイブ カンパニー | アリール置換ピラゾールアミド化合物の結晶形 |
| US7737149B2 (en) | 2006-12-21 | 2010-06-15 | Astrazeneca Ab | N-[5-[2-(3,5-dimethoxyphenyl)ethyl]-2H-pyrazol-3-yl]-4-(3,5-dimethylpiperazin-1-yl)benzamide and salts thereof |
| US7638541B2 (en) | 2006-12-28 | 2009-12-29 | Metabolex Inc. | 5-ethyl-2-{4-[4-(4-tetrazol-1-yl-phenoxymethyl)-thiazol-2-yl]-piperidin-1-yl}-pyrimidine |
| ES2340640T3 (es) | 2007-03-23 | 2010-06-07 | Icagen, Inc. | Inhibidores de canales de iones. |
| US8338434B2 (en) * | 2007-03-29 | 2012-12-25 | Glaxosmithkline Llc | Inhibitors of Akt activity |
| CL2008000979A1 (es) * | 2007-04-11 | 2008-10-17 | Sumitomo Chemical Co | Proceso para producir un compuesto derivado de 2-piridin-2-il-2h-pirazol-3-fenilamida; compuestos intermediarios; el compuesto en si; composicion plaguicida que contiene a dicho compuesto; uso de dicho compuesto como plaguicida; y metodo para control |
| EP1992344A1 (en) | 2007-05-18 | 2008-11-19 | Institut Curie | P38 alpha as a therapeutic target in pathologies linked to FGFR3 mutation |
| NZ581127A (en) * | 2007-05-25 | 2012-06-29 | Abbott Gmbh & Co Kg | Heterocyclic compounds as positive modulators of metabotropic glutamate receptor 2 (mglu2 receptor) |
| BRPI0814825A2 (pt) | 2007-07-17 | 2015-02-03 | Hoffmann La Roche | Composto, processo para a preparação do composto, composição farmacêutica que o compreende, seu uso e métodos para o tratamento ou profilaxia de diabetes, obesidade, distúrbios de alimentação ou dislipimedia e diabetes do tipo ii |
| BRPI0814294A2 (pt) | 2007-07-19 | 2015-02-03 | Metabolex Inc | Agonistas de receptor heterocíclico ligado a n para o tratamento do diabetes e de desordens metabólicas. |
| AU2008290329B2 (en) | 2007-08-22 | 2011-12-22 | Astrazeneca Ab | Cyclopropyl amide derivatives |
| US8080546B2 (en) | 2007-10-26 | 2011-12-20 | Amgen Inc. | Pyrazolo-pyridinone derivatives and methods of use |
| WO2009057784A1 (ja) | 2007-11-01 | 2009-05-07 | Takeda Pharmaceutical Company Limited | 複素環化合物 |
| CA2717138A1 (en) * | 2008-03-05 | 2009-09-11 | Takeda Pharmaceutical Company Limited | 5-membered heterocyclic compounds and bicyclic heteroaryl having glucagon antagonistic action useful for treating diabetes |
| WO2009140342A1 (en) * | 2008-05-16 | 2009-11-19 | Schering Corporation | Glucagon receptor antagonists, compositions, and methods for their use |
| EP2151434A1 (en) | 2008-08-05 | 2010-02-10 | Institut Pasteur | Alkoxypyrazoles and the process for their preparation |
| WO2010017902A1 (de) | 2008-08-14 | 2010-02-18 | Bayer Cropscience Aktiengesellschaft | Insektizide 4-phenyl-1h-pyrazole |
| EP2184273A1 (de) * | 2008-11-05 | 2010-05-12 | Bayer CropScience AG | Halogen-substituierte Verbindungen als Pestizide |
| WO2010071583A1 (en) * | 2008-12-18 | 2010-06-24 | Astrazeneca Ab | Pharmaceutical product comprising a p38 kinase inhibitor and a second active ingredient |
| TWI475018B (zh) * | 2009-02-06 | 2015-03-01 | Takeda Pharmaceutical | 雜環化合物 |
| TW201039825A (en) | 2009-02-20 | 2010-11-16 | Astrazeneca Ab | Cyclopropyl amide derivatives 983 |
| WO2011041154A1 (en) | 2009-10-01 | 2011-04-07 | Metabolex, Inc. | Substituted tetrazol-1-yl-phenoxymethyl-thiazol-2-yl-piperidinyl-pyrimidine salts |
| EP2536702A4 (en) | 2010-02-18 | 2013-07-10 | Astrazeneca Ab | NEW CRYSTALLINE FORM OF A CYCLOPROPYLBENZAMIDE DERIVATIVE |
| KR102113960B1 (ko) | 2010-03-30 | 2020-05-21 | 베르선 코포레이션 | 트롬빈 억제제로서의 다중치환된 방향족 화합물 |
| AU2011237936A1 (en) | 2010-04-07 | 2012-10-11 | F. Hoffmann-La Roche Ag | Pyrazol-4-yl-heterocyclyl-carboxamide compounds and methods of use |
| WO2011143430A1 (en) | 2010-05-12 | 2011-11-17 | Abbott Laboratories | Indazole inhibitors of kinase |
| WO2012138809A1 (en) * | 2011-04-05 | 2012-10-11 | Dawei Zhang | Heterocyclic compounds as kinase inhibitors |
| WO2014007228A1 (ja) | 2012-07-03 | 2014-01-09 | 小野薬品工業株式会社 | ソマトスタチン受容体作動活性を有する化合物およびその医薬用途 |
| JP6329170B2 (ja) | 2012-12-07 | 2018-05-23 | ケモセントリックス,インコーポレイティド | ジアゾールラクタム |
| DK2935227T3 (en) * | 2012-12-21 | 2017-12-04 | Chemocentryx Inc | DIAZOLAMIDES AS CCR1 RECEPTOR ANTAGONISTS |
| US20140179712A1 (en) | 2012-12-21 | 2014-06-26 | Astrazeneca Ab | Pharmaceutical formulation of n-[5-[2-(3,5-dimethoxyphenyl)ethyl]-2h-pyrazol-3-yl]-4-[(3r,5s)-3,5-dimethylpiperazin-1-yl]benzamide |
| AU2014237340C1 (en) | 2013-03-15 | 2018-11-08 | Global Blood Therapeutics, Inc. | Compounds and uses thereof for the modulation of hemoglobin |
| EP2968297B1 (en) | 2013-03-15 | 2018-09-26 | Verseon Corporation | Multisubstituted aromatic compounds as serine protease inhibitors |
| ES2791749T3 (es) * | 2013-03-15 | 2020-11-05 | Verseon Corp | Halogenopirazoles como inhibidores de la trombina |
| EA201992707A1 (ru) | 2013-11-18 | 2020-06-30 | Глобал Блад Терапьютикс, Инк. | Соединения и их применения для модуляции гемоглобина |
| WO2015084936A1 (en) * | 2013-12-04 | 2015-06-11 | The Scripps Research Institute | Novel compounds as jnk kinase inhibitors |
| SG11201605408RA (en) | 2014-01-10 | 2016-07-28 | Aurigene Discovery Tech Ltd | Indazole compounds as irak4 inhibitors |
| TR201815683T4 (tr) | 2014-01-13 | 2018-11-21 | Aurigene Discovery Tech Ltd | Irak4 inhibitörleri olarak bisiklik heterosiklil türevleri. |
| WO2015143654A1 (en) | 2014-03-26 | 2015-10-01 | Merck Sharp & Dohme Corp. | TrkA KINASE INHIBITORS,COMPOSITIONS AND METHODS THEREOF |
| WO2015143653A1 (en) | 2014-03-26 | 2015-10-01 | Merck Sharp & Dohme Corp. | TrkA KINASE INHIBITORS,COMPOSITIONS AND METHODS THEREOF |
| WO2015143652A1 (en) | 2014-03-26 | 2015-10-01 | Merck Sharp & Dohme Corp. | TrkA KINASE INHIBITORS,COMPOSITIONS AND METHODS THEREOF |
| US9815792B2 (en) | 2014-04-02 | 2017-11-14 | Bayer Cropscience Aktiengesellschaft | Method for producing carboxamides |
| EP3140298A1 (en) | 2014-05-07 | 2017-03-15 | Pfizer Inc. | Tropomyosin-related kinase inhibitors |
| US10356904B2 (en) * | 2014-05-14 | 2019-07-16 | AT&S Austria Technologie & Systemtechnik Aktiengesellshaft | Conductor track with enlargement-free transition between conductor path and contact structure |
| RU2583158C2 (ru) * | 2014-06-06 | 2016-05-10 | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Пермский государственный национальный исследовательский университет" | Метил 5-(арилкарбамоил)-1-(бензил и фенил)-4-циннамоил-1н-пиразол-3-карбоксилаты, проявляющие анальгетическую активность, и способ их получения |
| EA201692418A1 (ru) * | 2014-06-20 | 2017-04-28 | Ауриджен Дискавери Текнолоджиз Лимитед | Замещенные индазольные соединения в качестве irak4 ингибиторов |
| WO2016044662A1 (en) | 2014-09-17 | 2016-03-24 | Verseon Corporation | Pyrazolyl-substituted pyridone compounds as serine protease inhibitors |
| WO2016138532A1 (en) | 2015-02-27 | 2016-09-01 | Verseon Corporation | Substituted pyrazole compounds as serine protease inhibitors |
| WO2016161572A1 (en) | 2015-04-08 | 2016-10-13 | Merck Sharp & Dohme Corp. | TrkA KINASE INHIBITORS, COMPOSITIONS AND METHODS THEREOF |
| WO2016202935A1 (en) | 2015-06-19 | 2016-12-22 | Bayer Pharma Aktiengesellschaft | Glucose transport inhibitors |
| JP2019510832A (ja) | 2016-04-07 | 2019-04-18 | ケモセントリクス,インコーポレーテッド | Pd−1阻害剤又はpd−l1阻害剤と組み合わせてccr1アンタゴニストを投与することによる腫瘍負荷の低減 |
| KR20190035752A (ko) | 2016-08-03 | 2019-04-03 | 사이머베이 쎄라퓨틱스, 인코퍼레이티드 | 염증성 위장 질환 또는 위장 상태를 치료하기 위한 옥시메틸렌 아릴 화합물 |
| EP3512833B1 (en) | 2016-09-15 | 2020-07-29 | Boehringer Ingelheim International GmbH | Heteroaryl carboxamide compounds as inhibitors of ripk2 |
| EP3532465B1 (en) * | 2016-10-26 | 2023-03-01 | Rigel Pharmaceuticals, Inc. | Pyrazole amide compounds as irak inhibitors |
| CN110139862B (zh) * | 2016-11-03 | 2024-01-16 | 百时美施贵宝公司 | 可用作romk通道抑制剂的经取代的二环杂环衍生物 |
| TWI795381B (zh) * | 2016-12-21 | 2023-03-11 | 比利時商健生藥品公司 | 作為malt1抑制劑之吡唑衍生物 |
| IL305150A (en) | 2017-03-31 | 2023-10-01 | Aurigene Oncology Ltd | Compounds and preparations for the treatment of hematological disorders |
| US11479770B2 (en) | 2017-10-05 | 2022-10-25 | Fulcrum Therapeutics, Inc. | Use of p38 inhibitors to reduce expression of DUX4 |
| US10342786B2 (en) | 2017-10-05 | 2019-07-09 | Fulcrum Therapeutics, Inc. | P38 kinase inhibitors reduce DUX4 and downstream gene expression for the treatment of FSHD |
| KR20200080254A (ko) | 2017-10-31 | 2020-07-06 | 쿠리스 인코퍼레이션 | 혈액학적 장애를 치료하기 위한 화합물 및 조성물 |
| CN110028450A (zh) * | 2018-01-12 | 2019-07-19 | 沈阳中化农药化工研发有限公司 | 一种吡唑酰胺类化合物的制备方法 |
| CN112313224A (zh) * | 2018-04-06 | 2021-02-02 | 黑带医疗有限责任公司 | Atf6抑制剂和其用途 |
| US11040031B2 (en) | 2018-06-18 | 2021-06-22 | Janssen Pharmaceutica Nv | Pyrazole derivatives as MALT1 inhibitors |
| MX2020013699A (es) | 2018-06-18 | 2021-05-12 | Janssen Pharmaceutica Nv | Derivados de pirazol como inhibidores de malt1. |
| KR20220045954A (ko) | 2019-07-11 | 2022-04-13 | 이스케이프 바이오, 인크. | Lrrk2 억제제들로서의 인다졸들 및 아자인다졸들 |
Family Cites Families (55)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4134987A (en) * | 1976-01-14 | 1979-01-16 | Huppatz John L | Compounds and compositions |
| US4200750A (en) | 1977-01-07 | 1980-04-29 | Westwood Pharmaceuticals Inc. | 4-Substituted imidazo [1,2-a]quinoxalines |
| JPH04316559A (ja) | 1990-11-28 | 1992-11-06 | Nissan Chem Ind Ltd | ピラゾールカルボキサニリド誘導体及び殺菌剤 |
| GB9816837D0 (en) | 1998-08-04 | 1998-09-30 | Zeneca Ltd | Amide derivatives |
| KR100214732B1 (ko) * | 1992-12-14 | 1999-08-02 | 세야 히로미치 | 유리제품의 성형 방법 및 장치 |
| US5739135A (en) | 1993-09-03 | 1998-04-14 | Bristol-Myers Squibb Company | Inhibitors of microsomal triglyceride transfer protein and method |
| US5760246A (en) | 1996-12-17 | 1998-06-02 | Biller; Scott A. | Conformationally restricted aromatic inhibitors of microsomal triglyceride transfer protein and method |
| US6147080A (en) * | 1996-12-18 | 2000-11-14 | Vertex Pharmaceuticals Incorporated | Inhibitors of p38 |
| US6020357A (en) * | 1996-12-23 | 2000-02-01 | Dupont Pharmaceuticals Company | Nitrogen containing heteroaromatics as factor Xa inhibitors |
| AUPO622597A0 (en) * | 1997-04-15 | 1997-05-08 | Fujisawa Pharmaceutical Co., Ltd. | New heterocyclic compounds |
| US5998424A (en) * | 1997-06-19 | 1999-12-07 | Dupont Pharmaceuticals Company | Inhibitors of factor Xa with a neutral P1 specificity group |
| AU739066B2 (en) * | 1997-09-23 | 2001-10-04 | Astrazeneca Ab | Amide derivatives for the treatment of diseases mediated by cytokines |
| US6316466B1 (en) | 1998-05-05 | 2001-11-13 | Syntex (U.S.A.) Llc | Pyrazole derivatives P-38 MAP kinase inhibitors |
| AU3859999A (en) | 1998-05-14 | 1999-11-29 | G.D. Searle & Co. | 1,5-diaryl substituted pyrazoles as p38 kinase inhibitors |
| US6200968B1 (en) | 1998-08-06 | 2001-03-13 | Cephalon, Inc. | Particle-forming compositions containing fused pyrrolocarbazoles |
| ES2211172T3 (es) * | 1998-09-25 | 2004-07-01 | Astrazeneca Ab | Derivados de benzamida y su utilizacion como inhibidores de citoquinas. |
| US6184231B1 (en) | 1998-12-04 | 2001-02-06 | Bristol-Myers Squibb | 3-substituted-4-arylquinolin-2-one derivatives as potassium channel modulators |
| DE60017115T2 (de) | 1999-02-10 | 2005-12-08 | Mitsubishi Pharma Corp. | Amid-derivate und deren medizinische verwendung |
| US6548529B1 (en) | 1999-04-05 | 2003-04-15 | Bristol-Myers Squibb Company | Heterocyclic containing biphenyl aP2 inhibitors and method |
| AU766079B2 (en) | 1999-06-03 | 2003-10-09 | Teikoku Hormone Mfg. Co., Ltd. | Substituted pyrazole compounds |
| FR2795726A1 (fr) * | 1999-06-30 | 2001-01-05 | Aventis Cropscience Sa | Nouveaux pyrazoles fongicides |
| JP4788939B2 (ja) | 1999-11-18 | 2011-10-05 | 味の素株式会社 | 新規フェニルアラニン誘導体 |
| MY125533A (en) | 1999-12-06 | 2006-08-30 | Bristol Myers Squibb Co | Heterocyclic dihydropyrimidine compounds |
| US6569885B1 (en) | 1999-12-23 | 2003-05-27 | Icos Corporation | Cyclic AMP-specific phosphodiesterase inhibitors |
| US6194132B1 (en) * | 1999-12-28 | 2001-02-27 | Eastman Kodak Company | Photographic element, compound, and process |
| US20020065270A1 (en) * | 1999-12-28 | 2002-05-30 | Moriarty Kevin Joseph | N-heterocyclic inhibitors of TNF-alpha expression |
| US6906067B2 (en) * | 1999-12-28 | 2005-06-14 | Bristol-Myers Squibb Company | N-heterocyclic inhibitors of TNF-α expression |
| US6197492B1 (en) * | 1999-12-28 | 2001-03-06 | Eastman Kodak Company | Photographic element, compound, and process |
| HN2001000008A (es) | 2000-01-21 | 2003-12-11 | Inc Agouron Pharmaceuticals | Compuesto de amida y composiciones farmaceuticas para inhibir proteinquinasas, y su modo de empleo |
| MY138097A (en) | 2000-03-22 | 2009-04-30 | Du Pont | Insecticidal anthranilamides |
| CA2417638A1 (en) * | 2000-07-31 | 2002-02-07 | Smithkline Beecham P.L.C. | Carboxamide compounds and their use as antagonists of a human 11cby receptor |
| WO2002023986A1 (fr) * | 2000-08-25 | 2002-03-28 | Sankyo Company, Limited | Derives de 4-acylaminopyrazole |
| KR100804564B1 (ko) | 2000-10-30 | 2008-02-20 | 쿠도스 파마슈티칼스 리미티드 | 프탈라지논 유도체 |
| GB0102687D0 (en) | 2001-02-02 | 2001-03-21 | Pharmacia & Upjohn Spa | Oxazolyl-pyrazole derivatives active as kinase inhibitors,process for their preparation and pharmaceutical compositions comprising them |
| US6706711B2 (en) * | 2001-04-27 | 2004-03-16 | Vertex Pharmaceuticals Incorporated | Pyrazole derived kinase inhibitor |
| ATE339418T1 (de) | 2001-06-01 | 2006-10-15 | Vertex Pharma | Thiazolverbindungen, die sich als inhibitoren von proteinkinasen eignen |
| AU2002316421B2 (en) * | 2001-06-26 | 2008-05-15 | Bristol-Myers Squibb Company | N-heterocyclic inhibitors of TNF-ALPHA expression |
| CA2465207C (en) * | 2001-11-01 | 2011-01-04 | Icagen, Inc. | Pyrazole-amides and -sulfonamides |
| WO2003050261A2 (en) * | 2001-12-10 | 2003-06-19 | Bristol-Myers Squibb Company | (1-phenyl-2-heteroaryl)ethyl-guanidine compounds as inhibitors of mitochondrial f1f0 atp hydrolase |
| US6521395B1 (en) * | 2002-01-30 | 2003-02-18 | Eastman Kodak Company | Infrared couplers for incorporating and recovering metadata |
| US7378428B2 (en) | 2002-01-31 | 2008-05-27 | Ono Pharmaceutical Co., Ltd. | Nitrogen-containing bicyclic compounds and drugs containing the same as the active ingredient |
| EP1553089B1 (en) * | 2002-07-30 | 2009-09-30 | Banyu Pharmaceutical Co., Ltd. | Antagonist of melanin-concentrating hormone receptor comprising benzimidazole derivative as active ingredient |
| US7122580B2 (en) | 2002-08-09 | 2006-10-17 | Transtech Pharma, Inc. | Aryl and heteroaryl compounds and methods to modulate coagulation |
| AU2003301443A1 (en) | 2002-10-18 | 2004-05-04 | E.I. Du Pont De Nemours And Company | Azolecarboxamide herbicides |
| EP1583746A1 (en) * | 2003-01-06 | 2005-10-12 | Eli Lilly And Company | A pyrazole derivative as ppar modulator |
| ES2349532T3 (es) | 2003-02-06 | 2011-01-04 | Bristol-Myers Squibb Company | Compuestos basados en tiazolilo útiles como inhibidores de cinasa. |
| ATE482200T1 (de) | 2003-05-01 | 2010-10-15 | Bristol Myers Squibb Co | Als kinaseinhibitoren geeignete arylsubstituierte pyrazolamidverbindungen |
| WO2004106324A1 (en) | 2003-05-27 | 2004-12-09 | E.I. Dupont De Nemours And Company | Azolecarboxamide herbicides |
| US7419978B2 (en) | 2003-10-22 | 2008-09-02 | Bristol-Myers Squibb Company | Phenyl-aniline substituted bicyclic compounds useful as kinase inhibitors |
| GB0329572D0 (en) | 2003-12-20 | 2004-01-28 | Astrazeneca Ab | Amide derivatives |
| TWI338004B (en) | 2004-02-06 | 2011-03-01 | Bristol Myers Squibb Co | Process for preparing 2-aminothiazole-5-aromatic carboxamides as kinase inhibitors |
| US7652146B2 (en) | 2004-02-06 | 2010-01-26 | Bristol-Myers Squibb Company | Process for preparing 2-aminothiazole-5-carboxamides useful as kinase inhibitors |
| US7491725B2 (en) | 2004-02-06 | 2009-02-17 | Bristol-Myers Squibb Company | Process for preparing 2-aminothiazole-5-aromatic carboxamides as kinase inhibitors |
| US20060069132A1 (en) | 2004-04-07 | 2006-03-30 | Armel Gregory R | Azolecarboxamide herbicides |
| US20080312215A1 (en) | 2005-06-28 | 2008-12-18 | Pharmacopeia Drug Discovery, Inc. | Substituted [1,4]-diazepanes as CXCR3 antagonists and their use in the treatment of inflammatory disorders |
-
2004
- 2004-05-03 AT AT04751133T patent/ATE482200T1/de active
- 2004-05-03 JP JP2006514216A patent/JP4601611B2/ja not_active Expired - Fee Related
- 2004-05-03 AT AT09010209T patent/ATE522525T1/de not_active IP Right Cessation
- 2004-05-03 GE GEAP20049086A patent/GEP20074236B/en unknown
- 2004-05-03 US US10/838,129 patent/US7396935B2/en active Active
- 2004-05-03 MX MXPA05011666A patent/MXPA05011666A/es active IP Right Grant
- 2004-05-03 EP EP11005867.4A patent/EP2385041B1/en not_active Expired - Lifetime
- 2004-05-03 KR KR1020057020642A patent/KR20060022649A/ko not_active Application Discontinuation
- 2004-05-03 RU RU2005135162/04A patent/RU2342365C2/ru not_active IP Right Cessation
- 2004-05-03 EP EP09010209A patent/EP2133348B1/en not_active Expired - Lifetime
- 2004-05-03 ES ES04751133T patent/ES2350837T3/es not_active Expired - Lifetime
- 2004-05-03 EP EP04760683A patent/EP1617840A4/en not_active Withdrawn
- 2004-05-03 RS YUP-2005/0789A patent/RS20050789A/sr unknown
- 2004-05-03 WO PCT/US2004/013604 patent/WO2004099156A1/en active Application Filing
- 2004-05-03 CN CNA2004800188458A patent/CN1816529A/zh active Pending
- 2004-05-03 ES ES04760705T patent/ES2386784T3/es not_active Expired - Lifetime
- 2004-05-03 DE DE602004029242T patent/DE602004029242D1/de not_active Expired - Lifetime
- 2004-05-03 SI SI200431517T patent/SI1618092T1/sl unknown
- 2004-05-03 AU AU2004236240A patent/AU2004236240C1/en not_active Ceased
- 2004-05-03 CA CA002524321A patent/CA2524321A1/en not_active Abandoned
- 2004-05-03 WO PCT/US2004/013594 patent/WO2004098518A2/en active Application Filing
- 2004-05-03 PL PL04751133T patent/PL1618092T3/pl unknown
- 2004-05-03 BR BRPI0409949-4A patent/BRPI0409949A/pt not_active IP Right Cessation
- 2004-05-03 PT PT04751133T patent/PT1618092E/pt unknown
- 2004-05-03 EP EP04760705A patent/EP1620108B1/en not_active Expired - Lifetime
- 2004-05-03 US US10/838,006 patent/US7151113B2/en active Active
- 2004-05-03 WO PCT/US2004/013786 patent/WO2004098528A2/en active Application Filing
- 2004-05-03 DK DK04751133.2T patent/DK1618092T3/da active
- 2004-05-03 ES ES09010209T patent/ES2370463T3/es not_active Expired - Lifetime
- 2004-05-03 UA UAA200511373A patent/UA81668C2/ru unknown
- 2004-05-03 US US10/837,778 patent/US7414056B2/en active Active
- 2004-05-03 NZ NZ543375A patent/NZ543375A/en unknown
- 2004-05-03 EP EP04751133A patent/EP1618092B1/en not_active Expired - Lifetime
-
2005
- 2005-10-26 NO NO20054970A patent/NO20054970L/no not_active Application Discontinuation
- 2005-10-28 IS IS8101A patent/IS8101A/is unknown
- 2005-10-31 ZA ZA200508830A patent/ZA200508830B/xx unknown
- 2005-11-01 CO CO05111218A patent/CO5640039A2/es not_active Application Discontinuation
-
2006
- 2006-06-28 US US11/477,010 patent/US7253170B2/en not_active Expired - Lifetime
-
2007
- 2007-08-02 US US11/832,924 patent/US7592338B2/en not_active Expired - Lifetime
- 2007-10-31 US US11/931,309 patent/US7390810B2/en not_active Expired - Lifetime
-
2008
- 2008-05-12 US US12/118,794 patent/US7605273B2/en not_active Expired - Lifetime
-
2009
- 2009-09-18 US US12/562,383 patent/US20100016320A1/en not_active Abandoned
-
2010
- 2010-12-06 HR HR20100670T patent/HRP20100670T1/hr unknown
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210094161A (ko) * | 2015-12-16 | 2021-07-28 | 닛뽕소다 가부시키가이샤 | 아릴아졸 화합물 및 유해 생물 방제제 |
| US11884633B2 (en) | 2015-12-16 | 2024-01-30 | Nippon Soda Co., Ltd. | Arylazole compound and pest control agent |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4601611B2 (ja) | キナーゼインヒビターとして有用なアリール置換ピラゾール−アミド化合物 | |
| EP1910348B1 (en) | Benzothiazole and azabenzothiazole compounds useful as kinase inhibitors | |
| EP1778693B1 (en) | Tricyclic-heteroaryl compounds useful as kinase inhibitors | |
| EP1594854B1 (en) | Thiazolyl-based compounds useful as kinase inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |