KR101052581B1 - 음이온 결합성 중합체 및 그 용도 - Google Patents
음이온 결합성 중합체 및 그 용도 Download PDFInfo
- Publication number
- KR101052581B1 KR101052581B1 KR1020067010898A KR20067010898A KR101052581B1 KR 101052581 B1 KR101052581 B1 KR 101052581B1 KR 1020067010898 A KR1020067010898 A KR 1020067010898A KR 20067010898 A KR20067010898 A KR 20067010898A KR 101052581 B1 KR101052581 B1 KR 101052581B1
- Authority
- KR
- South Korea
- Prior art keywords
- polymer
- delete delete
- amine
- crosslinked
- phosphate
- Prior art date
Links
- JMASBTZJOKUHTO-ZHLKMWHVSA-N C/C=C(/CN)\C=C(/C)\CN Chemical compound C/C=C(/CN)\C=C(/C)\CN JMASBTZJOKUHTO-ZHLKMWHVSA-N 0.000 description 1
- 0 C1C2C(*CC3)C33C2C13 Chemical compound C1C2C(*CC3)C33C2C13 0.000 description 1
- DHUJSIVUHAIAMS-UHFFFAOYSA-N CC(C)(CC(C)(C)N1CCNCC1)N Chemical compound CC(C)(CC(C)(C)N1CCNCC1)N DHUJSIVUHAIAMS-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F26/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by a single or double bond to nitrogen or by a heterocyclic ring containing nitrogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/74—Synthetic polymeric materials
- A61K31/785—Polymers containing nitrogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
- A61P3/14—Drugs for disorders of the metabolism for electrolyte homeostasis for calcium homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F26/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by a single or double bond to nitrogen or by a heterocyclic ring containing nitrogen
- C08F26/06—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by a single or double bond to nitrogen or by a heterocyclic ring containing nitrogen by a heterocyclic ring containing nitrogen
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/02—Polyamines
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/02—Polyamines
- C08G73/0206—Polyalkylene(poly)amines
- C08G73/0213—Preparatory process
- C08G73/022—Preparatory process from polyamines and epihalohydrins
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L39/00—Compositions of homopolymers or copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by a single or double bond to nitrogen or by a heterocyclic ring containing nitrogen; Compositions of derivatives of such polymers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L39/00—Compositions of homopolymers or copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by a single or double bond to nitrogen or by a heterocyclic ring containing nitrogen; Compositions of derivatives of such polymers
- C08L39/02—Homopolymers or copolymers of vinylamine
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Polymers & Plastics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Physical Education & Sports Medicine (AREA)
- Rheumatology (AREA)
- Endocrinology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Macromolecular Compounds Obtained By Forming Nitrogen-Containing Linkages In General (AREA)
- Polymers With Sulfur, Phosphorus Or Metals In The Main Chain (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Medicinal Preparation (AREA)
- Steroid Compounds (AREA)
Abstract
음이온 결합성 중합체에 대하여 기술된다. 일부 경우에서 음이온 결합성 중합체는 저팽윤 음이온 결합성 중합체이다. 일부 경우에서, 음이온 결합성 중합체는 중합체의 일부가 중합체에 대한 표적 이온의 분자량의 일정 비율 이상인 상호작용이 없는 용질에 이용될 수 없도록 하는 동공 부피 분배를 가지고 있다. 일부 경우에서, 음이온 결합성 중합체는 낮은 이온 결합 간섭도의 특징을 가지는데, 여기에서 간섭도는 예를 들어 비간섭 완충액에서와 비교한 위장 유사액에서 측정된다. 또한 약학 조성물, 사용 방법 및 키트에 대하여 기술된다.
Description
상호 참조
본 출원은 2004년 3월 22일에 출원되고 제목이 “가교 아민 중합체”인 일련 번호 10/806,495, 2003년 11월 3일에 출원되고 제목이 “폴리아민 중합체”인 일련 번호 10/701,385, 그리고 2004년 10월 13일에 출원되고 제목이 “음이온 결합성 중합체와 그 용도”인 일련 번호 10/965,044의 일부계속출원으로, 기존 출원은 여기에 참고문헌으로 전문이 포함되며 35 USC 120조에 근거하여 우선권이 주장된다.
이온 선택적 흡착제는 고인산혈증, 고옥살산뇨증, 고칼슘혈증 및 고칼륨혈증과 같은 상태의 전해질 균형 장애를 바로잡기 위한 인간 치료에 사용되어 왔다. 고인산혈증은 신장이 음식물로부터 섭취하는 외인 포스페이트를 상쇄할 만큼 충분한 포스페이트를 분비하지 못하는 신부전증을 가진 환자에게서 발생한다. 이러한 상태는 높은 혈청 포스페이트 농도와 높은 칼슘 x 포스페이트 곱으로 이어진다. 병인은 완전히 증명되지 않았지만, 높은 칼슘 x 포스페이트 곱이 연조직석회화 및 심장혈관 질환에 대한 책임이 있는 것으로 알려져 왔다. 심장혈관 질환은 모든 투석 환자에 있어 거의 절반의 사인이다.
위장관에서의 포스페이트 흡수를 조절하고 전신의 포스페이트 수치를 정상으로 회복시키기 위해 알루미늄염, 칼슘염, 그리고 좀 더 최근에 란탄염이 처방되어 왔다. 그러나 이러한 염들은 가용성의 알루미늄 및 칼슘 양이온을 위장관에 유리시키며, 이 양이온들은 그후 부분적으로 혈류에 흡수된다. 알루미늄 흡수는 알루미늄 골 질환과 치매와 같은 심각한 부작용을 야기할 수 있으며, 칼슘 다량 섭취는 고칼슘혈증으로 이어지고 환자들을 심장동맥 석회화의 위험에 처하게 한다.
강염기 이온교환 물질 즉 도웩스(Dowex) 및 콜레스티라민 (Cholesyramine) 수지와 같은 비금속 포스페이트 결합제를 포스페이트 결합제로 사용할 것이 제안되어 왔다. 그러나 결합능이 낮기 때문에 환자들이 잘 적응하지 못하는 높은 복용량이 필요하다.
아민 작용기성 중합체가 포스페이트 결합제 또는 옥살레이트 결합제로서 기술되어 왔다. 예를 위해서는 5,985,938; 5,980,881; 6,180,094; 6,423,754와 PCT 공개 WO 95/05184를 참조하기 바란다. 가교 폴리알릴아민 수지인 레나겔 (Renagel)은 비금속 포스페이트 결합제로 상품화된 포스페이트 격리 물질이다. 생체외 (In vitro)에서 레나겔의 포스페이트 결합능은 물에서는 6 mmol/gm, 중성 pH에서 100 mM 염화나트륨과 20 mM 포스페이트에서 측정할 때는 2.5 mmol/gm이다. 포스페이트 농도를 6 mg/dL보다 낮게 유지하기 위해 표적의 환자 집단에게 권장된 복용량은 전형적으로 하루에 5 그램에서 15 그램 사이이다. 건강한 지원자들에게 실행된 레나겔에 대한 발표된 제1임상 단계에 의하면, 15 그램의 레나겔은 포스페이트 뇨 배설을 기준치인 25 밀리몰에서 17 밀리몰로 감소시키는데, 이 차이는 자유 포스페이트 와 중합체가 결합된 포스페이트로서 대변으로 배설된다. 이 데이터로부터, 생체내 (in vivo) 결합능 범위는 0.5-1 mmol/gm로 성립될 수 있는데, 이는 식염수에서 측정된 생체외 결합능인 6 mmol/gr보다 훨씬 낮은 것이다. 식염수에서 측정된 레나겔의 생체외 결합능만을 고려할 때, 15 그램의 포스페이트 결합제 결합능은 평균 미국인들의 식사의 전 포스페이트 함량인 1일 당 37 밀리몰보다 더 많이 결합할 것이다. 혈청 포스페이트를 안전한 범위로 낮추기 위해 더 많은 수지가 필요하게 되므로, 생체외 결합능과 자료화된 낮은 생체내 결합능의 불일치는 약의 치료 효과에 부정적인 영향을 끼친다.
이러한 이온교환 수지 결합능 상실은 위장관 환경과 같은 복잡한 환경에서 사용될 경우 레나겔에만 국한되는 것이 아니다. 독물학상 관점에서 볼 때 일반적으로 안전하기는 하더라도, 다량의 복용량과 수 그램의 수지를 복용하는 데 수반되는 불편함은 수지 결합능 개선의 필요에 찬성하게 한다. 한 예로서, 레나겔 결합제에 대한 보고된 안전성 연구에서조차 환자들이 8주간 1일당 최저 1.2-2.0 그램의 복용량에 위장관 불쾌감을 보고하였다. 1일당 5.4 그램의 레나겔을 투여받은 환자들은 연구 사례의 8.9%인 위장관 불쾌감 같은 부작용에 기인하여 치료를 중단하였다 (Slatapolsky, et al Kidney Int. 55:299-307, 1999; Chertwo, et al Nephrol Dial Transplant 14:2907-2914, 1999). 따라서 더 낮고 잘 적응되는 복용이 되게 할 생체내 결합능의 개선은 수지에 기반을 둔 치료에 있어 환영받는 개선이 될 것이다.
이러한 사항들을 고려할 때, 더 낮은 약 용량과 더 나은 환자 순응도를 가지 며 신체로부터 이온을 선택적으로 제거하는, 안전하며 고용량의 결합제의 필요성이 여전히 높다.
오늘날 환자 순응도는 환자가 K/DOQI 권장사항에 따르는 데 주된 제한 요소 중의 하나로 인식된다. 용량 증가는 환자가 매일 800 밀리그램짜리 알약을 10정 또는 그 이상을 복용해야 함을 의미한다. 레나겔 알약은 삼킬 수 있는 정제의 형태로 최소한의 액체와 함께 투여되는데, 이는 수분 제한이 요구되는 말기신질환 환자들에게 부담을 증가시킨다. 더 복용하기 쉬운 약학적 제제가 바람직할 것이다: 특히 저작정이 노인 및 소아 인구와 큰 알약의 부담이 요구되는 치료에서 점점 인기를 끌고 있다. 저작정은 더 강한 알약을 가능하게 하여 궁극적으로 매 식사 당 정제의 수를 감소시킨다. 저작정에 포함된 유효성분은 씹기와 타액의 효과로 인해 삼켜지기 전에 먼저 분산되기 때문에, 정제의 형태와 중량에 대한 요건이 삼키는 정제에 가해지는 요건보다 훨씬 덜 엄격하다. 그러나, 현재까지 중합체의 높은 팽윤 특성 때문에 레나겔과 같은 수화겔을 저작정으로 만드는 것이 가능하지 않았다. 레나겔은 등장 용액에서 보통 제 중량의 10배까지 매우 빠르게 팽윤한다. 이는 별로 바라지 않는 2 가지 결과를 가져온다: 우선, 입에 있는 동안 중합체가 팽윤하여 심한 불쾌감을 주고 (구강 건조, 질식감), 둘째로, 환자가 구강의 감각을 극복한다 하더라도 팽윤된 겔을 식도에 투여하는 것은 위험할 수 있다. 게다가, 고팽윤성 겔을 수 그램의 범위로 투여하면 더부룩함, 변비 또는 설사 같은 부작용을 일으킨다는 것 또한 잘 알려져 있다.
발명의 요약
한 가지 측면에서, 이 발명은 음이온 결합성 중합체를 제공한다. 일부 실시예에서, 이 발명은 중합체가 표적 음이온(예를 들면, 포스페이트 또는 옥살레이트)에 결합하고, 중합체가 다음 특징 중 적어도 2 가지의 특징을 가지는 음이온 결합성 중합체를 제공한다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
일부 실시예에서, 팽윤율은 약 4 미만, 또는 약 3 미만, 또는 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만, 또는 약 2.5 미만이다. 일부 실시예에서, 중합체는 약 2 mmol/gm 미만, 또는 약 1 mmol/gm미만, 또는 약 0.5 mmol/gm 미만, 또는 약 0.3 mmol/gm 미만, 또는 약 0.1 mmol/gm 미만의 결합능으로 담즙산 또는 시트레이트에 결합한다. 일부 실시예에서, 팽윤율은 중성 pH의 등장 용액에서 측정된다. 일부 실시예에서, 중합체는 아민 단량체로 구성된다. 일부 실시예에서, 아민 단량체는 알릴아민, 비닐아민, 에틸렌이민, 1,3-디아미노 프로판, N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄, 1,2,3,4 테트라아미노부탄, 화학식 1 및 화학식 2로 구성된 군에서 선택되는데, 이때 화학식 1과 화학식 2는 다음의 구조를 가진다:
화학식 1 화학식 2
일부 실시예에서, 이 발명은 중합체가 역상 현탁에 의해 얻어지는 가교 중합체를 포함하는 음이온 결합성 중합체를 제공하며, 여기에서 중합체의 팽윤율은 5 미만이다.
일부 실시예에서, 이 발명은 포스페이트 결합성 중합체를 제공하며, 이때 중합체는 다음 특징 중 적어도 1 가지의 특징을 가진다: a) 약 5 미만, 바람직하게는 약 2.5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 약 200 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임. 일부 실시예에서, 팽윤율은 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만이다. 일부 실시예에서, 중합체는 약 2 mmol/gm 미만, 또는 약 1 mmol/gm 미만, 또는 약 0.5 mmol/gm 미만, 또는 약 0.3 mmol/gm 미만, 또는 약 0.1 mmol/gm 미만의 결합능으로 담즙산 또는 시트레이트에 결합한다. 일부 실시예에서, 팽윤율은 중성 pH의 등장 용액에서 측정된다.
일부 실시예에서, 본 발명은 포스페이트 결합성 중합체를 제공하며, 이때 중 합체는 팽윤율 5 미만, 바람직하게는 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만이거나, 가장 바람직하게는 약 2.5 미만의 특징을 가지며, 이 비율은 중성 pH의 등장 용액에서 측정된다. 실시예에서, 중합체는 0.5 mole/gm보다 높은 평균 생체내 포스페이트 결합능을 가진다. 실시예에서, 중합체는 폴리아민 중합체이고, 중합체의 클로라이드 함량은 아민기 함량의 약 35 몰%보다 적다.
일부 실시예에서, 이 발명은 중합체가 표적 음이온(예를 들면, 포스페이트 또는 옥살레이트)에 결합하고, 중합체가 다음 특징 중 적어도 2 가지의 특징을 가지는 음이온 결합성 중합체를 제공한다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
이때 중합체는 1종 이상의 아민 단량체와 1종 이상의 가교제를 포함하며, 중합체는 아민:용매 비율이 약 3:1에서 약 1:3까지의 비율로 가교되기 전에 아민이 용매에 존재하는 과정에 의해 생성되고, 그리고 반응 혼합물에 가해진 가교제 총 함량은 아민 단량체에 대한 평균 연결 수 (NC)가 약 2.05와 약 6 사이, 또는 약 2.2와 약 4.5 사이가 된다. 일부 실시예에서, 중합체는 또한 표적 음이온이 가교 반응 동안에 존재하는 과정에 의해 생성되는데, 그 예는 다음과 같다: a) 아민 단량체를 유리 염기로 가하고 표적 음이온을 이의 산 형태로 가한다; b) 가교제를 가한다; c) 가교 반응을 수행한다, 그리고 d) 표적 이온을 씻어낸다.
일부 실시예에서, 이 발명은 중합체가 표적 음이온(예를 들면, 포스페이트 또는 옥살레이트)에 결합하고, 중합체가 다음 특징 중 적어도 2 가지의 특징을 가지는 음이온 결합성 중합체를 제공한다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
이때 중합체는 1종 이상의 아민 단량체와 1종 이상의 가교제를 포함하고 중합체는 다음 단계를 포함하는 방법에 의해 생성된다: a) 아민 단량체 성분 전부를 한 후 연속적으로 가교제를 일부분씩 연속적으로 가함으로써 시럽(syrup)을 형성하여 가용성 초기중합체를 형성하는 단계; b) 시럽을 유중에서 에멀젼화하는 단계; 및 c) 가교제의 남은 일부를 가하여 가교된 비드를 형성하는 단계.
일부 실시예에서 본 발명은 중합체가 표적 음이온(예를 들면, 포스페이트 또는 옥살레이트)에 결합하고, 중합체가 다음 특징 중 적어도 2 가지의 특징을 가지는 음이온 결합성 중합체를 제공한다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및, c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임, 이때 중합체는 1종 이상의 아민 단량체와 1종 이상의 가교제를 포함하고 중합체는 다음 단계를 포 함하는 방법에 의해 생성된다: a) 아민 단량체와 가교제 간의 1차 반응을 수행하여 겔을 형성하는 단계; b) 상기 겔을 아미노알킬할라이드와 반응시키는 단계로서, 여기서 아민 알킬기는 아민 작용기성 겔의 할라이드 치환을 통해 겔에 화학적으로 부착되는 것인 단계.
일부 실시예에서, 이 발명은 1종 이상의 아민 단량체와 1종 이상의 가교제를 포함하는 포스페이트 결합성 중합체를 제공하며, 이때 중합체는 반응 혼합물에 가해진 가교제 총 함량은 아민 단량체에 대한 평균 연결 수가 2.2와 4.5 사이가 되는 과정에 의해 생성된다.
일부 실시예에서, 아민 단량체는 1,3-디아미노 프로판과 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄으로 구성된 군에서 선택되고, 이때 가교제는 1,3 디클로로프로판과 에피클로로히드린으로 구성된 군에서 선택된다. 실시예에서, 이 발명은 에피클로로히드린으로 가교된 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄을 포함하는 이온 결합성 중합체를 제공하며, 이때 중합체는 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄의 초기 농도와 물의 비율이 약 1:3 내지 약 4:1, 또는 약 1.5:1 내지 약 4:1인 과정에 의해 생성된다.
일부 실시예에서, 이 발명은 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄 단량체와 에피클로로히드린 가교제를 포함하는 포스페이트 결합성 중합체를 제공하며, 여기에서 중합체는 반응 혼합물에 가해진 총 에피클로로히드린 가교제의 양이 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄 함량의 약 200% 내지 약 300 몰%, 또는 약 230 내지 약 270 몰%, 또는 약 250 몰%이 되는 과 정에 의해 생성된다. 이러한 일부 실시예에서, 중합체는 초기 반응 혼합물에서 단량체와 물의 비율이 약 3:1 내지 약 1:1, 또는 약 1.73이 되는 과정에 의해 생성된다. 일부 실시예에서, 중합체는 구형 비드의 형태이다.
일부 실시예에서, 이 발명은 폴리알릴아민 단량체와 에피클로로히드린 가교제로 구성된 포스페이트 결합성 중합체를 제공하며, 여기에서 중합체는 폴리알릴아민 단량체를 단량체:물의 비율이 약 3:1 내지 약 1:3이 되도록 물에 먼저 녹임으로써 생성된다. 이러한 일부 실시예에서, 반응 혼합물에 가해진 총 에피클로로히드린 양은 총 폴리알릴아민 함량의 약 10 몰%이다.
일부 실시예에서, 이 발명은 1,3 디아미노 프로판과 1,3 디클로로프로판 가교제가 1:1 몰비로 구성된 초기중합체를 포함하는 포스페이트 결합성 중합체를 제공하며, 여기에서 초기중합체는 에피클로로히드린 가교제와 더 가교되고, 여기에서 반응 혼합물에 가해진 총 에피클로로히드린 가교제의 양은 총 초기중합체 양의 약 200 몰%이고, 반응 혼합물의 초기중합체:물의 비율은 약 1.1:1 내지 약 1.7:1이다.
이 발명은 중합체가 입자의 형태이고 중합체 입자가 외피에 싸여 있는 임의의 상기 중합체를 포함하는 조성물을 뒤이어 제공한다.
또 다른 측면에서, 이 발명은 약학 조성물을 제공한다. 한 실시예에서, 약학 조성물은 본 발명의 중합체와 약학적으로 허용되는 부형제를 포함한다. 일부 실시예에서, 조성물은 중합체가 액체 운반 수단인 물과 적절한 부형제 내에서 분산되는 액제이다. 일부 실시예에서, 이 발명은 표적 음이온에 결합하는 음이온 결합성 중합체, 1종 이상의 적절한 약학 부형제로 구성된 약학 조성물을 제공하며, 이 때 조성물은 경구 붕괴되는 저작정의 형태이고, 구강과 식도를 통과하는 동안 중합체의 팽윤율이 약 5 미만, 또는 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만 또는 바람직하게는 약 2.5 미만이다. 일부 실시예에서 저작정은 50℃보다 높은 전이 온도를 갖는 중합체를 포함한다.
일부 실시예에서 저작정은 수크로스, 만니톨, 크실리톨, 프럭토스, 소르비톨 및 이의 조합물로 구성된 군으로부터 선택된 약학 부형제를 포함하고, 고용체를 형성하도록 중합체가 부형제와 함께 예비 제제화되는 과정에 의해 생성된다. 일부 실시예에서 중합체의 표적 음이온은 포스페이트이다. 일부 실시예에서 중합체는 생체내에서 0.5 mmol/gr 이상의 결합능으로 표적 이온에 결합한다. 일부 실시예에서 음이온 결합성 중합체는 정제 중량의 약 50% 이상이다. 일부 실시예에서, 정제는 직경이 약 22 밀리미터이고 높이가 약 4 밀리미터인 원주형이고, 음이온 결합성 중합체는 총 정제 중량 중 약 1.6 그램 이상을 포함한다. 이 발명의 일부 저작정에서, 부형제는 감미제, 결합제, 윤활제 및 붕괴제로 구성된 군에서 선택된다. 임의적으로, 중합체는 평균 직경이 약 40 um 미만인 입자로서 존재한다. 이러한 일부 실시예에서, 감미제는 수크로스, 만니톨, 크실리톨, 말토덱스트린, 프럭토스 그리고 소르비톨 및 이의 조합물로 구성된 군으로부터 선택된다.
또 다른 측면에서, 이 발명은 표적 이온에 결합하는 이온 결합성 중합체에 대한 표적 이온 결합 간섭도를 다음과 같이 측정하는 방법을 제공한다: a) 표적 이온을 함유하는 비간섭 완충액에 이온 결합성 중합체를 가하고 중합체의 표적 이온 결합능을 측정하는 단계; b) 포유동물의 위장관 효소로 표준 식이를 인위적으로 소 화시키는 방식 및/또는 상기 표준 식이를 섭취한 포유동물의 상부위장관으로부터 유미즙을 흡인하는 방식에 의해 간섭 완충액 제조하는 단계로서, 여기서 표준 식이는 표적 이온을 포함하는 것인 단계; c) 이온 결합성 중합체를 가하고, 평형에 이른 동일 농도에서 비간섭 완충액에서와 소화된 식사 또는 탈체 가사액에서의 결합 측정 사이에 관찰되는 표적 이온에 대한 표적 이온 결합능을 측정하여 백분율로 표현하는 단계.
더 이어진 측면에서, 본 발명은 i) 1) 단량체에 대한 가교제의 비율; 2) 반응 매질에서 용매에 대한 (단량체 + 가교제)의 비율; 3) 생리적 pH와 장성에서 중합체의 순전하; 및/또는 4) 골격 중합체의 친수성/소수성 균형을 변화시키는 단계; ii) 생성되는 중합체의 팽윤성, 다공성 및 이온 결합 간섭도 평가하는 단계; 및 iii) 상기 특징 중 적어도 1개의 특징을 가지는 중합체 선택하는 단계를 포함하는, 이온 결합성 중합체를 선택하는 방법을 제공하며, 여기서 상기 중합체는 단량체 및 가교제를 포함하고, 하기 특징 a) ∼ c) 중 적어도 1가지 특징을 가진다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
또 다른 측면에서, 이 발명은 다음 단계 중 적어도 1 단계를 포함하는 폴리아민 중합체의 치료적 특성 및/또는 투여 적합성 및/또는 약학적 특성을 개선하는 방법을 제공한다: a) 폴리아민 단량체에 대한 평균 연결 수가 약 2.05와 약 6 사이가 되도록 상기 중합체를 가교제로 가교시키는 단계; 및/또는 b) 폴리아민:물의 비율이 약 3:1 내지 1:3이 되는 비율로 폴리아민이 초기에 존재하는 방법에 의해 상기 중합체를 생성하는 단계.
또 다른 측면에서, 이 발명은 표적 이온에 결합하는 음이온 결합성 중합체를 제조하는 방법을 제공하며 이는 아민 단량체와 가교제를 불균일법에 의해 배합하는 것을 포함하며, 여기에서 포스페이트 결합성 중합체는 다음 특징 중 적어도 2 가지의 특징을 가진다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
일부 실시예에서 아민 단량체는 폴리알릴아민이다. 일부 실시예에서 가교제는 에피클로로히드린이다.
또 다른 측면에서 이 발명은 표적 이온에 결합하는 음이온 결합성 중합체를 제공하며, 여기에서 중합체는 폴리알릴아민을 불균일 과정에 의해 가교시키는 것을 포함하는 과정에 의해 생성되고, 그리고 상기 중합체가 다음 특징 중 적어도 2 가지의 특징을 가진다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징 으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임. 한 실시예에서, 폴리알릴아민은 에피클로로히드린에 의해 가교된다.
또 다른 측면에서, 본 발명은 이 발명의 중합체의 유효량을 동물에게 투여함으로써 음이온을 동물로부터 제거하는 방법을 제공한다. 일부 실시예에서, 중합체는 음이온 결합성 중합체이며 이때 중합체는 표적 음이온(예를 들면, 포스페이트 또는 옥살레이트)에 결합하고, 중합체는 다음 특징 중 적어도 2 가지의 특징을 가진다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
일부 실시예에서, 중합체의 표적 음이온은 포스페이트이고, 일부 실시예에서 포스페이트는 위장관으로부터 제거되며, 일부 실시예에서 투여 방법은 경구 복용이다. 일부 실시예에서, 동물은 고인산혈증, 저칼슘혈증, 갑상선기능항진증, 신장의 칼시트리올 합성 기능저하, 저칼슘혈증으로 인한 강직, 신기능부전, 연조직에서의 이소성 석회화, 그리고 말기신질환으로 구성된 군으로부터 선택된 질환 중 적어도 1개의 질환을 앓고 있다. 일부 실시예에서, 동물은 인간이다.
일부 실시예에서, 중합체는 위산 분비 억제제, 칼슘감지수용체, 비타민 및 그 유사체, 또는 탄산알루미늄, 탄산칼슘, 아세트산칼슘, 탄산란탄 및 염산 세벨라 머와 같은 포스페이트 결합제 중 적어도 1 가지와 공동 투여된다.
참조 병합
본 명세서에 언급된 모든 발표문과 특허 출원은 각각의 발표문 또는 특허 출원이 참조 병합으로 특정적 및 개별적으로 언급된 것과 똑같은 범위로 여기에 참조로 병합된다.
도면의 간단한 설명
도 1은 비간섭 완충액에서 중합체에 의한 표적 이온의 등온 결합도를 간섭 매질(예를 들면, 위장 유사액 또는 탈체 가사액)에서 중합체에 의한 표적 이온의 결합도에 비교함으로써 결합 간섭도를 측정함을 보여주는 그래프이다.
도 2는 겔의 접근 가능하지 않은 부피 대 시료 용질 반경을 보여주는 그래프이다.
도 3은 포스페이트 결합성 중합체 (EC172A)에 대한 결합 간섭도 측정을 보여주는 그래프이다.
도 4는 포스페이트 결합성 중합체(레나겔)에 대한 결합 간섭도 측정을 보여주는 그래프이다.
도 5는 상호 작용하지 않는 시료에 대해 접근 가능하지 않은 부피 대 시료 분자량을 도시한 것으로, 본 발명의 포스페이트 결합성 중합체 (EC 172A)와 시판되는 포스페이트 결합제(레나겔)의 차이를 보여주는 것이다.
도 6은 상호 작용하지 않는 시료에 대해 접근 가능하지 않은 부피 대 시료 반경을 도시한 것으로, 본 발명의 포스페이트 결합성 중합체 (EC 172A)와 시판되는 포스페이트 결합제(레나겔)의 차이를 보여주는 것이다.
도 7은 FR-005-144를 염화프로필아민, 염산으로 변형시켰을 때 결합능의 변화를 보여주는 그래프이다.
이 발명의 새로운 특징들은 첨부된 청구항에서 상세하게 진술된다. 본 발명의 특징과 이점은, 발명의 원리가 이용되고 그에 대한 도면을 수반하여 실례를 든 실시예에서 진술되는 다음의 상세한 설명을 참조하면 더 잘 이해가 될 것이다:
I.
서론
발명의 한 측면에서 낮은 팽윤성, 생체내에서의 높은 이온 결합능, 간섭 이온으로부터의 낮은 간섭도 및/또는 특정 다공성의 특징 중 1개 이상의 특징을 가지는 음이온 결합성 중합체 물질을 제공한다. 발명의 또 다른 측면에서 음이온 결합성 중합체의 약학 조성물을 제공하며, 이때 약학 조성물은 저작정이거나 액제이다. 발명의 더 나아간 측면에서 낮은 팽윤성, 생체내에서의 높은 이온 결합능, 간섭 이온으로부터의 낮은 간섭도 및/또는 특정 다공성의 특징 중 1개 이상의 특징을 가지는 음이온 결합성 중합체를 만들거나 개선시키는 방법을 제공한다. 발명의 한층 더 나아간 측면은 이온이 과잉된 상태를 치료하는 데 본 발명의 음이온 결합성 중합체를 이용하는 방법에 대한 것이다. 바람직한 한 실시예에서, 음이온 결합성 중합체가 위장관으로부터 표적 음이온을 제거하는 데 사용된다. 위장관으로부터 제거될 수 있는 표적 음이온의 예로는 포스페이트와 옥살레이트를 들 수 있는데, 이에 국한되지는 않는다. 또 다른 바람직한 실시예에서, 여기에 서술된 조성물은 고인산혈증, 저칼슘혈증, 갑상선기능항진증, 신장의 칼시트리올 합성 기능저하, 저칼슘혈증으로 인한 강직, 신기능부전, 연조직에서의 이소성 석회화, 그리고 동화 대사의 치료에 사용된다.
II
.
중합체
이 발명의 중합체는 이온에 결합하는 능력이 있다는 특징을 가진다. 바람직하게는 이 발명의 중합체는 음이온에 결합하며, 더 바람직하게는 포스페이트 및/또는 옥살레이트에 결합하고, 그리고 가장 바람직하게는 포스페이트에 결합한다. 설명을 위하여, 음이온 결합성 중합체 및 특히 포스페이트 결합성 중합체가 설명될 것이나, 이 기술은 당업자에게는 명백하게 보일 적절한 변형을 하면 모든 이온과 용질에 동등하게 적용된다. 여기에 사용된 바대로, 중합체는 음이온과 같은 이온에 “결합”하는, 즉 “이온 결합” 중합체(예를 들면, “포스페이트 결합” 중합체)로, 일반적으로 중합체가 이온과 결합할 때 반드시 비공유적인 방법을 통한 것은 아니며, 적어도 이온의 일부분이 생체외 또는 생체내 조건에서 결합된 상태로 머무를 정도의 충분한 결합능으로 결합하는데, 이런 조건에서 중합체는 충분한 시간 동안 용액으로부터 또는 신체로부터의 이온 제거를 달성하는 데 사용된다. “표적 이온”은 중합체가 결합하는 이온으로, 통상적으로 중합체에 의해 결합되는 주 이온, 또는 중합체에 결합하는 이온이 중합체의 치료 효과를 생산한다고 생각되는 이온을 칭한다. 중합체는 1종 이상의 표적 이온을 가질 수 있다. 음이온의 “결합능”은 최소 결합능 이상으로, 즉 중합체 1그램 당 적어도 약 0.01 밀리몰의 음이온, 더 바람직하게는 중합체 1그램 당 적어도 약 0.05 밀리몰의 음이온, 좀 더 바람직하게는 중합체 1그램 당 적어도 약 0.1 밀리몰의 음이온, 그리고 가장 바람직하게는 중합체 1그램 당 적어도 약 0.5 밀리몰의 음이온이다. 이 발명은 선택적 음이온 결합이라는 특징을 가진 중합체를 제공하며, 예를 들어, 일부 실시예에서, 이 발명의 중합체는 약 2 mol/gm 미만, 바람직하게는 약 1 mol/gm 미만, 더 바람직하게는 약 0.5 mol/gm 미만, 좀 더 바람직하게는 약 0.3 mol/gm 미만, 가장 바람직하게는 약 0.1 mol/gm 미만의 결합능으로 담즙산에 결합한다. 일부 실시예에서, 이 발명의 중합체는 약 2 mmol/gm 미만, 바람직하게는 약 1 mmol/gm 미만, 더 바람직하게는 약 0.5 mmol/gm 미만, 좀더 바람직하게는 약 0.3 mmol/gm 미만, 가장 바람직하게는 약 0.1 mmol/gm 미만의 결합능으로 시트레이트에 결합한다.
A.
특징
이 발명의 중합체는 다음의 특징 중 1개 이상의 특징을 가진다: 1) 낮은 팽윤율; 2) 생리적 조건 하에서 낮은 결합 간섭도; 3) 표적 이온에 결합하고 간섭 용질을 제외시키는 데 적절한 다공성; 4) 치료 용도로 효과적이기에 충분한 표적 이온에 대한 생체내 결합능. 일부 실시예에서, 중합체는 음이온 결합성 중합체(예를 들어, 포스페이트 및/또는 옥살레이트에 결합하는 중합체)이며, 이때 중합체는 다음 특징 중 적어도 2 가지의 특징을 가진다: 1) 약 5 미만의 팽윤율; 2) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 3) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
일부 실시예에서, 중합체는 적어도 다음 특징 중 적어도 1 가지의 특징을 가지는 포스페이트 결합성 중합체이다: 1) 약 5 미만이며, 바람직하게는 약 2.5 미만의 팽윤율; 2) 생리적 매질에서 측정한 겔 동공 부피 분포는, 약 200 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 3) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임. 일부 실시예에서, 포스페이트 결합성 중합체의 팽윤율은 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만이다. “생리적 매질”은 중성에서 등장인 매질이다. 일부 실시예에서 이 발명은 중성의 등장 매질에서 측정된 팽윤율이 약 5 미만, 바람직하게는 약 2.5 미만이고, 임의적으로 포스페이트에 대한 생체내 결합능 평균이 약 0.5 mole/gm 이상인 특징을 가지는 포스페이트 결합성 중합체를 제공한다. 일부 실시예에서, 포스페이트 결합성 중합체의 팽윤율은 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만이다. 일부 실시예에서, 이 발명의 중합체는 약 2 mmol/gm 미만, 바람직하게는 약 1 mmol/gm 미만, 더 바람직하게는 약 0.5 mmol/gm 미만, 좀 더 바람직하게는 약 0.3 mmol/gm 미만, 그리고 가장 바람직하게는 약 0.1 mmol/gm의 결합능으로 담즙산에 결합한다. 일부 실시예에서, 이 발명의 중합체는 약 2 mmol/gm 미만, 바람직하게는 약 1 mmol/gm 미만, 더 바람직하게는 약 0.5 mmol/gm 미만, 좀 더 바람직하게는 약 0.3 mmol/gm 미만, 그리고 가장 바람직하게는 약 0.1 mmol/gm 미만의 결합능으로 시트레이트에 결합한다. 바람직하게, 중합체는 아민 단량체로 구성된다.
일반적으로, 이러한 특징들은 중합체의 생성에 있어 1개 이상의 요소를 조절함으로써 성취될 수 있다.
1) 팽윤율. 이 발명의 중합체는 가교 물질이며, 이는 중합체가 용매에서 녹지 않고 기껏해야 용매에서 팽윤한다는 의미이다.
대표적인 사용 환경인 위장관과 같은 생리적 등장 완충액에서의 팽윤율은 전형적으로 약 1.2 내지 약 100의 범위에 들며, 바람직하게는 약 2 내지 20에 든다. 일부 실시예에서, 이 발명의 중합체는 약 5 미만, 또는 약 4 미만, 또는 약 3 미만, 또는 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만, 또는 약 2.5 미만의 팽윤율을 가진다. 여기에서 사용된 바대로, “팽윤율”은 수성 환경에서 평형이 유지되었을 때 1 그램의 건조 가교 중합체에 의해 취해진 용매의 그램 수를 가리킨다. 주어진 중합체에 대한 팽윤 측정값이 1개 이상이면, 팽윤율은 측정값의 평균을 취한다.
팽윤율은 다양한 방법을 이용하여 측정 가능하다: 가장 바람직한 방법은 중량법으로, 건조 중합체를 중량을 재고 과량의 액체에 가하는 방법이다. 일부 경우에 액체는 증류수일 수 있으며; 바람직하게는 액체가 혈장에 대해 등장인 수용액이고; 가장 바람직하게는 액체가 혈장에 대해 등장이고 중성 pH로 완충된 수용액이다. 예를 들면, 0.9% NaCl 용액이 사용될 수 있다. 포스페이트 완충 식염수(PBS) 또한 사용될 수 있다. 팽윤 측정에 가장 바람직한 생리적 매질은 30 mM MES로 완충된 0.9% NaCl이고 pH가 약 6.5와 7.5 사이이다. 건조 중합체(예를 들어, 포스페이트 결합성 중합체)는 대개 클로라이드와 같은 상대이온과 함께 완전히 양성자화된 형태로 사용된다. 중합체는 평형에 이를 때까지 액체에 담가 둔다. 그리고 나서 푹 젖은 겔을 원심분리기로 분리하여, 상층액은 기울여 따르고, 젖은 겔의 중량을를 잰다. 겔 붕괴를 피하기 위해 너무 높은 g 수로 원심분리하지 않도록 주의한다. 팽윤율(SR)은 “(젖은 겔의 중량 - 건조 중합체의 중량)/건조 중합체의 중량”로 계산된다.
또 다른 방법은 염색법으로, 겔과 상호 작용하지 않는다고 알려진 분자량이 매우 큰 염료를 수용액으로 조제하여 건조 중합체의 분취량을 용액에 가하는 방법이다. 중합체에 대한 용액의 중량 대 중량 비율은 예상되는 팽윤율에 가까우면서 약간 높도록 조정된다. 염료의 분자량이 매우 크기 때문에 (예를 들어 200,000 g/mol 이상), 물은 겔에 스며드는 반면 염료는 스며들지 않으므로, 결과적으로 염료 농도는 증가하게 되고, 이로부터 팽윤율이 측정된다. 유용한 염료의 예로는 fluoresceine isothiocyanate (FITC)로 구조가 변형된 덱스트란이 있다.
중합체의 팽윤율은 온도, 이온 세기, 중합체 전하 밀도, 중합체-용매 Flory-Huggins 계수 및 전교 밀도와 같은 변수의 수에 의해 좌우된다. 이 발명의 이온 결합성 중합체는 대부분 하전 중합체(예를 들어, 포스페이트 결합 폴리아민은 창자의 pH에서 양성자화된다)이기 때문에, 전형적인 여러자리 전해질 이온 겔의 팽윤 거동을 보인다. 팽윤율이 크면 대개 동공이 큰 것처럼 팽윤율과 동공 크기가 어느 정도 관련이 있기는 하지만, 여러자리 전해질 이온 겔의 배제 한계를 정확하게 예측할 수 있는 이론적인 근거는 없다.
2) 결합 간섭도. 일부 실시예에서, 이 발명의 중합체는 위장 유사액에서 측정했을 때 약 70% 미만, 더 바람직하게는 약 60% 미만, 좀 더 바람직하게는 약 50% 미만, 더욱 바람직하게는 약 40% 미만, 더더욱 바람직하게는 약 30% 미만, 그리고 가장 바람직하게는 약 20% 미만의 결합 간섭도를 가진다. 이 발명의 포스페이트 결합성 중합체는 위장 유사액에서 측정했을 때 약 70% 미만, 더 바람직하게는 약 60% 미만, 좀 더 바람직하게는 약 50% 미만, 더욱 바람직하게는 약 40% 미만, 더더욱 바람직하게는 약 30% 미만, 그리고 가장 바람직하게는 약 20% 미만의 결합 간섭도를 보인다.
“결합에서의 간섭 정도” 또는 여기에서 사용된 바대로 “결합 간섭도”는 표적 이온에 대한 결합능의 감소 비율을 가리키며, 백분율로 표시되고, 평형 상태이고 표적 음이온의 농도가 같을 때 비간섭 완충액에서와 위장 유사액에서의 결합 실험에서 관찰된다. 여기에서 사용된 바대로 “비간섭 완충액”은 표적 이온과의 결합을 간섭하는 1개 이상의 용질을 포함하지 않는 완충액을 가리키며, 위장 유사액에서와 같은 pH로 완충된다. 비간섭 완충액에 반드시 모든 간섭 용질이 없는 것은 아니며, 예를 들어 비간섭 완충액에는 위장에 널리 퍼져 있는 이온인 클로라이드나 카르보네이트 중 하나 또는 둘 다 있을 수 있으며, 존재하는 경우, 생리적 농도일 것이다. 비간섭 완충액의 예는 실시예 1에 주어진다. 여기에서 “위장 유사액”은 식사 섭취 후 위장관 일부분의 환경을 모방하도록 조제된 것을 가리키며, 바람직하게는 위장관의 이 부분에서 중합체가 대부분의 표적 이온과 결합할 것이다. 위장 유사액은 전형적으로 실시예 1에서 설명된 방법에 의해 조제된다. 위장 유사액의 표적 이온은 비간섭 완충액 실험에서 사용된 것과 같은 농도로 존재해야 한다. 간섭도는 도 1에서 보여진 바처럼 위장 유사액과 비간섭 완충액에 상응하는 2개의 결합 등온선을 도시함으로써 쉽게 설명된다. 위장 유사액을 이용하여 결합 간섭도를 측정하는 예가 실시예 1에 주어진다.
또한 피험자(바람직하게는 인간 피험자)의 소화 가사액 내 표적 이온의 결합을 비간섭 완충액에서의 결합에 비교함으로써 결합 간섭도를 측정하는 것도 가능하다. 이 측정을 하려면, 많은 피험자로부터 가사액을 얻어야 하고 평균 간섭도를 결합 간섭도로서 취해야 한다.
팽윤율 선택 및/또는 겔의 분자량 배제 한계 조절을 주의깊게 함으로써, 경쟁 방식(예를 들면, 생체내 또는 위장 유사액에서)에서 측정된 결합능이 같은 중합체 조성을 가지면서 겔 다공성에 있어 최적화되지 않은 같은 다른 겔에 비교하여 상당히 증가될 수 있다는 것이 밝혀졌다.
놀랍게도, 가교 및/또는 얽힘이 증가된 중합체는 가교 및/또는 얽힘이 낮은 중합체보다 낮은 팽윤성을 가지는 것으로 밝혀졌지만, 표적 이온(예를 들어, 포스페이트)에 대한 결합능은 가교 및/또는 얽힘이 낮은 중합체와 같거나 더 컸다. 이론에 얽매이지는 않기 바라면서, 발명의 중합체가 체 효과를 발휘하며 용액 내의 특정 크기의 용질에만 결합하고 중합체 내의 결합 자리에 경쟁할 만한 크기가 더 큰 다른 종들은 배제한다고 가정한다. 분자량이 더 큰 종에는, 무기 및 유기 음이온, 올리고펩티드, 탄수화물, 빌리루빈, 지방질 미셀 및 지방질 막소포가 있으나, 이에 국한되는 것은 아니다.
(3) 다공성. 중합체를 생산하는 과정을 중합체가 목표로 하는 표적 이온(예를 들어, 음이온)에 결합하고 간섭 물질을 배제하기에 적절한 다공성을 더 최상으로 나타내도록 조절하는 것이 가능하다는 사실이 밝혀졌다.
중합체 겔의 동공 크기 분포는 수은 다공도측정법, 질소 흡착, 시차주사열량법, 또는 용질 투과 분배 기술과 같은 다양한 방법에 의해 얻어진다. 마지막 기술인 용질 투과 분배 기술이, 사용되는 환경에서 우세한 상태와 동일한 완전히 수화된 상태에서 겔을 검사하기에 가장 바람직하다. 용질 투과 기술은 Kuga (Kuga S.J., J. of Chromatography, 1986, 206:449-461)에 의해 소개된 간접 방법이며 분자량을 알고 있는 용질의 겔 분배를 측정하는 것을 포함한다. 이 방법에는 다음의 주요 단계가 포함된다 (Kremer et al., Macromolecules, 1994, 27, 2965-73):
1. 농도와 분자 크기를 알고 있는 용질이 녹아 있는 용액을 팽윤된 겔과 접촉하도록 한다. 용질의 분자 크기는 반드시 기본적인 범위를 포함해야만 한다.
2. 겔로의 용질 확산이 이루어진다. 특정 용질의 분배는 용질의 크기와 겔 동공의 크기 분포 둘 다에 의해 좌우된다.
3. 겔을 주위 용액으로부터 분리하고 나서, 주위 용액 내의 용질의 농도 측정을 한다. 초기 저장 용질 농도에 비교한 각 용질 농도의 감소량이 겔 동공 크기 분포 계산에 사용된다.
분자간 인력/반발 효과로부터 크기 배제 효과를 분리하기 위하여, 용질은 겔 중합체와 상호작용이 거의 없거나 전혀 없는 중합체 또는 소중합체로부터 선택되며; 폴리에틸렌글리콜, 폴리에틸렌 옥시드 또는 덱스트란과 같이 분자량 분포가 좁은 중성의 친수성 중합체가 가장 적합하다. 그러므로, 여기에서 별도의 언급이 없는 한, 용질의 특정 크기의 배제를 위한 부피(또한 여기에서 “임계 투과 부피”라고도 불림)는 측정되는 중합체와 본질적으로 상호 작용이 없는 용질을 이용하여 측정한 부피를 가리킨다.
Kremer et al., Macromolecules, 1994, 27, 2965-73에서 주어진 실험 프로토콜과 자료 처리 방법을 따라서, 동공 크기 분포는 도 2에서와 같이 표현될 수 있다. 도 2에서 Y축은 주어진 분자 크기의 용질에 접근 가능하지 않은 팽윤 겔의 부피를 나타낸다. 도에서 보여진 예에서, 5 옹스트롬 미만의 크기를 가진 작은 분자는 겔 전체에 걸쳐 투과할 수 있다. 다른 쪽 극단에서, 유체 역학 반경이 1000 옹스트롬 이상인 중합체는 젤로부터 완전히 배제된다. 그런 경우에 평형 상태에서 접근 가능하지 않은 부피와 겔의 부피는 같다.
중합체의 크기와 분자량은 Mark-Houvink 방정식을 통하여 관계 지어지며, 이는 분자 표식자로서 이용된 중합체 용질에 대해 표로 작성된다. 예를 들어:
반경 (옹스트롬))=0.217M0 .498 덱스트란
반경 (옹스트롬))=0.271M0 .517 폴리에틸렌글리콜
반경 (옹스트롬)=0.166M0 .573 폴리에틸렌옥시드
저분자량 표식자 또한 이용될 수 있다:
요소: 분자 반경 2.5 옹스트롬
에틸렌글리콜: 분자 반경 2.8 옹스트롬
글리세롤: 분자 반경 3.1 옹스트롬
글루코스: 분자 반경 4.4 옹스트롬
사카로스: 분자 반경 5.3 옹스트롬
그러므로, 용질의 크기는 분자량으로 전환될 수 있으며 그 역도 성립된다.
용질의 크기가 동공의 크기와 같은 것은 아니다; 그렇지 않다면 용질의 분자 크기보다 큰 동공 내에 존재하는 모든 액체가 접근 가능한 부피로 사용될 수 있다는 의미가 될 것이다: 이것은 기벽 효과라고도 알려진 배제 부피 효과 때문에 옳지 않다.
분자 배제 한계를 특징 짓는 직접적인 방법은 다음과 같다: (i) 분자 표식자의 분배를 정량한다, (ii) 상술된 대로 접근 가능한 부피(또는 중량)를 계산한다 그리고 (iii) 그것을 총 겔 부피(또는 중량)로 표준화한다.
중합체 가닥의 얽힘과 가교제의 농도와 같은 생성 변수를 조정함으로써 원하는 분자 배제 한계를 성취할 수 있다. 일반적으로, 중합체는 결합될 이온(예를 들어, 음이온)에 근거한 분자 배제 한계와 배제되길 원하는 간섭 물질 같은 가능한 동일성, 중합체 용도에 대해 허용되는 팽윤량을 갖도록 생성된다. 발명의 일부 실시예에서, 이온 결합성 중합체는 상기된 절차에 따라 정의되고, 중합체 동공 부피의 약 60% 미만, 약 40% 미만, 또는 약 20% 미만이 표적 이온 분자량의 2배 이상의 분자량을 가지는 상호작용이 없는 용질에 접근 가능한 생리적 매질에서 측정된 겔 동공 부피 분포(임계 투과 부피)를 나타낸다. 발명의 일부 실시예에서, 이온 결합성 중합체는 중합체 동공 부피의 약 60% 미만, 약 40% 미만, 또는 약 20% 미만이 표적 이온 분자량의 약 1.8배 이상의 분자량을 가지는 상호작용이 없는 용질에 접근 가능한 겔 동공 부피 분포(임계 투과 부피)를 나타낸다. 발명의 일부 실시예에서, 이온 결합성 중합체는 중합체 동공 부피의 약 60% 미만, 약 40% 미만, 또는 약 20% 미만이 표적 이온 분자량의 약 1.6배 이상의 분자량을 가지는 상호작용이 없는 용질에 접근 가능한 겔 동공 부피 분포(임계 투과 부피)를 나타낸다. 발명의 일부 실시예에서, 이온 결합성 중합체는 중합체 동공 부피의 약 60% 미만, 약 40% 미만, 또는 약 20% 미만이 표적 이온 분자량의 약 1.4배 이상의 분자량을 가지는 상호작용이 없는 용질에 접근 가능한 겔 동공 부피 분포(임계 투과 부피)를 나타낸다. 발명의 일부 실시예에서, 이온 결합성 중합체는 중합체 동공 부피의 약 60% 미만, 약 40% 미만, 또는 약 20% 미만이 표적 이온 분자량의 약 1.2배 이상의 분자량을 가지는 상호작용이 없는 용질에 접근 가능한 겔 동공 부피 분포(임계 투과 부피)를 나타낸다. 발명의 실시예에서, 상기된 절차에 따라 정의되고, 중합체 동공 부피의 약 60% 미만, 약 40% 미만, 또는 약 20% 미만이 약 200 이상, 더 바람직하게는 약 180 이상, 좀 더 바람직하게는 약 160 이상, 더욱 바람직하게는 약 140 이상, 그리고 가장 바람직하게는 약 120 이상의 분자량을 가지는 상호작용이 없는 용질에 접근 가능한 생리적 매질에서 측정된 겔 동공 부피 분포(임계 투과 부피)를 나타내는 포스페이트 결합성 중합체를 제공한다.
4) 결합능. 여기에서 기술된 중합체는 이온 결합 성질, 일반적으로 음이온 결합 성질을 나타낸다. 바람직한 실시예에서, 중합체는 포스페이트 결합 성질을 나타낸다. 이온(예를 들어, 포스페이트) 결합능은 주어진 용액에서 이온 결합제가 결합할 수 있는 특정 이온의 양을 측정한 것이다. 예를 들어, 이온 결합성 중합체의 결합능은 물 또는 식염수와 같은 생체외 조건, 또는 이온(예를 들어, 포스페이트) 뇨 배설과 같은 생체내 조건, 또는 실험 동물, 환자 또는 자원자들로부터 얻어진 미즙과 같은 가사액을 이용한 탈체 조건에서 측정될 수 있다. 측정은 표적 이온만을 포함하거나, 적어도 중합체에 대한 반응에 대해 표적 이온과 경쟁하는 다른 경쟁 용질이 없는 용액에서 이루어질 수 있다. 이러한 경우, 비간섭 완충액이 이용될 것이다. 또는, 수지에 대한 결합에 대해 표적 이온과 경쟁하는 다른 이온이나 대사 물질과 같은 다른 경쟁 용질의 존재 하에 측정을 할 수 있다.
중합체에 대한 이온 결합능은 mmol/gr로 표시되는 V*(Cstart-Ceq)/P로 계산되는데, 이때 V는 사용된 용질에 대한 고정 부피이고 단위는 L이며, Cstart는 용질의 초기 표적 이온 농도로서 단위는 mM이고, Ceq는 단위가 그램인 중합체 중량 P를 가하고 평형이 성립된 후의 용액내의 평형 표적 이온 농도로서 단위는 mM이다.
일부 실시예에서 중합체는 포스페이트에 결합한다. 고인산혈증 치료와 같은 생체내 용도를 위해서, 중합체가 높은 포스페이트 결합능을 가지는 것이 바람직하다. 결합능의 생체외 측정이 항상 생체내 결합능과 같은 것은 아니다. 그러므로, 생체외 결합능과 생체내 결합능 모두에 대해 결합능을 정의하는 것이 유용하다.
비간섭 완충액에 본 발명의 중합체에 대한 생체외 포스페이트 결합능은 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 5.0, 6.0, 8.0, 또는 10.0 mmol/gr 이상일 수 있다. 일부 실시예에서, 표적 이온에 대한 본 발명의 중합체의 생체외 포스페이트 결합능은 약 0.5 mmol/gr 이상, 바람직하게는 약 2.5 mmol/gr 이상, 더 바람직하게는 약 3 mmol/gr 이상, 좀 더 바람직하게는 약 4 mmol/gr 이상, 더욱 바람직하게는 약 6 mmol/gr 이상이다. 일부 실시예에서, 포스페이트 결합능은 약 0.5 mmol/gr에서 약 10 mmol/gr의 범위에 있으며, 바람직하게는 약 2.5 mmol/gr 내지 약 8 mmol/gr의 범위, 그리고 더 바람직하게는 약 3 mmol/gr 내지 약 6 mmol/gr의 범위에 있다. 포스페이트 결합능을 측정하는 여러 가지 방법이 현 기술 상 알려져 있다. 이 발명의 중합체에 대한 생체외 포스페이트 결합능은 실시예 1에서 비간섭 완충액에서의 결합능 측정에 대해 기술된 바대로 측정된다.
일부 실시예에서, 인간 피험자로부터의 소화 가사액에서 측정된 본 발명의 포스페이트 결합성 중합체의 탈체 포스페이트 결합능 평균은 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0, 1.2, 1.4, 1.6, 1.8, 2.0, 2.5, 3.0, 4.0, 5.0, 또는 6.0 mmol/gr 이상이다. 탈체 가사액은 실시예 1에서 기술된 대로 정상 피험자로부터 얻어지며, 결합은 비간섭 완충액에 대하여 측정된다. 평균값은 약 5-15명, 또는 약 15-30명, 또는 약 30-60명의 피험자로부터 취한다. 일부 실시예에서, 측정값은 6-12명의 피험자로부터 취한다.
여기에서 사용된 바대로, “생체내 포스페이트 결합능 평균”은 별도로 명기되지 않는 한 정상 인간 피험자에게서 측정된 중합체의 결합능을 가리키며, 이때 중합체의 포스페이트 결합능은 자유 포스페이트 및 중합체가 결합된 포스페이트로서 변으로 배설된 포스페이트의 측정과 결합된 포스페이트 뇨 배설에서의 감소에 의해 측정된다 (아래 참조). 평균값은 약 5-15명, 또는 약 15-30명, 또는 약 30-60명의 피험자로부터 취한다. 일부 실시예에서, 측정값은 6-12명의 피험자로부터 취한다. 일부 실시예에서, 이 발명의 중합체의 생체내 평균 포스페이트 결합능은, 바람직하게는 인간 피험자에게서 측정되고, 적어도 약 0.3 mmol/gr, 적어도 약 0.5 mmol/gr, 적어도 약 0.8 mmol/gr, 적어도 약 1.0 mmol/gr, 적어도 약 1.5 mmol/gr, 적어도 약 2.0 mmol/gr, 적어도 약 3.0 mmol/gr, 적어도 약 4.0 mmol/gr, 적어도 약 5.0 mmol/gr, 또는 적어도 약 6.0 mmol/gr이다.
중합체의 생체내 결합능은 바람직하게는 포유동물에서의 (바람직하게는 인간에서의) 표적 이온(예를 들면, 포스페이트)의 균형을 측정함으로써 결정될 수 있다: 피험자에게 포스페이트 및 결합성 중합체의 함량이 조절된 식사가 주어지고, 포스페이트 섭취량과 대변과 소변으로 배설된 포스페이트를 모니터한다. 이 실험은 세척 기간, 피험자가 일일 용량(바람직하게는 하루에 3번)의 포스페이트 결합제를 복용하는 기간, 기준선으로의 복귀를 관찰하기 위해 치료제를 복용하지 않는 며칠 간으로 구성된다. 소변에서의 포스페이트 결핍은 대개 대변에서의 포스페이트 증가와 일치한다. “(대변에서 배설된 포스페이트의 몰 수 - 기준선)/투여된 결합제의 중량”가 생체내 결합능의 측정값을 제공한다. 달리 명시되지 않는 한, 여기에서 언급된 “생체내” 측정은 상기 프로토콜을 이용한 것이다. 또 다른 방법은 생체내 포스페이트 결합을 측정하고 제자리 (in situ)에서 실시예 1에 명시된 프로토콜을 따르는 것을 포함하는데, 여기에서 작은 창자의 일정 지점에서 미즙을 회수하기 위한 이중내강튜브를 포유동물에 삽입한다. 임의의 포스페이트 함량이 포함된 식사를 함량을 알고 있는 포스페이트 결합제 및 표지물과 함께 투여한다. 표지물은 염료나 비흡수성 중합체(예를 들어, 폴리에틸렌글리콜)일 수 있으며, 표지물을 미즙에서 적정하여 소화 과정 중에 일어나는 희석도를 측정한다. 그리고 나서 식사 내의 초기 농도와 표지물 실험으로 측정된 희석 비율로부터 결합제의 실제 농도를 계산한다. 총 포스페이트 함량은 미즙 시료에 대해 분석된다. “가용성” 포스페이트 함량은 시료를 원심분리하고 상층액을 기울여 따르고 포스페이트를 분석함으로써 측정된다. “결합된” 포스페이트 함량은 총 포스페이트 함량과 가용성 포스페이트 함량 사이의 차에 의해 얻어진다. 위약(미세결정성 셀룰로스)이나 약 중 하나를 복용하는 피험자 군(6-12명)에 대해 두 시리즈의 실험이 행해진다. 결합능은 “약 투여를 한 것과 하지 않은 두 세트의 실험 간의 “결합된” 포스페이트 함량의 증가 / 결합제의 농도”를 측정함으로써 얻어진다. 피험자 기준 또는 군 기준으로 계산을 할 수 있다.
B.
중합체 제조
발명의 중합체는 당업자에게 알려진 방법에 의해 조제되며 그 예를 들면 다음과 같다: 이온 결합 단량체 또는 그 선구 물질이 가교제 존재 하에 공중합될 수 있다; 기성 이온 결합성 중합체가 이어서 화학 반응이나 조사(照射)를 통하여 가교된다; 또는 중합체 선구 물질이 먼저 가교되고 중합체에 이온 결합 작용기를 생성하도록 더 반응시켜진다.
중합체는 직접 또는 역상 현탁, 에멀젼, 침전법, 연무제에서의 중합화 또는 벌크 중합화/가교 방법 사용, 그리고 압출 및 연마와 같은 크기 축소 공정에 의해 얻어진다. 공정은 배치, 준연속 및 연속 공정으로 실행될 수 있다.
팽윤율, 결합 간섭도, 결합능 및 분자량 배제 한계는 적어도 다음의 조성과 공정 변수에 의한 영향을 받는다:
1 - 중합체 사슬의 화학적 가교의 농도.
2 - 가교 반응에서 용매에 대한 (단량체 + 가교제)의 비율.
3 - 중합체의 순전하 (중합체가 사용될 환경의 생리적 pH와 장성에서).
4 - 골격 중합체의 친수성/소수성 균형.
5 - 껍질 구성 성분이 핵심 물질의 팽윤 범위를 제한하는 핵심-껍질 구조의 존재 또는 부재.
다음에서, 조성 및 공정의 바람직한 조작 범위가 포스페이트 결합 성질을 가진 가교된 폴리아민 물질로 예시되고 있다. 이 예는 대표적인 조건에 한한 것이며 여기에 기술된 방법은 광범위한 용질에 결합하는 중합체의 선택과 생성에 사용될 수 있음이 당업자에게는 명백할 것이다.
1) 중합체 사슬의 화학적 가교의 농도. 화학적 가교의 농도는 중합체의 팽윤 성질과 동공 분포를 조절하는 중요한 특징이다. 이 발명의 중합체를 기술하는 간편한 한 방법은 아민 반복 단위와 나머지 중합체에 대한 평균 연결 수를 정의하는 것이다. “A”는 아민 반복 단위로 정의되고 “NC”는 “A”로부터의 평균 연결 수이며, NC는 2, 3, 4 및 그 이상일 수 있다. 불용성 겔을 형성하기 위해서는, 일반적으로 NC가 2 이상이어야 한다.
NC 값은 그리고 나서 다음의 방정식에 의해 아민 대 가교제 화학량적 비율로 전환될 수 있다.
N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄 또는 1,3 디아미노 프로판과 같은 저분자량 단량체의 경우, NC=BㆍFb/A이고, 이때 B는 가교제의 몰 수, Fb는 공유 결합을 형성하기 위해 A와 반응하는 B의 원자단의 수, 그리고 A는 아민의 몰 수이다.
아민 물질이 고분자량을 가지고 있고, 비닐아민, 폴리에틸렌이민, 폴리비닐아민, 또는 폴리알릴아민과 같이 아민 단량체의 중합화로부터 유도된 경우에는, 중합체 골격 내에서 아민 단량체 반복을 잇는 2개의 연결을 참작해서 식이 바뀐다. 그러면 NC는 다음과 같이 된다: NC=(2ㆍA + BㆍFb)/A.
역으로, 아민에 대한 가교제의 몰비는 상기 방정식을 변형시켜 목표 NC 값으로부터 계산될 수 있다:
저분자량 아민:
B/A= NCㆍFb
고분자량 아민:
B/A= (NC-2)ㆍFb
아래의 표는 NC와 실제 가교제 대 아민 비율 사이의 전환 예를 보여주는데, 여기에서 아민은 고분자량 물질이거나 저분자이고, 가교제 물질은 이작용기성이거나 삼작용기성이다.
놀랍게도, 생체내 효능을 반영하는 결합 선택성이 NC에 대해 최적을 통과한 것이 밝혀졌다: NC 값이 낮은 범위일 때, 물질은 상당히 팽윤하는 경향이 있었으며 결과적으로 위장 유사액에서 많은 결합 간섭도를 보였다. 그러나, 높은 범위에서는, 물질이 본질적으로 낮은 고유 결합능을 보였으며 이 때문에 생체내에서의 전반적 성능이 분명하게 낮아졌다. 최적 NC 값은 아민/가교제 시스템에 따라 2.05에서 5 사이인 것으로 밝혀졌다.
그러나 최종 중합체에 원하는 특성들의 조합을 부여하는 최적 범위는 사용되는 특정 단량체와 가교제, 그리고 반응 매질 내의 단량체 초기 농도와 같은 생성 과정에서 사용되는 다른 조건들에 의존하며, 일상 실험에 관한 문제이다.
일부 실시예에서, 중합체 내 단량체의 총 아민기에 대한 가교제의 비율은 50 몰% 이상, 60 몰% 이상, 70 몰% 이상, 80 몰% 이상, 또는 90 몰% 이상이다.
1종 이상의 저분자량 아민 단량체와 1종 이상의 가교제를 포함하는 포스페이트 결합성 중합체를 다루는 발명의 일부 실시예에서, NC는 약 2 이상, 또는 약 3 이상, 또는 약 4 이상이다. 일부 실시예에서 중합체는 에피클로로히드린(Fb = 2)에 의해 가교된 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄 단량체(저분자량 단량체)로부터 만들어지는데, 이때 B/A는 약 2.0 (몰/몰) 내지 약 3.0 (몰/몰) (즉, NC는 약 4 내지 약 6이다), 또는 약 2.3 (몰/몰) 내지 약 2.7 (몰/몰) (즉, NC는 약 4.6 내지 약 5.4이다), 또는 약 2.5 (몰/몰) (즉, NC는 약 5.0이다)이다. 일부 실시예에서 중합체는 에피클로로히드린에 의해 가교된 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄 단량체로부터 만들어지는데, 이때 물에 대한 단량체의 초기 비율은 약 3:1 w/w 내지 1:3 w/w, 또는 약 1.5:1 내지 약 2:1 w/w, 또는 약 1:1, 또는 약 3:1이고, B/A는 약 2.0 (몰/몰) 내지 약 3.0 (몰/몰) (즉, NC는 약 4 내지 약 6이다), 또는 약 2.3 (몰/몰) 내지 약 2.7 (몰/몰) (즉, NC는 약 4.6 내지 약 5.4이다), 또는 약 2.5 (몰/몰) (즉, NC는 약 5.0이다)이다.
2) 가교 반응에서 용매에 대한 (단량체 + 가교제 )의 비율. 모든 다른 조건들이 동일하게 유지될 때 용매에 대한 (단량체 + 가교제)의 비율이 높으면 밀집하게 가교된 물질이 선호된다. 예를 들어, 고분자량 아민이 사용되고 사슬 길이와 중합체 농도가 충분이 클 때는, 일단 구조가 화학적으로 가교되면 많은 가교 마디를 만드는 사슬 얽힘이 생성된다. 더 일반적으로, 고분자량 및 저분자량 아민 둘 다의 경우, 용매에 대한 (단량체 + 가교제)의 비율이 높으면 겔 결함(예를 들어 고리 구조를 유도하는 사슬내 가교, 결합되어 있지 않은 말단을 유도하는 미완성의 가교 반응)을 유도하는 부반응의 정도를 최소화하는 경향이 있다.
이러한 조건은 반응 매질에서의 단량체(예를 들어, 아민)와 가교제 둘 다의 농도에 의해 우선적으로 결정된다. 발명의 일부 실시예에서, 반응 매질에서의 단량체와 가교제의 농도는 약 20 중량%, 바람직하게는 40 중량%, 더 바람직하게는 60 중량% 이상이다. 일부 실시예에서, (단량체 + 가교제):용매(예를 들어, 물)의 비율은 약 3:1 내지 약 1:3 (w/w)으로 사용된다. 일부 실시예에서, (단량체 + 가교제):용매(예를 들어, 물)의 비율은 약 3:1 내지 약 1:1(w/w)으로 사용된다. 일부 실시예에서, (단량체 + 가교제):용매(예를 들어, 물)의 비율은 약 3:1 또는 약 2.5:1, 또는 약 2.0:1, 또는 약 1.5:1, 또는 약 1:1 (w/w)로 사용된다. 가교제는 중합화 반응 절차에 따라 다양한 시점에 가해질 수 있다. 일부 실시예에서, 초기 단량체:용매 비율(가교제를 가하기 전)은 약 4:1에서 1:1 사이, 또는 약 3:1에서 약 1:1 사이이고, 그리고 나서 가교제를 가하여 초기 단량체 함량의 약 100 몰%에서 약 400 몰% 사이, 또는 초기 단량체 함량의 약 200 몰%에서 약 300 몰% 사이가 되도록 한다. 일부 실시예에서, 단량체는 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄이고, 가교제는 에피클로로히드린이며, 그리고 초기 단량체:물 비율은 약 4:1 내지 1:1, 또는 약 3:1 내지 약 1:1, 또는 약 1.7, 또는 약 1.73이고, 그리고 가교제는 단량체 함량의 약 200 몰% 내지 약 300몰%, 또는 약 230 몰% 내지 약 270 몰%, 또는 약 250 몰%가 되도록 가한다.
예를 들어 단량체가 폴리알릴아민인 실시예과 같은 일부 실시예에서, 단량체의 양이 가교제의 양보다 훨씬 많고 (예를 들어, 몰 기준으로 가교제의 10배이며 중량 기준으로는 훨씬 더 많다), 그리고 상기 비율은 가교제를 무시한 단량체:용매 비율로 표현될 수도 있다. 일부 실시예에서, 단량체(예를 들어, 폴리알릴아민)는 약 3:1 내지 약 1:3의 단량체:용매의 비율로 존재한다. 일부 실시예에서, 단량체는 폴리알릴아민이고 가교제는 에피클로로히드린이며, 이때 폴리알릴아민은 약 3:1 내지 약 1:3의 단량체:물의 비율로 존재하고, 그리고 에피클로로히드린은 총 폴리알릴아민 함량의 약 10 몰%로 반응 혼합물에 가해진다.
가능하다면 무용매 과정이 훨씬 더 바람직하다: 한 실시예에서 아민과 가교제가 빨리 혼합되고 이어서 물과 같은 연속상에서 순액체로 분산된다. 가교 반응은 분산된 작은 방울 내에서 일어나고 비드의 형태로 회수된다.
3) 중합체의 순전하 (중합체가 사용될 환경의 생리적 pH 와 장성에서). 중합체의 순전하는 이온 결합의 몰 함량, 고유 전하, 그리고 생리적 pH에서의 이온화 정도에 의해 주어진다. 전하 밀도는 바람직하게는 3 내지 20 mmol/gr, 바람직하게는 6 내지 15 mmol/gr의 범위에 있다.
4) 골격 중합체의 친수성 / 소수성 균형. 중합체의 친수성 / 소수성 균형은 다소 단독적으로 화학적 가교 밀도와 팽윤율을 조절할 수 있게 한다. 팽윤율은 Flory-Huggins 형식론(Flory P.J. “Principles of Polymer Chemistry, Cornell Ithaca Pub.1953)에서 기술된 바대로 중합체 용매 상호작용 파라미터인 χij 에 매우 민감하다. 1953). χij 값을 0.4 및 그 이상으로 증가시키면 중합체에 대한 용매 조건이 좋지 않게 되고, 이로 인해 용매(물)에 대한 단량체의 상호작용이 최소화되며 따라서 팽윤도 훨씬 감소한다. 이것은 긴 사슬의 소수성, (폴리)방향족 치환체 또는 불화 원자단과 같은 소수성 부분을 겔에 포함시킴으로서 성취될 수 있다. 팽윤의 정도와 그 결과에 따른 겔의 배제 한계를 조절하기 위해 이 방법을 선택한 경우, 소수성 단량체와 가교제의 준위는 약 0.5 몰%에서 약 50 몰% 사이이며, 바람직하게는 약 20%에서 50% 사이이다.
바람직한 방법에서, 절대 소수성은 단량체의 log P에서의 절대 차에 의해 정량화된다. 정량적으로, 단량체의 소수성/친수성은 특정 단량체의 log P에 따라 결정될 수 있는데, log P는 때로 옥탄올-물 분배 계수로 불리기도 한다. Log P 값은 잘 알려져 있으며 물/1-옥탄올 분리된 혼합물에서 단량체의 농도를 결정하는 표준 시험에 의해 결정된다. 특히, 컴퓨터 프로그램이 시판되고 있을 뿐 아니라 인터넷에서 특정 단량체에 대한 log P 값을 개산(槪算)할 수도 있다. 이 출원에서 사용된 일부 log P 값은 웹사이트 http://esc.syrres.com/interkow/kowdemo.htm에서 개산된 것으로, 이 웹사이트는 간단히 CAS 등록 번호 또는 화학 표기법을 삽입하면 분자에 대한 log P 값을 제공한다. 소수성 단량체는 전형적으로 0 이상의 log P 값을 가질 것이고 친수성 단량체는 전형적으로 0에 가깝거나 0 이하의 log P 값을 가질 것이다. 일반적으로, 이 발명의 목적을 위한 소수성 단량체의 log P는 적어도 약 0.5, 바람직하게는 적어도 약 0.75, 더 바람직하게는 적어도 약 1.0, 좀 더 바람직하게는 적어도 약 1.5 그리고 가장 바람직하게는 적어도 약 2이어야 한다.
5) 껍질 구성 성분이 핵심 물질의 팽윤 범위를 제한하는 핵심-껍질 구조의 존재. 핵심-껍질 형태를 가진 겔 입자는 이 발명의 맥락에서 유용하다: 껍질 물질은 팽윤을 제한할 수 있고, 따라서 핵심 물질로부터 생기는 팽윤 압력에 대한 역학적 저항을 가함으로써 배제 한계를 제한하는데, 그렇지 않다면 핵심 물질은 훨씬 더 많이 팽윤할 것이다. 껍질 물질은 핵심 물질과 같은 조성일 수 있으나, 가교 밀도는 더 높아야 한다. 그러한 핵심-껍질 물질의 고안과 제조 방법은 US 특허 출원 번호 10/814,789에 나와 있다.
껍질 물질은 핵심 물질에 화학적으로 고정되거나 물리적으로 입혀질 수 있다. 전자의 경우, 껍질은 다음과 같은 예의 화학적 방법을 통해 핵심 구성 성분 위에서 자랄 수 있다: 핵심 중합체에 고정되는 활성 자리에서부터 진행되는 중합화 반응을 이용한 핵심에 대한 껍질 중합체의 화학적 접목; 계면 반응, 즉 계면 중축합화 반응 같은 핵심 입자 표면에서의 화학 반응; 그리고 핵심 입자 합성 동안 현탁화제로서 블록 (block) 공중합체 사용.
화학적 방법이 사용될 때는 계면 반응과 블록 중합체 사용이 바람직하다. 계면 반응 경로에서, 전형적으로, 핵심 입자의 표면은 핵심 경계면에서 저분자 또는 거대분자를 반응시킴으로써 화학적으로 변형된다. 예를 들어, 이온 결합 핵심 입자를 포함하는 아민은 에폭시, 이소시아네이트, 활성화된 에스테르, 할로겐기와 같은 아민 반응성기를 포함하는 중합체와 반응하여 핵심을 둘러싼 가교 껍질을 형성한다.
또 다른 실시예에서, 껍질이 먼저 계면 중축합화 또는 용매 코아세르베이션 (coacervation)을 이용하여 제조되어 피막을 형성한다. 그리고 나서 피막의 내부는 껍질 피막 내에 핵심을 만들도록 핵심 형성 선구 물질로 채워진다.
일부 실시예에서는 블록 공중합체 접근법을 사용하는데, 역상 또는 직접 현탁 입자 형성법에서 핵심 입자를 형성하기 위한 현탁화제로서 양친매성 블록 공중합체가 사용될 수 있다. 역상 유중수형 (water-in-oil) 현탁법이 사용될 때, 블록 공중합체는 연속 유상(油相)에 가용성인 하나의 블록과 핵심 중합체와 반응할 수 있는 작용기를 가진 또 다른 친수성 블록을 포함한다. 핵심 형성 선구 물질 및 유상과 더불어 수상(水相)에 가해질 때, 블록 공중합체는 유중수형 계면에 위치하여 현탁화제로서의 역할을 한다. 친수성 블록은 핵심 물질과 반응하거나, 또는 핵심 형성 선구 물질과 함께 반응한다. 입자들이 유상으로부터 분리되고 난 후, 블록 공중합체는 핵심 표면에 공유 결합으로 부착된 얇은 껍질을 형성한다. 블록의 화학적 성질과 길이는 관심 있는 용질에 대한 껍질의 투과 특성을 변화시키도록 바뀔 수 있다.
껍질 물질이 핵심 물질에 물리적으로 흡착되는 경우에는, 용매 코아세르베이션, 유동층 스프레이 코터 (spray coater), 또는 다중에멀젼법과 같은 잘 알려진 미세 캡슐화 기술이 사용될 수 있다. 바람직한 미세 캡슐화법은 Wurster 배열의 유동층 스프레이 코터이다. 또 다른 실시예에서, 껍질 물질은 입과 식도에서 핵심 입자의 팽윤을 지연시킴으로써 일시적인 작용만을 하고, 위나 십이지장에서 임의로 붕괴한다. 그리고 나서 껍질은 높은 소수성과 낮은 액체 투과성의 층을 형성함으로써 물이 핵심 입자 속으로 수송되는 것을 막도록 선택된다.
따라서, 발명의 한 측면에서 i) 1) 단량체에 대한 가교제의 비율; 2) 반응 매질에서 용매에 대한 (단량체 + 가교제)의 비율; 3) 생리적 pH와 장성에서 중합체의 순전하; 4) 골격 중합체의 친수성/소수성 균형을 변화시키는 단계; ii) 생성되는 중합체의 팽윤성, 다공성, 그리고 이온 결합 간섭도를 평가하는 단계; 및 iii) 상기 특징 중 적어도 1 가지의 특징을 가지는 중합체를 선택하는 단계에 의한 이온 결합성 중합체 선택 방법을 제공하며, 여기서 상기 중합체는 단량체 및 가교제를 포함하고, 다음의 특징 중 적어도 1 가지 특징을 가진다: 1) 약 5 미만의 팽윤율; 2) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 3) 표적 음이온에 대한 이온 결합 간섭도를 위장 유사액에서 측정했을 때 비간섭 완충액에서와 비교하여 약 60% 낮음.
또 다른 측면에서, 이 발명은 다음 단계 중 적어도 1 단계를 포함하는 폴리아민 중합체의 치료적 특성 및/또는 투여 적합성 및/또는 약학적 특성을 개선하는 방법을 제공한다: a) 폴리아민 단량체에 대한 평균 연결 수가 약 2.05와 약 6 사이가 되도록 상기 중합체를 가교제로 가교시키는 단계; 및/또는 b) 폴리아민이 약 3:1에서 1:3의 폴리아민:물의 비율이 이 되는 비율로 초기에 존재하는 방법에 의해 상기 중합체를 생성하는 단계.
C.
단량체
이 발명의 중합체에는 모든 적합한 단량체와 가교제가 사용될 수 있다. 중합체가 포스페이트 또는 옥살레이트에 결합할 때, 중합체는 대개 폴리아민과 가교제로 구성된다. 폴리아민은 미국 특허 번호 5,496,545; 5,667,775; 6,509,013; 6,132,706; 그리고 5,968,499; 그리고 미국 특허 출원 번호 10/806,495 및 10/701,385에 기술된 바와 같은 아민 작용기성 단량체를 포함한다. 이 특허 및 특허 출원은 여기에 참조 문헌으로 전문이 포함된다.
일부 실시예에서, 이 발명은 가교 아민 부분을 포함하는 이온 결합성 중합체를 제공한다. 이러한 일부 실시예에서, 중합체는 낮은 팽윤성, 생체내에서의 높은 이온 결합성, 간섭 이온으로부터의 낮은 간섭 및/또는 특정 다공성의 특성 중 1개 이상의 특징을 가진다. 동종중합체와 공중합제를 포함하여, 반복되는 가교 아민 단위를 가진 중합체가 여기에서 가교 아민 중합체로 일컬어진다. 중합체 내의 반복되는 아민 단위는 같거나 변화하는 길이의 반복되는 링커 (또는 개재) 단위에 의해 분리될 수 있다. 일부 실시예에서, 중합체는 “아민 반복 단위 + 개재 링커 단위”로 구성된다. 다른 실시예에서, 다중 아민 단위는 1개 이상의 링커 단위에 의해 분리된다.
이 발명의 중합체에서 유용한 하나의 단량체는 화학식 I의 아민으로 구성된다.
여기에서 각 n은 각각 3과 같거나 그 이상이고, m은 1과 같거나 그 이상이고, 그리고 각 R1은 각각 H이거나 선택적으로 치환된 알킬 또는 아릴이거나 또는 선택적으로 치환된 지방족 고리, 방향족 또는 이종원자고리기를 형성하기 위해 이웃하는 R1에 연결된다. 한 실시예에서, 이 발명은 기술된 대로 화학식 I의 아민으로 구성되는 가교 아민 중합체이며, 이때 아민은 가교제와 함께 가교된다.
화학식 I의 바람직한 아민에는 다음이 포함된다:
이 발명의 한 측면에서 본 발명의 중합체를 이용하여 인간을 포함한 동물을 치료하는 방법을 제공한다. 이 측면의 한 실시예는 가교 아민 중합체의 유효량을 투여함으로써 동물의 위장관으로부터 포스페이트를 제거하는 방법으로, 여기에서 상기 중합체는 화학식 I의 아민을 포함한다.
이 발명의 중합체에서 유용한 2번째 단량체는 화학식 II의 아민으로 구성된다.
여기에서 p=1일 때 R2와 R3는 둘 다 H가 아니며 p=2, 3, 또는 4일 때 R2와 R3는 H, 알킬 또는 -C(R1)2-R4-N(R1)2이고 R4는 결합이거나 메틸렌이라는 조건 하에 p는 1, 2, 3, 또는 4이고, 각 R1은 각각 H이거나 선택적으로 치환된 알킬 또는 아릴이거나 또는 선택적으로 치환된 지방족 고리, 방향족 또는 이종원자고리기이고, R2와 R3는 각각 H이거나 선택적으로 치환된 알킬 또는 아릴이다; 그 외에 일부 실시예에서 화학식 II의 아민은 p가 4 이상인 아민을 포함한다. 여러 실시예에서, p는 8 이상, 12 이상, 16 이상, 또는 20 이상일 수 있다. 다른 실시예에서, p는 25 미만, 20 미만, 15 미만, 또는 10 미만일 수 있다. 한 실시예에서 이 발명은 기술된 대로 화학식 II의 아민으로 구성되는 가교 아민 중합체이며, 이때 아민은 가교제와 함께 가교된다.
화학식 II의 바람직한 아민에는 다음이 포함된다:
이 발명의 한 실시예는 가교 아민 중합체의 유효량을 투여함으로써 동물의 위장관으로부터 포스페이트를 제거하는 방법으로, 여기에서 상기 중합체는 화학식 II의 아민을 포함한다.
이 발명의 중합체에서 유용한 3번째 단량체는 화학식 III의 아민으로 구성된다.
여기에서 q는 0, 1, 또는 2이고, 각 R1은 각각 H이거나 선택적으로 치환된 알킬 또는 아릴이거나 또는 선택적으로 치환된 지방족 고리, 방향족 또는 이종원자고리기를 형성하기 위해 이웃하는 R1에 연결된다. 한 실시예에서, 이 발명은 기술된 대로 화학식 III의 아민으로 구성되는 가교 아민 중합체이며, 이때 아민은 가교제와 함께 가교된다..
화학식 III의 바람직한 아민에는 다음이 포함된다:
이 발명의 한 실시예는 가교 아민 중합체의 유효량을 투여함으로써 동물의 위장관으로부터 포스페이트를 제거하는 방법으로, 여기에서 상기 중합체는 화학식 III의 아민을 포함한다.
이 발명의 중합체에서 유용한 4번째 단량체는 화학식 IV의 아민으로 구성된다.
여기에서 각 n은 각각 3과 같거나 그 이상이고, 각 r은 각각 0, 1, 또는 2이고, 그리고 각 R1은 각각 H이거나 선택적으로 치환된 알킬 또는 아릴이거나 또는 선택적으로 치환된 지방족 고리, 방향족 또는 이종원자고리기를 형성하기 위해 이웃하는 R1에 연결된다. 한 실시예에서, 이 발명은 기술된 대로 화학식 IV의 아민으로 구성되는 가교 아민 중합체이며, 이때 아민은 가교제와 함께 가교된다.
화학식 IV의 바람직한 아민에는 다음이 포함된다:
이 발명의 한 실시예는 가교 아민 중합체의 유효량을 투여함으로써 동물의 위장관으로부터 포스페이트를 제거하는 방법으로, 여기에서 상기 중합체는 화학식 IV의 아민을 포함한다.
이 발명의 중합체에서 유용한 5번째 단량체는 화학식 V의 아민으로 구성된다.
여기에서 각 n은 각각 3과 같거나 그 이상이고, 각 r은 각각 0, 1, 또는 2이고, 그리고 각 R1은 각각 H이거나 선택적으로 치환된 알킬 또는 아릴이거나 또는 선택적으로 치환된 지방족 고리, 방향족 또는 이종원자고리기를 형성하기 위해 이웃하는 R1에 연결된다. 한 실시예에서, 이 발명은 기술된 대로 화학식 V의 아민으로 구성되는 가교 아민 중합체이며, 이때 아민은 가교제와 함께 가교된다.
화학식 V의 바람직한 아민에는 다음이 포함된다:
n: 3, 4, 또는 5
이 발명의 한 실시예는 가교 아민 중합체의 유효량을 투여함으로써 동물의 위장관으로부터 포스페이트를 제거하는 방법으로, 여기에서 상기 중합체는 화학식 V의 아민을 포함한다.
이 발명의 중합체에서 유용한 6번째 단량체는 화학식 VI의 아민으로 구성된다.
여기에서 각 m은 각각 3과 같거나 그 이상이다. 한 실시예에서 이 발명은 기술된 대로 화학식 VI의 아민으로 구성되는 가교 아민 중합체이며, 이때 아민은 가교제와 함께 가교된다.
이 발명의 한 실시예는 가교 아민 중합체의 유효량을 투여함으로써 동물의 위장관으로부터 포스페이트를 제거하는 방법으로, 여기에서 상기 중합체는 화학식 VI의 아민을 포함한다.
일반 화학식 I-VI로 표현된 아민은 당업자에게 잘 알려진 방법에 의해 합성될 수 있다. 이러한 합성 방법에는 알코올로부터의 촉매 전환 반응, 환원성 아미노화 반응, 마이클 (Michael) 첨가 반응, 그리고 니트릴의 수소화 반응이 포함된다 (예로는 Karsten Eller et al, Ullmann's Encyclopedia of Industrial Chemistry 2002 by Wiley-VCH Verlag GmbH & Co. KGaA을 참고). 여러 가지 저분자 아민 단량체 및/또는 아민 더하기 개재 링커 단위 또한 시판되고 있다.
한 실시예에서, 본 발명에 유용한 아민인 아래 그려져 있는 테트라메틸렌 테트라민은 시판되는 디아미노말레오니트릴 (DAMN)의 촉매 수소화 반응에 의해 합성된다.
본 발명에 사용된 아민은 대개 중합화 반응을 위한 단량체 또는 단량체 단위의 일부분으로 사용되는 저분자 아민이지만, 여기에 국한되지는 않는다. 일부 실시예에서, 단량체는 분자량이 200 g/mol 미만인 저분자 단량체이다.
이 발명의 실시예에서, 단량체는 비중합 아민과 같은 비중합성이다. 여기에서 사용된 바대로, “중합체”는 높은 상대분자질량을 가진 분자, 실제 또는 개념적으로 낮은 상대분자질량의 분자로부터 유도된 단위의 다중 반복을 본질적으로 포함하는 구조를 포함한다.
본 발명의 중합체 합성에 적합한 아민의 예에는 표 1에 보여진 아민이 포함되나 여기에 국한되지는 않는다.
[표 1]
이 발명의 중합체로 사용될 수 있는 추가적인 아민 단량체에는 이웃자리 아민 부분이 포함된다. 중합체는 반복 단위인 이웃자리 아민을 포함하는 동종중합체일 수 있고, 또는 1개 이상의 반복 단위인 이웃자리 아민과 아크릴레이트, 메타크릴레이트, 아크릴아미드, 메타크릴아미드, 비닐 에스테르, 비닐 아미드, 올레핀, 스티렌 등과 같은 다른 아민 단량체를 포함하는 공중합체이다. 중합체의 크기는 예를 들어 약 500과 약 1,000,000 달톤 (Dalton)사이에서 달라질 수 있다.
이 발명의 중합체에서 사용된 이웃자리 아민 단량체는 화학식 VII에서 보여진 아민 단량체이다:
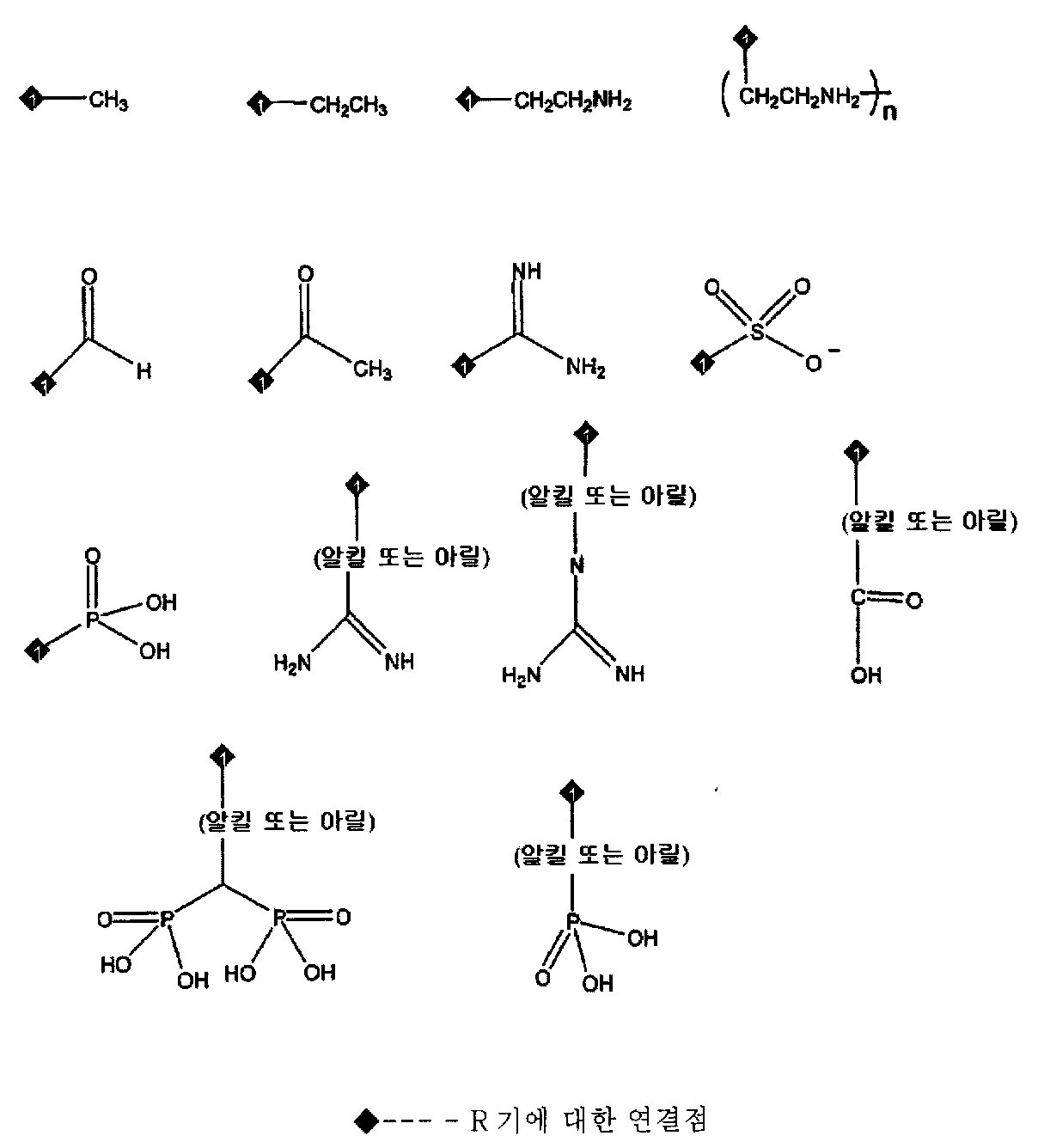
여기에서 n은 0, 1, 또는 1 이상이고, 각 R은 각각 질소의 원자가를 상보하기에 적합한 화학기이고, 그리고 각 R'은 각각 H, 알킬, 또는 아미노이다.
또 다른 실시예에서, 중합체는 다음 화학식의 반복 단위를 갖거나,
또는 그것으로부터의 공중합체를 갖는 특징을 가지며, 여기에서 n은 0, 1, 또는 1 이상이고, 각 R은 각각 질소의 원자가를 상보하기에 적합한 화학기이고, 그리고 각 R'은 각각 H, 알킬, 또는 아미노이고, 그리고 X-는 음전하를 가진 유기 또는 무기 상대이온이다.
화학식 VIII의 바람직한 중합체에는 다음이 포함된다:
본 발명의 중합체에는 또한 다음 화학식의 반복 단위를 갖는 특징을 가지는 중합체가 포함되고
여기에서 n은 0, 1, 또는 1 이상이고, 각 R은 각각 질소의 원자가를 상보하기에 적합한 화학기이고, 그리고 각 R'은 각각 H, 알킬, 또는 아미노이고, 그리고 X-는 음전하를 가진 유기 또는 무기 상대이온이다.
한 실시예에서, 이웃하는 질소 원자의 R기가 서로에게 연결되어 화학식 X에 그려진 바와 같은 구조를 갖는다.
여기에서 Q는 결합, 알킬, 알킬아미노, 알킬카르보닐, 알케닐, 아릴, 또는 이종원자고리 (heterocyclyl)이다.
여기에서 기술된 중합체에서, n은 0, 1, 또는 1 이상이다. 바람직한 실시예에서, n은 0-5이고, 더욱 바람직하게는 n은 0 또는 1이다.
n' 값은 원하는 중합체의 성질, 중합체의 잠재적 용도, 그리고 사용되는 합성 기술에 의해 좌우된다.
화학식 VII, VIII, IX 및 X의 매달린 질소 원자는 매달린 기가 니트로소, 니트로, 니트록시드 라디칼, 니트론, 니트렌, 이소시아네이트, 카르바지드, 히드라진, 디아조기, 이민, 아미딘, 구아니딘, 술파메이트, 포스포라미데이트 및 이종원자고리가 되도록 C, H, O, S, P 및 N과 같은 원자에 결합될 수 있다.
적합한 R기의 예에는 H, 할로겐, R'', CO2H, CO2R'', COR'', C(=NR”)(NR”), CN, CONH2, CONR”2, OR'', SO3R”, Si(R'')3, 및 P(O)(OR”)2가 포함된다. 적합한 R''기에는 H, 선택적으로 치환된 알킬, 아실, 알킬아미노, 알케닐, 이종원자고리 및 아릴기가 포함된다. 바람직한 R'은 H, 메틸, 또는 아미노이다.
R''기의 치환기는 산소, 질소, 인, 또는 황을 가진 이온체일 수 있다. 치환기의 예로는 카르복실레이트, 술포네이트, 술파메이트, 술폰기, 포스포네이트, 포스파젠, 포스포라미데이트기, 4급 암모늄기, 또는 일차 및 이차 알킬 또는 아릴 아민과 같은 아민기가 있다. 적합한 치환기의 다른 예에는 히드록시, 알콕시, 카르복사미드, 술폰아미드, 할로겐, 알킬, 아릴, 히드라진, 구아니딘, 요소 및 카르복실산 에스테르가 포함된다.
바람직한 R기에는 H와 다음의 원자단이 포함된다:
음전하를 가진 상대이온 X-는 유기 이온, 무기 이온, 또는 그로부터의 조합일 수 있다. 이 발명의 용도에 적합한 무기 이온에는 할라이드 (특히 클로라이드), 카르보네이트, 비카르보네이트, 설페이트, 비설페이트, 히드록시드, 니트레이트, 퍼설페이트 및 설파이트가 포함된다. 적합한 유기 이온에는 아세테이트, 아스코르베이트, 벤조에이트, 시트레이트, 시트르산이수소, 시트르산수소, 옥살레이트, 숙시네이트, 타르트레이트, 타우로콜레이트, 글리코콜레이트 및 콜레이트가 포함된다. 바람직한 X-는 클로라이드 또는 카르보네이트이다.
바람직한 한 실시예에서, 상대이온은 환자에게 유해한 부작용을 가지고 있지 않으며 환자에게 치료적 또는 영양학적 이익이 있는 것으로 선택된다.
이 발명의 중합체에 사용되는 또 다른 단량체는 아래 보여진 화학식 XI으로,
여기에서 R'''은 H 또는 CH3이고, R은 상기된 바와 같은 의미를 가진다. 바람직한 화학식 XI의 구조는 R=H일때이다.
한 실시예에서, 중합체는 여기에서 기술된 바대로 반복 단위 중 1 가지를 단량체로 가지는 공중합체이다.
본 발명의 공중합체는 교대 공중합체이거나 불규칙 공중합체일 수 있다. 일반적으로, 아미노 선구 물질과 공중합화될 수 있는 단량체에는 스티렌, 치환된 스티렌, 알킬 아크릴레이트, 치환된 알킬 아크릴레이트, 알킬 메타크릴레이트, 치환된 알킬 메타크릴레이트, 아크릴로니트릴, 메타크릴로니트릴, 아크릴아미드, 메티아크릴아미드, N-알킬아크릴아미드, N-알킬메타크릴아미드, N,N-디알킬아크릴아미드, N,N-디알킬메타크릴아미드, 이소프렌, 부타디엔, 에틸렌, 비닐 아세테이트, N-비닐 아미드, 말레산 유도체, 비닐 에테르, 알릴렌, 메탈릴 단량체 및 이의 조합물로 구성된 군으로부터 선택된 1종 이상의 단량체가 포함된다. 단량체의 기능성화된 형태 또한 사용될 수 있다. 이 발명에 사용될 수 있는 특정 단량체 또는 공 단량체에는, 메틸 메타크릴레이트, 에틸 메타크릴레이트, 프로필 메타크릴레이트 (모든 이성질체), 부틸 메타크릴레이트 (모든 이성질체), 2-에틸헥실 메타크릴레이트, 이소보닐 메타크릴레이트, 메타크릴산, 벤질 메타크릴레이트, 페닐 메타크릴레이트, 메타크릴로니트릴, α-메틸스티렌, 메틸 아크릴레이트, 에틸 아크릴레이트, 프로필 아크릴레이트 (모든 이성질체), 부틸 아크릴레이트 (모든 이성질체), 2-에틸헥실 아크릴레이트, 이소보닐 아크릴레이트, 아크릴산, 벤질 아크릴레이트, 페닐 아크릴레이트, 아크릴로니트릴, 스티렌, 글리시딜 메타크릴레이트, 2-히드록시에틸 메타크릴레이트, 히드록시프로필 메타크릴레이트 (모든 이성질체), 히드록시부틸 메타크릴레이트 (모든 이성질체), N,N-디메틸아미노에틸 메타크릴레이트, N,N-디에틸아미노에틸 메타크릴레이트, 트리에틸렌글리콜 메타크릴레이트, 무수 이타콘산, 이타콘산, 글리시딜 아크릴레이트, 2-히드록시에틸 아크릴레이트, 히드록시프로필 아크릴레이트 (모든 이성질체), 히드록시부틸 아크릴레이트 (모든 이성질체), N,N-디메틸아미노에틸 아크릴레이트, N,N-디에틸아미노에틸 아크릴레이트, 트리에틸렌글리콜 아크릴레이트, 메타크릴아미드, N-메틸아크릴아미드, N,N-디메틸아크릴아미드, N-tert-부틸메타크릴아미드, N-n-부틸메타크릴아미드, N-메틸로메타크릴아미드, N-에틸로메타크릴아미드, N-tert-부틸아크릴아미드, N-n-부틸아크릴아미드, N-메틸로아크릴아미드, N-에틸로아크릴아미드, 4-아크릴로일몰포린, 비닐 벤조산 (모든 이성질체), 디에틸아미노스티렌 (모든 이성질체), α-메틸비닐 벤조산 (모든 이성질체), 디에틸아미노 α-메틸스티렌 (모든 이성질체), α-메틸스티렌 (모든 이성질체), p-비닐벤젠 술폰산, p-비닐벤젠 술폰산 나트륨염, 트리메톡시실릴프로필 메타크릴레이트, 트리에톡시실릴프로필 메타크릴레이트, 트리부톡시실릴프로필 메타크릴레이트, 디메톡시메틸실릴프로필 메타크릴레이트, 디에톡시메틸실릴프로필 메타크릴레이트, 디부톡시메틸실릴프로필 메타크릴레이트, 디이소프로폭시메틸실릴프로필 메타크릴레이트, 디메톡시실릴프로필 메타크릴레이트, 디에톡시실릴프로필 메타크릴레이트, 디부톡시실릴프로필 메타크릴레이트, 디이소프로폭시실릴프로필 메타크릴레이트, 트리메톡시실릴프로필 아크릴레이트, 트리에톡시실릴프로필 아크릴레이트, 트리부톡시실릴프로필 아크릴레이트, 디메톡시메틸실릴프로필 아크릴레이트, 디에톡시메틸실릴프로필 아크릴레이트, 디부톡시메틸실릴프로필 아크릴레이트, 디이소프로폭시메틸실릴프로필 아크릴레이트, 디메톡시실릴프로필 아크릴레이트, 디에톡시실릴프로필 아크릴레이트, 디부톡시실릴프로필 아크릴레이트, 디이소프로폭시실릴프로필 아크릴레이트, 무수 말레산, N-페닐말레이미드, N-부틸말레이미드, N-비닐포름아미드, N-비닐 아세타미드, 알릴아민, 메탈릴아민, 알릴알코올, 메틸-비닐에테르, 에틸비닐에테르, 부틸비닐에테르, 부타디엔, 이소프렌, 염화프렌, 에틸렌, 비닐 아세테이트, 및 이의 조합물이 포함된다. 바람직한 단량체 또는 공 단량체는 아크릴아미드, 디메틸아크릴아미드, N-비닐 포름아미드, N-비닐아세타미드, 비닐 아세테이트, 메틸 아크릴레이트, 그리고 부틸 아크릴레이트이다.
이 발명의 중합체로 사용될 수 있는 추가적인 단량체에는 다음이 포함된다:
여기에서 각 R은 각각 H 또는 치환되거나 치환되지 않은 탄소수가 적은 알킬 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐), 알킬아미노 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐, 예로는 에틸아미노) 또는 아릴(예를 들어, 페닐)기이다;
여기에서 각 R은 각각 H, 또는 치환되거나 치환되지 않은 알킬 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐), 알킬아미노 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐, 예로는 에틸아미노) 또는 아릴(예를 들어, 페닐)기이고, 각 X-는 교환 가능한 음전하를 가진 상대이온이다.
또 다른 적합한 단량체는 다음 화학식의 구조이다
여기에서 각 R은 각각 H, 또는 치환되거나 치환되지 않은 알킬 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐), 알킬아미노 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐, 예로는 에틸아미노) 또는 아릴 (예를 들어, 페닐)기이다;
또 다른 적합한 단량체는 다음 화학식의 구조이다
여기에서 각 R1과 R2는 각각 H, 또는 치환되거나 치환되지 않은 알킬 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐), 알킬아미노 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐, 예로는 에틸아미노) 또는 아릴(예를 들어, 페닐)기이고, 각 X-는 교환 가능한 음전하를 가진 상대이온이다. 한 실시예에서, R기 중 적어도 1개는 수소 원자이다.
또 다른 적합한 단량체는 다음 화학식의 구조이다.
여기에서 각 R1과 R2는 각각 H, 또는 1개 내지 20개의 탄소 원자를 포함하는 치환되거나 치환되지 않은 알킬기, 알킬아미노기 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐, 예로는 에틸아미노) 또는 6개 내지 12 원자를 포함하는 아릴(예를 들어, 페닐)기이다;
또 다른 적합한 단량체는 다음 화학식의 구조이다.
여기에서 각 R1과 R2 과 R3는 각각 H, 또는 1개 내지 20개의 탄소 원자를 포함하는 치환되거나 치환되지 않은 알킬기, 알킬아미노기 (예를 들어 1개와 5개를 포함하여 1개에서 5개 사이의 탄소 원자를 가짐, 예로는 에틸아미노) 또는 6개 내지 12 원자를 포함하는 아릴(예를 들어, 페닐)기이고, 그리고 각 X-는 교환 가능한 음전하를 가진 상대이온이다.
이러한 단량체의 각 경우에서, R기는 1개 이상의 치환기를 가질 수 있다. 적합한 치환기에는 4차 암모늄기와 같은 치료적 음이온기, 또는 일차 및 이차 알킬 또는 아릴 아민과 같은 아민기가 포함된다. 적합한 치환기의 다른 예에는 히드록시, 알콕시, 카르복사미드, 술폰아미드, 할로겐, 알킬, 아릴, 히드라진, 구아니딘, 요소 및 카르복실산 에스테르가 포함된다.
음전하를 가진 상대이온 X-는 유기 이온, 무기 이온, 또는 그로부터의 조합일 수 있다. 이 발명의 용도에 적합한 무기 이온에는 할라이드 (특히 클로라이드), 카르보네이트, 비카르보네이트, 설페이트, 비설페이트, 히드록시드, 니트레이트, 퍼설페이트 및 설파이트가 포함된다. 적합한 유기 이온에는 아세테이트, 아스코르베이트, 벤조에이트, 시트레이트, 시트르산이수소, 시트르산수소, 옥살레이트, 숙시네이트, 타르트레이트, 타우로콜레이트, 글리코콜레이트 및 콜레이트가 포함된다.
합성물이 여기에서 기술된 과정에 의해 원하는 성질을 가지도록 생성될 수 있고 포스페이트 및 옥살레이트와 결합하므로, 구아니딘기를 포함하는 중합체 또한 유용하다. 그러한 중합체는 여기에 참조 문헌으로 전문이 포함된 미국 특허 번호 6,132,706과 5,968,499에 기술되어 있다. 간략하게, 구아니딘기는 중합체 구조에 부착된다. 결합 효과는 구아니딘기에 기인하므로 중합체 골격의 본질은 근본적으로 중요하지는 않다. 가교 및 다른 인자들이 조절될 수 있는 바람직한 중합체에는 디비닐 벤젠으로 가교된 폴리에틸렌 골격을 가지는 중합체가 포함된다. 예를 들어 폴리포스파젠 중합체와 같은 무기 골격을 가지는 중합체 또한 사용될 수 있다. 중합체는 2개 또는 그 이상의 다른 종류의 단량체로부터 유도된 공중합체일 수 있다. 유용한 중합체의 또 다른 예에는 셀룰로스 및 아가로스를 포함하는 탄수화물 중합체가 있다. 구아니딘기는 구아니딘기(NH2--C(N=H)--NH--)의 말단 NH기를 통한 화학 결합을 통하여 중합체 골격에 부착된다. 구아니딘기의 중합체 골격에 대한 화학 결합은 직접적이거나 또는 중합체 골격에 연결되는 “간격 띄우개” 역할을 하는 일종의 원자단을 통한 것일 수 있다. 여러 형태의 연결법이 사용될 수 있는데, 바람직한 형태는 중합체의 기본 종류에 따라 달라진다. 예를 들어, 1-4개의 탄소 원자를 가진 알킬렌기, 아미드기, 에테르기 또는 이의 조합물이 사용될 수 있다. 구아니딘기의 중합체 골격에 대한 바람직한 연결 방법은 물론 골격의 본질에 따라 좌우되겠지만, 간편을 위해서 가능하다면 골격 원자와 구아니딘기의 NH기 사이의 직접 결합이 바람직하다.
구아니딘을 포함하는 중합체의 제조 방법은 당업자에게는 명백하겠지만, 예를 들어서 여기에 참조 문헌으로 전문이 포함되는 Schnaar, R.L. and Lee, Y.C., 1975, Biochemistry 14, 1535-1541의 방법을 따라서 제조될 수 있는데, 여기에는 생물학적 활성 리간드를 중합체 기질에 연결하는 방법이 기술되어 있다. 또는 중합체는 중합체 골격인 (a) 3,5-디메틸피라졸-1-카르복사미딘 질산, (b) S-메틸티오우로니움 황산, 또는 (c) O-메틸유사요소 수소 황산에 부착된 아미노기를 포함하는 중합체와의 반응을 통하여 편리하게 제조될 수 있다.
이 발명의 바람직한 단량체는 아민이다. 발명의 중합체 용도를 위해 가장 바람직한 단량체에는 알릴아민, 비닐아민, 에틸렌이민, 메틸렌, 1,3 디아미노 프로판, N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄, 1,2,3,4 테트라아미노부탄, 화학식 1 및 화학식 2가 포함되는데, 여기에서 화학식 1과 화학식 2는 다음의 구조를 가진다:
화학식 1 화학식 2
일부 실시예에서, 이 발명의 중합체는 1종 이상의 아민 단량체와 1종 이상의 가교제로 구성되고 이때 중합체는 아민:용매 비율이 약 3:1에서부터 약 1:3까지의 비율로 가교되기 전에 아민이 용매에 존재하는 과정에 의해 생성되고, 그리고 반응 혼합물에 가해진 가교제 총 함량은 아민 단량체에 대한 평균 연결 수가 약 2.05와 약 6 사이, 또는 약 2.2와 약 4.5 사이가 된다. 일부 실시예에서, 이 발명의 중합체는 1종 이상의 아민 단량체와 1종 이상의 가교제를 포함하는 포스페이트 결합성 중합체이고 이때 중합체는 반응 혼합물에 가해진 가교제 총 함량이 아민 단량체에 대한 평균 연결 수가 약 2.2와 약 4.5 사이가 되도록 하는 과정에 의해 생성된다. 바람직한 실시예에서, 아민 단량체는 1,3-디아미노 프로판과 N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄으로 구성된 군에서 선택되고, 그리고 여기에서 가교제는 1,3 디클로로프로판과 에피클로로히드린으로 구성된 군에서 선택된다. 일부 실시예에서, 이 발명의 중합체는 1종 이상의 아민 단량체와 1종 이상의 가교체로 구성되며, 여기에서 아민 단량체는 폴리알릴아민 단량체가 아니고 및/또는 가교제는 에피클로로히드린이 아니다.
포스페이트 결합성 중합체에서와 같은 일부 실시예에서, 최종 중합체의 클로라이드 대 아민 비율을 일정 수준 이하로 유지하는 것이 바람직하다. 일부 실시예에서, 이 비율은 약 0 내지 약 35 몰%, 바람직하게는 약 0 내지 약 15 몰%이다. 단량체는 이 기준에 따라 선택될 수 있다.
D.
가교제
가교제는 미국 특허 번호 5,496,545; 5,667,775; 6,509,013; 6,132,706; 및 5,968,499; 그리고 미국 특허 출원 번호 10/806,495 및 10/701,385에 기술되어 있다.
가교제는 전형적으로 할로겐기, 카르보닐기, 에폭시기, 에스테르기, 산 무수물기, 산 할로겐화물기, 이소시아네이트기, 비닐기 및 클로로포르메이트기 중 선택된 적어도 2개의 작용기를 가지는 화합물이다. 가교제는 탄소 골격에 부착되거나 아민 중합체에 매달린 질소에 부착될 수 있다. 본 발명의 중합체 합성에 적합한 가교제의 예에는 표 2에 보여진 가교제가 포함되나 여기에 국한되지는 않는다.
[표 2]
가교제의 적합한 예는 디아크릴레이트와 디메타크릴레이트 (예를 들어, 에틸렌 글리콜 디아크릴레이트, 프로필렌 글리콜 디아크릴레이트, 부틸렌 글리콜 디아크릴레이트, 에틸렌 글리콜 디메타크릴레이트, 프로필렌 글리콜 디메타크릴레이트, 부틸렌 글리콜 디메타크릴레이트, 폴리에틸렌글리콜 디메타크릴레이트, 폴리에틸렌글리콜 디아크릴레이트), 메틸렌 비스아크릴아미드, 메틸렌 비스메타크릴아미드, 에틸렌 비스아크릴아미드, 에틸렌 비스메타크릴아미드, 에틸리덴 비스아크릴아미드, 디비닐 벤젠, 비스페놀 A 디메타크릴레이트, 비스페놀 A 디아크릴레이트, 디에폭시드, 이할로겐화물, 디이소시아네이트, 디아실 클로라이드, 이무수화물, 그리고 디메틸 에스테르이다.
바람직한 가교제의 예에는 에피클로로히드린, 1,4 부탄디올디글리시딜 에테르, 1,2 에탄디올디글리시딜 에테르, 1,3-디클로로프로판, 1,2-디클로로에탄, 1,3-디브로모프로판, 1,2-디브로모에탄, 숙시닐 디클로라이드, 디메틸숙시네이트, 톨루엔 디이소시아네이트, 아크릴로일 클로라이드, 메틸 아크릴레이트, 에틸렌 비스아크릴아미드 및 피로멜리틱 이무수화물이 포함된다.
E.
중합화
반응
중합화 반응은 현 기술 상 알려진 방법에 의해 성취될 수 있으며 그 예가 여기에서 발표된 실시예에 자세히 설명되어 있다. 상술된 바대로, 중합화 반응 조건은 원하는 특성을 가진 중합체를 생성시키기 위하여 조절될 수 있다.
가교 반응은 벌크 (bulk) 용액 (즉 순액체 아민과 순액체 가교제 화합물 사용) 또는 분산 매체 내에서 실행된다. 젤 형성을 유도하는 가교 반응은 다양한 과정을 사용하여 수행될 수 있고, 그 과정은 다음의 2 가지 범주로 나누어진다:
i) 아민 작용기성 선구 물질(저분자 아민 또는 고분자량 폴리아민)이 연속상에서 가용성이고, 가교 반응에 의해 얻어지는 겔이 상기 연속상에서 벌크 겔 또는 겔 곤죽 (slurry)으로 회수되는 균일법. 벌크 겔 과정은 용매 전체가 하나의 덩어리를 형성하는 겔 그물에 포착되고 나서 압출, 연마 및 관련 방법을 이용하여 더 작은 입자로 분쇄되는 상황을 말한다. 벌크법이 사용되는 경우, 용매가 반응물을 함께 용해시키면서 아민 가교 반응에는 간섭하지 않는 용매를 선택한다. 적합한 용매에는 물, 끊는점이 낮은 알코올 (메탄올, 에탄올, 부탄올), 디메틸포름아미드, 디메틸술폭시드, 아세톤, 메틸에틸케톤 및 기타 같은 종류가 포함된다. 겔 곤죽은 전형적으로 반응 매질 점성도가 낮은 범위이고 전단율이 높아서 생성되는 겔 조각들이 곤죽 형태의 현탁 상태에 머무를 때 얻어진다.
ii) 아민 작용기성 선구 물질(저분자 아민 또는 고분자량 폴리아민)이 연속상에서 불용성이어서 분산된 작은 방울 또는 입자를 형성하고, 그리고 나서 가교 반응을 진행하는데 이때 상기 연속상에서 현탁 상태에 있게 되는 비드나 불규칙한 모양의 입자를 형성하는 불균일법.
균일법은 본 발명에서 의도된 것과 같이 제한된 팽윤율을 가진 가교 물질에 대해서는 비실용적일 수 있다: 원하는 팽윤율 범위와 동공 크기 분포를 위한 전형적인 가교 준위는 매우 짧은 겔 시간과 높은 국부 점성도를 유발하며, 이 둘 다 대규모 생산에 있어서는 비실용적이다.
본 발명에 대한 바람직한 합성법은 불균일법을 이용하는 것이다. 그런 방법은 또한 분산 매질에서의 중합화 반응이라고도 불리며, 역상 현탁, 직접 현탁, 침전 중합화, 에멀젼 중합화 및 미세 에멀젼 중합화, 연무제에서의 반응 및 기타 같은 종류가 포함된다. 연속상은 톨루엔, 벤젠, 탄화수소, 할로겐화 용매, 표면 이산화탄소 및 기타 같은 종류의 비극성 용매로부터 선택될 수 있다. 직접 현탁 또는 에멀젼법에는 물이 사용될 수 있으나, 소금물 또한 아민과 가교제를 작은 방울 분리상으로 “염석”하는 데 유용하며, 이는 미국 특허 5,414,068에 기술되어 있다. 단량체 선구 물질은 순액체 또는 용액의 상태로 연속상에서 분산될 수 있다. 아민과 가교제는 바람직하게는 2개의 분리된 단계로 도입되는데, 아민이 먼저 작은 방울로 분산되고 이어서 가교제가 반응 매질에 가해지고 분산상으로 이동한다. 가교 반응은 분산 상태에서 점성도의 현저한 변화를 초래하지 않고 작은 방울 상 내에서 일어난다. 이는 비드 내에서의 우수한 겔 균일성을 보증하면서 발열 반응에 의해 발생되는 열을 방산시키는 이점을 가진다. 합성의 바람직한 방법은 다음의 단계로 구성된다:
i) 아민 단량체 또는 아민 중합체를 물에 녹이기
ii) 아민의 일부분을 HCl과 같은 산으로 중화시키기,
iii) 상기 아민 용액을 물과 섞이지 않는 용매에 분산시켜 에멀젼 형성하기
iv) 가교제를 단계적으로 에멀젼에 가하기
v) 가교 반응이 완료되도록 두기
vi) 증류법으로 물 제거하기
vii) 거르기로 비드 분리하기
viii) 씻기 및 건조하기
이 과정에서 중합체 입자는 구형 비드로 얻어지는데, 비드의 직경은 가급적이면 5 내지 500 미크론의 범위, 바람직하게는 25 내지 250 미크론의 범위에 있도록 조절된다. 이러한 일부 실시예에서 비드는 40 미크론 미만의 평균 직경을 가진다.
그러므로, 한 측면에서, 이 발명은 표적 이온에 결합하는 음이온 결합성 중합체를 만드는 방법을 제공하며 이는 아민 단량체와 가교제를 불균일법에 의해 배합하는 것을 포함하며, 여기에서 포스페이트 결합성 중합체는 다음 특징 중 적어도 2 가지의 특징을 가진다: a) 약 5 미만, 또는 약 4.5 미만, 또는 약 4 미만, 또는 약 3 미만인 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
일부 실시예에서 아민 단량체는 폴리알릴아민이다. 일부 실시예에서 가교제는 에피클로로히드린이다.
또 다른 측면에서 이 발명은 표적 이온에 결합하는 음이온 결합성 중합체를 제공하며, 여기에서 중합체는 폴리알릴아민을 불균일법에 의해 가교시키는 것을 포함하는 과정에 의해 생성되며, 그리고 상기 중합체가 다음 특징 중 적어도 2 가지의 특징을 가진다: a)약 5 미만, 또는 4.5 미만, 또는 약 4 미만, 또는 약 3 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임. 한 실시예에서, 폴리알릴아민이 에피클로로히드린에 의해 가교된다.
위에서 검토한 바와 같이, 아민에 대한 가교제의 몰비는 생성되는 겔 물질의 가교 밀도뿐 아니라 범위까지 조절한다. 비율이 너무 낮으면 불완전한 가교 반응과 가용성 소중합체 형성을 초래할 수 있는 반면 비율이 너무 높으면 거의 결합성이 없는 매우 빽빽한 그물을 생성할 수 있다. 아민 성분은 1종 또는 여러 개 아민의 조합물일 수 있고, 가교제 성분에 대해서도 마찬가지이다. 둘 중 하나의 기능성이 겔 형성의 범위와 팽윤 특성에 영향을 끼칠 수 있으므로, 아민과 가교제의 새로운 조합에 대해서는 최적화 과정이 요구될 수 있다. 예를 들어 Fb가 2인 가교제에 의해 가교된 저분자량 아민 단량체의 실시예와 같은 일부 실시예에서, 아민에 대한 가교제의 몰비 (B/A)는 약 0.2 에서 약 10 사이, 바람직하게는 약 0.5에서 약 5 사이, 그리고 가장 바람직하게는 약 0.5에서 약 2사이를 이룬다. 이 비율은 아민 단량체가 고분자량 아민 단량체 또는 저분자량 아민 단량체인가, 및/또는 가교제의 Fb 수에 근거하여 조정될 수 있다 (아래의 토의와 표 참조)
일부 경우에서 중합체는 중합체 반응 후에 가교된다. 그러한 가교 반응을 얻는 한 방법에는 에피클로로히드린, 숙시닐 디클로라이드, 비스페놀 A의 디글리시딜 에테르, 피로멜리틱 이무수화물, 톨루엔 디이소시아네이트 및 에틸렌디아민과 같은 이작용기성 가교제와 중합체의 반응이 포함된다. 대표적인 예는 폴리(에틸렌이민)과 에피클로로히드린의 반응이다. 이 예에서 에피클로로히드린(1 내지 100 parts)을 폴리에틸렌이민(100 parts)을 포함한 용액에 가하고 가열하여 반응을 촉진시킨다. 대표적인 예는 다중이웃자리아민 (polyvicinalamine)과 에피클로로히드린의 반응이다. 이 예에서 에피클로로히드린(1 내지 200 parts)을 다중이웃자리아민(100 parts)을 포함한 용액에 가하고 가열하여 반응을 촉진시킨다. 이미 중합화된 물질에 가교를 유도하는 다른 방법에는 이온화 방사선에의 노출, 자외선 방사, 전자 빔, 라디칼 및 열분해가 포함되나 이에 국한되지는 않는다.
가교 반응은 배치(batch) 또는 준연속 방식으로 실행될 수 있다. 준연속 방식에서, 아민 또는 가교제가 초기 내용물로 가해지고 그리고 나서 공반응물이 주어진 시간 동안 계량된다. 한 실시예에서, 아민 단량체 성분 전체를 가하고 나서 가교제의 일부를 연속적으로 가하여 시럽을 형성함으로써 가용성 초기중합체가 먼저 조제된다. 그리고 나서 시럽은 기름 연속상에서 작은 방울로 에멀젼화되고 가교제의 남은 부분이 가해져 가교된 비드가 형성된다. 가교제가 알킬 할로겐화 화합물인 경우, 반응 중 형성되는 산을 청소하기 위해 염기가 사용될 수 있다. 무기 또는 유기 염기가 적합하다. NaOH가 바람직하다. 가교제에 대한 염기의 비율은 바람직하게는 약 0.5에서 약 2 사이이다.
일부 실시예에서 중합체는 후(後)아미노화 반응 (3-염화프로필아민과의 후반응) 처리된다. 이 실시예에서, 아민 단량체와 가교제의 반응을 먼저 수행하여 겔을 형성하고 나서 겔을 아미노알킬 할로겐화물과 후반응시키는데, 이때 아민 알킬기는 아민 작용기성 겔의 할로겐 치환을 통해 겔에 화학적으로 부착된다.
여기에서 기술된 모든 중합체는 더 가교되고 포스페이트와 같은 음이온으로 각인(imprint)될 수 있다. 한 실시예에서 표적 음이온(예를 들어 포스페이트 또는 옥살레이트)이 중합화 반응 중에 존재하고 그리고나서 가교 반응이 완료되면 세척된다. 이 방법은 “각인”이라 불리며, 겔 안에 주어진 음이온에 대한 인식을 가지는 “본떠진” 주머니를 형성함으로써 음이온에 대한 겔의 화학 친화성을 증가시키는 경향이 있다. 포스페이트가 각인된 겔에 대한 예는 Fujiwara et al, Analytical Sciences April 2000, vol. 16, 407, 그리고 ACS symposium series 703, “Molecular and Ionic Recognition with Imprinted Polymers, Bartsch RA and Maeda M. Editors, 1998, Chap.22, 315에 기술되어 있다. 전형적으로 음이온은 약 10%에서 약 100% 사이, 더 바람직하게는 약 10% 내지 약 60%, 가장 바람직하게는 약 30% 내지 약 50%의 아민(질소 원자로 나타내진)에 대한 몰비로 존재한다. 가장 바람직하게는, 음이온은 산 형태(예를 들어, 포스페이트, 옥살레이트)로 그리고 아민은 유리 염기로 도입되어 제자리(in situ) 암모늄/음이온 염을 형성한다. 그리고 나서 가교 반응이 앞서 기술된 바대로 팽윤율, 임계 투과 부피 및 결합 간섭의 면에서 목표하는 겔 특징을 얻도록 적절한 양의 가교제 대 아민 비율을 사용하면서 수행된다. 가교 반응 후에 곧바로 생성되는 겔은 각인된 음이온을 제거하기 위해 산도가 높거나 (예를 들어 pH < 2) 염기도 높은 (예를 들어 pH > 12) 매질에서 철저하게 세척되고 그리고 나서 중성 매질에서 다시 세척된다. 모든 변수가 같을 때 (예를 들어, 아민 대 가교제 비율, 단량체 대 용매 비율) 여기에서 기술된 각인법은 결합능을 대개 1.1배, 1.3배, 또는1.5배까지 증가시킨다.
III
.
약학 조성물
또 다른 측면에서, 이 발명은 약학 조성물을 제공한다. 한 실시예에서, 약학 조성물은 저작정이다. 또 다른 실시예에서, 약학 조성물은 액제이다.
본 발명의 약학 조성물에는 가교 아민 중합체와 같은 본 발명의 중합체가 유효량, 즉 치료 및/또는 예방 효과를 성취하기에 유효량으로 존재하는 조성물이 포함된다. 특정 용도에 효과적인 실제 양은 환자(예를 들어, 연령, 체중), 치료 대상의 상태, 그리고 투여 방법에 의해 좌우될 것이다. 유효량의 결정은 특히 여기에 포함된 명세의 견지에서 볼 때 충분히 당업자의 능력 내에 있다.
인간에게 사용될 유효량은 동물 모델로부터 결정될 수 있다. 예를 들어, 인간에 대한 용량은 동물에게 효과적으로 밝혀진 순환 농도 및/또는 위장 농도를 성취하도록 제제될 수 있다.
약학 조성물은 가교 아민 중합체와 같은 중합체, 1종 이상의 약학적으로 허용된 운반체, 희석제 또는 부형제, 그리고 선택적으로 추가되는 치료제로 구성된다.
본 발명에 따른 용도에 대한 약학 조성물은, 활성 화합물의 처리를 촉진시키는 부형제와 보조제를 포함하는 1개 이상의 생리학적으로 허용되는 운반체를 약학적으로 이용될 수 있는 조제법으로 사용하는 관례적인 방법으로 제제될 수 있다. 적절한 제제법은 선택되는 투여 방법에 의해 좌우된다. 아민을 약학 조성물로 조제하는 적합한 방법은 예를 들어 Gennaro AR (ed), Remington's Pharmaceutical Sciences, 20th Edition, Lippincott, Williams and Wilkins, Baltimore MD (2001)에서처럼 현 기술 상 잘 알려져 있으며, 이는 여기에서 전문이 포함되어 있다.
본 약학 조성물은 잘 알려져 있고 쉽게 이용가능한 성분을 이용하여 알려진 절차에 의해 일반적으로 조제된다. 본 발명의 조성물을 만드는 데 있어서, 포스페이트 결합성 중합체와 같은 이온 결합성 중합체는 따로 존재할 수 있고, 운반체와 혼합될 수 있고, 운반체로 희석될 수 있고, 또는 캡슐, 봉지, 종이 또는 다른 용기의 형태인 운반체 내에 포함될 수도 있다. 운반체가 희석제의 역할을 하는 경우, 운반체는 중합체의 매개체, 부형제 또는 매질의 역할을 하는 고체, 반고체 또는 액체 물질일 수 있다. 그러므로, 조성물은 정제, 환약, 분말, 마름모꼴 정제, 작은 봉지, 교갑 (카세), 엘릭시르, 현탁액, 시럽, 분무제 (액체 매질 내의 고체로서), 연질 또는 경질 젤라틴 캡슐, 무균 포장된 분말 및 기타 같은 종류의 형태일 수 있다. 바람직한 제제법은 저작정과 액제이다. 다른 제제법뿐 아니라 이러한 제제법에서 사용될 수 있는 운반체, 부형제 및 희석제의 예에는 음식, 음료, 유당, 덱스트로스, 수크로스, 소르비톨, 만니톨, 전분, 아카시아 수액, 알긴산, 트라가칸스, 젤라틴, 규산 칼슘, 미세결정성 셀룰로스, 폴리비닐피롤리돈, 셀룰로스, 메틸 셀룰로스, 메틸히드록시벤조에이트, 프로필히드록시벤조에이트, 프로필히드록시벤조에이트 및 활석 가루가 포함된다.
이 발명의 또 다른 측면에서, 음이온(예를 들어 포스페이트) 결합성 중합체는 상대이온이 없는 자유 아민으로 제제된다. 레나겔(폴리알릴아민 염산)로 치료되는 유지 혈액투석 환자들이 칼슘 함유 포스페이트 결합제(즉, 클로라이드 포함하지 않는)로 치료되는 환자들보다 현저하게 낮은 혈청 비카르보네이트 준위를 가진다는 것이 단기 및 장기 연구에서 증명되었다. 염산 세벨라머(상품명 레나겔의 활성 약학적 성분)가 산증을 초래하는 산 부하를 유도한다는 것이 나타났다 (Brezina B. et al, Kidney International, vo.66, suppl.90 (2004), 39-45). 산증은 그 범주의 환자들에게 심각한 부작용을 끼칠 수 있다. 또 다른 실시예에서, 아민 가교 중합체는 폴리아민 중합체이고, 이때 중합체의 클로라이드 함량은 아민기 함량의 약 40 몰%미만이고, 더 바람직하게는 약 20 몰% 미만이고, 좀 더 바람직하게는 아민기 함량의 약 5% 미만이다. 가장 바람직하게는, 중합체에 기본적으로 클로라이드가 없어야 한다.
A.
저작정
일부 실시예에서 이 발명의 중합체는 저작정의 형태의 약학 조성물로 다루어진다.
오늘날 환자 순응도는 환자가 고인산혈증과 같은 이온 불균형 장애 치료를 위한 권장 사항을 따르는 데 주된 제한 요소 중의 하나로 인식된다. 예를 들어, 레나겔과 같은 현재 포스페이트 결합성 중합체를 이용한 고인산혈증의 치료에 있어, 최근 조사에서 환자가 매일 평균 9정 내지 10정의 800 밀리그램의 알약을 복용해야 하며 그 중 25%의 환자는 훨씬 더 높은 일용량인 12정 내지 15정의 알약을 복용한다는 사실이 제안되었다. 레나겔은 삼키는 정제의 형태로서 정제를 삼키는 데 필요한 양의 액체와 함께 투여되는데, 이는 수분 제한이 요구되는 말기신질환 환자들에게 부담을 증가시킨다. 높은 일일 복용량으로 인한 낮은 환자 순응도는 이 계열의 약물의 용납성에 분명히 영향을 끼치는 요소로 두드러진다.
더 복용하기 쉬운 액제 제조가 바람직할 것이다. 많은 경우에 있어 저작정의 의한 약물 전달이 매우 편리하겠지만, 제제자가 만족스러운 감각적 특성을 얻는 데 있어 어려움을 겪고 있기 때문에 그 사용이 제한되어 왔다. 정제를 씹어먹는 경우 다음의 감각적 변수가 중요하다: 사상성, 치아 틈 메우기, 텁텁함, 식감 및 전반적 기호도.
현재의 저작정은 상당한 양의 활성 성분이 투여될 필요가 있는 분야에 있어 주로 사용되며 비타민, 제산제, 완화제 및 진통제와 같은 일반 판매 제품이 포함된다. 처방되는 씹어먹는 제품에는 임산부 비타민과 씹어먹는 항생제 그리고 과량의 경구 투여를 요구하는 항바이러스 제품이 포함된다. 흔히 크긴 하지만, 씹기 쉬움과 곤죽으로 만들기에 적절한 “경도”를 용이하게 하도록 형태가 최적화될 필요가 있다. 약 0.3 내지 0.4의 높이/직경 비율을 가진 동그랗고 끝이 경사진 모양이 흔하다.
활성 상분 이외에, 다음 종류의 부형제가 흔히 사용된다: 필요한 기호도를 제공하기 위한 감미제, 그리고 감미제가 충분한 정제 경도를 제공하는 데 불충분한 경우에는 결합제, 틀벽 (die wall)에서의 마찰 효과를 최소화하고 정제 거부를 용이하게 하기 위한 윤활제, 그리고 일부 제제에서는 씹기를 용이하게 하기 위하여 소량의 붕괴제가 가해진다. 일반적으로 현재 시판되고 있는 저작정에서의 부형제 준위는 활성 성분(들)의 약 3-5배인데, 감미제가 비활성 성분의 대부분을 차지한다.
이온 결합성 중합체를 포함하는 저작정을 고안함에 있어 중요한 고려 사항은 중합체의 팽윤율이다. 이 발명이 저팽윤성인 중합체를 다루고 있으므로, 그 중합체가 고팽윤성 중합체의 저작정에 수반되는 불쾌하고 때로는 위험한 부작용 없이 씹어먹는 제제에 사용될 수 있다. 고팽윤성 물질이 경구 투여 중 어려움을 유발하고 잠재적으로 질식 및 식도 봉쇄를 야기하는 한 예가 실리엄(Psyllium)이다. 실리엄은 아시아 일부분, 유럽의 지중해 지역 및 북부 아프리카가 원산지인 플란타고 오바타 (Plantago ovata) 식물의 씨를 간 것이고 미국에서 완하제로 흔히 사용된다. 실리엄은 대개 35-50배 팽윤하며 다량의 액체와 함께 복용되어야만 한다. 투여시 액체 섭취가 불충분하면 섬유질이 팽윤되고 질식이나 심지어 식도 파열까지 이를 수 있다. 실리엄은 연하장애 및/또는 좁은 식도를 가진 환자에게는 금지된다.
본 발명은 발명의 중합체 또는 중합체들과 저작정의 제제에 적합한 1종 이상의 약학 부형제를 포함하는 저작정을 제공한다. 이 발명의 저작정에 사용되는 중합체는 가급적이면 구강과 식도를 통화하는 동안 약 5 미만, 바람직하게는 약 4 미만, 더 바람직하게는 약 3 미만, 좀 더 바람직하게는 약 2.5 미만, 그리고 가장 바람직하게는 약 2 미만의 팽윤율을 가진다. 일부 실시예에서 중합체는 포스페이트 결합성 중합체와 같은 음이온 결합성 중합체이다. 중합체를 포함하고 적합한 부형제가 첨가된 정제는 식감, 맛 및 치아 틈 메우기와 같은 감각 수용성이 만족스럽고, 동시에 씹기 및 타액과의 접촉 후에 식도를 차단하는 위험을 지니지 않는다.
이 발명의 일부 측면에서, 중합체(들)는 보통 부형제에 의해 나타나는 역학적 특성 및 열 특성을 가지므로, 제제에 필요한 부형제의 양이 감소한다. 일부 실시예에서 활성 성분(예를 들어 중합체, 바람직하게는 이온 결합성 중합체)은 중량비로 저작정의 약 30% 이상, 더 바람직하게는 약 40% 이상, 좀 더 바람직하게는 약 50% 이상, 그리고 가장 바람직하게는 약 60% 이상을 차지하고, 나머지는 적합한 부형제(들)로 구성된다. 일부 실시예에서, 이온 결합성 중합체와 같은 중합체는 정제의 총 중량의 약 0.6 밀리그램 내지 약 2.0 밀리그램, 바람직하게는 약 0.8 밀리그램 내지 약 1.6 밀리그램을 차지한다. 일부 실시예에서, 음이온 결합성 중합체와 같은 중합체는 정제의 약 0.8 밀리그램 이상, 바람직하게는 정제의 약 1.2 밀리그램 이상, 그리고 가장 바람직하게는 정제의 약 1.6 밀리그램 이상을 차지한다. 중합체는 적당한 경도, 좋은 식감, 압축성 및 기타 같은 종류와 같은 부형제가 사용되는 목적과 같은 특성을 제공하기 위해 적절한 강도/무름 그리고 입자 크기를 가지도록 생성된다. 이 발명의 저작정에 사용되는 중합체의 입자 크기는 평균 직경이 약 80, 70, 60, 50, 40, 30 또는 20 미크론 미만이다. 바람직한 실시예에서, 입자 크기는 약 80 미크론 미만, 더 바람직하게는 약 60 미크론 미만, 그리고 가장 바람직하게는 약 40 미크론 미만이다.
이 발명의 저작정에 유용한 약학 부형제에는 미세결정성 셀룰로스, 콜로이드 실리카 및 그로부터의 조합(Prosolv 90), 카보폴, 프로비돈 및 크산 검과 같은 결합제, 수크로스, 만니톨, 크실리톨, 말토덱스트린, 프럭토스 또는 소르비톨과 같은 방향제, 스테아린산 마그네슘, 스테아린산, 스테아릴푸마르산 나트륨 그리고 지방산 기반의 야채와 같은 윤활제, 그리고 선택적으로 크로스카르멜로 나트륨, 겔란 검, 셀룰로스의 저치환도 히드록시프로필 에테로, 나트륨 전분 글리코산염과 같은 붕괴제가 포함된다. 다른 첨가제로 가소제, 색소, 활석 가루 및 기타 같은 종류가 포함될 수 있다. 그러한 첨가제 및 다른 적합한 성분은 현 기술 상 잘 알려져 있으며, Gennaro AR (ed), Remington's Pharmaceutical Sciences, 20th Edition를 참조하기 바란다.
일부 실시예에서 이 발명은 포스페이트 결합성 중합체와 적합한 부형제로 구성된 저작정로 제제된 약학 조성물을 제공한다. 일부 실시예에서 이 발명은 포스페이트 결합성 중합체, 충전재 및 윤활제로 구성된 저작정으로저작정성물을 제공하며, 여기에서 충전재는 수크로스, 만니톨, 크실리톨, 말토덱스트린, 프럭토스 및 소르비톨로 구성된 군에서 선택되고, 윤활제는 스테아릴산 마그네슘과 같은 마그네슘 지방산염이다.
정제는 씹을 수 있음 및 구강 붕괴에 적합한 어떠한 크기와 형태일 수 있지만, 약 10 밀리미터 내지 약 40 밀리미터의 직경과 약 2 밀리미터 내지 약 10 밀리미터의 높이, 가장 바람직하게는 약 22 밀리미터의 직경과 약 6 밀리미터의 높이를 가지는 원통형이 바람직하다.
한 실시예에서 중합체는 약 30℃ 이상, 바람직하게는 약 50℃ 이상의 전이 온도를 갖는다.
또 다른 실시예에서, 중합체는 중합체와 부형제가 근본적으로 섞이는 고체 용액을 형성하도록 만니톨, 소르보스, 수크로스와 같은 높은 Tg / 높은 녹는점 저분자량의 부형제와 초기 제제된다. 압출, 분무 건조, 냉각 건조, 동결건조 또는 습식 제립법과 같은 혼합 방법이 유용하다. 혼합 준위의 표시는 시차주사열량계 또는 동적기계분석기와 같은 알려진 물리적 방법에 의해 얻는다.
중합체를 포함하여 약학적 성분을 포함하는 저작정을 제조하는 방법은 현 기술 상 알려져 있다. 여기에 참조 문헌으로 전문이 포함된 유럽 특허 출원 번호 EP373852A2와 미국 특허 번호 6,475,510그리고 Remington's Pharmaceutical Sciences를 참조하기 바란다.
B.
액제
일부 실시예에서 본 발명의 중합체는 액제 형태의 약학 조성물로 다루어진다. 일부 실시예에서 약학 조성물은 적합한 액체 부형제에 분산된 이온 결합성 중합체를 포함한다. 적합한 액체 부형제는 현 기술 상 알려져 있다. 예를 위해서는 Remington's Pharmaceutical Sciences를 참고하기 바란다.
IV
.
치료 방법
또 다른 측면에서, 이 발명은 이온 불균형 장애에 대한 치료 방법을 제공한다. 여기에서 사용되는 “이온 불균형 장애”라는 용어는 신체 내에 존재하는 이온의 준위가 비정상인 상태를 일컫는다. 한 실시예에서, 이 발명은 포스페이트 불균형 장애에 대한 치료 방법을 제공한다. 여기에서 사용되는 “포스페이트 불균형 장애”라는 용어는 신체 내에 존재하는 인의 준위가 비정상인 상태를 일컫는다. 포스페이트 불균형 장애의 한 예에는 고인산혈증이 포함된다. 여기에서 사용되는 “고인산혈증”이라는 용어는 신체 내에 원소 인이 높은 준위로 존재하는 상태를 일컫는다. 대표적으로, 혈중 포스페이트 준위가 예를 들어 혈액 데시리터 당 약 4.5 밀리그램 이상 및/또는 사구체 여과율이 예를 들어 약 20% 이상으로 감소된 경우, 환자는 대개 고인산혈증으로 진단된다.
그러므로, 예를 들어 이 발명은 본 발명의 중합체의 유효량을 동물에게 투여함으로써 음이온을 동물로부터 제거하는 방법을 제공한다. 일부 실시예에서, 중합체는 음이온 결합성 중합체이며 이때 중합체는 표적 음이온(예를 들면, 포스페이트 또는 옥살레이트)에 결합하고, 중합체는 다음 특징 중 적어도 2 가지의 특징을 가진다: a) 약 5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
일부 실시예에서, 중합체의 표적 음이온은 포스페이트이고, 일부 실시예에서 포스페이트는 포스페이트부터 제거되며, 일부 실시예에서 투여 방법은 경구 복용이다. 일부 실시예에서, 동물은 고인산혈증, 저칼슘혈증, 갑상선기능항진증, 신장의 칼시트리올 합성 기능저하, 저칼슘혈증으로 인한 강직, 신기능부전, 연조직에서의 이소성 석회화, 그리고 말기신질환으로 구성된 군으로부터 선택된 질환 중 적어도 1 가지를 앓고 있다. 일부 실시예에서, 동물은 인간이다. 여기에서 기술된 모든 중합체가 동물 내의 음이온과 결합하는 데 및/또는 동물 내의 이온 불균형에 의해 야기된 상태를 치료하는 데 유용할 수 있다는 점이 통찰될 것이다. 바람직한 실시예에서, 중합체는 포스페이트 결합성 중합체이며, 이때 중합체는 다음 특징 중 적어도 1 가지의 특징을 가진다: a) 약 5 미만, 바람직하게는 약 2.5 미만의 팽윤율; b) 생리적 매질에서 측정한 겔 동공 부피 분포는, 표적 음이온의 분자량의 약 2배 초과의 분자량을 가지는 비상호작용 용질에 접근 가능한 상기 동공 부피의 일부가 겔 중량의 약 20% 미만인 것을 특징으로 함; 및 c) 위장 유사액에서 측정하는 경우 표적 음이온에 대한 이온 결합 간섭도가 비간섭 완충액에 비교하여 약 60% 미만임.
일부 실시예에서, 팽윤율은 약 2.8 미만, 또는 약 2.7 미만, 또는 약 2.6 미만이다.
본 발명의 방법, 조성물 및 키트로 치료될 수 있는 다른 질병에는 저칼슘혈증, 갑상선기능항진증, 골 기아 증후군, 신장의 칼시트리올 합성 기능저하, 저칼슘혈증으로 인한 강직, 신기능부전, 그리고 관절, 폐, 콩판, 결막 및 심근 조직의 석회화를 포함한 연조직에서의 이소성 석회화가 포함된다. 또한, 본 발명은 상기 질병의 예방 치료를 포함하여 말기신질환 및 투석 환자들의 치료에 사용될 수 있다.
또한, 여기에서 기술된 중합체는 인 섭취량의 식이조절, 무기금속염 및/또는 다른 중합체 수지 투석을 이용하는 것과 같은 다른 치료법의 보조로 사용될 수 있다.
본 발명의 조성물은 또한 위장관으로부터 클로라이드, 비카르보네이트, 철 이온, 옥살레이트 및 담즙산을 제거하는 데 유용할 수 있다. 옥살레이트 이온을 제거하는 중합체는 담석 생성의 위험을 증가시키는 옥살산증 또는 고옥살산뇨증과 같은 옥살레이트 불균형 장애의 치료에 사용된다. 클로라이드 이온을 제거하는 중합체는 예를 들어 산증, 가슴쓰림, 위산 역류 질병, 속쓰림 또는 위염을 치료하는 데 사용된다. 일부 실시예에서, 본 발명의 조성물은 지방산, 빌리루빈 및 관련 화합물을 제거하는 데 유용하다. 일부 실시예는 또한 단백질, 핵산, 비타민 또는 세포 찌꺼기와 같은 고분자량 분자에 결합하여 제거할 수도 있다.
본 발명은 동물의 치료를 위한 방법, 약학 조성물 및 키트를 제공한다. 여기에서 사용된 “동물” 또는 “동물 피험체”라는 용어는 다른 포유동물뿐 아니라 인간도 포함한다. 이 발명의 한 실시예는 여기에서 기술된 가교 아민 중합체 중 적어도 1 가지 아민의 유효량을 투여함으로써 동물의 위장관으로부터 포스페이트를 제거하는 방법이다.
여기에서 사용된 “치료”라는 용어와 이의 문법적 동의어에는 치료 효과 및/또는 예방 효과 성취가 포함된다. 치료 효과라 함은 치료 대상인 선행 장애의 박멸, 개선 또는 예방을 의미한다. 예를 들어, 고인산혈증 환자에 있어 치료 효과에는 선행 고인산혈증의 박멸 또는 개선이 포함된다. 또한, 치료 효과는 환자가 여전히 선행 장애를 앓고 있다 하더라도 환자에 있어 증진이 관찰되는 것과 같이 선행 장애와 관련된 1개 이상의 생리적 증상의 박멸, 개선 또는 예방으로 성취된다. 예를 들어, 여기에서 기술된 신기능부전 및/또는 고인산혈증을 앓고 있는 환자에게 가교 아민 중합체를 투여하는 것은 환자의 혈청 포스페이트 준위가 감소할 때뿐 아니라 이소성 석회화 및 신장성골형성장애 같은 신부전증 및/또는 고인산혈증을 동반하는 다른 장애와 관련한 증진이 환자에게 관찰될 때에도 치료 효과를 제공한다. 예방 효과를 위해서, 예를 들어 고인산혈증 진단이 내려지지 않았다 하더라도 가교 아민 중합체가 고인산혈증 발병의 위험이 있는 환자 또는 고인산혈증의 1개 이상의 생리적 증상을 보고하는 환자에게 투여될 수 있다. 예를 들어, 이 발명의 중합체를 고인산혈증이 진단되지 않았으나 만성 신장 질환을 가진 환자에게 투여될 수 있다.
동물에 있어 가교 아민 중합체와 같은 중합체의 복용량은 치료 대상인 병, 투여 경로, 그리고 치료 받는 동물의 신체적 특성에 따라 좌우된다. 가교 아민 중합체가 사용되는 일부 실시예에서, 치료적 및/또는 예방적 용도에 대한 가교 아민 중합체의 복용량 준위는 하루에 약 1 그램에서 약 30 그램까지일 수 있다. 중합체는 식사와 더불어 투여되는 것이 바람직하다. 중합체는 하루에 1번, 하루에 2번, 또는 하루에 3번 투여될 수 있다. 바람직한 투여량은 하루에 약 2 그램에서 약 20 그램까지이며 더 바람직한 투여량 범위는 하루에 약 3 그램에서 약 7 그램까지이다. 여기에서 기술된 중합체의 투여량은 하루에 약 50 그램 미만, 바람직하게는 하루에 약 40 그램 미만, 더 바람직하게는 하루에 약 30 그램 미만, 좀 더 바람직하게는 하루에 약 20 그램 미만, 그리고 가장 바람직하게는 하루에 약 10 그램 미만일 수 있다.
바람직하게, 치료 및/또는 예방 효과를 위해 사용되는, 가교 아민 중합체와 같은 이온 결합성 중합체는 따로 투여될 수 있고, 또는 여기에서 기술된 약학 조성물의 형태로 투여될 수 있다. 예를 들어, 본 발명의 가교 아민 중합체는 치료 대상의 상태에 따라 다른 약학적 활성 성분과 공동 투여될 수도 있다. 공동 투여될 수 있는 약학적 성분의 예에는, 위산 분비 억제제, 칼슘감지수용체(예를 들어, 씨나캘셋), 비타민 D 및 그 유사체, 그리고 포스페이트 결합제가 포함된다. 포스페이트 결합체로 적합한 성분의 예에는 탄산알루미늄, 탄산칼슘, 아세트산칼슘 (포스로 (PhosLo)), 탄산란탄 (포스레놀(Fosrenol)) 및 레나겔이 포함된다. 이러한 공동 투여에는 같은 투여 형태의 2 가지 성분의 동시 투여, 다른 투여 형태의 동시 투여, 그리고 분리 투여가 포함될 수 있다. 예를 들어, 고인산혈증 치료를 위해, 가교 아민 중합체는 고인산혈증으로부터 기인한 저칼슘혈증을 치료하는 데 쓰이는 칼슘염과 공동 투여될 수 있다. 칼슘과 중합체는 같은 투여 형태로 함께 제제되어 동시에 투여될 수 있다. 또는, 칼슘염과 중합체가 두 성분이 각각의 제제로 존재하는 상태로 동시에 투여될 수 있다. 또 다른 방안으로는, 칼슘염이 중합체에 바로 뒤이어 투여될 수 있고 또는 그 역(逆)도 가능하다. 분리 투여 프로토콜에서, 중합체와 칼슘염은 몇 분 간격, 또는 몇 시간 간격, 또는 며칠 간격으로 투여될 수 있다.
중합체는 주사, 국부적, 경구, 피부경유, 또는 직장 좌약식으로 투여될 수 있다. 바람직하게는, 중합체 또는 중합체를 포함하는 약학 조성물은 경구로 투여된다. 중합체가 투여되는 경구 형태에는 분말, 정제, 캡슐, 용액 또는 에멀젼이 포함될 수 있다. 유효량은 1회 투여량, 또는 적절한 시간 간격(예를 들어, 몇 시간)으로 분리된 일련의 투여량으로 투여될 수 있다.
이 발명은 또한 폐수를 본 발명의 음이온 결합성 중합체에 접촉시킴으로써 폐수로부터 음이온성 오염 물질을 제거하는 방법을 제공한다.
V.
키트
또 다른 측면에서, 본 발명은 포스페이트 불균형 장애와 같은 음이온 불균형 장애 치료에 대한 키트를 제공한다. 이 키트에는 여기에서 기술된 중합체 또는 중합체들과 여기에서 기술된 다양한 방법과 접근법에 따른 키트 사용법을 설명하는 사용설명서가 포함되어 있다. 이 키트에는 또한 과학 참고 문헌, 첨부서, 임상 실험 결과, 및/또는 기타 같은 종류의 개요가 포함될 수도 있는데, 이런 사항은 조성물의 활성도 및/또는 이점을 지적하거나 입증하는 것이다. 이러한 정보는 예를 들어 생체내 모델을 포함한 실험 동물을 이용한 연구 및 인간 임상 실험에 근거한 연구와 같은 다양한 연구의 결과에 근거하고 있을 수 있다. 여기에서 기술된 키트는 의사, 간호사, 약사, 약전 공무원 및 기타 같은 종류를 포함하는 보건종사자에게 제공되고, 판매되고, 및/또는 판매 촉진될 수 있다. 미용 용도를 위한 키트는 소비자에게 직접 제공되고, 판매되고, 및/또는 판매 촉진될 수 있다.
본 명세서에 언급된 모든 발표문과 특허 출원은 각각의 발표문 또는 특허 출원이 특정적 개별적으로 참조 병합으로 나타낸 것과 같은 정도로 여기에 참조로 병합된다.
첨부된 청구 사항의 진의나 범위를 벗어남 없이 많은 교체와 변경이 여기에서 존재하는 명세서에 대해 이루어질 수 있음이 당 기술 분야의 통상적 지식을 가진 자에게는 명백할 것이다.
실시예
1: 포스페이트 결합능 측정 프로토콜
이 실시예에서 음이온(이 경우에는 포스페이트)과의 결합에 대한 중합체의 결합능을 측정하는 다양한 프로토콜이 기술된다.
비간섭
완충액에서의
포스페이트 결합능 측정
중량이 P(gr)인 건조 중합체의 분취량을 pH가 6.5인 다음과 같은 완충액의 고정 부피 V(L)과 함께 적당하게 교반하면서 섞는다: 20 mM H3PO4, 80 mM NaCl, 100 mM MES 나트륨 염 (모르폴리노에탄 술폰산). 단일 결합능 측정을 했을 때는, 후자 완충액을 사용하였다. 예를 들어 결합 등온선 도시를 위한 것과 같은 다중 측정을 했을 때는, 완충액의 포스페이트 농도를 변화시켰다. 초기 포스페이트 농도를 Pstart(mM)라 한다. 이 용액은 중합체 수지와의 반응에 대해 포스페이트와 경쟁하는 다른 경쟁 용질을 포함하고 있지 않으므로 비간섭 완충액이라 불릴 수 있다. 수지 평형화 후에, 용액을 원심 분리에 의해 기울여 따르고, 상층액을 이온 크로마토그라피로 잔류 포스페이트 농도, Peq(mM)에 대해 분석하였다. 결합능은 V*(Pstart-Peq)/P로 계산되었고, 상응하는 중합체에 대한 표에서 나타내진 바와 같이 단위는 mmol/gr이다.
위장
유사액에서의
결합능
이 과정은 위장관 내의 포스페이트 결합성 중합체 사용 상태를 모방하고 다른 대사 물질(경쟁 용질)의 존재 하에 포스페이트(표적 용질)에 대한 중합체의 결합 특성을 측정하도록 고안되었다. 유동식이 위장관 유사액을 생성하도록 펩신과 췌액의 존재 하에 인공적으로 소화되었다. 소화 과정이 공장(빈창자) 준위까지 모방되도록 효소 첨가 순서와 pH 분포를 조절하였다.
다음의 성분들을 다음의 순서로 1번에 1 가지씩 약 2.5 L의 물에 가하고 용해시켰다 (거품이 생기지 않도록 하면서 격렬하게 교반하였다): 분유 291 g, 베네프로틴 (Beneprotein) 72.8 g, 덱스트로스 152 g, 폴리코스 (Polycose) 156 g, 염 화나트륨 17.6 g. 염화나트륨을 녹인 후에 240 g의 옥수수기름을 가하였다. 그리고 나서 ddH2O를 가하여 부피를 4L로 만들었다. 혼합물을 2시간 동안 격렬하게 교반하였다. 이때 pH는 약 6.4였다. 그리고 나서 최종 pH가 2.0이 되도록 3M HCl 153 ml를 적가하였다 (약 150 ml). 혼합물을 15분간 교반하였고, 그 후에 pH가 약 2.1로 증가하였다. 그리고 나서 최종 농도가 1 mg/ml이 되도록 10mM HCl에 있는 800 ml의 펩신을 적가하였다. 혼합물을 상온에서 30분간 교반하였고, 그 후에 pH가 약 2.3이었다. 그리고 나서 100mM NaHCO3에 있는 췌장 효소와 담즙산의 저장 용액 5L를 가하여 최종 농도가 췌장 효소는 0.3 mg/ml, 담즙산은 2 mg/ml이 되도록 하였다. 혼합물을 상온에서 120분간 교반하였고, 그 후에 pH가 약 6.5이었다. 모방 식사는 사용 전에 -80℃에서 1개월까지 보관하였다.
위장관 유사액의 분취액을 원심분리하여 상층액을 인에 대해 분석하였다. 포스페이트 결합능 분석은 위장관 유사액이 사용되었다는 점 이외에는 상술한 비간섭 완충액에서와 같다.
탈체
가사액에서의
결합능
작은창자의 내강에 삽입한 튜브를 이용하여, 건강한 환자들에게 상술한 위장관 유사액의 조제법과 같은 성분을 가진 식사와 미즙의 분취액을 주입하고 나서 시료를 채취하였다.
피험자들에게 작은 창자 내에서의 움직임을 용이하게 하도록 튜브의 한 끝에 수은으로 무거워진 봉지를 부착한 이중내강 폴리비닐 튜브를 삽입하였다. 위치를 잡기 위해 투시 검사를 사용하여, 이중내강 튜브의 삽입 구멍 1개를 위 안에 꽂고, 다른 구멍은 현수 인대(상부 공장 안에 있는)에 꽂았다.
올바른 튜브 위치를 잡은 후에, 액체화된 검사식 (표지물인 폴리에틸렌 글리콜 (PEG ) 2g/550mL가 추가된) 550 mL을 분 당 22 mL의 속도로 위에 삽입된 구멍을 통해 위 안으로 주입되었다. 식사 전체가 위에 도달하는 데 보통의 식사를 하는 데 요구되는 시간과 비슷하게 대략 25분이 소요되었다.
공장 미즙을 현수 인대에 위치한 내강의 튜브로부터 빨아내었다. 이 액을 30분 간격으로 2시간 반 동안 연속적으로 수집하였다. 이로부터 5개의 표본을 얻어 혼합하고, 부피를 측정하고, 동결건조하였다.
탈체 가사액에 대한 포스페이트 결합능 분석을 실행하였다. 포스페이트 결합능 절차는 탈체 가사액이 사용되었다(동결건조 물질을 적절한 양의 탈이온수로 원래 상태로 되게 한 후)는 점 이외에는 상술한 비간섭 완충액에서와 같다. 탈체 가사액의 포스페이트 결합능은 위장관 유사액 실험에서와 같은 방법으로 계산하였다.
실시예 2: 벌크 용액법으로 형성된 가교 중합체의 라이브러리 및 포스페이트 결합능 측정
중합체 라이브러리 만들기
다음의 5가지 예는 각각 최고 24개의 가교 중합체를 포함하는 라이브러리로 이루어진다. 중합체는 4x6 배열 형식으로 배치한 분식반응조(batch reactor)에서 제조하였다. 각 반응조는 350 마이크로리터 즉 3 mL 부피이고 자기적으로 교반하 였으며 온도가 조절되었다. 전형적인 절차에서, 아민, 가교제, 용매 그리고 선택적으로 염기를 각 반응조에 로봇을 이용하여 분배하였고, 선택적으로 교반하였다. 그리고 나서 반응조를 밀봉하고 표시된 온도까지 15시간 동안 가열하였다. 그리고 나서 반응조 배열을 빼내어 가교 중합체의 덩어리를 유리 바이얼에 옮기고, 빻고, 탈이온수로 반복해서 씻고, 그리고 냉동건조시켰다. 5개의 라이브러리가 반응에 사용된 상응하는 반응 조건과 함께 아래의 표 3에 식별되었다.
[표 3]
비간섭 완충액에서의 포스페이트 결합능 측정
또한 라이브러리의 각 중합체에 대해 포스페이트 결합능을 측정하였다. 절차에 대해서는 실시예 1을 참조하기 바란다.
결과
표 4 내지 표 8은 5개의 라이브러리 각각의 중합체를 형성하는 데 사용된 물질 과 양, 그리고 비간섭 완충액에서 생성된 중합체에 대해 측정된 포스페이트 결합능을 제공한다. 기재 사항은 각 반응 우물(reaction well)에서 사용된 화학 약품의 중량에 상응하고 단위는 mg이며, 그리고 얻어진 중합체 겔의 포스페이트 결합능(빈 칸은 특정 반응에서 생성된 가교 겔이 없음을 의미한다)이다.
[표 4]
라이브러리: 접시 3 (ID:100275) 단위mg
[표 5]
라이브러리: 접시 1 (ID: 100277) 단위: mg
[표 6]
라이브러리: 접시 3 (ID: 100279) 단위: mg
[표 7]
라이브러리: 접시 1 (ID: 100353) 단위: mg
[표 8]
라이브러리: 접시 1 (ID: 100384) 단위: mg
실시예
3:
현탁법으로
생성된 1,3-
디아미노프로판
/
에피클로로히드린
가교된 비드의 합성
4개의 측 조절 장치가 달린 3구 둥근바닥 플라스크로 된 3리터짜리 반응 용기를 사용하였다. 반응 플라스크는 기름 중탕기, 냉수 환류 냉각기, 그리고 3인치짜리 추진기가 있는 교반기를 갖추었다. 이 반응 용기에 1,3-디아미노프로판(90.2 g, 1.21 mole)을 90.2 g의 물에 녹인 용액, 계면 활성제 (가지 달린 도데실벤젠 술폰산 나트륨염 6.4 g을 100 g의 물에 녹인 것), 그리고 1 Kg의 톨루엔을 가하였다. 이 초기 내용물을 600 rpm에서 2분간 교반하고 나서 300 rpm로 낮추어 10분간 교반한 후 에피클로로히드린을 가하였다. 나머지 실험에 걸쳐서 300 rpm 속도를 유지하였다. 이 용액을 80℃로 가열하였고 또 실험 내내 이 온도를 유지하였다.
다른 용기에, 톨루엔에 든 에피클로로히드린의 40 질량% 용액을 조제하였다. 주사기 펌프를 이용하여, 에피클로로히드린 1.2 당량(134.7 g, (1.45 mole))을 초 기 내용물이 든 반응 용기에 3시간에 걸쳐 가하였다. 반응을 2시간 동안 더 진행시킨 후 40 중량% 용액의 수산화나트륨 0.75당량 (36.5 g (0.91 mole))을 가하였다. 수산화나트륨 용액을 주사기 펌프를 이용하여 반응물에 2.5시간 반 동안에 걸쳐 가하였다. 반응을 그 후 8시간 동안 80℃로 유지하였다.
이 시간 후에, 생성된 비드를 톨루엔을 제거하고, 1000 ml의 아세톤, 메탄올, 20% 수산화나트륨 용액 (계면 활성제를 제거하기 위하여)의 순서로 씻고, 그리고 나서 탈이온수로 2번을 더 씻어 정제한다. 비드를 3일 동안 냉동건조 시켜 평균 직경이 93 μm인 160 g의 미세한 흰색 분말(92% 수율)을 얻었다.
실시예
4: 1,3-
디아미노프로판
/1,3-디클로로프로판 가교 중합체의 합성
물을 용매로 이용하여, 20 mL짜리 섬광 바이얼에서 1000 mg의 B-SM-22-DA 를 1524 mg의 X-Cl-3 및 2524 mg의 물과 혼합하였다. 반응을 자기교반시키고 하룻밤 동안 80℃의 온도를 유지하고 나서 그 후 2시간 동안 90℃를 유지하였다. 반응 혼합물의 34 중량% (1716 mg)를 물/원심분리 단계에서 3차례 세척함으로 정제하여 144.7 mg의 본 실시예의 중합체 분말을 얻었다.
실시예 5: 1,3-디아미노프로판/1,3-디클로로프로판 가교 중합체의 합성
물을 용매로 이용하여, 20 mL짜리 섬광 바이얼에서 2000 mg의 B-SM-22-DA 를 3048 mg의 X-Cl-3 및 5048 mg의 물과 혼합하였다. 반응을 자기교반시키고 하룻밤 동안 80℃의 온도를 유지하였다.
사용된 가교제가 알킬할로겐화물이었으므로 반응 동안에 형성되는 산을 청소하기 위하여 3시간의 반응 시간 후에 3597 mg의 30 중량% NaOH 수용액을 가하였다. 반응 혼합물의 20.3 중량% (2773.5 mg)를 물/원심분리 단계에서 3차례 세척함으로 정제하여 591.3 mg의 본 실시예의 중합체 분말을 얻었다.
실시예
6:
초기중합체법을
이용하여 1,3-
디아미노프로판
/1,3-디클로로프로판으로 조제된 가교된 비드의 합성
초기중합체 제조
반응 용기는 냉수 환류 냉각기, 교반기를 갖춘 250 mL짜리, 2구 둥근바닥 플라스크였고, 아르곤으로 채워졌다. 이 반응 용기에 30.15 g의 물에 용해된 1,3-디아미노프로판(31.15 g, 0.42 mole)을 가한다. 이 초기 내용물을 300 rpm에서 교반한다. 용액을 80℃로 가열하였고 또 실험 내내 이 온도를 유지하였다. 주사기 펌프를 이용하여, 1 당량(47.47 g, 40.0 mL, 0.42 mol)의 1,3-디아미노프로판 (Aldrich 99%)을 2시간에 걸쳐 가하였다. 반응을 2시간 동안 더 진행시킨 후 10 중량% (1,3-디아미노프로판에 대하여) 수산화나트륨(1.68 g (0.042 mole)의 NaOH로 40 중량%의 수용액을 만들었다)을 가하였다. 수산화나트륨 용액을 피펫으로 반응물에 2분에 걸쳐 가하였다. 반응물을 그후 4시간 동안 80℃로 유지하였다. 80℃에서의 용액은 점성이 있고 25℃로 냉각시키면 물에 쉽게 용해되는 고형 덩어리가 된다.
정제
고형 덩어리에 물을 가하고, 200 ml의 물과 200 ml의 MeOH로 씻어낸다. 그리고 나서 이 덩어리를 MeOH/이소프로필 알코올의 50/50 용액이 담겨 있는 1 L짜리 비이커에 가한다. 흰색의 중합체가 침전한다. 현탁액을 원심분리기에 돌린 후, 상층액을 제거한다. 이소프로필 알코올을 이용하여 이 과정을 2번 더 반복한다. 그리고 나서 이소프로필 알코올을 제거하기 위해 흰색 침전물을 상온에서 감압 하에 건조시킨다. 분리된 중합체의 중량: 평균 분자량 (폴리에틸렌이민에 대한 GPC) ~600.
가교 입자의 합성
흰색의 초기중합체(8.7 g)를 1.3 g의 가지 달린 도데실벤젠 술폰산 나트륨염 (물에 대해 30 중량%)과 34.8 g의 톨루엔이 든 플라스크에 가하였다. 그리하여 톨루엔에 현탁화된 중합체의 20 중량% 용액을 었었다. 분쇄기(상표: IKA. 모델: Ultra-Turax T8)를 이용하여 중합체를 미크론 크기의 입자로 분쇄하였다. 이 결과로 생기는 2.2 g의 현탁물을 가열기, 교반기 및 주사기 펌프를 갖춘 10 mL짜리 반응 플라스크에 담았다. 반응 플라스크에 3779 mg의 톨루엔을 추가로 채웠다. 이 플라스크를 80℃까지 가열하고 교반기를 작동시켰다 (500 RPM). 이 온도에서 3시간 동안 교반시킨 후, 112.2 mg (0.0012 mole)의 에피클로로히드린을 1.5 시간 동안에 걸쳐 가하였다. 그 후 반응을 2시간 동안 더 진행시키고, 224.4 mg (0.0056 mol)의 수산화나트륨 (40 중량%의 수용액)을 2시간 동안에 걸쳐 가하였다. 반응물이 상온까지 식도록 두고 교반을 멈추었다. 생성된 비드를 톨루엔을 제거하고, 메탄올과 20% 수산화나트륨 용액 (계면 활성제를 제거하기 위하여)의 순서로 씻고, 그리고 나서 탈이온수로 2번을 더 씻어 정제한다. 비드를 3일 동안 동결건조 시켜 미세한 흰색 분말을 얻었다. 비간섭 완충액에서 측정된 결합능은 3.85 mmol/gr이었다.
실시예
7: 1,3-
디아미노프로판
/1,3-디클로로프로판
1으로
조제되는
저분자량
중합체 (초기중합체)의 합성과 분리
다음의 실시예에서 사용되는 약어는 다음과 같다:
에피클로로히드린: ECH
N,N,N',N'-테트라키스 (3-아미노프로필) 1,4 디아미노부탄: BTA
BC: 결합능
이 실시예에서, 반응 혼합물 내 단량체 (이 경우에는 초기중합체) 대 용매 비율의 변화가 결합능과 팽윤율에 끼치는 영향을 나타내었다. 이 실시예는 두 부분의 과정에 대해 기술한다: 첫째, 1,3 디아미노프로판과 1,3 디클로로프로판으로부터 생기는 가용성 초기중합체 생성물의 합성, 그리고 둘째, 초기중합체를 ECH와 더 가교시킴으로 불용성 비드의 조제. 2번째 반응은 물 대 초기중합체 비율이 달라지는 역상현탁법을 포함한다. 이 변화가 반응 성능과 팽윤에 끼치는 영향을 평가하였다.
초기중합체의 합성
1단계 (초기중합체 제조): 반응 용기는 냉수 환류 냉각기, 교반기를 갖춘 250 mL짜리 2구 둥근바닥 플라스크였고, 아르곤으로 채워졌다. 이 반응 용기에 30.15 g의 물에 용해된 1,3-디아미노프로판(31.15 g, 0.42 mole) 용액을 가하였다. 이 초기 내용물을 300 rpm에서 교반하였다. 이 용액을 80℃로 가열하였고 또 실험 내내 이 온도를 유지하였다. 주사기 펌프를 이용하여, 1 당량(47.47 g, 40.0 mL, 0.42 mol)의 1,3-디아미노프로판(Aldrich 99%)을 2시간에 걸쳐 가하였다. 반응을 2시간 동안 더 진행시킨 후 10 중량% (1,3-디아미노프로판에 대하여) 수산화나트륨(1.68 g (0.042 mole)의 NaOH로 40중량% 수용액을 만들었다)을 가하였다. 수산화나트륨 수용액을 반응물에 피펫을 이용하여 2분간에 걸쳐 가하였다. 반응을 그 후 4시간 동안 80℃로 유지하였다. 이 용액은 80℃에서 점성이 있었고 25℃로 냉각시키면서 물에 쉽게 용해되는 고형 덩어리가 되었다.
2단계 (정제): 고형 덩어리에 물을 가하고, 200 ml의 물과 200 ml의 MeOH로 씻어내었다. 그리고 나서 이 덩어리를 MeOH/이소프로필 알코올의 50/50 용액이 담겨 있는 1 L짜리 비이커에 가하였다. 흰색의 중합체가 침전하였다. 원심분리 후에, 상층액을 제거하였다. 이소프로필 알코올을 이용하여 이 과정을 2번 더 반복하였다. 그리고 나서 이소프로필 알코올을 제거하기 위해 흰색 침전물을 상온에서 감압 하에 건조시켰다. 분리된 중합체의 분자량: 평균 분자량 (폴리에틸렌이민 표준에 대한 GPC) ~600.
반연속적인 24개의 평행 우물 중합체
반응조에서
1,3-
디아미노프로판
/ 1,3-디클로로프로판으로 조제되는 미크론 크기의 가교 입자 합성.
흰색의 초기중합체(8.7 g)를 1.3 g의 가지 달린 도데실벤젠 술폰산 나트륨염 (물에서 30 중량%)과 34.8 g의 톨루엔이 든 플라스크에 가하였다. 그리하여 톨루엔에 현탁화된 중합체의 20 중량% 용액을 었었다. 고전단 파쇄기(상표: IKA. 모델: Ultra-Turax T8)를 이용하여 에멀젼을 미크론 크기의 입자로 분쇄하였다. 이 결과로 생기는 2.2 g의 에멀젼을 가열기, 교반기 및 주사기 펌프를 갖춘 10 mL짜리 반응 플라스크 24개에 담았다. 각 반응 플라스크에 3779 mg의 톨루엔을 추가로 채 웠다. 이 플라스크를 80℃까지 가열하고 교반기를 작동시켰다 (500 RPM). 다양한 초기중합체 대 물의 비율을 생성하기 위해 필요한 양의 물을 튜브에 채웠다. 이 온도에서 3시간 동안 교반시킨 후, 원하는 양의 에피클로로히드린 (이 실시예에서는, 초기중합체 건조 중량의 20%와 동일한 양의 에피클로로히드린을 가하였다)을 1.5 시간에 걸쳐 가하였다. 그 후 반응을 2시간 동안 더 진행시키고, 224.4 mg (0.0056 mol)의 수산화나트륨 (40 중량%의 수용액)을 2시간 동안에 걸쳐 가하였다. 반응물이 상온까지 식도록 두고 교반을 멈추었다. 생성된 비드를 톨루엔을 제거하고, 메탄올과 20% 수산화나트륨 용액 (계면 활성제를 제거하기 위하여)의 순서로 씻고, 그리고 나서 여분의 HCl을 제거하기 위해 탈이온수로 2번을 더 씻어 정제하였다. 비드를을 3일 동안 동결건조 시켜 미세한 흰색 분말을 얻었다.
이렇게 합성된 중합체 비드를 비간섭 완충액에서 및 위장관 유사액에서의 결합능 (BC)과 팽윤율에 대해 분석하였다. 결과는 표 9에 요약되어 있다.
[표 9]
1,3
디아미노
프로판 / 1,3 디클로로프로판 /
ECH
겔
비드
.
결합능과
팽윤율에 끼치는 단위체 대 물 비율의 영향
이 결과는 비간섭 완충액에서와 유장관 유사액 둘 다에서의 결합능이 단량체 대 물 비율이 증가함에 따라 증가하고 팽윤율은 감소하여 원하는 범위에 이르는 것을 보여준다.
실시예
8: 24개의 평행 우물 중합체
반응조를
이용하여 분쇄된
BTA
/
ECH
벌크
겔로부터의
미크론 크기의 가교 입자 합성
이 실시예에서 단량체에 대한 가교제 양의 변화가 결합능과 팽윤율에 끼치는 영향을 보였다.
다음의 저장 용액을 조제하였다: 2몰 당량의 진한 염산을 1몰 당량의 BTA에 2시간에 걸쳐 가하였다. 그리고 나서 물을 이 용액에 가하여 생성되는 용액이 다음의 중량% 조성을 갖도록 하였다: BTA 45 중량%, HCl 10 중량%, 물 45 중량%. 5 mL짜리 플라스크를 사용하는 24개의 우물 반응조의 각 플라스크에 0.6 g의 조제된 저장 용액을 가하였다. 시험될 단량체:가교제 비율에 이르도록 원하는 양의 에피클로로히드린을 각 바이얼에 가하였다. 반응조를 9시간 동안 80℃로 가열하였다. 반응조를 식게 두었다. 생성되는 겔이 팽윤하도록 각 바이얼에 물을 가하였다. 그리고 나서 고전단 파쇄기(상표: IKA. 모델: Ultra-Turax T8)를 이용하여 겔을 미크론 크기의 입자로 분쇄하였다. 입자를 물을 제거하고, 메탄올과 20% 수산화나트륨 용액의 순서로 씻고, 그리고 나서 아민 기능성 입자를 양성자화하기 위해 HCl로 씻어 정제한다. 그리고 나서 여분의 HCl을 제거하기 위해 입자를 탈이온수로 2번 씻는다. 입자를 3일 동안 동결건조 시켜 미세한 흰색 분말을 얻었다.
결합능과 팽윤율 실험에 대한 결과는 표 10에 요약되어 있다.
[표 10]
BTA
/
ECH
겔:
가교제
함량에 대비한 팽윤율 및 결합능에 관한 데이터. 벌크 겔 (단량체 대 물 비율이 75 중량%인
Bow
-
Tie
(2
HCl
) 수용액) 단량체 대 물 비율은 3.5(
ECH
:
BTA
=0.85)부터 4.8(
ECH
:
BTA
=6.4)까지의 범위이다.
이 데이터는 위장관 유사액에서의 결합능이 가교제 대 아민 비율이 변함에 따라 최고치를 지남을 보여준다. 이 특정 시스템에서 위장관 유사액에서의 최적 결합능은 3.6 내지 5.6의 NC 값에 상응하는 가교제 비율이 각각 1.8 내지 2.8일 때 관찰된다. 그 가교 범위에서 팽윤비가 최소이다. 중합체가 사용될 특정 용도에 대한 원하는 결과를 가져올 비율을 결정하기 위해서 이 중합체 프로토콜을 이용하여 다른 단량체와 가교제에 대해 비슷한 시험을 정기적으로 실행할 수 있다.
실시예 9: 역상 현탁을 통한 미크론 크기의 가교 BTA / ECH 비드 합성
다음을 저장 용액을 조제하였다: 2몰 당량의 진한 염산을 1몰 당량의 BTA에 2시간에 걸쳐 가하였다. 그리고 나서 물과 계면 활성제 (가지 달린 도데실벤젠 술폰산 나트륨염, 물에서 30 중량%)를 이 용액에 가하여 생성되는 용액이 다음의 중량% 조성을 갖도록 하였다: BTA 41.8 중량%, HCl 9.4 중량%, 물 41.1 중량%, 계면 활성제 (30 중량% 수용액) 7.7 중량%.
사용된 반응 용기는 기름 중탕기, 냉수 환류 냉각기, 그리고 1인치짜리 추진기가 있는 교반기를 갖추고, 4개의 측 조절 장치가 달린 0.25 리터짜리 3구 둥근바닥 플라스크였다. 이 반응 용기에 25 g의 준비된 저장 용액과 75 g의 톨루엔을 가하였다.
다른 용기에, 톨루엔에 든 에피클로로히드린의 40 질량% 용액을 조제하였다. 주사기 펌프를 이용하여, 원하는 양의 ECH를 90분간에 걸쳐 가하였다. 반응을 그 후 2시간 동안 더 진행시키고 딘 스탁 장치 (dean stark apparatus)를 이용하여 탈수를 시작하였다. 시스템으로부터 물이 모두 제거되었을 때 반응의 종말점에 이르렀다. 비드를 톨루엔을 제거하고, 메탄올과 20% 수산화나트륨 용액 (계면 활성제를 제거하기 위하여)의 순서로 씻고, 그리고 나서 비드를 양성자화하기 위해 HCl로 정제한다. 그리고 나서 여분의 HCl을 제거하기 위해 비드를 탈이온수로 2번 씻는다. 비드를 3일 동안 동결건조 시켜 미세한 흰색 분말을 얻었다.
결합능과 팽윤율 실험에 대한 결과는 표 11에 요약되어 있다.
[표 11]
BTA
/
ECH
겔 비드:
가교제
함량에 대한 팽윤율과 결합능.
이 결과는 위장관 유사액에서의 결합능이 가교제 대 아민 비율이 변함에 따라 최고치를 지남을 보여준다. 이 특정 시스템에서 위장관 유사액에서의 최적 결합능은 3.5 내지 6의 NC 값에 상응하는 가교제 비율이 각각 1.75 내지 3일 때 관찰된다. 그 가교 범위에서 팽윤비가 최소이다. 중합체가 사용될 특정 용도에 대한 원하는 결과를 가져올 비율을 결정하기 위해서 이 중합체 프로토콜을 이용하여 다 른 단량체와 가교제에 대해 비슷한 시험을 정기적으로 실행할 수 있다.
실시예 10: 24개의 평행 우물 중합체 반응조를 이용한, 분쇄된 폴리알릴아민 /ECH 벌크 겔로부터의 미크론 크기의 가교 입자 합성
이 실시예는 고분자량 단량체와 반응 혼합물에서의 단량체 대 물 비율 변화를 이용한 중합체 합성을 설명한다. 사용된 조건은 BTA 대신 폴리알릴아민 (Mw=60,000 g/mole)이 사용되었다는 점 이외에는 실시예 8에서 기술된 바와 동일하다. ECH 대 알릴아민 반복 단위 비는 1:0.106 (NC 값 2.2에 상응)이었다. 초기 폴리알릴아민 대 물 비율은 1.1에서부터 1.4까지 변화시켰다. 비교예로서, 레나겔 정제로부터 분리된 가교 폴리알릴아민을 사용하였다.
이 데이터는 아민 대 물의 비율이 높을수록 팽윤율이 낮아지고 위장관 유사액에서 결합능이 높아지는 것이 수반됨을 보여준다. 중합체가 사용될 특정 용도에 대한 원하는 결과를 가져올 비율을 결정하기 위해서 이 중합체 프로토콜을 이용하여 다른 단량체와 가교제에 대해 비슷한 시험을 정기적으로 실행할 수 있다.
실시예
11: 결합 간섭도 준위 측정
이 실시예는 본 발명의 중합체와 선행 기술의 중합체(비교를 위하여)를 이용한 결합 간섭도 측정법에 대해 설명한다. 가교 폴리아민 물질 (EC172A)이 실시예 4에서 기술된 바에 따라 조제되었고, BTA:ECH 몰비는 2.5, 그리고 (BTA+ECH) 대 물 의 비율은 1.73이었다. 결합 간섭도가 레나겔과 비교되었다.
"결합에서의 간섭의 정도” 또는 여기서 사용된 바대로 “결합 간섭도”는, 평형에 이른 표적 음이온의 농도가 같을 때 비간섭 완충액에서와 위장 유사에서의 결합 실험에서 관찰되는 표적 이온에 대한 결합능의 감소 비율을 가리킨다. 비간섭 완충액에서의 결합 등온선은 우선 다양한 농도의 포스페이트에 대하여 평형에서 결합능 대 포스페이트를 도시함으로써 얻는다. 그리고 나서 임의의 포스페이트 농도에서의 결합능을 예측하기 위해 그 등온선을 지수 함수에 맞추었다. 그리고 나서 위장관 유사액에서 측정된 결합능을 같은 등온선에 기록하고, 평형에서 위장관 유사액에 대하여 포스페이트 대 포스페이트 결합의 점을 도시하고 이 점을 지나서 비간섭 등온선과 교차하도록 수직선을 연장시켰다. 그리고 나서 간섭도를 (BCNI-BCGI)/BCNI*100로 계산하였다.
EC172A에 대한 결합 간섭도가 아래 표와 도 3에 나와 있다.
레나겔에 대한 결합 간섭도가 아래 표와 도 4에 나와 있다.
EC172A에 대한 결합 간섭도는 레나겔에 대한 간섭도보다 약 34% 낮다.
실시예
12: 인간
탈체
가사액에서의
이온 결합 성질
가교 폴리아민 물질 (EC172A)이 실시예 4에서 기술된 바에 따라 조제되었고, BTA:ECH 몰비는 2.5, 그리고 (BTA+ECH) 대 물의 비율은 1.73이었다. 그리고 나서 이 물질을 실시예 1에서 기술된 바대로 인간 가사액에서의 포스페이트 결합능에 대해 시험하였다.
EC172A의 포스페이트 결합능을 레나겔 (Genzyme)으로부터 분리한 의약품 원재료인 가교 폴리알릴아민의 포스페이트 결합능과 비교하였다. EC172A가 훨씬 낮은 간섭도 준위와 훨씬 낮은 팽윤 지수 (2.5 vs 레나겔에 대한 지수는 9)를 나타낸다.
또 다른 실험에서, 다른 인간 탈체 가사액에서 시트레이트와 담즙산과 같은 용질과 경쟁함으로써 생성되는 포스페이트 결합에 대한 간섭도를 정량화하기 위해 EC172A와 레나겔 두 물질 모두를 사용하였다. 시트레이트 음이온와 담즙산을 각각 이온 크로마토그라피와 효소 분석으로 적정하였다. 아래 보여진 데이터(지원자 6명의 평균)는 본 발명의 중합체가 훨씬 나은 선택성과 전반적 포스페이트 결합능을 보인다는 것을 나타낸다.
실시예 13: 용질 분배법을 이용한 겔 다공성 측정
이 실시예는 겔 다공성 특정에 대해 설명한다. 이 발명의 중합체와 비교를 위해 시판되고 있는 포스페이트 결합성 중합체에 대한 측정을 실행하였다. 이 발명의 중합체로서, 가교 폴리아민 물질 (EC172A)이 실시예 10에서 기술된 바에 따라 조제되었고, BTA:ECH 몰비는 2.5, 그리고 (BTA+ECH) 대 물의 비율은 1.73이었다. 비교를 위해, 레나겔에 대해 같은 다공성 측정을 실행하였다.
시료는 분자량 범위가 200에서 20,000 Da인 8개의 폴리에틸렌글리콜 (PEG)과 4개의 폴리에틸렌옥시드 (PEO) (30,000 내지 230,000 Da)였다.
모든 시료는 30 mM 아세트산 암모늄 완충액 pH 5.5 (농도 5 g/L)에 용해시켰다. 시료 용액을 미리 중량을 잰 EC172A HCl 액(5 mL/g) 그리고 레나겔 HCl 액(15 mL/g dry gel)에 가하고 Vortexer에서 4일간 흔들어 섞었다.
시료 용액을 10배로 희석하고 Polymer Lab Evaporative Light Scattering Detector를 이용하여 액체 크로마토그라피 분석을 하였다(봉우리 넓이 비가 중량 농도 비와 같음을 보장하는 검출기의 직선 범위에 있도록 하기 위하여).
접근 가능하지 않은 부피의 계산 = msw + [1 - cbefore/cafter]msolv; 이때
msw 겔에 의해 흡수된 물의 양 [g/g 건조 겔]
msolv 초기에 시료가 용해된 물의 양 [g/g 건조 겔]
cbefore 그리고 cafter : 평형 전과 후의 시료 농도. cbefore/cafter 비는 LC 분석으로 얻어진 봉우리 넓이의 비와 같다.
이 비교예의 결과는 도 5와 6에 나타나 있는데, 도 5는 분자량 측면에서의 결과이고 도 6은 용질의 크기 측면에서의 결과이다. EC172A는 분자량 200까지의 용질에 대한 일정 분자 배제를 나타내고, 이에 비해 레나겔은 최고 1000의 분자량에 대해 배제 감소를 보인다.
실시예
14:
염화프로필아민
, 염산과의 비드의
후(後)변형
저장 용액 제조:
ㆍ50 중량% 염화프로필아민, 염산 (B-SM-34-A) 수용액 - d = 1.132.
ㆍ30 중량% 수산화나트륨 수용액 (50 중량% 용액의 희석에 의하여) - d = 1.335.
합성:
실시예 9에 따라 조제되고, 2.5의 BTA:ECH 몰비와 1.73의 (BTA+ECH) 대 물의 비율을 가진 포스페이트 결합제 중합체인 FR-0005-144를 속(續) 아미노화 반응의 기질로 사용하엿다. FR-0005-144 비드를 4 mL짜리 바이얼(각각 21개의 바이얼을 포함하는 2개의 4 x6판)에 옮기고, 액체를 분배하는 로봇을 이용하여 염화프로필아 민, 염산 저장 용액 및 수산화나트륨 저장 용액을 가하였다. 바이얼을 마개로 봉하고, 판을 가열기와 개별 교반을 갖춘 반응조에 설치하였다.
가열기와 교반기를 12시간 동안 작동시켰다: 반응조의 온도는 85℃에 그리고 교반 속도는 1200 rpm에 맞추었다.
정제:
각 물질을 일회용 배양 튜브(16x100 mm)로 옮기고 메탄올로 1번, 1M 염산 수용액으로 2번, 그리고 물로 3번 씻어냈다. 원심분리로 비드를 매번 분리하였다.
그리고 나서 비드를 동결건조기에서 건조시키고 소화된 식사 선별, 비간섭 완충액 및 팽윤율에 대해 분석하였다. 결과는 아래의 표 12와 도 7에 나와 있다.
[표 12]
염화프로필아민, 염산과의 비드의 후(後)변형에 의해 제조된 중합체의 특성
실시예
15: N,N'(
테트라
-3-아미노프로필) 1,4
디아미노부탄
/ 에피클로로히드린으로부터의 포스페이트 주형(templated) 미크론 크기의 가교 입자 합성
다음을 저장 용액을 조제하였다: 1몰 당량의 포스페이트 (Alrich, 85% 수용액)을 1몰 당량의 N,N'(테트라-3-아미노프로필) 1,4 디아미노부탄에 2시간에 걸쳐 가하였다. 그리고 나서 물을 이 용액에 가하여 생성되는 용액이 다음의 중량% 조성을 갖도록 하였다: N,N'(테트라-3-아미노프로필) 1,4 디아미노부탄 42 중량%, H3PO4 13 중량%, 물 45 중량%. 반응조에는 5 mL짜리 플라스크를 사용하는 24개의 우물이 있었고, 각 플라스크에는 자석 젓기 막대 (magnetic stir bar)가 들어있다. 각 플라스크에 0.6-0.7 g의 제조된 저장 용액을 가하였다. 교반기를 작동시켰다. 원하는 양의 에피클로로히드린을 각 바이얼에 순액체 상태로 가하였다. 반응조를 1시간 동안 60℃로 가열하고 나서 8시간 동안 80℃로 가열하였다. 반응조를 식게 두었다. 생성되는 겔이 팽윤하도록 각 바이얼에 물을 가하였다. 겔을 10 mL짜리 시험관이 있는 4x6 판으로 옮겼다. 그리고 나서 분쇄기 (상표: IKA. 모델: Ultra-Turax T8)를 이용하여 겔을 미크론 크기의 입자로 분쇄하였다. 입자를 물을 제거하고, 메탄올로 씻은 후 20% NaOH 용액으로 더 씻어서 정제하였다. 그후에 겔 입자를 1몰 HCl로 씻고, 30분간 섞은 다음, 겔이 가라앉도록 두었다가 상층액을 기울여 따라 내었다. 아민 작용기성 입자를 클로라이드로 양성자화하고 결합된 H3PO4를 교체시키기 위해 이 과정을 5번 반복하였다. 그리고 나서 아민 작용기성 겔 입자를 탈양성자화 시키기 위해 겔 입자를 20% NaOH 용액으로 씻었다. 그리고 나서 겔 입자를 여분의 NaOH/HCl을 제거하기 위해 탈이온수로 2번 씻었다. 겔 입자를 3일 동안 동결건조 시켜 미세한 흰색 분말을 얻었다. 합성은 표 13에 요약되어 있다.
[표 13]
인산으로 분자 각인된 겔의 합성 ID 102776
상술된 바대로 합성된 중합체는 포스페이트에 결합한다.
본 발명의 바람직한 실시예에서 보여지고 여기에서 기술되긴 했지만, 이러한 실시예는 예의 수단으로서만 제공된다는 사실이 당업자에게는 명백할 것이다. 이 제 수많은 변형, 변화 및 치환이 본 발명으로부터 벗어남 없이 당업자에게 생각날 것이다. 여기에서 기술된 발명의 실시예에 대한 다양한 대안이 본 발명을 실행함에 있어 사용될 수 있다. 다음의 청구항들로 본 발명의 범위를 정의하고, 청구항 범위 내의 방법과 구조 및 그에 상당하는 것을 다루고자 한다.
Claims (78)
- 고인산혈증, 저칼슘혈증, 부갑상선기능항진증, 신장의 칼시트리올 합성 기능저하, 저칼슘혈증으로 인한 강직, 신기능부전, 연조직에서의 이소성 석회화, 만성 신기능부전 및 동화 대사로부터 선택된 병태를 치료하기 위한 약학 조성물로서, 아민 단량체를 포함하는 가교된 아민 중합체를 포함하고, 여기서 아민은 가교제에 의해 가교된 것이고, 아민 단량체는 하기 화학식 I의 아민 또는 하기 화학식 IV의 아민인 약학 조성물:(상기 식에서, 각 n은 독립적으로 3과 같거나 그 이상이고, m은 1과 같거나 그 이상이고, 각 R1은 독립적으로 H이거나 또는 선택적으로 치환된 알킬 또는 아릴이거나 또는 이웃하는 R1에 연결되어 선택적으로 치환된 지방족 고리, 방향족 또는 이종원자고리기를 형성한다);(상기 식에서, 각 n은 독립적으로 3과 같거나 그 이상이고, 각 r은 독립적으로 0, 1, 또는 2이고, 각 R1은 독립적으로 H이거나 또는 선택적으로 치환된 알킬 또는 아릴이거나 또는 이웃하는 R1에 연결되어 선택적으로 치환된 지방족 고리, 방향족 또는 이종원자고리기를 형성한다)
- 제1항에 있어서, 상기 치료되는 병태는 고인산혈증 및 신기능부전에서 선택된 것인 약학 조성물.
- 제1항 내지 제3항 중 어느 하나의 항에 있어서, 가교제는 2 이상의 작용기를 갖는 것인 약학 조성물.
- 제5항 또는 제6항에 있어서, 가교제는 2 이상의 작용기를 갖는 것인 약학 조성물.
- 제8항에 있어서, 아민 단량체는 N,N,N',N'-테트라키스-(3-아미노프로필)-1,4-디아미노부탄인 가교된 아민 중합체.
- 제8항 또는 제9항에 있어서, 가교제는 1,3-디클로로프로판 및 에피클로로히드린으로 구성된 군에서 선택된 것인 가교된 아민 중합체.
- 제10항에 있어서, 중합체는 N,N,N',N'-테트라키스-(3-아미노프로필)-1,4-디아미노부탄과 에피클로로히드린의 중합으로 유도된 반복 단위를 포함하고, 여기서 중합체는 N,N,N',N'-테트라키스-(3-아미노프로필)-1,4-디아미노부탄의 초기 농도 대 물의 비율이 약 1:3 내지 약 4:1인 방법에 의해 생성된 것인 가교된 아민 중합체.
- 제10항에 있어서, 중합체는 아민 단량체 N,N,N',N'-테트라키스-(3-아미노프로필)-1,4-디아미노부탄 및 에피클로로히드린의 중합으로 유도된 반복 단위를 포함하는 포스페이트 결합성 중합체이고, 여기서 중합체는 반응 혼합물에 가해지는 에피클로로히드린 가교제의 총량이 반응 혼합물의 아민 단량체 N,N,N',N'-테트라키스-(3-아미노프로필)-1,4-디아미노부탄 총 함량의 약 200 몰% 내지 300 몰% 범위인 방법에 의해 생성된 것인 가교된 아민 중합체.
- 제14항 또는 제15항에 있어서, 아민 단량체는 N,N,N',N'-테트라키스-(3-아미노프로필)-1,4-디아미노부탄인 약제.
- 제14항 또는 제15항에 있어서, 가교제는 1,3-디클로로프로판 및 에피클로로히드린으로 구성된 군에서 선택된 것인 약제.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/701,385 | 2003-11-03 | ||
| US10/701,385 US7385012B2 (en) | 2003-11-03 | 2003-11-03 | Polyamine polymers |
| US10/806,495 US7335795B2 (en) | 2004-03-22 | 2004-03-22 | Crosslinked amine polymers |
| US10/806,495 | 2004-03-22 | ||
| US10/965,044 | 2004-10-13 | ||
| US10/965,044 US7459502B2 (en) | 2003-11-03 | 2004-10-13 | Pharmaceutical compositions comprising crosslinked polyamine polymers |
| PCT/US2004/036745 WO2005041902A2 (en) | 2003-11-03 | 2004-11-03 | Anion-binding polymers and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20070026338A KR20070026338A (ko) | 2007-03-08 |
| KR101052581B1 true KR101052581B1 (ko) | 2011-07-29 |
Family
ID=34557428
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020067010898A KR101052581B1 (ko) | 2003-11-03 | 2004-11-03 | 음이온 결합성 중합체 및 그 용도 |
Country Status (18)
| Country | Link |
|---|---|
| US (1) | US7459502B2 (ko) |
| EP (5) | EP1834976B1 (ko) |
| JP (3) | JP3996944B2 (ko) |
| KR (1) | KR101052581B1 (ko) |
| AT (5) | ATE414730T1 (ko) |
| AU (1) | AU2004285609B2 (ko) |
| BR (1) | BRPI0416172A (ko) |
| CA (1) | CA2542730C (ko) |
| CY (3) | CY1107728T1 (ko) |
| DE (5) | DE602004006892T2 (ko) |
| DK (3) | DK1682606T3 (ko) |
| ES (4) | ES2318823T3 (ko) |
| GB (1) | GB2426248B (ko) |
| HK (1) | HK1101697A1 (ko) |
| PL (3) | PL1854826T3 (ko) |
| PT (3) | PT1854826E (ko) |
| SI (3) | SI1854826T1 (ko) |
| WO (2) | WO2005041900A2 (ko) |
Families Citing this family (73)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6733780B1 (en) | 1999-10-19 | 2004-05-11 | Genzyme Corporation | Direct compression polymer tablet core |
| US20040161474A1 (en) * | 2002-05-24 | 2004-08-19 | Moerck Rudi E. | Rare earth metal compounds methods of making, and methods of using the same |
| US20060083791A1 (en) * | 2002-05-24 | 2006-04-20 | Moerck Rudi E | Rare earth metal compounds methods of making, and methods of using the same |
| US7381428B2 (en) * | 2003-08-26 | 2008-06-03 | Shire International Licensing B.V. | Stabilized lanthanum carbonate compositions |
| DE202004021169U1 (de) * | 2003-08-26 | 2007-03-01 | Shire Holdings Ag | Pharmazeutische Formulierung, die Lanthanverbindungen enthält |
| US7335795B2 (en) * | 2004-03-22 | 2008-02-26 | Ilypsa, Inc. | Crosslinked amine polymers |
| US7459502B2 (en) * | 2003-11-03 | 2008-12-02 | Ilypsa, Inc. | Pharmaceutical compositions comprising crosslinked polyamine polymers |
| US7767768B2 (en) * | 2003-11-03 | 2010-08-03 | Ilypsa, Inc. | Crosslinked amine polymers |
| US7385012B2 (en) | 2003-11-03 | 2008-06-10 | Ilypsa, Inc. | Polyamine polymers |
| US7608674B2 (en) | 2003-11-03 | 2009-10-27 | Ilypsa, Inc. | Pharmaceutical compositions comprising cross-linked small molecule amine polymers |
| US7449605B2 (en) * | 2003-11-03 | 2008-11-11 | Ilypsa, Inc. | Crosslinked amine polymers |
| CA2583548A1 (en) * | 2004-10-15 | 2006-04-27 | Altairnano, Inc. | Phosphate binder with reduced pill burden |
| US7985418B2 (en) | 2004-11-01 | 2011-07-26 | Genzyme Corporation | Aliphatic amine polymer salts for tableting |
| US20060177415A1 (en) * | 2004-11-01 | 2006-08-10 | Burke Steven K | Once a day formulation for phosphate binders |
| ITME20040015A1 (it) | 2004-12-07 | 2005-03-07 | Vincenzo Savica | Chewing gum, caramelle gommose, pastiglie, compresse a lento rilascio di chelanti fosfato e/o fosforo salivare e capsule a lento rilascio di chelanti fosfato e/o fosforo a livello gastroenterico. |
| EP1947960A4 (en) * | 2005-08-17 | 2009-05-06 | Altairnano Inc | COMPOSITIONS AND METHODS FOR TREATING HYPERPHOSPHATEMIA IN DOMESTIC ANIMALS |
| US20080058250A1 (en) * | 2005-08-17 | 2008-03-06 | Allison Wren | Treatment of chronic renal failure and other conditions in domestic animals: compositions and methods |
| JP2009507019A (ja) | 2005-09-02 | 2009-02-19 | ジェンザイム・コーポレーション | リン酸塩を除去する方法およびそれに使用される重合体 |
| US8114393B2 (en) * | 2005-09-14 | 2012-02-14 | Wisconsin Alumni Research Foundation | Methods and compositions for phosphate binding |
| CA2622021C (en) | 2005-09-14 | 2014-07-15 | Wisconsin Alumni Research Foundation | Composition comprising a dendrimer and the use thereof for binding phosphate |
| AU2012205214B2 (en) * | 2005-09-15 | 2015-05-21 | Genzyme Corporation | Formulation for Amine Polymers |
| KR101574072B1 (ko) | 2005-09-15 | 2015-12-04 | 젠자임 코포레이션 | 아민 중합체에 대한 샤셋 제형 |
| JP2009510126A (ja) * | 2005-09-30 | 2009-03-12 | レリプサ, インコーポレイテッド | 哺乳類の胃腸管からカリウムイオンを選択的に除去するための方法および組成物 |
| CA2624112A1 (en) * | 2005-09-30 | 2007-04-05 | Ilypsa, Inc. | Methods for preparing core-shell composites having cross-linked shells and core-shell composites resulting therefrom |
| EP1973529B1 (en) * | 2006-01-05 | 2011-05-25 | LifeCycle Pharma A/S | Disintegrating loadable tablets |
| US20070177866A1 (en) * | 2006-01-31 | 2007-08-02 | Yoshizo Fujimoto | Camera extension arm |
| WO2007094779A1 (en) * | 2006-02-14 | 2007-08-23 | Teva Pharmaceutical Industries Ltd. | Pharmaceutical formulations of aliphatic amine polymers and methods for their manufacture |
| CN100398112C (zh) * | 2006-03-24 | 2008-07-02 | 辽宁诺康生物制药有限责任公司 | 一种治疗血磷酸盐过多症的药物及其制备方法 |
| JP2009536246A (ja) * | 2006-05-05 | 2009-10-08 | ゲンズイメ コーポレーション | ホスフェート捕捉剤としてのアミン縮合重合体 |
| CA2658338A1 (en) * | 2006-07-18 | 2008-01-24 | Genzyme Corporation | Amine dendrimers |
| WO2008062437A2 (en) * | 2006-09-01 | 2008-05-29 | Usv Limited | Process for the preparation of sevelamer hydrochloride and formulation thereof |
| US7964182B2 (en) * | 2006-09-01 | 2011-06-21 | USV, Ltd | Pharmaceutical compositions comprising phosphate-binding polymer |
| EP2066293A2 (en) | 2006-09-29 | 2009-06-10 | Genzyme Corporation | Amide dendrimer compositions |
| WO2008076242A1 (en) | 2006-12-14 | 2008-06-26 | Genzyme Corporation | Amido-amine polymer compositions |
| US20100129309A1 (en) * | 2007-02-23 | 2010-05-27 | Dhal Pradeep K | Amine polymer compositions |
| US20100196305A1 (en) * | 2007-03-08 | 2010-08-05 | Dhal Pradeep K | Sulfone polymer compositions |
| WO2008133954A1 (en) * | 2007-04-27 | 2008-11-06 | Genzyme Corporation | Amido-amine dendrimer compositions |
| US20100189679A1 (en) * | 2007-07-11 | 2010-07-29 | Toray Industries, Inc. | Crosslinked polyallylamine or acid addition salt thereof, and use thereof for medical purposes |
| EP2016947A1 (en) * | 2007-07-17 | 2009-01-21 | Chemo Ibérica, S.A. | Novel one step process for preparing cross-linked poly(allylamine) polymers |
| WO2009023544A2 (en) * | 2007-08-10 | 2009-02-19 | Ilypsa, Inc. | Dosage unit anion-exchange polymer pharmaceutical compositions |
| WO2009034540A1 (en) * | 2007-09-11 | 2009-03-19 | Ranbaxy Laboratories Limited | Pharmaceutical composition of sevelamer |
| JP5332520B2 (ja) * | 2007-11-07 | 2013-11-06 | アステラス製薬株式会社 | 医薬用錠剤 |
| WO2009097127A1 (en) * | 2008-01-31 | 2009-08-06 | Genzyme Corporation | Pharmaceutical compositions |
| WO2009154747A1 (en) * | 2008-06-20 | 2009-12-23 | Genzyme Corporation | Pharmaceutical compositions |
| AU2010209293A1 (en) * | 2009-01-22 | 2011-09-08 | Usv Limited | Pharmaceutical compositions comprising phosphate-binding polymer |
| IT1394299B1 (it) * | 2009-05-12 | 2012-06-06 | Chimico Internaz Spa Lab | Procedimento per la preparazione di sevelamer |
| AU2011220748B2 (en) | 2010-02-24 | 2015-11-05 | Relypsa, Inc. | Amine polymers for use as bile acid sequestrants |
| WO2011106545A1 (en) * | 2010-02-24 | 2011-09-01 | Relypsa, Inc. | Polyimidazoles for use as bile acid sequestrants |
| EP2998329A3 (en) * | 2010-02-24 | 2016-04-06 | Relypsa, Inc. | Crosslinked polyvinylamine, polyallylamine, and polyethyleneimine for use as bile acid sequestrants |
| US8961917B2 (en) | 2010-05-12 | 2015-02-24 | Spectrum Pharmaceuticals, Inc. | Lanthanum carbonate hydroxide, lanthanum oxycarbonate and methods of their manufacture and use |
| US20130156720A1 (en) | 2010-08-27 | 2013-06-20 | Ironwood Pharmaceuticals, Inc. | Compositions and methods for treating or preventing metabolic syndrome and related diseases and disorders |
| US10369529B2 (en) | 2012-01-30 | 2019-08-06 | California Institute Of Technology | Mixed matrix membranes with embedded polymeric particles and networks and related compositions, methods, and systems |
| US9302922B2 (en) | 2012-01-30 | 2016-04-05 | California Institute Of Technology | Filtration membranes and related compositions, methods and systems |
| EP2557074A1 (en) | 2011-08-11 | 2013-02-13 | Astellas Pharma Inc. | Process for the preparation of N,N,N',N'-tetrakis(3-aminopropyl)-1,4-butanediamine |
| CN104640906B (zh) | 2012-07-19 | 2016-11-23 | 佐治亚-太平洋化工品有限公司 | 来自新的交联剂的高效湿强度树脂 |
| US20160024233A1 (en) * | 2013-03-15 | 2016-01-28 | Genzyme Corporation | Sequestrants of advanced glycation end product (age) precursors |
| LT3003327T (lt) | 2013-06-05 | 2017-12-27 | Tricida Inc. | Protonus surišantys polimerai, skirti geriamajam vartojimui |
| US10435528B2 (en) | 2013-09-17 | 2019-10-08 | Aquanano Llc | High-capacity anion exchange materials |
| JP5843986B2 (ja) * | 2014-03-25 | 2016-01-13 | アステラス製薬株式会社 | 粒状医薬組成物 |
| WO2016043808A1 (en) | 2014-09-17 | 2016-03-24 | Aquanano Llc | High-capacity anion exchange material |
| MX2017007497A (es) * | 2014-12-10 | 2017-10-04 | Tricida Inc | Polimeros de union a protones para administracion oral. |
| EP3280769B1 (en) * | 2015-04-06 | 2022-03-16 | 3M Innovative Properties Company | Removable film forming gel compositions and methods for their application |
| BR112017025566B1 (pt) * | 2015-05-29 | 2022-11-29 | Ecolab Usa Inc | Resina de fortalecimento |
| RU2018142943A (ru) | 2016-05-06 | 2020-06-08 | Трисида, Инк. | Композиции для лечения нарушений кислотно-основного равновесия |
| EP3564292B1 (en) | 2016-12-28 | 2021-06-16 | FUJIFILM Corporation | Emulsion of nitrogen atom-containing polymer or salt thereof, production method therefor, and production method for particles |
| CN107141408A (zh) * | 2017-06-12 | 2017-09-08 | 厦门建霖健康家居股份有限公司 | 一种抗菌聚合物及其制备方法 |
| US10934380B1 (en) | 2017-09-25 | 2021-03-02 | Tricida, Inc. | Crosslinked poly(allylamine) polymer pharmaceutical compositions |
| WO2019078198A1 (ja) | 2017-10-16 | 2019-04-25 | 富士フイルム株式会社 | 高リン血症治療剤および粒子 |
| CN111225674A (zh) | 2017-10-16 | 2020-06-02 | 富士胶片株式会社 | 高磷血症治疗剂 |
| US11266684B2 (en) | 2017-11-03 | 2022-03-08 | Tricida, Inc. | Compositions for and method of treating acid-base disorders |
| CN111521705B (zh) * | 2020-05-05 | 2021-04-20 | 大连润生康泰医学检验实验室有限公司 | 一种血清中胆汁酸的富集方法 |
| WO2023064357A1 (en) * | 2021-10-13 | 2023-04-20 | Tricida, Inc. | Pharmaceutical compositions for the treatment of lithiasis disorders |
| CN115260355A (zh) * | 2022-05-16 | 2022-11-01 | 江苏中天药业有限公司 | 一种阴离子交换树脂、其制备方法、该树脂与药物的复合物和其掩味制剂 |
Family Cites Families (90)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US814789A (en) | 1904-12-21 | 1906-03-13 | Edward D Mackintosh | Drawing and plotting device. |
| US3308020A (en) | 1961-09-22 | 1967-03-07 | Merck & Co Inc | Compositions and method for binding bile acids in vivo including hypocholesteremics |
| US3499960A (en) | 1965-01-25 | 1970-03-10 | Merck & Co Inc | Palatable coated particles of an anion exchange resin |
| US3692895A (en) | 1970-09-08 | 1972-09-19 | Norman A Nelson | Method of reducing hypercholesteremia in humans employing a copolymer of polyethylenepolyamine and a bifunctional substance, such as epichlorohydria |
| US3974272A (en) | 1972-09-01 | 1976-08-10 | Merck & Co., Inc. | Palatable cholestyramine coacervate compositions |
| US4027009A (en) | 1973-06-11 | 1977-05-31 | Merck & Co., Inc. | Compositions and methods for depressing blood serum cholesterol |
| US3930810A (en) | 1974-07-31 | 1976-01-06 | Universal Oil Products Company | Additives for petroleum distillates |
| US4015939A (en) | 1976-05-12 | 1977-04-05 | Bio-Rad Laboratories, Inc. | Competitive binding thyroid assay with improved bound-free separation step |
| US4135880A (en) | 1977-08-19 | 1979-01-23 | Bio-Rad Laboratories, Inc. | Folate assay with ion exchange resin bound-free separation |
| US4410688A (en) | 1981-04-29 | 1983-10-18 | Allied Corporation | Macromolecular highly branched homogeneous compound |
| US4507466A (en) | 1983-01-07 | 1985-03-26 | The Dow Chemical Corporation | Dense star polymers having core, core branches, terminal groups |
| US4568737A (en) | 1983-01-07 | 1986-02-04 | The Dow Chemical Company | Dense star polymers and dendrimers |
| US4558120A (en) | 1983-01-07 | 1985-12-10 | The Dow Chemical Company | Dense star polymer |
| US4631337A (en) | 1983-01-07 | 1986-12-23 | The Dow Chemical Company | Hydrolytically-stable dense star polyamine |
| US4737550A (en) | 1983-01-07 | 1988-04-12 | The Dow Chemical Company | Bridged dense star polymers |
| JPS6090243A (ja) | 1983-10-25 | 1985-05-21 | Nitto Boseki Co Ltd | 小球状モノアリルアミン橋かけ重合体の製造方法 |
| US4587329A (en) | 1984-08-17 | 1986-05-06 | The Dow Chemical Company | Dense star polymers having two dimensional molecular diameter |
| US4599400A (en) | 1984-12-18 | 1986-07-08 | The Dow Chemical Company | Star/comb-branched polyamide |
| US4747881A (en) | 1985-02-05 | 1988-05-31 | Warner-Lambert Company | Ingestible aggregate and delivery system prepared therefrom |
| US4734200A (en) | 1986-04-04 | 1988-03-29 | Advanced Separation Technologies Incorporated | Process for removal of fluoride and phosphorus-type contaminants from acidic wastewater |
| IT1190349B (it) | 1986-06-16 | 1988-02-16 | Prodotti Formenti Srl | Composizioni farmaceutiche ad attivita' sequestrante degli acidi biliari contenenti colestiramina quale principio attivo,e procedimento per prepararle |
| US5338532A (en) | 1986-08-18 | 1994-08-16 | The Dow Chemical Company | Starburst conjugates |
| US5807582A (en) | 1988-08-26 | 1998-09-15 | Pharmacia & Upjohn Company | Fine-beaded colestipol hydrochloride and pharmaceutically elegant dosage forms made therefrom |
| GB8829088D0 (en) | 1988-12-13 | 1989-01-25 | Smith Kline French Lab | Compounds |
| US5091175A (en) | 1990-05-14 | 1992-02-25 | Erbamont Inc. | Pharmaceutical composition containing bile acid sequestrant enclosed in a size-exclusion membrane |
| FR2680791B1 (fr) | 1991-08-30 | 1994-09-09 | Bp Chemicals Snc | Procede de fabrication d'un polymere reticule et utilisation du polymere. |
| US5530092A (en) | 1992-01-13 | 1996-06-25 | Dsm N.V. | Dendritic macromolecule and the preparation thereof |
| BE1007260A3 (nl) | 1993-07-08 | 1995-05-02 | Dsm Nv | Werkwijze voor het bereiden van een dendritisch macromolekuul. |
| US5380522A (en) | 1992-08-11 | 1995-01-10 | Day; Charles E. | Method for treatment of irritable bowel syndrome |
| US5451397A (en) * | 1992-12-21 | 1995-09-19 | Rohm And Haas Company | Bile acid sequestrant |
| EP0684958B1 (en) | 1993-02-17 | 1998-06-10 | Btg International Limited | Polymers containing guanidino groups for use in therapy |
| US5487888A (en) | 1993-05-20 | 1996-01-30 | Geltex, Inc. | Iron-binding polymers for oral administration |
| US5618530A (en) | 1994-06-10 | 1997-04-08 | Geltex Pharmaceuticals, Inc. | Hydrophobic amine polymer sequestrant and method of cholesterol depletion |
| US6129910A (en) | 1993-06-02 | 2000-10-10 | Geltex Pharmaceuticals, Inc. | Water-insoluble noncrosslinked bile acid sequestrants |
| US5607669A (en) | 1994-06-10 | 1997-03-04 | Geltex Pharmaceuticals, Inc. | Amine polymer sequestrant and method of cholesterol depletion |
| CA2129079C (en) | 1993-08-03 | 2006-01-17 | Tatsuo Nomura | Orally administrable cholesterol lowering agent |
| US5496545A (en) * | 1993-08-11 | 1996-03-05 | Geltex Pharmaceuticals, Inc. | Phosphate-binding polymers for oral administration |
| US5667775A (en) | 1993-08-11 | 1997-09-16 | Geltex Pharmaceuticals, Inc. | Phosphate-binding polymers for oral administration |
| US5414068A (en) | 1994-01-24 | 1995-05-09 | Rohm And Haas Company | Crosslinked anion exchange particles and method for producing the particles |
| WO1995020619A1 (en) | 1994-01-28 | 1995-08-03 | Dsm N.V. | Dendritic macromolecule and a process for the preparation thereof |
| BE1008134A3 (nl) | 1994-03-16 | 1996-01-23 | Dsm Nv | Bereiding van stervormig vertakte polymeren. |
| TW474813B (en) | 1994-06-10 | 2002-02-01 | Geltex Pharma Inc | Alkylated composition for removing bile salts from a patient |
| GB9503061D0 (en) | 1995-02-16 | 1995-04-05 | British Tech Group | Polymeric compounds |
| US6060604A (en) | 1995-03-31 | 2000-05-09 | Florida State University | Pharmaceutical compounds comprising polyamines substituted with electron-affinic groups |
| NL1001973C2 (nl) | 1995-12-21 | 1997-06-24 | Stork Friesland Bv | Semipermeabel composietmembraan. |
| TW528597B (en) | 1996-03-05 | 2003-04-21 | Mitsubishi Electric Corp | Medicament for preventive and/or therapeutic treatment of hyperphosphatemia |
| US6034129A (en) | 1996-06-24 | 2000-03-07 | Geltex Pharmaceuticals, Inc. | Ionic polymers as anti-infective agents |
| CN1230118A (zh) | 1996-07-19 | 1999-09-29 | 日研化学株式会社 | 高磷血症治疗剂 |
| EP0934352B1 (en) | 1996-10-23 | 2007-05-02 | Dow Global Technologies Inc. | Water-soluble polymers for the reduction of dietary phosphate or oxalate absorption |
| TW592727B (en) | 1997-04-04 | 2004-06-21 | Chugai Pharmaceutical Co Ltd | Phosphate-binding polymer preparations |
| JP2003183168A (ja) * | 1997-04-04 | 2003-07-03 | Chugai Pharmaceut Co Ltd | リン酸結合性ポリマー含有製剤 |
| US6423754B1 (en) | 1997-06-18 | 2002-07-23 | Geltex Pharmaceuticals, Inc. | Method for treating hypercholesterolemia with polyallylamine polymers |
| US6007803A (en) | 1997-09-19 | 1999-12-28 | Geltex Pharmaceuticals, Inc. | Ionic polymers as toxin binding agents |
| US20040170600A1 (en) | 1997-10-22 | 2004-09-02 | Jaime Simon | Water-soluble polymers for the reduction of dietary phosphate or oxalate absorption |
| US5985938A (en) | 1997-11-05 | 1999-11-16 | Geltex Pharmaceuticals, Inc. | Method for reducing oxalate |
| US6726905B1 (en) | 1997-11-05 | 2004-04-27 | Genzyme Corporation | Poly (diallylamines)-based phosphate binders |
| US6566407B2 (en) | 1997-11-05 | 2003-05-20 | Geltex Pharmaceuticals, Inc. | Method for reducing oxalate |
| EP1047407A4 (en) | 1997-12-19 | 2007-05-02 | Smithkline Beecham Corp | METHOD FOR PRODUCING A COUTINE TABLET |
| US6333051B1 (en) | 1998-09-03 | 2001-12-25 | Supratek Pharma, Inc. | Nanogel networks and biological agent compositions thereof |
| TW568788B (en) | 1998-10-12 | 2004-01-01 | Chugai Pharmaceutical Co Ltd | Polymer combining with phosphoric acid and preparation containing the same |
| JP3363143B2 (ja) * | 1998-10-12 | 2003-01-08 | 中外製薬株式会社 | リン酸結合性ポリマー粒子 |
| US6361768B1 (en) | 1998-12-29 | 2002-03-26 | Pmd Holdings Corp. | Hydrophilic ampholytic polymer |
| US6180754B1 (en) | 1999-09-03 | 2001-01-30 | The Dow Chemical Company | Process for producing cross-linked polyallylamine polymer |
| US6362266B1 (en) | 1999-09-03 | 2002-03-26 | The Dow Chemical Company | Process for reducing cohesiveness of polyallylamine polymer gels during drying |
| US20020054903A1 (en) | 1999-10-19 | 2002-05-09 | Joseph Tyler | Direct compression polymer tablet core |
| US6733780B1 (en) | 1999-10-19 | 2004-05-11 | Genzyme Corporation | Direct compression polymer tablet core |
| US20040059065A1 (en) | 2000-03-09 | 2004-03-25 | Takeshi Goto | Crosslinked anion-exchange resin or salt thereof |
| DE10011481A1 (de) | 2000-03-09 | 2001-10-18 | Fresenius Hemocare Gmbh | Adsorbens zum Absenken der Konzentration von Fibrinogen und/oder Fibrin, Verwendung des Adsorbens zur Herstellung eines Adsorbers und Adsorber mit dem Adsorbens |
| WO2001066607A1 (fr) * | 2000-03-09 | 2001-09-13 | Hisamitsu Pharmaceutical Co., Inc. | Resine echangeuse d'anions reticulee ou sel de celle-ci et adsorbant phosphoreux la contenant |
| WO2001068106A1 (fr) | 2000-03-13 | 2001-09-20 | Hisamitsu Pharmaceutical Co., Inc. | Prophylactiques et/ou remedes pour hyperphosphatemie |
| US6471968B1 (en) | 2000-05-12 | 2002-10-29 | Regents Of The University Of Michigan | Multifunctional nanodevice platform |
| US6646083B2 (en) | 2000-06-16 | 2003-11-11 | Nippon Shokubai Co., Ltd. | Crosslinked polymers containing tertiary amine and/or quaternary ammonium salt structures, processes for making and uses thereof |
| DE60132256T2 (de) | 2000-11-20 | 2008-12-24 | Sorbent Therapeutics, Inc., Vernon Hills | Wasserabsorbierende polymere und deren verwendung |
| WO2002066543A1 (en) | 2001-02-16 | 2002-08-29 | Genzyme Corporation | Method of drying a material having a cohesive phase |
| WO2002085383A1 (en) | 2001-04-18 | 2002-10-31 | Genzyme Corporation | Method for reducing copper levels and treating copper toxicosis |
| BR0209124A (pt) | 2001-04-18 | 2005-02-09 | Genzyme Corp | Método para tratar uma sìndrome x ou inibir o inìcio dos sintomas da sìndrome x e uso de uma quantidade terapeuticamente efetiva de um sal de pelo menos um polìmero de amina alifática |
| AU2002257145B2 (en) | 2001-04-18 | 2005-06-02 | Genzyme Corporation | Method for lowering serum glucose |
| JP2004528332A (ja) | 2001-04-18 | 2004-09-16 | ジェンザイム コーポレーション | 痛風を治療する方法および尿酸を結合する方法 |
| WO2002085380A1 (en) | 2001-04-18 | 2002-10-31 | Geltex Pharmaceuticals, Inc. | Method for treating gout and reducing serum uric acid |
| WO2002085379A1 (en) | 2001-04-18 | 2002-10-31 | Geltex Pharmaceuticals, Inc. | Method for improving vascular access in patients with vascular shunts |
| US6600011B2 (en) | 2001-10-09 | 2003-07-29 | Genzyme Corporation | Process for purification and drying of polymer hydrogels |
| JP3931639B2 (ja) * | 2001-11-19 | 2007-06-20 | セイコーエプソン株式会社 | インクジェットプリンタに使用するための水性インク組成物 |
| AU2003282867A1 (en) | 2002-10-22 | 2004-05-13 | Genzyme Corporation | Amine polymers for promoting bone formation |
| DE10305807A1 (de) | 2003-02-12 | 2004-08-26 | Basf Ag | Polymethylenamine und Verfahren zu deren Herstellung |
| US7335795B2 (en) | 2004-03-22 | 2008-02-26 | Ilypsa, Inc. | Crosslinked amine polymers |
| US7459502B2 (en) * | 2003-11-03 | 2008-12-02 | Ilypsa, Inc. | Pharmaceutical compositions comprising crosslinked polyamine polymers |
| US7608674B2 (en) | 2003-11-03 | 2009-10-27 | Ilypsa, Inc. | Pharmaceutical compositions comprising cross-linked small molecule amine polymers |
| US7449605B2 (en) | 2003-11-03 | 2008-11-11 | Ilypsa, Inc. | Crosslinked amine polymers |
| US7385012B2 (en) | 2003-11-03 | 2008-06-10 | Ilypsa, Inc. | Polyamine polymers |
| US20050276781A1 (en) | 2004-06-09 | 2005-12-15 | Ross Edward A | Molecularly imprinted phosphate binders for therapeutic use |
-
2004
- 2004-10-13 US US10/965,044 patent/US7459502B2/en not_active Expired - Fee Related
- 2004-11-03 AT AT07109664T patent/ATE414730T1/de active
- 2004-11-03 JP JP2006538481A patent/JP3996944B2/ja active Active
- 2004-11-03 AT AT04810309T patent/ATE398636T1/de not_active IP Right Cessation
- 2004-11-03 PL PL07109664T patent/PL1854826T3/pl unknown
- 2004-11-03 PL PL08164715T patent/PL2009042T3/pl unknown
- 2004-11-03 ES ES07109664T patent/ES2318823T3/es active Active
- 2004-11-03 DE DE602004006892T patent/DE602004006892T2/de active Active
- 2004-11-03 PT PT07109664T patent/PT1854826E/pt unknown
- 2004-11-03 EP EP07108283A patent/EP1834976B1/en not_active Not-in-force
- 2004-11-03 EP EP08164715A patent/EP2009042B1/en not_active Not-in-force
- 2004-11-03 DE DE602004014527T patent/DE602004014527D1/de active Active
- 2004-11-03 KR KR1020067010898A patent/KR101052581B1/ko not_active IP Right Cessation
- 2004-11-03 DK DK04810316T patent/DK1682606T3/da active
- 2004-11-03 CA CA2542730A patent/CA2542730C/en not_active Expired - Fee Related
- 2004-11-03 GB GB0610607A patent/GB2426248B/en not_active Expired - Fee Related
- 2004-11-03 EP EP07109664A patent/EP1854826B1/en not_active Not-in-force
- 2004-11-03 AT AT04810316T patent/ATE364057T1/de active
- 2004-11-03 PL PL04810316T patent/PL1682606T3/pl unknown
- 2004-11-03 ES ES04810316T patent/ES2287806T3/es active Active
- 2004-11-03 DE DE602004023661T patent/DE602004023661D1/de active Active
- 2004-11-03 SI SI200430903T patent/SI1854826T1/sl unknown
- 2004-11-03 AT AT07108283T patent/ATE546482T1/de active
- 2004-11-03 DK DK07109664T patent/DK1854826T3/da active
- 2004-11-03 DE DE602004017918T patent/DE602004017918D1/de active Active
- 2004-11-03 PT PT04810316T patent/PT1682606E/pt unknown
- 2004-11-03 WO PCT/US2004/036738 patent/WO2005041900A2/en active Application Filing
- 2004-11-03 DK DK08164715T patent/DK2009042T3/da active
- 2004-11-03 ES ES04810309T patent/ES2308294T3/es active Active
- 2004-11-03 BR BRPI0416172-6A patent/BRPI0416172A/pt not_active IP Right Cessation
- 2004-11-03 AT AT08164715T patent/ATE445662T1/de active
- 2004-11-03 AU AU2004285609A patent/AU2004285609B2/en not_active Ceased
- 2004-11-03 EP EP04810309A patent/EP1687349B1/en not_active Not-in-force
- 2004-11-03 SI SI200431249T patent/SI2009042T1/sl unknown
- 2004-11-03 ES ES08164715T patent/ES2330693T3/es active Active
- 2004-11-03 DE DE112004002099T patent/DE112004002099T5/de not_active Withdrawn
- 2004-11-03 PT PT08164715T patent/PT2009042E/pt unknown
- 2004-11-03 EP EP04810316A patent/EP1682606B1/en not_active Not-in-force
- 2004-11-03 WO PCT/US2004/036745 patent/WO2005041902A2/en active IP Right Grant
- 2004-11-03 SI SI200430413T patent/SI1682606T1/sl unknown
-
2007
- 2007-02-23 JP JP2007044763A patent/JP4902864B2/ja active Active
- 2007-06-11 HK HK07106216.8A patent/HK1101697A1/xx not_active IP Right Cessation
- 2007-07-04 JP JP2007176813A patent/JP5074838B2/ja active Active
- 2007-09-05 CY CY20071101150T patent/CY1107728T1/el unknown
-
2009
- 2009-02-18 CY CY20091100185T patent/CY1110475T1/el unknown
- 2009-11-19 CY CY20091101207T patent/CY1110562T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101052581B1 (ko) | 음이온 결합성 중합체 및 그 용도 | |
| US7608674B2 (en) | Pharmaceutical compositions comprising cross-linked small molecule amine polymers | |
| US7449605B2 (en) | Crosslinked amine polymers | |
| EP1831266B1 (en) | Crosslinked amine polymers | |
| US20080107737A1 (en) | Crosslinked Amine Polymers | |
| CA2658338A1 (en) | Amine dendrimers | |
| JP2010525061A (ja) | アミドアミンデンドリマー組成物 | |
| JP2011506449A (ja) | コーティング医薬組成物 | |
| JP2010520285A (ja) | スルホンポリマー組成物 | |
| MXPA06004859A (en) | Anion-binding polymers and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20140716 Year of fee payment: 4 |
|
| LAPS | Lapse due to unpaid annual fee |