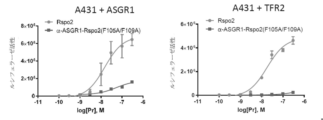
JP7305543B2 - 組織特異的Wntシグナル増強分子およびその使用 - Google Patents
組織特異的Wntシグナル増強分子およびその使用 Download PDFInfo
- Publication number
- JP7305543B2 JP7305543B2 JP2019541341A JP2019541341A JP7305543B2 JP 7305543 B2 JP7305543 B2 JP 7305543B2 JP 2019541341 A JP2019541341 A JP 2019541341A JP 2019541341 A JP2019541341 A JP 2019541341A JP 7305543 B2 JP7305543 B2 JP 7305543B2
- Authority
- JP
- Japan
- Prior art keywords
- tissue
- polypeptide
- molecule
- domain
- wnt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 230000002708 enhancing effect Effects 0.000 title claims description 100
- 102000013814 Wnt Human genes 0.000 claims description 501
- 108050003627 Wnt Proteins 0.000 claims description 501
- 210000001519 tissue Anatomy 0.000 claims description 439
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 321
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 309
- 229920001184 polypeptide Polymers 0.000 claims description 303
- 210000004027 cell Anatomy 0.000 claims description 292
- 230000011664 signaling Effects 0.000 claims description 199
- 150000007523 nucleic acids Chemical class 0.000 claims description 140
- 230000027455 binding Effects 0.000 claims description 130
- 239000000556 agonist Substances 0.000 claims description 115
- 239000012634 fragment Substances 0.000 claims description 111
- 101710085992 Norrin Proteins 0.000 claims description 110
- 102100025036 Norrin Human genes 0.000 claims description 110
- 238000000034 method Methods 0.000 claims description 103
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 102
- 108090001126 Furin Proteins 0.000 claims description 98
- 102000004961 Furin Human genes 0.000 claims description 98
- 239000008194 pharmaceutical composition Substances 0.000 claims description 95
- 239000013598 vector Substances 0.000 claims description 94
- 108090000623 proteins and genes Proteins 0.000 claims description 91
- 201000010099 disease Diseases 0.000 claims description 71
- 108020004999 messenger RNA Proteins 0.000 claims description 67
- 102000004169 proteins and genes Human genes 0.000 claims description 65
- 235000018102 proteins Nutrition 0.000 claims description 63
- 125000005647 linker group Chemical group 0.000 claims description 57
- 108020001507 fusion proteins Proteins 0.000 claims description 56
- 102000037865 fusion proteins Human genes 0.000 claims description 56
- 102100026245 E3 ubiquitin-protein ligase RNF43 Human genes 0.000 claims description 55
- 101710109241 E3 ubiquitin-protein ligase RNF43 Proteins 0.000 claims description 52
- 101710200897 Asialoglycoprotein receptor 1 Proteins 0.000 claims description 46
- 102100026292 Asialoglycoprotein receptor 1 Human genes 0.000 claims description 46
- 239000013604 expression vector Substances 0.000 claims description 44
- 230000001965 increasing effect Effects 0.000 claims description 40
- 101000835086 Homo sapiens Transferrin receptor protein 2 Proteins 0.000 claims description 39
- 101001038507 Homo sapiens Ly6/PLAUR domain-containing protein 3 Proteins 0.000 claims description 38
- 102100040281 Ly6/PLAUR domain-containing protein 3 Human genes 0.000 claims description 38
- 102100026143 Transferrin receptor protein 2 Human genes 0.000 claims description 38
- 102000005962 receptors Human genes 0.000 claims description 38
- 108020003175 receptors Proteins 0.000 claims description 38
- 150000003839 salts Chemical class 0.000 claims description 38
- 108010001857 Cell Surface Receptors Proteins 0.000 claims description 37
- 102000000844 Cell Surface Receptors Human genes 0.000 claims description 37
- 102100026293 Asialoglycoprotein receptor 2 Human genes 0.000 claims description 35
- 101710200901 Asialoglycoprotein receptor 2 Proteins 0.000 claims description 35
- 239000000203 mixture Substances 0.000 claims description 34
- 235000001014 amino acid Nutrition 0.000 claims description 33
- 108010058828 Parathyroid Hormone Receptors Proteins 0.000 claims description 32
- 108091006611 SLC10A1 Proteins 0.000 claims description 32
- 102000054329 Solute carrier family 10 member 1 Human genes 0.000 claims description 31
- 150000001413 amino acids Chemical group 0.000 claims description 31
- 208000035475 disorder Diseases 0.000 claims description 31
- 102000039446 nucleic acids Human genes 0.000 claims description 31
- 108020004707 nucleic acids Proteins 0.000 claims description 31
- 229940024606 amino acid Drugs 0.000 claims description 30
- 239000003446 ligand Substances 0.000 claims description 28
- 210000000988 bone and bone Anatomy 0.000 claims description 27
- 238000011282 treatment Methods 0.000 claims description 26
- 239000013603 viral vector Substances 0.000 claims description 26
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 claims description 22
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 claims description 22
- 210000005228 liver tissue Anatomy 0.000 claims description 22
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 21
- 239000003085 diluting agent Substances 0.000 claims description 20
- 101000825949 Homo sapiens R-spondin-2 Proteins 0.000 claims description 18
- 102000047209 human Rspo2 Human genes 0.000 claims description 18
- 230000004927 fusion Effects 0.000 claims description 17
- 230000008901 benefit Effects 0.000 claims description 16
- 210000004400 mucous membrane Anatomy 0.000 claims description 15
- 102100022763 R-spondin-2 Human genes 0.000 claims description 14
- 101710110295 R-spondin-2 Proteins 0.000 claims description 14
- -1 Wnt2B Proteins 0.000 claims description 14
- 102000011799 Desmoglein Human genes 0.000 claims description 13
- 108050002238 Desmoglein Proteins 0.000 claims description 13
- 102000037126 Leucine-rich repeat-containing G-protein-coupled receptors Human genes 0.000 claims description 13
- 108091006332 Leucine-rich repeat-containing G-protein-coupled receptors Proteins 0.000 claims description 13
- 239000002671 adjuvant Substances 0.000 claims description 13
- 208000019423 liver disease Diseases 0.000 claims description 13
- 230000002829 reductive effect Effects 0.000 claims description 12
- 241000711549 Hepacivirus C Species 0.000 claims description 11
- 210000002200 mouth mucosa Anatomy 0.000 claims description 11
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 claims description 11
- 230000010354 integration Effects 0.000 claims description 10
- 210000003491 skin Anatomy 0.000 claims description 10
- 230000001720 vestibular Effects 0.000 claims description 10
- 241000700721 Hepatitis B virus Species 0.000 claims description 9
- 241000124008 Mammalia Species 0.000 claims description 9
- 238000002560 therapeutic procedure Methods 0.000 claims description 9
- 239000004471 Glycine Substances 0.000 claims description 8
- 102100022762 R-spondin-1 Human genes 0.000 claims description 8
- 210000003169 central nervous system Anatomy 0.000 claims description 8
- 230000000968 intestinal effect Effects 0.000 claims description 8
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 claims description 8
- 238000011069 regeneration method Methods 0.000 claims description 8
- 238000006467 substitution reaction Methods 0.000 claims description 8
- 210000001779 taste bud Anatomy 0.000 claims description 8
- 101710110302 R-spondin-1 Proteins 0.000 claims description 7
- 230000001154 acute effect Effects 0.000 claims description 7
- 210000003027 ear inner Anatomy 0.000 claims description 7
- 210000003780 hair follicle Anatomy 0.000 claims description 7
- 210000005003 heart tissue Anatomy 0.000 claims description 7
- 210000004072 lung Anatomy 0.000 claims description 7
- 210000005075 mammary gland Anatomy 0.000 claims description 7
- 230000002611 ovarian Effects 0.000 claims description 7
- 210000004923 pancreatic tissue Anatomy 0.000 claims description 7
- 230000008929 regeneration Effects 0.000 claims description 7
- 210000005084 renal tissue Anatomy 0.000 claims description 7
- 230000002207 retinal effect Effects 0.000 claims description 7
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 claims description 6
- 101710094892 Furin-1 Proteins 0.000 claims description 6
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 6
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 claims description 6
- 101150010310 WNT-4 gene Proteins 0.000 claims description 6
- 101150019524 WNT2 gene Proteins 0.000 claims description 6
- 102000052547 Wnt-1 Human genes 0.000 claims description 6
- 108700020987 Wnt-1 Proteins 0.000 claims description 6
- 102000052556 Wnt-2 Human genes 0.000 claims description 6
- 108700020986 Wnt-2 Proteins 0.000 claims description 6
- 102000052549 Wnt-3 Human genes 0.000 claims description 6
- 108700020985 Wnt-3 Proteins 0.000 claims description 6
- 102000052548 Wnt-4 Human genes 0.000 claims description 6
- 108700020984 Wnt-4 Proteins 0.000 claims description 6
- 102000044880 Wnt3A Human genes 0.000 claims description 6
- 108700013515 Wnt3A Proteins 0.000 claims description 6
- 101100485097 Xenopus laevis wnt11b gene Proteins 0.000 claims description 6
- 235000004279 alanine Nutrition 0.000 claims description 6
- 210000003477 cochlea Anatomy 0.000 claims description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 6
- 102100022766 R-spondin-3 Human genes 0.000 claims description 5
- 101710110310 R-spondin-3 Proteins 0.000 claims description 5
- 101000767160 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Intracellular protein transport protein USO1 Proteins 0.000 claims description 5
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 claims description 5
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical group [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims description 5
- 230000001476 alcoholic effect Effects 0.000 claims description 5
- 235000004400 serine Nutrition 0.000 claims description 5
- 208000007788 Acute Liver Failure Diseases 0.000 claims description 4
- 206010000804 Acute hepatic failure Diseases 0.000 claims description 4
- 208000022309 Alcoholic Liver disease Diseases 0.000 claims description 4
- 201000004384 Alopecia Diseases 0.000 claims description 4
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 claims description 4
- 208000010334 End Stage Liver Disease Diseases 0.000 claims description 4
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 claims description 4
- 206010067125 Liver injury Diseases 0.000 claims description 4
- 102000037054 SLC-Transporter Human genes 0.000 claims description 4
- 108091006207 SLC-Transporter Proteins 0.000 claims description 4
- 241000700605 Viruses Species 0.000 claims description 4
- 231100000836 acute liver failure Toxicity 0.000 claims description 4
- 235000009582 asparagine Nutrition 0.000 claims description 4
- 229960001230 asparagine Drugs 0.000 claims description 4
- 230000001684 chronic effect Effects 0.000 claims description 4
- 208000011444 chronic liver failure Diseases 0.000 claims description 4
- 208000019425 cirrhosis of liver Diseases 0.000 claims description 4
- 230000001419 dependent effect Effects 0.000 claims description 4
- 231100000753 hepatic injury Toxicity 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- 230000003612 virological effect Effects 0.000 claims description 4
- 230000029663 wound healing Effects 0.000 claims description 4
- 208000024827 Alzheimer disease Diseases 0.000 claims description 3
- 208000010392 Bone Fractures Diseases 0.000 claims description 3
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 3
- 206010011878 Deafness Diseases 0.000 claims description 3
- 208000008960 Diabetic foot Diseases 0.000 claims description 3
- 206010016654 Fibrosis Diseases 0.000 claims description 3
- 206010017076 Fracture Diseases 0.000 claims description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 claims description 3
- 208000001145 Metabolic Syndrome Diseases 0.000 claims description 3
- 208000001132 Osteoporosis Diseases 0.000 claims description 3
- 208000001164 Osteoporotic Fractures Diseases 0.000 claims description 3
- 206010033645 Pancreatitis Diseases 0.000 claims description 3
- 201000007737 Retinal degeneration Diseases 0.000 claims description 3
- 206010049416 Short-bowel syndrome Diseases 0.000 claims description 3
- 208000006011 Stroke Diseases 0.000 claims description 3
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 claims description 3
- 239000004473 Threonine Substances 0.000 claims description 3
- 208000030886 Traumatic Brain injury Diseases 0.000 claims description 3
- 208000036866 Vitreoretinopathy Diseases 0.000 claims description 3
- 241000282485 Vulpes vulpes Species 0.000 claims description 3
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 claims description 3
- 231100000360 alopecia Toxicity 0.000 claims description 3
- 208000020832 chronic kidney disease Diseases 0.000 claims description 3
- 230000007882 cirrhosis Effects 0.000 claims description 3
- 238000012258 culturing Methods 0.000 claims description 3
- 239000004053 dental implant Substances 0.000 claims description 3
- 206010012601 diabetes mellitus Diseases 0.000 claims description 3
- 230000004064 dysfunction Effects 0.000 claims description 3
- 201000007089 exocrine pancreatic insufficiency Diseases 0.000 claims description 3
- 230000002496 gastric effect Effects 0.000 claims description 3
- 230000012010 growth Effects 0.000 claims description 3
- 208000016354 hearing loss disease Diseases 0.000 claims description 3
- 208000017169 kidney disease Diseases 0.000 claims description 3
- 208000002780 macular degeneration Diseases 0.000 claims description 3
- 201000006417 multiple sclerosis Diseases 0.000 claims description 3
- 230000000399 orthopedic effect Effects 0.000 claims description 3
- 208000029985 osteonecrosis of the jaw Diseases 0.000 claims description 3
- 208000028169 periodontal disease Diseases 0.000 claims description 3
- 230000006785 proliferative vitreoretinopathy Effects 0.000 claims description 3
- 230000004258 retinal degeneration Effects 0.000 claims description 3
- 208000020431 spinal cord injury Diseases 0.000 claims description 3
- 208000003265 stomatitis Diseases 0.000 claims description 3
- 238000001356 surgical procedure Methods 0.000 claims description 3
- 235000008521 threonine Nutrition 0.000 claims description 3
- 230000009529 traumatic brain injury Effects 0.000 claims description 3
- 230000000840 anti-viral effect Effects 0.000 claims description 2
- 208000029078 coronary artery disease Diseases 0.000 claims description 2
- 239000003814 drug Substances 0.000 claims description 2
- 231100000888 hearing loss Toxicity 0.000 claims description 2
- 230000010370 hearing loss Effects 0.000 claims description 2
- 102000006461 Parathyroid Hormone Receptors Human genes 0.000 claims 9
- 229940079593 drug Drugs 0.000 claims 1
- 230000001568 sexual effect Effects 0.000 claims 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 109
- 102000040430 polynucleotide Human genes 0.000 description 100
- 108091033319 polynucleotide Proteins 0.000 description 100
- 239000002157 polynucleotide Substances 0.000 description 100
- 230000009471 action Effects 0.000 description 81
- 230000008685 targeting Effects 0.000 description 71
- 230000014509 gene expression Effects 0.000 description 57
- 230000000694 effects Effects 0.000 description 48
- 125000000539 amino acid group Chemical group 0.000 description 34
- 108020004414 DNA Proteins 0.000 description 29
- 108010032035 Desmoglein 3 Proteins 0.000 description 25
- 102000007577 Desmoglein 3 Human genes 0.000 description 25
- 230000035772 mutation Effects 0.000 description 25
- 102100032256 Parathyroid hormone/parathyroid hormone-related peptide receptor Human genes 0.000 description 23
- 239000005090 green fluorescent protein Substances 0.000 description 22
- 210000000056 organ Anatomy 0.000 description 22
- 102100026144 Transferrin receptor protein 1 Human genes 0.000 description 18
- 239000000427 antigen Substances 0.000 description 17
- 108091007433 antigens Proteins 0.000 description 17
- 102000036639 antigens Human genes 0.000 description 17
- 238000003556 assay Methods 0.000 description 17
- 101710181403 Frizzled Proteins 0.000 description 16
- 210000004185 liver Anatomy 0.000 description 16
- 239000013543 active substance Substances 0.000 description 15
- 150000001875 compounds Chemical class 0.000 description 15
- 239000003636 conditioned culture medium Substances 0.000 description 15
- 230000004048 modification Effects 0.000 description 15
- 238000012986 modification Methods 0.000 description 15
- 125000003729 nucleotide group Chemical group 0.000 description 15
- 230000001225 therapeutic effect Effects 0.000 description 15
- 239000013641 positive control Substances 0.000 description 13
- 210000000130 stem cell Anatomy 0.000 description 13
- 108091026890 Coding region Proteins 0.000 description 11
- 230000003247 decreasing effect Effects 0.000 description 11
- 150000003384 small molecules Chemical class 0.000 description 11
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 10
- 241001465754 Metazoa Species 0.000 description 10
- 239000002773 nucleotide Substances 0.000 description 10
- 108060001084 Luciferase Proteins 0.000 description 9
- 125000003275 alpha amino acid group Chemical group 0.000 description 9
- 150000001412 amines Chemical class 0.000 description 9
- 230000004071 biological effect Effects 0.000 description 9
- 239000013642 negative control Substances 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 230000001105 regulatory effect Effects 0.000 description 9
- 102000009027 Albumins Human genes 0.000 description 8
- 108010088751 Albumins Proteins 0.000 description 8
- 101000825954 Homo sapiens R-spondin-1 Proteins 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 230000003993 interaction Effects 0.000 description 8
- 102000014914 Carrier Proteins Human genes 0.000 description 7
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 7
- 108010045438 Frizzled receptors Proteins 0.000 description 7
- 102000005698 Frizzled receptors Human genes 0.000 description 7
- 239000005089 Luciferase Substances 0.000 description 7
- 239000002253 acid Substances 0.000 description 7
- 108091008324 binding proteins Proteins 0.000 description 7
- 102000050526 human RSPO1 Human genes 0.000 description 7
- 239000000546 pharmaceutical excipient Substances 0.000 description 7
- 230000002265 prevention Effects 0.000 description 7
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 108010047118 Wnt Receptors Proteins 0.000 description 6
- 208000027418 Wounds and injury Diseases 0.000 description 6
- 239000000969 carrier Substances 0.000 description 6
- 238000012217 deletion Methods 0.000 description 6
- 230000037430 deletion Effects 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 239000002777 nucleoside Substances 0.000 description 6
- 125000003835 nucleoside group Chemical group 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 229920001223 polyethylene glycol Polymers 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- 230000007781 signaling event Effects 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 238000001890 transfection Methods 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 5
- 101000864646 Homo sapiens Dickkopf-related protein 1 Proteins 0.000 description 5
- 101001061405 Homo sapiens Frizzled-9 Proteins 0.000 description 5
- 108091006905 Human Serum Albumin Proteins 0.000 description 5
- 102000008100 Human Serum Albumin Human genes 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- 206010028980 Neoplasm Diseases 0.000 description 5
- 229930185560 Pseudouridine Natural products 0.000 description 5
- PTJWIQPHWPFNBW-UHFFFAOYSA-N Pseudouridine C Natural products OC1C(O)C(CO)OC1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-UHFFFAOYSA-N 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- WGDUUQDYDIIBKT-UHFFFAOYSA-N beta-Pseudouridine Natural products OC1OC(CN2C=CC(=O)NC2=O)C(O)C1O WGDUUQDYDIIBKT-UHFFFAOYSA-N 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 210000004899 c-terminal region Anatomy 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 230000012202 endocytosis Effects 0.000 description 5
- 239000003623 enhancer Substances 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 208000014674 injury Diseases 0.000 description 5
- 238000003780 insertion Methods 0.000 description 5
- 230000037431 insertion Effects 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- PTJWIQPHWPFNBW-GBNDHIKLSA-N pseudouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-GBNDHIKLSA-N 0.000 description 5
- 210000002784 stomach Anatomy 0.000 description 5
- 235000000346 sugar Nutrition 0.000 description 5
- 238000013518 transcription Methods 0.000 description 5
- 230000035897 transcription Effects 0.000 description 5
- ZAYHVCMSTBRABG-UHFFFAOYSA-N 5-Methylcytidine Natural products O=C1N=C(N)C(C)=CN1C1C(O)C(O)C(CO)O1 ZAYHVCMSTBRABG-UHFFFAOYSA-N 0.000 description 4
- ZAYHVCMSTBRABG-JXOAFFINSA-N 5-methylcytidine Chemical compound O=C1N=C(N)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ZAYHVCMSTBRABG-JXOAFFINSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- 102100030074 Dickkopf-related protein 1 Human genes 0.000 description 4
- 102100030091 Dickkopf-related protein 2 Human genes 0.000 description 4
- 102100021259 Frizzled-1 Human genes 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 102000003886 Glycoproteins Human genes 0.000 description 4
- 108090000288 Glycoproteins Proteins 0.000 description 4
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 4
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 101000864647 Homo sapiens Dickkopf-related protein 2 Proteins 0.000 description 4
- 101000885581 Homo sapiens Frizzled-4 Proteins 0.000 description 4
- 101000825960 Homo sapiens R-spondin-3 Proteins 0.000 description 4
- 101000825962 Homo sapiens R-spondin-4 Proteins 0.000 description 4
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 4
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 4
- 102000007330 LDL Lipoproteins Human genes 0.000 description 4
- 108010007622 LDL Lipoproteins Proteins 0.000 description 4
- 241001529936 Murinae Species 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 101710110307 R-spondin-4 Proteins 0.000 description 4
- 102100022759 R-spondin-4 Human genes 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 239000011230 binding agent Substances 0.000 description 4
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 239000000539 dimer Substances 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- XKUKSGPZAADMRA-UHFFFAOYSA-N glycyl-glycyl-glycine Chemical compound NCC(=O)NCC(=O)NCC(O)=O XKUKSGPZAADMRA-UHFFFAOYSA-N 0.000 description 4
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 4
- 210000003494 hepatocyte Anatomy 0.000 description 4
- 102000054144 human RSPO3 Human genes 0.000 description 4
- 102000048108 human RSPO4 Human genes 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 210000003734 kidney Anatomy 0.000 description 4
- 210000004379 membrane Anatomy 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 244000005700 microbiome Species 0.000 description 4
- 150000003833 nucleoside derivatives Chemical class 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 230000009919 sequestration Effects 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 230000017423 tissue regeneration Effects 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- LLXVXPPXELIDGQ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(2,5-dioxopyrrol-1-yl)benzoate Chemical compound C=1C=CC(N2C(C=CC2=O)=O)=CC=1C(=O)ON1C(=O)CCC1=O LLXVXPPXELIDGQ-UHFFFAOYSA-N 0.000 description 3
- 102100027271 40S ribosomal protein SA Human genes 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 102000000905 Cadherin Human genes 0.000 description 3
- 108050007957 Cadherin Proteins 0.000 description 3
- 108010025905 Cystine-Knot Miniproteins Proteins 0.000 description 3
- 102100037986 Dickkopf-related protein 4 Human genes 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 102100028461 Frizzled-9 Human genes 0.000 description 3
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 3
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 3
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 3
- 108700020797 Parathyroid Hormone-Related Proteins 0.000 description 3
- 102000003982 Parathyroid hormone Human genes 0.000 description 3
- 108090000445 Parathyroid hormone Proteins 0.000 description 3
- 102000043299 Parathyroid hormone-related Human genes 0.000 description 3
- 108700008625 Reporter Genes Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 102000004338 Transferrin Human genes 0.000 description 3
- 108090000901 Transferrin Proteins 0.000 description 3
- 108091023045 Untranslated Region Proteins 0.000 description 3
- 102000006757 Wnt Receptors Human genes 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 239000003613 bile acid Substances 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 3
- 235000018417 cysteine Nutrition 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 208000037765 diseases and disorders Diseases 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 108010001064 glycyl-glycyl-glycyl-glycine Proteins 0.000 description 3
- 230000035876 healing Effects 0.000 description 3
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 3
- 230000013632 homeostatic process Effects 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 229920002521 macromolecule Polymers 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 239000000199 parathyroid hormone Substances 0.000 description 3
- 229960001319 parathyroid hormone Drugs 0.000 description 3
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 206010041823 squamous cell carcinoma Diseases 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 239000012581 transferrin Substances 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 102000005427 Asialoglycoprotein Receptor Human genes 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 206010052360 Colorectal adenocarcinoma Diseases 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 2
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 2
- 101710099550 Dickkopf-related protein 3 Proteins 0.000 description 2
- 102100037985 Dickkopf-related protein 3 Human genes 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 239000004214 Fast Green FCF Substances 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 102100039820 Frizzled-4 Human genes 0.000 description 2
- 101150013134 Fzd10 gene Proteins 0.000 description 2
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101000785944 Homo sapiens Asialoglycoprotein receptor 1 Proteins 0.000 description 2
- 101000951340 Homo sapiens Dickkopf-related protein 4 Proteins 0.000 description 2
- 101001061408 Homo sapiens Frizzled-8 Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 102100021711 Ileal sodium/bile acid cotransporter Human genes 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 102000003960 Ligases Human genes 0.000 description 2
- 108090000364 Ligases Proteins 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 102000011716 Matrix Metalloproteinase 14 Human genes 0.000 description 2
- 108010076557 Matrix Metalloproteinase 14 Proteins 0.000 description 2
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical group CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 108091006614 SLC10A2 Proteins 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 102100034201 Sclerostin Human genes 0.000 description 2
- 108050006698 Sclerostin Proteins 0.000 description 2
- 229910052770 Uranium Inorganic materials 0.000 description 2
- 206010052428 Wound Diseases 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical group OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 2
- 239000003443 antiviral agent Substances 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 108010006523 asialoglycoprotein receptor Proteins 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 238000012575 bio-layer interferometry Methods 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 150000001735 carboxylic acids Chemical class 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 239000002612 dispersion medium Substances 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 229930182830 galactose Natural products 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 102000051237 human ASGR1 Human genes 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- 108010028309 kalinin Proteins 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 244000144972 livestock Species 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 210000000963 osteoblast Anatomy 0.000 description 2
- 201000008129 pancreatic ductal adenocarcinoma Diseases 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 229920005862 polyol Polymers 0.000 description 2
- 150000003077 polyols Chemical class 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 230000018883 protein targeting Effects 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 2
- 238000010188 recombinant method Methods 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 239000002342 ribonucleoside Substances 0.000 description 2
- 238000007423 screening assay Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 125000006850 spacer group Chemical group 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 description 2
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- 230000000451 tissue damage Effects 0.000 description 2
- 231100000827 tissue damage Toxicity 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000003146 transient transfection Methods 0.000 description 2
- 108091005703 transmembrane proteins Proteins 0.000 description 2
- 102000035160 transmembrane proteins Human genes 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- BQWBEDSJTMWJAE-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-[(2-iodoacetyl)amino]benzoate Chemical compound C1=CC(NC(=O)CI)=CC=C1C(=O)ON1C(=O)CCC1=O BQWBEDSJTMWJAE-UHFFFAOYSA-N 0.000 description 1
- PMJWDPGOWBRILU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-[4-(2,5-dioxopyrrol-1-yl)phenyl]butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCC(C=C1)=CC=C1N1C(=O)C=CC1=O PMJWDPGOWBRILU-UHFFFAOYSA-N 0.000 description 1
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 1
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 1
- PHIQHXFUZVPYII-ZCFIWIBFSA-O (R)-carnitinium Chemical compound C[N+](C)(C)C[C@H](O)CC(O)=O PHIQHXFUZVPYII-ZCFIWIBFSA-O 0.000 description 1
- VZZPYUKWXDLMGI-UHFFFAOYSA-N 1,6-diisothiocyanatohexane Chemical compound S=C=NCCCCCCN=C=S VZZPYUKWXDLMGI-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- AASYSXRGODIQGY-UHFFFAOYSA-N 1-[1-(2,5-dioxopyrrol-1-yl)hexyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C(CCCCC)N1C(=O)C=CC1=O AASYSXRGODIQGY-UHFFFAOYSA-N 0.000 description 1
- IPJGAEWUPXWFPL-UHFFFAOYSA-N 1-[3-(2,5-dioxopyrrol-1-yl)phenyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C1=CC=CC(N2C(C=CC2=O)=O)=C1 IPJGAEWUPXWFPL-UHFFFAOYSA-N 0.000 description 1
- KHAWDEWNXJIVCJ-UHFFFAOYSA-N 1-fluoro-4-(4-fluoro-3-nitrophenyl)sulfonyl-2-nitrobenzene Chemical compound C1=C(F)C([N+](=O)[O-])=CC(S(=O)(=O)C=2C=C(C(F)=CC=2)[N+]([O-])=O)=C1 KHAWDEWNXJIVCJ-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 1
- RFVNOJDQRGSOEL-UHFFFAOYSA-N 2-hydroxyethyl octadecanoate Chemical class CCCCCCCCCCCCCCCCCC(=O)OCCO RFVNOJDQRGSOEL-UHFFFAOYSA-N 0.000 description 1
- RLFPCLMBTQOMLI-UHFFFAOYSA-N 2-iodo-n-[2-[(2-iodoacetyl)amino]ethyl]acetamide Chemical compound ICC(=O)NCCNC(=O)CI RLFPCLMBTQOMLI-UHFFFAOYSA-N 0.000 description 1
- LQILVUYCDHSGEU-UHFFFAOYSA-N 4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexane-1-carboxylic acid Chemical compound C1CC(C(=O)O)CCC1CN1C(=O)C=CC1=O LQILVUYCDHSGEU-UHFFFAOYSA-N 0.000 description 1
- NQXOUNOJWFMRLG-UHFFFAOYSA-N 4-[4-(2,5-dioxopyrrol-1-yl)phenyl]butanoic acid;pyrrolidine-2,5-dione Chemical compound O=C1CCC(=O)N1.C1=CC(CCCC(=O)O)=CC=C1N1C(=O)C=CC1=O NQXOUNOJWFMRLG-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- RGUKYNXWOWSRET-UHFFFAOYSA-N 4-pyrrolidin-1-ylpyridine Chemical compound C1CCCN1C1=CC=NC=C1 RGUKYNXWOWSRET-UHFFFAOYSA-N 0.000 description 1
- 239000013607 AAV vector Substances 0.000 description 1
- 101150087690 ACTB gene Proteins 0.000 description 1
- 101150096411 AXIN2 gene Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 241000024188 Andala Species 0.000 description 1
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 1
- 102100031936 Anterior gradient protein 2 homolog Human genes 0.000 description 1
- 241000269350 Anura Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 200000000007 Arterial disease Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 101100264044 Caenorhabditis elegans cwn-2 gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 102000005701 Calcium-Binding Proteins Human genes 0.000 description 1
- 108010045403 Calcium-Binding Proteins Proteins 0.000 description 1
- 102100033620 Calponin-1 Human genes 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 239000004380 Cholic acid Substances 0.000 description 1
- 102000003914 Cholinesterases Human genes 0.000 description 1
- 108090000322 Cholinesterases Proteins 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 101710099518 Dickkopf-related protein 1 Proteins 0.000 description 1
- 101710099523 Dickkopf-related protein 2 Proteins 0.000 description 1
- 101710099554 Dickkopf-related protein 4 Proteins 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 1
- UDSFAEKRVUSQDD-UHFFFAOYSA-N Dimethyl adipate Chemical compound COC(=O)CCCCC(=O)OC UDSFAEKRVUSQDD-UHFFFAOYSA-N 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 102100021261 Frizzled-10 Human genes 0.000 description 1
- 102100021265 Frizzled-2 Human genes 0.000 description 1
- 102100039818 Frizzled-5 Human genes 0.000 description 1
- 102100039799 Frizzled-6 Human genes 0.000 description 1
- 102100028466 Frizzled-8 Human genes 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010043685 GPI-Linked Proteins Proteins 0.000 description 1
- 102000002702 GPI-Linked Proteins Human genes 0.000 description 1
- 108010001517 Galectin 3 Proteins 0.000 description 1
- 102100039558 Galectin-3 Human genes 0.000 description 1
- 101000650147 Gallus gallus Protein Wnt-9a Proteins 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 208000018565 Hemochromatosis Diseases 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 239000005057 Hexamethylene diisocyanate Substances 0.000 description 1
- 101000775021 Homo sapiens Anterior gradient protein 2 homolog Proteins 0.000 description 1
- 101000945318 Homo sapiens Calponin-1 Proteins 0.000 description 1
- 101000924311 Homo sapiens Desmoglein-3 Proteins 0.000 description 1
- 101000802406 Homo sapiens E3 ubiquitin-protein ligase ZNRF3 Proteins 0.000 description 1
- 101000819438 Homo sapiens Frizzled-1 Proteins 0.000 description 1
- 101000819451 Homo sapiens Frizzled-10 Proteins 0.000 description 1
- 101000819477 Homo sapiens Frizzled-2 Proteins 0.000 description 1
- 101000819458 Homo sapiens Frizzled-3 Proteins 0.000 description 1
- 101000885585 Homo sapiens Frizzled-5 Proteins 0.000 description 1
- 101000885673 Homo sapiens Frizzled-6 Proteins 0.000 description 1
- 101000885797 Homo sapiens Frizzled-7 Proteins 0.000 description 1
- 101001063456 Homo sapiens Leucine-rich repeat-containing G-protein coupled receptor 5 Proteins 0.000 description 1
- 101000979761 Homo sapiens Norrin Proteins 0.000 description 1
- 101001135770 Homo sapiens Parathyroid hormone Proteins 0.000 description 1
- 101001135995 Homo sapiens Probable peptidyl-tRNA hydrolase Proteins 0.000 description 1
- 101100091155 Homo sapiens RNF43 gene Proteins 0.000 description 1
- 101000652736 Homo sapiens Transgelin Proteins 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108010030506 Integrin alpha6beta4 Proteins 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 101150086425 LYPD3 gene Proteins 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 102100031036 Leucine-rich repeat-containing G-protein coupled receptor 5 Human genes 0.000 description 1
- 101710172064 Low-density lipoprotein receptor-related protein Proteins 0.000 description 1
- 101710108696 Ly6/PLAUR domain-containing protein 3 Proteins 0.000 description 1
- NPBGTPKLVJEOBE-IUCAKERBSA-N Lys-Arg Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(O)=O)CCCNC(N)=N NPBGTPKLVJEOBE-IUCAKERBSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 206010028116 Mucosal inflammation Diseases 0.000 description 1
- 201000010927 Mucositis Diseases 0.000 description 1
- 108010072610 N-acetyl-gamma-glutamyl-phosphate reductase Proteins 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- FABQUVYDAXWUQP-UHFFFAOYSA-N N4-(1,3-benzodioxol-5-ylmethyl)-6-(3-methoxyphenyl)pyrimidine-2,4-diamine Chemical compound COC1=CC=CC(C=2N=C(N)N=C(NCC=3C=C4OCOC4=CC=3)C=2)=C1 FABQUVYDAXWUQP-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102100036893 Parathyroid hormone Human genes 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 238000001190 Q-PCR Methods 0.000 description 1
- 230000006819 RNA synthesis Effects 0.000 description 1
- 230000004570 RNA-binding Effects 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 108091006216 SLC10 Proteins 0.000 description 1
- 239000002262 Schiff base Substances 0.000 description 1
- 150000004753 Schiff bases Chemical class 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 102100021988 Sodium/bile acid cotransporter Human genes 0.000 description 1
- 102100036428 Spondin-1 Human genes 0.000 description 1
- 101710092167 Spondin-1 Proteins 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- WBWWGRHZICKQGZ-UHFFFAOYSA-N Taurocholic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(=O)NCCS(O)(=O)=O)C)C1(C)C(O)C2 WBWWGRHZICKQGZ-UHFFFAOYSA-N 0.000 description 1
- 241000255588 Tephritidae Species 0.000 description 1
- 108010033576 Transferrin Receptors Proteins 0.000 description 1
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 230000004156 Wnt signaling pathway Effects 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- 101150041027 ZNRF3 gene Proteins 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 238000004630 atomic force microscopy Methods 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- NXVYSVARUKNFNF-UHFFFAOYSA-N bis(2,5-dioxopyrrolidin-1-yl) 2,3-dihydroxybutanedioate Chemical compound O=C1CCC(=O)N1OC(=O)C(O)C(O)C(=O)ON1C(=O)CCC1=O NXVYSVARUKNFNF-UHFFFAOYSA-N 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- 230000008468 bone growth Effects 0.000 description 1
- HBIRLMFCDJACGA-UHFFFAOYSA-M bromo(tripyrrolidin-1-yl)phosphanium;bromide Chemical compound [Br-].C1CCCN1[P+](N1CCCC1)(Br)N1CCCC1 HBIRLMFCDJACGA-UHFFFAOYSA-M 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 235000013877 carbamide Nutrition 0.000 description 1
- 229960004203 carnitine Drugs 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000009087 cell motility Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000017455 cell-cell adhesion Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 235000019416 cholic acid Nutrition 0.000 description 1
- 229960002471 cholic acid Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000001010 compromised effect Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 239000000039 congener Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 231100000895 deafness Toxicity 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 210000001047 desmosome Anatomy 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- ZLFRJHOBQVVTOJ-UHFFFAOYSA-N dimethyl hexanediimidate Chemical compound COC(=N)CCCCC(=N)OC ZLFRJHOBQVVTOJ-UHFFFAOYSA-N 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000005014 ectopic expression Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 230000010235 enterohepatic circulation Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- FBPFZTCFMRRESA-GUCUJZIJSA-N galactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-GUCUJZIJSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 208000024963 hair loss Diseases 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- RRAMGCGOFNQTLD-UHFFFAOYSA-N hexamethylene diisocyanate Chemical compound O=C=NCCCCCCN=C=O RRAMGCGOFNQTLD-UHFFFAOYSA-N 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 102000050762 human DKK1 Human genes 0.000 description 1
- 102000048882 human DKK2 Human genes 0.000 description 1
- 102000047598 human DSG3 Human genes 0.000 description 1
- 102000052343 human FZD4 Human genes 0.000 description 1
- 102000050476 human LYPD3 Human genes 0.000 description 1
- 102000055524 human NDP Human genes 0.000 description 1
- 102000052014 human TFR2 Human genes 0.000 description 1
- 102000047156 human ZNRF3 Human genes 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- 208000036971 interstitial lung disease 2 Diseases 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 108010057670 laminin 1 Proteins 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 230000029226 lipidation Effects 0.000 description 1
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 1
- 230000006674 lysosomal degradation Effects 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 108091070501 miRNA Proteins 0.000 description 1
- 239000002679 microRNA Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 238000013048 microbiological method Methods 0.000 description 1
- 230000001617 migratory effect Effects 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 230000004001 molecular interaction Effects 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- UYDLBVPAAFVANX-UHFFFAOYSA-N octylphenoxy polyethoxyethanol Chemical class CC(C)(C)CC(C)(C)C1=CC=C(OCCOCCOCCOCCO)C=C1 UYDLBVPAAFVANX-UHFFFAOYSA-N 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 150000002482 oligosaccharides Polymers 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 125000001151 peptidyl group Chemical group 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000004713 phosphodiesters Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 108010087782 poly(glycyl-alanyl) Proteins 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 108010054442 polyalanine Proteins 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 108010094020 polyglycine Proteins 0.000 description 1
- 229920000232 polyglycine polymer Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 108010000222 polyserine Proteins 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 229940071643 prefilled syringe Drugs 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 235000013930 proline Nutrition 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical compound CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 description 1
- 229940080818 propionamide Drugs 0.000 description 1
- 238000002818 protein evolution Methods 0.000 description 1
- 230000005892 protein maturation Effects 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000007420 reactivation Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000001718 repressive effect Effects 0.000 description 1
- 230000008458 response to injury Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 102000035087 single-pass transmembrane proteins Human genes 0.000 description 1
- 108091005496 single-pass transmembrane proteins Proteins 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- TYFQFVWCELRYAO-UHFFFAOYSA-L suberate(2-) Chemical compound [O-]C(=O)CCCCCCC([O-])=O TYFQFVWCELRYAO-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical class ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- WBWWGRHZICKQGZ-GIHLXUJPSA-N taurocholic acid Chemical compound C([C@@H]1C[C@H]2O)[C@@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@@H]([C@@H](CCC(=O)NCCS(O)(=O)=O)C)[C@@]2(C)[C@H](O)C1 WBWWGRHZICKQGZ-GIHLXUJPSA-N 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 150000003585 thioureas Chemical class 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000759 toxicological effect Toxicity 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 108091007466 transmembrane glycoproteins Proteins 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 229950008718 vantictumab Drugs 0.000 description 1
- 210000005167 vascular cell Anatomy 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 239000002676 xenobiotic agent Substances 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/65—Peptidic linkers, binders or spacers, e.g. peptidic enzyme-labile linkers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2851—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the lectin superfamily, e.g. CD23, CD72
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2881—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD71
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/40—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1025—Acyltransferases (2.3)
- C12N9/104—Aminoacyltransferases (2.3.2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y203/00—Acyltransferases (2.3)
- C12Y203/02—Aminoacyltransferases (2.3.2)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- Wood Science & Technology (AREA)
- Physical Education & Sports Medicine (AREA)
- General Engineering & Computer Science (AREA)
- Rheumatology (AREA)
- Diabetes (AREA)
- Biotechnology (AREA)
- Toxicology (AREA)
- Neurosurgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurology (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
Description
本出願は、2017年1月26日に出願された米国仮特許出願第62/450,804号、および2017年4月19日に出願された米国仮特許出願第62/487,135号の優先権を主張し、その各々は、その全体が参照により本明細書に組み込まれる。
配列表に関する記載
本出願に関連する配列表は、紙のコピーの代わりにテキストフォーマットで提供され、参照により本明細書に組み込まれる。配列表を含むテキストファイルの名前は、SRZN_003_02WO_ST25.txtである。テキストファイルは454KBで、2018年1月26日に作成され、EFS-Webを介して電子的に送信されている。
本発明は、例えば、以下の項目を提供する。
(項目1)
組織特異的Wnt(「ウィングレス関連統合部位」または「ウィングレスおよびInt-1」または「ウィングレス-Int」)シグナル増強分子、またはその薬学的に許容される塩であって、ジンクリングフィンガー3(ZNRF3)およびリングフィンガータンパク質43(RNF43)から選択される1つ以上の膜貫通型E3ユビキチンリガーゼに特異的に結合する第1のドメインと、組織特異的細胞表面分子に特異的に結合する第2のドメインとを含み、前記化合物が、前記組織特異的細胞表面分子を含む前記組織においてWntシグナル伝達を増加させる、組織特異的Wntシグナル増強分子、またはその薬学的に許容される塩。
(項目2)
前記組織が、骨組織、肝臓組織、皮膚組織、胃組織、腸管組織、口腔粘膜組織、腎臓組織、中枢神経系組織、乳腺組織、味蕾組織、卵巣組織、内耳組織(蝸牛および前庭組織を含む)、毛包、膵臓組織、網膜組織、角膜組織、心臓組織および肺組織からなる群から選択される、項目1に記載の分子。
(項目3)
前記第1のドメインが、第1のポリペプチド配列を含み、かつ/または前記第2のドメインが、第2のポリペプチド配列を含む、項目1または項目2に記載の分子。
(項目4)
前記化合物が、前記第1のポリペプチド配列および前記第2のポリペプチド配列を含む融合タンパク質または抗体である、項目3に記載の分子。
(項目5)
前記第1のポリペプチド配列が、
a)R-スポンジンポリペプチド配列であって、前記R-スポンジンが、場合により、R-スポンジン-1、R-スポンジン-2、R-スポンジン-3、またはR-スポンジン-4である、R-スポンジンポリペプチド配列またはその断片もしくはバリアント、あるいは
b)R-スポンジンフリンドメイン1配列および、場合により、野生型もしくは変異型フリンドメイン2またはそれらの断片もしくはバリアントを含み、前記第1のポリペプチド配列は、場合により、全長R-スポンジンと比較してロイシンリッチリピート含有Gタンパク質共役受容体4~6(LGR4~6)への結合が減少している、項目3または項目4に記載の分子。
(項目6)
前記R-スポンジンフリンドメイン1が、配列番号1~4に存在するフリン1ドメインのうちのいずれかと少なくとも90%の同一性を有する、項目5に記載の分子。
(項目7)
前記第2のポリペプチド配列が、ペプチド、ポリペプチド、抗体もしくはその断片、あるいはリガンドまたはその断片もしくはバリアントである、項目3~6のいずれかに記載の分子。
(項目8)
a)前記組織が、骨組織であり、前記細胞表面分子が、副甲状腺ホルモン受容体1(PTH1R)であるか、
b)前記組織が、肝臓組織であり、前記細胞表面分子が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)もしくは溶質キャリアファミリー10メンバー1(SLC10A1)であるか、または
c)前記組織が、口腔粘膜であり、前記細胞表面分子が、Ly6/PLAURドメイン含有3(LYPD3)もしくはデスモグレイン(DSG3)である、項目1~7のいずれか一項に記載の分子。
(項目9)
a)前記細胞表面分子が、副甲状腺ホルモン受容体1(PTH1R)であり、前記第2のポリペプチド配列が、PTH1Rに特異的に結合するか、
b)前記細胞表面分子が、アシアロ糖タンパク質受容体1(ASGR1)であり、前記第2のポリペプチド配列が、ASGR1に特異的に結合するか、
c)前記細胞表面分子が、アシアロ糖タンパク質受容体2(ASGR2)であり、前記第2のポリペプチド配列が、ASGR2に特異的に結合するか、
d)前記細胞表面分子が、溶質キャリアファミリー10メンバー1(SLC10A1)であり、前記第2のポリペプチド配列が、溶質キャリアファミリー10メンバー1(SLC10A1)に特異的に結合するか、
e)前記細胞表面分子が、トランスフェリン受容体2(TFR2)であり、前記第2のポリペプチド配列が、TFR2に特異的に結合するか、
f)前記細胞表面分子が、Ly6/PLAURドメイン含有3(LYPD3)であり、前記第2のポリペプチド配列が、LYPD3に特異的に結合するか、または
g)前記細胞表面分子が、デスモグレイン(DSG3)であり、前記第2のポリペプチド配列が、DSG3に特異的に結合し、
前記第2のポリペプチドが、抗体もしくはその断片または抗体とは異なるペプチドもしくはポリペプチド、低分子、あるいは前記細胞表面分子のリガンドまたはその断片もしくはバリアントである、項目3~8のいずれかに記載の分子。
(項目10)
前記第1のドメインおよび前記第2のドメインが、リンカー部分によって結合している、項目1~9のいずれかに記載の分子。
(項目11)
前記リンカー部分が、ペプチジルリンカー配列である、項目10に記載の分子。
(項目12)
前記リンカー配列が、グリシン、アスパラギン、セリン、トレオニンおよびアラニンからなる群から選択される1つ以上のアミノ酸を含む、項目11に記載の分子。
(項目13)
項目4~12のいずれかに記載の融合タンパク質をコードする核酸配列。
(項目14)
前記核酸配列が、DNAまたはmRNAである、項目13に記載の核酸配列。
(項目15)
項目13に記載の核酸配列を含むベクター。
(項目16)
前記ベクターが、前記核酸配列に機能的に連結されたプロモーター配列を含む発現ベクターである、項目15に記載のベクター。
(項目17)
前記ベクターが、前記核酸配列に機能的に連結されたプロモーター配列を含むウイルスである、項目15に記載のベクター。
(項目18)
項目16に記載のベクターを含む宿主細胞。
(項目19)
項目4~12のいずれかに記載の融合ポリペプチドを生成するための方法であって、前記融合ポリペプチドが前記発現ベクターによって発現される条件下で項目18に記載の宿主細胞を培養することを含む、方法。
(項目20)
生成された前記融合ポリペプチドを単離する工程をさらに含む、項目19に記載の方法。
(項目21)
(i)有効量の、項目1~12のいずれかに記載の分子、項目13~14のいずれかに記載の核酸配列、項目15~17のいずれかに記載のベクター、または項目18に記載の宿主細胞と、
(ii)薬学的に許容される希釈剤、アジュバントまたは担体と、を含む、薬学的組成物。
(項目22)
有効量の項目1~12のいずれかに記載の分子と、有効量のWntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子とを含む、項目21に記載の薬学的組成物。
(項目23)
有効量の項目13~14のいずれかに記載の核酸配列と、Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする有効量の核酸配列とを含み、前記Wntポリペプチド、前記ノリンポリペプチド、または前記Wntシグナル伝達アゴニスト分子をコードする前記核酸配列が、場合によりDNAまたはmRNAである、項目21に記載の薬学的組成物。
(項目24)
項目13~14のいずれかに記載の核酸配列および/または前記Wntポリペプチド、前記ノリンポリペプチド、もしくは前記Wntシグナル伝達アゴニスト分子をコードする前記核酸配列が、修飾mRNAである、項目23に記載の薬学的組成物。
(項目25)
有効量の項目15~17のいずれかに記載のベクターと、Wntポリペプチド、ポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする核酸配列を含む有効量のベクターとを含み、ノリン前記Wntポリペプチド、前記ノリンポリペプチド、または前記Wntシグナル伝達アゴニスト分子をコードする前記核酸配列を含む前記ベクターが、場合により発現ベクターである、項目22に記載の薬学的組成物。
(項目26)
(i)Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする有効量の核酸と、
(ii)薬学的に許容される希釈剤、アジュバントまたは担体と、を含む、薬学的組成物。
(項目27)
前記核酸が、DNAまたはmRNA、場合により修飾mRNAである、項目26に記載の薬学的組成物。
(項目28)
前記核酸が、発現ベクター、場合によりウイルスベクター中に存在する、項目26に記載の薬学的組成物。
(項目29)
前記Wntポリペプチドが、Wnt1、Wnt2、Wnt2B、Wnt3、Wnt3A、Wnt4、Wnt5A、Wnt5B、Wnt6、Wnt7A、Wnt7B、Wnt8A、Wnt8B、Wnt9A、Wnt9B、Ant10A、Wnt10B、Wnt11、およびWnt16、ならびにこれらのうちのいずれかの機能的バリアントおよび断片から選択される哺乳動物Wntポリペプチドである、項目22~28のいずれかに記載の薬学的組成物。
(項目30)
前記ノリンポリペプチドが、哺乳動物ノリンポリペプチドまたはその機能的バリアントもしくは断片である、項目22~28のいずれかに記載の薬学的組成物。
(項目31)
前記Wntシグナル伝達アゴニスト分子が、フリズルド(Fzd)受容体をLrp5/6と二量体化させる水溶性Wntシグナル伝達アゴニストである、項目22~28のいずれかに記載の薬学的組成物。
(項目32)
前記Wntシグナル伝達アゴニスト分子が、ポリペプチドを含む、項目31に記載の薬学的組成物。
(項目33)
前記ポリペプチドが、1つ以上のFzdタンパク質に対して高い親和性を有する結合ドメインと、Lrp5/Lrp6タンパク質に対して高い親和性を有する結合ドメインとを含み、前記結合ドメインが、場合により、直接結合しているか、またはリンカーにより結合している、項目32に記載の薬学的組成物。
(項目34)
標的組織においてWnt(「ウィングレス関連統合部位」または「ウィングレスおよびInt-1」または「ウィングレス-Int」)シグナル伝達を増加させるための方法であって、前記標的組織を、
a)項目1~12のいずれかに記載の分子、項目13~14のいずれかに記載の核酸、項目15~17のいずれかに記載のベクター、または項目18に記載の宿主細胞であって、前記第2のドメインが前記標的組織上の細胞特異的表面分子に特異的に結合し、項目1~12のいずれか一項に記載の分子が前記標的組織に結合して、前記標的組織におけるジンクリングフィンガー3(ZNRF3)およびリングフィンガータンパク質43(RNF43)から選択される1つ以上の膜貫通型E3ユビキチンリガーゼを隔離またはそのエンドサイトーシスを増加させるもの、および/または
b)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子;Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸配列;Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸配列を含むベクター;またはWntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸配列を含む発現ベクターを含む宿主細胞であって、前記Wntポリペプチド、前記ノリンポリペプチド、または前記Wntシグナル伝達アゴニスト分子をコードする前記核酸配列が、場合によりDNAまたはmRNA、場合により修飾mRNAであるもの、と接触させることを含む、方法。
(項目35)
前記標的組織を項目1~12のいずれかに記載の分子と接触させることを含む、項目34に記載の方法。
(項目36)
前記標的組織を項目13~14のいずれかに記載の核酸と接触させることを含む、項目34に記載の方法。
(項目37)
前記標的組織を項目15~17のいずれかに記載のベクターと接触させることを含む、項目34に記載の方法。
(項目38)
前記標的組織を、前記Wntポリペプチド、前記ノリンポリペプチド、または前記Wntシグナル伝達アゴニスト分子をコードする前記核酸配列と接触させることを含む、項目34に記載の方法。
(項目39)
a)前記組織が、骨組織であり、前記細胞表面分子が、副甲状腺ホルモン受容体1(PTH1R)であるか、
b)前記組織が、肝臓組織であり、前記細胞表面分子が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)、もしくは溶質キャリアファミリー10メンバー1(SLC10A1)であるか、または
c)前記組織が、口腔粘膜組織であり、前記細胞表面分子が、Ly6/PLAURドメイン含有3(LYPD3)もしくはデスモグレイン(DSG3)である、項目34~39のいずれかに記載の方法。
(項目40)
疾患または状態の治療または予防を必要とする対象においてそれを行うための方法であって、前記疾患または障害が、Wnt(「ウィングレス関連統合部位」または「ウィングレスおよびInt-1」または「ウィングレス-Int」)シグナル伝達の減少と関連しているか、またはWntシグナル伝達の増加による恩恵を受けるであろうものであり、有効量の項目21~33のいずれかに記載の薬学的組成物を前記対象に提供することを含む、方法。
(項目41)
薬学的に許容される希釈剤、アジュバントまたは担体と、有効量の、
(a)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子、
(b)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸配列であって、場合によりDNAもしくはmRNAである、前記Wntポリペプチド、前記ノリンポリペプチド、もしくは前記Wntシグナル伝達アゴニスト分子をコードする核酸配列、
(c)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸配列を含むベクターであって、場合により発現ベクターである、前記Wntポリペプチド、前記ノリンポリペプチド、もしくは前記Wntシグナル伝達アゴニスト分子をコードする前記核酸配列を含むベクター、または
(d)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸を含む発現ベクターを含む宿主細胞と、を含む薬学的組成物を前記対象に提供することをさらに含む、項目40に記載の方法。
(項目42)
有効量の項目1~12のいずれかに記載の分子を含む薬学的組成物と、有効量のWntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子を含む薬学的組成物とを前記対象に提供することを含む、項目41に記載の方法。
(項目43)
有効量の項目13~14のいずれかに記載の核酸配列を含む薬学的組成物と、Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする有効量の核酸配列を含む薬学的組成物とを前記対象に提供することを含み、前記核酸配列のうちの一方または両方が、場合によりDNAまたはmRNA、場合により修飾mRNAである、項目41に記載の方法。
(項目44)
有効量の項目15~17のいずれかに記載のベクターを含む薬学的組成物と、Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする核酸配列を含む有効量のベクターを含む薬学的組成物とを前記対象に提供することを含み、前記ベクターのうちの一方または両方が、場合により発現ベクターまたはウイルスベクターである、項目41に記載の方法。
(項目45)
疾患または状態の治療または予防を必要とする対象においてそれを行うための方法であって、前記疾患または障害が、Wnt(「ウィングレス関連統合部位」または「ウィングレスおよびInt-1」または「ウィングレス-Int」)シグナル伝達の減少と関連しているか、またはWntシグナル伝達の増加による恩恵を受けるであろうものであり、薬学的に許容される希釈剤、アジュバントまたは担体と、有効量の、
a)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸配列であって、場合によりDNAもしくはmRNA、場合により修飾mRNAである、前記Wntポリペプチド、前記ノリンポリペプチド、もしくは前記Wntシグナル伝達アゴニスト分子をコードする核酸配列、
b)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸配列を含むベクターであって、場合により発現ベクターである、前記Wntポリペプチド、前記ノリンポリペプチド、もしくは前記Wntシグナル伝達アゴニスト分子をコードする前記核酸配列を含むベクター、または
c)Wntポリペプチド、ノリンポリペプチド、もしくはWntシグナル伝達アゴニスト分子をコードする核酸を含む発現ベクターを含む宿主細胞と、を含む薬学的組成物を前記対象に提供することを含む、方法。
(項目46)
前記Wntポリペプチドが、Wnt1、Wnt2、Wnt2B、Wnt3、Wnt3A、Wnt4、Wnt5A、Wnt5B、Wnt6、Wnt7A、Wnt7B、Wnt8A、Wnt8B、Wnt9A、Wnt9B、Ant10A、Wnt10B、Wnt11、およびWnt16、ならびにこれらのうちのいずれかの機能的バリアントおよび断片から選択される哺乳動物Wntポリペプチドである、項目41~45のいずれかに記載の方法。
(項目47)
前記ノリンポリペプチドが、哺乳動物ノリンポリペプチドまたはその機能的バリアントもしくは断片である、項目41~45のいずれかに記載の方法。
(項目48)
前記Wntシグナル伝達アゴニスト分子が、フリズルド(Fzd)受容体をLrp5/6と二量体化させる水溶性Wntシグナル伝達アゴニストである、項目41~45のいずれかに記載の方法。
(項目49)
前記Wntシグナル伝達アゴニスト分子が、ポリペプチドを含む、項目41に記載の方法。
(項目50)
前記ポリペプチドが、1つ以上のFzdタンパク質に対して高い親和性を有する結合ドメインと、Lrp5/Lrp6タンパク質に対して高い親和性を有する結合ドメインとを含み、前記結合ドメインが、場合により、直接結合しているか、またはリンカーにより結合している、項目42に記載の方法。
(項目51)
前記疾患または障害が、骨組織、肝臓組織、皮膚組織、胃組織、腸管組織、口腔粘膜組織、腎臓組織、中枢神経系組織、乳腺組織、味蕾組織、卵巣組織、内耳組織(蝸牛および前庭組織を含む)、毛包、膵臓組織、網膜組織、角膜組織、心臓組織および肺組織からなる群から選択される組織の疾患または障害である、項目40~50のいずれかに記載の方法。
(項目52)
前記疾患または障害が、
a)骨組織の疾患または障害であり、細胞表面受容体が、副甲状腺ホルモン受容体1(PTH1R)であるか、
b)肝臓組織の疾患または障害であり、細胞表面受容体が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)、もしくは溶質キャリアファミリー10メンバー1(SLC10A1)であるか、あるいは
c)口腔粘膜組織の疾患または障害であり、細胞表面受容体が、Ly6/PLAURドメイン含有3(LYPD3)またはデスモグレイン(DSG3)である、項目51に記載の方法。
(項目53)
前記疾患または状態が、骨折、骨粗鬆症、骨粗鬆症性骨折、脊椎固定術、整形外科用装置の骨結合、腱と骨の統合、歯の成長と再生、歯科インプラント術、歯周病、顎顔面再建、顎骨壊死、脱毛症、難聴、前庭機能低下、黄斑変性、硝子体網膜症、網膜変性症、フックスジストロフィー、脳卒中、外傷性脳損傷、アルツハイマー病、多発性硬化症、脊髄損傷、口腔粘膜炎、短腸症候群、炎症性腸疾患(IBD)、メタボリックシンドローム、糖尿病、膵炎、外分泌膵機能不全、創傷治癒、糖尿病性足部潰瘍、冠状動脈疾患、急性腎臓病、慢性腎臓病、慢性閉塞性肺疾患(COPD)、急性肝不全、急性アルコール性肝障害、C型肝炎ウイルス(HCV)による慢性肝疾患、HCV患者の抗ウイルス薬治療後、B型肝炎ウイルス(HBV)による慢性肝疾患、HBV患者の抗ウイルス薬治療後、慢性アルコール性肝疾患、非アルコール性脂肪性肝疾患および非アルコール性脂肪性肝炎(NASH)、肝硬変、ならびにあらゆる原因による慢性肝不全からなる群から選択される、項目40~50のいずれかに記載の方法。
(項目54)
前記薬学的組成物が、非経口的に、経口的に、筋肉内に、局所的に、または局部的に提供される、項目40~53のいずれかに記載の方法。
(項目55)
前記対象が、哺乳動物、場合によりヒトである、項目40~54のいずれか一項に記載の方法。
本明細書で使用される「ベクター」は、ポリヌクレオチドを含むかまたはそれと会合し、細胞へのポリヌクレオチドの送達を媒介するために使用することができる巨大分子または巨大分子の会合を指す。例示的なベクターには、例えば、プラスミド、ウイルスベクター、リポソーム、および他の遺伝子送達媒体が含まれる。
特定の態様では、本開示は、組織特異的または細胞特異的様式でWnt活性を増強することができる新規の組織特異的Wntシグナル増強分子を提供する。特定の実施形態では、組織特異的Wntシグナル増強分子は、1つ以上のZNRF3および/またはRNF43リガーゼに結合する第1のドメインと、1つ以上の標的組織または細胞型に組織特異的または細胞特異的様式で結合する第2のドメインと、を含む二機能性分子である。第1のドメインおよび第2のドメインはそれぞれ、リガーゼ複合体または標的組織もしくは細胞にそれぞれ結合することができる任意の部分であり得る。例えば、第1のドメインおよび第2のドメインのそれぞれは、限定されないが、ポリペプチド(例えば、抗体もしくはその抗原結合断片、または抗体とは異なるペプチドもしくはポリペプチド)、低分子、および天然のリガンドまたはそのバリアント、断片もしくは誘導体から選択される部分であり得る。特定の実施形態では、天然リガンドは、ポリペプチド、小分子、イオン、アミノ酸、脂質、または糖分子である。第1のドメインおよび第2のドメインは、互いに同じ種類の部分であってもよく、または異なる種類の部分であってもよい。特定の実施形態では、組織特異的Wntシグナル増強分子は、組織特異的または細胞特異的な細胞表面受容体に結合する。特定の実施形態では、組織特異的Wntシグナル増強分子は、例えば、ネガティブコントロールと比較して、Wntシグナル伝達を、少なくとも50%、少なくとも2倍、少なくとも3倍、少なくとも5倍、少なくとも10倍、少なくとも20倍、少なくとも30倍、少なくとも40倍、または少なくとも50倍増加または増強させる。
RスポンジンはWntシグナルを増幅することができる。R-スポンジンの最小機能単位は、2つのフリンドメイン、ZNRF3/RNF43E3リガーゼに結合するフリンドメイン1、およびR-スポンジン、LGR、およびE3リガーゼの三元複合体をまとめる、LGR4~6に結合するフリンドメイン2から構成される。これは、複合体全体の内在化をもたらし、かつZNRF3/RNF43をこれらの破壊の標的から離して除去する。フリンドメイン1単独では機能的ではないが、それはZNRF3およびRNF43の両方に結合することができる(図1参照)。
特定の細胞型および特定の組織内の細胞は、細胞表面受容体などの1つ以上の細胞または組織特異的表面分子を含み得る(図2参照)。本明細書で使用される場合、1つ以上の他の細胞もしくは組織型、または任意の他の細胞もしくは組織型と比較して、より多くの分子が特定の細胞または組織型に存在する場合、分子は、細胞または組織特異的であると言われる。特定の実施形態では、より多い量は、1つ以上の他の細胞もしくは組織型、または任意の他の細胞もしくは組織型における量と比較して、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも20倍、少なくとも50倍、または少なくとも100倍である。特定の実施形態では、細胞特異的表面分子は、標的器官、組織または細胞型、例えば、1つ以上の他の非標的器官、組織または細胞型と比較したときに例えば、疾患または障害を治療または予防するためにWntシグナル伝達を増強することが望ましい器官、組織または細胞型で発現が増加または増強している。特定の実施形態では、細胞特異的表面分子は、それぞれ1つ以上の他の器官、組織または細胞型と比較して、標的器官、組織または細胞型の表面に優先的に発現される。例えば、特定の実施形態では、細胞表面受容体は、それが1つ以上、5つ以上、他の全ての器官、組織もしくは細胞、またはそれぞれ他の全ての器官、組織もしくは細胞の平均で発現されるよりも、標的器官、組織または細胞において、少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも20倍、少なくとも30倍、少なくとも40倍、少なくとも50倍、少なくとも100倍、少なくとも500倍、または少なくとも1000倍高いレベルで発現されている場合、組織特異的または細胞特異的細胞表面分子であると見なされる。特定の実施形態では、組織特異的または細胞特異的細胞表面分子は、細胞表面受容体、例えば、細胞表面膜内に位置する領域と標的ドメインが結合することができる細胞外領域とを含むポリペプチド受容体である。様々な実施形態では、本明細書に記載の方法は、標的組織または標的組織を含む組織のサブセット上でのみ発現される細胞表面分子を特異的に標的化することによって、または全ての、ほとんどの、またはかなりの数の他の組織と比較した場合に標的組織上でより高いレベルの発現を有する、例えば、少なくとも2、少なくとも5、少なくとも10、または少なくとも20の他の組織よりも標的組織における発現がより高い細胞表面分子を特異的に標的化することによって実施され得る。
特定の実施形態では、標的ドメインおよび作用ドメインは互いに直接結合または融合しているが、他の実施形態では、それらはリンカー、例えばポリペプチドリンカー、または非ペプチジルリンカーなどで隔てられている。例えば、リンカーはFcリンカー、例えば、例えば1つ以上のジスルフィド結合を介して他のFcリンカーと二量体化することができる抗体Fcドメインの領域である。別の特定の実施形態では、リンカーはアルブミン、例えばヒト血清アルブミンであり、ここで標的ドメインおよび作用ドメインはアルブミンのN末端およびC末端にある。
本開示はさらに、Wntポリペプチド、ノリンポリペプチド、およびWntシグナル伝達アゴニスト分子、ならびにWntシグナル伝達を増強し、本明細書中に記載されるものを含むWnt関連疾患または障害を治療または予防するためのそれらの使用に関する。特定の実施形態において、Wntポリペプチド、ノリンポリペプチドおよびWntシグナル伝達アゴニスト分子は、単独でまたは本明細書に記載の1つ以上の組織特異的Wntシグナル増強分子と組み合わせて対象に提供される。
本明細書に記載の組織特異的Wntシグナル増強分子および1つ以上の薬学的に許容される希釈剤、担体、または賦形剤を含む薬学的組成物も開示されている。特定の実施形態では、薬学的組成物は、本明細書に記載の1つ以上のWntポリペプチド、ノリンポリペプチドまたはWntシグナル伝達アゴニスト分子をさらに含む。
融合タンパク質に関して本明細書に例示される組織特異的Wntシグナル増強分子は、標的組織または細胞型におけるWntシグナル伝達を増加させるために使用され得る。特定の実施形態では、Wntシグナル伝達は標準Wntシグナル伝達である。したがって、いくつかの態様では、本発明は、標的組織または細胞におけるWnt増加またはWntシグナル伝達の増強方法であって、標的組織または細胞を有効量の本発明の組織特異的Wntシグナル増強分子と接触させることを含み、該分子は、標的組織または細胞上の細胞表面受容体に組織特異的または細胞特異的様式で結合する標的ドメインを含む、方法を提供する。いくつかの実施形態では、接触はインビトロ、エクスビボ、またはインビボで起こり、例えば、対象の組織特異的Wntシグナル増強分子が対象に投与または提供される。特定の実施形態では、細胞は培養細胞であり、接触はインビトロで起こる。
本明細書中で融合タンパク質に関して例示される組織特異的Wntシグナル増強分子は、例えば標的細胞、組織または器官におけるWntシグナル伝達を増加させることによって、疾患、障害または状態を処置するために使用され得る。したがって、いくつかの態様では、本発明は、それを必要とする対象における疾患または状態、例えばWntシグナル伝達の低下に関連するか、またはWntシグナル伝達の増加が治療上の恩恵をもたらすであろう疾患または障害を治療するための方法であって、対象を有効量の本開示の組成物と接触させることを含む、方法を提供する。特定の実施形態では、組成物は、以下のいずれかを含む薬学的組成物である:組織特異的Wntシグナル増強分子、例えば、小分子またはポリペプチド;組織特異的Wntシグナル増強分子、例えばDNAまたはmRNA、必要に応じて修飾mRNAをコードする核酸配列を含むポリヌクレオチド;組織特異的Wntシグナル増強分子をコードする核酸配列を含むベクター;例えば発現ベクターまたはウイルスベクター;または組織特異的Wntシグナル増強分子をコードする核酸配列を含む細胞、例えば、組織特異的Wntシグナル増強分子をコードする発現ベクターまたはウイルスベクターで形質導入された細胞。特定の実施形態では、疾患または状態は病的な疾患または障害、または損傷、例えば創傷から生じる損傷である。特定の実施形態では、創傷は別の治療的処置の結果であり得る。特定の実施形態では、疾患または状態は、組織修復の障害、治癒または再生を含むか、または組織修復の増加、治癒または再生の恩恵を受けるであろう。いくつかの実施形態では、接触はインビボで起こる、すなわち、対象組成物は対象に投与される。
SCFVフォーマットにおけるWNTシグナリングのASGR1特有の強化
Wntシグナル伝達の組織特異的増強は、変異型ヒトRspo2(アミノ酸残基)に融合したヒトASGR1に対するscFv抗体(特許WO2014/023709A1に基づいて設計された、クローン4F3)を含む組織特異的Wntシグナル増強分子を用いて初めて実証された。2つの点変異(F105AおよびF109A)を有する(α-ASGR-mtRspo2)。ヒトRspo2におけるこれらの変異は、図1に図解されるように、ZNRF3/RNF43との相互作用を妥協することなくLGR4-6への結合を減少/廃止し、図2に図解されるようにRspo2を作用ドメインとして機能させる。標的ドメインに対する陰性対照として(図2参照)、緑色蛍光タンパク質(GFP)に対するscFv抗体を同じ変異型ヒトRspo2(α-GFP-mtRspo2)に融合した。Wntシグナル増強活性についての陽性対照として、GFP抗体を野生型ヒトRspo2(アミノ酸残基37~143)(α-GFP-Rspo2)に融合した。これらの構築物を図5Aに図示し、それらのアミノ酸配列およびそれをコードするポリヌクレオチド配列を以下の通りに示す:α-GFP-mtRspo2(それぞれ配列番号8および7)、α-ASGR-mt-Rspo2(それぞれ配列番号10および9)。これらの組織特異的Wntシグナル増強分子はまた、分泌のためにN末端にシグナリングペプチドを、検出のためにC末端にFLAGタグを含み、続いてアフィニティー精製のために(His)8タグを含んだ。組織特異的Wntシグナル増強融合タンパク質および対照をコードする発現構築物を標準的な分子クローニング技術によって作製した。
行動領域のメカニズムと行動の動的範囲の変調
組織特異的Wntシグナル増強分子の融合構築物設計の作用機序を検証するために、追加の変異をRspo2(これは作用ドメインとして機能する)に導入し、これらの構築物の活性を、実施例1に記載したのと同じ一過性トランスフェクションに基づくレポーターアッセイにおいてHuh-7細胞中で分析した。ZNRF3/RNF43相互作用の役割は、S47、N50、R65、R69、およびQ70などのZNRF3/RNF43に結合することが知られているRspo2内の残基に(F105AおよびF109A変異に加えて)点変異を導入することによって最初に試験された。F105A/F109A/S47A/N50A変異を含むα-GFP-mtRspo2のアミノ酸配列を配列番号12に提供し、コードポリヌクレオチド配列を配列番号11に提供する。F105A/F109A/S47A/N50A変異を含むα-ASGR1-mtRspo2のアミノ酸配列は配列番号14に提供され、コードポリヌクレオチド配列は配列番号13に提供される。F105A/F109A/R65A/R69A/Q70A変異を含むα-GFP-mtRspo2のアミノ酸配列は配列番号16に提供され、コードポリヌクレオチド配列は配列番号15に提供される。F105A/F109A/R65A/R69A/Q70A変異を含むα-ASGR1-mtRspo2のアミノ酸配列は配列番号18に提供され、コードポリヌクレオチド配列は配列番号17に提供される。図6Aに示すように、S47A/N50AまたはR65A/R69A/Q70Aの変異の導入は、抗GFPおよび抗ASGR1構築物の両方のWntシグナル増強活性を無効にした。これらの結果は、これらの2つのE3リガーゼが作用ドメインによって標的とされるというメカニズムと一致している。
他の細胞表面受容体を用いた標的化戦略の検証
組織特異的Wntシグナル増強分子の抗ASGR1に基づく設計が単なる特定の場合ではなく、むしろ一般原則を表す例であることを検証するために、変異体(F105A/F109A)Rspo2断片(アミノ酸残基37~143)を、他の細胞表面受容体、ヒトトランスフェリン受容体1(TFR1)(特許WO2016/081640、クローン7A4に基づいて設計されている)に対するscFv抗体に融合した。構築物のアミノ酸配列は、配列番号28に提供されている。実施例1に記載の一過性トランスフェクションおよびレポーターアッセイを使用して、この新しい構築物は、野生型Rspo2に融合したポジティブコントロール抗GFP(配列番号6、図7Aおよび7B)の活性と同等またはそれを超える活性を有することが実証された。これは、標的戦略の一般化を支持するだけでなく、適切な細胞表面受容体を認識する標的ドメインが使用される限り、特異的Wntシグナル増強活性を有意に増強するこのアプローチの十分な可能性を証明した。TFR1受容体の広範な分布はまた、このWntシグナル増強戦略に感受性のある組織/細胞についてスクリーニングするためにこの融合構築物を使用する機会を提供した。
組織/細胞特異的WNTエンハンサーとしての精製融合タンパク質(SCFVフォーマット)
設計された融合タンパク質の活性を直接試験するために、構築物をバキュロウイルストランスファーベクターpAcGP67-Aにサブクローニングし、以前に記載されたように(Jandaら、2017 Nature)発現させSF9/hi5細胞から精製した。発現されたタンパク質を、complete hisタグ精製樹脂(Sigma-Aldrich)を使用して、販売元推奨手順に従ってHisタグを介して精製し、次いでサイズ排除カラム(S200、GE Healthcare)分画によってさらに精製した。図8Aは、表示された標的ドメインおよび作用ドメインを有する精製融合タンパク質(サイズ排除カラムによって抗TFR1構築物はさらに精製されなかった)のクマシー染色ゲル画像の代表例を示し、推定純度は>90%である。
一過性トランスフェクションによって実証された全長IGGフォーマットにおけるアクティブWNT信号エンハンサー
完全IgGフォーマットの抗体は、他の利点の中でも、優れた薬物動態学的特性および安定性と関連している。先の実施例に記載の組織特異的Wntシグナル増強分子が完全IgGフォーマットで活性であることを実証するために、これらの組織特異的Wntシグナル増強融合タンパク質を完全IgGフォーマットに変換した。TFR1結合剤は、本出願の先の例からのその最高の活性のために、IgGフォーマットのWntシグナル増強分子のための概念実証として選択された。図9Aの図に示すように、変異体(F105R/F109A)Rspo2をTFR1抗体(または陰性対照としてのGFP抗体、両方ともIgG2として)の軽鎖または重鎖のN末端に融合させた。これらの分子の活性は、Wntシグナル伝達に応答するレポーターを用いた293細胞への一過性トランスフェクションによって決定された。α-GFP IgGの重鎖のN末端に付加されたRspo2(F105R/F109A)ドメインを有する構築物については、α-GFP軽鎖のアミノ酸配列を配列番号36に提供し、そのコードポリヌクレオチド配列は配列番号35に提供され、Rspo2(F105R/F109A)、α-GFP重鎖IgG2のアミノ酸配列は配列番号38に提供され、そのコードポリヌクレオチド配列は配列番号37に提供される。α-TFR1 IgGの重鎖のN末端に付加されたRspo2(F105R/F109A)ドメインを有する構築物については、α-TFR1軽鎖のアミノ酸配列を配列番号40に提供し、そのコードポリヌクレオチド配列は配列番号39に提供され、Rspo2(F105R/F109A)、α-TFR1重鎖IgG2のアミノ酸配列は配列番号42に提供され、そのコードポリヌクレオチド配列は配列番号41に提供される。α-GFP IgGの軽鎖のN末端に付加されたRspo2(F105R/F109A)ドメインを有する構築物については、α-GFP二本鎖IgG2のアミノ酸配列を配列番号46に提供し、そのコード化ポリヌクレオチド配列は配列番号45に提供され、Rspo2(F105R/F109A)、α-GFP軽鎖のアミノ酸配列は配列番号44に提供され、そのコード化ポリヌクレオチド配列は配列番号43に提供される。α-TFR1 IgGの軽鎖のN末端に付加されたRspo2(F105R/F109A)ドメインを有する構築物については、α-TFR1二本鎖IgG2のアミノ酸配列を配列番号50に提供し、そのコードポリヌクレオチド配列は配列番号49に提供され、Rspo2(F105R/F109A)、α-TFR1軽鎖のアミノ酸配列は配列番号48に提供され、そのコード化ポリヌクレオチド配列は配列番号47に提供される。
対象となるWNT信号強化活動をサポートするための追加のRSPO変異体
RspoとLGRタンパク質との間の相互作用にとって最も重要であることが知られている2つの疎水性残基(ヒトRspo2の場合はF105およびF109)に加えて、さらなる残基も相互作用に寄与し得る。これらの残基には、例えば、Rspo2のK58、H76、S77、R86、N91、およびR121が含まれる。これらの残基における変異は、Fs105/F109変異と組み合わせて使用されて、RspoとLGRタンパク質との相互作用を廃止/妥協することができる。種々の構築物のアミノ酸配列およびそれをコードするポリヌクレオチド配列は以下の通り提供される:抗ASGR1、Rspo2(F105R/F109A)、配列番号52および51;抗GFP、Rspo2(R86E/F105R/F109A)、配列番号54および53;抗ASGR1、Rspo2(R86E/F105R/F109A)、配列番号56および55;抗TFR1、Rspo2(R86E/F105R/F109A)、配列番号58および57;抗GFP、Rspo2(R86E/F105R/F109A/R121E)、配列番号60および59;抗ASGR1、Rspo2(R86E/F105R/F109A/R121E)、配列番号62および61;抗TFR1、Rspo2(R86E/F105R/F109A/R121E)、配列番号64および63;抗GFP、Rspo2(K58E/R86E/F105R/F109A/R121E)、配列番号66および65;抗ASGR1、Rspo2(K58E/R86E/F105R/F109A/R121E)、配列番号68および67;抗TFR1、Rspo2(K58E/R86E/F105R/F109A/R121E)、配列番号70および69。
SCFVフォーマットにおける追加組換えタンパク質のWNTシグナル増強活性
一過性トランスフェクション実験によって観察されたscFv抗TFR1ベースの構築物のWntシグナル増強活性(図6C)は、精製タンパク質を用いてさらに検証された。抗hTFR1-Rspo2(F105R/F109A)および抗GFP対照(それぞれ配列番号30および32)の融合タンパク質をコードするプラスミドベクターをExpi293F細胞(Thermo Fisher Scientific)にトランスフェクトし、販売元推奨手順に従って、cOmplete hisタグ精製樹脂(Sigma-Aldrich)を用いて精製した。図11Aは、精製タンパク質のクマシー染色ゲル画像を示す。図11Bに示すように、TFR1標的組換えタンパク質は、抗GFP融合対照よりはるかに強力な活性を示した。さらに、この標的分子のEmaxは、Rspo2陽性対照のものと同等である。
精製タンパク質で実証された細胞表面受容体依存性
設計したWntシグナル増強分子の特異的細胞表面受容体の存在への依存性をさらに実証するために、ヒトASGR1標的分子(抗ASGR1-Rspo2(F105A/F109A);配列番号10)をASGR1レセプターを天然には発現しないA431細胞上でSTFアッセイで試験した。細胞を最初に、Lipofectamine 2000(Invitrogen)を使用してヒトASGR1またはヒトTFR2のいずれかを発現するベクターで、販売元推奨手順に従って96ウェルプレート中で一過性にトランスフェクトした。24時間後、トランスフェクトされた細胞を、陽性対照としてのRspo2と共に、hASGR1標的融合タンパク質で処理した。ASGR1発現ベクターによる一過性トランスフェクションはA431細胞を応答性にすることが見出されたが、TFR2発現ベクターによるコントロールトランスフェクションはWntシグナル増強分子に応答しなかった(図12)。
添付IGGフォーマットにおける精製タンパク質のWNTシグナル増強活性
一過性トランスフェクション実験(図9)によって実証されたTFR1標的付加IgG分子のWntシグナル増強活性をさらに検証するために、これらの分子をExpi293F細胞(Thermo Fisher Scientific)を用いて組換えタンパク質として発現させた。組換えタンパク質を最初にプロテインAアフィニティー樹脂(標準的手法)によって精製し、次いでサイズ排除カラム(S200、GE Healthcare)分画によって磨いた。精製タンパク質をSTFアッセイを用いてHuh-7および293T細胞上で直接試験した。これらは両方ともヒトTFR1受容体を発現する。図13に示すように、TFR1を標的とした分子は、抗GFP融合対照よりも3~4桁優れた効力およびより高いEmaxを示した。
追加IGGスキャフォールドの構造活性相関解析
完全長IgGのフォーマットの標的ドメインを用いて、作用ドメインを結合する複数の方法を比較した。試験した様々なIgG2足場の活性の要約を図14A~14Bに示し、ここで変異体Rspo2(F105R/F109A)は重鎖のN末端、軽鎖のN末端に結合している。標的ドメインとして抗ASGR1または抗TFR1のいずれかの軽鎖のC末端、または対照抗体として抗GFPまで。使用したいくつかの構築物は実施例5に記載されており、試験した追加の構築物は以下を含んでいた:α-ASGR1 IgGの重鎖のN末端に付加されたRspo2(F105R/F109A)ドメイン;軽鎖は配列番号72で提供され、そのコードポリヌクレオチド配列は配列番号71で提供され、Rspo2(F105R/F109A)のアミノ酸配列α-ASGR1重鎖IgGは配列番号74で提供されおよびそのコードポリヌクレオチド配列は、配列番号73に提供され;α-GFP IgG2の軽鎖のC末端に付加されたRspo2(F105R/F109A)ドメイン(ここで、α-GFP重鎖IgG2のアミノ酸配列は配列番号46に提供されている)およびそのコード化ポリヌクレオチド配列は配列番号45に提供され、Rspo2(F105R/F109A)、α-GFP軽鎖のアミノ酸配列は配列番号76に提供され、そのコードポリヌクレオチド配列は配列番号76に提供され;α-ASGR1 IgG2の軽鎖のC末端に付加されたRspo2(F105R/F109A)ドメイン(ここで、α-ASGR1二本鎖IgG2のアミノ酸配列は、配列番号80に提供される)およびそのコード化ポリヌクレオチド配列は配列番号79に提供され、Rspo2(F105R/F109A)、α-ASGR1軽鎖のアミノ酸配列は配列番号78に提供され、そのコードポリヌクレオチド配列は配列番号78に提供され;α-TFR1 IgG2の軽鎖のC末端に付加されたRspo2(F105R/F109A)ドメイン(ここで、α-TFR1二本鎖IgG2のアミノ酸配列は配列番号50に提供される)およびそのコード化ポリヌクレオチド配列は、配列番号49に提供されている;Rspo2のアミノ酸配列(F105R/F109A)、α-TFR1軽鎖は配列番号82に提供され、そのコードポリヌクレオチド配列は配列番号81に提供される。
行動領域としての4つのRスポンジンの構造活性相関解析
ヒトは、特にフリンドメイン内に、高い配列相同性を有する4つのR-スポンジンタンパク質を有する(図4)。インビトロでのWntシグナル伝達の増強におけるそれらの能力を直接比較するために、4つのヒトR-スポンジンの各々のFu1-Fu2ドメインを、一過性トランスフェクションによるExpi293F細胞におけるASGR1、TFR1およびGFPへのscFvバインダーのC末端への融合として発現させた。標準的なHisタグおよびサイズ排除クロマトグラフィー精製手順。抗GFP、Rspo1野生型融合タンパク質のアミノ酸配列およびコードポリヌクレオチド配列は、それぞれ配列番号96および95に提供されている。抗GFP、Rspo2野生型融合タンパク質のアミノ酸配列およびコードポリヌクレオチド配列は、それぞれ配列番号6および5に提供されている。抗GFP、Rspo3野生型融合タンパク質のアミノ酸配列およびコードポリヌクレオチド配列は、それぞれ配列番号98および97に提供されている。抗GFP、Rspo4野生型融合タンパク質のアミノ酸配列およびコードポリヌクレオチド配列は、それぞれ配列番号100および99に提供されている。次に精製タンパク質を、Wnt3a馴化培地の存在下でHuh-7および293T細胞中でSTFアッセイにより試験した。図15Aに示すように、Rspo2および3は、Rspo4および1よりも強力であり、以前の報告と一致していた。
追加されたIGGフォーマットにおける特定のWNT信号強化活動をサポートする多様なRSPO変異体
Wntシグナル増強分子の構築を支持し得る変異の多様性およびそれらの組み合わせをさらに実証するために、抗GFPまたは抗ASGR1に融合した一連の追加のRspo3変異体に基づく分子を作製し、それらの活性をHuh-7細胞において試験した。STFアッセイを使用する。これらの変異は、F106R/F110A(RA)、F106R/F110R(RR)、F106E/F110E(EE)、F106R/F110A(RE)、F106E/F110A(EA)、R60E/R88E/N93A/F106R/F110A(EEARA)を含んだ。R60、R88、およびN93は、他のRspoタンパク質との相同性に基づいて、LGR相互作用に関与している残基である(図16A)。これらの構築物のアミノ酸およびコードポリヌクレオチド配列は以下の通りである:抗GFP Rspo3野生型、配列番号98および97;抗GFP Rspo3 RA、配列番号104および103;抗GFP Rspo3 RR、配列番号114および113;抗GFP Rspo3 EE、配列番号116および115; 抗GFP Rspo3 RE、配列番号118および117;抗GFP Rspo3 EA、配列番号120および119;抗GFP Rspo3 EEARA、配列番号122および121; 抗ASGR1 Rspo3 RA、配列番号108および107;抗ASGR1 Rspo3 RR、配列番号124および123;抗ASGR1 Rspo3 EE、配列番号126および125;抗ASGR1 Rspo3 RE、配列番号128および127;抗ASGR1 Rspo3 EA、配列番号130および129;抗ASGR1 Rspo3 EEARA、配列番号132および131。
非RSPOベースの作用ドメイン
作用ドメインとして非Rspoベースの構造を使用することの実現可能性を実証するために、抗ヒトZNRF3 mAbのFab断片(特許WO2013054307A2からのAb2)を抗ASGR1、抗TFR1、または抗GFPのIgGに融合した「Fab-IgG」融合タンパク質を設計した(図17A)。抗ZNRF3抗GFP構築物は、示されたポリペプチド配列およびコードポリヌクレオチド配列を有する以下のポリペプチドを含んでいた:抗GFP軽鎖(S176K)(配列番号134および133)、抗ZNRF3軽鎖(S176E)(配列番号136および135)、ならびに抗ZNRF3-抗GFP融合重鎖(配列番号138および137)。抗ZNRF3-抗ASGR1構築物は、示されたポリペプチド配列およびコードポリヌクレオチド配列を有する以下のポリペプチドを含んでいた:抗ASGR1軽鎖(S176K)(配列番号140および139)、抗ZNRF3軽鎖(S176E)(配列番号136および135)、ならびに抗ZNRF3-抗ASGR1融合重鎖(配列番号142および141)。抗ZNRF3-抗TFR1構築物は、示されたポリペプチド配列およびコードポリヌクレオチド配列を有する以下のポリペプチドを含んでいた:抗TFR1軽鎖(S176K)(配列番号144および143)、抗ZNRF3軽鎖(S176E)(配列番号1136および135)、ならびに抗ZNRF3-抗TFR1融合重鎖(配列番号146および145)。
肝臓を標的としたWNTエンハンサーに加えて、組織を標的としたWNTエンハンサー
上記に提供された例は、様々な用途のために肝臓を標的とする能力を有するWntシグナル伝達増強分子を生成するためにASGR1結合剤を利用した。TFR1結合剤はまた、肝臓、ならびにそれが発現されるより広範囲の組織を標的とし得る。肝臓を超えた組織標的を提供するために、公共の遺伝子発現データベース(https://www.proteinatlas.org/)を検索することによって、追加の組織特異的細胞表面分子を同定した。LYPD3、Ly6/PLAURドメイン含有タンパク質3、およびDSG3、デスモグレイン3は、それらが口腔粘膜、皮膚および扁桃腺由来の粘膜上皮細胞において非常に豊富かつ特異的に発現されるので、標的分子として選択された。さらに、それらの特異的抗体配列は以前に公開されていた(US20170158775A1、mAbクローンM31-B01がLYPD3結合剤として選択され;US20100092457A1、mAbクローンDF364cがDSG3結合剤として選択された)。
組織特異的WNTシグナルエンハンサーによるWNT応答遺伝子のインビボ誘導
設計したWntシグナルエンハンサーのインビボ活性を調べるために、Wnt応答遺伝子であるAxin2の誘導を調べた。図19Aに示したように、AAV-hASGR1を最初に動物当たり1E11の力価で8週齢のオスのマウスに静脈内注射した。これはマウス肝臓におけるヒトASGR1遺伝子発現をもたらした。7日後、精製したタンパク質を特定の用量で8つの群に分けて静脈内注射した。単独で、またはWntシグナルと組み合わせてのいずれかで、0.46mg/kgのRspo2陽性対照、1mg/kgの抗GFP-Rspo2(F105R/F109A)、および1mg/kgの抗ASGR1-Rspo2(F105R/F109A)3mg/kgのアゴニスト18R5-Dkk1c(Janda et al.、2017 Nature)。8時間後、マウスを安楽死させ、肝臓サンプルを遺伝子発現の定量的PCR分析のために採取した。抗GFP構築物は、示されたポリペプチドおよびコードポリヌクレオチド配列を有する以下のポリペプチドを含んでいた:抗GFP軽鎖(配列番号36および35)および抗GFP重鎖IgG1(LALA-PG)(配列番号156および155)。抗GFP Rspo2(F105R/F109A)、N-HC構築物は、配列番号35~38に提供されるポリペプチドを含んでいた。抗ASGR1 IgG2 N-HC構築物は、配列番号71~74に提供されるポリペプチドを含んでいた。18R5-Dkk1c構築物は、配列番号158に開示されているポリペプチド配列を有し、配列番号157に開示されているポリヌクレオチド配列によってコードされていた。
参考文献:
Clevers H,Loh KM and Nusse R.2014,An integral program for tissue renewal and regeneration:Wnt signaling and stem cell control.Science 346(6205):1248012.
Knight MN and Hankenson KD.R-spondins:novel matricellular regulators of the skeleton.Matrix Biology 37:157-161.
Yan JJ,Liao JZ,Lin JS and He XX.2015,Active radar guides missile to its target:receptor-based targeted treatment of hepatocellular carcinoma by nanoparticulate systems.Tumor Biology 36:55-67.
Stockert RJ,Morell AG and Ashwell G.1991,Structural characteristics and regulation of the asialoglycoprotein receptor.Targeted Diagnostic and Therapy 4:41-64.
D’Souza AA and Devarajan PV.2015,Asialoglycoprotein receptor mediated hepatocyte targeting-strategies and applications.Journal of Controlled Release,203:126-139.
Yan H,Zhong G,Xu G,He W,Jing Z,Gao Z,Huang Y,Qi Y,Peng B,Wang H,Fu L,Song M,Chen P,Gao W,Ren B,Sun Y,Cai T,Feng X,Sui J,Li W.2012,Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus.eLife,1:e00049.
Worthen CA and Enns CA.2014,The role of hepatic transferrin receptor 2 in the regulation of iron homeostasis in the body.Frontiers in Pharmacology 5:34
Mannstadt M,Juppner H,and Gardella TJ.1999,Receptors for PTH and PTHrP:their biological importance and functional properties.American Journal of Physiology 277:F665-F675.
Janda CY,Dang LT,You C,Chang J,de Lau W,Zhong ZA,Yan KS,Marecic O,Siepe D,Li X,Moody JD,Williams BO,Clevers H,Piehler J,Baker D,Kuo CJ,and Garcia KC.2017,Surrogate Wnt agonists that phenocopy canonical Wnt and β-catenin signaling.Nature 545:234-237.
Lo M,Kim HS,Tong RK,Bainbridge TW,Vernes JM,Zhang Y,Lin YL,Chung S,Dennis MS,Zuchero YJ,Watts RJ,Couch JA,Meng YG,Atwal JK,Brezski RJ,Spiess C,Ernst JA.2017,Effector-attenuating Substitutions That Maintain Antibody Stability and Reduce Toxicity in Mice.J BiolChem.292:3900-3908.
Jacobsen FW,Stevenson R,Li C,Salimi-Moosavi H,Liu L,Wen J,Luo Q,Daris K,Buck L,Miller S,Ho SY,Wang W,Chen Q,Walker K,Wypych J,Narhi L,Gunasekaran K.2017 Engineering an IgG Scaffold Lacking Effector Function with Optimized Developability.J BiolChem.292:1865-1875.
Paret C,Bourouba M,Beer A,Miyazaki K,Schnolzer M,Fiedler S,Zoller M.International Journal of Cancer.2005 Jul 10;115(5):724-33.Ly6 family member C4.4A binds laminins 1 and 5,associates with galectin-3 and supports cell migration.
Arumugam T,Deng D,Bover L,Wang H,Logsdon CD,Ramachandran V.Molecular Cancer Therapeutics.2015 Apr;14(4):941-51.New Blocking Antibodies against Novel AGR2-C4.4A Pathway Reduce Growth and Metastasis of Pancreatic Tumors and Increase Survival in Mice.
Ngora H1,Galli UM,Miyazaki K,Zoller M.Neoplasia.2012 Feb;14(2):95-107.Membrane-bound and exosomal metastasis-associated C4.4A promotes migration by associating with the α(6)β(4) integrin and MT1-MMP.
Wolfgang-Moritz Heupel,Detlef Zillikens,Detlev Drenckhahn and Jens Waschke Pemphigus.Vulgaris IgG Directly Inhibit Desmoglein 3-Mediated Transinteraction.Journal of Immunology.August 1,2008,181(3)1825-1834.
Claims (49)
- 組織特異的Wnt(「ウィングレス関連統合部位」または「ウィングレスおよびInt-1」または「ウィングレス-Int」)シグナル増強分子、またはその薬学的に許容される塩であって、ジンクリングフィンガー3(ZNRF3)およびリングフィンガータンパク質43(RNF43)から選択される1つ以上の膜貫通型E3ユビキチンリガーゼに特異的に結合する第1のドメインと、組織特異的細胞表面分子に特異的に結合する第2のドメインとを含み、前記組織特異的Wntシグナル増強分子が、前記組織特異的細胞表面分子を含む前記組織においてWntシグナル伝達を増加させ、
a)前記組織が、骨組織であり、前記細胞表面分子が、副甲状腺ホルモン受容体1(PTH1R)であるか、
b)前記組織が、肝臓組織であり、前記細胞表面分子が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)、もしくは溶質キャリアファミリー10メンバー1(SLC10A1)であるか、または
c)前記組織が、口腔粘膜であり、前記細胞表面分子が、Ly6/PLAURドメイン含有3(LYPD3)もしくはデスモグレイン(DSG3)である、
組織特異的Wntシグナル増強分子、またはその薬学的に許容される塩。 - 前記第1のドメインが、第1のポリペプチド配列を含み、かつ前記第2のドメインが、第2のポリペプチド配列を含む、請求項1に記載の分子。
- 前記組織特異的Wntシグナル増強分子が、前記第1のポリペプチド配列および前記第2のポリペプチド配列を含む融合タンパク質を含む、請求項2に記載の分子。
- 前記第2のドメインが抗体を含み、前記抗体が、重鎖ポリペプチドおよび軽鎖ポリペプチドを含み、前記第1のポリペプチド配列が、前記重鎖ポリペプチドまたは前記軽鎖ポリペプチドのN末端および/またはC末端に融合されている、請求項2に記載の分子。
- (a)前記第1のドメインが、2つのR-スポンジン-2ポリペプチドまたはそのバリアントを含み、前記R-スポンジン-2ポリペプチドまたはそのバリアントが、前記R-スポンジン-2ポリペプチドのフリン1ドメインを含み、前記R-スポンジン-2ポリペプチドが、ヒトR-スポンジン-2のF105およびR109に対応するアミノ酸でアミノ酸置換を含み、かつ
(b)前記第2のドメインが、2つの重鎖ポリペプチドおよび2つの軽鎖ポリペプチドを含む抗体を含み、
前記R-スポンジン-2ポリペプチドが、IgG抗体の重鎖ポリペプチドに融合されている、請求項4に記載の分子。 - 前記第1のポリペプチド配列が、
a)R-スポンジンポリペプチド配列またはその断片もしくはバリアントであって、前記R-スポンジンが、場合により、R-スポンジン-1、R-スポンジン-2、R-スポンジン-3、またはR-スポンジン-4であり、前記その断片もしくはバリアントが、ZNRF3および/またはRNF43に結合することができる、R-スポンジンポリペプチド配列またはその断片もしくはバリアント、
b)R-スポンジンフリンドメイン1配列、あるいは
c)R-スポンジンフリンドメイン1配列、および野生型もしくは変異型フリンドメイン2
を含み、前記第1のポリペプチド配列は、場合により、全長R-スポンジンと比較してロイシンリッチリピート含有Gタンパク質共役受容体4~6(LGR4~6)への結合が減少している、請求項2または請求項3に記載の分子。 - 前記R-スポンジンフリンドメイン1が、配列番号1~4に存在するフリン1ドメインのうちのいずれかと少なくとも90%の同一性を有する、請求項6に記載の分子。
- 前記第2のポリペプチド配列が、ペプチド、ポリペプチド、抗体、あるいはリガンドまたはそのバリアントである、請求項2~7のいずれかに記載の分子。
- 前記組織が、肝臓組織であり、前記細胞表面分子が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)もしくは溶質キャリアファミリー10メンバー1(SLC10A1)である、請求項1~8のいずれか一項に記載の分子。
- 前記組織が肝臓組織であり、前記細胞表面分子がASGR1である、請求項9に記載の分子。
- a)前記細胞表面分子が、副甲状腺ホルモン受容体1(PTH1R)であり、前記第2のドメインが、PTH1Rに特異的に結合するか、
b)前記細胞表面分子が、アシアロ糖タンパク質受容体1(ASGR1)であり、前記第2のドメインが、ASGR1に特異的に結合するか、
c)前記細胞表面分子が、アシアロ糖タンパク質受容体2(ASGR2)であり、前記第2のドメインが、ASGR2に特異的に結合するか、
d)前記細胞表面分子が、溶質キャリアファミリー10メンバー1(SLC10A1)であり、前記第2のドメインが、溶質キャリアファミリー10メンバー1(SLC10A1)に特異的に結合するか、
e)前記細胞表面分子が、トランスフェリン受容体2(TFR2)であり、前記第2のドメインが、TFR2に特異的に結合するか、
f)前記細胞表面分子が、Ly6/PLAURドメイン含有3(LYPD3)であり、前記第2のドメインが、LYPD3に特異的に結合するか、または
g)前記細胞表面分子が、デスモグレイン(DSG3)であり、前記第2のドメインが、DSG3に特異的に結合し、
前記第2のドメインが、抗体もしくはその断片、あるいは前記細胞表面分子のリガンドまたはその断片もしくはバリアントである、請求項1~8のいずれかに記載の分子。 - 前記第1のポリペプチド配列および前記第2のポリペプチド配列が、リンカー部分によって結合している、請求項2~8および11、ならびに請求項2に従属する場合の請求項9のいずれかに記載の分子。
- 前記リンカー部分が、ペプチジルリンカー配列である、請求項12に記載の分子。
- 前記リンカー配列が、グリシン、アスパラギン、セリン、トレオニンおよびアラニンからなる群から選択される1つ以上のアミノ酸を含む、請求項13に記載の分子。
- 第1のポリペプチド配列および第2のポリペプチド配列を含む融合タンパク質であって、
前記第1のポリペプチド配列が、ジンクリングフィンガー3(ZNRF3)およびリングフィンガータンパク質43(RNF43)から選択される1つ以上の膜貫通型E3ユビキチンリガーゼに特異的に結合し、
前記第2のポリペプチド配列が、組織特異的細胞表面分子に特異的に結合する抗体の重鎖ポリペプチド配列または軽鎖ポリペプチド配列であり、
a)前記組織が、骨組織であり、前記細胞表面分子が、副甲状腺ホルモン受容体1(PTH1R)であるか、
b)前記組織が、肝臓組織であり、前記細胞表面分子が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)、もしくは溶質キャリアファミリー10メンバー1(SLC10A1)であるか、または
c)前記組織が、口腔粘膜であり、前記細胞表面分子が、Ly6/PLAURドメイン含有3(LYPD3)もしくはデスモグレイン(DSG3)である、
融合タンパク質。 - 請求項15に記載の融合タンパク質をコードする核酸。
- 前記核酸が、DNAまたはmRNAである、請求項16に記載の核酸。
- 請求項16または請求項17に記載の核酸を含むベクター。
- 前記ベクターが、前記核酸に機能的に連結されたプロモーター配列を含む発現ベクターである、請求項18に記載のベクター。
- 前記ベクターが、前記核酸に機能的に連結されたプロモーター配列を含むウイルスである、請求項18に記載のベクター。
- 請求項19に記載のベクターを含む宿主細胞。
- 請求項15に記載の融合タンパク質を生成するための方法であって、前記融合タンパク質が前記発現ベクターによって発現される条件下で請求項21に記載の宿主細胞を培養することを含む、方法。
- 生成された前記融合タンパク質を単離する工程をさらに含む、請求項22に記載の方法。
- (i)有効量の、請求項1~14のいずれかに記載の分子、請求項15に記載の融合タンパク質、請求項16~17のいずれかに記載の核酸、または請求項18~20のいずれかに記載のベクターと、
(ii)薬学的に許容される希釈剤、アジュバントまたは担体と、を含む、薬学的組成物。 - 有効量の請求項1~14のいずれか一項に記載の分子を含む薬学的組成物。
- 有効量の請求項1~14のいずれかに記載の分子と、有効量のWntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子とを含む、請求項24に記載の薬学的組成物。
- 有効量の請求項16~17のいずれかに記載の核酸と、Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする有効量の核酸とを含み、前記Wntポリペプチド、前記ノリンポリペプチド、または前記Wntシグナル伝達アゴニスト分子をコードする前記核酸が、場合によりDNAまたはmRNAである、請求項24に記載の薬学的組成物。
- 請求項16~17のいずれかに記載の核酸および/または前記Wntポリペプチド、前記ノリンポリペプチド、もしくは前記Wntシグナル伝達アゴニスト分子をコードする前記核酸が、修飾mRNAである、請求項27に記載の薬学的組成物。
- 有効量の請求項18~20のいずれかに記載のベクターと、Wntポリペプチド、ポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする核酸を含む有効量のベクターとを含み、ノリン前記Wntポリペプチド、前記ノリンポリペプチド、または前記Wntシグナル伝達アゴニスト分子をコードする前記核酸を含む前記ベクターが、場合により発現ベクターである、請求項24に記載の薬学的組成物。
- 前記Wntポリペプチドが、Wnt1、Wnt2、Wnt2B、Wnt3、Wnt3A、Wnt4、Wnt5A、Wnt5B、Wnt6、Wnt7A、Wnt7B、Wnt8A、Wnt8B、Wnt9A、Wnt9B、Ant10A、Wnt10B、Wnt11、およびWnt16、ならびにこれらのうちのいずれかの機能的バリアントおよび断片から選択される哺乳動物Wntポリペプチドである、請求項26~29のいずれかに記載の薬学的組成物。
- 前記ノリンポリペプチドが、哺乳動物ノリンポリペプチドまたはその機能的バリアントもしくは断片である、請求項26~29のいずれかに記載の薬学的組成物。
- 前記Wntシグナル伝達アゴニスト分子が、フリズルド(Fzd)受容体をLrp5/6と二量体化させる水溶性Wntシグナル伝達アゴニストである、請求項26~29のいずれかに記載の薬学的組成物。
- 前記Wntシグナル伝達アゴニスト分子が、1つ以上のFzdタンパク質に対して高い親和性を有する結合ドメインと、Lrp5/Lrp6タンパク質に対して高い親和性を有する結合ドメインとを含み、前記結合ドメインが、場合により、直接結合しているか、またはリンカーにより結合している、請求項32に記載の薬学的組成物。
- 疾患または状態の治療または予防を必要とする対象においてそれを行うための、請求項24~33のいずれかに記載の薬学的組成物であって、前記疾患または障害が、Wnt(「ウィングレス関連統合部位」または「ウィングレスおよびInt-1」または「ウィングレス-Int」)シグナル伝達の減少と関連しているか、またはWntシグナル伝達の増加による恩恵を受けるであろうものである、薬学的組成物。
- 請求項1~14のいずれかに記載の分子を含む薬学的組成物が、Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子を含む薬学的組成物と組み合わせて提供されることを特徴とする、請求項34に記載の薬学的組成物。
- 請求項16~17のいずれかに記載の核酸を含む薬学的組成物が、Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする核酸を含む薬学的組成物と組み合わせて提供されることを特徴とし、前記核酸のうちの一方または両方が、場合によりDNAまたはmRNA、場合により修飾mRNAである、請求項34に記載の薬学的組成物。
- 請求項18~20のいずれかに記載のベクターを含む薬学的組成物が、Wntポリペプチド、ノリンポリペプチド、またはWntシグナル伝達アゴニスト分子をコードする核酸を含むベクターを含む薬学的組成物と組み合わせて提供されることを特徴とし、前記ベクターのうちの一方または両方が、場合により発現ベクターまたはウイルスベクターである、請求項34に記載の薬学的組成物。
- 前記Wntポリペプチドが、Wnt1、Wnt2、Wnt2B、Wnt3、Wnt3A、Wnt4、Wnt5A、Wnt5B、Wnt6、Wnt7A、Wnt7B、Wnt8A、Wnt8B、Wnt9A、Wnt9B、Ant10A、Wnt10B、Wnt11、およびWnt16、ならびにこれらのうちのいずれかの機能的バリアントおよび断片から選択される哺乳動物Wntポリペプチドである、請求項35~37のいずれかに記載の薬学的組成物。
- 前記ノリンポリペプチドが、哺乳動物ノリンポリペプチドまたはその機能的バリアントもしくは断片である、請求項35~37のいずれかに記載の薬学的組成物。
- 前記Wntシグナル伝達アゴニスト分子が、フリズルド(Fzd)受容体をLrp5/6と二量体化させる水溶性Wntシグナル伝達アゴニストである、請求項35~37のいずれかに記載の薬学的組成物。
- 前記Wntシグナル伝達アゴニスト分子が、1つ以上のFzdタンパク質に対して高い親和性を有する結合ドメインと、Lrp5/Lrp6タンパク質に対して高い親和性を有する結合ドメインとを含み、前記結合ドメインが、場合により、直接結合しているか、またはリンカーにより結合している、請求項35に記載の薬学的組成物。
- 前記疾患または障害が、骨組織、肝臓組織、皮膚組織、胃組織、腸管組織、口腔粘膜組織、腎臓組織、中枢神経系組織、乳腺組織、味蕾組織、卵巣組織、内耳組織(蝸牛および前庭組織を含む)、毛包、膵臓組織、網膜組織、角膜組織、心臓組織および肺組織からなる群から選択される組織の疾患または障害である、請求項33~41のいずれかに記載の薬学的組成物。
- 前記疾患または障害が、
a)骨組織の疾患または障害であり、細胞表面受容体が、副甲状腺ホルモン受容体1(PTH1R)であるか、
b)肝臓組織の疾患または障害であり、細胞表面受容体が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)、もしくは溶質キャリアファミリー10メンバー1(SLC10A1)であるか、あるいは
c)口腔粘膜組織の疾患または障害であり、細胞表面受容体が、Ly6/PLAURドメイン含有3(LYPD3)またはデスモグレイン(DSG3)である、請求項42に記載の薬学的組成物。 - 前記疾患または状態が、骨折、骨粗鬆症、骨粗鬆症性骨折、脊椎固定術、整形外科用装置の骨結合、腱と骨の統合、歯の成長と再生、歯科インプラント術、歯周病、顎顔面再建、顎骨壊死、脱毛症、難聴、前庭機能低下、黄斑変性、硝子体網膜症、網膜変性症、フックスジストロフィー、脳卒中、外傷性脳損傷、アルツハイマー病、多発性硬化症、脊髄損傷、口腔粘膜炎、短腸症候群、炎症性腸疾患(IBD)、メタボリックシンドローム、糖尿病、膵炎、外分泌膵機能不全、創傷治癒、糖尿病性足部潰瘍、冠状動脈疾患、急性腎臓病、慢性腎臓病、慢性閉塞性肺疾患(COPD)、急性肝不全、急性アルコール性肝障害、C型肝炎ウイルス(HCV)による慢性肝疾患、HCV患者の抗ウイルス薬治療後、B型肝炎ウイルス(HBV)による慢性肝疾患、HBV患者の抗ウイルス薬治療後、慢性アルコール性肝疾患、非アルコール性脂肪性肝疾患および非アルコール性脂肪性肝炎(NASH)、肝硬変、ならびにあらゆる原因による慢性肝不全からなる群から選択される、請求項34~41のいずれかに記載の薬学的組成物。
- 前記疾患または障害が、肝臓組織の疾患または障害であり、前記細胞表面受容体が、アシアロ糖タンパク質受容体1(ASGR1)、アシアロ糖タンパク質受容体2(ASGR2)、トランスフェリン受容体2(TFR2)、もしくは溶質キャリアファミリー10メンバー1(SLC10A1)である、請求項44に記載の薬学的組成物。
- 前記疾患または障害が、急性肝不全、急性アルコール性肝障害、C型肝炎ウイルス(HCV)による慢性肝疾患、B型肝炎ウイルス(HBV)による慢性肝疾患、慢性アルコール性肝疾患、非アルコール性脂肪性肝疾患、非アルコール性脂肪性肝炎(NASH)、肝硬変、ならびにあらゆる原因による慢性肝不全からなる群から選択される、請求項45に記載の薬学的組成物。
- 前記組織特異的Wntシグナル増強分子が、
(a)2つのR-スポンジン-2ポリペプチドまたはそのバリアントを含む第1のドメインであって、前記R-スポンジン-2ポリペプチドまたはそのバリアントが、前記R-スポンジン-2ポリペプチドのフリン1ドメインを含む、第1のドメイン、ならびに
(b)2つの重鎖ポリペプチドおよび2つの軽鎖ポリペプチドを含む抗体を含む第2のドメイン
を含み、前記R-スポンジン-2ポリペプチドまたはそのバリアントが、IgG抗体の重鎖ポリペプチドに融合されている、請求項46に記載の薬学的組成物。 - 前記薬学的組成物が、非経口的に、経口的に、筋肉内に、局所的に、または局部的に提供される、請求項34~47のいずれかに記載の薬学的組成物。
- 前記対象が、哺乳動物、場合によりヒトである、請求項34~48のいずれか一項に記載の薬学的組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023057334A JP2023078467A (ja) | 2017-01-26 | 2023-03-31 | 組織特異的Wntシグナル増強分子およびその使用 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762450804P | 2017-01-26 | 2017-01-26 | |
| US62/450,804 | 2017-01-26 | ||
| US201762487135P | 2017-04-19 | 2017-04-19 | |
| US62/487,135 | 2017-04-19 | ||
| PCT/US2018/015595 WO2018140821A1 (en) | 2017-01-26 | 2018-01-26 | Tissue-specific wnt signal enhancing molecules and uses thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023057334A Division JP2023078467A (ja) | 2017-01-26 | 2023-03-31 | 組織特異的Wntシグナル増強分子およびその使用 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020506701A JP2020506701A (ja) | 2020-03-05 |
| JP2020506701A5 JP2020506701A5 (ja) | 2021-02-25 |
| JP7305543B2 true JP7305543B2 (ja) | 2023-07-10 |
Family
ID=62978866
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019541341A Active JP7305543B2 (ja) | 2017-01-26 | 2018-01-26 | 組織特異的Wntシグナル増強分子およびその使用 |
| JP2023057334A Pending JP2023078467A (ja) | 2017-01-26 | 2023-03-31 | 組織特異的Wntシグナル増強分子およびその使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023057334A Pending JP2023078467A (ja) | 2017-01-26 | 2023-03-31 | 組織特異的Wntシグナル増強分子およびその使用 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US11958891B2 (ja) |
| EP (1) | EP3574019A4 (ja) |
| JP (2) | JP7305543B2 (ja) |
| CN (1) | CN110234662A (ja) |
| AU (1) | AU2018211985A1 (ja) |
| CA (1) | CA3050133A1 (ja) |
| WO (1) | WO2018140821A1 (ja) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018132572A1 (en) | 2017-01-11 | 2018-07-19 | The Board Of Trustees Of The Leland Stanford Junior University | R-spondin (rspo) surrogate molecules |
| AU2018211985A1 (en) | 2017-01-26 | 2019-07-18 | Surrozen Operating, Inc. | Tissue-specific Wnt signal enhancing molecules and uses thereof |
| US11773171B2 (en) | 2017-12-19 | 2023-10-03 | Surrozen Operating, Inc. | WNT surrogate molecules and uses thereof |
| WO2019126401A1 (en) | 2017-12-19 | 2019-06-27 | Surrozen, Inc. | Anti-lrp5/6 antibodies and methods of use |
| EP3728323A4 (en) | 2017-12-19 | 2022-01-26 | Surrozen Operating, Inc. | ANTI-FZD ANTIBODIES AND METHODS OF USE |
| JP2021530223A (ja) * | 2018-07-09 | 2021-11-11 | スロゼン, インコーポレイテッド | 組織特異性Wntシグナル増強分子及びその使用 |
| AU2019416324A1 (en) * | 2018-12-27 | 2021-07-22 | H. Lee Moffitt Cancer Center And Research Institute Inc. | Bispecific antibody for membrane clearance of target receptors |
| JP2022520084A (ja) * | 2019-02-11 | 2022-03-28 | スロゼン オペレーティング, インコーポレイテッド | 眼障害におけるwntシグナル伝達の調節 |
| WO2020206005A1 (en) * | 2019-04-02 | 2020-10-08 | Surrozen, Inc. | Modulation of wnt signaling in auditory disorders |
| KR20220024460A (ko) * | 2019-06-11 | 2022-03-03 | 안틀라 테라퓨틱스 아이엔씨. | 다가 fzd 및 wnt 결합 분자 및 이의 용도 |
| US11713461B2 (en) | 2019-06-21 | 2023-08-01 | Regeneran Pharmaceuticals, Inc. | Treatment of decreased bone mineral density with zinc and ring finger 3 (ZNRF3) inhibitors |
| KR102192471B1 (ko) * | 2019-10-18 | 2020-12-17 | 주식회사 인코스팜 | 탈모 완화 및 모발 성장을 촉진시키는 펩타이드 및 이를 포함하는 화장료 조성물 |
| CN115427446A (zh) * | 2020-02-24 | 2022-12-02 | 瑟罗泽恩奥普瑞汀公司 | Wnt超级激动剂 |
| CN116745318A (zh) * | 2020-11-10 | 2023-09-12 | 斯克里普斯研究学院 | 用于阿片样物质治疗的抗体 |
| EP4243878A1 (en) * | 2020-11-16 | 2023-09-20 | Surrozen Operating, Inc. | Liver-specific wnt signal enhancing molecules and uses thereof |
| CN112386687B (zh) * | 2020-12-09 | 2021-05-04 | 爱龄医美国际健康咨询服务(北京)有限公司 | 一种干细胞外泌体及其在药品和化妆品中的应用 |
| CN113307882B (zh) * | 2021-05-12 | 2022-12-20 | 东北大学 | 靶向治疗Rspo过度激活导致的结直肠癌的融合蛋白SZ1及其偶联纳米药物 |
| CN113293214A (zh) * | 2021-06-17 | 2021-08-24 | 深圳华因康基因科技有限公司 | 一种检测神经母细胞瘤复发转移基因wnt2扩增的引物探针及其应用 |
| CA3225626A1 (en) * | 2021-07-15 | 2023-01-19 | Diogenx | Recombinant variants of r-spondin proteins and their use |
| EP4428238A1 (en) * | 2021-11-02 | 2024-09-11 | Rena Therapeutics Inc. | Ligand-bound nucleic acid complex |
| CN116789843B (zh) * | 2022-03-16 | 2024-09-17 | 伯桢生物科技(杭州)有限公司 | Wnt重组蛋白及其应用 |
| CN116836274A (zh) * | 2022-03-23 | 2023-10-03 | 东莞市朋志生物科技有限公司 | 抗血清淀粉样蛋白a抗体、检测血清淀粉样蛋白a的试剂和试剂盒 |
| WO2023250291A2 (en) * | 2022-06-21 | 2023-12-28 | Surrozen Operating, Inc. | Modulation of wnt signalling in corneal disorders |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008093646A1 (ja) | 2007-02-01 | 2008-08-07 | National University Corporation NARA Institute of Science and Technology | Wntシグナル伝達系活性化ペプチド |
| JP2014530816A (ja) | 2011-10-14 | 2014-11-20 | ノバルティスアーゲー | Wnt経路関連疾患のための抗体および方法 |
| JP2015511484A (ja) | 2012-02-28 | 2015-04-20 | ノバルティス アーゲー | RNF43変異ステータスを利用したWntシグナル伝達阻害剤の投与のためのがん患者選択法 |
Family Cites Families (55)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030044409A1 (en) | 2001-05-01 | 2003-03-06 | Carson Dennis A. | Immunologic compositions and methods for studying and treating cancers expressing frizzled antigens |
| DK1673475T3 (da) | 2003-10-10 | 2010-07-19 | Deutsches Krebsforsch | Sammensætninger til diagnose og terapi af sygdomme, som er forbundet med aberrant ekspression af futriner (R-Spondiner) og/eller Wnt |
| DE102004050620A1 (de) | 2004-10-13 | 2006-04-20 | Eberhard-Karls-Universität Tübingen | Monoklonaler Antikörper gegen Frizzled-Rezeptoren |
| DE102005035568A1 (de) | 2005-07-25 | 2007-02-01 | M-Phasys Gmbh | Frizzled 9 als Biomarker für Substrukturen des humanen Gehirns |
| LT2578685T (lt) | 2005-08-23 | 2019-06-10 | The Trustees Of The University Of Pennsylvania | Rnr, apimančios modifikuotus nukleozidus ir jų panaudojimo būdai |
| WO2007148417A1 (en) | 2006-06-21 | 2007-12-27 | Oncotherapy Science, Inc. | Tumor-targeting monoclonal antibodies to fzd10 and uses thereof |
| US20100092457A1 (en) | 2006-08-14 | 2010-04-15 | Forerunner Pharma Research Co., Ltd. | Diagnosis and Treatment of Cancer Using Anti-Desmoglein-3 Antibodies |
| JP5792621B2 (ja) | 2008-09-26 | 2015-10-14 | オンコメッド ファーマシューティカルズ インコーポレイテッド | frizzled結合剤およびその使用 |
| JO3382B1 (ar) | 2008-12-23 | 2019-03-13 | Amgen Inc | أجسام مضادة ترتبط مع مستقبل cgrp بشري |
| EP2412800A1 (en) | 2010-07-29 | 2012-02-01 | Koninklijke Nederlandse Akademie van Wetenschappen | Liver organoid, uses thereof and culture method for obtaining them |
| JP5458112B2 (ja) | 2009-02-03 | 2014-04-02 | コーニンクレッカ ネザーランド アカデミー ヴァン ウェテンシャッペン | 上皮幹細胞および該幹細胞を含むオルガノイドのための培養培地 |
| WO2010092457A1 (en) | 2009-02-10 | 2010-08-19 | Nokia Corporation | Method, apparatus and computer program product for transfer of capability support information in a multi-rat environment |
| EP2305274A1 (en) | 2009-09-21 | 2011-04-06 | Centre National de la Recherche Scientifique (CNRS) | Use of WNT stimulators for treating demyelinating diseases |
| LT2510012T (lt) | 2009-12-09 | 2017-07-25 | Bayer Pharma Aktiengesellschaft | Antikūnai prieš c4.4a ir jų panaudojimas |
| MX347515B (es) | 2010-04-01 | 2017-04-28 | Oncomed Pharmaceuticals Inc * | Agentes que se unen al receptor encrespado y usos de los mismos. |
| CA2796464C (en) | 2010-04-16 | 2021-08-03 | Immune Disease Institute, Inc. | Sustained polypeptide expression from synthetic, modified rnas and uses thereof |
| HRP20220796T1 (hr) | 2010-10-01 | 2022-10-14 | ModernaTX, Inc. | Ribonukleinske kiseline koje sadrže n1-metil-pseudouracil i njihove uporabe |
| HUE041335T2 (hu) | 2011-03-29 | 2019-05-28 | Roche Glycart Ag | Antitest FC-variánsok |
| WO2012138453A1 (en) | 2011-04-03 | 2012-10-11 | The General Hospital Corporation | Efficient protein expression in vivo using modified rna (mod-rna) |
| GB201106395D0 (en) * | 2011-04-14 | 2011-06-01 | Hubrecht Inst | Compounds |
| EP3492109B1 (en) | 2011-10-03 | 2020-03-04 | ModernaTX, Inc. | Modified nucleosides, nucleotides, and nucleic acids, and uses thereof |
| WO2013071047A1 (en) | 2011-11-11 | 2013-05-16 | Children's Medical Center Corporation | Compositions and methods for in vitro transcription of rna |
| WO2013078199A2 (en) | 2011-11-23 | 2013-05-30 | Children's Medical Center Corporation | Methods for enhanced in vivo delivery of synthetic, modified rnas |
| CA2868391A1 (en) | 2012-04-02 | 2013-10-10 | Stephane Bancel | Polynucleotides comprising n1-methyl-pseudouridine and methods for preparing the same |
| CN109705218B (zh) | 2012-08-09 | 2022-07-19 | 罗切格利卡特公司 | Asgpr抗体及其用途 |
| PL2922554T3 (pl) | 2012-11-26 | 2022-06-20 | Modernatx, Inc. | Na zmodyfikowany na końcach |
| EP2931319B1 (en) | 2012-12-13 | 2019-08-21 | ModernaTX, Inc. | Modified nucleic acid molecules and uses thereof |
| US20160022840A1 (en) | 2013-03-09 | 2016-01-28 | Moderna Therapeutics, Inc. | Heterologous untranslated regions for mrna |
| KR20170010764A (ko) * | 2014-04-21 | 2017-02-01 | 애브비 스템센트알엑스 엘엘씨 | 신규한 항-rnf43 항체 및 사용 방법 |
| WO2016040895A1 (en) | 2014-09-12 | 2016-03-17 | xxTHE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY | Wnt signaling agonist molecules |
| SG11201703403TA (en) | 2014-10-27 | 2017-05-30 | Agency Science Tech & Res | Anti-tim-3 antibodies |
| WO2016073879A2 (en) | 2014-11-06 | 2016-05-12 | Scholar Rock, Inc. | Transforming growth factor-related antibodies and uses thereof |
| EP3221361B1 (en) | 2014-11-19 | 2021-04-21 | Genentech, Inc. | Anti-transferrin receptor / anti-bace1 multispecific antibodies and methods of use |
| SI3365373T1 (sl) * | 2015-10-23 | 2021-08-31 | Merus N.V. | Vezne molekule, ki zaviranjo rast raka |
| DK3386534T3 (da) | 2015-12-08 | 2020-11-30 | Regeneron Pharma | Sammensætninger og fremgangsmåder til internalisering af enzymer |
| US20170349659A1 (en) | 2016-06-03 | 2017-12-07 | The Board Of Trustees Of The Leland Stanford Junior University | Wnt signaling agonist molecules |
| WO2018107116A1 (en) | 2016-12-09 | 2018-06-14 | Abbvie Stemcentrx Llc | Methods of reducing toxicity of antibody drug conjugates, and compositions produced thereby |
| WO2018132572A1 (en) | 2017-01-11 | 2018-07-19 | The Board Of Trustees Of The Leland Stanford Junior University | R-spondin (rspo) surrogate molecules |
| AU2018211985A1 (en) | 2017-01-26 | 2019-07-18 | Surrozen Operating, Inc. | Tissue-specific Wnt signal enhancing molecules and uses thereof |
| US20200123256A1 (en) | 2017-05-02 | 2020-04-23 | Chugai Seiyaku Kabushiki Kaisha | Cytotoxicity-inducing therapeutic agent |
| GB201708330D0 (en) | 2017-05-24 | 2017-07-05 | Koninklijke Nederlandse Akademie Van Wetenschappen | Fusion protein for enhancing intestinal regeneration |
| WO2019126401A1 (en) | 2017-12-19 | 2019-06-27 | Surrozen, Inc. | Anti-lrp5/6 antibodies and methods of use |
| EP3728323A4 (en) | 2017-12-19 | 2022-01-26 | Surrozen Operating, Inc. | ANTI-FZD ANTIBODIES AND METHODS OF USE |
| US11773171B2 (en) | 2017-12-19 | 2023-10-03 | Surrozen Operating, Inc. | WNT surrogate molecules and uses thereof |
| EP3820906A4 (en) | 2018-07-05 | 2022-04-20 | Surrozen Operating, Inc. | MULTISPECIFIC WNT SUBSTITUTES AND USES THEREOF |
| JP2021530223A (ja) | 2018-07-09 | 2021-11-11 | スロゼン, インコーポレイテッド | 組織特異性Wntシグナル増強分子及びその使用 |
| WO2020132356A1 (en) | 2018-12-19 | 2020-06-25 | Surrozen, Inc. | Antigen binding formats for receptor complexes |
| JP2022520084A (ja) | 2019-02-11 | 2022-03-28 | スロゼン オペレーティング, インコーポレイテッド | 眼障害におけるwntシグナル伝達の調節 |
| KR20210138023A (ko) | 2019-03-11 | 2021-11-18 | 서로젠, 인크. | 위장 장애에서 wnt 신호 전달의 조절 |
| WO2020206005A1 (en) | 2019-04-02 | 2020-10-08 | Surrozen, Inc. | Modulation of wnt signaling in auditory disorders |
| KR20220024460A (ko) | 2019-06-11 | 2022-03-03 | 안틀라 테라퓨틱스 아이엔씨. | 다가 fzd 및 wnt 결합 분자 및 이의 용도 |
| US11050604B2 (en) | 2019-07-01 | 2021-06-29 | Rampart Communications, Inc. | Systems, methods and apparatuses for modulation-agnostic unitary braid division multiplexing signal transformation |
| CN115427446A (zh) | 2020-02-24 | 2022-12-02 | 瑟罗泽恩奥普瑞汀公司 | Wnt超级激动剂 |
| EP4243878A1 (en) | 2020-11-16 | 2023-09-20 | Surrozen Operating, Inc. | Liver-specific wnt signal enhancing molecules and uses thereof |
| US20240150473A1 (en) | 2021-03-10 | 2024-05-09 | Surrozen Operating, Inc. | Modulation of wnt signaling in gastrointestinal disorders |
-
2018
- 2018-01-26 AU AU2018211985A patent/AU2018211985A1/en active Pending
- 2018-01-26 JP JP2019541341A patent/JP7305543B2/ja active Active
- 2018-01-26 EP EP18744610.9A patent/EP3574019A4/en active Pending
- 2018-01-26 US US16/481,001 patent/US11958891B2/en active Active
- 2018-01-26 WO PCT/US2018/015595 patent/WO2018140821A1/en unknown
- 2018-01-26 CN CN201880008831.XA patent/CN110234662A/zh active Pending
- 2018-01-26 CA CA3050133A patent/CA3050133A1/en active Pending
-
2023
- 2023-03-31 JP JP2023057334A patent/JP2023078467A/ja active Pending
-
2024
- 2024-03-06 US US18/597,679 patent/US20240279303A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008093646A1 (ja) | 2007-02-01 | 2008-08-07 | National University Corporation NARA Institute of Science and Technology | Wntシグナル伝達系活性化ペプチド |
| JP2014530816A (ja) | 2011-10-14 | 2014-11-20 | ノバルティスアーゲー | Wnt経路関連疾患のための抗体および方法 |
| JP2015511484A (ja) | 2012-02-28 | 2015-04-20 | ノバルティス アーゲー | RNF43変異ステータスを利用したWntシグナル伝達阻害剤の投与のためのがん患者選択法 |
Non-Patent Citations (1)
| Title |
|---|
| Dominik Witzigmann,Hepatology Resarch,2016年,46(7),686-696 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2023078467A (ja) | 2023-06-06 |
| EP3574019A1 (en) | 2019-12-04 |
| AU2018211985A1 (en) | 2019-07-18 |
| WO2018140821A1 (en) | 2018-08-02 |
| US20240279303A1 (en) | 2024-08-22 |
| US11958891B2 (en) | 2024-04-16 |
| US20200048324A1 (en) | 2020-02-13 |
| CN110234662A (zh) | 2019-09-13 |
| JP2020506701A (ja) | 2020-03-05 |
| EP3574019A4 (en) | 2021-03-03 |
| CA3050133A1 (en) | 2018-08-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7305543B2 (ja) | 組織特異的Wntシグナル増強分子およびその使用 | |
| US20210380678A1 (en) | Tissue-specific wnt signal enhancing molecules and uses | |
| JP6783797B2 (ja) | 抗がん融合ポリペプチド | |
| KR101993714B1 (ko) | 대사 장애를 치료하는데 이용하기 위한 조성물과 방법 | |
| JP2023091081A (ja) | Wntシグナリングアゴニスト分子 | |
| JP6809789B2 (ja) | 疾患の治療または予防に用いるためのファクター1およびファクター2タンパク質、およびその阻害剤 | |
| US20230374090A1 (en) | Liver-specific wnt signal enhancing molecules and uses thereof | |
| CN115427446A (zh) | Wnt超级激动剂 | |
| CN112566940A (zh) | 多特异性wnt替代分子和其用途 | |
| US20230212240A1 (en) | Wnt signaling agonist molecules | |
| JP2023543232A (ja) | ヘッジホッグシグナル伝達経路の活性化のための強力な結合剤 | |
| JP2023509189A (ja) | Rspo1タンパク質およびその使用 | |
| US20240317867A1 (en) | Igfr-like 2 receptor and uses thereof | |
| CN116723867A (zh) | 肝脏特异性Wnt信号增强分子及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190927 Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190801 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210108 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210108 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220128 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220426 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220728 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20221003 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20221227 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230331 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230602 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230628 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7305543 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |