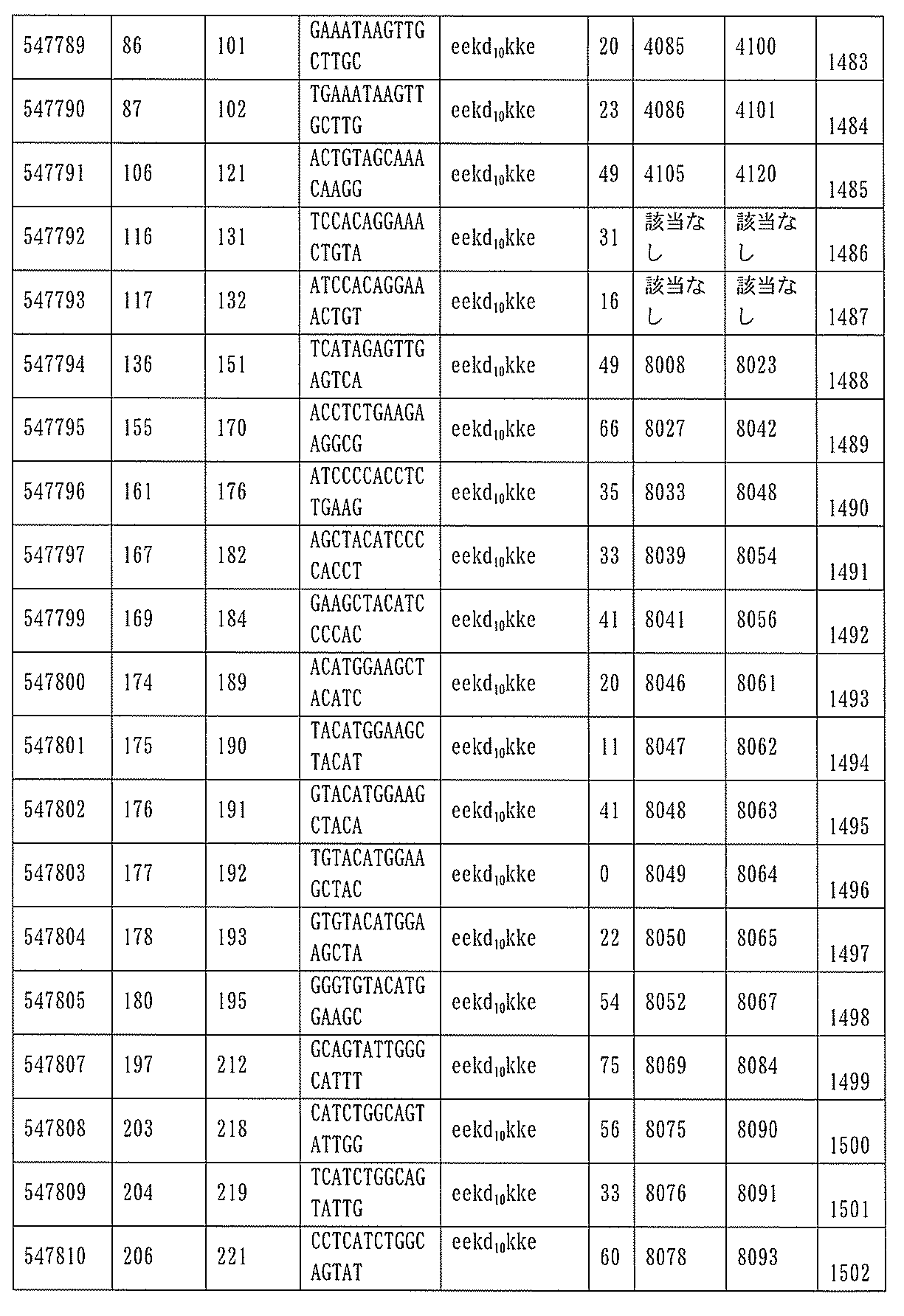
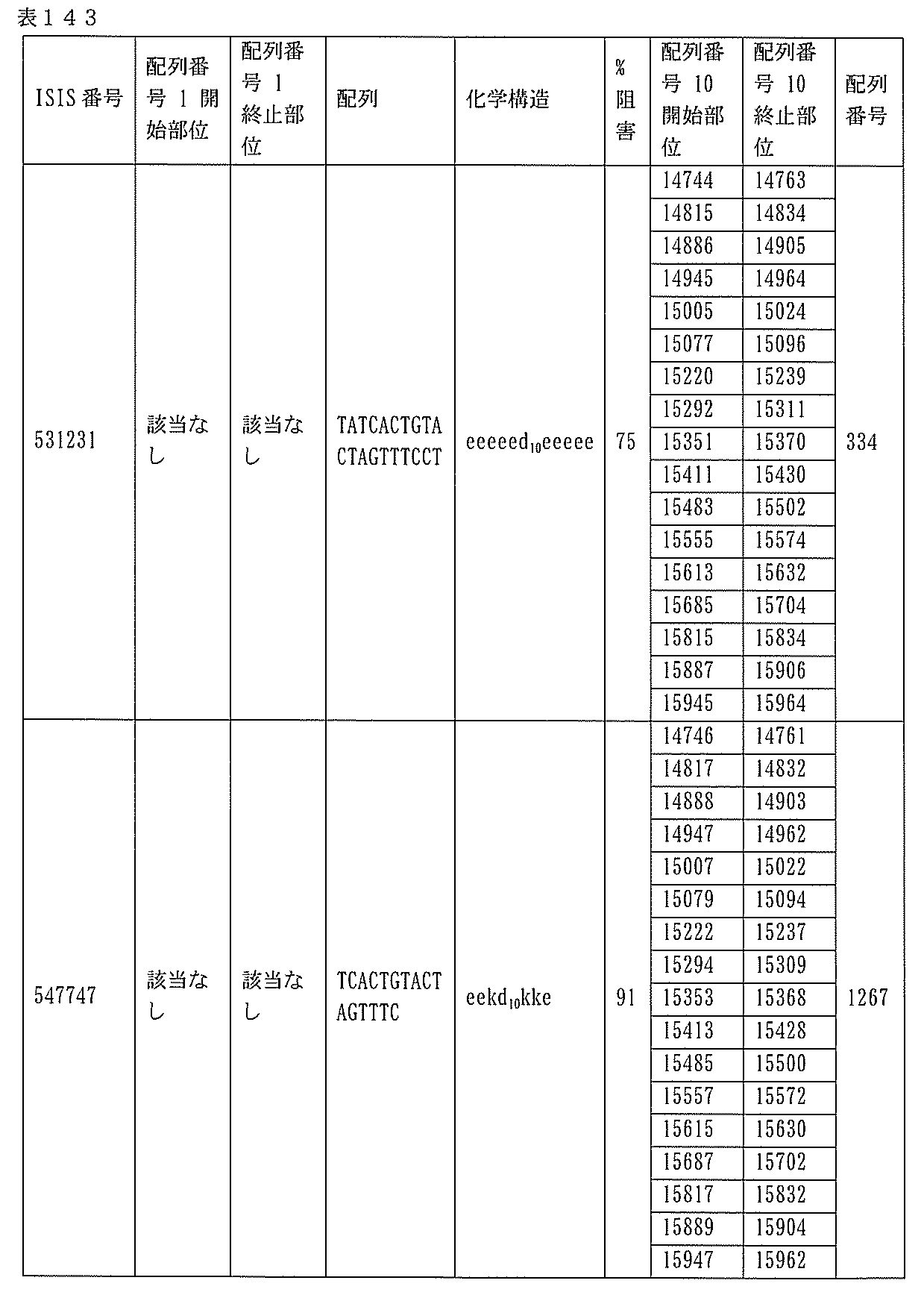
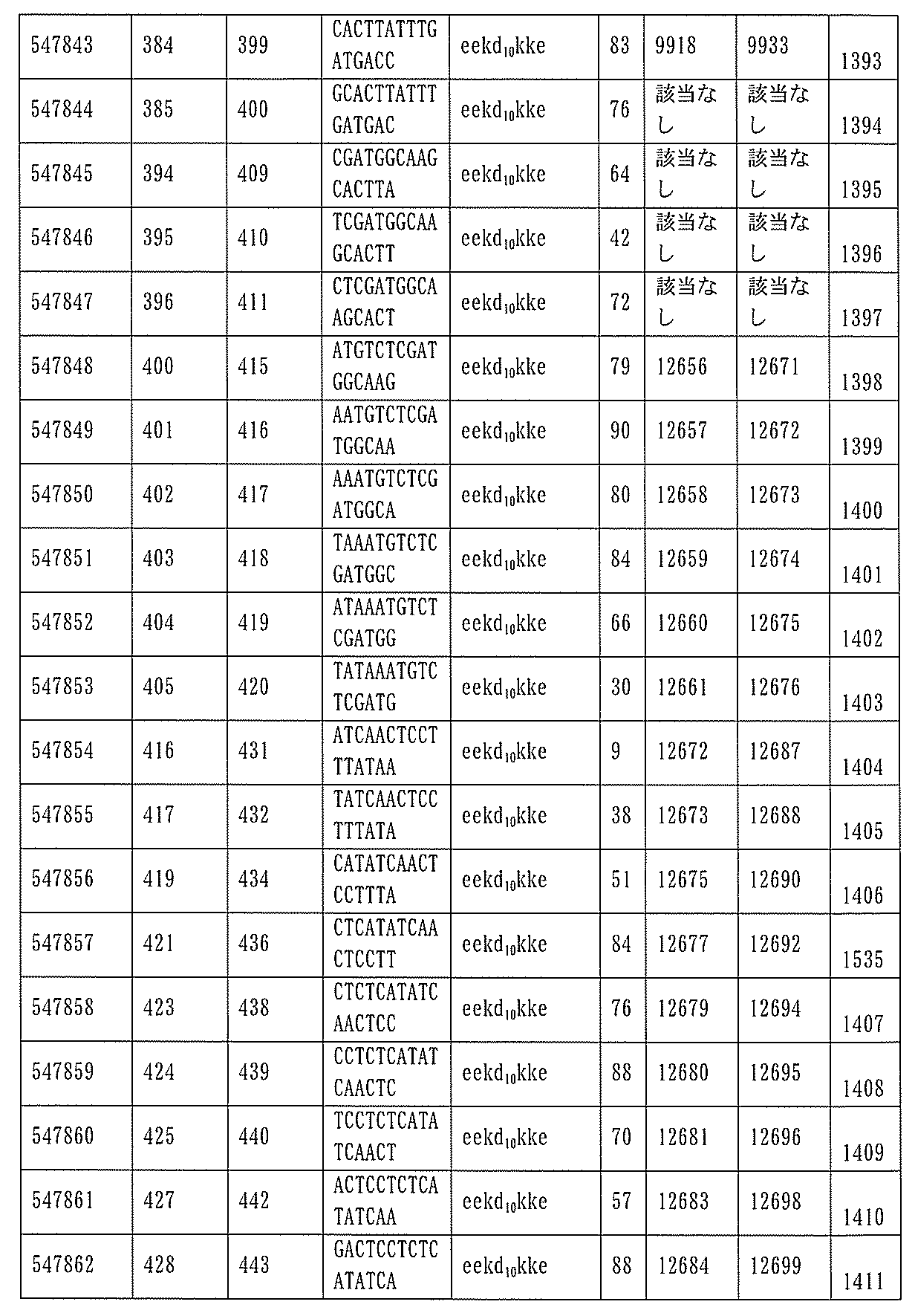
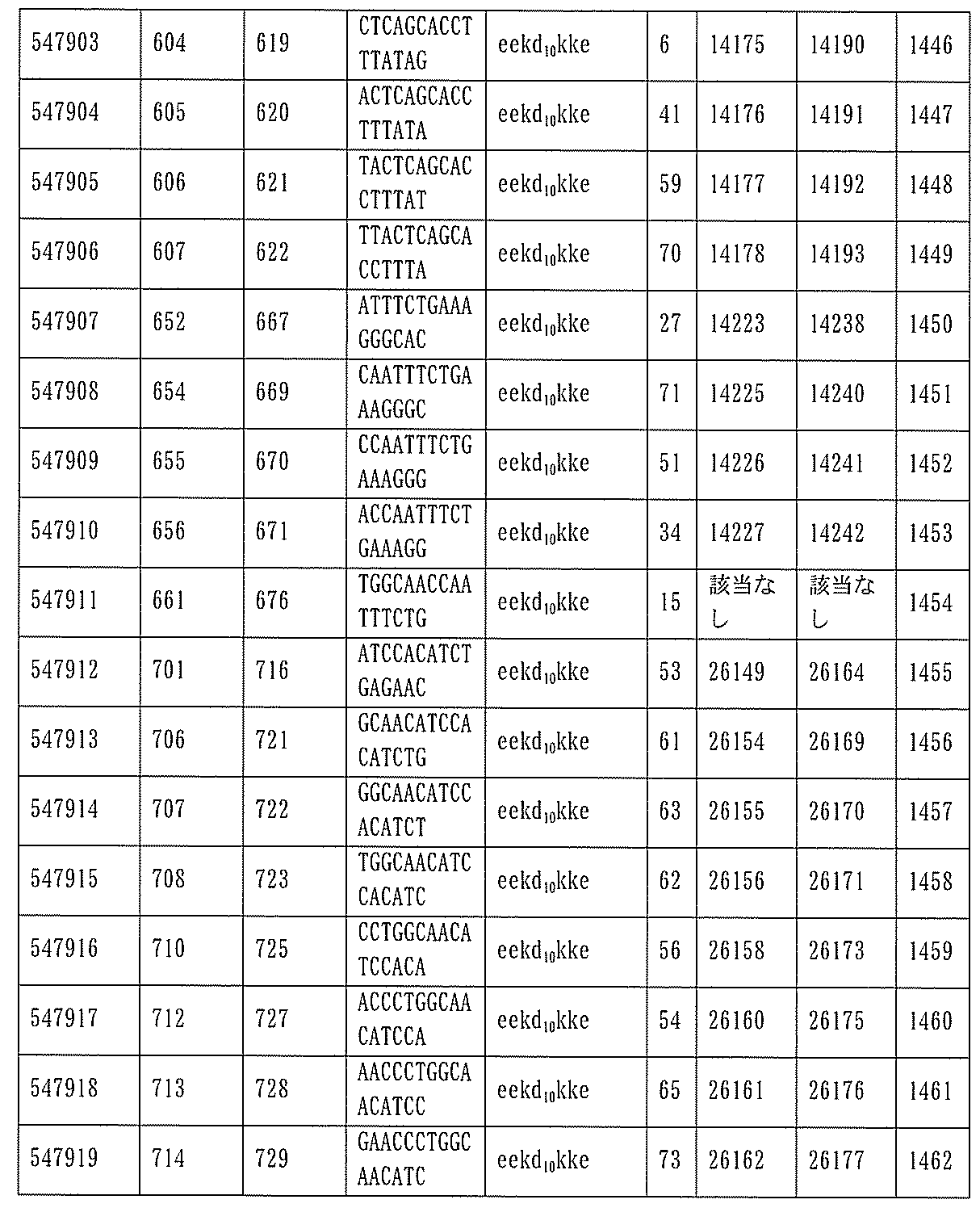
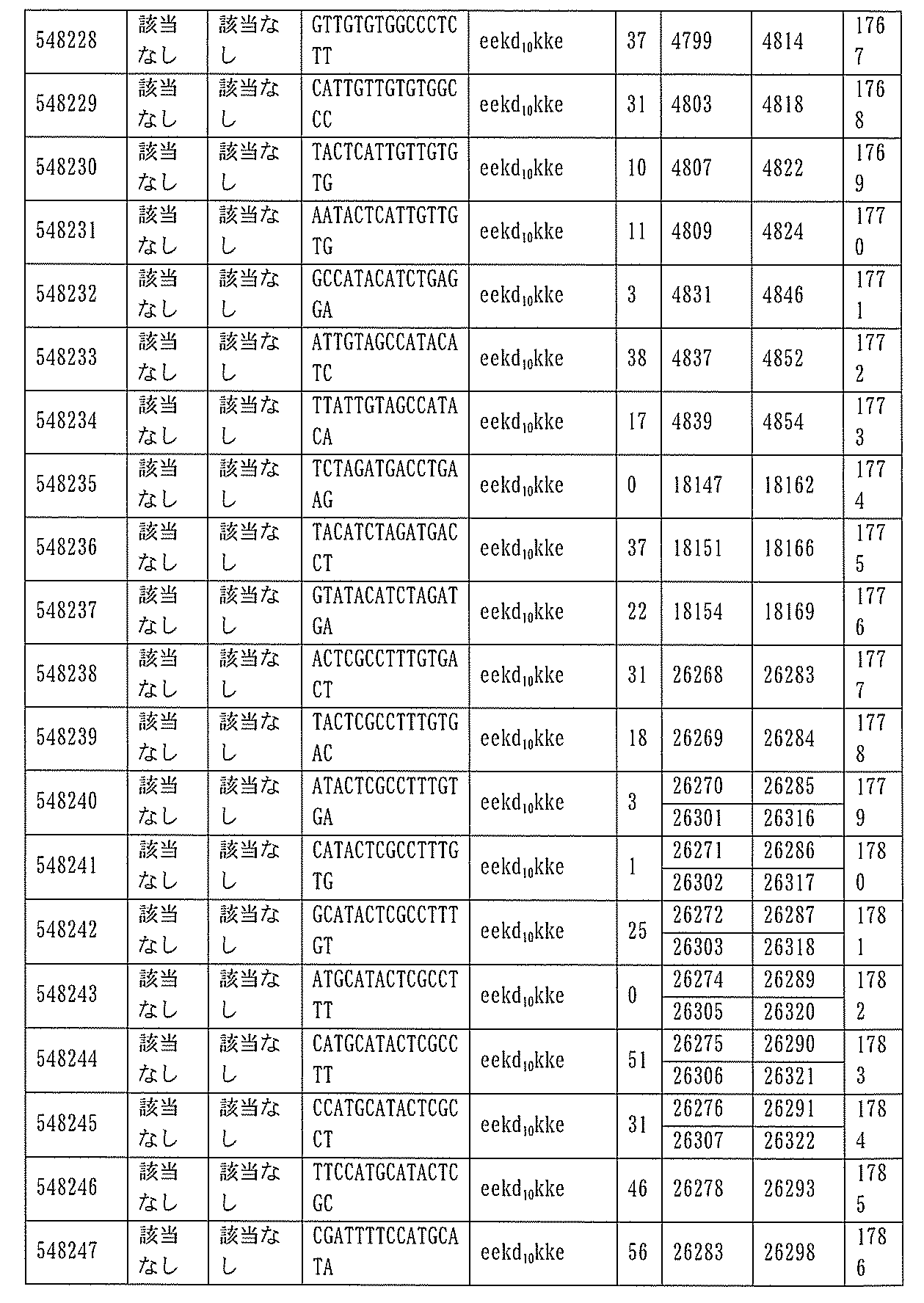
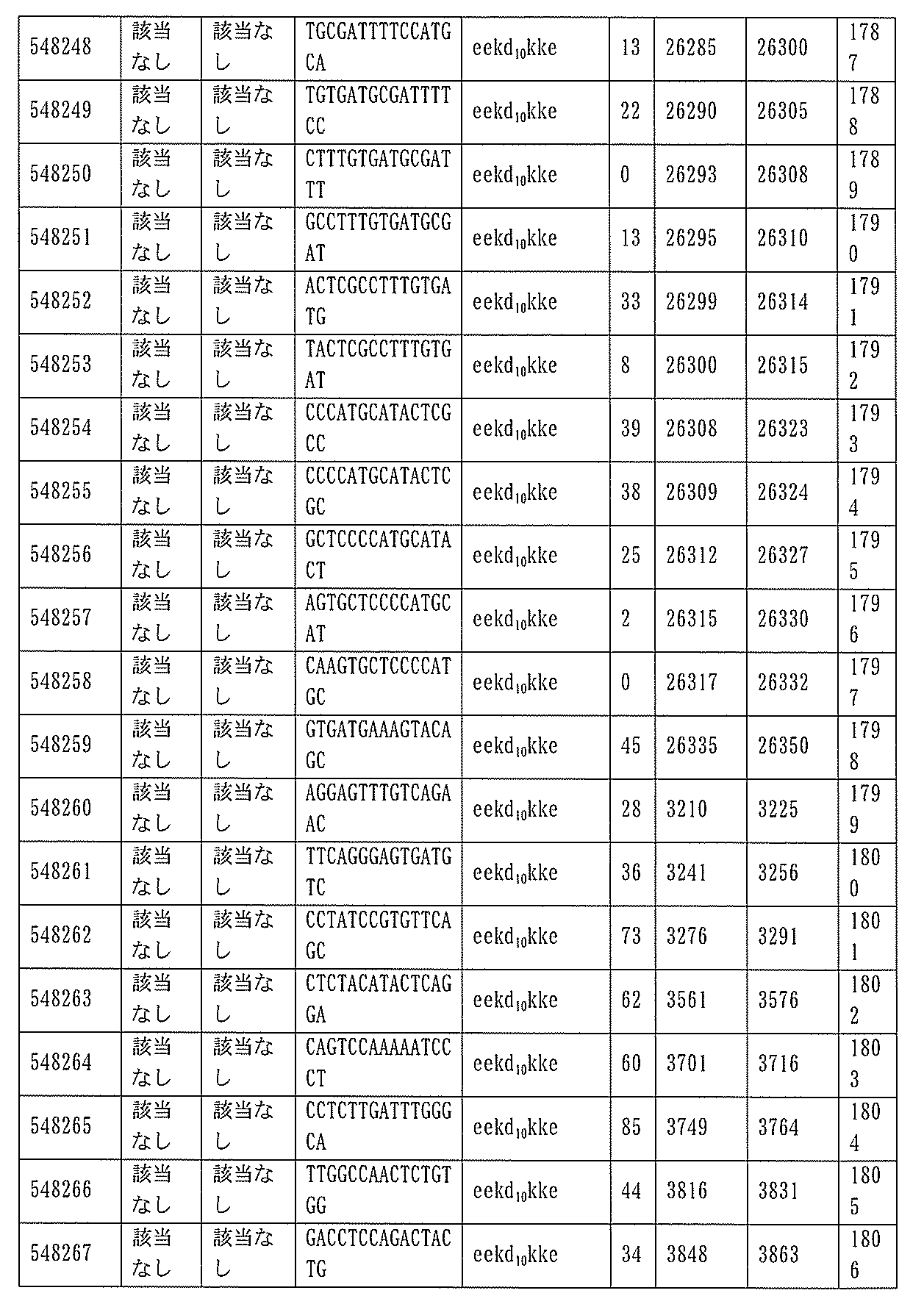
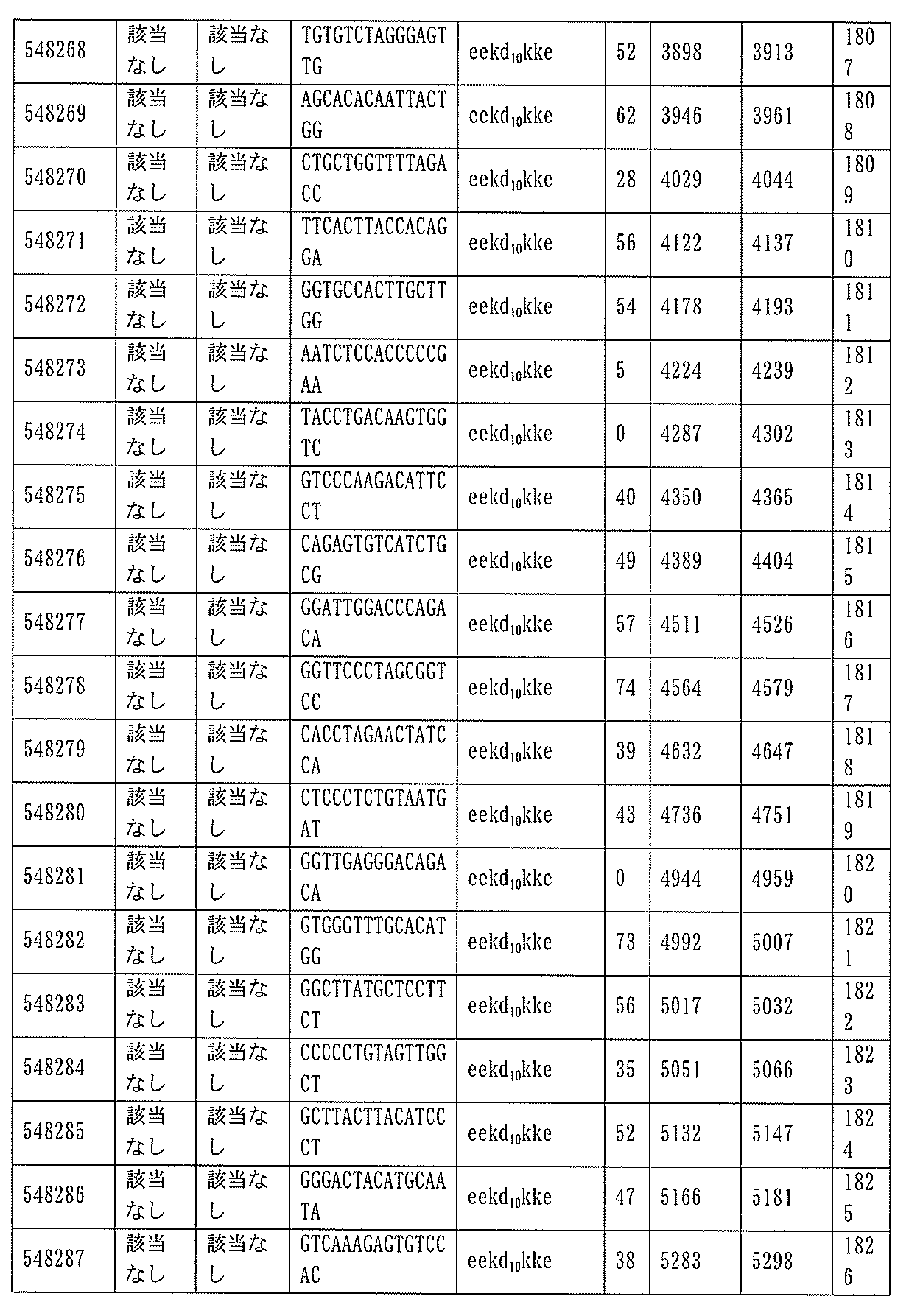
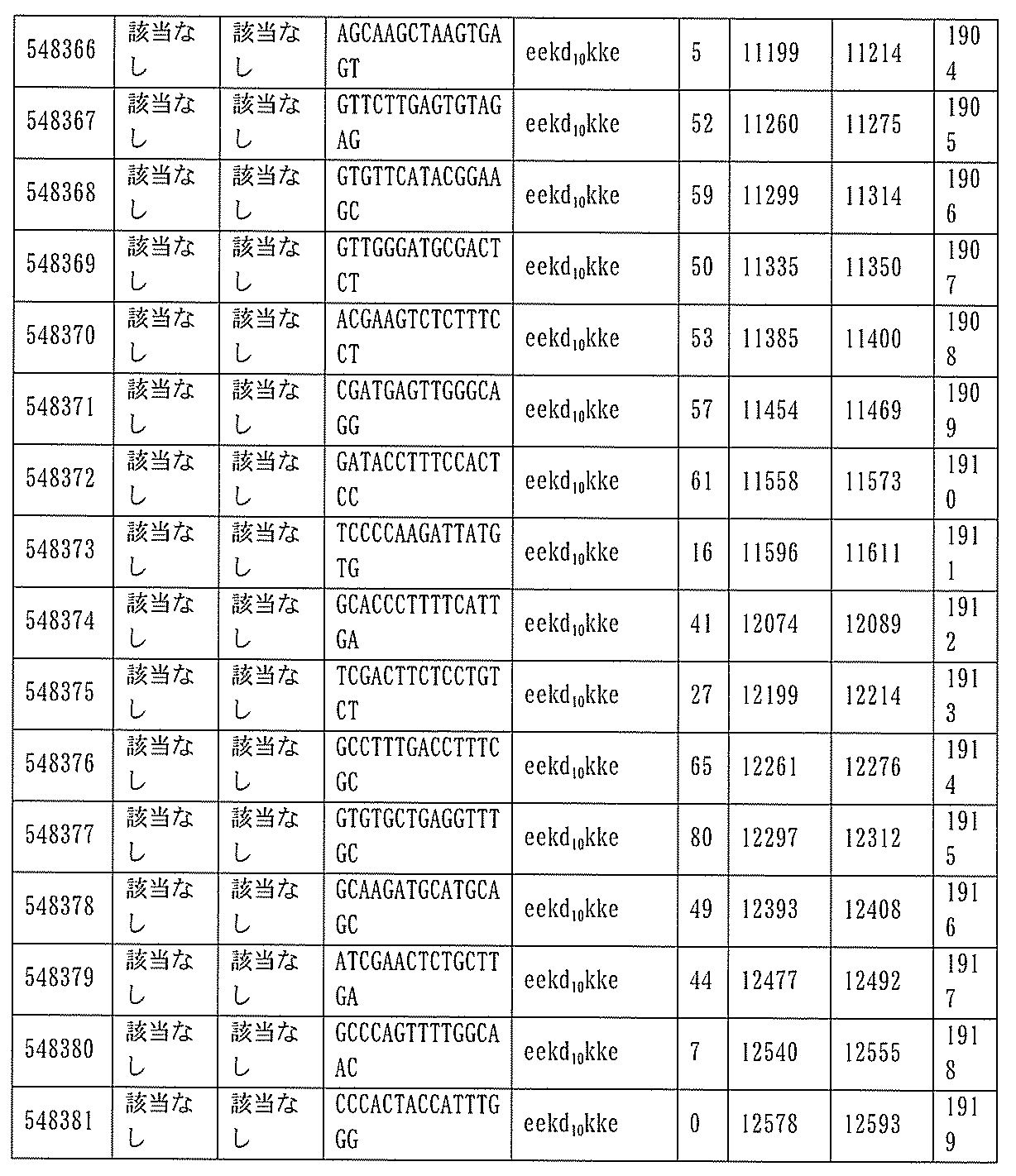
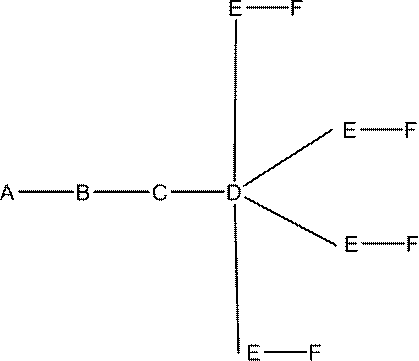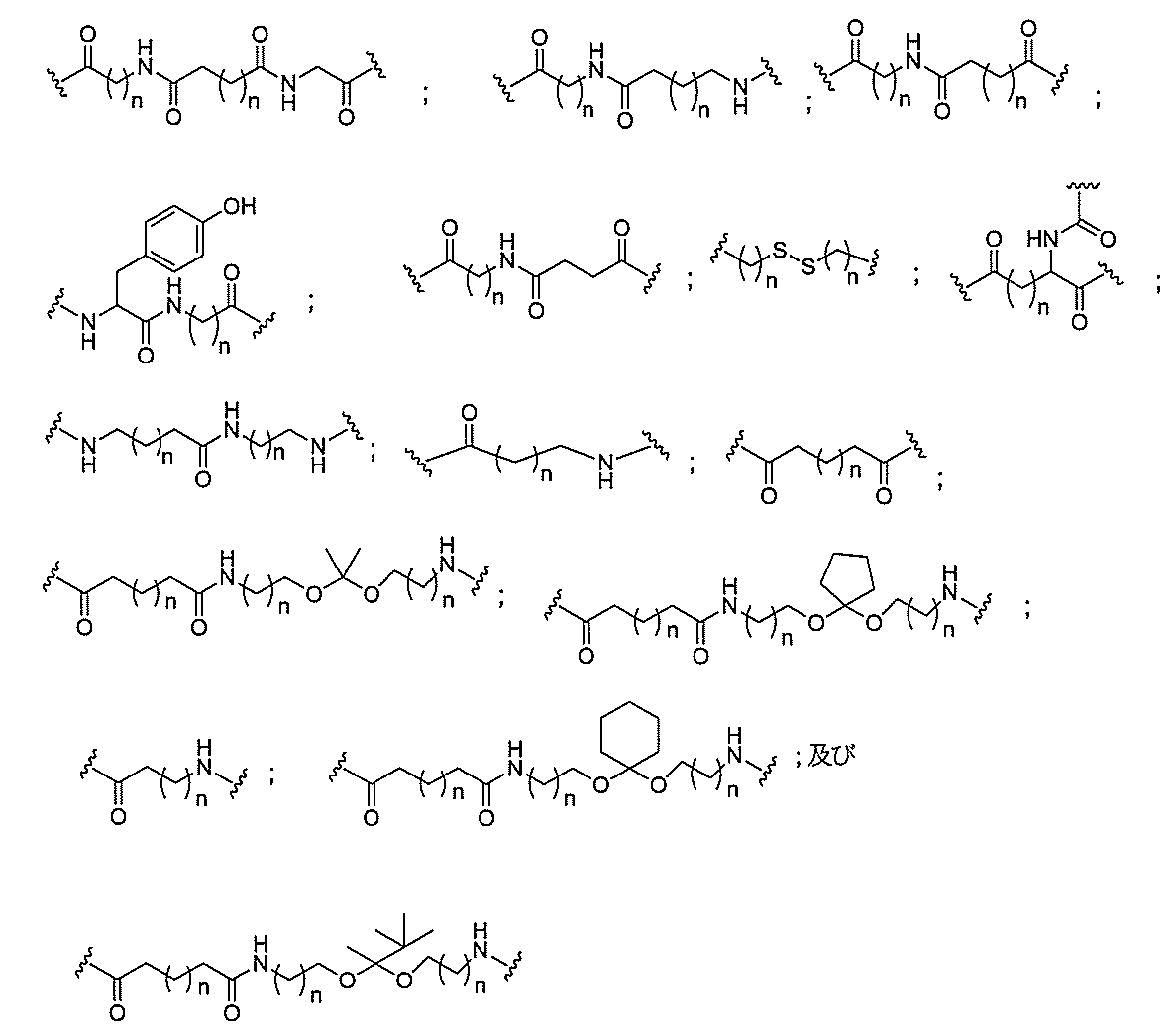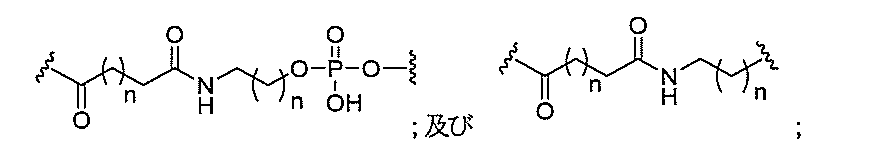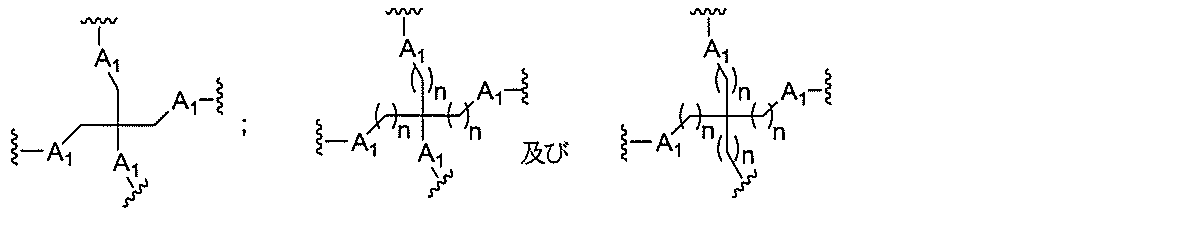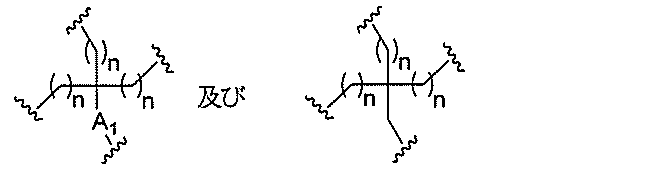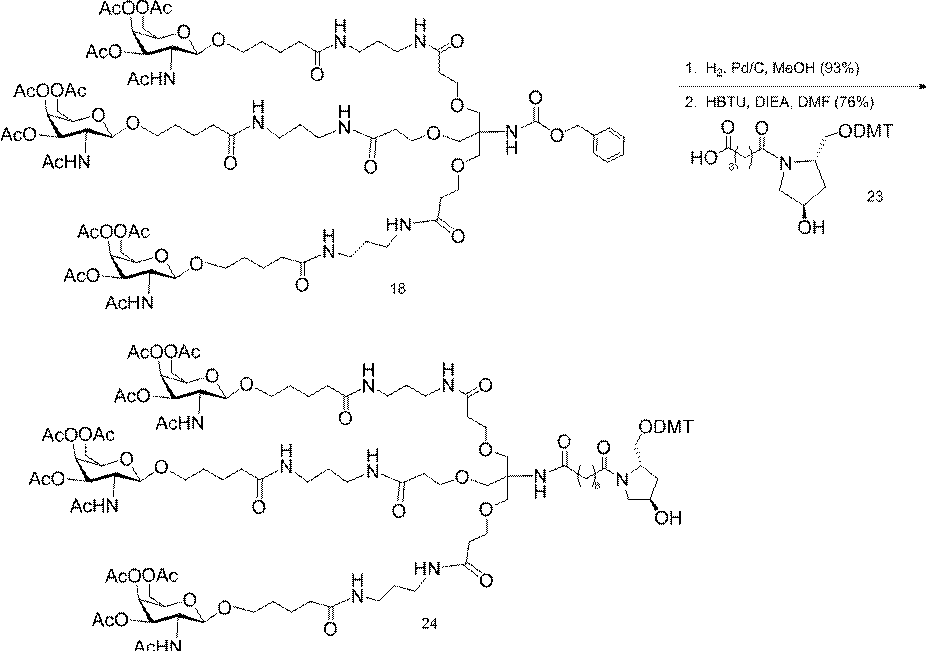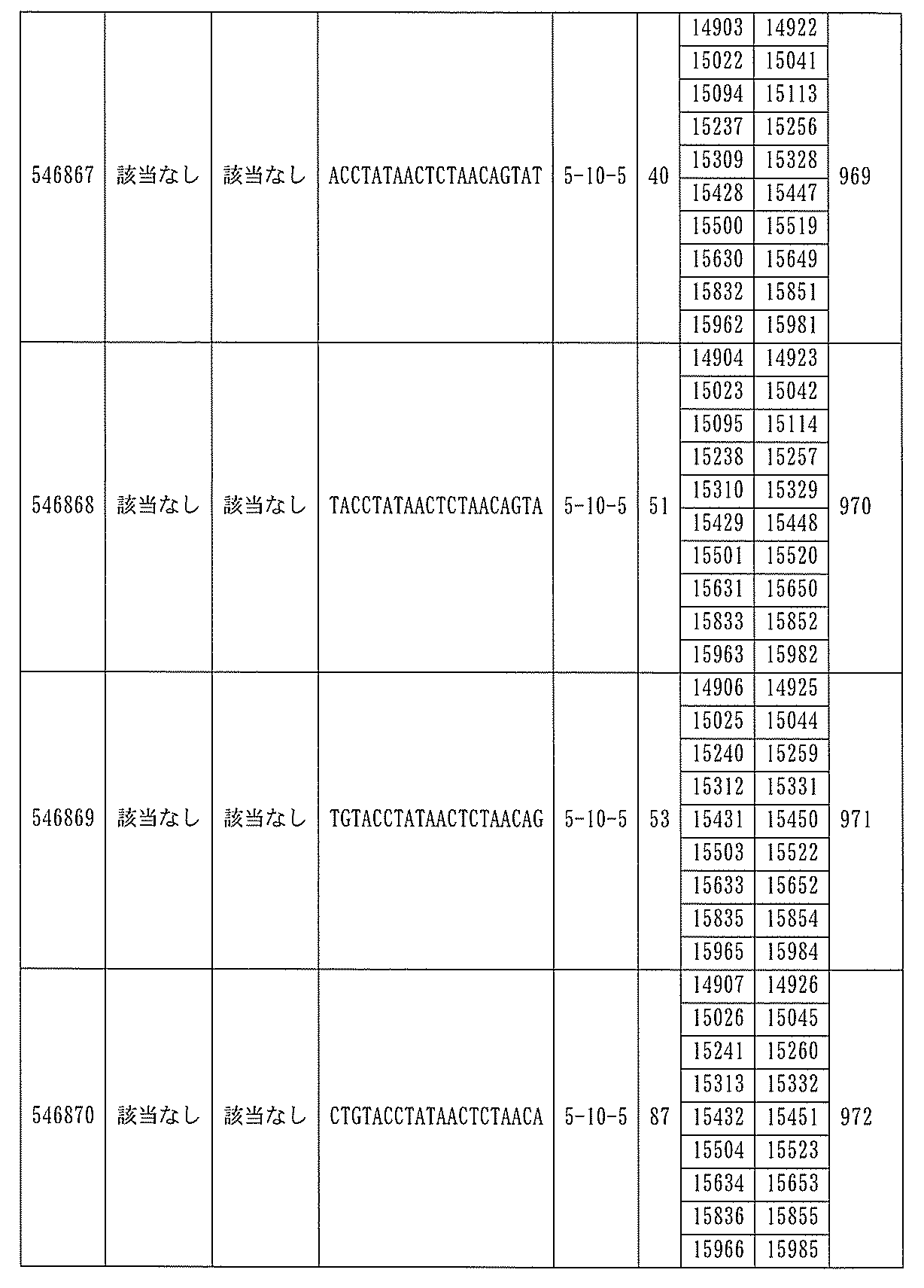JP7127076B2 - Pkk発現を調節するための組成物及び方法 - Google Patents
Pkk発現を調節するための組成物及び方法 Download PDFInfo
- Publication number
- JP7127076B2 JP7127076B2 JP2020025372A JP2020025372A JP7127076B2 JP 7127076 B2 JP7127076 B2 JP 7127076B2 JP 2020025372 A JP2020025372 A JP 2020025372A JP 2020025372 A JP2020025372 A JP 2020025372A JP 7127076 B2 JP7127076 B2 JP 7127076B2
- Authority
- JP
- Japan
- Prior art keywords
- certain embodiments
- modified
- compound
- modified oligonucleotide
- antisense
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/555—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound pre-targeting systems involving an organic compound, other than a peptide, protein or antibody, for targeting specific cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/315—Phosphorothioates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/321—2'-O-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/322—2'-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/323—Chemical structure of the sugar modified ring structure
- C12N2310/3231—Chemical structure of the sugar modified ring structure having an additional ring, e.g. LNA, ENA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
- C12N2310/334—Modified C
- C12N2310/3341—5-Methylcytosine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/341—Gapmers, i.e. of the type ===---===
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/345—Spatial arrangement of the modifications having at least two different backbone modifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/346—Spatial arrangement of the modifications having a combination of backbone and sugar modifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3515—Lipophilic moiety, e.g. cholesterol
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/352—Nature of the modification linked to the nucleic acid via a carbon atom
- C12N2310/3525—MOE, methoxyethoxy
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Virology (AREA)
- Epidemiology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Rheumatology (AREA)
- Vascular Medicine (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Pulmonology (AREA)
- Urology & Nephrology (AREA)
- Pain & Pain Management (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
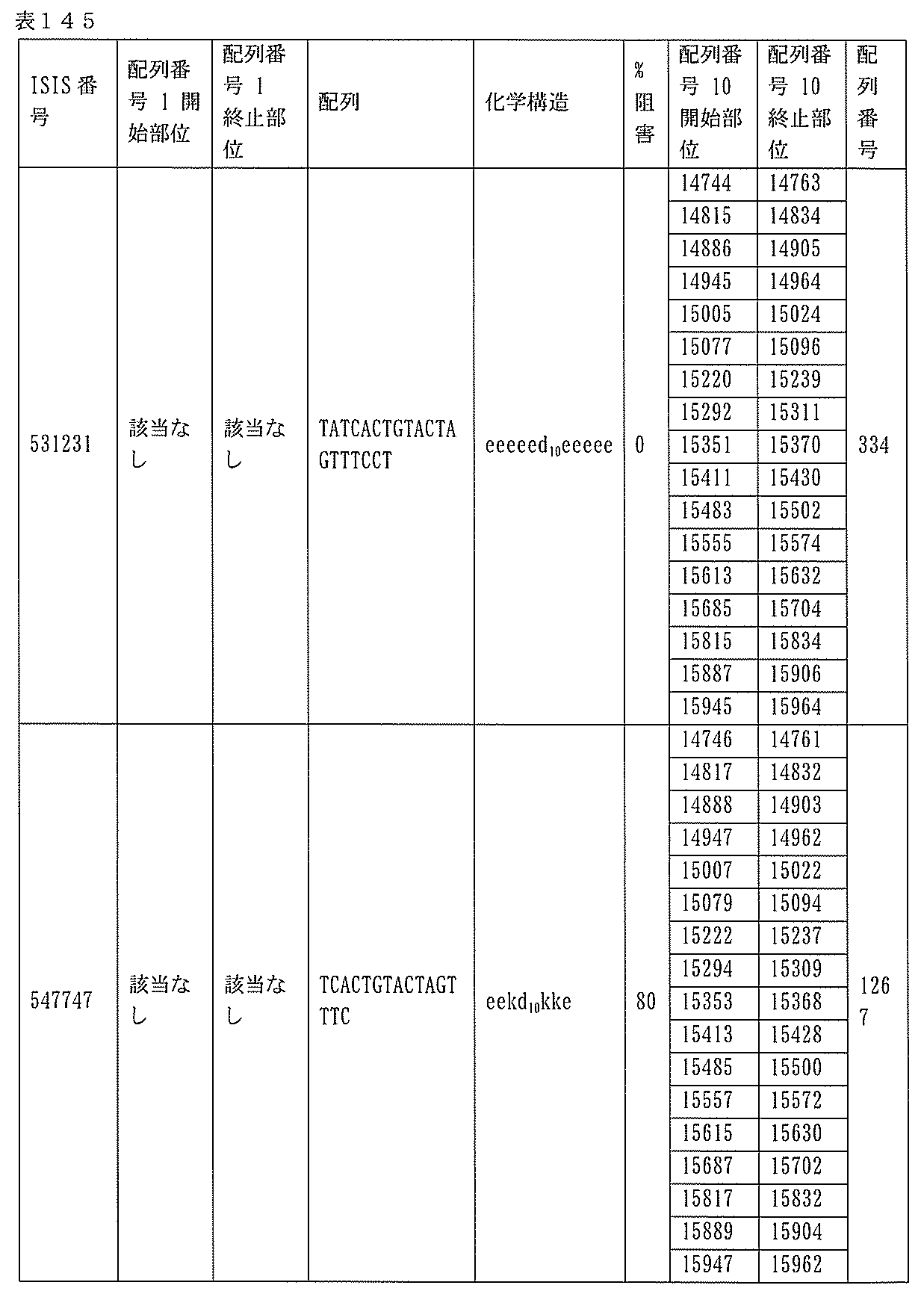
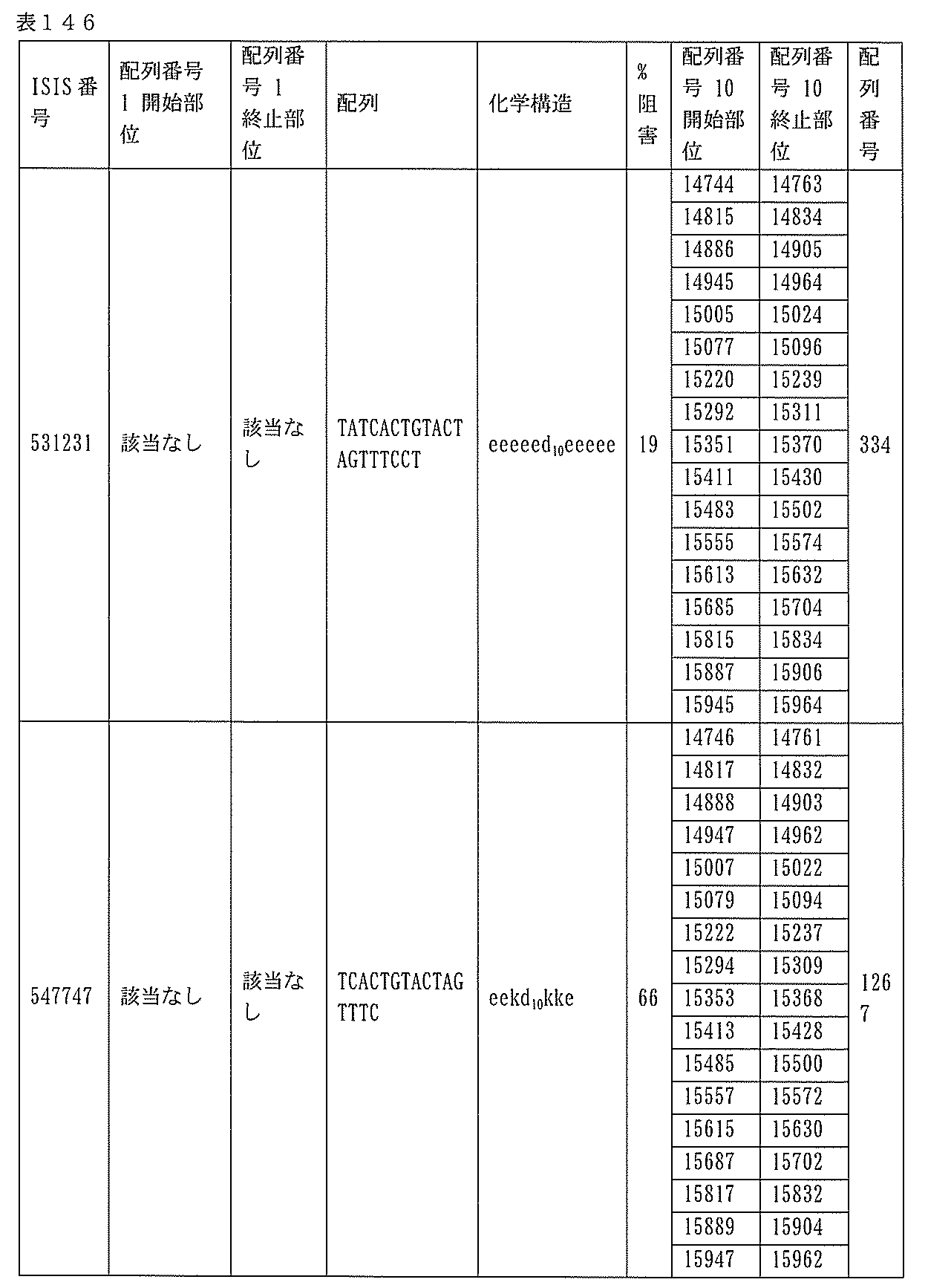
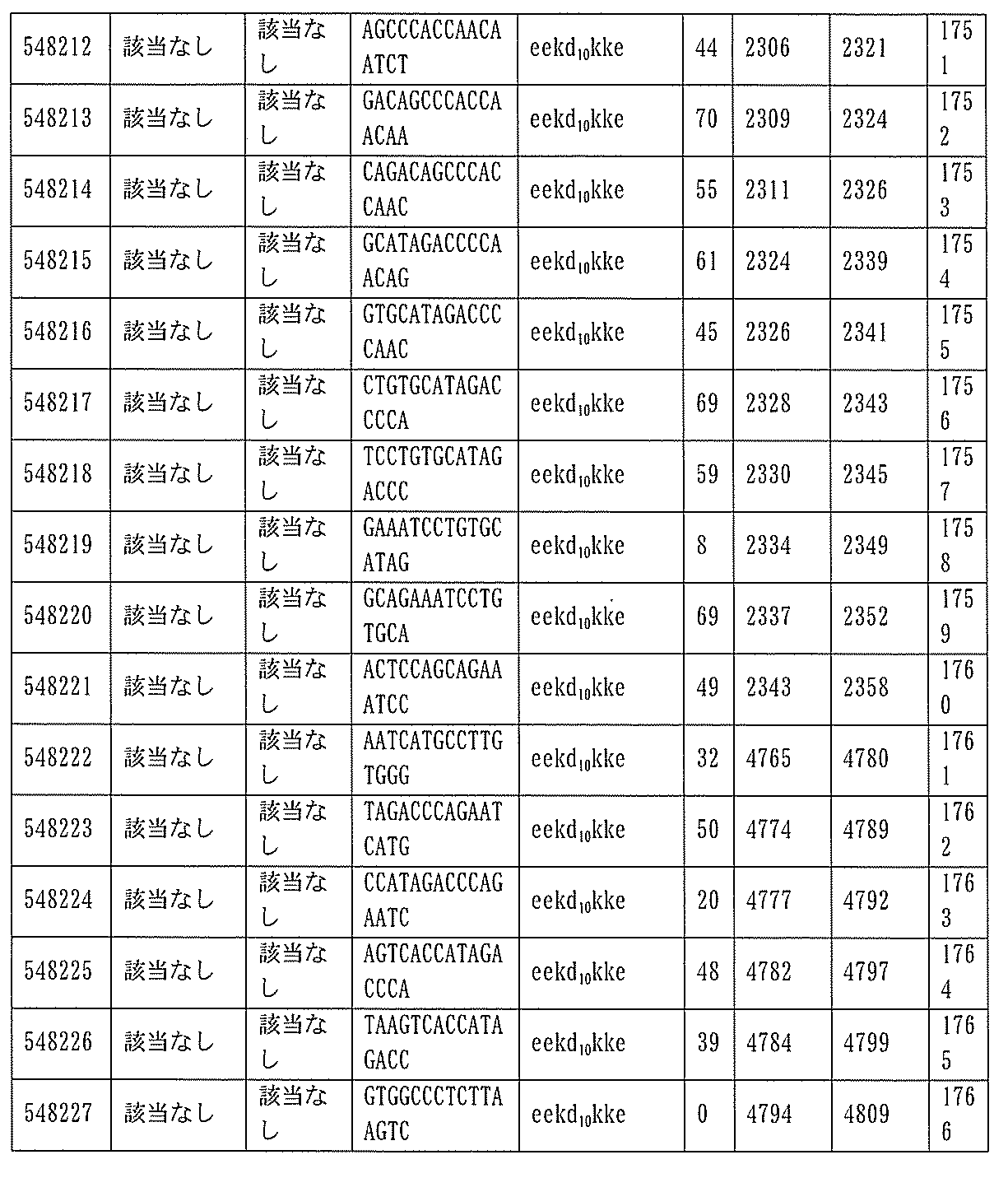
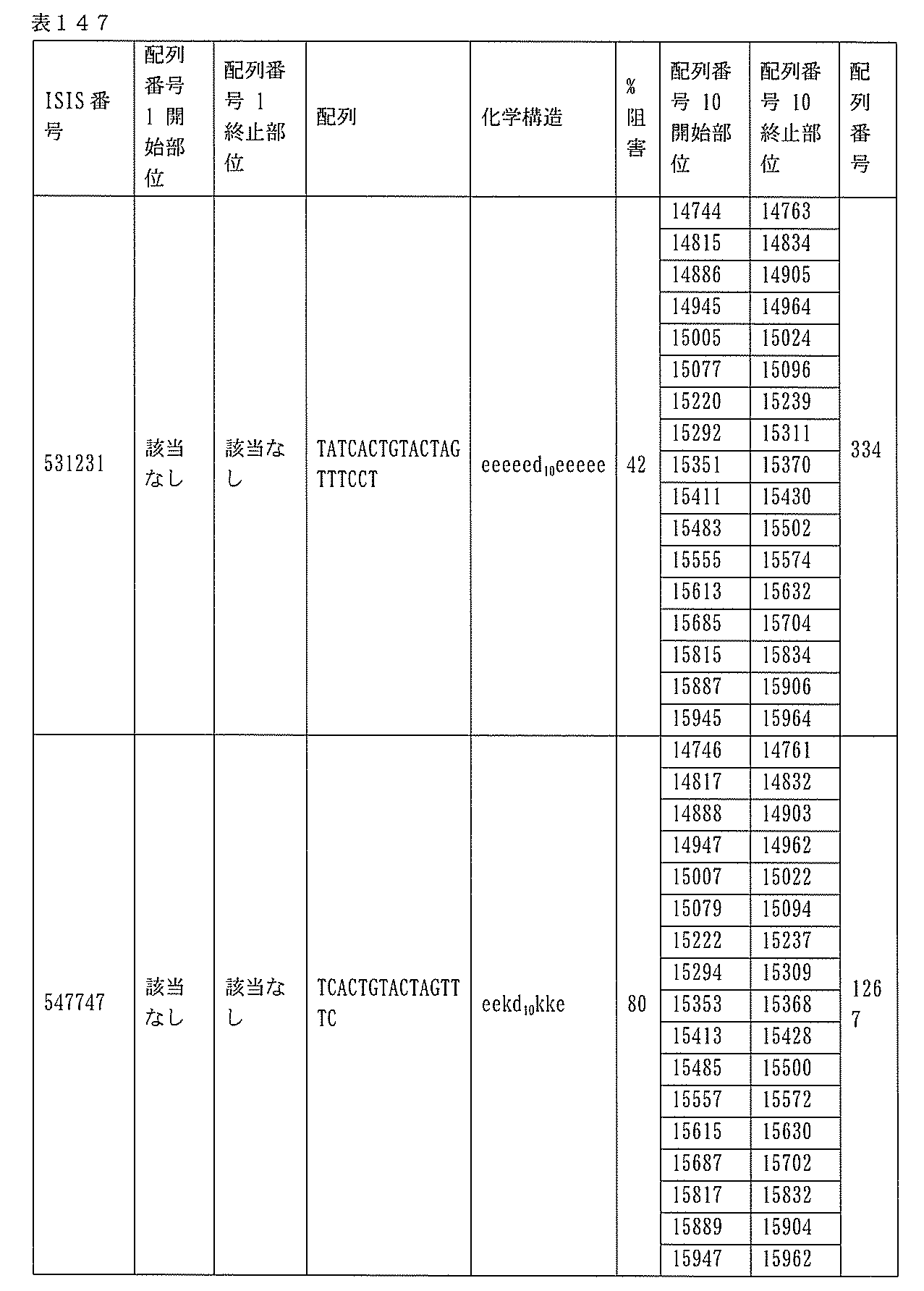
本願は、電子形式の配列表とともに出願されている。この配列表は、2015年4月27日に作成されたサイズ約636kbのBIOL0252WOSEQ_ST25.txtという名称のファイルとして提供される。この配列表の電子形式の情報は、参照によりその全体が本明細書に組み込まれる。
本明細書は、動物においてヒト血漿プレカリクレイン(PKK)mRNA及びタンパク質の発現を減少させるための化合物、組成物、及び方法を提供する。当該組成物及び方法は、炎症性及び血栓塞栓症病態を治療、予防、または改善するのに有用である。
及び環境因子を含む。ある特定の実施形態では、対象は、変異補体1エステラーゼ阻害剤(C1-INH)遺伝子または変異因子12遺伝子を有する。ある特定の実施形態では、当該対象は、アンジオテンシン変換酵素阻害剤(ACE阻害剤)、またはアンギオテンシンII受容体遮断薬(ARB)を摂取したことがあるか、摂取している。ある特定の実施形態では、対象は、血管性浮腫を引き起こすアレルギー反応があった。ある特定の実施形態では、対象は、I型HAEを有している。ある特定の実施形態では、対象は、II型HAEを有している。ある特定の実施形態では、対象は、III型HAEを有している。
[図面の簡単な説明]
[図2]実施例127に記載する、血液試料からの、HMWKのウエスタンブロット定量を示す。
当該一般的な説明及び以下の詳細な説明はどちらも例示的かつ説明的であるにすぎず、本願に係る発明を限定するものではないと理解すべきである。本明細書において、単数形の使用は、別段の明示がある場合を除き、複数形を含む。本明細書において「または(or)」の使用は、別段の言明がある場合を除き、「及び/または(and/or)」を意味する。さらに、「~を含む(including)」という用語、ならびに「~を含む(includes)」及び「含まれる(included)」などの他の形態の使用は、限定的ではない。また、「要素」または「成分」などの用語は、別段の明示がある場合を除き、1つのユニットを含む要素及び成分と2つ以上のサブユニットを含む要素及び成分をどちらも包含する。
o.,ペンシルベニア州イーストン,第21版,2005、及び「Antisense Drug Technology,Principles,Strategies,and Applications」Stanley T.Crooke編,CRC Press,フロリダ州ボカラトン、ならびにSambrook et al.,「Molecular Cloning,A laboratory Manual」第2版,Cold Spring Harbor Laboratory Press,1989に見いだすことができ、これらは、あらゆる目的のために参照により本明細書に組み込まれる。許容される場合、本開示の全体を通して言及する特許、出願、公開された出願、及び他の出版物、ならびに他のデータはすべて、参照によりそれらの全体が本明細書に組み込まれる。
特定の定義が与えられない限り、本明細書に記載する分析化学、合成有機化学、ならびに医化学及び製薬化学に関連して用いられる術語、ならびにそれらの手順及び技法は、周知であり、当技術分野で一般に使用されるものである。化学合成及び化学分析には、標準的技法を使用することができる。許可されている場合、本明細書出の開示全般を参照するすべての特許、出願、公開された出願及び他の刊行物、GENBANK寄託番号及び国立バイオテクノロジー情報センター(NCBI)及び他のデータ等のデータベースにより得られる関連の配列情報は、本明細書で検討する文書の部分を参照することにより、その全体が本明細書に組み込まれる。
意味する。5-メチルシトシンは修飾核酸塩基である。
化水素ラジカルを意味し、任意の2つの炭素原子の間の飽和度は、一重、二重、または三重結合である。脂肪族基は、好ましくは、1~約24個の炭素原子、より典型的には、1~約12個の炭素原子を含有し、1~約6個の炭素原子がより好ましい。脂肪族基の直鎖または分岐鎖は、窒素、酸素、硫黄、及びリンを含む2つ以上のヘテロ原子で中断されていてもよい。ヘテロ原子によって中断されているそのような脂肪族基には、ポリアルコキシ、例えば、ポリアルキレングリコール、ポリアミン、及びポリイミンが含まれるが、これらに限定されない。本明細書にいう脂肪族基は、場合によっては、さらなる置換基を含みうる。
hemistry,2003,(14):18-29、またはRensen et al.「Design and Synthesis of Novel N-Acetylgalactosamine-Terminated Glycolipids for
Targeting of Lipoproteins to the Hepatic Asiaglycoprotein Receptor」J.Med.Chem.2004,(47):5798-5808を参照のこと)。
プを排除しないことが理解される。
共役基に関連して「共役リンカー」または「リンカー」とは、任意の原子または原子団を含む共役基の一部分であって、(1)オリゴヌクレオチドを共役基の別の部分と共有結合で連結するか、または(2)共役基の2つ以上の部分を共有結合で連結するものを意味する。
(R1)(R2)]n-、-[C(R1)(R2)]n-O-、-C(R1R2)-N(R1)-O-または-C(R1R2)-O-N(R1)-が挙げられる。さらに、LNAの定義に含まれる他の架橋基は、4’-CH2-2’,4’-(CH2)2-2’,4’-(CH2)3-2’,4’-CH2-O-2’,4’-(CH2)2-O-2’,4’-CH2-O-N(R1)-2’及び4’-CH2-N(R1)-O-2’-架橋であり、各R1とR2は独立して、H、保護基、またはC1-C12アルキルである。
が取り付けられているフタルイミドのように、さらに置換基で置換することができる。単環式または多環式の環系は、環原子を介した直接結合、複数の環原子を介した縮合、置換基を介した結合、または二機能性連結部分を介した結合などといったさまざまな戦略を用いて、親分子に取り付けることができる。
ここで、
Ra及びRdはそれぞれ独立して、O、S、CH2、NH、またはNJ1であり、J1はC1-C6アルキルまたは置換C1-C6アルキルであり、
RbはOまたはSであり、
Rcは、OH、SH、C1-C6アルキル、置換C1-C6アルキル、C1-C6アル
コキシ、置換C1-C6アルコキシ、アミノまたは置換アミノであり、
J1は、Rbは、OまたはSである。
& Sons,Inc,ニューヨークに見いだすことができる。
チセンス化合物を意味する。
の1つの位置または2つ以上の位置に置換基を有する。置換基は、他の置換基でさらに置換されていてもよく、親化合物に直接取り付けるか、またはアルキル基もしくはヒドロカルビル基などの連結基を介して取り付けることができる。
またはin vivoのヌクレアーゼによる分解への抵抗等のオリゴヌクレオチドの特性を付加するために修飾された複数のヌクレオシドを意味する。
ある特定の実施形態は、血漿プレカリクレイン(PKK)mRNA及びタンパク質の発現を阻害するための化合物、組成物、及び方法を提供する。ある特定の実施形態は、PKK mRNA及びタンパク質レベルを減少させるための化合物、組成物、及び方法を提供する。
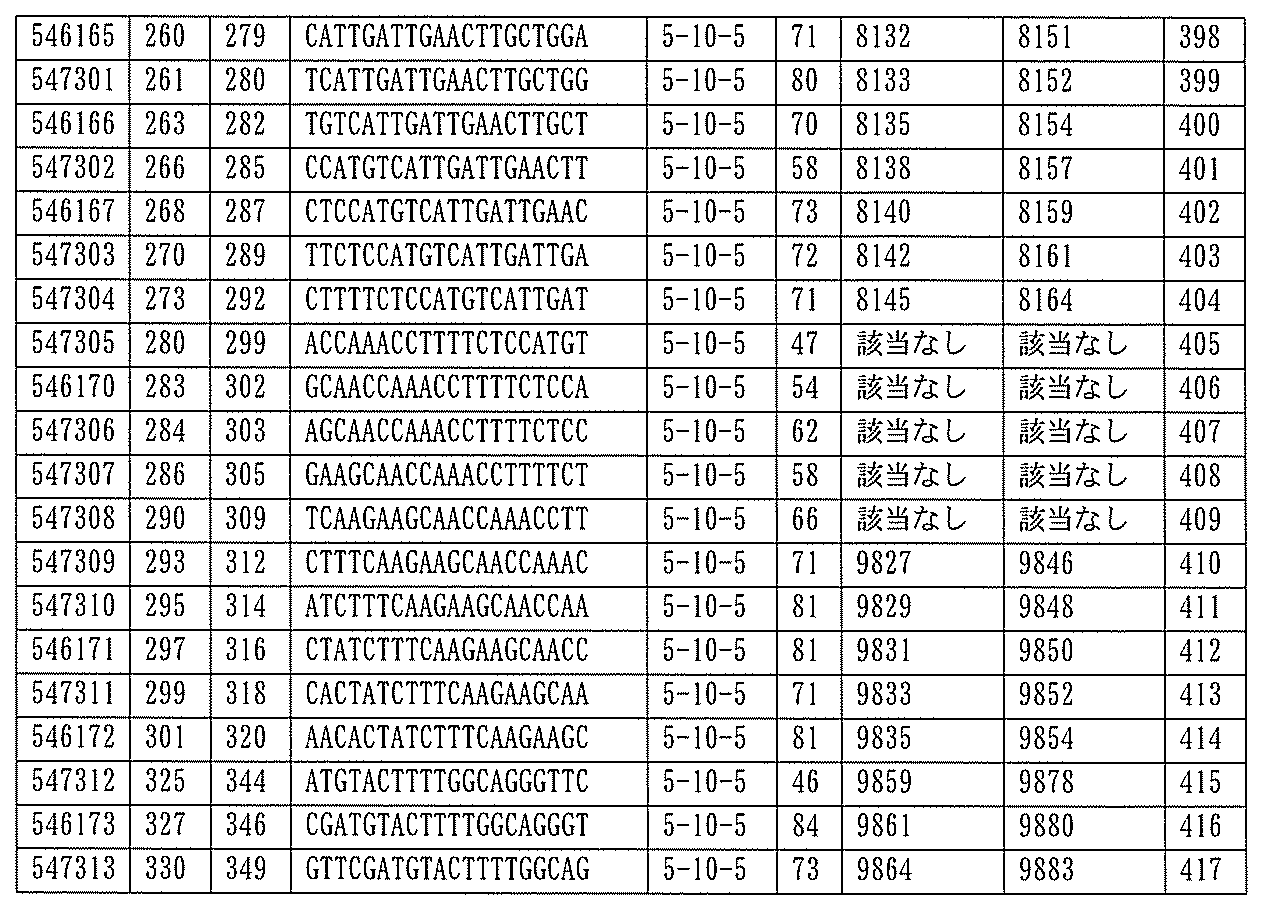
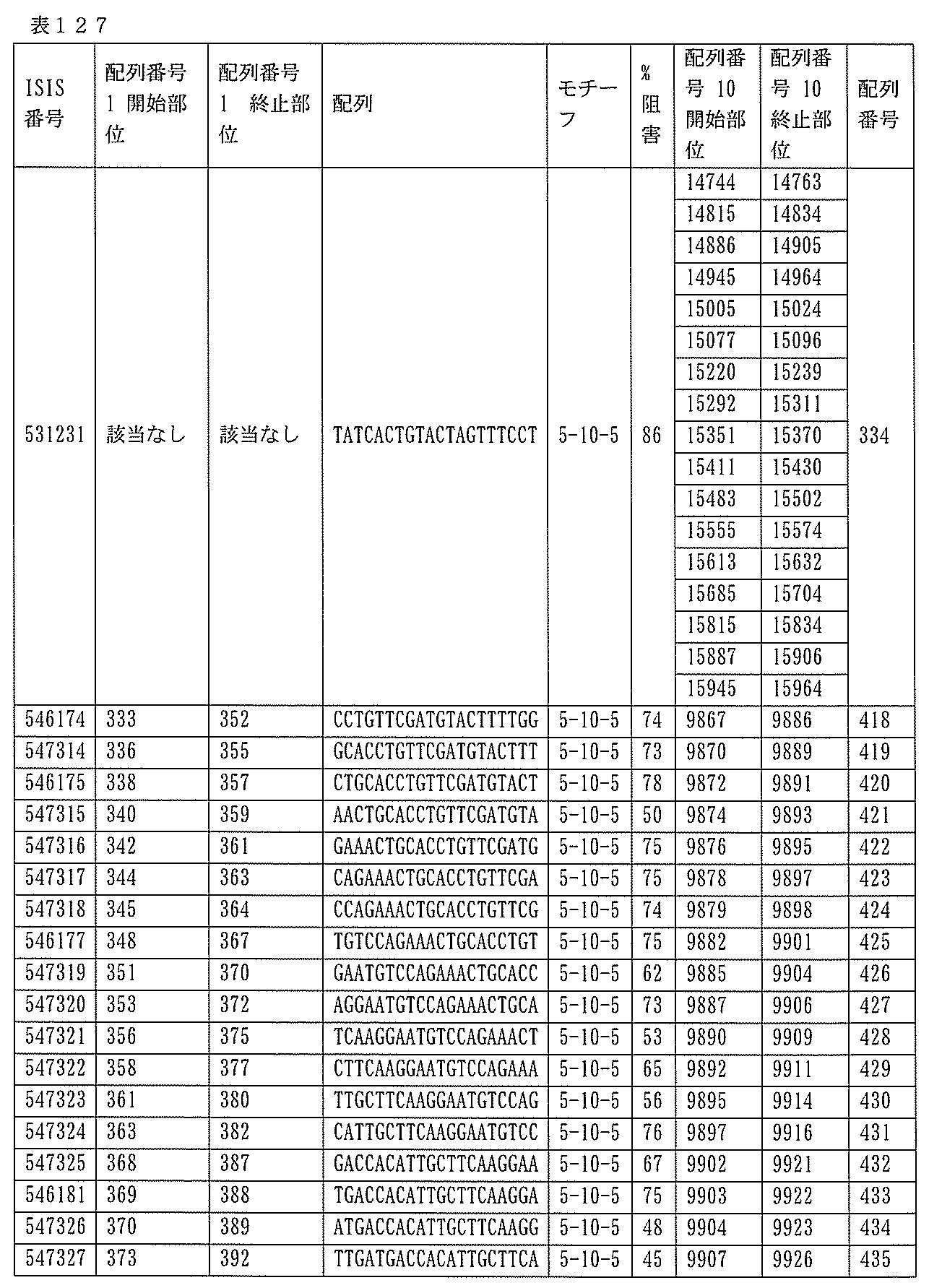
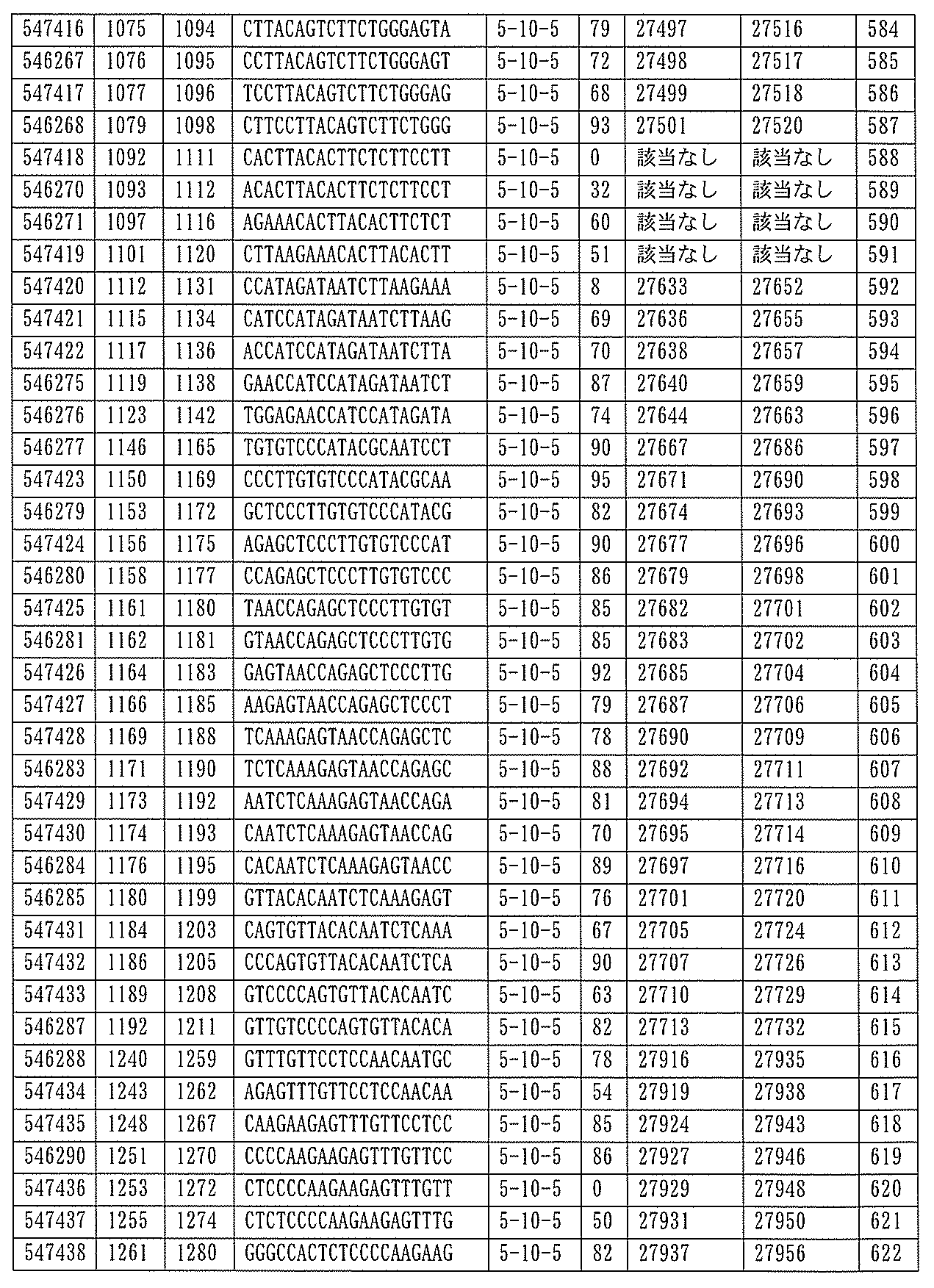
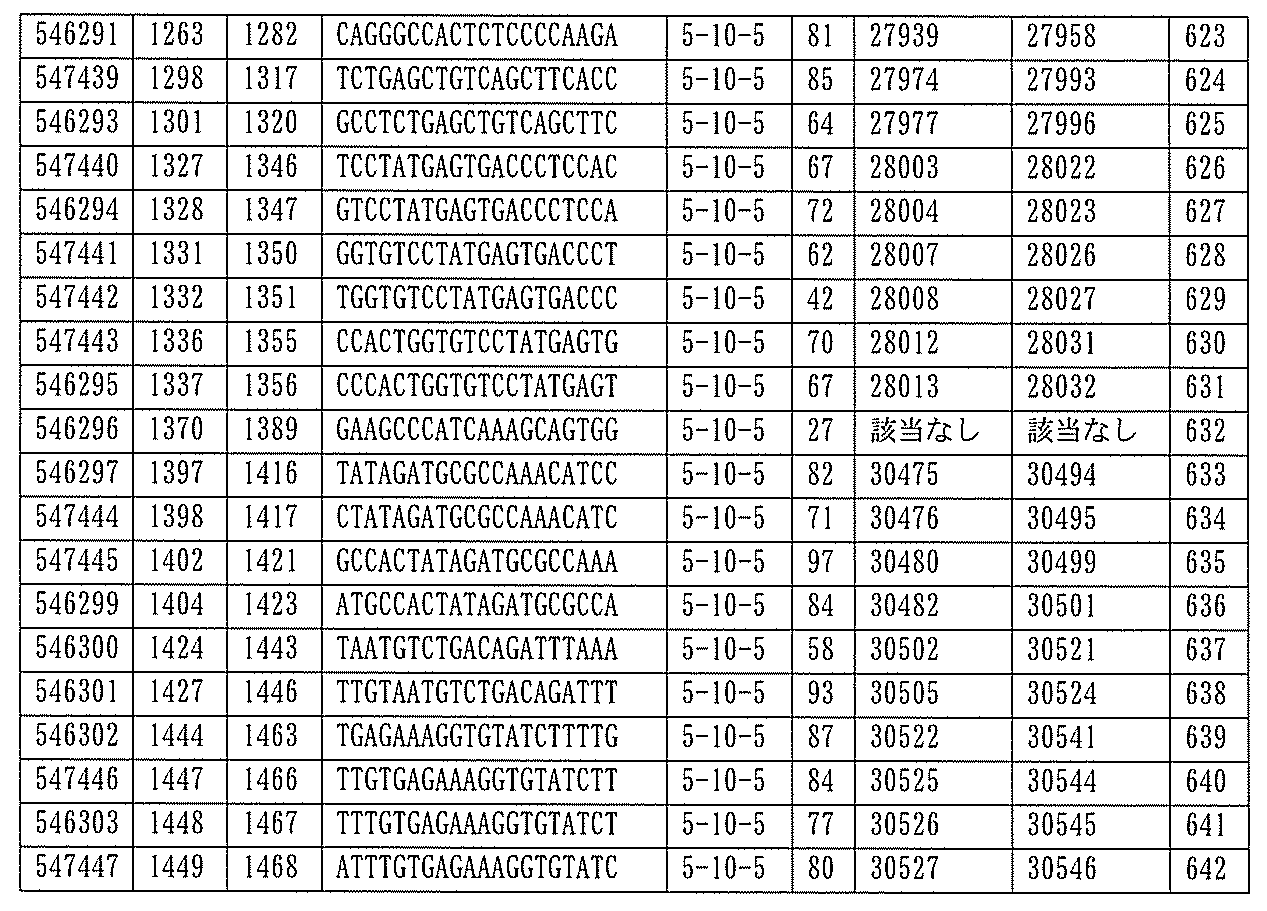
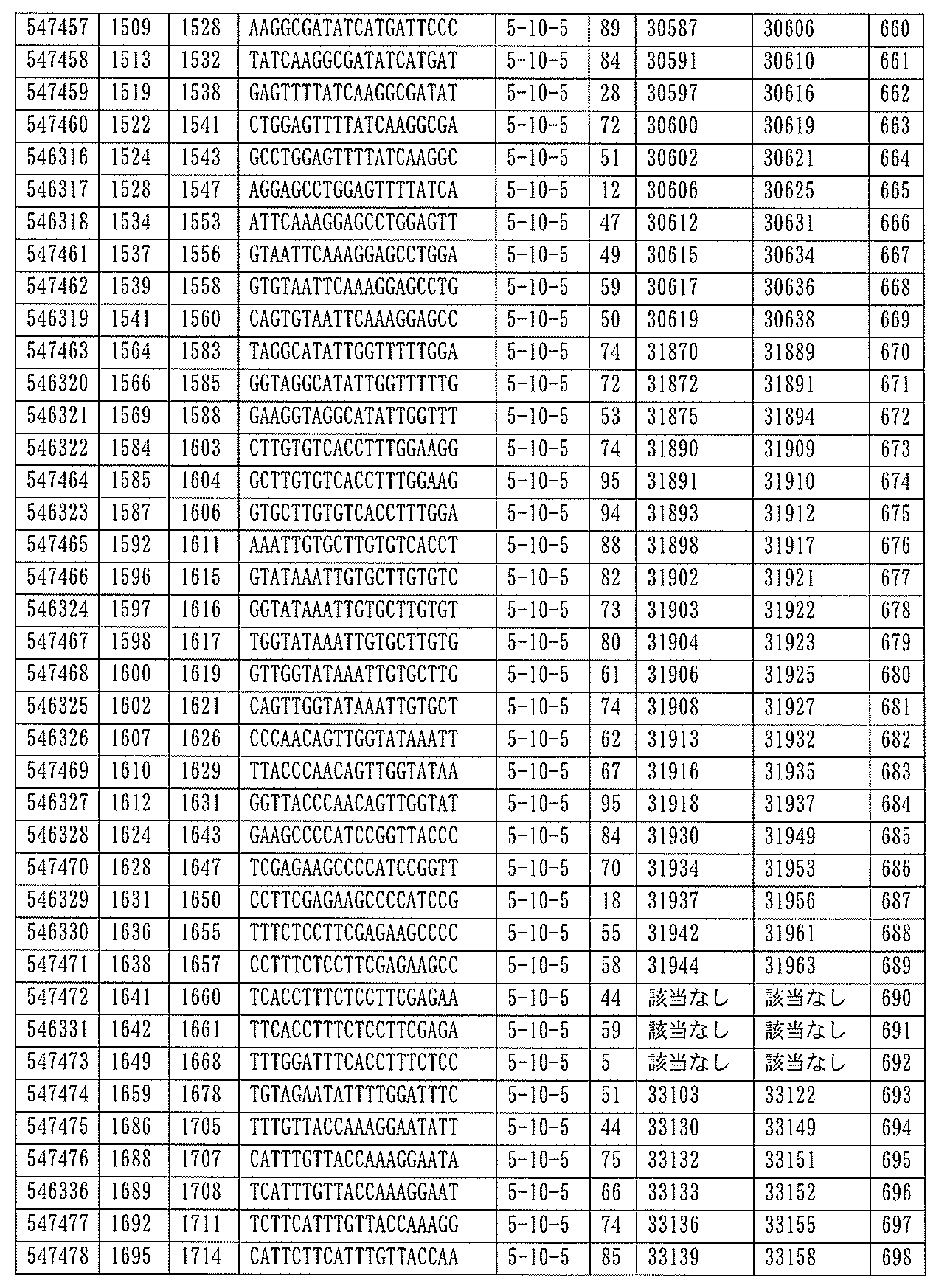
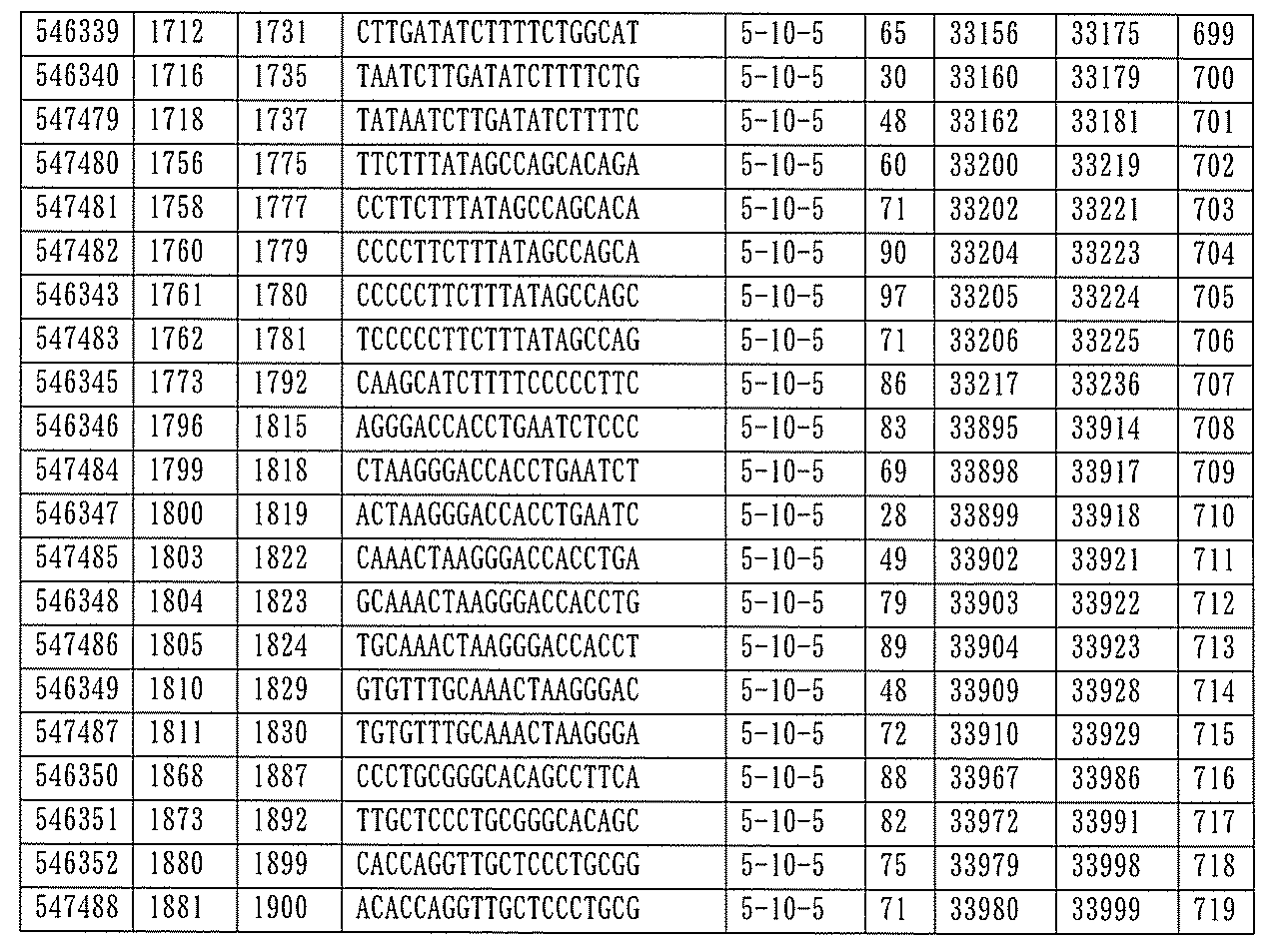
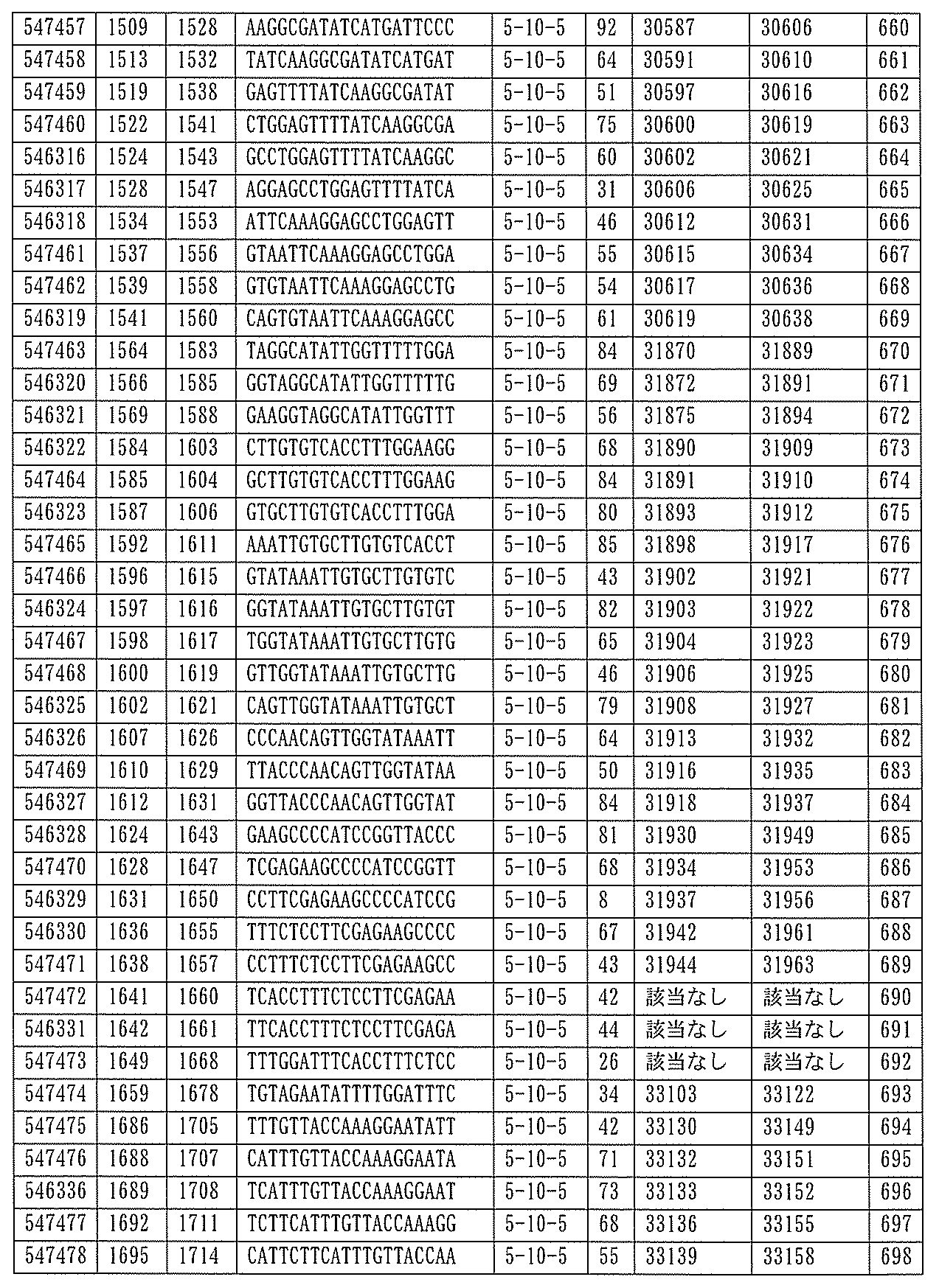
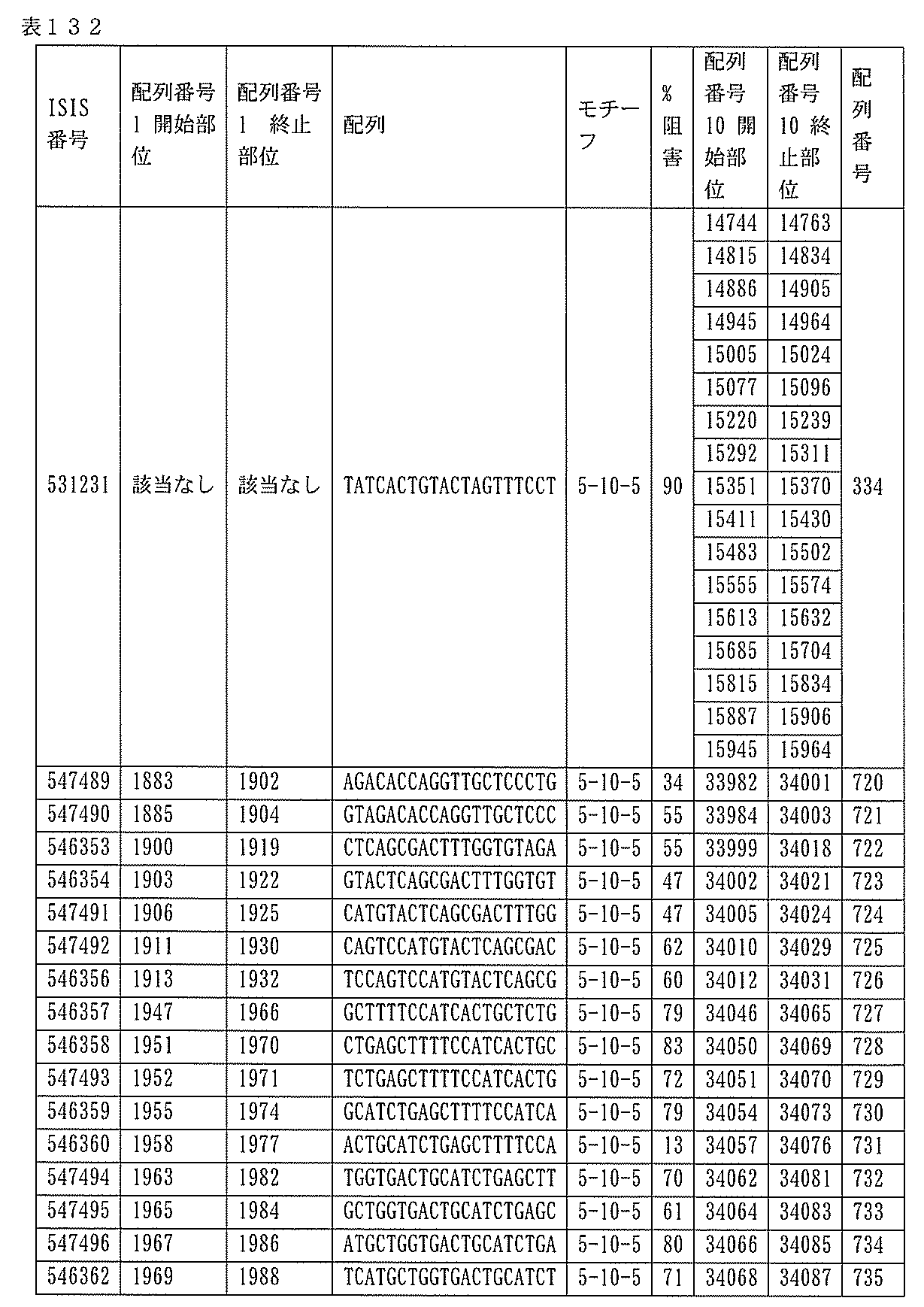
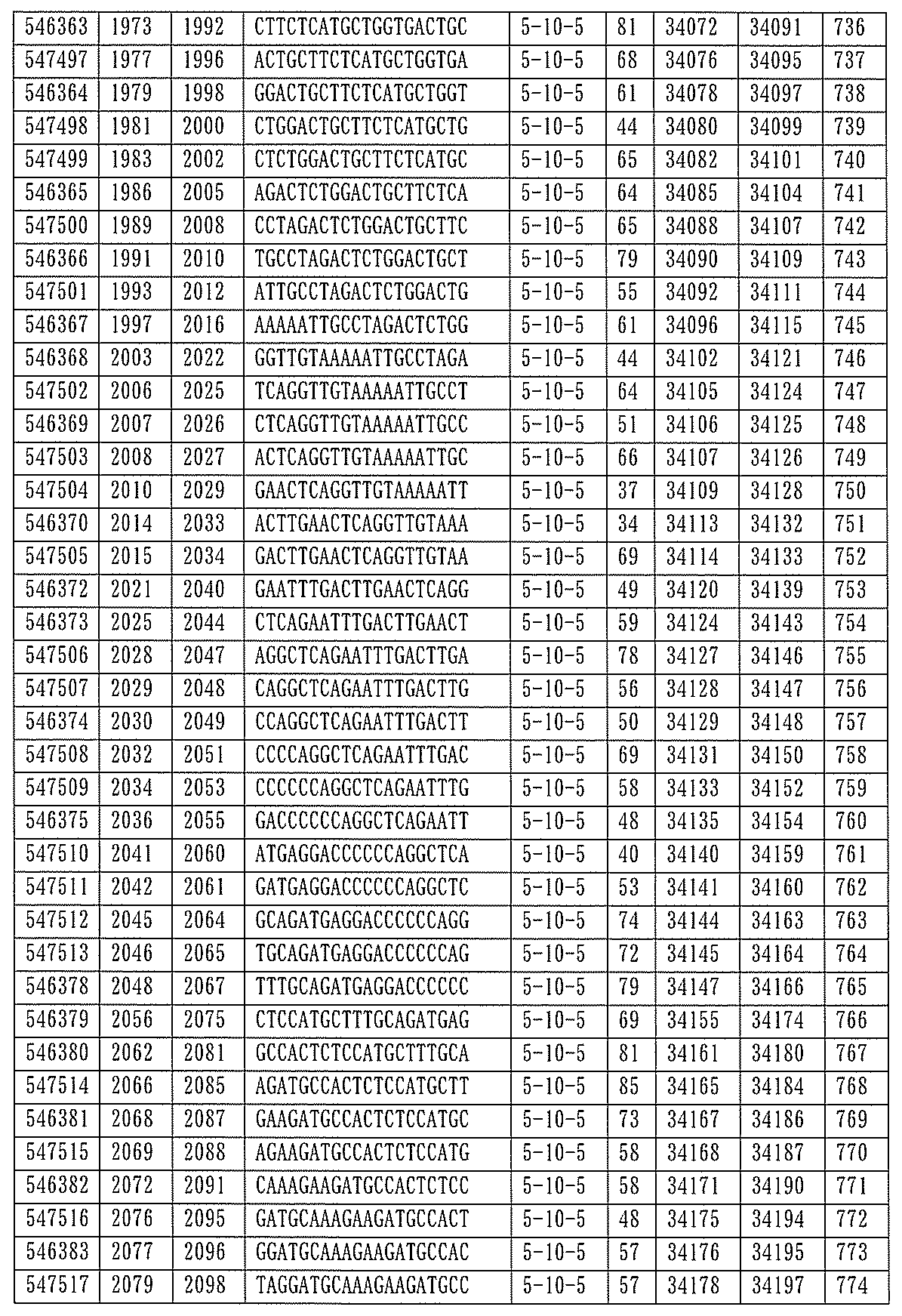
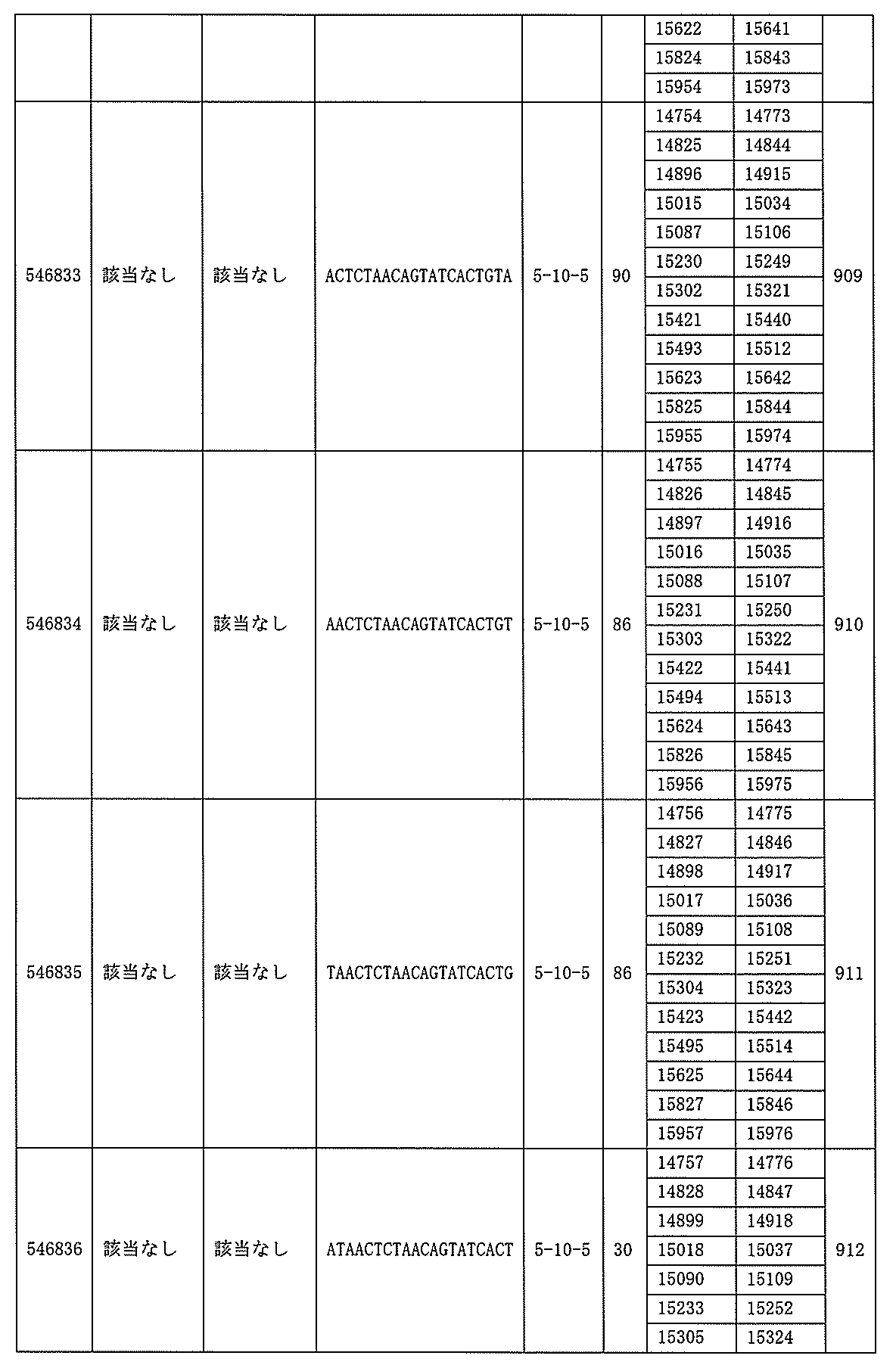
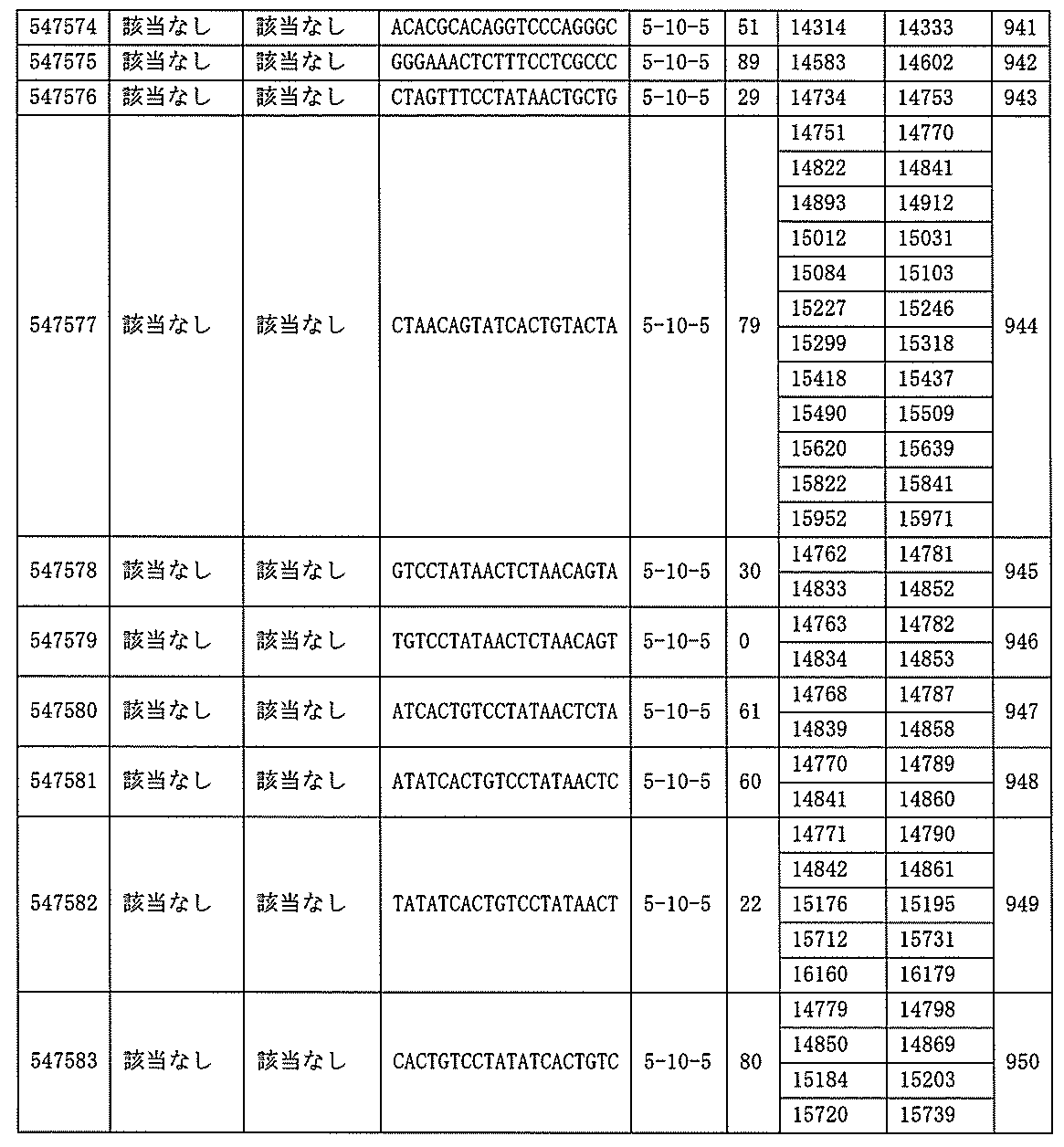
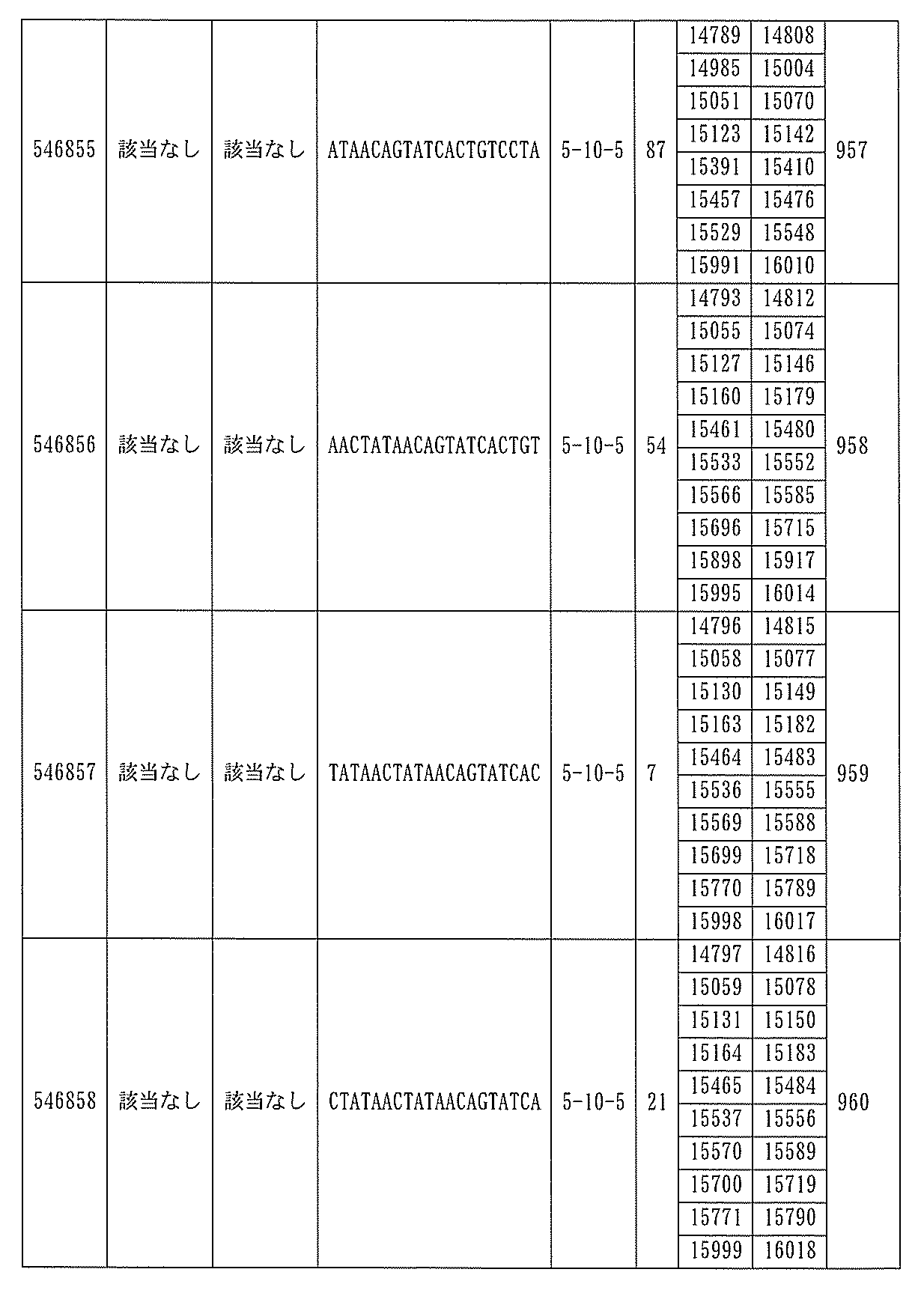
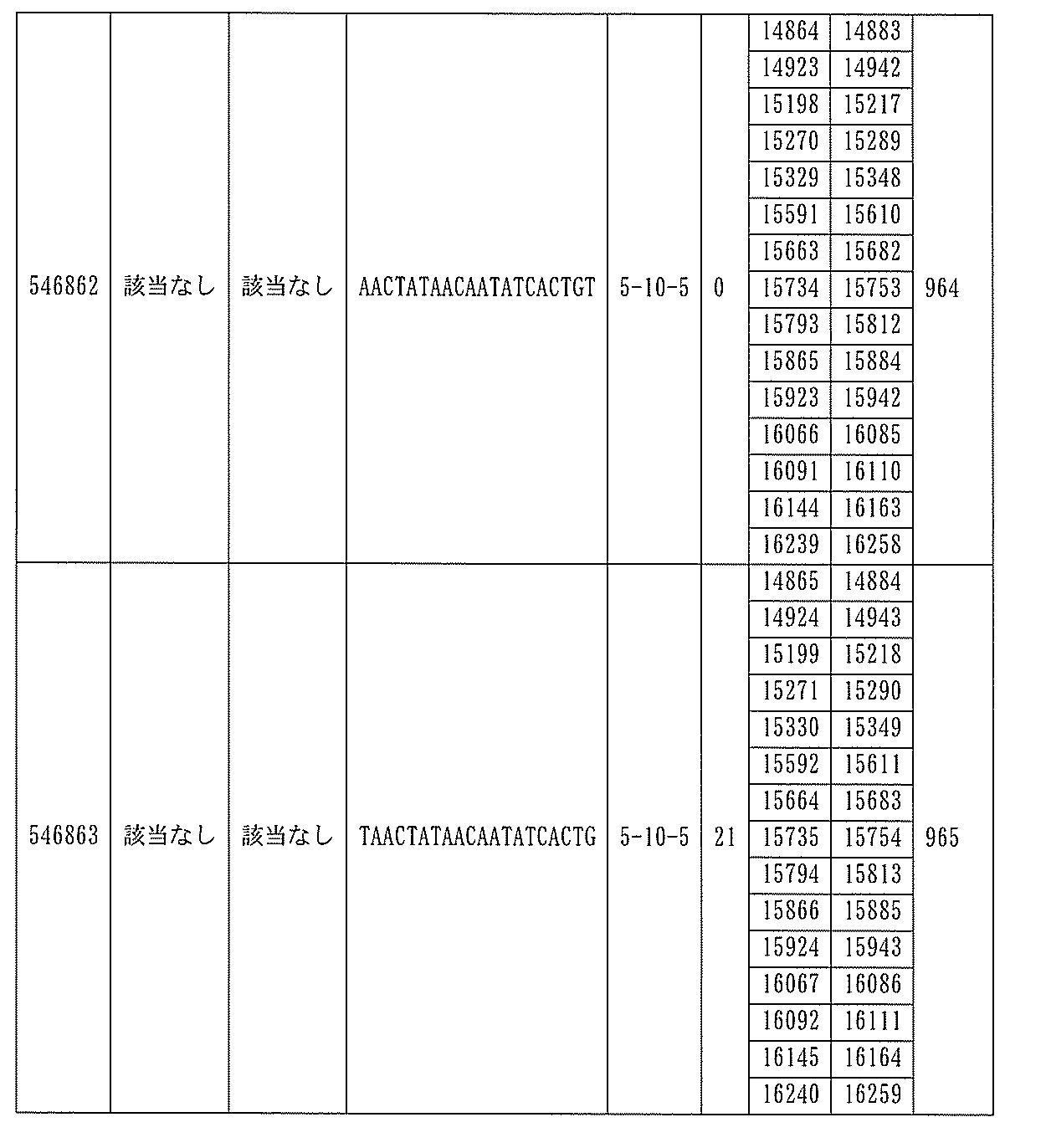
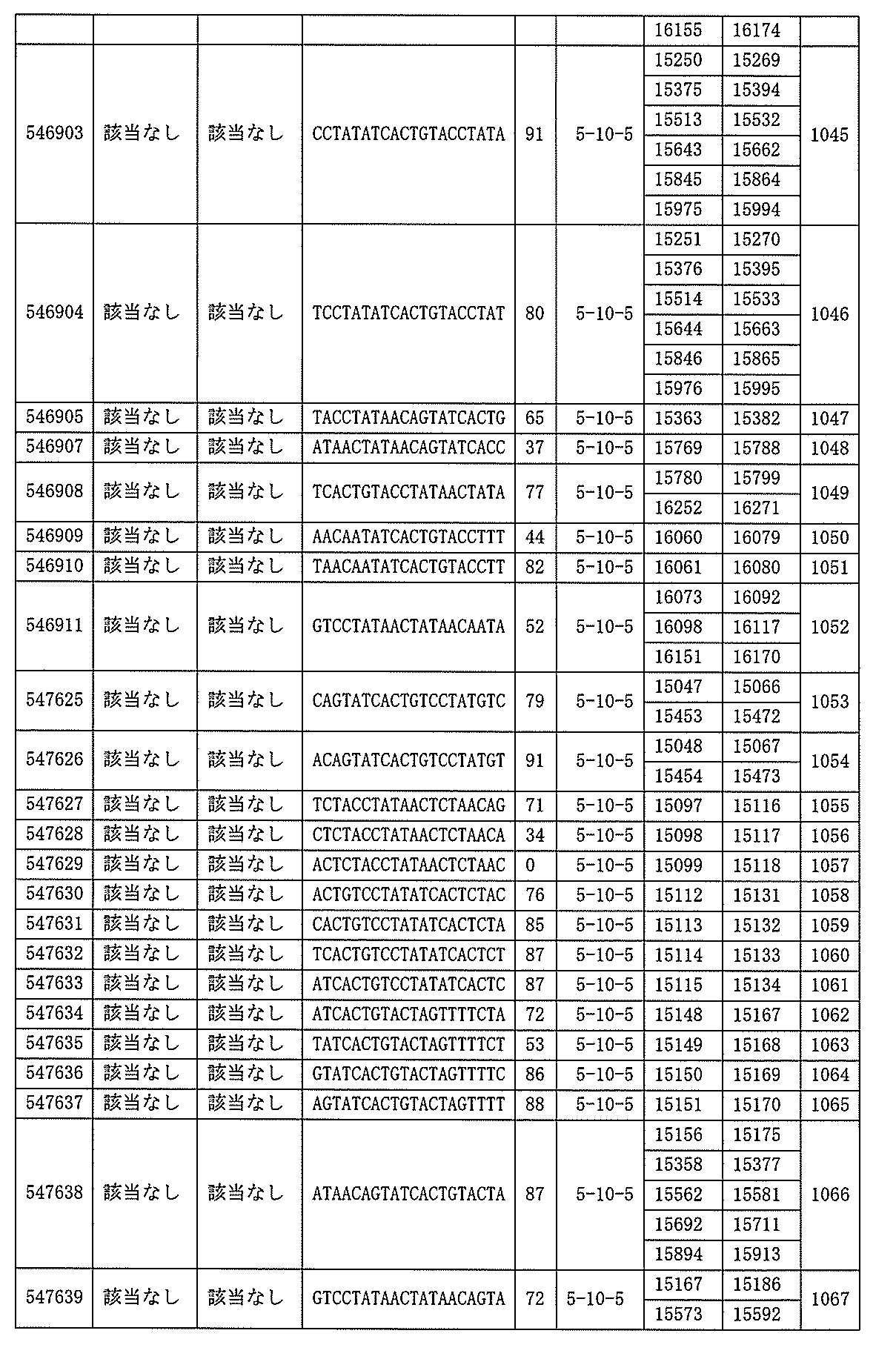
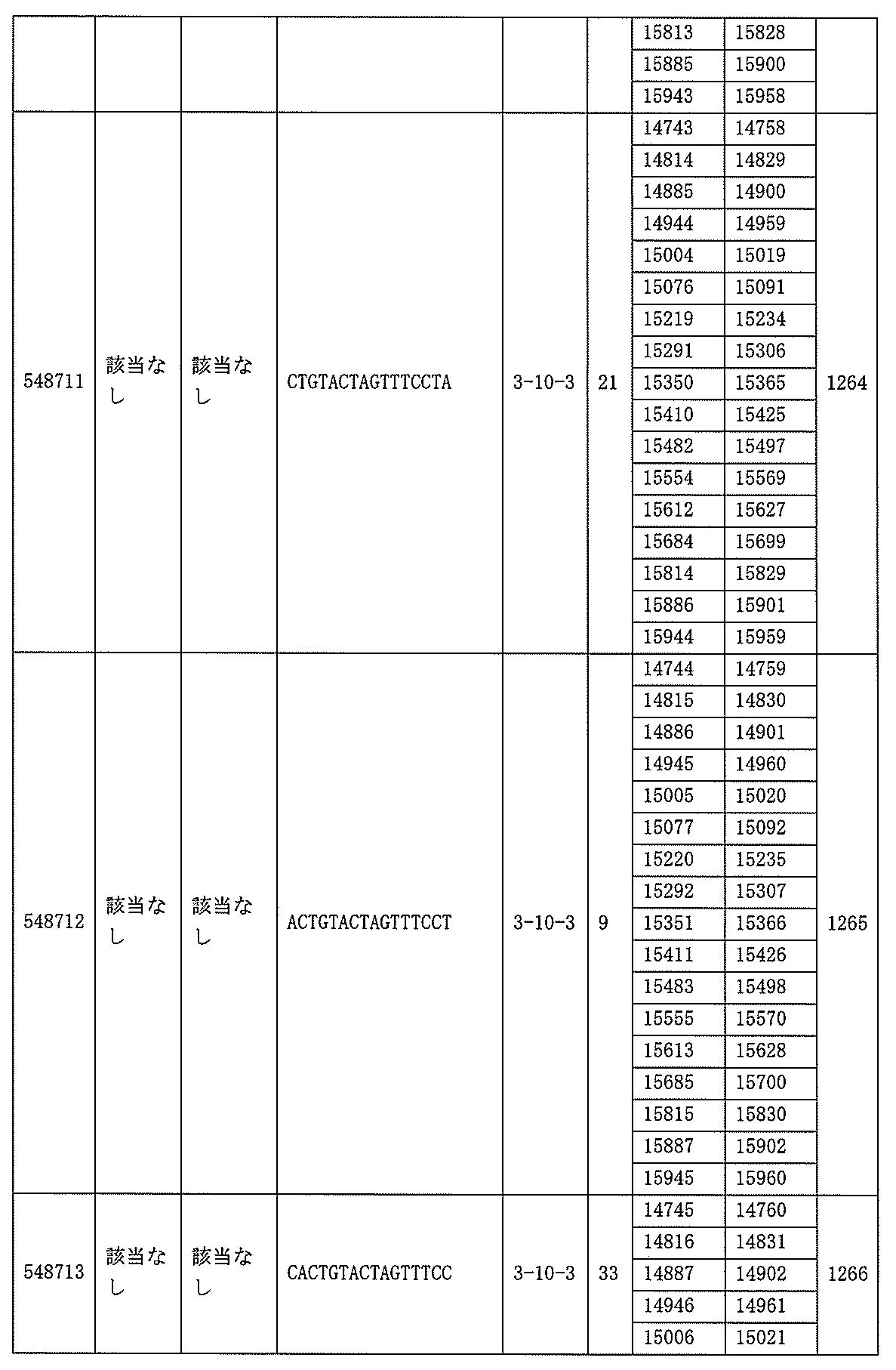
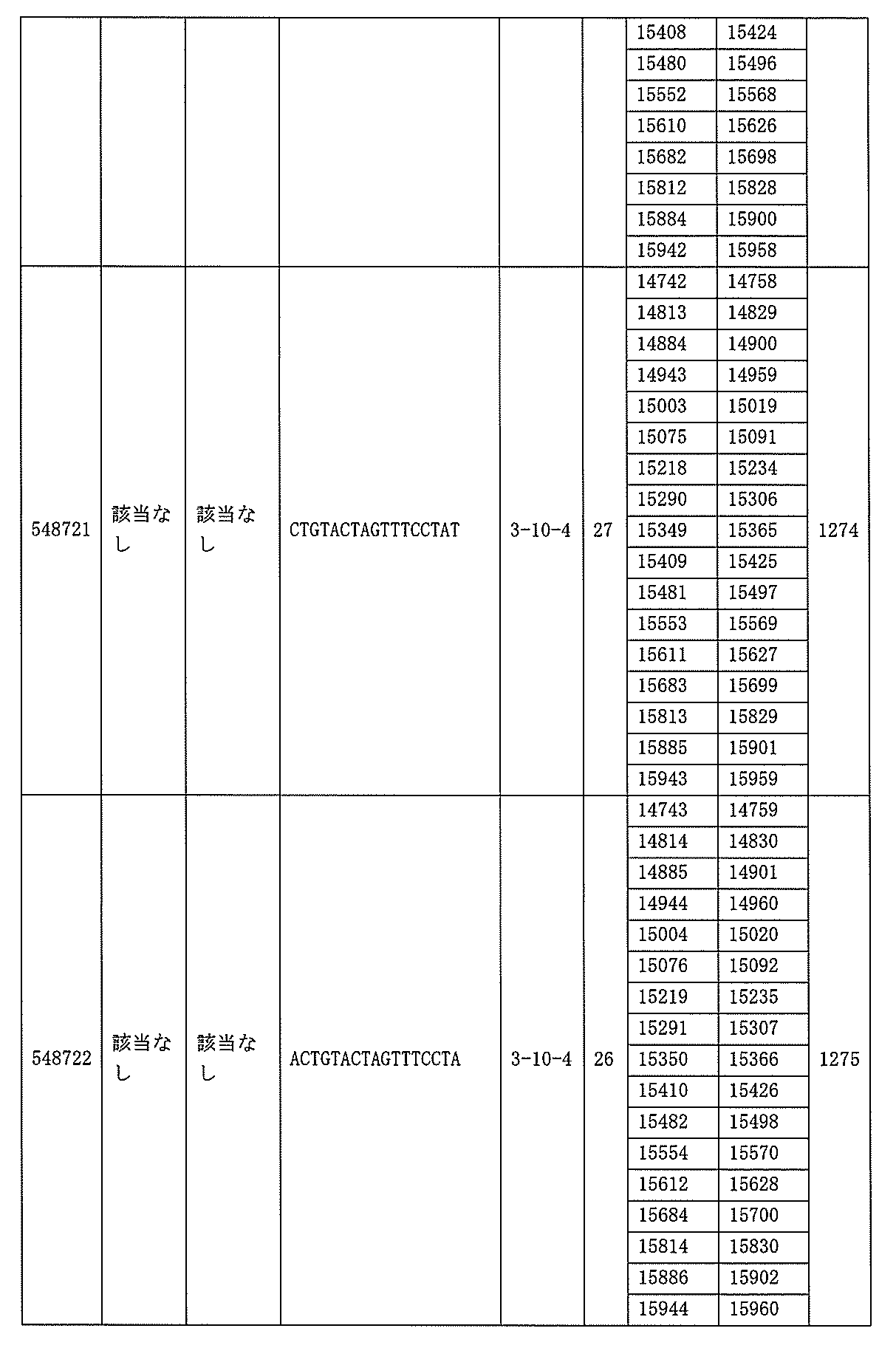
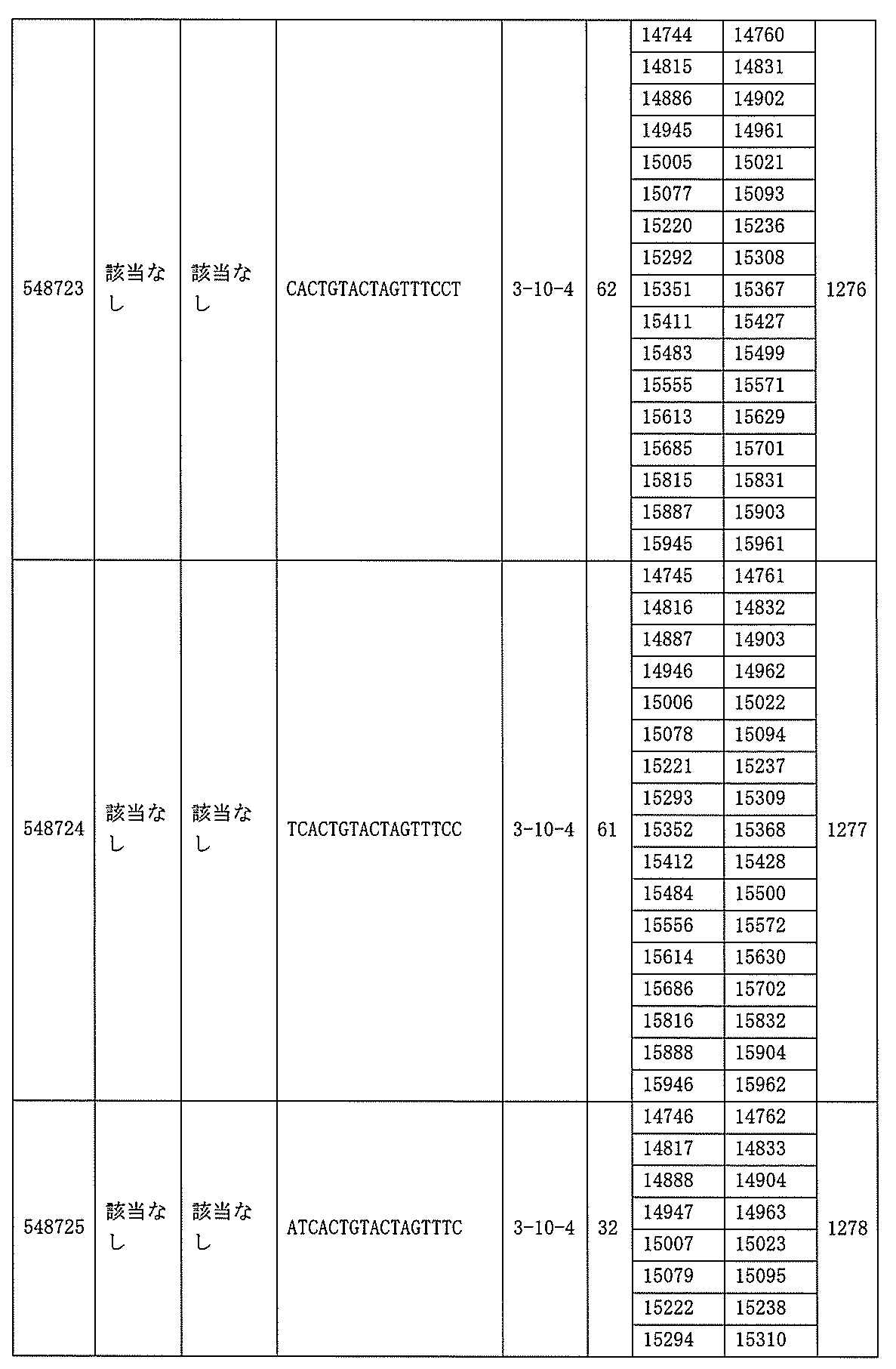
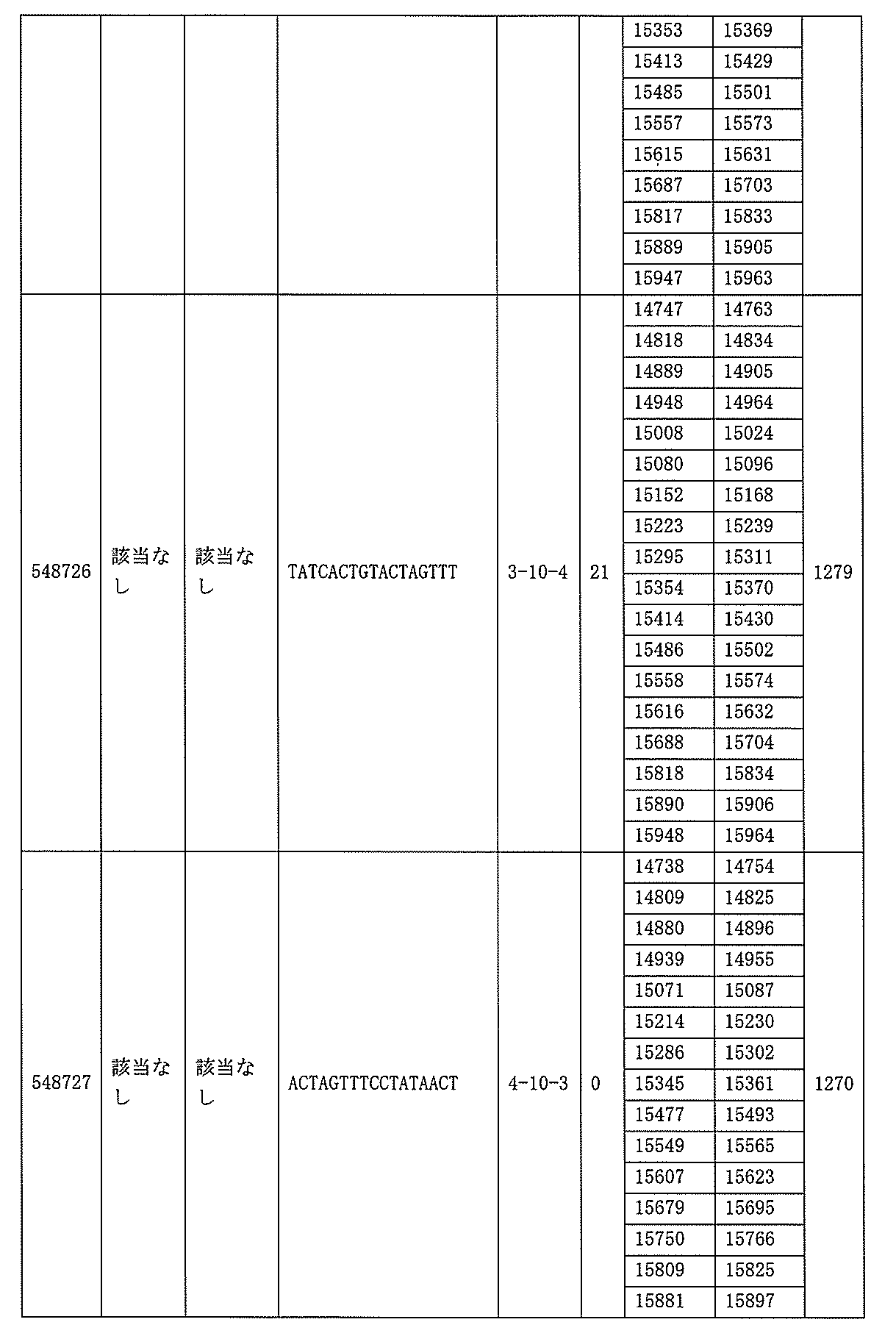
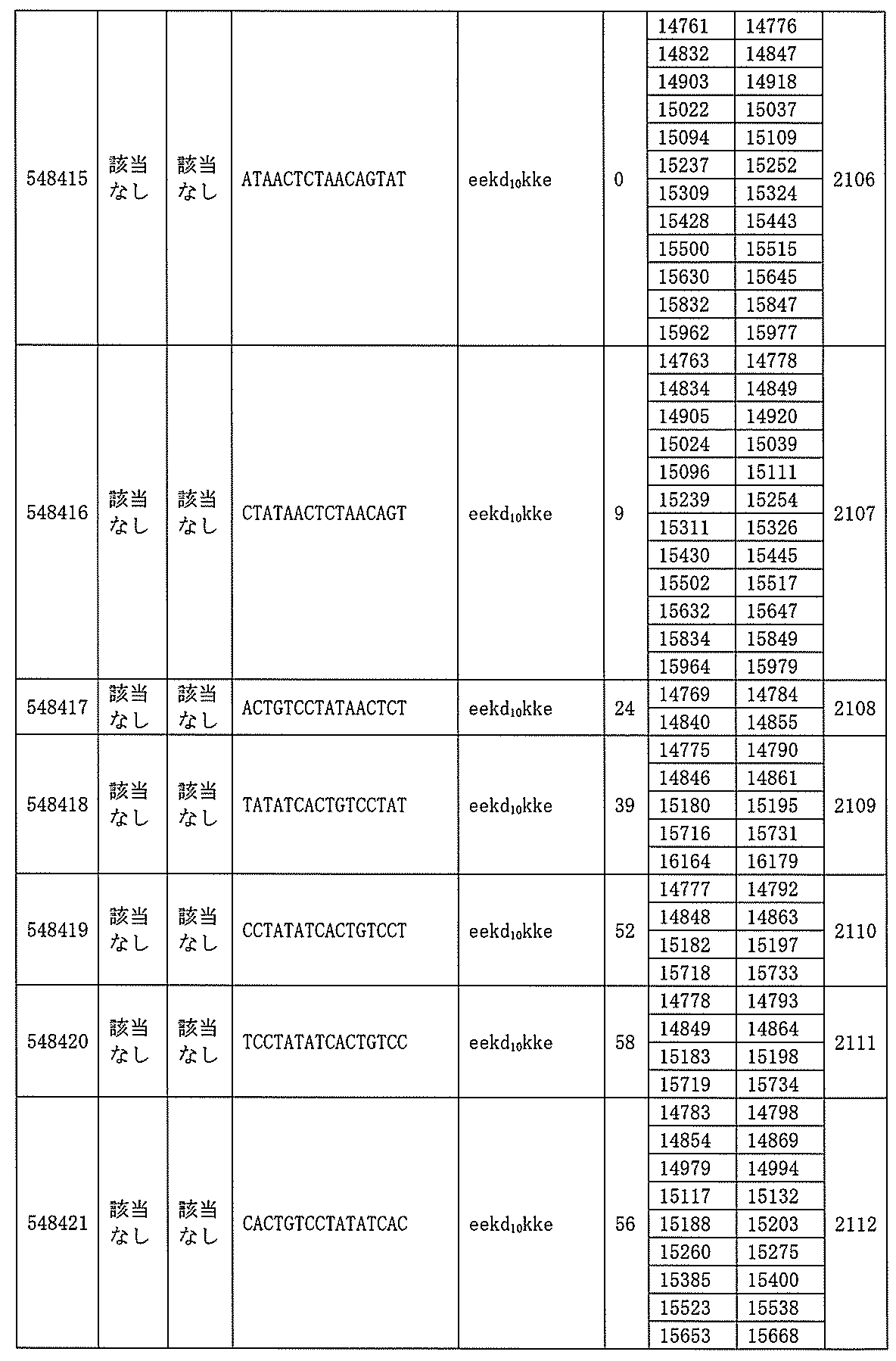
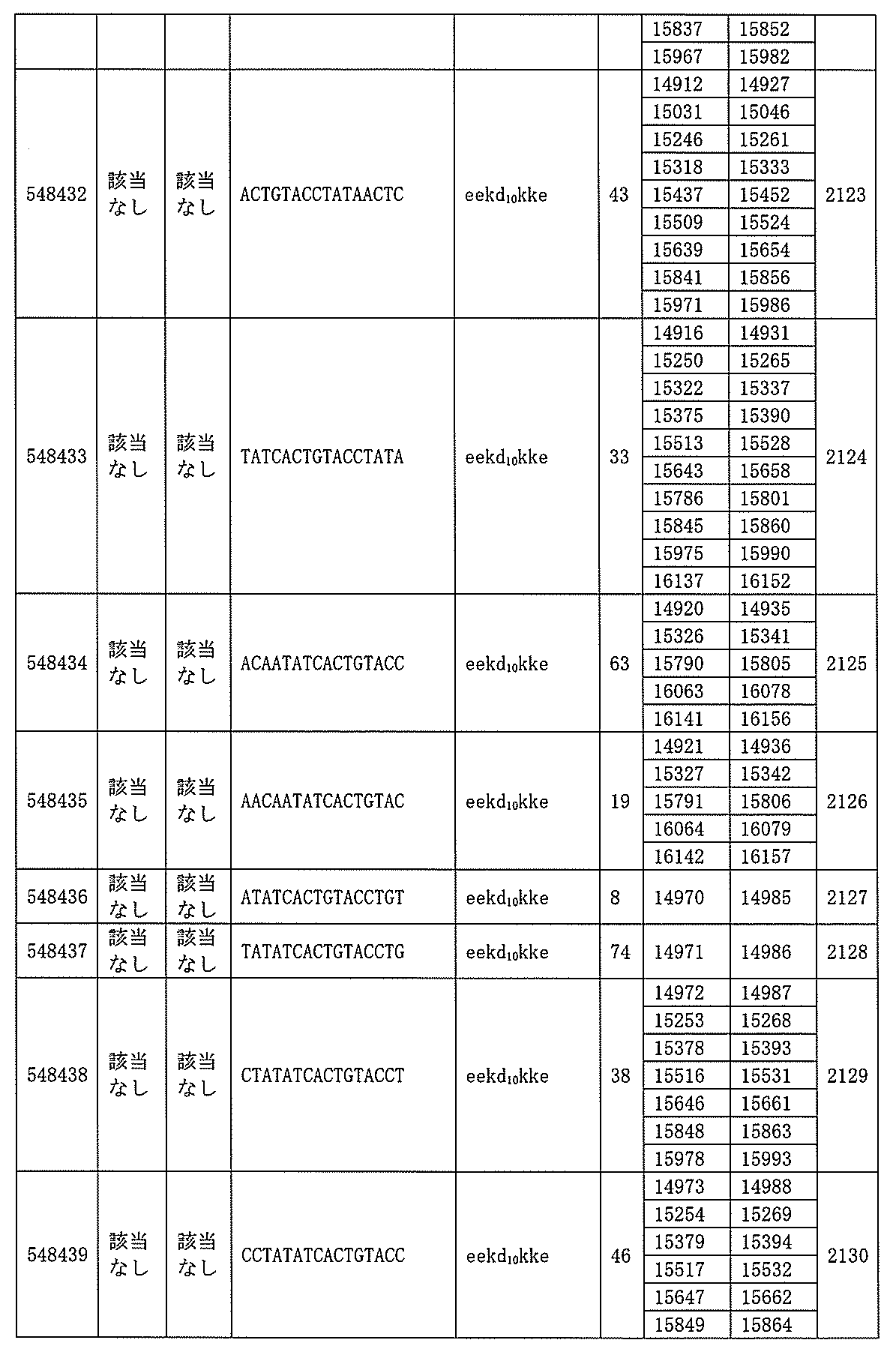
705の少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20個の連続した核酸塩基を含む核酸塩基配列を有する。
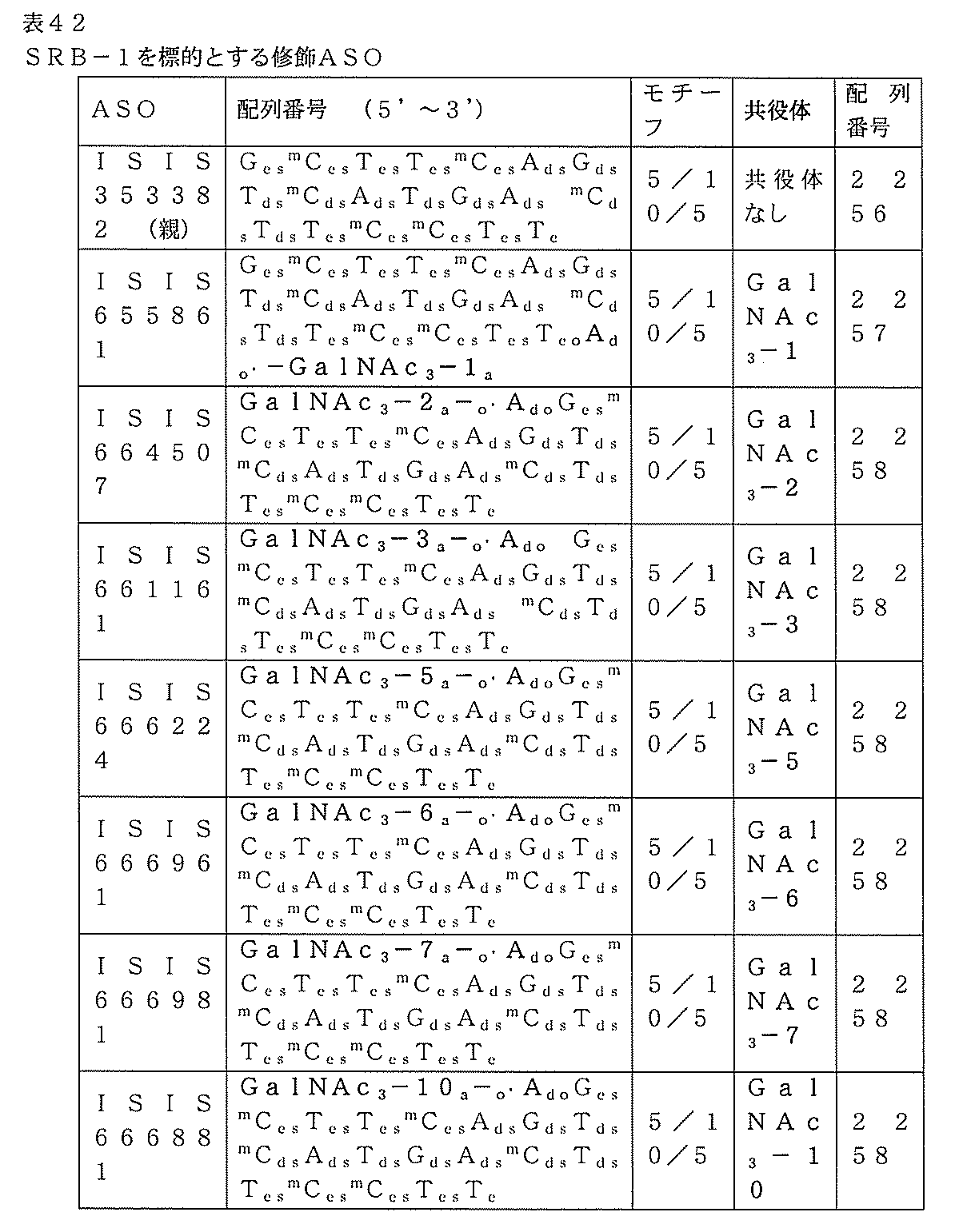
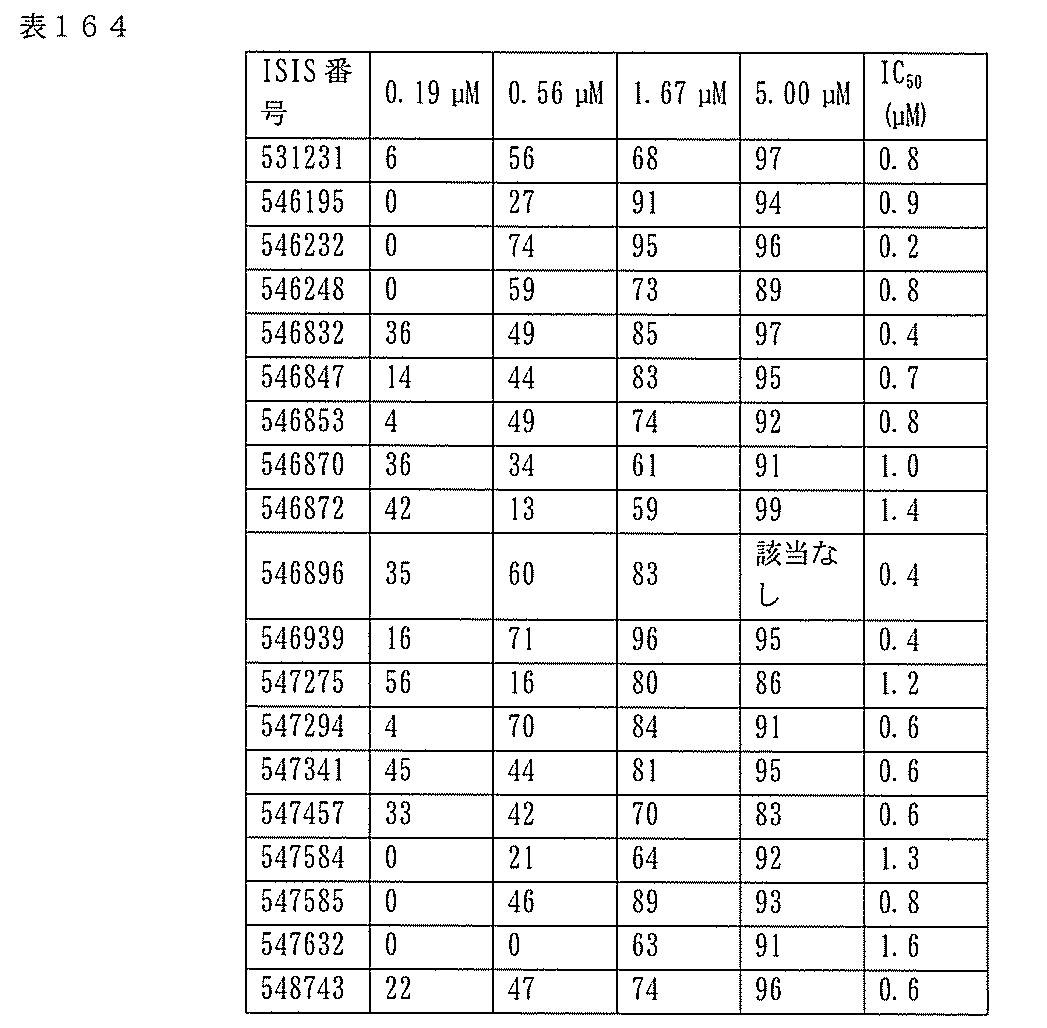
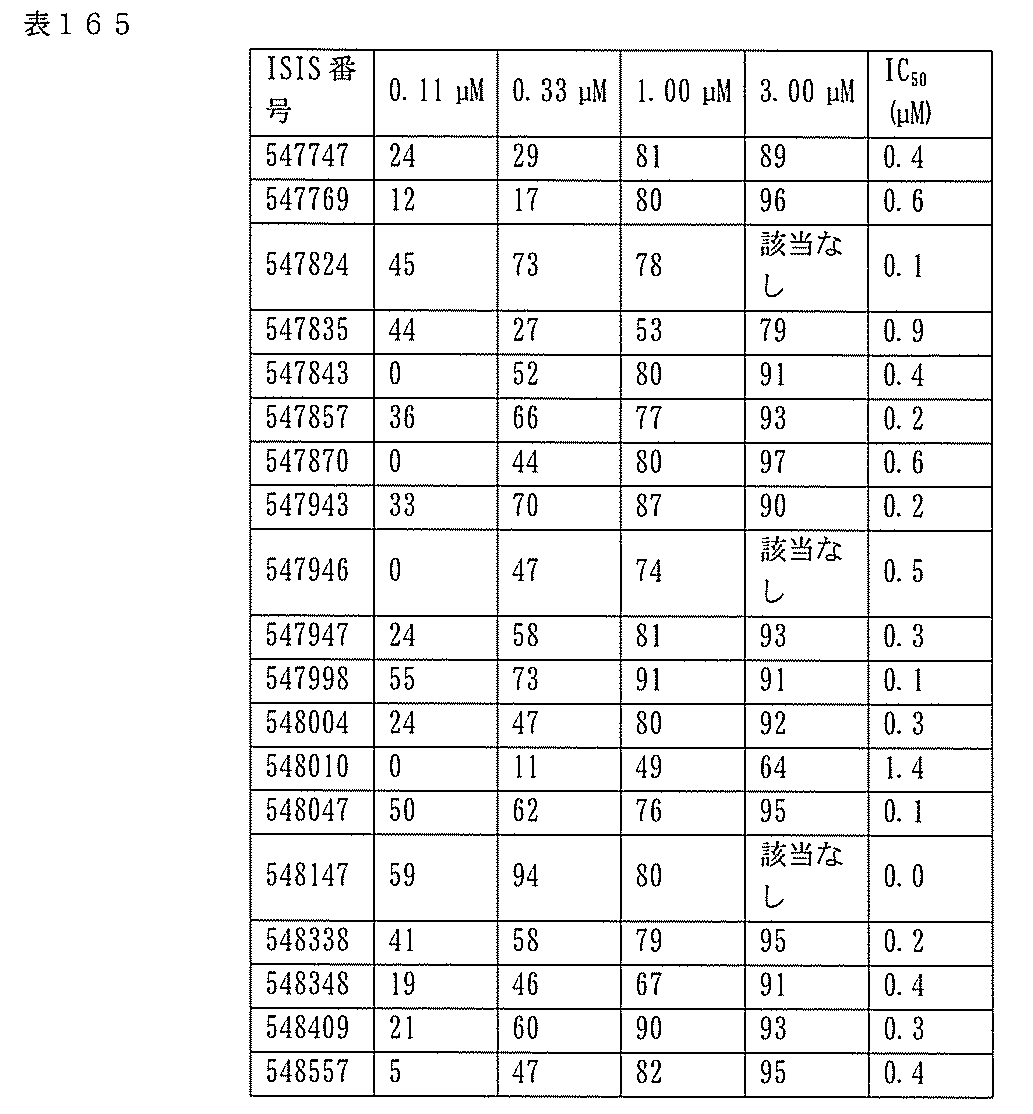
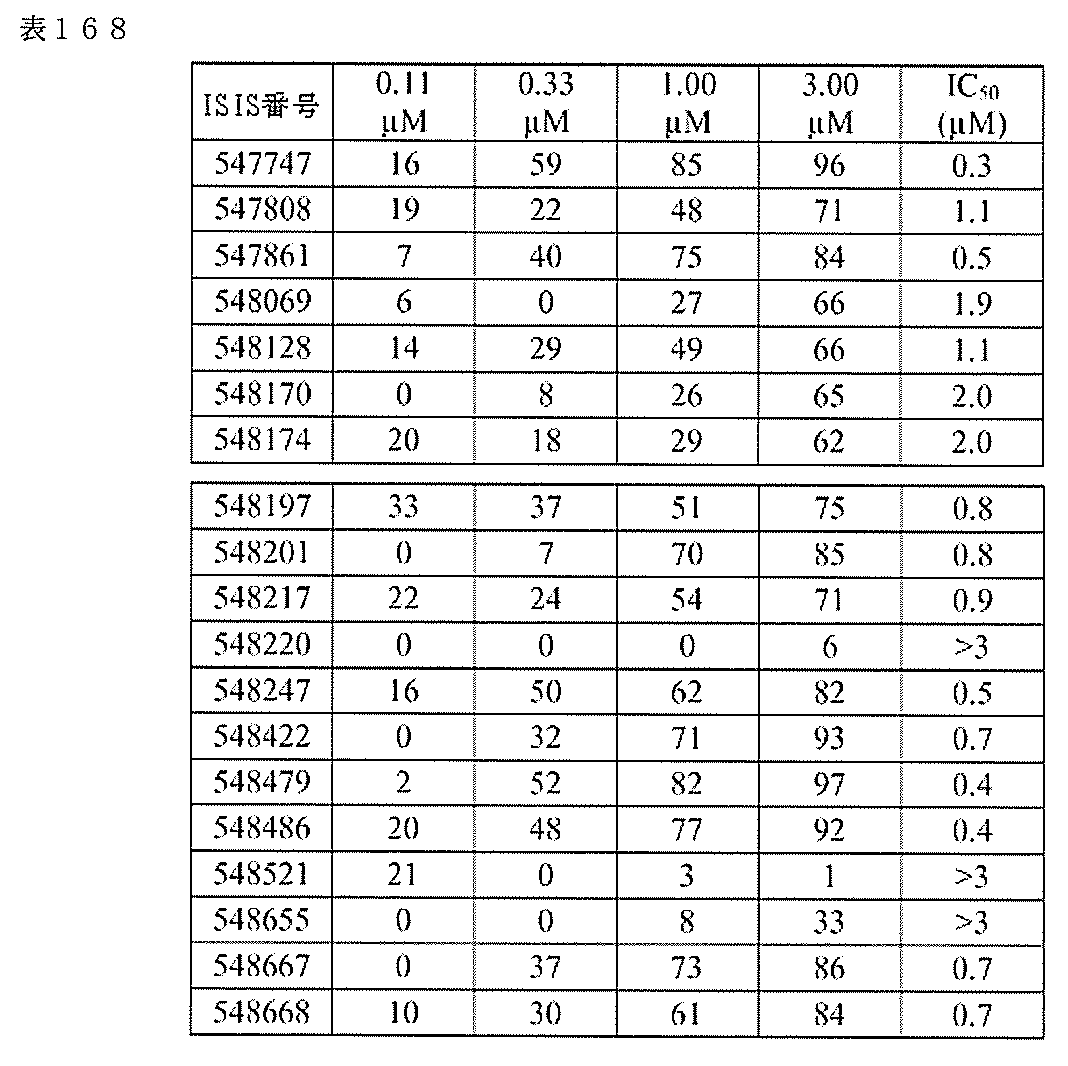
432、1434-1437、1439、1440、1443、1444、1451、1452、1471、1516、1527、1535、1537、1538、1539、1540、1541、1563、1564、1567、1568、1616、1617、1623、1629、1664、1665、1666、1679、1687、1734、1804、1876、1886、1915、2008、2018、2100、2101、2115、及び2116。ある実施形態では、当該修飾オリゴヌクレオチドはPKKの少なくとも80%のmRNAの阻害を達成する。
7、1665、1666、1804、1876、1881、2019、2044、2101、及び2116。ある特定の実施形態では、修飾オリゴヌクレオチドは、0.2以下のIC50(μM)を達成する。
該修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基30475~30639の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む。
10個の連結されたデオキシヌクレオシドからなるギャップセグメント、
5個の連結されたヌクレオシドからなる5’ウイングセグメント、
5個の連結されたヌクレオシドからなる3’ウイングセグメント、
ここで、当該ギャップセグメントは、5’ウイングセグメントと3’ウイングセグメントの間に位置し、各ウイングセグメントの各ヌクレオシドは修飾糖を含む。
mCds Aes Aes Aes mCes Aeに従う修飾オリゴヌクレオチドから成る化合物を提供し、ここで、
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合である。
Ads Gds mCes mCes Aes Ges mCeに従う修飾オリゴヌクレオチドからなる化合物を提供し、ここで
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合である。
mCks mCeに従う修飾オリゴヌクレオチドからなる化合物を提供し、ここで、
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
k=cEt修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合である。
546254を含むまたはそれから成り、ここでXは本明細書に記載のGalNAcを含む共役基である。
R1は-OCH2CH2OCH3(MOE)であり、R2はHであり、またはR1とR
2はともに橋を形成し、ここでR1は-O-であり、R2は-CH2-、-CH(CH3)-、または-CH2CH2-であり、R1とR2は、得られる橋が-O-CH2-、-O-CH(CH3)-、及び-O-CH2CH2-
から選択されるように、直接的に連結し、同じ環上のR3とR4の各対について、各環について独立して、R3は、H及び-OCH2CH2OCH3から選択され、R4はHで
あり、またはR3とR4は共に橋を形成し、ここでR3は-O-であり、R4は-CH2-、-CH(CH3)-、または-CH2CH2-であり、R3とR4は、得られる橋が-O-CH2-、-O-CH(CH3)-、及び-O-CH2CH2-
から選択されるように、直接的に連結し、
R5はH及びCH3から選択され、
Zは、S-及びO-から選択される。
病態を予防、治療または改善する。
的とするアンチセンス化合物は、長さが22のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが23のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが24のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが25のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが26のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが27のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが28のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが29のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが30のサブユニットである。ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物は、長さが31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、または80、または上記の2つ値のいずれかによって定義される範囲のの連結されたサブユニットである。ある特定の実施形態では、アンチセンス化合物はアンチセンスオリゴヌクレオチドであり、連結されたサブユニットは、ヌクレオシドである。
,March 2001)は、bcl-2 mRNAに対して100%の相補性を有し、かつbcl-xL mRNAに対して3つのミスマッチを有するオリゴヌクレオチドが、インビトロ及びインビボでbcl-2とbcl-xLの発現をどちらも低減できることを実証した。さらにまた、このオリゴヌクレオチドはインビボで強力な抗腫瘍活性も示した。
ある特定の実施形態では、PKK核酸を標的とするアンチセンス化合物が、強化された阻害活性、標的核酸に対する増加した結合アフィニティ、またはin vivoヌクレアーゼによる分解に対する耐性などといった性質が当該アンチセンス化合物に付与されるようなパターンまたはモチーフで配置された化学修飾サブユニットを有する。
特定の実施形態では、「X」と「Y」が、2つ以上の2’-デオキシヌクレオシドを含みうる。「Y」は2’-デオキシヌクレオシドを含みうる。本明細書において、「X-Y-Z」と記述されるギャップマーは、ギャップが5’-ウイング及び3’-ウイングのそれぞれと直接隣り合って配置されるような構成を有する。したがって、5’-ウイングとギャップの間にも、ギャップと3’-ウイングの間にも、介在ヌクレオチドは存在しない。本明細書に記載するアンチセンス化合物はいずれもギャップマーモチーフを有することができる。ある特定の実施形態では、「X」と「Z」が同じであり、別の実施形態では、それらが異なる。
ヒト血漿プレカリクレイン(PKK)をコードするヌクレオチド配列は、限定されないが、GENBANK寄託番号NM_000892.3(配列番号1として本明細書に組み込まれる)、GENBANK寄託番号:DC412984.1(配列番号2として本明細書に組み込まれる)、GENBANK寄託番号:CN265612.1(配列番号3として本明細書に組み込まれる)、GENBANK寄託番号AK297672.1(配列番号4として本明細書に組み込まれる)、GENBANK寄託番号DC413312.1(配列番号5として本明細書に組み込まれる)、GENBANK寄託番号AV688858.2(配列番号6として本明細書に組み込まれる)、GENBANK寄託番号:CD652077.1(配列番号7として本明細書に組み込まれる)、GENBANK寄託番号BC143911.1(配列番号8として本明細書に組み込まれる)、GENBANK寄託番号CB162532.1(配列番号9として本明細書に組み込まれる)、核酸塩基111693001から111730000まで切り捨てられたGENBANK寄託番号NT_016354.19、(配列番号10として本明細書に組み込まれる)、GENBANK寄託番号NM_008455.2(配列番号11として本明細書に組み込まれる)、GENBANK寄託番号BB598673.1(配列番号12として本明細書に組み込まれる)、核酸塩基6114001から6144000まで切り捨てられたGENBANK寄託番号NT_039460.7(配列番号13として本明細書に組み込まれる)、GENBANK寄託番号NM_012725.2(配列番号14として本明細書に組み込まれる)、核酸塩基10952001から10982000 まで切り捨てられたGENBANK寄託番号NW_047473.1(配列番号15として本明細書に組み込まれる)、GENBANK寄託番号XM_002804276.1(配列番号17として本明細書に組み込まれる)、及び核酸塩基2358000から2391000まで切り捨てられたGENBANK寄託番号NW_001118167.1(配列番号18として本明細書に組み込まれる)である。
書に組み込まれる。ある特定の実施形態では、標的領域は、標的領域内の1つの標的セグメントの5’標的部位から、同一の標的領域内の別の標的セグメントの3’標的部位までの配列を含んでいてもよい。
いくつかの実施形態では、本明細書に開示するアンチセンス化合物と標的核酸との間でハイブリダイゼーションが起こる。最もよくあるハイブリダイゼーションの機序は、核酸
分子の相補的核酸塩基間での水素結合形成(例えばワトソン-クリック型、フーグスティーン型または逆フーグスティーン型水素結合形成)を必要とする。
アンチセンス化合物の十分な数の核酸塩基が、所望の効果(例えばPKK核酸などの標的核酸のアンチセンス阻害)が生じるような形で、標的核酸の対応する核酸塩基と水素結合することができるのであれば、そのアンチセンス化合物と標的核酸とは互いに相補的である。
ニバーシティ・リサーチ・パーク)により、デフォルト設定を使って決定することができる。
相補的である。ある特定の実施形態では、アンチセンス化合物が、ある標的セグメントの少なくとも13核酸塩基部分に相補的である。ある特定の実施形態では、アンチセンス化合物が、ある標的セグメントの少なくとも14核酸塩基部分に相補的である。ある特定の実施形態では、アンチセンス化合物が、ある標的セグメントの少なくとも15核酸塩基部分に相補的である。ある標的セグメントの少なくとも9、10、11、12、13、14、15、16、17、18、19、20核酸塩基部分もしくはそれ以上の核酸塩基部分、またはこれらの値のうちの任意の2つによって画定される範囲に相補的な、アンチセンス化合物も考えられる。
ここに提供するアンチセンス化合物は、ある特定ヌクレオチド配列、配列番号、もしくは具体的Isis番号によって表される化合物、またはその一部分に対して、所定の同一性パーセントも有しうる。本明細書にいうアンチセンス化合物は、それが同じ核酸塩基対合能を有するのであれば、本明細書に開示する配列と同一である。例えば、ウラシルとチミジンはどちらもアデニンと対合するので、開示したDNA配列中のチミジンの代わりにウラシルを含有するRNAは、当該DNA配列と同一であるとみなされるであろう。本明細書に記載するアンチセンス化合物の短縮型及び延長型、ならびにここに提供するアンチセンス化合物と比較して非同一塩基を有する化合物も考えられる。非同一塩基は互いに隣り合っていてもよいし、アンチセンス化合物全体に散在していてもよい。アンチセンス化合物のパーセント同一性は、比較対象である配列との比較で同一塩基対合を有する塩基の数に従って計算される。
ヌクレオシドは塩基-糖の組み合わせである。ヌクレオシドの核酸塩基(塩基ともいう)部分は、通常、複素環式塩基部分である。ヌクレオチドは、ヌクレオシドの糖部分に共有結合で連結されたリン酸基をさらに含むヌクレオシドである。ペントフラノシル糖を含むヌクレオシドの場合は、リン酸基を、糖の2’、3’または5’ヒドロキシル部分に連結することができる。オリゴヌクレオチドは、互いに隣り合うヌクレオシドを共有結合で連結して、線状ポリマー状のオリゴヌクレオチドを形成させることによって形成される。オリゴヌクレオチド構造内では、リン酸基は、オリゴヌクレオチドのヌクレオシド間連結部を形成していると、一般に言われる。
、増加した阻害活性などといった望ましい性質ゆえに、ネイティブ型より好ましいことが多い。
RNA及びDNAの天然に存在するヌクレオシド間連結部は、3’→5’ホスホジエステル連結部である。2つ以上の修飾(すなわち天然に存在しない)ヌクレオシド間連結部を有するアンチセンス化合物は、例えば強化された細胞取り込み、核酸標的に対する強化されたアフィニティ、及びヌクレアーゼの存在下での増加した安定性などといった望ましい性質ゆえに、天然に存在するヌクレオシド間連結部を有するアンチセンス化合物よりも選択されることが多い。
エートである。
形態では、オリゴヌクレオチドが少なくとも8つの連続するホスホロチオエートヌクレオシド間連結部のブロックを少なくとも1つは含む。ある特定の実施形態では、オリゴヌクレオチドが少なくとも10個の連続するホスホロチオエートヌクレオシド間連結部のブロックを少なくとも1つは含む。 ある特定の実施形態では、オリゴヌクレオチドが少なく
とも12個の連続するホスホロチオエートヌクレオシド間連結部のブロックを少なくとも1つは含む。 ある特定のそのような実施形態では、少なくとも1つの上述のブロックが
、オリゴヌクレオチドの3’端に位置する。ある特定のそのような実施形態では、少なくとも1つの上述のブロックがオリゴヌクレオチドの3’端から3ヌクレオシド以内に位置する。
オエートヌクレオシド間連結部の数を減少させ、ホスホジエステルヌクレオシド間連結部を増加させることができる。ある特定の実施形態では、ヌクレアーゼ耐性を保ったまま、ホスホロチオエートヌクレオシド間連結部の数を減少させることが望ましい。ある特定の実施形態では、ヌクレアーゼ活性を保ったまま、ホスホジエステルヌクレオシド間連結部の数を増加させることが望ましい。
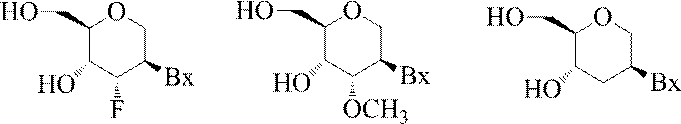
アンチセンス化合物は、場合によっては、糖基が修飾されているヌクレオシドを2つ以上含有しうる。そのような糖修飾ヌクレオシドは、強化されたヌクレアーゼ安定性、増加した結合アフィニティ、または他の何らかの有益な生物学的性質を、アンチセンス化合物に付与しうる。ある特定の実施形態では、ヌクレオシドが化学修飾リボフラノース環部分を含む。化学修飾リボフラノース環の例には、置換基の付加(5’置換基、2’置換基、非ジェミナル環原子の橋による二環式核酸(BNA)の形成、S、N(R)、またはC(R1)(R2)(R、R1及びR2は、それぞれ独立して、H、C1-C12アルキルまたは保護基である)によるリボシル環酸素原子の置き換え、及びそれらの組み合わせなどがあるが、これらに限定されない。化学修飾糖の例としては、2’-F-5’-メチル置換ヌクレオシド(開示されている他の5’,2’-ビス置換ヌクレオシドについては、PCT国際出願WO2008/101157(公開日2008年8月21日)を参照された
い)、またはSによるリボシル環酸素原子の置き換えと2’位におけるさらなる置換(米国特許出願公開US2005-0130923(公開日2005年6月16日)参照)、あるいはBNAの5’-置換(PCT国際出願WO2007/134181(公開日2007年11月22日)参照、この場合はLNAが例えば5’-メチル基または5’-ビニル基で置換されている)などがある。
,670,461号;同第6,770,748号;同第6,794,499号;同第7,034,133号;同第7,053,207号;同第7,399,845号;同第7,547,684号;及び同第7,696,345号;米国特許出願公開番号US2008-0039618;同US2009-0012281;米国特許出願第61/026,995号及び同第61/097,787号;PCT国際出願公開WO1999/014226;同WO2004/106356;同WO2005/021570;同WO2007/134181;同WO2008/150729;同WO2008/154401;同WO2009/006478;同WO2010/036698;同WO2011/017521;同WO2009/067647同WO2009/100320参照。前述の二環式ヌクレオシドのそれぞれは、例えばα-L-リボフラノースとβ-D-リボフラノースなど、2つ以上の立体化学的糖配置を有するものを調製することができる(1999年3月25日にWO99/14226として公開されたPCT国際出願PCT/DK98/00393を参照されたい)。
式中、
xは、0、1、または2であり、
nは、1、2、3、または4であり、
各Ra及びRbは、独立して、H、保護基、ヒドロキシル、C1-C12アルキル、置換C1-C12アルキル、C2-C12アルケニル、置換C2-C12アルケニル、C2-C12アルキニル、置換C2-C12アルキニル、C5-C20アリール、置換C5-C20アリール、複素環ラジカル、置換複素環ラジカル、ヘテロアリール、置換ヘテロアリール、C5-C7脂環式ラジカル、置換C5-C7脂環式ラジカル、ハロゲン、OJ1、NJ1J2、SJ1、N3、COOJ1、アシル(C(=O)-H)、置換アシル、CN、スルホニル(S(=O)2-J1)、またはスルホキシル(S(=O)-J1)であり、かつ
各J1及びJ2は、独立して、H、C1-C12アルキル、置換C1-C12アルキル、C2-C12アルケニル、置換C2-C12アルケニル、C2-C12アルキニル、置換C2-C12アルキニル、C5-C20アリール、置換C5-C20アリール、アシル(C(=O)-H)、置換アシル、複素環ラジカル、置換複素環ラジカル、C1-C12アミノアルキル、置換C1-C12アミノアルキルまたは保護基である。
ucleic Acids Research,2003,21,6365-6372)。
[式中、
Bxは、複素環式塩基部分であり、
-Qa-Qb-Qc-は、-CH2-N(Rc)-CH2-、-C(=O)-N(Rc)-CH2-、-CH2-O-N(Rc)-、-CH2-N(Rc)-O-または-N(Rc)-O-CH2であり、
Rcは、C1-C12アルキルまたはアミノ保護基であり、かつ
Ta及びTbは、それぞれ独立して、H、ヒドロキシル保護基、共役基、反応性リン基、リン部分または支持媒体への共有結合による取り付けである]
を有する二環式ヌクレオシドが提供される。
[式中、
Bxは、複素環式塩基部分であり、
Ta及びTbは、それぞれ独立して、H、ヒドロキシル保護基、共役基、反応性リン基、リン部分または支持媒体への共有結合による取り付けであり、
Zaは、C1-C6アルキル、C2-C6アルケニル、C2-C6アルキニル、置換C1-C6アルキル、置換C2-C6アルケニル、置換C2-C6アルキニル、アシル、置換アシル、置換アミド、チオールまたは置換チオである]
を有する二環式ヌクレオシドが提供される。
[式中、
Bxは、複素環式塩基部分であり、
Ta及びTbは、それぞれ独立して、H、ヒドロキシル保護基、共役基、反応性リン基、リン部分または支持媒体への共有結合による取り付けであり、
Zbは、C1-C6アルキル、C2-C6アルケニル、C2-C6アルキニル、置換C1-C6アルキル、置換C2-C6アルケニル、置換C2-C6アルキニルまたは置換アシル(C(=O)-)である]
を有する二環式ヌクレオシドが提供される。
[式中、
Bxは、複素環式塩基部分であり、
Ta及びTbは、それぞれ独立して、H、ヒドロキシル保護基、共役基、反応性リン基、リン部分または支持媒体への共有結合による取り付けであり、
Rdは、C1-C6アルキル、置換C1-C6アルキル、C2-C6アルケニル、置換C2-C6アルケニル、C2-C6アルキニルまたは置換C2-C6アルキニルであり、
各qa、qb、qc及びqdは、独立して、H、ハロゲン、C1-C6アルキル、置換C1-C6アルキル、C2-C6アルケニル、置換C2-C6アルケニル、C2-C6アルキニルまたは置換C2-C6アルキニル、C1-C6アルコキシル、置換C1-C6アルコキシル、アシル、置換アシル、C1-C6アミノアルキルまたは置換C1-C6アミノアルキルである]
を有する二環式ヌクレオシドが提供される。
[式中、
Bxは、複素環式塩基部分であり、
Ta及びTbは、それぞれ独立して、H、ヒドロキシル保護基、共役基、反応性リン基、リン部分または支持媒体への共有結合による取り付けであり、
qa、qb、qe及びqfは、それぞれ独立して、水素、ハロゲン、C1-C12アルキル、置換C1-C12アルキル、C2-C12アルケニル、置換C2-C12アルケニル、C2-C12アルキニル、置換C2-C12アルキニル、C1-C12アルコキシ、置換C1-C12アルコキシ、OJj、SJj、SOJj、SO2Jj、NJjJk、N3、CN、C(=O)OJj、C(=O)NJjJk、C(=O)Jj、O-C(=O)-NJjJk、N(H)C(=NH)NJjJk、N(H)C(=O)-NJjJkまたはN(H)C(=S)NJjJkであるか、または
qe及びqfが全体として=C(qg)(qh)であり、
qg及びqhは、それぞれ独立して、H、ハロゲン、C1-C12アルキルまたは置換C1-C12アルキルである]
を有する二環式ヌクレオシドが提供される。
製はWO98/39352及びWO99/14226にも記述されている。
[式中、
Bxは、複素環式塩基部分であり、
Ta及びTbは、それぞれ独立して、H、ヒドロキシル保護基、共役基、反応性リン基、リン部分または支持媒体への共有結合による取り付けであり、
各qi、qj、qk及びqlは、独立して、H、ハロゲン、C1-C12アルキル、置換C1-C12アルキル、C2-C12アルケニル、置換C2-C12アルケニル、C2-C12アルキニル、置換C2-C12アルキニル、C1-C12アルコキシル、置換C1-C12アルコキシル、OJj、SJj、SOJj、SO2Jj、NJjJk、N3、CN、C(=O)OJj、C(=O)NJjJk、C(=O)Jj、O-C(=O)-NJjJk、N(H)C(=NH)NJjJk、N(H)C(=O)NJjJkまたはN(H)C(=S)NJjJkであり、かつ
qiとqjまたはqlとqkは、全体として、=C(qg)(qh)であり、式中、qg及びqhは、それぞれ独立して、H、ハロゲン、C1-C12アルキルまたは置換C1-C12アルキルである]
を有する二環式ヌクレオシドが提供される。
VII
を有する糖代用物が選択され、
式中、当該少なくとも1つの式VIIのテトラヒドロピランヌクレオシド類似体のそれぞれについて、独立して、
Bxは、複素環式塩基部分であり、
Ta及びTbは、それぞれ独立して、テトラヒドロピランヌクレオシド類似体をアンチセンス化合物に連結するヌクレオシド間連結基であるか、またはTa及びTbのうちの一方がテトラヒドロピランヌクレオシド類似体をアンチセンス化合物に連結するヌクレオシド間連結基であり、Ta及びTbのうちの他方がH、ヒドロキシル保護基、連結された共役基または5’もしくは3’末端基であり、
q1、q2、q3、q4、q5、q6及びq7は、それぞれ独立して、H、C1-C6アルキル、置換C1-C6アルキル、C2-C6アルケニル、置換C2-C6アルケニル、C2-C6アルキニルまたは置換C2-C6アルキニルであり、かつR1及びR2のそれぞれは、水素、ヒドロキシル、ハロゲン、置換または無置換アルコキシ、NJ1J2、SJ1、N3、OC(=X)J1、OC(=X)NJ1J2、NJ3C(=X)NJ1J2及びCNであり、XはO、SまたはNJ1であり、かつ各J1、J2及びJ3は、独立して、HまたはC1-C6アルキルである。
、上記モルホリノ構造のさまざまな置換基を改変することによって、モルホリノが修飾されていてもよい。そのような糖代用物を本明細書では「修飾モルホリノ」という。
Letters,2007,48,3621-3623;Nauwelaerts et al.,J.Am.Chem.Soc.,2007,129(30),9340-9348;Gu et al.,Nucleosides, Nucleotides &
Nucleic Acids,2005,24(5-7),993-998;Nauwelaerts et al.,Nucleic Acids Research,2005,33(8),2452-2463;Robeyns et al.,Acta Crystallographica,Section F:Structural Biology and Crystallization Communications,2005,F61(6),585-586;Gu et al.,Tetrahedron,2004,60(9),2111-2123;Gu et al.,Oligonucleotides,2003,13(6),479-489;Wang et al.,J.Org.Chem.,2003,68,4499-4505;Verbeure
et al.,Nucleic Acids Research,2001,29(24),4941-4947;Wang et al.,J.Org.Chem.,2001,66,8478-82;Wang et al.,Nucleosides,Nucleotides & Nucleic Acids,2001,20(4-7),785-788;Wang et al.,J.Am.Chem.,2000,122,8595-8602;PCT出願公開WO06/047842;及びPCT出願公開WO01/049687を参照されたい;また、各文献の本文は、参照によりそのまま本明細書に組み込まれる)。ある特定の修飾シクロヘキセニルヌクレオシドは、式Xを有する。
Bxは、複素環式塩基部分であり、
T3及びT4は、それぞれ独立して、シクロヘキセニルヌクレオシド類似体をアンチセンス化合物に連結するヌクレオシド間連結基であるか、またはT3及びT4のうちの一方がテトラヒドロピランヌクレオシド類似体をアンチセンス化合物に連結するヌクレオシド間連結基であり、かつT3及びT4のうちの他方がH、ヒドロキシル保護基、連結された共役基、または5’末端基もしくは3’末端基であり、かつ
q1、q2、q3、q4、q5、q6、q7、q8及びq9は、それぞれ独立して、H、C1-C6アルキル、置換C1-C6アルキル、C2-C6アルケニル、置換C2-C6アルケニル、C2-C6アルキニル、置換C2-C6アルキニルまたは他の糖置換基である。
567,811;U.S.5,576,427;U.S.5,591,722;U.S.5,597,909;U.S.5,610,300;U.S.5,627,053;U.S.5,639,873;U.S.5,646,265;U.S.5,670,633;U.S.5,700,920;U.S.5,792,847及びU.S.6,600,032ならびに2005年12月22日にWO2005/121371として公開された国際出願PCT/US2005/019219(出願日2005年6月2日)
などがあり、これらはそれぞれ参照により本明細書にそのまま組み込まれる。
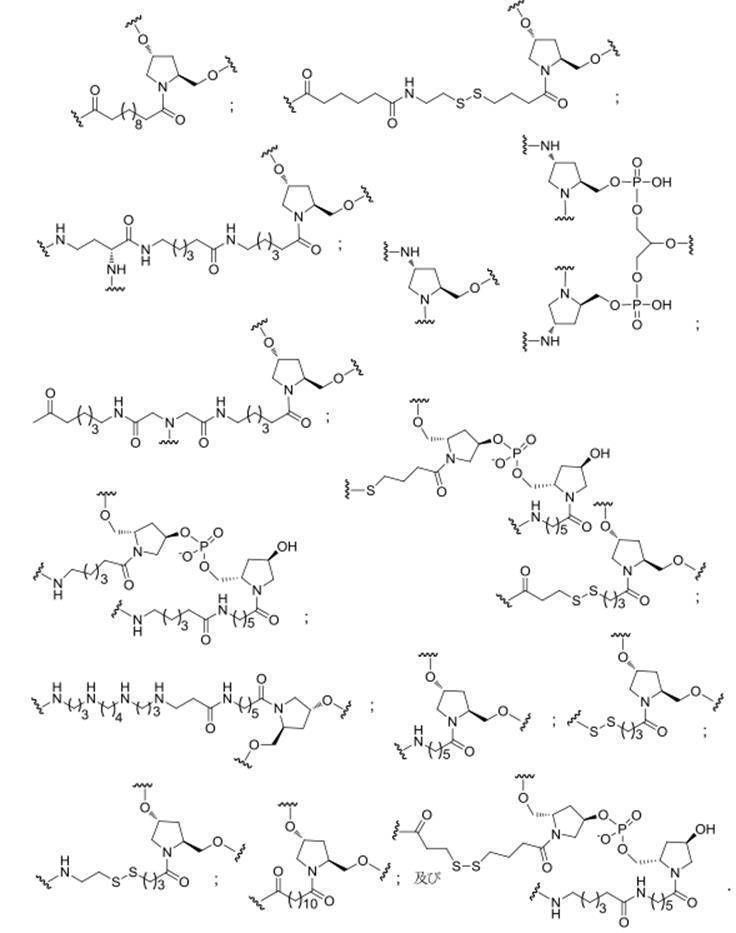
ある特定の実施形態において、本開示は、共役アンチセンス化合物を提供する。ある特定の実施形態において、本開示は、核酸転写産物に相補的なアンチセンスオリゴヌクレオチドを含む共役アンチセンス化合物を提供する。ある特定の実施形態において、本開示は、細胞を、核酸転写産物に相補的なアンチセンスオリゴヌクレオチドを含む共役アンチセンス化合物と接触させることを含む方法を提供する。ある特定の実施形態において、本開示は、細胞を、アンチセンスオリゴヌクレオチドを含む共役アンチセンス化合物と接触させること、及び細胞内の核酸転写産物の量または活性を低減させることを含む方法を提供する。
な実施形態では、共役体は、利益(細胞内への取り込みの改良)をもたらすのに十分な時間、アンチセンス化合物に取り付けられた状態にあるべきだが、その後は、切断されるか、または他の何らかの形で、活性に必要な後続ステップ、例えば標的核酸へのハイブリダイゼーション及びRNase Hまたはスプライシングもしくはスプライシング調節に関連する酵素との相互作用などを妨害しないようにすべきである。この性質のバランスは、共役体を単にセンス鎖に取り付けるだけでよいsiRNA化合物の場合よりも、一本鎖アンチセンス化合物の場合に、より一層重要である。本明細書には、共役体を欠く同じアンチセンス化合物と比較して、インビボで肝臓細胞における力価が改良されている共役一本鎖アンチセンス化合物を開示する。これらの化合物に要求される性質のバランスを考えると、そのような力価の改良は驚くべきことである。
技法を使ってオリゴヌクレオチドを合成し、最後(最も5’側)のヌクレオシドと共に共役体を導入するか、またはオリゴヌクレオチドを固体支持体から切り離してから共役体を導入することができる。
曝露の低減をもたらす。例えば、実施例20に示すように、GalNAc含有共役体の特定実施形態を含むアンチセンスオリゴヌクレオチドの濃度は、腎臓では、GalNAc含有共役体を欠くアンチセンスオリゴヌクレオチドの濃度より低い。これは、いくつかの有益な治療的意味を有する。腎臓における活性が求められていない治療的適応の場合、腎臓への曝露には、腎毒性のリスクがあり、それに見合う利益がない。さらに、腎臓における高濃度は、典型的には、尿への化合物の損失をもたらし、その結果、クリアランスが速くなる。したがって、標的が腎臓でない場合、腎臓内での蓄積は望ましくない。
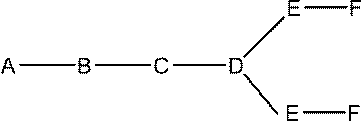
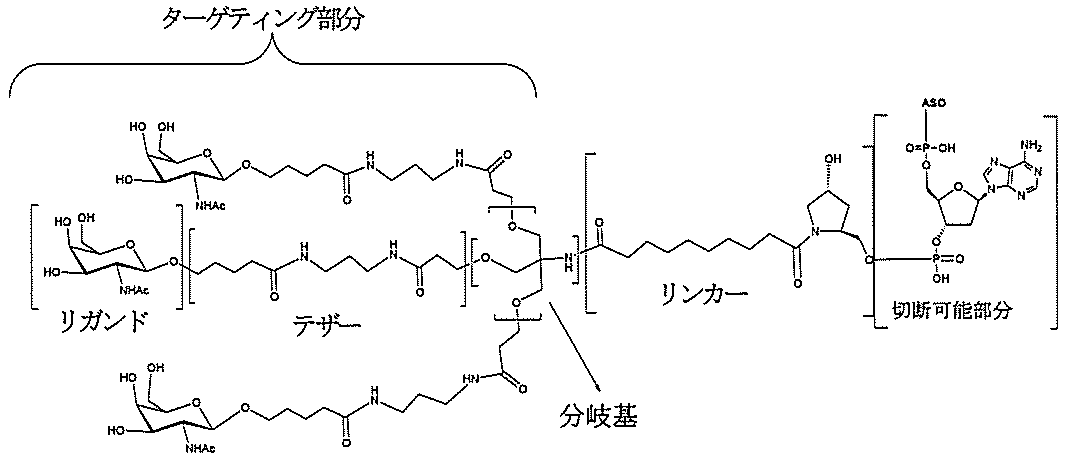
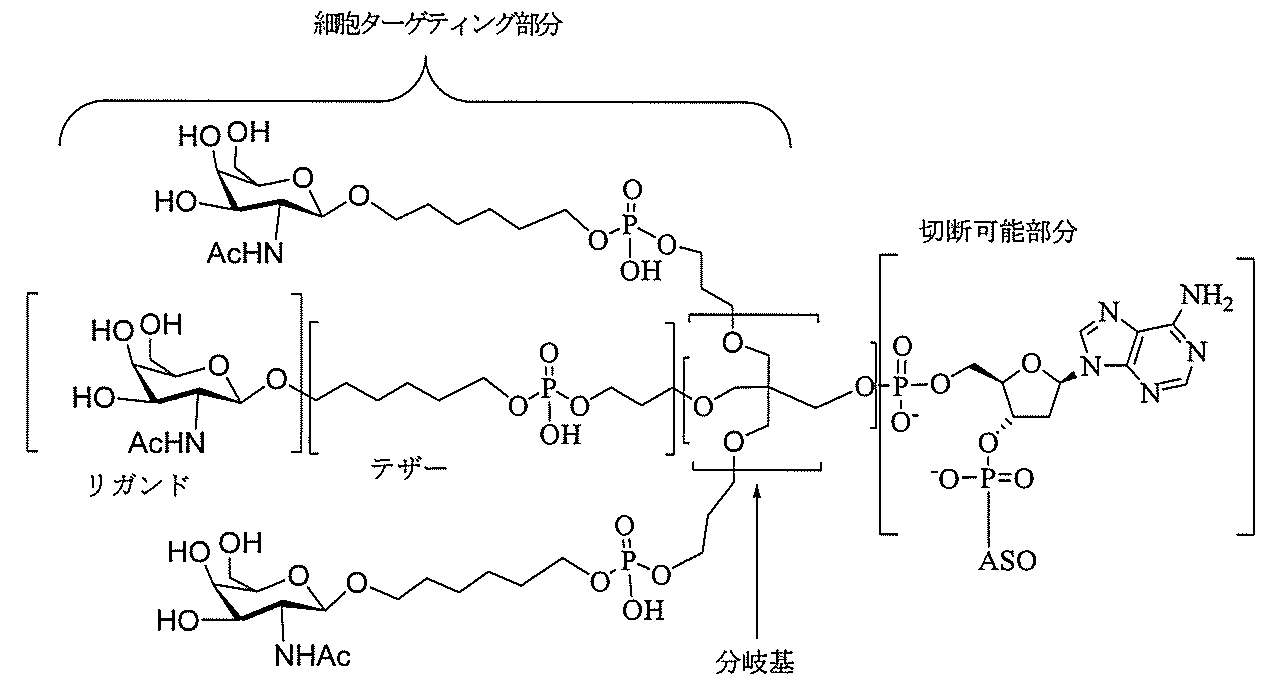
[式中、
Aは、アンチセンスオリゴヌクレオチドであり、
Bは、切断可能部分であり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、かつ
qは、1~5の整数である]
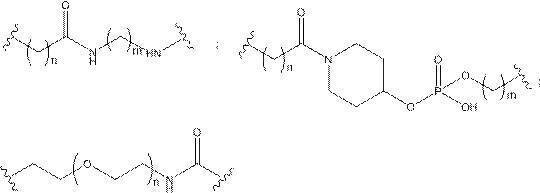
によって表される共役アンチセンス化合物を提供する。
ある特定の実施形態において、切断可能部分は、切断可能な結合である。ある特定の実施形態において、切断可能部分は、切断可能な結合を含む。ある特定の実施形態において、共役基は、切断可能部分を含む。ある特定のそのような実施形態において、切断可能部分は、アンチセンスオリゴヌクレオチドに結合する。ある特定のそのような実施形態において、切断可能部分は、細胞ターゲティング部分に直接結合する。ある特定のそのような実施形態において、切断可能部分は、共役リンカーに結合する。ある特定の実施形態において、切断可能部分は、ホスフェートまたはホスホジエステルを含む。ある特定の実施形態において、切断可能部分は、切断可能なヌクレオシドまたはヌクレオシド類似体である。ある特定の実施形態において、ヌクレオシドまたはヌクレオシド類似体は、プリン、置換プリン、ピリミジン、または置換ピリミジンから選択される場合によっては保護された複素環式塩基を含む。ある特定の実施形態において、切断可能部分は、ウラシル、チミン、シトシン、4-N-ベンゾイルシトシン、5-メチルシトシン、4-N-ベンゾイル-5-メチルシトシン、アデニン、6-N-ベンゾイルアデニン、グアニン、及び2-N-イソブチリルグアニンから選択される、場合によっては保護された複素環式塩基を含むヌクレオシドである。ある特定の実施形態では、切断可能部分が、ホスホジエステル連結部によってアンチセンスオリゴヌクレオチドの3’位に取り付けられ、かつホスホジエステルまたはホスホロチオエート連結部によってリンカーに取り付けられた2’-デオキシヌクレオシドである。ある特定の実施形態では、切断可能部分が、ホスホジエステル連結部によってアンチセンスオリゴヌクレオチドの3’位に取り付けられ、かつホスホジエステルまたはホスホロチオエート連結部によってリンカーに取り付けられた2’-デオキシアデノシンである。ある特定の実施形態では、切断可能部分が、ホスホジエステル連結部に
よってアンチセンスオリゴヌクレオチドの3’位に取り付けられ、かつホスホジエステル連結部によってリンカーに取り付けられた2’-デオキシアデノシンである。
ある特定の実施形態において、共役基は、リンカーを含む。ある特定のそのような実施形態において、リンカーは、切断可能部分に共有結合される。ある特定のそのような実施形態において、リンカーは、アンチセンスオリゴヌクレオチドに共有結合される。ある特定の実施形態において、リンカーは、細胞ターゲティング部分に共有結合される。ある特定の実施形態において、リンカーは、固体支持体への共有結合をさらに含む。ある特定の実施形態において、リンカーは、タンパク質結合部分への共有結合をさらに含む。ある特定の実施形態において、リンカーは、固体支持体への共有結合をさらに含み、タンパク質結合部分への共有結合もさらに含む。ある特定の実施形態において、リンカーは、係留される(tethered)リガンドを取り付けるための位置を複数含んでいる。ある特定の実施形態において、リンカーは、係留されるリガンドを取り付けるための位置を複数含み、分岐基には取り付けられない。ある特定の実施形態において、リンカーは、2つ以上の切断可能な結合をさらに含む。ある特定の実施形態において、共役基は、リンカーを含まない。
ロール、コール酸、アダマンタン酢酸、1-ピレン酪酸、ジヒドロテストステロン、1,3-ビス-O(ヘキサデシル)グリセロール、ゲラニルオキシヘキシル基、ヘキサデシルグリセロール、ボルネオール、メントール、1,3-プロパンジオール、ヘプタデシル基、パルミチン酸、ミリスチン酸、O3-(オレオイル)リトコール酸、O3-(オレオイル)コレン酸、ジメトキシトリチル、またはフェノキサジン)、ビタミン(例えば葉酸塩、ビタミンA、ビタミンE、ビオチン、ピリドキサール)、ペプチド、炭水化物(例えば単糖、二糖、三糖、四糖、オリゴ糖、多糖)、エンドソーム溶解成分、ステロイド(例えばウバオール、ヘシゲニン、ジオスゲニン)、テルペン(例えばトリテルペン、例えば、サルササポゲニン、フリーデリン、エピフリーデラノール誘導体化リトコール酸)、またはカチオン性脂質を含むが、これらに限定されない。ある特定の実施形態において、タンパク質結合部分は、C16~C22長鎖飽和もしくは不飽和脂肪酸、コレステロール、コール酸、ビタミンE、アダマンタン、または1-ペンタフルオロプロピルである。
ある特定の実施形態において、共役基は、細胞ターゲティング部分を含む。ある特定のそのような細胞ターゲティング部分は、アンチセンス化合物の細胞取り込みを増加させる。ある特定の実施形態において、細胞ターゲティング部分は、分岐基、2つ以上のテザー、及び2つ以上のリガンドを含む。ある特定の実施形態において、細胞ターゲティング部分は、分岐基、2つ以上のテザー、2つ以上のリガンド、及び2つ以上の切断可能な結合を含む。
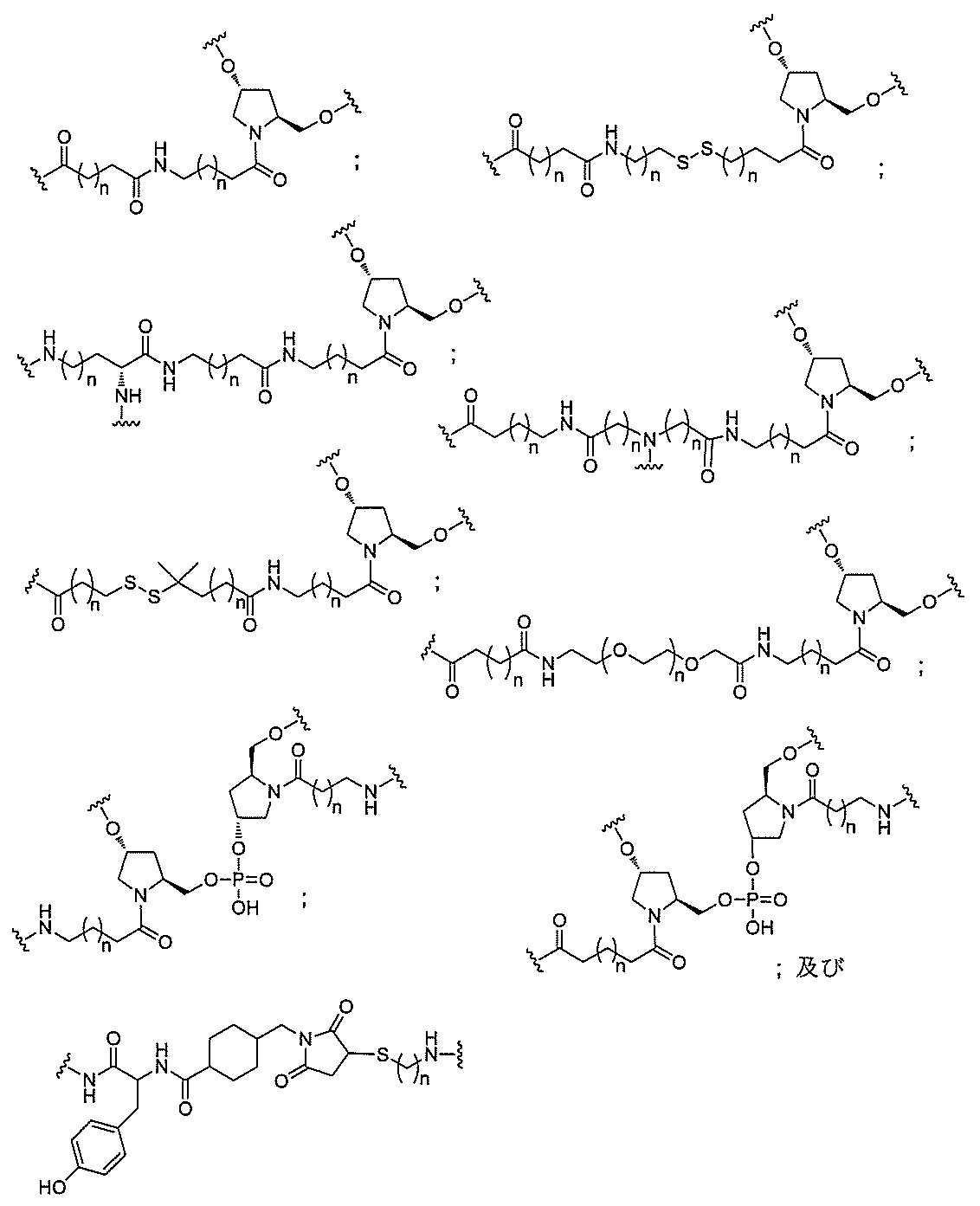
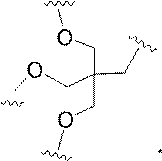
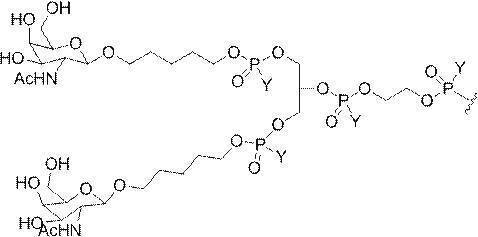
ある特定の実施形態において、共役基は、分岐基及び少なくとも2つのテザーリガンドを含むターゲティング部分を含む。ある特定の実施形態において、分岐基は、共役リンカーを結合する。ある特定の実施形態において、分岐基は、切断可能部分を結合する。ある特定の実施形態において、分岐基は、アンチセンスオリゴヌクレオチドを結合する。ある特定の実施形態において、分岐基は、リンカー及びテザーリガンドのそれぞれに共有結合される。ある特定の実施形態において、分岐基は、アルキル、アミド、ジスルフィド、ポリエチレングリコール、エーテル、チオエーテル及びヒドロキシルアミノ基から選択される基を含む分岐状脂肪族基を含む。ある特定の実施形態において、分岐基は、アルキル、アミド、及びエーテル基から選択される基を含む。ある特定の実施形態において、分岐基は、アルキル及びエーテル基から選択される基を含む。ある特定の実施形態において、分岐基は、単環式または多環式環系を含む。ある特定の実施形態において、分岐基は、2つ以上の切断可能な結合を含む。ある特定の実施形態において、共役基は、分岐基を含まない。
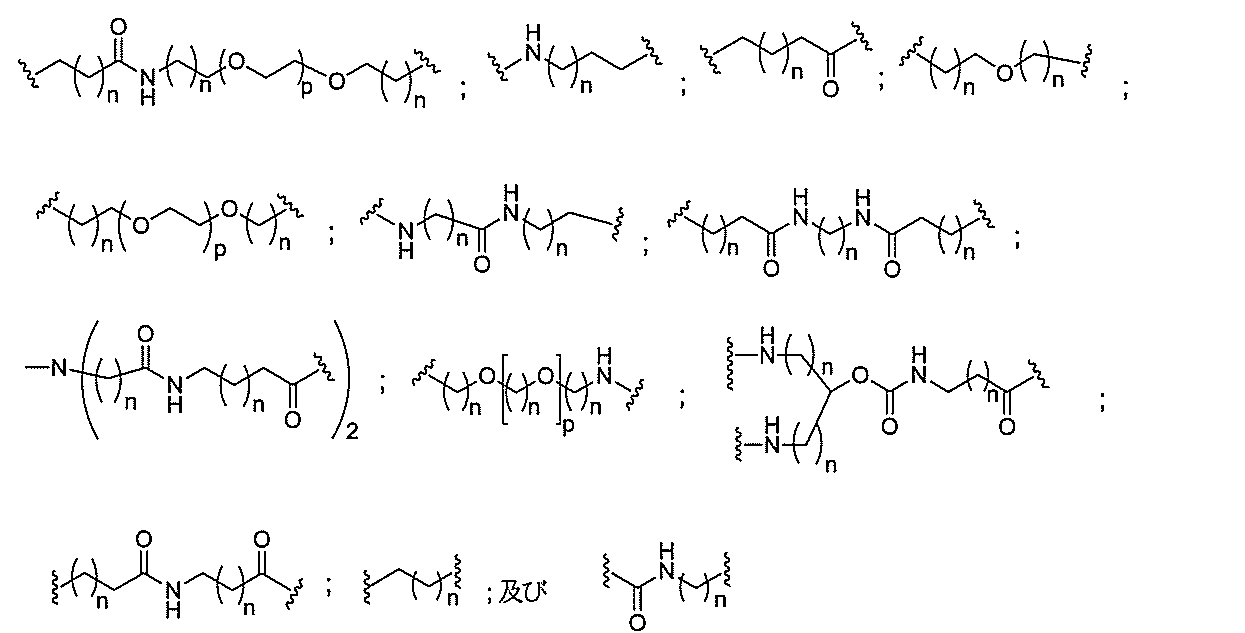
ある特定の実施形態において、共役基は、分岐基に共有結合される2つ以上のテザーを含む。ある特定の実施形態において、共役基は、連結基に共有結合される2つ以上のテザーを含む。ある特定の実施形態において、各テザーは、アルキル、エーテル、チオエーテル、ジスルフィド、アミド、及びポリエチレングリコール基から選択される2つ以上の基を任意の組み合わせで含む線状脂肪族基である。ある特定の実施形態において、各テザーは、アルキル、置換アルキル、エーテル、チオエーテル、ジスルフィド、アミド、ホスホジエステル及びポリエチレングリコール基から選択される2つ以上の基を任意の組み合わせで含む線状脂肪族基である。ある特定の実施形態において、各テザーは、アルキル、エーテル、及びアミド基から選択される2つ以上の基を任意の組み合わせで含む線状脂肪族基である。ある特定の実施形態において、各テザーは、アルキル、置換アルキル、ホスホ
ジエステル、エーテル、及びアミド基から選択される2つ以上の基を任意の組み合わせで含む線状脂肪族基である。ある特定の実施形態において、各テザーは、アルキル及びホスホジエステルから選択される2つ以上の基を任意の組み合わせで含む線状脂肪族基である。ある特定の実施形態において、各テザーは、少なくとも1つのリン連結基または中性連結基を含む。
Z1は、C(=O)O-R2であり、
Z2は、H、C1-C6アルキルまたは置換C1-C6アルキルであり、
R2はH、C1-C6アルキルまたは置換C1-C6アルキルであり、
各m1は独立して0~20であり、各テザーにつき少なくとも1つのm1は0よりも大きい。
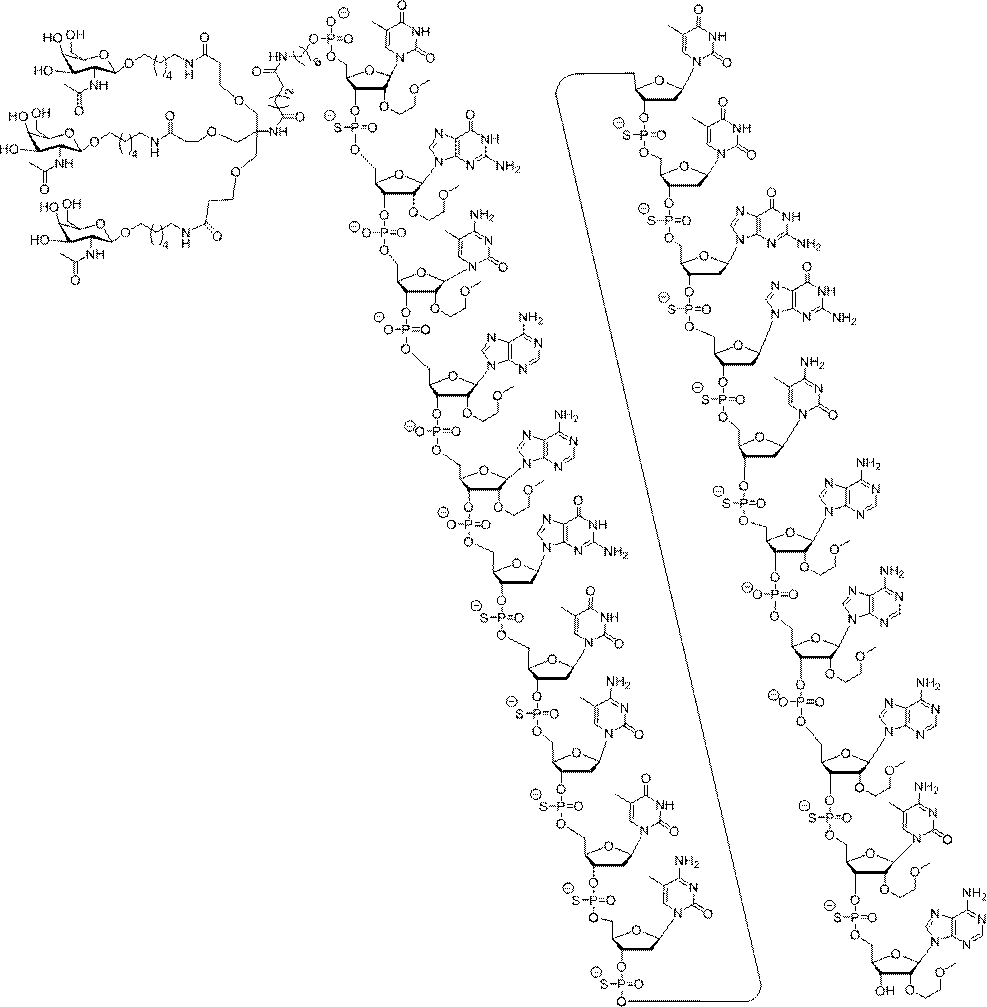
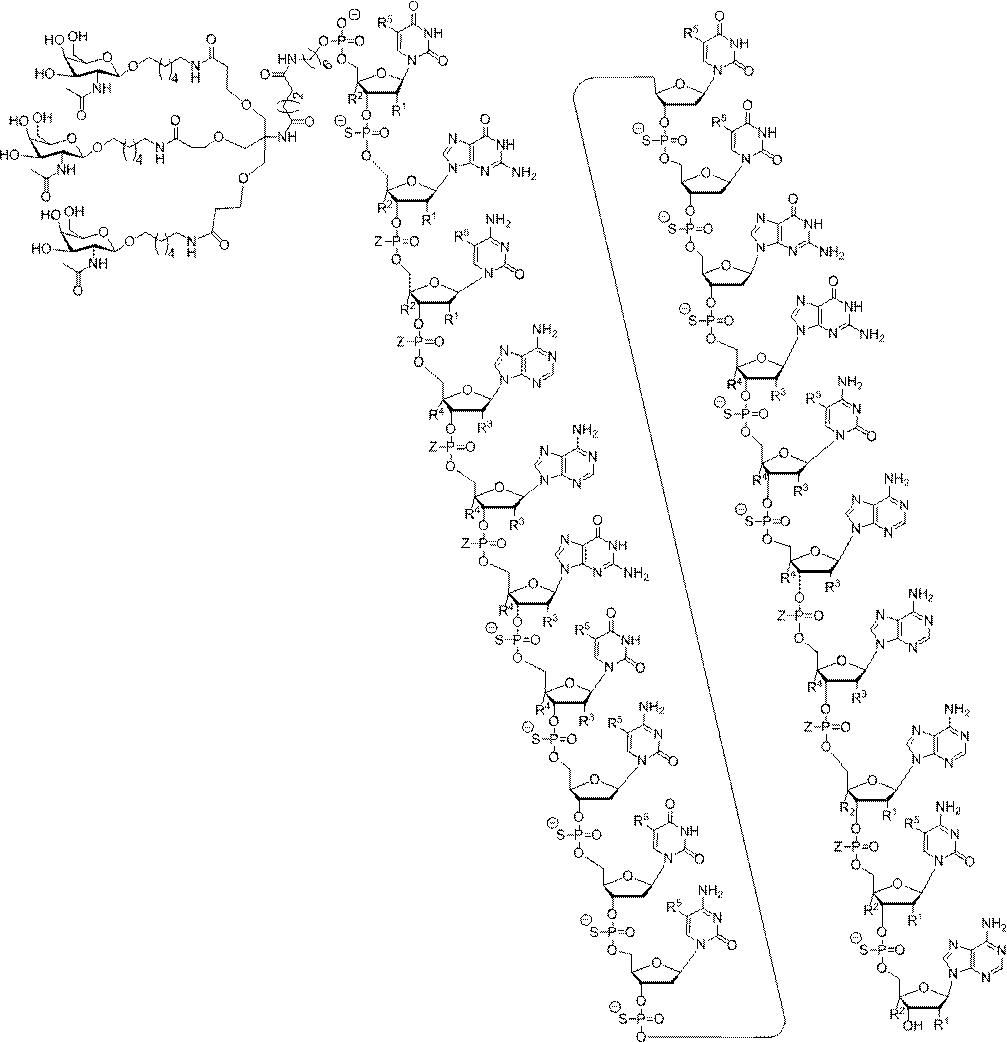
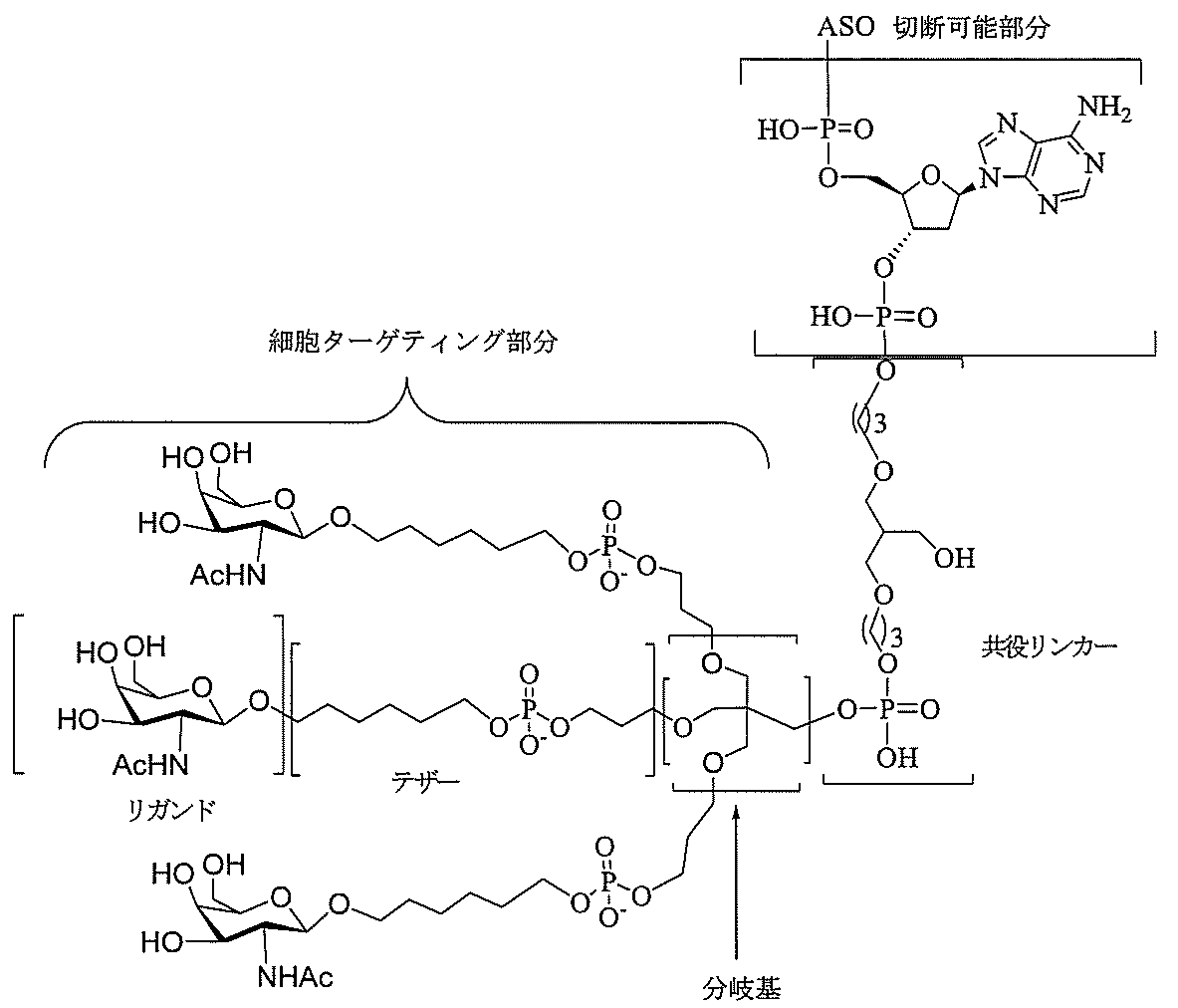
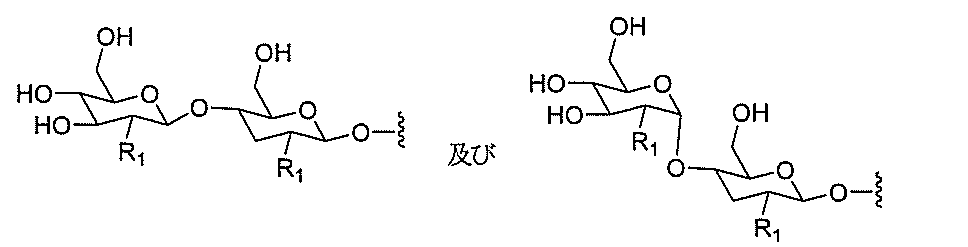
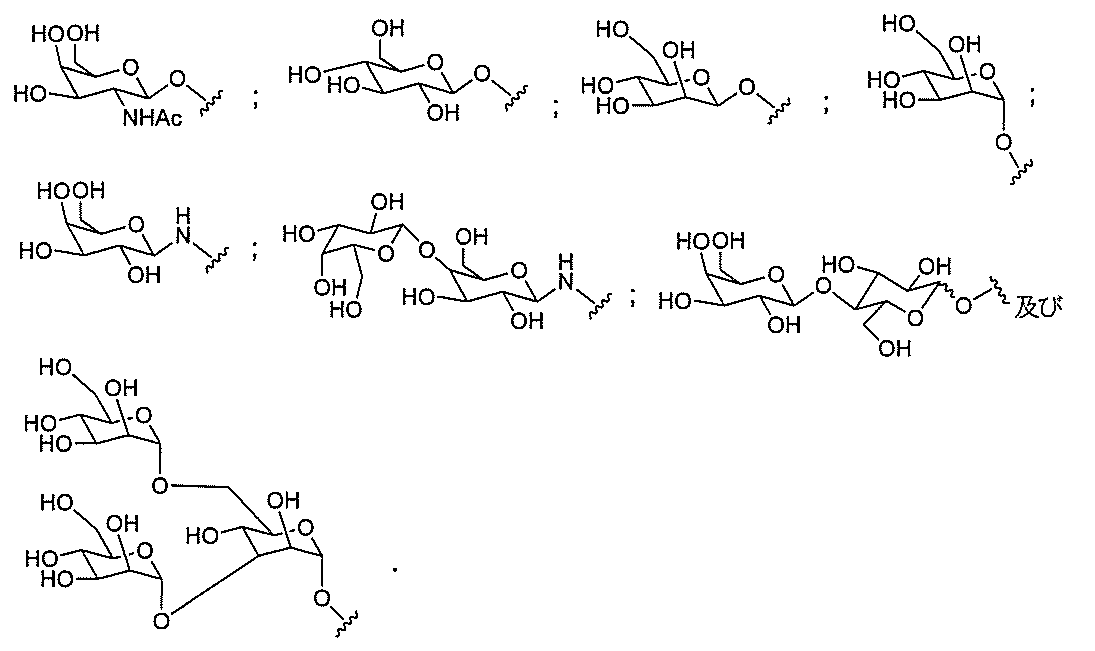
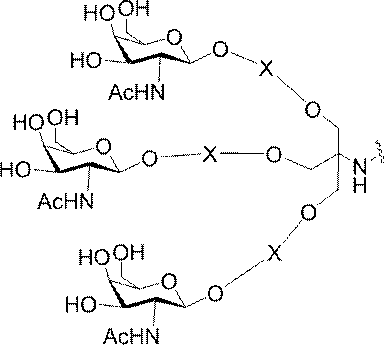
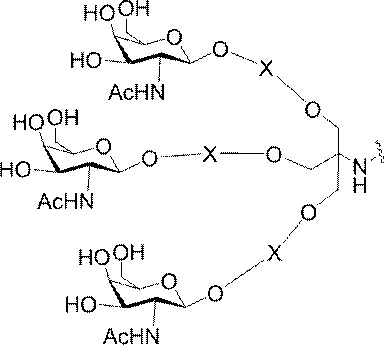
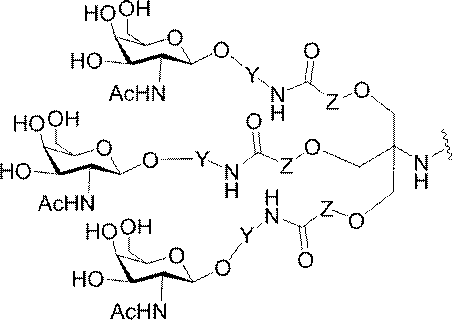
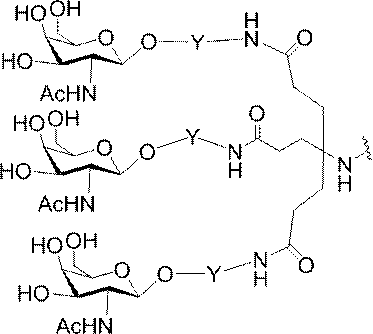
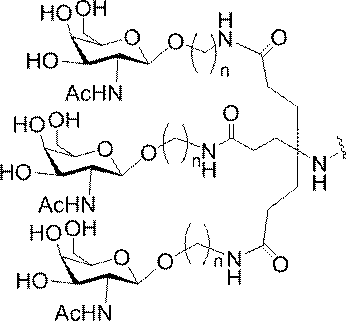
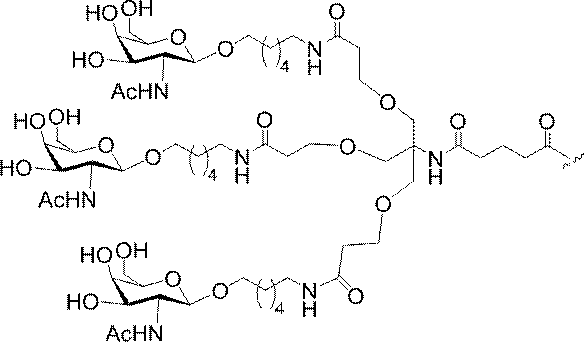
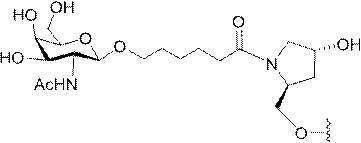
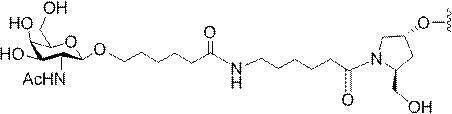
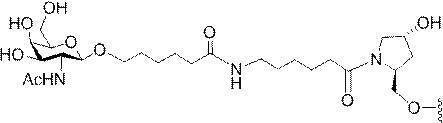
ある特定の実施形態において、本開示は、各リガンドがテザーに共有結合されるリガンドを提供する。ある特定の実施形態において、各リガンドは、標的細胞において少なくとも1種類の受容体に対する親和性を有するように選択される。ある特定の実施形態において、哺乳類肝臓細胞の表面において少なくとも1種類の受容体に対する親和性を有するリガンドが選択される。ある特定の実施形態において、肝アシアロ糖タンパク質受容体(ASGP-R)に対する親和性を有するリガンドが選択される。ある特定の実施形態において、各リガンドは、炭水化物である。ある特定の実施形態において、各リガンドは、ガラクトース、N-アセチルガラクトースアミン、マンノース、グルコース、グルコサミン、及びフコースから独立して選択される。ある特定の実施形態において、各リガンドは、N-アセチルガラクトースアミン(GalNAc)である。ある特定の実施形態において、ターゲティング部分は2~6個のリガンドを含む。ある特定の実施形態において、ターゲティング部分は3個のリガンドを含む。ある特定の実施形態において、ターゲティング部分は3個のN-アセチルガラクトサミンリガンドを含む。
デオキシ-D-ガラクトピラノースの両方を含む、2-(アセチルアミノ)-2-デオキシ-D-ガラクトピラノースを指す。ある特定の実施形態において、β型:2-(アセチルアミノ)-2-デオキシ-β-D-ガラクトピラノースとα型:2-(アセチルアミノ)-2-デオキシ-D-ガラクトピラノースはどちらも可換的に使用されうる。したがって一方の型が図示される構造において、これらの構造は、他方の型も同様に含むものとする。例えばα型:2-(アセチルアミノ)-2-デオキシ-D-ガラクトピラノースの構造が示される場合、この構造は他方の型も同様に含むものとする。特定の好ましい実施形態では、β型:2-(アセチルアミノ)-2-デオキシ-D-ガラクトピラノースが好ましい実施形態である。
ある特定の実施形態において、共役基は、上述の構造的特徴を含む。特定のそのような実施形態において、共役基は以下の構造を有し、
式中、Y及びZは、C1-C12置換もしくは無置換アルキル、アルケニル、もしくはアルキニル基、またはエーテル、ケトン、アミド、エステル、カルバメート、アミン、ピペリジン、ホスフェート、ホスホジエステル、ホスホロチオエート、トリアゾール、ピロリジン、ジスルフィド、もしくはチオエーテルを含む基から独立して選択される。
式中、Y及びZは、C1-C12置換もしくは無置換アルキル基、またはエーテル1個だけもしくはエーテル2個だけ、アミド、アミン、ピペリジン、ホスフェート、ホスホジエステル、またはホスホロチオエートを含む基から独立して選択される。
式中、Yは、C1-C12置換もしくは無置換アルキル、アルケニル、もしくはアルキニル基、またはエーテル、ケトン、アミド、エステル、カルバメート、アミン、ピペリジン、ホスフェート、ホスホジエステル、ホスホロチオエート、トリアゾール、ピロリジン、ジスルフィド、もしくはチオエーテルを含む基から選択される。
ある特定の実施形態において、共役体は、ヌクレオシドの2’、3’、または5’位でアンチセンスオリゴヌクレオチドのヌクレオシドに結合される。ある特定の実施形態において、共役アンチセンス化合物は以下の構造を有し、
式中、
Aは、アンチセンスオリゴヌクレオチドであり、
Bは、切断可能部分であり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
式中、
Aは、アンチセンスオリゴヌクレオチドであり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
ある特定のそのような実施形態において、共役リンカーは、少なくとも1つの切断可能な結合を含む。
ある特定のそのような実施形態において、分岐基は、少なくとも1つの切断可能な結合を含む。
ある特定の実施形態において、各テザーは、少なくとも1つの切断可能な結合を含む。
a Triantennary Galactoside with High Affinity for the Hepatic Asialoglycoprotein Receptor:a Potent Cholesterol Lowering
Agent」J.Med.Chem.(1995)38:1846-1852、BIESSEN et al.「Synthesis of Cluster Galactoside with High Affinity for the Hepatic Asialoglycoprotein Receptor」J.Med.Chem.(1995)38:1538-1546、LEE et al.「New and more efficient multivalent glyco-ligands for asialoglycoprotein receptor of mammalian hepatocytes」Bioorganic & Medicinal Ch
emistry(2011)19:2494-2500、RENSEN et al.「Determination of the Upper Size Limit for Uptake and Processing of Ligands by the Asialoglycoprotein Receptor on Hepatocytes in Vitro and in Vivo」J.Biol.Chem.(2001)276(40):37577-37584、RENSEN et al.「Design and Synthesis of Novel N-Acetylgalactosamine-Terminated Glycolipids for Targeting of Lipoproteins to the Hepatic Asialoglycoprotein Receptor」J.Med.Chem.(2004)47:5798-5808、SLIEDREGT et al.「Design and Synthesis of Novel Amphiphilic Dendritic Galactosides for Selective Targeting of Liposomes to the Hepatic Asialoglycoprotein Receptor」J.Med.Chem.(1999)42:609-618、及びValentijn et al.「Solid-phase synthesis of lysine-based Cluster galactosides with high affinity for the Asialoglycoprotein Receptor」Tetrahedron,1997,53(2),759-770が含まれるが、これらに限定されず、これらの文献のそれぞれは、参照によりその全体が本明細書に組み込まれる。
al.,J Med Chem,1995,38,1538-1546、Valentijn et al.,Tetrahedron,1997,53,759-770、Kim et al.,Tetrahedron Lett,1997,38,3487-3490、Lee et al.,Bioconjug Chem,1997,8,762-765、Kato et al.,Glycobiol,2001,11,821-829、Rensen et al.,J Biol Chem,2001,276,37577-37584、Lee et al.,Methods Enzymol,2003,362,38-43、Westerlind et al.,Glycoconj
J,2004,21,227-241、Lee et al.,Bioorg Med
Chem Lett,2006,16(19),5132-5135、Maierhofer et al.,Bioorg Med Chem,2007,15,7661-7676、Khorev et al.,Bioorg Med Chem,2008,16,5216-5231、Lee et al.,Bioorg Med Chem,2011,19,2494-2500、Kornilova et al.,Analyt Biochem,2012,425,43-46、Pujol et al.,Angew Chemie Int Ed Engl,2012,51,7445-7448、Biessen et al.,J Med Chem,1995,38,1846-
1852、Sliedregt et al.,J Med Chem,1999,42,609-618、Rensen et al.,J Med Chem,2004,47,5798-5808、Rensen et al.,Arterioscler Thromb Vasc Biol,2006,26,169-175、van Rossenberg et al.,Gene Ther,2004,11,457-464、Sato et al.,J Am Chem Soc,2004,126,14013-14022、Lee et al.,J Org Chem,2012,77,7564-7571、Biessen et al.,FASEB J,2000,14,1784-1792、Rajur et al.,Bioconjug Chem,1997,8,935-940、Duff et al.,Methods Enzymol,2000,313,297-321、Maier et al.,Bioconjug Chem,2003,14,18-29、Jayaprakash et al.,Org
Lett,2010,12,5410-5413、Manoharan,Antisense Nucleic Acid Drug Dev,2002,12,103-128、Merwin et al.,Bioconjug Chem,1994,5,612-620、Tomiya et al.,Bioorg Med Chem,2013,21,5275-5281、国際出願WO1998/013381;WO2011/038356;WO1997/046098;WO2008/098788;WO2004/101619;WO2012/037254;WO2011/120053;WO2011/100131;WO2011/163121;WO2012/177947;WO2013/033230;WO2013/075035;WO2012/083185;WO2012/083046;WO2009/082607;WO2009/134487;WO2010/144740;WO2010/148013;WO1997/020563;WO2010/088537;WO2002/043771;WO2010/129709;WO2012/068187;WO2009/126933;WO2004/024757;WO2010/054406;WO2012/089352;WO2012/089602;WO2013/166121;WO2013/165816;米国特許4,751,219;8,552,163;6,908,903;7,262,177;5,994,517;6,300,319;8,106,022;7,491,805;7,491,805;7,582,744;8,137,695;6,383,812;6,525,031;6,660,720;7,723,509;8,541,548;8,344,125;8,313,772;8,349,308;8,450,467;8,501,930;8,158,601;7,262,177;6,906,182;6,620,916;8,435,491;8,404,862;7,851,615;米国特許出願公開US2011/0097264;US2011/0097265;US2013/0004427;US2005/0164235;US2006/0148740;US2008/0281044;US2010/0240730;US2003/0119724;US2006/0183886;US2008/0206869;US2011/0269814;US2009/0286973;US2011/0207799;US2012/0136042;US2012/0165393;US2008/0281041;US2009/0203135;US2012/0035115;US2012/0095075;US2012/0101148;US2012/0128760;US2012/0157509;US2012/0230938;US2013/0109817;US2013/0121954;US2013/0178512;US2013/0236968;US2011/0123520;US2003/0077829;US2008/0108801;及びUS2009/0203132のうちのいずれかにおいて見いだされる任意の共役基を含み、これらの文献のそれぞれは参照によりその全体が組み込まれる。
アンチセンス化合物がPKK核酸のレベル、活性または発現に与える効果は、様々な細胞型でin vitroで試験を行うことができる。このような分析に使用する細胞型は、市販の販売者(例えば、American Type Culture Collection, Manassus, VA; Zen-Bio, Inc., Research Triangle Park, NC; Clonetics Corporation, Walkersville、MD)から入手可能であり、市販で入手可能な試薬(例えばLife Technologies、カリフォルニア州カールズバッド)を使用して、販売者の指示書に従って培養する。例示的な細胞型としては、HepaRGTMT細胞及びマウス初代培養肝細胞が挙げられるが、これらに限定されない。
本明細書には、細胞をアンチセンスオリゴヌクレオチドで処置するための方法を記載する。この方法には、他のアンチセンス化合物による処置のために、適宜変更を加えることができる。
使用される。エレクトロポレーションによるトランスフェクションの場合は、それより高い625nMから20,000nMまでの範囲の濃度で、アンチセンスオリゴヌクレオチドが使用される。
RNA分析は、全細胞RNAまたはポリ(A)+mRNAで行うことができる。RNA単離の方法は当技術分野ではよく知られている。RNAは当技術分野において周知の方法を使って、例えばTRIZOL試薬(Life Technologies,カリフォルニア州カールズバッド)を製造者が推奨するプロトコルに従って使用することによって、調製される。
PKK核酸のレベルまたは発現の阻害は、当技術分野で周知の様々な方法でアッセイすることができる。例えば、標的核酸レベルは、例えばノーザンブロット分析、競合的ポリメラーゼ連鎖反応(PCR)、または定量的リアルタイムPCRによって定量することができる。RNA分析は、全細胞RNAまたはポリ(A)+mRNAで行うことができる。RNA単離の方法は当技術分野ではよく知られている。ノーザンブロット分析は、また当該技術分野ではルーチンになっている。定量的リアルタイムPCRは、PE-Applied Biosystems社、カリフォルニア州フォスターシティーから入手できる市販のABI PRISM 7600、7700、または7900配列検出システムを、製造者の指示書に従って使用することで好都合に達成することができる。
標的RNAレベルの定量は、製造業者の説明書に従ってABI PRISM 7600、7700、または7900配列検出システム(PE-Applied Biosystems社、カリフォルニア州フォスターシティ)を用いて定量的リアルタイムPCRによって達成することができる。定量的リアルタイムPCRの方法は、当技術分野でよく知られている。
R EXPRESSソフトウェア(Applied Biosystems、カリフォルニア州フォスターシティ)等のソフトウェアを使用してもよい。
PKK核酸のアンチセンス阻害は、PKKタンパク質レベルを測定することによって評価することができる。PKKのタンパク質レベルは、免疫沈降、ウエスタンブロット分析(イムノブロッティング)、酵素結合免疫吸着アッセイ(ELISA)、定量タンパク質アッセイ、タンパク質活性アッセイ(例えば、カスパーゼ活性アッセイ)、免疫組織化学、免疫細胞化学または蛍光活性化細胞選別(FACS)等の当該技術で周知の様々な方法で評価または定量化することができる。標的に対する抗体を同定し、抗体のMSRSカタログ(Aerie Corporation、ミズーリ州バーミンガム)等の種々のソースから得ることができ、当該技術で周知の従来のモノクローナルまたはポリクローナル抗体生成法で調製することができる。
PKKの発現を阻害し、表現型の変化を起こす能力を評価するために、アンチセンス化合物、例えば、アンチセンスオリゴヌクレオチドの試験を動物で行う。
ある特定の実施形態では、本発明は、個体の治療方法を提供し、本明細書に記載の1つ以上の医薬組成物を投与することを含む。
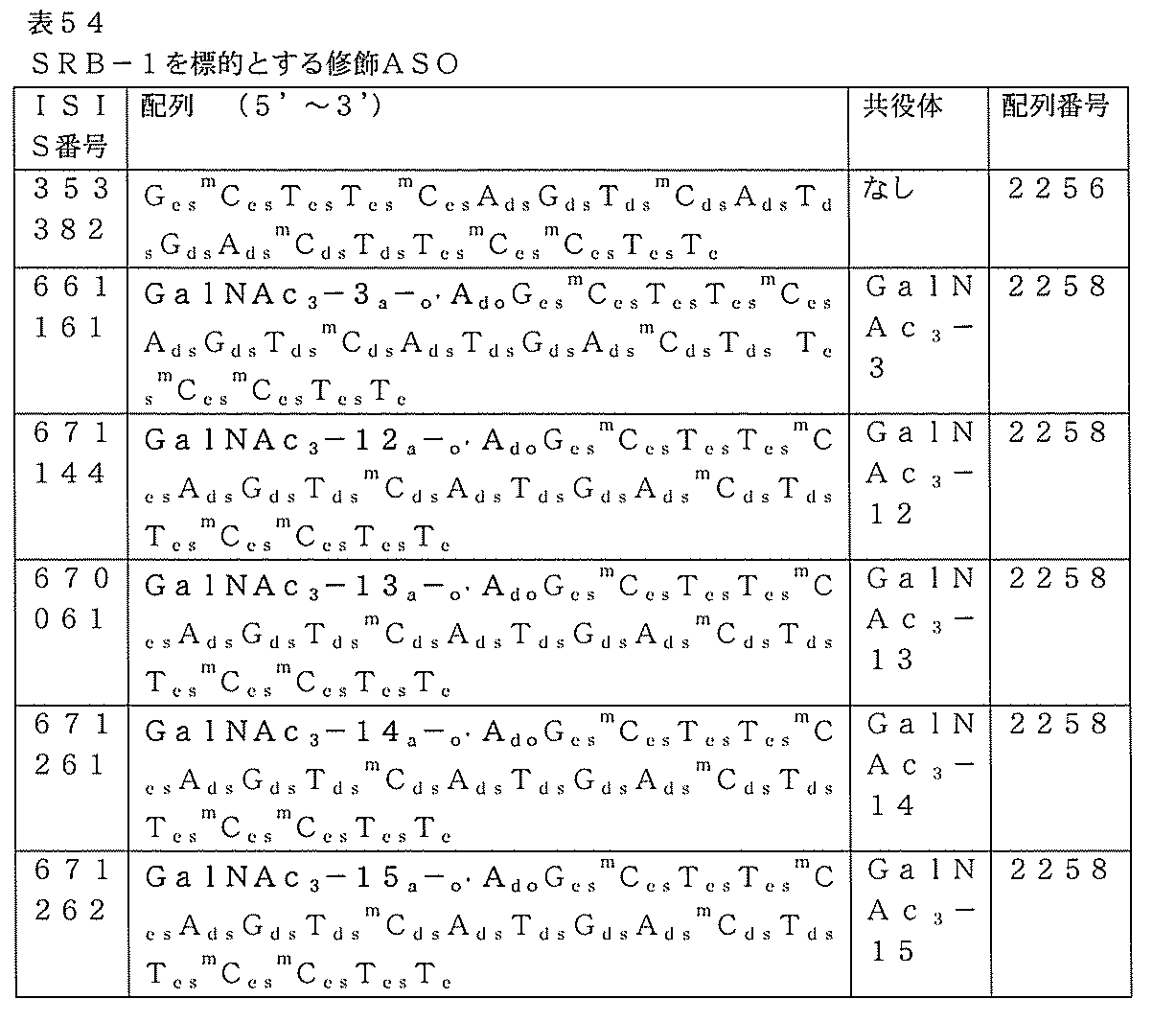
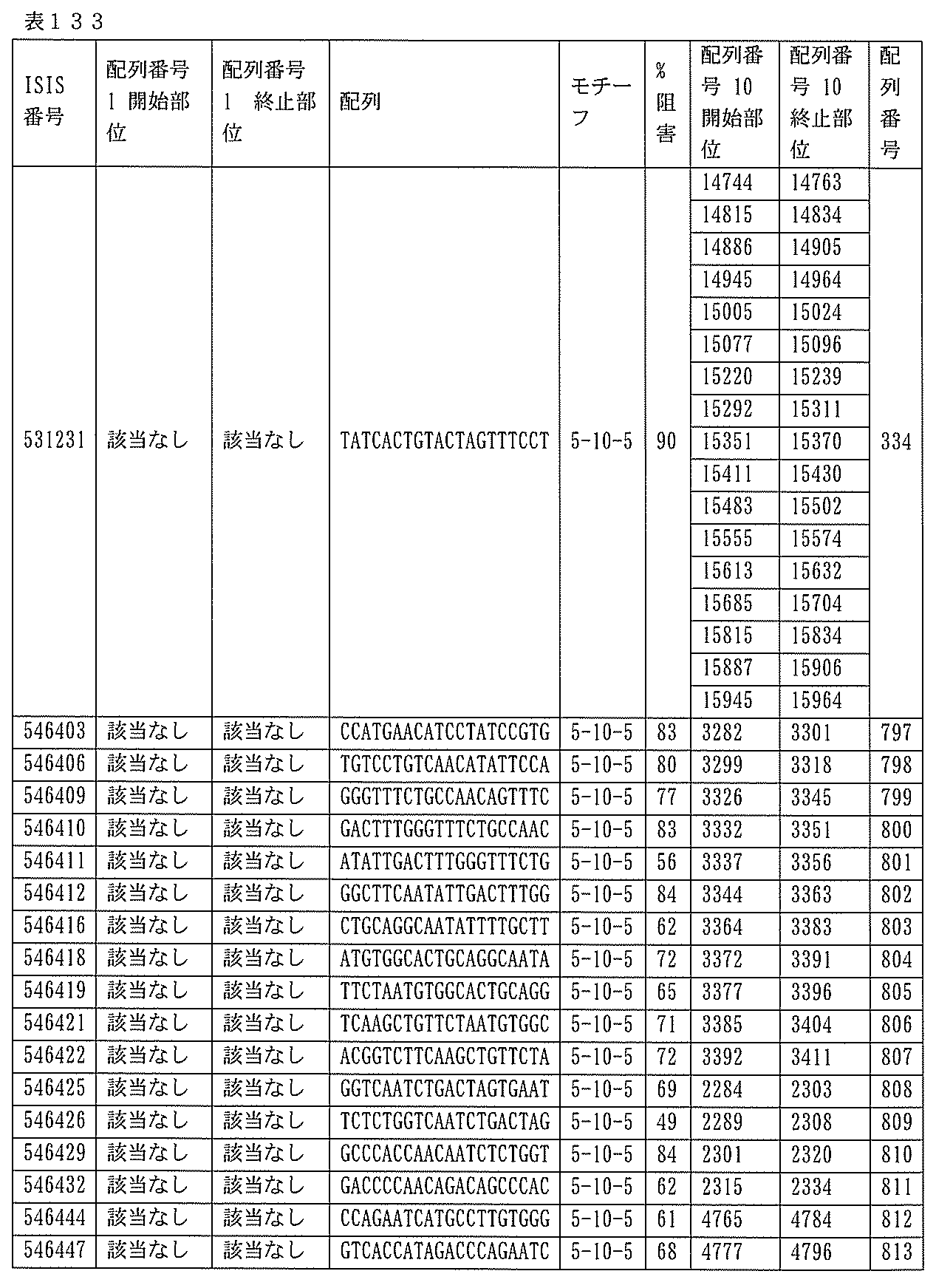
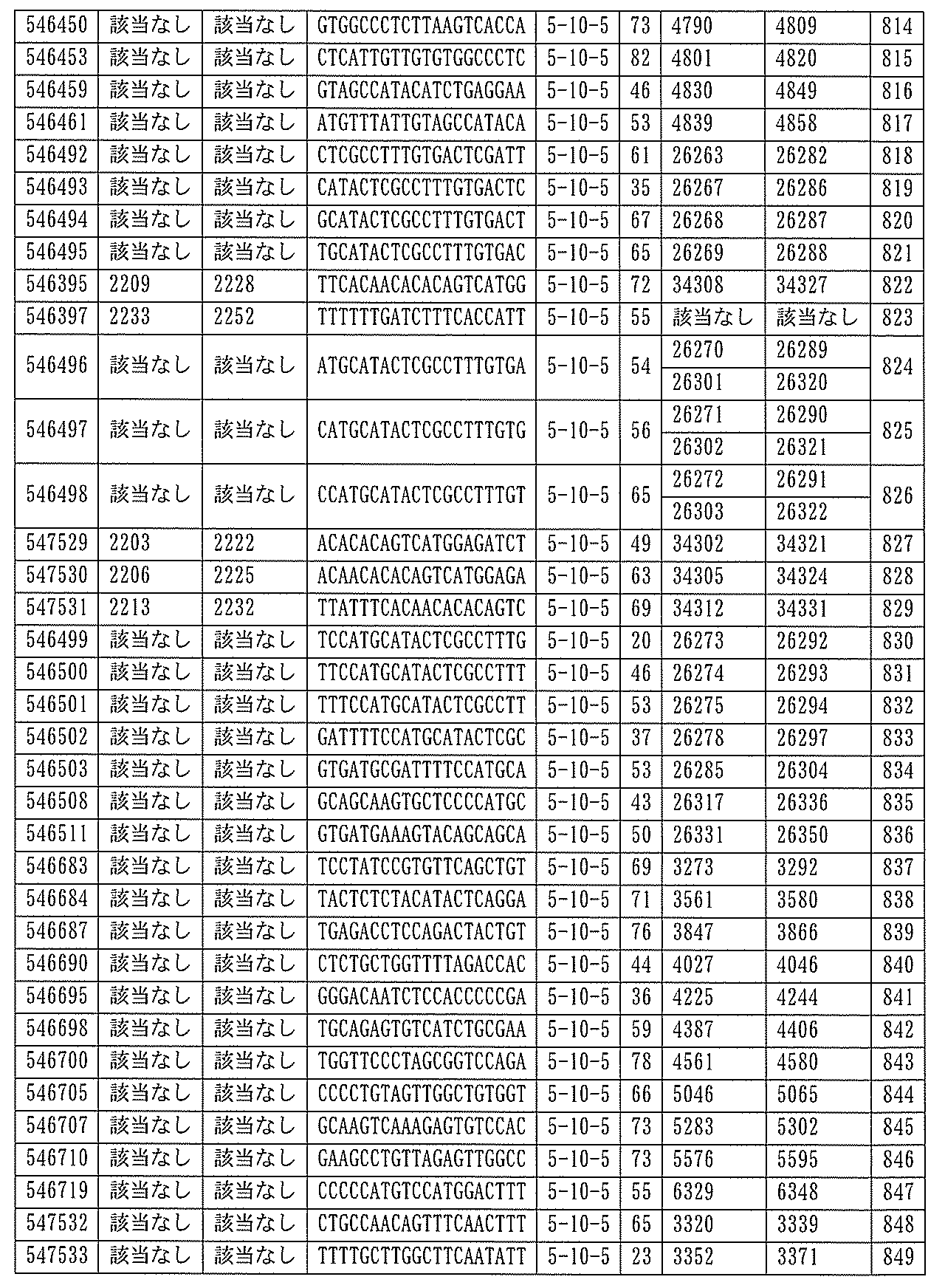
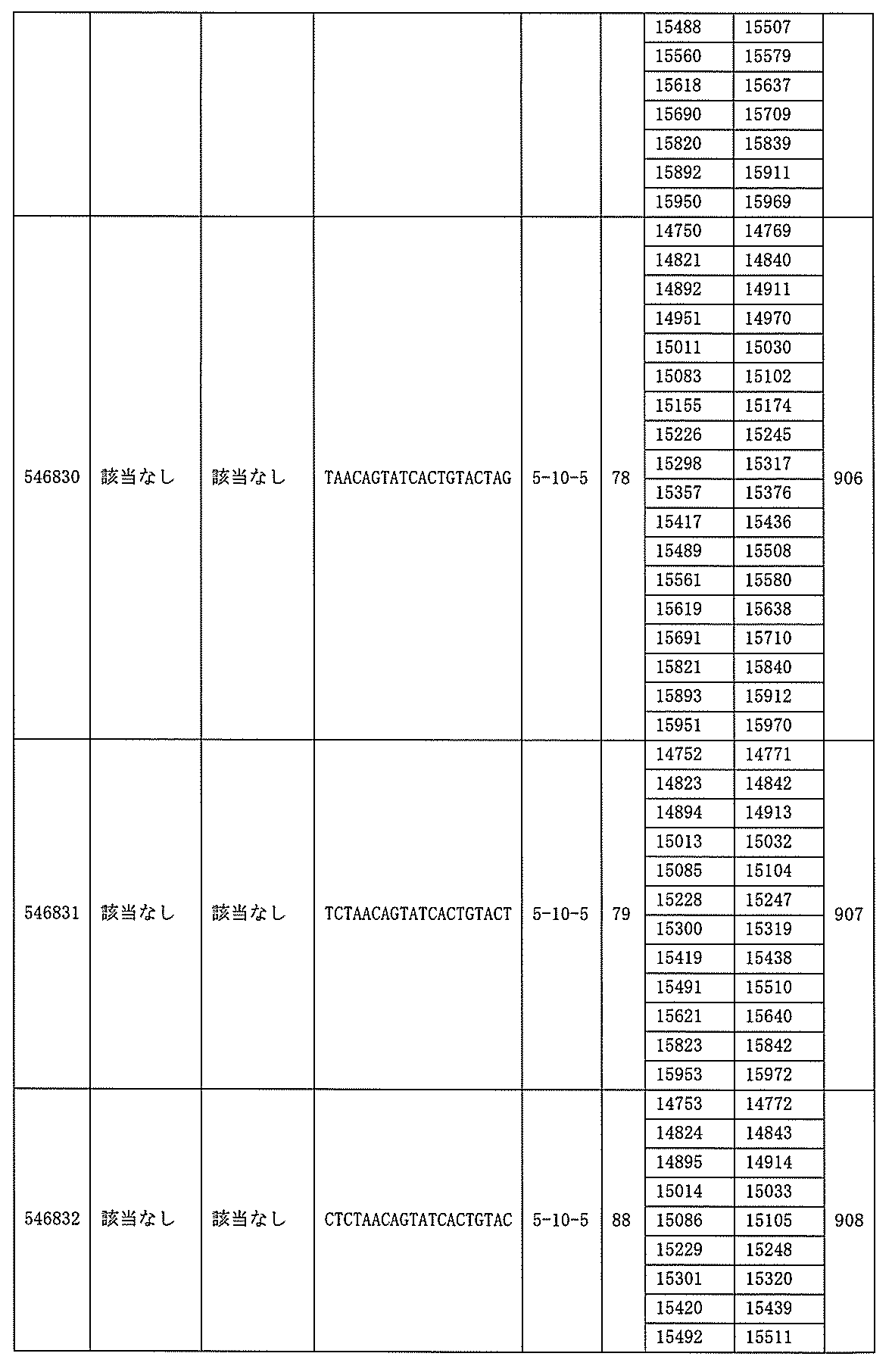
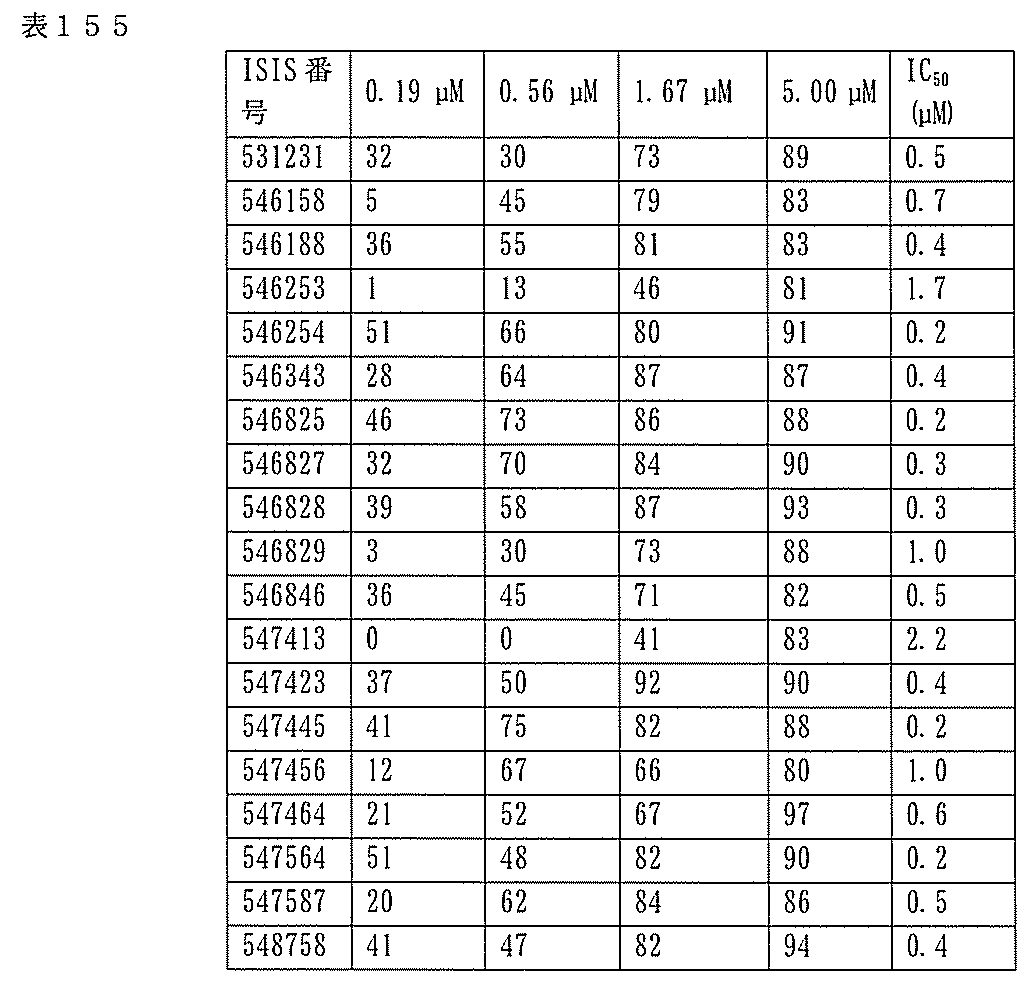
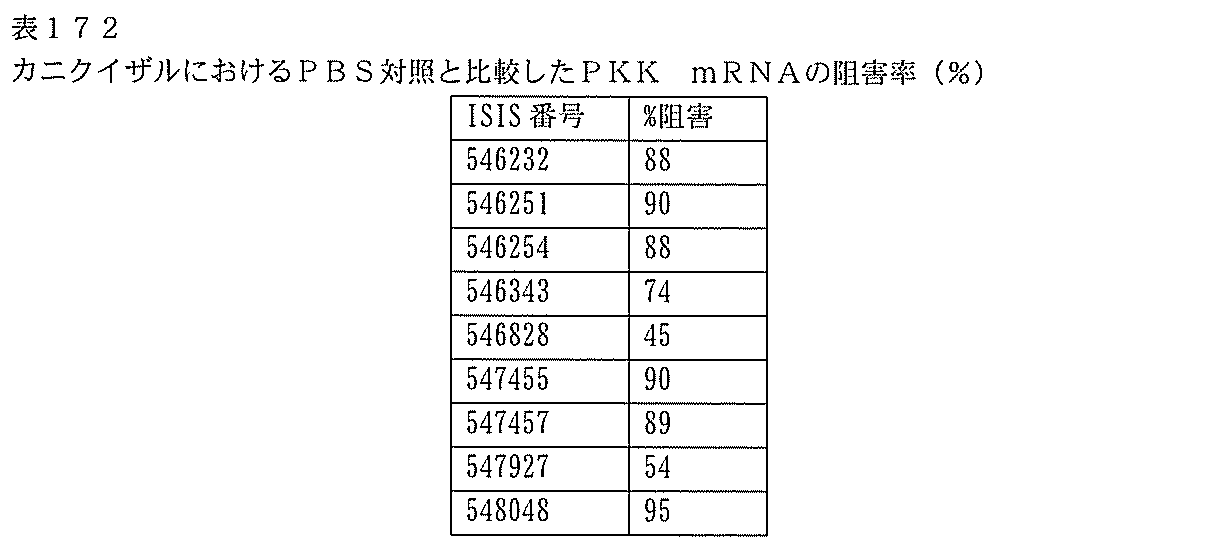
1.ISIS 546254
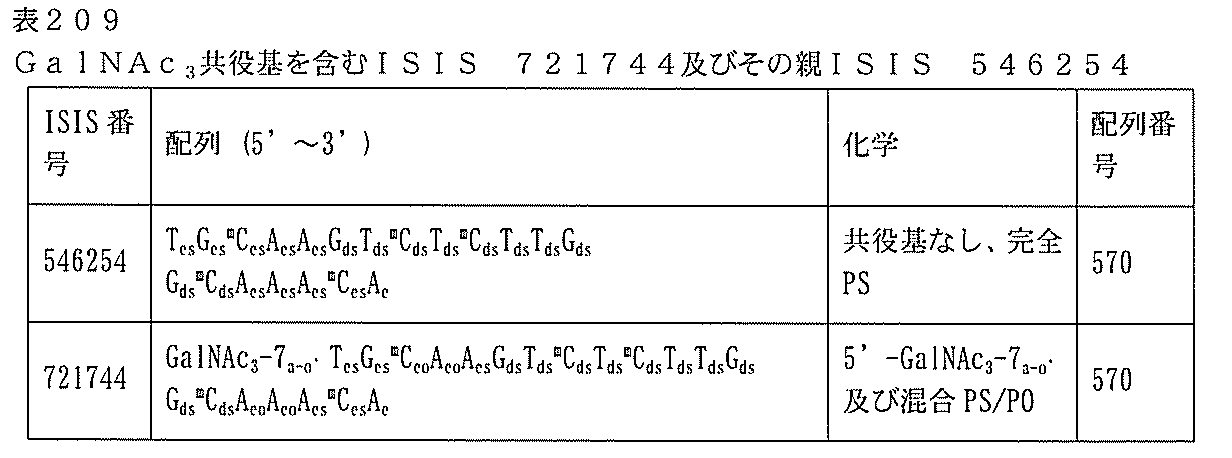
ある特定の実施形態では、ISIS 546254は、5-10-5MOEギャップマーを特徴とし、(5’から3’)TGCAAGTCTCTTGGCAAACA(配列番号570として本明細書に組み込まれる)の配列を有し、各ヌクレオシド間結合はホスホロチオエート結合であり、各シトシンは、5’-メチルシトシンであり、ヌクレオシド1-5及び16-20のそれぞれは、2’-O-メトキシエチル修飾ヌクレオシドであり、ヌクレオシド6-15のそれぞれは、2’-デオキシヌクレオシドである。
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合である。
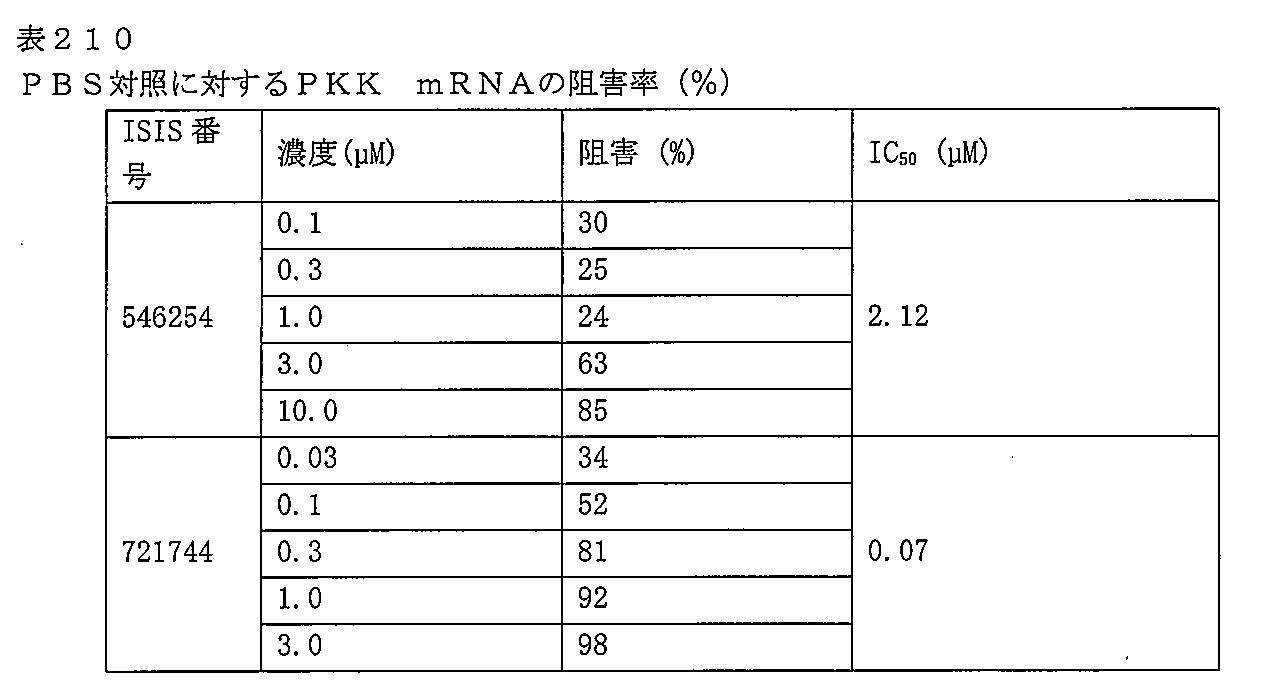
ある特定の実施形態では、実施例2(以下)に提供されるように、ISIS 546254は、処理時間24時間の後に、エレクトロポレーションを用いて5,000nMのアンチセンスオリゴヌクレオチドでトランスフェクトし、ヒトプライマープローブセットRTS3454を使用することによって測定し、定量的リアルタイムPCRにより測定し、RIBOGREEN(登録商標)によって測定された総RNA含量に従って調整した場合に、培養されたHepaRG(商標)細胞(ウェル当たり20,000細胞の密度)中のヒトPKK mRNAを95%阻害した。
254は、PKK mRNA及びタンパク質の発現の阻害に有効であり、霊長類に許容される。
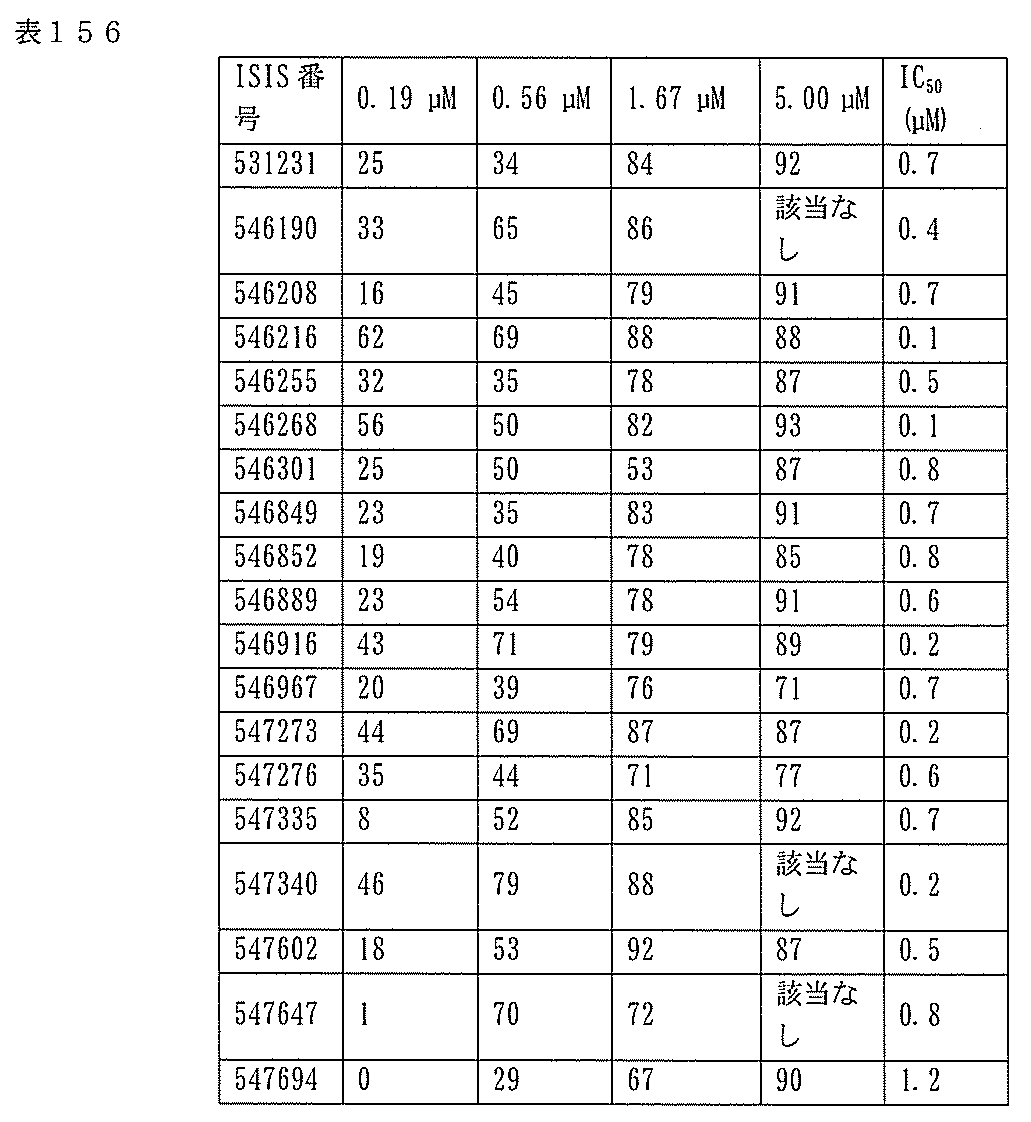
ある特定の実施形態では、ISIS 546343は、5-10-5MOEギャップマーを特徴とし、(5’から3’) CCCCCTTCTTTATAGCCAGC(配列番
号705として本明細書に組み込まれる)の配列を有し、各ヌクレオシド間結合はホスホロチオエート結合であり、各シトシンは、5’-メチルシトシンであり、ヌクレオシド1-5及び16-20のそれぞれは、2’-O-メトキシエチル修飾ヌクレオシドであり、ヌクレオシド6-15のそれぞれは、2’-デオキシヌクレオシドである。
Tds Ads Tds Ads Gds mCes mCes Aes Ges mCeで記述され、ここで、
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合である。
ある特定の実施形態では、実施例2(以下の表9及び10を参照のこと)に提供されるように、ISIS 546343は、処理時間24時間の後に、エレクトロポレーションを用いて5,000nMのアンチセンスオリゴヌクレオチドでトランスフェクトし、ヒト
プライマープローブセットRTS3454を使用することによって測定し、RIBOGREEN(登録商標)によって測定された総RNA含量に従って調整された定量的リアルタイムPCRにより測定した場合に、培養されたHepaRG(商標)細胞(ウェル当たり20,000細胞の密度)中のヒトPKK mRNAを97%及び91%阻害した。
ある特定の実施形態では、ISIS 548048は、核酸塩基配列(5’から3’)CGATATCATGATTCCC(配列番号1666として本明細書に取り込まれる)を有する修飾されたアンチセンスオリゴヌクレオチドを特徴とし、16個の2’-デオキシヌクレオシド、2’-O-メトキシエチル修飾ヌクレオシド、及びcEt修飾ヌクレオシドの組み合わせから成り、ヌクレオシド1,2及び16のそれぞれは、2’-O-メトキシエチル修飾ヌクレオシドであり、ヌクレオシド3、14、及び15のそれぞれはcEt修飾ヌクレオシドであり、ヌクレオシド4-13のそれぞれは2’-デオキシヌクレオシドであり、各ヌクレオシド間結合はホスホロチオエートヌクレオシド間結合であり、各シトシンは、5’-メチルシトシンである。
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
k=cEt修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合
ある特定の実施形態では、実施例3(以下)に提供されるように、ISIS 548048は、処理時間24時間の後に、エレクトロポーションを用いて1,000nMのアンチセンスオリゴヌクレオチドでトランスフェクトし、ヒトプライマープローブセットRTS3454を使用して定量的リアルタイムPCRにより測定し、RIBOGREEN(登録商標)によって測定された総RNA含量に従って調整した場合に、培養されたHepaRG(商標)細胞(ウェル当たり20,000細胞の密度)中のmRNAを84%阻害した。
れる。
ある特定の実施形態では、ISIS 721744は、5-10-5MOEギャップマーとして特徴を有し、(5’から3’)TGCAAGTCTCTTGGCAAACA(配列番号570として本明細書に組み込まれる)の配列を有し、ヌクレオシド3~4、4~5、16~17、及び17~18の間のヌクレオシド間結合は、ホスホジエステル結合であり、ヌクレオシド1~2、2~3、5~6、6~7、7~8、8~9、9~10、10~11、11~12、12~13、13~14、14~15、15~16、18~19、及び19~20の間のヌクレオシド間結合は、ホスホロチオエート結合であり、各シトシンは5’-メチルシトシンであり、ヌクレオシド1~5及び16~20のそれぞれは、2’-O-メトキシエチル修飾ヌクレオシドであり、ヌクレオシド6~15のそれぞれは、2’-デオキシヌクレオシドである。
Tds mCds Tds Tds Gds Gds mCds Aeo Aeo Aes mCes Aeによって記述され、ここで、
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
o=ホスホジエステルヌクレオシド間結合、
s=ホスホロチオエートヌクレオシド間結合、及び
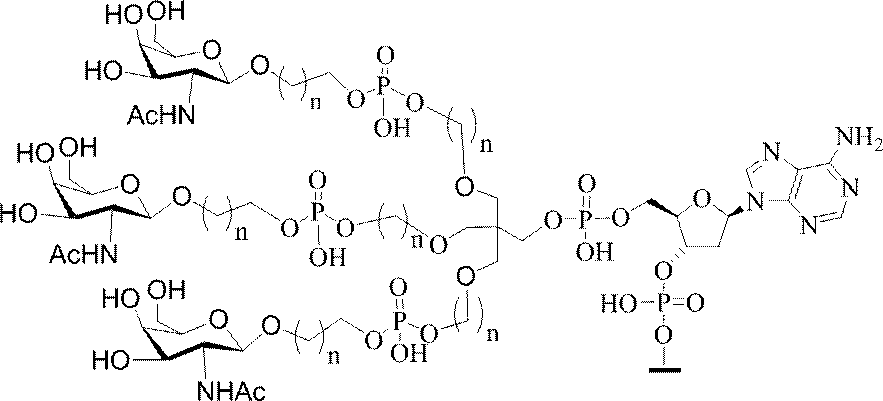
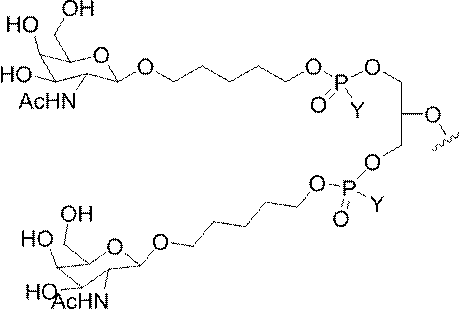
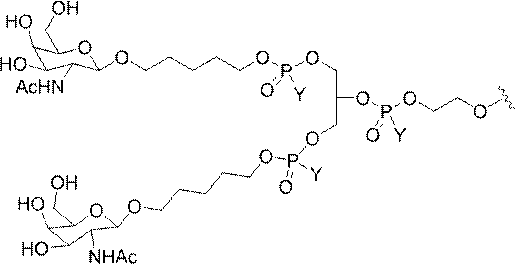
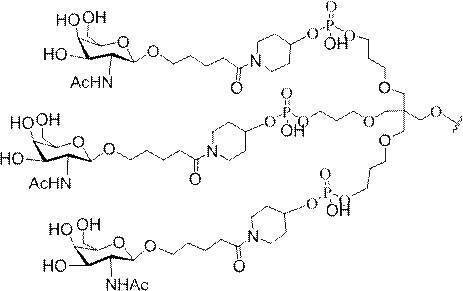
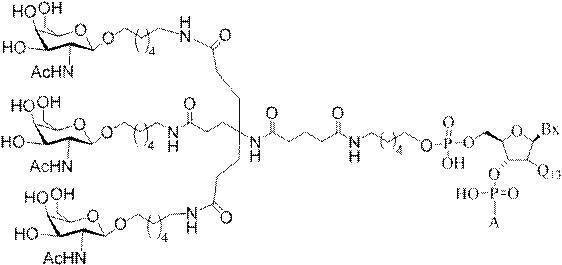
GalNAc3-7a-o’=
1.配列番号10の核酸塩基27427~27466
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基27427~27466を標的とするように設計する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、配列番号10の核酸塩基27427~27466は、ホットスポット領域である。ある特定の実施形態では、配列番号10の核酸塩基27427~27466はアンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
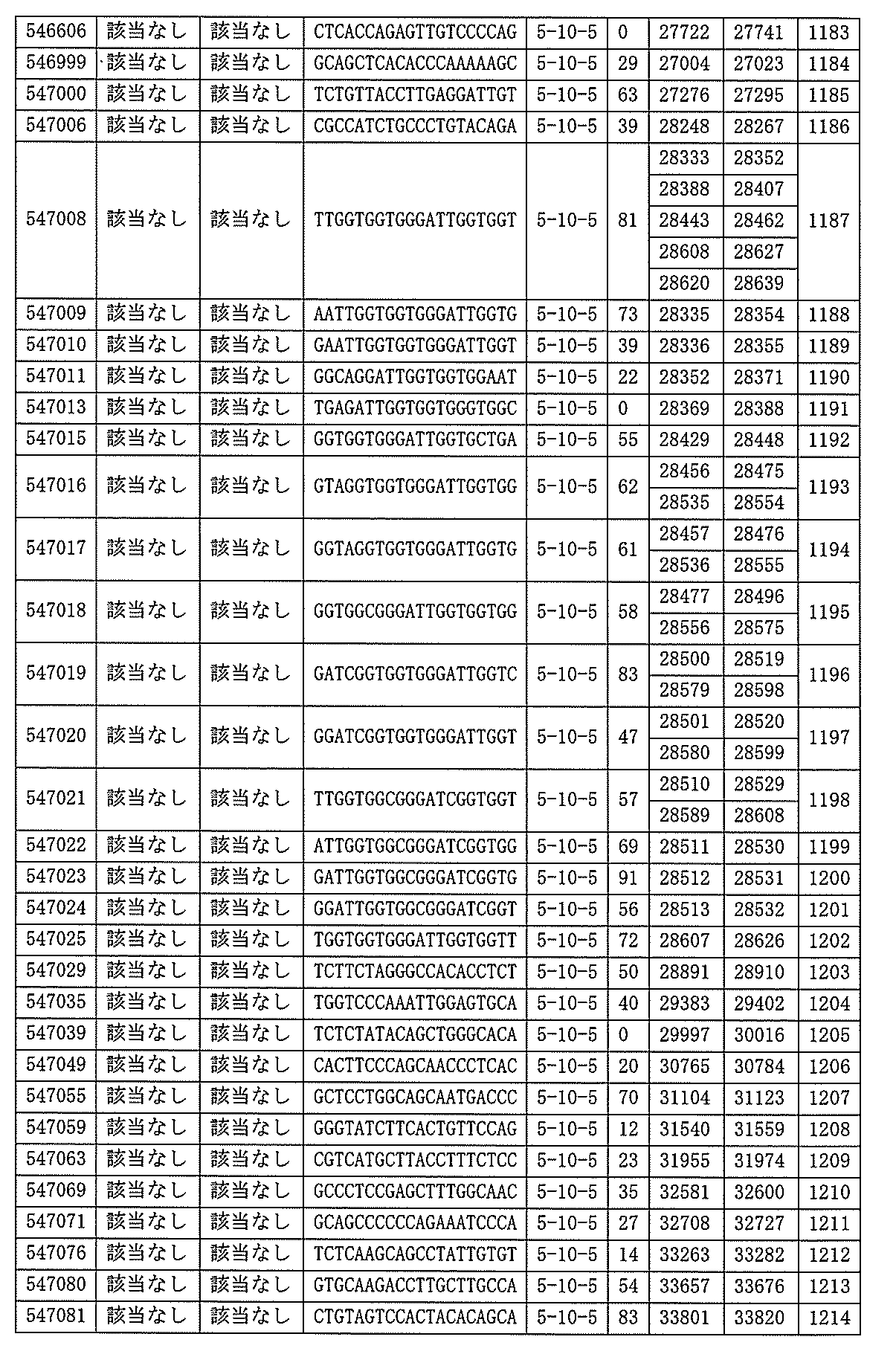
S番号:530993、530994、530995、546251、546252、546253、546254、546255、546256、547410、547411、547978、547979、547980、及び547981によって標的とされる。
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基33183~33242を標的とするように設計する(核酸塩基111693001~111730000を切り捨てられたGENBANK寄託番号NT_016354.19)。ある特定の実施形態では、配列番号10の核酸塩基33183~33242はホットスポット領域である。ある特定の実施形態では、配列番号10の核酸塩基33183~33242は、アンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
31057、531158、546343、546345、547480、547481、547482、及び547483によって標的とされる。
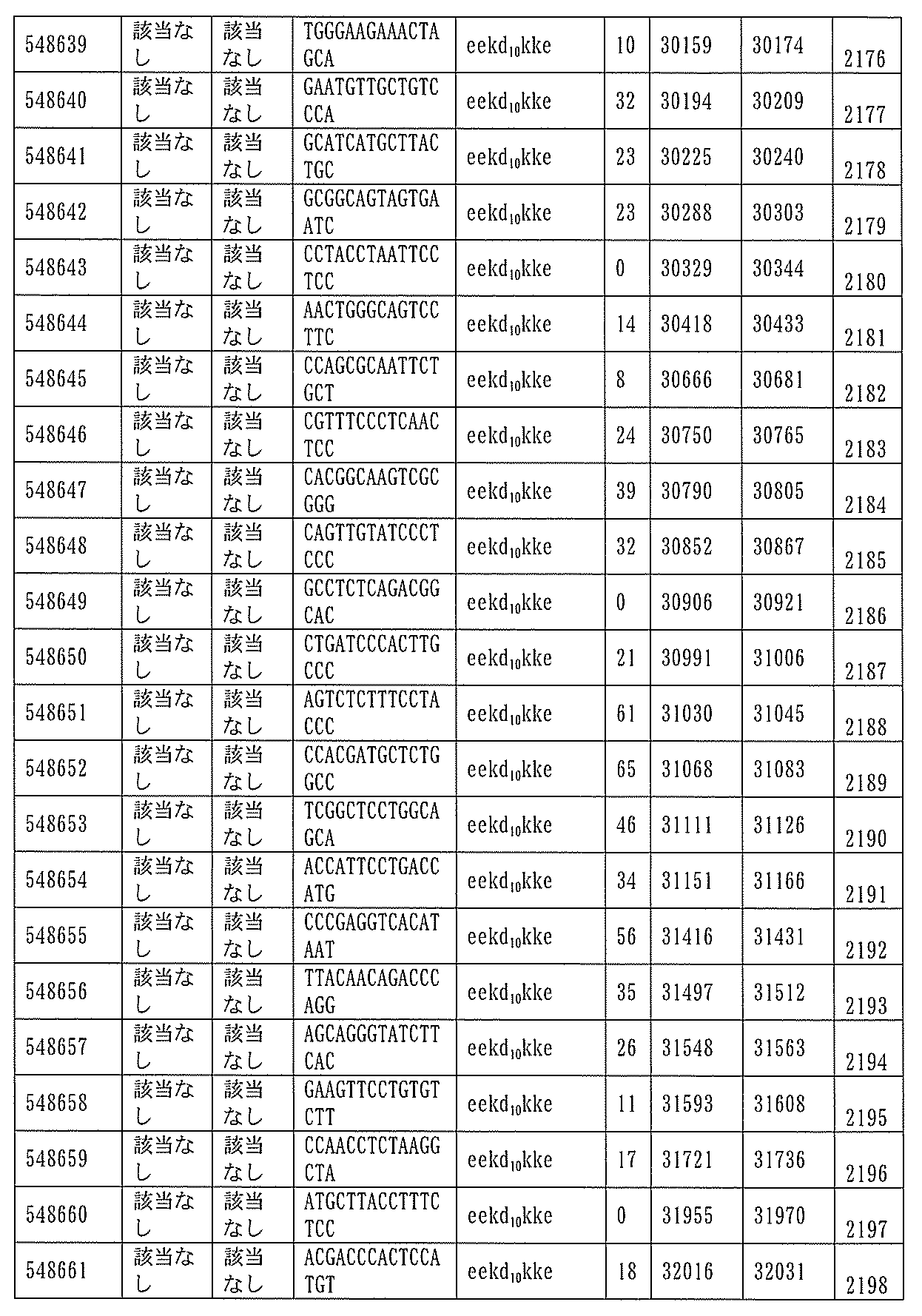
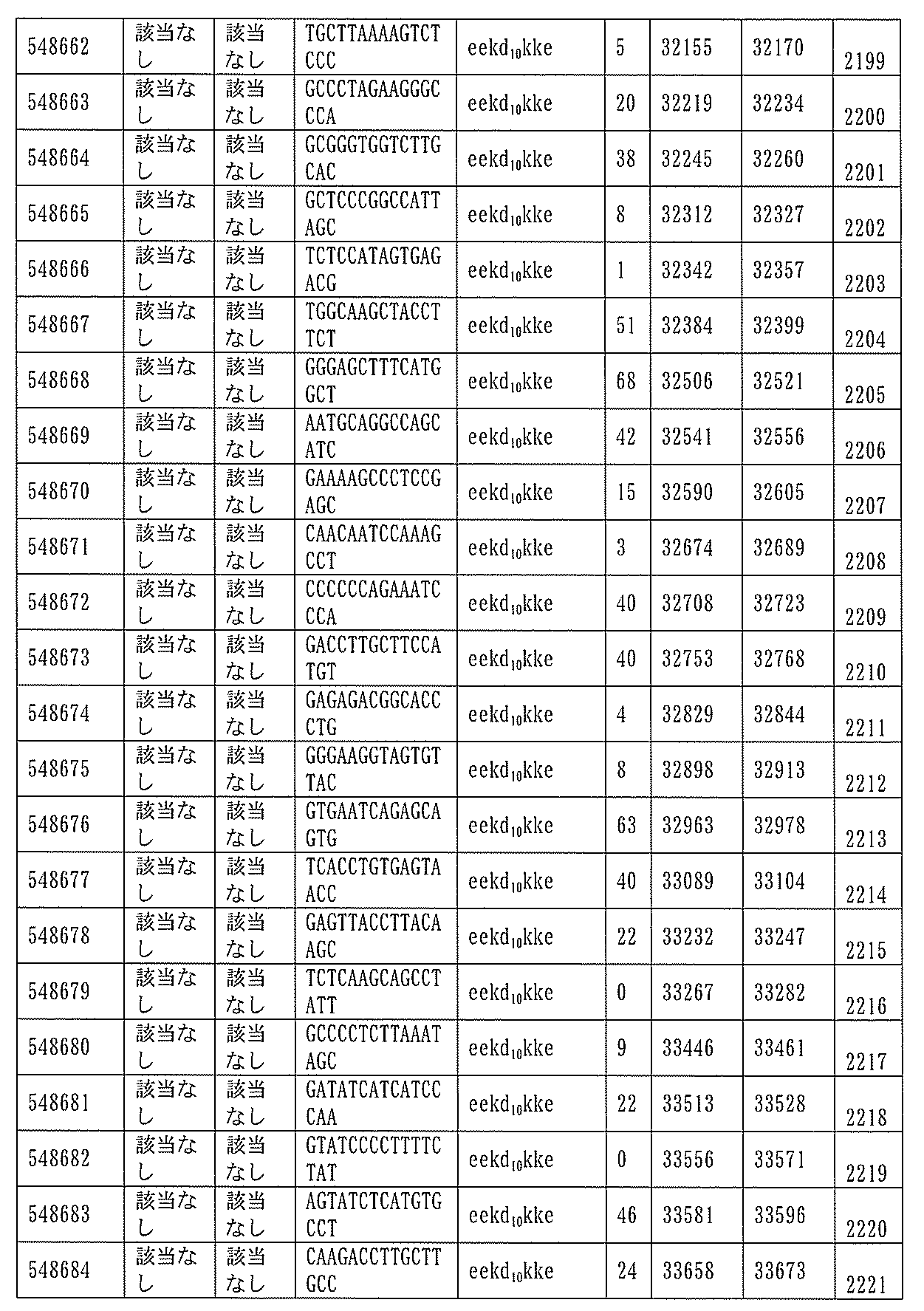
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基30570~30610を標的とするように設計する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、配列番号10の核酸塩基30570~30610は、ホットスポットの領域である。ある特定の実施形態では、配列番号10の核酸塩基30570~30610は、アンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
れる。
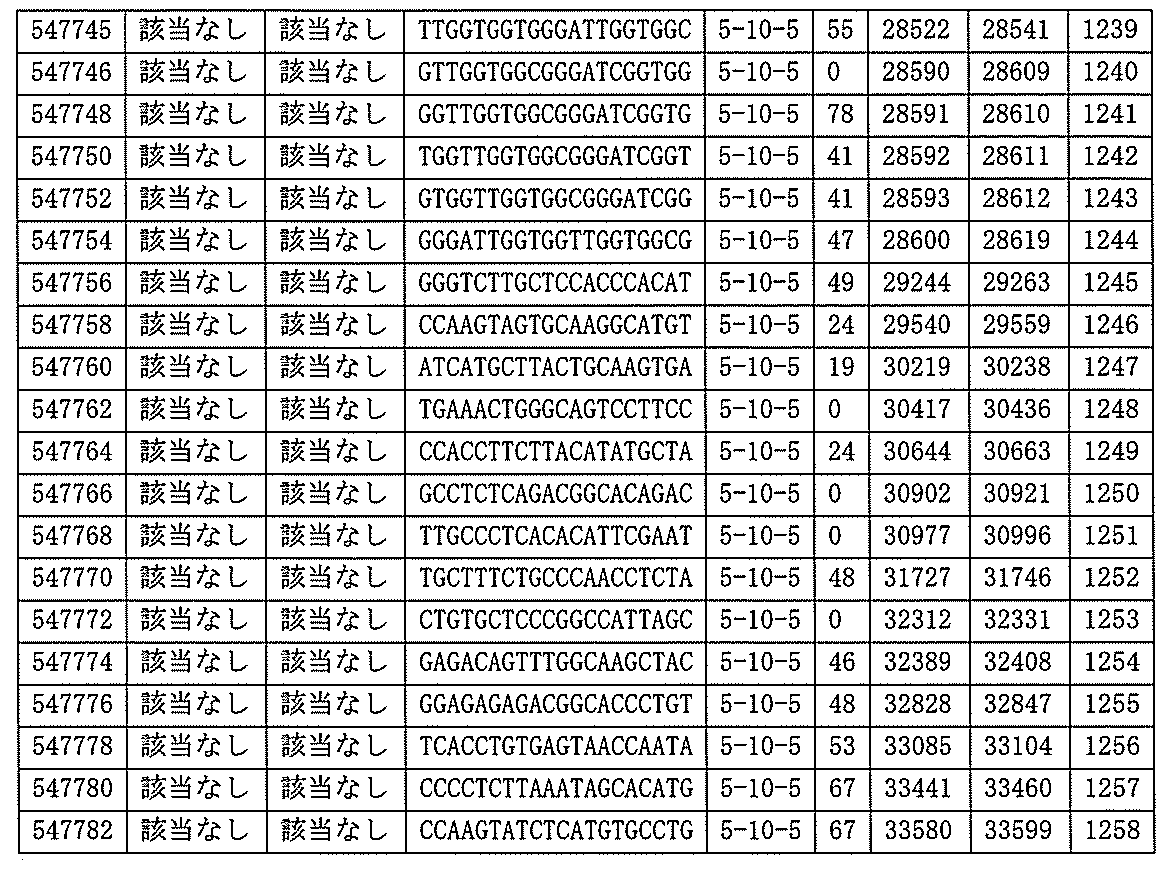
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基27427~27520を標的とするように設計する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、配列番号10の核酸塩基27427~27520は、ホットスポット領域である。ある特定の実施形態では、配列番号10の核酸塩基27427~27520はアンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基33085~33247を標的とするように設計する(核酸塩基111693001~111730000を切り捨てられたGENBANK寄託番号NT_016354.19)。ある特定の実施形態では、配列番号10の核酸塩基33085~33247は、ホットスポットの領域である。ある特定の実施形態は、配列番号10の33085~33247は、アンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
、2214、及び2215によって標的とされる。
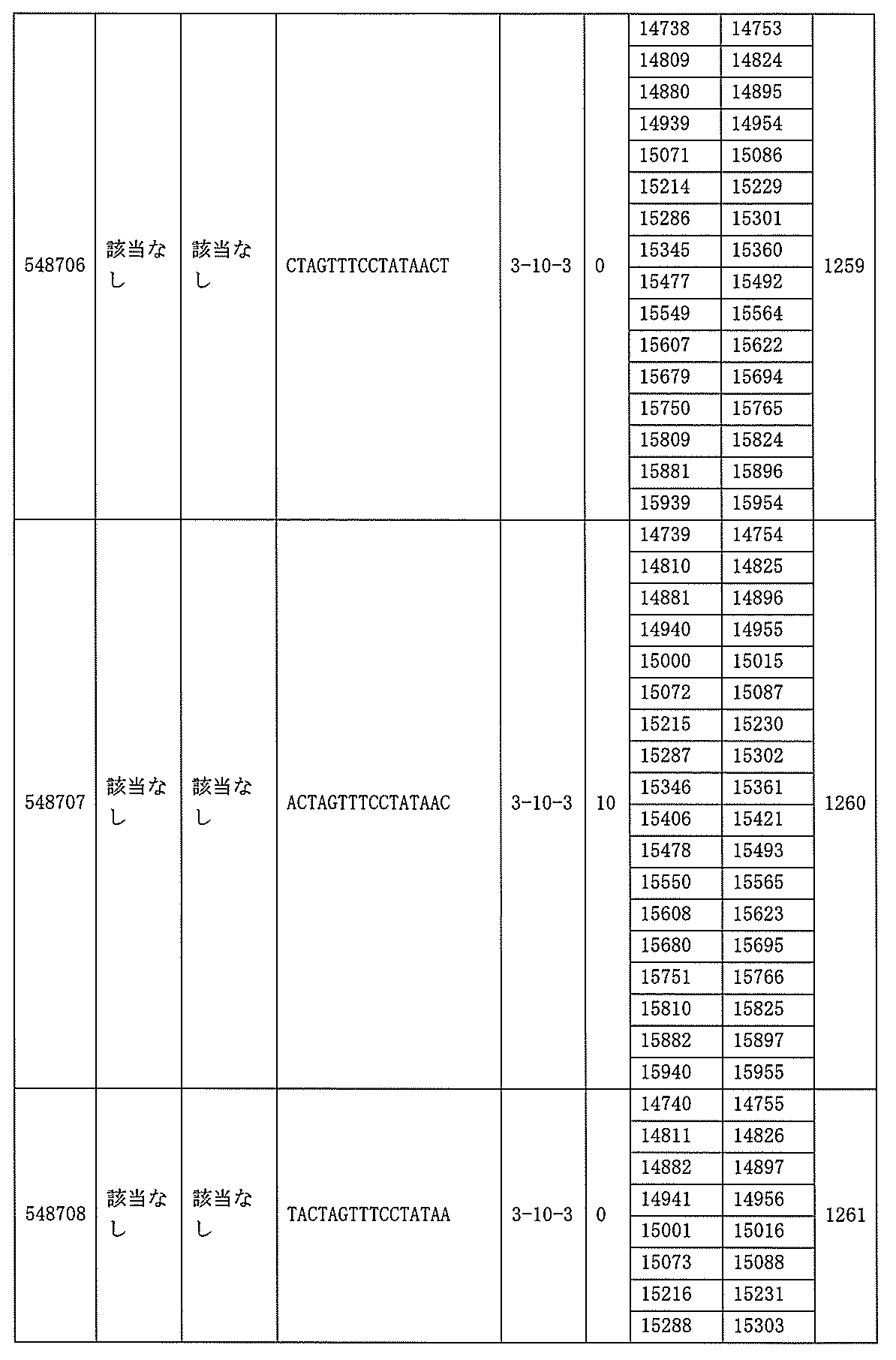
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基30475~30639を標的とするように設計する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、配列番号10の核酸塩基30475~30639は、ホットスポットの領域である。ある特定の実施形態は、配列番号10の核酸塩基30475~30639は、アンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基27362~27524を標的とするように設計する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、核酸塩基27362から27524は、PKKのエクソン9に対応する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、配列番号10の核酸塩基27362~27524は、ホットスポットの領域である。ある特定の実施形態では、配列番号10の核酸塩基27362~27524は、アンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
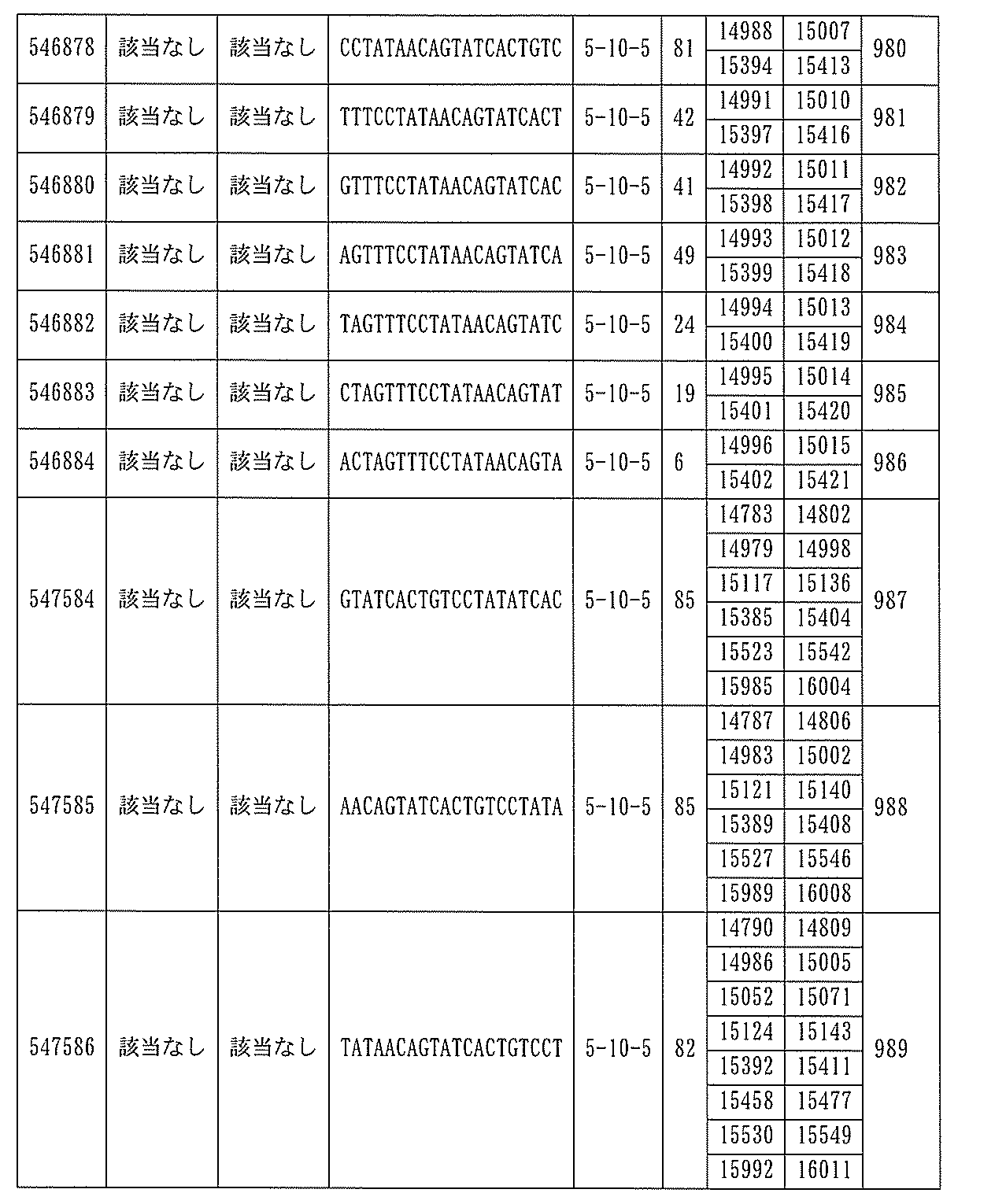
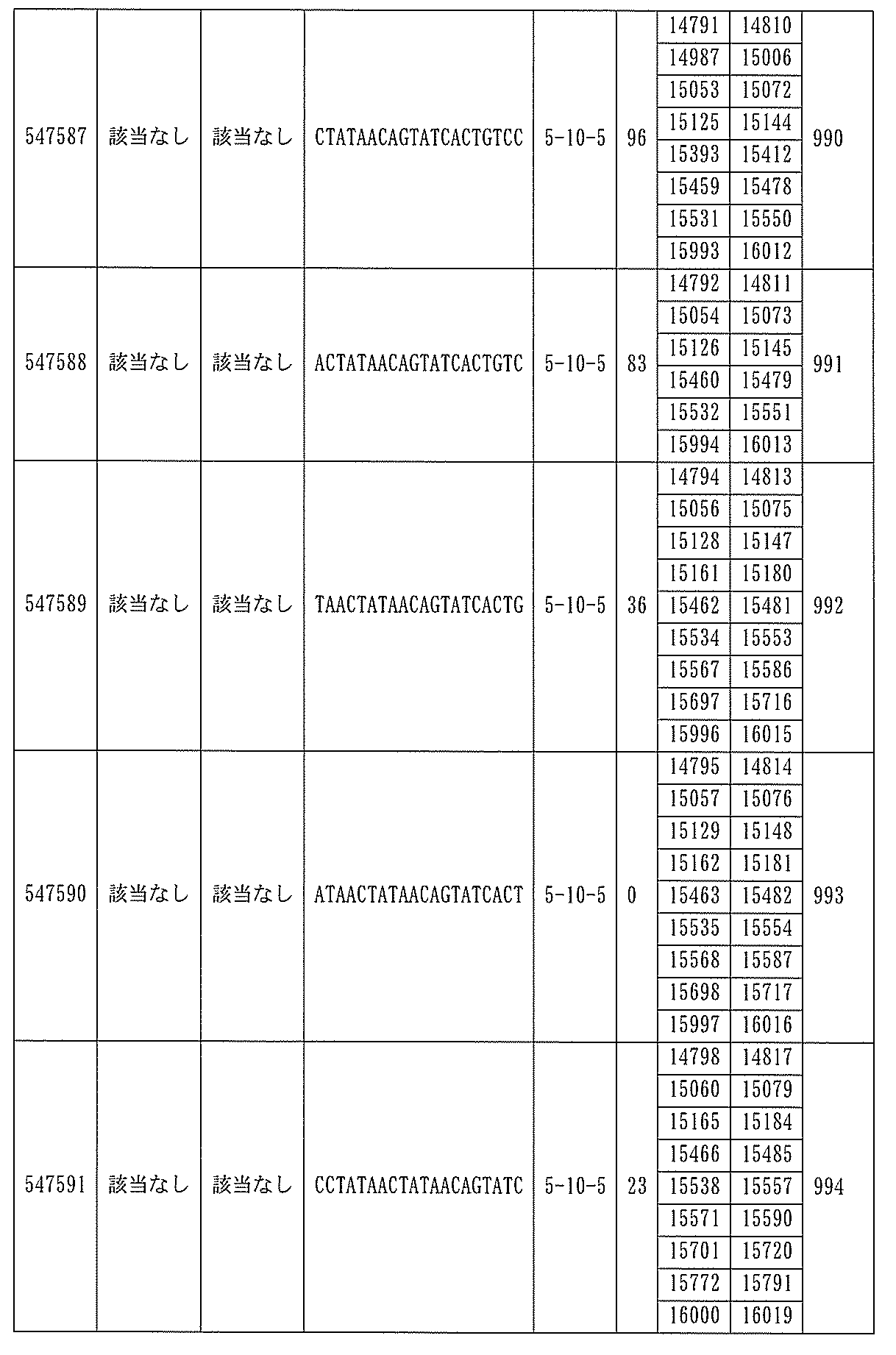
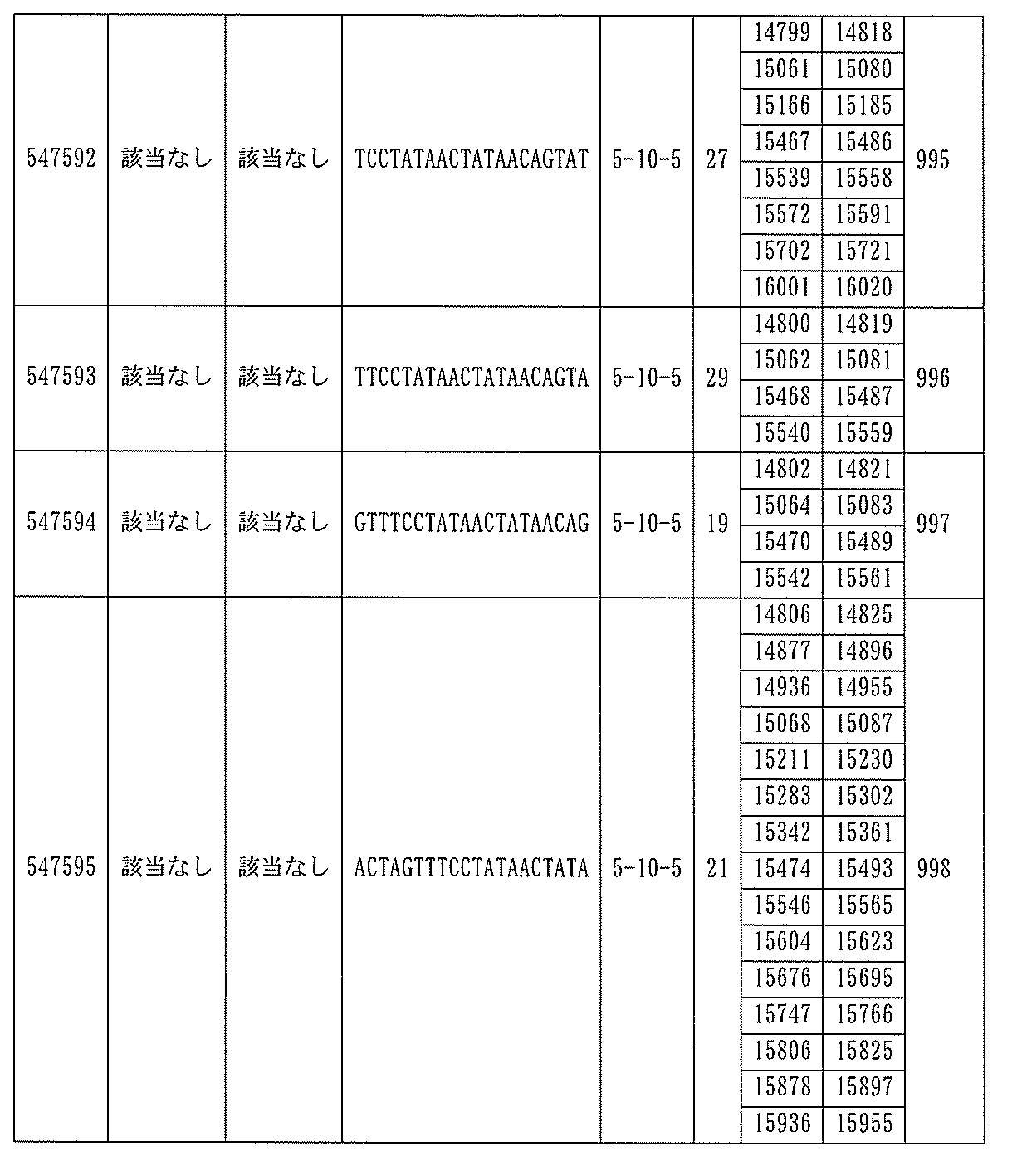
は、配列番号86~100、554~587、1217、及び1588~1611によって標的とされる。
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基33101~33240を標的とするように設計する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、核酸塩基33101~33240は、PKKのエクソン14に対応する(GENBANK寄託番号NT_016354.19、核酸塩基111693001~111730000を切り捨てられた)。ある特定の実施形態では、配列番号10の核酸塩基33101~33240は、ホットスポット領域である。ある特定の実施形態は、配列番号10の核酸塩基33101~33240は、アンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドはホスホロチオエートヌクレオシド間結合によって連結されている。
ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、配列番号10の核酸塩基30463~30638を標的とするように設計する(核酸塩基111693001~111730000を切り捨てられたGENBANK寄託番号NT_016354.19)。ある特定の実施形態では、核酸塩基30463~30638はPKKのエクソン12に対応する(核酸塩基111693001~111730000を切り捨てられたGENBANK寄託番号NT_016354.19)。ある特定の実施形態では、配列番号10の核酸塩基30463~30638は、ホットスポット領域である。ある特定の実施形態では、配列番号10の核酸塩基30463~30638は、アンチセンスオリゴヌクレオチドによって標的とされる。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、長さが15、16、17、18、19、または20の核酸塩基である。ある特定の実施形態では、アンチセンスオリゴヌクレオチドは、ギャップマーである。ある特定の実施形態では、ギャップマーは5-10-5MOEギャップマー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーである。ある特定の実施形態では、ギャップマーは、5-10-5MOE及びcEtギャップマー、4-9-4MOE及びcEtギャップマー、4-10-4MOE及びcEtギャップマー、4-10-3MOE及びcEtギャップマー、3-10-4MOE及びcEtギャップマー、または3-10-3MOE及びcEtギャップマーである。ある特定の実施形態では、アンチセンスオリゴヌクレオチドのヌクレオシドは、ホスホロチオエートヌクレオシド間結合によって連結されている。
056によって標的とされる。
本明細書に記載のある特定の化合物、組成物及び方法を、ある特定の実施形態に従って具体的に説明してきたが、以下の実施例は、本明細書に記載の化合物を例示するためにのみあり、これを限定するものではない。本出願に記載の参考文献の各々は、その全体が参照により本明細書に組み込まれる。
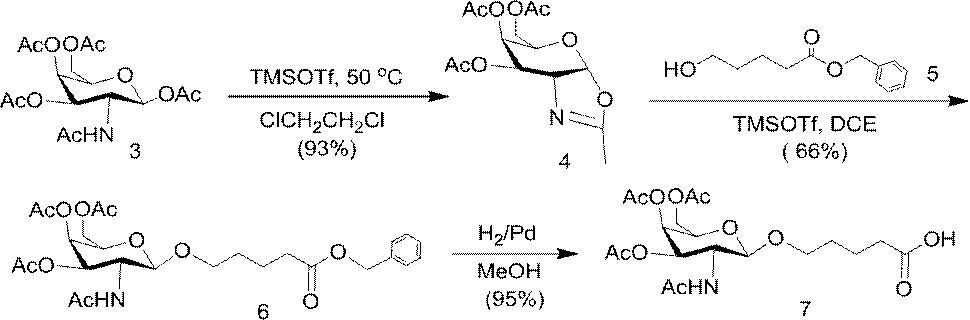
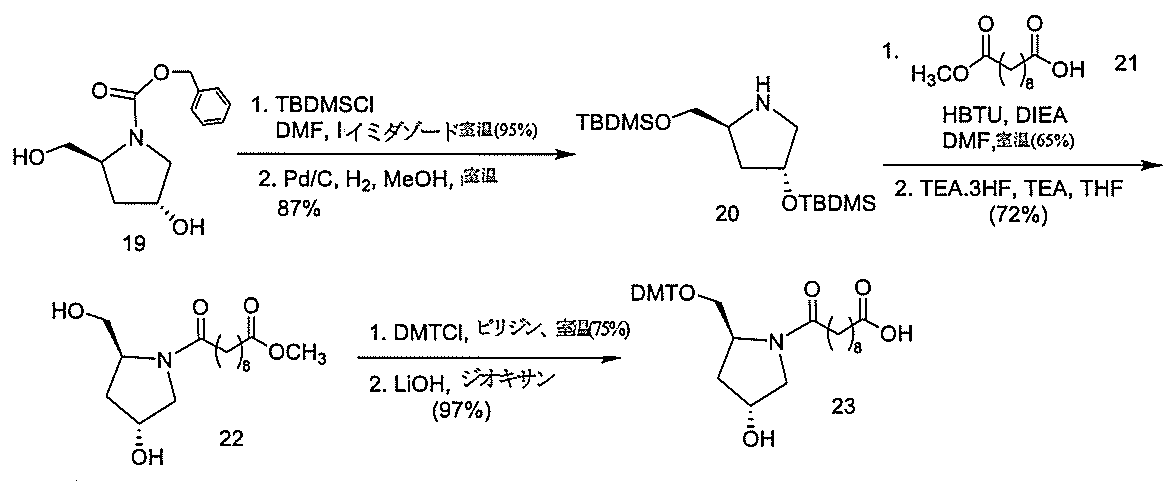
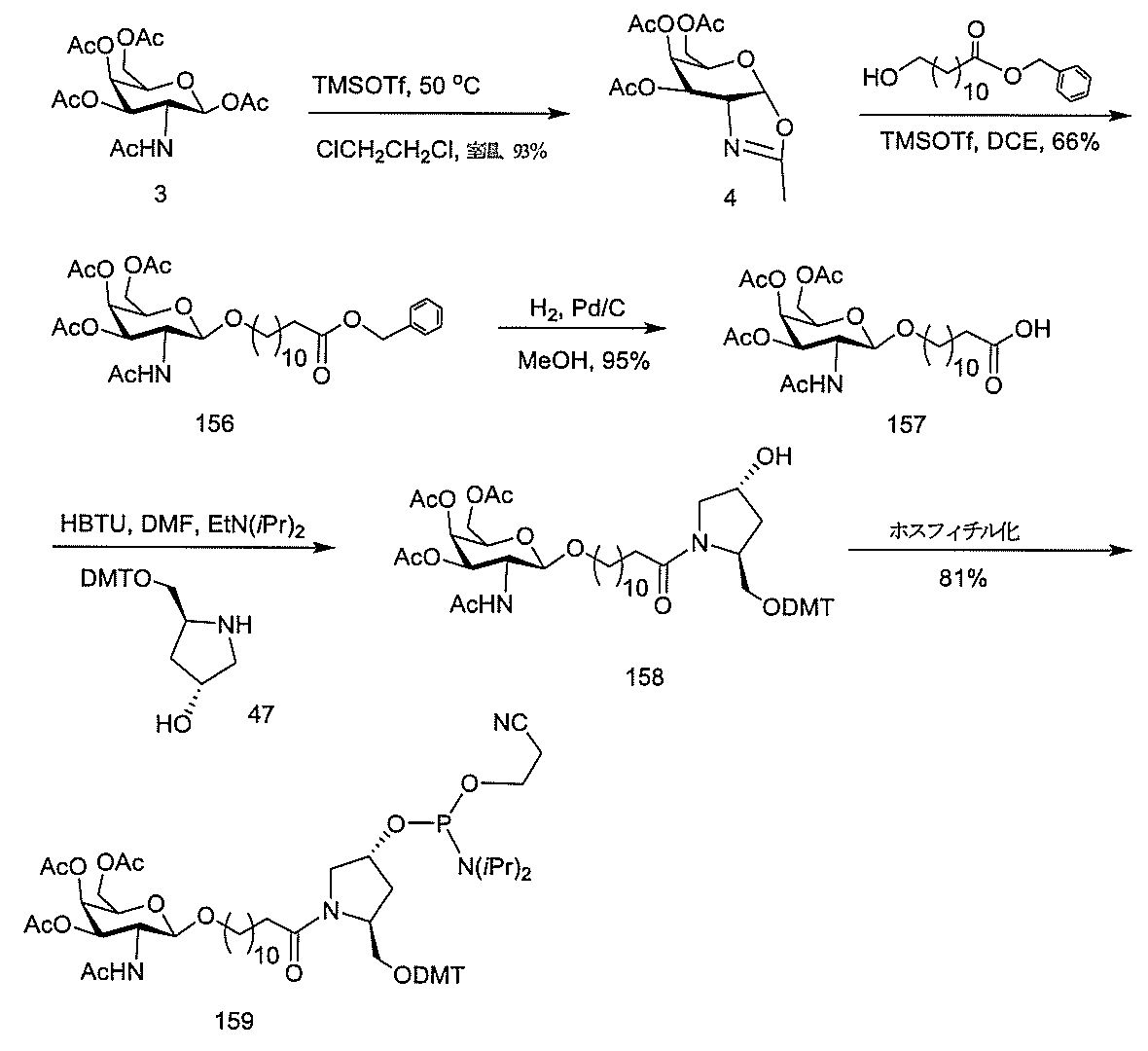
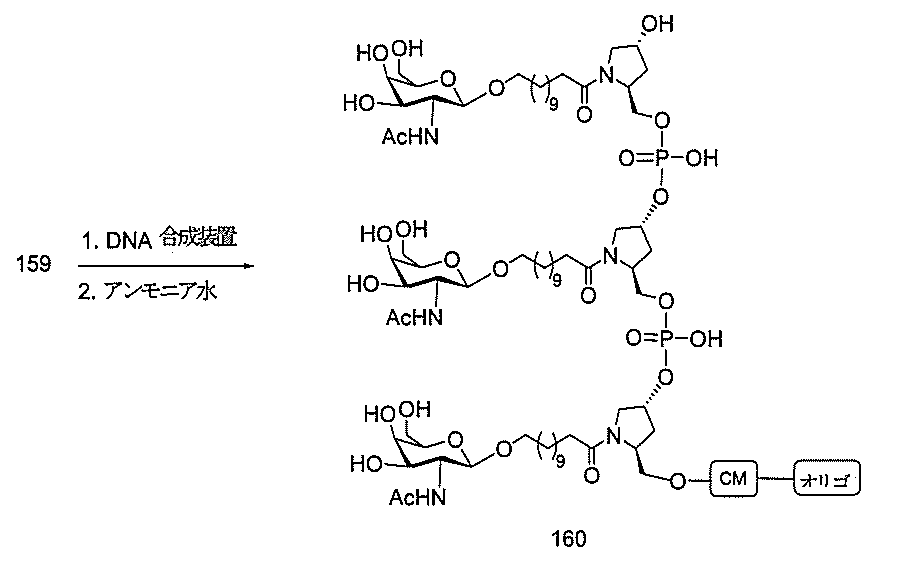
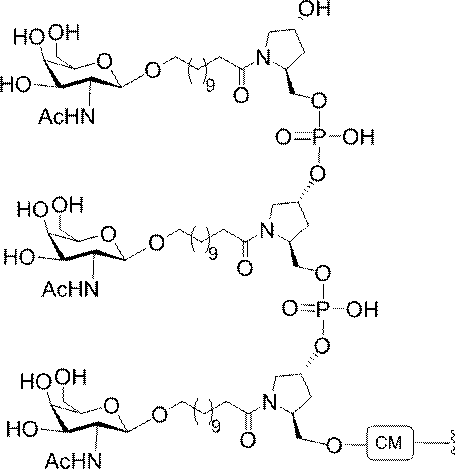
化合物3(2-アセトアミド-1,3,4,6-テトラ-O-アセチル-2-デオキシ-β-Dガラクトピラノースまたはガラクトサミンペンタアセテート)は、市販のものである。化合物5を公開された手順(Weber et al.,J.Med.Chem.,1991,34,2692)に従って調製した。
ミダイト構築ブロックを用いて既定の配列及び組成を有するオリゴマー化合物を調製することができるため、例証されるホスホラミダイトは、代表的なものであり、限定する意図はない。固体支持体に添加されるホスホラミダイトの順序及び量を調整して、本明細書に記載するギャップトオリゴマー化合物を調製することができる。そのようなギャップトオリゴマー化合物は、任意の所与の標的によって決まる既定の組成及び塩基配列を有しうる。
別段の明示がある場合を除き、オリゴマー化合物の合成に用いるすべての試薬及び溶液を商業的供給源から購入する。標準のホスホラミダイト構築ブロック及び固体支持体を、例えば、T、A、G、及びmC残基を含む、ヌクレオシド残基の組み込みのために用いる。無水アセトニトリル中のホスホラミダイトの0.1M溶液をb-D-2’-デオキシリ
ボヌクレオシド及び2’-MOEに用いた。
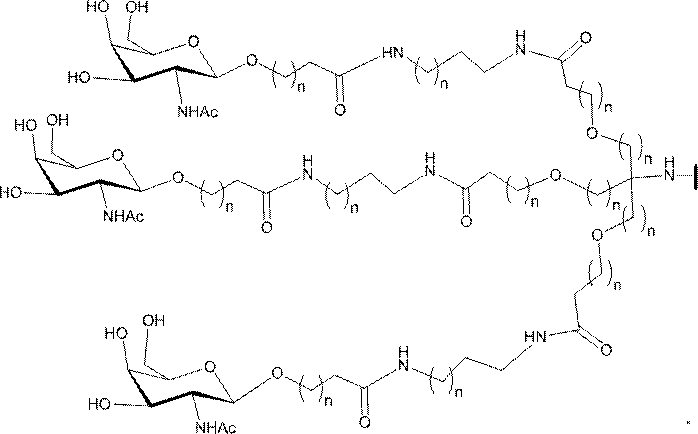
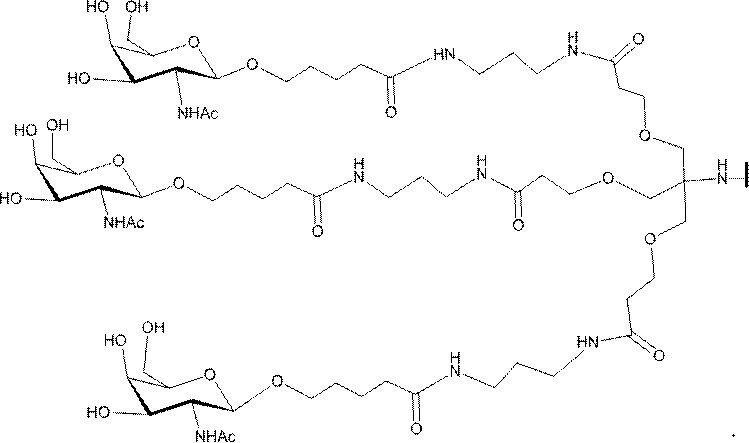
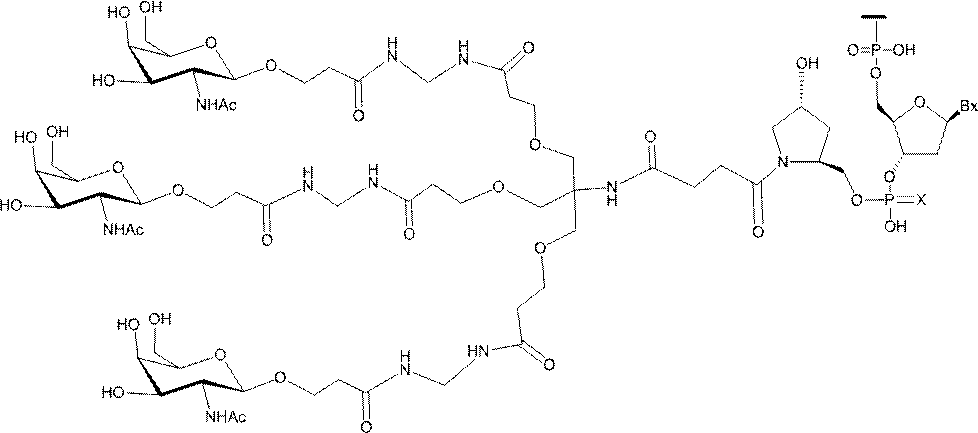
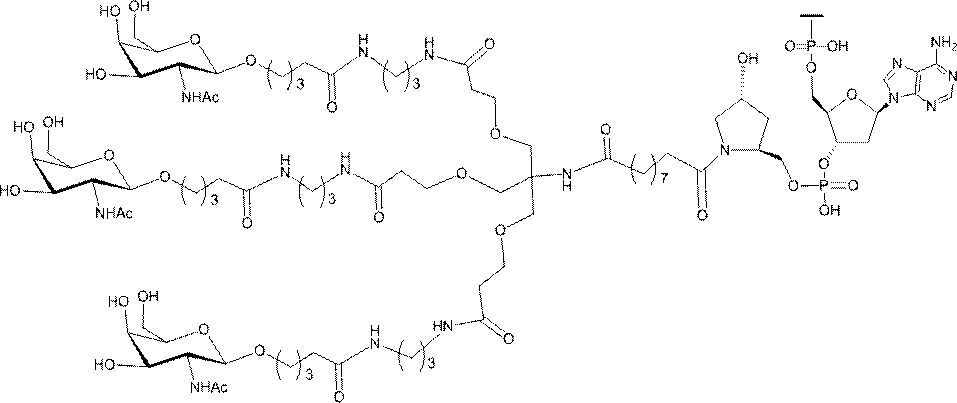
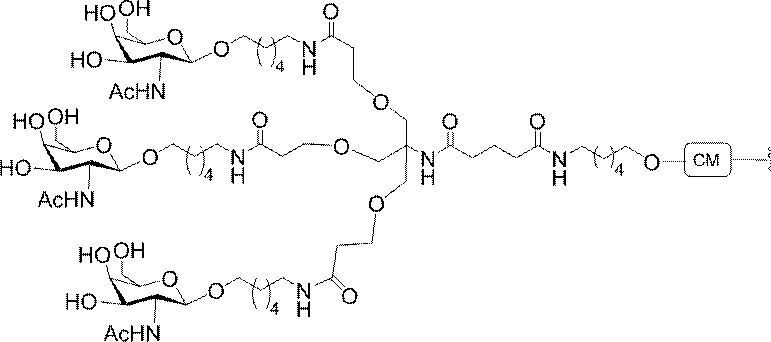
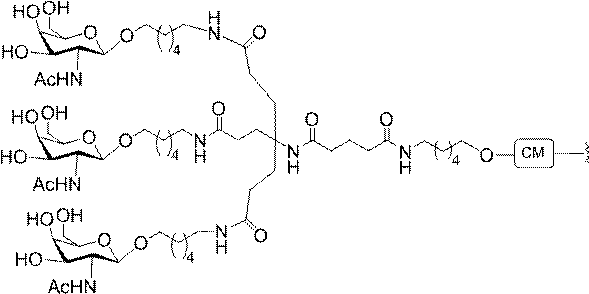
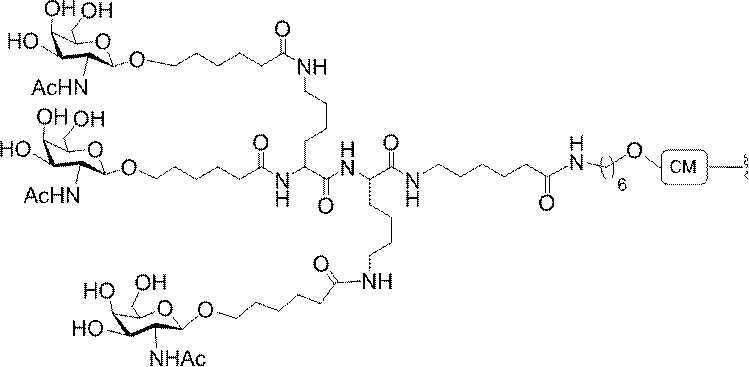
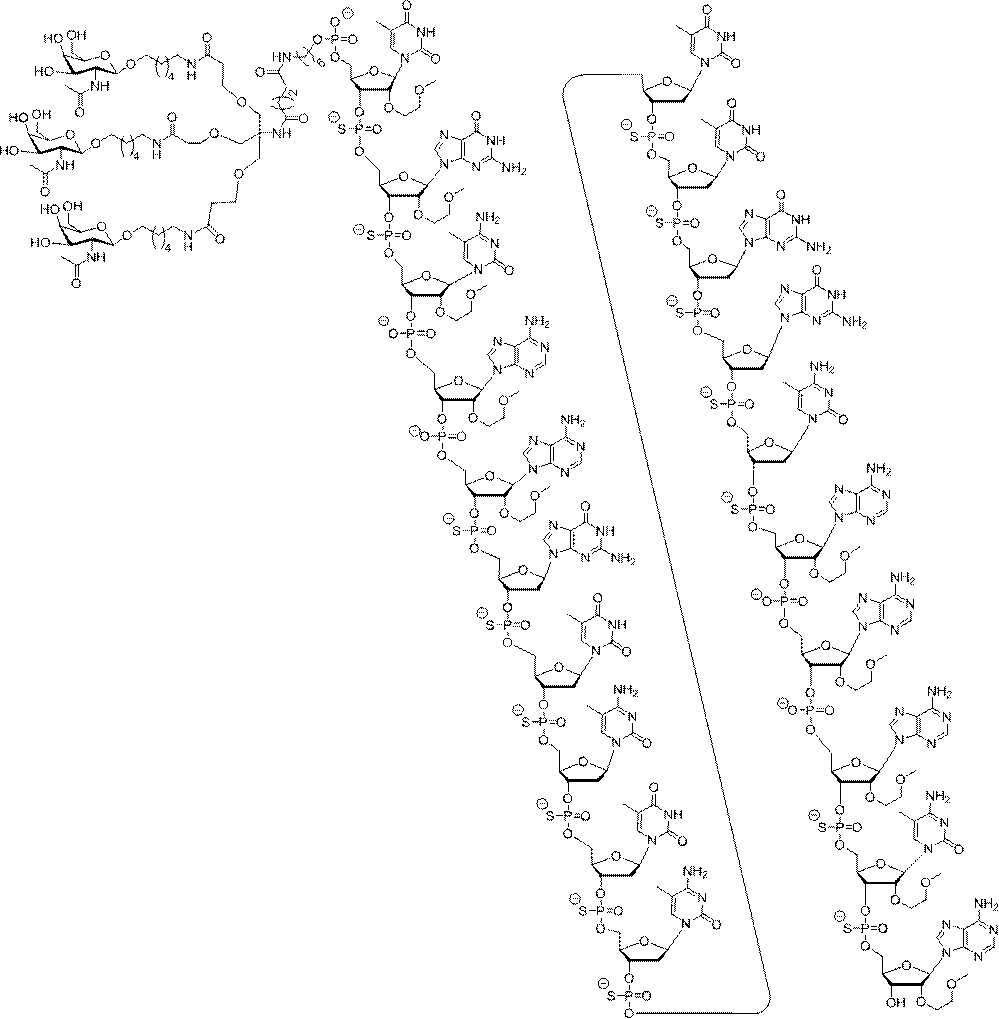
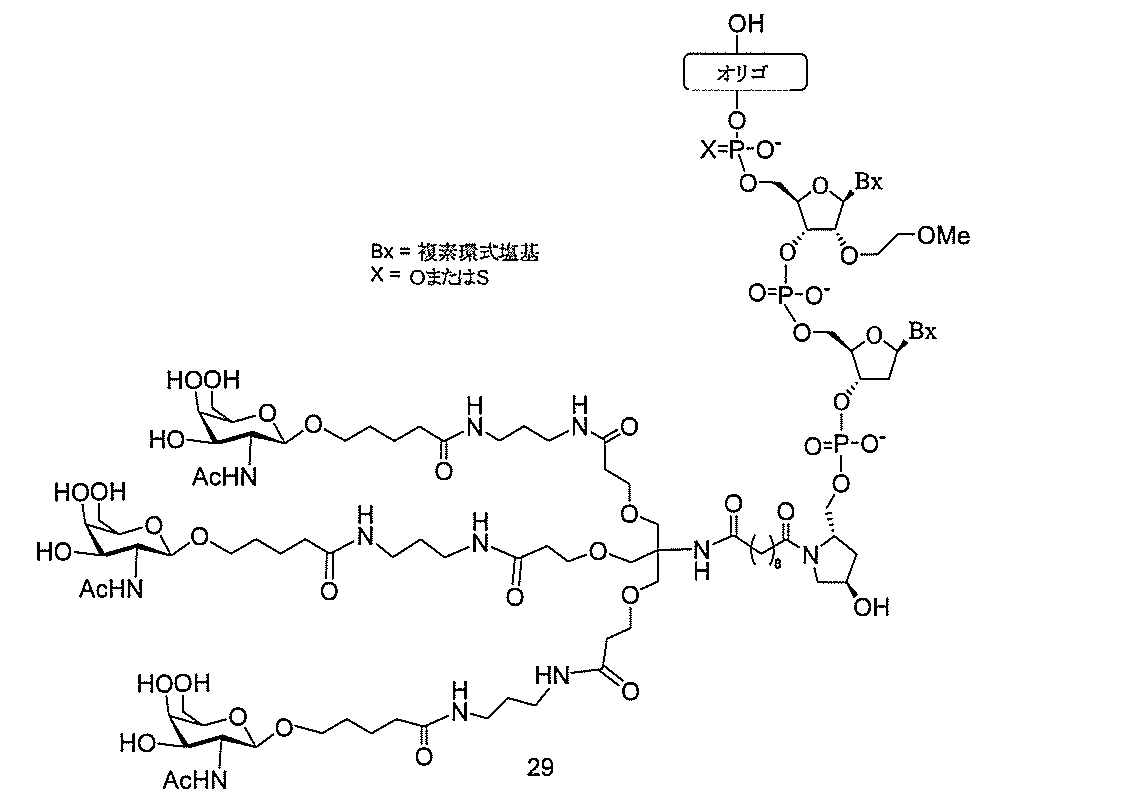
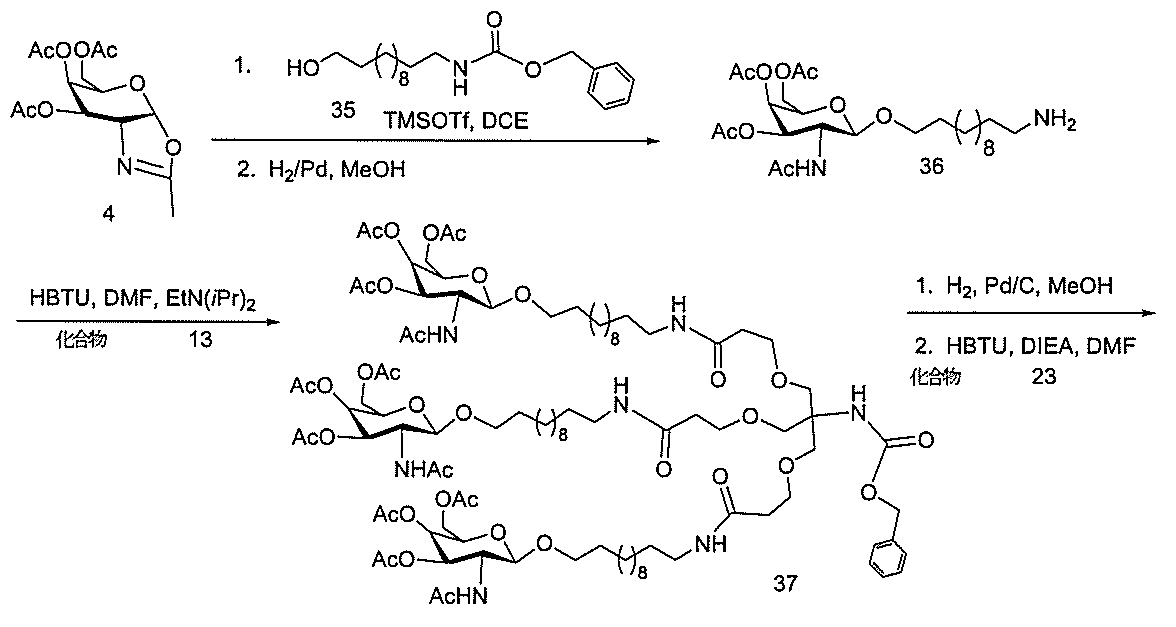
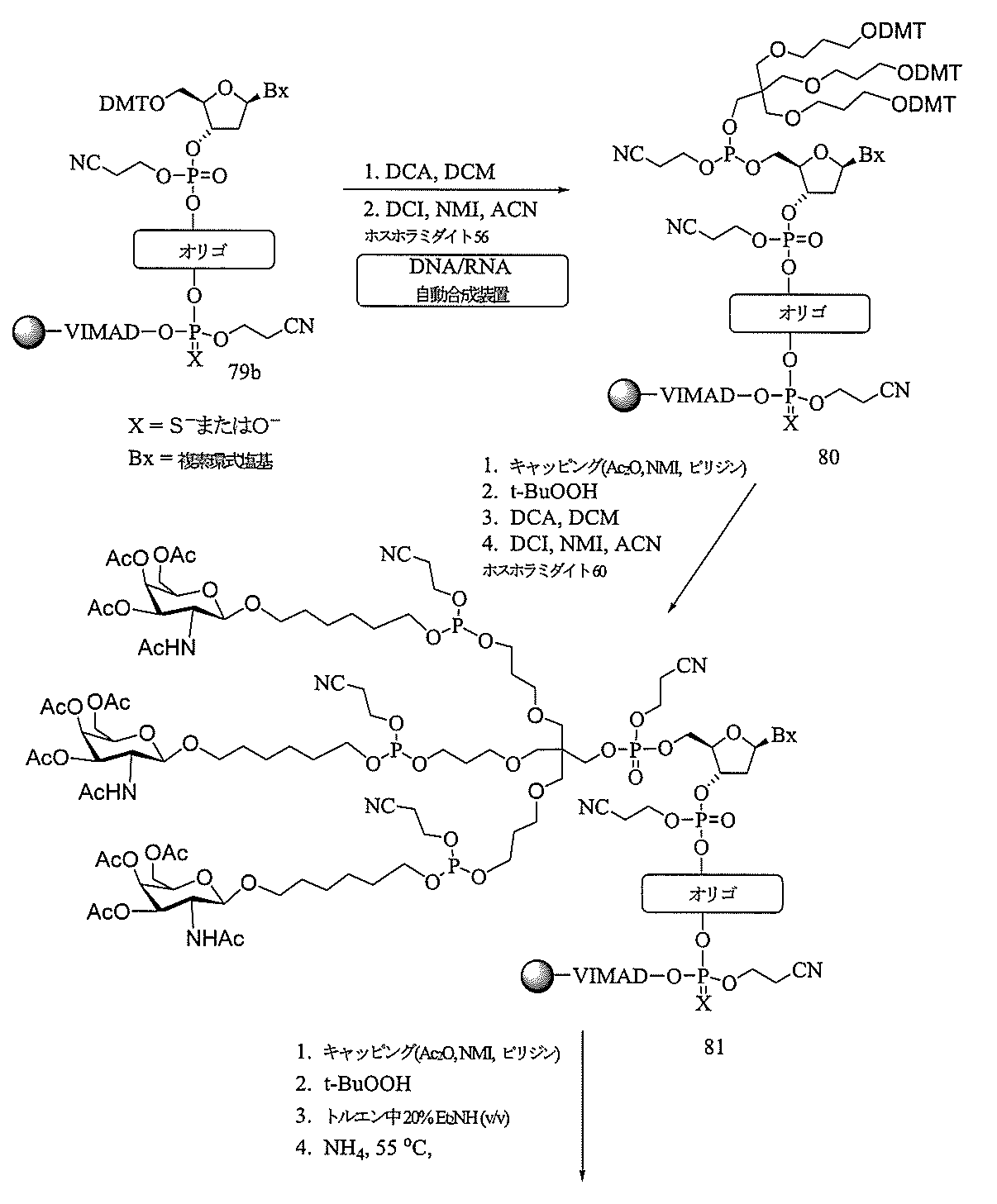
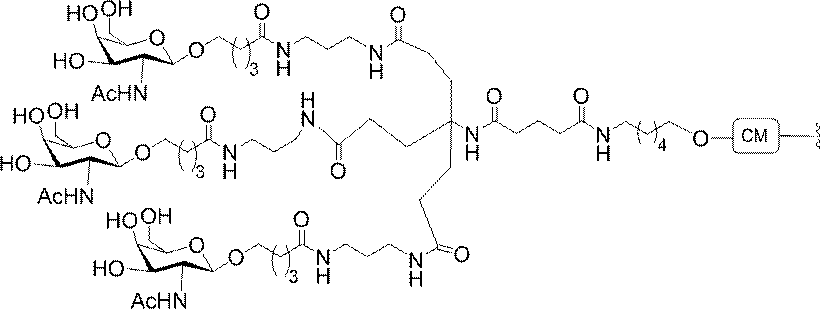
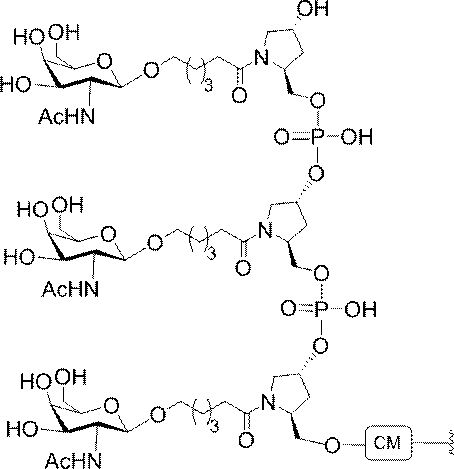
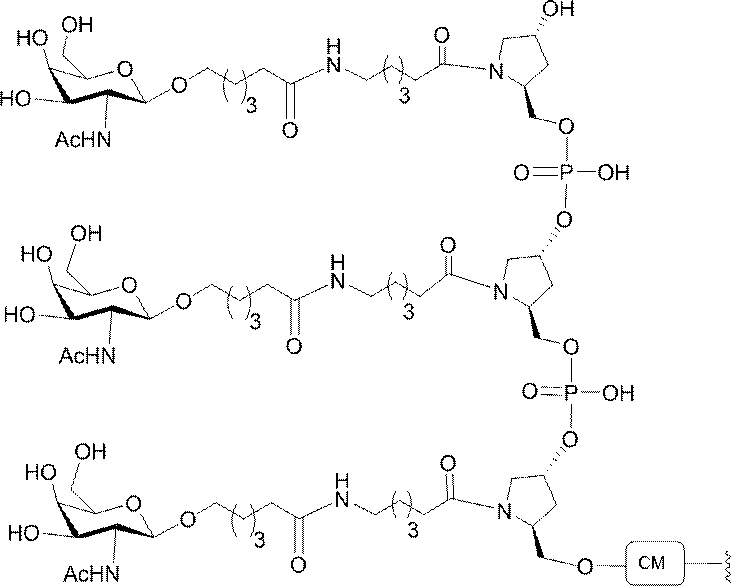
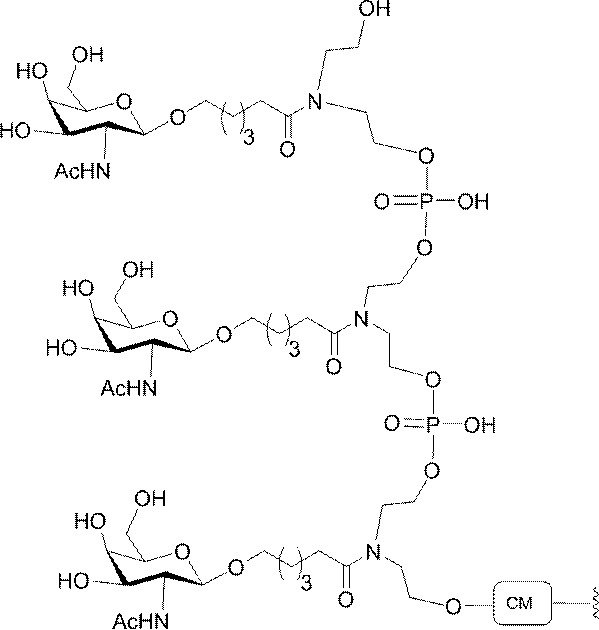
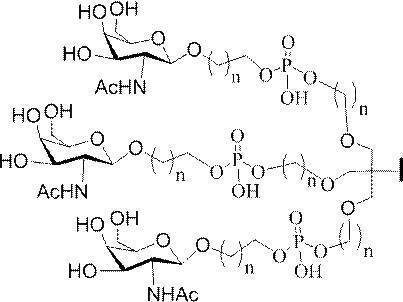
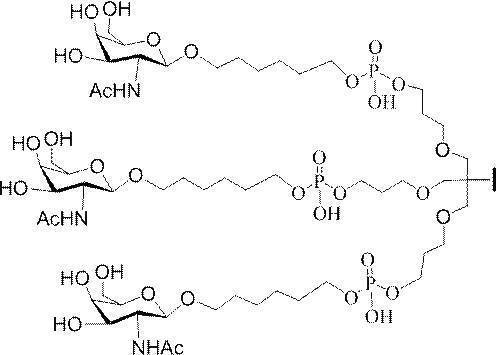
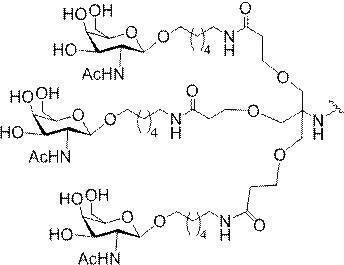
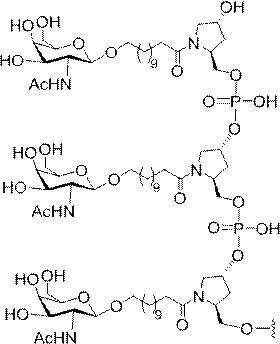
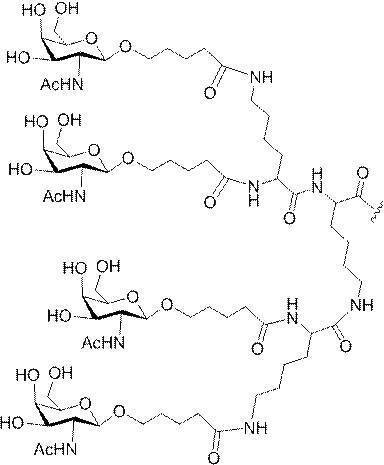
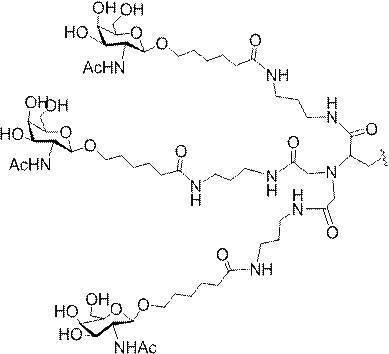
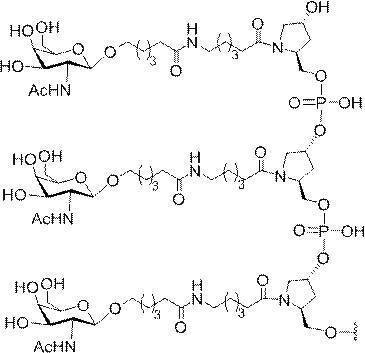
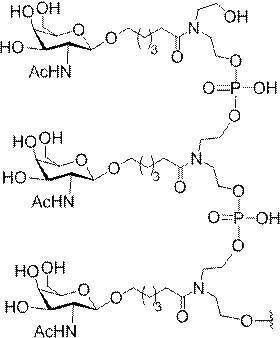
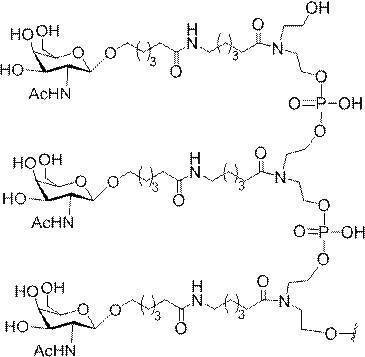
示す。「GalNAc3-1」は、先の実施例9に示された構造を有する共役基を示す。GalNAc3-1が、ASOを共役体の残りの部分に連結させる切断可能なアデノシンを含み、「GalNAc3-1a」と指定されることに留意されたい。上述の表ではこの命名法を用いて、共役体の一部であるアデノシンを含む全核酸塩基配列を示す。したがって、上述の表において、「Ado」を省略して「GalNAc3-1」で終了する配列を列記することもできる。下付き文字「a」を用いて切断可能なヌクレオシドまたは切断可能部分を欠く共役基の部分を示すこの慣例をこれらの実施形態の全体を通して用いる。切断可能部分を欠く共役基のこの部分は、本明細書において「クラスター」または「共役クラスター」または「GalNAc3クラスター」と称される。特定の事例において、これは、そのクラスター及びその切断可能部分を別々に提供することによって共役基を説明するのに好都合である。
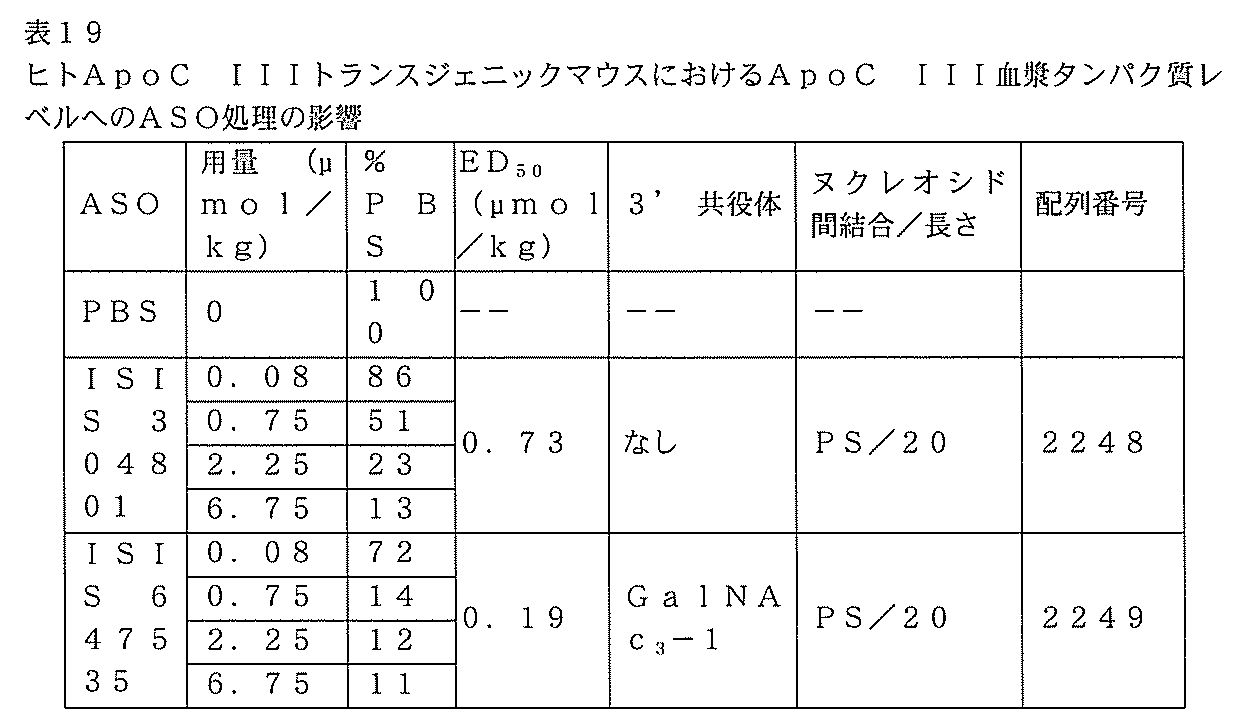
それぞれヒトApoC IIIを標的とし、かつ上に記載されるISIS 304801及びISIS 647535を別々に試験し、用量依存的試験において、ヒトApoC
IIIトランスジェニックマウスにおけるヒトApoC IIIを阻害するそれらの能力について評価した。
処理
ApoC III mRNA分析
2013年3月29日の出版前にオンラインで公開されたGraham et al(Circulation Research)によって報告された手順を用いて、血漿ApoC IIIタンパク質分析を行った。
ASOのPKも評価した。肝臓及び腎臓試料を切り刻み、標準のプロトコルを用いて抽出した。試料をIP-HPLC-MSを利用するMSD1で分析した。全長ISIS 304801及び647535の組織レベル(μg/g)を測定し、結果が表23に提供される。例証されるように、総全長アンチセンス化合物の肝臓濃度は、これら2つのアンチセンス化合物と同様であった。したがって、GalNAc3-1共役アンチセンス化合物が肝臓でより活性であるが(上のRNA及びタンパク質データによって実証されるように)、肝臓内で著しく高い濃度では存在しない。実際には、計算されたEC50(表23に提供される)は、共役化合物の力価の観察された増加が蓄積の増加に完全に起因するわけではないことを裏付ける。この結果は、共役体が、肝臓蓄積単独以外の機構によって、おそらくアンチセンス化合物の細胞への生産的な取り込みを改善することによって、力価を改善したことを示唆する。
それぞれヒトApoC IIIを標的とし、かつ表17に記載されるISIS 304801、647535、及び647536を、単回投与試験において、ヒトApoC IIIトランスジェニックマウスにおけるヒトApoC IIIを阻害するそれらの能力についてさらに評価した。
ヒトApoCIIIトランスジェニックマウスを12時間の明暗周期に維持し、Teklad実験食餌を不断給餌した。実験開始前に動物を研究施設で少なくとも7日間順化させた。ASOをPBS中に調製し、0.2ミクロンのフィルターを通して濾過滅菌した。注入のためにASOを0.9%PBS中に溶解した。
それぞれSRB-1を標的とし、かつ表17に記載されるISIS 440762及び651900を、用量依存的試験において、Balb/cマウスにおけるSRB-1を阻害するそれらの能力について評価した。
6週齢の雄Balb/cマウス(Jackson Laboratory,Bar Harbor,ME)に、ISIS 440762、651900、またはPBS処理対照を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物からなった。最終投与の48時間後にマウスを屠殺して、標準のプロトコルに従ってリアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNAレベルを決定した。PBS処理対照に対して正規化する前に(Ribogreenを用いて)SRB-1 mRNAレベルを全RNAとの比較で相対的に決定した。以下の結果は、PBS処理対照に対して正規化された各処理群のSRB-1 mRNAレベルの平均パーセントとして提示され、「%PBS」で表示される。
BD Vautainer CPTチューブ法を用いてhPBMCアッセイを実行した。US HealthWorks clinic(Faraday & El Camino Real,Carlsbad)においてインフォームドコンセントを得た志願ドナー由来の全血試料を得て、4~15個のBD Vacutainer CPT8mLチューブ(VWRカタログ番号BD362753)内に収集した。PBMCアッセイデータシートを用いて、各ドナーのCPTチューブ内の開始合計全血量の近似値を記録した。
/ウェル中に5×105でプレーティングした。RPMI+10%FBS+pen/strep中で希釈した2倍濃度のオリゴ/対照の50μL/ウェルを実験テンプレートに従って添加した(合計100μL/ウェル)。プレートを振盪器に設置し、約1分間混合させた。37℃、5%CO2で24時間インキュベートした後、プレートを400×gで10分間遠心分離し、その後、MSDサイトカインアッセイ(すなわち、ヒトIL-6、IL-10、IL-8、及びMCP-1)のために上澄みを除去した。
表30に列記されるアンチセンスオリゴヌクレオチド(ASO)を、実施例23に記載されるプロトコルを用いたhPBMCアッセイにおいて炎症誘発作用について評価した。ISIS 353512は、このアッセイにおいてIL-6放出に関する高レスポンダーとして知られる内部標準物である。hPBMCを新鮮な志願ドナーから単離し、0、0.0128、0.064、0.32、1.6、8、40、及び200μm濃度のASOで処理した。処理から24時間後、サイトカインレベルを測定した。
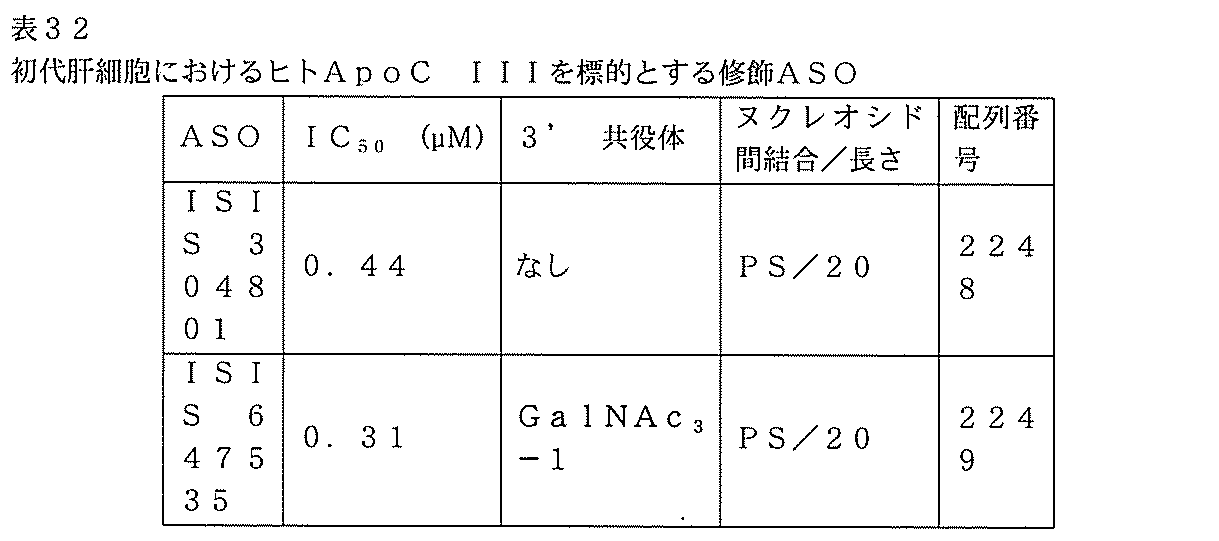
上述のISIS 304801及び647535を生体外で試験した。トランスジェニックマウス由来の25,000細胞/ウェルの密度の初代肝細胞を、0.03,0.08、0.24、0.74、2.22、6.67、及び20μm濃度の修飾オリゴヌクレオチドで処理した。約16時間の処理期間後、RNAを細胞から単離し、mRNAレベルを定量的リアルタイムPCRで測定し、hApoC III mRNAレベルをRIBOGREENで測定された全RNA含有量に従って調整した。
は、GalNAc共役体を欠くオリゴヌクレオチドと比較して、さまざまなGalNAc共役体を含むオリゴヌクレオチドの力価の増加を示した(実施例60、82、及び92を参照のこと)。
ヒトApoC IIIトランスジェニックマウスに、ISIS 304801もしくはISIS 616468(両方ともに上述のもの)またはPBS処理対照を、25mg/kgで週1回2週間、腹腔内注入した。処理群は、3匹の動物から成り、対照群は、4匹の動物からなった。治療前及び最終服用後に血液を各マウスから採取し、血漿試料を分析した。最終投与の72時間後にマウスを屠殺した。
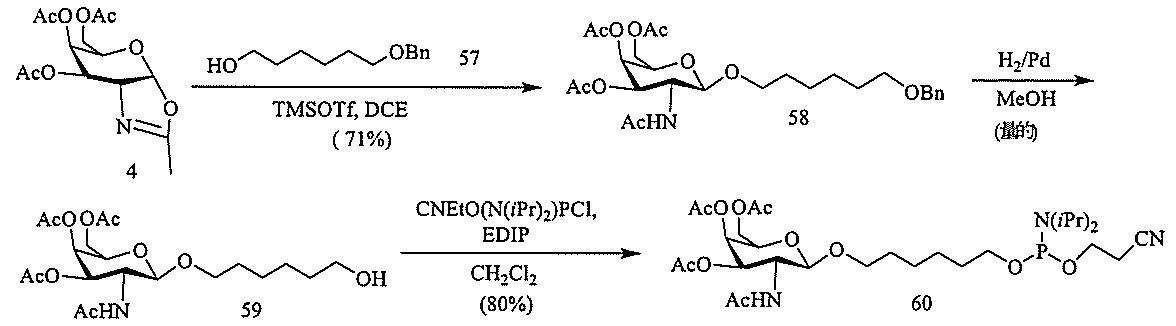
化合物56は、Glen Researchから市販されているか、またはShchepinov et al.,Nucleic Acids Research,1997,25(22),4447-4454によって報告された公開された手順に従って調製することができる。
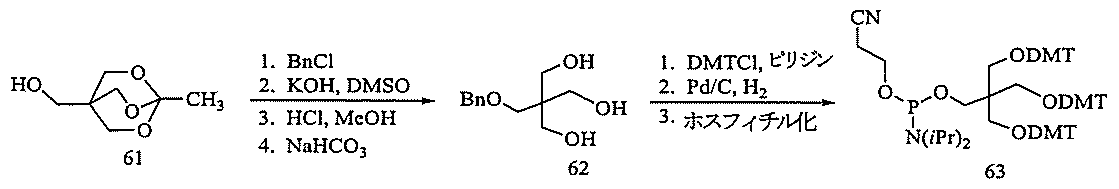
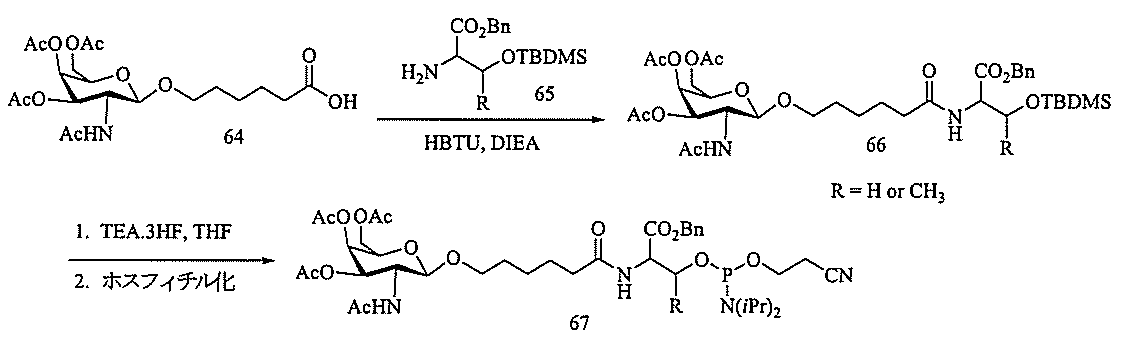
al.の公開されたPCT国際出願第WO2009003009号によって報告された手順と同様の手順を用いて調製する。他の保護基、例えば限定するわけではないが、本明細書に提示されるものを用いることができるため、化合物65に用いた保護基は、代表的なものであり、限定する意図はない。
示されるものを用いて、5’末端にホスホジエステル連結共役基を有するオリゴマー化合物を調製することができるため、例証されるホスホラミダイトは、代表的なものであり、限定する意図はない。固体支持体に添加されるホスホラミダイトの順序及び量を調整して、任意の既定の配列及び組成を有する本明細書に記載するオリゴマー化合物を調製することができる。
スホラミダイトは、代表的なものであり、限定する意図はない。固体支持体に添加されるホスホラミダイトの順序及び量を調整して、任意の既定の配列及び組成を有する本明細書に記載するオリゴマー化合物を調製することができる。
別段の明示がある場合を除き、オリゴマー化合物の合成に用いるすべての試薬及び溶液を商業的供給源から購入する。標準のホスホラミダイト構築ブロック及び固体支持体を、例えば、T、A、G、及びmC残基を含む、ヌクレオシド残基の組み込みのために用いる。ホスホラミダイト化合物56及び60を用いて、5’末端のホスホジエステル連結GalNAc3-2共役体を合成した。無水アセトニトリル中のホスホラミダイトの0.1M溶液をb-D-2’-デオキシリボヌクレオシド及び2’-MOEに用いた。
al.,2003)でのホスホラミダイトカップリング法により、ASO合成を、ABI 394合成装置(1~2μmolの規模)またはGE Healthcare Bioscience AKTAオリゴパイロット合成装置(40~200μmolの規模)で実行した。このカップリングステップについて、固体支持体の初期負荷量に対して4倍過剰のホスホラミダイトを送達し、ホスホラミダイトカップリングを10分間行った。すべての他のステップは、製造業者から提供された標準のプロトコルに従った。トルエン中の6%ジクロロ酢酸溶液を用いて、ヌクレオチドの5’-ヒドロキシル基からジメトキシトリチル(DMT)基を除去した。カップリングステップ中、無水CH3CN中の4,5-ジシアノイミダゾール(0.7M)を活性化剤として用いた。ホスホロチオエート連結部を、3分間の接触時間で、1:1のピリジン/CH3CN中のキサンタンヒドリドの0.1M溶液による硫化によって導入した。6%の水を含有するCH3CN中の20%のtert-ブチルヒドロペルオキシドの溶液を酸化剤として用いて、12分間の接触時間で、ホスホジエステルヌクレオシド間連結部を提供した。
ISIS 661166の合成を、実施例39及び41に例証される手順と同様の手順を用いて実行した。
5’末端にホスホジエステル連結GalNAc3-2共役体を含むISIS 661134(実施例41を参照のこと)を、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。非共役ISIS 440762及び651900(3’末端にGalNAc3-1共役体、実施例9を参照のこと)を比較のために試験に含め、先の表17に記載する。
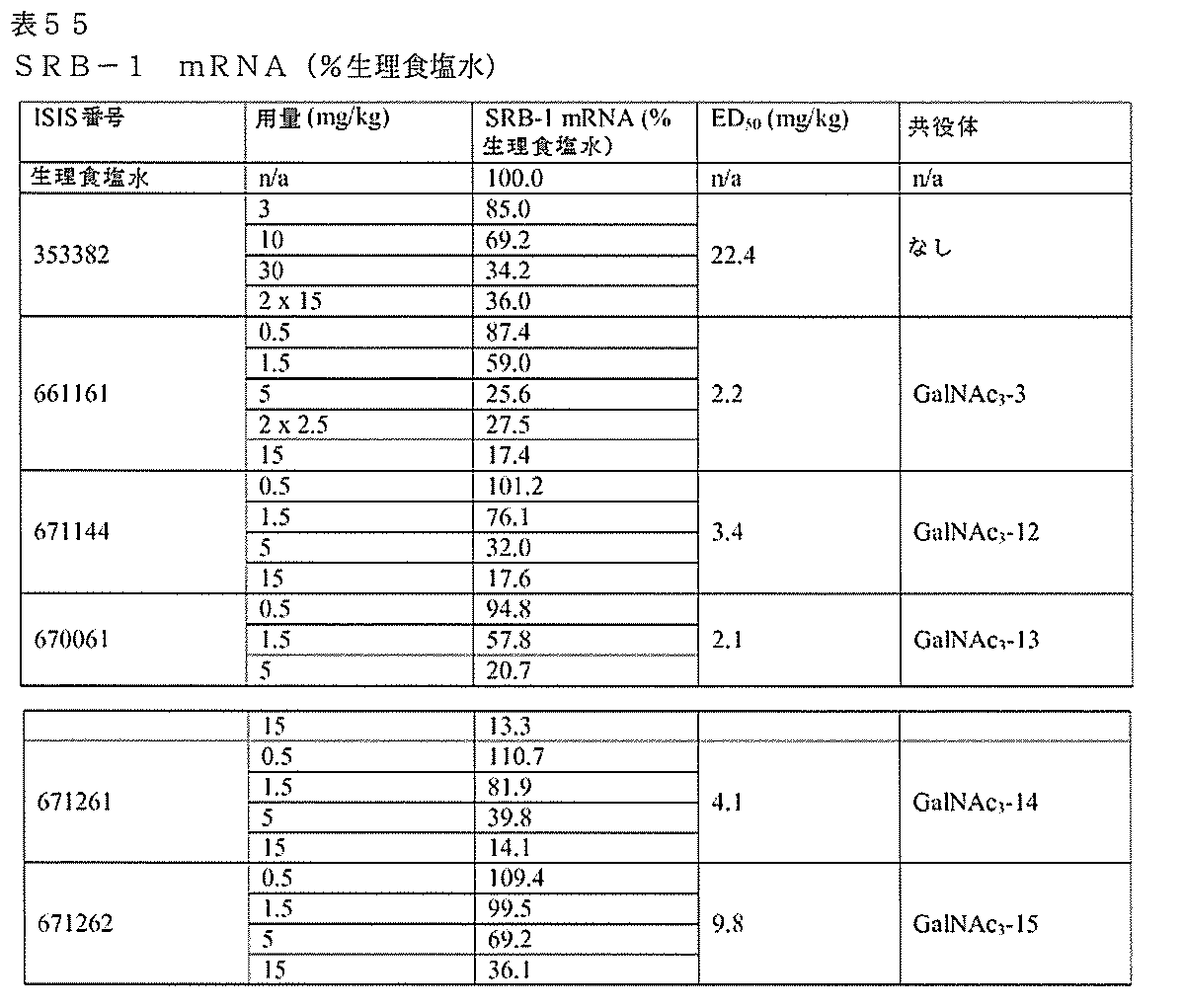
6週齢の雄Balb/cマウス(Jackson Laboratory,Bar Harbor,ME)に、ISIS 440762、651900、661134、またはPBS処理対照を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺して、リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNAレベルを標準プロトコルに従って決定した。PBS処理対照に対して正規化する前に(Ribogreenを用いて)SRB-1 mRNAレベルを全RNAとの比較で相対的に決定した。以下の結果は、PBS処理対照に対して正規化された各処理群のSRB-1 mRNAレベルの平均パーセントとして提示され、「%PBS」で表示される。当該方法と同様の方法を用いてED50を測定し、以下に提示する。
高用量群(7mg/kg)でのASOのPKを調べ、実施例20に例証される方法と同一の方法で評価した。肝臓試料を切り刻み、標準のプロトコルを用いて抽出した。661134(5’GalNAc3-2)及びISIS 651900(3’GalNAc3-1)の全長代謝物を特定し、これらの質量を高分解能質量分析によって確認した。結果は、5’末端にホスホジエステル連結GalNAc3-2共役体を含むASO(ISIS 661134)に対して検出された主な代謝物が、ISIS 440762であったことを示した(データ示されず)。検出可能なレベルでさらなる代謝物は観察されなかった。その対応物とは異なり、先の表23aに報告された代謝物と同様のさらなる代謝物が、3’末端にGalNAc3-1共役体を有するASO(ISIS 651900)で観察された。これらの結果は、ホスホジエステル連結GalNAc3-1またはGalNAc3-2共役体を有することで、それらの力価を損なうことなくASOのPKプロファイルを改善しうることを示唆する。
それぞれSRB-1を標的とする、3’末端にGalNAc3-1共役体を含むISIS 655861及び655862を、単回投与試験においてマウスにおけるSRB-1を阻害するそれらの能力について試験した。親非共役化合物ISIS 353382を比較のために試験に含めた。
処理
MRは、その構造と一致した。
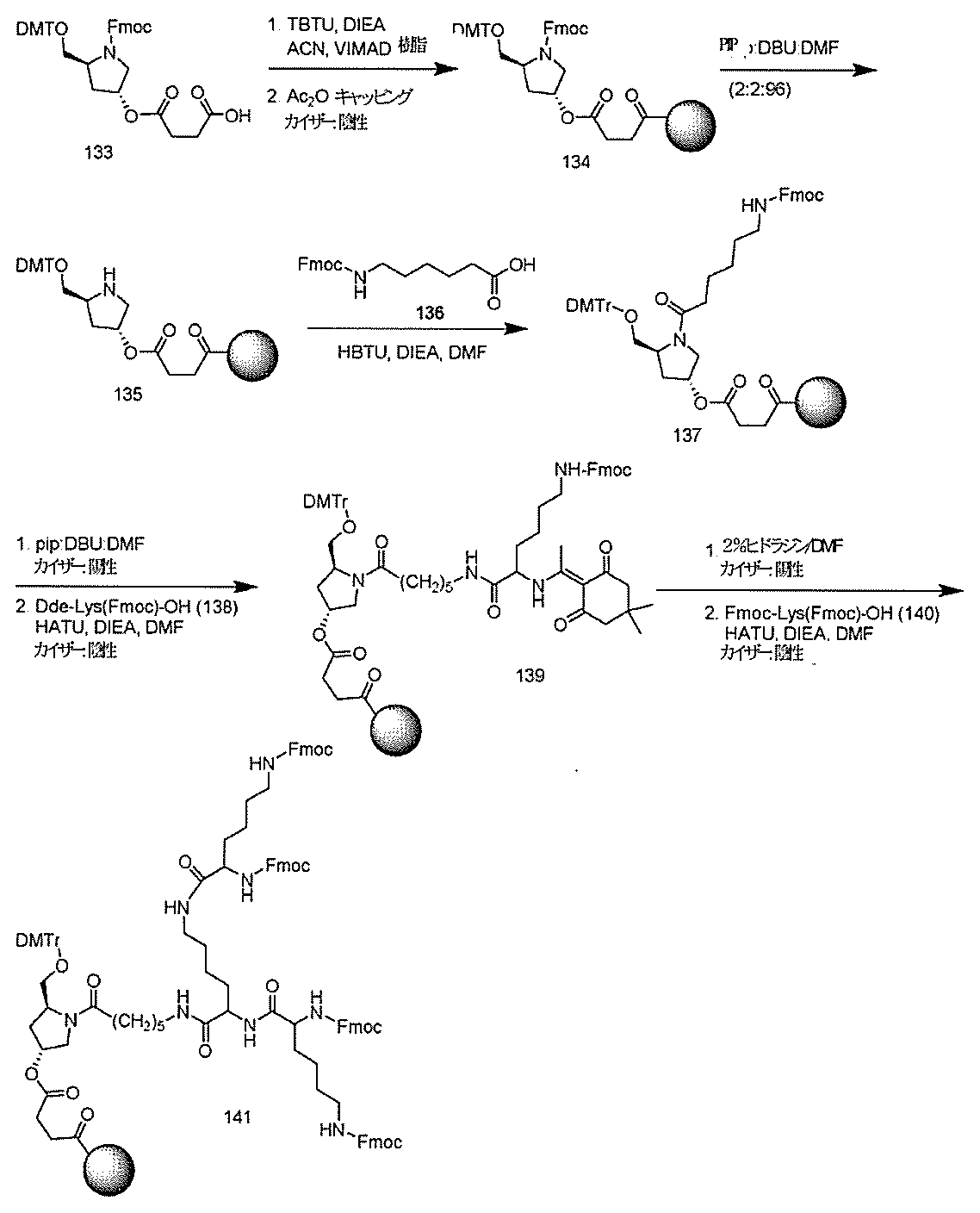
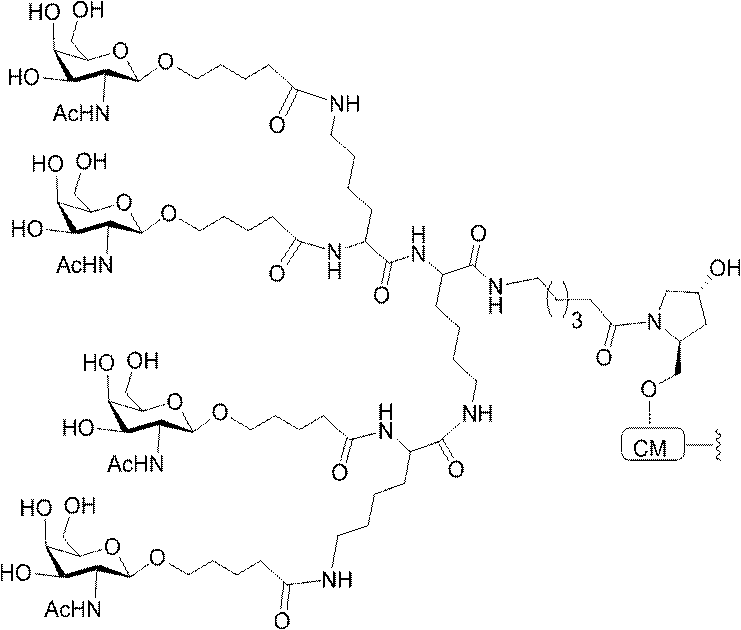
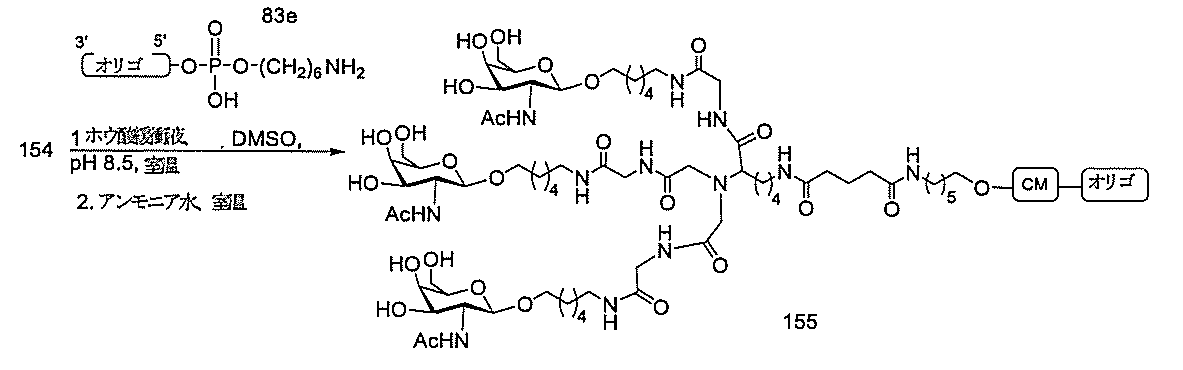
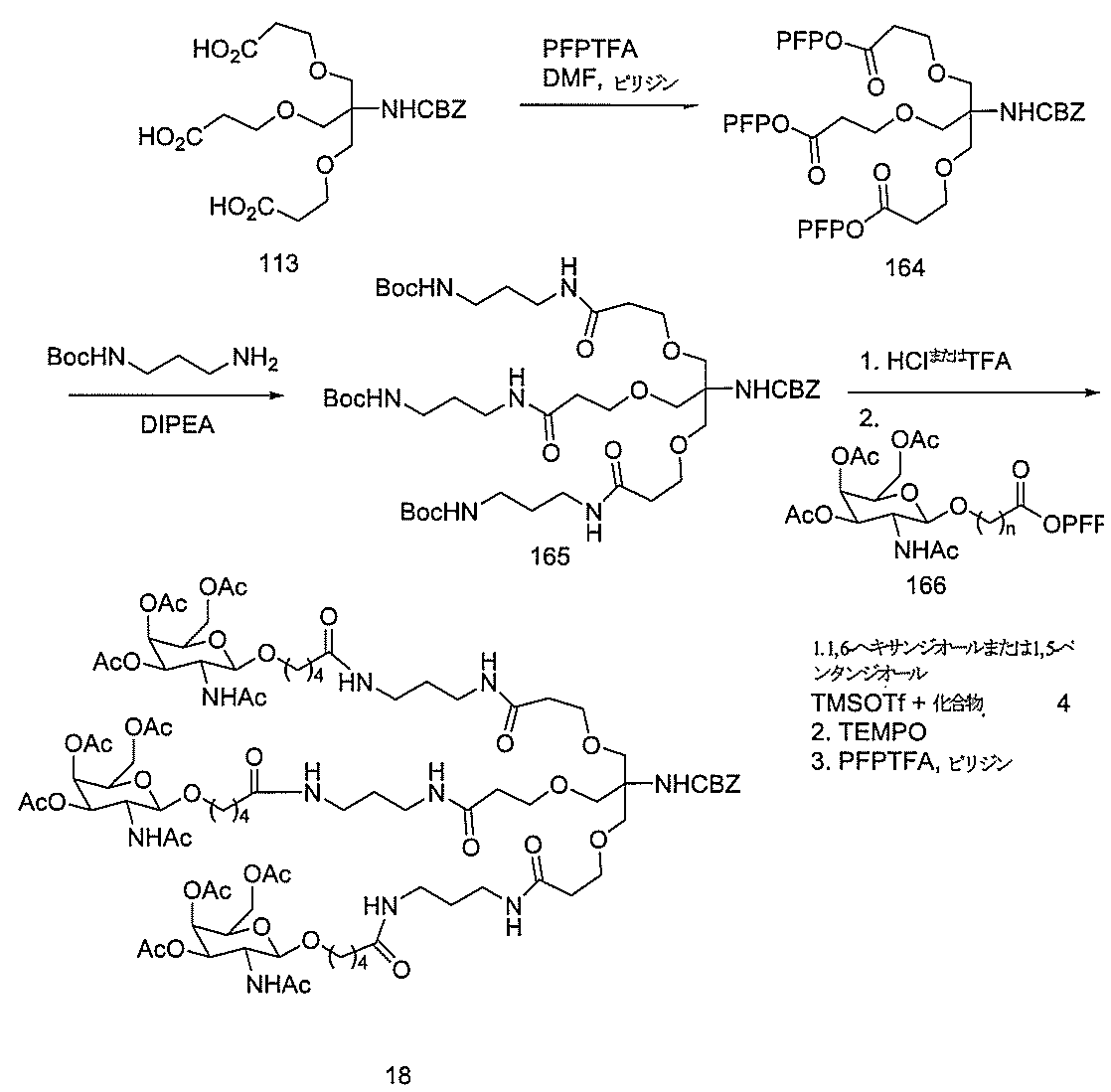
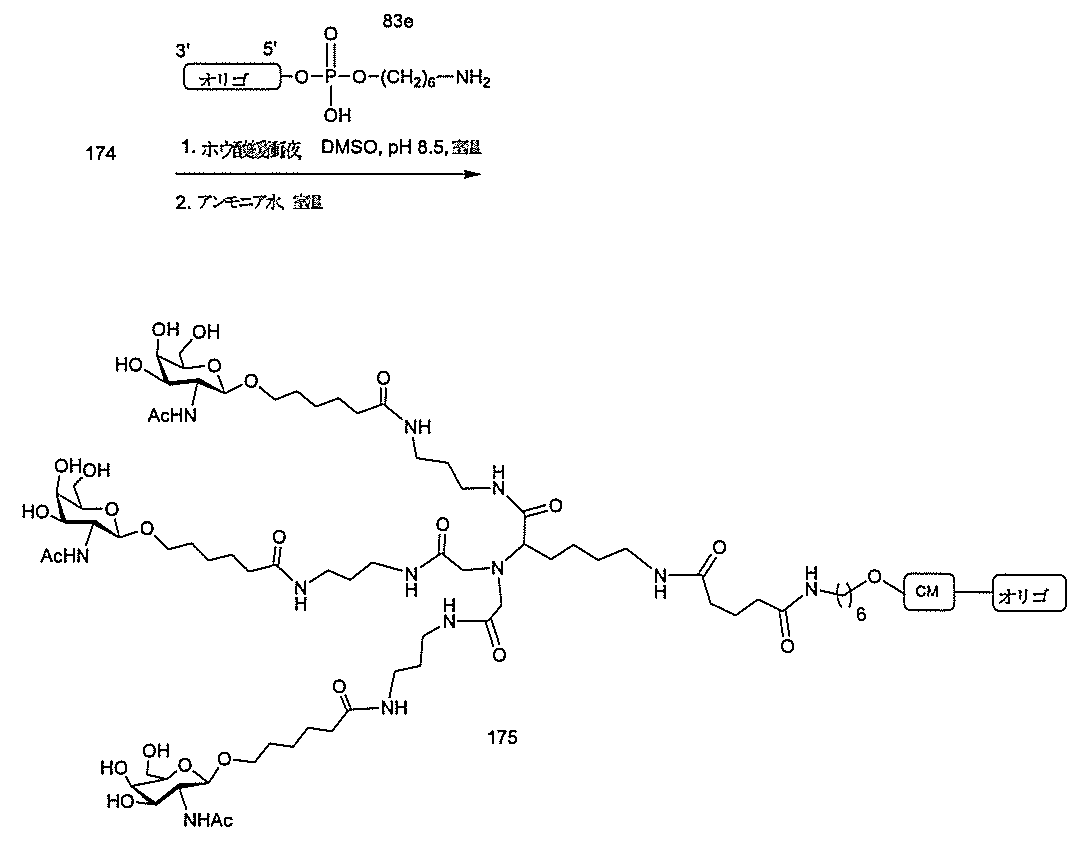
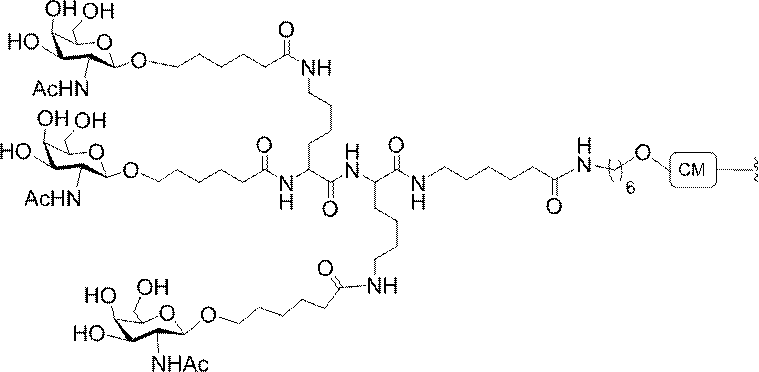
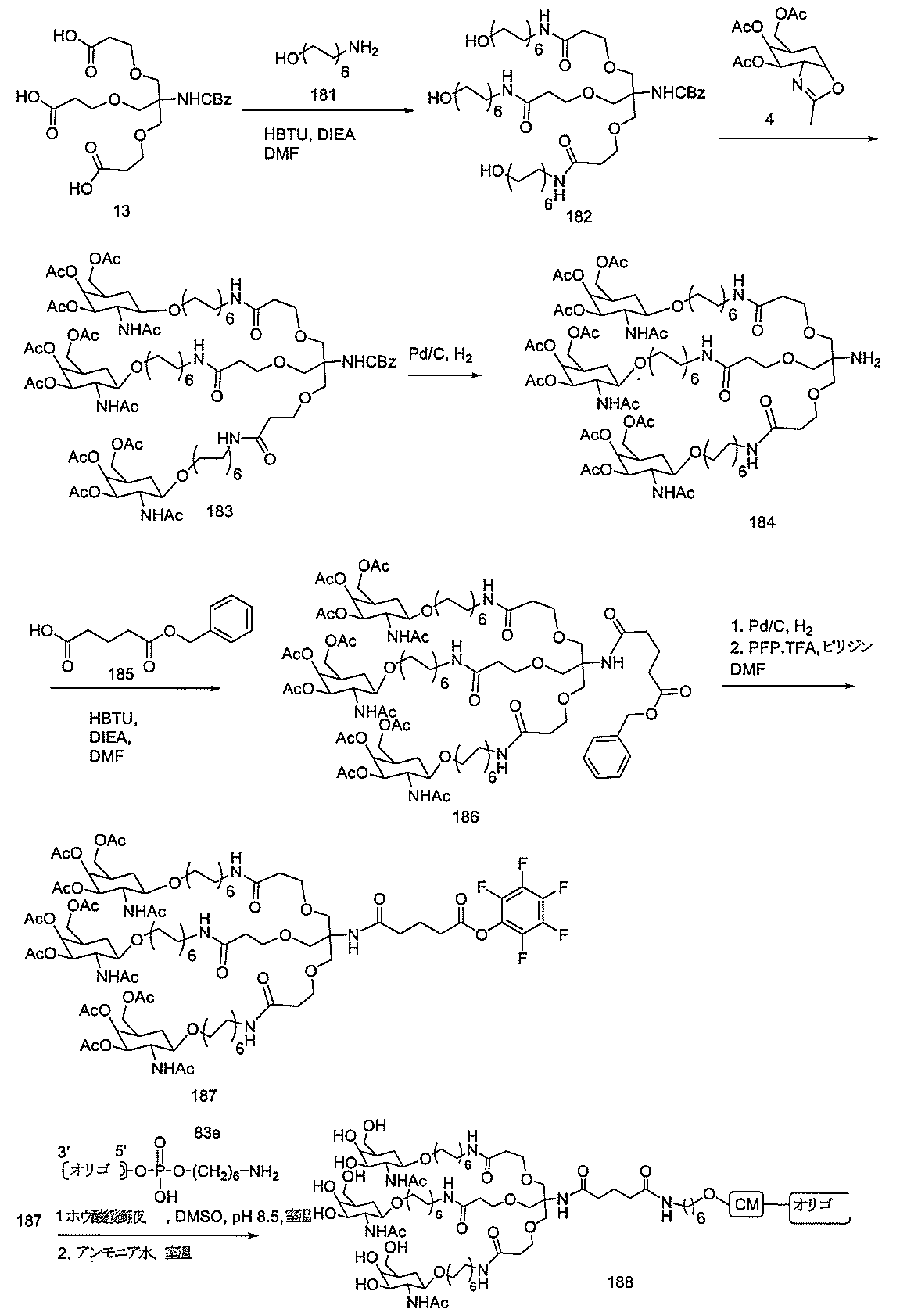
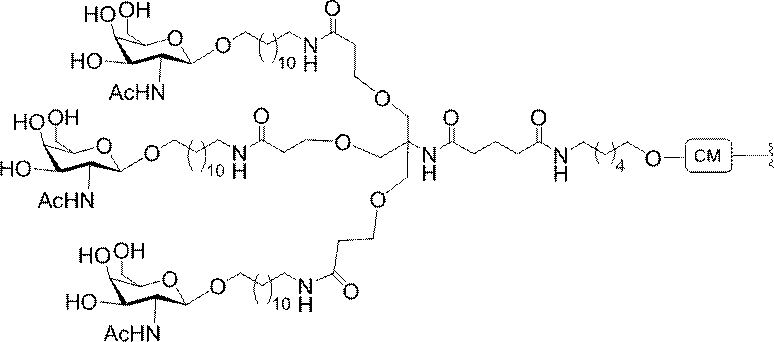
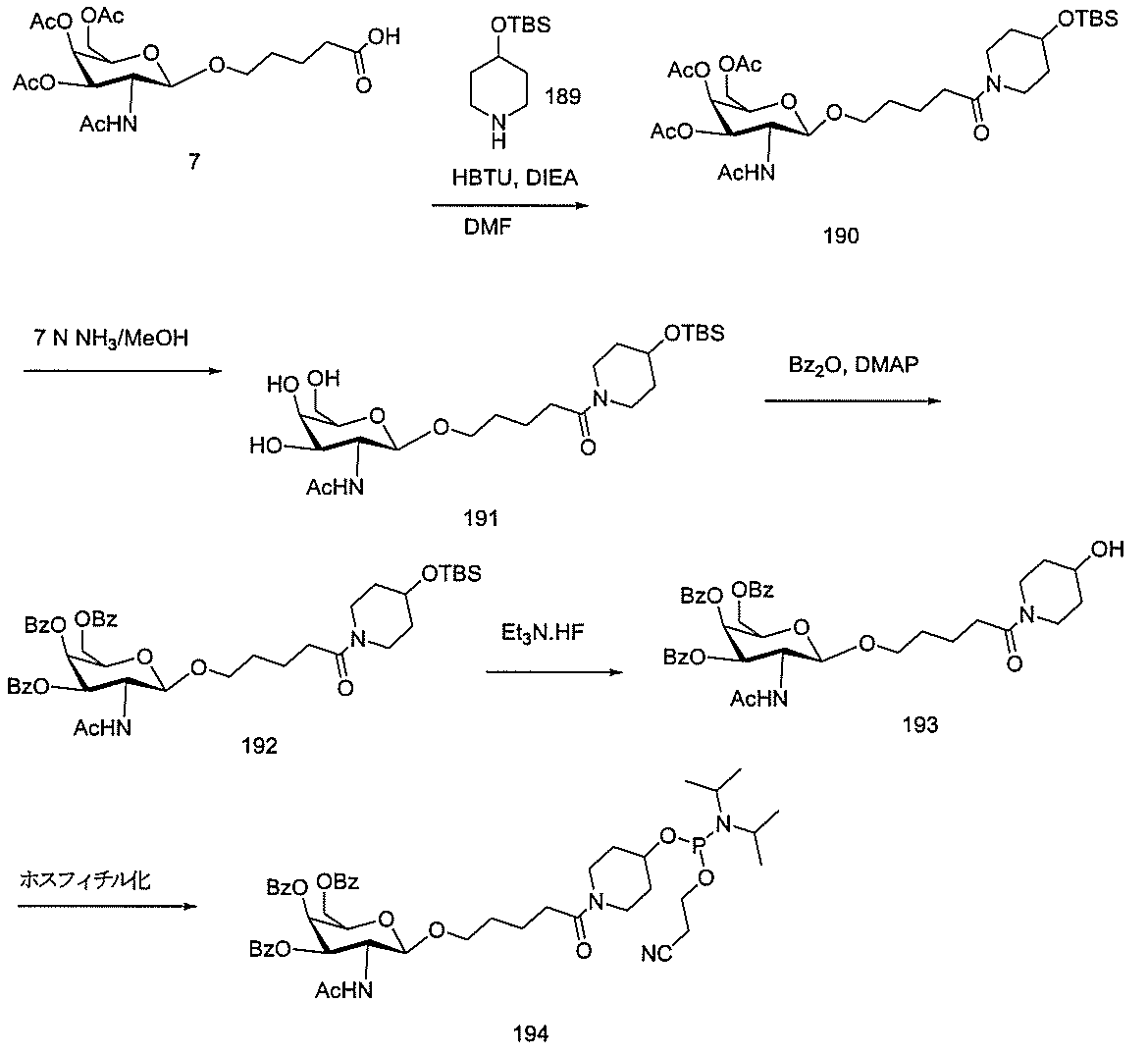
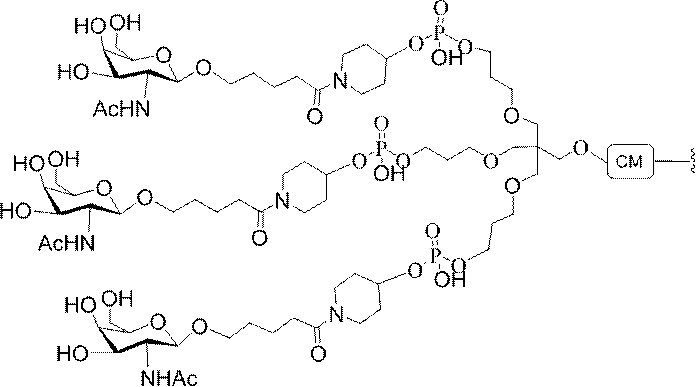
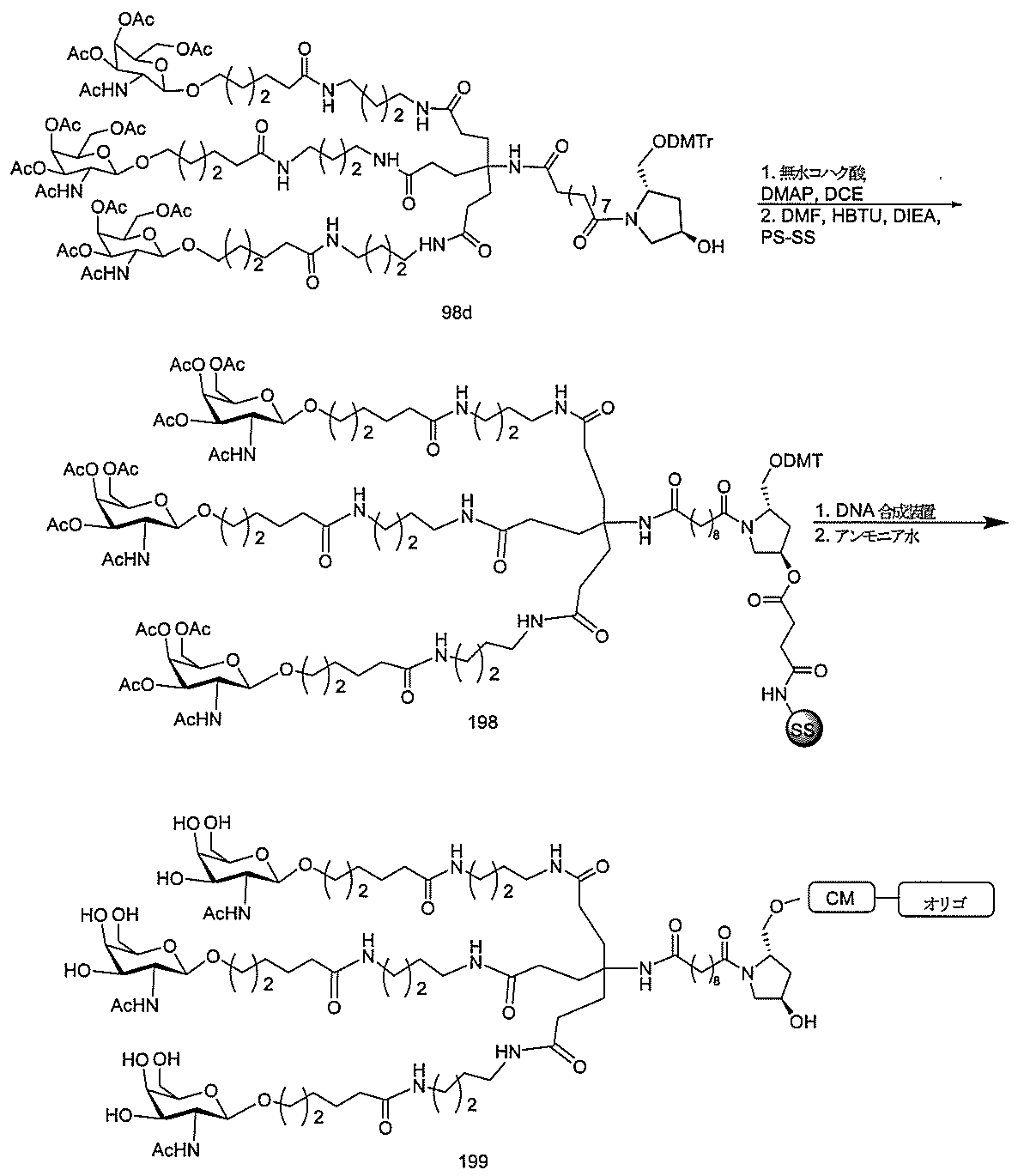
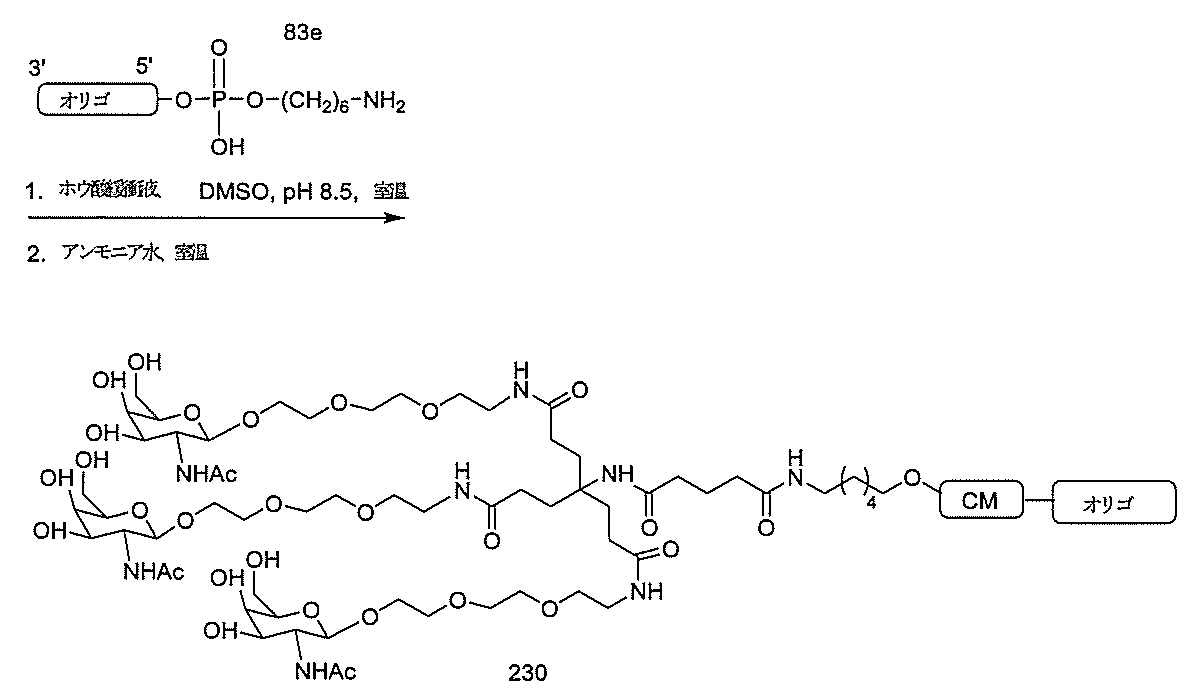
標準の固相オリゴヌクレオチド手順を用いて5’-ヘキシルアミノ修飾オリゴヌクレオチドを合成し、精製した。5’-ヘキシルアミノ修飾オリゴヌクレオチドを0.1M四ホウ酸ナトリウム(pH8.5、200μL)中に溶解し、DMSO(50μL)中に溶解した3当量の選択されたPFPエステル化GalNAc3クラスターを添加した。ASO溶液への添加時にPFPエステルが沈殿した場合、すべてのPFPエステルが溶解した状態になるまでDMSOを添加した。室温で約16時間混合した後、反応が完了した。結果として生じた溶液を水で希釈して12mLにし、その後、質量カットオフが3000Daのスピンフィルター中、3000rpmで沈降させた。このプロセスを2回繰り返して、小分子不純物を除去した。その後、この溶液を凍結乾燥乾固させ、濃縮アンモニア水中に再溶解し、室温で2.5時間混合し、その後、真空内で濃縮して、アンモニアの大部分を除去した。共役オリゴヌクレオチドを精製し、RP-HPLCによって脱塩し、凍結乾燥させて、GalNAc3共役オリゴヌクレオチドを得た。
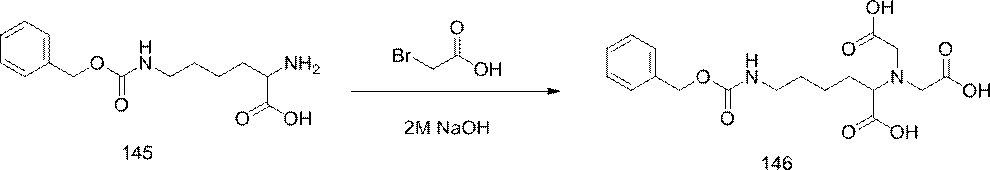
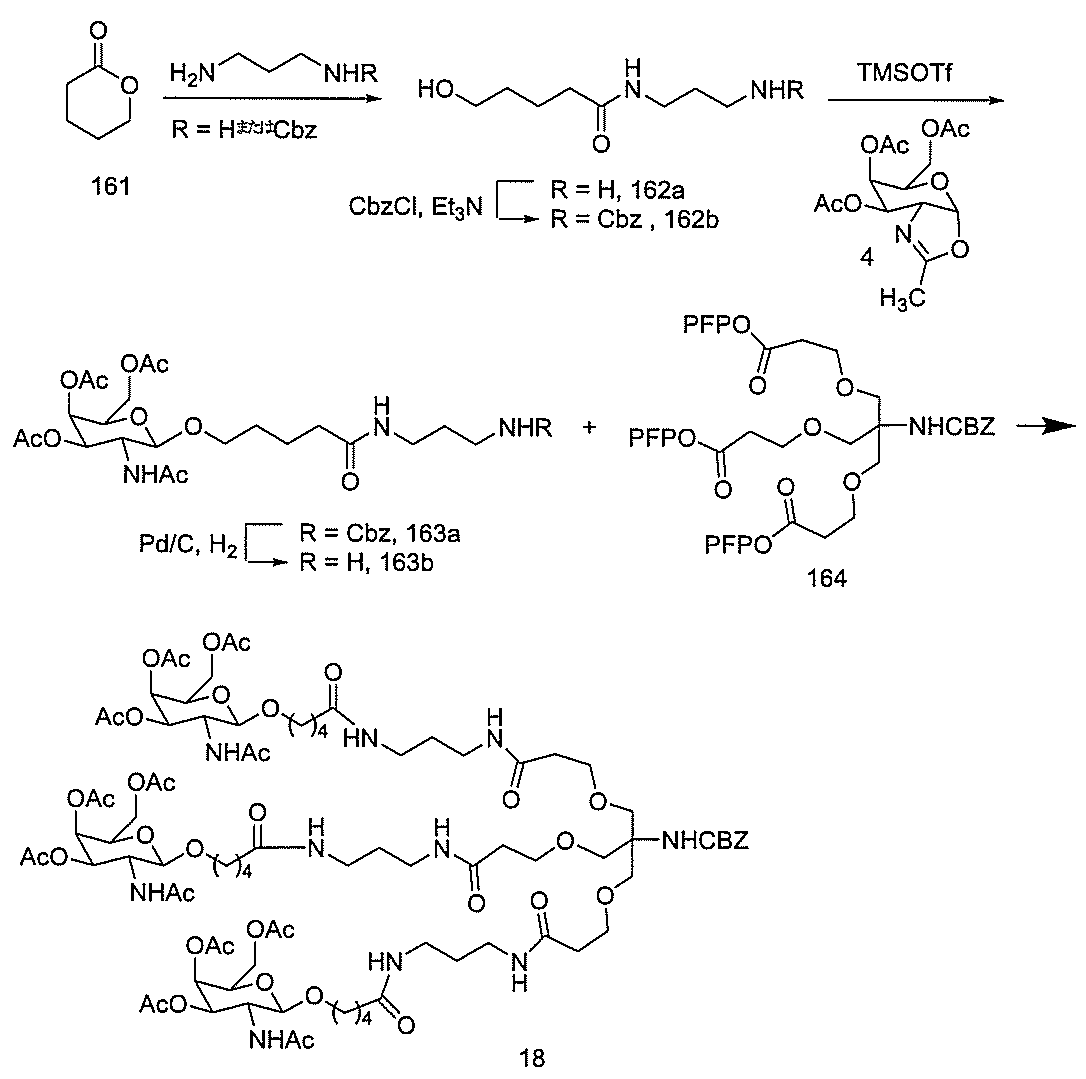
物を室温で30分間撹拌させた。Boc-ジアミン91aまたは91b(68.87mmol)をN,N-ジイソプロピルエチルアミン(12.35mL、72mmole)とともに添加し、反応物を室温で16時間撹拌させた。この時点で、DMFを減圧下で75%超、減量し、その後、混合物をジクロロメタン中に溶解した。有機層を重炭酸ナトリウム、水、及びブラインで洗浄した。その後、有機層を分離し、硫酸ナトリウム上で乾燥させ、濾過し、減圧下で減量して、油状物とした。結果として生じた油状物をシリカゲルクロマトグラフィー(2%→10%メタノール/ジクロロメタン)によって精製して、約80%の収率で化合物92a及び92bを得た。LCMS及びプロトンNMRは、その構造と一致した。
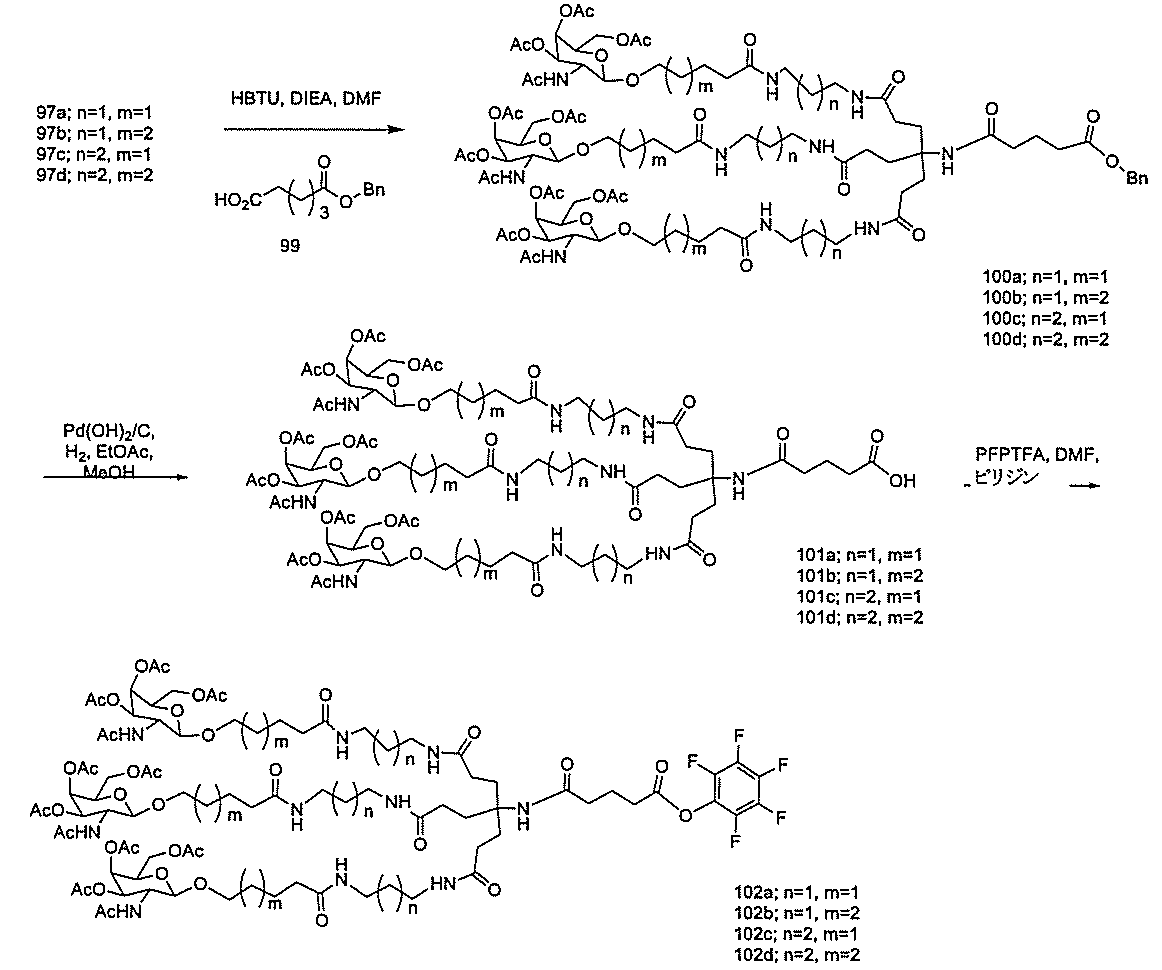
40~60%の収率で化合物100a~dを得た。LCMS及びプロトンNMRは、その構造と一致した。
化合物120(14.01g、40mmol)及びHBTU(14.06g、37mmol)を無水DMF(80mL)中に溶解した。トリエチルアミン(11.2mL、80.35mmol)を添加し、5分間撹拌した。反応混合物を氷浴中で冷却し、無水DMF(20mL)中の化合物121(10g、mmol)の溶液を添加した。さらなるトリエチルアミン(4.5mL、32.28mmol)を添加し、反応混合物をアルゴン雰囲気下で18時間撹拌した。TLC(1:1の酢酸エチル:ヘキサン;Rf=0.47)によって反応を監視した。溶媒を減圧下で除去した。残渣をEtOAc(300mL)中に取り込み、1M NaHSO4(3×150mL)、飽和NaHCO3水溶液(3×150mL)、及びブライン(2×100mL)で洗浄した。有機層をNa2SO4で乾燥させた。乾燥剤を濾去し、有機層を回転蒸発によって濃縮した。粗混合物をシリカゲルカラムクロマトグラフィーによって精製し、ヘキサン中の35~50%EtOAcを用いて溶出して、化合物122(15.50g、78.13%)を得た。この構造を、LCMS及び1H NMR分析によって確認した。質量(m/z)589.3[M+H]+。
28(1.67g)を得て、さらに精製することなく次のステップで使用した。LCMS及び1H NMRは、その構造と一致した。質量(m/z)478.2[M+H]+。
m)。濾液を回転蒸発によって濃縮し、高真空下で短時間乾燥させて、化合物151(0.57g)を得た。LCMSは、所望の生成物と一致した。この生成物を4mLの乾燥DMF中に溶解し、次のステップで即座に使用した。
合物をパージした。パールマン触媒(炭素上の水酸化パラジウム)を添加した(35mg)。この溶液を通して水素ガスを30分間バブリングした。完了した時点で(TLC(DCM中の10%MeOH)及びLCMS)、触媒を濾去した(シリンジチップTeflonフィルター、0.45μm)。濾液を回転蒸発によって濃縮し、高真空下で短時間乾燥させて、化合物153(0.33g、定量的)を得た。LCMSは、所望の生成物と一致した。
以下に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。非共役ISIS 353382を標準物として含めた。さまざまなGalNAc3共役基のそれぞれは、ホスホジエステル連結2’-デオキシアデノシンヌクレオシド(切断可能部分)によってそれぞれのオリゴヌクレオチドの3’末端または5’末端のいずれかで結合された。
処理
ル連結GalNAc3-1及びGalNAc3-9共役体(ISIS 655861及びISIS 664078)ならびに5’末端に連結されたGalNAc3-3及びGalNAc3-8共役体(ISIS 661161及びISIS 665001)を含むアンチセンスオリゴヌクレオチドは、非共役アンチセンスオリゴヌクレオチド(ISIS 353382)と比較して、力価の大幅な改善を示した。さらに、3’末端にGalNAc3-9共役体を含むISIS 664078は、3’末端にGalNAc3-1共役体を含むISIS 655861と比較して、本質的に等効力であった。それぞれ、GalNAc3-3またはGalNAc3-9を含む5’共役アンチセンスオリゴヌクレオチドISIS 661161及びISIS 665001は、3’共役アンチセンスオリゴヌクレオチド(ISIS 655861及びISIS 664078)と比較して、力価を増加させた。
以下に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。非共役ISIS 353382を標準物として含めた。3’末端にGalNAc3共役基を結合させたISIS 655861を除
いて、さまざまなGalNAc3共役基のそれぞれは、ホスホジエステル連結2’-デオキシアデノシンヌクレオシド(切断可能部分)によってそれぞれのオリゴヌクレオチドの5’末端に取り付けられた。
造は、先の実施例37に示される。GalNAc3-3aの構造は、先の実施例39に示される。GalNAc3-5aの構造は、先の実施例49に示される。GalNAc3-6aの構造は、先の実施例51に示される。GalNAc3-7aの構造は、先の実施例48に示される。GalNAc3-10aの構造は、先の実施例46に示される。
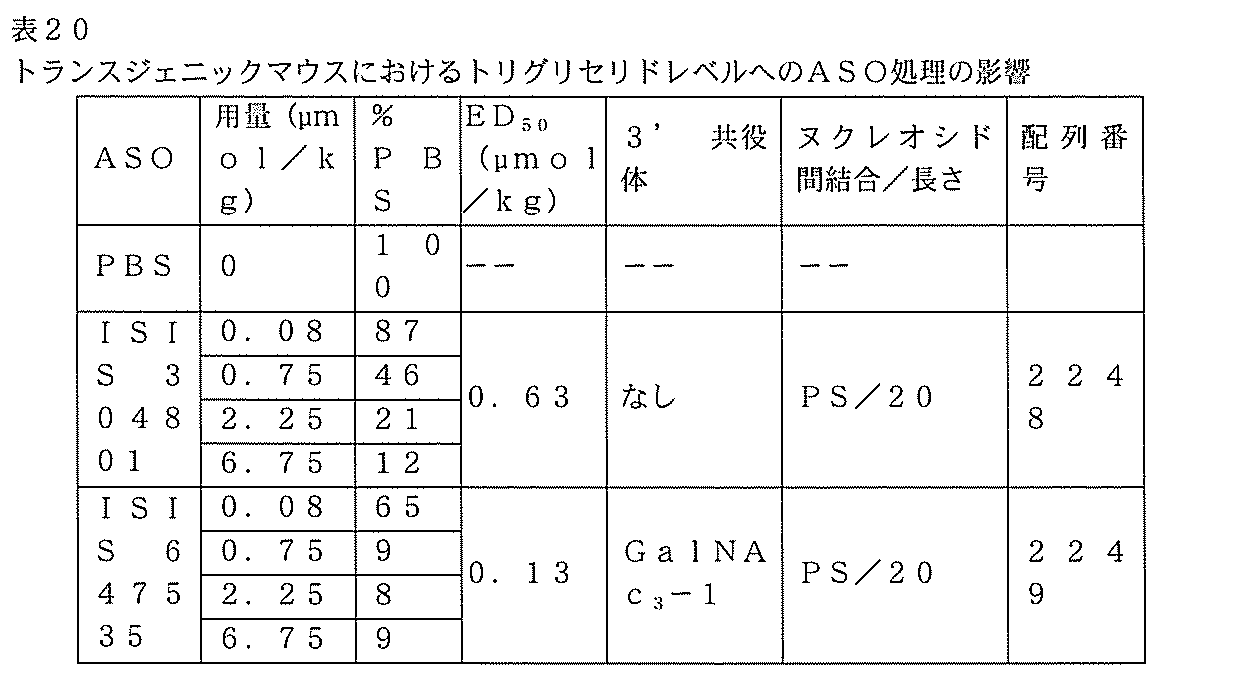
処理
マウスに以下に示される用量を1回注入し、ApoC-III及び血漿トリグリセリド(血漿TG)レベルを42日間にわたって監視した。各群におけるヒトAPOC-IIIを発現する3匹のトランスジェニックマウスを用いて、この試験を実行した。
以下に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。非共役ISIS 440762を非共役標準物として含めた。共役基のそれぞれは、ホスホジエステル連結2’-デオキシアデノシンヌクレオシド(切断可能部分)によってそれぞれのオリゴヌクレオチドの3’末端に取り付けられた。
6週齢の雄Balb/cマウス(Jackson Laboratory,Bar Harbor,ME)に、ISIS 440762、651900、663748、または生理食塩水を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺して、リアルタイムPCR及びRIBO
GREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNAレベルを決定した。以下の結果は、生理食塩水(対照)に対して正規化された各処理群のSRB-1 mRNAレベルの平均パーセントとして提示される。
以下に列記されるオリゴヌクレオチドを、複数回投与試験においてマウスにおけるFXIのアンチセンス阻害について試験した。ISIS 404071を非共役標準物として含めた。共役基のそれぞれは、ホスホジエステル連結2’-デオキシアデノシンヌクレオシドの切断可能部分によってそれぞれのオリゴヌクレオチドの3’末端に取り付けられた。
’」は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
6週齢の雄Balb/cマウス(Jackson Laboratory,Bar Harbor,ME)に、ISIS 404071、656172、656173、またはPBS処理対照を、以下に示される投与量で週2回3週間、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺して、リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるFXI mRNAレベルを決定した。ELISAを用いて血漿FXIタンパク質レベルも測定した。PBS処理対照に対して正規化する前に(RIBOGREEN(登録商標)を用いて)FXI mRNAレベルを全RNAとの比較で相対的に決定した。以下の結果は、各処理群のFXI mRNAレベルの平均パーセントとして提示される。データをPBS処理対照に対して正規化し、「%PBS」で表示する。当該方法と同様の方法を用いてED50を測定し、以下に提示する。
によって、力価がさらに増加した。
以下に列記されるオリゴヌクレオチドを、複数回投与試験において初代マウス肝細胞におけるSRB-1のアンチセンス阻害について試験した。ISIS 353382を非共
役標準物として含めた。共役基のそれぞれは、ホスホジエステル連結2’-デオキシアデノシンヌクレオシドの切断可能部分によってそれぞれのオリゴヌクレオチドの3’末端または5’末端に取り付けられた。
上に列記されるオリゴヌクレオチドを、25,000細胞/ウェルの密度でプレーティングし、かつ0.03、0.08、0.24、0.74、2.22、6.67、または20nMの修飾オリゴヌクレオチドで処理した初代マウス肝細胞において生体外で試験した。約16時間の処理期間後、RNAを細胞から単離し、mRNAレベルを定量的リアルタイムPCRによって測定し、RIBOGREEN(登録商標)によって測定された総RNA含有量に従ってSRB-1 mRNAレベルを調整した。
以下に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。非共役ISIS 353382を標準物として含めた。GalNAc3共役基のそれぞれは、ホスホジエステル連結2’-デオキシ
アデノシンヌクレオシド(切断可能部分)によってそれぞれのオリゴヌクレオチドの5’末端に取り付けられた。
処理
食塩水(対照)に対して正規化された各処理群のSRB-1 mRNAレベルの平均パーセントとして提示される。
以下に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。GalNAc3共役基のそれぞれは、ホスホジエステル連結ヌクレオシド(切断可能部分(CM))によってそれぞれのオリゴヌクレオチドの5’末端に取り付けられた。
6~8週齢のC57bl6マウス(Jackson Laboratory,Bar Harbor,ME)に、ISIS 661161、670699、670700、670701、671165、または生理食塩水を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺して、リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNAレベルを決定した。以下の結果は、生理食塩水(対照)に対して正規化された各処理群のSRB-1 mRNAレベルの平均パーセントとして提示される。
の実施形態において、切断可能部分は、-P(=O)(OH)-Ad-P(=O)(OH)-である。GalNAc3-20(GalNAc3-20a-CM-)の構造は、以下に示される:
3-22(GalNAc3-22a-CM-)の構造は、以下に示される:
以下に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。GalNAc3共役基のそれぞれは、それぞれのオリゴヌクレオチドの5’末端に取り付けられた。
6~8週齢のC57BL/6マウス(Jackson Laboratory,Bar
Harbor,ME)に、表60に列記されるオリゴヌクレオチドまたは生理食塩水を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺して、リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNAレベルを決定した。以下の結果は、生理食塩水(対照)に対して正規化された各処理群のSRB-1 mRNAレベルの平均パーセントとして提示される。
様式でSRB-1 mRNAレベルを低下させた。GalNAc共役体を含むアンチセンスオリゴヌクレオチドは、同様の力価を示し、GalNAc共役体を欠く親オリゴヌクレオチドよりも著しく強力であった。
実施例65、66、及び74に記載される処理手順に従って得た肝臓試料を用いて、上の表54、57、及び60におけるASOのPKを評価した。肝臓試料を切り刻み、標準のプロトコルを用いて抽出し、内部標準とともにIP-HPLC-MSによって分析した。適切なUVピークを統合することによってすべての代謝物の合わせた組織レベル(μg/g)を測定し、適切な抽出イオンクロマトグラム(EIC)を用いて、共役体を欠く全長ASO(この場合、ISIS番号353382の「親」)の組織レベルを測定した。
って精製し、ジクロロメタン中の2~10%メタノールの勾配で溶出して、化合物228を得た。LCMS及びNMRは、その構造と一致した。化合物228(1.7g、1.02mmol)をエタノール(100mL)中のラネーニッケル(約2g、湿性)で、水素雰囲気下で処理した。12時間後、触媒を濾去し、有機層を蒸発させて固体にし、これを次のステップで直接使用した。LCMS及びNMRは、その構造と一致した。この固体(0.87g、0.53mmol)をDMF(5mL)中のベンジルグルタル酸(0.18g、0.8mmol)、HBTU(0.3g、0.8mmol)、及びDIEA(273.7μL、1.6mmol)で処理した。16時間後、DMFを減圧下で65℃で除去して油状物とし、この油状物をジクロロメタン中に溶解した。有機層を飽和NaHCO3、ブラインで洗浄し、Na2SO4上で乾燥させた。有機層を蒸発させた後、化合物をカラムクロマトグラフィーによって精製し、ジクロロメタン中の2~20%メタノールの勾配で溶出して、カップリング生成物を得た。LCMS及びNMRは、その構造と一致した。ベンジルエステルをパールマン触媒で、水素雰囲気下で1時間脱保護した。その後、この触媒を濾去し、溶媒を除去乾固して、酸を得た。LCMS及びNMRは、その構造と一致した。酸(486mg、0.27mmol)を乾燥DMF(3mL)中に溶解した。ピリジン(53.61μL、0.66mmol)を添加し、反応物をアルゴンでパージした。ペンタフルオロトリフルオロアセテート(46.39μL、0.4mmol)を反応混合物に緩徐に添加した。反応物の色が淡黄色からワイン色に変化し、少しの煙を発し、この煙をアルゴン流で吹き飛ばした。反応物を室温で1時間撹拌させた(反応の完了をLCMSによって確認した)。この溶媒を減圧下(回転蒸発)で70℃で除去した。残渣をDCMで希釈し、1N NaHSO4、ブライン、飽和重炭酸ナトリウム、及び再度ブラインで洗浄した。有機物をNa2SO4上で乾燥させ、濾過し、濃縮乾固させて、黄色の脆い泡状物として225mgの化合物229を得た。LCMS及びNMRは、その構造と一致した。
以下に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。
6~8週齢のC57BL/6マウス(Jackson Laboratory,Bar
Harbor,ME)のそれぞれに、表64に列記されるオリゴヌクレオチドまたは生理食塩水を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺して、リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNAレベルを決定した。以下の結果は、生理食塩水(対照)に対して正規化された各処理群のSRB-1 mRNAレベルの平均パーセントとして提示される。
以下に列記されるオリゴヌクレオチドを、用量依存的試験において正常血圧のSprague Dawleyラットにおけるアンギオテンシノーゲン(AGT)のアンチセンス阻害について試験した。
6週齢の雄Sprague Dawleyラットのそれぞれに、表67に列記されるオリゴヌクレオチドまたはPBSを、以下に示される投与量で週1回、合計3回の投与で、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にラットを屠殺した。リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるAGT mRNAレベルを決定した。全アンギオテンシノーゲンELISA(カタログ番号JP27412、IBL International,Toronto,ON)を用いて、1:20,000で希釈したAGT血漿タンパク質レベルを測定した。以下の結果は、PBS対照に対して正規化された各処理群の肝臓におけるAGT mRNAレベルまたは血漿におけるAGTタンパク質レベルの平均パーセントとして提示される。
以下の表70に列記されるオリゴヌクレオチドを、単回投与試験においてマウスにおける作用持続時間について試験した。
ヒトAPOC-IIIを発現する6~8週齢のトランスジェニックマウスのそれぞれに、表70に列記されるオリゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、3匹の動物からなった。投薬前に血液を採取して、ベースライン、ならびに投与後72時間、1週間、2週間、3週間、4週間、5週間、及び6週間時点のレベルを決定した。実施例20に記載されるように、血漿トリグリセリド及びAPOC-IIIタンパク質レベルを測定した。以下の結果は、ベースラインレベルに対して正規化された各処理群の血漿トリグリセリド及びAPOC-IIIレベルの平均パーセントとして提示され、親オリゴヌクレオチドの投与量がGalNAc共役基を含むオリゴヌクレオチドの投与量の3倍であったにもかかわらず、GalNAc共役基を含むオリゴヌクレオチドが共役基を有しない親オリゴヌクレオチド(ISIS 304801)よりも長い作用持続時間を示したことを示す。
以下の表72に列記されるオリゴヌクレオチドを、マウスにおけるA1ATの用量依存的阻害試験において試験した。
6週齢の雄C57BL/6マウス(Jackson Laboratory,Bar Harbor,ME)のそれぞれに、表72に列記されるオリゴヌクレオチドまたはPBSを、以下に示される投与量で週1回、合計3回の投与で、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺した。リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるA1AT mRNAレベルを決定した。マウスα1-抗トリプシンELISA(カタログ番号41-A1AMS-E01、Alpco,Salem,NH)を用いて、A1AT血漿タンパク質レベルを決定した。以下の結果は、PBS対照に対して正規化された各処理群の肝臓におけるA1AT
mRNA及び血漿タンパク質レベルの平均パーセントとして提示される。
表72に列記されるオリゴヌクレオチドを、単回投与試験においてマウスにおける作用持続時間について試験した。
6週齢の雄C57BL/6マウスのそれぞれに、表72に列記されるオリゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、4匹の動物からなった。投薬の前日に血液を採取して、ベースライン、ならびに投与後5、12、19、及び25日時点のレベルを決定した。ELISAを用いて血漿A1ATタンパク質レベルを測定した(実施例80を参照のこと)。以下の結果は、ベースラインレベルに対して正規化された各処理群の血漿A1ATタンパク質レベルの平均パーセントとして提示される。結果は、GalNAc共役体を含むオリゴヌクレオチドがGalNAc共役体を欠く親(ISIS 476366)よりも強力であり、かつより長い作用持続時間を有したことを示す。さらに、5’-GalNAc共役体を含むオリゴヌクレオチド(ISIS 678381、678382、678383、及び678384)は、概して、3’-GalNAc共役体を含むオリゴヌクレオチド(ISIS 656326)よりもさらに強力であり、さらに長い作用持続時間を有した。
処理の2時間前に、初代マウス肝細胞を15,000細胞/ウェルで96ウェルプレートに播種した。表76に列記されるオリゴヌクレオチドをウィリアムE培地に2、10、50、または250nMで添加し、細胞を37℃、5%CO2で一晩インキュベートした。オリゴヌクレオチド添加の16時間後に細胞を溶解し、RNease 3000 BioRobot(Qiagen)を用いて全RNAを精製した。リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、SRB-1 mRNAレベルを標準のプロトコルに従って決定した。Prism 4ソフトウェア(GraphPad)を用いて、IC50値を決定した。結果は、さまざまな異なるGalNAc共役基及びさまざまな異なる切断可能部分を含むオリゴヌクレオチドが、生体外自由取り込み実験において、GalN
Ac共役基を欠く親オリゴヌクレオチド(ISIS 353382及び666841)よりも著しく強力であることを示す。
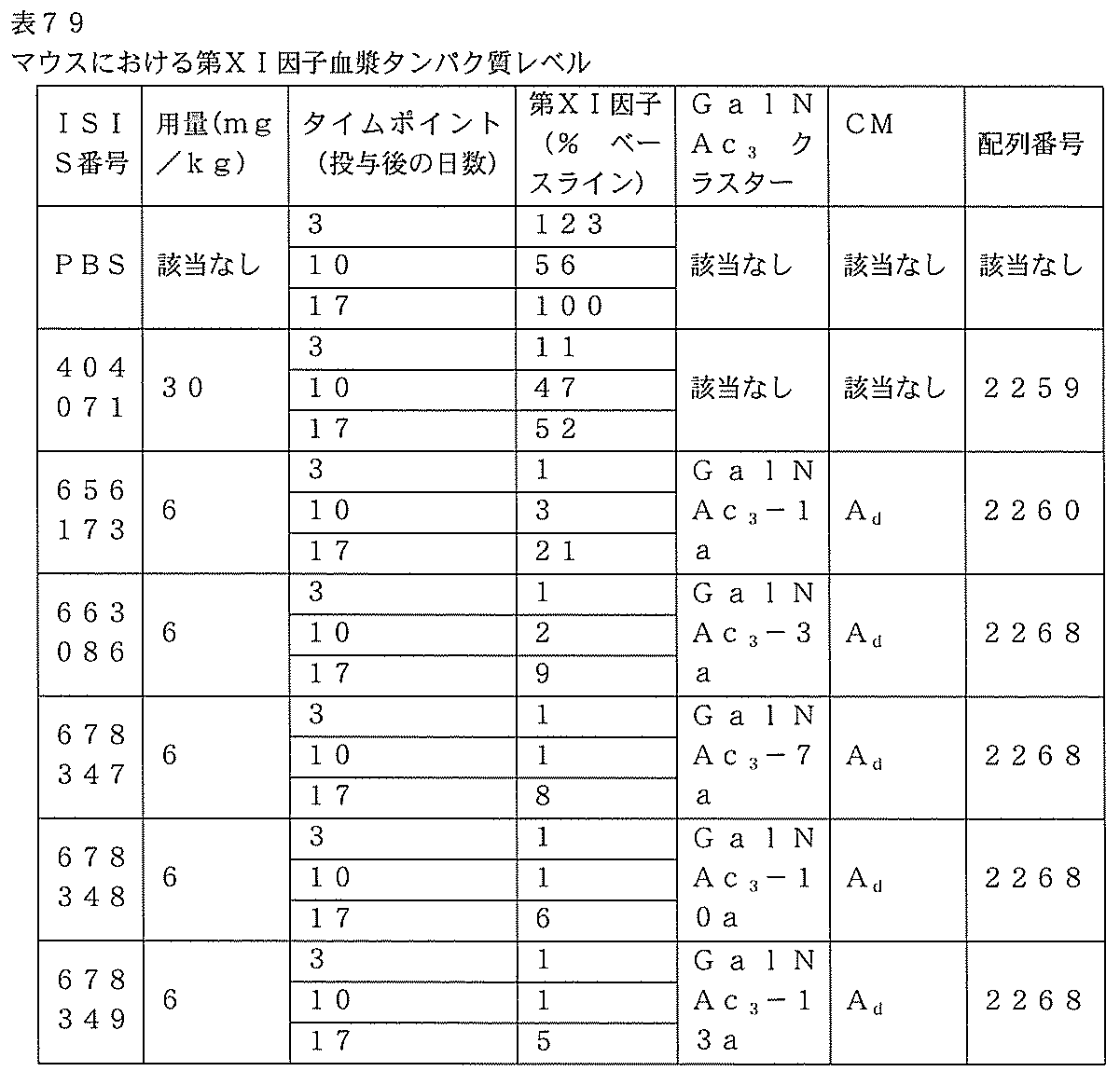
以下の表77に列記されるオリゴヌクレオチドを、マウスにおける第XI因子の用量依存的阻害試験において試験した。
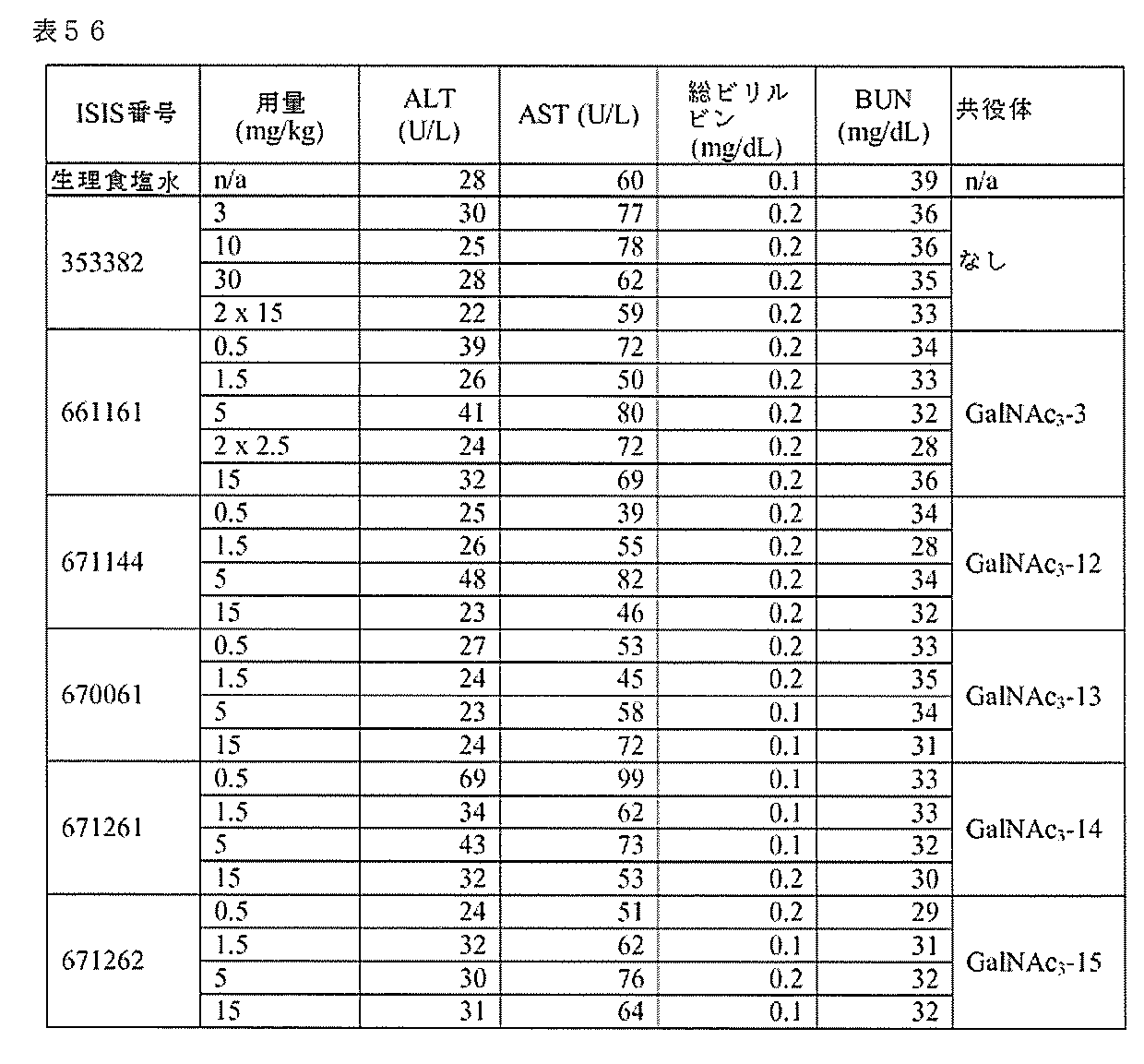
6~8週齢のマウスのそれぞれに、以下に列記されるオリゴヌクレオチドまたはPBSを、以下に示される投与量で週1回、合計3回の投与で、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺した。リアルタイムPCRを用いて肝臓における第XI因子mRNAレベルを測定し、標準のプロトコルに従ってシクロフィリンに対して正規化した。肝臓トランスアミナーゼ、BUN、及びビリルビンも測定した。以下の結果は、PBS対照に対して正規化された各処理群の平均パーセントとして提示される。
表77に列記されるオリゴヌクレオチドを、単回投与試験においてマウスにおける作用持続時間について試験した。
6~8週齢のマウスのそれぞれに、表77に列記されるオリゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、4匹の動物からなった。投薬の前日に尾採血によって血液を採取して、ベースライン、ならびに投与後3、10、及び17日間時点のレベルを決定した。R & D Systems(Minneapolis,MN)の第XI因子捕捉及びビオチン化検出抗体(それぞれ、カタログ番号AF2460及びBAF2460)、ならびにOptEIA試薬セットB(カタログ番号550534、BD Biosciences,San Jose,CA)を用いて、第XI因子血漿タンパク質レベルをELISAによって測定した。以下の結果は、ベースラインレベルに対して正規化された各処理群の第XI因子血漿タンパク質レベルの平均パーセントとして提示される。結果は、GalNAc共役体を含むオリゴヌクレオチドが、GalNAc共役体を欠く親(ISIS 404071)よりも強力であり、より長い作用持続時間を有したことを示す。さらに、5’-GalNAc共役体を含むオリゴヌクレオチド(ISIS 663086、678347、678348、及び678349)は、3’-GalNAc共役体を含むオリゴヌクレオチド(ISIS 656173)よりもさらに強力であり、さらに長い作用持続時間を有した。
表76に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。
6~8週齢のC57BL/6マウスのそれぞれに、表76に列記されるオリゴヌクレオチドまたは生理食塩水を、以下に示される投与量で週1回、合計3回の投与で、皮下注入した。各処理群は、4匹の動物からなった。最終投与の48時間後にマウスを屠殺して、リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、SRB-1 mRNAレベルを決定した。以下の結果は、生理食塩水(対照)に対して正規化された各処理群の肝臓におけるSRB-1 mRNAレベルの平均パーセントとして提示される。
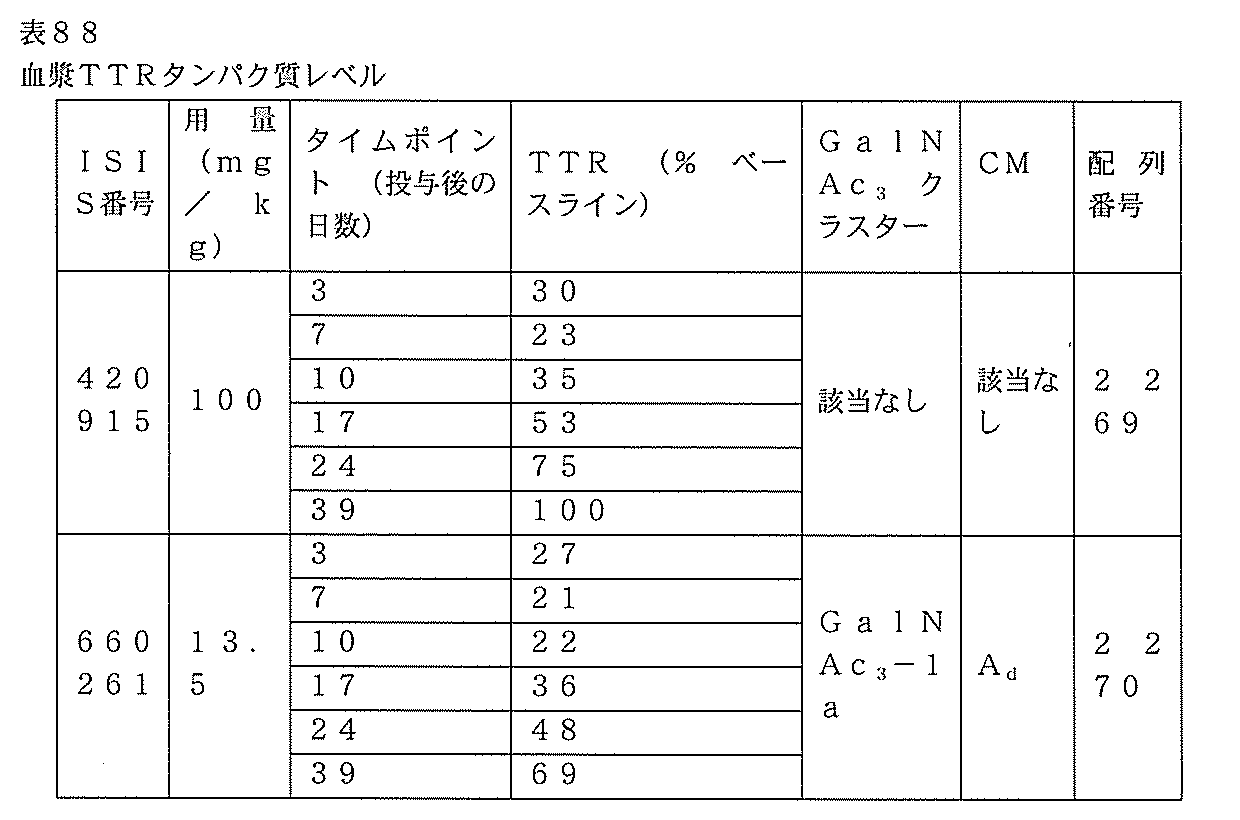
以下の表83に列記されるオリゴヌクレオチドを、用量依存的試験においてヒトTTR遺伝子を発現するトランスジェニックマウスにおけるヒトトランスサイレチン(TTR)のアンチセンス阻害について試験した。
8週齢のTTRトランスジェニックマウスのそれぞれに、以下の表に列記されるオリゴヌクレオチド及び投与量またはPBSを、週1回3週間、合計3回の投与で、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺した。この実験を通してさまざまな時点で尾採血を実行し、血漿TTRタンパク質、ALT、及びASTレベルを測定し、表85~87に報告した。動物を屠殺した後、血漿ALT、AST、及びヒトTTRレベルを測定し、体重、臓器重量、及び肝臓におおけるヒトTTR mRNAレベルも測定した。臨床分析器(AU480、Beckman Coulter,CA)を用いて、TTRタンパク質レベルを測定した。標準のプロトコルに従ってリアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるヒトTTR
mRNAレベルを決定した。表84~87に提示される結果は、各処理群の平均値である。mRNAレベルは、PBS群の平均と比較した平均値である。血漿タンパク質レベルは、ベースラインでのPBS群の平均値と比較した平均値である。体重は、個々の処理群それぞれを屠殺するまでのベースラインからの平均体重変化率である。示される臓器重量は、動物の体重に対して正規化されており、各処理群の平均正規化臓器重量は、PBS群の平均正規化臓器重量との比較で提示される。
ISIS番号420915及び660261(表83を参照のこと)を、単回投与試験においてマウスにおける作用持続時間について試験した。ISIS番号420915、682883、及び682885(表83を参照のこと)も、単回投与試験においてマウスにおける作用持続時間について試験した。
ヒトTTRを発現する8週齢の雄トランスジェニックマウスのそれぞれに、100mg/kgのISIS番号420915または13.5mg/kgのISIS番号660261を1回皮下注入した。各処理群は、4匹の動物からなった。投薬前に尾採血を実行して、ベースライン、ならびに投与後3、7、10、17、24、及び39日目のレベルを決定した。実施例86に記載されるように、血漿TTRタンパク質レベルを測定した。以下の結果は、ベースラインレベルに対して正規化された各処理群の血漿TTRレベルの平均パーセントとして提示される。
ヒトTTRを発現する雌トランスジェニックマウスのそれぞれに、100mg/kgのISIS番号420915、10.0mg/kgのISIS番号682883、または10.0mg/kgの682885を1回皮下注入した。各処理群は、4匹の動物からなった。投薬前に尾採血を実行して、ベースライン、ならびに投与後3、7、10、17、24、及び39日目のレベルを決定した。実施例86に記載されるように、血漿TTRタンパク質レベルを測定した。以下の結果は、ベースラインレベルに対して正規化された各処理群の血漿TTRレベルの平均パーセントとして提示される。
表90に列記されるオリゴヌクレオチドを、マウスにおけるヒト運動ニューロン生存(SMN)のスプライシング調節について試験した。
ヒトSMNを発現する6週齢のトランスジェニックマウスに、表91に列記されるオリゴヌクレオチドまたは生理食塩水を1回皮下注入した。各処理群は、2匹の雄及び2匹の雌からなった。投与の3日後にマウスを屠殺して、標準のプロトコルに従ってリアルタイムPCRを用いて、エクソン7を有する場合とエクソン7を有しない場合の肝臓におけるヒトSMN mRNAレベルを決定した。Ribogreen試薬を用いて総RNAを測定した。SMN mRNAレベルを総mRNAに対して正規化し、さらに生理食塩水処理
群の平均に対して正規化した。結果として生じたエクソン7を含むSMN mRNAとエクソン7を欠くSMN mRNAとの平均比が、表91に示される。結果は、スプライシングを調節し、かつGalNAc共役体を含む完全修飾オリゴヌクレオチドが、GlaNAc共役体を欠く親オリゴヌクレオチドよりも肝臓におけるスプライシングの改変に著しく強力であることを示す。さらに、この傾向は、2’-MOE及びモルホリノ修飾オリゴヌクレオチドを含む複数の修飾化学でも維持される。
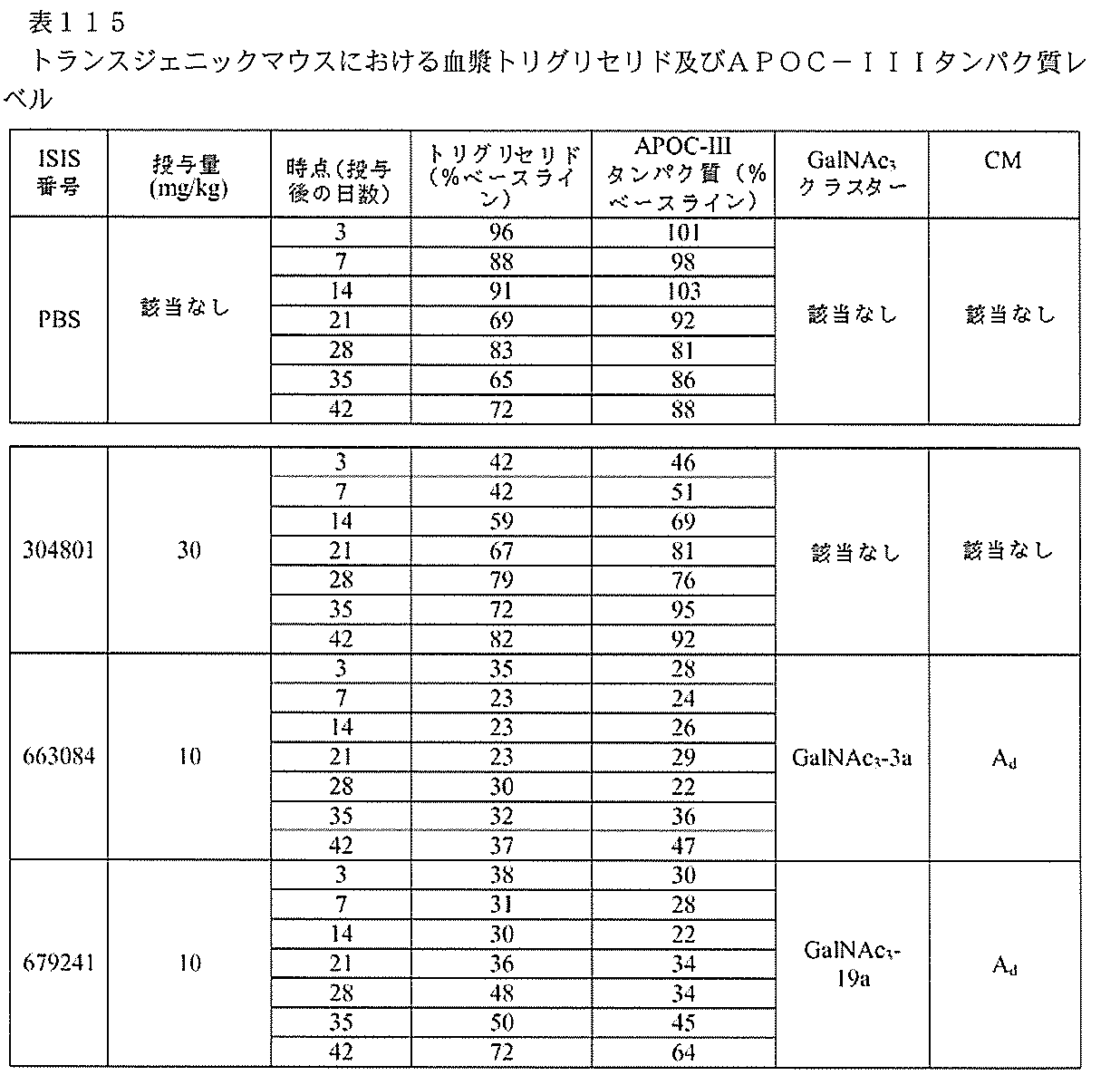
以下の表92に列記されるオリゴヌクレオチドを、トランスジェニックマウスにおけるApo(a)の用量依存的阻害に関する試験で試験した。
8週齢の雌C57BL/6マウス(Jackson Laboratory,Bar Harbor,ME)のそれぞれに、表92に列記されるオリゴヌクレオチドまたはPBSを、以下に示される投与量で週1回、合計6回の投与で、皮下注入した。各処理群は、3~4匹の動物からなった。第1の投与の前日に、かつ各投与後週1回、尾採血を実行して、血漿Apo(a)タンパク質レベルを決定した。最終投与の2日後にマウスを屠殺した。リアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるApo(a)mRNAレベルを決定した。ELISAを用いてApo(a)血漿タンパク質レベルを決定し、肝臓トランスアミナーゼレベルを決定した。表93におけるmRNA及び血漿タンパク質の結果は、PBS処理群と比較した処理群の平均パーセントとして提示される。血漿タンパク質レベルをさらにPBS群のベースライン(BL)値に対して正規化した。平均絶対トランスアミナーゼレベル及び体重(ベースライン平均と比較した%)が表94に報告される。
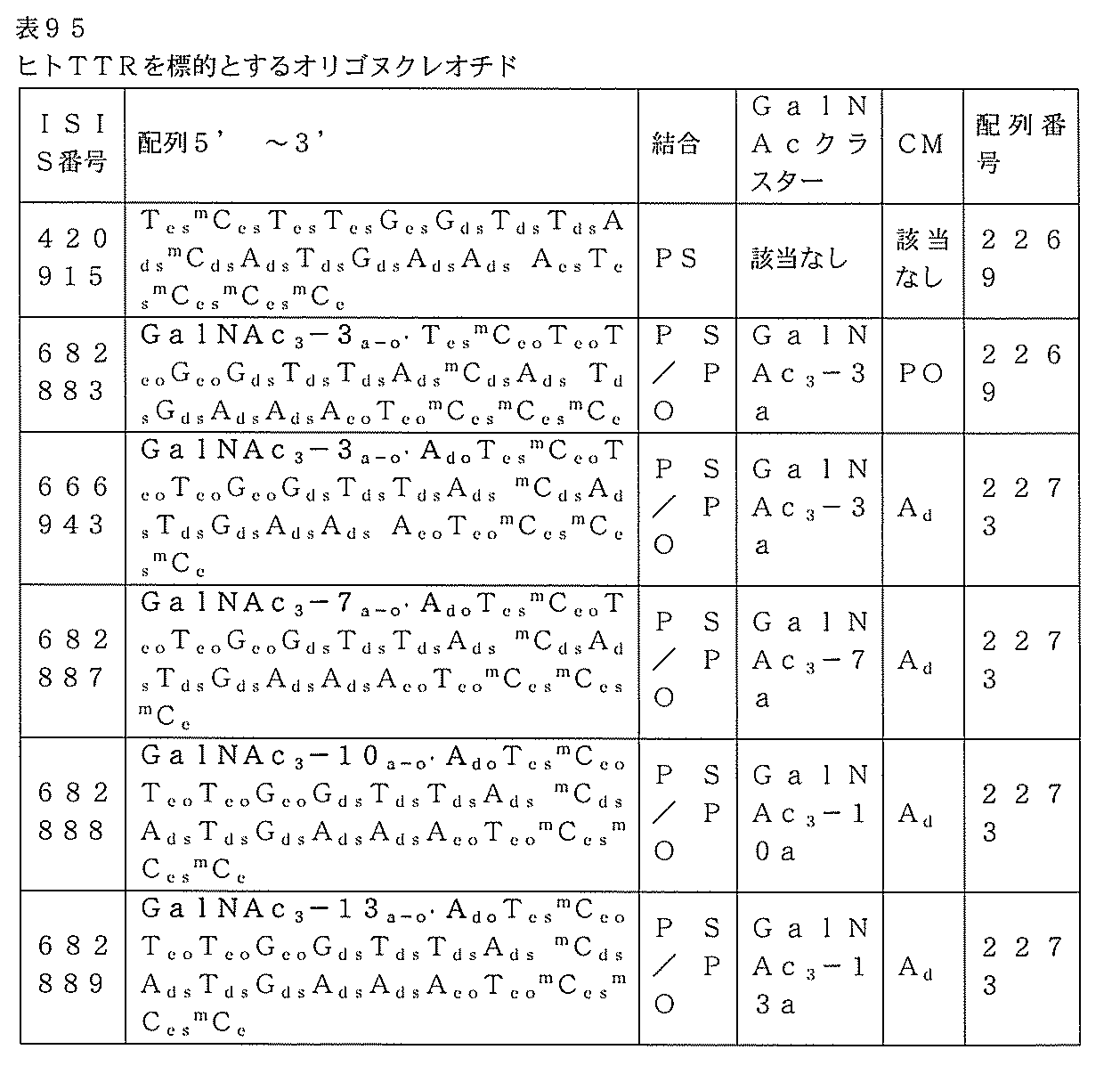
以下の表95に列記されるオリゴヌクレオチドを、用量依存的試験においてヒトTTR遺伝子を発現するトランスジェニックマウスにおけるヒトトランスサイレチン(TTR)のアンチセンス阻害について試験した。
TTRトランスジェニックマウスのそれぞれに、表96に列記されるオリゴヌクレオチ
ド及び投与量またはPBSを、週1回3週間、合計3回の投与で、皮下注入した。各処理群は、4匹の動物からなった。第1の投与の前に、尾採血を実行して、ベースライン(BL)での血漿TTRタンパク質レベルを決定した。最終投与の72時間後にマウスを屠殺した。臨床分析器(AU480、Beckman Coulter,CA)を用いて、TTRタンパク質レベルを測定した。標準のプロトコルに従ってリアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるヒトTTR mRNAレベルを決定した。表96に提示される結果は、各処理群の平均値である。mRNAレベルは、PBS群の平均と比較した平均値である。血漿タンパク質レベルは、ベースラインでのPBS群の平均値と比較した平均値である。「BL」は、第1の投与の直前に測定したベースラインを示す。表96に例証されるように、アンチセンスオリゴヌクレオチドでの処理は、用量依存的様式でTTR発現レベルを低下させた。GalNAc共役体を含むオリゴヌクレオチドは、GalNAc共役体を欠く親(ISIS 420915)よりも強力であり、ホスホジエステルまたはデオキシアデノシンの切断可能部分を含むオリゴヌクレオチドは、共役体を欠く親と比較して、力価の著しい改善を示した(ISIS番号682883及び666943対420915、ならびに実施例86及び87を参照のこと)。
lNAc3-10aの構造は、実施例46に示される。GalNAc3-13aの構造は、実施例62に示される。
以下の表97に列記されるオリゴヌクレオチドを、非終末用量増加試験(non-terminal,dose escalation study)においてサルにおける第VII因子のアンチセンス阻害について試験した。
処置した(non-naive)サルのそれぞれに、増加用量の表97に列記されるオ
リゴヌクレオチドまたはPBSを、0、15、及び29日目に皮下注入した。各処理群は、4匹の雄及び1匹の雌からなった。第1の投与の前とその後のさまざまな時点で、血液採取を実行して、血漿第VII因子タンパク質レベルを決定した。ELISAによって第VII因子タンパク質レベルを測定した。表98に提示される結果は、第1の投与の直前に測定したベースライン(BL)でのPBS群の平均値と比較した各処理群の平均値である。表98に例証されるように、アンチセンスオリゴヌクレオチドでの処理は、用量依存的様式で第VII因子の発現レベルを低下させ、GalNAc共役体を含むオリゴヌクレオチドは、サルにおいてGalNAc共役体を欠くオリゴヌクレオチドよりも著しく強力であった。
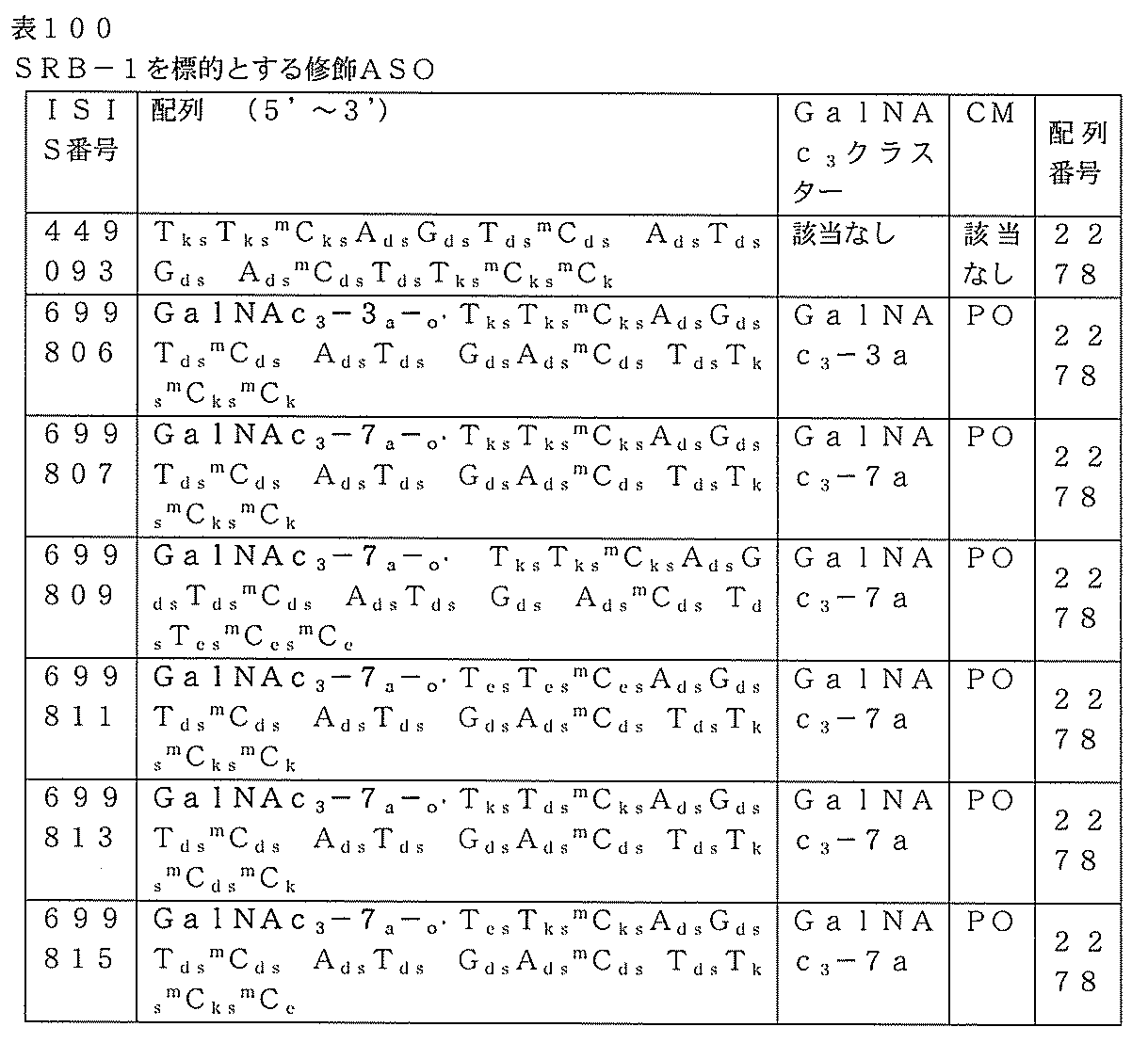
初代マウス肝細胞を15,000細胞/ウェルで96ウェルプレートに播種し、マウスApoC-IIIを標的とする表99に列記されるオリゴヌクレオチドを、0.46、1.37、4.12、または12.35、37.04、111.11、もしくは333.33nMまたは1.00μmで添加した。オリゴヌクレオチドとともに24時間インキュベートした後、細胞を溶解し、RNeasy(Qiagen)を用いて全RNAを精製した。標準のプロトコルに従ってリアルタイムPCR及びRIBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,Inc.)を用いて、ApoC-III mRNAレベルを決定した。Prism 4ソフトウェア(GraphPad)を用いて、IC50値を決定した。結果は、切断可能部分がホスホジエステルであるかホスホジエステル連結デオキシアデノシンであるかにかかわらず、GalNAc共役体を含
むオリゴヌクレオチドが、共役体を欠く親オリゴヌクレオチドよりも著しく強力であったことを示す。
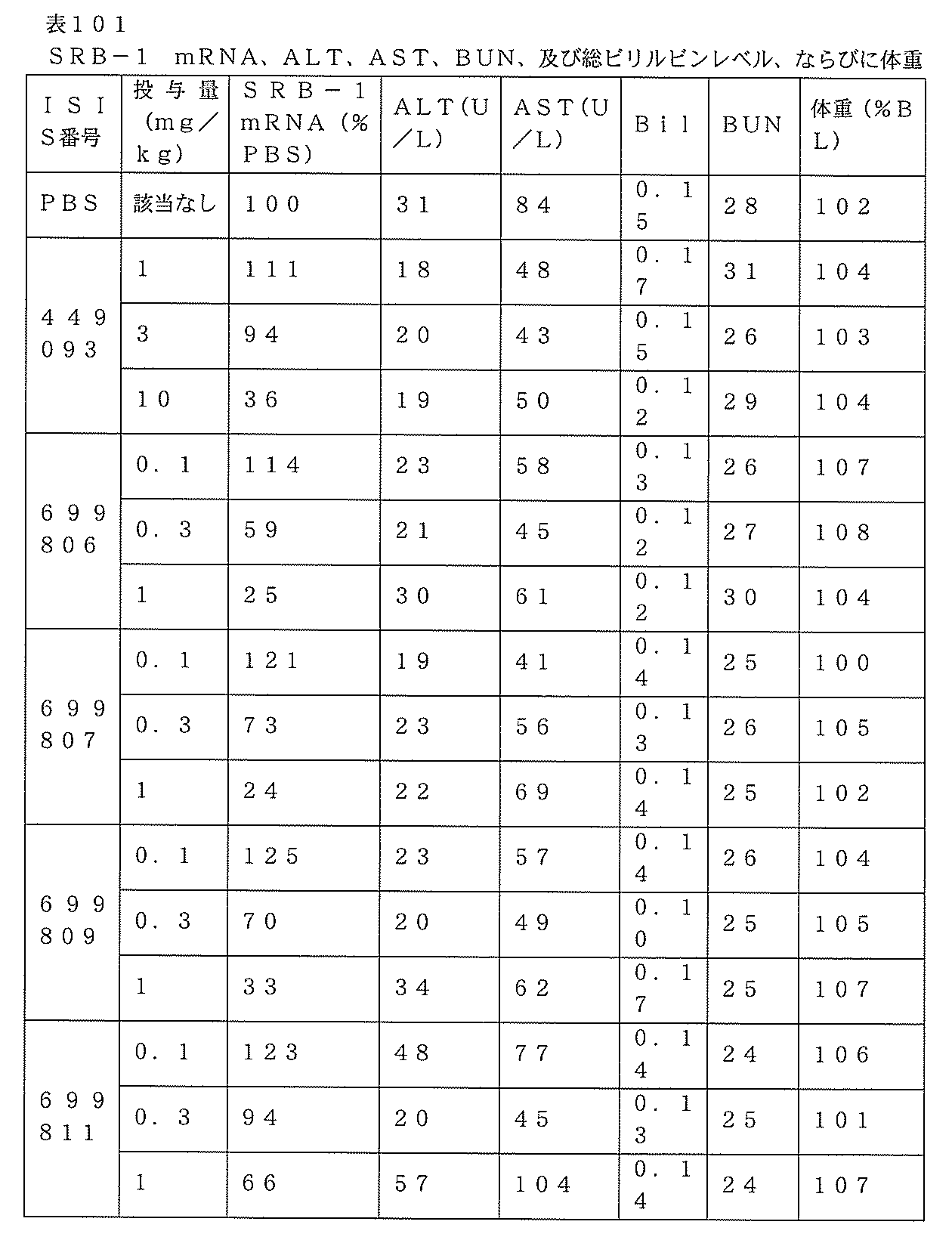
表100に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。
6~8週齢のC57BL/6マウス(Jackson Laboratory,Bar
Harbor,ME)に、表100に列記されるオリゴヌクレオチドまたは生理食塩水を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物からなった。最終投与の72時間後にマウスを屠殺した。リアルタイムPCRを用いて、肝臓におけるSRB-1 mRNAレベルを測定した。標準のプロトコルに従って、SRB-1 mRNAレベルをシクロフィリンmRNAレベルに対して正規化した。結果は、生理食塩水対照群と比較した各処理群のSRB-1 mRNAレベルの平均パーセントとして提示される。表101に例証されるように、アンチセンスオリゴヌクレオチドでの処理は、用量依存的様式でSRB-1 mRNAレベルを低下させ、GalNAc共役体を含み、かつ完全cEtまたは混成糖修飾のいずれかのウイングを有するギャップマーオリゴヌクレオチドは、共役体を欠き、かつ完全cEt修飾ウイングを含む親オリゴヌクレオチドよりも著しく強力であった。
値が表101に示される。体重は、オリゴヌクレオチド投与の直前に測定したベースライン体重(%BL)と比較した平均体重率として示される。
表102に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。
実施例93に記載されるプロトコルを用いて試験を完了した。結果が以下の表103に示され、GalNAc共役体を含む2’-MOE修飾オリゴヌクレオチドと2’-OMe修飾オリゴヌクレオチドとが両方ともに、共役体を欠くそれぞれの親オリゴヌクレオチドよりも著しく強力であったことを示す。体重、肝臓トランスアミナーゼ、総ビリルビン、及びBUNの測定結果は、これらの化合物がすべて良好な耐容性を示したことを示す。
表104に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。
実施例93に記載されるプロトコルを用いて試験を完了した。結果が以下の表105に示され、GalNAc共役体及びさまざまな二環式ヌクレオシド修飾を含むオリゴヌクレオチドが、共役体を欠くが二環式ヌクレオシド修飾を含む親オリゴヌクレオチドよりも著しく強力であったことを示す。さらに、GalNAc共役体及びフルオロ-HNA修飾を含むオリゴヌクレオチドは、共役体を欠くがフルオロ-HNA修飾を含む親よりも著しく強力であった。体重、肝臓トランスアミナーゼ、総ビリルビン、及びBUNの測定結果は、これらの化合物がすべて良好な耐容性であったことを示した。
ApoC-IIIを標的とする表70に列記されるオリゴヌクレオチド及びApo(a)を標的とする表106におけるオリゴヌクレオチドを限外濾過アッセイにおいて試験し
て、血漿タンパク質結合を評価した。
試料の平均濃度を用いて、血漿タンパク質に結合されていない血漿中のオリゴヌクレオチドの割合(%非結合)を決定する。各オリゴヌクレオチドの%非結合を%回収で割ることによって、最終非結合オリゴヌクレオチド値を非特異的結合に対して補正する。最終%非結合値を100から差し引くことによって、最終%結合オリゴヌクレオチド値を決定する。各種の血漿において試験した2つの濃度のオリゴヌクレオチド(5μg/mL及び150μg/mL)の結果が表107に示される。結果は、GalNAc共役基が血漿タンパク質結合に大きな影響を与えないことを示す。さらに、完全PSヌクレオシド間連結部を有するオリゴヌクレオチドも混成PO/PS連結部を有するオリゴヌクレオチドも血漿タンパク質に結合し、完全PS連結部を有するオリゴヌクレオチドは、混合PO/PS連結部を有するオリゴヌクレオチドよりも若干高い程度に血漿タンパク質に結合する。
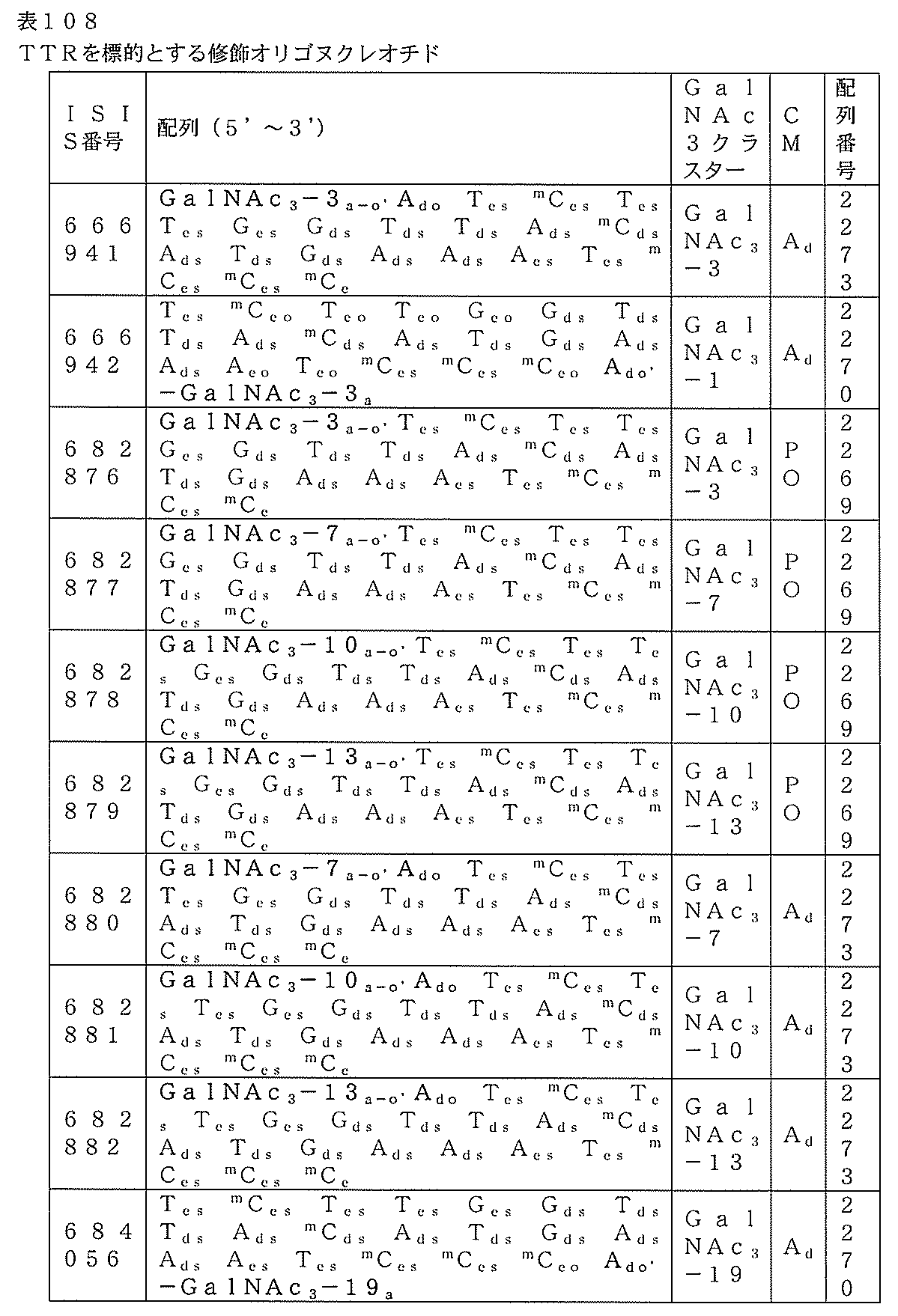
GalNAc共役体を含む表108に示されるオリゴヌクレオチドを、TTRを標的とするように設計した。
表109に列記されるオリゴヌクレオチドを、実施例23及び24に記載されるようにhPMBCアッセイにおいて炎症誘発作用について試験した(オリゴヌクレオチドの説明については、表30、83、95、及び108を参照のこと)。ISIS 353512は、正の対照として用いられる高レスポンダーであり、他のオリゴヌクレオチドは、表83、95、及び108に記載されるものである。1人の志願ドナー由来の血液を用いて表109に示される結果を得た。結果は、混合PO/PSヌクレオシド間連結部を含むオリゴヌクレオチドが、完全PS連結部を有する同一のオリゴヌクレオチドと比較して、著しく低い炎症誘発応答をもたらしたことを示す。さらに、GalNAc共役基は、このアッセイにおいて大きく影響しなかった。
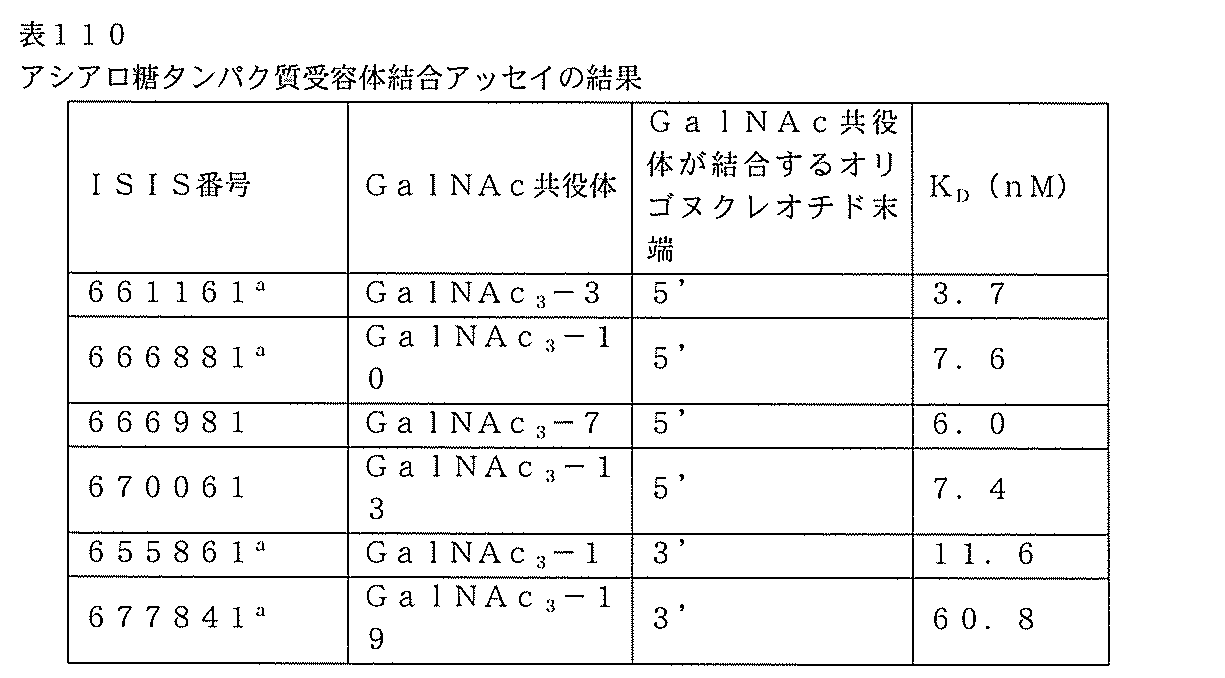
アシアロ糖タンパク質受容体に対する表110に列記されるオリゴヌクレオチド(オリゴヌクレオチドの説明については、表76を参照のこと)の結合親和性を、競合的受容体結合アッセイにおいて試験した。競合相手のリガンドであるα1-酸性糖タンパク質(AGP)を、50mM酢酸ナトリウム緩衝液(pH5)中で1Uノイラミニダーゼ-アガロースとともに37℃で16時間インキュベートし、シアル酸アッセイまたはサイズ排除クロマトグラフィー(SEC)のいずれかで90%を超える脱シアル化を確認した。Atsma et al.(J Lipid Res.1991 Jan;32(1):173-81を参照のこと)の手順に従って、一塩化ヨウ素を用いてAGPをヨウ素化した。この方法において、脱シアル化α1-酸性糖タンパク質(de-AGP)を、10mM塩化ヨウ素、Na125I、及び0.25M NaOH中の1Mグリシンに添加した。室温で10分間インキュベートした後、3KDMWCOスピンカラムを利用してこの混合物を2回濃縮することによって、125I標識de-AGPを遊離125Iから分離した。このタンパク質を、Agilent SEC-3カラム(7.8×300mm)及びβ-RAMカウンタを装備したHPLCシステムにおいて標識効率及び純度について試験した。125I標識de-AGP及びASOを含有するさまざまなGalNAcクラスターを利用した競合実験を以下のとおりに実行した。ヒトHepG2細胞(106細胞/mL)を、2mLの適切な成長培地中の6ウェルプレートにプレーティングした。10%ウシ胎児血清(FBS)、2mM L-グルタミン、及び10mM HEPESを補充したMEM培地を用いた。細胞を、それぞれ、5%及び10%CO2で、37℃で16~20時間インキュベートした。実験前に細胞をFBSを有しない培地で洗浄した。細胞を、2%FBSを有する適切な成長培地を含有する1mLの競合混合物、10-8M 125I標識de-AGP、及び10-11~10-5Mの範囲の濃度のASOを含有するGalNAcクラスターとともに、37℃で30分間インキュベートした。10-2M GalNAc糖の存在下で非特異的結合を決定した。細胞をFBSを有しない培地で2回洗浄して、非結合125I標識de-AGP及び競合相手であるGalNAc ASOを除去した。1%β-メルカプトエタノールを含有するQiagenのRLT緩衝液を用いて、細胞を溶解
した。10分間の短時間凍結/解凍サイクル後に溶解物を丸底アッセイチューブに移し、γ-カウンタでアッセイした。非特異的結合を差し引いた後に、125Iタンパク質カウントを最も低いGalNAc-ASO濃度カウントの値で割った。非線形回帰アルゴリズムを用いた単一部位競合結合等式に従って阻害曲線を当てはめて、結合親和性(KD)を計算した。
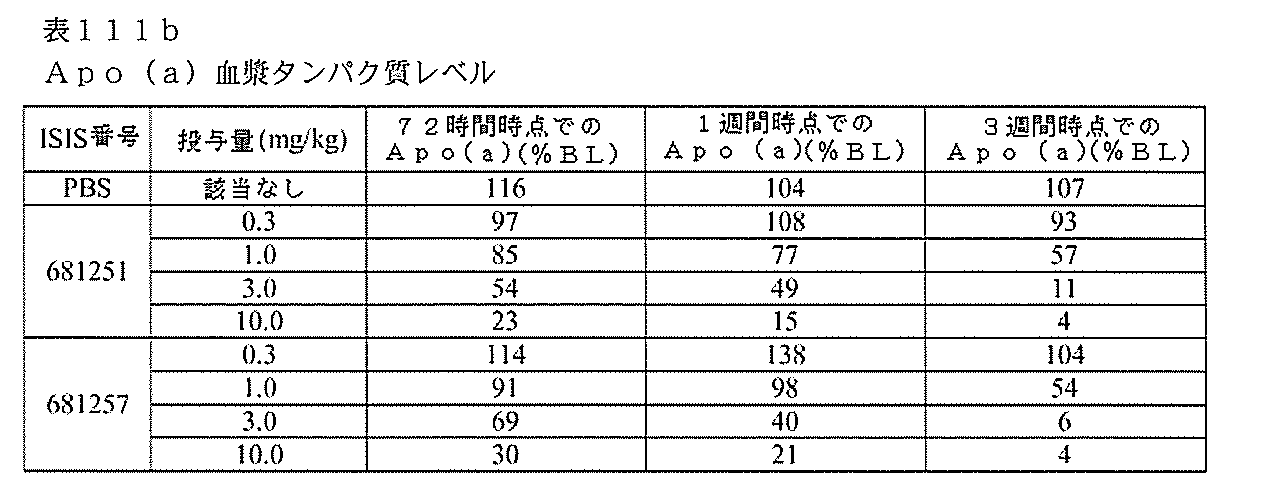
以下の表111aに列記されるオリゴヌクレオチドを、単回投与試験においてマウスにおける作用持続時間について試験した。
ヒトApo(a)を発現する雌トランスジェニックマウスのそれぞれに、表111bに
列記されるオリゴヌクレオチド及び投与量またはPBSを、週1回、合計6回の投与で、皮下注入した。各処理群は、3匹の動物からなった。投薬の前日に血液を採取して、血漿中のApo(a)タンパク質のベースラインレベル、ならびに第1の投与後72時間、1週間、及び2週間時点のレベルを決定した。第1の投与後3週間、4週間、5週間、及び6週間時点でさらに血液を採取する。ELISAを用いて血漿Apo(a)タンパク質レベルを測定した。表111bにおける結果は、ベースラインレベル(%BL)に対して正規化された各処理群の血漿Apo(a)タンパク質レベルの平均パーセントとして提示され、結果は、GalNAc共役基を含むオリゴヌクレオチドがApo(a)発現の強力な減少を示したことを示す。この強力な影響は、完全PSヌクレオシド間連結部を含むオリゴヌクレオチド及び混成PO及びPS連結部を含むオリゴヌクレオチドにおいて観察された。
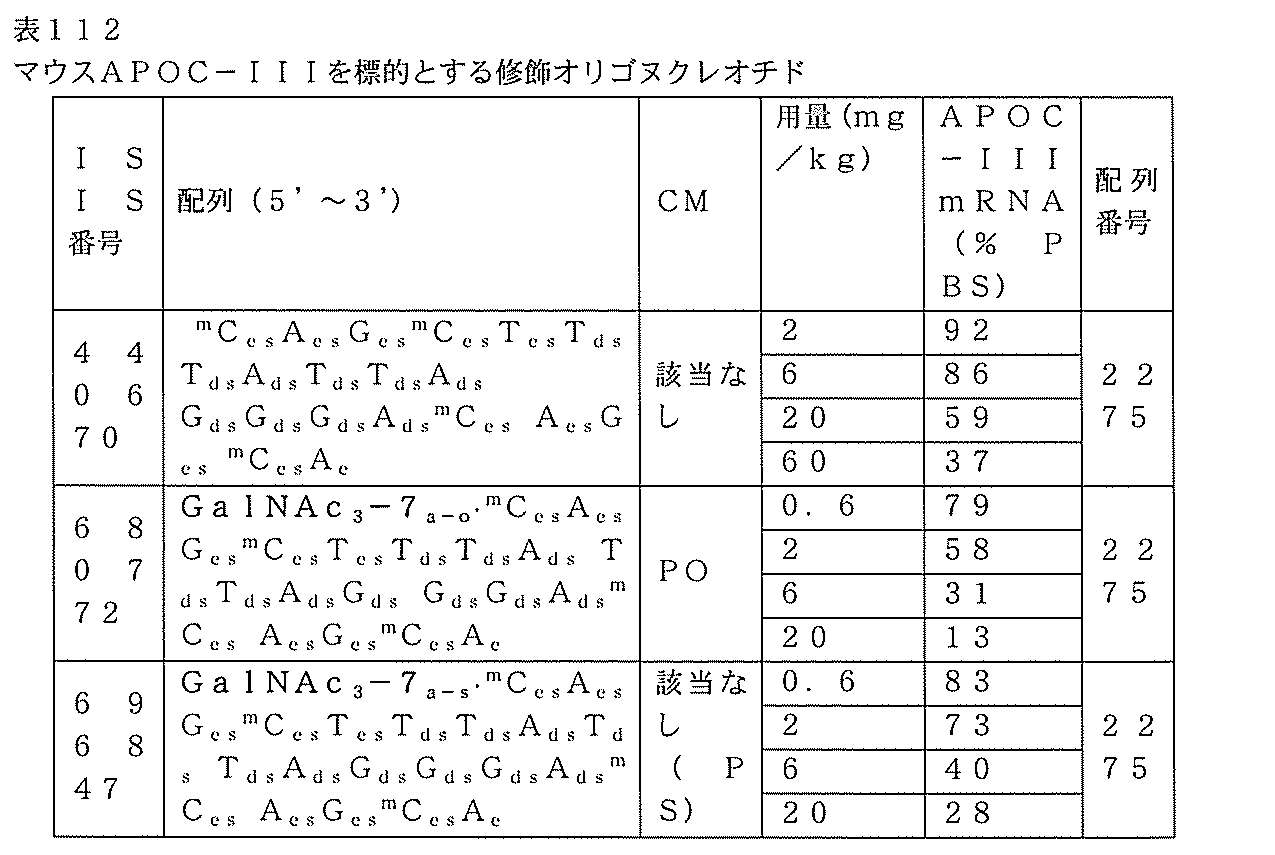
表112に列記されるオリゴヌクレオチドを生体内におけるマウスAPOC-III発現の阻害について試験した。C57Bl/6マウスのそれぞれに、表112に列記されるオリゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、4匹の動物からなった。ISIS 440670で処理した各マウスは、2、6、20、または60mg/kgの投与を受けた。ISIS 680772または696847で処理した各マウスは、0.6、2、6、または20mg/kgを受けた。ISIS 696847のGalNAc共役基は、安定した部分(容易に切断可能なホスホジエステル含有結合の代わりにホスホロチオエート連結部)を介して連結されている。投与の72時間後に動物を屠殺した。リアルタイムPCRを用いて、肝臓におけるAPOC-III mRNAレベルを測定した。標準のプロトコルに従って、APOC-III mRNAレベルをシクロフィリンmRNAレベルに対して正規化した。結果は、生理食塩水対照群と比較した各処理群のAPOC-III mRNAレベルの平均パーセントとして表112に提示される。結果は、GalNAc共役基を含むオリゴヌクレオチドが、共役基を欠くオリゴヌクレオチドよりも著しく強力であったことを示す。さらに、切断可能部分を介してオリゴヌクレオチドに連結されたGalNAc共役基を含むオリゴヌクレオチド(ISIS 680772)は、安定した部分を介してオリゴヌクレオチドに連結されたGalNAc共役基を含むオリゴヌクレオチド(ISIS 696847)よりもさらに強力であった。
GalNAc共役体を含まないISIS 353382(表36を参照のこと)及びGalNAc共役体を含むISIS 655861(表36を参照のこと)の肝臓における分布を評価した。雄balb/cマウスに、ISIS 353382または655861を、表113に列記される投与量で1回、皮下注入した。2匹の動物からなった18mg/kgのISIS 655861群を除いて、各処理群は、3匹の動物からなった。投与の48時間後に動物を屠殺して、オリゴヌクレオチドの肝臓における分布を決定した。1細胞あたりのアンチセンスオリゴヌクレオチド分子の数を測定するために、ルテニウム(II)トリス-ビピリジン標識(MSD TAG、Meso Scale Discovery)を、アンチセンスオリゴヌクレオチドを検出するために用いるオリゴヌクレオチドプローブに共役させた。表113に提示される結果は、1細胞あたり100万オリゴヌクレオチド分子を1単位として表した各処理群のオリゴヌクレオチドの平均濃度である。結果は、等価用量で、GalNAc共役体を含むオリゴヌクレオチドが、全肝臓及び肝細胞において、GalNAc共役体を含まないオリゴヌクレオチドよりも高い濃度で存在したことを示す。さらに、GalNAc共役体を含むオリゴヌクレオチドは、非実質肝臓細胞において、GalNAc共役体を含まないオリゴヌクレオチドよりも低い濃度で存在した。1細胞あたりの肝細胞及び非実質肝臓細胞におけるISIS 655861の濃度が同様であった一方で、肝臓は、約80体積%肝細胞であった。したがって、肝臓内に存在するISIS 655861オリゴヌクレオチドの大部分が肝細胞内に見られる一方で、肝臓内に存在するISIS 353382オリゴヌクレオチドの大部分は、非実質肝臓細胞内に見られた。
以下の表114に列記されるオリゴヌクレオチドを、単回投与試験においてマウスにおける作用持続時間について試験した。
ヒトAPOC-IIIを発現する雌トランスジェニックマウスのそれぞれに、表114に列記されるオリゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、3匹の動物からなった。投薬前に血液を採取して、ベースライン、ならびに投与後3、7、14、21、28、35、及び42日間のレベルを決定した。実施例20に記載されるように、血漿トリグリセリド及びAPOC-IIIタンパク質レベルを測定した。表115における結果は、ベースラインレベルに対して正規化された各処理群の血漿トリグリセリド及
びAPOC-IIIレベルの平均パーセントとして提示される。実施例79の表71における結果と以下の表115における結果の比較は、ホスホジエステルヌクレオシド間連結部及びホスホロチオエートヌクレオシド間連結部の両方を含むオリゴヌクレオチドが、ホスホロチオエートヌクレオシド間連結部のみを含む等価オリゴヌクレオチドよりも増加した作用持続時間を示したことを示す。
チルアミン(0.3mL、1.73mmol)及びPFPTFA(0.30mL、1.73mmol)を添加した。室温で30分間撹拌した後、反応混合物を水(40mL)に注ぎ、EtOAc(2×50mL)で抽出した。上述のように標準の後処理を完了して、化合物234を得た。LCMS及びNMRは、その構造と一致した。実施例46に記載される一般的手順を用いて、オリゴヌクレオチド235を調製した。共役基GalNAc2-24のGalNAc2クラスター部分(GalNAc2-24a)をオリゴヌクレオチド上に存在する任意の切断可能部分と組み合わせて、さまざまな共役基を提供することができる。GalNAc2-24(GalNAc2-24a-CM)の構造は、以下に示される:
表116及び117に列記されるオリゴヌクレオチドを、用量依存的試験においてマウスにおけるSRB-1のアンチセンス阻害について試験した。
処理
以下の表118に列記されるオリゴヌクレオチドを、マウスにおける単回投与試験において試験した。
ヒトApo(a)を発現する雄トランスジェニックマウスのそれぞれに、表119に列記されるオリゴヌクレオチド及び投与量またはPBSを1回皮下注入した。各処理群は、4匹の動物からなった。投薬の前日に血液を採取して、血漿中のApo(a)タンパク質のベースラインレベル及び第1の投与後の1週間時点のレベルを決定した。週1回約8週間、さらに血液を採取する。ELISAを用いて血漿Apo(a)タンパク質レベルを測定した。表119における結果は、ベースラインレベル(%BL)に対して正規化された各処理群の血漿Apo(a)タンパク質レベルの平均パーセントとして提示され、結果は、アンチセンスオリゴヌクレオチドがApo(a)タンパク質の発現を低下させたことを示す。さらに、GalNAc共役基を含むオリゴヌクレオチドは、共役基を含まないオリゴヌクレオチドよりもさらに強力なApo(a)発現の減少を示した。
SRB-1を標的とする表120のオリゴヌクレオチドをGalNAc1共役基で合成して、GalNAcリガンドを含有する共役基を含むオリゴヌクレオチドの力価をさらに試験した。
表121のオリゴヌクレオチドは、ヒトカリクレインB、血漿(フレッチャー因子)1またはプレカリクレイン(PKK)を標的とするように設計した。
アンチセンスオリゴヌクレオチドは、PKKを標的とするように設計し、PKK mRNAに対する効果についてin vitro試験を実施した。HepaRG(商標)細胞は、ヒト肝前駆細胞株由来の分化された肝細胞であり、初代ヒト肝細胞の特性を保持しており(Lubberstedt M. et al., J. Pharmacol. Toxicol. Methods 2011 63: 59-68)、スクリーン中で使用した。
捨てられたGENBANK寄託番号NT_016354.19)のいずれかを標的とする。「該当なし」は、そのアンチセンスオリゴヌクレオチドが当該特定の遺伝子配列を標的としないことを示す。
追加のアンチセンスオリゴヌクレオチドは、PKK核酸を標的とするように設計し、PKK mRNAに対する効果についてin vitro試験を実施した。
ー、4-9-4MOEギャップマー、4-10-4MOEギャップマー、4-10-3MOEギャップマー、3-10-4MOEギャップマー、または3-10-3MOEギャップマーとして設計した。5-10-5MOEギャップマーは、20ヌクレシオド長であり、中央のギャップセグメントは10個の2’-デオキシヌレドで構成され、中央のギャップセグメントは10個の2’-デオキシヌクレオシドで構成され、5’側と3’側にそれぞれ5個のヌクレオシドを含むウイングセグメントが隣接している。4-9-4MOEギャップマーは、17ヌクレシオド長であり、中央のギャップセグメントは9個の2’-デオキシヌレドで構成され、5’側と3’側にそれぞれ4個のヌクレオシドを含むウイングセグメントが隣接している。4-10-4MOEギャップマーは、18ヌクレシオド長であり、中央のギャップセグメントは10個の2’-デオキシヌレドで構成され、5’側と3’側にそれぞれ4個のヌクレオシドを含むウイングセグメントが隣接している。4-10-3MOEギャップマーは、17ヌクレシオド長であり、中央のギャップセグメントは10個の2’-デオキシヌレドで構成され、5’側と3’側にそれぞれ4個と3個のヌクレオシドを含むウイングセグメントが隣接している。3-10-4MOEギャップマーは、17ヌクレシオド長であり、中央のギャップセグメントは10個の2’-デオキシヌレドで構成され、5’側にウイングセグメントが隣接しており、3’側にそれぞれ4個と3個のヌクレオシドを含む。3-10-3MOEギャップマーは、16ヌクレシオド長であり、中央のギャップセグメントは10個の2’-デオキシヌレドで構成され、5’側と3’側にそれぞれ3個のヌクレオシドを含むウイングセグメントが隣接している。5’ウイングセグメント中の各ヌクレオシドと3’ウイングセグメント中の各ヌクレオシドは2’-O-メトキシエチル修飾を有する。ヌクレオシド間連結部は、各ギャップマーの全体を通して、ホスホロチオエート連結部である。シトシン残基は、各ギャップマーの全体を通してすべて、5-メチルシトシンである。「開始部位」とは、ヒト遺伝子配列中で当該ギャップマーの標的になる最も5’側のヌクレオシドを示す。「終止部位」とは、ヒト遺伝子配列中で当該ギャップマーの標的になる最も3’側のヌクレオシドを示す。以下の表に示す各ギャップマーは、配列番号1または配列10のいずれかを標的とする。「該当なし」は、そのアンチセンスオリゴヌクレオチドが当該特定の遺伝子配列を標的としないことを示す。
追加のアンチセンスオリゴヌクレオチドは、PKK核酸を標的にするように設計し、PKK mRNAに対する効果についてin vitro試験を行った。
PKK mRNAの有意なin vitro阻害を表す上記の試験からギャップマーを選択し、HepaRG(商標)細胞中で、様々な用量で試験を行った。ウェルあたり20,000個の細胞密度で細胞を播種し、0.12μM、0.37μM、1.11μM、3.33μM及び10.00μMの濃度のアンチセンスオリゴヌクレオチドを、エレクトロポレーションを用いてトランスフェクトした。約16時間処理を行った後、RNAを細胞から単離し、PKK mRNAレベルを定量的リアルタイムPCRで測定した。ヒトPKKプライマープローブセットRTS3454を使用して、mRNAレベルを測定した。PKK mRNAレベルをRIBOGREEN(登録商標)によって測定したときの総RNA含量に従って調整した。同様の培養条件を有する一連の実験で、アンチセンスオリゴヌクレオチドの試験を行った。各実験の結果は、以下に示す別個の表に表す。結果は、未処理の対照細胞に対するPKKの阻害率(%)として表す。
PKK mRNAの有意なin vitro阻害を表す上記の試験からギャップマーを選択し、HepaRG(商標)細胞中で、様々な用量で試験を行った。ウェルあたり20,000個の細胞密度で細胞を播種し、0.19μM、0.56μM、1.67μM、及び5.00μMの濃度のアンチセンスオリゴヌクレオチドを、エレクトロポレーションを用いてトランスフェクトした。約16時間処理を行った後、RNAを細胞から単離し、PKK mRNAレベルを定量的リアルタイムPCRで測定した。ヒトPKKプライマープローブセットRTS3454を使用して、mRNAレベルを測定した。PKK mRNAレベルをRIBOGREEN(登録商標)によって測定したときの総RNA含量に従って調整した。同様の培養条件を有する一連の実験で、アンチセンスオリゴヌクレオチドの試験を行った。各実験の結果は、以下に示す別個の表に表す。結果は、未処理の対照細胞に対するPKKの阻害率(%)として表す。「該当なし」は、特定の用量の特定のアンチセンスオリゴヌクレオチドについて、測定を実施しなかったことを示す。
PKK mRNAの有意なin vitro阻害を表す上記の試験のギャップマーを選択し、HepaRG(商標)細胞中で様々な用量で試験を行った。ウェルあたり20,000個の細胞密度で細胞を播種し、0.11μM、0.33μM、1.00μM、及び3.00μMの濃度のアンチセンスオリゴヌクレオチドを、エレクトロポレーションを用いてトランスフェクトした。約16時間処理を行った後、RNAを細胞から単離し、PKK
mRNAレベルを定量的リアルタイムPCRで測定した。ヒトPKKプライマープローブセットRTS3454を使用して、mRNAレベルを測定した。PKK mRNAレベルを、RIBOGREEN(登録商標)によって測定したときの総RNA含量に従って調整した。同様の培養条件を有する一連の実験でアンチセンスオリゴヌクレオチドの試験を行った。各実験の結果は、以下に示す別個の表に表す。結果は、未処理の対照細胞に対するPKKの阻害率(%)として表す。「該当なし」は、特定の用量の特定のアンチセンスオリゴヌクレオチドについて、測定を実施しなかったことを示す。
ヒトKLKB1遺伝子配列の37,390塩基対フラグメント(染色体4:位置187148672-187179625、寄託番号:NC_000004.11)を含むトランスジェニックマウスは、上述の試験から選択したISISアンチセンスオリゴヌクレオチドで処置を行い、このモデルにおける有効性を評価した。
トランスジェニックマウスの群に、ISIS 546232、ISIS 546251、ISIS 546254、ISIS 546343、ISIS 546828、ISIS 547455、ISIS 547457、ISIS 547927、及びISIS 548048を、2.5mg/kg/週、5.0mg/kg/週、10mg/kg/週または20mg/kg/週で、3週間週に2回、皮下注射した。トランスジェニックマウスの1つの群には、PBSを3週間皮下注射した。最後の投与から48時間後にマウスを安楽死させ、次の分析のために臓器及び血漿を採取した。
ISISオリゴヌクレオチドの標的の減少への効果を評価するために、ヒトPKKのリアルタイムPCR分析のために、RNAを肝組織から抽出した。結果は、PBS対照に対するPKK mRNAの阻害率(%)として表す。表169に示すように、ISISアンチセンスオリゴヌクレオチドによる処理は、PBS対照に比べ、PKK mRNAが有意に減少した。
すべての群で血漿PKKタンパク質レベルを評価した。結果は、PBS対照に対するPKKタンパク質の阻害率(%)として表す。表170に示すように、ISISアンチセン
スオリゴヌクレオチドによる処理は、PBS対照に比べて、PKKタンパク質レベルが有意に減少した。
上述の試験から選択したISISアンチセンスオリゴヌクレオチドで、カニクイザルに処置を行った。アンチセンスオリゴヌクレオチドの有効性と耐容性を評価した。試験対象のヒトアンチセンスオリゴヌクレオチドは、アカゲザルのゲノム配列(ヌクレオチド2358000~2391000を切り捨てられ、配列番号18として本明細書で示されたGENBANK寄託番号NW_001118167.1)と交差反応性であった。配列番号18に対する各オリゴヌクレオチドの標的開始部位を、表171に表す。「ミスマッチ」は、オリゴヌクレオチドがアカゲザルの配列とミスマッチするヌクレオチドの数を示している。ヒトオリゴヌクレオチドとアカゲザルの配列との間の相補性が大きいほど、ヒトオリゴヌクレオチドがアカゲザルの配列と交差反応する可能性が大きい。「該当なし」は、オリゴヌクレオチドが、アカゲザルの配列と3つより多いミスマッチがあることを示している。
試験を実施する前に、サルを30日間隔離し、その間に健康全般を毎日観察した。サルは2~4歳で、体重は2~4kgであった。4匹のランダムに割り付けられた雄のカニクイザルの10の群に、ISISオリゴヌクレオチドまたはPBSを皮下注射した。試験の第1週に4つの用量からなる投与計画(loading regimen)(1、3、5、7日目)で、40mg/kgの用量のPBS溶液またはISISオリゴヌクレオチドを最初に投与し、次に14日目(2~13週)に、週に1回の維持投与計画(maintenance regimen)を開始した。背中の4部位に時計回りに、1用量につき1部位、皮下注射を行った。注射部位は、ケタミンで鎮静させながら、いれずみで印をつけ、最小3cmの間隔を置いた。
RNA分析
87または88日目、最後の投与から48時間後に、プライマープローブセットRTS3455(配列番号23として本明細書で設計した順方向配列CCTGTGTGGAGGGTCACTCA、配列番号24として本明細書で設計した逆方向配列CCACTATAGATGCGCCAAACATC、配列番号25として本明細書で設計したプローブ配列CCCACTGCTTTGATGGGCTTCCC)を使用して、PKKのリアルタイムPCR分析のために、RNAを肝組織から抽出した。得られたものはハウスキーピング遺伝子シクロフィリンに正規化した。結果をPBS対照に対するPKK mRNAの阻害率(%)として表す。表172に示すように、ISISアンチセンスオリゴヌクレオチドでの処置によって、PBS対照に比べて、PKK mRNAが有意に減少した。
約0.9mLの血液を、投与前、17日目、31日目、45日目、59日目、73日目の各時間に、すべての対象動物から採取し、3.2%のクエン酸ナトリウムを含む管に置いた。管を遠心分離(室温で10分間3000回転)にかけ、血漿を得た。血漿中のPKKタンパク質レベルをELISAによって測定した。結果は表173に表し、PBS対照レベルと比較した阻害率(%)として表した。結果は、ISISアンチセンスオリゴヌクレオチドがPKKタンパク質レベルを有意に減少させたことを示す。
肝機能
ISISオリゴヌクレオチドの肝機能への影響を評価するために、サルを一晩絶食にした。約1.5mLの血液試料を全試験群から採取した。血液は、血漿を分離するために抗凝固剤のない管に集めた。管を最短90分間室温に保管し、その後10分間、3,000回転で遠心分離にかけた。様々な肝機能マーカーのレベルをToshiba 120FR
NEO化学分析器(Toshiba Co., Japan)を用いて測定した。結果は表174に表し、アンチセンスオリゴヌクレオチドは、アンチセンスオリゴヌクレオチドの予測の範囲を超えて、肝機能に影響することはなかった。
カニクイザルの体内のISISオリゴヌクレオチドが血液学的数値に及ぼす影響を評価するために、約1.2mLの血液試料を、投与前、87日目または88日目に、試験対象の動物それぞれから採取し、K2-EDTAを含む管に保管した。試料は、赤血球細胞(RBC)数、白血球細胞(WBC)数、血小板数、ヘモグロビン含有量、ヘマトクリットについて、ADVIA2120i血液学的検査器(SIEMENS、USA)を用いて分析した。分析データを表175に表す。
ISISオリゴヌクレオチドの腎機能に及ぼす影響を評価するために、サルを一晩絶食にした。約1.5mLの血液試料を全試験群から採取した。血液は、血漿を分離するために、抗凝固剤のない管に集めた。管を最短90分間室温に保管し、10分間、3,000回転の遠心分離にかけた。Toshiba 120FR NEO化学分析器(Toshiba Co., Japan)を使用して、BUNとクレアチニンのレベルを測定した。結果はmg/dLの単位で表176に表した。血漿の化学データによると、ISISオリゴヌクレオチドの大部分が、アンチセンスオリゴヌクレオチドの予測の範囲を超えて、腎機能に影響を及ぼさなかった。特に、ISIS 546254による処理は、サルの腎機能に関して良好な耐容性であった。
カニクイザルのISISオリゴヌクレオチドの炎症効果を評価するために、サルを一晩絶食にした。約1.5mLの血液試料を全試験群から採取した。血液は、血漿を分離するために抗凝固剤のない管に集めた。管を最短90分間室温に保管し、10分間、3,000回転で遠心分離にかけた。C反応性タンパク質(CRP)は、肝臓で合成され、炎症のマーカーとして使用され、Toshiba 120FR NEO化学分析器(Toshiba Co., Japan)を使用して測定した。相補的C3も同様に測定し、データはベースライン値の割合として表す。結果は表178に表し、ISISオリゴヌクレオチドによる処理が、サルに炎症を引き起こさなかったことを示している。
マウスPKK核酸を標的とするアンチセンスオリゴヌクレオチドを設計し、PKK mRNAに及ぼす効果についてin vitro試験を行った。ウェルあたり10,000細胞の密度で培養されたマウスの初代培養肝細胞に、サイトフェクチン試薬を使用して、12.5nM、25.0nM、50.0nM、100.0nM、及び200.0nMのアンチセンスオリゴヌクレオチドをトランスフェクトした。約24時間の処理を行った後、RNAを細胞から単離し、マウスPKK mRNAレベルを、マウスプライマープローブセットRTS3313(配列番号2228として本明細書で設計した順方向配列TGCCTGCTGTTCAGCTTTCTC、配列番号2229として本明細書で設計した逆方向配列TGGCAAAGTCCCTGTAATGCT、配列番号2230として本明細書で設計したプローブ配列CGTGACTCCACCCAAAGAGACAAATAAACG)を用いて、定量的リアルタイムPCRによって測定した。PKK mRNAレベルは、RIBOGREENによって測定したときのRNA総含量に従って調整した。
少したことを示している。
PKK mRNAに対するISIS 482584の効果について、in vivo試験を行った。
雄BALB/cマウスの6つの群を、2.5mg/kg、5.0mg/kg、10.0mg/kg、20.0mg/kg、40.0mg/kg、または80.0mg/kgのISIS 482584を、3週間にわたって週に2回(週の用量は5.0mg/kg、10.0mg/kg、20.0mg/kg、40.0mg/kg、80.0mg/kg、または160.0mg/kg)、皮下投与をして処置した。BALB/cマウスの対照群を、PBSを3週間にわたって週に2回皮下投与して処置した。アンチセンスオリゴヌクレオチドまたはPBSの最後の投与から2日後に、10mg/kgのキシラジンで混合した150mg/kgのケタミンを腹腔内注射することによって、全群のマウスに麻酔をかけた。肝臓をRNA分析のために回収した。
PKKのリアルタイムPCRを実施するために肝臓組織からRNAを抽出した。PKK
mRNAレベルは、マウスプライマープローブセットを使用して測定した(配列番号2231として本明細書で設計した順方向配列ACAAGTGCATTTTACAGACCAGAGTAC、配列番号2232として本明細書で設計した逆方向配列GGTTGTCCGCTGACTTTATGCT、配列番号2233として本明細書で設計したプローブ配列AAGCACAGTGCAAGCGGAACACCC)。結果はPBS対照に対するPKKの阻害率(%)として表す。表180に示すように、ISIS 482584による処置は、PBS対照に比べ、PKK mRNAを用量依存的に有意に減少させた。
抗凝固剤としてクエン酸ナトリウムを含む管に血漿を集めた。試料は、4~12%勾配SDS-ポリアクリルアミドゲル(Invitrogen)で実行し、次にマウスPKK抗体(R&D Systems)による免疫ブロット法を実行した。ブロットを二次的フルオロフォア標識抗体(LI-COR)でインキュベートし、Odyssey Imager (LI-COR)に撮像した。結果は、PBS対照に対するPKKの阻害率(%)として表す。表181に示すように、ISIS 482584の処置は、PBS対照に比べ、PKK血漿タンパク質を用量依存的に有意に減少させた。
遺伝性血管浮腫(HAE)は、局所的膨張及び皮下組織中の血管透過性の増加を特徴とする(Morgan, B.P. N. Engl. J. Med. 363: 581-83, 2010)。補体系のタンパク質であるC1阻害因子の欠損によって引き起こされる。C1-INH欠損の確立されたマウスモデルとCaptopril誘導性浮腫(両者ともHAEの特徴である血管透過性を引き起こす)の2つのマウスモデルを本試験に使用した。血管透過性の回復は、高分子キニノゲン(HMWK)の血漿レベルの増加を伴う。
このアッセイについての様々な処置群を表182に表す。
足、結腸、耳及び腸から採取した組織は、別個にホルムアミドに一晩おき、エバンスブルーを浸出した。耳及び足の組織を含むホルムアミド溶液を55℃に加熱し、一晩放置した。染液が浸透したホルムアミド溶液の色彩強度は、OD600nmで測定し、表183に表す。浮腫を表しているマウスにはより多くの染液を取り込み、高いOD値を示している。
ゴニスト、HOE140で処置されたマウスに見られた血管透過性と同等であった。
血液試料からのHMWKのウエスタンブロット法を、図1に表す。
基礎の透過性は、ナイーブ、未処置のマウスに起こる血管透過性のレベルである。基礎またはCaptopril誘発性のいずれかの血管透過性の予防におけるISIS 482584の効果を評価した。
処置
処置した。処置期間の最後に、30μgのHOE-140を腹腔内投与した。群3は基礎の血管透過性の阻害についての陽性対照とした。
足、結腸、腸及び耳から採取した組織は、別個にホルムアミドに一晩おき、エバンスブルーを浸出した。足及び耳の組織を含むホルムアミド溶液を55℃に加熱し、一晩放置した。染液が浸透したホルムアミド溶液の色彩強度は、OD600nmで測定し、表185に表す。浮腫を表しているマウスには染液をより多く取り込み、高いOD値を示している。
E-140での処理(陽性対照とした群4)によって生じたものと同等であった。
ISIS 482584の用量を変化させたときのCaptopril誘発性血管透過性に与える効果を評価した。
このアッセイの様々な処置群は、表186に表す。
採取した組織は、別個にホルムアミド溶液に一晩おき、エバンスブルーを浸出した。足及び耳の組織を含むホルムアミド溶液を55℃に加熱し、一晩放置した。染液が浸透したホルムアミド溶液の色彩強度は、OD600nmで測定し、表187に表す。浮腫を表しているマウスは染液をよりおおく取り込み、高いOD値を示している。
心臓穿刺によって採取された血液は、すぐに、氷冷した3倍体積のエタノールと混合した。溶液を4℃で20分間、15,000gの遠心分離にかけ、細胞片と沈殿した血漿タンパク質を取り除いた。10kDaのMWCOフィルターによる限外濾過によってエタノール抽出物をさらに精製した。エタノール抽出血漿溶液の色彩強度を、OD620nmで測定した。結果は、PBS対照群1のOD値に対する増加率または減少率として、表188に表す。浮腫を発現しているマウスの組織は、血漿からより多くの染液を漏出しており、そのため、血管漏出の減少により、高いODを示す処置群に対し、ODが低いことが予想された。160mg/kg/週及び80mg/kg/週のISIS 482584を投与されたマウス(群4及び5)は、Captoprilを投与されたPBS陰性対照(群2)に比べ、血管漏出が低かった。群4及び5の結果は、HOE-140を投与された陽性群(群3)と同等であった。
ISIS 482584の用量を変化させたときの血管透過性に及ぼす効果を評価した。
このアッセイの様々な処置群は、表189に表す。
足、結腸及び耳から採取した組織は、別個にホルムアミドに一晩おき、エバンスブルーを浸出した。足及び耳の組織を含むホルムアミド溶液を55℃に加熱し、一晩放置した。染液が浸透したホルムアミド溶液の色彩強度は、OD600nmで測定し、表190に表す。高いOD値は高い透過性と関連している。
心臓穿刺によって採取された血液は、すぐに、氷冷した3倍体積のエタノールと混合した。溶液は4℃で20分間、15,000gで遠心分離にかけ、細胞片と沈殿した血漿タンパク質を取り除いた。エタノール抽出物は、10kDaのMWCOフィルターによる限外濾過によってさらに精製した。エタノール抽出血漿溶液の色彩強度は、OD620nmで測定した。結果は、群1PBS対照のOD値に対する増加率または減少率として表191に表す。処置群は、血管漏出の減少により高いOD値を表しうることが予想された。ISISオリゴヌクレオチド処置群のすべてのマウスが、PBS陰性対照に比べ、有意に血管漏出が減少した。
血液試料からのHMWKのウエスタンブロット法を、図2及び表192及び193に示す。
Captopril誘発性血管透過性モデルにおいて、ISIS 410944、因子12を標的とする5-10-5MOEギャップマー(GCATGGGACAGAGATGGTGC;配列番号2247)であるISIS 482584の用量を変化させてマウスに処置を行った。
このアッセイの様々な処置群は、表194に表す。
足、結腸、及び耳から採取した組織は、ホルムアミドに一晩おき、エバンスブルーに浸
出した。足及び耳の組織を含むホルムアミド溶液を55℃に加熱し、一晩放置した。染液が浸透したホルムアミド溶液の色彩強度は、OD600nmで測定し、表195に表す。より高いOD値は、より高い透過性レベルに関連している。
基礎血管透過性において、ISIS 410944、因子12を標的とするアンチセンスオリゴヌクレオチド、ISIS 482584の用量を変化させてマウスに処置を行った。
このアッセイの様々な処置群は、表196に表す。
た。群1には他のいかなる治療薬も投与せず、血管透過性の基礎レベルを測定するための対照群とした。
足、結腸、腸及び耳から採取した組織は、ホルムアミドに一晩おき、エバンスブルーを浸出した。足及び耳の組織を含むホルムアミド溶液を55℃に加熱し、一晩放置した。染液が浸透したホルムアミド溶液の色彩強度は、OD600nmで測定し、表197に表す。より高いOD値は、より高い透過性レベルに関連している。
せで処置されたマウスの大部分の組織は、全ての用量(群2~7)で、PBS対照(群1)に比べ、血管透過性が減少した。ISISオリゴヌクレオチド処置群の血管透過性の減少は、HOE140で処置された陽性対照(群2)で示された血管透過性の減少と同等であった。PKKと因子12アンチセンスオリゴヌクレオチドの組み合わせでは、透過性が相乗的に減少した。予想したように、血管漏出の対応する相乗的な減少も観察した。
PKK mRNAのアンチセンス阻害の因子12タンパク質活性化への影響を評価した。
このアッセイの様々な処理群は、表198に表す。
96ウェルのポリプロピレンマイクロプレート中の85μLのPBSおよび1μg/mlのデキストラン硫酸(500kDa)に、血漿(5μL)を添加し、溶液を室温で5分間インキュベートした。Spectrozyme(登録商標)FXIIa(10μLの2mM溶液)と0.2mMのKALLISTOP(商標)溶液を添加し、吸光速度(absorbance kinetic)を405nmで測定した。因子12の活性化は、吸光度蓄積(absorbance accumulation)の線形位相で測定した。結果は、PBS対照試料で測定された因子12の活性化の割合として、表199に表す。表199に見られるように、ISIS 482584によるPKKの阻害は、基質による因子12の活性化の減少をもたらし、このことはPKKが、適切な因子12の活性化に必要であることを示唆している。
マウスC1阻害因子mRNAを標的とするアンチセンスオリゴヌクレオチドであるISIS 461756によって誘発される血管透過性は、マウスの血管透過性を増加させ、
遺伝性血管浮腫の病理を再現する。このモデルへのISIS 482584の効果を評価した。
8匹のマウスから成る一群は、40mg/kgのISIS 482584を、3週間にわたって週に2回(週の用量は80mg/kg)、投与した。8匹のマウスから成る第二の群は、40mg/kgの対照オリゴヌクレオチド、ISIS 141923で、3週間にわたって週に2回(週の用量は80mg/kg)皮下投与して処置した。8匹のマウスから成る第三の群3は、PBSを3週間にわたって週に2回投与することによって処置した。14日目に、全群に12.5mg/kgのISIS 461756を3週間にわたって週に2回(週の用量は25mg/kg)を投与した。マウスの対照群は、PBSを3週間にわたって週に2回投与したが、ISIS 461756は投与しなかった。
RNAは、C1-INH及びPKK mRNAのRT-PCR分析のために、肝臓から単離した。C1-INHのためのプライマープローブセットは、RTS3218(配列番号2234として本明細書で指定した順方向配列GAGTCCCCCAGAGCCTACAGT、配列番号2235として本明細書で指定した逆方向配列TGTCATTTGTTATTGTGATGGCTACA、配列番号2236として本明細書で設計したプローブ配列CTGCCCTCTACCTGGCCAACAACCA)である。PKKのためのプライマープローブセットは、RTS3287(配列番号2237として指定した順方向配列ACAAGTGCATTTTACAGACCAGAGTAC、配列番号2238として設計した逆方向配列GGTTGTCCGCTGACTTTATGCT、配列番号2239として指定したプローブ配列AAGCACAGTGCAAGCGGAACACCC)である。結果は、ISIS 461756で処置をしていないPBS対照と比較したときの阻害率(%)として、表200に表す。データは、ISIS 461756がC1-INH
mRNA発現を有意に減少させ、ISIS 482584による処置がPKK発現を有意に減少させたことを示している。
足、結腸、及び腸から採取した組織は、ホルムアミド溶液に一晩おき、エバンスブルーを浸出した。足の組織を含むホルムアミド溶液を55℃に加熱し、一晩放置した。染液が浸透したホルムアミド溶液の色彩強度は、OD600nmで測定した。データは、ISIS 461756で処置していないPBS対照と比較したときの増加率または減少率(%)として、表201に表す。データは、ISIS 482584による処置が、ISIS
461756によって誘発される血管透過性を防いだことを示している。
PKKのin vitro及びin vivoの有意な阻害を示したISIS 482584を、FeCl3誘発性下大静脈血栓症マウスモデルで評価した。
8匹の雄BALB/cマウスの3つの群に、10mg/kg、20mg/kg、または40mg/kgのISIS 482584を、3週間にわたって週2回(週の用量は20mg/kg、40mg/kg、または80mg/kg)皮下投与した。12匹のBALB/cマウスの2つの対照群にそれぞれ、PBSで処置、3週間にわたって週2回皮下投与して処置した。アンチセンスオリゴヌクレオチドまたはPBSの最後の投与から2日後に、10mg/kgのキシラジンと混合した150mg/kgのケタミンを腹腔内注射することによって、全群のマウスに麻酔をかけた。第1の対照群を除き、麻酔をかけたマウスの全群で、FeCl3によって血栓形成が誘発した。
血小板因子4(PF-4)のリアルタイムPCRを使用して、血栓形成の測定値として、大静脈の血小板を定量した。PF-4 mRNAレベルは、マウスプライマープローブセットmPF4_LTS_00086(配列番号2240として本明細書で指定した順方向配列AGACCCATTTCCTCAAGGTAGAACT、配列番号2241として本明細書で指定した逆方向配列CGCAGCGACGCTCATG、配列番号2242として本明細書で指定したプローブ配列TCTTTGGGTCCAGTGGCACCCTCTT)を使用して測定した。結果は、2つのPBS処理対照群と比較したときの、ISISオリゴヌクレオチド処置マウスのPF-4の割合として表す。表202に示すように、ISIS 482584による処置は、PBS対照に比べ、PF-4の有意な減少をもたらした。そのため、当該化合物によるPKKの減少は、血栓の形成の阻害に有用である。
ISIS 482584による処置が、マウスに過剰な出血または大量の出血を引き起こすかどうかを観察するために、尾の出血を測定した。
10匹の雄BALB/cマウスの群を、10mg/kg、20mg/kg、または40mg/kgのISIS 482584を、3週間にわたって週2回(週の用量は20mg/kg、40mg/kg、または80mg/kg)を皮下投与して処置した。8匹のBALB/cマウスの対照群を、PBSを3週間にわたって週2回、皮下投与して処置した。
ISISオリゴヌクレオチドまたはPBSの最後の処置から2日後に、マウスを尾を出血させるためのチャンバーに固定した。マウスにイソフランでチャンバーにおいて麻酔をかけた。その後、尾の小さい部分(切片から約4mm)を滅菌ハサミで切り出した。切り出した尾は、37℃に温めた約10mLの0.9%のNaCl緩衝液で満たされた15mLのFalcon管にすぐに置いた。血液は40分かけて採取した。出血前と出血後の管の生理食塩水の重さを測った。結果は表203に示す。
FeCl3誘発性腸間膜血栓症マウスモデルでISIS 482584を評価した。
Swiss-Websterマウス6~8匹の群を、40mg/kgのISIS 482584を、3週間にわたって週2回皮下注射して処置した(週の用量は80mg/kg)。Swiss-Websterマウス6匹の対照群を、PBSを3週間にわたって週2回皮下注射して処置した。アンチセンスオリゴヌクレオチドまたはPBSの最後の投与から2日後に、25mg/kgのキシラジンで混合した75mg/kgのケタミンを腹腔内注射することによって、全群のマウスに麻酔をかけた。
狭窄誘発性下大静脈(IVC)血栓症モデルでISIS 482584を評価した。血流の減少及び内皮損傷が、このモデルの特徴であり、St.Tomasモデルとしても知られている。
BALB/cマウス6~8匹の4つの群を、5mg/kg、10mg/kg、20mg/kgまたは40mg/kgのISIS 482584を3週間にわたって週2回皮下注射して処置した(週の用量は10mg/kg、20mg/kg、40mg/kgまたは80mg/kg)。BALB/cマウス8匹の対照群を、3週間にわたって週2回PBSを皮下注射して処置した。アンチセンスオリゴヌクレオチドまたはPBSの最後の投与から2日後に、2.5%の吸入用のイソフルランで麻酔をかけた。マウスのIVCを、左腎静脈の下、正中切開によって露わにし、鈍的解剖によって腹部大動脈から分離した。6-0シルクタイ(silk tie)(Ethicon、UK)をちょうど左腎静脈のシアノ血管の後ろに配置し、金属製4-0縫合糸(Ethicon、UK)をIVCにわたって長軸方向に配値し、シルクタイを頂上で縛った。金属製縫合糸はその後取り除いた。2つの神経血管手術用クリップ(Braun Medical Inc, PA)を、結紮下の2つに分かれた位置にそれぞれ20秒間置き、その後、取り除いた。腹腔の内容物を置き換え、腹腔を閉じた。24時間後、IVCをあらわにし、血栓形成を確認した。形成された血栓のすべてを採取し、10%のホルマリンに24時間固定した。
以下の表に示すように、PKK mRNAの効果について、ISIS 482584とISIS 722059のin vivo試験を行った。
C57Bl/6J-Tyrc-2Jマウス4匹からなる4つの群を、5.0mg/kg、10.0mg/kg、20.0mg/kg、または40.0mg/kgのISIS 482584を、3週間にわたって週2回皮下注射して処置した(週の用量は10.0mg/kg、20.0mg/kg、40.0mg/kg、または80.0mg/kg)。BALB/cマウス4匹からなる4群を、それぞれ、1.0mg/kg、2.0mg/kg、4.0mg/kg、または8.0mg/kgのISIS 722059を、3週間にわたって週2回皮下注射して処置した(週の用量は2.0mg/kg、4.0mg/kg、8.0mg/kg、または16.0mg/kg)。BALB/cマウス4匹の対照群を、PBSを3週間にわたって週2回皮下注射した。アンチセンスオリゴヌクレオチドまたはPBSの最後の投与から3日後に、全群のマウスに、誘導のために空気中に2.5%蒸発させたイソフルラン、次にメインテナンスのためにノーズコーンによる1~2%のイソフルランによって麻酔をした。その後、頚椎脱臼した。安楽死の後、RNA分析のために肝臓を回収した。
PKKのリアルタイムPCRのためにRNAを肝組織から抽出した。PKK mRNAレベルを、マウスプライマープローブセットを使用して測定した(配列番号2231として本明細書で指定した順方向配列ACAAGTGCATTTTACAGACCAGAGTAC、配列番号2232として本明細書で指定した逆方向配列GGTTGTCCGCTGACTTTATGCT、配列番号2233として本明細書で指定したプローブ配列AAGCACAGTGCAAGCGGAACACCC)。結果は、PBS対照に対するPKKの阻害率(%)として表す。以下の表208に示すように、GalNAc3共役基を含むIsis 722059は、親アンチセンスオリゴヌクレオチド、Isis 482584より、有意に強力にPKK mRNAを減少させた。この結果は、上述の実施例の結果と一致しており、マウスとヒトの両方の多くの標的遺伝子で、GalNAc3共役基を含むアンチセンスオリゴヌクレオチドは、親アンチセンスオリゴヌクレオチドより有意に強力であった。したがって、GalNAc3共役基を含むヒトPKKアンチセンスオリゴヌクレオチドは、同様に、共役基を含まない親アンチセンスオリゴヌクレオチドより、強力にヒトPKK mRNAを減少させることが予想される。
以下の表に示すように、ヒトPKK mRNAに対する効果について、ISIS 546254とISIS 721744のin vitro試験を行った。
Software、Cary、NC)を使用して計算した。結果は、オリゴヌクレオチドを細胞に人工的に移行することを促進するための試薬またはエレクトロポレーション技術を使用しない自由な取り込み条件下で、GalNAc共役体を含むオリゴヌクレオチドが、GalNAc共役体を含まない親オリゴヌクレオチドより、有意に強力であったことを示している。
〔1〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは、12~30個の連結されたヌクレオシドから成り、配列番号30~2226の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20個の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔2〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号570の少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20個の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔3〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号705の少なくとも8、少なくとも9、
少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20個の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔4〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号1666の少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔5〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは20個の連結されたヌクレオシドから成り、配列番号570の核酸塩基配列を有する、化合物。
〔6〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは20個の連結されたヌクレオシドから成り、配列番号705の核酸塩基配列を有する、化合物。
〔7〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは16個の連結されたヌクレオシドから成り、配列番号1666の核酸塩基配列を有する、化合物。
〔8〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号62、72、103、213、312、334-339、344、345、346、348、349、351、369、373、381、382、383、385、387-391、399、411、412、414、416、444、446-449、452、453、454、459、460、462-472、473、476、477、479、480、481、484、489-495、497、500、504、506、522、526、535、558、559、560、564、566、568-571、573、576、577、578、587、595、597-604、607、608、610、613、615、618、619、622、623、624、633、635、636、638、639、640、642、643、645、652、655-658、660、661、670、674-679、684、685、698、704、705、707、708、713、716、717、728、734、736、767、768、776、797、798、800、802、810、815、876、880、882、883、886、891、901-905、908-911、922、923、924、931、942、950-957、972、974、978、979、980、987-991、1005、1017-1021、1025、1026、1029、1030、1032、1034、1035、1037、1040、1041、1045、1046、1051、1054、1059、1060、1061、1064、1065、1066、1075、1076、1087、1089、1111、1114、1116、1117、1125、1133、1153、1169、1177、1181、1182、1187、1196、1200、1214、1222、1267、1276、1277、1285、1286、1289、1290、1291、1303、1367、1389、1393、1398-1401、1406、1407、1408、1411、1419-1422、1426、1430、1431、1432、1434-1437、1439、1440、1443、1444、1451、1452、1471、1516、1527、1535、1537、1538、1539、1540、1541、1563、1564、1567、1568、1616、1617、1623、1629、1664、1665、1666、1679、1687、1734、1804、1876、1886、1915、2008、2018、2100、2101、2115、及び2116の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少
なくとも16個の連続する核酸塩基配列を有する、化合物。
〔9〕
前記修飾オリゴヌクレオチドはPKKの少なくとも80%のmRNAの阻害を達成する、請求項8に記載の化合物。
〔10〕
修飾オリゴヌクレオチド及び共役基から成り、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号62、72、103、213、334-339、344、346、348、349、351、381、382、383、385、389、390、391、446、448、452、453、454、466-473、476、481、484、491、492、494、495、497、504、526、558、559、566、568-571、576、578、587、595、597、598、600-604、607、610、613、618、619、624、635、638、639、645、652、656、657、658、660、674、675、676、684、698、704、705、707、713、716、768、876、880、901-905、908-911、922、923、924、931、942、951、954-957、972、974、978、979、987、988、990、1005、1019、1020、1021、1025、1032、1037、1040、1041、1045、1054、1059、1060、1061、1064、1065、1066、1075、1111、1116、1117、1125、1133、1153、1169、1177、1200、1222、1267、1285、1290、1291、1303、1367、1398、1399、1401、1406、1408、1411、1419、1420、1421、1426、1430、1431、1432、1434-1437、1440、1443、1444、1451、1537-1540、1563、1616、1679、1687、1804、2008、2101、2115、及び2116の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16個の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔11〕
前記修飾オリゴヌクレオチドはPKKの少なくとも85%のmRNAの阻害を達成する、請求項10に記載の化合物。
〔12〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号334、346、351、382、390、391、446、448、452、453、468、469、470、471、472、476、481、491、495、504、558、566、568、570、571、578、587、597、598、600、604、613、635、638、645、656、658、660、674、675、684、704、705、880、901-905、909、922、931、951、954、956、990、1005、1020、1032、1037、1040、1041、1045、1054、1075、1111、1125、1133、1153、1200、1267、1291、1303、1398、1399、1401、1406、1420、1426、1430、1431、1434、1435、1436、1440、1443、1451、1537-1540、2115、及び2116の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16個の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔13〕
前記修飾オリゴヌクレオチドはPKKの少なくとも90%のmRNAの阻害を達成する、請求項12に記載の化合物。
〔14〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号334、391、448、468、469、568、570、598、635、658、674、684、705、901、903、904、922、990、1267、1291、1420、1430、1431、1434、1435、1436、1537、1538、及び1540の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔15〕
前記修飾オリゴヌクレオチドはPKKの少なくとも95%のmRNAの阻害を達成する、請求項14に記載の化合物。
〔16〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号334、338、346、349、382、383、390、448、452、453、454、495、526、559、570、587、598、635、660、705、901、903、904、908、923、931、955、974、988、990、1020、1039、1040、1111、1117、1267、1291、1349、1352、1367、1389、1393、1399、1401、1408、1411、1426、1499、1516、1535、1544、1548、1563、1564、1568、1569、1598、1616、1617、1623、1624、1643、1661、1665、1666、1673、1679、1695、1720、1804、1817、1876、1881、1886、1940、1947、2008、2018、2019、2031、2044、2100、2101、2115、及び2116のいずれかの核酸塩基配列の少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16個の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔17〕
前記修飾オリゴヌクレオチドは0.4以下のIC50(μM)を達成する、請求項16に記載の化合物。
〔18〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号334、346、349、382、453、454、495、526、570、587、598、635、660、901、903、904、931、955、990、1020、1111、1267、1349、1352、1367、1389、1399、1408、1411、1426、1516、1535、1544、1548、1563、1564、1568、1569、1598、1616、1617、1623、1643、1661、1665、1666、1673、1695、1804、1876、1881、2019、2044、2100、2101、2115、及び2116の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔19〕
前記修飾オリゴヌクレオチドは0.3以下のIC50(μM)を達成する、請求項18に記載の化合物。
〔20〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号334、346、382、453、495、526、570、587、598、635、901、904、931、955、10
20、1111、1349、1352、1389、1426、1516、1535、1544、1548、1564、1569、1598、1616、1617、1665、1666、1804、1876、1881、2019、2044、2101、及び2116の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔21〕
前記修飾オリゴヌクレオチドは、0.2以下のIC50(μM)を達成する請求項20に記載の化合物。
〔22〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号334、495、587、598、635、1349、1352、1389、1516、1544、1548、1569、1598、1617、1665、1666、1804、1881、及び2019の核酸塩基配列のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、または少なくとも16個の連続する核酸塩基を含む核酸塩基配列を有する、化合物。
〔23〕
前記修飾オリゴヌクレオチドは、0.2以下のIC50(μM)を達成する、請求項22に記載の化合物。
〔24〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基27427~27466の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔25〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基33183~33242の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔26〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基30570~30610の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔27〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基27427~27521の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔28〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30
個の連結されたヌクレオシドから成り、配列番号10の核酸塩基33085~33248の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔29〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基30475~30639の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔30〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基27362~27525の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔31〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基33101~33241の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔32〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、配列番号10の核酸塩基30463~30639の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔33〕
修飾オリゴヌクレオチド及び共役基を含み、前記修飾オリゴヌクレオチドは12~30個の連結されたヌクレオシドから成り、PKK核酸のエクソン9、エクソン12、またはエクソン14の長さが等しい部分に相補的な、少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または少なくとも20の連続した核酸塩基を含む核酸塩基配列を含む、化合物。
〔34〕
前記修飾オリゴヌクレオチドの前記核酸塩基配列は、配列番号10と少なくとも80%、少なくとも81%、少なくとも82%、少なくとも83%、少なくとも84%、少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%相補的である、請求項24~33に記載の化合物。
〔35〕
一本鎖修飾オリゴヌクレオチド及び共役基からなる、前記請求項のいずれかに記載の化
合物。
〔36〕
少なくとも1つのヌクレオシド間結合は修飾ヌクレオシド間結合である、前記請求項のいずれかに記載の化合物。
〔37〕
少なくとも1つの修飾ヌクレオシド間結合はホスホロチオエートヌクレオシド間結合である、請求項36に記載の化合物。
〔38〕
前記修飾オリゴヌクレオチドは、少なくとも1つのホスホジエステルヌクレオシド間結合を含む、請求項36に記載の化合物。
〔39〕
前記修飾オリゴヌクレオチドは、少なくとも2つのホスホジエステルヌクレオシド間結合を含む、請求項36に記載の化合物。
〔40〕
修飾オリゴヌクレオチドは、少なくとも3つのホスホジエステルヌクレオシド間結合を含む、請求項36に記載の化合物。
〔41〕
前記修飾オリゴヌクレオチドは、少なくとも4つのホスホジエステルヌクレオシド間結合を含む、請求項36に記載の化合物。
〔42〕
前記修飾オリゴヌクレオチドは、少なくとも5つのホスホヌクレオシド間結合を含む、請求項36に記載の化合物。
〔43〕
前記修飾オリゴヌクレオチドは、少なくとも6つのホスホジエステルヌクレオシド間結合を含む、請求項36に記載の化合物。
〔44〕
前記修飾オリゴヌクレオチドは、少なくとも7つのホスホジエステルヌクレオシド間結合を含む、請求項36に記載の化合物。
〔45〕
前記修飾オリゴヌクレオチドの各ヌクレオシド間結合は、ホスホジエステル結合及びホスホロチオエートヌクレオシド間結合から選択される、請求項38~44のいずれかに記載の化合物。
〔46〕
各ヌクレオシド間結合はホスホロチオエート結合である、請求項37に記載の化合物。〔47〕
少なくとも1つのヌクレオシドは修飾核酸塩基を含む、前記請求項のいずれかに記載の化合物。
〔48〕
前記修飾核酸塩基は5-メチルシトシンである、請求項39に記載の化合物。
〔49〕
前記修飾オリゴヌクレオチドは、少なくとも1つの修飾糖を含む、前記請求項のいずれかに記載の化合物。
〔50〕
前記修飾糖は2’修飾糖、BNA、またはTHPである、請求項49に記載の化合物。〔51〕
前記修飾糖は、2’-O-メトキシエチル、2’-O-メチル、拘束エチル、LNA、または3’-フルオロHNAのいずれかである、請求項50に記載の化合物。
〔52〕
少なくとも1つの2’-O-メトキシエチルヌクレオシド、2’-O-メチルヌクレオシド、拘束エチルヌクレオシド、LNAヌクレオシド、または3’-フルオロ-HNAヌ
クレオシドを含む、前記請求項のいずれかに記載の化合物。
〔53〕
前記修飾オリゴヌクレオチドは
10個の連結されたデオキシヌクレオシドからなるギャップセグメント、
5個の連結されたヌクレオシドからなる5’ウイングセグメント、
5個の連結されたヌクレオシドからなる3’ウイングセグメント、
を含む、前記請求項に記載の化合物であって、前記ギャップセグメントは5’ウイングセグメントと3’ウイングセグメントの間に位置し、各ウイングセグメントの各ヌクレオシドは修飾糖を含む、前記化合物。
〔54〕
前記修飾オリゴヌクレオチドは20個の連結されたヌクレオシドからなる、前記請求項のいずれかに記載の化合物。
〔55〕
前記修飾オリゴヌクレオチドは19個の連結されたヌクレオシドからなる、前記請求項のいずれかに記載の化合物。
〔56〕
前記修飾オリゴヌクレオチドは18個の連結されたヌクレオシドからなる、前記請求項のいずれかに記載の化合物。
〔57〕
共役基及び以下の式Tes Ges mCes Aes Aes Gds Tds mCds Tds mCds Tds Tds Gds Gds mCds Aes Aes Aes mCes Aeに従う修飾オリゴヌクレオチドからなる化合物であって、
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合
である、化合物。
〔58〕
共役基及び以下の式mCes mCes mCes mCes mCes Tds Tds mCds Tds Tds Tds Ads Tds Ads Gds mCes
mCes Aes Ges mCeに従う修飾オリゴヌクレオチドからなる化合物であって、
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合
である、化合物。
〔59〕
共役基及び以下の式mCes Ges Aks Tds Ads Tds mCds Ads Tds Gds Ads Tds Tds mCks mCks mCeに従う修飾オリゴヌクレオチドからなる化合物であって、
A=アデニン、
mC=5’-メチルシトシン、
G=グアニン、
T=チミン、
e=2’-O-メトキシメチル修飾ヌクレオシド、
k=cEt修飾ヌクレオシド、
d=2’-デオキシヌクレオシド、及び
s=ホスホロチオエートヌクレオシド間結合
である、化合物。
〔60〕
以下の式に従う共役基及び修飾オリゴヌクレオチドからなる化合物。
〔61〕
以下の式に従う共役基及び修飾オリゴヌクレオチドからなる化合物。
〔62〕
以下の式に従う共役基及び修飾オリゴヌクレオチドからなる化合物。
〔63〕
前記共役基は、前記修飾オリゴヌクレオチドの5’末端の前記修飾オリゴヌクレオチドに連結されている、請求項1~62のいずれかに記載の化合物。
〔64〕
前記共役基は、前記修飾オリゴヌクレオチドの3’末端の前記修飾オリゴヌクレオチドに連結されている、請求項1~62のいずれかに記載の化合物。
〔65〕
前記共役基は1つだけリガンドを含む、請求項1~64のいずれかの化合物。
〔66〕
前記共役基は2つだけリガンドを含む、請求項1~64のいずれかに記載の化合物。
〔67〕
前記共役基は3つ以上のリガンドを含む、請求項1~64のいずれかの化合物。
〔68〕
前記共役基は3つだけリガンドを含む、請求項1~64のいずれかに記載の化合物。
〔69〕
各リガンドは、多糖、修飾多糖、マンノース、ガラクトース、マンノース誘導体、ガラクトース誘導体、D-マンノピラノース、L-マンノピラノース、D-アラビノース、L-ガラクトース、D-キシロフラノース、L-キシロフラノース、D-グルコース、L-グルコース、D-ガラクトース、L-ガラクトース、α-D-マンノフラノース、β-D-マンノフラノース、α-D-マンノピラノース、β-D-マンノピラノース、α-D-グルコピラノース、β-D-グルコピラノース、α-D-グルコフラノース、β-D-グルコフラノース、α-D-フルクトフラノース、α-D-フルクトピラノース、α-D-ガラクトピラノース、β-D-ガラクトピラノース、α-D-ガラクトフラノース、β-D-ガラクトフラノース、グルコサミン、シアル酸、α-D-ガラクトサミン、N-アセチルガラクトサミン、2-アミノ-3-O-[(R)-1-カルボキシエチル]-2-デオキシ-β-D-グルコピラノース、2-デオキシ-2-メチルアミノ-L-グルコピラノース、4,6-ジデオキシ-4-ホルムアミド-2,3-ジ-O-メチル-D-マンノピラノース、2-デオキシ-2-スルホアミノ-D-グルコピラノース、N-グリコロイル-α-ノイラミン酸、5-チオ-β-D-グルコピラノース、メチル2,3,4-トリ-O-アセチル-1-チオ-6-O-トリチル-α-D-グルコピラノシド、4-チオ-β-D-ガラクトピラノース、エチル3,4,6,7-テトラ-O-アセチル-2-デオキシ-1,5-ジチオ-α-D-グルコ-ヘプトピラノシド、2,5-アンヒドロ-D-アロノニトリル、リボース、D-リボース、D-4-チオリボース、L-リボース、L-
4-チオリボースのなかから選択される、請求項65~68のいずれか一項に記載の化合物。
〔70〕
各リガンドは、N-アセチルガラクトサミンである、請求項69に記載の化合物。
〔71〕
前記共役基は以下を含む、請求項1~64のいずれかに記載の化合物。
〔72〕
前記共役基は以下を含む、請求項1~64のいずれかに記載の化合物。
〔73〕
前記共役基は以下を含む、請求項1~64のいずれかに記載の化合物。
〔74〕
前記共役基は以下を含む、請求項1~64のいずれかに記載の化合物。
〔75〕
前記共役基は以下を含む、請求項1~64のいずれかに記載の化合物。
〔76〕
前記共役基は、少なくとも1つのリン共役基または中性の共役基を含む、請求項64~70のいずれかに記載の化合物。
〔77〕
前記共役基は以下のなかから選択される構造を含み、
nは1~12であり、
mは1~12である、
請求項1~76のいずれかに記載の化合物。
〔78〕
前記共役基は、以下のなかから選択される構造を有するテザーを有し、
Lはリン共役基または中性連結基のいずれかであり、
Z1はC(=O)OR2であり、
Z2は、H、C1-C6アルキルまたは置換C1-C6アルキルであり、
R2はH、C1-C6アルキルまたは置換C1-C6アルキルであり、
各m1は独立して0~20であり、少なくとも1つのm1は各テザーにつき0よりも大きい、
請求項1~76のいずれかに記載の化合物。
〔79〕
共役基は以下のなかから選択される構造を有するテザーを有し、
Z2はHまたはCH3であり、
各m1は独立して0~20であり、少なくとも1つのm1は各テザーにつき0よりも大きい、
請求項78に記載の化合物。
〔80〕
前記共役基は、以下のなかから選択される構造を有するテザーを有し、
nは1~12であり、
mは1~12である、
請求項64~70のいずれかに記載の化合物。
〔81〕
前記共役基は修飾オリゴヌクレオチドに共有結合で結合されている、請求項1~80のいずれかに記載の化合物。
〔82〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Bは切断可能部分であり、
Cは共役リンカーであり、
Dは分岐基であり、
各Eはテザーであり、
各Fはリガンドであり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔83〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Bは切断可能部分であり、
Cは共役リンカーであり、
Dは分岐基であり、
各Eはテザーであり、
各Fはリガンドであり、
各nは独立して0または1であり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔84〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Bは切断可能部分であり、
Cは共役リンカーであり、
各Eはテザーであり、
各Fはリガンドであり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔85〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Cは共役リンカーであり、
Dは分岐基であり、
各Eはテザーであり、
各Fはリガンドであり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔86〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Cは共役リンカーであり、
各Eはテザーであり、
各Fはリガンドであり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔87〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Bは切断可能部分であり、
Dは分岐基であり、
各Eはテザーであり、
各Fはリガンドであり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔88〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Bは切断可能部分であり、
各Eはテザーであり、
各Fはリガンドであり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔89〕
以下の式によって表される構造を有し、
ここで、
Aは修飾オリゴヌクレオチドであり、
Dは分岐基であり、
各Eはテザーであり、
各Fはリガンドであり、
qは1~5の整数である、
請求項1~81のいずれかに記載の化合物。
〔90〕
前記共役リンカーは、以下のなかから選択される構造を有し、
ここで、各Lは、独立して、リン共役基または中性の共役基であり、
各nは独立して1~20である、
請求項82~89のいずれかに記載の化合物。
〔92〕
前記共役リンカーは、以下のなかから選択される構造を有する、請求項83~90のいずれかに記載の化合物:
〔93〕
前記共役リンカーは以下の構造を有する、請求項83~90のいずれかに記載の化合物:
〔94〕
前記共役リンカーは、以下のなかから選択される構造を有する、請求項83~90のいずれかに記載の化合物:
〔95〕
前記共役リンカーは、以下のなかから選択される構造を有する、請求項83~90のいずれかに記載の化合物:
〔96〕
前記共役リンカーは、以下のなかから選択される構造を有する、請求項83~90のいずれかに記載の化合物:
〔97〕
前記共役リンカーはピロリジンを含む、請求項83~96のいずれかに記載の化合物。〔98〕
前記共役リンカーはピロリジンを含まない、請求項83~96のいずれかに記載の化合物。
〔99〕
前記共役リンカーはPEGを含む、請求項83~98のいずれかに記載の化合物。
〔100〕
前記共役リンカーはアミドを含む、請求項83~99のいずれかに記載の化合物。
〔101〕
前記共役リンカーは、少なくとも2つのアミドを含む、請求項83~99のいずれかに記載の化合物。
〔102〕
前記共役リンカーはアミドを含まない、請求項83~99のいずれかに記載の化合物。〔103〕
前記共役リンカーはポリアミドを含む、請求項83~102のいずれかに記載の化合物。
〔104〕
前記共役リンカーはアミンを含む、請求項83~103のいずれかに記載の化合物。
〔105〕
前記共役リンカーは、2つ以上のジスルフィド結合を含む、請求項83~104のいずれかに記載の化合物。
〔106〕
前記共役リンカーはタンパク質結合部分を含む、請求項83~105のいずれかに記載の化合物。
〔107〕
前記タンパク質結合部分は脂質を含む、請求項106に記載の化合物。
〔108〕
前記タンパク質結合部分は、コレステロール、コール酸、アダマンタン酢酸、1-ピレン酪酸、ジヒドロテストステロン、1,3-ビス-O(ヘキサデシル)グリセロール、ゲラニルオキシヘキシル基、ヘキサデシルグリセロール、ボルネオール、メントール、1,3-プロパンジオール、ヘプタデシル基、パルミチン酸、ミリスチン酸、O3-(オレオイル)リトコール酸、O3-(オレオイル)コレン酸、ジメトキシトリチル、またはフェノキサジン)、ビタミン(例えば、葉酸、ビタミンA、ビタミンE、ビオチン、ピリドキサール)、ペプチド、炭水化物(例えば、単糖、二糖、三糖、四糖、オリゴ糖、多糖)、エンドソーム溶解成分、ステロイド(例えば、ウバオール、hecigenin、ジオスゲニン)、テルペン(例えば、トリテルペン、例えば、サルササポゲニン、フリーデリン、エピフリーデリノール誘導体化リトコール酸)、またはカチオン性脂質のなかから選択される、請求項106に記載の化合物。
〔109〕
前記タンパク質結合部分は、C16~C22長鎖の飽和もしくは不飽和脂肪酸、コレス
テロール、コール酸、ビタミンE、アダマンタンまたは1-ペンタフルオロプロピルのなかから選択される請求項106に記載の化合物。
〔110〕
前記共役リンカーは、以下のなかから選択される構造を有し、
ここで、各nは独立して1~20であり、pは1から6である、
請求項82~109のいずれかに記載の化合物。
〔111〕
前記共役リンカーは、以下のなかから選択される構造を有し、
ここで、各nは独立して1~20である、
請求項82~110のいずれかに記載の化合物。
〔112〕
前記共役リンカーは、以下のなかから選択される構造を有する、請求項82~110のいずれかに記載の化合物:
〔113〕
前記共役リンカーは、以下のなかから選択される構造を有し、
nは1~20である、
請求項82~110のいずれかに記載の化合物。
〔114〕
前記共役リンカーは、以下のなかから選択される構造を有する、請求項82~110のいずれかに記載の化合物:
〔115〕
前記共役リンカーは、以下のなかから選択される構造を有し、
ここで、各nは独立して、0、1、2、3、4、5、6、または7である、
請求項82~110のいずれかに記載の化合物。
〔116〕
前記共役リンカーは、以下の構造を有する、請求項82~110のいずれかに記載の化合物:
〔117〕
前記分枝基は、以下の構造の1つを有し、
ここで、各A1は独立してO、S、C=OまたはNHであり、
各nは独立して1~20である、
請求項82~116のいずれかに記載の化合物。
〔118〕
前記分枝基は以下の構造の1つを有し、
各A1は独立してO、S、C=OまたはNHであり、
各nは独立して1~20である、
請求項82~116のいずれかに記載の化合物。
〔119〕
前記分枝基は、以下の構造を有する、請求項82~116のいずれかに記載の化合物:
〔120〕
前記分枝基は以下の構造を有する、請求項82~116のいずれかに記載の化合物:
〔121〕
前記分枝基は、以下の構造を有する、請求項82~116のいずれかに記載の化合物:
〔122〕
前記分枝基は、以下の構造を有する、請求項82~116のいずれかに記載の化合物:
〔123〕
前記分岐基はエーテルを含む、請求項82~116のいずれかに記載の化合物。
〔124〕
前記分枝基は、以下の構造を有し、
ここで、各nは独立して1~20であり、
mは2から6である、
請求項82~116のいずれかに記載の化合物。
〔125〕
前記分枝基は、以下の構造を有する、請求項82~116のいずれかに記載の化合物:
〔126〕
前記分枝基は、以下の構造を有する、請求項82~116のいずれかに記載の化合物:
〔127〕
前記分岐基は以下を含み、
ここで、各jは1から3の整数であり、
前記各nは1から20の整数である、
請求項82~116のいずれかに記載の化合物。
〔128〕
前記分岐基は以下を含む請求項82~116のいずれかに記載の化合物:
〔129〕
各テザーは、以下のなかから選択され、
ここで、Lは、リン共役基及び中性の共役基から選択され、
Z1はC(=O)OR2であり、
Z2は、H、C1-C6アルキルまたは置換C1-C6アルキルであり、
R2はH、C1-C6アルキルまたは置換C1-C6アルキルであり、
各m1は独立して0~20であり、少なくとも1つのm1は各テザーにつき0よりも大きい、
請求項82~128のいずれかに記載の化合物。
〔130〕
各テザーは、以下のなかから選択され、
Z2はHまたはCH3であり、
各m2は独立して0~20であり、少なくとも1つのm2は各テザーにつき0よりも大きい、
請求項82~128のいずれかに記載の化合物。
〔131〕
各テザーは、以下のなかから選択され、
nは1~12であり、
mは1~12である、
請求項82~128のいずれかに記載の化合物。
〔132〕
少なくとも1つのテザーはエチレングリコールを含む、請求項82~128のいずれかに記載の化合物。
〔133〕
少なくとも1つのテザーはアミドを含む、請求項82~128または130のいずれかに記載の化合物。
〔134〕
少なくとも1つのテザーはポリアミドを含む、請求項82~128または130のいずれかに記載の化合物。
〔135〕
少なくとも1つのテザーはアミンを含む、請求項82~128または130のいずれかに記載の化合物。
〔136〕
少なくとも2つのテザーは互いに異なっている、請求項82~128または130のいずれかに記載の化合物。
〔137〕
テザーの全ては互いに同じである、請求項82~128または130のいずれかに記載の化合物。
〔138〕
各テザーは、以下のなかから選択され、
ここで、各nは独立して1~20であり、
各pは1から約6である、
請求項82~128のいずれかに記載の化合物。
〔139〕
各テザーは、以下のなかから選択される、請求項82~128のいずれかに記載の化合物:
〔140〕
各テザーは、以下の構造を有し、
各nは独立して1~20である、
請求項82~128のいずれかに記載の化合物。
〔141〕
各テザーは、以下の構造を有する、請求項82~128のいずれかに記載の化合物:
〔142〕
前記テザーは、以下のなかから選択される構造を有し、
各nは独立して、0、1、2、3、4、5、6、または7である、
請求項82~128のいずれかに記載の化合物。
〔143〕
前記テザーは、以下のなかから選択される構造を有する、請求項82~128のいずれかに記載の化合物:
〔144〕
前記リガンドはガラクトースである、請求項140~143のいずれかに記載の化合物。
〔145〕
前記リガンドはマンノース-6-リン酸である、請求項140~143のいずれかに記載の化合物。
〔146〕
各リガンドは以下のなかから選択され、
各R1はOH及びNHCOOHから選択される、
請求項140~143のいずれかに記載の化合物。
〔147〕
各リガンドは以下のなかから選択される、請求項140~143のいずれかに記載の化合物:
〔148〕
各リガンドは以下の構造を有する、請求項140~143のいずれかに記載の化合物:
〔149〕
各リガンドは以下の構造を有する、請求項140~143のいずれかに記載の共役されるアンチセンス化合物:
前記共役基は細胞標的化部分を含む、前記請求項のいずれかに記載の化合物。
〔151〕
前記共役基は以下の構造を有する細胞標的化部分を含み、
各nは独立して1~20である、
請求項150に記載の化合物。
〔152〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔153〕
細胞標的化部分は以下の構造を有し、
各nは独立して1~20である、
請求項150に記載の化合物。
〔154〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔155〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔156〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔157〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔158〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔159〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔160〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔161〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔162〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔163〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔164〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔165〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔166〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔167〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔168〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔169〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔170〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔171〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔172〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔173〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔174〕
前記細胞標的化部分は以下を含む、請求項150に記載の化合物:
〔175〕
前記細胞標的化部分は以下の構造を有する、請求項150に記載の化合物:
〔176〕
前記細胞標的化部分は以下を含み、
各Yは、O、S、置換もしくは非置換C1-C10アルキル、アミノ、置換アミノ、アジド、アルケニルまたはアルキニルから選択される、請求項150に記載の化合物。
〔177〕
前記共役基は以下を含み、
各Yは、O、S、置換もしくは非置換C1-C10アルキル、アミノ、置換アミノ、アジド、アルケニルまたはアルキニルから選択される、請求項150に記載の化合物。
〔178〕
前記細胞標的化部分は以下の構造を有し、
各Yは、O、S、置換もしくは非置換C1-C10アルキル、アミノ、置換アミノ、アジド、アルケニルまたはアルキニルから選択される、請求項150に記載の化合物。
〔179〕
前記共役基は以下を含む、前記請求項のいずれかに記載の化合物:
〔180〕
前記共役基は以下を含む、前記請求項のいずれかに記載の化合物:
〔181〕
前記共役基は以下を含む、前記請求項のいずれかに記載の化合物:
〔182〕
前記共役基は以下を含む、前記請求項のいずれかに記載の化合物:
〔183〕
前記共役基は、ホスホジエステル、アミド、またはエステルのなかから選択される切断可能部分を含む、前記請求項のいずれかに記載の化合物。
〔184〕
前記共役基は、ホスホジエステル切断可能部分を含む、前記請求項のいずれかに記載の化合物。
〔185〕
前記共役基は、切断可能部分を含まず、前記共役基は、前記共役基と前記オリゴヌクレオチドの間にホスホロチオエート結合を含む、前記請求項のいずれかに記載の化合物。
〔186〕
前記共役基はアミド切断可能部分を含む、前記請求項のいずれかに記載の化合物。
〔187〕
前記共役基は、エステル切断可能部分を含む、前記請求項のいずれかに記載の化合物。〔188〕
以下の構造を有し、
各nは独立して1~20であり、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔189〕
以下の構造を有し、
各nは独立して1~20であり、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔190〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Zは、Hまたは連結された固体支持体であり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔191〕
以下の構造を有し、
各nは独立して1~20であり、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Zは、Hまたは連結された固体支持体であり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔192〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔193〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔194〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔195〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔196〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔197〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔198〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔199〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔200〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔201〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔202〕
以下の構造を有し、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔203〕
前記共役基は以下を含み、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔204〕
前記共役基は以下を含み、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔205〕
前記共役基は以下を含み、
Q13はHまたはO(CH2)2-OCH3であり、
Aは修飾オリゴヌクレオチドであり、
Bxは複素環式塩基部分である、
前記請求項のいずれかに記載の化合物。
〔206〕
Bxは、アデニン、グアニン、チミン、ウラシル、またはシトシンまたは5-メチルシトシンのなかから選択される、前記請求項のいずれかに記載の化合物。
〔207〕
Bxはアデニンである、前記請求項のいずれかに記載の化合物。
〔208〕
Bxはチミンである、前記請求項のいずれかに記載の化合物。
〔209〕
Q13はO(CH2)2-OCH3である、前記請求項のいずれかに記載の化合物。
〔210〕
Q13はHである、前記請求項のいずれかに記載の化合物。
〔211〕
以下に記載の修飾オリゴヌクレオチドからなる化合物:
〔212〕
前記請求項のいずれかに記載の化合物またはその塩、及び医薬的に許容される担体また
は希釈剤の少なくとも1つを含む組成物。
〔213〕
請求項1~212のいずれかの化合物を含むプロドラッグ。
〔214〕
前記請求項のいずれかに記載の化合物またはその塩、及び医薬的に許容される担体または希釈剤の少なくとも1つを含む組成物。
〔215〕
動物に前記請求項のいずれかに記載の化合物または組成物を投与することを含む方法。〔216〕
前記動物はヒトである、請求項215に記載の方法。
〔217〕
前記化合物を投与することによりPKK関連疾患、障害または病態を予防、治療、または改善する、請求項215または216に記載の方法。
〔218〕
前記PKK関連疾患、障害または病態は、遺伝性血管浮腫(HAE)、浮腫、血管浮腫、腫脹、目蓋の血管浮腫、眼の浮腫、黄斑浮腫、脳浮腫、血栓症、塞栓症、血栓塞栓症、深部静脈血栓症、肺塞栓症、心筋梗塞、脳卒中、または梗塞である、請求項217に記載の方法。
〔219〕
炎症性疾患または血栓塞栓性疾患を治療するための医薬品を製造するための前記請求項のいずれかに記載の化合物または組成物の使用。
Claims (23)
- 修飾オリゴヌクレオチド及びコンジュゲート基を含む化合物であって、前記修飾オリゴヌクレオチドは、12~30個の連結されたヌクレオシドから成り、前記修飾オリゴヌクレオチドは、
核酸塩基:配列番号10の33183-33242
の長さが等しい部分に100%相補的な少なくとも12個の連続する核酸塩基を含む核酸塩基配列を有し、前記修飾オリゴヌクレオチドの核酸塩基配列は、プレカリクレイン(PKK)核酸の長さが等しい部分に少なくとも90%相補的であり、前記修飾オリゴヌクレオチドは、PKK mRNA及び/またはPKKタンパク質レベルを減少させることができる、前記化合物。 - 修飾オリゴヌクレオチド及びコンジュゲート基を含む化合物であって、前記修飾オリゴヌクレオチドは、12~30個の連結されたヌクレオシドから成り、前記修飾オリゴヌクレオチドは、
配列番号: 705, 155-160, 261, 702-704, 706 及び 707
のいずれか一つから選択される配列の少なくとも12個の連続する核酸塩基を含む核酸塩基配列を有し、前記修飾オリゴヌクレオチドの核酸塩基配列は、プレカリクレイン(PKK)核酸の長さが等しい部分に少なくとも90%相補的であり、前記修飾オリゴヌクレオチドは、PKK mRNA及び/またはPKKタンパク質レベルを減少させることができる、前記化合物。 - 前記修飾オリゴヌクレオチドが15~30個の連結されたヌクレオシドから成る、請求項1または2のいずれか一つに記載の化合物。
- 前記修飾オリゴヌクレオチドの核酸塩基配列が、配列番号10の長さが等しい部分に少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%相補的である、請求項1~3のいずれか一つに記載の化合物。
- 前記修飾オリゴヌクレオチドが一本鎖修飾オリゴヌクレオチドである、請求項1~4のいずれか一つに記載の化合物。
- 前記一本鎖修飾オリゴヌクレオチドがギャップマーである、請求項5の化合物。
- 前記修飾オリゴヌクレオチドは
10個の連結されたデオキシヌクレオシドからなるギャップセグメント;
5個の連結されたヌクレオシドからなる5’ウイングセグメント;及び
5個の連結されたヌクレオシドからなる3’ウイングセグメント、
を含み、
前記ギャップセグメントは、5’ウイングセグメントと3’ウイングセグメントに直接隣接して5’ウイングセグメントと3’ウイングセグメントの間に位置し、各ウイングセグメントの各ヌクレオシドは修飾された糖を含む、請求項1~6のいずれか一つに記載の化合物。 - 請求項1~7のいずれか一つに記載の化合物であって、
a.前記修飾オリゴヌクレオチドの少なくとも1つのヌクレオシド間結合が修飾ヌクレオシド間結合であり、該修飾ヌクレオシド間結合はホスホロチオエートヌクレオシド間結合であってもよい、前記化合物;または
b.前記修飾オリゴヌクレオチドの各ヌクレオシド間結合が修飾ヌクレオシド間結合であり、該修飾ヌクレオシド間結合はホスホロチオエートヌクレオシド間結合であってもよい、前記化合物。 - 前記修飾オリゴヌクレオチドの少なくとも1つの核酸塩基が修飾核酸塩基であり、該修飾核酸塩基は5-メチルシトシンであってもよい、請求項1~8のいずれか一つに記載の化合物。
- 請求項1~9のいずれか一つに記載の化合物であって、
a.前記修飾オリゴヌクレオチドの少なくとも1つのヌクレオシドが修飾された糖を含む、前記化合物;または、
b.前記修飾オリゴヌクレオチドの各ヌクレオシドが修飾された糖を含む、前記化合物。 - 前記修飾された糖が二環式糖であり、該二環式糖は:
a. 4’-(CH2)n-O-2’橋{ここでnは1または2である};または
b. 4’-CH(CH3)-O-2’橋
を含んでもよい、請求項10の化合物。 - 前記修飾された糖は2’-修飾された糖であり、該2’-修飾された糖は、2’-O-メトキシエチル、2’-F、及び2’-O-メチルから選択される置換を含み得る、請求項10の化合物。
- 前記コンジュゲート基が、少なくとも1つのN-アセチルガラクトサミン(GalNAc)リガンドを含む、請求項1~12のいずれか一つに記載の化合物。
- 前記コンジュゲート基は、前記修飾オリゴヌクレオチドの5’末端または3’末端で、該修飾オリゴヌクレオチドに共有結合で結合している、請求項1~14のいずれか一つに記載の化合物。
- 前記修飾オリゴヌクレオチドの核酸塩基配列が配列番号705を含むか、または配列番号705からなる、請求項1~15のいずれか一つに記載の化合物。
- 修飾オリゴヌクレオチド及びコンジュゲート基を含む化合物であって、前記修飾オリゴヌクレオチドは、5’ウイングセグメント、中央のギャップセグメント、及び3’ウイングセグメントから成るギャップマーであり:
5’ウイングセグメントは5個の2’-O-メトキシエチルヌクレオシドからなり、
中央のギャップセグメントは10個のβ-D-デオキシリボヌクレオシドからなり、
3’ウイングセグメントは5個の2’-O-メトキシエチルヌクレオシドからなり、
前記修飾オリゴヌクレオチドは、核酸塩基配列 5’CCCCCTTCTTTATAGCCAGC - 3’ (配列番号705)を有し、ここで、各シトシンは5メチルシトシンであり、前記修飾オリゴヌクレオチドの各ヌクレオシド間結合はホスホロチオエートヌクレオシド間結合であり、及び
前記コンジュゲート基は、以下の化学構造:
- 前記修飾オリゴヌクレオチドが二本鎖修飾オリゴヌクレオチドである、請求項1~4及び7~17のいずれか一つに記載の化合物。
- 請求項1~18のいずれかに記載の化合物、及び医薬的に許容される担体または希釈剤を含む組成物。
- 請求項19に記載の組成物であって、
a.前記医薬上許容される希釈剤が、リン酸緩衝生理食塩水(PBS)である;及び/または
b.前記化合物の前記修飾オリゴヌクレオチドが、塩である、
前記組成物。 - 請求項1~18のいずれかに記載の化合物、または請求項19または20の組成物を含む、PKK関連疾患、障害または病態を予防、治療、または改善するための医薬組成物。
- 前記PKK関連疾患、障害または病態は、
(i)浮腫、黄斑浮腫、眼の浮腫、脳浮腫、血管浮腫、遺伝性血管浮腫(HAE)、または目蓋の血管浮腫;
(ii)腫脹;
(iii)血栓症、または深部静脈血栓症;
(vi)塞栓症、または肺塞栓症;
(v)血栓塞栓症;または
(vi)梗塞、心筋梗塞、または脳卒中
を含む、請求項21に記載の医薬組成物。 - 請求項1~18のいずれかに記載の化合物、または請求項19または20の組成物を含む、炎症性疾患、障害または病態を予防、治療、または改善するための医薬組成物。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022129902A JP2022169653A (ja) | 2014-05-01 | 2022-08-17 | Pkk発現を調節するための組成物及び方法 |
| JP2025114273A JP2025148418A (ja) | 2014-05-01 | 2025-07-07 | Pkk発現を調節するための組成物及び方法 |
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461987478P | 2014-05-01 | 2014-05-01 | |
| US61/987,478 | 2014-05-01 | ||
| US201462058629P | 2014-10-01 | 2014-10-01 | |
| US62/058,629 | 2014-10-01 | ||
| US201462088459P | 2014-12-05 | 2014-12-05 | |
| US62/088,459 | 2014-12-05 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016565502A Division JP6665111B2 (ja) | 2014-05-01 | 2015-05-01 | Pkk発現を調節するための組成物及び方法 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022129902A Division JP2022169653A (ja) | 2014-05-01 | 2022-08-17 | Pkk発現を調節するための組成物及び方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020096629A JP2020096629A (ja) | 2020-06-25 |
| JP2020096629A5 JP2020096629A5 (ja) | 2020-09-10 |
| JP7127076B2 true JP7127076B2 (ja) | 2022-08-29 |
Family
ID=54359499
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016565502A Active JP6665111B2 (ja) | 2014-05-01 | 2015-05-01 | Pkk発現を調節するための組成物及び方法 |
| JP2020025372A Active JP7127076B2 (ja) | 2014-05-01 | 2020-02-18 | Pkk発現を調節するための組成物及び方法 |
| JP2022129902A Pending JP2022169653A (ja) | 2014-05-01 | 2022-08-17 | Pkk発現を調節するための組成物及び方法 |
| JP2025114273A Pending JP2025148418A (ja) | 2014-05-01 | 2025-07-07 | Pkk発現を調節するための組成物及び方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016565502A Active JP6665111B2 (ja) | 2014-05-01 | 2015-05-01 | Pkk発現を調節するための組成物及び方法 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022129902A Pending JP2022169653A (ja) | 2014-05-01 | 2022-08-17 | Pkk発現を調節するための組成物及び方法 |
| JP2025114273A Pending JP2025148418A (ja) | 2014-05-01 | 2025-07-07 | Pkk発現を調節するための組成物及び方法 |
Country Status (15)
| Country | Link |
|---|---|
| US (4) | US10294477B2 (ja) |
| EP (3) | EP3137091B1 (ja) |
| JP (4) | JP6665111B2 (ja) |
| KR (1) | KR102366078B1 (ja) |
| CN (1) | CN106232125B (ja) |
| AU (2) | AU2015252917B2 (ja) |
| BR (1) | BR112016022855B1 (ja) |
| CA (1) | CA2943705A1 (ja) |
| DK (1) | DK3137091T3 (ja) |
| ES (1) | ES2849600T3 (ja) |
| HU (1) | HUE052709T2 (ja) |
| IL (2) | IL247862B (ja) |
| MX (2) | MX377141B (ja) |
| RU (1) | RU2703411C2 (ja) |
| WO (1) | WO2015168532A2 (ja) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK2991656T3 (da) | 2013-05-01 | 2020-03-23 | Ionis Pharmaceuticals Inc | Sammensætninger og fremgangsmåder til modulering af apolipoprotein c-iii-ekspression |
| JP6652922B2 (ja) | 2013-08-28 | 2020-02-26 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | プレカリクレイン(pkk)発現の調節 |
| SG10201910844SA (en) * | 2014-04-01 | 2020-01-30 | Biogen Ma Inc | Compositions for modulating sod-1 expression |
| KR20200102553A (ko) | 2014-05-01 | 2020-08-31 | 아이오니스 파마수티컬즈, 인코포레이티드 | 성장 호르몬 수용체 발현을 조절하기 위한 조성물 및 방법 |
| WO2015168532A2 (en) * | 2014-05-01 | 2015-11-05 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulating pkk expression |
| CA2961993A1 (en) | 2014-10-10 | 2016-04-14 | F. Hoffmann-La Roche Ag | Galnac phosphoramidites, nucleic acid conjugates thereof and their use |
| CA2999341A1 (en) * | 2015-11-06 | 2017-05-11 | Ionis Pharmaceuticals, Inc. | Modulating apolipoprotein (a) expression |
| MA45478A (fr) | 2016-04-11 | 2019-02-20 | Arbutus Biopharma Corp | Compositions de conjugués d'acides nucléiques ciblés |
| US20180193270A1 (en) | 2016-11-29 | 2018-07-12 | PureTech Health LLC | Exosomes for delivery of therapeutic agents |
| KR20250145702A (ko) | 2017-04-11 | 2025-10-13 | 아뷰터스 바이오파마 코포레이션 | 표적화 조성물 |
| EP3719125B1 (en) | 2017-12-01 | 2025-01-08 | Suzhou Ribo Life Science Co., Ltd. | Nucleic acid, composition and conjugate containing same, and preparation method and use |
| WO2019105419A1 (zh) | 2017-12-01 | 2019-06-06 | 苏州瑞博生物技术有限公司 | 一种核酸、含有该核酸的组合物与缀合物及制备方法和用途 |
| US11414661B2 (en) | 2017-12-01 | 2022-08-16 | Suzhou Ribo Life Science Co., Ltd. | Nucleic acid, composition and conjugate containing nucleic acid, preparation method therefor and use thereof |
| CA3083968C (en) | 2017-12-01 | 2024-04-23 | Suzhou Ribo Life Science Co., Ltd. | Double-stranded oligonucleotide, composition and conjugate comprising double-stranded oligonucleotide, preparation method thereof and use thereof |
| EP3718572B1 (en) | 2017-12-01 | 2024-07-31 | Suzhou Ribo Life Science Co., Ltd. | Nucleic acid, composition and conjugate containing nucleic acid, preparation method and use |
| KR102617947B1 (ko) | 2017-12-29 | 2023-12-27 | 쑤저우 리보 라이프 사이언스 컴퍼니, 리미티드 | 접합체와 제조 및 그 용도 |
| CN111655849B (zh) | 2018-08-21 | 2024-05-10 | 苏州瑞博生物技术股份有限公司 | 一种核酸、含有该核酸的药物组合物和缀合物及其用途 |
| CN111655297A (zh) | 2018-09-30 | 2020-09-11 | 苏州瑞博生物技术有限公司 | 一种siRNA缀合物及其制备方法和用途 |
| JP7507495B2 (ja) | 2018-12-28 | 2024-06-28 | スーチョウ リボ ライフ サイエンス カンパニー、リミテッド | 核酸、当該核酸を含む組成物及び複合体ならびに調製方法と使用 |
| EP3974530A4 (en) | 2019-05-22 | 2023-07-12 | Suzhou Ribo Life Science Co., Ltd. | NUCLEIC ACID, PHARMACEUTICAL COMPOSITION, CONJUGATE, METHOD FOR PREPARATION AND USE |
| EP3974532A4 (en) | 2019-05-22 | 2024-01-24 | Suzhou Ribo Life Science Co., Ltd. | NUCLEIC ACID, PHARMACEUTICAL COMPOSITION, CONJUGATE, PROCESS OF PREPARATION AND USE |
| US20220315929A1 (en) * | 2019-05-24 | 2022-10-06 | Suzhou Ribo Life Science Co., Ltd. | Nucleic acid, pharmaceutical composition and conjugate, preparation method therefor and use thereof |
| IL295280A (en) | 2020-02-07 | 2022-10-01 | Intellia Therapeutics Inc | Preparations and methods for editing the kallikrein gene (klkb1) |
| CN115244179A (zh) * | 2020-03-13 | 2022-10-25 | Ionis制药公司 | 用于治疗和预防前激肽释放酶相关疾患的组合物和方法 |
| CN116669746B (zh) * | 2020-12-29 | 2025-09-09 | 苏州瑞博生物技术股份有限公司 | 一种核酸、含有该核酸的药物组合物与siRNA缀合物及制备方法和用途 |
| WO2023056440A1 (en) * | 2021-10-01 | 2023-04-06 | Adarx Pharmaceuticals, Inc. | Prekallikrein-modulating compositions and methods of use thereof |
| IL312811A (en) | 2021-11-16 | 2024-07-01 | Shanghai Argo Biopharmaceutical Co Ltd | Composition and method for inhibiting angiotensinogen (agt) protein expression |
| TW202346586A (zh) * | 2022-01-28 | 2023-12-01 | 大陸商上海舶望製藥有限公司 | 用於抑制前激肽釋放酶(pkk)蛋白表達的組合物和方法 |
| CN117756866A (zh) * | 2022-01-30 | 2024-03-26 | 大睿生物医药科技(上海)有限公司 | 含有n-乙酰半乳糖胺的靶向配体 |
| CA3261605A1 (en) * | 2022-07-08 | 2024-01-11 | Intellia Therapeutics, Inc. | METHODS FOR IN VIVO EDITING OF KLKB1 |
| WO2025030064A1 (en) * | 2023-08-01 | 2025-02-06 | Ionis Pharmaceuticals, Inc. | Compounds and methods for reducing tubb4a expression |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012170945A2 (en) | 2011-06-10 | 2012-12-13 | Isis Pharmaceuticals, Inc. | Methods for modulating kallikrein (klkb1) expression |
| WO2013003808A1 (en) | 2011-06-29 | 2013-01-03 | Isis Pharmaceuticals, Inc. | Methods for modulating kallikrein (klkb1) expression |
| WO2013033230A1 (en) | 2011-08-29 | 2013-03-07 | Isis Pharmaceuticals, Inc. | Oligomer-conjugate complexes and their use |
| JP2016533751A (ja) | 2013-08-28 | 2016-11-04 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | プレカリクレイン(pkk)発現の調節 |
| JP2017518045A (ja) | 2014-05-01 | 2017-07-06 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | Pkk発現を調節するための組成物及び方法 |
Family Cites Families (152)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2654124A1 (de) | 1976-11-29 | 1978-06-01 | Bayer Ag | Derivate des trypsin-kallikrein-inhibitors aus rinderorganen (bpti) mit proteasenhemmwirkung und antiphlogistischer wirkung, ihre herstellung und ihre verwendung als arzneimittel |
| US5118800A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | Oligonucleotides possessing a primary amino group in the terminal nucleotide |
| FR2567892B1 (fr) | 1984-07-19 | 1989-02-17 | Centre Nat Rech Scient | Nouveaux oligonucleotides, leur procede de preparation et leurs applications comme mediateurs dans le developpement des effets des interferons |
| US4751219A (en) | 1985-02-05 | 1988-06-14 | Nederlandse Centrale Organisatie Voor Toegepast-Natuur-Wetenschappelijk Onderzoek | Synthetic glycolipides, a process for the preparation thereof and several uses for these synthetic glycolipides |
| US5166315A (en) | 1989-12-20 | 1992-11-24 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| US5034506A (en) | 1985-03-15 | 1991-07-23 | Anti-Gene Development Group | Uncharged morpholino-based polymers having achiral intersubunit linkages |
| US5506337A (en) | 1985-03-15 | 1996-04-09 | Antivirals Inc. | Morpholino-subunit combinatorial library and method |
| US5185444A (en) | 1985-03-15 | 1993-02-09 | Anti-Gene Deveopment Group | Uncharged morpolino-based polymers having phosphorous containing chiral intersubunit linkages |
| FR2599752B1 (fr) | 1986-06-10 | 1989-11-03 | Transgene Sa | Variants de l'alpha1- antitrypsine utiles notamment comme inhibiteurs de la kallikreine |
| US5591722A (en) | 1989-09-15 | 1997-01-07 | Southern Research Institute | 2'-deoxy-4'-thioribonucleosides and their antiviral activity |
| EP0942000B1 (en) | 1989-10-24 | 2004-06-23 | Isis Pharmaceuticals, Inc. | 2'-Modified oligonucleotides |
| US5670633A (en) | 1990-01-11 | 1997-09-23 | Isis Pharmaceuticals, Inc. | Sugar modified oligonucleotides that detect and modulate gene expression |
| US5646265A (en) | 1990-01-11 | 1997-07-08 | Isis Pharmceuticals, Inc. | Process for the preparation of 2'-O-alkyl purine phosphoramidites |
| GB9009980D0 (en) | 1990-05-03 | 1990-06-27 | Amersham Int Plc | Phosphoramidite derivatives,their preparation and the use thereof in the incorporation of reporter groups on synthetic oligonucleotides |
| DK0455905T3 (da) | 1990-05-11 | 1998-12-07 | Microprobe Corp | Dipsticks til nukleinsyrehybridiseringsassays og fremgangsmåde til kovalent immobilisering af oligonukleotider |
| US6582908B2 (en) | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| ES2103918T3 (es) | 1991-10-17 | 1997-10-01 | Ciba Geigy Ag | Nucleosidos biciclicos, oligonucleotidos, procedimiento para su obtencion y productos intermedios. |
| US5359044A (en) | 1991-12-13 | 1994-10-25 | Isis Pharmaceuticals | Cyclobutyl oligonucleotide surrogates |
| FR2687679B1 (fr) | 1992-02-05 | 1994-10-28 | Centre Nat Rech Scient | Oligothionucleotides. |
| EP0577558A2 (de) | 1992-07-01 | 1994-01-05 | Ciba-Geigy Ag | Carbocyclische Nukleoside mit bicyclischen Ringen, Oligonukleotide daraus, Verfahren zu deren Herstellung, deren Verwendung und Zwischenproduckte |
| EP0673559A1 (en) | 1992-12-14 | 1995-09-27 | Honeywell Inc. | Motor system with individually controlled redundant windings |
| CA2159631A1 (en) | 1993-03-30 | 1994-10-13 | Sanofi | Acyclic nucleoside analogs and oligonucleotide sequences containing them |
| US5801154A (en) | 1993-10-18 | 1998-09-01 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide modulation of multidrug resistance-associated protein |
| US5446137B1 (en) | 1993-12-09 | 1998-10-06 | Behringwerke Ag | Oligonucleotides containing 4'-substituted nucleotides |
| US6057287A (en) | 1994-01-11 | 2000-05-02 | Dyax Corp. | Kallikrein-binding "Kunitz domain" proteins and analogues thereof |
| US5519134A (en) | 1994-01-11 | 1996-05-21 | Isis Pharmaceuticals, Inc. | Pyrrolidine-containing monomers and oligomers |
| US5627053A (en) | 1994-03-29 | 1997-05-06 | Ribozyme Pharmaceuticals, Inc. | 2'deoxy-2'-alkylnucleotide containing nucleic acid |
| US5597909A (en) | 1994-08-25 | 1997-01-28 | Chiron Corporation | Polynucleotide reagents containing modified deoxyribose moieties, and associated methods of synthesis and use |
| US5681940A (en) * | 1994-11-02 | 1997-10-28 | Icn Pharmaceuticals | Sugar modified nucleosides and oligonucleotides |
| US6908903B1 (en) | 1994-12-07 | 2005-06-21 | Aletheon Pharmaceuticals, Inc. | Cluster clearing agents |
| US6172045B1 (en) | 1994-12-07 | 2001-01-09 | Neorx Corporation | Cluster clearing agents |
| US5786328A (en) | 1995-06-05 | 1998-07-28 | Genentech, Inc. | Use of kunitz type plasma kallikrein inhibitors |
| US20030119724A1 (en) | 1995-11-22 | 2003-06-26 | Ts`O Paul O.P. | Ligands to enhance cellular uptake of biomolecules |
| AU1039397A (en) | 1995-11-22 | 1997-06-27 | Johns Hopkins University, The | Ligands to enhance cellular uptake of biomolecules |
| WO2005121371A2 (en) | 2004-06-03 | 2005-12-22 | Isis Pharmaceuticals, Inc. | Double strand compositions comprising differentially modified strands for use in gene modulation |
| US5869637A (en) | 1996-07-22 | 1999-02-09 | Incyte Pharmaceuticals, Inc. | Human Kallikrein |
| US6620916B1 (en) | 1996-09-26 | 2003-09-16 | Ajinomoto Co., Inc. | Modified physiologically active proteins and medicinal compositions containing the same |
| US6770748B2 (en) | 1997-03-07 | 2004-08-03 | Takeshi Imanishi | Bicyclonucleoside and oligonucleotide analogue |
| JP3756313B2 (ja) | 1997-03-07 | 2006-03-15 | 武 今西 | 新規ビシクロヌクレオシド及びオリゴヌクレオチド類縁体 |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| NZ503765A (en) | 1997-09-12 | 2002-04-26 | Exiqon As | Bi-cyclic and tri-cyclic nucleotide analogues |
| US20030228597A1 (en) | 1998-04-13 | 2003-12-11 | Cowsert Lex M. | Identification of genetic targets for modulation by oligonucleotides and generation of oligonucleotides for gene modulation |
| US6300319B1 (en) | 1998-06-16 | 2001-10-09 | Isis Pharmaceuticals, Inc. | Targeted oligonucleotide conjugates |
| US6043352A (en) | 1998-08-07 | 2000-03-28 | Isis Pharmaceuticals, Inc. | 2'-O-Dimethylaminoethyloxyethyl-modified oligonucleotides |
| JP2002543214A (ja) | 1999-05-04 | 2002-12-17 | エクシコン エ/エス | L−リボ−lna類縁体 |
| US6525191B1 (en) | 1999-05-11 | 2003-02-25 | Kanda S. Ramasamy | Conformationally constrained L-nucleosides |
| US6383812B1 (en) | 1999-05-28 | 2002-05-07 | Academia Sinica | Anti liver disease drug R-YEEE and method of synthesizing branched galactose-terminal glycoproteins |
| US8137695B2 (en) | 2006-08-18 | 2012-03-20 | Arrowhead Madison Inc. | Polyconjugates for in vivo delivery of polynucleotides |
| US8541548B2 (en) | 1999-06-07 | 2013-09-24 | Arrowhead Madison Inc. | Compounds and methods for reversible modification of biologically active molecules |
| US20080281041A1 (en) | 1999-06-07 | 2008-11-13 | Rozema David B | Reversibly Masked Polymers |
| US20020082227A1 (en) * | 1999-09-30 | 2002-06-27 | Scott Henry | Use of oligonucleotides for inhibition of complement activation |
| EP1244667B1 (en) | 1999-12-30 | 2006-04-05 | K.U. Leuven Research & Development | Cyclohexene nucleic acids |
| US7491805B2 (en) | 2001-05-18 | 2009-02-17 | Sirna Therapeutics, Inc. | Conjugates and compositions for cellular delivery |
| IL155991A0 (en) | 2000-12-01 | 2003-12-23 | Max Planck Gesellschaft | Rna interference mediating small rna molecules |
| CA2431839A1 (en) | 2000-12-01 | 2002-06-06 | Paul O. P. Ts'o | Conjugates of glycosylated/galactosylated peptide |
| WO2002087541A1 (en) | 2001-04-30 | 2002-11-07 | Protiva Biotherapeutics Inc. | Lipid-based formulations for gene transfer |
| WO2003004602A2 (en) | 2001-07-03 | 2003-01-16 | Isis Pharmaceuticals, Inc. | Nuclease resistant chimeric oligonucleotides |
| US9181551B2 (en) * | 2002-02-20 | 2015-11-10 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| US20100240730A1 (en) | 2002-02-20 | 2010-09-23 | Merck Sharp And Dohme Corp. | RNA Interference Mediated Inhibition of Gene Expression Using Chemically Modified Short Interfering Nucleic Acid (siNA) |
| US20040097441A1 (en) | 2002-11-16 | 2004-05-20 | Isis Pharmaceuticals Inc. | Modulation of NIMA-related kinase 6 expression |
| ES2348230T3 (es) | 2002-06-07 | 2010-12-01 | Dyax Corp. | Prevención y reducción de la isquemia. |
| EP1543019A2 (en) | 2002-09-11 | 2005-06-22 | Santaris Pharma A/S | Modified pna molecules |
| WO2004041889A2 (en) | 2002-11-05 | 2004-05-21 | Isis Pharmaceuticals, Inc. | Polycyclic sugar surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| AU2003290598A1 (en) | 2002-11-05 | 2004-06-03 | Isis Pharmaceuticals, Inc. | Modified oligonucleotides for use in rna interference |
| EP2305813A3 (en) | 2002-11-14 | 2012-03-28 | Dharmacon, Inc. | Fuctional and hyperfunctional sirna |
| WO2004063208A1 (en) | 2003-01-09 | 2004-07-29 | Postech Foundation | New phosphoramidite compounds |
| EP2660322A3 (en) | 2003-04-17 | 2013-11-13 | Alnylam Pharmaceuticals Inc. | Modified iRNA agents |
| US7851615B2 (en) | 2003-04-17 | 2010-12-14 | Alnylam Pharmaceuticals, Inc. | Lipophilic conjugated iRNA agents |
| US7723509B2 (en) | 2003-04-17 | 2010-05-25 | Alnylam Pharmaceuticals | IRNA agents with biocleavable tethers |
| WO2004101619A1 (ja) | 2003-05-15 | 2004-11-25 | Shionogi Co., Ltd. | 機能的糖ペプチドの合理的設計および合成 |
| WO2004106356A1 (en) | 2003-05-27 | 2004-12-09 | Syddansk Universitet | Functionalized nucleotide derivatives |
| EP1730158A2 (en) | 2003-08-06 | 2006-12-13 | Cygene, Inc. | Methods and compositions for in vitro and in vivo use of parallel stranded hairpins and triplex structures as nucleic acid ligands |
| EP1661905B9 (en) | 2003-08-28 | 2012-12-19 | IMANISHI, Takeshi | Novel artificial nucleic acids of n-o bond crosslinkage type |
| US20070191296A1 (en) | 2003-08-30 | 2007-08-16 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with kallikrein 13 (klk13) |
| EP1677822B1 (en) | 2003-09-18 | 2014-04-23 | Isis Pharmaceuticals, Inc. | 4'-thionucleosides and oligomeric compounds |
| WO2005075665A2 (en) | 2004-02-03 | 2005-08-18 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with plasma kallikrein (klkb1) |
| US20050221354A1 (en) | 2004-02-18 | 2005-10-06 | Wyeth | Nucleic acid arrays for monitoring expression profiles of drug target genes |
| WO2005083110A1 (en) | 2004-02-26 | 2005-09-09 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with kallikrein 4 (klk4) |
| CA2566286A1 (en) | 2004-05-11 | 2005-12-08 | Rnai Co., Ltd. | Polynucleotide causing rna interfere and method of regulating gene expression with the use of the same |
| WO2005116265A2 (en) | 2004-05-26 | 2005-12-08 | Wyeth | Probe arrays for expression profiling of rat genes |
| WO2006008002A2 (en) | 2004-07-23 | 2006-01-26 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with kallikrein 1 (klk1) |
| JP5192234B2 (ja) | 2004-08-10 | 2013-05-08 | アルナイラム ファーマシューティカルズ, インコーポレイテッド | 化学修飾オリゴヌクレオチド |
| US20090203132A1 (en) | 2004-09-09 | 2009-08-13 | Swayze Eric E | Pyrrolidinyl groups for attaching conjugates to oligomeric compounds |
| US7235530B2 (en) | 2004-09-27 | 2007-06-26 | Dyax Corporation | Kallikrein inhibitors and anti-thrombolytic agents and uses thereof |
| WO2006047842A2 (en) | 2004-11-08 | 2006-05-11 | K.U. Leuven Research And Development | Modified nucleosides for rna interference |
| US20060185027A1 (en) | 2004-12-23 | 2006-08-17 | David Bartel | Systems and methods for identifying miRNA targets and for altering miRNA and target expression |
| US20060148740A1 (en) | 2005-01-05 | 2006-07-06 | Prosensa B.V. | Mannose-6-phosphate receptor mediated gene transfer into muscle cells |
| JP2008527993A (ja) | 2005-01-24 | 2008-07-31 | アヴァリス・アクチエボラーグ | 特異性及び送達の改善のためのsiRNA分子、shRNA分子又はアンチセンス分子及び機能的実体を含む複合体 |
| US8841259B2 (en) | 2005-02-24 | 2014-09-23 | Joslin Diabetes Center | Compositions and methods for treating vascular permeability |
| CN100585701C (zh) | 2005-05-13 | 2010-01-27 | 松下电器产业株式会社 | 混合声音分离装置 |
| US7569686B1 (en) | 2006-01-27 | 2009-08-04 | Isis Pharmaceuticals, Inc. | Compounds and methods for synthesis of bicyclic nucleic acid analogs |
| CN102908630B (zh) | 2006-01-27 | 2014-11-19 | Isis制药公司 | 6-修饰的双环核酸类似物 |
| US7547684B2 (en) | 2006-05-11 | 2009-06-16 | Isis Pharmaceuticals, Inc. | 5′-modified bicyclic nucleic acid analogs |
| US7666854B2 (en) | 2006-05-11 | 2010-02-23 | Isis Pharmaceuticals, Inc. | Bis-modified bicyclic nucleic acid analogs |
| EP2051707B1 (en) | 2006-07-31 | 2013-07-17 | Activesite Pharmaceuticals, Inc. | Inhibitors of plasma kallikrein |
| US8658211B2 (en) | 2006-08-18 | 2014-02-25 | Arrowhead Madison Inc. | Polyconjugates for in vivo delivery of polynucleotides |
| AU2007299705B2 (en) | 2006-09-22 | 2012-09-06 | Dharmacon, Inc. | Duplex oligonucleotide complexes and methods for gene silencing by RNA interference |
| WO2008101157A1 (en) | 2007-02-15 | 2008-08-21 | Isis Pharmaceuticals, Inc. | 5'-substituted-2'-f modified nucleosides and oligomeric compounds prepared therefrom |
| WO2008098788A2 (en) | 2007-02-16 | 2008-08-21 | Ktb Tumorforschungsgesellschaft Mbh | Receptor and antigen targeted prodrug |
| AU2008242583B2 (en) | 2007-04-23 | 2013-10-10 | Alnylam Pharmaceuticals, Inc. | Glycoconjugates of RNA interference agents |
| WO2008150729A2 (en) | 2007-05-30 | 2008-12-11 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| ES2386492T3 (es) | 2007-06-08 | 2012-08-21 | Isis Pharmaceuticals, Inc. | Análogos de ácidos nucleicos bicíclicos carbocíclicos |
| US20090004140A1 (en) | 2007-06-26 | 2009-01-01 | Yao-Ling Qiu | 4-substituted pyrrolidine as anti-infectives |
| ATE538127T1 (de) | 2007-07-05 | 2012-01-15 | Isis Pharmaceuticals Inc | 6-disubstituierte bicyclische nukleinsäureanaloga |
| JP2010536870A (ja) | 2007-08-21 | 2010-12-02 | ジェンザイム・コーポレーション | カリクレイン阻害剤を用いた治療 |
| CA2695012A1 (en) | 2007-08-23 | 2009-02-26 | Genzyme Corporation | Treatment with kallikrein inhibitors |
| US8095862B2 (en) | 2007-10-10 | 2012-01-10 | International Business Machines Corporation | End-to-end cyclic redundancy check protection for high integrity fiber transfers |
| US8546556B2 (en) | 2007-11-21 | 2013-10-01 | Isis Pharmaceuticals, Inc | Carbocyclic alpha-L-bicyclic nucleic acid analogs |
| JP5635412B2 (ja) | 2007-12-04 | 2014-12-03 | アルニラム ファーマスーティカルズ インコーポレイテッドAlnylam Pharmaceuticals, Inc. | 標的化脂質 |
| MX2010008394A (es) | 2008-01-31 | 2010-11-12 | Alnylam Pharmaceuticals Inc | Metodos optimizados para administracion de arndc focalizando el gen pcsk9. |
| EP2265627A2 (en) | 2008-02-07 | 2010-12-29 | Isis Pharmaceuticals, Inc. | Bicyclic cyclohexitol nucleic acid analogs |
| US8071291B2 (en) | 2008-03-13 | 2011-12-06 | Celera Corporation | Genetic polymorphisms associated with venous thrombosis, methods of detection and uses thereof |
| WO2009142822A2 (en) | 2008-03-26 | 2009-11-26 | Alnylam Pharmaceuticals, Inc. | 2-f modified rna interference agents |
| EP2274425A2 (en) | 2008-04-11 | 2011-01-19 | Alnylam Pharmaceuticals Inc. | Site-specific delivery of nucleic acids by combining targeting ligands with endosomolytic components |
| WO2009143369A2 (en) | 2008-05-22 | 2009-11-26 | Isis Pharmaceuticals, Inc. | Method of preparing nucleosides and analogs thereof without using chromatography |
| US8962580B2 (en) | 2008-09-23 | 2015-02-24 | Alnylam Pharmaceuticals, Inc. | Chemical modifications of monomers and oligonucleotides with cycloaddition |
| WO2010036698A1 (en) | 2008-09-24 | 2010-04-01 | Isis Pharmaceuticals, Inc. | Substituted alpha-l-bicyclic nucleosides |
| WO2010036696A1 (en) | 2008-09-24 | 2010-04-01 | Isis Pharmaceuticals, Inc. | Cyclohexenyl nucleic acid analogs |
| CN111909020A (zh) | 2008-11-10 | 2020-11-10 | 阿布特斯生物制药公司 | 用于递送治疗剂的脂质和组合物 |
| US8637454B2 (en) | 2009-01-06 | 2014-01-28 | Dyax Corp. | Treatment of mucositis with kallikrein inhibitors |
| US20120101148A1 (en) | 2009-01-29 | 2012-04-26 | Alnylam Pharmaceuticals, Inc. | lipid formulation |
| KR20240015723A (ko) | 2009-05-05 | 2024-02-05 | 알닐람 파마슈티칼스 인코포레이티드 | 지질 조성물 |
| CA2764609C (en) | 2009-06-10 | 2018-10-02 | Alnylam Pharmaceuticals, Inc. | Improved cationic lipid of formula i |
| CN102458366B (zh) | 2009-06-15 | 2015-02-11 | 阿尔尼拉姆医药品有限公司 | 靶向pcsk9基因的脂质配制的dsrna |
| EP2462153B1 (en) | 2009-08-06 | 2015-07-29 | Isis Pharmaceuticals, Inc. | Bicyclic cyclohexose nucleic acid analogs |
| US8552163B2 (en) | 2009-09-25 | 2013-10-08 | Johns Hopkins University | Liver-targeting agents and their synthesis |
| TWI388338B (zh) | 2009-10-26 | 2013-03-11 | Iner Aec Executive Yuan | 對聚合醣鏈進行放射標誌以作為肝受體造影劑之方法 |
| TWI391144B (zh) | 2009-10-26 | 2013-04-01 | Iner Aec Executive Yuan | 一種定量肝殘餘功能的檢驗方法與其新穎肝受體造影檢驗藥劑 |
| WO2011072290A2 (en) | 2009-12-11 | 2011-06-16 | The Regents Of The University Of Michigan | Targeted dendrimer-drug conjugates |
| CA2783801A1 (en) | 2009-12-18 | 2011-06-23 | Activesite Pharmaceuticals, Inc. | Prodrugs of inhibitors of plasma kallikrein |
| RS62853B1 (sr) | 2010-01-06 | 2022-02-28 | Takeda Pharmaceuticals Co | Proteini koji vezuju kalikrein plazme |
| US9198972B2 (en) | 2010-01-28 | 2015-12-01 | Alnylam Pharmaceuticals, Inc. | Monomers and oligonucleotides comprising cycloaddition adduct(s) |
| CN102869774B (zh) | 2010-02-24 | 2018-02-09 | 箭头研究公司 | 用于靶向递送siRNA的组合物 |
| WO2011115818A1 (en) | 2010-03-17 | 2011-09-22 | Isis Pharmaceuticals, Inc. | 5'-substituted bicyclic nucleosides and oligomeric compounds prepared therefrom |
| WO2011120053A1 (en) | 2010-03-26 | 2011-09-29 | Mersana Therapeutics, Inc. | Modified polymers for delivery of polynucleotides, method of manufacture, and methods of use thereof |
| US20130109817A1 (en) | 2010-03-26 | 2013-05-02 | Mersana Therapeutics, Inc. | Modified Polymers for Delivery of Polynucleotides, Method of Manufacture, and Methods of Use Thereof |
| WO2011163121A1 (en) | 2010-06-21 | 2011-12-29 | Alnylam Pharmaceuticals, Inc. | Multifunctional copolymers for nucleic acid delivery |
| AU2011302152B2 (en) | 2010-09-15 | 2015-06-11 | Alnylam Pharmaceuticals, Inc. | Modified iRNA agents |
| EP2640400A4 (en) | 2010-11-19 | 2016-01-20 | Sirna Therapeutics Inc | (POLY) AMID POLYMERS FOR THE ADMINISTRATION OF OLIGONUCLEOTIDES |
| US8501930B2 (en) | 2010-12-17 | 2013-08-06 | Arrowhead Madison Inc. | Peptide-based in vivo siRNA delivery system |
| MX346144B (es) | 2010-12-17 | 2017-03-09 | Arrowhead Res Corp * | Porcion activadora del modulador farmacocinetico del agregado de galactosa para arnsi. |
| CA2976966C (en) | 2010-12-29 | 2021-11-09 | F. Hoffmann-La Roche Ag | Small molecule conjugates for intracellular delivery of nucleic acids |
| WO2012170947A2 (en) | 2011-06-10 | 2012-12-13 | Isis Pharmaceuticals, Inc. | Methods for modulating factor 12 expression |
| KR102540778B1 (ko) | 2011-06-21 | 2023-06-07 | 알닐람 파마슈티칼스 인코포레이티드 | 아포리포단백질 c-iii(apoc3) 유전자의 발현 억제를 위한 조성물 및 방법 |
| BR112014004585A2 (pt) | 2011-08-26 | 2017-06-13 | Arrowhead Res Corp | polímeros de poli(éster vinílico) para liberação de ácido nucleico in vivo |
| RU2678807C2 (ru) | 2011-11-18 | 2019-02-01 | Элнилэм Фармасьютикалз, Инк. | СРЕДСТВА ДЛЯ РНКи, КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С ТРАНСТИРЕТИНОМ (TTR) |
| US9133461B2 (en) * | 2012-04-10 | 2015-09-15 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for inhibiting expression of the ALAS1 gene |
| TWI595885B (zh) | 2012-05-02 | 2017-08-21 | 喜納製藥公司 | 包含四galnac之新穎結合物及傳送寡核苷酸之方法 |
| US20150299696A1 (en) | 2012-05-02 | 2015-10-22 | Sirna Therapeutics, Inc. | SHORT INTERFERING NUCLEIC ACID (siNA) COMPOSITIONS |
| WO2013188876A2 (en) * | 2012-06-15 | 2013-12-19 | Joslin Diabetes Center, Inc. | Methods for modulating kallikrein (klkb1) expression |
| CN117126846A (zh) | 2012-11-15 | 2023-11-28 | 罗氏创新中心哥本哈根有限公司 | 寡核苷酸缀合物 |
| DK2991656T3 (da) | 2013-05-01 | 2020-03-23 | Ionis Pharmaceuticals Inc | Sammensætninger og fremgangsmåder til modulering af apolipoprotein c-iii-ekspression |
-
2015
- 2015-05-01 WO PCT/US2015/028765 patent/WO2015168532A2/en not_active Ceased
- 2015-05-01 BR BR112016022855-3A patent/BR112016022855B1/pt active IP Right Grant
- 2015-05-01 CN CN201580020831.8A patent/CN106232125B/zh active Active
- 2015-05-01 HU HUE15786489A patent/HUE052709T2/hu unknown
- 2015-05-01 MX MX2016014140A patent/MX377141B/es active IP Right Grant
- 2015-05-01 AU AU2015252917A patent/AU2015252917B2/en active Active
- 2015-05-01 US US15/308,027 patent/US10294477B2/en active Active
- 2015-05-01 RU RU2016146818A patent/RU2703411C2/ru active
- 2015-05-01 EP EP15786489.3A patent/EP3137091B1/en active Active
- 2015-05-01 JP JP2016565502A patent/JP6665111B2/ja active Active
- 2015-05-01 EP EP20211051.6A patent/EP3862362A3/en active Pending
- 2015-05-01 CA CA2943705A patent/CA2943705A1/en active Pending
- 2015-05-01 KR KR1020167032651A patent/KR102366078B1/ko active Active
- 2015-05-01 DK DK15786489.3T patent/DK3137091T3/da active
- 2015-05-01 EP EP25156688.1A patent/EP4534092A3/en active Pending
- 2015-05-01 ES ES15786489T patent/ES2849600T3/es active Active
-
2016
- 2016-09-16 IL IL247862A patent/IL247862B/en active IP Right Grant
- 2016-10-27 MX MX2020011749A patent/MX2020011749A/es unknown
-
2019
- 2019-03-25 US US16/363,969 patent/US20200056185A1/en not_active Abandoned
- 2019-12-23 AU AU2019284028A patent/AU2019284028A1/en not_active Withdrawn
-
2020
- 2020-02-18 JP JP2020025372A patent/JP7127076B2/ja active Active
- 2020-03-04 IL IL273058A patent/IL273058A/en unknown
- 2020-05-11 US US15/929,573 patent/US11613752B2/en active Active
-
2022
- 2022-08-17 JP JP2022129902A patent/JP2022169653A/ja active Pending
-
2024
- 2024-08-26 US US18/158,290 patent/US20240401054A1/en active Pending
-
2025
- 2025-07-07 JP JP2025114273A patent/JP2025148418A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012170945A2 (en) | 2011-06-10 | 2012-12-13 | Isis Pharmaceuticals, Inc. | Methods for modulating kallikrein (klkb1) expression |
| WO2013003808A1 (en) | 2011-06-29 | 2013-01-03 | Isis Pharmaceuticals, Inc. | Methods for modulating kallikrein (klkb1) expression |
| WO2013033230A1 (en) | 2011-08-29 | 2013-03-07 | Isis Pharmaceuticals, Inc. | Oligomer-conjugate complexes and their use |
| JP2016533751A (ja) | 2013-08-28 | 2016-11-04 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | プレカリクレイン(pkk)発現の調節 |
| JP2017518045A (ja) | 2014-05-01 | 2017-07-06 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | Pkk発現を調節するための組成物及び方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7127076B2 (ja) | Pkk発現を調節するための組成物及び方法 | |
| US11312964B2 (en) | Compositions and methods for modulating growth hormone receptor expression | |
| JP6637442B2 (ja) | 補体b因子発現を調節するための組成物及び方法 | |
| JP2020074784A (ja) | アンジオポエチン様因子3発現を調節するための組成物及び方法 | |
| HK1234330A1 (en) | Conjugates of modified antisense oligonucleotides and their use for modulating pkk expression | |
| HK1234330B (en) | Conjugates of modified antisense oligonucleotides and their use for modulating pkk expression | |
| NZ764037A (en) | Compositions and methods for modulating growth hormone receptor expression |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200306 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200306 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200729 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210421 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210701 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211021 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220107 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220316 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220706 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220720 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220817 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7127076 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |