JP7112331B2 - オキシステロールおよびその使用方法 - Google Patents
オキシステロールおよびその使用方法 Download PDFInfo
- Publication number
- JP7112331B2 JP7112331B2 JP2018551145A JP2018551145A JP7112331B2 JP 7112331 B2 JP7112331 B2 JP 7112331B2 JP 2018551145 A JP2018551145 A JP 2018551145A JP 2018551145 A JP2018551145 A JP 2018551145A JP 7112331 B2 JP7112331 B2 JP 7112331B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- pharmaceutically acceptable
- disorders
- acceptable salt
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/575—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of three or more carbon atoms, e.g. cholane, cholestane, ergosterol, sitosterol
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07J—STEROIDS
- C07J9/00—Normal steroids containing carbon, hydrogen, halogen or oxygen substituted in position 17 beta by a chain of more than two carbon atoms, e.g. cholane, cholestane, coprostane
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/58—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids containing heterocyclic rings, e.g. danazol, stanozolol, pancuronium or digitogenin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07J—STEROIDS
- C07J17/00—Normal steroids containing carbon, hydrogen, halogen or oxygen, having an oxygen-containing hetero ring not condensed with the cyclopenta(a)hydrophenanthrene skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07J—STEROIDS
- C07J43/00—Normal steroids having a nitrogen-containing hetero ring spiro-condensed or not condensed with the cyclopenta(a)hydrophenanthrene skeleton
- C07J43/003—Normal steroids having a nitrogen-containing hetero ring spiro-condensed or not condensed with the cyclopenta(a)hydrophenanthrene skeleton not condensed
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Epidemiology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Anesthesiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Steroid Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本願は、2016年4月1日に出願された米国出願第62/317,002号に対する優先権を主張し、この米国仮出願の全体が、参照によって本明細書中に組み込まれる。
NMDAレセプターは、NR1、NR2、および/またはNR3サブユニットを含むヘテロメリック複合体であり、外因性リガンドおよび内因性リガンドのための異なる認識部位を有する。これらの認識部位は、グリシンのための結合部位ならびにグルタミン酸アゴニストおよびモジュレーターを含む。NMDAレセプターは、末梢組織およびCNSにおいて発現され、ここで興奮性シナプス伝達に関与する。これらのレセプターを活性化すると、状況によってはシナプス可塑性に寄与し、他の場合には興奮毒性に寄与する。これらのレセプターは、グルタメートとグリシンとの結合後にCa2+を受け入れるリガンド依存性イオンチャネルであり、そして興奮性神経伝達および正常なCNS機能にとって基本的である。これらのレセプターの正のモジュレーターは、認知増強剤として、およびグルタミン酸作動性伝達が低下または欠損している精神障害の治療において潜在的な臨床用途を有する治療剤として有用であり得る(例えば、Horak et al.,J.of Neuroscience,2004,24(46),10318-10325を参照のこと)。対照的に、これらのレセプターの負のモジュレーターは、グルタミン酸作動性伝達が病理学的に増加している精神医学的障害(例えば、治療抵抗性うつ病)の治療において潜在的な臨床用途を有する治療薬として有用であり得る。
オキシステロールは、NMDAレセプター機能のモジュレーターである、コレステロールアナログである。NMDAの発現および機能に関連する状態の予防および治療のためにNMDAレセプターを調節する新規なオキシステロールが必要とされている。本明細書に記載の化合物、組成物および方法は、この目的に向けられている。
本明細書中で、広範な障害(NMDAにより媒介される障害が挙げられるが、これに限定されない)を予防および/または処置するために有用な、新規なオキシステロールが提供される。さらに、本発明の化合物を含有する薬学的組成物、ならびにこれらの使用および処置の方法が提供される。
1つの局面において、式(I-A):
1つの局面において、式(I-B):
いくつかの実施形態において、この化合物は、式(II-A)、式(II-B)、または式(II-C):
いくつかの実施形態において、pは、0、1、または2から選択される整数である。いくつかの実施形態において、pは0である。いくつかの実施形態において、pは1である。いくつかの実施形態において、pは1であり、そしてXはハロゲンである。
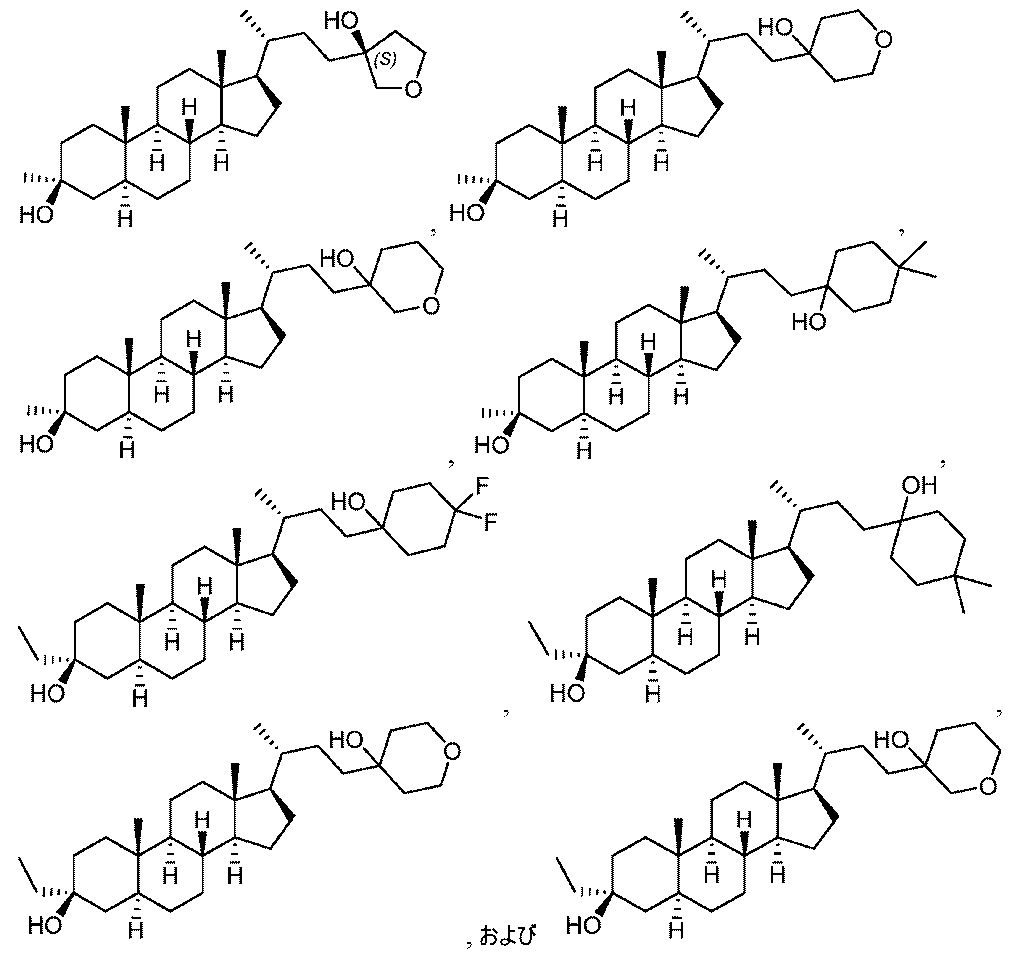
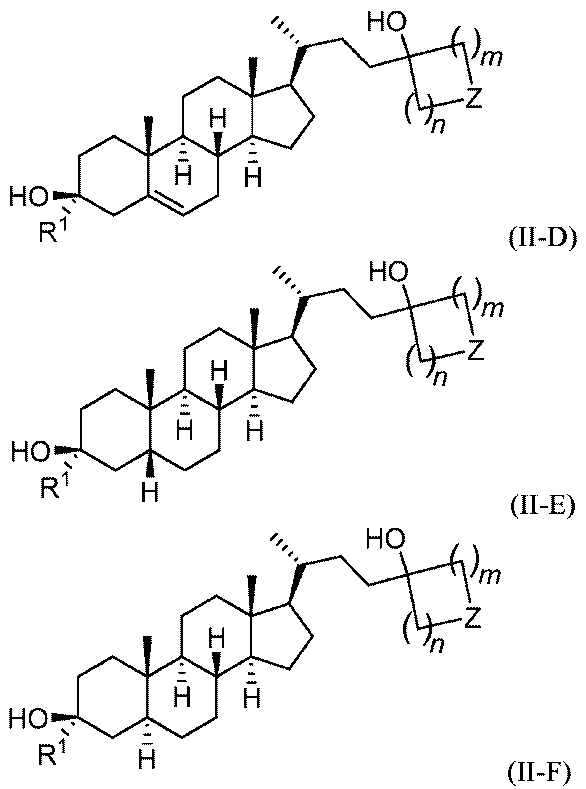
いくつかの実施形態において、この化合物は、式(II-D)、式(II-E)、または式(II-F):
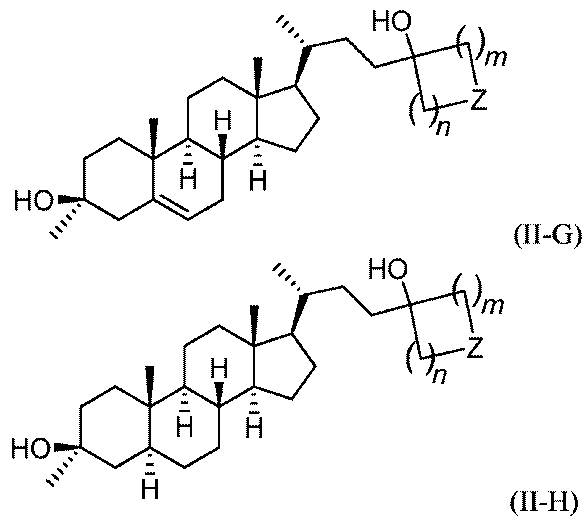
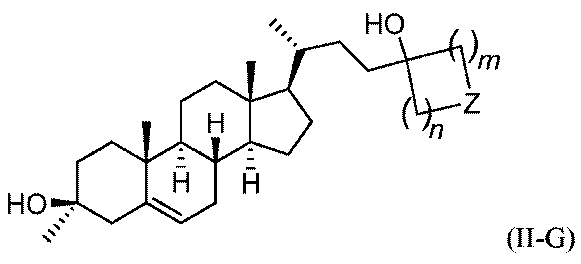
いくつかの実施形態において、この化合物は、式(II-G)または式(II-H):
いくつかの実施形態において、この化合物は、式(II-I)または式(II-J):
いくつかの実施形態において、R1はC1~6アルキルである。いくつかの実施形態において、R1は、メチルまたはエチルである。いくつかの実施形態において、R1は、-CH3、-CF3、-CH2CH3である。
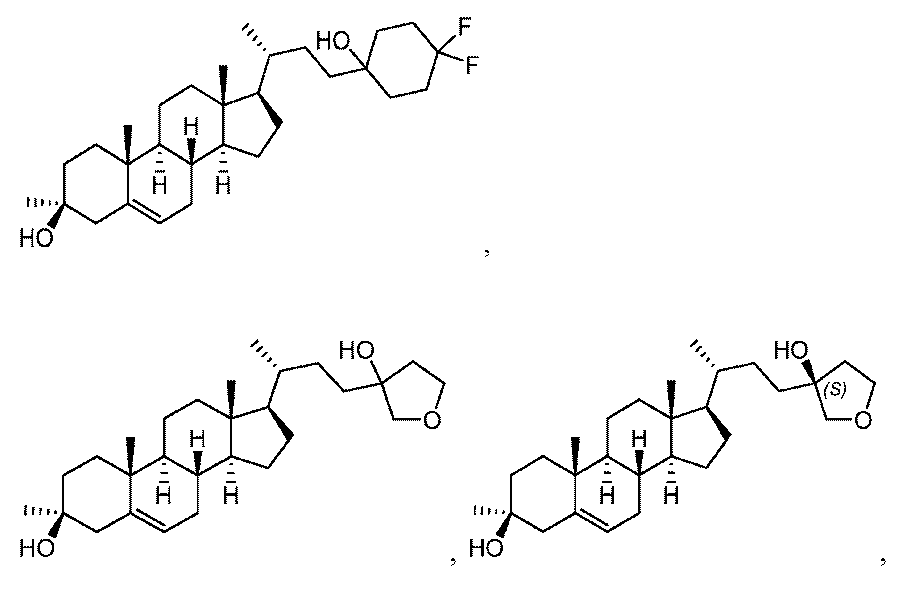
いくつかの実施形態において、Zは、-C(RA)2-、-O-、または-NRB-である。あるいは、Zは-CH2-である。あるいは、ZはOである。あるいは、Zは-NRB-であり、ここでRBは、-NH-、-N-(C1~C4アルキル)-、または-NC(O)-(C1-C4アルキル)である。いくつかの実施形態において、RAはハロゲン(例えば、-F)である。いくつかの実施形態において、Zは、-CH2-、-CF2-、または-C(CH3)2-である。
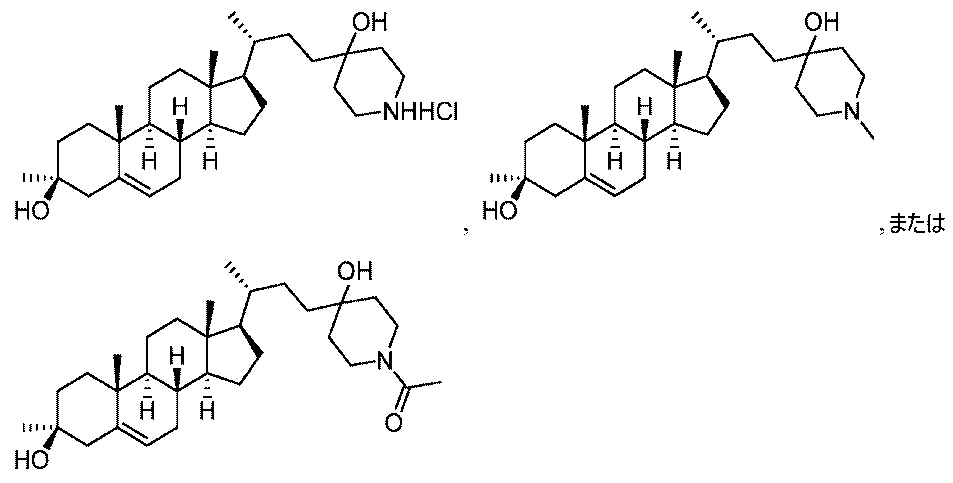
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、Zは、-O-または-NRB-である。
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、Zは、-NH-、-NMe-、または-NAc-である。
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、Zは-CH2-である。いくつかの実施形態において、Zは-C(CH3)2-である。いくつかの実施形態において、Zは-CF2-である。いくつかの実施形態において、mは1であり、nは2であり、そしてZは-O-である。いくつかの実施形態において、mは2であり、そしてnは2である。いくつかの実施形態において、mは3であり、そしてnは1である。いくつかの実施形態において、mは3であり、nは1であり、そしてZは-O-である。いくつかの実施形態において、mは2であり、nは2であり、そしてZは、-O-または-NRB-である。
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
別の局面において、鎮静または麻酔を誘導する方法が本明細書中に提供され、その方法は、有効量の本明細書中に記載されるような化合物(例えば、式(I-A) (I-B)、(II-A)、(II-B)、(II-C)、(II-D)、(II-E)、(II-F)、(II-G)、(II-H)、(II-I)、もしくは(II-J))、またはその薬学的に受容可能な塩あるいはその薬学的組成物を被験体に投与することを含む。
定義
化学的定義
他の定義
略語
上に一般的に記載されたように、本発明は、広範な障害(NMDAにより媒介される障害が挙げられるが、これに限定されない)を予防および/または処置するために有用な、新規なオキシステロールを提供する。
化合物
1つの局面において、式(I-A):
1つの局面において、式(I-B):
いくつかの実施形態において、この化合物は、式(II-A)、式(II-B)、または式(II-C):
いくつかの実施形態において、pは、0、1、または2から選択される整数である。いくつかの実施形態において、pは0である。いくつかの実施形態において、pは1である。いくつかの実施形態において、pは1であり、そしてXはハロゲンである。
いくつかの実施形態において、この化合物は、式(II-D)、式(II-E)、または式(II-F):
いくつかの実施形態において、この化合物は、式(II-G)または式(II-H):
いくつかの実施形態において、この化合物は、式(II-I)または式(II-J):
いくつかの実施形態において、R1はC1~6アルキルである。いくつかの実施形態において、R1は、メチルまたはエチルである。いくつかの実施形態において、R1は、-CH3、-CF3、-CH2CH3である。
いくつかの実施形態において、Zは、-C(RA)2-、-O-、または-NRB-である。あるいは、Zは-CH2-である。あるいは、ZはOである。あるいは、Zは-NRB-であり、ここでRBは、-NH-、-N-(C1~C4アルキル)-、または-NC(O)-(C1~C4アルキル)である。いくつかの実施形態において、RAはハロゲン(例えば、-F)である。いくつかの実施形態において、Zは、-CH2-、-CF2-、または-C(CH3)2-である。
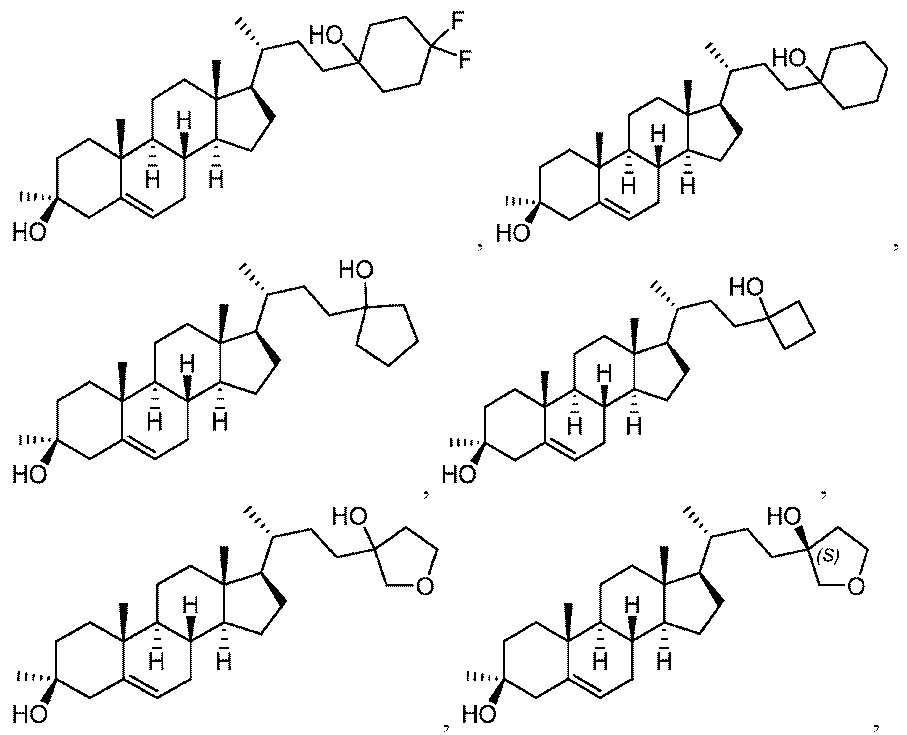
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、Zは、-O-または-NRB-である。
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、Zは、-NH-、-NMe-、または-NAc-である。
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、Zは-CH2-である。いくつかの実施形態において、Zは-C(CH3)2-である。いくつかの実施形態において、Zは-CF2-である。いくつかの実施形態において、mは1であり、nは2であり、そしてZは-O-である。いくつかの実施形態において、mは2であり、そしてnは2である。いくつかの実施形態において、mは3であり、そしてnは1である。いくつかの実施形態において、mは3であり、nは1であり、そしてZは-O-である。いくつかの実施形態において、mは2であり、nは2であり、そしてZは-O-または-NRB-である。
いくつかの実施形態において、この化合物は:
いくつかの実施形態において、この化合物は:
薬学的組成物
処置の方法および使用
疾患および障害
ステロール合成障害を処置する方法が本明細書中に記載される。例示的な障害は、本明細書中に記載される。その方法は、被験体、例えば、SLOSなどのステロール合成障害に罹患している被験体に、NMDAレセプター調節化合物を投与することを含む。例示的な化合物は、本明細書中に記載される。
ステロール合成障害
スミス・レムリ・オピッツ症候群
デスモステロローシス
シトステロール血症
脳腱黄色腫症(CTX)
メバロン酸キナーゼ欠損症症候群(MKD)
SC4MOL遺伝子変異(SMO欠損症)
ニーマン・ピック病
自閉症
フェニルケトン尿症に関連する障害
代替の実施形態
代替の実施形態において、本明細書中に記載される化合物(例えば、式(I-A) (I-B)、(II-A)、(II-B)、(II-C)、(II-D)、(II-E)、(II-F)、(II-G)、(II-H)、(II-I)、または(II-J)の化合物)はまた、1つまたはそれより多くの同位体置換を含み得る。いくつかの実施形態において、水素は、2H(Dすなわちジュウテリウム)、または3H(Tすなわちトリチウム)であってもよい。いくつかの実施形態において、炭素は、13Cまたは14Cであってもよい。いくつかの実施形態において、酸素は18O)であってもよい。いくつかの実施形態において、窒素は15Nであってもよい。さらなる実施形態において、化合物は、1つまたはそれより多くの同位体置換を含み得、同位体置換の部位が、特定の同位体で富化されている。例えば、本明細書中に記載される化合物は、2Hまたは3Hとして富化された水素、13Cまたは14Cとして富化された炭素、18Oとして富化された酸素、あるいは15Nとして富化された窒素を含み得る。
材料および方法
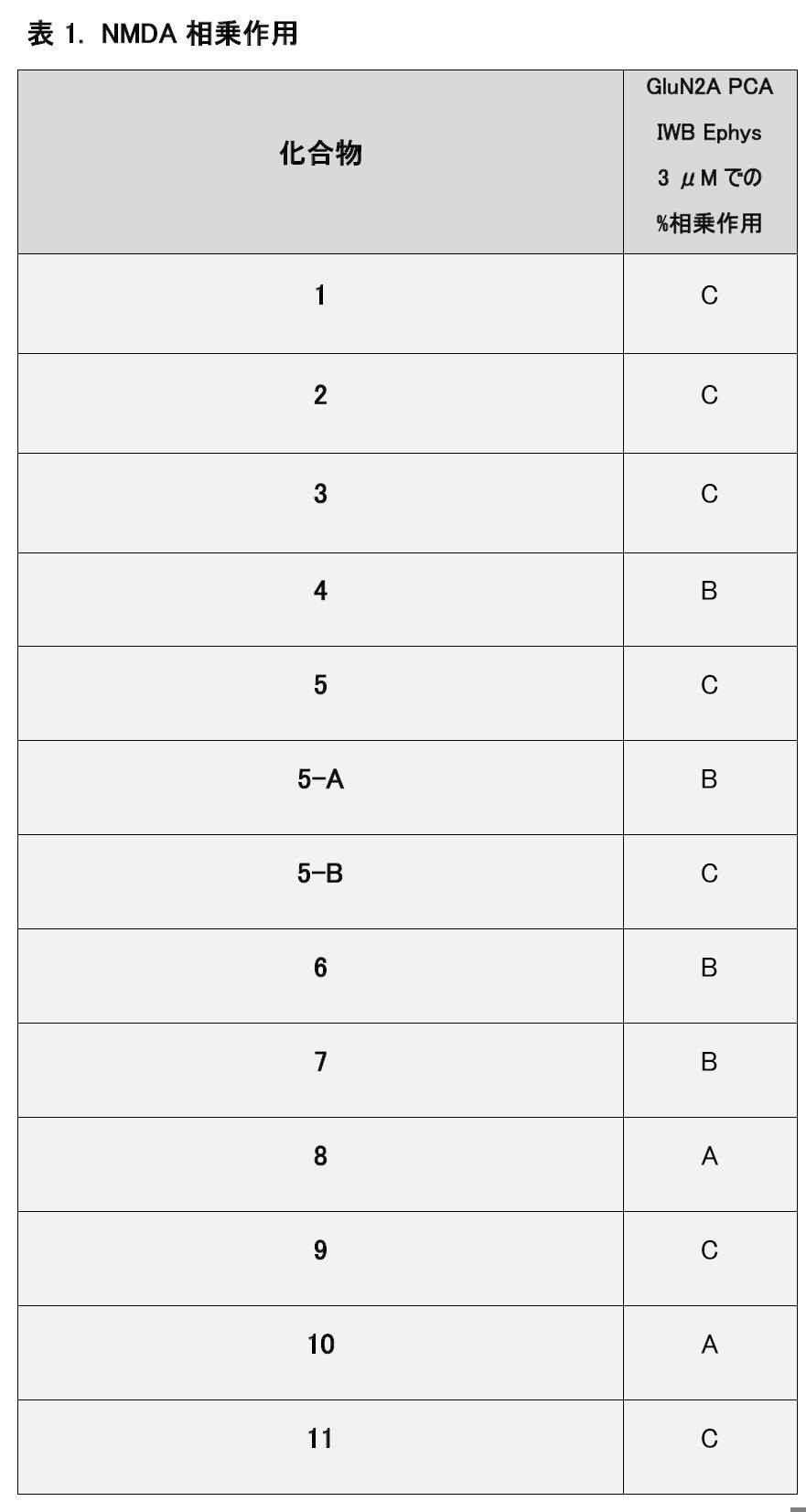
NMDA相乗作用
哺乳動物細胞のホールセルパッチクランプ(Ionworks Barracuda (IWB)
ホールセルパッチクランプ技術を使用して、哺乳動物細胞において発現されたGlunN1/GluN2Aグルタメートレセプターに対する化合物の効果を調査した。その結果を表1に示す。
HEK293細胞を、アデノウイルス5 DNAで形質転換させ、そしてヒトGRIN1/GRIN2A遺伝子をコードするcDNAでトランスフェクトした。安定なトランスフェクション物を、発現プラスミドに組み込んだG418およびゼオシン(Zeocin)抵抗性遺伝子を使用して、そして淘汰圧を培地中のG418およびゼオシンで維持して、選択した。細胞を、10%のウシ胎仔血清、100μg/mlのペニシリンGナトリウム、100μg/mlの硫酸ストレプトマイシン、100μg/mlのゼオシン、5μg/mlのブラストサイジンおよび500μg/mlのG418を補充したダルベッコ改変イーグル培地/栄養分混合物(D-MEM/F-12)中で培養した。
試験物品の効果を、8点濃度応答フォーマット(4連のウェル/濃度)で評価した。全ての試験溶液およびコントロール溶液が、0.3%のDMSOおよび0.01%のKolliphor(登録商標)EL(C5135,Sigma)を含んだ。試験物品の処方物を、384ウェルの化合物プレートに、自動液体ハンドリングシステム(SciClone ALH3000,Caliper LifeScienses)を使用して装填した。測定を、Ion Works Barracudaプラットフォームを使用して、この手順に従って行った:
電気生理学的手順:
a)細胞内溶液(mM):50mMのCsCl、90mMのCsF、2mMのMgCl2、5mMのEGTA、10mMのHEPES。CsOHでpH7.2に調整。
b)細胞外溶液、HB-PS(mMでの組成):NaCl,137;KCl,1.0;CaCl2,5;HEPES,10;グルコース,10;pHをNaOHで7.4に調整(使用まで冷蔵)。
c)保持電位:-70mV、アゴニスト/PAM増幅中の電位:-40mV。
記録手順:
a)細胞外バッファは、PPCプレートウェルに装填される(1ウェルあたり11μL)。細胞懸濁物は、PPC平面電極のウェルにピペットで入れられる(1ウェルあたり9μL)。
b)ホールセル記録構成は、パッチ穿孔により確立され、膜電流は、オンボードパッチクランプ増幅器によって記録される。
c)2回の記録(走査)が行われる。1回目は、試験物品単独の増幅前の間(増幅前の持続時間-5分間)であり、そして2回目は、試験物品およびアゴニスト(EC20 L-グルタメートおよび30μMのグリシン)の同時適用中であり、試験物品の正の調節効果を検出する。
試験物品の投与:1回目の予備適用は、20μLの、2倍に濃縮した試験物品溶液の添加からなり、そして2回目は、20μLの1倍濃度の試験物品およびアゴニストの10μL/sでの添加からなる(2秒間の全適用時間)。
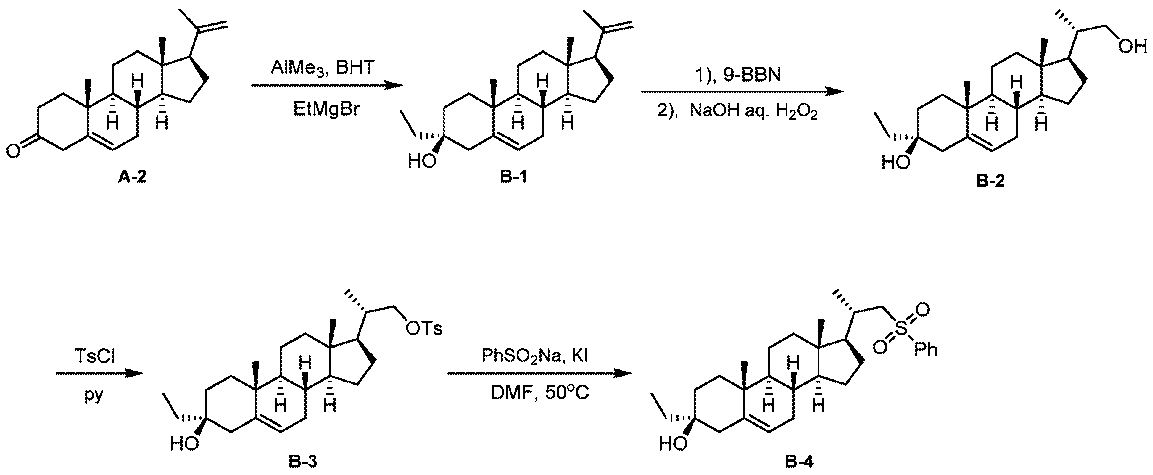
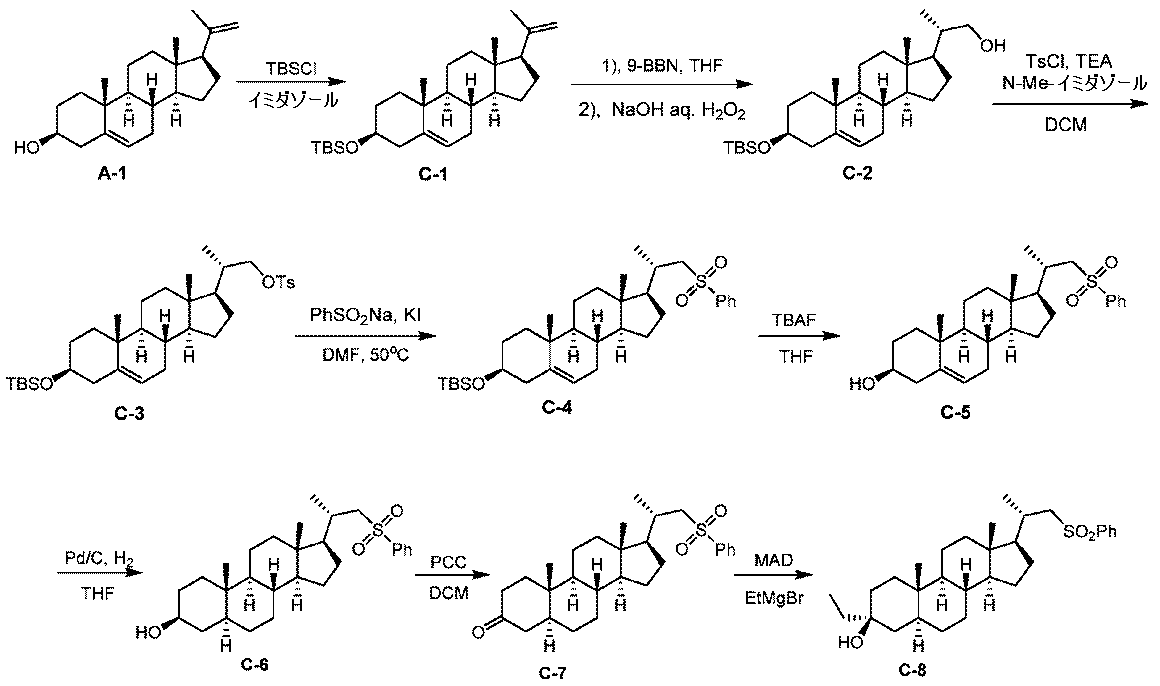
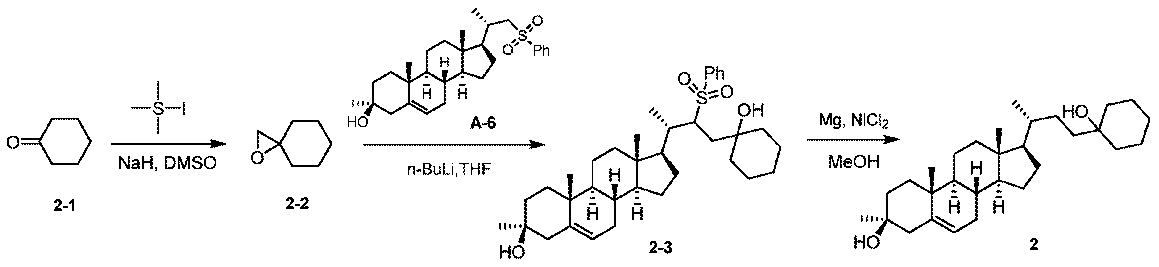
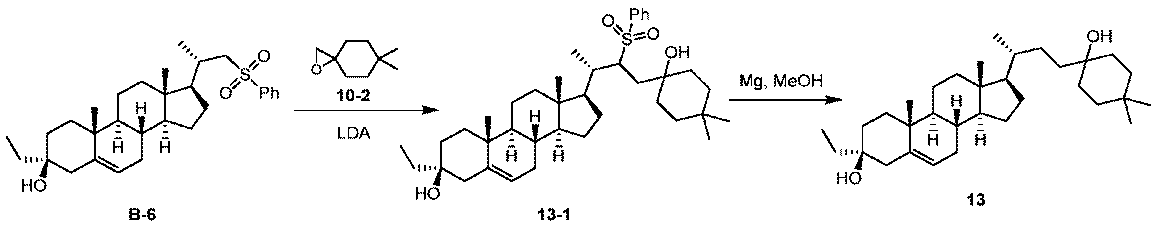
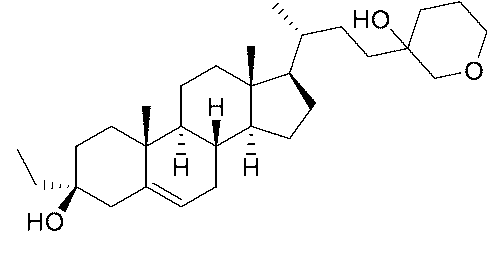
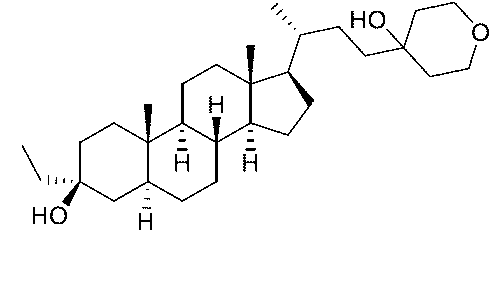
実施例1。中間体A-6の合成。
1H NMR (400 MHz, CDCl3) δ 5.40-5.30 (m, 1H), 4.85 (s, 1H), 4.71 (s, 1H), 3.60-3.50 (m, 1H), 2.36-2.18 (m, 2H), 2.08-1.96 (m, 2H), 1.92-1.78 (m, 3H), 1.76 (s, 3H), 1.73-1.48 (m, 9H), 1.38-1.03 (m, 4H), 1.01 (s, 3H), 1.00-0.91 (m, 1H), 0.58 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 5.35-5.28 (m, 1H), 4.85 (s, 1H), 4.71 (s, 1H), 2.48-2.37 (m, 1H), 2.08-1.94 (m, 3H), 1.92-1.85 (m, 1H), 1.82-1.33 (m, 14H), 1.29-1.08 (m, 7H), 1.02 (s, 3H), 1.00-0.93 (m, 1H), 0.59 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 5.31-5.29 (m, 1H), 3.65-3.63 (m, 1H), 3.38-3.37 (m, 1H), 2.42 (d, J = 12.4, 1H), 2.05-1.92 (m, 3H), 1.88-1.63 (m, 4H), 1.63-1.40 (m, 8H), 1.40-0.90 (m, 16H), 0.70 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 7.78 (d, J = 8.0 Hz, 2H), 7.34 (d, J = 8.4 Hz, 2H), 5.29-5.28 (m, 1H), 3.96 (dd, J = 3.2, 9.6 Hz, 1H), 3.79 (dd, J = 6.4, 9.2 Hz, 1H), 2.45 (s, 3H), 2.41 (d, J = 13.6 Hz, 1H), 1.99-1.91 (m, 3H), 1.77-1.39 (m, 11H), 1.26-0.86 (m, 16H), 0.64 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 7.91 (d, J = 7.2 Hz, 2H), 7.69-7.61 (m, 1H), 7.60-7.50 (m, 2H), 5.28-5.27 (m, 1H), 3.14 (d, J = 14.0 Hz, 1H), 2.85 (dd, J = 9.6, 14.0 Hz, 1H), 2.41 (d, J = 12.8 Hz, 1H), 2.17-2.03 (m, 1H), 2.02-1.87 (m, 3H), 1.81-1.65 (m, 3H), 1.60-1.32 (m, 8H), 1.25-0.85 (m, 15H), 0.65 (s, 3H)。LCMS 3.0分間のクロマトグラフィーでRt = 2.057分、30~90 AB、MS ESI C29H41O2S [M+H-H2O]+についての計算値453、実測値453。
1H NMR (400 MHz, CDCl3) δ 5.35-5.25 (m, 1H), 4.85 (s, 1H), 4.71 (s, 1H), 2.40-2.30 (m, 1H), 2.10-1.60 (m, 14H), 1.50-0.75 (m, 17H), 0.58 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 5.31-5.29 (m, 1H), 3.70-3.60 (m, 1H), 3.40-3.30 (m, 1H), 2.40-2.30 (m, 1H), 2.10-1.90 (m, 3H), 1.75-1.65 (m, 1H), 1.65-1.55 (m, 2H), 1.50-1.26 (m, 6H), 1.25-0.95 (m, 15H), 0.90-0.75 (m, 6H), 0.70 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 7.78 (d, J = 8.4 Hz, 2H), 7.34 (d, J = 8.0 Hz, 2H), 5.30-5.20 (m, 1H), 4.00-3.90 (m, 1H), 3.80-3.70 (m, 1H), 2.45 (s, 3H), 2.40-2.30 (m, 1H), 2.10-1.90 (m, 3H), 1.75-1.60 (m, 6H), 1.55-1.30 (m, 5H), 1.25-0.95 (m, 13H), 0.90-0.80 (m, 5H), 0.65-0.50 (m, 3H)。
1H NMR (400 MHz, CDCl3) δ 7.95-7.88 (m, 2H), 7.68-7.62 (m, 1H), 7.61-7.53 (m, 2H), 5.30-5.22 (m, 1H), 3.20-3.08 (m, 1H), 2.91-2.79 (m, 1H), 2.40-2.30 (m, 1H), 2.09-1.87 (m, 4H), 1.74-1.60 (m, 4H), 1.50-1.36 (m, 7H), 1.24-0.98 (m, 13H), 0.90-0.80 (m, 4H), 0.65 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 5.38-5.28 (m, 1H), 4.85 (s, 1H), 4.71 (s, 1H), 3.57-3.41 (m, 1H), 2.33-2.11 (m, 2H), 2.10-1.94 (m, 2H), 1.90-1.61 (m, 8H), 1.60-1.38 (m, 6H), 1.28-1.03 (m, 4H), 1.00 (s, 3H), 0.98-0.91 (m, 1H), 0.89 (s, 9H), 0.58 (s, 3H), 0.06 (s, 6H)。
1H NMR (400 MHz, CDCl3) δ 5.40-5.23 (m, 1H), 3.70-3.60 (m, 1H), 3.55-3.42 (m, 1H), 3.41-3.31 (m, 1H), 2.31-2.20 (m, 1H), 2.20-2.11 (m, 1H), 2.06-1.91 (m, 2H), 1.89-1.67 (m, 3H), 1.65-1.39 (m, 7H), 1.38-1.08 (m, 6H), 1.05 (d, J = 6.4 Hz, 3H), 1.00 (s, 3H), 0.99-0.91 (m, 2H), 0.88 (s, 9H), 0.70 (s, 3H), 0.05 (s, 6H)。
1H NMR (400 MHz, CDCl3) δ 7.78 (d, J = 8.4 Hz, 2H), 7.34 (d, J = 8.0 Hz, 2H), 5.37-5.25 (m, 1H), 3.96 (dd, J = 2.8, 9.2 Hz, 1H), 3.79 (dd, J = 6.4, 9.2 Hz, 1H), 3.53-3.41 (m, 1H), 2.45 (s, 3H), 2.32-2.20 (m, 1H), 2.20-2.11 (m, 1H), 2.01-1.88 (m, 2H), 1.84-1.61 (m, 4H), 1.56-1.31 (m, 6H), 1.23-1.02 (m, 5H), 1.02-0.95 (m, 7H), 0.93-0.90 (m, 1H), 0.88 (s, 9H), 0.63 (s, 3H), 0.05 (s, 6H)。
1H NMR (400 MHz, CDCl3) δ 8.00-7.82 (m, 2H), 7.69-7.61 (m, 1H), 7.60-7.49 (m, 2H), 5.37-5.20 (m, 1H), 3.57-3.39 (m, 1H), 3.14 (d, J = 14.0 Hz, 1H), 2.85 (dd, J = 9.6, 14.0 Hz, 1H), 2.35-2.05 (m, 3H), 2.02-1.88 (m, 2H), 1.85-1.62 (m, 3H), 1.61-1.32 (m, 7H), 1.29-0.91 (m, 12H), 0.88 (s, 9H), 0.65 (s, 3H), 0.05 (s, 6H)。
1H NMR (400 MHz, CDCl3) δ 7.98-7.88 (m, 2H), 7.69-7.61 (m, 1H), 7.60-7.51 (m, 2H), 5.40-5.28 (m, 1H), 3.58-3.44 (m, 1H), 3.14 (d, J = 13.2 Hz, 1H), 2.85 (dd, J = 9.6, 14.0 Hz, 1H), 2.36-2.18 (m, 2H), 2.18-2.04 (m, 1H), 2.03-1.90 (m, 2H), 1.89-1.79 (m, 2H), 1.78-1.68 (m, 1H), 1.62-1.48 (m, 6H), 1.38-0.84 (m, 14H), 0.65 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 7.85-7.82 (m, 2H), 7.58-7.55 (m, 1H), 7.52-7.47 (m, 2H), 3.54-3.47 (m, 1H), 3.09-3.04 (m, 1H), 2.80-2.74 (m, 1H), 2.03-1.83 (m, 2H), 1.63-1.46 (m, 2H), 1.30-1.21 (m, 8H), 1.20-1.17 (m, 7H), 1.16-1.10 (m, 6H), 1.09-0.92 (m, 2H), 0.72 (s, 3H), 0.60-0.48 (m, 4H)。
1H NMR (400 MHz, CDCl3) δ 7.95-7.85 (m, 2H), 7.70-7.60 (m, 1H), 7.60-7.50 (m, 2H), 3.20-3.10 (m, 1H), 2.90-2.80 (m, 1H), 2.45-2.20 (m, 3H), 2.15-1.90 (m, 4H), 1.75-1.60 (m, 2H), 1.55-1.00 (m, 16H), 0.99 (s, 3H), 0.95-0.70 (m, 2H), 0.66 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 7.95-7.85 (m, 2H), 7.70-7.60 (m, 1H), 7.60-7.50 (m, 2H), 3.20-3.10 (m, 1H), 2.90-2.80 (m, 1H), 2.15-2.05 (m, 1H), 1.95-1.85 (m, 1H), 1.75-1.60 (m, 3H), 1.55-1.40 (m, 6H), 1.40-1.15 (m, 11H), 1.15-0.95 (m, 7H), 0.88 (t, J = 7.2 Hz, 3H), 0.81 (s, 3H), 0.65-0.55 (m, 4H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.194分、30~90 AB、純度100%、MS ESI C30H48O4S[M+H2O]+についての計算値504、実測値504。
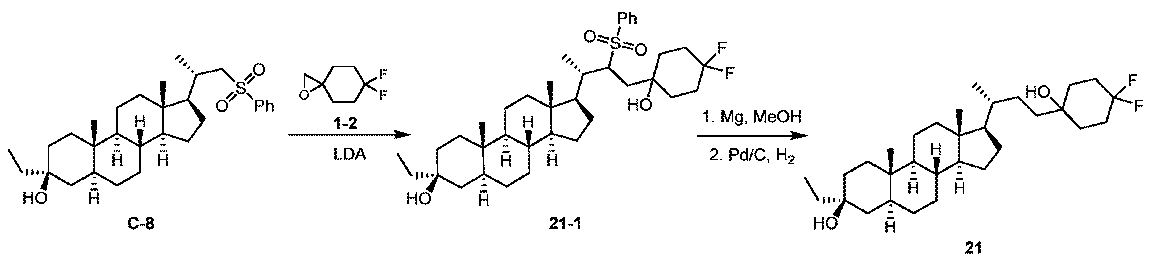
1H NMR (400 MHz, CDCl3) δ 2.72 (s, 2H), 2.20-1.85 (m, 8H)。
1H NMR (400 MHz, CDCl3) δ 5.31-5.29 (m, 1H), 2.43-2.40 (m, 1H), 2.20-2.02 (m, 4H), 2.00-1.73 (m, 5H), 1.72-1.61 (m, 5H), 1.60-1.46 (m, 10H), 1.45-1.22 (m, 3H), 1.21-1.06 (m, 8H), 1.05-0.96 (m, 3H), 0.95-0.90 (m, 5H), 0.68 (s, 3H)。LCMS 2.0分間のクロマトグラフィーでRt = 1.256分、30~90AB_ELSD、純度100%、MS ESI C30H45F2 [M+H-2H2O]+についての計算値443、実測値443。
1H NMR (400 MHz, CDCl3) δ 2.59 (s, 2H), 1.78-1.71 (m, 4H), 1.59-1.51 (m, 6H)。
1H NMR (400 MHz, CDCl3) δ 5.31-5.30 (m, 1H), 2.44-2.41 (m, 1H), 2.02-1.93 (m, 3H), 1.86-1.58 (m, 6H), 1.52-1.36 (m, 16H), 1.32-1.25 (m, 3H), 1.18-1.07 (m, 9H), 1.03-0.92 (m, 8H), 0.68 (s, 3H)。LCMS 2.0分間のクロマトグラフィーでRt = 1.353分、30~90 AB、MS ESI C30H47 [M+H-2H2O]+についての計算値407、実測値407。
1H NMR (400 MHz, CDCl3) δ 2.83 (s, 2H), 1.95-1.77 (m, 4H), 1.74-1.60 (m, 4H)。
1H NMR (400 MHz, CDCl3) δ 5.34-5.28 (m, 1H), 2.46-2.35 (m, 1H), 2.05-1.93 (m, 3H), 1.89-1.59 (m, 12H), 1.53-1.24 (m, 11H), 1.21-0.99 (m, 13H), 0.96-0.89 (m, 4H), 0.68 (s, 3H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.161分および1.295分、30~90 AB_E、MS ESI C29H45 [M+H-2H2O]+についての計算値393、実測値393。
1H NMR (400 MHz, CDCl3) δ 2.67 (s, 2H), 2.54-2.43 (m, 2H), 2.30-2.20 (m, 2H), 1.89-1.72 (m, 2H)。
1H NMR (400 MHz, CDCl3) δ 5.34-5.26 (m, 1H), 2.46-2.37 (m, 1H), 2.09-1.57 (m, 14H), 1.54-1.23 (m, 11H), 1.21-1.05 (m, 8H), 1.04-0.90 (m, 8H), 0.69 (s, 3H)。LCMS 2.0分間のクロマトグラフィーでRt = 1.230分、30~90 AB、MS ESI C28H43 [M+H-2H2O]+についての計算値379、実測値379。
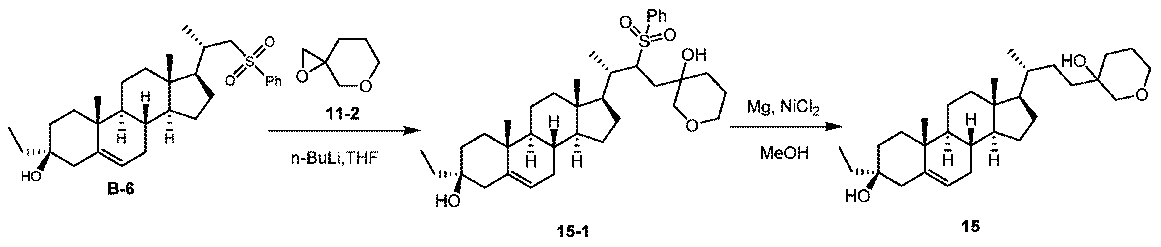
1H NMR (400 MHz, CDCl3) δ 4.12-3.93 (m, 3H), 3.68 (d, J = 10.4Hz, 1H), 3.05 (d, J = 4.4Hz, 1H), 2.96 (d, J = 4.4Hz, 1H), 2.37-2.25 (m, 1H), 2.02-1.92 (m, 1H)。
1H NMR (400 MHz, CDCl3) δ 5.37-5.24 (m, 1H), 4.08-3.98 (m, 1H), 3.94-3.84 (m, 1H), 3.74-3.65 (m, 1H), 3.59-3.51 (m, 1H), 2.48-2.37 (m, 1H), 2.06-1.67 (m, 9H), 1.66-1.38 (m, 13H), 1.34-1.07 (m, 8H), 1.06-0.90 (m, 7H), 0.68 (s, 3H)。LCMS 2分間のクロマトグラフィーでRt = 1.111分、30~90AB_E、MS ESI C30H49O3NNa [M+MeCN+Na]+についての計算値494、実測値494。
1H NMR (400 MHz, CDCl3) δ 5.33-5.28 (m, 1H), 4.10-4.00 (m, 1H), 3.93-3.85 (m, 1H), 3.69 (d, J = 9.2 Hz, 1H), 3.54 (d, J = 9.2 Hz, 1H), 2.46-2.38 (m, 1H), 2.04-1.88 (m, 5H), 1.87-1.56 (m, 9H), 1.53-1.23 (m, 7H), 1.21-1.09 (m, 7H), 1.08-0.89 (m, 9H), 0.68 (s, 3H)。
LCMS 2分間のクロマトグラフィーでRt = 1.091分、30~90AB_E、純度100%、MS ESI C28H46O3Na [M+Na]+についての計算値453、実測値453。
1H NMR (400 MHz, CDCl3) δ 5.32-5.28 (m, 1H), 4.10-4.00 (m, 1H), 3.93-3.85 (m, 1H), 3.70 (d, J = 9.2 Hz, 1H), 3.55 (d, J = 9.2 Hz, 1H), 2.45-2.39 (m, 1H), 2.04-1.83 (m, 6H), 1.81-1.63 (m, 4H), 1.61-1.54 (m, 5H), 1.52-1.37 (m, 6H), 1.26-1.08 (m, 8H), 1.05-0.92 (m, 8H), 0.68 (s, 3H)。
LCMS 2分間のクロマトグラフィーでRt = 1.093分、30~90AB_E、純度100%、MS ESI C28H43O [M+H-2H2O]+についての計算値395、実測値395。
1H NMR (400 MHz, CDCl3) δ 3.93-3.76 (m, 4H), 2.69 (s, 2H), 1.94-1.81 (m, 2H), 1.58-1.48 (m, 2H)。
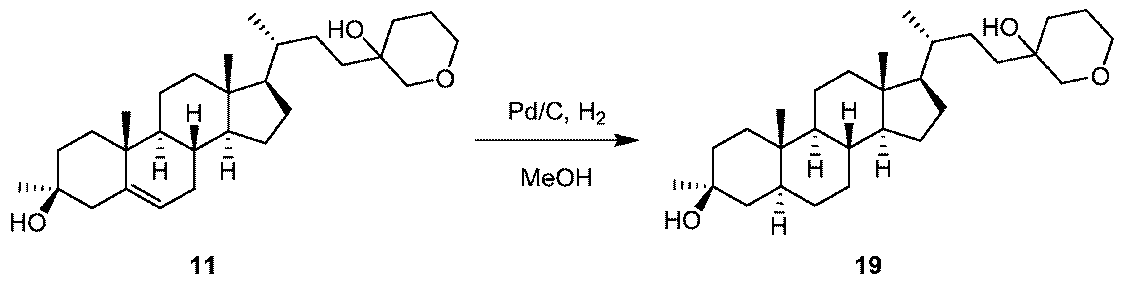
1H NMR (400 MHz, DMSO-d6) δ 5.24-5.15 (m, 1H), 4.34 (s, 1H), 4.02 (s, 1H), 3.64-3.47 (m, 4H), 2.30-2.23 (m, 1H), 2.00-1.75 (m, 5H), 1.70-1.24 (m, 14H), 1.20-0.83 (m, 18H), 0.63 (s, 3H)。LCMS 3.0分間のクロマトグラフィーでRt = 2.043分、10~80 AB、MS ESI C29H45O [M+H-2H2O]+についての計算値409、実測値409。
1H NMR (400 MHz, CDCl3) δ 3.77-3.66 (m, 2H), 3.43 (m, 2H), 2.69 (s, 2H), 1.86-1.72 (m, 2H), 1.52-1.39 (m, 11H)。
1H NMR (400 MHz, CDCl3) δ 7.96-7.87 (m, 2H), 7.72-7.55 (m, 3H), 5.31-5.24 (m, 1H), 4.00-3.83 (m, 2H), 3.43-3.32 (m, 1H), 3.30-3.06 (m, 2H), 2.44-2.24 (m, 2H), 1.99-1.87 (m, 3H), 1.80-1.50 (m, 11H), 1.49-1.42 (m, 12H), 1.40-1.25 (m, 4H), 1.18-0.80 (m, 15H), 0.43 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 5.34-5.27 (m, 1H), 3.91-3.66 (m, 2H), 3.23-3.07 (m, 2H), 2.47-2.38 (m, 1H), 2.03-1.91 (m, 3H), 1.88-1.65 (m, 4H), 1.60-1.54 (m, 4H), 1.47-1.42 (m, 12H), 1.38-1.24 (m, 4H), 1.20-0.97 (m, 14H), 0.97-0.77 (m, 7H), 0.68 (s, 3H)。
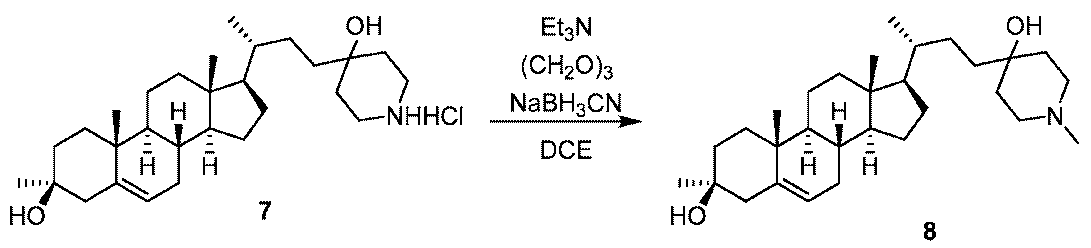
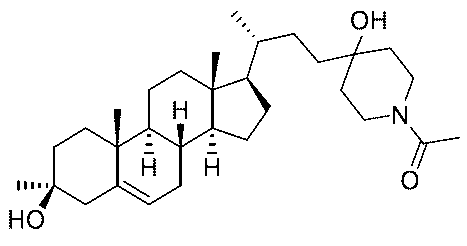
1H NMR (400 MHz, DMSO-d6) δ 8.70-8.38 (m, 1H), 5.24-5.15 (m, 1H), 4.52-4.24 (m, 2H), 3.11-2.94 (m, 4H), 2.35-2.25 (m, 1H), 1.98-1.77 (m, 4H), 1.71-1.50 (m, 8H), 1.47-1.31 (m, 7H), 1.28-0.98 (m, 8H), 0.97-0.86 (m, 10H), 0.65 (s, 3H)。LCMS 2.0分間のクロマトグラフィーでRt = 1.054分、10~80 AB、MS ESI C29H50NO2 [M+H]+についての計算値444、実測値444。
1H NMR (400 MHz, CDCl3) δ 5.34-5.26 (m, 1H), 3.44-3.32 (m, 2H), 3.19-3.04 (m, 2H), 2.78 (d, J = 4.0 Hz, 3H), 2.48-2.37 (m, 1H), 2.16-1.92 (m, 5H), 1.86-1.56 (m, 9H), 1.51-1.35 (m, 7H), 1.31-1.04 (m, 10H), 1.04-0.87 (m, 8H), 0.67 (s, 3H)。LCMS 2.0分間のクロマトグラフィーでRt = 0.748分、30~90 AB、MS ESI C30H52NO2 [M+H]+についての計算値458、実測値458。
1H NMR (400 MHz, CDCl3) δ 5.35-5.25 (m, 1H), 4.43-4.27 (m, 1H), 3.65-3.38 (m, 2H), 3.12-2.94 (m, 1H), 2.48-2.37 (m, 1H), 2.11 (s, 11H), 1.89-1.57 (m, 6H), 1.52-1.21 (m, 9H), 1.20-1.03 (m, 8H), 1.03-0.89 (m, 8H), 0.68 (s, 3H)。LCMS 2.0分間のクロマトグラフィーでRt = 1.036分、30~90 AB、MS ESI C31H52NO3 [M+H]+についての計算値486、実測値486。
1H NMR (400 MHz, CDCl3) δ 2.58 (s, 2H), 1.90-1.80 (m, 1H), 1.70-1.55 (m, 2H), 1.54-1.45 (m, 3H), 1.40-1.30 (m, 2H), 1.00-0.90 (m, 6H)。
1H NMR (400 MHz, CDCl3) δ 5.35-5.30 (m, 1H), 2.45-2.40 (m, 2H), 2.10-1.95 (m, 3H), 1.90-1.65 (m, 7H), 1.60-1.40 (m, 14H), 1.39-1.10 (m, 11H), 1.09-1.00 (m, 4H), 0.09-0.88 (m, 6H), 0.87 (s, 3H), 0.67 (m, 3H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.481分、30~90 AB、純度100%、MS ESI C32H51 [M+H-2H2O]-についての計算値435、実測値435。
1H NMR (400 MHz, CDCl3) δ 3.81-3.60 (m, 3H), 3.49 (d, J = 12.0 Hz, 1H), 2.73-2.65 (m, 2H), 2.03-1.82 (m, 2H), 1.81-1.62 (m, 2H)。
LCMS 1.5分間のクロマトグラフィーでRt = 0.939分、5~95 AB、純度79%、MS ESI C35H51O4S [M+H -H2O]+についての計算値567、実測値567。
1H NMR (400 MHz, CDCl3) δ 5.25-5.22 (m, 1H), 3.84-3.75 (m, 1H), 3.50-3.40 (m, 1H), 3.36-3.21 (m, 2H), 2.39-2.32 (m, 1H), 2.19-2.14 (m, 1H), 1.96-1.86 (m, 3H), 1.85-1.51 (m, 6H), 1.49-1.40 (m, 3H), 1.44-1.26 (m, 8H), 1.25-1.14 (m, 2H), 1.13-0.97 (m, 8H), 0.96-0.82 (m, 8H), 0.61 (s, 3H)。
LCMS 2分間のクロマトグラフィーでRt = 1.226分、30~90AB_E、純度100%、MS ESI C29H45O [M+H-2H2O]+についての計算値409、実測値409。
1H NMR (400 MHz, CDCl3) δ 7.96-7.90 (m, 2H), 7.70-7.62 (m, 1H), 7.62-7.55 (m, 2H), 5.30-5.26 (m, 1H), 3.58 (m, 1H), 2.40-2.28 (m, 3H), 2.10-2.00 (m, 2H), 1.99-1.76 (m, 6H), 1.75-1.58 (m, 7H), 1.56-1.31 (m, 8H), 1.30-1.15 (m, 4H), 1.14-1.03 (m, 3H), 1.01 (s, 3H), 0.96-0.75 (m, 8H), 0.58 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 5.30-5.26 (m, 1H), 2.38-2.31 (m, 1H), 2.18-1.76 (m, 8H), 1.75-1.58 (m, 8H), 1.56-1.41 (m, 9H), 1.40-1.20 (m, 3H), 1.18-1.05 (m, 5H), 1.02 (s, 3H), 1.00-0.90 (m, 6H), 0.88-0.80 (m, 3H), 0.68 (s, 3H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.268分、30~90 AB、純度100%、MS ESI C31H47F2 [M+H-2H2O]+についての計算値457、実測値457。
1H NMR (400 MHz, CDCl3) δ 5.31-5.26 (m, 1H), 2.42-2.31 (m, 1H), 2.07-1.92 (m, 3H), 1.92-1.78 (m, 1H), 1.77-1.68 (m, 1H), 1.68-1.58 (m, 3H), 1.52-1.44 (m, 10H), 1.44-1.34 (m, 4H), 1.34-1.23 (m, 3H), 1.22-1.14 (m, 3H), 1.14-1.05 (m, 5H), 1.04-0.96 (m, 5H), 0.96-0.89 (m, 7H), 0.89-0.82 (m, 6H), 0.68 (s, 3H)。
LCMS 2分間のクロマトグラフィーでRt = 1.475分、30~90AB、純度100%、MS ESI C33H53 [M+H-2H2O]+についての計算値449、実測値449。
LCMS 1.5分間のクロマトグラフィーでRt = 0.953分、5~95 AB、純度36%、MS ESI C36H54O5SNa [M+Na]+についての計算値621、実測値621。
1H NMR (400 MHz, CDCl3) δ 5.26-5.18 (m, 1H), 3.78-3.61 (m, 4H), 2.34-2.25 (m, 1H), 2.02-1.85 (m, 4H), 1.83-1.71 (m, 1H), 1.69-1.49 (m, 7H), 1.47-1.35 (m, 9H), 1.27-1.15 (m, 4H), 1.12-0.96 (m, 9H), 0.90-0.77 (m, 7H), 0.61 (s, 3H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.227分、30~90 AB、純度100%、MS ESI C30H47O [M+H-2H2O]+についての計算値423、実測値423。
LCMS 1.5分間のクロマトグラフィーでRt = 0.973分、5~95 AB、純度47%、MS ESI C36H53O4S [M+H -H2O]+についての計算値581、実測値581。
1H NMR (400 MHz, CDCl3) δ 5.25-5.18 (m, 1H), 3.84-3.74 (m, 1H), 3.50-3.41 (m, 1H), 3.35-3.21 (m, 2H), 2.33-2.26 (m, 1H), 2.20-2.12 (m, 1H), 2.00-1.64 (m, 7H), 1.63-1.47 (m, 6H), 1.44-1.31 (m, 9H), 1.26-1.14 (m, 3H), 1.10-0.94 (m, 8H), 0.89-0.75 (m, 7H), 0.61 (s, 3H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.284分、30~90 AB、純度100%、MS ESI C30H47O [M+H-2H2O]+についての計算値423、実測値423。
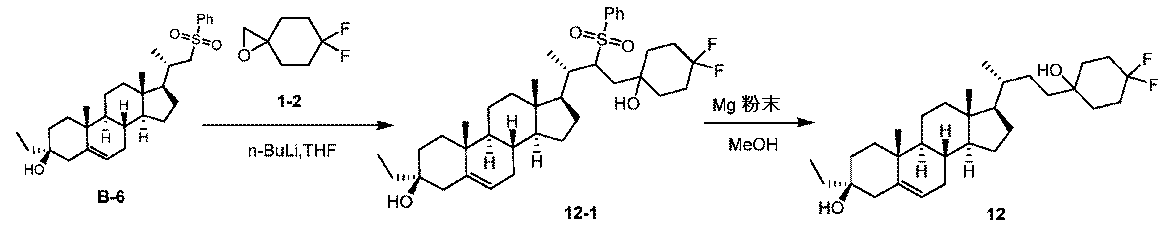
1H NMR (400 MHz, CDCl3) δ 2.20-2.00 (m, 2H), 1.99-1.75 (m, 4H), 1.70-1.60 (m, 5H), 1.59-1.42 (m, 8H), 1.41-1.23 (m, 6H), 1.22-1.16 (m, 6H), 1.15-0.96 (m, 8H), 0.95-0.82 (m, 4H), 0.80 (s, 3H), 0.70-0.60 (m, 4H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.275分、30~90 AB、純度100%、MS ESI C30H47F2 [M+H-2H2O]+についての計算値445、実測値445。
1H NMR (400 MHz, CDCl3) δ 4.06-3.98 (m, 1H), 3.93-3.85 (m, 1H), 3.69 (d, J = 9.2 Hz, 1H), 3.54 (d, J = 9.2 Hz, 1H), 1.99-1.75 (m, 4H), 1.74-1.58 (m, 5H), 1.55-1.37 (m, 7H), 1.35-1.18 (m, 10H), 1.17-0.95 (m, 7H), 0.94-0.83 (m, 4H), 0.80 (s, 3H), 0.70-0.60 (m, 4H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.114分、30~90 AB、純度100%、MS ESI C28H45O [M+H-2H2O]+についての計算値397、実測値397。
1H NMR (400 MHz, CDCl3) δ 3.75-3.61 (m, 4H), 1.92-1.84 (m, 1H), 1.81-1.70 (m, 1H), 1.66-1.49 (m, 7H), 1.48-1.36 (m, 7H), 1.34-1.22 (m, 5H), 1.20-1.12 (m, 7H), 1.09-0.98 (m, 5H), 0.96-0.77 (m, 6H), 0.81 (s, 3H), 0.64-0.53 (m, 4H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.216分、30~90 AB、純度100%、MS ESI C29H47O [M+H-2H2O]+についての計算値411、実測値411。
1H NMR (400 MHz, CDCl3) δ 3.84-3.74 (m, 1H), 3.49-3.42 (m, 1H), 3.35-3.20 (m, 2H), 2.18-2.14 (m, 1H), 1.93-1.71 (m, 3H), 1.68-1.49 (m, 5H), 1.47-1.34 (m, 7H), 1.33-1.21 (m, 4H), 1.21-1.10 (m, 8H), 1.10-0.89 (m, 7H), 0.88-0.68 (m, 7H), 0.63-0.52 (m, 4H)。
LCMS 2分間のクロマトグラフィーでRt = 1.249分、30~90AB_E、純度100%、MS ESI C29H47O [M+H -2H2O]+についての計算値411、実測値411。
1H NMR (400 MHz, CDCl3) δ 7.95-7.83 (m, 2H), 7.66-7.60 (m, 1H), 7.58-7.51 (m, 2H), 3.17-3.08 (m, 1H), 2.88-2.68 (m, 1H), 2.15-2.03 (m, 1H), 1.94-1.86 (m, 1H), 1.73-1.40 (m, 9H), 1.40-0.90 (m, 19H), 0.90-0.80 (m, 1H), 0.79 (s, 3H), 0.62 (s, 3H)。
1H NMR (400 MHz, CDCl3) δ 2.00-1.91 (m, 1H), 1.89-1.78 (m, 1H), 1.70-1.51 (m, 3H), 1.51-1.19 (m, 13H), 1.19-1.04 (m, 13H), 1.18-1.06 (m, 5H), 1.06-0.96 (m, 3H), 0.95-0.86 (m, 10H), 0.82-0.79(m, 3H), 0.70-0.60 (m, 4H)。
LCMS 2分間のクロマトグラフィーでRt = 1.442分、30~90AB_2MIN_E、純度100%、MS ESI C32H53 [M+H-2H2O]+についての計算値437、実測値437。
1H NMR (400 MHz, CDCl3) δ 2.20-2.01 (m, 2H), 1.98-1.72 (m, 4H), 1.70-1.58 (m, 10H), 1.56-1.41 (m, 6H), 1.40-1.30 (m, 5H), 1.29-1.18 (m, 4H), 1.17-1.05 (m, 4H), 1.04-0.96 (m, 3H), 0.95-0.80 (m, 10H), 0.68-0.58 (m, 4H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.325分、30~90 AB、純度100%、MS ESI C31H49F2 [M+H-2H2O]+についての計算値459、実測値459。
1H NMR (400 MHz, CDCl3) δ 2.00-1.91 (m, 1H), 1.91-1.73 (m, 1H), 1.69-1.56 (m, 5H), 1.54-1.44 (m, 9H), 1.44-1.41 (m, 1H), 1.41-1.32 (m, 4H), 1.32-1.15 (m, 9H), 1.15-1.04 (m, 5H), 1.04-0.95 (m, 3H), 0.95-0.91 (m, 5H), 0.91-0.89 (m, 2H), 0.89-0.85 (m, 6H), 0.85-0.79 (m, 3H), 0.69-0.60 (m, 4H)
LCMS 2分間のクロマトグラフィーでRt = 1.515分、30~90AB、純度100%、MS ESI C33H55 [M+H-2H2O]+についての計算値451、実測値451。
1H NMR (400 MHz, CDCl3) δ 3.82-3.69 (m, 4H), 1.99-1.91 (m, 1H), 1.87-1.75 (m, 1H), 1.73-1.57 (m, 7H), 1.55-1.42 (m, 7H), 1.40-1.17 (m, 10H), 1.16-0.95 (m, 8H), 0.94-0.84 (m, 7H), 0.82 (s, 3H), 0.70-0.55 (m, 4H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.208分、30~90 AB、純度100%、MS ESI C30H49O [M+H-2H2O]+についての計算値425、実測値425。
1H NMR (400 MHz, CDCl3) δ 3.89-3.81 (m, 1H), 3.55-3.48 (m, 1H), 3.43-3.25 (m, 2H), 2.25-2.20 (m, 1H), 1.99-1.77 (m, 3H), 1.73-1.57 (m, 6H), 1.54-1.41 (m, 7H), 1.40-1.18 (m, 10H), 1.15-0.96 (m, 7H), 0.93-0.80 (m, 10H), 0.70-0.57 (m, 4H)。
LCMS 2.0分間のクロマトグラフィーでRt = 1.270分、30~90 AB、純度100%、MS ESI C30H49O [M+H-2H2O]+についての計算値425、実測値425。
他の実施形態
本発明の実施形態において、例えば以下の項目が提供される。
(項目1)
式(I-A):
の化合物またはその薬学的に受容可能な塩であって、式(I-A)において:
Aは、カルボシクリルまたはヘテロシクリルであり;
R 1 は、C 1~6 アルキルであり;
R 5 は、存在しないかまたは水素であり;
は、単結合または二重結合を表し、ここで一方の
が二重結合である場合、他方の
は単結合であり、そしてR 5 は存在しない、
化合物またはその薬学的に受容可能な塩。
(項目2)
式(I-B):
の化合物またはその薬学的に受容可能な塩であって、式(I-B)において:
R 1 は、水素またはC 1~6 アルキルであり;
R 5 は、存在しないかまたは水素であり;
Zは、-C(R A ) 2 -、-NR B -、-O-、または-S-であり;
Xは、ハロゲン、C 1~6 アルキル、または-OR C であり;
R A は、水素、ハロゲン、またはC 1~6 アルキルであり;
R B は、水素、C 1~6 アルキル、-C(O)R C 、-C(O)OR C 、-C(O)N(R D ) 2 、または-S(O) 2 R C であり;
R C は、水素またはC 1~6 アルキルであり;
各R D は独立して、水素、C 1~6 アルキル、アリール、またはヘテロアリールであり;
mは、1、2、および3から選択される整数であり;
nは、1、2、および3から選択される整数であり;
pは、0、1、2、3、4、および5から選択される整数であり;そして
は、単結合または二重結合を表し、ここで一方の
が二重結合である場合、他方の
は単結合であり、そしてR 5 は存在しない、
化合物またはその薬学的に受容可能な塩。
(項目3)
前記化合物は、式(II-A)、式(II-B)、または式(II-C):
の化合物である、項目2に記載の化合物。
(項目4)
pは、0、1、または2から選択される整数である、項目2に記載の化合物。
(項目5)
pは0である、項目2に記載の化合物。
(項目6)
pは1である、項目2に記載の化合物。
(項目7)
pは1であり、そしてXはハロゲンである、項目2に記載の化合物。
(項目8)
前記化合物は、式(II-D)、式(II-E)、または式(II-F):
の化合物である、項目3に記載の化合物。
(項目9)
R 1 はC 1~6 アルキルである、項目2に記載の化合物。
(項目10)
R 1 は、メチルまたはエチルである、項目9に記載の化合物。
(項目11)
R 1 は、-CH 3 または-CH 2 CH 3 である、項目9に記載の化合物。
(項目12)
前記化合物は、式(II-G)または式(II-H):
の化合物である、項目2に記載の化合物。
(項目13)
前記化合物は、式(II-I)または式(II-J):
の化合物である、項目2に記載の化合物。
(項目14)
Zは、-C(R A ) 2 -、-O-、または-NR B -である、項目2に記載の化合物。
(項目15)
R A はハロゲンである、項目2に記載の化合物。
(項目16)
Zは、-CH 2 -、-CF 2 -、または-C(CH 3 ) 2 -である、項目2に記載の化合物。
(項目17)
Zは、-O-または-NR B -である、項目2に記載の化合物。
(項目18)
Zは、-NH-、-NMe-、または-NAc-である、項目2に記載の化合物。
(項目19)
Zは-CH 2 -である、項目2に記載の化合物。
(項目20)
Zは-C(CH 3 ) 2 -である、項目2に記載の化合物。
(項目21)
Zは-CF 2 -である、項目2に記載の化合物。
(項目22)
mは1であり、nは2であり、そしてZは-O-である、項目2に記載の化合物。
(項目23)
mは2であり、そしてnは2である、項目2に記載の化合物。
(項目24)
mは3であり、そしてnは1である、項目2に記載の化合物。
(項目25)
mは3であり、nは1であり、そしてZは-O-である、項目2に記載の化合物。
(項目26)
mは2であり、nは2であり、そしてZは、-O-または-NR B -である、項目2に記載の化合物。
(項目27)
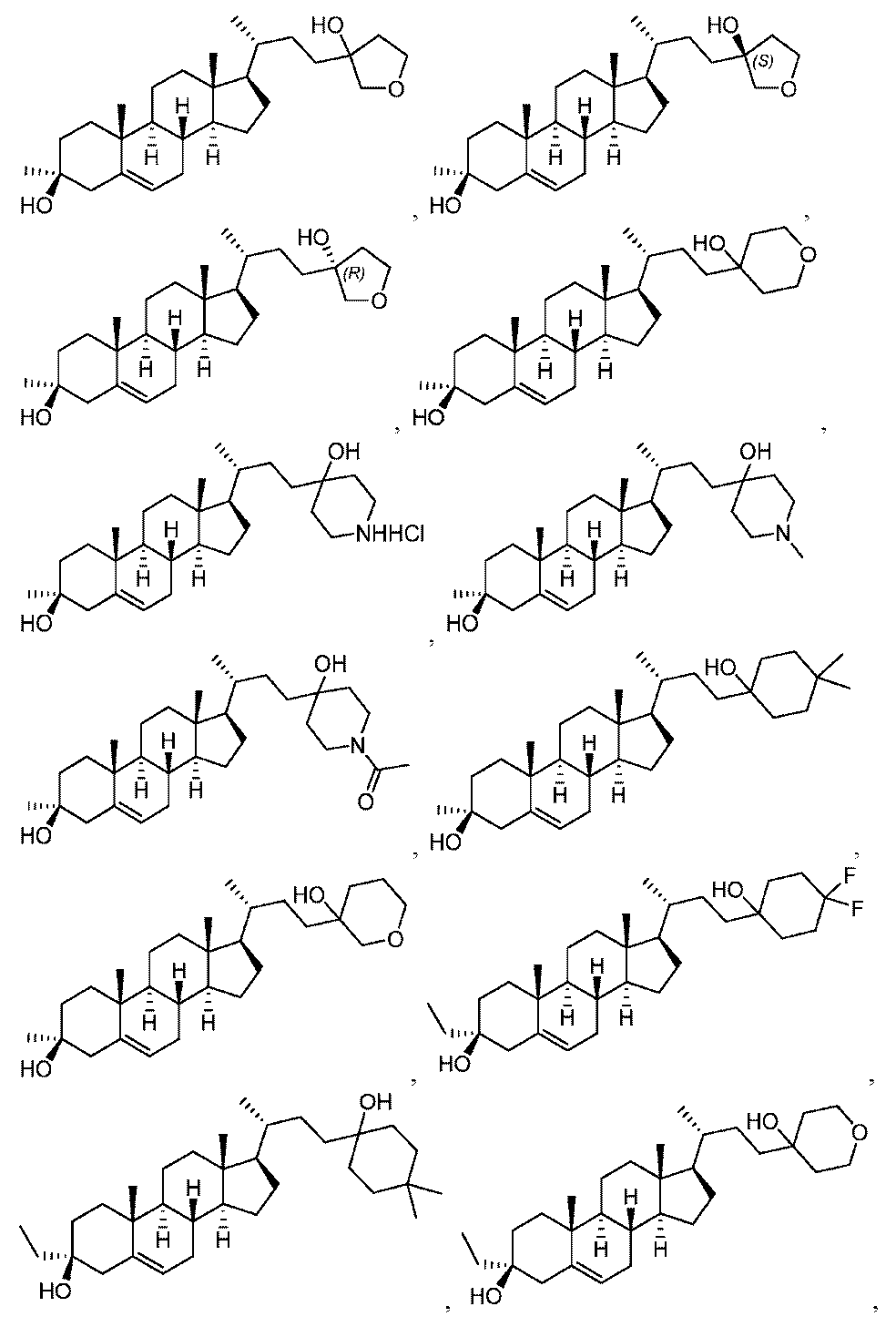
から選択される化合物。
(項目28)
から選択される化合物の薬学的に受容可能な塩。
(項目29)
項目1~28のいずれか1項に記載の化合物、および薬学的に受容可能なキャリアを含有する、薬学的組成物。
(項目30)
鎮静または麻酔を誘導する方法であって、被験体に、有効量の項目1~28のいずれか1項に記載の化合物またはその薬学的組成物を投与する工程を包含する、方法。
(項目31)
本明細書中に記載される障害を処置するためまたは予防するための方法であって、該処置または予防を必要とする被験体に、有効量の項目1~28のいずれか1項に記載の化合物またはその薬学的組成物を投与する工程を包含する、方法。
(項目32)
前記障害は、胃腸(GI)障害、GIに影響を与える構造障害、肛門の障害、結腸ポリープ、がん、大腸炎である、項目31に記載の方法。
(項目33)
前記障害は、炎症性腸疾患である、項目31に記載の方法。
(項目34)
前記障害は、がん、糖尿病またはステロール合成障害である、項目31に記載の方法。
(項目35)
前記障害は、代謝障害である、項目31に記載の方法。
(項目36)
CNS関連状態を処置するためまたは予防するための方法であって、該処置または予防を必要とする被験体に、有効量の項目1~28のいずれか1項に記載の化合物またはその薬学的組成物を投与する工程を包含する、方法。
(項目37)
前記CNS関連状態は、適応障害、不安障害、認知障害、解離性障害、摂食障害、気分障害、双極性障害、気分変調性障害、自殺傾向、統合失調症または他の精神病性障害、睡眠障害、物質関連障害、人格障害、自閉症スペクトラム障害、神経発達障害、多発性硬化症、ステロール合成障害、疼痛、ある医学的状態に対して二次的な脳障害、発作性障害、脳卒中、外傷性脳損傷、運動障害、視覚障害、聴覚障害、および耳鳴である、項目36に記載の方法。
(項目38)
前記障害は、ステロール合成障害である、項目36に記載の方法。
(項目39)
スミス・レムリ・オピッツ症候群(SLOS)、デスモステロローシス、シトステロール血症、脳腱黄色腫症(CTX)、メバロン酸キナーゼ欠損症症候群(MKD)、SC4MOL遺伝子変異(SMO欠損症)、ニーマン・ピック病、フェニルケトン尿症に関連する自閉症障害を処置するためまたは予防するための方法であって、該処置または予防を必要とする被験体に、有効量の項目1~28のいずれか1項に記載の化合物またはその薬学的組成物を投与する工程を包含する、方法。
Claims (49)
- 式(I-B):
R1は、水素またはC1~6アルキルであり;
R5は、存在しないかまたは水素であり;
Zは、-C(RA)2-、-NRB-、-O-、または-S-であり;
Xは、ハロゲン、C1~6アルキル、または-ORCであり;
RAは、ハロゲンまたはC1~6アルキルであり;
RBは、水素、C1~6アルキル、-C(O)RC、-C(O)ORC、-C(O)N(RD)2、または-S(O)2RCであり;
RCは、水素またはC1~6アルキルであり;
各RDは独立して、水素、C1~6アルキル、アリール、またはヘテロアリールであり;
mは、1、2、および3から選択される整数であり;
nは、1、2、および3から選択される整数であり;
pは、0、1、2、3、4、および5から選択される整数であり;そして
化合物またはその薬学的に受容可能な塩。 - pは、0、1、または2から選択される整数である、請求項1に記載の化合物またはその薬学的に受容可能な塩。
- pは1であり、そしてXはハロゲンである、請求項3に記載の化合物またはその薬学的に受容可能な塩。
- R1はC1~6アルキルである、請求項1に記載の化合物またはその薬学的に受容可能な塩。
- R1はメチルまたはエチルである、請求項6に記載の化合物またはその薬学的に受容可能な塩。
- RAはハロゲンである、請求項1に記載の化合物またはその薬学的に受容可能な塩。
- Zは、-CF2-、または-C(CH3)2-である、Zは、-O-または-NRB-である、あるいはZは、-NH-、-NMe-、または-NAc-である、請求項1に記載の化合物またはその薬学的に受容可能な塩。
- a)mは2であり、そしてnは2である、
b)mは3であり、そしてnは1である、
c)mは1であり、nは2であり、そしてZは-O-である、
d)mは3であり、nは1であり、そしてZは-O-である、または
e)mは2であり、nは2であり、そしてZは、-O-または-NRB-である、
請求項1に記載の化合物またはその薬学的に受容可能な塩。 - 請求項1~12、14、16、18、20、22、24、26、28、30、32、34、36、38、および40のいずれか1項に記載の化合物、および薬学的に受容可能なキャリアを含有する、薬学的組成物。
- 請求項1~11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、および41のいずれか1項に記載の化合物の薬学的に受容可能な塩、および薬学的に受容可能なキャリアを含有する、薬学的組成物。
- 被験体において鎮静または麻酔を誘導する方法における使用のための、請求項42もしくは43に記載の薬学的組成物。
- 障害を処置または予防する方法における使用のための、請求項42もしくは43に記載の薬学的組成物であって、前記障害は、胃腸(GI)障害、GI管に影響を与える構造障害、肛門の障害、結腸ポリープ、がん、大腸炎、炎症性腸疾患、過敏性腸症候群、糖尿病、ステロール合成障害または代謝障害である、薬学的組成物。
- 被験体においてCNS関連状態を処置または予防する方法における使用のための、請求項42もしくは43に記載の薬学的組成物。
- 前記CNS関連状態は、適応障害、不安障害、認知障害、解離性障害、摂食障害、気分障害、双極性障害、気分変調性障害、自殺傾向、統合失調症または他の精神病性障害、睡眠障害、物質関連障害、人格障害、自閉症スペクトラム障害、神経発達障害、多発性硬化症、ステロール合成障害、疼痛、ある医学的状態に対して二次的な脳障害、発作性障害、脳卒中、外傷性脳損傷、運動障害、視覚障害、聴覚障害、または耳鳴である、請求項46に記載の使用のための、薬学的組成物。
- 前記CNS関連状態は、ステロール合成障害である、請求項46に記載の使用のための、薬学的組成物。
- スミス・レムリ・オピッツ症候群(SLOS)、デスモステロローシス、シトステロール血症、脳腱黄色腫症(CTX)、メバロン酸キナーゼ欠損症症候群(MKD)、SC4MOL遺伝子変異(SMO欠損症)、ニーマン・ピック病、またはフェニルケトン尿症に関連する自閉症障害を処置または予防する方法における使用のための、請求項42もしくは43に記載の薬学的組成物。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021112089A JP7308886B2 (ja) | 2016-04-01 | 2021-07-06 | オキシステロールおよびその使用方法 |
| JP2023110063A JP7693755B2 (ja) | 2016-04-01 | 2023-07-04 | オキシステロールおよびその使用方法 |
| JP2025094185A JP2025131749A (ja) | 2016-04-01 | 2025-06-05 | オキシステロールおよびその使用方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662317002P | 2016-04-01 | 2016-04-01 | |
| US62/317,002 | 2016-04-01 | ||
| PCT/US2017/025535 WO2017173358A1 (en) | 2016-04-01 | 2017-03-31 | Oxysterols and methods of use thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021112089A Division JP7308886B2 (ja) | 2016-04-01 | 2021-07-06 | オキシステロールおよびその使用方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019510051A JP2019510051A (ja) | 2019-04-11 |
| JP2019510051A5 JP2019510051A5 (ja) | 2020-05-07 |
| JP7112331B2 true JP7112331B2 (ja) | 2022-08-03 |
Family
ID=59965335
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018551145A Active JP7112331B2 (ja) | 2016-04-01 | 2017-03-31 | オキシステロールおよびその使用方法 |
| JP2021112089A Active JP7308886B2 (ja) | 2016-04-01 | 2021-07-06 | オキシステロールおよびその使用方法 |
| JP2023110063A Active JP7693755B2 (ja) | 2016-04-01 | 2023-07-04 | オキシステロールおよびその使用方法 |
| JP2025094185A Pending JP2025131749A (ja) | 2016-04-01 | 2025-06-05 | オキシステロールおよびその使用方法 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021112089A Active JP7308886B2 (ja) | 2016-04-01 | 2021-07-06 | オキシステロールおよびその使用方法 |
| JP2023110063A Active JP7693755B2 (ja) | 2016-04-01 | 2023-07-04 | オキシステロールおよびその使用方法 |
| JP2025094185A Pending JP2025131749A (ja) | 2016-04-01 | 2025-06-05 | オキシステロールおよびその使用方法 |
Country Status (20)
| Country | Link |
|---|---|
| US (3) | US20190330259A1 (ja) |
| EP (1) | EP3436022B1 (ja) |
| JP (4) | JP7112331B2 (ja) |
| CN (2) | CN109195604B (ja) |
| AU (3) | AU2017240157B2 (ja) |
| CA (1) | CA3019146C (ja) |
| CY (1) | CY1125230T1 (ja) |
| DK (1) | DK3436022T3 (ja) |
| ES (1) | ES2921010T3 (ja) |
| HR (1) | HRP20220716T1 (ja) |
| HU (1) | HUE059491T2 (ja) |
| LT (1) | LT3436022T (ja) |
| MA (1) | MA44526A (ja) |
| PL (1) | PL3436022T3 (ja) |
| PT (1) | PT3436022T (ja) |
| RS (1) | RS63280B1 (ja) |
| RU (1) | RU2754130C2 (ja) |
| SI (1) | SI3436022T1 (ja) |
| SM (1) | SMT202200300T1 (ja) |
| WO (1) | WO2017173358A1 (ja) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107936076B (zh) | 2011-09-08 | 2021-10-15 | 萨奇治疗股份有限公司 | 神经活性类固醇、组合物、及其用途 |
| MX362544B (es) | 2013-03-13 | 2019-01-24 | Sage Therapeutics Inc | Esteroides neuroactivos y metodos para su uso. |
| EP4306114A1 (en) | 2014-06-18 | 2024-01-17 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| PL3319612T3 (pl) | 2015-07-06 | 2021-12-20 | Sage Therapeutics, Inc. | Oksysterole i sposoby ich stosowania |
| EP3828194B1 (en) | 2015-07-06 | 2025-04-16 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| US20190330259A1 (en) | 2016-04-01 | 2019-10-31 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| US10752653B2 (en) | 2016-05-06 | 2020-08-25 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| MD3481846T2 (ro) | 2016-07-07 | 2021-11-30 | Sage Therapeutics Inc | 24-Hidroxisteroli 11-substituiți pentru utilizare în tratamentul stărilor legate de NMDA |
| CN121085986A (zh) | 2016-09-30 | 2025-12-09 | 萨奇治疗股份有限公司 | C7取代的氧固醇及其作为nmda调节剂的方法 |
| KR102521573B1 (ko) | 2016-10-18 | 2023-04-14 | 세이지 테라퓨틱스, 인크. | 옥시스테롤 및 그의 사용 방법 |
| TW202444381A (zh) * | 2016-10-18 | 2024-11-16 | 美商賽吉醫療公司 | 氧固醇(oxysterol)及其使用方法 |
| US10857163B1 (en) | 2019-09-30 | 2020-12-08 | Athenen Therapeutics, Inc. | Compositions that preferentially potentiate subtypes of GABAA receptors and methods of use thereof |
| AU2022291395A1 (en) | 2021-06-11 | 2024-01-04 | Sage Therapeutics, Inc. | Neuroactive steroid for the treatment of alzheimer's disease |
| JP2024534558A (ja) | 2021-09-22 | 2024-09-20 | セージ セラピューティクス, インコーポレイテッド | 重水素化nmda正調節化合物及びその使用方法 |
| WO2023114224A1 (en) | 2021-12-13 | 2023-06-22 | Sage Therapeutics, Inc. | Combination of muscarinic receptor positive modulators and nmda positive allosteric modulators |
| WO2025020190A1 (zh) * | 2023-07-27 | 2025-01-30 | 珂阑(上海)医药科技有限公司 | 甾类化合物、其制备方法和应用 |
| WO2025021193A1 (zh) * | 2023-07-27 | 2025-01-30 | 珂阑(上海)医药科技有限公司 | 甾类化合物、其制备方法和应用 |
| TW202508555A (zh) * | 2023-07-27 | 2025-03-01 | 大陸商珂闌(上海)醫藥科技有限公司 | 甾類化合物、其製備方法和應用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014160441A1 (en) | 2013-03-13 | 2014-10-02 | Sage Therapeutics, Inc. | Neuroactive steroids, compositions, and uses thereof |
| JP2014526469A (ja) | 2011-09-08 | 2014-10-06 | セージ セラピューティクス, インコーポレイテッド | 神経刺激性のステロイド、組成物、およびそれらの使用 |
| WO2015195967A1 (en) | 2014-06-18 | 2015-12-23 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| WO2017007836A1 (en) | 2015-07-06 | 2017-01-12 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
Family Cites Families (115)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2259698A (en) | 1938-05-07 | 1941-10-21 | Rare Chemicals Inc | Physiologically effective substance and process of preparing same |
| US2594323A (en) | 1948-07-22 | 1952-04-29 | Upjohn Co | 24-substituted delta 5-cholene-3, 24-diols |
| US3079385A (en) | 1961-01-24 | 1963-02-26 | Roussel Uclaf | Novel process of preparation of polyhydroxylated pregnanes |
| US3206459A (en) | 1962-10-19 | 1965-09-14 | Syntex Corp | 10alpha-pregnan-19-ol derivatives |
| JPS5324071B2 (ja) | 1974-04-30 | 1978-07-18 | ||
| US4071625A (en) | 1974-05-13 | 1978-01-31 | Richardson-Merrell Inc. | 19-Oxygenated-5α-androstanes for the enhancement of libido |
| CH628907A5 (en) | 1975-10-10 | 1982-03-31 | Hoffmann La Roche | Process for the preparation of 24,25-dihydroxycholesterol derivatives |
| JPS5840960B2 (ja) | 1976-12-28 | 1983-09-08 | 帝人株式会社 | ヒドロキシコレステロ−ル立体異性体間の相互変換法 |
| JPS54163565A (en) | 1978-06-09 | 1979-12-26 | Teijin Ltd | 24*255epoxyy3beta * 266 dihydroxyychlestoo55ene or protected derivative of hydroxyl group thereof and production |
| JPS5735597A (en) | 1980-08-13 | 1982-02-26 | Teijin Ltd | 25,26-epoxy-3beta,24-dihydroxycholest-5-ene or its hydroxyl- protected derivative and their preparation |
| US4358406A (en) | 1981-07-27 | 1982-11-09 | Wisconsin Alumni Research Foundation | 26,26,26,27,27,27-Hexafluoro-1α,25-dihydroxycholecalciferol and process for preparing same |
| JPS61254599A (ja) | 1985-05-07 | 1986-11-12 | Sumitomo Pharmaceut Co Ltd | コレステロ−ルのフツ素誘導体 |
| JPS62187485A (ja) | 1986-02-13 | 1987-08-15 | Teijin Ltd | 24,25−エポキシコレステロ−ル類の製造法 |
| AU609927B2 (en) | 1987-08-25 | 1991-05-09 | Kelvin W. Gee | Compositions and methods for alleviating stress, anxiety and seizure activity |
| US5232917A (en) | 1987-08-25 | 1993-08-03 | University Of Southern California | Methods, compositions, and compounds for allosteric modulation of the GABA receptor by members of the androstane and pregnane series |
| US5376645A (en) | 1990-01-23 | 1994-12-27 | University Of Kansas | Derivatives of cyclodextrins exhibiting enhanced aqueous solubility and the use thereof |
| EP0701444B1 (en) | 1993-05-24 | 2010-04-07 | Purdue Pharma Ltd. | Methods and compositions for inducing sleep |
| IL110309A0 (en) | 1993-07-15 | 1994-10-21 | Univ Kentucky Res Found | A method of protecting against neuron loss |
| DE4338316A1 (de) | 1993-11-10 | 1995-05-11 | Jenapharm Gmbh | Neue Steroide mit radikophilen Substituenten, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel |
| PT752860E (pt) | 1994-02-14 | 2000-12-29 | Euro Celtique Sa | Androstanos e pregnanos para modulacao alosterica do receptor de gaba |
| TW385308B (en) | 1994-03-04 | 2000-03-21 | Merck & Co Inc | Prodrugs of morpholine tachykinin receptor antagonists |
| US5595996A (en) | 1994-10-25 | 1997-01-21 | Merck & Co., Inc. | 7-substituted 4-aza cholanic acid derivatives and their use |
| CN1171114A (zh) | 1994-11-23 | 1998-01-21 | 科斯赛斯公司 | 用于γ-氨基丁酸受体的变构调节的雄甾烷和孕甾烷组系 |
| JPH08268917A (ja) | 1995-03-31 | 1996-10-15 | D D S Kenkyusho:Kk | 癌組織への移行性の高い制癌剤 |
| CA2223996A1 (en) | 1995-06-06 | 1996-12-19 | Cocensys, Inc. | Neuroactive steroids of the androstane and pregnane series |
| US5792635A (en) | 1995-06-07 | 1998-08-11 | Magainin Pharmaceuticals, Inc. | Method of inhibiting the sodium/proton exchanger NHE3 and method of inhibiting growth by administering squalamine |
| US6645953B2 (en) | 1995-06-23 | 2003-11-11 | Novo Nordisk A/S | Meiosis regulating compounds |
| ATE254628T1 (de) | 1995-06-23 | 2003-12-15 | Novo Nordisk As | Meiose regulierende verbindungen. |
| US5888996A (en) | 1995-07-26 | 1999-03-30 | Trustees Of Boston University | Inhibition of NMDA receptor activity and modulation of glutamate-mediated synaptic activity |
| WO1997003677A1 (en) | 1995-07-24 | 1997-02-06 | Trustees Of Boston University | Inhibition of nmda receptor activity by pregnenolone sulfate derivatives |
| JPH09328498A (ja) | 1996-06-10 | 1997-12-22 | Teijin Ltd | 24,25−ジヒドロキシコレステロールの製造法およびその合成中間体 |
| WO1998005337A1 (en) | 1996-08-01 | 1998-02-12 | Cocensys, Inc. | Use of gaba and nmda receptor ligands for the treatment of migraine headache |
| DE19635525A1 (de) | 1996-08-20 | 1998-02-26 | Schering Ag | 7alpha-(xi-Aminoalkyl)-estratriene, Verfahren zu deren Herstellung, pharmazeutische Präparate, die diese 7alpha(xi-Aminoalkyl-estratriene enthalten sowie deren Verwendung zur Herstellung von Arzneimitteln |
| WO1999058497A1 (en) | 1998-05-11 | 1999-11-18 | Novo Nordisk A/S | Substituted guanidines and diaminonitroethenes, their preparation and use |
| KR20010043558A (ko) | 1998-05-13 | 2001-05-25 | 한센 핀 베네드, 안네 제헤르, 웨이콥 마리안느 | 감수분열 조절 화합물 |
| US8541600B2 (en) | 1998-11-24 | 2013-09-24 | Harbor Therapeutics, Inc. | 11-aza, 11-thia and 11-oxa sterol compounds and compositions |
| DE19917930A1 (de) | 1999-04-15 | 2000-10-19 | Schering Ag | Ent-Steroide als selektiv wirksame Estrogene |
| RU2243232C2 (ru) | 1999-04-29 | 2004-12-27 | Еро-Сельтик С.А. | 3альфа-гидрокси-3бета-метоксиметил-21-гетероцикл-замещенные стероиды, фармацевтическая композиция, способ облегчения или профилактики бессонницы или погружения в наркоз |
| US6376530B1 (en) | 1999-05-10 | 2002-04-23 | Merck & Co., Inc. | Cyclic amidines useful as NMDA NR2B antagonists |
| GB9910934D0 (en) | 1999-05-11 | 1999-07-14 | Res Inst Medicine Chem | Chemical compounds |
| CN1098273C (zh) | 1999-11-12 | 2003-01-08 | 中国科学院上海有机化学研究所 | 高立体选择性的合成24r,25-和24s,25-二羟基甾体化合物 |
| GB0000228D0 (en) | 2000-01-06 | 2000-03-01 | Phytopharm Plc | Fluoro substituted sapogenins and their use |
| GB0019290D0 (en) | 2000-08-04 | 2000-09-27 | Symphar Sa | Methods for inducing apolipoprotein E secretion |
| GR1003861B (el) | 2000-12-29 | 2002-04-11 | Νεα νευροστεροειδη που αλληλεπιδρουν με τον υποδοχεα gabaa. | |
| GB0107822D0 (en) | 2001-03-28 | 2001-05-23 | Phytopharm Plc | Sapogenin derivatives their synthesis and use methods based upon their use |
| US20070197484A1 (en) | 2001-05-03 | 2007-08-23 | Ching Song | Method of treating disorder related to high cholesterol concentration |
| DK1392713T3 (da) | 2001-05-03 | 2008-02-18 | Univ Chicago | Lever-X-receptoragonister |
| JP2005508368A (ja) | 2001-11-08 | 2005-03-31 | ザ ユニバーシティー オブ シカゴ | 高コレステロール濃度に関連した疾患の治療方法 |
| CA2468989A1 (en) | 2001-12-07 | 2003-06-19 | Daniel M. Schwartz | Treatment for age-related macular degeneration |
| KR101130212B1 (ko) | 2002-03-27 | 2012-04-13 | 파이토팜 피엘씨 | 사포게닌 및 그 유도체의 치료 방법 및 사용법 |
| NZ547344A (en) | 2002-03-27 | 2007-11-30 | Phytopharm Plc | Therapeutic methods and uses of sapogenins and their derivatives |
| GB0216621D0 (en) | 2002-07-17 | 2002-08-28 | Imaging Res Solutions Ltd | Imaging compounds |
| US6933312B2 (en) | 2002-10-07 | 2005-08-23 | Agouron Pharmaceuticals, Inc. | Pyrazole derivatives |
| CA2506568A1 (en) | 2002-11-22 | 2004-06-10 | Merck & Co., Inc. | 2-[(4-benzyl)-1-piperidinyl)methyl]benzimidazole-5-ol derivatives as nr2b receptor antagonists |
| AU2003288231A1 (en) | 2002-12-13 | 2004-07-09 | Bayer Healthcare Ag | Cholesterol 24-hydroxylase (cyp46) as therapeutic target for the treatment of alzheimer's disease |
| FR2850023B1 (fr) | 2003-01-17 | 2007-04-06 | Mapreg | Medicaments pour le systeme nerveux |
| US20050142192A1 (en) | 2003-10-15 | 2005-06-30 | Wyeth | Oral administration of [2-(8,9-dioxo-2,6-diazabicyclo[5.2.0]non-1(7)-en-2-yl)alkyl] phosphonic acid and derivatives |
| GB0403889D0 (en) | 2004-02-21 | 2004-03-24 | Univ Edinburgh | Uses of er-beta modulators |
| US8604011B2 (en) * | 2004-09-27 | 2013-12-10 | The Regents Of The University Of California | Therapy for treatment of chronic degenerative brain diseases and nervous system injury |
| US20070032464A1 (en) | 2004-10-08 | 2007-02-08 | Shutsung Liao | Methods of treating cancers |
| CA2585471A1 (en) | 2004-11-01 | 2006-05-11 | Seo Hong Yoo | Methods and compositions for reducing neurodegeneration in amyotrophic lateral sclerosis |
| CA2643732C (en) | 2006-02-27 | 2012-08-21 | The Regents Of The University Of California | Oxysterol compounds and the hedgehog pathway |
| CN101164540A (zh) | 2006-08-03 | 2008-04-23 | 中山大学 | 海洋甾体化合物在制备治疗神经元损伤药物中的应用 |
| GB0619860D0 (en) | 2006-10-06 | 2006-11-15 | Birkeland Innovasjon As | Treatment of insulin resistance and disorders associated therewith |
| WO2008057468A1 (en) | 2006-11-02 | 2008-05-15 | Curis, Inc. | Small organic molecule regulators of cell proliferation |
| EP2097437B1 (en) | 2006-11-21 | 2015-05-27 | Umecrine Cognition AB | The use of pregnane and androstane steroids for the manufacture of a pharmaceutical composition for the treatment of cns disorders |
| JP5587184B2 (ja) | 2007-06-20 | 2014-09-10 | オースペックス・ファーマシューティカルズ・インコーポレイテッド | 繊維症阻害剤としての置換n−アリールピリジノン |
| GB0712494D0 (en) | 2007-06-27 | 2007-08-08 | Isis Innovation | Substrate reduction therapy |
| WO2009059961A2 (en) | 2007-11-06 | 2009-05-14 | N.V. Organon | A method of hormone suppression in humans |
| JP2011505357A (ja) | 2007-12-03 | 2011-02-24 | ザ リージェンツ オブ ザ ユニバーシティー オブ カリフォルニア | ヘッジホッグシグナル伝達、骨誘導、抗脂肪生成、及びwntシグナル伝達を活性するためのオキシステロール |
| WO2009090063A1 (en) | 2008-01-16 | 2009-07-23 | Jado Technologies Gmbh | Steroid sapogenin, androstane and triterpenoid sapogenin derivatives for the treatment and prevention of infectious diseases |
| AU2009206580A1 (en) | 2008-01-25 | 2009-07-30 | Merck Sharp & Dohme Corp. | Quinolizidinone M1 receptor positive allosteric modulators |
| NZ589764A (en) | 2008-05-09 | 2012-10-26 | Univ Emory | NMDA receptor antagonists for the treatment of neuropsychiatric disorders |
| WO2010065709A2 (en) | 2008-12-03 | 2010-06-10 | Amin Khan | Hydroxamic acid derivatives, preparation and therapeutic uses thereof |
| WO2010075282A1 (en) | 2008-12-22 | 2010-07-01 | University Of Washington | Molecular inhibitors of the wnt/beta-catenin pathway |
| WO2010088414A2 (en) | 2009-01-28 | 2010-08-05 | Emory University | Subunit selective nmda receptor potentiators for the treatment of neurological conditions |
| JP2013500986A (ja) | 2009-07-29 | 2013-01-10 | ザ・ユニバーシティ・オブ・シカゴ | 肝臓x受容体アゴニスト |
| WO2011028794A2 (en) | 2009-09-01 | 2011-03-10 | Lazarus Therapeutics, Inc. | Treatment of huntington's disease with cycloserine and an nmda receptor antagonist |
| FR2953138B1 (fr) | 2009-12-02 | 2015-10-16 | Assist Publ Hopitaux Marseille | Composes aminosteroidiens pour une application topique locale pour la decolonisation cutaneo-muqueuse de staphylococcus aureus |
| WO2011092127A1 (en) | 2010-01-26 | 2011-08-04 | Bayer Schering Pharma Aktiengesellschaft | 14,17-bridged estratriene derivatives comprising heterocyclic bioisosteres for the phenolic a-ring |
| KR101692275B1 (ko) | 2010-02-11 | 2017-01-04 | 노오쓰웨스턴 유니버시티 | 2차 구조 안정화된 nmda 수용체 조절제 및 그의 용도 |
| US8247436B2 (en) | 2010-03-19 | 2012-08-21 | Novartis Ag | Pyridine and pyrazine derivative for the treatment of CF |
| GB201008047D0 (en) | 2010-05-14 | 2010-06-30 | Ge Healthcare Ltd | Method of synthesis |
| US20120035156A1 (en) | 2010-08-09 | 2012-02-09 | Daniela Alberati | Combination of glyt1 compound with antipsychotics |
| US8969525B2 (en) | 2010-11-09 | 2015-03-03 | Enzo Life Sciences, Inc. | Hydroxycholesterol immunoassay |
| US20150031655A1 (en) | 2011-04-15 | 2015-01-29 | University Of North Dakota | Combination of liver x receptor modulator and estrogen receptor modulator for the treatment of age-related diseases |
| CA2874998A1 (en) | 2011-05-27 | 2012-12-06 | Cytocure Llc | Methods, compositions, and kits for the treatment of cancer |
| EP2736919A4 (en) | 2011-07-29 | 2015-01-14 | Univ California | NEW 17-BETA-HETEROARYL-SUBSTITUTED STEROIDS AS MODULATORS OF GABAA RECEPTORS |
| SG2014010417A (en) | 2011-10-07 | 2014-06-27 | Takeda Pharmaceutical | 1 - arylcarbonyl - 4 - oxy - piperidine compounds useful for the treatment of neurodegenerative diseases |
| CN113234114A (zh) * | 2011-10-14 | 2021-08-10 | 萨奇治疗股份有限公司 | 3,3-二取代的19-去甲孕甾烷化合物、组合物、及其用途 |
| US20150119327A1 (en) | 2012-04-25 | 2015-04-30 | The Regents Of The University Of California | Drug screening platform for rett syndrome |
| US9737522B2 (en) | 2012-08-09 | 2017-08-22 | Emory University | NMDA receptor modulators and uses related thereto |
| PT2935307T (pt) | 2012-12-18 | 2018-07-31 | Univ Washington | Esteroides 19-alcoxi-17-substituídos neuroativos, úteis em métodos de tratamento |
| EP3309166A3 (en) | 2013-01-23 | 2018-08-22 | Sphaera Pharma Pvt. Ltd. | 11beta-hydroxy-steroids for use in mitochondria biogenesis and diseases associated with mitochondrial dysfunction or depletion |
| KR20150110787A (ko) | 2013-01-29 | 2015-10-02 | 노렉스, 인크. | 스피로-락탐 nmda 수용체 조절인자 및 그의 용도 |
| MX362544B (es) * | 2013-03-13 | 2019-01-24 | Sage Therapeutics Inc | Esteroides neuroactivos y metodos para su uso. |
| KR20160060688A (ko) | 2013-09-25 | 2016-05-30 | 반 안델 리서치 인스티튜트 | 고도로 강력한 글루코코르티코이드 |
| WO2016007762A1 (en) | 2014-07-09 | 2016-01-14 | Duke University | Compositions and methods for the repair of myelin |
| RU2764702C2 (ru) | 2014-10-07 | 2022-01-19 | Сейдж Терапьютикс, Инк. | Нейроактивные соединения и способы их применения |
| PL3319612T3 (pl) | 2015-07-06 | 2021-12-20 | Sage Therapeutics, Inc. | Oksysterole i sposoby ich stosowania |
| HK1255500A1 (zh) | 2015-07-06 | 2019-08-16 | Sage Therapeutics, Inc. | 氧固醇及其使用方法 |
| GB2557875A (en) | 2015-09-02 | 2018-07-04 | Univ Swansea | Diagnostic methods and kits |
| US20190330259A1 (en) | 2016-04-01 | 2019-10-31 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| US10752653B2 (en) | 2016-05-06 | 2020-08-25 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| MD3481846T2 (ro) | 2016-07-07 | 2021-11-30 | Sage Therapeutics Inc | 24-Hidroxisteroli 11-substituiți pentru utilizare în tratamentul stărilor legate de NMDA |
| CA3030420C (en) | 2016-07-11 | 2025-11-18 | Sage Therapeutics, Inc. | C7, C12 AND C16 SUBSTITUTED NEUROACTIVE STEROIDS AND ASSOCIATED METHODS OF USE |
| CN121085986A (zh) | 2016-09-30 | 2025-12-09 | 萨奇治疗股份有限公司 | C7取代的氧固醇及其作为nmda调节剂的方法 |
| TW202444381A (zh) * | 2016-10-18 | 2024-11-16 | 美商賽吉醫療公司 | 氧固醇(oxysterol)及其使用方法 |
| KR102521573B1 (ko) | 2016-10-18 | 2023-04-14 | 세이지 테라퓨틱스, 인크. | 옥시스테롤 및 그의 사용 방법 |
| WO2018170336A1 (en) | 2017-03-15 | 2018-09-20 | Modernatx, Inc. | Lipid nanoparticle formulation |
| AU2018288883B2 (en) | 2017-06-23 | 2022-06-02 | Intercept Pharmaceuticals, Inc. | Methods and intermediates for the preparation of bile acid derivatives |
| SG11202004329TA (en) | 2017-11-10 | 2020-06-29 | Marinus Pharmaceuticals Inc | Ganaxolone for use in treating genetic epileptic disoders |
| TW202523658A (zh) | 2019-05-24 | 2025-06-16 | 美商賽吉醫療公司 | 化合物、組合物及使用方法 |
| JP2024544777A (ja) | 2021-12-13 | 2024-12-04 | セージ セラピューティクス, インコーポレイテッド | ハンチントン病の治療のための神経活性ステロイド |
| WO2023114224A1 (en) | 2021-12-13 | 2023-06-22 | Sage Therapeutics, Inc. | Combination of muscarinic receptor positive modulators and nmda positive allosteric modulators |
-
2017
- 2017-03-31 US US16/089,896 patent/US20190330259A1/en not_active Abandoned
- 2017-03-31 HU HUE17776839A patent/HUE059491T2/hu unknown
- 2017-03-31 HR HRP20220716TT patent/HRP20220716T1/hr unknown
- 2017-03-31 ES ES17776839T patent/ES2921010T3/es active Active
- 2017-03-31 AU AU2017240157A patent/AU2017240157B2/en active Active
- 2017-03-31 RS RS20220536A patent/RS63280B1/sr unknown
- 2017-03-31 RU RU2018138183A patent/RU2754130C2/ru active
- 2017-03-31 WO PCT/US2017/025535 patent/WO2017173358A1/en not_active Ceased
- 2017-03-31 PT PT177768397T patent/PT3436022T/pt unknown
- 2017-03-31 MA MA044526A patent/MA44526A/fr unknown
- 2017-03-31 DK DK17776839.7T patent/DK3436022T3/da active
- 2017-03-31 CN CN201780032798.XA patent/CN109195604B/zh active Active
- 2017-03-31 EP EP17776839.7A patent/EP3436022B1/en active Active
- 2017-03-31 PL PL17776839.7T patent/PL3436022T3/pl unknown
- 2017-03-31 LT LTEPPCT/US2017/025535T patent/LT3436022T/lt unknown
- 2017-03-31 SM SM20220300T patent/SMT202200300T1/it unknown
- 2017-03-31 CA CA3019146A patent/CA3019146C/en active Active
- 2017-03-31 SI SI201731174T patent/SI3436022T1/sl unknown
- 2017-03-31 JP JP2018551145A patent/JP7112331B2/ja active Active
- 2017-03-31 CN CN202111482711.3A patent/CN114272249A/zh active Pending
-
2021
- 2021-04-28 US US17/242,860 patent/US11884697B2/en active Active
- 2021-07-06 JP JP2021112089A patent/JP7308886B2/ja active Active
-
2022
- 2022-06-09 CY CY20221100401T patent/CY1125230T1/el unknown
- 2022-12-19 AU AU2022291419A patent/AU2022291419B2/en active Active
-
2023
- 2023-07-04 JP JP2023110063A patent/JP7693755B2/ja active Active
- 2023-12-11 US US18/535,256 patent/US12448409B2/en active Active
-
2024
- 2024-12-04 AU AU2024278111A patent/AU2024278111A1/en active Pending
-
2025
- 2025-06-05 JP JP2025094185A patent/JP2025131749A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014526469A (ja) | 2011-09-08 | 2014-10-06 | セージ セラピューティクス, インコーポレイテッド | 神経刺激性のステロイド、組成物、およびそれらの使用 |
| WO2014160441A1 (en) | 2013-03-13 | 2014-10-02 | Sage Therapeutics, Inc. | Neuroactive steroids, compositions, and uses thereof |
| WO2015195967A1 (en) | 2014-06-18 | 2015-12-23 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
| WO2017007836A1 (en) | 2015-07-06 | 2017-01-12 | Sage Therapeutics, Inc. | Oxysterols and methods of use thereof |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7308886B2 (ja) | オキシステロールおよびその使用方法 | |
| JP7602513B2 (ja) | オキシステロールおよびそれらの使用の方法 | |
| JP7602512B2 (ja) | オキシステロールおよびそれらの使用の方法 | |
| HK40004292A (en) | Oxysterols and methods of use thereof | |
| HK40004292B (en) | Oxysterols and methods of use thereof | |
| HK40053565A (en) | Oxysterols and methods of use thereof | |
| HK40051330A (en) | Oxysterols and methods of use thereof | |
| BR112018070123B1 (pt) | Compostos oxiesteróis, composição farmacêutica compreendendo os referidos compostos e uso destes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200326 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200326 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210406 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210706 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210907 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220107 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20220107 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20220120 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20220217 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20220218 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220406 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220706 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220715 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220722 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7112331 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |