JP6947647B2 - 遺伝子改変t細胞の選択方法 - Google Patents
遺伝子改変t細胞の選択方法 Download PDFInfo
- Publication number
- JP6947647B2 JP6947647B2 JP2017562971A JP2017562971A JP6947647B2 JP 6947647 B2 JP6947647 B2 JP 6947647B2 JP 2017562971 A JP2017562971 A JP 2017562971A JP 2017562971 A JP2017562971 A JP 2017562971A JP 6947647 B2 JP6947647 B2 JP 6947647B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- tyms
- dhfr
- transgene
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 210000001744 T-lymphocyte Anatomy 0.000 title claims description 436
- 238000000034 method Methods 0.000 title claims description 141
- 101000809797 Homo sapiens Thymidylate synthase Proteins 0.000 claims description 275
- 102100038618 Thymidylate synthase Human genes 0.000 claims description 275
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 claims description 266
- 229960000485 methotrexate Drugs 0.000 claims description 266
- 108700019146 Transgenes Proteins 0.000 claims description 228
- 210000004027 cell Anatomy 0.000 claims description 179
- 230000014509 gene expression Effects 0.000 claims description 169
- 108090000623 proteins and genes Proteins 0.000 claims description 146
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 claims description 142
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 claims description 86
- 229960002949 fluorouracil Drugs 0.000 claims description 82
- 230000015572 biosynthetic process Effects 0.000 claims description 70
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 70
- 150000007523 nucleic acids Chemical class 0.000 claims description 68
- 238000003786 synthesis reaction Methods 0.000 claims description 68
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 claims description 67
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 claims description 67
- 229940104230 thymidine Drugs 0.000 claims description 67
- 210000003289 regulatory T cell Anatomy 0.000 claims description 62
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 claims description 61
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 60
- 230000009261 transgenic effect Effects 0.000 claims description 59
- 238000011282 treatment Methods 0.000 claims description 57
- 102000039446 nucleic acids Human genes 0.000 claims description 55
- 108020004707 nucleic acids Proteins 0.000 claims description 55
- 229920001184 polypeptide Polymers 0.000 claims description 55
- 239000003112 inhibitor Substances 0.000 claims description 54
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 50
- 108020004999 messenger RNA Proteins 0.000 claims description 39
- 239000013598 vector Substances 0.000 claims description 36
- 206010028980 Neoplasm Diseases 0.000 claims description 32
- 108090000695 Cytokines Proteins 0.000 claims description 28
- 102000004127 Cytokines Human genes 0.000 claims description 28
- 102000013462 Interleukin-12 Human genes 0.000 claims description 28
- 108010065805 Interleukin-12 Proteins 0.000 claims description 28
- 230000035755 proliferation Effects 0.000 claims description 28
- 229960005079 pemetrexed Drugs 0.000 claims description 24
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 claims description 24
- 108091008874 T cell receptors Proteins 0.000 claims description 22
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims description 22
- 239000000203 mixture Substances 0.000 claims description 22
- 230000001988 toxicity Effects 0.000 claims description 22
- 231100000419 toxicity Toxicity 0.000 claims description 22
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 claims description 20
- -1 larcitrexed Chemical compound 0.000 claims description 19
- 238000012546 transfer Methods 0.000 claims description 18
- 201000011510 cancer Diseases 0.000 claims description 17
- 210000003162 effector t lymphocyte Anatomy 0.000 claims description 15
- 210000000581 natural killer T-cell Anatomy 0.000 claims description 15
- 108091023040 Transcription factor Proteins 0.000 claims description 11
- 102000040945 Transcription factor Human genes 0.000 claims description 11
- 230000001939 inductive effect Effects 0.000 claims description 11
- 102000019034 Chemokines Human genes 0.000 claims description 10
- 108010012236 Chemokines Proteins 0.000 claims description 10
- 230000012010 growth Effects 0.000 claims description 10
- 210000004475 gamma-delta t lymphocyte Anatomy 0.000 claims description 9
- 108010038988 Peptide Hormones Proteins 0.000 claims description 8
- 102000015731 Peptide Hormones Human genes 0.000 claims description 8
- 210000002203 alpha-beta t lymphocyte Anatomy 0.000 claims description 8
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 claims description 8
- 210000002443 helper t lymphocyte Anatomy 0.000 claims description 8
- 230000002401 inhibitory effect Effects 0.000 claims description 8
- 210000003071 memory t lymphocyte Anatomy 0.000 claims description 8
- 239000000813 peptide hormone Substances 0.000 claims description 8
- 102000004039 Caspase-9 Human genes 0.000 claims description 7
- 108090000566 Caspase-9 Proteins 0.000 claims description 7
- 210000004962 mammalian cell Anatomy 0.000 claims description 6
- 239000003102 growth factor Substances 0.000 claims description 5
- 238000010187 selection method Methods 0.000 claims description 4
- 125000003275 alpha amino acid group Chemical group 0.000 claims 19
- 102100024746 Dihydrofolate reductase Human genes 0.000 claims 13
- 108020001096 dihydrofolate reductase Proteins 0.000 claims 13
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 claims 1
- 150000001576 beta-amino acids Chemical group 0.000 claims 1
- 108010044229 Dihydroflavanol 4-reductase Proteins 0.000 description 304
- 238000002474 experimental method Methods 0.000 description 88
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 80
- 239000003814 drug Substances 0.000 description 64
- 229940079593 drug Drugs 0.000 description 60
- 230000001965 increasing effect Effects 0.000 description 51
- 239000002773 nucleotide Substances 0.000 description 51
- 125000003729 nucleotide group Chemical group 0.000 description 51
- 230000000638 stimulation Effects 0.000 description 38
- 230000004083 survival effect Effects 0.000 description 38
- 238000012360 testing method Methods 0.000 description 38
- 238000004520 electroporation Methods 0.000 description 37
- 108010002350 Interleukin-2 Proteins 0.000 description 35
- 102000000588 Interleukin-2 Human genes 0.000 description 35
- 230000000694 effects Effects 0.000 description 34
- 108020004414 DNA Proteins 0.000 description 29
- 102000004169 proteins and genes Human genes 0.000 description 29
- 229940117681 interleukin-12 Drugs 0.000 description 25
- 108020004705 Codon Proteins 0.000 description 24
- 102000040430 polynucleotide Human genes 0.000 description 24
- 108091033319 polynucleotide Proteins 0.000 description 24
- 239000002157 polynucleotide Substances 0.000 description 24
- 150000001413 amino acids Chemical group 0.000 description 23
- 229940126575 aminoglycoside Drugs 0.000 description 23
- 230000005764 inhibitory process Effects 0.000 description 23
- 241000124008 Mammalia Species 0.000 description 22
- 108091007433 antigens Proteins 0.000 description 22
- 102000036639 antigens Human genes 0.000 description 22
- 239000000427 antigen Substances 0.000 description 21
- 239000005090 green fluorescent protein Substances 0.000 description 20
- 108091028043 Nucleic acid sequence Proteins 0.000 description 19
- 230000004186 co-expression Effects 0.000 description 18
- 239000013612 plasmid Substances 0.000 description 18
- 210000004986 primary T-cell Anatomy 0.000 description 18
- 230000001404 mediated effect Effects 0.000 description 17
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 15
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 15
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 15
- 230000003013 cytotoxicity Effects 0.000 description 15
- 231100000135 cytotoxicity Toxicity 0.000 description 15
- 238000005457 optimization Methods 0.000 description 15
- 101710088791 Elongation factor 2 Proteins 0.000 description 14
- 230000008901 benefit Effects 0.000 description 14
- 231100000433 cytotoxic Toxicity 0.000 description 14
- 230000001472 cytotoxic effect Effects 0.000 description 14
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 14
- 239000012634 fragment Substances 0.000 description 14
- 238000003501 co-culture Methods 0.000 description 12
- 230000000875 corresponding effect Effects 0.000 description 12
- 230000026731 phosphorylation Effects 0.000 description 12
- 238000006366 phosphorylation reaction Methods 0.000 description 12
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 11
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 11
- 230000004913 activation Effects 0.000 description 11
- 238000003556 assay Methods 0.000 description 11
- 230000033228 biological regulation Effects 0.000 description 11
- 230000006870 function Effects 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 240000007019 Oxalis corniculata Species 0.000 description 10
- 241001506137 Rapa Species 0.000 description 10
- 239000011324 bead Substances 0.000 description 10
- 230000001419 dependent effect Effects 0.000 description 10
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 10
- 229940088597 hormone Drugs 0.000 description 10
- 239000005556 hormone Substances 0.000 description 10
- 230000007246 mechanism Effects 0.000 description 10
- 230000008685 targeting Effects 0.000 description 10
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 9
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 9
- 230000007423 decrease Effects 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- 230000002062 proliferating effect Effects 0.000 description 9
- 238000013519 translation Methods 0.000 description 9
- 230000009471 action Effects 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 230000003432 anti-folate effect Effects 0.000 description 8
- 229940127074 antifolate Drugs 0.000 description 8
- 230000027455 binding Effects 0.000 description 8
- 238000002659 cell therapy Methods 0.000 description 8
- 235000019152 folic acid Nutrition 0.000 description 8
- 239000011724 folic acid Substances 0.000 description 8
- 239000004052 folic acid antagonist Substances 0.000 description 8
- 238000001727 in vivo Methods 0.000 description 8
- 239000002609 medium Substances 0.000 description 8
- 230000037361 pathway Effects 0.000 description 8
- 238000010186 staining Methods 0.000 description 8
- 231100000331 toxic Toxicity 0.000 description 8
- 230000002588 toxic effect Effects 0.000 description 8
- 206010059866 Drug resistance Diseases 0.000 description 7
- 241000713666 Lentivirus Species 0.000 description 7
- 229930193140 Neomycin Natural products 0.000 description 7
- 108010084455 Zeocin Proteins 0.000 description 7
- 230000008859 change Effects 0.000 description 7
- 102000003675 cytokine receptors Human genes 0.000 description 7
- 108010057085 cytokine receptors Proteins 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 108091006047 fluorescent proteins Proteins 0.000 description 7
- 102000034287 fluorescent proteins Human genes 0.000 description 7
- 230000006872 improvement Effects 0.000 description 7
- 238000002955 isolation Methods 0.000 description 7
- 229960004927 neomycin Drugs 0.000 description 7
- CWCMIVBLVUHDHK-ZSNHEYEWSA-N phleomycin D1 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC[C@@H](N=1)C=1SC=C(N=1)C(=O)NCCCCNC(N)=N)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C CWCMIVBLVUHDHK-ZSNHEYEWSA-N 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 230000035899 viability Effects 0.000 description 7
- MSTNYGQPCMXVAQ-KIYNQFGBSA-N 5,6,7,8-tetrahydrofolic acid Chemical compound N1C=2C(=O)NC(N)=NC=2NCC1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 MSTNYGQPCMXVAQ-KIYNQFGBSA-N 0.000 description 6
- 102000009410 Chemokine receptor Human genes 0.000 description 6
- 108050000299 Chemokine receptor Proteins 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 102000051325 Glucagon Human genes 0.000 description 6
- 108060003199 Glucagon Proteins 0.000 description 6
- 238000012313 Kruskal-Wallis test Methods 0.000 description 6
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 229960004316 cisplatin Drugs 0.000 description 6
- 231100000673 dose–response relationship Toxicity 0.000 description 6
- 229960000304 folic acid Drugs 0.000 description 6
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 6
- 229960004666 glucagon Drugs 0.000 description 6
- 102000006495 integrins Human genes 0.000 description 6
- 108010044426 integrins Proteins 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 230000035897 transcription Effects 0.000 description 6
- 238000013518 transcription Methods 0.000 description 6
- 238000007492 two-way ANOVA Methods 0.000 description 6
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 5
- 229940045513 CTLA4 antagonist Drugs 0.000 description 5
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 5
- 108020004511 Recombinant DNA Proteins 0.000 description 5
- 102000008579 Transposases Human genes 0.000 description 5
- 108010020764 Transposases Proteins 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- 238000004163 cytometry Methods 0.000 description 5
- 229940127089 cytotoxic agent Drugs 0.000 description 5
- 239000002254 cytotoxic agent Substances 0.000 description 5
- 238000012217 deletion Methods 0.000 description 5
- 230000037430 deletion Effects 0.000 description 5
- 230000004069 differentiation Effects 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 230000002255 enzymatic effect Effects 0.000 description 5
- 238000000684 flow cytometry Methods 0.000 description 5
- 108020001507 fusion proteins Proteins 0.000 description 5
- 102000037865 fusion proteins Human genes 0.000 description 5
- 238000001415 gene therapy Methods 0.000 description 5
- 230000001976 improved effect Effects 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000003780 insertion Methods 0.000 description 5
- 230000037431 insertion Effects 0.000 description 5
- 230000010354 integration Effects 0.000 description 5
- 230000007774 longterm Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 238000013105 post hoc analysis Methods 0.000 description 5
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000001105 regulatory effect Effects 0.000 description 5
- 229960002930 sirolimus Drugs 0.000 description 5
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 5
- 230000004936 stimulating effect Effects 0.000 description 5
- 231100000816 toxic dose Toxicity 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 4
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 4
- GRSZFWQUAKGDAV-UHFFFAOYSA-N Inosinic acid Natural products OC1C(O)C(COP(O)(O)=O)OC1N1C(NC=NC2=O)=C2N=C1 GRSZFWQUAKGDAV-UHFFFAOYSA-N 0.000 description 4
- 108010021466 Mutant Proteins Proteins 0.000 description 4
- 102000008300 Mutant Proteins Human genes 0.000 description 4
- 102000002508 Peptide Elongation Factors Human genes 0.000 description 4
- 108010068204 Peptide Elongation Factors Proteins 0.000 description 4
- 108091000080 Phosphotransferase Proteins 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- UDMBCSSLTHHNCD-KQYNXXCUSA-N adenosine 5'-monophosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O UDMBCSSLTHHNCD-KQYNXXCUSA-N 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 239000011651 chromium Substances 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 230000003247 decreasing effect Effects 0.000 description 4
- 230000000779 depleting effect Effects 0.000 description 4
- 238000001647 drug administration Methods 0.000 description 4
- 230000002124 endocrine Effects 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 4
- 235000008191 folinic acid Nutrition 0.000 description 4
- 239000011672 folinic acid Substances 0.000 description 4
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 4
- 108091008039 hormone receptors Proteins 0.000 description 4
- 210000005260 human cell Anatomy 0.000 description 4
- 230000005847 immunogenicity Effects 0.000 description 4
- 230000001506 immunosuppresive effect Effects 0.000 description 4
- 238000009169 immunotherapy Methods 0.000 description 4
- 238000010348 incorporation Methods 0.000 description 4
- 235000013902 inosinic acid Nutrition 0.000 description 4
- 230000009545 invasion Effects 0.000 description 4
- 229960001691 leucovorin Drugs 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 4
- 102000020233 phosphotransferase Human genes 0.000 description 4
- 238000003752 polymerase chain reaction Methods 0.000 description 4
- 230000010076 replication Effects 0.000 description 4
- 230000003362 replicative effect Effects 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 230000000284 resting effect Effects 0.000 description 4
- 238000007619 statistical method Methods 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 241001430294 unidentified retrovirus Species 0.000 description 4
- XZKIHKMTEMTJQX-UHFFFAOYSA-N 4-Nitrophenyl Phosphate Chemical compound OP(O)(=O)OC1=CC=C([N+]([O-])=O)C=C1 XZKIHKMTEMTJQX-UHFFFAOYSA-N 0.000 description 3
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 3
- 229930182566 Gentamicin Natural products 0.000 description 3
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 3
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- RTRQQBHATOEIAF-UUOKFMHZSA-N acadesine Chemical compound NC1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RTRQQBHATOEIAF-UUOKFMHZSA-N 0.000 description 3
- 229960003000 acadesine Drugs 0.000 description 3
- 208000026935 allergic disease Diseases 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 238000000540 analysis of variance Methods 0.000 description 3
- 210000000612 antigen-presenting cell Anatomy 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 238000002512 chemotherapy Methods 0.000 description 3
- 230000001276 controlling effect Effects 0.000 description 3
- 230000002596 correlated effect Effects 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 238000007405 data analysis Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- OZRNSSUDZOLUSN-LBPRGKRZSA-N dihydrofolic acid Chemical compound N=1C=2C(=O)NC(N)=NC=2NCC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OZRNSSUDZOLUSN-LBPRGKRZSA-N 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- 239000013613 expression plasmid Substances 0.000 description 3
- 229960002518 gentamicin Drugs 0.000 description 3
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 3
- 229940097277 hygromycin b Drugs 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 238000012417 linear regression Methods 0.000 description 3
- 210000005087 mononuclear cell Anatomy 0.000 description 3
- 239000008188 pellet Substances 0.000 description 3
- 230000001124 posttranscriptional effect Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 125000006850 spacer group Chemical group 0.000 description 3
- 239000012192 staining solution Substances 0.000 description 3
- 230000001629 suppression Effects 0.000 description 3
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- AUHDWARTFSKSAC-HEIFUQTGSA-N (2S,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)-2-(6-oxo-1H-purin-9-yl)oxolane-2-carboxylic acid Chemical compound [C@]1([C@H](O)[C@H](O)[C@@H](CO)O1)(N1C=NC=2C(O)=NC=NC12)C(=O)O AUHDWARTFSKSAC-HEIFUQTGSA-N 0.000 description 2
- QYNUQALWYRSVHF-OLZOCXBDSA-N (6R)-5,10-methylenetetrahydrofolic acid Chemical compound C([C@H]1CNC=2N=C(NC(=O)C=2N1C1)N)N1C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QYNUQALWYRSVHF-OLZOCXBDSA-N 0.000 description 2
- 108010039627 Aprotinin Proteins 0.000 description 2
- 108010005327 CD19-specific chimeric antigen receptor Proteins 0.000 description 2
- 108010078791 Carrier Proteins Proteins 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 108091033380 Coding strand Proteins 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 2
- 108090000144 Human Proteins Proteins 0.000 description 2
- 102000003839 Human Proteins Human genes 0.000 description 2
- 108091006905 Human Serum Albumin Proteins 0.000 description 2
- 102000008100 Human Serum Albumin Human genes 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 206010062016 Immunosuppression Diseases 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 241000204031 Mycoplasma Species 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 2
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 2
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 230000004075 alteration Effects 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 229960004405 aprotinin Drugs 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- 238000001815 biotherapy Methods 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- JSRLJPSBLDHEIO-SHYZEUOFSA-N dUMP Chemical compound O1[C@H](COP(O)(O)=O)[C@@H](O)C[C@@H]1N1C(=O)NC(=O)C=C1 JSRLJPSBLDHEIO-SHYZEUOFSA-N 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000000432 density-gradient centrifugation Methods 0.000 description 2
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 229940014144 folate Drugs 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 230000005251 gamma ray Effects 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 238000011194 good manufacturing practice Methods 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 230000002519 immonomodulatory effect Effects 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 239000000411 inducer Substances 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 229940028843 inosinic acid Drugs 0.000 description 2
- 239000004245 inosinic acid Substances 0.000 description 2
- PGHMRUGBZOYCAA-UHFFFAOYSA-N ionomycin Natural products O1C(CC(O)C(C)C(O)C(C)C=CCC(C)CC(C)C(O)=CC(=O)C(C)CC(C)CC(CCC(O)=O)C)CCC1(C)C1OC(C)(C(C)O)CC1 PGHMRUGBZOYCAA-UHFFFAOYSA-N 0.000 description 2
- PGHMRUGBZOYCAA-ADZNBVRBSA-N ionomycin Chemical compound O1[C@H](C[C@H](O)[C@H](C)[C@H](O)[C@H](C)/C=C/C[C@@H](C)C[C@@H](C)C(/O)=C/C(=O)[C@@H](C)C[C@@H](C)C[C@@H](CCC(O)=O)C)CC[C@@]1(C)[C@@H]1O[C@](C)([C@@H](C)O)CC1 PGHMRUGBZOYCAA-ADZNBVRBSA-N 0.000 description 2
- 231100000518 lethal Toxicity 0.000 description 2
- 230000001665 lethal effect Effects 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 238000001823 molecular biology technique Methods 0.000 description 2
- 238000009126 molecular therapy Methods 0.000 description 2
- 238000000491 multivariate analysis Methods 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 230000000926 neurological effect Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 238000001543 one-way ANOVA Methods 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 108700012813 7-aminoactinomycin D Proteins 0.000 description 1
- YXHLJMWYDTXDHS-IRFLANFNSA-N 7-aminoactinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=C(N)C=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 YXHLJMWYDTXDHS-IRFLANFNSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- HJCMDXDYPOUFDY-WHFBIAKZSA-N Ala-Gln Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CCC(N)=O HJCMDXDYPOUFDY-WHFBIAKZSA-N 0.000 description 1
- 108090000672 Annexin A5 Proteins 0.000 description 1
- 102000004121 Annexin A5 Human genes 0.000 description 1
- 241000269350 Anura Species 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 210000001239 CD8-positive, alpha-beta cytotoxic T lymphocyte Anatomy 0.000 description 1
- 241000282421 Canidae Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000269333 Caudata Species 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000282994 Cervidae Species 0.000 description 1
- 108091062157 Cis-regulatory element Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 230000004543 DNA replication Effects 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 238000001061 Dunnett's test Methods 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 1
- 102000014158 Interleukin-12 Subunit p40 Human genes 0.000 description 1
- 108010011429 Interleukin-12 Subunit p40 Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 108091092878 Microsatellite Proteins 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- XJLXINKUBYWONI-NNYOXOHSSA-O NADP(+) Chemical compound NC(=O)C1=CC=C[N+]([C@H]2[C@@H]([C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](OP(O)(O)=O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 XJLXINKUBYWONI-NNYOXOHSSA-O 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 102000019055 Nucleoside Transport Proteins Human genes 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000002151 Pleural effusion Diseases 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 208000009052 Precursor T-Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 230000004570 RNA-binding Effects 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 208000029052 T-cell acute lymphoblastic leukemia Diseases 0.000 description 1
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 1
- 108060005989 Tryptase Proteins 0.000 description 1
- 102000001400 Tryptase Human genes 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 229940126574 aminoglycoside antibiotic Drugs 0.000 description 1
- 239000002647 aminoglycoside antibiotic agent Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000005809 anti-tumor immunity Effects 0.000 description 1
- 229940045687 antimetabolites folic acid analogs Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000013043 chemical agent Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000002038 chemiluminescence detection Methods 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 238000012136 culture method Methods 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 229940009976 deoxycholate Drugs 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000006862 enzymatic digestion Effects 0.000 description 1
- 238000001976 enzyme digestion Methods 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- 239000012997 ficoll-paque Substances 0.000 description 1
- 150000002224 folic acids Chemical class 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 229940029575 guanosine Drugs 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 229940124622 immune-modulator drug Drugs 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940124589 immunosuppressive drug Drugs 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 238000013101 initial test Methods 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000010212 intracellular staining Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 231100000636 lethal dose Toxicity 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- FVVLHONNBARESJ-NTOWJWGLSA-H magnesium;potassium;trisodium;(2r,3s,4r,5r)-2,3,4,5,6-pentahydroxyhexanoate;acetate;tetrachloride;nonahydrate Chemical compound O.O.O.O.O.O.O.O.O.[Na+].[Na+].[Na+].[Mg+2].[Cl-].[Cl-].[Cl-].[Cl-].[K+].CC([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O FVVLHONNBARESJ-NTOWJWGLSA-H 0.000 description 1
- 238000007885 magnetic separation Methods 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- 239000002679 microRNA Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 230000004660 morphological change Effects 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 108091006527 nucleoside transporters Proteins 0.000 description 1
- 230000030648 nucleus localization Effects 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229940081858 plasmalyte a Drugs 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 229940087463 proleukin Drugs 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 230000006916 protein interaction Effects 0.000 description 1
- 229960004432 raltitrexed Drugs 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- 239000005460 tetrahydrofolate Substances 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000002992 thymic effect Effects 0.000 description 1
- 229940043263 traditional drug Drugs 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 1
- 229940045145 uridine Drugs 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0012—Oxidoreductases (1.) acting on nitrogen containing compounds as donors (1.4, 1.5, 1.6, 1.7)
- C12N9/0026—Oxidoreductases (1.) acting on nitrogen containing compounds as donors (1.4, 1.5, 1.6, 1.7) acting on CH-NH groups of donors (1.5)
- C12N9/0028—Oxidoreductases (1.) acting on nitrogen containing compounds as donors (1.4, 1.5, 1.6, 1.7) acting on CH-NH groups of donors (1.5) with NAD or NADP as acceptor (1.5.1)
- C12N9/003—Dihydrofolate reductase [DHFR] (1.5.1.3)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
- C07K14/5434—IL-12
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
- C07K14/5443—IL-15
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
- C12N5/0637—Immunosuppressive T lymphocytes, e.g. regulatory T cells or Treg
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
- C12N5/0638—Cytotoxic T lymphocytes [CTL] or lymphokine activated killer cells [LAK]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1003—Transferases (2.) transferring one-carbon groups (2.1)
- C12N9/1007—Methyltransferases (general) (2.1.1.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y201/00—Transferases transferring one-carbon groups (2.1)
- C12Y201/01—Methyltransferases (2.1.1)
- C12Y201/01045—Thymidylate synthase (2.1.1.45)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/22—Cysteine endopeptidases (3.4.22)
- C12Y304/22062—Caspase-9 (3.4.22.62)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
- G01N33/54326—Magnetic particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5158—Antigen-pulsed cells, e.g. T-cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/04—Immunosuppressors, e.g. cyclosporin, tacrolimus
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/06—Anti-neoplasic drugs, anti-retroviral drugs, e.g. azacytidine, cyclophosphamide
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/20—Cytokines; Chemokines
- C12N2501/23—Interleukins [IL]
- C12N2501/2312—Interleukin-12 (IL-12)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/50—Cell markers; Cell surface determinants
- C12N2501/599—Cell markers; Cell surface determinants with CD designations not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y105/00—Oxidoreductases acting on the CH-NH group of donors (1.5)
- C12Y105/01—Oxidoreductases acting on the CH-NH group of donors (1.5) with NAD+ or NADP+ as acceptor (1.5.1)
- C12Y105/01003—Dihydrofolate reductase (1.5.1.3)
Description
2016年2月2日に作成され、「UTFCP1272WO_ST25.txt」と命名された13KB(Microsoft Windows(登録商標)において計測)のファイルに含まれる配列リストは、電子的に提出されることによって、本明細書と共に出願され、参照によって本明細書に援用される。
本開示は、遺伝子導入T細胞の調製と、哺乳類から単離されたT細胞集団における制御性T細胞の濃縮と、を目的とする方法及び組成物に関する。
ヒト疾患をT細胞の標的にするということが進められて、25年を超える期間が経過した。Yee C.,Immunological reviews 2014,257(1):250−263を参照のこと。臨床試験の初期の目的は、T細胞を方向付けることで、例えば、転移性メラノーマ及び白血病といった、びまん性の癌を標的として死滅させることあった。Yee C.,Immunological reviews 2014,257(1):250−263、及びRoddie C and Peggs KS,Expert opinion on biological therapy 2011,11(4):473−487を参照のこと。
したがって、文献における既報内容にかかわらず、遺伝子導入T細胞の調製方法、治療的な治療を目的とするT細胞の増殖方法、及び制御性T細胞の選択方法を改善する必要がある。さらに、遺伝子導入T細胞の調製方法及び使用方法、ならびに遺伝子導入T細胞の増殖及び選択を制御する薬剤があれば、癌、自己免疫疾患、感染性疾患、及び免疫系が役割を担う任意の数の他の医学的病状の治療に大いに役立つこととなる。
別段の定義がない限り、本明細書で使用される技術用語及び科学用語はすべて、本発明が属する技術分野の当業者によって一般に理解される意味と同一の意味を有する。本発明の試験を実施する際は、本明細書に記載のものと類似または同等の任意の方法及び材料を使用することができるが、本明細書では、好ましい材料及び方法が記載される。本発明の説明及び請求では、下記の用語が使用されることになる。
1つの態様では、導入遺伝子と、DHFRFS及びTYMSSSのうちの1つまたは複数と、を含むか、または発現する、単離された遺伝子導入哺乳類T細胞が提供される。いくつかの実施形態では、単離された遺伝子導入哺乳類T細胞は、導入遺伝子、DHFRFS、及びTYMSSSを含むか、または発現する。簡潔に記載すると、T細胞は、末梢血単核細胞、骨髄、リンパ節組織、臍帯血、胸腺組織、感染部位に由来する組織、腹水、胸水、脾臓組織、及び腫瘍から得ることができる。当該技術分野において利用可能なT細胞株を使用してよい。好ましくは、T細胞は、当業者に知られる任意の数の手法を使用して対象から収集した一定単位の血液から得られる。T細胞の単離は、US2013/0287748A1において説明されるように、当該技術分野において知られる手順に従って進めてよい。その後、収集したT細胞は、US2013/0287748A1において説明されるものなどの、当該技術分野においてよく知られる方法を使用して増殖させる。
材料及び方法
細胞及び培養条件:
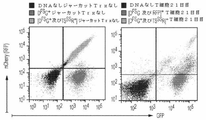
細胞:Gulf Coast Regional Blood BankまたはMDACC Blood Bank(両機関共にテキサス州ヒューストン)において健康なドナーから得られた末梢血単核細胞(PBMC)を、Ficoll−Paque Plus(GE Healthcare Biosciences,Piscataway Township,NJ;カタログ番号17−1440−02)を使用した密度勾配遠心に供した。PBMCをCliniMACS Plus PBS/EDTA緩衝液(Miltenyi Biotec,Gladbach,Germany,カタログ番号130−070−525)において1回洗浄し、Dulbecco’s PBS(D−PBS)(Sigma−Aldrich,St.Louis,Missouri,カタログ番号D8537)において2回洗浄した後、RPMI1640(Thermo Scientific Hyclone,Bridgewater,NJ;カタログ番号SH30096.01)、10%の熱非働化ウシ胎児血清(FBS−Thermo Scientific Hyclone,カタログ番号SH30070.03)、及び2mMのGlutaMAXサプリメント(Life Technologies,Grand Island,NY;カタログ番号35050061)から調製された完全培地(CM)において休止させた。あるいは、50%の熱非働化FBS、40%のRPMI1640、及び10%のDMSO(Sigma−Aldrich,PA;カタログ番号D2650)から調製された混合物を凍結培地(FM)として使用し、PBMCを4X107個細胞/mLとして凍結した。休止または凍結したPBMCの使用概要は、以下の各実験に記載される。ヒトT細胞急性リンパ性白血病の細胞由来であるジャーカット細胞株(American Type Culture Collection,Manassas,VA,カタログ番号TIB−152)を使用し、CMにおいて維持した。この細胞株の同定は、短いタンデムリピートを有するDNAを用いるフィンガープリンティング法を使用し、MDACC Cancer Center Support Grant Characterized Cell Line Coreによって確実に実施された。T細胞の刺激には、活性化及び増殖用細胞(Activating and propagating cell)(AaPC)を使用した。膜結合型IL−15と共にCD86、CD137、CD64を発現するAaPC細胞株K562のクローン4を改変することで、T細胞のポリクローナル刺激向けにOKT3抗体を提示した。これは、既報のとおりに実施した(Singh et al.,Journal of immunotherapy 2014,37(4):204−213)。キメラ抗原受容体(CAR)+T細胞の増殖には、AaPC CARL+ K562(Rushworth et al.,Journal of immunotherapy 2014,37(4):204−213)を利用した。
CD3及びCD28を介した刺激は、30ng/mLのOKT3抗体(eBioscience,San Diego,CA,カタログ番号16−0037−85)、100ng/mLの抗CD28抗体(EMD Millipore,Temecula,CA,カタログ番号CBL517)を添加することによって達成した。組換えヒトIL−2(Proleukin,Prometheus Labs,San Diego,CA)を含めてT細胞を刺激した。記載があるときは、下記の薬物を使用した:5−FU、MTX、ペメトレキセド、ラルチトレキセド、G418、及びAP20187。各薬物に関する追加情報は、表1に示される。
抗チミジル酸物質耐性(AThyR)導入遺伝子を試験するためのDNAプラスミドは、既報のDNAプラスミドであるG4CAR(前出のRushworth et al.)を骨格として使用して生成させた。商業的に合成されたFLAG−DHFRFS、コドン最適化(CoOp)DHFRFS、FLAG−TYMSSS、及びCoOp TYMSSSのDNA(Life Technologies,Gene Art)、ならびにネオマイシン耐性遺伝子(NeoR)のDNA産物は、NheI及びApaIによって切断した。レポーター遺伝子としては、N末端にSV40核局在化配列を有するmCherry(RFP)、誘導性自殺遺伝子であるCoOp iC9(両遺伝子共にGeneArtが製造)、及び高感度緑色蛍光タンパク質を使用した。
ジャーカット及びヒトPBMCは両方共、電気穿孔にはAmaxa Nucleofector(登録商標)II(Lonza,Allendale,NJ)を使用した。ジャーカット細胞の電気穿孔では、5mMのKCl、15mMのMgCl2、pH7.2の120mMのNa2HPO4/NaH2PO4、及び50mMのDMSOを含む改変緩衝液(Chicaybam et al.,Proceedings of the National Academy of Sciences of the United States of America 2002,99(6):3400−3405)を利用し、プログラムT−14を使用して、ジャーカット細胞をキュベット当たり106個として電気穿孔し、その直後にCMに移した。電気穿孔の48時間後に薬物を添加し、電気穿孔から10〜12日目の遺伝子発現を調べるために試料採取するまでそのまま細胞を培養した。ヒトPBMCの電気穿孔は、既報のプロトコール(前出のRushworth et al.)に従った。簡潔に記載すると、解凍PBMCをキュベット当たり1〜2X107個とし、プログラムU14を使用して、Amaxa T cell Nucleofector溶液(Lonza Biosciences;カタログ番号VPA−1002)において電気穿孔した。別段の記載がない限り、次の日に、新鮮なCMにおいて、1:1の比でAaPCを用い、50IU/mLのIL−2を含めてPBMCを刺激した。細胞の共培養濃度は、それぞれの刺激で106個細胞/mLを維持し、同一濃度を使用してPBMC由来のT細胞を7日ごとに再刺激した。刺激の間に培地交換を行うときは、IL−2を添加した。共培養開始の48時間後に薬物処理を開始し、14日目まで継続した。薬物添加には、必ず新鮮なCMを用いた。
培養物から106個のT細胞を遠心分離し、上清を吸引除去し、液体窒素中でペレットを急速凍結した。50mMのTris、150mMのNaCl、1mMのEDTA、1%のNP−40、0.5%のデオキシコール酸塩(deoxycholate)、1mMのフッ化フェニルメチルスルホニル、150mMのpニトロフェニルリン酸(p−nitrophenyl phosphate)、及び0.3μMのアプロチニンをpH 7.4で使用し、全細胞抽出物を収集した。タンパク質は、還元条件のSDS−PAGEによって分離し、表3に示される特異的な一次抗体を使用して分析した。検出は、高感度化学発光検出システムを使用して実施した。
培養した細胞を再懸濁し、FACS染色液において1回洗浄した(前出のRushworth et al.)。導入遺伝子の単独発現を探索するのであれば、試料はフローサイトメーターで分析した。RFP発現の分析には、BD LSRFortessa(BD Biosciences)を使用した。そうでない場合は、BD FACSCalibur(BD Biosciences)を使用した。抗体による表面染色は、蛍光色素複合型抗体を用いて、FACS染色溶液において4℃で少なくとも30分間実施した。抗体の標的、濃度、及び製造者は、表4に示される。フローサイトメトリーのデータ解析には、FlowJo v10.0.5(Tree Star Inc.,Ashland,OR)を利用した。
培養したT細胞におけるffLuc導入遺伝子の存続性は、D−ルシフェリンの切断によって試験した(Perkin Elmer,Waltham,MA,カタログ番号122796)。再懸濁した細胞をプレートに播種し、D−PBSにおいて1回洗浄した後、D−ルシフェリンを0.14mg/mLで含むD−PBS溶液において試験した。37℃で10分間インキュベートした後、プレートをTopCount NXT Luminescence Counter(Perkin Elmer)で分析した。
抗原特異的細胞傷害性は、CRAによってアッセイした。このアッセイは、既報のものである(前出のRushworth et al.)。簡潔に記載すると、各細胞株に51Crを3時間負荷し、その後、標的とエフェクター細胞との比を1:5としてCD19特異的CAR+T細胞と共に6時間インキュベートした後、抗原陽性のCD19+EL−4と、抗原陰性のCD19negEL−4と、を比較した。細胞が溶解して生じる51Cr放出を、TopCount NXTシンチレーションカウンターによって評価した。
データの統計解析及び図表記は、Prism v6.0(Graph Pad Software Inc.,La Jolla,Ca)を使用して達成した。変数が複数存在する実験は、多変量解析によって解析した:適切なときは、シダック(Sidak)の多重比較検定と共に二元配置ANOVAを使用し、適切なときであり、適用可能な場合は、チューキー(Tukey)またはダネット(Dunnett)の多重比較検定と共に一元配置ANOVAを使用した。非正規分布は、クラスカル・ワリス(Kruskall−Wallis)検定の後、ダン(Dunn)の多重比較検定によって評価した。単一変数の検定(実験と対照との比較)は、マン・ホイットニー(Mann−Whitney)検定を使用して実施した。統計学的有意性は、α<0.05とした。
A.ジャーカットにおけるAThyR導入遺伝子の選択試験
悪性腫瘍の初期治療において使用される毒性用量のAThyに対する耐性を獲得するようにT細胞を遺伝子改変することができるかを、DHFRFSを使用して決定した。MTXに対する耐性を有するDHFRFS+T細胞は、Jonnalagadda et al.,PloS one 2013,8(6):e65519、及びJonnalagadda et al.,Gene therapy 2013,20(8):853−860によって報告されている。5−FU耐性であり、細菌培養系内で以前に同定されたTYMS変異タンパク質(Landis et al.,Cancer research 2001,61(2):666−672)は、ヒト細胞で試験し(データ未掲載)、追加試験には、TYMSSSを選択した。
示されるように、TYMSSSは、MTX及びPemの存在下で、DHFRFSを発現するジャーカットの生存能力を増進し、MTX及びPemは両方共、内在性のDHFR及びTYMSを標的とすることでチミジン合成を阻止するものである。DHFRFS及びTYMSSSによって毒性濃度のMTXに対する生存強固性が向上することを考慮し、抗葉酸物質及びAThyへの耐性を示すために、MTXを用いた実験を試みた。電気穿孔によってヒトPBMCに導入することによって、ヒト細胞においてTYMSSSをDHFRFSと共に試験した。電気穿孔の次の日に、ポリクローナルなT細胞増殖を生じさせる能力を有するOKT3結合型AaPCを用いて細胞を刺激した。増殖スキームは、図3Aに示される。図3に示されるように、AaPCによる刺激の2日後に、0.1μMのMTX、5μMの5−FU、または1.4mMのG418を共培養物に添加し、14日目まで保持した。1〜35日目の間、7日ごとにAaPCを1:1の比で用いて共培養物を再刺激し、50IU/mLのIL−2を添加した。薬物を投与した最初の14日間、及び薬物投与終了後の21日間、導入遺伝子発現における表現型の変化を追跡した。図3B−I、図C−I、図D−Iでは、導入遺伝子の週ごとの発現変化を確認することができる。
導入遺伝子の発現をMTX媒介性に変化させることは、動物及びヒトの両方において、導入遺伝子の発現をインビボで制御するために有用である。したがって、本発明によれば、臨床的に利用可能な薬物であるMTXを使用することで、T細胞における導入遺伝子の発現向上または発現低下のいずれも媒介される。この制御の存続性を調べるために、ジャーカットにおいて発現したDHFRFS、CoOp DHFRFS、及び[DHFRFS及びTYMSSS]を、1μMのMTXにおいて2週間選択し、3〜5週間休止させた後、DHFRFSの発現におけるMTX媒介性の制御を試験した。図5Aでは、選択されたDHFRFS及びコドン最適化(CoOp)DHFRFSのジャーカットT細胞株における発現は一定であったことが示される。シスで発現したeGFPによって示されるように、CoOp DHFRFSは、DHFRFSの有意な発現上昇に寄与することもなく、導入遺伝子発現のMTX誘導性の増加を阻止することもないことが、図5Bにおいて確認された。これは、予想外のことであった。しかしながら、図5A及び図5Bに示されるように、TYMSSSをDHFRFSと同時発現すると、DHFRFS発現のMTX誘導性の増加が減少することが確認された。TYMSSSを追加すると、MTXの非存在下で、未変化のDHFRFSの発現に僅かな減少が生じた。MTXを添加しても、いずれかのDHFRFS型の完全発現の間に見られたDHFRFS発現のものと同一の増加を誘導することはできなかった。したがって、TYMSSSは、DHFRFSのMTX誘導性の増加において一定の役割を担っている。ある特定の実験では、ジャーカットにおいてTYMSSSをDHFRFSと共に同時発現すると、eGFPのMFIの、MTX誘導性の増加が鈍る(図3B−I)。したがって、MTX媒介性のTYMS阻害に依存するシス−導入遺伝子のMTX誘導性の発現は、DHFRFSによって維持される。
AThyRは、ヒトタンパク質であり、それ故に、NeoRまたは典型的には細菌を起源とする類似の薬物耐性導入遺伝子と比較して、ヒトにおける免疫原性が低い。したがって、免疫原性が低く、インビトロでの取り扱いが容易であるため、対象導入遺伝子の選択には、AThyRを使用することが望ましい。示されるように、DFSiC9と命名された構築物においてiC9をDHFRFSと共に同時発現することによって、自殺遺伝子である誘導性カスパーゼ9(iC9)を選択した(図8A)。iC9を選択する現行の方法は、表面に発現した抗原を利用し、磁気ビーズによって単離するというものである。しかしながら、この選択方法は、薬物添加と比較して労働集約性が高く、AThy耐性という機能性を付加するものではない。0.1μMのMTXへ曝露した2〜7日目の日数を含む、AaPCに基づく7日間の刺激後に、DFSiC9プラスミドはT細胞の生存を対象として有意に選択された(図8B)。次に、電気穿孔によってCARと共にDFSiC9を同時導入してT細胞で発現させた。CARは、CAR細胞外ドメイン結合リガンド(CARL)+K562 AaPC(前出のRushworth et al.)によって特異的に選択し、DFSiC9は、0.1μMのMTXを使用して選択した。2〜14日目にかけて、0.1μMのMTXに曝露した後、CAR+DFSiC9+T細胞を、MTXを含めずに休止させるか、またはさらに7日間、0.1μMのMTXにおいて選択した。図8Cでは、2〜21日目にかけて0.1μMのMTXにおいて選択したT細胞と、電気穿孔によってモックを導入したT細胞と、の比較が示される。前述のように、21日目までMTXで選択した後、CD4+Tが優勢となる方向に向かう選択は生じていない。
材料及び方法
健康なドナーに由来する末梢血は、テキサス州ヒューストンのMDACC Blood Bankから入手し、密度勾配遠心に供すことで単核細胞を単離した。単離した単核細胞は、完全培地(CM)において休止させるか、または既に要約したように凍結した。末梢血由来の単核細胞(PBMC)を休止または凍結したものの使用については、各実験において要約した。活性化及び増殖用細胞(AaPC)であるOKT3抗体結合型K562のクローン番号4を解凍して使用し、PBMC由来のT細胞を刺激した。Singh H,et al,PloS one 2013,8(5)を参照のこと。AaPCにおけるマイコプラズマの存在を試験してから、T細胞の刺激を実施した。細胞の計数は、自動化細胞計数機(automated cell counting)(Nexcelcom,Lawrence,MA)を使用し、0.1%のトリパンブルー(Sigma−Aldrich,T8154)で染色された細胞を除外することによって達成した。細胞の単離は、製造者の説明書に従って、CD4+,CD25+制御性T細胞単離キット(Miltenyi Biotec,San Diego,CA,130−091−301)を用いた、磁気ビーズに基づく選別を使用して達成した。簡潔に記載すると、CD4+T細胞を陰性に選択した後、抗CD25ビーズを用いた選別を1回実施することで、エフェクターT細胞(CD25neg)とTreg(CD25pos)とを区別した。
選択ベクター:FLAG−DHFRFS−2A−eGFP pSBSO(DHFRFS−GFP(DG)と記載)、FLAG−TYMSSS−2A−eGFP pSBSO(TYMSSS−GFP(TSG)と記載)、NLS−mCherry pSBSO(RFP)、FLAG−TYMSSS−2A−NLS−mCherry pSBSO(TYMSSS−RFP(TRG)と記載)、ネオマイシン耐性(NeoR)−2A−eGFP pSBSO(NeoR−GFP(NRG)と記載)、及びMyc−ffLuc−NeoR pSBSO(NRF)を、既に記載したように設計、構築、及び利用した。SBトランスポザーゼを用いたゲノムへの組込みを誘導するために、スリーピングビューティー(Sleeping Beauty)(SB)非直列/直列反復配列(IR/DR)部位を各構築物に存在させた。各導入遺伝子は、伸長因子1アルファ(EF1α)プロモーターによって発現させた。
既に記載したように、ヒトPBMCの形質転換には、Amaxa Nucleofector(登録商標)IIを利用し、プログラムU14を使用して、Amaxa T cell Nucleofector溶液において1〜2*107の解凍PBMCを電気穿孔した。次の日に、CMにおいて、AaPCを1:1の比で用い、50IU/mLのIL−2を含めてPBMCを刺激した。後に実施する刺激のそれぞれで、T細胞とAaPCとの共培養は、1*106個細胞/mLに維持した。記載の濃度でIL−2及びAaPCTを用いて、7日ごとに共培養物を再刺激することによって、細胞の増殖を促進した。刺激の間に培地交換を行うときは、IL−2を新たに添加した。遺伝子導入実験の間、共培養開始から48時間後に薬物を添加し、14日目まで所与の濃度を維持した。14日目以降は、T細胞培養物への薬物添加は実施しなかった。
記載のあるときは、ウエスタンブロットに向けて、1*106個のT細胞を遠心することによってT細胞を培養物から分離し、液体窒素中で細胞ペレットを急速凍結した。細胞ペレットは、50mMのトリス、150mMのNaCl、1mMのEDTA、1%のNP−40、0.5%のデオキシコール酸、1mMのフッ化フェニルメチルスルホニル、150mMのp−ニトロフェニルリン酸、及び0.3μMのアプロチニンをpH7.4で用いて溶解及び調製した。SDS−PAGEで分離したタンパク質、及び表6に示される一次抗体を使用することで、化学発光を介してタンパク質の存在を検出した。
培養したT細胞は、FACS染色溶液[95]において洗浄した後、FACS染色溶液において、蛍光色素複合型抗体を用いて4℃で少なくとも30分間、抗体による表面染色を実施した。細胞内転写因子及びサイトカインの染色は、表面染色後に実施し、その際、FoxP3/転写因子染色緩衝液セットを利用し、製造者のプロトコール(eBioscience,00−5523−00)に従った。FoxP3を発現する試料のほとんどで、分析にはBD FACSCalibur(BD Biosciences)を使用した。抗体の標的、濃度、及び製造者は、表7に示される。フローサイトメトリーのデータ解析には、FlowJo v10.0.5(Tree Star Inc.,Ashland,OR)を利用した。リン酸化抗原を染色した細胞のフローサイトメトリーによるイメージングは、下記のプロコールに従ってImageStreamX Mark II(Amnis,Seattle,WA)を使用して達成した;表面染色の後、100%のメタノール(Sigma)において試料を4℃で1時間固定化した後、製造者のプロコールに要約されるように、FoxP3/転写因子染色緩衝液セットの洗浄用緩衝液において洗浄及び染色を実施した。イメージサイトメトリーのデータ解析には、Amnis IDEAS v6.0を利用した。
チミジン取り込みアッセイは、各ウェルに2*105個の生存細胞を含め、抗CD3/CD28及びIL2を使用し、生存細胞を刺激して実施した。エフェクターT細胞(Teff)とTregとをさまざまな比で各ウェルにおいて混合し、U底の96ウェルプレートにおいて、ウェルをすべて3連にして実験を実施した。48時間時点で、1μCiの[3H]チミジン(Perkin−Elmer,Waltham,MA)を各ウェルに添加し、24時間後に、Top Count NXT(Perkin−Elmer)で細胞の放射能を評価した。Treg媒介性の成長抑制を下記式によって決定した:(処理なしのTeff[cpm]−(Treg及び処理なしのTeff[cpm]))/処理なしのTeff[cpm]。
図表記及びデータの統計解析は、Prism v6.0(Graph Pad Software Inc.,La Jolla,Ca)を用いて実施した。適切なときであり、適用可能な場合は、チューキー(Tukey)またはダネット(Dunnett)の多重比較検定と共に一元配置ANOVAを使用した。非正規分布は、クラスカル・ワリス(Kruskall−Wallis)検定の後、ダン(Dunn)の多重比較検定によって評価した。TCD4,FoxP3に関わる総細胞数及び発現データは、非正規分布となる傾向を有していた。単一変数の検定(実験と対照との比較)は、マン・ホイットニー(Mann−Whitney)検定を使用して実施した。統計学的有意性は、α<0.05とした。
MTXによるTCD4,FoxP3の薬物選択の一部は、毒性を介して生じる。
TCD4,FoxP3の選択にMTXがどのように寄与するかを決定するために、細胞傷害性薬物または致死性のγ線照射の存在下で、抗CD3/CD28抗体及びIL−2を用いて、新たに得られたPBMCを刺激した。7日後、刺激と共に細胞傷害性の侵襲のいずれを与えて刺激したT細胞においても、生存マーカーであるアネキシンV及び7−AADに有意差が存在した(図1B−I)。TCD4,FoxP3の選択は、細胞傷害性とは一致しなかった。7日間の刺激の後、2グレイのγ線照射は、生存集団におけるTCD4,FoxP3の量を有意に増加させた(図1B−II)。この致死性処理は、考えられる一般経路を標的としたものでもなく、シスプラチンもそうではないが、両方がTCD4,FoxP3を増加させた。しかしながら、シスプラチンによって誘導されたTCD4,FoxP3の増加は僅かであった。5−FU及びMTXでは、有意な増加が生じた。リボソーム伸長阻害剤であるG418は例外であったが、それぞれの細胞傷害性処理は、生存TCD4,FoxP3の割合を増加させるものであると思われる。Bar−Nun S.et al.,Biochimica et biophysica acta 1983,741(1):123−127を参照のこと。さまざまな細胞傷害性の侵襲に対して、このようなパターンでTCD4,FoxP3の割合が増加することは、ある特定の薬剤によって増進し得る一般経路の存在を示唆するものである。理論に拘束されるものではないが、この経路は、Tregの増殖速度の減少と関係する可能性があり、リボソームによって媒介されるもののように思われる。この理由は、TCD4,FoxP3の割合が増加するという、この一般的な傾向をG418が阻害し得るためである。Cao M.et al.,International journal of radiation biology 2011,87(1):71−80を参照のこと。
制御性T細胞は、薬物による選択の後、CD8+T細胞の増殖を阻害したという仮説を立てた。この仮説を試験するために、DHFRFS、TYMSSS、NeoR、またはそれらの組み合わせを形質転換することによって薬物耐性T細胞を得て、既に記載したように、数的に増殖させた。簡潔に記載すると、35日目まで、7日ごとに、OKT3結合型AaPCと、50IU/mLのIL−2とを用いて刺激しながら、2〜14日目と命名したものと同様に、0.1μMのMTX、5μMの5−FU、または1.6mMのG418の存在下で、形質転換T細胞を選択した。Singh H.et al.,PloS one 2013,8(5)を参照のこと。CD4+T細胞集団におけるFoxP3の発現上昇によってTregの試験を最初に実施したところ、DHFRFSを発現するT細胞においてTCD4,FoxP3の割合が有意に増加することが示された。MTXを使用する選択において、電気穿孔によってモックを導入した(DNAなし)T細胞との比較を21日目に実施したところ、この増加が示され(図11)、この増加は、選択の間に5−FUとMTXとを組み合わせると、35日目まで存続した(図12A)。選択の後、各実験集団では、遺伝子導入T細胞はほとんど完全にCD4+であったが、Tregの優位性は、未操作のCD4+T細胞コンパートメントにおいて典型的に見られる5〜10%を超えることが多いように思われた。Treg機能のマーカーも評価した。IL−2の発現が低いこと[]が、Tregの形質として知られており、FoxP3の発現と併せて評価した。図12Bでは、FoxP3pos、IL−2negの発現パターンを有するT細胞集団の割合が示される。図12Cでは、TGF−β複合体の一部である潜在関連ペプチド(LAP)の発現と、活性化Tregとの強い関連が見られる。
代替用量のG418、異なるアミノグリコシドであるハイグロマイシンB、DNAを標的とする抗生物質であるゼオシン(Zeocin)、及びRapaの存在下で、抗CD3/CD28をIL−2と併せて用いて、解凍PBMCを7日間活性化することで、アミノグリコシドによるTCD4,FoxP3の用量依存的な選択または枯渇を評価した(図14A)。アミノグリコシドであるG418の存在下で、TCD4,FoxP3の枯渇が再び確認される。代替アミノグリコシドであるハイグロマイシンでは、0.2mMのハイグロマイシンでTCD4,FoxP3の僅かな増加が生じた。この増加は、ハイグロマイシンを1.5mM及び2.3mMとして高用量で用いると有意に減少した。ハイグロマイシンでは、未処理対照との比較で、TCD4,FoxP3の有意な枯渇は示されなかった。
代替用量のG418、異なるアミノグリコシドであるハイグロマイシンB、[146]DNAを標的とする抗生物質であるゼオシン(Zeocin)、及びRapaの存在下で、抗CD3/CD28をIL−2と併せて用いて、解凍PBMCを7日間活性化することで、アミノグリコシドによるTCD4,FoxP3の用量依存的な選択または枯渇を評価した(図14A)。アミノグリコシドであるG418の存在下で、TCD4,FoxP3の枯渇が再び確認される。代替アミノグリコシドであるハイグロマイシンでは、0.2mMのハイグロマイシンでTCD4,FoxP3の僅かな増加が生じた。この増加は、ハイグロマイシンを1.5mM及び2.3mMとして高用量で用いると有意に減少した。ハイグロマイシンでは、未処理対照との比較で、TCD4,FoxP3の有意な枯渇は示されなかった。
CD4及びCD25を発現するPBMCを磁気選別することで、Tregを含むと広く考えられているCD4+CD25+集団と、エフェクターT細胞(Teff)のCD25neg集団と、を得た。Miyara M.et al.,Immunity 2009,30(6):899−911を参照のこと。こうした集団を、上記のように、AaPCとの共培養の最初の7日間、同一濃度のMTX、5−FU、G418で処理するか、または未処理とした。この期間の後、7日ごとにAaPCを用いて刺激することによって、薬物なしで共培養を21日目まで継続した。この時点で、前述のように、CD25、CTLA−4、LAP、及びIL−2の細胞における発現をアッセイした。実験概要は、図15Aで確認することができる。増殖したTregの機能性に対する各薬物の作用を決定するために、[3H]チミジン取り込みアッセイも実施した。
上で確認されたように(図13)、AMPKは、TCD4,FoxP3の選択において一定の役割を担うと仮定される。さらに、AMPKの活性が増進すると、TCD4,FoxP3においてeEF2の阻害が生じ得る。Browne GJ.et al.,The Journal of biological chemistry 2004,279(13):12220−12231を参照のこと。翻訳伸長が優先的に阻害されるのであれば、多くの細胞傷害性薬物の存在下でTCD4,FoxP3の選択が生じ、翻訳伸長阻害剤の存在下でTCD4,FoxP3の枯渇が生じるということを説明できる。このことを、PBMC活性化の24時間後に、フローサイトメトリー(図16A及び図16B)及びイメージングサイトメトリー(図16C)を使用して、AMPKのリン酸化を評価することによって試験した。T172でのAMPKのリン酸化は、活性化を示すものであり、未刺激のTCD4,FoxP3を上回って、刺激したTCD4,FoxP3で増進した。Hardie DG et al.,Diabetes 2013,62(7):2164−2172を参照のこと。このAMPK活性化増進は、CD4+,FoxP3negT細胞においても増加したが(図16Aの上パネル)、有意な増加(t検定でp=0.03)は、事後解析後は存続しなかった。同様に、活性化AMPKをFoxP3と共に示したフロープロットは、このAMPK活性化増進が、FoxP3発現サブセットにおいて顕著さが際立っていることを示している(図16Bの上パネル)。MacIver NJ et al.,Journal of immunology 2011,187(8):4187−4198を参照のこと。翻訳開始マーカーであるS6は、mTORによる制御に感受性であり、活性を有するときはリン酸化されている。Mahoney SJ et al.,Progress in molecular biology and translational science 2009,90:53−107を参照のこと。刺激後に、TCD4,FoxP3におけるリン酸化S6(p−S6)は有意に増進し(図16Aの下パネル)、このことは以前にCarbone et al.によって示されたことである。Carbone F.et al.,Nature medicine 2014,20(1):69−74を参照のこと。p−S6は、FoxP3negT細胞において増加したが(t検定でp=0.01)、この増加は、事後解析後は有意ではなかった。p−S6の増進は、図16Bの下パネルに示される代表的なフロープロットで観測可能である。代謝制御因子であるAMPK及びS6の活性化は、活性化後のFoxP3+及びFoxP3negであるCD4+T細胞の両方において増進したが、二元配置ANOVAをシダック(Sidak)の事後検定と組み合わせると、TCD4,FoxP3においてのみ、増加は有意であった。TCD4,FoxP3の活性化後に生じるAMPK及びS6の活性化増進は、図16Dに示されるイメージサイトメトリーのプロファイルで見ることができ、抗CD3/CD28及びIL−2を用いた刺激前は上パネル、刺激後は下パネルに示される。同一の補正及び視覚化を各パネルに適用することで、上パネルと下パネルの比較を実現した。
翻訳伸長がeEF2のリン酸化によって阻害され得ることを示唆しており、細胞傷害性薬物の存在下でTCD4,FoxP3の生存が増加し、アミノグリコシドのような翻訳伸長阻害剤に対する感受性が生じることの説明となる可能性がある。図16A〜16Cのものと同一の実験を実施することで、eEF2がT56でリン酸化されることによって生じる不活性化の評価を実施した。[135]イメージサイトメトリーを使用することで、事象をすべて定量化及び視覚化した。図16Dは、刺激後に、同一サブセットのT細胞、すなわち、TCD4,FoxP3においてeEF2のリン酸化が有意に増加することを示す。また、eEF2に生じる阻害性のリン酸化は、刺激したFoxP3negT細胞を上回って有意に増加し、このことは、AMPKまたはS6のリン酸化では確認されなかったことである。eEF2に生じるリン酸化が、刺激したTCD4,FoxP3のみにおいて増加することは、Cao et al.によって示されるように、刺激時におけるTCD4,FoxP3の複製能力が減少するであろうことを示唆している。活性eEF2のレベル減少は、細胞周期を介した増殖を阻害するものであり、eEF2のリン酸化増加は、図10において確認された、細胞傷害性環境におけるTCD4,FoxP3の生存を説明し得ることを示唆している。同様に、翻訳能力が減少すれば、図14においてアミノグリコシドで示されたように、翻訳伸長阻害剤に対する、TCD4,FoxP3の感受性が増加することになる。したがって、eEF2の活性は、こうした試験において、Tregの選択及び枯渇の両方に影響する主要因子であり得る。
***
特定の実施形態では、例えば以下の項目が提供される。
(項目1)
導入遺伝子及びDHFR FS を含むか、または発現する、単離された遺伝子導入哺乳類T細胞。
(項目2)
導入遺伝子及びTYMS SS を含むか、または発現する、単離された遺伝子導入哺乳類T細胞。
(項目3)
導入遺伝子、DHFR FS 、及びTYMS SS を含むか、または発現する、単離された遺伝子導入哺乳類T細胞。
(項目4)
DHFR FS 及びTYMS SS を含むか、または発現する単離された遺伝子導入哺乳類T細胞。
(項目5)
前記単離された遺伝子導入哺乳類T細胞が、ヘルパーT細胞(TH細胞)、細胞傷害性T細胞(Tc細胞またはCTL)、メモリーT細胞(TCM細胞)、エフェクターT細胞(TEM細胞)、制御性T細胞(Treg細胞;抑制性T細胞としても知られる)、ナチュラルキラーT細胞(NKT細胞)、粘膜関連インバリアントT細胞、アルファ−ベータT細胞(Tαβ細胞)、及びガンマ−デルタT細胞(Tγδ細胞)からなる群から選択される、項目1〜4のいずれかに記載の単離された遺伝子導入哺乳類T細胞。
(項目6)
哺乳類T細胞におけるAThy毒性の阻害方法であって、前記哺乳類T細胞におけるAThyR導入遺伝子の発現を含む、前記阻害方法。
(項目7)
前記AThyR導入遺伝子が、DHFR FS である、項目5に記載の方法。
(項目8)
前記AThyR導入遺伝子が、TYMS SS である、項目5に記載の方法。
(項目9)
哺乳類T細胞が、ヘルパーT細胞(TH細胞)、細胞傷害性T細胞(Tc細胞またはCTL)、メモリーT細胞(TCM細胞)、エフェクターT細胞(TEM細胞)、制御性T細胞(Treg細胞;抑制性T細胞としても知られる)、ナチュラルキラーT細胞(NKT細胞)、粘膜関連インバリアントT細胞、アルファ−ベータT細胞(Tαβ細胞)、及びガンマ−デルタT細胞(Tγδ細胞)からなる群から選択される、項目6〜8のいずれかに記載の方法。
(項目10)
対象導入遺伝子を発現するT細胞の選択方法であって、
a)前記対象導入遺伝子及びDHFR FS を発現するT細胞を含む複数のT細胞に対するチミジン合成阻害剤の適用と、
b)前記チミジン合成阻害剤の適用から7日後以降に生存している1つまたは複数のT細胞の選択と、
を含み、前記1つまたは複数のT細胞が、前記対象導入遺伝子及びDHFR FS を含むベクターを発現する、前記選択方法。
(項目11)
前記チミジン合成阻害剤が、トトレキサート(MTX)、5−FU、ラルチトレキセド、及びペメトレキセドからなる群から選択される、項目10に記載の方法。
(項目12)
前記T細胞が、ヘルパーT細胞(TH細胞)、細胞傷害性T細胞(Tc細胞またはCTL)、メモリーT細胞(TCM細胞)、エフェクターT細胞(TEM細胞)、制御性T細胞(Treg細胞;抑制性T細胞としても知られる)、ナチュラルキラーT細胞(NKT細胞)、粘膜関連インバリアントT細胞、アルファ−ベータT細胞(Tαβ細胞)、及びガンマ−デルタT細胞(Tγδ細胞)からなる群から選択される、項目10に記載の方法。
(項目13)
MTX及び5−FUに対する耐性を有する末梢血単核細胞(PBMC)の選択的増殖方法であって、
a)AThyR遺伝子を含むベクターを用いたPBMCへの遺伝子導入と、
b)チミジン合成阻害剤を用いた前記遺伝子導入PBMCの処理と、
c)前記AThyR遺伝子を発現するPBMCの選択と、
を含む、前記選択的増殖方法。
(項目14)
前記遺伝子導入PBMCに由来するT細胞集団の増殖をさらに含む、項目13に記載の方法。
(項目15)
前記チミジン合成阻害剤が、MTXである、項目13に記載の方法。
(項目16)
前記チミジン合成阻害剤が、メトトレキサート(MTX)、5−FU、ラルチトレキセド、及びペメトレキセドからなる群から選択される、項目13に記載の方法。
(項目17)
前記AThyR遺伝子が、TYMS SS である、項目13に記載の方法。
(項目18)
前記AThyR遺伝子が、DHFR FS である、項目13に記載の方法。
(項目19)
対象導入遺伝子と、DHFR FS をコードするヌクレオチド配列と、を含む核酸配列を含む、単離された遺伝子導入哺乳類T細胞。
(項目20)
対象導入遺伝子と、TYMS SS をコードするヌクレオチド配列と、を含む核酸配列を含む、単離された遺伝子導入哺乳類T細胞。
(項目21)
対象導入遺伝子と、DHFR FS をコードするヌクレオチド配列と、を含む核酸を含む、単離された遺伝子導入哺乳類T細胞であって、前記対象導入遺伝子と、DHFR FS をコードする前記ヌクレオチド配列と、が機能可能なように連結される、前記単離された遺伝子導入哺乳類T細胞。
(項目22)
前記対象導入遺伝子と、DHFR FS をコードする前記ヌクレオチド配列とが、発現に際して、同一のmRNAにコードされる、項目21に記載の遺伝子導入哺乳類T細胞。
(項目23)
前記対象導入遺伝子をコードする前記配列と、DHFR FS をコードする前記ヌクレオチド配列とが、内部リボソーム進入部位(IRES)またはリボソームスリップ配列によって分離される、項目21に記載の遺伝子導入哺乳類T細胞。
(項目24)
前記対象導入遺伝子が、DHFR FS をコードする前記ヌクレオチド配列に対して、3’側に位置する、項目21に記載の遺伝子導入哺乳類T細胞。
(項目25)
対象導入遺伝子と、TYMS SS をコードするヌクレオチド配列と、を含む核酸を含む、単離された遺伝子導入哺乳類T細胞であって、前記対象導入遺伝子と、TYMS SS をコードする前記ヌクレオチド配列と、が機能可能なように連結される、前記単離された遺伝子導入哺乳類T細胞。
(項目26)
前記対象導入遺伝子と、TYMS SS をコードする前記ヌクレオチド配列とが、発現に際して、同一のmRNAにコードされる、項目25に記載の遺伝子導入哺乳類T細胞。
(項目27)
前記対象導入遺伝子をコードする前記配列と、TYMS SS をコードするヌクレオチド配列とが、内部リボソーム進入部位(IRES)またはリボソームスリップ配列によって分離される、項目25に記載の遺伝子導入哺乳類T細胞。
(項目28)
前記対象導入遺伝子が、TYMS SS をコードする前記ヌクレオチド配列に対して、3’側に位置する、項目25に記載の遺伝子導入哺乳類T細胞。
(項目29)
DHFR FS をコードするヌクレオチド配列をさらに含む、項目25に記載の遺伝子導入哺乳類T細胞。
(項目30)
前記対象導入遺伝子が、キメラ抗原受容体(CAR)構築物、ポリペプチドホルモン、自殺遺伝子、またはT細胞受容体(TCR)をコードする、項目25に記載の遺伝子導入哺乳類T細胞。
(項目31)
前記対象導入遺伝子が、増殖因子またはサイトカインをコードする、項目25に記載の遺伝子導入哺乳類T細胞。
(項目32)
前記サイトカインが、IL−12である、項目31に記載の遺伝子導入哺乳類T細胞。
(項目33)
前記サイトカインが、IL−15である、項目31に記載の遺伝子導入哺乳類T細胞。
(項目34)
導入遺伝子及びDHFR FS を発現する、単離された遺伝子導入哺乳類T細胞であって、前記T細胞が、(1)前記導入遺伝子をコードする配列を含むポリヌクレオチドと、(2)前記DHFR FS をコードする配列を含むポリヌクレオチドと、を含む、前記単離された遺伝子導入哺乳類T細胞。
(項目35)
導入遺伝子及びTYMS SS を発現する、単離された遺伝子導入哺乳類T細胞であって、前記T細胞が、(1)前記導入遺伝子をコードする配列を含むポリヌクレオチドと、(2)前記TYMS SS をコードする配列を含むポリヌクレオチドと、を含む、前記単離された遺伝子導入哺乳類T細胞。
(項目36)
前記T細胞が、ヘルパーT細胞(TH細胞)、細胞傷害性T細胞(Tc細胞またはCTL)、メモリーT細胞(TCM細胞)、エフェクターT細胞(TEM細胞)、制御性T細胞(Treg細胞;抑制性T細胞としても知られる)、ナチュラルキラーT細胞(NKT細胞)、粘膜関連インバリアントT細胞、アルファ−ベータT細胞(Tαβ細胞)、及びガンマ−デルタT細胞(Tγδ細胞)からなる群から選択される、項目19〜35のいずれかに記載の単離された遺伝子導入哺乳類T細胞。
(項目37)
癌を有する患者の治療方法であって、項目1〜4及び項目16〜21のいずれかに記載の単離された遺伝子導入哺乳類T細胞の、治療上有効な量での患者に対する投与を含む、前記治療方法。
(項目38)
前記図のいずれかにおいて示されるか、または前記説明に記載の対象導入遺伝子を発現するT細胞の、選択方法。
(項目39)
前記図のいずれかにおいて示されるか、または前記説明に記載の、単離された遺伝子導入哺乳類T細胞。
(項目40)
前記図のいずれかにおいて示されるか、または前記説明に記載の、MTX、5−FU、ラルチトレキセド、及びペメトレキセドのうちの1つまたは複数に対する耐性を有するヒトT細胞の、選択的増殖方法。
(項目41)
前記T細胞が、ヘルパーT細胞(TH細胞)、細胞傷害性T細胞(Tc細胞またはCTL)、メモリーT細胞(TCM細胞)、エフェクターT細胞(TEM細胞)、制御性T細胞(Treg細胞;抑制性T細胞としても知られる)、ナチュラルキラーT細胞(NKT細胞)、粘膜関連インバリアントT細胞、アルファ−ベータT細胞(Tαβ細胞)、及びガンマ−デルタT細胞(Tγδ細胞)からなる群から選択される、項目40に記載の方法。
(項目42)
哺乳類から単離されたT細胞集団における制御性T細胞の濃縮方法であって、前記T細胞集団と、MTX、5−FU、ラルチトレキセド、及びペメトレキセド、またはそれらの組み合わせからなる群から選択されるチミジン合成阻害剤と、の接触によって、前記集団におけるエフェクターT細胞を選択的に枯渇させる、前記濃縮方法。
(項目43)
哺乳類から単離された前記T細胞集団が、MTX及び5−FUの両方と接触する、項目42に記載の方法。
(項目45)
哺乳類から単離されたT細胞集団における制御性T細胞の枯渇方法であって、1つまたは複数のアミノグリコシドの存在下で前記T細胞集団を培養して、前記培養において前記制御性T細胞を選択的に枯渇させることによる前記枯渇方法としてさらに定義される、項目40〜43のいずれか1項に記載の方法。
(項目46)
前記T細胞が、DHFR FS 及びTYMS SS のうちの1つまたは複数を発現する、項目40〜45のいずれか1項に記載の方法。
(項目47)
哺乳類から単離された制御性T細胞の選択方法であって、
a)チミジン合成阻害剤を用いた、DHFR FS 及びTYMS SS のうちの1つまたは複数を発現する複数のT細胞の処理と、
b)制御性T細胞のマーカーを発現する制御性T細胞の選択と、
を含む、前記選択方法。
(項目48)
前記複数のT細胞が、DHFR FS を発現する、項目47に記載の方法。
(項目49)
前記選択段階が、抗CD4抗体、抗CD25抗体、抗CD3抗体、抗CD8抗体、抗CD39抗体、抗CD45抗体、抗CD152抗体、及び抗LAP抗体のうちの1つまたは複数を使用する、磁気ビーズによる選別を用いた細胞の単離を含む、項目47に記載の方法。
(項目50)
前記選択段階が、抗CD4抗体、抗CD25抗体、抗CD3抗体、抗CD8抗体、抗CD25抗体、抗CD39抗体、抗CD45抗体、抗CD152抗体、抗KI−67抗体、及び抗FoxP3抗体のうちの1つまたは複数を使用する、磁気ビーズによる選別を用いた細胞の単離を含む、項目47に記載の方法。
(項目51)
前記チミジン合成阻害剤が、メトトレキサート(MTX)である、項目47に記載の方法。
(項目52)
前記チミジン合成阻害剤が、5−FUである、項目47に記載の方法。
(項目53)
前記チミジン合成阻害剤が、ラルチトレキセドまたはペメトレキセドである、項目47に記載の方法。
(項目54)
c)葉酸(folate)を用いた、前記制御性T細胞の処理、
をさらに含む、項目47に記載の方法。
(項目55)
c)制御性T細胞における葉酸(folate)合成の回復、
をさらに含む、項目47に記載の方法。
(項目56)
c)ロイコボリン及びFUのうちの1つまたは複数を用いた、前記制御性T細胞の処理、
をさらに含む、項目47に記載の方法。
(項目57)
c)ロイコボリン及びMTXのうちの1つまたは複数を用いた、前記制御性T細胞の処理、
をさらに含む、項目47に記載の方法。
(項目58)
哺乳類から単離された第1の複数のT細胞と、チミジン合成阻害剤と、を含む組成物であって、哺乳類から単離され、チミジン合成阻害剤を含まない第2の複数のT細胞と比較して、前記第1の複数のT細胞の制御性T細胞が濃縮される、前記組成物。
(項目59)
第1の導入遺伝子の発現制御の提供方法であって、TYMS SS をコードするヌクレオチド配列に機能可能なように連結された前記第1の導入遺伝子を含む核酸を含む遺伝子導入哺乳類細胞の提供を含み、前記細胞が、DHFR FS をコードするヌクレオチド配列をさらに含む、前記提供方法。
(項目60)
前記第1の導入遺伝子と、TYMS SS をコードするヌクレオチド配列とが、発現に際して、同一のmRNAにコードされる、項目59に記載の方法。
(項目61)
前記第1の導入遺伝子をコードする前記配列と、TYMS SS をコードする前記ヌクレオチド配列とが、内部リボソーム進入部位(IRES)またはリボソームスリップ配列によって分離される、項目59に記載の方法。
(項目62)
前記第1の対象導入遺伝子が、キメラ抗原受容体(CAR)構築物である、項目59に記載の方法。
(項目63)
前記第1の対象導入遺伝子が、ポリペプチドホルモン、ケモカイン、またはサイトカインである、項目59に記載の方法。
(項目64)
前記サイトカインが、IL−12である、項目63に記載の方法。
(項目65)
前記サイトカインが、IL−15である、項目63に記載の方法。
(項目66)
DHFR FS をコードする前記ヌクレオチド配列が、機能可能なように第2の導入遺伝子に連結される、項目59に記載の方法。
(項目67)
前記第2の導入遺伝子と、DHFR FS をコードする前記ヌクレオチド配列とが、発現に際して、同一のmRNAにコードされる、項目66に記載の方法。
(項目68)
前記第2の対象導入遺伝子をコードする前記配列と、DHFR FS をコードするヌクレオチド配列とが、内部リボソーム進入部位(IRES)またはリボソームスリップ配列によって分離される、項目67に記載の方法。
(項目69)
前記第2の導入遺伝子が、自殺遺伝子、CAR、TCR、ポリペプチドホルモン、サイトカイン、ケモカイン、または転写因子である、項目67に記載の方法。
(項目70)
前記自殺遺伝子が、誘導性自殺遺伝子である、項目69に記載の方法。
(項目71)
前記自殺遺伝子が、誘導性カスパーゼ9である、項目70に記載の方法。
(項目72)
前記哺乳類細胞が、T細胞である、項目59に記載の方法。
(項目73)
TYMS SS と、第1の導入遺伝子をコードする配列と、をコードする、組換えRNA。
(項目74)
5’から3’に向かって、TYMS SS をコードする配列と、IL−12をコードする配列と、を含む組換え核酸分子であって、発現に際して、TYMS SS をコードする前記配列と、IL−12をコードする配列と、が同一RNAにコードされる、前記組換え核酸分子。
Claims (36)
- 導入遺伝子をコードする核酸及びTYMSSS ポリペプチドをコードする核酸を含む、単離された操作された哺乳類T細胞であって、前記TYMS SS ポリペプチドのアミノ酸配列は、配列番号11のアミノ酸配列によって示されるとおりである、単離された操作された哺乳類T細胞。
- 導入遺伝子をコードする核酸、DHFRFS ポリペプチドをコードする核酸、及びTYMSSS ポリペプチドをコードする核酸を含む、単離された操作された哺乳類T細胞であって、前記DHFR FS ポリペプチドのアミノ酸配列は、配列番号12のアミノ酸配列によって示されるとおりであり、前記TYMS SS ポリペプチドのアミノ酸配列は、配列番号11のアミノ酸配列によって示されるとおりである、単離された操作された哺乳類T細胞。
- DHFRFS ポリペプチドをコードする核酸及びTYMSSS ポリペプチドをコードする核酸を含む単離された操作された哺乳類T細胞であって、前記DHFR FS ポリペプチドのアミノ酸配列は、配列番号12のアミノ酸配列によって示されるとおりであり、前記TYMS SS ポリペプチドのアミノ酸配列は、配列番号11のアミノ酸配列によって示されるとおりである、単離された操作された哺乳類T細胞。
- 前記単離された操作された哺乳類T細胞が、ヘルパーT細胞(TH細胞)、細胞傷害性T細胞(Tc細胞またはCTL)、メモリーT細胞(TCM細胞)、エフェクターT細胞(TEM細胞)、制御性T細胞(Treg細胞;抑制性T細胞としても知られる)、ナチュラルキラーT細胞(NKT細胞)、粘膜関連インバリアントT細胞、アルファ−ベータT細胞(Tαβ細胞)、またはガンマ−デルタT細胞(Tγδ細胞)である、請求項1〜3のいずれかに記載の単離された操作された哺乳類T細胞。
- 単離された操作された哺乳類T細胞におけるAThy毒性を阻害するための組成物であって、請求項1〜4のいずれか一項に記載の単離された操作された哺乳類T細胞を含む、前記組成物。
- 対象導入遺伝子を発現する単離された哺乳類T細胞の選択方法であって、
a)前記対象導入遺伝子、DHFRFS及びTYMSSS、または、前記対象導入遺伝子及びTYMSSSを発現するT細胞を含む複数の単離されたT細胞に対するチミジン合成阻害剤の適用と、
b)前記チミジン合成阻害剤の適用から7日後以降に生存している1つまたは複数の単離されたT細胞の選択と、
を含み、前記1つまたは複数の単離されたT細胞が、前記対象導入遺伝子、DHFRFS及びTYMSSSを含むベクター、または、前記対象導入遺伝子及びTYMSSSを含むベクターを発現し、前記TYMS SS のアミノ酸配列は、配列番号11のアミノ酸配列によって示されるとおりであり、前記DHFR FS のアミノ酸配列は、配列番号12のアミノ酸配列によって示されるとおりである、前記選択方法。 - 前記チミジン合成阻害剤が、トトレキサート(MTX)、5−FU、ラルチトレキセド、及びペメトレキセドからなる群から選択される、請求項6に記載の方法。
- 前記単離された哺乳類T細胞が、ヘルパーT細胞(TH細胞)、細胞傷害性T細胞(Tc細胞またはCTL)、メモリーT細胞(TCM細胞)、エフェクターT細胞(TEM細胞)、制御性T細胞(Treg細胞;抑制性T細胞としても知られる)、ナチュラルキラーT細胞(NKT細胞)、粘膜関連インバリアントT細胞、アルファ−ベータT細胞(Tαβ細胞)、またはガンマ−デルタT細胞(Tγδ細胞)である、請求項6に記載の方法。
- MTX及び5−FUに対する耐性を有する単離された末梢血単核細胞(PBMC)の選択的増殖方法であって、
a)AThyR遺伝子を含むベクターを用いた単離されたPBMCへの遺伝子導入と、
b)チミジン合成阻害剤を用いた前記遺伝子導入PBMCの処理と、
c)前記AThyR遺伝子を発現する単離されたPBMCの選択と、
を含み、前記AThyR導入遺伝子がTYMSSSであり、前記TYMS SS のアミノ酸配列は、配列番号11のアミノ酸配列によって示されるとおりである、前記選択的増殖方法。 - 前記遺伝子導入PBMCに由来するT細胞集団の増殖をさらに含む、請求項9に記載の方法。
- 前記チミジン合成阻害剤が、MTXである、請求項9に記載の方法。
- 前記チミジン合成阻害剤が、メトトレキサート(MTX)、5−FU、ラルチトレキセド、及びペメトレキセドからなる群から選択される、請求項9に記載の方法。
- 請求項1〜3のいずれかに記載の単離された操作された哺乳類T細胞であって、前記対象導入遺伝子と、TYMSSS ポリペプチドをコードする前記核酸と、が機能可能なように連結される、前記単離された操作された哺乳類T細胞。
- 前記対象導入遺伝子と、TYMSSS ポリペプチドをコードする前記核酸とが、発現に際して、同一のmRNAにコードされる、請求項13に記載の単離された操作された哺乳類T細胞。
- 前記対象導入遺伝子をコードする前記核酸と、TYMSSS ポリペプチドをコードする核酸とが、内部リボソーム進入部位(IRES)またはリボソームスリップ配列によって分離される、請求項13に記載の単離された操作された哺乳類T細胞。
- 前記対象導入遺伝子が、TYMSSS ポリペプチドをコードする前記核酸に対して、3’側に位置する、請求項13に記載の単離された操作された哺乳類T細胞。
- DHFRFS ポリペプチドをコードする核酸をさらに含む、請求項13に記載の単離された操作された哺乳類T細胞。
- 前記対象導入遺伝子が、キメラ抗原受容体(CAR)構築物、ポリペプチドホルモン、自殺遺伝子、またはT細胞受容体(TCR)をコードする、請求項13に記載の単離された操作された哺乳類T細胞。
- 前記対象導入遺伝子が、増殖因子またはサイトカインをコードする、請求項13に記載の単離された操作された哺乳類T細胞。
- 前記サイトカインが、IL−12である、請求項19に記載の単離された操作された哺乳類T細胞。
- 前記サイトカインが、IL−15である、請求項19に記載の単離された操作された哺乳類T細胞。
- 癌の治療における使用のための組成物であって、請求項1〜4及び請求項13〜21のいずれかに記載の単離された操作された哺乳類T細胞の、治療上有効な量を含む、前記組成物。
- 第1の導入遺伝子の発現制御の提供方法であって、TYMSSSをコードする核酸に機能可能なように連結された前記第1の導入遺伝子を含む核酸を含む単離された操作された哺乳類細胞の提供を含み、前記細胞が、DHFRFSをコードする核酸をさらに含み、前記TYMS SS のアミノ酸配列は、配列番号11のアミノ酸配列によって示されるとおりであり、前記DHFR FS のアミノ酸配列は、配列番号12のアミノ酸配列によって示されるとおりである、前記提供方法。
- 前記第1の導入遺伝子と、TYMSSSをコードする核酸とが、発現に際して、同一のmRNAにコードされる、請求項23に記載の方法。
- 前記第1の導入遺伝子をコードする前記核酸と、TYMSSSをコードする前記核酸とが、内部リボソーム進入部位(IRES)またはリボソームスリップ配列によって分離される、請求項23に記載の方法。
- 前記第1の対象導入遺伝子が、キメラ抗原受容体(CAR)構築物である、請求項23に記載の方法。
- 前記第1の対象導入遺伝子が、ポリペプチドホルモン、ケモカイン、またはサイトカインである、請求項23に記載の方法。
- 前記サイトカインが、IL−12である、請求項27に記載の方法。
- 前記サイトカインが、IL−15である、請求項27に記載の方法。
- DHFRFSをコードする前記核酸が、機能可能なように第2の導入遺伝子に連結される、請求項23に記載の方法。
- 前記第2の導入遺伝子と、DHFRFSをコードする前記核酸とが、発現に際して、同一のmRNAにコードされる、請求項30に記載の方法。
- 前記第2の対象導入遺伝子をコードする前記核酸と、DHFRFSをコードする核酸とが、内部リボソーム進入部位(IRES)またはリボソームスリップ配列によって分離される、請求項31に記載の方法。
- 前記第2の導入遺伝子が、自殺遺伝子、CAR、TCR、ポリペプチドホルモン、サイトカイン、ケモカイン、または転写因子である、請求項31に記載の方法。
- 前記自殺遺伝子が、誘導性自殺遺伝子である、請求項33に記載の方法。
- 前記自殺遺伝子が、誘導性カスパーゼ9である、請求項34に記載の方法。
- 前記哺乳類細胞が、T細胞である、請求項23に記載の方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562120329P | 2015-02-24 | 2015-02-24 | |
| US62/120,329 | 2015-02-24 | ||
| US201562120790P | 2015-02-25 | 2015-02-25 | |
| US62/120,790 | 2015-02-25 | ||
| US201562175794P | 2015-06-15 | 2015-06-15 | |
| US62/175,794 | 2015-06-15 | ||
| PCT/US2016/019288 WO2016138091A2 (en) | 2015-02-24 | 2016-02-24 | Selection methods for genetically-modified t cells |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018506995A JP2018506995A (ja) | 2018-03-15 |
| JP2018506995A5 JP2018506995A5 (ja) | 2019-03-14 |
| JP6947647B2 true JP6947647B2 (ja) | 2021-10-13 |
Family
ID=56464271
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017562971A Active JP6947647B2 (ja) | 2015-02-24 | 2016-02-24 | 遺伝子改変t細胞の選択方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US10808230B2 (ja) |
| EP (2) | EP3261656B1 (ja) |
| JP (1) | JP6947647B2 (ja) |
| KR (1) | KR20170117095A (ja) |
| CN (1) | CN107667169B (ja) |
| AU (2) | AU2016222850B2 (ja) |
| CA (1) | CA2976126A1 (ja) |
| HK (1) | HK1248555A1 (ja) |
| WO (1) | WO2016138091A2 (ja) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014186469A2 (en) | 2013-05-14 | 2014-11-20 | Board Of Regents, The University Of Texas System | Human application of engineered chimeric antigen receptor (car) t-cells |
| SG10201811816RA (en) | 2014-02-14 | 2019-02-27 | Univ Texas | Chimeric antigen receptors and methods of making |
| CA2964783C (en) | 2014-11-05 | 2024-01-23 | Board Of Regents, The University Of Texas System | Chimeric antigen receptors (car) to selectively target protein complexes |
| AU2016229094B2 (en) | 2015-03-11 | 2020-02-06 | Board Of Regents, The University Of Texas System | Transposase polypeptides and uses thereof |
| EP3349791A1 (en) | 2015-09-15 | 2018-07-25 | Board of Regents, The University of Texas System | T-cell receptor (tcr)-binding antibodies and uses thereof |
| EP3368075B1 (en) | 2015-10-27 | 2020-01-29 | Board of Regents, The University of Texas System | Chimeric antigen receptor molecules and uses thereof |
| WO2018218038A1 (en) * | 2017-05-24 | 2018-11-29 | Effector Therapeutics, Inc. | Methods and compositions for cellular immunotherapy |
| CN109136282A (zh) * | 2018-09-30 | 2019-01-04 | 北京鼎成肽源生物技术有限公司 | 一种hafft1细胞的构建方法 |
| WO2020102726A1 (en) * | 2018-11-16 | 2020-05-22 | Rapa Therapeutics, Llc | Method for manufacturing of human hybrid regulatory t/th2 cells (hybrid treg/th2 cells) from de-differentiated t cells |
| KR102594009B1 (ko) | 2021-02-01 | 2023-10-24 | 서울대학교산학협력단 | 형질전환 생식세포의 제조 방법 및 이를 이용한 형질전환 동물의 제조 방법 |
| WO2023056408A1 (en) * | 2021-09-30 | 2023-04-06 | University Of Southern California | Human hepatocyte culture medium and conditioned medium of in vitro cultured human hepatocytes and uses thereof |
| CN114740196B (zh) * | 2022-04-08 | 2023-04-18 | 中南大学湘雅二医院 | 标志物及其在制备评价机体免疫功能的产品中的应用 |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0920679A2 (pt) * | 2008-10-08 | 2022-05-17 | Intrexon Corp | Células construídas expressando múltiplos imunomoduladores e usos das mesmas |
| EP2496244B8 (en) * | 2009-11-02 | 2017-11-08 | Emory University | Drug resistant immunotherapy for treatment of a cancer |
| NZ612512A (en) | 2010-12-09 | 2015-03-27 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| AU2012203048A1 (en) * | 2011-05-24 | 2012-12-13 | Agency For Science, Technology And Research | IRES mediated multicistronic vectors |
| US10391126B2 (en) | 2011-11-18 | 2019-08-27 | Board Of Regents, The University Of Texas System | CAR+ T cells genetically modified to eliminate expression of T-cell receptor and/or HLA |
| EP3594245A1 (en) * | 2012-02-13 | 2020-01-15 | Seattle Children's Hospital d/b/a Seattle Children's Research Institute | Bispecific chimeric antigen receptors and therapeutic uses thereof |
| WO2014186469A2 (en) | 2013-05-14 | 2014-11-20 | Board Of Regents, The University Of Texas System | Human application of engineered chimeric antigen receptor (car) t-cells |
| SG11201509609SA (en) | 2013-05-24 | 2015-12-30 | Univ Texas | Chimeric antigen receptor-targeting monoclonal antibodies |
| CA2926859A1 (en) | 2013-10-25 | 2015-04-30 | Board Of Regents, The University Of Texas System | Polyclonal gamma delta t cells for immunotherapy |
| JP6976058B2 (ja) * | 2013-11-22 | 2021-12-01 | セレクティスCellectis | 免疫療法のための化学療法薬耐性t細胞を工学的に作製する方法 |
| SG10201811816RA (en) | 2014-02-14 | 2019-02-27 | Univ Texas | Chimeric antigen receptors and methods of making |
| BR112016023500A2 (pt) * | 2014-04-10 | 2017-10-17 | Seattle Childrens Hospital Dba Seattle Childrens Res Inst | método e composições para imunoterapia celular |
| US20170158749A1 (en) | 2014-04-23 | 2017-06-08 | Board Of Regents, The University Of Texas System | Chimeric antigen receptors (car) and methods for making and using the same |
| AU2015249371B2 (en) | 2014-04-24 | 2020-04-30 | Board Of Regents, The University Of Texas System | Application of induced pluripotent stem cells to generate adoptive cell therapy products |
| CA2964785A1 (en) | 2014-11-05 | 2016-05-12 | Board Of Regents, The University Of Texas System | Gene modified immune effector cells and engineered cells for expansion of immune effector cells |
| CA2964783C (en) | 2014-11-05 | 2024-01-23 | Board Of Regents, The University Of Texas System | Chimeric antigen receptors (car) to selectively target protein complexes |
| AU2016229094B2 (en) | 2015-03-11 | 2020-02-06 | Board Of Regents, The University Of Texas System | Transposase polypeptides and uses thereof |
| EP3349791A1 (en) | 2015-09-15 | 2018-07-25 | Board of Regents, The University of Texas System | T-cell receptor (tcr)-binding antibodies and uses thereof |
| EP3368075B1 (en) | 2015-10-27 | 2020-01-29 | Board of Regents, The University of Texas System | Chimeric antigen receptor molecules and uses thereof |
-
2016
- 2016-02-24 EP EP16741163.6A patent/EP3261656B1/en active Active
- 2016-02-24 CA CA2976126A patent/CA2976126A1/en active Pending
- 2016-02-24 JP JP2017562971A patent/JP6947647B2/ja active Active
- 2016-02-24 US US15/552,821 patent/US10808230B2/en active Active
- 2016-02-24 EP EP20191615.2A patent/EP3804741A3/en active Pending
- 2016-02-24 KR KR1020177024195A patent/KR20170117095A/ko not_active Application Discontinuation
- 2016-02-24 WO PCT/US2016/019288 patent/WO2016138091A2/en active Application Filing
- 2016-02-24 AU AU2016222850A patent/AU2016222850B2/en active Active
- 2016-02-24 CN CN201680011714.XA patent/CN107667169B/zh active Active
-
2018
- 2018-06-27 HK HK18108279.5A patent/HK1248555A1/zh unknown
-
2020
- 2020-09-04 US US17/013,195 patent/US20210054346A1/en not_active Abandoned
-
2021
- 2021-06-02 AU AU2021203606A patent/AU2021203606A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US10808230B2 (en) | 2020-10-20 |
| CN107667169A (zh) | 2018-02-06 |
| JP2018506995A (ja) | 2018-03-15 |
| EP3261656A2 (en) | 2018-01-03 |
| AU2016222850B2 (en) | 2021-04-01 |
| EP3804741A2 (en) | 2021-04-14 |
| WO2016138091A2 (en) | 2016-09-01 |
| US20180298349A1 (en) | 2018-10-18 |
| WO2016138091A3 (en) | 2016-12-29 |
| US20210054346A1 (en) | 2021-02-25 |
| EP3261656B1 (en) | 2020-08-19 |
| AU2021203606A1 (en) | 2021-07-01 |
| AU2016222850A1 (en) | 2017-08-24 |
| CN107667169B (zh) | 2021-10-29 |
| KR20170117095A (ko) | 2017-10-20 |
| HK1248555A1 (zh) | 2018-10-19 |
| EP3804741A3 (en) | 2021-07-14 |
| CA2976126A1 (en) | 2016-09-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6947647B2 (ja) | 遺伝子改変t細胞の選択方法 | |
| JP2021121208A (ja) | 改変t細胞に関する方法および組成物 | |
| US9598489B2 (en) | Human alpha-folate receptor chimeric antigen receptor | |
| JP2021516996A (ja) | 生物学的に関連する直交サイトカイン/受容体対 | |
| CN108137670A (zh) | Ny-eso-1特异性tcr及其使用方法 | |
| KR20180028530A (ko) | 증가된 세포독성을 갖는 변형된 자연 살해 세포 및 자연 살해 세포주 | |
| KR20200133370A (ko) | 입양 주입된 t 세포의 지속성 강화 방법 | |
| JP2021502113A (ja) | 免疫療法のためのt細胞におけるtgfbr2のcrispr−cas9編集のための方法、組成物、および構成要素 | |
| TW201928052A (zh) | 靶向ny-eso-1的基因修飾免疫細胞及其用途 | |
| US20220110973A1 (en) | Method and composition for treating tumors | |
| EP3217989B1 (en) | Compositions and methods of stimulating and expanding t cells | |
| CN114222815A (zh) | Suv39h1缺陷的免疫细胞 | |
| JP2023182711A (ja) | 免疫療法のためのt細胞におけるcblbのcrispr-cas9編集のための方法、組成物および構成要素 | |
| WO2020118634A1 (zh) | 靶向gpc3的免疫效应细胞及其应用 | |
| US10081663B2 (en) | Affinity maturated T cell receptors and use thereof | |
| US20210069245A1 (en) | Mirna modulation of t cell signaling and uses thereof | |
| US20240018474A1 (en) | Modulating bhlhe40 in the differentiation of type 1 regulatory t cells and controlling t cell exhaustion | |
| Kerr | Modulation of T Cells to Promote an Anti-Tumor Response: Activation And Inhibition Of T Cells For Efficacy In T-Cell Lymphomas And Melanoma | |
| JP2024502170A (ja) | 癌のための改良された養子細胞移植療法 | |
| WO2024052676A1 (en) | Modified t-cells for use in the treatment of gastroesophageal cancer | |
| CN116390746A (zh) | 双car-t细胞 | |
| NZ757552A (en) | Chimeric antigen receptor | |
| KR20190070317A (ko) | 암 면역요법을 위한 조성물 및 방법 | |
| NZ757552B2 (en) | Chimeric antigen receptor |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190201 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200109 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200409 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200915 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201203 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210317 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210611 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210816 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210827 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210916 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6947647 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |