JP6930911B2 - 分子の探索、検出、および解析のための外部光源を備える集積装置 - Google Patents
分子の探索、検出、および解析のための外部光源を備える集積装置 Download PDFInfo
- Publication number
- JP6930911B2 JP6930911B2 JP2017506981A JP2017506981A JP6930911B2 JP 6930911 B2 JP6930911 B2 JP 6930911B2 JP 2017506981 A JP2017506981 A JP 2017506981A JP 2017506981 A JP2017506981 A JP 2017506981A JP 6930911 B2 JP6930911 B2 JP 6930911B2
- Authority
- JP
- Japan
- Prior art keywords
- waveguide
- excitation
- sample
- excitation energy
- specimen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6408—Fluorescence; Phosphorescence with measurement of decay time, time resolved fluorescence
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6869—Methods for sequencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6869—Methods for sequencing
- C12Q1/6874—Methods for sequencing involving nucleic acid arrays, e.g. sequencing by hybridisation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6452—Individual samples arranged in a regular 2D-array, e.g. multiwell plates
- G01N21/6454—Individual samples arranged in a regular 2D-array, e.g. multiwell plates using an integrated detector array
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/648—Specially adapted constructive features of fluorimeters using evanescent coupling or surface plasmon coupling for the excitation of fluorescence
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6486—Measuring fluorescence of biological material, e.g. DNA, RNA, cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N2021/6417—Spectrofluorimetric devices
- G01N2021/6419—Excitation at two or more wavelengths
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N2021/6417—Spectrofluorimetric devices
- G01N2021/6421—Measuring at two or more wavelengths
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
- G01N2021/6441—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks with two or more labels
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N2021/6463—Optics
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N2021/6463—Optics
- G01N2021/6471—Special filters, filter wheel
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/06—Illumination; Optics
- G01N2201/064—Stray light conditioning
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/06—Illumination; Optics
- G01N2201/069—Supply of sources
- G01N2201/0696—Pulsed
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/08—Optical fibres; light guides
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/12—Circuits of general importance; Signal processing
Description
。
励起エネルギーで照明するステップと、第一のピクセルのセンサ領域の少なくとも1つのセンサからの読取り信号から、第一のマーカによる放出物から生成された放出エネルギーの寿命を検出するステップとを含む。
「タグ」という用語は、本開示において、タグ、プローブ、またはレポータを指すために使用され得、解析対象の検体に付着されるマーカ、または検体と結合されてもよい反応物質に付着されるマーカを含む。
「放出物」という用語は、本開示において、マーカおよび/または検体からの発光を指すために使用され得る。これには、放射放出物(例えば、光学放出物)または非放射エネルギー移動(例えば、デクスタ型エネルギー移動またはフェルスタ共鳴エネルギー移動)が含まれる。放出物は、検体ウェル内の検体および/またはマーカの励起から得られる。
「セルフアライン」という用語は、本開示において、第一のリソグラフィによるパターニングステップ(例えば、フォトリソグラフィ、イオンビームリソグラフィ、EUVリソグラフィ)によって第一の要素のパターンが印刷され、第二のリソグラフィによるパターニングステップによって、第一のリソグラフィによるパターニングステップと整合させて第二の要素のパターンが印刷される2つの別々のリソグラフィパターニングステップを使用せずに、少なくとも2つの異なる要素(例えば、検体ウェルおよび放出物結合構造、検体ウェルおよび励起源)が製造されて、相互に整列される微細製作プロセスを指すために使用され得る。セルフアラインプロセスは、1つのリソグラフィパターニングステップに第一および第二の要素の両方のパターンを含めるステップを含んでいてもよく、または第一の要素の製造後の構造の特徴物を使用して第二の要素を形成するステップを含んでいてもよい。
当業者であれば、本明細書中で説明する図面が例示を目的としているにすぎないことがわかるであろう。当然のことながら、いくつかの例において、本発明の各種の態様が本発明の理解を容易にするために誇張または拡大して示され得る。図面中、同様の参照文字は異なる図面を通じて概して同様の特徴、機能的に同様のおよび/または構造的に同様の要素を指す。図面は必ずしも正確な縮尺によるとはかぎらず、その代わりに本教示の原理を例示することに重点を置いている。図面は、決して本教示の範囲を限定することを意図されていない。
より明らかとなるであろう。
図面に関して実施形態を説明する際、方向に関する言及(「上」、「下」、「上側」、「下側」、「左」、「右」、「水平」、「垂直」等)が使用され得る。このような言及は、通常の向きで図面を見ている読者にとっての補助となるためのものにすぎない。これらの方向に関する言及は、実施される装置の好ましいまたは唯一の向きを説明しようとするものではない。装置は他の向きでも実施されてよい。
単回使用集積装置は、世界の何れの場所でも使用でき、検体解析にコスト高の生物学研究所が必要となるという制約を受けない。そのため、世界においてこれまで生物検体の定量解析を実行できなかった地域に自動生体解析がもたらされ得る。例えば、乳児の血液検査は、血液検体を使い捨て集積装置の上に載せ、使い捨て集積装置を小型のポータブルの基本解析機器内にセットし、結果をコンピュータで処理して、使用者が即時にそれを見られるようにすることによって実行できる。データはまた、データネットワーク上で離れた場所に転送することにより、解析され、および/または後に臨床解析するために保存されてもよい。
核酸分子を合成し、時間に伴うヌクレオチドの組込みを識別することによって判定すること(例えば、合成による配列解析)を含むことができる。代替案として、配列解析は、生体分子の個別のサブユニットを直接識別することを含み得る。
生率において異なっていてもよい。例えば、核酸配列解析法のなかには、合成による配列解析に基づくものがあり、この場合、ヌクレオチドの識別は、新たに合成される、標的核酸分子と相補的な核酸の鎖内にヌクレオチドが組み込まれるときに判定される。合成による配列解析法のなかには、標的核酸分子の集合(例えば、標的核酸のコピー)の存在、または標的核酸の集合を実現するための標的核酸の増幅ステップを必要とするものがある。
命は、いくつかの実施形態において、0.1〜20nsの範囲であってもよい。しかしながら、本明細書に記載されている技術は、使用されるマーカの寿命に関して限定されない。
てもよい。他の実施形態において、マーカのサブセットが同じ放出寿命を有するが、異なる放出波長および/または異なる励起波長を有するようなマーカの集合が選択されてもよい。他の実施形態において、マーカのサブセットが同じ励起波長を有するが、異なる放出波長および/または異なる放出寿命を有するようなマーカの集合が選択されてもよい。
いくつかの実施形態において、マーカの識別に3つ以上の励起波長またはエネルギーが使用されてもよい。このような実施形態において、マーカは、複数の励起波長に応答して放出された光子の強度または数によって区別されてもよい。マーカは、マーカを特定の励起波長に曝すことに応答して放出された光子の数を検出することによって、複数のマーカから区別可能であってもよい。いくつかの実施形態において、マーカは、マーカを一度に複数の励起エネルギーのうちの1つで照明し、複数の励起エネルギーのうちでそのマーカが最も多い光子を放出した励起エネルギーを識別することによって区別されてもよい。他の実施形態において、マーカが異なる励起エネルギーに応答して放出した光子の数がマーカを識別するために使用されてもよい。第一の励起エネルギーに応じて光子を放出する確率が第二の励起エネルギーより高い第一のマーカは、第二の励起エネルギーに応答して光子を放出する確率が第一の励起エネルギーより高い第二のマーカから区別されてもよい。このようにして、異なる励起エネルギーに応答して特定の量の光子を放出する確率が区別可能であるマーカは、未知のマーカを異なる励起エネルギーに曝しながら、放出された光子を測定することによって識別されてもよい。このような実施形態において、マーカは、複数の励起エネルギーに曝されてもよく、マーカの識別は、そのマーカが何れかの光を放出したか否か、および/または放出された特定の数の光子を判定することによって実現されてもよい。何れの適当な数の励起エネルギー源が使用されてもよい。いくつかの実施形態において、異なるマーカ(例えば、4つの異なるマーカ)間の区別に4つの異なる励起エネルギーが使用されてもよい。いくつかの実施形態において、異なるマーカ間の区別に3つの異なる励起エネルギーが使用されてもよい。マーカの存在を区別するために、放出寿命および放出スペクトルを含め、異なる励起エネルギーに応答して放出された光子の量と共に、マーカのその他の特徴が使用されてもよい。
識し、そのように理解した。低コストの集積装置の使用により、所定のバイオアッセイで実行コストが削減される。生物検体が集積装置上にセットされ、バイオアッセイが終了したら廃棄されてもよい。集積装置は、様々な使い捨ての集積装置と共に繰返し使用されてもよい、より高価で複数回使用される機器とインタフェースする。小型のポータブル機器とインタフェースする低コストの集積装置は、世界の何れの場所でも使用でき、検体解析のために研究の専門知識を必要とする高コストの生物学的研究所の制約を受けない。そのため、世界においてこれまで生物検体の定量解析を行うことのできなかった地域に自動生体解析がもたらされ得る。例えば、乳児の血液検査は、血液検体を使い捨て集積装置の上に載せ、使い捨て集積装置を小型のポータブルの解析機器にセットし、結果を機器に接続されたコンピュータで処理して、使用者が即時にそれを見られるようにすることによって実行してもよい。データはまた、データネットワーク上で離れた場所に転送することにより、解析され、および/または後に臨床解析するために保存されてもよい。あるいは、機器はまた、集積装置のセンサから得たデータを解析するための1つまたは複数のプロセッサを含んでいてもよい。
I.システムの概要
システムは、集積装置と、集積装置とインタフェースするように構成された機器とを含む。集積装置はピクセルのアレイを含み、ピクセルは検体ウェルと、少なくとも1つのセンサとを含む。集積装置の表面には複数の検体ウェルがあり、検体ウェルは、集積装置の表面上に載せられた試料からの検体を受けるように構成される。試料は複数の検体、いくつかの実施形態において、異なる種類の検体を含んでいてもよい。複数の検体ウェルは、検体ウェルの少なくとも一部が試料からの1つの検体を受けるように構成される設計であってもよい。いくつかの実施形態において、検体ウェル内の検体の数は検体ウェル間で分散されてもよく、1つの検体を収容する検体ウェルがあれば、検体が収容されない、または2つ以上の検体を収容する検体ウェルもある。例えば、試料には複数の一本鎖DNA鋳型が含まれていてもよく、集積装置の表面上の検体ウェルは、1つの一本鎖DNA鋳型を受けてもよい。集積装置の検体ウェルの少なくとも一部は、一本鎖DNA鋳型を収容してもよい。試料にはまた、タグ付きdNTPが含まれていてもよく、これはその後、検体ウェルに入り、それがDNAの相補的な鎖内に組み込まれるときにヌクレオチドの識別が可能になり得る。このような例において、「検体」とは、一本鎖DNAとポリメラーゼによって現在組み込まれているタグ付きdNTPとの両方を指してもよい。いくつかの実施形態において、試料には一本鎖DNA鋳型が含まれていてもよく、タグ付きdNTPはその後、検体ウェル内に、ヌクレオチドがその検体ウェル内のDNA相補的な鎖内に組み込まれたときに導入され得る。このようにして、ヌクレオチド組込みのタイミングは、タグ付きdNTPが集積装置の検体ウェル内にいつ導入されるかによって制御されてもよい。
ネルギーの空間的分散を捕捉する大きさおよび配置であってもよい。いくつかの実施形態において、1つまたは複数のセンサは、検体の放出エネルギーに関連付けられるタイミングの特徴(例えば、蛍光寿命)を検出するように構成されてもよい。したがって、1つまたは複数のセンサからの出力信号は、複数のマーカからマーカを区別するために使用されてもよく、この複数のマーカは、試料内のある検体を識別するために使用されてもよい。いくつかの実施形態において、検体は、複数の励起エネルギーによって励起されてもよく、複数の励起エネルギーに応答して検体により放出された放出エネルギーおよび/または放出エネルギーのタイミングの特徴は、複数のマーカからあるマーカを区別できる。
00ピクセル、いくつかの実施形態によれば1,000〜10,000ピクセル、いくつかの実施形態によれば10,000〜100,000ピクセル、いくつかの実施形態によれば100,000〜1,000,000ピクセル、さらにいくつかの実施形態によれば1,000,000〜10,000,000ピクセルを含んでいてもよい。いくつかの実施形態において、集積装置2−102には、それより少ないまたはそれより多いピクセルがあってもよい。集積装置2−102と機器2−104とは、大きいピクセルアレイ(例えば、1000を超えるピクセル)に関連付けられるデータを取り扱うための多チャンネル高速通信リンクを含んでいてもよい。
−110の読取り信号からの情報が含まれていてもよい。機器2−104はまた、センサ2−110から受け取られたデータを解析し、および/または制御信号を励起源2−106に送信するための処理装置2−122も含んでいてよい。いくつかの実施形態において、処理装置2−122は、汎用プロセッサ、専用に調整されたプロセッサ(例えば、1つまたは複数のマイクロプロセッサまたはマイクロコントローラコア、フィールドプログラマブルゲートアレイ(FPGA:field−programmable integrated circuit)、特定用途集積回路(ASIC:application−specific integrated circuit)、カスタム集積回路、デジタル信号プロセッと(DSP:digital signal processor)、またはそれらの組合せなどの中央処理装置(CPU:central processing unit))を含んでいてもよい。いくつかの実施形態において、センサ2−110からのデータの処理は、処理装置2−122と外部コンピューティングデバイス2−120との両方で行われてもよい。他の実施形態において、コンピューティングデバイス2−120を省略してもよく、センサ2−110からのデータの処理は処理装置2−122によってのみ行われてもよい。
、励起エネルギーを検体ウェル3−108に送達して、検体、または検体に付着されているか、またはその他の方法で検体に関連付けられている少なくとも1つの発光マーカを、それが検体ウェル3−108内の励起領域にある間に励起させるように構成されていてもよい。複数分子の検体において、1種類の発光マーカが分子の種類に一意的に関連付けられてもよい。励起中または励起後に、発光マーカは放出エネルギーを放出してもよい。複数のマーカが使用される場合、これらは異なる特徴的エネルギーを放出してもよい。いくつかの実施形態において、複数のマーカは異なる特徴的寿命を有していてもよい。それに加えて、多数のマーカは複数の励起エネルギーに対する応答において異なっていてもよい。検体のためのマーカは、その励起応答、特徴的エネルギーまたは波長、および/または特徴的寿命により識別されてもよい。検体からの放出は、検体ウェル3−108からセンサ3−110へと放射してもよい。
もよい。図2−2において、集積装置の構成要素は1つのレベルで描かれているが、構成要素は基板2−200の上の複数のレベルに製造してもよい。
II.集積装置
集積装置は、外部励起エネルギー源から励起エネルギーを受けるように構成されていてもよい。いつくかの実施形態において、装置のある領域が、集積装置の外にある励起エネ
ルギー源に結合されるために使用されてもよい。集積装置の構成要素は、励起源結合領域からの励起エネルギーを少なくとも1つのピクセルに案内してもよい。いくつかの実施形態において、少なくとも1つの波長は、検体ウェルを有する少なくとも1つのピクセルに励起エネルギーを送達するように構成されていてもよい。検体ウェル内にある検体は、励起エネルギーで照明されたことに応答して放出エネルギーを放出してもよい。ピクセル内にある1つまたは複数のセンサは、放出エネルギーを受け取るように構成される。
3−220および検体ウェル3−203の構成により、励起エネルギー収集構成要素3−215がなくても励起エネルギーを十分に結合でき得る。
A.励起源結合領域
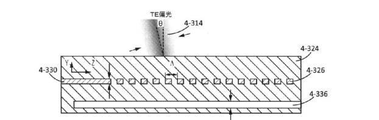
励起源は、外部励起エネルギー源と結合し、励起を集積装置のピクセル領域の少なくとも1つのピクセルに向かって案内するように構成された励起源結合領域を有していてもよい。励起源結合領域は、光を少なくとも1つの導波路に結合するように構成された1つまたは複数の構造を含んでいてもよい。励起エネルギーを導波路へと結合するための何れの適当なメカニズムが使用されてもよい。
を介して導波路に光を結合してもよい。格子カプラと導波路のテーパとのこのような組合せによって、励起源と集積装置とのアラインメントおよび位置決めの許容差を大きくすることができる。
2に示されるy方向に沿って、約50nm、約100nm、約150nm、または約200nmの寸法を有していてもよい。導波路内の光の伝播に平行な方向に沿った、例えば図4−2に示されるz方向に沿った格子カプラの構造間の間隔は、何れの適当な距離であってよい。格子間隔は、約300nm、約350nm、約400nm、約420nm、約450nm、または約500nmであってもよい。いくつかの実施形態において、格子間隔は格子カプラ内で可変的であってもよい。格子カプラ4−216は、集積装置4−200の表面4−215に対して実質的に平行なその1つまたは複数の寸法は、外部励起源4−214との結合に適した面積を提供してもよい。格子カプラ4−216の面積は、励起源4−214からの光のビームの1つまたは複数の寸法とマッチしていてもよく、それによってビームは格子カプラ4−215と重複する。格子カプラの面積は、約10マイクロメートル、約20マイクロメートル、約30マイクロメートル、または約40マイクロメートルの直径のビームに合わせて構成されてもよい。
−320の寸法が得られる。格子カプラ4−316の、図4−3Cの平面内の面積は、外部励起源との結合に適していてもよい。ビームが格子カプラ4−316領域と実質的に重複するような、ビームの格子カプラ4−316に対する励起エネルギーのアラインメントは、導波路4−320への励起エネルギーの結合を改善してもよい。テーパ領域4−318の格子カプラ4−316に関する配置は、適当な結合効率を提供してもよい。テーパ領域4−318と格子カプラ4−316との角度は、光の伝播に対して垂直な導波路の寸法の減少に伴って励起エネルギーの損失を減らすことにより、励起源から導波路4−320の励起エネルギーの結合の効率を改善するように選択されてもよい。
B.導波路
集積装置は、所望の量の励起エネルギーを集積装置の1つまたは複数の検体ウェルに送達するように構成された1つまたは複数の導波路を含んでいてもよい。1つまたは複数の検体ウェルの付近に、励起エネルギーが導波路に沿って伝播すると、励起エネルギーの一部が1つまたは複数の検体ウェルに結合するように位置付けられた導波路である。導波路は、複数のピクセルに励起エネルギーを結合し、バス導波路として機能してもよい。例えば、1つの導波路が励起エネルギーを集積装置の行と列とのピクセルに送達してもよい。いくつかの実施形態において、導波路は、複数の特徴的波長を有する励起エネルギーを伝播させるように構成されてもよい。集積装置のピクセルは、導波路の励起エネルギーを検体ウェルの付近に向かって誘導するように構成された追加の構造(例えば、マイクロキャビティ)を含んでいてもよい。いくつかの実施形態において、導波路は、検体ウェル内および/または検体ウェルの付近の領域に延長するように構成されたエバネッセントテールを有する光学モードを搬送してもよい。検体ウェルの付近に配された追加のエネルギー結合構造は、エバネッセンステールからのエネルギーを検体ウェル内に結合してもよい。
られてもよく、これは約0.3マイクロメートル、約0.5マイクロメートル、または約0.7マイクロメートルである。
よび/または周辺材料の所望の屈折率は、導波路および/または周辺材料を、複数の材料を含むように形成することによって得られる。いくつかの実施形態において、導波路は、窒化シリコンを含み、周辺材料は二酸化シリコンを含む。
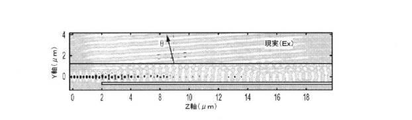
関する曲率半径に関して、曲げによる光の損失をグラフにしたものである。一例として、90度の曲げ部につき少なくとも0.1dBの損失を実現するために、断面幅が500nmの導波路は、その曲げ半径が約35マイクロメートルより大きくてもよく、断面幅が700nmの導波路は、その曲げ半径は約22マイクロメートルより大きくてもよい。
クセルに提供される。
において、入力4−720は異なる励起エネルギーをMMIスプリッタ4−717に提供してもよい。他の実施形態において、導波路の分割は、複数の分割ステップで実行されてもよい。一例として、分割は、マルタモード干渉スプリッタの2つの集合を使用して実行されてもよく、第一のMMIスプリッタからの出力導波路が第二のMMIスプリッタのための入力として使用される。例えば、図4−7に示されるように、入力導波路4−730はMMIスプリッタ4−727によって複数の出力に分割され、これには出力4−738を提供するように構成されたMMIスプリッタ4−737に結合される出力4−728が含まれる。いくつかの実施形態において、MMIスプリッタ4−727は、35の出力を提供してもよく、出力の各々は4−737等の他のMMIスプリッタにより8つの出力導波路に分割される。中間の35の導波路の各々が8つの導波路に分割されるため、この非限定的な例において、280の導波路が形成される。
うに構成されてもよい。図4−9Aはスライス格子カプラを示しており、これは、1つまたは複数の波長を有する光を複数の出力導波路4−904に結合するために使用されてもよい。スライス格子は線形の回折格子構造であり、光の波長よりはるかに広い(例えば、幅が数百マイクロメートル)。これは、窒化シリコンと酸化シリコンなどの誘電体との交互の層から形成される。いくつかの実施形態において、異なる波長をスライス格子に、これらが異なる角度で入射するように発射することにより、複数の波長をスライス格子に結合することができる。このような実施形態において、格子カプラに入射する1つまたは複数のビームは、図4−9Aに示されるように、格子構造自体の大きさと略同じスポットサイズ4−603を有する。
C.検体ウェル
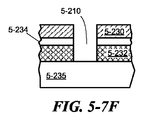
いくつかの実施形態によれば、検体ウェル5−210は、集積装置の1つまたは複数のピクセルに形成されてもよい。検体ウェルは小さい体積または領域を含んでいてもよく、これらは基板5−105の基板に形成され、検体5−101が基板の表面上に置かれた試料から検体ウェル内に、またはそれから拡散するように配置されており、それが集積装置の1つのピクセル5−100を示す図5−1および図5−2に描かれている。各種の実施形態において、検体ウェル5−210は導波路5−240からの励起エネルギーを受けるようには配置されていてもよい。検体ウェル内に拡散した検体5−101は、接着剤5−211により、検体ウェルの励起領域5−215内に一時的または永久的に保持されてもよい。励起領域において、検体は励起エネルギー(例えば、励起放射5−247)によって励起され、その後、放射を放出し、それが観察されて、評価され、検体が特徴付けられてもよい。
した。これらの態様は、検体ウェルの形状および構造に関係し、また、励起エネルギーを検体ウェルおよび検体ウェルから放出された放射に結合することを補助する、隣接する光学的およびプラズモン構造(後述)に関係する。
において、窪みの形状および構造は、局所的な励起電場を変化させ(例えば、層5−235と検体ウェル内の流体との間の屈折率の違いによる)、さらに窪み内の励起エネルギーの強度を増大させることができる。窪み5−216は、層5−235内において、検体体積のうちの検体ウェル5−214と窪み5−216とを占有する部分が、層5−216を形成する材料により取り囲まれるように形成されてもよい。
において、第一の層5−610は、酸化物(例えば、SiO2)または窒化物(例えば、Si3N4)から形成されてもよく、第二の層5−620は、酸化物または窒化物から形成されてもよい。
放射物の急冷および/または放射寿命の変更を減らすことができる。
退ドープ半導体またはグラフェンが使用されてもよい。いくつかの実装形態において、検体ウェルは2つの層に形成されてもよく、他の実装形態において、検体ウェルは4つ以上の層に形成されてもよい。いくつかの実施形態において、検体ウェルを形成するために使用される多層材料は、検体ウェルに入射する励起放射により生成され得る界面励起子を増加させ、または抑制するように選択されてもよい。いくつかの実施形態において、検体ウェルを形成するために使用される多層材料は、検体ウェルの底部での表面プラズモンの生成を増大させ、またはウェルの上部での表面プラズモン放射を抑制するように選択されてもよい。いくつかの実施形態において、検体ウェルを形成するために使用される多層材料は、励起放射が検体ウェルおよび多層構造を超えてバルク試料中へと伝播するのを抑制するように選択されてもよい。いくつかの実施形態において、検体ウェルを形成するために使用される多層材料は、検体ウェルに入射する励起放射により生成され得る界面励起子を増加させ、または抑制するように選択されてもよい。
対する化学物質の親和性に基づいて選択されてもよく、層5−280は、検体の種が層に付着することをさらに阻止するために化学的または生物学的物質で処理されてもよい。いくつかの実施形態によれば、例えば、コーティング層5−280は、ポリリン酸保護層で保護され得るアルミナを含んでいてもよい。いくつかの実施形態において、追加のまたは代替的なコーティングおよび保護材が使用されてもよい。
検体ウェル5−210は、何れの適当なマイクロまたはナノ製造工程により形成されてもよく、これには、フォトリソグラフィ、深紫外線フォトリソグラフィ、浸漬フォトリソグラフィ、近接場光接触フォトリソグラフィ、EUVリソグラフィ、X線リソグラフィ、ナノインプリントリソグラフィ、干渉リソグラフィ、ステップアンドフラッシュリソグラフィ、直接書込み電子ビームリソグラフィ、イオンビームリソグラフィ、イオンビームミリング、リフトオフ加工、反応イオンエッチング等が含まれていてもよいが、これらに限定されない。いくつかの実施形態によれば、検体ウェル5−210は、フォトリソグラフィおよびリフトオフ加工を使用して形成されてもよい。検体ウェルのリフトオフ加工に関連する例示的な製造ステップが図5−9A〜Fに示されている。ピクセルにおいて単一の検体ウェルまたは構造を製造することが典型的に図面に示されているが、基板上に(例えば各ピクセルに)多数の検体ウェルまたは構造が同時製造されてもよいことがわかるであろう。
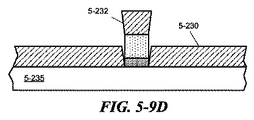
C層5−910に転写されてもよい。この領域は、その後、検体ウェルを形成するのに望ましい少なくとも1つの材料5−230、例えば導電体または金属で被覆されてもよい。堆積された材料の一部は、図5−9Dに示されるように、ピラー5−922の上のキャップ5−232を形成する。フォトレジスト5−920とARC層5−910とは、その後、選択的除去プロセス(例えば、少なくともレジストを溶解させ、キャップを解放または「リフトオフ」する、撹拌のあるまたはないケミカルバスを使用して)剥離されてもよい。ARC層5−910が残っている場合、選択的エッチングを使用して基板から剥離してもよく、それによって図5−9Eに示されるように、検体ウェル5−210が残る。いくつかの実施形態によれば、検体ウェルの側壁5−214は、少なくとも1つの材料2−230の堆積の性質により、傾斜していてもよい。
質マスクにより、材料の層5−230内により深くエッチングし、より高いアスペクト比の検体ウェルを形成することができる。
および隣接する層5−235の上で停止してもよく、またはいくつかの実施形態において、非選択的で時間制御されたエッチングであってもよい。
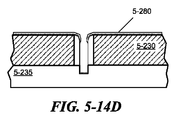
テーパ付きの検体ウェルの基部の中央に堆積されてもよい。例えば、接着剤または接着剤前駆体は、図5−14Aに示されるように、前述のように形成されたテーパ付きの検体ウェル内に指向的に堆積させてもよい。検体ウェルの壁は、接着剤層5−211の堆積前または後に酸化プロセスによって保護されてもよい。材料5−230の表面上に残る接着剤または前駆体は、図5−14Dに関連して説明したように保護されてもよい。いくつかの実施形態において、材料5−230の上面上の接着剤は、化学機械的研磨ステップにより除去されてもよい。接着剤層または接着剤層前駆体を検体ウェルの基部の中央に形成することによって、検体からの放出に対する有害な効果(例えば、検体ウェルからの検体の放射の抑制または急冷、検体ウェルの周囲に形成されたエネルギー結合構造に関して中央に位置付けられていないことによる検体からの好ましくない放射分布、検体に関する発光寿命に対する悪影響)が低減し得る。
よい。第二の酸化アルミニウム層が堆積されて、窪みの底を含め、検体ウェルの縁辺を等角的に被覆してもよい。第二の酸化アルミニウム層は、いくつかの実施形態によれば、原子層堆積技術より堆積されてもよい。次に、酸化アルミニウムの第二の層に対して窪みの底部から異方性エッチングが行われ、酸化シリコン基板が露出されてもよい。
D.励起エネルギーの検体ウェルへの結合
集積装置の1つまたは複数の検体ウェルへの励起エネルギーの結合は、1つまたは複数の技術を通じて行われてもよい。前述のように、いくつかの実施形態において、導波路は、励起源と共に1つまたは複数の検体ウェルに結合するように位置付けられる。励起エネルギーが導波路に沿って伝播する間、励起エネルギーの一部は様々な光結合技術を通じて1つまたは複数の検体ウェルに結合されてもよい。例えば、導波路は励起エネルギーを実質的に1つの方向に案内してもよく、エバネッセント波またはテールがこの1つの方向に垂直に形成され得、いくつかの例において導波路構造の外部にあり得る。このようなエバネッセントテールは、励起エネルギーの一部を1つまたは複数の検体ウェルに向かって誘導してもよい。いくつかの実施形態において、検体ウェル層は、励起エネルギーを検体ウェル内の局所化された領域に誘導するように設計され、構成されてもよい。検体ウェルは、検体ウェルの局所化された領域内に検体を保持するように構成されてもよく、それによって励起エネルギーは検体へと誘導される。
ビティは、何れの適当な材料から形成されてもよい。いくつかの実施形態において、マイクロキャビティは、窒化シリコンを含んでいてもよい。
に配置され、マイクロキャビティと検体ウェルとが重複しない。図6−3Bは、検体ウェル6−318から、マイクロキャビティ6−316aと検体ウェル6−318との間に重複領域がないように位置付けられたマイクロキャビティ6−318aを示している。同様に、図6−3Cは、検体ウェル6−328から、マイクロキャビティ6−324に関して、マイクロキャビティ6−316aと検体ウェル6−318との間に重複領域がないように位置付けられたマイクロキャビティ6−326を示している。いくつかの実施形態において、複数のマイクロキャビティが検体ウェルからずらして位置付けられていてもよい。図6−3Dは、検体ウェル6−338から、導波路6−334に関して、検体ウェル6−338と6−336aまたは6−336bの何れとの間にも重複領域がないように位置付けられたマイクロキャビティ6−336aおよび6−336bを示している。マイクロキャビティの設計、検体ウェルに関する位置、および/または導波路に関する位置は、全体的な結合損失の低減および導波路と検体ウェルとの間の結合効率の改善に基づいて決定されてもよい。
ティ6−536aおよび6−536bを有する構成における光の伝播のシミュレーション結果を示す。図6−5に示されるように、暗い領域は光のより高い強度に対応し、導波路6−534から検体ウェル6−538へと延び、マイクロキャビティ6−536aおよび6−536bによりサポートされる。
0nmである。
ように位置付けられていてもよい。図6−7Dに示されるように、マイクロキャビティ6−738は検体ウェル6−728からy方向に沿って、寸法d1を有する距離に位置付けられる。マイクロキャビティ6−738は、導波路6−734からy方向に沿って、寸法d2を有する距離に位置付けられている。いくつかの実施形態において、寸法d2はd1より小さい。いくつかの実施形態において、マイクロキャビティ6−738は層6−734内の検体ウェル6−728の表面上に、寸法d1がゼロと等しくなるように位置付けられる。
bは、導波路の端に近接して位置付けられる。回折格子6−810aおよび6−810bは、導波路6−808の、センサ6−812aおよび6−812bの反対側に位置付けられる。回折格子6−810aおよび6−810bは、導波路6−808内で励起エネルギーをセンサ6−812aおよび6−812bに向けて誘導するように構成されてもよい。回折格子6−810aとセンサ6−812aとの組合せは、導波路6−804への励起エネルギー入力をモニタしてもよい。回折格子6−810bとセンサ6−812bとの組合せは、励起エネルギーが検体ウェル6−808の行に結合された後に導波路6−804の端に励起エネルギーが残っていれば、その励起エネルギーをモニタしてもよい。このようにして、センサ6−812aおよび6−812bは、入力端、および出力端、および/または導波路6−808に沿った何れかの適当な位置において、導波路6−804のパワーをモニタしてもよい。センサ6−812aおよび6−812bは、導波路6−808に沿ったある位置におけるパワーレベルを含む情報を検出してもよい。この情報は、励起源を集積装置および/または励起源のパワーと整列させるように機能する構成要素の態様を制御するために使用されてもよい。
られる。距離d2は、約50nm、約100nm、約150nm、約200nm、または約250nmであってもよい。図6−11Cは、図6−11Bに示される線A−A’に沿った断面図を示す。図6−11Cに示されるように、導波路6−1118は、x方向に沿った横方向の寸法を有していてもよく、これは検体ウェル層6−1116の、検体ウェル6−1112を含むずれ領域と重複する。層6−1114は、導波路6−1118の上に、層6−1114が導波路6−111Cの複数の面と接触するように形成されてもよい。
および6−1404は、検体ウェルの行に結合され、各検体ウェルに近接して位置付けられた領域6−1310および6−1404と同様の領域を含むように構成されてもよい。いくつかの実施形態において、行内の複数の検体ウェルに近接して位置付けられた領域は、実質的に同様の量の励起エネルギーが各検体ウェルに結合されるように大きさおよび/または形状が変化してもよい。このようにして、導波路の領域は、導波路に沿って伝播する励起エネルギーの、検体ウェルの行に沿った低減に対応できるように構成されてもよい。
E.放出エネルギーのセンサへの誘導
集積装置は、検体ウェルとピクセルのセンサとの間に位置付けられた、検体ウェル内の検体からの発光のセンサによる収集を改善するための1つまたは複数の構成要素を含んでいてもよい。このような構成要素は、背景信号に対する発光信号の信号対ノイズ比を改善して、発光マーカの検出を改善してもよい。いくつかの構成要素は、検体ウェルからピクセル内の対応するセンサへと発光を誘導してもよい。いくつかの実施形態において、構成要素は検体ウェルへの励起エネルギーの適当な結合と検体ウェルからの発光の結合との両方を提供してもよい。他の構成要素(例えば、フィルタ)は、励起エネルギーならびに検体および/またはマーカに関連していない他の光が、センサにより取得される信号に寄与するのを減少させてもよい。
ャビティ7−211は、検体ウェル7−208からの発光を誘導するように構成される。図7−2Aは、検体ウェル7−208により放出された発光の強度を示し、発光強度がより高い領域はより暗い。マイクロキャビティ7−211は、発光を導波路7−204から斜めに誘導し、導波路7−204による発光の散乱を軽減させてもよい。図7−2Bは、角度に関する検体ウェルから放出された発光のグラフを示す。図7−2Bに示されるように、マイクロキャビティ7−211は発光をy方向から約15度の角度で誘導してもよい。1つまたは複数のマイクロキャビティは、y軸から約5度、約10度、約15度、約20度、約25度の角度で発光を誘導してもよい。いくつかの実施形態において、センサは、このような角度で誘導された発光を受けるように検体ウェルからずらされてもよい。マイクロキャビティ7−211はまた、導波路から検体ウェルへと励起エネルギーを結合して、マイクロキャビティ7−211が励起エネルギーの検体ウェルへの結合と検体ウェルからの発光の誘導との両方を提供するように構成されてもよい。いくつかの実施形態において、1つの検体ウェルからの発光を結合するために複数のマイクロキャビティが形成されてもよい。
きが1%未満であってもよく、それによって波長フィルタ内で適当な厚さ均一性が提供される。
してもよい。このようにして、波長フィルタは、スペーサの厚さのばらつきにより提供される波長フィルタ全体にわたる透過光の波長を変化させてもよい。このような多波長フィルタは、複数の発光波長が検出される実施形態において使用されてもよい。多波長フィルタは、10dBより大きい励起エネルギーを反射してもよい。
F.センサ
タイムビン情報を取得できる何れの適当なセンサが、発光マーカの寿命検出のための測定に使用されてもよい。例えば、2015年5月20日に出願された、「受け取られた光子の時間的ビニングのための集積装置(INTEGRATED DEVICE FOR
TEMPORAL BINNING OF RECEIVED PHOTONS」という名称の米国仮特許出願第62/164,506号明細書に、光子の到来時間を判定できるセンサが記載されており、その全体が参照により本願に援用される。センサは、各検体ウェルが検体ウェルからの発光を検出するための少なくとも1つのセンサ領域を有するように整列される。いくつかの実施形態において、集積装置は、ガイガモードアバランシェフォトダイオードアレイおよび/または単一光子アバランシェダイオードアレイ(SPAD:single photon avalanche diode array)を含んでいてもよい。
成されてもよい。
または複数の電極を含んでいてもよく、その電圧は、キャリア移動/捕捉領域7−906の電位を変化させるように、制御回路によって制御されてもよい。
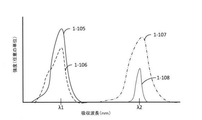
著に長い持続時間のタイムビンは、複数の寿命を区別するために使用されてもよい。例えば、タイムビンのほとんどは、約0.1〜0.5nsの範囲の時間間隔を捕捉してもよいが、あるタイムビンは、約2〜5nsの範囲の時間間隔を捕捉してもよい。タイムビンの数および/または各ビンの時間間隔は、検体となる物体から放出される光子を検出するために使用されるセンサに依存してもよい。各ビンの時間間隔の決定には、センサにより提供されたタイムビンの数が検体の解析に使用される発光マーカ間の区別を付けるのに必要な時間間隔を特定するステップを含んでいてもよい。記録されたヒストグラムの分布を、同様の条件とタイムビンによるマーカの既知のヒストグラムと比較することにより、検体ウェル内のマーカの種類を識別してもよい。本願の異なる実施形態は、マーカの寿命を測定するが、マーカを励起するために使用された励起エネルギー、各ピクセル内のセンサ領域の数、および/またはセンサにより検出される波長は異なり得る。
III.励起源
いくつかの実施形態によれば、1つまたは複数の励起源が集積装置の外に配置されてもよく、検体ウェルを有する集積装置に光のパルスを送達するように構成されてもよい。例えば、2015年5月20日に出願された「パルスレーザ(PULSED LASER)」という名称の米国仮特許出願第62/164,485号明細書に、励起源として使用可能なパルスレーザ源について記載されており、その全体が参照により本願に援用される。光のパルスは、複数の検体ウェルに連結され、例えば、ウェル内の1つまたは複数のマーカを励起するのに使用されてもよい。1つまたは複数の励起源は、いくつかの実装形態によれば、1つまたは複数の特徴的波長で光のパルスを供給してもよい。場合により、励起源は、その中に集積装置が装填されてもよいベースとなる機器内に取り付けられるか、それに連結される交換式モジュールとしてパッケージされてもよい。励起源からのエネルギーは、少なくとも1つの検体ウェルに、または少なくとも1つの検体ウェル内の少なくとも1つの検体に放射的に、または非放射的に送達されてもよい。いくつかの実装形態において、制御可能強度を有する励起源は、励起エネルギーを集積装置の複数のピクセルに送達するように配置されてもよい。ピクセルは、線形アレイ(例えば、行または列)に、または2Dアレイ(例えば、ピクセルのアレイのサブエリアまたはピクセルのアレイ全体)に配置されてもよい。
ルスは、先行するパルスからの励起された蛍光体が合理的時間で蛍光を発するまでは到達しない。いくつかの実施形態において、間隔Tは、蛍光体を励起する励起パルスと、励起パルスが終了してから次の励起パルスまでの間に蛍光体により放出される次の光子との間の時間を判定するのに十分な長さである必要がある。
、光子は電子正孔対を再び組み合わせることを通じて生成される。キャリア濃度は光信号に関係しており、キャリア濃度が閾値より高い場合、シミュレーションによる放出を通じて実質的な数のコヒーレント光子が生成される。レーザダイオードに供給される電流は、機器内に電子またはキャリアを注入してもよく、それによってキャリア濃度が高まる。キャリア濃度が閾値より高いと、光子は電流がキャリアに供給されるより高速で生成されてもよく、そのため、キャリアの濃度は閾値より減少し、光子の生成が減少する。光子の生成が減少すると、電流の注入と光子の吸収が続くために、キャリア濃度は再び増大し始め、最終的に再び閾値を超える。このサイクルの結果、キャリア濃度は光子生成のための閾値の周囲で変動し、振動する光信号が得られる。弛緩振動と呼ばれるこのようなダイナミクスは、キャリア濃度の変動によって、光信号内のアーチファクトの原因となり得る。電流がまずレーザに供給されると、キャリア濃度の変動により、光信号が安定下パワーに到達する前に振動があってもよい。パルス式励起源を形成する際、キャリア濃度の変動は、パルス式光信号に関するアーチファクトを導入し得る。例えば、図8−1のグラフは、キャリア濃度がどのように弛緩振動を有するか、および利得スイッチングによる変調を通じて、変動するパワーを有する、それに対応する光信号を示す。このような弛緩信号からのアーチファクトは、パルス式光信号の幅を広げ、および/または光信号のテールを生じさせ得、それによって、励起信号が発光マーカにより放出された光子と重なる可能性があるため、このようなパルス光源により検出可能な寿命が限定される。
ように選択されてもよい。
最適な電力供給が行われることを示している。
IV.励起源と集積装置とのアラインメント
1つまたは複数の励起源からの励起エネルギーを集積装置上の格子カプラに位置決めすることは、何れの適当な技術を使用して行われてもよい。いくつかの実施形態において、励起エネルギーは、励起源から1つまたは複数の光学構成要素を通じて格子カプラに誘導されてもよい。このような実施形態において、励起エネルギーは集積装置に投射されてもよい。このような励起源のアラインメントは、励起源および/または光学構成要素を位置決めすることによりアクティブ方式で実行されてもよい。他の実施形態において、励起源は、励起源を格子カプラに関して位置決めする構成要素を通じて格子カプラと整列されてもよい。このような励起エネルギー源の位置決めは、フェルール内に励起エネルギーを提供するように構成された光ファイバのパッシブアラインメントを通じて行われてもよい。このような実施形態において、励起源は直接または間接に集積装置に接続されてもよい。A.アクティブアラインメント
1つまたは複数の励起源と集積装置とのアラインメントは、励起エネルギーが検体ウェルに送達される前に1回、および/または集積装置が解析に使用されている間に複数回行われてもよい。励起エネルギーを集積装置に結合するために、1つまたは複数の励起源のアラインメントおよび/または安定化のための何れの適当な技術が使用されてもよい。いくつかの実施形態において、外部励起源を集積装置に整列させ、その後、その位置に固定してもよく、集積回路が解析に使用されている間にわたり、それ以上調整する必要がない。他の実施形態において、励起源と集積装置とのアラインメントを改善するために、フィードバックメカニズムが提供される。フィードバックメカニズムは、手動アラインメントメカニズムを使用するオペレータに関連して使用され、励起源をフィードバック信号に基づいて整列させてもよい。他の例において、自動アラインメントメカニズムが、励起源と集積装置とのアラインメントをフィードバック信号に基づいて自動的に調節してもよい。自動アラインメントは、集積装置が動作する前に、および/または測定値を得る前に行われてもよい。自動アラインメントはまた、集積装置の動作中、測定値が取得されている間に行われてもよい。いくつかの例において、自動アラインメントが行われるタイミングは、センサが能動的に測定値を取得していないときに対応してもよい。励起源と集積装置とのアラインメントを再調整することにより、1つまたは複数の検体についての経時的な励起源の安定性および/またはセンサ測定の一貫性を改善できる。
ウントを通じて集積装置に接続されてもよい。このようなアラインメントメカニズムは、1つまたは複数のサーボ制御光学要素を使用して実行されてもよい。アクティブアラインメントメカニズムは、集積装置内の1つまたは複数の導波路への励起源の全体的な結合効率を増大させてもよい。このようなアラインメントメカニズムにより、他のアラインメント方式と比較して、使い捨て集積装置に関連する追加のコストが削減され、および/または他のアラインメント方式により必要となる集積装置上でのフットプリントが縮小される。それに加えて、アクティブアラインメントメカニズムによれば、オペレータがそのような集積装置および/またはシステムを操作するのに必要となる訓練が減少する。
ュール9−210が9−202に結合するように構成されたソケット9−216から受け取られたフィードバック信号(実線の矢印で示される)に基づいて変更してもよい。フィードバック信号は、励起エネルギーの集積装置9−202の領域(例えば、格子カプラ)とのアラインメントの表示を提供してもよい。アラインメントメカニズム9−208は、励起エネルギーの集積装置への結合を改善するために、励起源9−206および/または光学構成要素のx、y、z位置、xおよびy入射角、およびz位置決めまたは焦点を調整してもよい。このような光学構成要素は、ミラー、リフレクタ、レンズ、プリズム、回折格子、および/または傾斜可能ウィンドウ、例えば図9−3において配置されている光学構成要素の例示的集合を含んでいてもよい。
整でき、その一方で、平坦で平行な平板を集光レンズの後に組み込むと、ビームのx−y位置を調整できる。励起源モジュール内部の光学構成要素は、図9−10に示される断面図で示されているように、レーザダイオードからの光を誘導し、変調する。光ビームの経路は点線で示されている。光ビームは、励起源モジュールの上面から入り、すなわち図の平面に背後から入り、45度プリズムにより反射されて、図9−10の平面図の上方へと伝播する。平坦で平行な平板9−512を有するロータリアクチュエータ9−511が光路に沿って、入射角が調整可能なアナモルフィックプリズム9−513の前に提供される。アナモルフィックプリズムは、ビームを1方向に拡縮して、ビームの断面を楕円形のプロファイルから実質的により円形のプロファイルに調整する。ビーム拡縮量は、プリズムの入射角により制御される。したがって、光ビームは他のプリズム9−514により反射されて集光レンズ9−515を通過し、ビームを集積装置上で集光させる。次に、ビームはロータリアクチュエータにより駆動されるさらに2つの傾斜可能ウィンドウ9−516を通過し、それによって集積装置上のビームのx−y位置が調整されて、光ビームは図9−10において、図の平面から垂直に、見ている人に向かって伝播する。励起源モジュール内の3つのロータリアクチュエータの位置決めを示す別の視点が図9−11に示されている。
B.パッシブアラインメント
1つまたは複数の励起源の位置決めは、励起エネルギーを搬送する光ファイバの集積装置に対するパッシブアラインメントを通じて行われてもよい。パッシブアラインメント方式は、光ファイバを格子カプラに関して確実に位置決めすることにより、励起エネルギーを導波路に結合する一連の構成要素が含まれていてもよい。コンポーネントは、プラスチックおよび金属を含む何れかの適当な材料で製造される。パッシブアラインメント構成要素は、特定の大きさの光ファイバを収容するための何れかの適当な大きさである。それに加えて、構成要素は、光ファイバを集積装置に容易に接続し、それから切断できる設計とされてもよい。
09と重複してもよい。
光ファイバからの励起エネルギーは、特定の長さを有する集積装置の方向に整列された初期導波路と結合してもよい。いくつかの実施形態において、初期導波路は、長さ約9mmの集積装置の方向に整列される。
C.励起エネルギーモニタセンサ
様々なモニタセンサが集積基板内に形成され、集積装置内の異なる位置における励起エネルギーの強度および/またはパワーをモニタするように構成されてもよい。このようなモニタセンサにより生成される電気信号は、集積装置の動作中、フィードバックプロセスにおいて使用されてもよい。モニタ信号からの電気信号はまた、集積装置を通って伝播した励起エネルギーの品質低下を示していてもよく、オペレータに対してエラー信号を生成する。これには、励起源が故障した、または故障しつつあるとの表示が含まれてもよい。いくつかの例において、モニタセンサは、格子カプラに対する励起エネルギーのアラインメント中にフィードバック信号を提供してもよい。モニタセンサは、光検出器とフォトダイオードをはじめとする光センサを含む何れかの適当なセンサであってもよい。
せるために使用されてもよい。いくつかの例において、複数のモニタセンサが格子カプラの下に配置される。複数の穴を有し、金属等の不透明材料の層が格子カプラと複数のセンサとの間に配置されてもよい。不透明層の各穴は各センサと重複して、穴を通る励起エネルギーがセンサによって検出される。各穴を通過する励起エネルギーを複数のセンサで検出することにより、格子上の励起エネルギービームの位置が判断されてもよい。図9−20はこのような配置の一例を示し、金属層内の4つの穴9−2010が、光が4つのセンサ9−2008を通過できるように位置付けられており、これらは4眼光検出器と考えることができる。励起エネルギー9−2004は、格子カプラ9−2002およびテーパ付き導波路9−2006に結合すると、励起エネルギーの一部が金属層の穴9−2010を通ってセンサ9−2008の1つまたは複数へと通過してもよい。金属層は、穴9−2010を有さない領域において反射層として機能してもよく、励起エネルギー9−2004の格子カプラ9−2002および導波路9−2006との結合を改善できる。センサ9−2008からの信号は、アラインメントフィードバックのためのベクトルを提供し、これはフィードバックループ内での各調整に必要な大きさおよび符号の両方を推測するための十分な情報を伴う。いくつかの例において、アラインメントフィードバックは、励起エネルギーの各パルスと共に提供されてもよい。アラインメントは、励起エネルギーのビームの中心が4つのセンサ上にあるときに実現されてもよい。
1つまたは複数の格子カプラを有していてもよい。入力導波路は複数の導波路に分割されてもよく、分割された各導波路が励起エネルギーを検体ウェルの行に送達する。片側で、センサは格子カプラ上の入力励起エネルギーの位置をモニタしてもよい。反対側のセンサは、検体ウェルの行の後の、1つまたは複数の導波路の端からの励起エネルギーを測定してもよい。いくつかの実施形態において、集積装置に対する励起源のアラインメントは、まず、ビームのx−y位置を示す入力センサからの信号を使用して励起エネルギービームを格子カプラにセンタリングするステップと、各導波路の端における出力センサからの信号から、焦点および/または入射角などの励起エネルギービームのパラメータをさらに調整するステップとからなってもよい。いくつかの例において、出力センサからの信号は、集積装置を解析に使用する前に、各集積装置について決定され得る校正ステップとして使用されてもよい。それに加えて、出力センサからの信号は、集積装置を用いて得られた測定値を正規化するために使用されてもよい。
D.複数の励起源
複数の励起源が、異なるエネルギーまたは波長を有する光を複数の検体ウェルに供給してもよい。複数の励起源の各々は、異なる特徴波長またはエネルギーを有する光を供給してもよい。1つまたは複数のマーカは、励起源からの光がマーカを励起して、マーカが光子を放出するようにするか否かに基づいて識別されてもよい。このようにして、異なる励起源からの光で検体を照明した後、検体の応答を測定することによって、マーカがその吸収スペクトルに基づいて識別されてもよい。例えば、マーカを有する検体は、第一の励起源からの光、およびそれに続いて第二の励起源からの光で照明されてもよい。マーカが第一の励起源からの光で照明されたことに応答して発光した場合、マーカは第一の励起源の特徴波長と重複する吸収スペクトルを有していてもよい。
へとダイシングされ、個々にパッケージングされる。しかし、複数のエミッタを有する基板にダイシングすることも可能である。いくつかの実施形態において、エミッタはほとんど同じであり、相互にリソグラフィ許容度に合わせて相互から均等に離間されていてもよく、これは典型的には0.1マイクロメートルのオーダである。
けてもよい。
検体内の分子の検出、解析、および/または探索のための測定は、本明細書に記載されている集積装置または集積装置と励起源とのあらゆる組合せを使用して取得されてもよい。励起源は、パルス式励起源、またはいくつかの例では連続波源であってもよい。特定の検体にタグ付けされる発光マーカは、検体の存在を示してもよい。発光マーカは、励起エネルギー、発光放出波長、および/またはマーカにより放出された放出エネルギーの寿命により区別されてもよい。同様の発光放出波長を有するマーカは、各マーカの寿命を判定することによって識別されてもよい。それに加えて、同様の寿命を有するマーカは、各マーカに関する発光放出波長により識別されてもよい。マーカを使用することにより、マーカが放出された発光の時間的および/またはスペクトル特性の組合せにより識別される場合、マーカとそれに関連する検体との定量解析および/または識別が実行されてもよい。
FOR NUCLEIC ACID SEQUENCING)」という名称の米国仮特許出願第62/164,482号明細書に記載されており、その全体が参照によって本願に援用される。
A.単一分子検出と配列解析
本願のある態様によれば、単一分子は、複数の別々の光パルスにさらされたときに分子から放出される一連の光子の1つまたは複数の特性に基づいて識別(例えば、反応検体内の他のあり得る分子から区別)できる。いくつかの実施形態において、分子に発光マーカで標識する。いくつかの実施形態において、発光マーカは蛍光体である。いくつかの実施形態において、発光マーカは発光マーカの特性に基づいて識別または区別可能である。発光マーカ(例えば、蛍光体)の特性としては、発光寿命、吸収スペクトル、放出スペクトル、発光量子収量、発光強度、およびこれらの2つ以上の組合せが含まれるが、これらに限定されない。
るべき一本鎖標的核酸鋳型の連続する各塩基位置について繰り返すことができる。
メントによる)使用できる。リードは、染色体領域、染色体全体、またはゲノム全体を再構成するために使用できる。配列リードまたはこのようなリードから生成されるより大きい配列は、被験者のゲノムを解析するため、例えば多様体または遺伝子多型を特定するために使用できる。多様体の例としては、タンデムSNPを含む単一ヌクレオチド多型(SNP:single nucleotide polymorphism)、Indel、すなわち欠失挿入多型(DIP:delition insertion polmorphism)とも呼ばれる小規模複数塩基欠失または挿入、多塩基多型(MNP:Multi−Nucleotide Polymorphism)、短反復配列(STR:Short Tandem Repeat)、マイクロインサーションを含む挿入、複製、逆転、転座、重複、複雑なマルチサイト多様体、コピー型多型(CNV:copy number variation)が含まれるが、これらに限定されない。ゲノム配列は、多様体の組合せを含むことができる。例えば、ゲノム配列は、1つまたは複数のSNPと1つまたは複数のCNVとの組合せを包含できる。
グメントを含む。1つの態様において、本願は、鋳型(または標的)の配列を判定する方法を提供する。
願の態様により、複数の単一分子シーケンシング反応が平行して(例えば、1台の集積装置またはチップ上で)実行される。
分子(例えばビオチン)を含むリンカー603によって固定される。
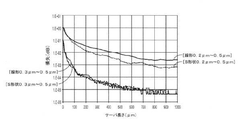
発光寿命を判定するためにのみ処理されているが、データはまた、他の発光特性、例えば発光強度または吸収または放出された光子の波長について評価されてもよい。例示的な処理データは、標的空間内の発光マーカの発光寿命についての指数関数的減衰曲線の特徴を概算している。発光マーカ#は発光マーカ*より短い発光寿命を有するため、ステージBに関する処理データは、より長い時間にわたり、より少ないカウントを有し、その一方で、ステージDに関する処理データは、より長時間にわたり、比較的より多いカウントを有する。
B.発光特性
本明細書に記載されているように、発光分子は1つまたは複数の光子を吸収する分子であり、その後、1つまたは複数の期間が経過すると1つまたは複数の光子を放出し得る。分子の発光は、いくつかのパラメータにより説明され、これには、発光寿命、吸収および/または放出スペクトル、発光量子収量、および発光強度が含まれるが、これらに限定されない。
む。いくつかの実施形態において、方法は、パルスと発光の各ペア間の複数の持続時間を記録するステップと、パルスと発光の各ペア間の複数の持続時間の分布を評価するステップとをさらに含む。
C.発光標識されたヌクレオチド
1つの態様において、本明細書に記載されている方法と組成物は1つまたは複数の発光標識されたヌクレオチドを含む。特定の実施形態において、1つまたは複数のヌクレオチドはデオキシリボヌクレオシドを含む。特定の実施形態において、1つまたは複数のヌクレオチドは、リボースヌクレオシドを含む。いくつかの実施形態において、全てのヌクレオシドはリボースヌクレオシドを含む。いくつかの実施形態において、1つまたは複数のヌクレオチドは修飾されたリボース糖またはリボース類似体(例えば、ロックド核酸)を含む。いくつかの実施形態において、1つまたは複数のヌクレオチドは、自然起源の塩基(例えば、シトシン、グアニン、アデニン、チミン、ウラシル)を含む。いくつかの実施形態において、1つまたは複数のヌクレオチドは、シトシン、グアニン、アデニン、チミン、またはウラシルの誘導体または類似体を含む。
シグアノシン三リン酸(dGTP)、デオキシウリジン三リン酸(dUTP)、およびデオキシチミジン三リン酸(dTTP)dNTPから選択できる。
D.マーカ
特定の実施形態において、組み込まれる分子は発光分子であり、例えば、明確な発光マーカが取り付けられていない。典型的なヌクレオチドとアミノ酸は発光せず、または適当な励起および放出エネルギー範囲内で発光しない。特定の実施形態において、組み込まれる分子は発光マーカを含む。特定の実施形態において、組み込まれる分子は発光標識されたヌクレオチドである。特定の実施形態において、組み込まれる分子は発光標識されたアミノ酸または発光標識されたtRNAである。いくつかの実施形態において、発光標識されたヌクレオチドは、ヌクレオチドと発光マーカを含む。いくつかの実施形態において、発光標識されたヌクレオチドは、ヌクレオチド、発光マーカ、およびリンカーを含む。いくつかの実施形態において、発光マーカは蛍光体である。
E.リンカー
発光マーカは分子に、例えば結合によって直接付着されても、またはリンカーを介して付着されてもよい。特定の実施形態において、リンカーは1つまたは複数のリン酸を含む。いくつかの実施形態において、ヌクレオシドは発光マーカに、1つまたは複数のリン酸を含むリンカーによって接続される。いくつかの実施形態において、ヌクレオシドは発光マーカに、3つ以上のリン酸を含むリンカーによって接続される。いくつかの実施形態において、ヌクレオシドは、4つ以上のリン酸を含むリンカーにより接続される。
F.検体ウェル表面処理
特定の実施形態において、1つまたは発光標識された分子を検出する方法は、標的空間内に分子が閉じ込められた状態で実行される。いくつかの実施形態において、標的空間は検体ウェル(例えば、ナノアパーチャ)内の領域である。特定の実施形態において、検体ウェルは、第一の材料を含む底面と複数の金属または酸化金属層により形成された側壁を含む。いくつかの実施形態において、第一の材料は透明材料またはガラスである。いくつかの実施形態において、底面は平坦である。いくつかの実施形態において、底面は湾曲したウェルである。いくつかの実施形態において、底面は側壁のうち、複数の金属または酸化金属層により形成された側壁の下の部分を含む。いくつかの実施形態において、第一の材料は溶融シリカまたは二酸化シリコンである。いくつかの実施形態において、複数の層の各々は金属(例えば、Al、Ti)または酸化金属(例えば、Al2O3、TiO2、TiN)を含む。
G.保護膜
1つまたは複数の分子または複合体が表面に固定される場合、機器の他の表面を保護して、望ましくない位置での固定化を防止することが望ましい。いくつかの実施形態において、分子または複合体は検体ウェルの底面に固定され、検体ウェルの側壁が保護される。いくつかの実施形態において、側壁は、金属または酸化金属バリア層を側壁表面上に堆積
させるステップと、コーティングをバリア層に塗布するステップによって保護される。いくつかの実施形態において、酸化金属バリア層は酸化アルミニウムを含む。いくつかの実施形態において、堆積させるステップは、側壁面と底面上に金属または酸化金属バリア層を堆積させるステップを含む。いくつかの実施形態において、堆積させるステップは、底面から金属または酸化金属層をエッチングするステップをさらに含む。
H.ポリメラーゼ固定
いくつかの実施形態において、1つまたは複数の分子または複合体が表面に固定される場合、この表面は機能化され、分子または複合体の1つまたは複数を付着させることができる。いくつかの実施形態において、機能化表面は検体ウェルの底面である。特定の実施形態において、機能化表面は透明ガラスを含む。特定の実施形態において、機能化表面は溶融シリカまたは二酸化シリコンを含む。いくつかの実施形態において、機能化表面はシランで機能化される。いくつかの実施形態において、機能化表面はイオン的に帯電したポ
リマーで機能化される。いくつかの実施形態において、イオン的に帯電したポリマーはポリ(リジン)を含む。いくつかの実施形態において、機能化表面は、ポリ(リジン)−グラフト−ポリ(エチレングリコール)で機能化される。いくつかの実施形態において、機能化表面はビオチン化ウシ血清アルブミン(BSA)で機能化される。
1000倍少ないビオチン化シランを含む。
I.ポリメラーゼ
「ポリメラーゼ」という用語は、本明細書で使用されるかぎり、一般に重合反応の触媒として作用できる任意の酵素(または重合化酵素)を指す。ポリメラーゼの例は、限定せずに、核酸ポリメラーゼ、転写酵素、またはリガーゼを含む。ポリメラーゼは、重合化酵素とすることができる。
J.寿命測定
寿命測定は、1つの励起エネルギー波長を使用して検体ウェル内のマーカを励起して実行される。異なる寿命を有するマーカの組合せは、寿命測定に基づいて個々のマーカを区別するために選択される。それに加えて、マーカの組合せは、使用される励起源によって照明されたときに励起状態に到達できる。1回の励起を用いて寿命測定のために構成された集積装置は、行に沿って位置付けられた複数のピクセルを含んでいてもよく、各検体ウェルは同じ導波路と結合するように構成される。ピクセルは検体ウェルとセンサとを含む。各ピクセルのための検体ウェルに導波路を結合するために、1つまたは複数のマイクロキャビティまたはブルズアイ格子が使用されてもよい。
K.スペクトル−寿命測定
寿命測定は、1つまたは複数の発光マーカのスペクトル測定と組み合わせてもよい。スペクトル測定は、個々のマーカに関する発光の波長に依存していてもよく、ピクセルごとに少なくとも2つのセンサ領域を使用して捕捉される。集積装置の例示的構造はピクセルを含み、各々が2つの異なる領域を有するセンサを有し、各領域は異なる波長を検出するように構成される。例えば図7−7に示され、説明されているような多波長フィルタは、各センサ領域に異なる波長の光を選択的に透過させるために使用されてもよい。例えば、1つのセンサ領域とフィルタとの組合せは赤色光を検出するように構成されていてもよく、他のセンサ領域とフィルタとの組合せは緑色光を検出するように構成されていてもよい。
に選択される。それに加えて、マーカの組合せは、使用される励起源により照明されると励起状態に到達できるように選択される。
L.寿命−励起エネルギー測定
寿命測定と少なくとも2つの励起エネルギー波長の使用との組合せが、複数のマーカの
区別に使用されてもよい。いくつかのマーカは、1つの励起波長が使用され、他の波長は使用されないときに励起されてもよい。異なる寿命を有するマーカの組合せは、各励起波長に関して、寿命測定に基づいて個々のマーカ間で区別するように選択される。この実施形態において、集積装置は、各ピクセルが1つの領域を有するセンサを有するように構成されてもよく、外部励起源は、時間的インタリーブ方式で電気的に変調されたパルス式ダイオードレーザからの少なくとも2つの励起エネルギー波長を提供するように構成されてもよい。
VI.製造ステップ
上述の集積装置は、何れの適当な方法で製造されてもよい。以下に、適当な集積装置を作るための、当技術分野で知られている技術とどのようにでも組み合わせられてもよい集積装置の各種の構成要素の製造について説明する。
A.検体ウェル製造プロセス
検体ウェル(例えば、ナノアパーチャ)は、何れの適当な方法で製造されてもよい。いくつかの実施形態において、検体ウェルは、標準的なフォトリソグラフィプロセスとエッチング方式を使用して製造されてもよい。検体ウェルは、金属(例えば、Al、TiN)、またはフォトリソグラフィプロセスと適合するあらゆる適当な材料を有する層で形成されてもよい。図11−1は、集積装置の検体ウェルの例示的な製造方法を示す。層11−112は検体ウェルを形成し、AlまたはTiN等の金属を含んでいてもよい。層11−110は、誘電層として機能してもよく、SiO2または窒化シリコン等の何れの適当な誘電基板から形成されてもよい。方法の1つのステップは、基板11−110に層11−112を直接堆積させるステップを含む。いくつかの実施形態において、層11−112と層11−110との間に追加の層を堆積させてもよい。層11−112は、何れの適当な厚さで堆積させてもよく、いくつかの実施形態において、厚さは結果として得られる検体ウェルの高さを決定してもよい。層11−112の厚さは約50nm、約100nm、または約150nmであってもよい。次に、反射防止コーティング(ARC)11−122を層11−112の上に堆積させる。エッチマスク11−120(例えば、フォレジストエッチマスク)をARC 11−122の上に堆積させる。従来のフォトリソグラフィ技術を使用して、エッチマスク11−120とARC層11−122に穴をパターニングする。エッチマスク11−120によりパターニングされる穴は、直径が約50nm、約100nm、または約150nmであってもよい。次に、エッチング、例えば反応イオン法を使用して穴パターンを下層11−112に転写し、検体ウェルを形成する。エッチングは層11−110の表面で停止してもよく、またはエッチングで層11−112の穴の下の層11−110に窪みを形成してもよい。従来の方法を使用して、層11−112からエッチマスク11−120およびARC 11−122を剥離する。検体ウェルの寸法は約50nm、約100nm、または約150nmであってもよい。
法を使用して製造してもよい。図11−3は、集積装置の検体ウェル形成の例示的実施形態を示している。ハードエッチマスク層11−314を基板11−310の上に堆積させる。ハードウェッチマスク層11−314は、Tiまたは他の何れの適当な材料を含んでいてもよい。基板11−310は、誘電材料(例えば、SiO2)または他の何れの適当な材料を含んでいてもよい。次に、ARC層11−322をハードエッチマスク層11−314の上に堆積させてもよく、その後、フォトレジスト層11−320を堆積させる。従来のフォトリソグラフィ法を使用して、フォトレジストをパターニングし、レジストのピラー11−320を形成する。このフォトレジストピラーパターンは、ARC層11−322とハードエッチマスク層11−314をエッチングするためのエッチマスクとして使用される。次に、フォトレジスト層11−320とARC 11−322を剥離して、ハードエッチマスクのピラー11−330を残す。従来の技術を使用して、残りのフォトレジストとARC層をピラーから溶解させてもよい。次のステップは、層11−312をピラー11−330の上に直接堆積させて、キャップ付ピラーを形成するステップを含んでいてもよい。検体ウェルを形成するために、層11−314を腐食させる過酸化水素エッチングまたは他の適当なエッチングによりキャップ付ピラーを剥離し、キャップを「リフトオフ」し、その結果、層11−312内に検体ウェルが形成される。
B.窪みを有する検体ウェル層
検体ウェル層は、検体ウェル(例えば、ナノアパーチャ)が導波路までの特定の距離に位置付けられるように窪みを含んでいてもよい。検体ウェル層内に窪みを形成するための何れの適当な技術が使用されてもよい。1つの方法は、トポグラフィを有するレジストを形成するために使用されるグレイスケールリソグラフィを含み、その後、エッチングによりトポグラフィを酸化物層に転写する。酸化物層にディップトポグラフィが転写された後、検体ウェルおよび/またはその他の構造が形成されてよい。図11−5は、窪みを有する検体ウェル層を形成する例示的実施形態を示す。導波路11−820が周辺材料層11−810内に形成され、周辺材料層11−810の表面上にレジスト11−830がパターニングされる。レジスト11−830のパターニングは、何れの適当な大きさまたは形状であってもよい。層11−810の表面がエッチングされ、レジスト11−830のパターニングに基づいて所望の窪み形状が形成される。検体ウェル層11−812は、本明細書に記載されている技術の何れかの組合せによって層11−810のエッチングされた表面上に堆積されて、一部は、導波路11−820からある距離に、導波路11−820と検体ウェル11−832との間の適当な結合を提供するために位置付けられた検体ウェル11−832を有する。
C.同心円回折格子(ブルズアイ)の製造プロセス
同心円回折格子、またはブルズアイは、何れの適当な方法で製造されてもよい。いくつかの実施形態において、同心円回折格子は、標準的なリソグラフィプロセスおよびエッチング法を使用して製造してもよい。何れの適当な誘電材料、例えばSiO2または窒化シリコンを同心円回折格子の形成に使用してもよい。図11−7に示される実施形態において、SiO2層11−1010は、同心円回折格子の製造に使用される。製造プロセス内の第一のステップは、ハードエッチマスク11−1014をSiO2層11−1010の上に直接堆積させるステップを含んでいてもよい。製造プロセスの次のステップ11−1001は、シリコンを含んでいてもよいハードエッチマスクの上の反射防止コーティング(ARC)層11−1022の上に直接フォトレジスト層11−1020を堆積させるステップを含んでいてもよい。従来のフォトリソグラフィ法を使用して、ハードエッチマス
ク内にブルズアイパターンを作り、これは例えば、ステップ11−1003によってフォトレジストに同心円回折格子をパターニングし、ステップ11−1005によってレジストパターンをARC層およびハードエッチマスクにエッチングすることによる。その後、ステップ11−1007により、ブルズアイパターンを、エッチング、例えば反応イオンエッチング法を使用して下のSiO2層に転写し、同心円回折格子を形成する。同心円回折格子の厚さは、何れの適当な厚さとすることもできる。図11−7に示される実施形態において、エッチングの深さは約80nmである。ステップ11−1009により、従来の技術を使い、レジストおよびエッチマスク残留物を剥離し、同心円回折格子の表面を洗浄する。ステップ11−1011により、層11−1012の検体ウェルが、リフトオフまたはエッチプロセスを使用して同心円回折格子の上に直接製造されてもよい。他の実施形態において、同心円回折格子と検体ウェルとの間にその他の層が堆積されてもよい。
D.マイクロキャビティの製造プロセス
マイクロキャビティは何れの適当な方法で製造されてもよい。いくつかの実施形態において、マイクロキャビティは、標準的なリソグラフィプロセスおよびエッチング法を使用して製造してもよい。マイクロキャビティは窒化シリコンを含んでいてもよい。製造プロセスの第一のステップは、酸化膜の上に窒化シリコンを堆積させるステップを含んでいてもよい。窒化シリコン層がパターニングされ、エッチングされて、マイクロキャビティ構造が形成されてもよい。窒化シリコンのエッチング後に、酸化物が窒化シリコンの特徴物の上に堆積され、CMP等により平坦に研磨されてもよい。検体ウェルを有する検体ウェル層は、マイクロキャビティの上またはその付近に製作されてもよい。マイクロキャビティは、検体ウェルからずれていてもよい。図11−10は、オフセットマイクロキャビティ構造のための2つの可能な製造設計を示している。
E.導波路格子カプラの下のリフレクタ層
格子カプラの下のリフレクタ層は、何れの適当な方法で形成されてもよい。リフレクタ層は、励起エネルギーの導波路への結合を改善するために、導波路格子カプラから制御された距離にある金属層であってもよい。例示的な製造プロセスは、リソグラフィおよび/またはエッチングを用いて、酸化物層内の格子カプラの位置に凹部を形成するステップを含む。リフレクタ材料が堆積され、溝が充填される。レジスト層がリフレクタの上に形成され、リソグラフィおよびエッチングを用いて余剰のリフレクタ材料が除去される。酸化物がリフレクタの上に、例えばPECVDを通じて形成され、導波路製造のための平面が形成される。
F.励起フィルタ
励起フィルタは、高屈折率および低屈折率の材料の交互の層により形成されてもよい。何れの適当な低屈折率材料が使用されてもよい。低屈折率材料の例には、PVD、PECVD、LPCVD、ALD、および/または蒸着方式を使用して形成される二酸化シリコンが含まれる。何れの適当な高屈折率材料が使用されてもよい。高屈折率材料の例には、シリコン、窒化シリコン、二酸化チタン、および五酸化タンタルが含まれる。
G.バッフル
ピクセル内のセンサと検体ウェルとの間にバッフルを形成して、導波路からの励起光等の迷光を遮断および/または吸収して、センサにより検出されないようにしてもよい。1つの方法は、酸化物層の隆起部分に吸収層を堆積することであり、隆起部分はセンサと重複し、その後、CMPにより研磨される。他の方法は、吸収薄膜を酸化物層の上に堆積させ、その後、リソグラフィおよびエッチング法を用いて、吸収層内のセンサの上に穴を形成することである。
C.レンズ製造プロセス:屈折レンズ
屈折レンズアレイは、検体ウェルに励起を集中させ、それからの放出光を収集する効率を改善するために、何れの適当な方法で作られてもよい。いくつかの実施形態において、屈折レンズアレイは、レンズアレイ上の「デッドゾーン」を最小限にするための「ギャップレス」アレイであってもよい。図11−11に示される実施形態において、屈折マイクロレンズアレイが、個々のレンズ間にギャップがないように示されている。いくつかの実施形態において、「ギャップレス」アレイを製造するステップは2つのエッチングステップを含んでいてもよい。第一のエッチングは、ステップ11−1801により、マイクロレンズトポグラフィの深さを決定してもよい。第二のエッチングは、動作11−1803により、第一のエッチングをたどり、個々のマイクロレンズ間の平坦なギャップを除去してもよく、それによって1つのレンズは端で終了し、そこから別のレンズが始まる。第一および第二のエッチングの合計は、焦点距離を画定する。図11−12に示される実施形態において、マイクロレンズアレイの、第一のHFエッチングの後(1)、第二のHFエッチングの後(2)、マイクロレンズがより高屈折率の材料である窒化シリコンでコーティングされた後(3)、および高屈折率の材料が研磨され、平坦化された後(4)の上面図が示される。
的な屈折レンズアレイが図11−13に示されており、ナノアパーチャ層11−2007は、基板11−2005の上にある誘電レンズ層11−2003の上にある透明スペーサ層11−2001の上に製造される。いくつかの実施形態において、屈折レンズは、標準的なフォトリソグラフィプロセスおよびエッチング法を使用して製造してもよい。SiO2または窒化シリコン等、何れの適当な誘電材料を屈折レンズの形成に使用してもよい。図11−14に示される実施形態において、窒化シリコンはSiO2基板トポグラフィに充填するために使用される。製造プロセス内の第一のステップ11−2101は、ハードエッチマスク11−2114をSiO2基板11−2110の上に直接堆積させるステップを含んでいてもよい。SiO2層に使用されるものと同じエッチングプロセス中に溶解しない、何れの適当な金属をハードエッチマスク11−2114に使用してもよい。例えば、Crが使用され、他の金属も使用可能である。次のステップは、フォトレジスト層11−2120をハードエッチマスク11−2114の上に形成するステップを含んでいてもよい。ステップ11−2103により、従来のフォトリソグラフィ法を使用してハードエッチマスクに円形パターンを作る。その後、従来のエッチング法、例えば反応イオンエッチング法を使用して下のCr層に円形パターンを転写する。SiO2層は、SiO2はエッチングできるがハードエッチマスクはエッチングできない何れかの適当な選択的エッチング法を使用してエッチングされる。例えば、HFを用いる等方性ウェットエッチングを使用して、SiO2層に凹面を作る。その後、ステップ11−2105により、従来のエッチング法を使い、ハードエッチマスク11−2114が除去される。任意選択により、HFを用いる第二のウェットエッチングにより、レンズ間のギャップが除去される。屈折レンズを作るために、ステップ11−2107により、SiO2層の空洞に高屈折率材料層11−2118、例えば窒化シリコンが充填される。最後に、ステップ11−2109により、レンズの上面が従来の方法、例えば化学機械研磨等で平坦化される。ステップ11−2111により、層11−2118の上にスペーサ層11−2124が堆積されてもよい。例えば、オルモーサ(ORMOCER)(商標)から作られたスペーサ層が窒化シリコン層の上にスピンコートされてもよい。あるいは、SiO2の層が堆積されてもよい。検体ウェルは、屈折レンズの上に直接製作されてもよい。他の実施形態において、屈折レンズと検体ウェルとの間に他の層が堆積されてもよい。
I.D.レンズ製造プロセス:フレネルレンズ
回折光学素子(DOE:diffractive optical element)は何れの適当な形状であってよく、CMOSセンサ上での集光と発光光子の選別を改善するための何れの適当な方法で製造されてもよい。いくつかの実施形態において、DOEはフレネルレンズの一部を含んでいてもよい。図11−16〜11−20に示されるように、DOEはフレネルレンズの中心からずれた正方形部分として特徴付けられる。図11−
17に示されるように、DOEは2つのユニットセル層を含んでいてもよく、第一の層11−2301は「小型の」特徴を含み、第二の層11−2303は「大型の」特徴を含む。ユニットセル層は、何れの適当なピッチを有していてもよく、さらに、フレネルレンズの光学設計に応じて異なるピッチを有していてもよい。図11−17の例に示されているように、小型のDOE層のピッチは220nmであり、大型のDOE層のピッチは440nmである。大型のDOE層は小型のDOE層の上に重なっていてもよく(またはその逆もあり)、多層回折光学系が形成される。図11−17は、オフセットフレネルアレイ11−2405の一例を示し、大きい位置合わせマーカがオフセットフレネルレンズを取り囲む。それに加えて、オフセットフレネルアレイは、集光および発光のセンサのスペクトル分離を提供するようにセンサの上に位置付けられ得る。
、4つのより小さいステップを含む。
/または追加の層の上に製造されてもよい。
区別して、請求要素を区別するためのラベルとして使用されるにすぎない。
<付記>
1. 集積装置であって、
該集積装置は、複数のピクセルを含み、前記複数のピクセルのうちの1つのピクセルが、
前記集積装置の外部の励起源から励起エネルギーを受け取るように構成された検体ウェルと、
前記検体ウェル内に位置付けられた検体からの発光を受け取り、かつ前記受け取られた発光に基づいて前記検体の識別情報を提供する信号を生成するように位置付けられた少なくとも1つのセンサと
を含む集積装置。
2. 前記信号が前記受け取られた発光の時間的パラメータを示す、付記1に記載の集積装置。
3. 前記時間的パラメータが、前記検体からの前記発光に関連付けられる寿命である、付記2に記載の集積装置。
4. 前記信号が前記発光のスペクトルを示す、付記1に記載の集積装置。
5. 前記信号が前記発光の特徴的波長を示す、付記4に記載の集積装置。
6. 前記信号および前記励起エネルギーが、前記検体の吸収スペクトルを示す、付記1に記載の集積装置。
7. 前記信号および前記励起エネルギーが、前記検体により吸収される特徴的波長を示す、付記6に記載の集積装置。
8. 集積装置であって、
ピクセル領域であって、
複数のピクセルであって、前記複数のピクセルのうちの1つのピクセルが、
前記集積装置の表面上の検体ウェルであって、検体を受けるように構成された検体ウェルと、
前記検体ウェルからの発光を受け取るように構成された少なくとも1つのセンサとを含む複数のピクセルと、
前記検体ウェルの付近に励起エネルギーを送達する少なくとも1つの導波路と
を含むピクセル領域と、
励起源結合領域であって、
外部励起エネルギー源から励起エネルギーを受け取り、かつ前記励起エネルギーを前記導波路に結合するように構成された結合構成要素
を含む励起源結合領域と
を含む集積装置。
9. 前記検体ウェルが、複数の分子を含む検体から分子を分離するように構成される、付記8に記載の集積装置。
10. 前記結合構成要素が格子カプラを含む、付記8に記載の集積装置。
11. 前記励起源結合領域が、前記格子カプラに向かって励起エネルギーを反射するように位置付けられたリフレクタ層をさらに含む、付記10に記載の集積装置。
12. 前記リフレクタ層が少なくとも1つの穴を含み、前記励起源結合領域が、前記リフレクタ層の前記少なくとも1つの穴を通じて励起エネルギーを受け取り、かつ前記受け取られた励起エネルギーの強度を測定するように位置付けられた少なくとも1つのモニタセンサをさらに含む、付記11に記載の集積装置。
13. 前記受け取られた励起エネルギーの前記強度が、前記格子カプラに対する前記励起エネルギーのアラインメントプロセスのためのフィードバックループの一部として信号を提供する、付記12に記載の集積装置。
14. 前記少なくとも1つのピクセルが、前記検体ウェルと前記導波路との間に、前記導波路から前記検体ウェルに励起エネルギーを結合する少なくとも1つの結合要素をさらに含む、付記8に記載の集積装置。
15. 前記少なくとも1つの結合要素がマイクロキャビティである、付記14に記載の集積装置。
16. 前記少なくとも1つの結合要素がブルズアイ回折格子である、付記14に記載の集積装置。
17. 前記少なくとも1つのピクセルが、励起エネルギーが前記少なくとも1つのセンサにより検出されるのを抑制するバッフルをさらに含む、付記8に記載の集積装置。
18. 前記ピクセル領域が、前記導波路と前記少なくとも1つのセンサとの間に位置付けられている、励起エネルギーを選択的にフィルタ処理するとともに前記検体ウェルからの発光エネルギーを透過させる少なくとも1つの励起フィルタをさらに含む、付記8に記載の集積装置。
19. 前記格子カプラが、前記導波路の方向にテーパが付けられている幅を有する、付記8に記載の集積装置。
20. 前記検体ウェルが、金属材料において形成されたナノアパーチャを含む、付記8に記載の集積装置。
21. 前記金属材料から形成される複数のリングを含む同心円リング回折格子をさらに含み、前記ナノアパーチャが前記複数のリングの最も内側のリング内に配置される、付記20に記載の集積装置。
22. 前記少なくとも1つの導波路が、前記検体ウェル内の励起領域に励起エネルギーを提供するように構成され、前記励起領域内に配置された検体が、前記励起領域を照明する励起エネルギーに応答して励起エネルギーを放出する、付記8に記載の集積装置。
23. 前記少なくとも1つの導波路が、前記複数のピクセルのうちのピクセルの一部の各ピクセルのための検体ウェルの付近に励起エネルギーを送達するように構成される、付記8に記載の集積装置。
24. 前記複数のピクセルのうちの1つのピクセルが、前記少なくとも1つの導波路に結合し、かつ検体ウェルの付近に励起エネルギーを誘導するように構成された少なくとも1つの励起結合構造をさらに含む、付記8に記載の集積装置。
25. 前記複数のピクセルのうちの1つのピクセルが、検体ウェル内に配置された検体により放出された放出エネルギーと結合するように構成された少なくとも1つの表面エネルギー結合要素をさらに含む、付記8に記載の集積装置。
26. システムであって、
第一の持続時間を有する励起エネルギーのパルスを放出するように構成された励起源を含む励起源モジュールと、
集積装置であって、
前記励起エネルギーのパルスに結合されると発光を放出する検体を受けるように構成された検体ウェルと、
第二の持続時間にわたり前記発光を検出するセンサであって、前記第二の持続時間が前記第一の持続時間後に発生する、センサと、
第一のエネルギー経路であって、該第一のエネルギー経路に沿って前記励起エネルギーのパルスが前記励起源からエネルギー源結合構成要素へ移動する、第一のエネルギー経路と、
第二のエネルギー経路であって、該第二のエネルギー経路に沿って前記励起エネルギーのパルスが前記エネルギー源結合構成要素から前記検体ウェルへ移動する、第二のエネルギー経路と、
第三のエネルギー経路であって、該第三のエネルギー経路に沿って前記発光が前記検体ウェルから前記センサへと移動する、第三のエネルギー経路と
を含む集積装置と
を含むシステム。
27. 前記励起源モジュールおよび前記集積装置が取り付けられる基本機器をさらに含む、付記26に記載のシステム。
28. 前記励起源モジュールがヒンジピンを介して前記基本機器に蝶着される、付記27に記載のシステム。
29. 前記集積装置が複数のスチール製ボールをさらに含み、
前記励起源モジュールが、前記複数のスチール製ボール上に載るように構成された複数の磁化された径方向v字溝を含む、付記28に記載のシステム。
30. 前記励起源モジュールが前記基本機器に着脱可能に取り付けられる、付記27に記載のシステム。
31. 前記励起源がスライドメカニズムを介して前記基本機器に取り付けられる、付記27に記載のシステム。
32. 前記励起源モジュールが、光のパルスの前記集積装置への入射角および/または位置を制御するように構成された少なくとも1つの傾斜可能ウィンドウを含む、付記26に記載のシステム。
33. 前記集積装置が少なくとも1つのモニタセンサをさらに含む、付記26に記載のシステム。
34. 前記励起源が、アクティブアラインメントメカニズムを介して前記エネルギー源結合構成要素に整列される、付記26に記載のシステム。
35. 検体における分子の存在を検出する方法であって、
複数の発光マーカのうちの1つで標識された検体を検体ウェル内に導入するステップであって、前記複数の発光マーカの少なくとも一部が異なる発光寿命値を有する、ステップと、
前記検体ウェルに光のパルスを照射するステップと、
前記検体ウェルから放出された光子の到来時間を測定するステップと、
前記光子の前記到来時間に基づいてマーカの識別を判定するステップと
を含む方法。
36. 前記検体ウェルから放出された前記光子の波長を測定するステップと、
前記光子の前記測定された波長に基づいてマーカの識別を判定するステップと
をさらに含む、付記35に記載の方法。
37. 前記検体ウェルの前記照射が前記検体ウェルの付近の導波路を使用して達成されることにより、前記光のエバネッセントテールが前記検体ウェルと結合する、付記35に記載の方法。
38. 前記光がスターカプラを使用して前記導波路に結合される、付記37に記載の方法。
39. 前記光がスライス回折格子を使用して前記導波路に結合される、付記37に記載の方法。
40. 前記光がマルチモード干渉スプリッタを使用して前記導波路に結合される、付記37に記載の方法。
41. 集積装置であって、
複数の発光マーカのうちの1つで標識された検体を受けるように構成された検体ウェルであって、前記複数の発光マーカの各々が異なる発光寿命値を有する、検体ウェルと、
前記複数の発光マーカのうちの1つからの発光を複数の持続時間にわたって検出するように構成されたセンサであって、前記複数の持続時間が前記複数の発光マーカが互いに区別されるように選択される、センサと
を含む集積装置。
42. 励起エネルギーを前記検体ウェルの付近に送達する導波路をさらに含む、付記41に記載の集積装置。
43. 前記励起エネルギーを外部エネルギー源から受け取り、かつ前記励起エネルギーを前記導波路に結合する格子カプラをさらに含む、付記42に記載の集積装置。
44. 前記格子カプラが、前記導波路の方向にテーパが付けられている幅を有する、付記42に記載の集積装置。
45. 前記検体ウェルが金属材料において形成されたナノアパーチャを含む、付記41に記載の集積装置。
46. 前記金属材料から形成された複数のリングを含む同心円リング回折格子をさらに含み、前記ナノアパーチャが前記複数のリングの最も内側のリング内に配置される、付記45に記載の集積装置。
47. 前記検体ウェルの付近に少なくとも1つのマイクロキャビティをさらに含み、前記少なくとも1つのマイクロキャビティが、導波路からの励起エネルギーを前記検体ウェルに結合するように構成される、付記45に記載の集積装置。
48. 集積装置であって、
複数の発光マーカのうちの1つで標識された検体を受けるように構成された検体ウェルであって、前記複数の発光マーカの各々が、複数のスペクトル範囲のうちの1つ内の発光を放出し、前記複数のスペクトル範囲のうちの1つで発光を放出する前記複数の発光マーカの一部がそれぞれ異なる発光寿命値を有する、検体ウェルと、
複数のセンサであって、前記複数のセンサの各センサが、複数の持続時間にわたって前記複数のスペクトル範囲のうちの1つを検出するように構成され、前記複数の持続時間が、前記複数の発光マーカの前記一部が互いに区別されるように選択される、複数のセンサと
を含む集積装置。
49. 前記検体ウェルと前記複数のセンサとの間に配置されたパターン付きカラーフィルタをさらに含む、付記48に記載の集積装置。
50. 前記パターン付きカラーフィルタが、前記複数のスペクトル範囲のうちの第一のスペクトル範囲内の光を前記複数のセンサのうちの第一のセンサへと透過させ、かつ前記複数のスペクトル範囲のうちの第二のスペクトル範囲内の光を前記複数のセンサのうちの第二のセンサへと透過させる、付記48に記載の集積装置。
51. システムであって、
複数の励起エネルギーを放出するように構成された複数の励起源であって、前記複数の励起源の各々が、前記複数の励起エネルギーのうちの1つのパルスを放出する、複数の励起源と、
集積装置であって、
複数の発光マーカのうちの1つで標識された検体を受けるように構成された検体ウェルであって、前記複数の発光マーカの一部が前記複数の励起エネルギーのうちの1つにより照明された後に発光を放出し、各々が異なる寿命値を有する、検体ウェルと、
前記複数の発光マーカのうちの1つからの発光を、前記複数の励起エネルギーのうちの1つのパルスの後、複数の持続時間にわたって検出するように構成されたセンサであって、前記複数の励起エネルギーのうちの1つの前記パルスのタイミングおよび前記複数の持続時間によって、前記複数の発光マーカが互いに区別される、センサと
を含む集積装置と
を含むシステム。
52. 集積装置を形成する方法であって、
複数のセンサ領域を形成するステップであって、前記複数のセンサ領域のうちの1つのセンサ領域が複数のセンサを含む、ステップと、
複数の検体ウェルを形成するステップであって、前記複数の検体ウェルのうちの1つの検体ウェルが、前記複数のセンサ領域の対応する1つと整列する、ステップと、
前記複数の検体ウェルから離れて励起エネルギーを結合し、かつ励起エネルギーを少なくとも1つの検体ウェルに誘導するように構成された少なくとも1つの導波路を形成するステップと
を含む方法。
53. 前記複数の検体ウェルから離れた領域において、前記集積装置の外部の少なくとも1つの励起源から励起エネルギーを受け取り、かつ前記励起エネルギーを前記少なくとも1つの導波路に結合するように構成された格子カプラを形成するステップをさらに含む、付記52に記載の集積装置を形成する方法。
54. 機器であって、
少なくとも1つの励起エネルギーを供給する少なくとも1つの励起源と、
前記少なくとも1つの励起源により放出された前記少なくとも1つの励起エネルギーを集積装置の結合領域に整列させる励起源位置決めシステムと、
前記集積装置上のセンサにより検出された放出エネルギーを表す少なくとも1つの読取り信号を受け取るように構成された読取り回路と
を含む機器。
55. 前記集積装置に対する前記少なくとも1つの励起源のアラインメントを、励起エネルギーを受け取るように構成された少なくとも1つのモニタセンサからの読取り信号に基づいて調整するように構成された励起源回路をさらに含む、付記54に記載の機器。
56. 標的核酸分子を配列解析する方法であって、
前記標的核酸分子、重合酵素、および複数の種類のヌクレオチドまたはヌクレオチド類似体を収容する検体ウェルを含む集積装置を提供するステップであって、前記複数の種類のヌクレオチドまたはヌクレオチド類似体のうちの各種類のヌクレオチドまたはヌクレオチド類似体が複数のマーカのうちの1つで標識される、ステップと、
重合酵素の存在下で前記標的核酸分子のプライミング位置において伸長反応を実行して、前記ヌクレオチドまたはヌクレオチド類似体の少なくとも一部を、前記標的核酸分子と相補的である成長鎖内に連続的に組み込むステップであって、励起エネルギーによる励起時に、前記ヌクレオチドまたはヌクレオチド類似体を標識する前記マーカが、前記成長鎖内への組込みの際に前記検体ウェルから放出を生成し、放出寿命が前記複数の種類のヌクレオチドまたはヌクレオチド類似体について区別可能である、ステップと、
前記ヌクレオチドまたはヌクレオチド類似体を、前記放出寿命を示す、センサから受け取られた信号に基づいて識別することによって前記標的核酸分子を配列解析するステップと
を含む方法。
57. 前記複数の種類のヌクレオチドまたはヌクレオチド類似体が4つの異なる種類のヌクレオチドまたはヌクレオチド類似体を含み、前記4つの異なる種類のヌクレオチドまたはヌクレオチド類似体に関連付けられる前記放出寿命が相互に区別可能である、付記56に記載の方法。
58. 前記放出寿命が、励起に使用された前記励起エネルギーの波長に基づいて区別可能である、付記56に記載の方法。
59. 前記重合酵素が前記検体ウェル内に固定される、付記56に記載の方法。
60. 前記重合酵素が前記検体ウェルの底部に固定される、付記59に記載の方法。
61. 前記重合酵素が、前記検体ウェルの表面に付着されるリンカーを使用して固定される、付記59に記載の方法。
62. 前記ヌクレオチドまたはヌクレオチド類似体が、少なくとも1つの励起エネルギー源からの励起エネルギーによる励起時に放出物を放出する、付記56に記載の方法。
63. 前記少なくとも1つの励起エネルギー源が、少なくとも1つの導波路を通じて前記検体ウェルに動作可能に結合されるレーザ光源であり、前記励起エネルギーが、前記レーザ光源から前記少なくとも1つの導波路を通じて前記検体ウェルに誘導される、付記62に記載の方法。
64. 前記検体ウェルが、複数の検体ウェルのうちの1つであり、前記複数の検体ウェルが前記集積装置の一部である、付記62に記載の方法。
65. 核酸配列解析の方法であって、
複数の検体ウェルと、前記複数の検体ウェルに動作可能に結合された励起エネルギー源とを含む集積装置を提供するステップであって、前記複数の検体ウェルの個々の検体ウェルが、標的核酸分子、重合酵素、およびヌクレオチドまたはヌクレオチド類似体を含み、複数のマーカのうちの1つのマーカが前記ヌクレオチドまたはヌクレオチド類似体の各々を標識する、ステップと、
前記ヌクレオチドまたはヌクレオチド類似体および前記重合酵素の存在下で前記標的核酸分子を重合反応に曝して、前記標的核酸分子と相補的である成長鎖を生成するステップであって、前記ヌクレオチドまたはヌクレオチド類似体が前記成長鎖内に組み込まれている間、前記複数のマーカが、励起源からの励起エネルギーによる励起時に放出物を放出する、ステップと、
伸張反応の実行中に前記放出物の寿命を検出するステップであって、前記放出物の前記寿命が前記複数のマーカについて区別可能である、ステップと、
前記標的核酸分子の配列を前記放出物の前記寿命に基づいて識別するステップと
を含む方法。
66. 前記配列が、前記放出物の前記寿命を検出した後に識別される、付記65に記載の方法。
67. 前記複数の種類のヌクレオチドまたはヌクレオチド類似体が4つの異なる種類のヌクレオチドまたはヌクレオチド類似体を含み、前記4つの種類のヌクレオチドまたはヌクレオチド類似体に関連付けられる放出寿命が相互に区別可能である、付記65に記載の方法。
68. 前記放出寿命が、前記集積装置の一部であるセンサにより検出される、付記65に記載の方法。
69. 前記複数の種類のヌクレオチドまたはヌクレオチド類似体が4つの異なる種類のヌクレオチドまたはヌクレオチド類似体を含み、前記4つの種類のヌクレオチドまたはヌクレオチド類似体に関連付けられる吸収スペクトルが相互に区別可能である、付記65に記載の方法。
70. 前記複数の種類のヌクレオチドまたはヌクレオチド類似体が4つの異なる種類のヌクレオチドまたはヌクレオチド類似体を含み、前記4つの種類のヌクレオチドまたはヌクレオチド類似体に関連付けられる互いに異なる励起エネルギーに応答する放出物が相互に区別可能である、付記65に記載の方法。
71. 試料を解析する方法であって、
複数のピクセルを有する集積装置の表面上に前記試料を載せるステップであって、各ピクセルが、複数のマーカのうちの第一のマーカで標識された検体を受けるように構成された検体ウェルと、少なくとも1つのセンサを有するセンサ領域とを有する、ステップと、
前記集積装置を、励起エネルギーを第一のピクセルの検体ウェルに結合するための少なくとも1つの励起エネルギー源と、前記第一のピクセルの前記センサ領域の前記少なくとも1つのセンサからの読取り信号を受け取るための読取り回路とを有する機器と整列させるステップと、
前記第一のマーカを励起エネルギーで照明するステップと、
前記第一のピクセルの前記センサ領域の前記少なくとも1つのセンサからの前記読取り信号から、前記第一のマーカによる放出物から生成された放出エネルギーの寿命を検出するステップと
を含む方法。
72. 前記複数のマーカのうちの前記第一のマーカを、前記放出エネルギーの前記寿命に基づいて識別するステップをさらに含み、前記複数のマーカの各々の1つが異なる寿命を有する、付記71に記載の方法。
73. 前記第一のマーカを識別することに基づいて、前記第一のマーカで標識された分子の種類を判定するステップをさらに含む、付記72に記載の方法。
74. 前記分子の種類がヌクレオチドであり、および前記第一のマーカが蛍光体である、付記73に記載の方法。
75. 前記蛍光体がリンカー分子で前記ヌクレオチドに付着される、付記74に記載の方法。
76. 第二の検体を標識する第二のマーカを励起エネルギーで照明するステップと、
前記第一のピクセルの前記センサ領域の前記少なくとも1つのセンサからの前記読取り信号から、前記第二のマーカにより生成された放出エネルギーの寿命を検出するステップと
をさらに含む、付記71に記載の方法。
77. 前記第一のマーカが第一のヌクレオチドを標識し、および前記第二のマーカが第二のヌクレオチドを標識する、付記76に記載の方法。
Claims (26)
- 集積装置であって、
励起エネルギーを伝播させるように構成された少なくとも1つの導波路と、
前記集積装置の表面に入射する励起エネルギーを受け取り、前記励起エネルギーを前記少なくとも1つの導波路に結合するように構成された格子カプラであって、前記集積装置の前記表面が前記格子カプラよりも上に形成されたクラッド材料の表面であることにより、前記集積装置の前記表面よりも下に位置する格子カプラと、
複数のピクセルと、を含み、前記複数のピクセルのうちの1つのピクセルが、
前記表面上に形成され、前記少なくとも1つの導波路から励起エネルギーを受け取るように構成された検体ウェルと、
前記検体ウェル内に位置付けられた検体からの発光を受け取り、かつ前記受け取られた発光に基づいて前記検体の識別情報を提供する信号を生成するように位置付けられた少なくとも1つのセンサとを含む集積装置。 - 前記信号が前記受け取られた発光の時間的パラメータを示す、請求項1に記載の集積装置。
- 前記時間的パラメータが、前記検体からの前記発光に関連付けられる寿命である、請求項2に記載の集積装置。
- 前記少なくとも1つのセンサは、前記検体からの発光による受け取られた光子によって生成された電荷キャリアを、少なくとも2つのビンに集約することによって前記信号を生成する、請求項1に記載の集積装置。
- 前記少なくとも1つのセンサは、励起エネルギーのパルスが前記検体ウェルに送達された後の時間について、互いに異なる時間間隔にわたって前記電荷キャリアを前記少なくとも2つのビンに集約することと、前記互いに異なる時間間隔の各々において到来した光子の相対数を示す信号を生成することと、を行うようにさらに構成されている、請求項4に記載の集積装置。
- 前記信号が、前記発光のスペクトルと、前記発光の特徴的波長と、前記検体の吸収スペクトルと、のうちの少なくとも1つを示す、請求項1に記載の集積装置。
- リフレクタ層をさらに含み、前記リフレクタ層は、前記格子カプラの面の付近に配置され、前記格子カプラを通過する励起エネルギーを前記格子カプラに向かって反射するように位置付けられている、請求項1に記載の集積装置。
- 前記複数のピクセルは、前記集積装置のピクセル領域に配置され、前記格子カプラは、前記ピクセル領域から離れた励起源結合領域に配置されている、請求項1に記載の集積装置。
- 前記検体ウェルが、複数の分子を含む検体から分子を分離するように構成される、請求項1に記載の集積装置。
- 前記格子カプラに向かって励起エネルギーを反射するように位置付けられたリフレクタ層をさらに含む、請求項1に記載の集積装置。
- 前記リフレクタ層が少なくとも1つの穴を含み、前記集積装置が、前記リフレクタ層の前記少なくとも1つの穴を通じて励起エネルギーを受け取り、かつ前記受け取られた励起エネルギーの強度を測定するように位置付けられた少なくとも1つのモニタセンサをさらに含む、請求項10に記載の集積装置。
- 前記受け取られた励起エネルギーの前記強度が、前記格子カプラに対する前記励起エネルギーのアラインメントプロセスのためのフィードバックループの一部として信号を提供する、請求項11に記載の集積装置。
- 前記複数のピクセルのうちの前記1つのピクセルが、前記検体ウェルと前記少なくとも1つの導波路との間に、前記少なくとも1つの導波路から前記検体ウェルに励起エネルギーを結合する少なくとも1つの結合要素をさらに含む、請求項1に記載の集積装置。
- 前記少なくとも1つの結合要素がマイクロキャビティである、請求項13に記載の集積装置。
- 前記少なくとも1つの結合要素がブルズアイ回折格子である、請求項13に記載の集積装置。
- 前記複数のピクセルのうちの前記1つのピクセルが、励起エネルギーが前記少なくとも1つのセンサにより検出されるのを抑制するバッフルをさらに含む、請求項1に記載の集積装置。
- 前記ピクセル領域が、前記少なくとも1つの導波路と前記少なくとも1つのセンサとの間に位置付けられている、励起エネルギーを選択的にフィルタ処理するとともに前記検体ウェルからの発光エネルギーを透過させる少なくとも1つの励起フィルタをさらに含む、請求項8に記載の集積装置。
- 前記格子カプラが、前記少なくとも1つの導波路の方向にテーパが付けられている幅を有する、請求項1に記載の集積装置。
- 前記検体ウェルが、金属材料において形成されたナノアパーチャを含む、請求項1に記載の集積装置。
- 前記金属材料から形成される複数のリングを含む同心円リング回折格子をさらに含み、前記ナノアパーチャが前記複数のリングの最も内側のリング内に配置される、請求項19に記載の集積装置。
- 前記少なくとも1つの導波路が、前記検体ウェル内の励起領域に励起エネルギーを提供するように構成され、前記励起領域内に配置された検体が、前記励起領域を照明する励起エネルギーに応答して励起エネルギーを放出する、請求項1に記載の集積装置。
- 前記少なくとも1つの導波路が、前記複数のピクセルのうちのピクセルの一部の各ピクセルのための検体ウェルの付近に励起エネルギーを送達するように構成される、請求項1に記載の集積装置。
- 前記複数のピクセルのうちの前記1つのピクセルが、前記少なくとも1つの導波路に結合し、かつ前記検体ウェルの付近に励起エネルギーを誘導するように構成された少なくとも1つの励起結合構造をさらに含む、請求項1に記載の集積装置。
- 前記複数のピクセルのうちの前記1つのピクセルが、前記検体ウェル内に配置された検体により放出された放出エネルギーと結合するように構成された少なくとも1つの表面エネルギー結合要素をさらに含む、請求項1に記載の集積装置。
- 前記検体ウェルの深さは50nm〜500nmである、請求項1に記載の集積装置。
- 前記検体ウェルの側壁は、テーパ状である、請求項1に記載の集積装置。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021131765A JP2021193375A (ja) | 2014-08-08 | 2021-08-12 | 分子の探索、検出、および解析のための外部光源を備える集積装置 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462035258P | 2014-08-08 | 2014-08-08 | |
| US62/035,258 | 2014-08-08 | ||
| US201562164464P | 2015-05-20 | 2015-05-20 | |
| US62/164,464 | 2015-05-20 | ||
| PCT/US2015/044379 WO2016023011A1 (en) | 2014-08-08 | 2015-08-07 | Integrated device with external light source for probing, detecting, and analyzing molecules |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021131765A Division JP2021193375A (ja) | 2014-08-08 | 2021-08-12 | 分子の探索、検出、および解析のための外部光源を備える集積装置 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017525958A JP2017525958A (ja) | 2017-09-07 |
| JP2017525958A5 JP2017525958A5 (ja) | 2018-09-27 |
| JP6930911B2 true JP6930911B2 (ja) | 2021-09-01 |
Family
ID=53901158
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017506981A Active JP6930911B2 (ja) | 2014-08-08 | 2015-08-07 | 分子の探索、検出、および解析のための外部光源を備える集積装置 |
| JP2021131765A Pending JP2021193375A (ja) | 2014-08-08 | 2021-08-12 | 分子の探索、検出、および解析のための外部光源を備える集積装置 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021131765A Pending JP2021193375A (ja) | 2014-08-08 | 2021-08-12 | 分子の探索、検出、および解析のための外部光源を備える集積装置 |
Country Status (10)
| Country | Link |
|---|---|
| US (8) | US9885657B2 (ja) |
| EP (1) | EP3194934B1 (ja) |
| JP (2) | JP6930911B2 (ja) |
| KR (2) | KR102473461B1 (ja) |
| CN (3) | CN112903638A (ja) |
| AU (3) | AU2015300779B2 (ja) |
| BR (1) | BR112017002501B1 (ja) |
| CA (1) | CA2957546A1 (ja) |
| MX (2) | MX2017001808A (ja) |
| WO (1) | WO2016023011A1 (ja) |
Families Citing this family (98)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105917003A (zh) | 2013-11-17 | 2016-08-31 | 宽腾矽公司 | 用于生物和化学试样的快速分析的有源像素集成装置 |
| US9465175B2 (en) * | 2014-07-23 | 2016-10-11 | Sifotonics Technologies Co., Ltd. | Integrated lens-array-on-substrate for optical coupling system and fabrication method thereof |
| AU2015300778B2 (en) | 2014-08-08 | 2021-02-25 | Quantum-Si Incorporated | Optical system and assay chip for probing, detecting, and analyzing molecules |
| EP3471402B1 (en) | 2014-08-08 | 2023-05-31 | Quantum-Si Incorporated | Integrated device for temporal binning of received photons |
| MX2017001808A (es) * | 2014-08-08 | 2018-02-08 | Quantum Si Inc | Dispositivo integrado con fuente de luz externa para el sondeo, deteccion y analisis de moleculas. |
| US9721751B2 (en) * | 2014-08-22 | 2017-08-01 | The Board Of Trustees Of The Leland Stanford Junior University | Electron microscopy specimen and method of fabrication |
| US9970971B2 (en) * | 2014-09-23 | 2018-05-15 | The Boeing Company | Flashlamp degradation monitoring system and method |
| US9684162B2 (en) * | 2015-04-09 | 2017-06-20 | Goodrich Corporation | Optical sensors |
| US10246742B2 (en) * | 2015-05-20 | 2019-04-02 | Quantum-Si Incorporated | Pulsed laser and bioanalytic system |
| US10174363B2 (en) | 2015-05-20 | 2019-01-08 | Quantum-Si Incorporated | Methods for nucleic acid sequencing |
| US11466316B2 (en) | 2015-05-20 | 2022-10-11 | Quantum-Si Incorporated | Pulsed laser and bioanalytic system |
| US10605730B2 (en) | 2015-05-20 | 2020-03-31 | Quantum-Si Incorporated | Optical sources for fluorescent lifetime analysis |
| AU2016276980B2 (en) | 2015-06-12 | 2021-09-23 | Pacific Biosciences Of California, Inc. | Integrated target waveguide devices and systems for optical coupling |
| US10097281B1 (en) | 2015-11-18 | 2018-10-09 | Hypres, Inc. | System and method for cryogenic optoelectronic data link |
| US10352856B2 (en) * | 2015-12-14 | 2019-07-16 | Massachusetts Institute Of Technology | Apparatus and methods for spectroscopy and broadband light emission using two-dimensional plasmon fields |
| CN105487291A (zh) * | 2016-01-08 | 2016-04-13 | 京东方科技集团股份有限公司 | 一种背光模组、其制备方法及显示装置 |
| US20170212307A1 (en) * | 2016-01-21 | 2017-07-27 | Jia Jiang | Optical Coupling Using Plastic Optical Fiber |
| TW202139919A (zh) | 2016-02-17 | 2021-11-01 | 美商太斯萊特健康股份有限公司 | 用於生命期成像及偵測應用之感測器及裝置 |
| EP3223063A1 (en) | 2016-03-24 | 2017-09-27 | Thomson Licensing | Device for forming a field intensity pattern in the near zone, from incident electromagnetic waves |
| US9865447B2 (en) * | 2016-03-28 | 2018-01-09 | Kla-Tencor Corporation | High brightness laser-sustained plasma broadband source |
| KR102502291B1 (ko) * | 2016-04-22 | 2023-02-21 | 일루미나, 인코포레이티드 | 픽셀 내의 복수의 부위의 발광 이미징에서 사용하기 위한 광자 구조체-기반 디바이스 및 조성물, 및 이를 사용하는 방법 |
| BR112018074572B1 (pt) | 2016-06-01 | 2024-02-27 | Quantum-Si Incorporated | Métodos de identificação de nucleotídeos e para calibrar um instrumento de sequenciamento, meio de armazenamento legível em computador não transitório, dispositivo e instrumento de sequenciamento |
| CN114674788A (zh) * | 2016-06-01 | 2022-06-28 | 宽腾矽公司 | 用于检测及分析分子的集成装置 |
| FR3054331B1 (fr) * | 2016-07-20 | 2022-07-29 | Irisiome | Systeme de generation d'impulsions lumineuses breves ou ultra-breves |
| EP3312646A1 (en) * | 2016-10-21 | 2018-04-25 | Thomson Licensing | Device and method for shielding at least one sub-wavelength-scale object from an incident electromagnetic wave |
| EP3312660A1 (en) | 2016-10-21 | 2018-04-25 | Thomson Licensing | Device for forming at least one tilted focused beam in the near zone, from incident electromagnetic waves |
| KR20220084181A (ko) | 2016-12-16 | 2022-06-21 | 퀀텀-에스아이 인코포레이티드 | 콤팩트한 빔 셰이핑 및 스티어링 어셈블리 |
| KR102574176B1 (ko) * | 2016-12-16 | 2023-09-06 | 퀀텀-에스아이 인코포레이티드 | 광 커플러 및 도파로 시스템 |
| CN110088993B (zh) | 2016-12-16 | 2022-02-08 | 宽腾矽公司 | 紧密的锁模雷射模块 |
| US10731209B2 (en) | 2016-12-19 | 2020-08-04 | Quantum-Si Incorporated | Loading molecules into sample wells for analysis |
| TWI796311B (zh) | 2016-12-22 | 2023-03-21 | 美商寬騰矽公司 | 具有直接合併像素之整合式光電偵測器 |
| US10495815B2 (en) * | 2016-12-22 | 2019-12-03 | Nokia Of America Corporation | Optical grating coupler with back-side reflector |
| EP3385219B1 (en) | 2017-04-07 | 2021-07-14 | InterDigital CE Patent Holdings | Method for manufacturing a device for forming at least one focused beam in a near zone |
| KR20200004849A (ko) | 2017-05-05 | 2020-01-14 | 퀀텀-에스아이 인코포레이티드 | 생물학적 반응에 있어서 개질된 표면 반응성 및 오손방지 특성을 갖는 기재 |
| AU2018289454A1 (en) * | 2017-06-21 | 2019-12-05 | Butterfly Network, Inc. | Microfabricated ultrasonic transducer having individual cells with electrically isolated electrode sections |
| KR20200028474A (ko) * | 2017-07-24 | 2020-03-16 | 퀀텀-에스아이 인코포레이티드 | 광학 거부 광자 구조체들 |
| WO2019080040A1 (en) * | 2017-10-26 | 2019-05-02 | Shenzhen Genorivision Technology Co. Ltd. | BIOSENSOR |
| US10948652B2 (en) * | 2017-11-03 | 2021-03-16 | Pacific Biosciences Of California, Inc. | Systems, devices, and methods for improved optical waveguide transmission and alignment |
| BR112020013397A2 (pt) | 2018-01-08 | 2020-12-01 | Quantum-Si Incorporated | sistema e métodos para carregamento eletrocinético de câmaras de reação de escala por submícron |
| AU2019211435A1 (en) | 2018-01-26 | 2020-07-30 | Quantum-Si Incorporated | Machine learning enabled pulse and base calling for sequencing devices |
| GB2573576B (en) * | 2018-05-11 | 2020-06-10 | Rockley Photonics Ltd | Optoelectronic device and method of manufacturing thereof |
| CN108535806B (zh) * | 2018-05-14 | 2019-12-27 | 台州学院 | 一种带有金属衬底的微型集成波导分束器件及其加工制备方法 |
| CN108562591A (zh) * | 2018-06-04 | 2018-09-21 | 苏州莱铯科技有限公司 | 一种基于激光检测的轴承滚珠外壁检测设备 |
| BR112020024101A2 (pt) | 2018-06-15 | 2021-04-06 | Quantum-Si Incorporated | Controle de aquisição de dados para instrumentos analíticos avançados possuindo fontes óticas pulsadas |
| AU2019288394A1 (en) | 2018-06-22 | 2021-01-07 | Quantum-Si Incorporated | Integrated photodetector with charge storage bin of varied detection time |
| WO2020010288A1 (en) * | 2018-07-05 | 2020-01-09 | Mezent Corporation | Resonant sensing device |
| TWI828695B (zh) * | 2018-07-27 | 2024-01-11 | 日商索尼半導體解決方案公司 | 受光裝置及測距裝置 |
| WO2020040584A1 (ko) * | 2018-08-23 | 2020-02-27 | 권민상 | 분자센서 및 이 분자센서를 이용한 암 진단 시스템 |
| KR102231421B1 (ko) * | 2018-08-23 | 2021-03-24 | 권민상 | 분자센서 |
| TW202020164A (zh) * | 2018-08-29 | 2020-06-01 | 美商寬騰矽公司 | 用於積體感測器器件之樣本井製造技術及結構 |
| CA3109816A1 (en) * | 2018-08-29 | 2020-03-05 | Quantum-Si Incorporated | System and methods for detecting lifetime using photon counting photodetectors |
| US10707195B2 (en) | 2018-10-09 | 2020-07-07 | Waymo Llc | Multichannel monostatic rangefinder |
| WO2020094233A1 (de) * | 2018-11-08 | 2020-05-14 | Diamontech Ag | Vorrichtung und verfahren zum analysieren eines stoffs |
| CA3117889A1 (en) | 2018-11-15 | 2020-05-22 | Quantum-Si Incorporated | Methods and compositions for protein sequencing |
| US20200171484A1 (en) * | 2018-12-03 | 2020-06-04 | Quantum-Si Incorporated | Sample well fabrication techniques and structures for integrated sensor devices |
| WO2020142643A1 (en) | 2019-01-03 | 2020-07-09 | Quantum-Si Incorporated | Optical waveguides and couplers for delivering light to an array of photonic elements |
| TWI687687B (zh) * | 2019-01-11 | 2020-03-11 | 國立中正大學 | 雙光柵感測器、檢測方法及其製備方法 |
| US11473191B2 (en) * | 2019-02-27 | 2022-10-18 | Applied Materials, Inc. | Method for creating a dielectric filled nanostructured silica substrate for flat optical devices |
| MX2021010690A (es) * | 2019-03-05 | 2021-10-01 | Quantum Si Inc | Filtro de absorcion optica para un dispositivo integrado. |
| DE102019106194B4 (de) * | 2019-03-12 | 2020-12-03 | Surflay Nanotec Gmbh | Vorrichtung zur spektroskopischen Bestimmung der Bindungskinetik eines Analyten |
| FI129477B (fi) * | 2019-05-17 | 2022-03-15 | Andritz Oy | Soodakattilan reduktioasteen määritys |
| AU2020290510A1 (en) * | 2019-06-12 | 2022-02-03 | Quantum-Si Incorporated | Techniques for protein identification using machine learning and related systems and methods |
| AU2020294144A1 (en) | 2019-06-14 | 2022-01-27 | Quantum-Si Incorporated | Sliced grating coupler with increased beam alignment sensitivity |
| US11692938B2 (en) * | 2019-06-19 | 2023-07-04 | Quantum-Si Incorporated | Optical nanostructure rejecter for an integrated device and related methods |
| WO2021005179A1 (en) * | 2019-07-10 | 2021-01-14 | Ams Ag | Photothermal gas detector including an integrated on-chip optical waveguide |
| JP2022544476A (ja) | 2019-08-08 | 2022-10-19 | クアンタム-エスアイ インコーポレイテッド | 集積光学デバイスにおける放射収集効率の向上 |
| US11105745B2 (en) * | 2019-10-10 | 2021-08-31 | Visera Technologies Company Limited | Biosensor |
| US11712715B2 (en) | 2019-10-11 | 2023-08-01 | Quantum-Si Incorporated | Surface modification in the vapor phase |
| US11500154B1 (en) * | 2019-10-18 | 2022-11-15 | Apple Inc. | Asymmetric optical power splitting system and method |
| DE102019129932B4 (de) * | 2019-11-06 | 2023-12-21 | Technische Universität Braunschweig | Optische Detektionseinrichtung und Verfahren zum Betreiben einer optischen Detektionseinrichtung |
| US11232539B2 (en) * | 2019-11-27 | 2022-01-25 | The Boeing Company | Excitation array multiplexing for active non-destructive inspection imaging systems |
| US20210187503A1 (en) * | 2019-12-19 | 2021-06-24 | Personal Genomics Taiwan, Inc. | Apparatus and system for single-molecule nucleic acids detection |
| KR20220140523A (ko) | 2020-01-14 | 2022-10-18 | 퀀텀-에스아이 인코포레이티드 | 수명 플러스 스펙트럼 특성화를 위한 센서 |
| AU2021207501A1 (en) | 2020-01-14 | 2022-09-08 | Quantum-Si Incorporated | Integrated sensor for lifetime characterization |
| EP4090942A4 (en) * | 2020-01-14 | 2024-02-28 | Pacific Biosciences California Inc | NUCLEIC ACID SEQUENCING CARTRIDGES, PACKAGED DEVICES, AND SYSTEMS |
| JP2023511550A (ja) * | 2020-01-14 | 2023-03-20 | クアンタム-エスアイ インコーポレイテッド | 集積システムにおける励起光生成用パルスレーザー光源 |
| JP6894019B1 (ja) * | 2020-01-17 | 2021-06-23 | 浜松ホトニクス株式会社 | 検査装置及び検査方法 |
| EP4107561A4 (en) * | 2020-02-18 | 2024-04-03 | Pacific Biosciences California Inc | HIGHLY MULTIPLEXED NUCLEIC ACID SEQUENCING SYSTEMS |
| US11719639B2 (en) | 2020-03-02 | 2023-08-08 | Quantum-Si Incorporated | Integrated sensor for multi-dimensional signal analysis |
| EP4133524A2 (en) | 2020-04-08 | 2023-02-15 | Quantum-si Incorporated | Integrated sensor with reduced skew |
| WO2021230868A1 (en) * | 2020-05-14 | 2021-11-18 | Hewlett-Packard Development Company, L.P. | Nitrogen vacancy sensor with integrated optics |
| FR3110979A1 (fr) * | 2020-05-28 | 2021-12-03 | Commissariat A L'energie Atomique Et Aux Energies Alternatives | Dispositif de répartition de lumière basé sur des réseaux de diffraction |
| US11935311B2 (en) | 2020-06-11 | 2024-03-19 | Nautilus Subsidiary, Inc. | Methods and systems for computational decoding of biological, chemical, and physical entities |
| TWM602562U (zh) * | 2020-06-24 | 2020-10-11 | 傅宗民 | 適用於pcr裝置的光學模組以及含此光學模組的pcr裝置 |
| GB202010028D0 (en) * | 2020-06-30 | 2020-08-12 | Ams Int Ag | Apparatus for determining the presence or concentration of target molecules |
| US11906778B2 (en) | 2020-09-25 | 2024-02-20 | Apple Inc. | Achromatic light splitting device with a high V number and a low V number waveguide |
| US11442230B2 (en) * | 2020-11-13 | 2022-09-13 | Taiwan Semiconductor Manufacturing Company Limited | Silicon photonics coupling structure using an etch stop layer and methods of forming the same |
| AU2022209365A1 (en) | 2021-01-21 | 2023-07-20 | Nautilus Subsidiary, Inc. | Systems and methods for biomolecule preparation |
| US11505796B2 (en) | 2021-03-11 | 2022-11-22 | Nautilus Biotechnology, Inc. | Systems and methods for biomolecule retention |
| WO2022265497A1 (en) * | 2021-06-18 | 2022-12-22 | Technische Universiteit Eindhoven | A spectral sensing system |
| CA3227872A1 (en) | 2021-09-09 | 2023-03-16 | James Henry JOLY | Characterization and localization of protein modifications |
| AU2022352593A1 (en) | 2021-09-22 | 2024-02-15 | Nautilus Subsidiary, Inc. | Methods and systems for determining polypeptide interactions |
| US20230149883A1 (en) | 2021-11-03 | 2023-05-18 | Nautilus Biotechnology, Inc. | Systems and methods for surface structuring |
| WO2023154252A1 (en) * | 2022-02-10 | 2023-08-17 | ColdQuanta, Inc. | Miniature atomic spectroscopy reference cell system |
| WO2023192917A1 (en) | 2022-03-29 | 2023-10-05 | Nautilus Subsidiary, Inc. | Integrated arrays for single-analyte processes |
| WO2023250364A1 (en) | 2022-06-21 | 2023-12-28 | Nautilus Subsidiary, Inc. | Method for detecting analytes at sites of optically non-resolvable distances |
| WO2024073599A1 (en) | 2022-09-29 | 2024-04-04 | Nautilus Subsidiary, Inc. | Preparation of array surfaces for single-analyte processes |
| CN116297377B (zh) * | 2023-05-22 | 2023-07-28 | 深圳高性能医疗器械国家研究院有限公司 | 单分子荧光检测芯片及其制备方法、单分子荧光检测仪 |
Family Cites Families (181)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5198543A (en) | 1989-03-24 | 1993-03-30 | Consejo Superior Investigaciones Cientificas | PHI29 DNA polymerase |
| US4945250A (en) * | 1989-07-12 | 1990-07-31 | Pb Diagnostic Systems, Inc. | Optical read head for immunoassay instrument |
| US5302509A (en) | 1989-08-14 | 1994-04-12 | Beckman Instruments, Inc. | Method for sequencing polynucleotides |
| WO1991006678A1 (en) | 1989-10-26 | 1991-05-16 | Sri International | Dna sequencing |
| US6159686A (en) | 1992-09-14 | 2000-12-12 | Sri International | Up-converting reporters for biological and other assays |
| IL108497A0 (en) | 1993-02-01 | 1994-05-30 | Seq Ltd | Methods and apparatus for dna sequencing |
| US6893816B1 (en) | 1993-10-28 | 2005-05-17 | Houston Advanced Research Center | Microfabricated, flowthrough porous apparatus for discrete detection of binding reactions |
| US6570617B2 (en) | 1994-01-28 | 2003-05-27 | California Institute Of Technology | CMOS active pixel sensor type imaging system on a chip |
| US5471515A (en) | 1994-01-28 | 1995-11-28 | California Institute Of Technology | Active pixel sensor with intra-pixel charge transfer |
| WO1995033197A1 (en) | 1994-05-27 | 1995-12-07 | Ciba-Geigy Ag | Process for detecting evanescently excited luminescence |
| US5912155A (en) | 1994-09-30 | 1999-06-15 | Life Technologies, Inc. | Cloned DNA polymerases from Thermotoga neapolitana |
| US5814565A (en) | 1995-02-23 | 1998-09-29 | University Of Utah Research Foundation | Integrated optic waveguide immunosensor |
| EP0824684B1 (en) * | 1995-05-12 | 2007-11-07 | Novartis AG | Method for the parallel detection of a plurality of analytes using evanescently excited luminescence |
| US6261797B1 (en) | 1996-01-29 | 2001-07-17 | Stratagene | Primer-mediated polynucleotide synthesis and manipulation techniques |
| US5990506A (en) | 1996-03-20 | 1999-11-23 | California Institute Of Technology | Active pixel sensors with substantially planarized color filtering elements |
| EP0938656B1 (de) | 1996-11-18 | 2005-10-26 | Novartis AG | Messvorrichtung mit einem planaren optischen wellenleiter |
| WO1998035012A2 (en) | 1997-02-12 | 1998-08-13 | Chan Eugene Y | Methods and products for analyzing polymers |
| US6265193B1 (en) | 1997-03-12 | 2001-07-24 | Pe Corporation (Ny) | DNA polymerases having improved labeled nucleotide incorporation properties |
| US6327410B1 (en) | 1997-03-14 | 2001-12-04 | The Trustees Of Tufts College | Target analyte sensors utilizing Microspheres |
| US5986271A (en) * | 1997-07-03 | 1999-11-16 | Lazarev; Victor | Fluorescence imaging system |
| US20020158212A1 (en) * | 1998-04-17 | 2002-10-31 | French Todd E. | Apparatus and methods for time-resolved optical spectroscopy |
| US6825921B1 (en) * | 1999-11-10 | 2004-11-30 | Molecular Devices Corporation | Multi-mode light detection system |
| EP0921196A1 (en) | 1997-12-02 | 1999-06-09 | Roche Diagnostics GmbH | Modified DNA-polymerase from carboxydothermus hydrogenoformans and its use for coupled reverse transcription and polymerase chain reaction |
| DE19810879A1 (de) | 1998-03-13 | 1999-09-16 | Roche Diagnostics Gmbh | Polymerasenchimären |
| CA2325399A1 (en) | 1998-03-23 | 1999-09-30 | Invitrogen Corporation | Modified nucleotides and methods useful for nucleic acid sequencing |
| WO1999057321A1 (en) | 1998-05-01 | 1999-11-11 | Arizona Board Of Regents | Method of determining the nucleotide sequence of oligonucleotides and dna molecules |
| US7875440B2 (en) | 1998-05-01 | 2011-01-25 | Arizona Board Of Regents | Method of determining the nucleotide sequence of oligonucleotides and DNA molecules |
| GB9810350D0 (en) | 1998-05-14 | 1998-07-15 | Ciba Geigy Ag | Organic compounds |
| US6787308B2 (en) | 1998-07-30 | 2004-09-07 | Solexa Ltd. | Arrayed biomolecules and their use in sequencing |
| US6716394B2 (en) | 1998-08-11 | 2004-04-06 | Caliper Technologies Corp. | DNA sequencing using multiple fluorescent labels being distinguishable by their decay times |
| US6210896B1 (en) | 1998-08-13 | 2001-04-03 | Us Genomics | Molecular motors |
| US6280939B1 (en) | 1998-09-01 | 2001-08-28 | Veeco Instruments, Inc. | Method and apparatus for DNA sequencing using a local sensitive force detector |
| AU772281B2 (en) | 1998-12-14 | 2004-04-22 | Li-Cor Inc. | A system and methods for nucleic acid sequencing of single molecules by polymerase synthesis |
| JP2002537858A (ja) | 1999-03-10 | 2002-11-12 | エーエスエム サイエンティフィック, インコーポレイテッド | 核酸の配列を直接決定するための方法 |
| EP1681356B1 (en) | 1999-05-19 | 2011-10-19 | Cornell Research Foundation, Inc. | Method for sequencing nucleic acid molecules |
| US7056661B2 (en) | 1999-05-19 | 2006-06-06 | Cornell Research Foundation, Inc. | Method for sequencing nucleic acid molecules |
| US6137117A (en) | 1999-06-21 | 2000-10-24 | The United States Of America As Represented By The Secretary Of The Navy | Integrating multi-waveguide sensor |
| JP2001042171A (ja) * | 1999-07-28 | 2001-02-16 | Canon Inc | アクティブ光配線装置 |
| US7054002B1 (en) * | 1999-10-08 | 2006-05-30 | The Texas A&M University System | Characterization of luminescence in a scattering medium |
| US6399335B1 (en) | 1999-11-16 | 2002-06-04 | Advanced Research And Technology Institute, Inc. | γ-phosphoester nucleoside triphosphates |
| CA2407701A1 (en) | 2000-04-28 | 2001-11-08 | Edgelight Biosciences, Inc. | Micro-array evanescent wave fluorescence detection device |
| US6917726B2 (en) | 2001-09-27 | 2005-07-12 | Cornell Research Foundation, Inc. | Zero-mode clad waveguides for performing spectroscopy with confined effective observation volumes |
| US6936702B2 (en) | 2000-06-07 | 2005-08-30 | Li-Cor, Inc. | Charge-switch nucleotides |
| EP1287154A4 (en) | 2000-06-07 | 2010-12-15 | Pacific Biosciences California | NUCLEOTIDES WITH CHARGE SWITCHING |
| EP1311824A4 (en) | 2000-06-25 | 2010-12-08 | Affymetrix Inc | OPTICALLY ACTIVE SUBSTRATES |
| US6687000B1 (en) * | 2000-06-26 | 2004-02-03 | Wisconsin Alumni Research Foundation | Photon-sorting spectroscopic microscope system |
| FR2813121A1 (fr) | 2000-08-21 | 2002-02-22 | Claude Weisbuch | Dispositif perfectionne de support d'elements chromophores |
| US7153672B1 (en) | 2000-08-30 | 2006-12-26 | University Of Rochester | Method of performing reverse transcription reaction using reverse transcriptase encoded by non-LTR retrotransposable element |
| US20020031836A1 (en) | 2000-09-11 | 2002-03-14 | Feldstein Mark J. | Fluidics system |
| WO2002086088A2 (en) | 2001-04-24 | 2002-10-31 | Li-Cor, Inc. | Polymerases with charge-switch activity and methods of generating such polymerases |
| US7052839B2 (en) | 2001-08-29 | 2006-05-30 | Amersham Biosciences Corp | Terminal-phosphate-labeled nucleotides and methods of use |
| US7041812B2 (en) | 2001-08-29 | 2006-05-09 | Amersham Biosciences Corp | Labeled nucleoside polyphosphates |
| US7223541B2 (en) | 2001-08-29 | 2007-05-29 | Ge Healthcare Bio-Sciences Corp. | Terminal-phosphate-labeled nucleotides and methods of use |
| US7256019B2 (en) | 2001-08-29 | 2007-08-14 | Ge Healthcare Bio-Sciences Corp. | Terminal phosphate blocked nucleoside polyphosphates |
| US7244566B2 (en) | 2001-08-29 | 2007-07-17 | Ge Healthcare Bio-Sciences Corp. | Analyte detection |
| US7033762B2 (en) | 2001-08-29 | 2006-04-25 | Amersham Biosciences Corp | Single nucleotide amplification and detection by polymerase |
| US7727722B2 (en) | 2001-08-29 | 2010-06-01 | General Electric Company | Ligation amplification |
| CA2460546A1 (en) | 2001-09-14 | 2003-03-27 | Invitrogen Corporation | Dna polymerases and mutants thereof |
| US7057026B2 (en) | 2001-12-04 | 2006-06-06 | Solexa Limited | Labelled nucleotides |
| US20050079526A1 (en) | 2002-02-20 | 2005-04-14 | Affinium Pharmaceuticals, Inc. | Methods and apparatuses for characterizing refolding and aggregation of biological molecules |
| US7179654B2 (en) | 2002-03-18 | 2007-02-20 | Agilent Technologies, Inc. | Biochemical assay with programmable array detection |
| US6924887B2 (en) | 2002-03-27 | 2005-08-02 | Sarnoff Corporation | Method and apparatus for generating charge from a light pulse |
| US6982166B2 (en) | 2002-05-16 | 2006-01-03 | Applera Corporation | Lens assembly for biological testing |
| US7595883B1 (en) | 2002-09-16 | 2009-09-29 | The Board Of Trustees Of The Leland Stanford Junior University | Biological analysis arrangement and approach therefor |
| EP1592779A4 (en) | 2003-02-05 | 2007-12-12 | Ge Healthcare Bio Sciences | NUCLEOTIDES BRANDED BY TERMINAL PHOSPHATES, HAVING NEW LINKS |
| WO2004092331A2 (en) | 2003-04-08 | 2004-10-28 | Li-Cor, Inc. | Composition and method for nucleic acid sequencing |
| JP4177705B2 (ja) | 2003-05-13 | 2008-11-05 | 株式会社東芝 | 情報記憶媒体、情報再生装置、情報再生方法 |
| WO2005073407A1 (en) * | 2003-10-07 | 2005-08-11 | Ut-Battelle, Llc | Advanced integrated circuit biochip |
| US7169560B2 (en) | 2003-11-12 | 2007-01-30 | Helicos Biosciences Corporation | Short cycle methods for sequencing polynucleotides |
| US7456021B2 (en) * | 2004-01-16 | 2008-11-25 | Exxonmobil Chemical Patents Inc. | Analysis method |
| US20070281288A1 (en) | 2004-01-27 | 2007-12-06 | Shimshon Belkin | Method and System for Detecting Analytes |
| WO2005080605A2 (en) | 2004-02-19 | 2005-09-01 | Helicos Biosciences Corporation | Methods and kits for analyzing polynucleotide sequences |
| US7462452B2 (en) | 2004-04-30 | 2008-12-09 | Pacific Biosciences Of California, Inc. | Field-switch sequencing |
| EP1787106A1 (en) * | 2004-09-10 | 2007-05-23 | Wallac Oy | Instrumentation and method adapted for optical measurement of an amplified luminescent proximity homogeneous assay |
| US7170050B2 (en) | 2004-09-17 | 2007-01-30 | Pacific Biosciences Of California, Inc. | Apparatus and methods for optical analysis of molecules |
| US7476503B2 (en) | 2004-09-17 | 2009-01-13 | Pacific Biosciences Of California, Inc. | Apparatus and method for performing nucleic acid analysis |
| US7136160B2 (en) * | 2005-01-27 | 2006-11-14 | Hewlett-Packard Development Company, L.P. | Integrated system and method for transversal enhanced Raman Spectroscopy |
| US7345764B2 (en) | 2005-02-07 | 2008-03-18 | Vladimir Bulovic | Apparatus and method for a slim format spectrometer |
| JP4290128B2 (ja) | 2005-02-25 | 2009-07-01 | キヤノン株式会社 | センサ |
| JP2006254838A (ja) * | 2005-03-18 | 2006-09-28 | Toppan Printing Co Ltd | 検出チップ及びこれを用いた物質の検出方法 |
| US20060223067A1 (en) | 2005-03-31 | 2006-10-05 | Paolo Vatta | Mutant DNA polymerases and methods of use |
| US8349605B1 (en) | 2005-04-12 | 2013-01-08 | Colorado State University Research Foundation | Optical analyte sensor |
| US7738086B2 (en) | 2005-05-09 | 2010-06-15 | The Trustees Of Columbia University In The City Of New York | Active CMOS biosensor chip for fluorescent-based detection |
| WO2007002890A2 (en) | 2005-06-28 | 2007-01-04 | Agencourt Personal Genomics Corporation | Methods of producing and sequencing modified polynucleotides |
| EP1910575B1 (en) | 2005-07-01 | 2014-12-10 | Dako Denmark A/S | Immunohistochemistry detection method |
| US7426322B2 (en) | 2005-07-20 | 2008-09-16 | Searete Llc. | Plasmon photocatalysis |
| WO2007027634A2 (en) * | 2005-08-31 | 2007-03-08 | Stratagene California | Compact optical module for fluorescence excitation and detection |
| US7405281B2 (en) | 2005-09-29 | 2008-07-29 | Pacific Biosciences Of California, Inc. | Fluorescent nucleotide analogs and uses therefor |
| US7871777B2 (en) | 2005-12-12 | 2011-01-18 | The United States Of America As Represented By The Department Of Health And Human Services | Probe for nucleic acid sequencing and methods of use |
| CA2633476C (en) | 2005-12-22 | 2015-04-21 | Pacific Biosciences Of California, Inc. | Active surface coupled polymerases |
| CA2633524A1 (en) | 2005-12-22 | 2007-07-05 | Pacific Biosciences Of California, Inc. | Polymerases for nucleotide analogue incorporation |
| US7692783B2 (en) | 2006-02-13 | 2010-04-06 | Pacific Biosciences Of California | Methods and systems for simultaneous real-time monitoring of optical signals from multiple sources |
| US7995202B2 (en) | 2006-02-13 | 2011-08-09 | Pacific Biosciences Of California, Inc. | Methods and systems for simultaneous real-time monitoring of optical signals from multiple sources |
| US7715001B2 (en) | 2006-02-13 | 2010-05-11 | Pacific Biosciences Of California, Inc. | Methods and systems for simultaneous real-time monitoring of optical signals from multiple sources |
| US7389025B2 (en) * | 2006-03-29 | 2008-06-17 | 3M Innovative Properties Company | Coupling light into microresonators |
| US8975216B2 (en) | 2006-03-30 | 2015-03-10 | Pacific Biosciences Of California | Articles having localized molecules disposed thereon and methods of producing same |
| US20080050747A1 (en) | 2006-03-30 | 2008-02-28 | Pacific Biosciences Of California, Inc. | Articles having localized molecules disposed thereon and methods of producing and using same |
| DE102006030541B4 (de) | 2006-06-23 | 2010-05-12 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Optische Anordnung |
| WO2008028160A2 (en) | 2006-09-01 | 2008-03-06 | Pacific Biosciences Of California, Inc. | Substrates, systems and methods for analyzing materials |
| US8207509B2 (en) | 2006-09-01 | 2012-06-26 | Pacific Biosciences Of California, Inc. | Substrates, systems and methods for analyzing materials |
| WO2008051530A2 (en) | 2006-10-23 | 2008-05-02 | Pacific Biosciences Of California, Inc. | Polymerase enzymes and reagents for enhanced nucleic acid sequencing |
| FR2908888B1 (fr) | 2006-11-21 | 2012-08-03 | Centre Nat Rech Scient | Dispositif pour la detection exaltee de l'emission d'une particule cible |
| CN101622522A (zh) * | 2007-01-26 | 2010-01-06 | 贝克顿·迪金森公司 | 用于细胞计数和分析的方法、系统和组合物 |
| ATE509265T1 (de) | 2007-03-22 | 2011-05-15 | Univ Strasbourg Etablissement Public A Caractere Scient Culturel Et Professionel | Gerät zur sortierung und konzentration elektromagnetischer energie und vorrichtung mit mindestens einem derartigen gerät |
| US20080241866A1 (en) | 2007-03-30 | 2008-10-02 | Pacific Biosciences Of California, Inc. | Systems and methods for enhancing fluorescent signals |
| US7873085B2 (en) | 2007-10-23 | 2011-01-18 | Andrei Babushkin | Method and device for controlling optical output of laser diode |
| WO2009082706A1 (en) | 2007-12-21 | 2009-07-02 | The Trustees Of Columbia University In The City Of New York | Active cmos sensor array for electrochemical biomolecular detection |
| US20110165652A1 (en) | 2008-01-14 | 2011-07-07 | Life Technologies Corporation | Compositions, methods and systems for single molecule sequencing |
| EP2252625B1 (en) | 2008-02-07 | 2017-12-20 | Pacific Biosciences of California, Inc. | Cis reactive oxygen quenchers integrated into linkers |
| AU2009215193A1 (en) | 2008-02-12 | 2009-08-20 | Pacific Biosciences Of California, Inc. | Compositions and methods for use in analytical reactions |
| US8652781B2 (en) | 2008-02-12 | 2014-02-18 | Pacific Biosciences Of California, Inc. | Cognate sampling kinetics |
| WO2009114182A1 (en) | 2008-03-13 | 2009-09-17 | Pacific Biosciences Of California, Inc. | Labeled reactants and their uses |
| US7973146B2 (en) | 2008-03-26 | 2011-07-05 | Pacific Biosciences Of California, Inc. | Engineered fluorescent dye labeled nucleotide analogs for DNA sequencing |
| WO2009120374A2 (en) | 2008-03-28 | 2009-10-01 | Pacific Biosciences Of California, Inc. | Methods and compositions for nucleic acid sample preparation |
| CA2719747C (en) | 2008-03-28 | 2018-02-20 | Pacific Biosciences Of California, Inc. | Compositions and methods for nucleic acid sequencing |
| EP2274446B1 (en) | 2008-03-31 | 2015-09-09 | Pacific Biosciences of California, Inc. | Two slow-step polymerase enzyme systems and methods |
| US8420366B2 (en) | 2008-03-31 | 2013-04-16 | Pacific Biosciences Of California, Inc. | Generation of modified polymerases for improved accuracy in single molecule sequencing |
| US8999676B2 (en) | 2008-03-31 | 2015-04-07 | Pacific Biosciences Of California, Inc. | Recombinant polymerases for improved single molecule sequencing |
| US9127259B2 (en) | 2008-03-31 | 2015-09-08 | Pacific Biosciences Of California, Inc. | Enzymes resistant to photodamage |
| ES2614078T3 (es) | 2008-03-31 | 2017-05-29 | Pacific Biosciences Of California, Inc. | Generación de polimerasas modificadas para precisión mejorada en secuenciación de una única molécula |
| AU2009251881B2 (en) | 2008-03-31 | 2015-03-26 | Pacific Biosciences Of California, Inc | Single molecule loading methods and compositions |
| AU2009257179B2 (en) * | 2008-06-10 | 2014-12-11 | Garrett Thermal Systems Limited | Particle detection |
| US8503073B2 (en) * | 2008-06-24 | 2013-08-06 | CSEM Centre Suisse d'Electronique et de Microtechnique S.A.—Recherche et Developpement | Light coupling device and system, and method for manufacturing the device and system |
| AU2009288696A1 (en) | 2008-09-05 | 2010-03-11 | Pacific Biosciences Of California, Inc. | Sequencing by cognate sampling |
| EP2331934B1 (en) | 2008-09-16 | 2020-01-01 | Pacific Biosciences of California, Inc. | Analytic device including a zero mode waveguide substrate |
| US8921046B2 (en) | 2008-09-19 | 2014-12-30 | Pacific Biosciences Of California, Inc. | Nucleic acid sequence analysis |
| US8481264B2 (en) | 2008-09-19 | 2013-07-09 | Pacific Biosciences Of California, Inc. | Immobilized nucleic acid complexes for sequence analysis |
| US9156010B2 (en) | 2008-09-23 | 2015-10-13 | Bio-Rad Laboratories, Inc. | Droplet-based assay system |
| US8383369B2 (en) | 2008-09-24 | 2013-02-26 | Pacific Biosciences Of California, Inc. | Intermittent detection during analytical reactions |
| WO2010036287A1 (en) | 2008-09-24 | 2010-04-01 | Pacific Biosciences Of California, Inc. | Intermittent detection during analytical reactions |
| US8247216B2 (en) | 2008-09-30 | 2012-08-21 | Pacific Biosciences Of California, Inc. | Ultra-high multiplex analytical systems and methods |
| EP2182523B1 (en) | 2008-10-31 | 2013-01-09 | CSEM Centre Suisse d'Electronique et de Microtechnique SA -Recherche et Développement | Charge sampling device and method based on a MOS-transmission line |
| WO2010057185A1 (en) | 2008-11-17 | 2010-05-20 | Pacific Biosciences Of California, Inc. | Phospholink nucleotides for sequencing applications |
| JP2012516145A (ja) | 2009-01-30 | 2012-07-19 | オックスフォード ナノポア テクノロジーズ リミテッド | ハイブリダイゼーションリンカー |
| US20110014612A1 (en) | 2009-03-27 | 2011-01-20 | Life Technologies Corporation | Polymerase compositions & methods |
| WO2010117420A2 (en) | 2009-03-30 | 2010-10-14 | Pacific Biosciences Of California, Inc. | Fret-labeled compounds and uses therefor |
| US8501406B1 (en) | 2009-07-14 | 2013-08-06 | Pacific Biosciences Of California, Inc. | Selectively functionalized arrays |
| US9523701B2 (en) | 2009-07-29 | 2016-12-20 | Dynex Technologies, Inc. | Sample plate systems and methods |
| WO2011040971A2 (en) | 2009-09-30 | 2011-04-07 | Pacific Biosciences Of California, Inc. | Generation of modified polymerases for improved accuracy in single molecule sequencing |
| US8278728B2 (en) | 2009-10-17 | 2012-10-02 | Florida Institute Of Technology | Array of concentric CMOS photodiodes for detection and de-multiplexing of spatially modulated optical channels |
| US9579402B2 (en) | 2009-12-04 | 2017-02-28 | Biotium, Inc. | Heterocycle-substituted xanthene dyes |
| JP6017107B2 (ja) * | 2009-12-28 | 2016-10-26 | ソニー株式会社 | イメージセンサ及びその製造方法、並びにセンサデバイス |
| US20110236983A1 (en) | 2009-12-29 | 2011-09-29 | Joseph Beechem | Single molecule detection and sequencing using fluorescence lifetime imaging |
| US8994946B2 (en) | 2010-02-19 | 2015-03-31 | Pacific Biosciences Of California, Inc. | Integrated analytical system and method |
| EP2537053B1 (en) | 2010-02-19 | 2016-11-02 | Pacific Biosciences of California, Inc. | An analytical device comprising an optode array chip |
| US9482615B2 (en) * | 2010-03-15 | 2016-11-01 | Industrial Technology Research Institute | Single-molecule detection system and methods |
| JP2011203604A (ja) * | 2010-03-26 | 2011-10-13 | Oki Electric Industry Co Ltd | 光学素子とその製造方法 |
| CN102207459B (zh) * | 2010-03-31 | 2013-09-04 | 中国科学院电子学研究所 | 基于集成光技术的傅里叶变换芯片光谱仪 |
| US8865078B2 (en) | 2010-06-11 | 2014-10-21 | Industrial Technology Research Institute | Apparatus for single-molecule detection |
| US8865077B2 (en) * | 2010-06-11 | 2014-10-21 | Industrial Technology Research Institute | Apparatus for single-molecule detection |
| EP2689028B1 (en) | 2011-03-23 | 2017-08-30 | Pacific Biosciences Of California, Inc. | Isolation of polymerase-nucleic acid complexes and loading onto substrates |
| CN103460026B (zh) * | 2011-03-29 | 2015-06-10 | 奥林巴斯株式会社 | 利用单个发光粒子检测的光分析装置、光分析方法以及光分析用计算机程序 |
| EP2743684B1 (en) | 2011-08-12 | 2017-09-06 | Olympus Corporation | Method for detecting fluorescent particles |
| CN104054266B (zh) * | 2011-10-25 | 2016-11-23 | 中国科学院空间科学与应用研究中心 | 一种时间分辨单光子或极弱光多维成像光谱系统及方法 |
| CA3003082C (en) | 2011-10-28 | 2020-12-15 | Illumina, Inc. | Microarray fabrication system and method |
| US9606060B2 (en) | 2012-01-13 | 2017-03-28 | California Institute Of Technology | Filterless time-domain detection of one or more fluorophores |
| US8906660B2 (en) | 2012-02-01 | 2014-12-09 | Pacific Biosciences Of California, Inc. | Recombinant polymerases with increased phototolerance |
| EP3222627B1 (en) | 2012-02-15 | 2019-08-07 | Pacific Biosciences of California, Inc. | Polymerase enzyme substrates with protein shield |
| US8675193B2 (en) * | 2012-04-23 | 2014-03-18 | Jian Liu | Near-field material processing system |
| WO2013171197A1 (en) * | 2012-05-15 | 2013-11-21 | Ait Austrian Institute Of Technology Gmbh | Compact plasmon-enhanced fluorescence biosensor |
| US9372308B1 (en) | 2012-06-17 | 2016-06-21 | Pacific Biosciences Of California, Inc. | Arrays of integrated analytical devices and methods for production |
| CA2881823C (en) * | 2012-08-20 | 2019-06-11 | Illumina, Inc. | Method and system for fluorescence lifetime based sequencing |
| US9417186B2 (en) | 2012-08-30 | 2016-08-16 | Infineon Technologies Ag | Opto-electronic sensor |
| EP3734255B1 (en) * | 2012-12-18 | 2022-10-19 | Pacific Biosciences Of California, Inc. | An optical analytical device |
| WO2014165554A1 (en) | 2013-04-03 | 2014-10-09 | Life Technologies Corporation | Systems and methods for genetic sequencing |
| US9532016B2 (en) * | 2013-04-10 | 2016-12-27 | Prysm, Inc. | Self aligning imager array |
| US9091819B2 (en) * | 2013-04-11 | 2015-07-28 | International Business Machines Corporation | Grating edge coupler and method of forming same |
| US20150124336A1 (en) | 2013-06-25 | 2015-05-07 | Public Service Solutions, Inc. | Wide spectrum optical systems and devices implementing first surface mirrors |
| US9606047B2 (en) | 2013-06-28 | 2017-03-28 | Gothenburg Sensor Devices Ab | Waveguide structure |
| JP6871672B2 (ja) * | 2013-06-28 | 2021-05-12 | インターナショナル・ビジネス・マシーンズ・コーポレーションInternational Business Machines Corporation | 光デバイス |
| CN105917003A (zh) * | 2013-11-17 | 2016-08-31 | 宽腾矽公司 | 用于生物和化学试样的快速分析的有源像素集成装置 |
| WO2015110614A1 (en) | 2014-01-23 | 2015-07-30 | Imec Vzw | Integrated waveguide structure for fluorescence analysis |
| US9765395B2 (en) | 2014-04-28 | 2017-09-19 | Nanomedical Diagnostics, Inc. | System and method for DNA sequencing and blood chemistry analysis |
| US9453969B2 (en) * | 2014-04-29 | 2016-09-27 | Corning Optical Communications LLC | Grating-coupler assembly with small mode-field diameter for photonic-integrated-circuit systems |
| WO2015177373A1 (en) | 2014-05-22 | 2015-11-26 | Imec Vzw | Semiconductor device for detecting fluorescent particles |
| EP3167317B1 (en) | 2014-07-08 | 2019-12-11 | Telefonaktiebolaget LM Ericsson (publ) | Silicon photonic device, optical polarisation beam coupler, optical source and communications network light source system |
| MX2017001808A (es) | 2014-08-08 | 2018-02-08 | Quantum Si Inc | Dispositivo integrado con fuente de luz externa para el sondeo, deteccion y analisis de moleculas. |
| AU2015300778B2 (en) | 2014-08-08 | 2021-02-25 | Quantum-Si Incorporated | Optical system and assay chip for probing, detecting, and analyzing molecules |
| EP3471402B1 (en) | 2014-08-08 | 2023-05-31 | Quantum-Si Incorporated | Integrated device for temporal binning of received photons |
| US9666748B2 (en) | 2015-01-14 | 2017-05-30 | International Business Machines Corporation | Integrated on chip detector and zero waveguide module structure for use in DNA sequencing |
| WO2016149397A1 (en) | 2015-03-16 | 2016-09-22 | Pacific Biosciences Of California, Inc. | Integrated devices and systems for free-space optical coupling |
-
2015
- 2015-08-07 MX MX2017001808A patent/MX2017001808A/es unknown
- 2015-08-07 KR KR1020177006560A patent/KR102473461B1/ko active IP Right Grant
- 2015-08-07 AU AU2015300779A patent/AU2015300779B2/en active Active
- 2015-08-07 CN CN202110063517.5A patent/CN112903638A/zh active Pending
- 2015-08-07 CA CA2957546A patent/CA2957546A1/en active Pending
- 2015-08-07 EP EP15753565.9A patent/EP3194934B1/en active Active
- 2015-08-07 US US14/821,688 patent/US9885657B2/en active Active
- 2015-08-07 JP JP2017506981A patent/JP6930911B2/ja active Active
- 2015-08-07 KR KR1020227041884A patent/KR20220165286A/ko not_active Application Discontinuation
- 2015-08-07 BR BR112017002501-9A patent/BR112017002501B1/pt active IP Right Grant
- 2015-08-07 CN CN201580054785.3A patent/CN106796176B/zh active Active
- 2015-08-07 WO PCT/US2015/044379 patent/WO2016023011A1/en active Application Filing
- 2015-08-07 CN CN202110063547.6A patent/CN112903639B/zh active Active
-
2016
- 2016-09-02 US US15/255,245 patent/US9784679B2/en active Active
- 2016-09-02 US US15/255,303 patent/US9678012B2/en active Active
-
2017
- 2017-02-08 MX MX2021008484A patent/MX2021008484A/es unknown
- 2017-07-05 US US15/641,949 patent/US10288565B2/en active Active
- 2017-12-18 US US15/845,996 patent/US10288566B2/en active Active
-
2019
- 2019-03-15 US US16/354,839 patent/US10502684B2/en active Active
- 2019-11-19 US US16/688,728 patent/US11181477B2/en active Active
-
2021
- 2021-06-01 AU AU2021203568A patent/AU2021203568A1/en not_active Abandoned
- 2021-08-12 JP JP2021131765A patent/JP2021193375A/ja active Pending
- 2021-10-08 US US17/497,835 patent/US11959853B2/en active Active
-
2023
- 2023-08-03 AU AU2023210629A patent/AU2023210629A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6930911B2 (ja) | 分子の探索、検出、および解析のための外部光源を備える集積装置 | |
| JP6812341B2 (ja) | 分子の探索、検出及び解析のための光学システム及びアッセイチップ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180807 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180807 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180810 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20190529 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190702 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20191001 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20191202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191226 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200401 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200701 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200831 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200929 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201215 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210315 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210615 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210713 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210812 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6930911 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |