JP6928323B2 - 核酸増幅の特異的抑制方法 - Google Patents
核酸増幅の特異的抑制方法 Download PDFInfo
- Publication number
- JP6928323B2 JP6928323B2 JP2015165643A JP2015165643A JP6928323B2 JP 6928323 B2 JP6928323 B2 JP 6928323B2 JP 2015165643 A JP2015165643 A JP 2015165643A JP 2015165643 A JP2015165643 A JP 2015165643A JP 6928323 B2 JP6928323 B2 JP 6928323B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- amplification
- acid amplification
- template
- orn
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
(1)PCRによる増幅反応を特異的に阻害するために、長鎖(750塩基程度)のRNAを用いる方法が報告されている(非特許文献1)。この方法では、長鎖RNAをインビトロトランスクリプションで合成するため、コストと手間がかかる。また、長鎖RNA中の配列と一部相補的な鋳型DNAの増幅も阻害される可能性があることから、阻害の特異性が低下する可能性がある。
[1]複数領域の核酸増幅が同一反応系で進行する鋳型依存的核酸増幅反応において、標的領域の核酸増幅を特異的に抑制する方法であって、標的領域にハイブリダイズする一本鎖核酸を反応系に添加する工程を含み、該一本鎖核酸はRNAまたはRNAと他の核酸とのキメラであり、かつ、10〜200塩基からなることを特徴とする核酸増幅抑制方法。
[2]一本鎖核酸が10〜50塩基からなることを特徴とする前記[1]に記載の核酸増幅抑制方法。
[3]一本鎖核酸が20〜30塩基からなることを特徴とする前記[2]に記載の核酸増幅抑制方法。
[4]一本鎖核酸が一本鎖RNAである前記[1]〜[3]のいずれかに記載の核酸増幅抑制方法。
[5]鋳型依存的核酸増幅反応が、鋳型核酸にプライマーをアニーリングさせプライマーの3’末端から核酸を伸長させることにより核酸鎖を増幅する反応であることを特徴とする前記[1]〜[4]のいずれかに記載の核酸増幅抑制方法。
[6]鋳型依存的核酸増幅反応が、PCR法、RT−PCR法、LAMP法、ICAN法、NASBA法、LCR法、SDA法、TRC法およびTMA法からなる群より選択されるいずれかであることを特徴とする前記[5]に記載の核酸増幅抑制方法。
[7]鋳型依存的核酸増幅反応がPCR法またはRT−PCR法であることを特徴とする前記[6]に記載の核酸増幅抑制方法。
[8]鋳型依存的核酸増幅反応に用いるDNAポリメラーゼがα型DNAポリメラーゼであることを特徴とする前記[5]〜[7]のいずれかに記載の核酸増幅抑制方法。
実施例で用いたORNおよびプライマーは、すべてグライナー(Greiner)社に委託して化学合成したものを使用した。用いたORNを表1に、用いたプライマーを表2に示した。
鋳型には、293T細胞(Mol. Cell Biol. 1987,7(1):379-87、ECACC株番号:12022001)から、定法に従い精製したゲノムDNAを用いた。ヒトIRF−1(interferon regulatory factor 1、NCBI ACCESSION: NG_011450)遺伝子座内の2つの隣接する領域(いずれも0.9kbp)が増幅されるようにプライマーを設計した。図1に示したように、プライマーセット1(hIRF1-913F/hIRF1-10R)はヒトIRF−1遺伝子のエクソン1の上流側の標的領域(図1中Target)を増幅するように設計され、プライマーセット2(hIRF1+269F/hIRF1+1167R)はヒトIRF−1遺伝子のエクソン1の下流側の対照領域(図1中Reference)を増幅するように設計されている。標的領域にハイブリダイズ可能な、長さが異なる4種類のORN(ORN-302F(21塩基)、ORN-298F(17塩基)、ORN-306F(25塩基)、ORN-310F(29塩基))を使用した(図1参照)。
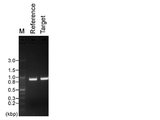
最初にORNを用いずに、プライマーセット1またはプライマーセット2を用いて、標的領域および対照領域をそれぞれPCR増幅した。すなわち、10μL中に、40ngの293T細胞のゲノムDNA、1×Buffer、0.32mMのdNTPs、0.25μMの各プライマー(プライマーセット1またはプライマーセット2)、および0.2μLのKOD FX(東洋紡)を含むPCR反応液を調製した。反応は最初に94℃2分間の変性を行った後、98℃10秒間の変性、68℃1分間のプライマーアニーリングおよび伸長を28サイクル行い、最後に68℃2分間の伸長を行った。定法に従い、アガロースゲル電気泳動で増幅産物の確認を行った。
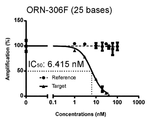
最初に、21塩基のORN−302Fを用いて、リアルタイムPCRにより特異的抑制の検討を行った。ORN−302Fの濃度は0、1、3、10、20、30、40、60および100nMとした。10μL中に、40ngの293T細胞のゲノムDNA、0.2μMの各プライマー(プライマーセット1およびプライマーセット2)、いずれかの濃度のORN、1×ROXリファレンス色素(ROX reference dye)、および5μLのKOD SYBR qPCR MIX(東洋紡)を含むリアルタイムPCR反応液を調製した。反応は最初に98℃2分間の変性を行った後、98℃10秒間の変性、60℃10秒間のプライマーアニーリングおよび68℃1分間の伸長を40サイクル行った。PCR産物の特異性は、95℃15秒、60℃15秒および99℃15秒の融解曲線分析(dissociation curve analysis)を行うことによって確認した。PCR増幅産物は7900HT Fast Real−Time PCR System(Applied Biosystems)を用いて定量した。全てのサンプルはトリプリケートでリアルタイムPCRを行った。Prism software(GraphPad)を用いて用量反応曲線を作成し、IC50値を算出した。
21塩基のORN−302Fに代えて、17塩基のORN−298F、25塩基のORN−306Fまたは29塩基のORN−310Fを用い、上記と同じ方法でリアルタイムPCRを行い、用量反応曲線を作成してIC50値を算出した。
標的領域の異なる位置にハイブリダイズする3種類のORN(ORN−666R、ORN−363R、ORN−181R、表2参照)をそれぞれ用いて、上記と同じ方法でリアルタイムPCRを行い、用量反応曲線を作成してIC50値を算出した。標的領域(Target)における各ORNの位置を図7に示した。
方向が異なる2種類のORN(ORN−302FおよびORN−363R)を同時に使用して、上記と同じ方法でリアルタイムPCRを行い、用量反応曲線を作成してIC50値を算出した。標的領域(Target)における各ORNの位置を図11に示した。
(1)hIRF−1−p/pBSプラスミドの構築
hIRF−1−p/pBSを構築するために、293T細胞のゲノムDNAを鋳型としてhIRF−1プロモーターの配列を、プライマーセット(hIRF1-913F_KpnI/hIRF1-10R_SacI)を用いてPCR増幅した。増幅産物を制限酵素KpnIおよびSacIを用いて切断し、同じく制限酵素KpnIおよびSacIを用いて切断したpBluescript−SK+(Stratagene)にライゲートした。
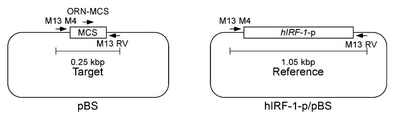
実験スキームを図13に示した。pBluescript−SK+(以下「pBS」と記す)を標的鋳型とし、hIRF−1−p/pBSを対照鋳型とした。プライマーには、M13プライマーM4およびM13プライマーRVを用いた。標的鋳型(pBS)を用いた場合、M13プライマーM4およびM13プライマーRVにより、マルチクローニングサイト(MCS)を含む0.25kbpの標的領域(Target)が増幅される。対照鋳型(hIRF−1−p/pBS)を用いた場合、M13プライマーM4およびM13プライマーRVにより、hIRF−1プロモーター配列を含む1.05kbpの対照領域(Reference)が増幅される。ORNとして、pBSのMCSにハイブリダイズするORN−MCS(21塩基)を用いた。
10μL中に、1000pgの標的鋳型(pBS)および10pgの対照鋳型(hIRF−1−p/pBS)、1×Buffer、0.2mMのdNTPs、0.3μMのM13プライマーM4およびM13プライマーRV、いずれかの濃度のORN−MCS、1.5mMのMgSO4、0.2μLのKOD−Plus−Ver.2(東洋紡)を含むPCR反応液を用いた。反応は最初に94℃2分間の変性を行った後、98℃10秒間の変性、55℃30秒間のプライマーアニーリングおよび68℃1分間の伸長を30サイクル行った。定法に従い、アガロースゲル電気泳動で増幅産物の確認を行った。
10μL中に、1000pgのpBSおよび10pgのhIRF−1−p/pBS、1×Buffer、0.2mMのdNTPs、5%DMSO、0.4μMのM13プライマーM4およびM13プライマーRV、いずれかのORN−MCS、0.1μLのPfu−X(Greiner)を含むPCR反応液を用いた。反応は最初に95℃2分間の変性を行った後、95℃20秒間の変性、55℃20秒間のプライマーアニーリングおよび68℃30秒間の伸長を25サイクル行い、最後に68℃30秒間の伸長を行った。定法に従い、アガロースゲル電気泳動で増幅産物の確認を行った。
図16に示したスキームで3’末端をリン酸化修飾したODN(方向が異なる2種類のODN、図16中ODN−FおよびODN−R)を用いて競合的状況におけるPCR増幅の特異的抑制を検討した。
(1)ODN−FおよびODN−R
ODN−FおよびODN−Rの塩基配列は以下のとおりであり、3’末端にリン酸基を付加して化学合成により作製した。
ODN-F: ATGGCTACCATAGCTCTTCCCTGG(配列番号17)
ODN-R: GGTGGACTGAATCTTGGGCCTGTA(配列番号18)
(2)mIL−2Rβ/pBSの構築
mIL−2Rβ/pBSを構築するために、Proc. Natl. Acad. Sci. USA 87:1806-1810, 1990に記載のあるmIL−2Rβ−10プラスミドからBamHIを用いてマウスIL−2Rβ cDNAを切り出し、同じくBamHIで切断したpBluescript−SK+(Stratagene)にライゲートした。
(3)hStat5/pBSの作り方
hStat5/pBSは、Immunity 2:321-329, 1995に記載されているものを利用した。
(4)PCR
PCRには、QIAGEN Long Range PCR Kitを用いた。50μL中に、10ngの標的鋳型(mIL−2Rβ/pBS)および1ngの対照鋳型(hStat5/pBS)、1×Buffer、0.5mMのdNTPs、0.4μMのM13プライマーM4およびM13プライマーRV、いずれかのODN、0.5μLのLong Range PCR enzyme Mix(QIAGEN)を含むPCR反応液を用いた。反応は最初に93℃3分間の変性を行った後、93℃15秒間の変性、62℃30秒間のプライマーアニーリングおよび68℃3分間の伸長を25サイクル行い、最後に68℃10分間の伸長を行った。定法に従い、アガロースゲル電気泳動で増幅産物の確認を行った。
図18に示したスキームで3’末端をリン酸化修飾したODN(方向が異なる2種類のODN、図18中ODN−FおよびODN−R)を用いて競合的状況におけるPCR増幅の特異的抑制を検討した。
hIL−2Rα−0.3K+0.1K/pMD20を構築するために、ヒトYT細胞のゲノムDNAを鋳型としてhIL−2Rαプロモーターの配列を、以下のプライマーセット(hIL2Ra-SalNot-F/hIL2Ra-SalNot-R)を用いてPCR増幅した。増幅産物をpMD20−Tにライゲートし、hIL−2Rα−0.3K+0.1K/pMD20とした。
hIL2Ra-SalNot-F:CTGTCGACGGGGAGGACTCAGCTTATGAAGTGCTG(配列番号19)
hIL2Ra-SalNot-R:CAGCGGCCGCCAGCCTCTTTTTGGCATCGCGCCGG(配列番号20)
hIL−2Rα−2.4K−0.3K/pMD20を構築するために、ヒトYT細胞のゲノムDNAを鋳型としてhIL−2Rαプロモーターの配列を、以下のプライマーセット(hIL2Ra-XhoCla-F/hIL2Ra-XhoCla-R)を用いてPCR増幅した。増幅産物をpMD20−Tにライゲートし、hIL−2Rα−2.4K−0.3K/pMD20とした。
hIL2Ra-XhoCla-F:GACTCGAGGGAACTTAGAAGACAGGTGAGTAGGTG(配列番号21)
hIL2Ra-XhoCla-R:ATATCGATTCAGGGCTGTAACGTCCTCAGGAGTC(配列番号22)
以下に示す方向が異なる2種類のODN(ODN-F hIL-2Rα blockSおよびODN-R hIL-2Rα blockA)を用いた。これらのODNは、3’末端にリン酸基を付加して化学合成により作製した。
ODN-F hIL-2Rα blockS: GGGGAGGACTCAGCTTATGAAGTGCTGTTA(配列番号23)
ODN-R hIL-2Rα blockA: CAGCCTCTTTTTGGCATCGCGCCGGTAA(配列番号24)
25μL中に、1ngの標的鋳型(hIL−2Rα−0.3K+0.1K/pMD20)および10ngの対照鋳型(hIL−2Rα−2.4K−0.3K/pMD20)、1×Buffer、1.5mMのMgCl2、0.2mMのdNTPs、0.4μMのM13プライマーM4およびM13プライマーRV、いずれかのODN、0.125μLのrTaq(タカラバイオ)を含むPCR反応液を用いた。反応は最初に94℃2分間の変性を行った後、94℃20秒間の変性、60℃30秒間のプライマーアニーリングおよび72℃30秒間の伸長を25サイクル行い、最後に72℃10分間の伸長を行った。定法に従い、アガロースゲル電気泳動で増幅産物の確認を行った。
以下に示す方向が異なる2種類のODN(ODN-F hIL-2Rα blockS2 FおよびODN-R hIL-2Rα blockA2 R)を用いた。これらのODNは、3’末端にリン酸基を付加して化学合成により作製した。
ODN-F hIL-2Rα blockS2 F: GGATCAGCGGCCGCCAGCCTCTTTTTGGCATATA(配列番号25)
ODN-R hIL-2Rα blockA2 R: GATTCTGTCGACGGGGAGGACTCAGCTTAACC(配列番号26)
25μL中に、1ngの標的鋳型(hIL−2Rα−0.3K+0.1K/pMD20)および10ngの対照鋳型(hIL−2Rα−2.4K−0.3K/pMD20)、1×Buffer、1.5mMのMgCl2、0.2mMのdNTPs、0.2μMのM13プライマーM4およびM13プライマーRV、いずれかのODN、0.25μLのKOD Dash(東洋紡)を含むPCR反応液を用いた。反応は、94℃30秒間の変性、60℃2秒間のプライマーアニーリングおよび74℃30秒間の伸長を25サイクル行った。定法に従い、アガロースゲル電気泳動で増幅産物の確認を行った。
結果を図19に示した。標的領域の増幅はODN濃度の増加と共に抑制され、IC50値は約10μMであった。しかし、対照領域の増幅も抑制されてしまい、この条件では標的領域のPCR増幅を特異的に抑制することは難しいことが判明した。
結果を図20に示した。標的領域の増幅はODN濃度の増加と共に抑制され、IC50値は数百nM程度であった。しかし、対照領域の増幅も抑制されてしまい、この条件では標的領域のPCR増幅を特異的に抑制することは難しいことが判明した。
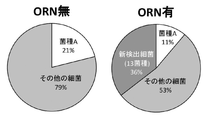
16SrDNA配列の解析によりマウスの腸内細菌叢を調べる際に、優占種特異的なORNを反応系に添加してPCRを行い、希少細菌の検出を試みた。
(1)鋳型の調製
マウス(C57BL/6J系統、雌、10.4週齢、SPF条件下での自家繁殖)を安楽死させた後、小腸(その内容物を含む)を摘出し、Proteinase KおよびPronase Eで処理した。得られたゲノムDNAをフェノール/クロロホルム抽出、エタノール沈殿により精製し、PCRの鋳型として用いた。
プライマーには、細菌類の16SrDNA増幅用ユニバーサルプライマーである10Fプライマー(5'-GTTTGATCCTGGCTCA-3' 配列番号27)および800Rプライマー(5'-TACCAGGGTATCTAATCC-3' 配列番号28)を用いた。
ORNには、菌種Aの16SrDNAにハイブリダイズするORN(5'-GAACAAGAGGGCAGAUUAUCCACGC-3' 配列番号29)を用いた。
10μL中に、20ngのマウス小腸由来ゲノムDNA、1×Buffer、0.2mMのdNTPs、5%DMSO、0.4μMの各プライマー(10Fプライマーおよび800Rプライマー)、および0.1μLのPfu−X(Greiner)を含むPCR反応液を調製した。この反応液に50μMのORNを添加してPCRを行い、ORNを添加せずにPCRを行った場合と比較した。反応は最初に95℃2分間の変性を行った後、95℃20秒間の変性、55℃20秒間のプライマーアニーリングおよび68℃30秒間の伸長を30サイクル行い、最後に68℃30秒間の伸長を行った。定法に従い、アガロースゲル電気泳動で増幅産物の確認を行い、ゲルからDNAを精製し、Zero Blunt TOPO PCR Cloning Kit for Sequencing(Invitrogen)を用いてクローニングを行った。次いで、クローン化されたインサートの塩基配列をサンガー法により決定し、菌種を同定した。
Claims (9)
- 複数領域の核酸増幅が同一反応系で進行する鋳型依存的核酸増幅反応において、標的領域の核酸増幅を特異的に抑制する方法であって、標的領域における顕著に短い任意の領域にハイブリダイズする一本鎖核酸を反応系に添加する工程を含み、該一本鎖核酸はRNAまたはRNAと他の核酸とのキメラであり、かつ、10〜70塩基からなることを特徴とする核酸増幅抑制方法。
- 一本鎖核酸が10〜50塩基からなることを特徴とする請求項1に記載の核酸増幅抑制方法。
- 一本鎖核酸が20〜30塩基からなることを特徴とする請求項2に記載の核酸増幅抑制方法。
- 一本鎖核酸が一本鎖RNAである請求項1〜3のいずれかに記載の核酸増幅抑制方法。
- 鋳型依存的核酸増幅反応が、鋳型核酸にプライマーをアニーリングさせプライマーの3’末端から核酸を伸長させることにより核酸鎖を増幅する反応であることを特徴とする請求項1〜4のいずれかに記載の核酸増幅抑制方法。
- 鋳型依存的核酸増幅反応が、PCR法、RT−PCR法、NASBA法、LCR法、TRC法およびTMA法からなる群より選択されるいずれかであることを特徴とする請求項5に記載の核酸増幅抑制方法。
- 鋳型依存的核酸増幅反応がPCR法またはRT−PCR法であることを特徴とする請求項6に記載の核酸増幅抑制方法。
- 鋳型依存的核酸増幅反応に用いるDNAポリメラーゼがα型DNAポリメラーゼであることを特徴とする請求項5〜7のいずれかに記載の核酸増幅抑制方法。
- 標的領域の核酸増幅を特異的に抑制するキットであって、標的領域における顕著に短い任意の領域にハイブリダイズする一本鎖核酸を含み、該一本鎖核酸はRNAまたはRNAと他の核酸とのキメラであり、かつ、10〜70塩基からなることを特徴とするキット。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015165643A JP6928323B2 (ja) | 2014-08-29 | 2015-08-25 | 核酸増幅の特異的抑制方法 |
| JP2020077741A JP6964900B2 (ja) | 2014-08-29 | 2020-04-24 | 核酸増幅の特異的抑制方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014176018 | 2014-08-29 | ||
| JP2014176018 | 2014-08-29 | ||
| JP2015165643A JP6928323B2 (ja) | 2014-08-29 | 2015-08-25 | 核酸増幅の特異的抑制方法 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020077741A Division JP6964900B2 (ja) | 2014-08-29 | 2020-04-24 | 核酸増幅の特異的抑制方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016049107A JP2016049107A (ja) | 2016-04-11 |
| JP6928323B2 true JP6928323B2 (ja) | 2021-09-01 |
Family
ID=55657140
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015165643A Active JP6928323B2 (ja) | 2014-08-29 | 2015-08-25 | 核酸増幅の特異的抑制方法 |
| JP2020077741A Active JP6964900B2 (ja) | 2014-08-29 | 2020-04-24 | 核酸増幅の特異的抑制方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020077741A Active JP6964900B2 (ja) | 2014-08-29 | 2020-04-24 | 核酸増幅の特異的抑制方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (2) | JP6928323B2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3789504A4 (en) * | 2018-04-20 | 2021-12-29 | Epigeneron, Inc. | Method for detecting difference in reference sequence in target nucleic acid region |
| WO2024106289A1 (ja) * | 2022-11-15 | 2024-05-23 | 国立大学法人弘前大学 | 塩基配列差異の検出キット及び検出法 |
-
2015
- 2015-08-25 JP JP2015165643A patent/JP6928323B2/ja active Active
-
2020
- 2020-04-24 JP JP2020077741A patent/JP6964900B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2016049107A (ja) | 2016-04-11 |
| JP2020182457A (ja) | 2020-11-12 |
| JP6964900B2 (ja) | 2021-11-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6434932B2 (ja) | トーホールドプライマーデュプレックスの組成物およびその使用方法 | |
| JP6804462B2 (ja) | 指数関数の底が2より大きい核酸増幅 | |
| US20180094309A1 (en) | Nucleic acid retro-activated primers | |
| JP2014510536A (ja) | 定量的pcrによる、ホルマリン固定パラフィン包埋(ffpe)試料におけるテロメア長測定 | |
| WO2012118802A9 (en) | Kit and method for sequencing a target dna in a mixed population | |
| CN113227398A (zh) | 在减少的扩增时间下使用巢式重叠引物的指数基数-3核酸扩增 | |
| JP6964900B2 (ja) | 核酸増幅の特異的抑制方法 | |
| JP2005518216A (ja) | 融解温度依存dna増幅 | |
| US10023908B2 (en) | Nucleic acid amplification method using allele-specific reactive primer | |
| JP2005518217A (ja) | ヘッドループdnaの増幅 | |
| KR20220083700A (ko) | 표적 핵산의 검출 방법, 핵산 결합 분자의 검출 방법 및 핵산 결합능의 평가 방법 | |
| JP5258760B2 (ja) | メチル化核酸又は非メチル化核酸を増幅する方法 | |
| JP2013509885A (ja) | 熱安定性ポリメラーゼとともに二本鎖核酸複合体を用いてデオキシリボヌクレオチド鎖を合成するための組成物および方法 | |
| KR102501070B1 (ko) | 표적 핵산 영역 내의 기준서열에 대한 차이를 검출하는 방법 | |
| JP7160142B2 (ja) | 核酸増幅用試薬及び核酸増幅法 | |
| EP4269612A1 (en) | Nucleic acid amplification method, primer set, probe, and kit for nucleic acid amplification method | |
| EP4074840A1 (en) | Pcr method and pcr kit for increasing allelic discrimination | |
| JP2009273432A (ja) | 逆転写反応用組成物 | |
| JP2021153393A (ja) | 核酸増幅反応用組成物 | |
| JP4942160B2 (ja) | RecAタンパク質を利用した核酸の等温増幅法 | |
| JP2008517602A (ja) | 増幅を改善するための核酸の修復 | |
| JP7306722B2 (ja) | プライマー及びその使用 | |
| JP2008178338A (ja) | 断片化核酸が混入する核酸試料中の標的核酸を増幅する核酸増幅方法、及びそのキット | |
| JP2007330101A (ja) | 核酸の増幅方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150904 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180801 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20190628 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190709 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190906 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200204 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20200424 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210112 |
|
| C13 | Notice of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: C13 Effective date: 20210309 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210409 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210413 |
|
| C23 | Notice of termination of proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C23 Effective date: 20210608 |
|
| C03 | Trial/appeal decision taken |
Free format text: JAPANESE INTERMEDIATE CODE: C03 Effective date: 20210713 |
|
| C30A | Notification sent |
Free format text: JAPANESE INTERMEDIATE CODE: C3012 Effective date: 20210713 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210721 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6928323 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |