JP6869336B2 - シクロスポリンを含む眼科用組成物 - Google Patents
シクロスポリンを含む眼科用組成物 Download PDFInfo
- Publication number
- JP6869336B2 JP6869336B2 JP2019515899A JP2019515899A JP6869336B2 JP 6869336 B2 JP6869336 B2 JP 6869336B2 JP 2019515899 A JP2019515899 A JP 2019515899A JP 2019515899 A JP2019515899 A JP 2019515899A JP 6869336 B2 JP6869336 B2 JP 6869336B2
- Authority
- JP
- Japan
- Prior art keywords
- cyclosporine
- composition
- water content
- perfluorobutyl
- pentane
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 title claims description 166
- 108010036949 Cyclosporine Proteins 0.000 title claims description 166
- 229960001265 ciclosporin Drugs 0.000 title claims description 166
- 229930182912 cyclosporin Natural products 0.000 title claims description 166
- 239000000203 mixture Substances 0.000 title claims description 155
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 86
- 238000000034 method Methods 0.000 claims description 22
- 239000006184 cosolvent Substances 0.000 claims description 21
- 208000024891 symptom Diseases 0.000 claims description 16
- 208000003556 Dry Eye Syndromes Diseases 0.000 claims description 15
- 238000001035 drying Methods 0.000 claims description 14
- 206010013774 Dry eye Diseases 0.000 claims description 12
- 208000009319 Keratoconjunctivitis Sicca Diseases 0.000 claims description 11
- 206010065062 Meibomian gland dysfunction Diseases 0.000 claims description 11
- 210000001519 tissue Anatomy 0.000 claims description 5
- 239000003230 hygroscopic agent Substances 0.000 claims description 4
- 239000002274 desiccant Substances 0.000 claims description 3
- 239000008194 pharmaceutical composition Substances 0.000 claims description 2
- 239000000243 solution Substances 0.000 description 30
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 29
- 229930105110 Cyclosporin A Natural products 0.000 description 13
- 210000001508 eye Anatomy 0.000 description 12
- 238000009472 formulation Methods 0.000 description 12
- 239000002904 solvent Substances 0.000 description 10
- 238000001179 sorption measurement Methods 0.000 description 8
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 208000002193 Pain Diseases 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 150000001335 aliphatic alkanes Chemical class 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 235000019198 oils Nutrition 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 230000008901 benefit Effects 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 230000035807 sensation Effects 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 238000003109 Karl Fischer titration Methods 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 208000003251 Pruritus Diseases 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 206010023332 keratitis Diseases 0.000 description 3
- 201000010666 keratoconjunctivitis Diseases 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 206010015946 Eye irritation Diseases 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 206010047513 Vision blurred Diseases 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 239000004359 castor oil Substances 0.000 description 2
- 235000019438 castor oil Nutrition 0.000 description 2
- 210000000795 conjunctiva Anatomy 0.000 description 2
- 210000004087 cornea Anatomy 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 231100000013 eye irritation Toxicity 0.000 description 2
- 210000000744 eyelid Anatomy 0.000 description 2
- 230000000762 glandular Effects 0.000 description 2
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 2
- 230000007803 itching Effects 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- 239000002808 molecular sieve Substances 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 238000005057 refrigeration Methods 0.000 description 2
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 2
- 230000003381 solubilizing effect Effects 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 238000009834 vaporization Methods 0.000 description 2
- 230000008016 vaporization Effects 0.000 description 2
- -1 1% by weight Chemical compound 0.000 description 1
- 206010006784 Burning sensation Diseases 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 206010010804 Contact lens intolerance Diseases 0.000 description 1
- NPEONIHYDZZZGH-UHFFFAOYSA-N Cyclosporin T Natural products CCC1NC(=O)C(C(O)C(C)CC=CC)N(C)C(=O)C(C(C)C)N(C)C(=O)C(CC(C)C)NC(=O)C(CC(C)C)N(C)C(=O)C(C)NC(=O)C(C)NC(=O)C(CC(C)C)N(C)C(=O)C(C(C)C)NC(=O)C(CC(C)C)N(C)C(=O)CN(C)C1=O NPEONIHYDZZZGH-UHFFFAOYSA-N 0.000 description 1
- 108010036941 Cyclosporins Proteins 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical class OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 206010020649 Hyperkeratosis Diseases 0.000 description 1
- 101100333728 Mus musculus Ercc8 gene Proteins 0.000 description 1
- 206010034960 Photophobia Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 206010039793 Seborrhoeic dermatitis Diseases 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000010420 art technique Methods 0.000 description 1
- 208000003464 asthenopia Diseases 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000004397 blinking Effects 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 238000003869 coulometry Methods 0.000 description 1
- PMATZTZNYRCHOR-UHFFFAOYSA-N cyclosporine a Chemical compound CCC1NC(=O)C(C(O)C(C)CC=CC)N(C)C(=O)C(C(C)C)N(C)C(=O)C(CC(C)C)N(C)C(=O)C(CC(C)C)N(C)C(=O)C(C)NC(=O)C(C)NC(=O)C(CC(C)C)N(C)C(=O)C(C(C)C)NC(=O)C(CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-UHFFFAOYSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 230000006589 gland dysfunction Effects 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 230000002727 hyperosmolar Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940124589 immunosuppressive drug Drugs 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 210000004561 lacrimal apparatus Anatomy 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 239000011356 non-aqueous organic solvent Substances 0.000 description 1
- 239000007764 o/w emulsion Substances 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000001991 pathophysiological effect Effects 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229930001118 polyketide hybrid Natural products 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 208000008742 seborrheic dermatitis Diseases 0.000 description 1
- 208000037921 secondary disease Diseases 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000012086 standard solution Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- 229940099259 vaseline Drugs 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
- A61K38/13—Cyclosporins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/04—Artificial tears; Irrigation solutions
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Ophthalmology & Optometry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
Description
1.1−パーフルオロブチル−ペンタン中に溶解したシクロスポリンを含む透明溶液の形態の組成物であって、組成物が共溶媒を本質的に含まず、かつ、15〜25℃でのシクロスポリンの濃度が約2.6mg/mLより高い、組成物。
2.組成物の残留水含有量が約0.04mg/mL未満である、項目1に記載の組成物。
3.15〜25℃でのシクロスポリンの濃度が、約2.6〜4.8mg/mL、または好ましくは約3.0〜4.8mg/mLの範囲内である、項目1または2のいずれかに記載の組成物。
4.1−パーフルオロブチル−ペンタン中に溶解したシクロスポリンを含む透明溶液の形態の組成物であって、組成物が共溶媒を本質的に含まず、かつ、組成物が約0.04mg/mL未満の残留水含有量を有する、組成物。
5.15〜25℃でのシクロスポリンの濃度が約0.5〜4.8mg/mLである、項目4に記載の組成物。
6.共溶媒がエタノールである、項目1〜5のいずれかに記載の組成物。
7.溶液が15〜25℃で熱力学的に安定である、項目1〜6のいずれかに記載の組成物。
1.1−パーフルオロブチル−ペンタン中に溶解したシクロスポリンを含む透明溶液の形態の組成物であって、組成物が共溶媒を本質的に含まず、15〜25℃でのシクロスポリンの濃度が約0.5〜4.8mg/mL、またはより好ましくは約0.5〜3.0mg/mL、または約0.5〜1.0mg/mLである、組成物。
2.1−パーフルオロブチル−ペンタン中に溶解したシクロスポリンを含む透明溶液の形態の組成物であって、組成物が共溶媒を本質的に含まず、15〜25℃でのシクロスポリンの濃度が約3.0〜4.8mg/mLの範囲内である、組成物。
3.共溶媒がエタノールである、項目1または2のいずれかに記載の組成物。
4.溶液が15〜25℃で熱力学的に安定である、項目1〜3のいずれかに記載の組成物。
1.1−パーフルオロブチル−ペンタン中に溶解したシクロスポリンを含む透明溶液の形態の組成物であって、組成物が共溶媒を本質的に含まず、かつ、組成物が約0.03mg/mL未満の残留水含有量を有する、組成物。
2.15〜25℃でのシクロスポリンの濃度が約0.5〜4.8mg/mLである、項目1に記載の組成物。
3.共溶媒がエタノールである、任意の先行する項目1または2に記載の組成物。7.
4.溶液が15〜25℃で熱力学的に安定である、任意の先行する項目に記載の組成物。
5.薬剤として使用するための、先行する項目のいずれかに記載の組成物。
6.乾性角結膜炎もしくはその症状の治療において使用するため、またはマイボーム腺機能障害もしくはその症状の治療において使用するための、項目5に記載の使用のための組成物。
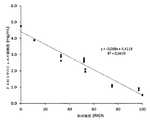
ダブルツイン微小熱量計に挿入された28mmの2チャンバー熱量測定セルを使用して25℃でのシクロスポリンの等温収着熱量測定を行った。真空下、モレキュラーシーブでシクロスポリンを1日乾燥することによって調製した乾燥資料を上(収着)チャンバーに置き、純水を下(気化)チャンバーに注入した。気化チャンバーにおいて記録された蒸発水のパワーから水分活性を算出した。シクロスポリンは99% RHの相対湿度にさらされた時に約8質量%までの水を含み得ることが分かった。
Claims (15)
- 1−パーフルオロブチル−ペンタン中に溶解したシクロスポリンを含む組成物であって、前記シクロスポリンが、前記シクロスポリンの全質量に基づいて、1.0質量%未満の水含有量を有する、組成物。
- 前記シクロスポリンが共溶媒の非存在下で溶解される、請求項1に記載の組成物。
- 15〜25℃の前記組成物中に溶解したシクロスポリンの濃度が2.6mg/mLより高い、請求項1または2に記載の組成物。
- 1−パーフルオロブチル−ペンタン中に溶解したシクロスポリンを含む透明溶液の形態の組成物を調製する方法であって、前記組成物が共溶媒を本質的に含まず、前記方法が、a)シクロスポリンの全質量に基づいて1.0質量%未満の水含有量を有するシクロスポリンを提供するステップ、およびb)前記シクロスポリンを1−パーフルオロブチル−ペンタン中に溶解させるステップを含む、方法。
- シクロスポリンの全質量に基づいて1.0質量%未満の水含有量を有するシクロスポリンを提供するステップa)が、前記シクロスポリンの全質量に基づいて1.6質量%、または1.6質量%より高い水含有量を有するシクロスポリンを乾燥させるステップを含む、請求項4に記載の方法。
- ステップa)が、真空下、場合により吸湿剤または乾燥剤の存在下で、シクロスポリンを乾燥させることを含む、請求項4または5に記載の方法。
- (i.)請求項1〜3のいずれかに定義される組成物、
(ii.)前記組成物を保持するために適した容器であって、目または眼科組織への前記組成物の外用投与に適した分注手段を有する、容器、
(iii.)場合により、吸湿剤、および
(iv.)場合により、乾性角結膜炎もしくはその症状の治療におけるキットの使用のため、またはマイボーム腺機能障害もしくはその症状の治療におけるキットの使用のための説明書を含む、医薬キット。 - 15〜25℃の前記組成物中に溶解したシクロスポリンの濃度が3.0〜4.8mg/mLである、請求項1に記載の組成物。
- 15〜25℃の前記組成物中に溶解したシクロスポリンの濃度が4.0mg/mLである、請求項8に記載の組成物。
- 1−パーフルオロブチル−ペンタンが0.00016mg/mL未満の水含有量を有する、請求項1に記載の組成物。
- 前記シクロスポリンが、前記シクロスポリンの全質量に基づいて、0.8質量%、または0.7質量%、または0.6質量%、または0.5質量%、または0.4質量%未満の水含有量を有する、請求項1に記載の組成物。
- 15〜25℃の前記組成物中に溶解したシクロスポリンの濃度が3.0〜4.8mg/mLであって、かつ、前記組成物が0.02mg/mL未満の全残留水含有量を有する、請求項1に記載の組成物。
- 眼科用の外用投与のための医薬組成物である、請求項1に記載の組成物。
- 前記シクロスポリンは、非晶性であり、または主に任意の特定の結晶形態である、請求項1に記載の組成物。
- 前記シクロスポリンと前記1−パーフルオロブチル−ペンタンからなる組成物であって、前記組成物が0.04mg/mL未満の全残留水含有量を有する、請求項1に記載の組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16190431 | 2016-09-23 | ||
| EP16190431.3 | 2016-09-23 | ||
| PCT/EP2017/074079 WO2018055101A1 (en) | 2016-09-23 | 2017-09-22 | Ophthalmic compositions comprising ciclosporin |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019529457A JP2019529457A (ja) | 2019-10-17 |
| JP2019529457A5 JP2019529457A5 (ja) | 2020-11-12 |
| JP6869336B2 true JP6869336B2 (ja) | 2021-05-12 |
Family
ID=56990364
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019515899A Active JP6869336B2 (ja) | 2016-09-23 | 2017-09-22 | シクロスポリンを含む眼科用組成物 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US10813976B2 (ja) |
| EP (1) | EP3515467B1 (ja) |
| JP (1) | JP6869336B2 (ja) |
| KR (1) | KR20190057338A (ja) |
| CN (1) | CN109906085B (ja) |
| AU (1) | AU2017329983B2 (ja) |
| CA (1) | CA3036306C (ja) |
| ES (1) | ES2965677T3 (ja) |
| MX (1) | MX2019003364A (ja) |
| WO (1) | WO2018055101A1 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2564502T3 (es) | 2010-03-17 | 2016-03-23 | Novaliq Gmbh | Composición farmacéutica para el tratamiento de la presión intraocular aumentada |
| PL3181119T3 (pl) | 2012-09-12 | 2020-01-31 | Novaliq Gmbh | Kompozycje semifluorowanych alkanów do zastosowania w leczeniu suchego zapalenia spojówki i rogówki |
| CN113679698B (zh) | 2012-09-12 | 2022-07-26 | 诺瓦利克有限责任公司 | 包含半氟化烷烃的混合物的组合物 |
| AU2014295052B2 (en) | 2013-07-23 | 2018-08-30 | Novaliq Gmbh | Stabilized antibody compositions |
| ES2803248T3 (es) | 2015-09-30 | 2021-01-25 | Novaliq Gmbh | 2-perfluorohexil octano para administración oftálmica |
| CN111743882A (zh) | 2015-09-30 | 2020-10-09 | 诺瓦利克有限责任公司 | 半氟化化合物和其组合物 |
| ES2763121T3 (es) | 2016-06-23 | 2020-05-27 | Novaliq Gmbh | Método de administración tópica |
| ES2969758T3 (es) | 2016-09-22 | 2024-05-22 | Novaliq Gmbh | Composiciones farmacéuticas para usar en la terapia de la blefaritis |
| CA3036306C (en) * | 2016-09-23 | 2024-05-14 | Novaliq Gmbh | Ophthalmic compositions comprising ciclosporin |
| CN110678207B (zh) | 2017-04-21 | 2024-08-02 | 德马利克治疗公司 | 碘组合物 |
| US11278503B2 (en) | 2017-05-12 | 2022-03-22 | Novaliq Gmbh | Pharmaceutical compositions comprising semifluorinated alkanes for the treatment of contact lense-related conditions |
| CN111372566A (zh) | 2017-09-27 | 2020-07-03 | 诺瓦利克有限责任公司 | 用于治疗眼部疾病的包含拉坦前列素的眼科用组合物 |
| WO2019068763A1 (en) | 2017-10-04 | 2019-04-11 | Novaliq Gmbh | OPHTHALMIC COMPOSITIONS COMPRISING F6H8 |
| WO2019166631A1 (en) | 2018-03-02 | 2019-09-06 | Novaliq Gmbh | Pharmaceutical compositions comprising nebivolol |
| WO2020074697A1 (en) | 2018-10-12 | 2020-04-16 | Novaliq Gmbh | Ophthalmic composition for treatment of dry eye disease |
Family Cites Families (141)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2616927A (en) | 1950-05-12 | 1952-11-04 | Minnesota Mining & Mfg | Fluorocarbon tertiary amines |
| US4452818A (en) | 1982-03-19 | 1984-06-05 | Haidt Sterling J | Extraocular method of treating the eye with liquid perfluorocarbons |
| US5077036A (en) | 1986-01-14 | 1991-12-31 | Alliance Pharmaceutical Corp. | Biocompatible stable fluorocarbon emulsions for contrast enhancement and oxygen transport comprising 40-125% wt./volume fluorocarbon combined with a phospholipid |
| JPS6452722A (en) | 1987-05-01 | 1989-02-28 | Anjierini Pharmaceut Inc | Ophthalmic composition |
| JP3046346B2 (ja) | 1990-03-12 | 2000-05-29 | 昭和電工株式会社 | 外用剤基剤又は補助剤とそれを含有する人又は動物の外用剤 |
| US6458376B1 (en) | 1990-09-27 | 2002-10-01 | Allergan, Inc. | Nonaqueous fluorinated drug delivery suspensions |
| US5518731A (en) | 1990-09-27 | 1996-05-21 | Allergan, Inc. | Nonaqueous fluorinated drug delivery vehicle suspensions |
| US5152997A (en) | 1990-12-11 | 1992-10-06 | Theratech, Inc. | Method and device for transdermally administering testosterone across nonscrotal skin at therapeutically effective levels |
| US5326566A (en) | 1991-05-17 | 1994-07-05 | Bristol-Myers Squibb Company | Use of dibutyl adipate and isopropyl myristate in topical and transdermal products |
| GB9114374D0 (en) | 1991-07-03 | 1991-08-21 | Smithkline Beecham Plc | Novel process |
| FR2679150A1 (fr) | 1991-07-17 | 1993-01-22 | Atta | Preparations comprenant un fluorocarbure ou compose hautement fluore et un compose organique lipophile-fluorophile, et leurs utilisations. |
| WO1993023010A1 (en) * | 1992-05-13 | 1993-11-25 | Sandoz Ltd. | Ophthalmic compositions containing a cyclosporin |
| US6602900B2 (en) | 1992-09-21 | 2003-08-05 | Allergan, Inc. | Cyclopentane heptan(ENE)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents |
| US5336175A (en) | 1992-10-29 | 1994-08-09 | Mames Robert N | Method for the treatment of retinal detachments |
| US5370313A (en) | 1994-01-10 | 1994-12-06 | Beard; Walter C. | Sterile liquid dispenser |
| DE4405627A1 (de) | 1994-02-22 | 1995-08-24 | Hoechst Ag | Fluorkohlenwasserstoffe enthaltende Ölemulsionen |
| FR2720943B1 (fr) | 1994-06-09 | 1996-08-23 | Applic Transferts Technolo | Emulsions inverses stables à forte concentration en composé(s) fluoré(s) et leur utilisation pour l'administration pulmonaire de médicaments et pour la fabrication d'émulsions multiples. |
| US6294563B1 (en) | 1994-10-27 | 2001-09-25 | Allergan Sales, Inc. | Combinations of prostaglandins and brimonidine or derivatives thereof |
| US5696164A (en) | 1994-12-22 | 1997-12-09 | Johnson & Johnson Consumer Products, Inc. | Antifungal treatment of nails |
| US5667809A (en) | 1995-06-07 | 1997-09-16 | Alliance Pharmaceutical Corp. | Continuous fluorochemical microdispersions for the delivery of lipophilic pharmaceutical agents |
| US5874481A (en) | 1995-06-07 | 1999-02-23 | Alliance Pharmaceutical Corp. | Fluorochemical solutions for the delivery of lipophilic pharmaceutical agents |
| DE19536504C2 (de) | 1995-09-29 | 1999-09-23 | H Meinert | Verwendung fluorierter Alkane |
| US5874469A (en) | 1996-01-05 | 1999-02-23 | Alcon Laboratories, Inc. | Fluoroalkyl hydrocarbons for administering water insoluble or unstable drugs |
| FR2752161B1 (fr) | 1996-08-07 | 1998-09-25 | Atta | Emulsions multiples de type hydrocarbure-dans-eau-dans- fluorocarbone pour le transport de substances medicamenteuses hydrophiles et/ou lipophiles |
| US5863560A (en) | 1996-09-11 | 1999-01-26 | Virotex Corporation | Compositions and methods for topical application of therapeutic agents |
| IN184589B (ja) | 1996-10-16 | 2000-09-09 | Alza Corp | |
| DE19709704C2 (de) | 1997-03-10 | 1999-11-04 | Michael Georgieff | Verwendung einer flüssigen Präparation von Xenon zur intravenösen Verabreichung bei Einleitung und/oder Aufrechterhaltung der Anaesthesie |
| US5980936A (en) | 1997-08-07 | 1999-11-09 | Alliance Pharmaceutical Corp. | Multiple emulsions comprising a hydrophobic continuous phase |
| US5851544A (en) | 1997-12-18 | 1998-12-22 | Chesebrough-Pond's Usa Co., Division Of Conopco, Inc. | Cosmetic skin or hair care compositions containing fluorocarbons infused with carbon dioxide |
| US5981607A (en) | 1998-01-20 | 1999-11-09 | Allergan | Emulsion eye drop for alleviation of dry eye related symptoms in dry eye patients and/or contact lens wearers |
| PT983037E (pt) | 1998-02-09 | 2003-09-30 | Macrochem Corp | Verniz para unhas antifungico |
| DE19861012A1 (de) | 1998-03-18 | 1999-09-30 | Pharm Pur Gmbh | Behandlungsmittel für die Ophthalmologie |
| CN1221249C (zh) | 1998-08-19 | 2005-10-05 | 斯凯伊药品加拿大公司 | 普鲁泊福的可注射水分散体 |
| US6140374A (en) | 1998-10-23 | 2000-10-31 | Abbott Laboratories | Propofol composition |
| US6159977A (en) | 1998-11-16 | 2000-12-12 | Astan, Inc. | Therapeutic anti-fungal nail preparation |
| US7258869B1 (en) | 1999-02-08 | 2007-08-21 | Alza Corporation | Stable non-aqueous single phase viscous vehicles and formulations utilizing such vehicle |
| PT1666026E (pt) | 1999-02-08 | 2012-03-15 | Intarcia Therapeutics Inc | Veículos viscosos não aquosos biocompatíveis monofásicos e métodos para a preparação dos mesmos |
| EP1124416A1 (en) | 1999-03-15 | 2001-08-22 | John Claude Krusz | Treatment of acute headaches and chronic pain using rapidly-cleared anesthetic drug at sub-anesthetic dosages |
| US6177477B1 (en) | 1999-03-24 | 2001-01-23 | American Home Products Corporation | Propofol formulation containing TRIS |
| US6239113B1 (en) | 1999-03-31 | 2001-05-29 | Insite Vision, Incorporated | Topical treatment or prevention of ocular infections |
| DE19926890C1 (de) | 1999-06-12 | 2000-07-27 | Pharm Pur Gmbh | Verwendung eines hochfluorierten oligomeren Alkans in der Ophthalmologie |
| DE19938668B4 (de) | 1999-08-14 | 2006-01-26 | Bausch & Lomb Inc. | Tränenersatzmittel |
| US6528086B2 (en) | 1999-09-28 | 2003-03-04 | Zars, Inc. | Methods and apparatus for drug delivery involving phase changing formulations |
| JP2001158734A (ja) | 1999-12-02 | 2001-06-12 | Lion Corp | 眼科用組成物及びソフトコンタクトレンズに対する吸着抑制方法 |
| US20030018044A1 (en) | 2000-02-18 | 2003-01-23 | Peyman Gholam A. | Treatment of ocular disease |
| DE10024413A1 (de) | 2000-05-19 | 2001-12-06 | Mika Pharma Gmbh | Pharmazeutische und/oder kosmetische Zubereitung |
| DE10042412B4 (de) | 2000-08-30 | 2005-12-22 | Lts Lohmann Therapie-Systeme Ag | Transdermales therapeutisches System zur Abgabe von Venlafaxin, und seine Verwendung |
| US6399087B1 (en) | 2000-12-20 | 2002-06-04 | Amphastar Pharmaceuticals, Inc. | Propofol formulation with enhanced microbial inhibition |
| WO2002089849A1 (en) | 2001-05-07 | 2002-11-14 | Corium International | Compositions and delivery systems for administration of a local anesthetic agent |
| WO2003020250A1 (en) | 2001-09-04 | 2003-03-13 | Trommsdorff Gmbh & Co. Kg Arzneimittel | Plaster for the treatment of dysfunctions and disorders of nail growth |
| AU2002325220A1 (en) | 2002-05-24 | 2003-12-12 | Dr. Gerhard Mann Chem.-Pharm. Fabrik Gmbh | Drop-forming ophthalmic gel preparation comprising diclofenamide and timolol |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| US7074827B2 (en) | 2002-10-24 | 2006-07-11 | Sucampo Ag (Usa) Inc. | Method for treating ocular hypertension and glaucoma |
| MXPA06002163A (es) | 2003-08-25 | 2006-05-22 | Foamix Ltd | Espuma farmaceutica de penetracion. |
| US20050079210A1 (en) | 2003-10-09 | 2005-04-14 | Gupta Shyam K. | Liposomal delivery system for topical pharmaceutical, cosmeceutical, and cosmetic ingredients |
| ES2377932T3 (es) | 2003-10-10 | 2012-04-03 | Ferring Bv | Formulación farmacéutica transdérmica para minimizar los residuos sobre la piel |
| WO2005051305A2 (en) | 2003-11-19 | 2005-06-09 | Barnes-Jewish Hospital | Enhanced drug delivery |
| GB0408164D0 (en) | 2004-04-13 | 2004-05-19 | Immune Targeting Systems Ltd | Antigen delivery vectors and constructs |
| ES2387619T3 (es) | 2004-04-19 | 2012-09-27 | Centre National De La Recherche Scientifique (Cnrs) | Suplementos de tensioactivos pulmonares |
| US20050288197A1 (en) | 2004-06-08 | 2005-12-29 | Ocularis Pharma, Inc. | Silicone polymer topical eye compositions and methods of use |
| US7063241B2 (en) | 2004-06-10 | 2006-06-20 | Allergan, Inc. | Dispensing tip |
| MX2007000208A (es) | 2004-07-01 | 2007-08-07 | Schepens Eye Res Inst | Composiciones y metodos para tratar trastornos y condiciones del ojo. |
| US7740875B2 (en) | 2004-10-08 | 2010-06-22 | Mediquest Therapeutics, Inc. | Organo-gel formulations for therapeutic applications |
| US20060078580A1 (en) | 2004-10-08 | 2006-04-13 | Mediquest Therapeutics, Inc. | Organo-gel formulations for therapeutic applications |
| EP1688161A1 (en) | 2004-11-02 | 2006-08-09 | Switch Biotech Aktiengesellschaft | Use of pirlindole for the treatment of diseases which are characterized by proliferation of t-lymphocytes and/or hyperproliferation of keratinocytes in particular atopic dermatitis and psoriasis |
| US7851504B2 (en) | 2005-03-16 | 2010-12-14 | Allergan, Inc. | Enhanced bimatoprost ophthalmic solution |
| GB0511499D0 (en) | 2005-06-06 | 2005-07-13 | Medpharm Ltd | Topical ungual formulations |
| EP1922060B1 (en) | 2005-08-05 | 2009-01-14 | Bharat Serums & Vaccines Ltd. | Intravenous propofol emulsion compositions having preservative efficacy |
| FR2892023B1 (fr) | 2005-10-14 | 2009-09-25 | Galderma Sa | Composition pharmaceutique a base d'amorolfine et d'agent filmogene hydrosoluble pour application ungueale et peri-ungueale |
| DE102005050431A1 (de) | 2005-10-21 | 2007-04-26 | Lts Lohmann Therapie-Systeme Ag | Transdermales therapeutisches System zur Verabreicherung lipophiler und/oder wenig hautpermeabler Wirkstoffe |
| DE102005055811A1 (de) | 2005-11-23 | 2007-05-31 | Novaliq Gmbh | Verwendung einer Zusammensetzung zur Konservierung von Organen und Gliedmaßen |
| TWI376239B (en) | 2006-02-01 | 2012-11-11 | Andrew Xian Chen | Vitamin e succinate stabilized pharmaceutical compositions, methods for the preparation and the use thereof |
| BRPI0714587A2 (pt) | 2006-07-25 | 2013-05-07 | Osmotica Corp | suluÇço oftÁlmica aquosa e uso da nesna |
| BRPI0715328A2 (pt) | 2006-08-04 | 2013-07-09 | Insys Therapeutics Inc | formulaÇço, e, dispositivo de dose unitÁria ou de dose méltipla para a administraÇço sublingual de uma droga |
| US20080089923A1 (en) | 2006-09-29 | 2008-04-17 | Burkstrand Michael J | Biodegradable ocular implants and methods for treating ocular conditions |
| EP2099408B1 (en) | 2006-11-28 | 2016-10-05 | Wisconsin Alumni Research Foundation | Fluoropolymer-based emulsions for the intravenous delivery of fluorinated volatile anesthetics |
| US8328775B2 (en) | 2006-12-07 | 2012-12-11 | Sun Pharma Advanced Research Company Limited | Metered drop bottle for dispensing microliter amounts of a liquid in the form of a drop |
| CN200977281Y (zh) | 2006-12-08 | 2007-11-21 | 陈宇 | 带助滴器的滴眼瓶 |
| FR2918891B1 (fr) | 2007-07-20 | 2009-09-25 | Thea Sa Lab | Solution ophtalmique a base de prostaglandines sans conservateur |
| US8222292B2 (en) | 2007-08-06 | 2012-07-17 | Insys Therapeutics, Inc. | Liquid cannabinoid formulations |
| DE102007055046A1 (de) | 2007-11-19 | 2009-05-28 | Fluoron Gmbh | Infusionslösung |
| US20090136430A1 (en) | 2007-11-27 | 2009-05-28 | Dugger Harry A | Antihistamine/Corticosteroid preparations for the treatment of atopic dermatitis |
| WO2009072007A2 (en) | 2007-12-07 | 2009-06-11 | Foamix Ltd. | Carriers, formulations, methods for formulating unstable active agents for external application and uses thereof |
| DK2110126T3 (da) | 2008-04-18 | 2012-02-27 | Novaliq Gmbh | Inhalations- og instillationsanvendelse af semifluorerede alkaner som aktiv bestanddel-bærere inden for det intrapulmonale område |
| US20100006600A1 (en) | 2008-07-14 | 2010-01-14 | Dascanio Gustavo A | Fluid dispenser including hydrophobic ring |
| AU2009308665B2 (en) | 2008-10-31 | 2015-10-22 | The University Of Mississippi | Compositions containing delta-9-THC-amino acid esters and process of preparation |
| WO2010062394A2 (en) | 2008-11-26 | 2010-06-03 | Surmodics, Inc. | Implantable ocular drug delivery device and methods |
| CN101502641B (zh) * | 2009-02-23 | 2012-05-02 | 姚定全 | 一种注射给药的环孢素药物组合物 |
| US8501800B2 (en) | 2009-03-05 | 2013-08-06 | Insite Vision Incorporated | Controlled-release ophthalmic vehicles |
| IT1393419B1 (it) | 2009-03-19 | 2012-04-20 | Medivis S R L | Composizioni oftalmiche a base di acidi grassi polinsaturi omega-3 e omega-6. |
| WO2010146536A1 (en) | 2009-06-18 | 2010-12-23 | Koninklijke Philips Electronics N.V. | Suspension of particles with drug |
| CN102802619A (zh) | 2009-06-25 | 2012-11-28 | 狮王株式会社 | 眼科用组合物 |
| JP5736635B2 (ja) | 2009-06-25 | 2015-06-17 | ライオン株式会社 | ドライアイ治療剤 |
| BRPI1006790B8 (pt) | 2009-07-24 | 2021-05-25 | Mika Pharma Ges Fuer Die Entwicklung Und Vermarktung Pharmazeutischer Produkte Mbh | método para desenvolver uma composição farmacêutica líquida a ser aplicada na pele como uma espuma e composição adequada para uso tópico |
| JP2011024841A (ja) | 2009-07-28 | 2011-02-10 | 健太 ▲浜崎▼ | 点眼補助具 |
| EP2332525A1 (en) | 2009-11-23 | 2011-06-15 | Novaliq GmbH | Pharmaceutical composition comprising propofol |
| EP2335735A1 (en) * | 2009-12-14 | 2011-06-22 | Novaliq GmbH | Pharmaceutical composition for treatment of dry eye syndrome |
| US20110223208A1 (en) | 2010-03-09 | 2011-09-15 | Beth Hill | Non-Aqueous High Concentration Reduced Viscosity Suspension Formulations |
| ES2564502T3 (es) | 2010-03-17 | 2016-03-23 | Novaliq Gmbh | Composición farmacéutica para el tratamiento de la presión intraocular aumentada |
| DE102010022567A1 (de) | 2010-06-02 | 2011-12-08 | Fluoron Gmbh | Zubereitung |
| EP2444063A1 (en) | 2010-10-20 | 2012-04-25 | Novaliq GmbH | Liquid pharmaceutical compositions for the delivery of active ingredients |
| EP2462921A1 (en) | 2010-11-11 | 2012-06-13 | Novaliq GmbH | Liquid pharmaceutical compositions for the treatment of a posterior eye disease |
| TR201901309T4 (tr) | 2011-01-04 | 2019-02-21 | Novaliq Gmbh | Semiflorlanmış alkanları içeren o/w emülsiyonları. |
| WO2012160180A2 (en) | 2011-05-25 | 2012-11-29 | Novaliq Gmbh | Pharmaceutical composition for administration to nails |
| PT3192501T (pt) | 2011-05-25 | 2020-07-31 | Novaliq Gmbh | Composição farmacêutica tópica à base de alcanos semifluorados |
| CN202136470U (zh) | 2011-06-08 | 2012-02-08 | 天津市金亿达药用包装材料有限公司 | 便于滴药的眼药瓶 |
| BR112014017719A8 (pt) | 2012-01-23 | 2017-07-11 | Novaliq Gmbh | Composições de proteína estabilizada baseadas em alcanos semifluorados |
| US9549966B2 (en) | 2012-02-21 | 2017-01-24 | Massachusetts Eye & Ear Infirmary | Inflammatory eye disorders |
| US9878000B2 (en) | 2012-06-20 | 2018-01-30 | University Of Waterloo | Mucoadhesive nanoparticle composition comprising immunosuppresant and methods of use thereof |
| PL3181119T3 (pl) | 2012-09-12 | 2020-01-31 | Novaliq Gmbh | Kompozycje semifluorowanych alkanów do zastosowania w leczeniu suchego zapalenia spojówki i rogówki |
| CN113679698B (zh) | 2012-09-12 | 2022-07-26 | 诺瓦利克有限责任公司 | 包含半氟化烷烃的混合物的组合物 |
| CN103054796B (zh) * | 2012-12-11 | 2014-07-16 | 山东省眼科研究所 | 一种环孢素a胶束滴眼液及其制备方法 |
| CA2891686A1 (en) | 2012-12-18 | 2014-06-26 | Novartis Ag | Compositions and methods that utilize a peptide tag that binds to hyaluronan |
| EP2783703A1 (en) | 2013-03-25 | 2014-10-01 | B. Braun Melsungen AG | Semifluorocarbon compound containing contrast agent |
| AU2014295052B2 (en) | 2013-07-23 | 2018-08-30 | Novaliq Gmbh | Stabilized antibody compositions |
| US9265809B2 (en) | 2013-10-09 | 2016-02-23 | Johnson Living Trust dated October 26, 2011, Leonidas A. Johnson, Trustee | Methods and compositions for treating and preventing signs or symptoms of eye disease |
| CN203524843U (zh) | 2013-10-20 | 2014-04-09 | 吕相瑜 | 自助滴眼液辅助支架 |
| EP3071193B1 (en) | 2013-11-20 | 2020-01-08 | Panag Pharma Inc. | Compositions and methods for treatment of ocular inflammation and pain |
| MX2016012684A (es) | 2014-03-31 | 2017-05-01 | Amcor Ltd | Recipiente de liberacion controlada. |
| EP2944324A1 (de) | 2014-05-13 | 2015-11-18 | LTS LOHMANN Therapie-Systeme AG | Verwendung von semifluorierten Alkanen in transdermalen therapeutischen Systemen |
| EP3179975A4 (en) | 2014-08-13 | 2018-04-18 | University of Florida Research Foundation, Inc. | Preservative removal from eye drops |
| MA41299A (fr) | 2014-12-30 | 2017-11-07 | Axim Biotechnologies Inc | Solutions ophtalmiques pour le traitement du glaucome et de la conjonctivite |
| ES2803248T3 (es) | 2015-09-30 | 2021-01-25 | Novaliq Gmbh | 2-perfluorohexil octano para administración oftálmica |
| CN111743882A (zh) | 2015-09-30 | 2020-10-09 | 诺瓦利克有限责任公司 | 半氟化化合物和其组合物 |
| ES2763121T3 (es) | 2016-06-23 | 2020-05-27 | Novaliq Gmbh | Método de administración tópica |
| ES2969758T3 (es) | 2016-09-22 | 2024-05-22 | Novaliq Gmbh | Composiciones farmacéuticas para usar en la terapia de la blefaritis |
| CA3036306C (en) * | 2016-09-23 | 2024-05-14 | Novaliq Gmbh | Ophthalmic compositions comprising ciclosporin |
| KR20190060787A (ko) | 2016-09-28 | 2019-06-03 | 노바리크 게엠베하 | 카나비노이드 수용체 결합 리간드를 포함하는 조성물 |
| EP3558308A1 (en) | 2016-12-22 | 2019-10-30 | Novaliq GmbH | Compositions comprising tacrolimus for the treatment of intraocular inflammatory eye diseases |
| CN110267645A (zh) | 2016-12-23 | 2019-09-20 | 诺瓦利克有限责任公司 | 用于治疗干眼病的眼用组合物 |
| CN110678207B (zh) | 2017-04-21 | 2024-08-02 | 德马利克治疗公司 | 碘组合物 |
| EP3618782B1 (en) | 2017-05-06 | 2021-05-26 | Novaliq GmbH | Drop dispenser |
| US11278503B2 (en) | 2017-05-12 | 2022-03-22 | Novaliq Gmbh | Pharmaceutical compositions comprising semifluorinated alkanes for the treatment of contact lense-related conditions |
| CN111372566A (zh) | 2017-09-27 | 2020-07-03 | 诺瓦利克有限责任公司 | 用于治疗眼部疾病的包含拉坦前列素的眼科用组合物 |
| WO2019068763A1 (en) | 2017-10-04 | 2019-04-11 | Novaliq Gmbh | OPHTHALMIC COMPOSITIONS COMPRISING F6H8 |
| WO2019166631A1 (en) | 2018-03-02 | 2019-09-06 | Novaliq Gmbh | Pharmaceutical compositions comprising nebivolol |
| CN111867560B (zh) | 2018-03-28 | 2024-08-13 | 诺瓦利克有限责任公司 | 包含噻吗洛尔的药物组合物 |
| CN112153970A (zh) | 2018-04-27 | 2020-12-29 | 诺瓦利克有限责任公司 | 用于治疗青光眼的包含他氟前列素的眼用组合物 |
| CA3111873A1 (en) | 2018-09-22 | 2020-03-26 | Novaliq Gmbh | Ophthalmic compositions for treatment of ocular surface damage and symptoms of dryness |
| WO2020074697A1 (en) | 2018-10-12 | 2020-04-16 | Novaliq Gmbh | Ophthalmic composition for treatment of dry eye disease |
| WO2020152046A1 (en) | 2019-01-21 | 2020-07-30 | Novaliq Gmbh | Pharmaceutical composition for the treatment of ocular neovascularisation |
-
2017
- 2017-09-22 CA CA3036306A patent/CA3036306C/en active Active
- 2017-09-22 WO PCT/EP2017/074079 patent/WO2018055101A1/en unknown
- 2017-09-22 EP EP17783740.8A patent/EP3515467B1/en active Active
- 2017-09-22 MX MX2019003364A patent/MX2019003364A/es unknown
- 2017-09-22 ES ES17783740T patent/ES2965677T3/es active Active
- 2017-09-22 AU AU2017329983A patent/AU2017329983B2/en active Active
- 2017-09-22 CN CN201780058489.XA patent/CN109906085B/zh active Active
- 2017-09-22 JP JP2019515899A patent/JP6869336B2/ja active Active
- 2017-09-22 US US16/336,005 patent/US10813976B2/en active Active
- 2017-09-22 KR KR1020197011208A patent/KR20190057338A/ko not_active Application Discontinuation
-
2020
- 2020-10-13 US US17/069,417 patent/US11400132B2/en active Active
-
2022
- 2022-07-25 US US17/814,818 patent/US20220354926A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| WO2018055101A1 (en) | 2018-03-29 |
| US20200023035A1 (en) | 2020-01-23 |
| CA3036306A1 (en) | 2018-03-29 |
| ES2965677T3 (es) | 2024-04-16 |
| EP3515467C0 (en) | 2023-11-29 |
| MX2019003364A (es) | 2019-10-02 |
| EP3515467B1 (en) | 2023-11-29 |
| AU2017329983A1 (en) | 2019-04-04 |
| CN109906085A (zh) | 2019-06-18 |
| US20210023166A1 (en) | 2021-01-28 |
| CN109906085B (zh) | 2024-03-08 |
| KR20190057338A (ko) | 2019-05-28 |
| US10813976B2 (en) | 2020-10-27 |
| US20220354926A1 (en) | 2022-11-10 |
| AU2017329983B2 (en) | 2022-05-05 |
| CA3036306C (en) | 2024-05-14 |
| JP2019529457A (ja) | 2019-10-17 |
| EP3515467A1 (en) | 2019-07-31 |
| US11400132B2 (en) | 2022-08-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6869336B2 (ja) | シクロスポリンを含む眼科用組成物 | |
| JP6397472B2 (ja) | ドライアイ症候群の治療のための医薬組成物 | |
| ES2957559T3 (es) | Composiciones de yodo | |
| JP6392858B2 (ja) | シクロスポリンを含有するナノエマルジョン点眼組成物およびその製造方法 | |
| JP2019534867A (ja) | カンナビノイド受容体結合リガンドを含む組成物 | |
| JP7353292B2 (ja) | ネビボロールを含む医薬組成物 | |
| JP7496778B2 (ja) | チモロールを含む医薬組成物 | |
| WO2022113970A1 (ja) | 涙液層破壊時間短縮型ドライアイ治療剤および該治療剤を含む点眼剤 | |
| US20140302099A1 (en) | Ophthalmic Composition Containing Cyclosporine And method For Preparing Same | |
| JP2001131064A (ja) | トラニラスト膏体組成物及びその製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200917 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200917 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20200917 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20201002 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201021 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210121 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210317 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210413 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6869336 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |