JP6568052B2 - 心不全を治療するためのニューレグリンの徐放 - Google Patents
心不全を治療するためのニューレグリンの徐放 Download PDFInfo
- Publication number
- JP6568052B2 JP6568052B2 JP2016514266A JP2016514266A JP6568052B2 JP 6568052 B2 JP6568052 B2 JP 6568052B2 JP 2016514266 A JP2016514266 A JP 2016514266A JP 2016514266 A JP2016514266 A JP 2016514266A JP 6568052 B2 JP6568052 B2 JP 6568052B2
- Authority
- JP
- Japan
- Prior art keywords
- neuregulin
- day
- pharmaceutical composition
- pump
- months
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/1883—Neuregulins, e.g.. p185erbB2 ligands, glial growth factor, heregulin, ARIA, neu differentiation factor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
Description
本発明は概して、ニューレグリンの徐放により、様々な心臓血管疾患又は障害、特に心不全を予防、治療又は遅延する組成物及び方法に関する。特に、本発明は、ポンプによる皮下注入を介した、哺乳動物へのニューレグリンの投与に関する。
心不全は約5,000,000人のアメリカ人が罹患し、毎年550,000人を超える新規患者がその病状と診断される。心不全のための現在の薬物療法は、主にアンギオテンシン変換酵素(ACE)阻害剤に向けられているが、それらは、血管を拡張させ、血圧を低下させ、心臓の作業負荷を減少させる血管拡張薬である。死亡率の減少割合は顕著であるが、ACE阻害剤による実際の死亡率の減少は平均3%〜4%に過ぎず、いくつかの潜在的な副作用がある。さらなる限界は、心不全を予防又は治療するための他の選択肢と関連する。例えば、心臓移植は薬物治療よりも明らかに高額で侵襲的であり、それはドナーの心臓の入手可能性によってさらに制限される。両心室ペースメーカーなどの機械装置の使用も同様に侵襲的で高額である。したがって、現在の療法の欠点を考慮した新しい療法が必要とされている。
本出願人により、静脈内注入によるニューレグリン(NRG)の徐放は、非徐放法により投与されるNRGと比べ、心不全の治療におけるNRGの効果を大きく改善することが発見された。静脈内注入によるNRGの徐放はまた、非徐放法により投与されるNRGと比べ、NRGの有害副作用を軽減するという恩恵も有する。本発明はさらに、哺乳動物、特にヒトへの皮下注入による、NRGの徐放による、様々な心臓血管疾患又は障害、特に心不全の予防、治療又は遅延のための組成物及び方法を提供する。特に本発明は、皮下注入のための携帯可能なミニポンプを使用する、NRGの徐放による、様々な心臓血管疾患又は障害、特に心不全を予防、治療又は遅延するための組成物及び方法に関する。
(A.定義)
限定するためではなく、開示を明確にするために、以降の本発明の詳細な説明を以下のサブセクションに分割する。本明細書で言及される全ての刊行物は、それらと関連して該刊行物が引用される方法及び/又は材料を開示及び説明するために、参照により組み込まれる。
別途定義されない限り、本明細書で用いる全ての技術用語及び科学用語は、本発明が属する技術分野の業者が共通に理解するのと同じ意味を有する。本明細書で言及される全ての特許、出願、公表出願、及び他の刊行物は、それらの全体が参照により組み込まれる。このセクションで示す定義が、参照により本明細書中に組み込まれる特許、出願、公開された出願、及び他の刊行物で示される定義と反するか、さもなければ矛盾する場合、このセクションで示す定義が参照により本明細書中に組み込まれる定義に優先する。
(実施例1:安定した慢性心不全の被験者における組換えヒトニューレグリン1の有効性及び安全性を評価する、無作為化並行群間二重盲検多施設プラセボ比較試験)
(1.緒言)
慢性心不全に対する皮下注入に関する組換えヒトニューレグリン-1の有効性及び安全性を評価するために、第II相無作為化並行群間二重盲検プラセボ比較試験が、米国の複数の臨床施設において行われた。NYHAクラスII又はIIIの安定した慢性心不全の患者合計67名が、参加した。被験者は、薬物に対し無作為化される前の1〜7日の間に、それらの植込み型除細動器(ICD)の調べを受けた。被験者は、ベースライン時の心臓コンピュータ断層撮影(CT)後、スクリーニングの終了時に、3種の治療アームの一つに無作為化された。本試験は、5つの期間からなり、これはスクリーニング及びベースライン期間(試験-21日目〜-3日目)、治療期間(試験1日目〜10日目、毎日の注入開始時間午前8時±2時間)、退院時(11日目)、経過観察期間(試験30、90及び180±5日目)、並びに365日目(±5日)までの最終経過観察来院時であり、およそ12ヶ月の期間続く。被験者は全員、試験参加期間は、それらの最新の安定した心臓レジメンを順守するように指導された。
本件出願は、以下の構成の発明を提供する。
[構成1]
哺乳動物において、心臓血管疾患又は障害を予防、治療又は遅延する方法であって、哺乳動物への0.3μg/kg/日〜3.0μg/kg/日の量のニューレグリンの皮下徐放を含み、ここで該哺乳動物へのニューレグリンの皮下徐放は、ポンプの使用により達成される、前記方法。
[構成2]
前記疾患又は障害が、心不全である、構成1記載の方法。
[構成3]
前記哺乳動物が、ヒトである、構成1載の方法。
[構成4]
前記哺乳動物へのニューレグリンの皮下徐放が、シリンジポンプの使用により達成される、構成1記載の方法。
[構成5]
前記シリンジポンプが、ミニポンプである、構成4記載の方法。
[構成6]
前記ミニポンプが、インスリンポンプである、構成5記載の方法。
[構成7]
前記ニューレグリンが、1.2μg/kg/日〜2.0μg/kg/日の量である、構成1記載の方法。
[構成8]
前記ニューレグリンが、1.2μg/kg/日の量である、構成1記載の方法。
[構成9]
前記ニューレグリンが、2.0μg/kg/日の量である、構成1記載の方法。
[構成10]
前記ニューレグリンが、6 EU/kg/日〜60 EU/kg/日の量である、構成1記載の方法。
[構成11]
前記ニューレグリンが、24 EU/kg/日〜40 EU/kg/日の量である、構成1記載の方法。
[構成12]
前記ニューレグリンが、24 EU/kg/日の量である、構成1記載の方法。
[構成13]
前記ニューレグリンが、40 EU/kg/日の量である、構成1記載の方法。
[構成14]
前記ニューレグリンが、誘導レジメンのために哺乳動物に投与される、構成1記載の方法。
[構成15]
前記誘導レジメンが、少なくとも連続する3、5、7、10又は15日のニューレグリンの投与を含む、構成14記載の方法。
[構成16]
前記誘導レジメンが、連続する10日のニューレグリンの投与を含む、構成14記載の方法。
[構成17]
前記ニューレグリンが、毎日連続して少なくとも2、4、6、8、10、12、16、20、24時間投与される、構成14記載の方法。
[構成18]
前記ニューレグリンが、毎日連続して8時間投与される、構成14記載の方法。
[構成19]
前記ニューレグリンが、誘導レジメン後、維持レジメンのために患者に投与される、構成14記載の方法。
[構成20]
前記維持レジメンが、誘導レジメン後、少なくとも3ヶ月、6ヶ月、12ヶ月、5年又はさらにそれよりも長い間のニューレグリンの投与を含む、構成19記載の方法。
[構成21]
前記維持レジメンが、3ヶ月、6ヶ月又は12ヶ月毎の誘導レジメンの反復を含む、構成19記載の方法。
[構成22]
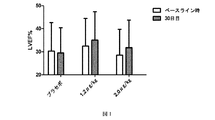
前記哺乳動物へのニューレグリンの徐放が、哺乳動物の駆出率(EF)の値を増大する、構成1記載の方法。
[構成23]
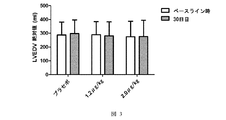
前記哺乳動物へのニューレグリンの徐放が、哺乳動物の左室拡張末期容積(LVEDV)を減少する、構成1記載の方法。
[構成24]
前記哺乳動物へのニューレグリンの徐放が、哺乳動物の左室収縮末期容積(LVESV)を減少する、構成1記載の方法。
[構成25]
前記哺乳動物へのニューレグリンの徐放が、哺乳動物の6分間歩行距離(6MWD)を改善する、構成1記載の方法。
[構成26]
前記哺乳動物へのニューレグリンの徐放が、哺乳動物の生活の質を改善する、構成1記載の方法。
[構成27]
ニューレグリン組成物又は製剤及びポンプを含む、哺乳動物における心臓血管疾患又は障害の予防、治療又は遅延のためのキット。
[構成28]
前記疾患又は障害が、心不全である、構成27記載のキット。
[構成29]
前記哺乳動物が、ヒトである、構成27記載のキット。
[構成30]
前記ポンプが、シリンジポンプである、構成27記載のキット。
[構成31]
前記ポンプが、ミニポンプである、構成27記載のキット。
[構成32]
前記ポンプが、インスリンポンプである、構成27記載のキット。
Claims (10)
- ニューレグリンを含む、ヒトにおいて心不全を治療するための医薬組成物であって、
該医薬組成物が、該ヒトへ1.2μg/kg/日の量のニューレグリンを皮下徐放するように使用され、
ここで、該ヒトへのニューレグリンの皮下徐放が、シリンジポンプ又はミニポンプの使用により達成される、前記医薬組成物。 - 前記ポンプが、シリンジポンプである、請求項1記載の医薬組成物。
- 前記ポンプが、ミニポンプである、請求項1記載の医薬組成物。
- 前記ミニポンプが、インスリンポンプである、請求項3記載の医薬組成物。
- 前記ニューレグリンが、誘導レジメンのために前記ヒトに投与される、請求項1〜4のいずれか一項記載の医薬組成物。
- 前記誘導レジメンが、
(a) 少なくとも連続する3、5、7、10又は15日間;
(b) 連続する10日間;
(c) 毎日連続して少なくとも2、4、6、8、10、12、16、20、24時間;又は
(d) 毎日連続して8時間
のニューレグリンの投与を含む、請求項5記載の医薬組成物。 - 前記ニューレグリンが、前記誘導レジメン後に、維持レジメンのために患者に投与される、請求項5記載の医薬組成物。
- 前記維持レジメンが、
(a) 前記誘導レジメン後、少なくとも3ヶ月、6ヶ月、12ヶ月、5年又はさらにそれよりも長い間のニューレグリンの投与;又は
(b) 3ヶ月、6ヶ月又は12ヶ月毎の前記誘導レジメンの反復
を含む、請求項7記載の医薬組成物。 - 前記ヒトへのニューレグリンの徐放が、
(a) 該ヒトの駆出率(EF)の値を増大する;
(b) 該ヒトの左室拡張末期容積(LVEDV)を減少する;
(c) 該ヒトの左室収縮末期容積(LVESV)を減少する;
(d) 該ヒトの6分間歩行距離(6MWD)を改善する;又は
(e) 該ヒトの生活の質を改善する、
請求項1〜8のいずれか一項記載の医薬組成物。 - 請求項1〜9のいずれか一項記載の医薬組成物、及びシリンジポンプを含む、ヒトにおいて心不全を治療するためのキット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361826433P | 2013-05-22 | 2013-05-22 | |
| US61/826,433 | 2013-05-22 | ||
| PCT/CN2014/078154 WO2014187342A1 (en) | 2013-05-22 | 2014-05-22 | Extended Release of Neuregulin for Treating Heart Failure |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019108985A Division JP2019172689A (ja) | 2013-05-22 | 2019-06-11 | 心不全を治療するためのニューレグリンの徐放 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016520089A JP2016520089A (ja) | 2016-07-11 |
| JP2016520089A5 JP2016520089A5 (ja) | 2017-06-29 |
| JP6568052B2 true JP6568052B2 (ja) | 2019-09-04 |
Family
ID=51932900
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016514266A Active JP6568052B2 (ja) | 2013-05-22 | 2014-05-22 | 心不全を治療するためのニューレグリンの徐放 |
| JP2019108985A Pending JP2019172689A (ja) | 2013-05-22 | 2019-06-11 | 心不全を治療するためのニューレグリンの徐放 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019108985A Pending JP2019172689A (ja) | 2013-05-22 | 2019-06-11 | 心不全を治療するためのニューレグリンの徐放 |
Country Status (11)
| Country | Link |
|---|---|
| US (3) | US10098834B2 (ja) |
| EP (3) | EP3610905B1 (ja) |
| JP (2) | JP6568052B2 (ja) |
| KR (3) | KR102578135B1 (ja) |
| CN (2) | CN105611955A (ja) |
| AU (2) | AU2014270882B2 (ja) |
| BR (1) | BR112015029293A2 (ja) |
| CA (1) | CA2911848A1 (ja) |
| ES (1) | ES2743617T3 (ja) |
| RU (1) | RU2015154737A (ja) |
| WO (1) | WO2014187342A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1981525B1 (en) | 2005-12-30 | 2015-01-21 | Zensun (Shanghai) Science and Technology Limited | Extended release of neuregulin for improved cardiac function |
| JP6096262B2 (ja) | 2009-08-25 | 2017-03-15 | ゼンサン (シャンハイ) サイエンス アンド テクノロジー,シーオー.,エルティーディー. | ニューレグリンに基づく心不全の治療方法 |
| CN102139095A (zh) | 2010-01-29 | 2011-08-03 | 上海泽生科技开发有限公司 | 神经调节蛋白用于预防、治疗或延迟心脏缺血再灌注损伤的方法和组合物 |
| WO2013053076A1 (en) | 2011-10-10 | 2013-04-18 | Zensun (Shanghai)Science & Technology Limited | Compositions and methods for treating heart failure |
| CN104884077B (zh) | 2012-10-08 | 2019-02-12 | 上海泽生科技开发股份有限公司 | 治疗糖尿病患者心力衰竭的组份和方法 |
| BR112015029293A2 (pt) | 2013-05-22 | 2018-04-24 | Zensun Shanghai Science & Tech Ltd | método e kit para prevenir, tratar ou retardar uma doença ou distúrbio cardiovascular em um mamífero |
| CN110946993A (zh) | 2014-01-03 | 2020-04-03 | 上海泽生科技开发股份有限公司 | 纽兰格林制剂的配方 |
| CN105497876B (zh) | 2014-09-24 | 2021-01-15 | 上海泽生科技开发股份有限公司 | 神经调节蛋白用于预防、治疗或延迟心脏室性心律失常的方法和组合物 |
| CN105561298A (zh) | 2014-10-17 | 2016-05-11 | 上海泽生科技开发有限公司 | 神经调节蛋白用于预防、治疗或延迟射血分数保留的心力衰竭的方法和组合物 |
| CN111407881A (zh) * | 2019-01-07 | 2020-07-14 | 上海泽生科技开发股份有限公司 | 神经调节蛋白用于预防、治疗或延迟心肌损伤的方法和组合物 |
| AR121035A1 (es) | 2019-04-01 | 2022-04-13 | Lilly Co Eli | Compuestos de neuregulina-4 y métodos de uso |
| CA3177693A1 (en) | 2019-04-05 | 2020-10-05 | Eli Lilly And Company | Therapeutic uses of dulaglutide |
| CN111840517A (zh) * | 2019-04-28 | 2020-10-30 | 上海泽生科技开发股份有限公司 | 神经调节蛋白用于长效预防、治疗或延迟心脏损伤的方法 |
Family Cites Families (89)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4263428A (en) | 1978-03-24 | 1981-04-21 | The Regents Of The University Of California | Bis-anthracycline nucleic acid function inhibitors and improved method for administering the same |
| ATE12348T1 (de) | 1980-11-10 | 1985-04-15 | Gersonde Klaus Prof Dr | Verfahren zur herstellung von lipid-vesikeln durch ultraschallbehandlung, anwendung des verfahrens und vorrichtung zur durchfuehrung des verfahrens. |
| IE52535B1 (en) | 1981-02-16 | 1987-12-09 | Ici Plc | Continuous release pharmaceutical compositions |
| EP0088046B1 (de) | 1982-02-17 | 1987-12-09 | Ciba-Geigy Ag | Lipide in wässriger Phase |
| DE3218121A1 (de) | 1982-05-14 | 1983-11-17 | Leskovar, Peter, Dr.-Ing., 8000 München | Arzneimittel zur tumorbehandlung |
| EP0102324A3 (de) | 1982-07-29 | 1984-11-07 | Ciba-Geigy Ag | Lipide und Tenside in wässriger Phase |
| JPS607934A (ja) | 1983-06-29 | 1985-01-16 | Dai Ichi Seiyaku Co Ltd | リポソ−ムの製造方法 |
| HUT35524A (en) | 1983-08-02 | 1985-07-29 | Hoechst Ag | Process for preparing pharmaceutical compositions containing regulatory /regulative/ peptides providing for the retarded release of the active substance |
| DE3486459D1 (de) | 1983-09-26 | 1997-12-11 | Udo Dr Med Ehrenfeld | Mittel und Erzeugnis für die Diagnose und Therapie von Tumoren sowie zur Behandlung von Schwächen der zelligen und humoralen Immunabwehr |
| DE3474511D1 (en) | 1983-11-01 | 1988-11-17 | Terumo Corp | Pharmaceutical composition containing urokinase |
| WO1989001489A1 (en) | 1987-08-10 | 1989-02-23 | Commonwealth Scientific And Industrial Research Or | Control of angiogenesis and compositions and methods therefor |
| SE463851B (sv) | 1988-09-02 | 1991-02-04 | Amsu Ltd | Komposition foer behandling av erektil dysfunktion via uretra |
| US7115554B1 (en) | 1993-05-06 | 2006-10-03 | Acorda Therapeutics, Inc. | Methods of increasing myotube formation or survival or muscle cell mitogenesis differentiation or survival using neuregulin GGF III |
| US5530109A (en) | 1991-04-10 | 1996-06-25 | Ludwig Institute For Cancer Research | DNA encoding glial mitogenic factors |
| GB9107566D0 (en) | 1991-04-10 | 1991-05-29 | Ludwig Inst Cancer Res | Glial mitogenic factors,their preparation and use |
| US5716930A (en) | 1991-04-10 | 1998-02-10 | Ludwig Institute For Cancer Research | Glial growth factors |
| US5834229A (en) | 1991-05-24 | 1998-11-10 | Genentech, Inc. | Nucleic acids vectors and host cells encoding and expressing heregulin 2-α |
| US6087323A (en) | 1992-04-03 | 2000-07-11 | Cambridge Neuroscience, Inc. | Use of neuregulins as modulators of cellular communication |
| DE4221256C2 (de) | 1992-06-26 | 1997-07-10 | Lancaster Group Ag | Galenische Zusammensetzung für die topische Anwendung |
| CA2126619A1 (en) | 1993-06-24 | 1994-12-25 | Yasutaka Igari | Sustained-release preparation of anti-endothelin substance |
| US6750196B1 (en) | 1995-03-27 | 2004-06-15 | Acorda Therapeutics | Methods of treating disorders of the eye |
| US5741511A (en) | 1995-04-12 | 1998-04-21 | Sam Yang Co., Ltd. | Transdermal drug delivery device for treating erectile dysfunction |
| US5912326A (en) | 1995-09-08 | 1999-06-15 | President And Fellows Of Harvard College | Cerebellum-derived growth factors |
| JP2000502682A (ja) | 1995-12-22 | 2000-03-07 | ローカルメッド インコーポレイテッド | 血管新生を促進する成長因子の局所的血管内デリバリー |
| US5736154A (en) | 1996-03-11 | 1998-04-07 | Fuisz Technologies Ltd. | Transdermal delivery system |
| ATE427353T1 (de) | 1997-02-10 | 2009-04-15 | Genentech Inc | Heregulin varianten |
| SE9703226D0 (sv) | 1997-09-08 | 1997-09-08 | Astra Ab | New pharmaceutical composition |
| WO1999018976A1 (en) | 1997-10-14 | 1999-04-22 | Cambridge Neuroscience, Inc. | Therapeutic methods comprising use of a neuregulin |
| US6197801B1 (en) | 1998-01-14 | 2001-03-06 | Usa Doctors Products, Inc. | Injectable pharmaceutical composition for treatment and reversal of erectile dysfunction |
| AUPP785098A0 (en) | 1998-12-21 | 1999-01-21 | Victor Chang Cardiac Research Institute, The | Treatment of heart disease |
| US6635249B1 (en) | 1999-04-23 | 2003-10-21 | Cenes Pharmaceuticals, Inc. | Methods for treating congestive heart failure |
| CN1138785C (zh) | 1999-06-04 | 2004-02-18 | 周明东 | 生长因子神经调节蛋白及其类似物的新应用 |
| AUPQ105799A0 (en) | 1999-06-18 | 1999-07-08 | Victor Chang Cardiac Research Institute, The | Cell growth inhibition |
| CA2400595A1 (en) | 2000-02-28 | 2001-09-07 | Decode Genetics Ehf | Human schizophrenia gene |
| US20010041869A1 (en) | 2000-03-23 | 2001-11-15 | Causey James D. | Control tabs for infusion devices and methods of using the same |
| US20050277887A1 (en) * | 2000-05-08 | 2005-12-15 | Joel Douglas | Micro infusion drug delivery device |
| ES2610353T3 (es) | 2000-05-23 | 2017-04-27 | Cenes Pharmaceuticals, Inc. | Moléculas de ácido nucleico NRG-2, polipéptidos y métodos diagnósticos y terapéuticos |
| US6589229B1 (en) | 2000-07-31 | 2003-07-08 | Becton, Dickinson And Company | Wearable, self-contained drug infusion device |
| WO2002024889A2 (en) | 2000-09-12 | 2002-03-28 | The Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services | Optimized cardiac contraction through differential phosphorylation of myosin |
| US6482624B2 (en) | 2000-11-14 | 2002-11-19 | Pe Corporation (Ny) | Isolated human kinase proteins, nucleic acid molecules encoding human kinase proteins, and uses thereof |
| AU2002222471A1 (en) | 2000-12-11 | 2002-06-24 | Yeda Research And Development Co..Ltd. | Inhibitory agents derived from specific growth factors |
| RU2180843C1 (ru) | 2001-02-19 | 2002-03-27 | Новокузнецкий государственный институт усовершенствования врачей | Способ профилактики повторного инфаркта миокарда |
| EP1390385A4 (en) * | 2001-05-29 | 2004-11-24 | Sirna Therapeutics Inc | MODULATION OF DISEASES AND DISEASES OF THE FEMALE REPRODUCTION SYSTEM BASED ON NUCLEIC ACID |
| WO2003035095A1 (en) | 2001-10-19 | 2003-05-01 | Maxim Pharmaceuticals, Inc. | Use of histamine to treat liver disease |
| AU2002304965A1 (en) | 2002-05-24 | 2003-12-12 | Zensun (Shanghai) Sci-Tech.Ltd | Neuregulin based methods and compositions for treating viral myocarditis and dilated cardiomyopathy |
| CN1498656A (zh) | 2002-11-08 | 2004-05-26 | 上海泽生科技开发有限公司 | 神经调节蛋白用于心肌梗死治疗的方法和组合物 |
| US7128727B2 (en) | 2002-09-30 | 2006-10-31 | Flaherty J Christopher | Components and methods for patient infusion device |
| US7144384B2 (en) | 2002-09-30 | 2006-12-05 | Insulet Corporation | Dispenser components and methods for patient infusion device |
| JP2006517092A (ja) | 2002-11-27 | 2006-07-20 | アルテシアン セラピューティック,インコーポレイティド | 心不全遺伝子の決定及び治療薬スクリーニング |
| JP2007505158A (ja) | 2003-05-21 | 2007-03-08 | ボード オブ リージェンツ ザ ユニバーシティー オブ テキサス システム | 心肥大および心不全の処置としてのプロテインキナーゼC−μ(PKD)の阻害 |
| US20050065760A1 (en) | 2003-09-23 | 2005-03-24 | Robert Murtfeldt | Method for advising patients concerning doses of insulin |
| CN1715926B (zh) | 2004-07-02 | 2011-08-17 | 上海泽生科技开发有限公司 | 神经调节蛋白突变体的应用 |
| CN1743006A (zh) | 2004-09-02 | 2006-03-08 | 上海泽生科技开发有限公司 | Mapk抑制剂的新用途及组合物 |
| CN1743005A (zh) | 2004-09-02 | 2006-03-08 | 上海泽生科技开发有限公司 | Pi3-k抑制剂的新用途及组合物 |
| US20080213395A1 (en) | 2004-10-14 | 2008-09-04 | Adventures Plus Pty Ltd | Method for the Treatment of Gastrointestinal and Other Disorders with an Admixture of Vitamins |
| US20060160062A1 (en) | 2005-01-14 | 2006-07-20 | Young Lindon H | Perfusion and/or preservation solution for organs |
| US20070141548A1 (en) | 2005-03-11 | 2007-06-21 | Jorg Kohl | Organ transplant solutions and method for transplanting organs |
| US7641649B2 (en) | 2005-05-06 | 2010-01-05 | Medtronic Minimed, Inc. | Reservoir support and method for infusion device |
| CN100361709C (zh) | 2005-08-30 | 2008-01-16 | 山东省生物药物研究院 | 一种对生命活性物质有保护作用的糖类组合 |
| CN1768859A (zh) | 2005-10-24 | 2006-05-10 | 天津大学 | 基于醛基的微粒表面多重生物功能因子组装方法 |
| US20070213264A1 (en) | 2005-12-02 | 2007-09-13 | Mingdong Zhou | Neuregulin variants and methods of screening and using thereof |
| CN101394861A (zh) | 2005-12-30 | 2009-03-25 | 上海泽生科技开发有限公司 | 纽兰格林持续给药能改善心脏功能 |
| EP1981525B1 (en) | 2005-12-30 | 2015-01-21 | Zensun (Shanghai) Science and Technology Limited | Extended release of neuregulin for improved cardiac function |
| US9580515B2 (en) | 2006-08-21 | 2017-02-28 | Zensun (Shanghai) Science & Technology, Co., Ltd. | Neukinase, a downstream protein of neuregulin |
| CN101310766B (zh) | 2007-05-25 | 2014-04-16 | 上海泽生科技开发有限公司 | 神经调节蛋白的新用途 |
| CN101310779A (zh) * | 2007-05-25 | 2008-11-26 | 上海泽生科技开发有限公司 | 包含神经调节蛋白的装置及药物制剂 |
| US20090156488A1 (en) | 2007-09-12 | 2009-06-18 | Zensun (Shanghai) Science & Technology Limited | Use of neuregulin for organ preservation |
| EP2320933B1 (en) | 2008-07-17 | 2017-12-27 | Acorda Therapeutics, Inc. | Therapeutic dosing of a neuregulin or a subsequence thereof for treatment or prophylaxis of heart failure |
| CN102231987A (zh) | 2008-11-28 | 2011-11-02 | 上海泽生科技开发有限公司 | 纽兰格林和心脏干细胞 |
| CN102232084B (zh) * | 2008-11-28 | 2014-05-28 | 上海泽生科技开发有限公司 | 纽兰格林及其用途 |
| ES2748886T3 (es) | 2009-06-09 | 2020-03-18 | Zensun Shanghai Science & Tech Co Ltd | Métodos basados en Neuregulina para el tratamiento de la insuficiencia cardíaca |
| WO2010142141A1 (en) * | 2009-06-09 | 2010-12-16 | Zensun (Shanghai) Science & Technology Limited | Neuregulin based methods for treating heart failure |
| JP6096262B2 (ja) | 2009-08-25 | 2017-03-15 | ゼンサン (シャンハイ) サイエンス アンド テクノロジー,シーオー.,エルティーディー. | ニューレグリンに基づく心不全の治療方法 |
| CN102139095A (zh) | 2010-01-29 | 2011-08-03 | 上海泽生科技开发有限公司 | 神经调节蛋白用于预防、治疗或延迟心脏缺血再灌注损伤的方法和组合物 |
| CA2792616A1 (en) | 2010-03-10 | 2011-09-15 | Cempra Pharmaceuticals, Inc. | Parenteral formulations of macrolide antibiotics |
| WO2011112791A1 (en) * | 2010-03-10 | 2011-09-15 | Corthera, Inc | Modulating aquaporins with relaxin |
| EP2555788B1 (en) | 2010-03-24 | 2017-10-11 | Massachusetts Institute of Technology | NEUREGULIN DIMER FOR AN ErbB/HER RECEPTOR FOR USE IN REDUCING CARDIOTOXICITY. |
| CN103327986B (zh) | 2010-07-22 | 2018-05-25 | 雷文制药有限公司 | 包含使用磁偶极子稳定化溶液的治疗或改善疾病并增强表现的方法 |
| WO2013053076A1 (en) | 2011-10-10 | 2013-04-18 | Zensun (Shanghai)Science & Technology Limited | Compositions and methods for treating heart failure |
| CA2868398A1 (en) | 2012-04-02 | 2013-10-10 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of cosmetic proteins and peptides |
| CN104884077B (zh) | 2012-10-08 | 2019-02-12 | 上海泽生科技开发股份有限公司 | 治疗糖尿病患者心力衰竭的组份和方法 |
| JP6542678B2 (ja) | 2013-03-06 | 2019-07-10 | アコーダ セラピューティクス インコーポレイテッド | 心不全の治療または予防のためのニューレグリンまたはその断片の治療的投与の方法 |
| BR112015029293A2 (pt) | 2013-05-22 | 2018-04-24 | Zensun Shanghai Science & Tech Ltd | método e kit para prevenir, tratar ou retardar uma doença ou distúrbio cardiovascular em um mamífero |
| CN110840895A (zh) | 2013-07-23 | 2020-02-28 | 上海泽生科技开发股份有限公司 | 使用维生素b组合物促进胃肠系统动力的方法 |
| CN104758300A (zh) | 2014-01-02 | 2015-07-08 | 上海泽生科技开发有限公司 | 维生素d及其组合物的抗菌用途 |
| CN110946993A (zh) | 2014-01-03 | 2020-04-03 | 上海泽生科技开发股份有限公司 | 纽兰格林制剂的配方 |
| CN105497876B (zh) | 2014-09-24 | 2021-01-15 | 上海泽生科技开发股份有限公司 | 神经调节蛋白用于预防、治疗或延迟心脏室性心律失常的方法和组合物 |
| CN105561298A (zh) | 2014-10-17 | 2016-05-11 | 上海泽生科技开发有限公司 | 神经调节蛋白用于预防、治疗或延迟射血分数保留的心力衰竭的方法和组合物 |
| AT521173B1 (de) | 2018-06-27 | 2019-11-15 | Trumpf Maschinen Austria Gmbh & Co Kg | Biegewerkzeug mit Distanzelement |
-
2014
- 2014-05-22 BR BR112015029293A patent/BR112015029293A2/pt not_active Application Discontinuation
- 2014-05-22 AU AU2014270882A patent/AU2014270882B2/en active Active
- 2014-05-22 EP EP19186339.8A patent/EP3610905B1/en active Active
- 2014-05-22 EP EP21165529.5A patent/EP3895724A1/en active Pending
- 2014-05-22 KR KR1020227002787A patent/KR102578135B1/ko active Application Filing
- 2014-05-22 RU RU2015154737A patent/RU2015154737A/ru not_active Application Discontinuation
- 2014-05-22 CA CA2911848A patent/CA2911848A1/en not_active Abandoned
- 2014-05-22 CN CN201480038610.9A patent/CN105611955A/zh active Pending
- 2014-05-22 JP JP2016514266A patent/JP6568052B2/ja active Active
- 2014-05-22 US US14/892,183 patent/US10098834B2/en active Active
- 2014-05-22 CN CN202011061572.2A patent/CN112168953A/zh active Pending
- 2014-05-22 WO PCT/CN2014/078154 patent/WO2014187342A1/en active Application Filing
- 2014-05-22 EP EP14800519.2A patent/EP2999499B1/en active Active
- 2014-05-22 KR KR1020157033291A patent/KR102357275B1/ko active IP Right Grant
- 2014-05-22 KR KR1020237030815A patent/KR20230132635A/ko not_active Application Discontinuation
- 2014-05-22 ES ES14800519T patent/ES2743617T3/es active Active
-
2018
- 2018-09-10 US US16/126,852 patent/US11179323B2/en active Active
-
2019
- 2019-05-30 AU AU2019203799A patent/AU2019203799B2/en active Active
- 2019-06-11 JP JP2019108985A patent/JP2019172689A/ja active Pending
-
2021
- 2021-10-25 US US17/510,271 patent/US20220211613A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP2999499A1 (en) | 2016-03-30 |
| KR20220018076A (ko) | 2022-02-14 |
| KR102357275B1 (ko) | 2022-02-03 |
| US20220211613A1 (en) | 2022-07-07 |
| EP3895724A1 (en) | 2021-10-20 |
| ES2743617T3 (es) | 2020-02-20 |
| WO2014187342A1 (en) | 2014-11-27 |
| KR20230132635A (ko) | 2023-09-15 |
| US11179323B2 (en) | 2021-11-23 |
| JP2019172689A (ja) | 2019-10-10 |
| KR20160009575A (ko) | 2016-01-26 |
| EP3610905B1 (en) | 2021-03-31 |
| AU2014270882A1 (en) | 2015-11-26 |
| US10098834B2 (en) | 2018-10-16 |
| EP2999499B1 (en) | 2019-07-17 |
| CA2911848A1 (en) | 2014-11-27 |
| AU2019203799A1 (en) | 2019-06-20 |
| AU2014270882B2 (en) | 2019-03-14 |
| BR112015029293A2 (pt) | 2018-04-24 |
| RU2015154737A3 (ja) | 2018-04-26 |
| RU2015154737A (ru) | 2017-06-27 |
| CN105611955A (zh) | 2016-05-25 |
| AU2019203799B2 (en) | 2021-05-20 |
| JP2016520089A (ja) | 2016-07-11 |
| US20160089329A1 (en) | 2016-03-31 |
| CN112168953A (zh) | 2021-01-05 |
| EP3610905A1 (en) | 2020-02-19 |
| KR102578135B1 (ko) | 2023-09-13 |
| EP2999499A4 (en) | 2017-01-18 |
| US20190240145A1 (en) | 2019-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6568052B2 (ja) | 心不全を治療するためのニューレグリンの徐放 | |
| JP7209382B2 (ja) | 心不全の治療用組成物 | |
| JP6266146B2 (ja) | ニューレグリンに基づく心不全の治療方法 | |
| JP6475623B2 (ja) | 糖尿病患者における心不全の治療用組成物 | |
| JP2013503110A (ja) | ニューレグリンに基づく心不全の治療方法 | |
| Gatto et al. | Current perspectives on the impact of clinical disease and biochemical control on comorbidities and quality of life in acromegaly | |
| JP2017125032A (ja) | 糖尿病患者における心不全の治療用組成物 | |
| JP2019112442A (ja) | 糖尿病患者における心不全の治療用組成物および治療法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160201 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170519 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170519 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180216 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180313 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180608 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180912 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20190212 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190611 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20190620 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190709 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190801 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6568052 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |