JP6504530B2 - 光学活性な2−(2−フルオロビフェニル−4−イル)プロパン酸の製造法 - Google Patents
光学活性な2−(2−フルオロビフェニル−4−イル)プロパン酸の製造法 Download PDFInfo
- Publication number
- JP6504530B2 JP6504530B2 JP2017543596A JP2017543596A JP6504530B2 JP 6504530 B2 JP6504530 B2 JP 6504530B2 JP 2017543596 A JP2017543596 A JP 2017543596A JP 2017543596 A JP2017543596 A JP 2017543596A JP 6504530 B2 JP6504530 B2 JP 6504530B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- formula
- compound represented
- mol
- nickel
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 *[C@]1N=C(C(*)(*)C2=N[C@@](*)CO2)OC1 Chemical compound *[C@]1N=C(C(*)(*)C2=N[C@@](*)CO2)OC1 0.000 description 5
- PXYFQHHKPOSAHF-JTQLQIEISA-N CCC(OC1)=N[C@@H]1c1ccccc1 Chemical compound CCC(OC1)=N[C@@H]1c1ccccc1 PXYFQHHKPOSAHF-JTQLQIEISA-N 0.000 description 2
- CVAWKJKISIPBOD-UHFFFAOYSA-N CC(C(OC(C)(C)C)=O)Br Chemical compound CC(C(OC(C)(C)C)=O)Br CVAWKJKISIPBOD-UHFFFAOYSA-N 0.000 description 1
- JPOAUYHZGGGXHU-ZDUSSCGKSA-N C[C@H](C(OC(C)(C)C)=O)c1ccc(-c2ccccc2)c(F)c1 Chemical compound C[C@H](C(OC(C)(C)C)=O)c1ccc(-c2ccccc2)c(F)c1 JPOAUYHZGGGXHU-ZDUSSCGKSA-N 0.000 description 1
- HTRNHWBOBYFTQF-UHFFFAOYSA-N Fc1cc(Br)ccc1-c1ccccc1 Chemical compound Fc1cc(Br)ccc1-c1ccccc1 HTRNHWBOBYFTQF-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/09—Preparation of carboxylic acids or their salts, halides or anhydrides from carboxylic acid esters or lactones
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J27/00—Catalysts comprising the elements or compounds of halogens, sulfur, selenium, tellurium, phosphorus or nitrogen; Catalysts comprising carbon compounds
- B01J27/06—Halogens; Compounds thereof
- B01J27/08—Halides
- B01J27/10—Chlorides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/02—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides
- B01J31/0234—Nitrogen-, phosphorus-, arsenic- or antimony-containing compounds
- B01J31/0235—Nitrogen containing compounds
- B01J31/0244—Nitrogen containing compounds with nitrogen contained as ring member in aromatic compounds or moieties, e.g. pyridine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C57/00—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms
- C07C57/52—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms containing halogen
- C07C57/58—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms containing halogen containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C67/00—Preparation of carboxylic acid esters
- C07C67/30—Preparation of carboxylic acid esters by modifying the acid moiety of the ester, such modification not being an introduction of an ester group
- C07C67/333—Preparation of carboxylic acid esters by modifying the acid moiety of the ester, such modification not being an introduction of an ester group by isomerisation; by change of size of the carbon skeleton
- C07C67/343—Preparation of carboxylic acid esters by modifying the acid moiety of the ester, such modification not being an introduction of an ester group by isomerisation; by change of size of the carbon skeleton by increase in the number of carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B53/00—Asymmetric syntheses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B61/00—Other general methods
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Catalysts (AREA)
Description
(1)光学活性な2−(2−フルオロビフェニル−4−イル)プロパン酸又はその製薬学的に許容される塩の製造法において、下記(a)〜(c)工程を含むことを特徴とする製造法:
(a)式[1]で表される化合物をマグネシウムと反応させることを含む、有機金属試薬を調製する工程、
X1はハロゲン原子を表し、
X2はハロゲン原子を表し、
R1はtert−ブチルジフェニルシリル、C1-6アルキル、C2-6アルケニル、C3-8シクロアルキル、フェニル、又は置換基群A1から選ばれる1から2個の基で置換されてもよいベンジルを表し、
R2及びR3は独立してC1-6アルキルを表し、
またはR2、R3、及び該置換基に隣接する炭素原子は一緒になってC3-6シクロアルカンを形成してもよく、
R4及びR5は独立してC1-6アルキル、ベンジル、フェネチル、又は置換基群A2から選ばれる1から2個の基で置換されてもよいフェニルを表し、
ここで、置換基群A1は、C1-6アルキル及びフェニルからなる群を表し、
置換基群A2は、ハロゲン原子、C1-6アルキル、ハロC1-6アルキル、C1-6アルコキシ、ハロC1-6アルコキシ、及びフェニルからなる群
を表す。
(2)工程(a)において、式[1]で表される化合物をマグネシウムと反応させた後、さらに塩化亜鉛又は臭化亜鉛を反応させて、有機金属試薬を調製する、(1)に記載の製造法。
(3)工程(b)における式[2]で表される化合物について、R1がC1-6アルキルである、(1)又は(2)に記載の製造法。
(4)工程(b)における式[2]で表される化合物について、R1がtert−ブチルである、(3)に記載の製造法。
(5)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.03から1.00mol%であり、使用する式[3]で表される光学活性な化合物の触媒量が0.036から1.20mol%である、(2)〜(4)のいずれかに記載の製造法。
(6)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.50から1.00mol%であり、使用する式[3]で表される光学活性な化合物の触媒量が0.60から1.20mol%である(1)、(3)又は(4)に記載の製造法。
(7)工程(b)において、反応温度が0から25℃である、(2)〜(5)のいずれかに記載の製造法。
(8)工程(b)において、反応温度が−20から0℃である(1)、(3)、(4)又は(6)に記載の製造法。
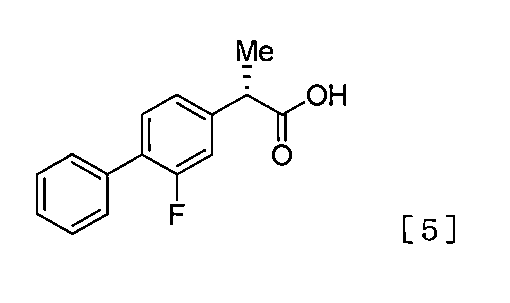
(9)工程(c)において、式[4]で表される化合物を式[5]で表される化合物に変換する工程が酸性条件下における変換である、(1)〜(8)のいずれかに記載の製造法。
(10)工程(b)における式[3]で表される光学活性な化合物について、
R2及びR3がともにメチルであり、
R4及びR5がともにフェニルである、(1)〜(9)のいずれかに記載の製造法、
(11)工程(a)において、式[1]で表される化合物とマグネシウムと反応させて調製した有機マグネシウム試薬と、さらに反応させる塩化亜鉛又は臭化亜鉛のモル比が、2:1から3:1である、(2)〜(5)、〈7〉〜(9)のいずれかに記載の製造法。
(12)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.10mol%以下であり、使用する式[3]で表される光学活性な化合物の触媒量が0.12mol%以下である、(2)に記載の製造法。
(13)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が1.00mol%以下であり、使用する式[3]で表される光学活性な化合物の触媒量が1.20mol%以下である、(1)に記載の製造法。
(14)工程(c)について、酸性条件下において、式[5]で表される化合物への変換に使用する酸が、塩酸、硫酸、ギ酸、トリフルオロ酢酸、メタンスルホン酸、及びp−トルエンスルホン酸からなる群から選ばれる酸である、(9)に記載の製造法。
(15)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が1.00mol%以下であり、使用する式[3]で表される光学活性な化合物の触媒量が1.20mol%以下である、(2)に記載の製造法。
(16)工程(b)において、反応温度が0℃以上である、(15)に記載の製造法。
(17)光学活性な2−(2−フルオロビフェニル−4−イル)プロパン酸の製造法であって、
(a)式[1]で表される化合物をマグネシウムと反応させ、場合によってはさらに塩化亜鉛又は臭化亜鉛を反応させて、有機金属試薬を調製する工程、
ここで、
上記式[1]から[5]において、
X1はハロゲン原子を表し、
X2はハロゲン原子を表し、
R1はtert−ブチルジフェニルシリル、C1-6アルキル、C2-6アルケニル、C3-8シクロアルキル、フェニル、又は置換基群A1から選ばれる1から2個の基で置換されてもよいベンジルを表し、
R2及びR3は独立してC1-6アルキルを表し、
またはR2、R3、及び該置換基に隣接する炭素原子は一緒になってC3-6シクロアルカンを形成してもよく、
R4及びR5は独立してC1-6アルキル、ベンジル、フェネチル、又は置換基群A2から選ばれる1から2個の基で置換されてもよいフェニルを表し、
ここで、置換基群A1は、C1-6アルキル及びフェニルからなる群を表し、
置換基群A2は、ハロゲン原子、C1-6アルキル、ハロC1-6アルキル、C1-6アルコキシ、ハロC1-6アルコキシ、及びフェニルからなる群
を表す、
(18)工程(a)において、式[1]で表される化合物をマグネシウムと反応させた後、さらに塩化亜鉛又は臭化亜鉛を反応させる、(17)に記載の製造法、
(19)工程(a)において、式[1]で表される化合物をマグネシウムと反応させた後、塩化亜鉛又は臭化亜鉛を反応させない、(17)に記載の製造法、
(20)工程(b)における式[2]で表される化合物について、R1がC1-6アルキルである、(17)に記載の製造法、
(21)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が1.00mol%以下であり、使用する式[3]で表される光学活性な化合物の触媒量が1.20mol%以下である、(17)に記載の製造法、
(22)工程(b)において、反応温度が0℃以上である、(21)に記載の製造法、
(23)工程(c)において、式[4]で表される化合物を式[5]で表される化合物に変換する工程が酸性条件下における変換である、(17)に記載の製造法、
(24)工程(b)における式[3]で表される光学活性な化合物について、
R2及びR3がともにメチルであり、
R4及びR5がともにフェニルである、(17)に記載の製造法、
(25)工程(b)における式[2]で表される化合物について、
R1がtert−ブチルである、(20)に記載の製造法、
(26)工程(a)において、式[1]で表される化合物とマグネシウムと反応させて調製した有機マグネシウム試薬と、さらに反応させる塩化亜鉛又は臭化亜鉛のモル比が、2:1から3:1である、(18)に記載の製造法、
(27)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.10mol%以下であり、使用する式[3]で表される光学活性な化合物の触媒量が0.12mol%以下である、(18)に記載の製造法、
(28)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.03から0.10mol%であり、使用する式[3]で表される光学活性な化合物の触媒量が0.036から0.12mol%である、(27)に記載の製造法、
(29)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が1.00mol%以下であり、使用する式[3]で表される光学活性な化合物の触媒量が1.20mol%以下である、(19)に記載の製造法、
(30)工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.50から1.00mol%であり、使用する式[3]で表される光学活性な化合物の触媒量が0.60から1.20mol%以下である、(29)に記載の製造法、
(31)工程(b)において、反応温度が0から25℃である、(22)に記載の製造法、
(32)工程(c)について、酸性条件下において、式[5]で表される化合物への変換に使用する酸が、塩酸、硫酸、ギ酸、トリフルオロ酢酸、メタンスルホン酸、及びp−トルエンスルホン酸からなる群から選ばれる酸である、(23)に記載の製造法。
X1が臭素原子であり、
X2が塩素原子又は臭素原子であり、
R1がtert−ブチルであり、
R2及びR3がともにメチルであり、
R4及びR5がともにフェニルである場合である。
X1が臭素原子であり、
X2が臭素原子であり、
R1がtert−ブチルジフェニルシリル、tert−ブチル、ネオペンチル、tert−アミル、シクロへキシル、1−メチル−1−フェニルエチル、又はベンズヒドリルであり、
R2及びR3がともにメチル又はエチルであり、
または、R2、R3、及び該置換基に隣接する炭素原子が一緒になって形成するC3-6シクロアルカンがシクロプロパンであり、
R4及びR5がともにフェニルであり、
亜鉛化合物が臭化亜鉛である場合である。
R2及びR3がともにメチルである場合である。
R1がtert-ブチルである場合である。
X1が臭素原子であり、
X2が臭素原子であり、
R1がtert−ブチル、tert−アミル、1−メチル−1−フェニルエチル、又はベンズヒドリルであり、
R2及びR3がともにメチル又はエチルであり、
または、R2、R3、及び該置換基に隣接する炭素原子が一緒になって形成するC3-6シクロアルカンがシクロプロパンであり、
R4及びR5がともにフェニルであり、
亜鉛化合物が臭化亜鉛である場合である。
R2及びR3がともにメチルである場合である。
R1がtert-ブチルである場合である。
R1がtert-ブチルである場合である。
1.工程(a)、有機マグネシウム試薬[6]の調製法
2.工程(b)、有機マグネシウム試薬[6]から式[4]で表される化合物の製造法
3.工程(a)、有機亜鉛試薬[7]の調製法
4.工程(b)、有機亜鉛試薬[7]から式[4]で表される化合物の製造法
5.工程(c)、式[5]で表される化合物の製造法
s : シングレット(singlet)
d : ダブレット(doublet)
t : トリプレット(triplet)
q : クァルテット(quartet)
m : マルチプレット(multiplet)
J : カップリング定数(coupling constant)
Hz : ヘルツ(Hertz)
CHLOROFORM−d、CDCl3 : 重クロロホルム
NMR:核磁気共鳴
MS:マススペクトル
ee:鏡像体過剰率
HPLC:高速液体クロマトグラフィー
Et:エチル
Me:メチル
Ph:フェニル
MsOH:メシル酸、メタンスルホン酸
TsOH:トシル酸、p−トルエンスルホン酸
TFA:トリフルオロ酢酸
acac:アセチルアセトナト
PPh3:トリフェニルホスフィン
TBDPS:tert−ブチルジフェニルシリル
THF:テトラヒドロフラン
DME:1,2−ジメトキシエタン
MgSO4:無水硫酸マグネシウム
rt:室温
(S) −2−(2−フルオロビフェニル−4−イル)プロパン酸tert−ブチルエステルの製造法
化学収率:84%
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.43 (s, 9 H), 1.48 (d, J=7.0 Hz, 3 H), 3.64 (q, J=7.0 Hz, 1 H), 7.08 - 7.16 (m, 2 H), 7.33 - 7.40 (m, 2 H), 7.43 (t, J=7.6 Hz, 2 H), 7.54 (d, J=8.3 Hz, 2 H).
MS(ESI/APCI Dual pos.)m/z: 323[M+Na]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:R体=4.19分、S体=4.60分
光学純度:93%ee(S)
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.52 (d, J=7.0 Hz, 3 H), 3.75 (q, J=7.0 Hz, 1 H), 7.08 - 7.16 (m, 2 H), 7.29 - 7.43 (m, 4 H), 7.45 - 7.51 (m, 2 H).
MS(ESI/APCI Dual neg.)m/z: 243[M-H]-
[α]20 D = +44.9±0.05(c=1.01、EtOH)
カラム名:DAICEL CHIRALPAK AY−H/SFC(4.6mmΦ x 250mmL)
溶離液:メタノール:二酸化炭素=10:90
流速:3.0mL/分
カラム温度:40℃
保持時間:R体=2.37分、S体=3.13分
光学純度:97%ee(S)
2−ブロモプロピオン酸tert−ブチルエステル(641mg、3.07mmol)、塩化ニッケル(II)・DME錯体(0.031mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1.0mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.037mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1.2mol%)を用い、金属マグネシウム片(116mg、4.78mmol)の代わりに金属マグネシウム片(101mg、4.14mmol)を用いた以外は、実施例1−1と同様の条件下、臭化亜鉛の使用量を変更し、反応を実施した。使用した化合物及びその使用量、収率、並びに光学純度について表1−1に示す。
4−ブロモ−2−フルオロビフェニル(1.007g、3.99mmol)、2−ブロモプロピオン酸tert−ブチルエステル(641mg、3.07mmol)、臭化亜鉛(1.99mmol)を用い、実施例1−1と同様の条件下、塩化ニッケル(II)・DME錯体及び(R,R)-2,2'-イソプロピリデンビス(4-フェニル-2-オキサゾリン)(表2−1では化合物[3−1]と表記)の使用量(各々2−ブロモプロピオン酸t−ブチルエステルに対するmol%で表記)を変更し、反応を実施した。使用した化合物及びその使用量、収率、並びに光学純度について表2−1に示す。
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.25 (t, J=7.2 Hz, 3 H), 1.53 (d, J=7.2 Hz, 3 H), 3.74 (q, J=7.2 Hz, 1 H), 4.11 - 4.24 (m, 2 H), 7.09 - 7.18 (m, 2 H), 7.35 - 7.47 (m, 4 H), 7.50 - 7.57 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 273[M+H]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:R体=5.50分、S体=6.18分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.88 (s, 9 H), 1.56 (d, J=7.4 Hz, 3 H), 3.73 - 3.85 (m, 3 H), 7.10 - 7.19 (m, 2 H), 7.34 - 7.47 (m, 4 H), 7.49 - 7.58 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 337[M+Na]+
カラム名:DAICEL CHIRALPAK AD−3 x 2(4.6mmΦ x 150mmL x 2)
溶離液:ヘキサン:エタノール=96:4
流速:1.0mL/分
カラム温度:40℃
保持時間:R体=4.44分、S体=5.54分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 0.80 (t, J=7.6 Hz, 3 H), 1.36 - 1.43 (m, 6 H), 1.49 (d, J=7.2 Hz, 3 H), 1.70 - 1.83 (m, 2 H), 3.66 (q, J=7.2 Hz, 1 H), 7.09 - 7.17 (m, 2 H), 7.34 - 7.47 (m, 4 H), 7.49 - 7.59 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 315[M+H]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:R体=4.02分、S体=4.31分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.55 (d, J=7.2 Hz, 3 H), 3.79 (q, J=7.2 Hz, 1 H), 4.55 - 4.68 (m, 2 H), 5.19 - 5.30 (m, 2 H), 5.82 - 5.95 (m, 1 H), 7.11 - 7.19 (m, 2 H), 7.34 - 7.47 (m, 4 H), 7.50 - 7.57 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 285[M+H]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:R体=6.18分、S体=6.91分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.14 - 1.90 (m, 10 H), 1.50 - 1.55 (m, 3 H), 3.72 (q, J=7.3 Hz, 1 H), 4.74 - 4.87 (m, 1 H), 7.10 - 7.18 (m, 2 H), 7.27 - 7.47 (m, 4 H), 7.49 - 7.59 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 327[M+H]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:R体=4.61分、S体=5.15分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.66 (d, J=7.0 Hz, 3 H), 4.00 (q, J=7.0 Hz, 1 H), 7.01 - 7.06 (m, 2 H), 7.19 - 7.28 (m, 3 H), 7.33 - 7.48 (m, 6 H), 7.54 - 7.58 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 343[M+Na]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:R体=22.7分、S体=26.9分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.54 - 1.57 (m, 3 H), 3.81 (q, J=7.3 Hz, 1 H), 5.05 - 5.21 (m, 2 H), 7.09 - 7.16 (m, 2 H), 7.26 - 7.39 (m, 7 H), 7.42 - 7.47 (m, 2 H), 7.51 - 7.56 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 357[M+Na]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:S体=10.5分、R体=12.4分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.49 (d, J=7.2 Hz, 3 H), 1.71 (s, 3H), 1.77 (s, 3H), 3.73 (q, J=7.2 Hz, 1 H), 7.06 - 7.15 (m, 2 H), 7.16 - 7.29 (m, 5 H), 7.32 - 7.49 (m, 4 H), 7.53 - 7.60 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 385[M+Na]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:S体=8.23分、R体=9.19分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.56 (d, J=7.2 Hz, 3 H), 3.87 (q, J=7.2 Hz, 1 H), 6.85 (s, 1 H), 7.06 - 7.17 (m, 4 H), 7.20 - 7.40 (m, 10 H), 7.42 - 7.48 (m, 2 H), 7.51 - 7.57 (m, 2 H).
MS(ESI/APCI Dual pos.)m/z: 433[M+Na]+
カラム名:DAICEL CHIRALPAK OJ−3(4.6mmΦ x 250mmL)
溶離液:ヘキサン:エタノール=84:16
流速:1.0mL/分
カラム温度:40℃
保持時間:S体=16.2分、R体=17.7分
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.01 (s, 9 H), 1.58 (d, J=7.2 Hz, 3 H), 3.88 (q, J=7.2 Hz, 1 H), 7.12 - 7.21 (m, 2 H), 7.29 - 7.73 (m, 16 H).
MS(ESI/APCI Dual pos.)m/z: 505[M+Na]+
光学純度:84%ee(S)
光学純度:95%ee(S)
光学純度:89%ee(S)
光学純度:91%ee(S)
化学収率:75%
光学純度:99%ee(S)
実施例1−1と同様の条件下、有機亜鉛試薬を調製した後に臭化リチウム(2−ブロモプロピオン酸tert−ブチルエステルに対して1当量)を加えて、2−ブロモプロピオン酸tert−ブチルエステルとのカップリング反応を2時間実施した。
化学収率:55%
得られた化合物の光学純度を以下に記載する。
光学純度:89%ee(S)
(S) −2−(2−フルオロビフェニル−4−イル)プロパン酸の製造法
1H NMR (600 MHz, CHLOROFORM-d) δ ppm 1.52 (d, J=7.0 Hz, 3 H), 3.75 (q, J=7.0 Hz, 1 H), 7.08 - 7.16 (m, 2 H), 7.29 - 7.43 (m, 4 H), 7.45 - 7.51 (m, 2 H).
MS(ESI/APCI Dual neg.)m/z: 243[M-H]-
カラム名:DAICEL CHIRALPAK AY−H/SFC(4.6mmΦ x 250mmL)
溶離液:メタノール:二酸化炭素=10:90
流速:3.0mL/分
カラム温度:40℃
実施例9−1と同様の条件下、反応温度、反応時間、使用する酸と溶媒を変更し、反応を実施した。使用した化合物、収率、並びに光学純度について表7−1に示す。
実施例例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(47.8mmol)、2−ブロモプロピオン酸tert−ブチルエステル(10g、47.8mmol)、塩化ニッケル(II)・DME錯体(0.478mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.574mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1.2mol%)を用い、実施例1−1(2)と同様の条件下、反応温度−20℃、反応時間24時間にて、カップリング反応を実施した。
化学収率:72%
光学純度:86%ee(S)
実施例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(12mmol)、2−ブロモプロピオン酸tert−ブチルエステル(2.09g、10mmol)、塩化ニッケル(II)・DME錯体(0.1mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.12mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1.2mol%)を用い、実施例1−1(2)と同様の条件下、反応温度−20℃、反応時間24時間にて、カップリング反応を実施した。
化学収率:89%
光学純度:87%ee(S)
実施例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(10mmol)、2−ブロモプロピオン酸tert−ブチルエステル(2.09g、10mmol)、塩化ニッケル(II)・DME錯体(0.05mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して0.5mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.06mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して0.6mol%)を用い、実施例1−1(2)と同様の条件下、反応温度−10℃、反応時間3時間にて、カップリング反応を実施した。
化学収率:72%
光学純度:87%ee(S)
実施例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(10mmol)、2−ブロモプロピオン酸tert−ブチルエステル(2.09g、10mmol)、塩化ニッケル(II)・DME錯体(0.1mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.12mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1.2mol%)を用い、実施例1−1(2)と同様の条件下、反応温度−10℃、反応時間3時間にて、カップリング反応を実施した。
化学収率:73%
光学純度:89%ee(S)
実施例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(10mmol)、2−ブロモプロピオン酸tert−ブチルエステル(2.09g、10mmol)、塩化ニッケル(II)・DME錯体(0.1mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.12mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して1.2mol%)を用い、実施例1−1(2)と同様の条件下、反応時間3時間にて、カップリング反応を実施した。
化学収率:72%
光学純度:86%ee(S)
実施例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(10mmol)、塩化ニッケル(II)・DME錯体(0.1mmol、2−クロロプロピオン酸tert−ブチルエステルに対して1mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.12mmol、2−クロロプロピオン酸tert−ブチルエステルに対して1.2mol%)を用い、実施例1−1(2)と同様の条件下、2−ブロモプロピオン酸tert−ブチルエステルの代わりに2−クロロプロピオン酸tert−ブチルエステル(1.65g、10mmol)を用い、反応時間24時間にてカップリング反応を実施した。
化学収率:60%
光学純度:94%ee(S)
実施例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(10mmol)、塩化ニッケル(II)・DME錯体(0.1mmol、2−クロロプロピオン酸tert−ブチルエステルに対して1mol%)、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2−オキサゾリン)(0.12mmol、2−クロロプロピオン酸tert−ブチルエステルに対して1.2mol%)を用い、実施例1−1(2)と同様の条件下、2−ブロモプロピオン酸tert−ブチルエステルの代わりに2−クロロプロピオン酸エチルエステル(1.37g、10mmol)を用い、反応時間24時間にてカップリング反応を実施した。
化学収率:79%
光学純度:85%ee(S)
実施例1−1(1)と同様の条件下、臭化亜鉛を加えずに、有機亜鉛試薬の代わりにグリニャール試薬を調製した。調製したグリニャール試薬(2.0mmol)、2−ブロモプロピオン酸tert−ブチルエステル(0.42g、2.0mmol)、塩化ニッケル(II)・DME錯体(0.1mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して5mol%)を用い、実施例1−1(2)と同様の条件下、(R,R) −2,2'−イソプロピリデンビス(4−フェニル−2-オキサゾリン)の代わりに(R,R) −2,2'−(ペンタン−3,3−ジイル)ビス(4−フェニル−2−オキサゾリン)(0.12mmol、2−ブロモプロピオン酸tert−ブチルエステルに対して6mol%)を用い、反応温度−20℃、反応時間3時間にて、2−ブロモプロピオン酸tert−ブチルエステルとのカップリング反応を実施した。
化学収率:53%
光学純度:90%ee(S)
Claims (15)
- 光学活性な2−(2−フルオロビフェニル−4−イル)プロパン酸又はその製薬学的に許容される塩の製造法において、下記(a)〜(c)工程を含むことを特徴とする製造法:
(a)式[1]で表される化合物をマグネシウムと反応させることを含む有機金属試薬を調製する工程、
X1はハロゲン原子を表し、
X2はハロゲン原子を表し、
R1はtert−ブチルジフェニルシリル、C1-6アルキル、C2-6アルケニル、C3-8シクロアルキル、フェニル、又は置換基群A1から選ばれる1から2個の基で置換されてもよいベンジルを表し、
R2及びR3は独立してC1-6アルキルを表し、
またはR2、R3、及び該置換基に隣接する炭素原子は一緒になってC3-6シクロアルカンを形成してもよく、
R4及びR5は独立してC1-6アルキル、ベンジル、フェネチル、又は置換基群A2から選ばれる1から2個の基で置換されてもよいフェニルを表し、
ここで、置換基群A1は、C1-6アルキル及びフェニルからなる群を表し、
置換基群A2は、ハロゲン原子、C1-6アルキル、ハロC1-6アルキル、C1-6アルコキシ、ハロC1-6アルコキシ、及びフェニルからなる群
を表す。 - 工程(a)において、式[1]で表される化合物をマグネシウムと反応させた後、さらに塩化亜鉛又は臭化亜鉛を反応させて、有機金属試薬を調製する、請求項1に記載の製造法。
- 工程(a)において、式[1]で表される化合物をマグネシウムと反応させた後、さらに塩化亜鉛又は臭化亜鉛を反応させて、有機金属試薬を調製する、請求項3に記載の製造法。
- 工程(b)における式[2]で表される化合物について、R1がC1-6アルキルである請求項1〜4のいずれか1項に記載の製造法。
- 工程(b)における式[2]で表される化合物について、R1がtert−ブチルである、請求項1〜4のいずれか1項のいずれか1項に記載の製造法。
- 工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が10mol%以下である請求項1〜6のいずれか1項に記載の製造法。
- 工程(b)において、式[2]で表される化合物に対して、使用する式[3]で表される光学活性な化合物の触媒量が12mol%以下である請求項1〜6のいずれか1項に記載の製造法。
- 工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.03から1.00mol%であり、使用する式[3]で表される光学活性な化合物の触媒量が0.036から1.20mol%である請求項2、4〜8のいずれか1項に記載の製造法。
- 工程(b)において、式[2]で表される化合物に対して、使用するニッケル化合物の触媒量が0.50から1.00mol%であり、使用する式[3]で表される光学活性な化合物の触媒量が0.60から1.20mol%である請求項1、3、5〜8のいずれか1項に記載の製造法。
- 工程(b)において、反応温度が−78℃から反応溶媒の沸点である請求項1〜10のいずれか1項に記載の製造法。
- 工程(b)において、反応温度が−20から25℃である請求項1〜11のいずれか1項に記載の製造法。
- 工程(b)において、反応温度が0から25℃である請求項2、4〜9、11、12のいずれか1項に記載の製造法。
- 工程(b)において、反応温度が−20から0℃である請求項1、3、5〜8、10〜12のいずれか1項に記載の製造法。
- 工程(c)において、式[4]で表される化合物を式[5]で表される化合物に変換する工程が酸性条件下における変換である請求項1、2、5〜14のいずれか1項に記載の製造法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015194284 | 2015-09-30 | ||
| JP2015194284 | 2015-09-30 | ||
| PCT/JP2016/078939 WO2017057642A1 (ja) | 2015-09-30 | 2016-09-29 | 光学活性な2-(2-フルオロビフェニル-4-イル)プロパン酸の製造法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2017057642A1 JPWO2017057642A1 (ja) | 2018-05-24 |
| JP6504530B2 true JP6504530B2 (ja) | 2019-04-24 |
Family
ID=58423941
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017543596A Active JP6504530B2 (ja) | 2015-09-30 | 2016-09-29 | 光学活性な2−(2−フルオロビフェニル−4−イル)プロパン酸の製造法 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US10207976B2 (ja) |
| EP (1) | EP3357901A4 (ja) |
| JP (1) | JP6504530B2 (ja) |
| CN (1) | CN108026014B (ja) |
| MY (1) | MY194792A (ja) |
| PH (1) | PH12018500677B1 (ja) |
| TW (1) | TWI730989B (ja) |
| WO (1) | WO2017057642A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT201800003382A1 (it) * | 2018-03-08 | 2019-09-08 | Taisho Pharmaceutical Co Ltd | Crystal of tert-butyl (2S)-2-(2-fluorobiphenyl-4-yl) propanoate and process for producing the same |
| CN108558651A (zh) * | 2018-06-13 | 2018-09-21 | 上海峰林生物科技有限公司 | 一种氟比洛芬的制备方法及氟比洛芬酯的制备方法 |
| CN112778127A (zh) * | 2020-06-25 | 2021-05-11 | 北京澳合药物研究院有限公司 | 一种氟比洛芬的制备方法 |
| CN112457182A (zh) * | 2020-12-16 | 2021-03-09 | 江苏慧聚药业有限公司 | 一种氟比洛芬杂质的制备方法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1459084A (en) | 1973-05-24 | 1976-12-22 | Boots Co Ltd | Preparation of arylalkanoic acid |
| ES446581A1 (es) * | 1975-04-04 | 1977-06-16 | Boots Co Ltd | Un procedimiento para preparar acidos 2-arilpropionicos. |
| DE3363606D1 (en) * | 1982-11-24 | 1986-06-26 | Syntex Pharma Int | Preparation of optically active alpha-arylalkanoic acids and precursors thereof |
| JPS6011439A (ja) * | 1983-06-29 | 1985-01-21 | Daikin Ind Ltd | 2−アリ−ルアルキルカルボン酸化合物の製法 |
| JPS60112735A (ja) * | 1983-11-22 | 1985-06-19 | シンテツクス・フア−マシユ−テイカルズ・インタ−ナシヨナル・リミテツド | 光学活性なα−アリ−ルアルカン酸類の製造法およびその前駆体 |
| JPS61210049A (ja) * | 1984-11-21 | 1986-09-18 | Daicel Chem Ind Ltd | 光学活性なα↓−芳香族基置換アルカンカルボン酸類の製造方法 |
| US5248815A (en) * | 1991-12-27 | 1993-09-28 | Paradies Henrich H | Stereo-selective synthesis of 2-aryl-propionic acids of high optical purity by using chiral oxazolines |
| JP4191829B2 (ja) | 1998-11-05 | 2008-12-03 | 大日本住友製薬株式会社 | 光学活性カルボン酸の製造方法 |
| JP2004339085A (ja) * | 2003-05-13 | 2004-12-02 | Asahi Kasei Pharma Kk | α−置換フェニル−アルカンカルボン酸エステル誘導体の製法 |
| JP2005255577A (ja) * | 2004-03-10 | 2005-09-22 | Asahi Kasei Pharma Kk | 管型反応装置を用いた連続的な製造方法 |
| JP5803590B2 (ja) * | 2011-11-14 | 2015-11-04 | 住友化学株式会社 | 光学活性ビスオキサゾリン化合物、不斉触媒およびそれを用いた光学活性シクロプロパン化合物の製造方法 |
| JP5737255B2 (ja) * | 2012-09-27 | 2015-06-17 | ダイキン工業株式会社 | チオノカルボン酸エステルの製造方法 |
| JP5988305B2 (ja) * | 2013-03-29 | 2016-09-07 | 国立大学法人山口大学 | 光学活性α−ブロモベンゾイル酢酸エステル類の製造方法 |
| CN103755566B (zh) * | 2014-01-17 | 2015-04-29 | 中国农业大学 | 一种不对称催化合成(s)-2-芳基丙酸酯的方法 |
| CN103755554B (zh) * | 2014-01-17 | 2015-02-18 | 中国农业大学 | 不对称催化合成(s)-非诺洛芬的方法 |
-
2016
- 2016-09-29 WO PCT/JP2016/078939 patent/WO2017057642A1/ja not_active Ceased
- 2016-09-29 TW TW105131363A patent/TWI730989B/zh active
- 2016-09-29 EP EP16851813.2A patent/EP3357901A4/en not_active Withdrawn
- 2016-09-29 PH PH1/2018/500677A patent/PH12018500677B1/en unknown
- 2016-09-29 CN CN201680057083.5A patent/CN108026014B/zh active Active
- 2016-09-29 JP JP2017543596A patent/JP6504530B2/ja active Active
- 2016-09-29 US US15/764,598 patent/US10207976B2/en active Active
- 2016-09-29 MY MYPI2018701271A patent/MY194792A/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| TW201726593A (zh) | 2017-08-01 |
| US20180282252A1 (en) | 2018-10-04 |
| MY194792A (en) | 2022-12-15 |
| TWI730989B (zh) | 2021-06-21 |
| CN108026014B (zh) | 2021-03-16 |
| EP3357901A4 (en) | 2019-06-19 |
| US10207976B2 (en) | 2019-02-19 |
| WO2017057642A1 (ja) | 2017-04-06 |
| CN108026014A (zh) | 2018-05-11 |
| JPWO2017057642A1 (ja) | 2018-05-24 |
| EP3357901A1 (en) | 2018-08-08 |
| PH12018500677A1 (en) | 2018-10-15 |
| PH12018500677B1 (en) | 2023-11-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6504530B2 (ja) | 光学活性な2−(2−フルオロビフェニル−4−イル)プロパン酸の製造法 | |
| NO327958B1 (no) | Pregabalin og metode for fremstilling av slike forbindelser | |
| KR100978970B1 (ko) | Hmg-coa 환원효소 저해 메발론산 유도체의 제조방법 | |
| JP5683273B2 (ja) | 光学活性カルボン酸の製造方法 | |
| EP2123661A1 (en) | Chiral iridium aqua complex and method for producing optically active hydroxy compound by using the same | |
| JPWO2008038578A1 (ja) | 軸不斉を有する光学活性な4級アンモニウム塩およびそれを用いたα−アミノ酸およびその誘導体の製造方法 | |
| EP2792664B1 (en) | Optical resolution method for bicyclic compound using asymmetric catalyst | |
| JP5396578B2 (ja) | 光学活性テトラアミノホスホニウム塩、不斉合成反応用触媒、及び光学活性β−ニトロアルコールの製造方法 | |
| US20100286442A1 (en) | Novel method for preparing pregabalin | |
| JP5622019B2 (ja) | アミノアルコール誘導体塩構造を有する不斉有機分子触媒及び該不斉有機分子触媒を用いた光学活性化合物の製造方法 | |
| HUE033534T2 (en) | Asymmetric synthesis of substituted pyrrolidine-2-carboxamide | |
| KR20130090360A (ko) | 물 또는 다양한 산을 첨가제로 이용한 새로운 마이클-첨가 반응을 통하여 화합물을 제조하는 방법 | |
| JP5569938B2 (ja) | ピロリジン誘導体及びその製造方法 | |
| CA3169869A1 (en) | Process for preparing s-beflubutamid by resolving 2-bromobutanoic acid | |
| JP2013173677A (ja) | (1r,2s)−1−アミノ−2−ビニルシクロプロパンカルボン酸エステルの製造法 | |
| US20030236429A1 (en) | Process for the production of chiral compounds | |
| JP2008115178A (ja) | ジフェニルアラニン−Ni(II)錯体の製造方法 | |
| Błocka et al. | Structural and electronic effects of oxazolidine ligands derived from (1R, 2S)-ephedrine in the asymmetric addition of diethylzinc to aldehydes | |
| HK1249498B (zh) | 光学活性的2-(2-氟联苯-4-基)丙酸的制备方法 | |
| WO2013135869A1 (en) | Process for the preparation of optically active 1,2-di(furan-2-yl)ethane-1,2-diols and derivates thereof | |
| HK1249498A1 (en) | Method for producing optically active 2- (2-fluorobiphenyl-4-yl)propanoic acid | |
| US7078547B2 (en) | Catalytic asymmetric cyanosilylation of ketones, aldehydes, thioketones, thioaldehydes, imines and hydrazones | |
| US11623913B2 (en) | Method of synthesizing (1R,2R)-nitroalcohol compound | |
| CN111377850A (zh) | 一种手性n-取代-3,3-二氟-4-羟基哌啶衍生物及其制备方法 | |
| KR20220088771A (ko) | 1-(4-벤질옥시-벤질)-3-메틸-티오우레아의 신규 결정형의 제조 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20180117 Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180202 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180202 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180920 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20181119 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190304 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6504530 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190317 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |