JP6314152B2 - 固体アルカリイオン伝導性膜の劣化防止 - Google Patents
固体アルカリイオン伝導性膜の劣化防止 Download PDFInfo
- Publication number
- JP6314152B2 JP6314152B2 JP2015549386A JP2015549386A JP6314152B2 JP 6314152 B2 JP6314152 B2 JP 6314152B2 JP 2015549386 A JP2015549386 A JP 2015549386A JP 2015549386 A JP2015549386 A JP 2015549386A JP 6314152 B2 JP6314152 B2 JP 6314152B2
- Authority
- JP
- Japan
- Prior art keywords
- ion
- ions
- pseudohalide
- sodium
- electrochemical cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/42—Methods or arrangements for servicing or maintenance of secondary cells or secondary half-cells
- H01M10/4235—Safety or regulating additives or arrangements in electrodes, separators or electrolyte
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/056—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes
- H01M10/0561—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes the electrolyte being constituted of inorganic materials only
- H01M10/0562—Solid materials
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/36—Accumulators not provided for in groups H01M10/05-H01M10/34
- H01M10/39—Accumulators not provided for in groups H01M10/05-H01M10/34 working at high temperature
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/36—Accumulators not provided for in groups H01M10/05-H01M10/34
- H01M10/39—Accumulators not provided for in groups H01M10/05-H01M10/34 working at high temperature
- H01M10/3909—Sodium-sulfur cells
- H01M10/3918—Sodium-sulfur cells characterised by the electrolyte
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/368—Liquid depolarisers
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M2300/00—Electrolytes
- H01M2300/0017—Non-aqueous electrolytes
- H01M2300/0065—Solid electrolytes
- H01M2300/0068—Solid electrolytes inorganic
- H01M2300/0071—Oxides
- H01M2300/0074—Ion conductive at high temperature
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/52—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- Inorganic Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- Physics & Mathematics (AREA)
- Secondary Cells (AREA)
- Hybrid Cells (AREA)
- Conductive Materials (AREA)
Description
13種の異なるNaSICON及びNaSICON型材料(セラマテック インク社製、ソルトレークシティー、ユタ州)を100℃の50重量%NaOH溶液中に配置した。試料を引き上げ溶解による重量ロスを測定した。試料は、約6.5重量%から50重量%を超える範囲で重量ロスが認められた。結果を図4に示す。
4種の異なる構成のNaSICON材料を100℃の50重量%NaOH溶液中に9週間配置し、溶解による重量ロスを測定した。それぞれの構成材料に対し3サンプルのそれぞれの重量を各週ごとに測定した。
3種の異なる構成のNaSICON材料を、異なるハロゲン化ナトリウム(6MのNaI、53重量%のNaBr、25重量%のNaCl)の100℃の溶液中に9週間配置し、溶解による重量ロスを測定した。それぞれの構成材料に対し3サンプルのそれぞれの重量を各週ごとに測定した。
4種の異なる構成のNaSICON材料を、異なるヨウ化ナトリウム(10MのNaI、6MのNaI及び3Mのヨウ素、6MのNaI、6MのNaI及び20重量%ホウ砂)の120℃の溶液中に9週間配置し、溶解による重量ロスを測定した。6MのNaI及び3Mのヨウ素は、ヨウ化ナトリウム塩を蒸留水に溶解し、次いで3Mのヨウ素結晶を溶液に添加して塩溶液中のヨウ素含有量を増加させる試みにより作成した。それぞれの構成材料に対し3サンプルのそれぞれの重量を各週ごとに測定した。
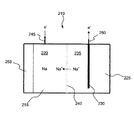
溶融ナトリウム二次電池(電池)を調製し、作動させた。負極(アノード)は溶融ナトリウムであり、正極(カソード)は銅線およびヨウ化銅であった。NaSICONナトリウムイオン伝導性電解質膜から成る1.4cmのディスクを負極と正極との間に配置した。正極溶液(または陰極液)は、10MのNaI中に2MのCuIを3mL含んでいる。電池は、約330時間を超えて43充電/放電サイクル被験された。電池は120℃の温度で作動させた。放電電圧は約2.15Vであった。図9は、種々の充電/放電サイクルに対する電池電圧のグラフを示す。理論にとらわれるわけではないが、充電サイクル中、CuIは過剰のヨウ素イオンとCuI2 −錯体を形成することにより溶解する。放電サイクル中、カソード上に銅メッキされる。二次電池の作動後、NaSICON電解質は、溶解による顕著な劣化を被っていない。
Claims (29)
- アノードから成る負極室と、水性陰極液を保持するための正極室と、負極室と正極室との間に配置される固体アルカリイオン伝導性セラミック電解質膜とから成る電気化学的セルであって、上記正極室は陰極液と接するように配置されるカソードから成り、陰極液は、ハロゲン化物イオン、ポリハロゲン化物イオン、疑似ハロゲン化物イオン、硫化物イオン又は多硫化物イオンから成り、その濃度が3Mを超えることを特徴とする電気化学的セル。
- ハロゲン化物イオン、ポリハロゲン化物イオン、疑似ハロゲン化物イオン、硫化物イオン又は多硫化物イオンの濃度が6Mを超える請求項1に記載の電気化学的セル。
- ハロゲン化物イオン、ポリハロゲン化物イオン、疑似ハロゲン化物イオン、硫化物イオン又は多硫化物イオンの濃度が1.5Mを超える請求項1に記載の電気化学的セル。
- 正極室の作動温度において、ハロゲン化物イオン、ポリハロゲン化物イオン、疑似ハロゲン化物イオン、硫化物イオン又は多硫化物イオンの濃度が3Mからハロゲン化物イオン、ポリハロゲン化物イオン、疑似ハロゲン化物イオン、硫化物イオン又は多硫化物イオンの飽和濃度までである請求項1に記載の電気化学的セル。
- ハロゲン化物イオン、ポリハロゲン化物イオン、疑似ハロゲン化物イオン、硫化物イオン又は多硫化物イオンの濃度が6M〜10Mである請求項1に記載の電気化学的セル。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンが、塩化物イオン、臭化物イオン、ヨウ化物イオン、アジド、チオシアネート及びシアン化物から選択される請求項1に記載の電気化学的セル。
- 固体アルカリイオン伝導性セラミック電解質膜が、NaSICON又はNaSICON型材料のセラミック、LiSICON又はLiSICON型材料のセラミック及びKSICON又はKSICON型材料のセラミックから選択される材料から成る請求項1に記載の電気化学的セル。
- 電気化学的セルが溶融ナトリウム再充電型電池であり、電池が作動中アノードは固体アルカリイオン伝導性セラミック電解質膜に接触する溶融ナトリウムから成り、固体アルカリイオン伝導性セラミック電解質膜が、NaSICON型ナトリウムイオン伝導性セラミック電解質膜であり、電池が作動温度100℃〜150℃で機能する請求項1に記載の電気化学的セル。
- 電池が作動温度110℃〜130℃で機能する請求項8に記載の電気化学的セル。
- カソードがオキシ水酸化ニッケル及び水酸化ニッケルから成る請求項8に記載の電気化学的セル。
- カソードが銅およびヨウ化銅から成り、陰極液がヨウ化ナトリウム又はナトリウムポリハロゲン化物から成る請求項8に記載の電気化学的セル。
- カソードが硫黄および多硫化物から成り、陰極液が硫化ナトリウム又は多硫化ナトリウムから成る請求項8に記載の電気化学的セル。
- 電気化学的セルを準備し、電気化学的セルを作動させることから成る固体アルカリイオン伝導性セラミック電解質膜を劣化から防ぐ方法であって、電気化学的セルは、アノードから成る負極室と、水性陰極液と接触するように配置され水性陰極液を保有するためのカソードから成る正極室と、負極室と正極室との間に配置される固体アルカリイオン伝導性セラミック電解質膜とから成り、陰極液は3Mを超える濃度のハロゲン化物イオン又は疑似ハロゲン化物イオンから成り、ハロゲン化物イオン又は疑似ハロゲン化物イオンの存在によって、固体アルカリイオン伝導性セラミック電解質膜の劣化を防ぐことを特徴とする固体アルカリイオン伝導性セラミック電解質膜を劣化から防ぐ方法。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンの濃度が6Mを超える請求項13に記載の方法。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンの濃度が、3Mから正極室の作動温度におけるハロゲン化物イオン又は疑似ハロゲン化物イオンの飽和濃度までの間である請求項13に記載の方法。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンの濃度が3M〜10Mである請求項13に記載の方法。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンが、塩化物イオン、臭化物イオン、ヨウ化物イオン、アジド、チオシアネート及びシアン化物から選択される請求項13に記載の方法。
- 固体アルカリイオン伝導性セラミック電解質膜が、NaSICON又はNaSICON型材料のセラミック、LiSICON又はLiSICON型材料のセラミック及びKSICON又はKSICON型材料から選択される材料から成る請求項13に記載の方法。
- 電気化学的セルが溶融ナトリウム再充電可能電池であって、アノードが、電池作動中に伝導性電解質膜に接する溶融ナトリウム金属から成り、固体アルカリイオン伝導性セラミック電解質膜がNaSICON型ナトリウムイオン伝導性セラミック電解質膜から成り、電池が作動温度100℃〜150℃の間で機能する請求項13に記載の方法。
- 作動温度が110℃〜130℃で電池が機能する請求項19に記載の方法。
- カソードがオキシ水酸化ニッケル及び水酸化ニッケルから成る請求項19に記載の方法。
- 負極、正極室および固体ナトリウムイオン伝導性セラミック電解質膜から成る溶融ナトリウム二次電池であって、負極は放電中に電気化学的に酸化してナトリウムイオンを放出し、充電中にナトリウムイオンをナトリウム金属に電気化学的に還元し、正極室中の正極は水性正極溶液中に配置され、水性正極溶液のハロゲン化物イオン又は疑似ハロゲン化物イオンの濃度が3Mを超え、固体ナトリウムイオン伝導性セラミック電解質膜は液体正極溶液から負極を分離し、電池が作動中に負極は溶融し、伝導性電解質膜に接触しており、作動温度100℃〜150℃で電池が機能することを特徴とする溶融ナトリウム二次電池。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンの濃度が6Mを超える請求項22に記載の溶融ナトリウム二次電池。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンの濃度が、6Mと、ハロゲン化物イオン又は疑似ハロゲン化物イオンの飽和濃度との間である請求項22に記載の溶融ナトリウム二次電池。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンの濃度が6M〜10Mである請求項22に記載の溶融ナトリウム二次電池。
- ハロゲン化物イオン又は疑似ハロゲン化物イオンが、塩化物イオン、臭化物イオン、ヨウ化物イオン、アジド、チオシアネート及びシアン化物から選択される請求項22に記載の溶融ナトリウム二次電池。
- 固体ナトリウムイオン伝導性セラミック電解質膜が、セラミックNaSICON又はNaSICON型材料から選択される材料から成る請求項22に記載の溶融ナトリウム二次電池。
- 電池が110℃〜130℃の作動温度で機能する請求項22に記載の溶融ナトリウム二次電池。
- 正極が銅およびヨウ化銅から成る請求項22に記載の溶融ナトリウム二次電池。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261723122P | 2012-12-19 | 2012-12-19 | |
| US61/723,122 | 2012-12-19 | ||
| PCT/US2013/068552 WO2014099153A1 (en) | 2012-12-19 | 2013-11-05 | Degradation protection of solid alkali ion conductive electrolyte membrane |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016502251A JP2016502251A (ja) | 2016-01-21 |
| JP2016502251A5 JP2016502251A5 (ja) | 2016-10-13 |
| JP6314152B2 true JP6314152B2 (ja) | 2018-04-18 |
Family
ID=50931256
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015549386A Active JP6314152B2 (ja) | 2012-12-19 | 2013-11-05 | 固体アルカリイオン伝導性膜の劣化防止 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9431682B2 (ja) |
| EP (1) | EP2935655B1 (ja) |
| JP (1) | JP6314152B2 (ja) |
| KR (1) | KR102139516B1 (ja) |
| AU (1) | AU2013364191B2 (ja) |
| CA (1) | CA2894266C (ja) |
| WO (1) | WO2014099153A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10320033B2 (en) | 2008-01-30 | 2019-06-11 | Enlighten Innovations Inc. | Alkali metal ion battery using alkali metal conductive ceramic separator |
| US10056651B2 (en) | 2010-11-05 | 2018-08-21 | Field Upgrading Usa, Inc. | Low temperature secondary cell with sodium intercalation electrode |
| US10020543B2 (en) | 2010-11-05 | 2018-07-10 | Field Upgrading Usa, Inc. | Low temperature battery with molten sodium-FSA electrolyte |
| US10224577B2 (en) | 2011-11-07 | 2019-03-05 | Field Upgrading Usa, Inc. | Battery charge transfer mechanisms |
| WO2014039762A1 (en) * | 2012-09-06 | 2014-03-13 | Ceramatec, Inc. | Sodium-halogen secondary cell |
| US10854929B2 (en) | 2012-09-06 | 2020-12-01 | Field Upgrading Usa, Inc. | Sodium-halogen secondary cell |
| CN104362691A (zh) * | 2014-10-31 | 2015-02-18 | 武汉洲连科技有限公司 | 一种蓄电池的充放电控制系统 |
| EP3217467A1 (de) * | 2016-03-08 | 2017-09-13 | Basf Se | Vorrichtung zur speicherung von elektrischer energie und verfahren zum betrieb der vorrichtung |
| EP3607603A4 (en) * | 2017-04-07 | 2021-01-13 | Ambri Inc. | MOLTEN SALT BATTERY WITH SOLID METAL CATHODE |
Family Cites Families (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4041215A (en) | 1976-04-05 | 1977-08-09 | Owens-Illinois, Inc. | Method for forming solid electrolyte composite |
| US4162351A (en) | 1977-10-12 | 1979-07-24 | Electric Power Research Institute, Inc. | Metal-halogen cell operation with storage of halogen via organic complexation external to the electrochemical cell |
| US4307164A (en) | 1978-07-25 | 1981-12-22 | El-Chem Corporation | Rechargeable electrical storage battery with zinc anode and aqueous alkaline electrolyte |
| US4244986A (en) | 1979-04-24 | 1981-01-13 | Westinghouse Electric Corp. | Method of forming sodium beta-Al2 O3 films and coatings |
| US4375501A (en) | 1980-10-17 | 1983-03-01 | Gte Laboratories Incorporated | Electrochemical cell |
| US4485154A (en) * | 1981-09-08 | 1984-11-27 | Institute Of Gas Technology | Electrically rechargeable anionically active reduction-oxidation electrical storage-supply system |
| ZA828603B (en) | 1981-12-10 | 1983-09-28 | South African Inventions | Electrochemical cell |
| US4427747A (en) | 1982-01-28 | 1984-01-24 | Diamond Shamrock Corporation | Bronze suppression in an alkali metal/sulfur ammonia battery |
| JPS6017872A (ja) | 1983-07-11 | 1985-01-29 | Nippon Denso Co Ltd | 有機電池 |
| US4753858A (en) | 1985-07-18 | 1988-06-28 | Allied-Signal Inc. | Rechargeable sodium alloy anode |
| JPS62186470A (ja) | 1986-02-10 | 1987-08-14 | Toshiba Battery Co Ltd | 非水電解液電池 |
| GB9003760D0 (en) | 1990-02-20 | 1990-04-18 | Lilliwyte Sa | Electrochemical cell |
| US5525442A (en) | 1990-09-14 | 1996-06-11 | Westinghouse Electric Corporation | Alkali metal battery |
| US5290405A (en) | 1991-05-24 | 1994-03-01 | Ceramatec, Inc. | NaOH production from ceramic electrolytic cell |
| US5422197A (en) | 1992-10-14 | 1995-06-06 | National Power Plc | Electrochemical energy storage and power delivery process utilizing iron-sulfur couple |
| US5264298A (en) | 1992-10-19 | 1993-11-23 | Hughes Aircraft Company | Lewis acid thermoelectrochemical converter |
| ZA95443B (en) | 1994-02-02 | 1995-08-02 | Programme 3 Patent Holdings | Electrochemical cell |
| CA2114902C (en) * | 1994-02-03 | 2001-01-16 | David S. Wainwright | Aqueous rechargeable battery |
| US6030720A (en) | 1994-11-23 | 2000-02-29 | Polyplus Battery Co., Inc. | Liquid electrolyte lithium-sulfur batteries |
| US6376123B1 (en) | 1994-11-23 | 2002-04-23 | Polyplus Battery Company | Rechargeable positive electrodes |
| US5686201A (en) | 1994-11-23 | 1997-11-11 | Polyplus Battery Company, Inc. | Rechargeable positive electrodes |
| US5552244A (en) | 1995-02-14 | 1996-09-03 | Eric Blair Griffen | Reversible high energy capacity metal-sulfur battery and method of making same |
| IL120784A (en) | 1997-05-05 | 2000-08-31 | Chemergy Ltd | Iron based sulfur battery |
| US6410181B1 (en) | 1999-05-05 | 2002-06-25 | Wilson Greatbatch Ltd. | High temperature lithium oxyhalide electrochemical cell |
| US20070221265A1 (en) | 2006-03-22 | 2007-09-27 | Sion Power Corporation | Rechargeable lithium/water, lithium/air batteries |
| KR100326466B1 (ko) | 2000-07-25 | 2002-02-28 | 김순택 | 리튬 설퍼 전지용 전해액 |
| US6653020B2 (en) | 2001-04-12 | 2003-11-25 | Rutgers University Foundation | Metal nitride electrode materials for high capacity rechargeable lithium battery cells |
| US20020172871A1 (en) | 2001-05-18 | 2002-11-21 | Trans Ionics Corporation | Thin film composite electrolytes, sodium-sulfur cells including same, processes of making same, and vehicles including same |
| US7070632B1 (en) | 2001-07-25 | 2006-07-04 | Polyplus Battery Company | Electrochemical device separator structures with barrier layer on non-swelling membrane |
| US6852209B2 (en) | 2002-10-02 | 2005-02-08 | Applied Materials, Inc. | Insoluble electrode for electrochemical operations on substrates |
| US6881234B2 (en) | 2003-08-08 | 2005-04-19 | Frank E. Towsley | Method for making electrodes for nickel-metal hydride batteries |
| KR20050040714A (ko) | 2003-10-28 | 2005-05-03 | 티디케이가부시기가이샤 | 다공질 기능성막, 센서, 다공질 기능성막의 제조방법,다공질 금속막의 제조방법 및 센서의 제조방법 |
| US7824536B2 (en) | 2003-12-11 | 2010-11-02 | Ceramatec, Inc. | Electrolytic method to make alkali alcoholates using ceramic ion conducting solid membranes |
| KR100651246B1 (ko) | 2004-02-17 | 2006-11-29 | 경상대학교산학협력단 | 액체전해질을 사용한 나트륨/유황 전지 |
| US7255961B2 (en) | 2004-03-12 | 2007-08-14 | Trans Ionics Corporation | Thin film composite electrolyte |
| JP4339741B2 (ja) * | 2004-05-11 | 2009-10-07 | 日本電信電話株式会社 | 層状酸化物電極材料及びそれを用いる電池 |
| JP4843908B2 (ja) * | 2004-05-18 | 2011-12-21 | 富士ゼロックス株式会社 | 二次電池及び発電方法 |
| US20060141346A1 (en) | 2004-11-23 | 2006-06-29 | Gordon John H | Solid electrolyte thermoelectrochemical system |
| US8257868B2 (en) | 2005-03-23 | 2012-09-04 | Kyoto University | Molten salt composition and use thereof |
| KR100693306B1 (ko) | 2005-05-16 | 2007-03-13 | 가부시키가이샤 피코 사이언스 | 자기재생형 알칼리 전지 및 그의 제조방법 |
| US7413582B2 (en) | 2005-08-29 | 2008-08-19 | Tsang Floris Y | Lithium battery |
| EP2087540A4 (en) * | 2006-10-13 | 2014-01-22 | Ceramatec Inc | ADVANCED AIR-METAL BATTERY HAVING CERAMIC MEMBRANE ELECTROLYTE |
| JP2008293678A (ja) | 2007-05-22 | 2008-12-04 | Doshisha | 半電池および該半電池を用いた空気二次電池 |
| WO2008153564A1 (en) | 2007-06-11 | 2008-12-18 | Midwest Research Institute | Multilayer solid electrolyte for lithium thin film batteries |
| WO2009032313A1 (en) | 2007-09-05 | 2009-03-12 | Ceramatec, Inc. | Lithium-sulfur battery with a substantially non- porous membrane and enhanced cathode utilization |
| JP2009129741A (ja) | 2007-11-26 | 2009-06-11 | Kyushu Univ | ナトリウムイオン二次電池およびそれに用いる負極活物質 |
| US9209445B2 (en) | 2007-11-26 | 2015-12-08 | Ceramatec, Inc. | Nickel-metal hydride/hydrogen hybrid battery using alkali ion conducting separator |
| US8012621B2 (en) | 2007-11-26 | 2011-09-06 | Ceramatec, Inc. | Nickel-metal hydride battery using alkali ion conducting separator |
| US8088270B2 (en) | 2007-11-27 | 2012-01-03 | Ceramatec, Inc. | Process for recovering alkali metals and sulfur from alkali metal sulfides and polysulfides |
| US8216722B2 (en) | 2007-11-27 | 2012-07-10 | Ceramatec, Inc. | Solid electrolyte for alkali-metal-ion batteries |
| US20090189567A1 (en) | 2008-01-30 | 2009-07-30 | Joshi Ashok V | Zinc Anode Battery Using Alkali Ion Conducting Separator |
| US8728295B2 (en) | 2008-10-09 | 2014-05-20 | Ceramatec, Inc. | Apparatus and method for reducing an alkali metal electrochemically at a temperature below the metal's melting temperature |
| KR20110139197A (ko) | 2009-03-16 | 2011-12-28 | 세라마테크, 인코오포레이티드 | 실질적으로 비다공성 멤브레인을 구비한 나트륨-황 배터리 및 개선된 캐소드 활용방법 |
| JP5359442B2 (ja) | 2009-03-25 | 2013-12-04 | 住友化学株式会社 | ナトリウムイオン電池 |
| EP2494648A1 (en) | 2009-10-27 | 2012-09-05 | Solvay Fluor GmbH | Lithium sulfur battery |
| EP2497133B1 (en) | 2009-11-05 | 2018-12-26 | Field Upgrading USA, Inc. | Solid-state sodium-based secondary cell having a sodium ion conductive ceramic separator |
| US8883339B2 (en) | 2010-07-22 | 2014-11-11 | University Of Central Florida Research Foundation, Inc. | Alkali metal-cathode solution battery |
| KR20120016840A (ko) | 2010-08-17 | 2012-02-27 | 삼성에스디아이 주식회사 | 리튬 이차 전지용 음극 및 이를 포함하는 리튬 이차 전지 |
| WO2012061823A2 (en) | 2010-11-05 | 2012-05-10 | Ceramatec, Inc. | Low temperature molten sodium secondary cell with sodium ion conductive electrolyte membrane |
| KR101940337B1 (ko) * | 2010-12-01 | 2019-01-18 | 필드 업그레이딩 유에스에이, 인코포레이티드 | 중온 나트륨 배터리 |
| US20120219843A1 (en) | 2011-02-24 | 2012-08-30 | General Electric Company | Composition, energy storage device, and related processes |
-
2013
- 2013-11-05 CA CA2894266A patent/CA2894266C/en active Active
- 2013-11-05 WO PCT/US2013/068552 patent/WO2014099153A1/en active Application Filing
- 2013-11-05 AU AU2013364191A patent/AU2013364191B2/en active Active
- 2013-11-05 US US14/072,468 patent/US9431682B2/en active Active
- 2013-11-05 JP JP2015549386A patent/JP6314152B2/ja active Active
- 2013-11-05 EP EP13865228.4A patent/EP2935655B1/en active Active
- 2013-11-05 KR KR1020157016278A patent/KR102139516B1/ko active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| WO2014099153A1 (en) | 2014-06-26 |
| US20140170443A1 (en) | 2014-06-19 |
| KR20150096675A (ko) | 2015-08-25 |
| CA2894266A1 (en) | 2014-06-26 |
| EP2935655A1 (en) | 2015-10-28 |
| EP2935655B1 (en) | 2017-12-27 |
| AU2013364191A1 (en) | 2015-07-09 |
| KR102139516B1 (ko) | 2020-07-30 |
| US9431682B2 (en) | 2016-08-30 |
| CA2894266C (en) | 2021-05-18 |
| AU2013364191B2 (en) | 2018-04-05 |
| EP2935655A4 (en) | 2016-08-24 |
| JP2016502251A (ja) | 2016-01-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6314152B2 (ja) | 固体アルカリイオン伝導性膜の劣化防止 | |
| CA2983001C (en) | Sodium-aluminum battery with sodium ion conductive ceramic separator | |
| EP2893590B1 (en) | Sodium-halogen secondary cell | |
| US10355305B2 (en) | Alkali metal intercalation material as an electrode in an electrolytic cell | |
| KR20120095949A (ko) | 나트륨 이온 전도성 세라믹 분리판을 갖는 고체-상태 나트륨계 2차 전지 | |
| JP2013541825A (ja) | ナトリウムイオン伝導性セラミックセパレーターを有する固体ナトリウム系二次電池 | |
| WO2013109542A1 (en) | Composite alkali ion conductive solid electrolyte | |
| JP6570510B2 (ja) | 溶融ナトリウム−fsa電解質を有する低温電池 | |
| JP2015515723A (ja) | 非極性アルカリ金属イオン伝導ハニカム構造セパレーターを有する電池 | |
| US20190115613A1 (en) | Aqueous batteries with a mediator-ion solid state electrolyte | |
| US10224577B2 (en) | Battery charge transfer mechanisms | |
| JP6546099B2 (ja) | 電解セルにおける電極としてのアルカリ金属挿入材料 | |
| DK3050153T3 (en) | MIDDLE-TEMPERATURE SODIUM METAL HALOGENIDE BATTERY | |
| JP2016534528A (ja) | ナトリウム−ハロゲン二次電池 | |
| JP6301931B2 (ja) | 電池の電荷移動機構 | |
| KR20190009420A (ko) | 알칼리 금속 전도성 세라믹 세퍼레이터를 사용하는 알칼리 금속 이온 배터리 | |
| EP3227951B1 (en) | Sodium-halogen secondary cell | |
| US20200119384A1 (en) | Electrochemical systems with precipitated reactants and related methods | |
| JP2017004934A (ja) | アルミニウム−マンガン電気化学セル |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160822 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160822 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170714 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170801 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171031 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20171120 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171226 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180116 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180227 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180326 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6314152 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |