JP6203747B2 - 多特異性結合体の遊離結合パートナーの検出方法 - Google Patents
多特異性結合体の遊離結合パートナーの検出方法 Download PDFInfo
- Publication number
- JP6203747B2 JP6203747B2 JP2014547933A JP2014547933A JP6203747B2 JP 6203747 B2 JP6203747 B2 JP 6203747B2 JP 2014547933 A JP2014547933 A JP 2014547933A JP 2014547933 A JP2014547933 A JP 2014547933A JP 6203747 B2 JP6203747 B2 JP 6203747B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- antigen
- multispecific
- sample
- binding specificity
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54306—Solid-phase reaction mechanisms
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/5306—Improving reaction conditions, e.g. reduction of non-specific binding, promotion of specific binding
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54393—Improving reaction conditions or stability, e.g. by coating or irradiation of surface, by reduction of non-specific binding, by promotion of specific binding
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Peptides Or Proteins (AREA)
Description
抗体を用いる標準的な固相免疫アッセイは、固相に吸着/固定化された抗体(捕捉抗体)、抗原および酵素または検出可能な標識にコンジュゲートされた抗原の別のエピトープに対する抗体(トレーサー抗体)の間で複合体を形成させるものである。このアッセイでは、固相/捕捉抗体/抗原/トレーサー抗体のサンドイッチが形成される。このサンドイッチによって触媒される反応においては、とりわけ、抗体にコンジュゲートされた酵素の活性が、インキュベート培地中の抗原濃度に比例する。抗イディオタイプ抗体アッセイは、例えば、US 5,219,730(特許文献1); WO 87/002778(特許文献2); EP 0 139 389(特許文献3); およびEP 0 170 302(特許文献4)で言及されている。Wadhwa, M.,ら(J. Immunol. Methods 278 (2003) 1-17)(非特許文献1)は、生物学的治療によって誘導される望ましくない抗体の検出、測定および特徴づけの戦略を報告している。抗イディオタイプ抗体を製造する方法は、EP 1 917 854(特許文献5)で報告されている。
本明細書には、多特異性結合体の少なくとも1つの結合特異性によって特異的に結合され得る、遊離の、すなわち複合体化されていない結合パートナーの存在の検出および/または量の決定のための方法が報告されている。遊離結合パートナーの存在または量の決定前に、多特異性結合体によって特異的に結合された結合パートナーを、すなわち結合パートナー・多特異性結合体複合体を、サンプルから除去することが有利であることが見出された。本明細書に報告される方法にしたがい、多特異性結合体の除去は、多特異性結合体の1つの結合特異性に特異的に結合する単特異性結合体と共にサンプルをインキュベートすることによって達成され、ここで、単特異性結合体は、決定対象の結合パートナーに結合しない多特異性結合体の結合特異性に特異的に結合する(図2を参照のこと)。
- 結合パートナーおよび多特異性結合体を含むサンプルを、多特異性結合体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する単特異性結合体と共にインキュベートする工程、
を含む、方法、である。
- 結合パートナーおよび多特異性結合体を含むサンプルを、多特異性結合体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する単特異性結合体と共にインキュベートする工程、ならびに
- 多特異性結合体除去サンプル中の結合パートナーの量を決定する工程、
を含む。
- 結合パートナーおよび多特異性結合体を含むサンプルを、多特異性結合体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する単特異性結合体と共にインキュベートする工程、
- 遊離結合パートナーの存在または量の決定前に、単特異性結合体・多特異性結合体複合体をサンプルから除去する工程、ならびに
- 多特異性結合体除去サンプル中の結合パートナーの量を決定する工程、
を含む。
- 多特異性抗体、多特異性抗体に結合した抗原および遊離抗原を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートする工程、
を含む、方法、である。
- 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートする工程、ならびに
- 多特異性抗体除去サンプル中の抗原の量を決定する工程、
を含む。
- 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートする工程、
- 遊離抗原の存在または量の決定前に、抗イディオタイプ抗体・多特異性抗体複合体をサンプルから除去する工程、ならびに
- 多特異性抗体除去サンプル中の抗原の量を決定する工程、
を含む。
- 多特異性抗体、多特異性抗体に結合した抗原および遊離抗原を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートし、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、ならびに
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程、
を含む。
- 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートし、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程、ならびに
- 多特異性抗体除去サンプル中の抗原の量を決定する工程、
を含む。
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートし、捕捉抗体・抗原複合体を形成させる工程、および
- 形成された捕捉抗体・抗原複合体をサンプル中の抗原の量と相関させる工程、
を含む。
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートし、捕捉抗体・抗原複合体を形成させる工程、
- 捕捉抗体・抗原複合体をトレーサー抗体と共にインキュベートする工程であって、それによって、捕捉抗体およびトレーサー抗体が抗原上の重複しないエピトープに結合する、工程、および
- 形成された捕捉抗体・抗原・トレーサー抗体複合体をサンプル中の抗原の量と相関させる工程、
を含む。
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートし、捕捉抗体・抗原複合体を形成させる工程、
- 捕捉抗体・抗原複合体をトレーサー抗体と共にインキュベートする工程であって、それによって、捕捉抗体およびトレーサー抗体が抗原上の重複しないエピトープに結合する、工程、
- 捕捉抗体・抗原・トレーサー抗体複合体を、検出可能な標識を含む検出抗体と共にインキュベートする工程であって、それによって、検出抗体がトレーサー抗体の可変ドメインの外側のエピトープにおいてトレーサー抗体に特異的に結合する、工程、および
- 形成された捕捉抗体・抗原・トレーサー抗体複合体をサンプル中の抗原の量と相関させる工程、
を含む。
本明細書には、前臨床および臨床サンプル中の多特異性結合体、例えば2特異性抗体/薬物の「遊離結合パートナー」を検出するための、サンプルの前処理のインビトロ方法が報告されている。
- 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートし、それによって多特異性抗体をサンプルから取り除く工程、
を含む、方法、である。
- 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートし、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、ならびに
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程、
を含む。
- 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートし、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程、ならびに
- 多特異性抗体除去サンプル中の抗原の量を決定する工程、
を含む。
- 遊離結合パートナーの存在または量の決定前に、単特異性結合体・多特異性結合体複合体をサンプルから除去する工程、
を含む。
- 結合パートナーおよび多特異性結合体を含むサンプルを、多特異性結合体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する単特異性結合体と共にインキュベートする工程、
- 遊離結合パートナーの存在または量の決定前に、単特異性結合体・多特異性結合体複合体をサンプルから除去する工程、ならびに
- 多特異性結合体除去サンプル中の結合パートナーの量を決定する工程、
を含む。
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートし、捕捉抗体・抗原複合体を形成させる工程、および
- 形成された捕捉抗体・抗原複合体を、サンプル中の抗原の量と相関させる工程、
を含む。
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートし、捕捉抗体・抗原複合体を形成させる工程、
- 捕捉抗体・抗原複合体をトレーサー抗体と共にインキュベートする工程であって、それによって、捕捉抗体およびトレーサー抗体が抗原上の重複しないエピトープに結合する、工程、および
- 形成された捕捉抗体・抗原・トレーサー抗体複合体をサンプル中の抗原の量と相関させる工程、
を含む。
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートし、捕捉抗体・抗原複合体を形成させる工程、
- 捕捉抗体・抗原複合体をトレーサー抗体と共にインキュベートする工程であって、それによって、捕捉抗体およびトレーサー抗体が抗原上の重複しないエピトープに結合する、工程、
- 捕捉抗体・抗原・トレーサー抗体複合体を、検出可能な標識を含む検出抗体と共にインキュベートする工程であって、それによって、検出抗体がトレーサー抗体の可変ドメインの外側のエピトープにおいてトレーサー抗体に特異的に結合する、工程、および
- 形成された捕捉抗体・遊離抗原・トレーサー抗体複合体をサンプル中の抗原の量と相関させる工程、
を含む。
一定濃度の抗原Xを、第1の結合特異性で抗原Xに特異的に結合し第2の結合特異性で抗原Yに特異的に結合する漸増量の2特異性モノクローナル抗体(抗X/Y抗体)と共に、室温で1時間インキュベートする。その後、このサンプルを、除去工程における陽性対照として使用する。
抗X/Y抗体に結合した抗原Xの除去のために、抗原Yに特異的に結合する結合特異性に対するビオチニル化抗イディオタイプ抗体(抗id Y抗体-BI)を、ストレプトアビジンコーティングされた磁気ビーズ(SAビーズ)に約10μg/ml結合させる。各サンプルにつき600μlのSAビーズを、磁気分離装置を用いて洗浄しそして上清から分離する。600μlのビオチニル化抗id Y抗体含有溶液をSAビーズと混合し、そして室温で約1時間インキュベートする。過剰な未結合の抗イディオタイプ抗体を、磁気分離装置を用いた3回のビーズ洗浄によって取り除いた。その後、抗イディオタイプ抗体でコーティングされたビーズを、抗X/Y抗体および抗原Xの複合体を含む約250μlのサンプルと共にインキュベートした。この混合物を、室温で約1時間、振盪しながらインキュベートする。インキュベート後、ビーズを磁気分離装置によってサンプルから分離する。上清を、ELISAにおける「遊離」抗原Xの分析(例えば、実施例2を参照のこと)に利用する。残ったビーズをELECSYS容器に移し、そしてビーズに結合した抗原X(2特異性抗体に結合した抗原X)を、ELECSYS 2010分析装置をユーザーガイドの標準操作手順にしたがい用いて分析する(例えば、実施例3を参照のこと)。
抗X/Y抗体に結合した抗原Yの除去のために、抗原Xに特異的に結合する結合特異性に対するビオチニル化抗イディオタイプ抗体(抗id X抗体-BI)を、ストレプトアビジンコーティングされた磁気ビーズ(SAビーズ)に約10μg/ml結合させる。各サンプルにつき600μlのSAビーズを、磁気分離装置を用いて洗浄しそして上清から分離する。600μlのビオチニル化抗id X抗体含有溶液をSAビーズと混合し、そして室温で約1時間インキュベートする。過剰な未結合の抗イディオタイプ抗体を、磁気分離装置を用いた3回のビーズ洗浄によって取り除いた。その後、抗イディオタイプ抗体でコーティングされたビーズを、抗X/Y抗体および抗原Yの複合体を含む約250μlのサンプルと共にインキュベートした。この混合物を、室温で約1時間、振盪しながらインキュベートする。インキュベート後、ビーズを磁気分離装置によってサンプルから分離する。上清を、ELISAにおける「遊離」抗原Yの分析(例えば、実施例2を参照のこと)に利用する。残ったビーズをELECSYS容器に移し、そしてビーズに結合した抗原Y(2特異性抗体に結合した抗原Y)を、ELECSYS 2010分析装置をユーザーガイドの標準操作手順にしたがい用いて分析する(例えば、実施例3を参照のこと)。
1. 多特異性結合体の第1の結合特異性によって特異的に結合され得る結合パートナーの存在および/または量のインビトロ決定方法であって、多特異性結合体に結合された結合パートナーが、結合パートナーの検出前に、多特異性結合体の第2の結合特異性に特異的に結合する単特異性結合体と共にサンプルをインキュベートすることによって、除去(deplete)される、方法。
2. 免疫アッセイを用いる、サンプル中の多特異性結合体の結合パートナーの存在および/または量の免疫学的決定方法であって、多特異性結合体が、結合パートナーの決定前にサンプルから除去される、方法。
3. 多特異性結合体の結合パートナーの存在および/または量の決定のためのインビトロ方法であって、結合パートナーが、多特異性結合体の第1の結合特異性によって特異的に結合され得るものであり、
- 結合パートナーおよび多特異性結合体を含むサンプルを、多特異性結合体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する単特異性結合体と共にインキュベートする工程
を含む、方法。
4. サンプル中の多特異性抗体の抗原の存在および/または量の決定のためのインビトロ方法であって、検出される抗原が、多特異性抗体の第1の結合特異性によって特異的に結合され得るものであり、
- 多特異性抗体、多特異性抗体に結合した抗原および遊離抗原を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートする工程
を含む、方法。
5. 第2の工程として、
- 遊離結合パートナーの存在および/または量の決定前に、単特異性結合体・多特異性結合体複合体をサンプルから除去する工程、
をさらに含む点を特徴とする、項目3〜4のいずれかに記載の方法。
6. 最終工程として、
- 多特異性結合体除去サンプル中の結合パートナーの量を決定する工程
を含む点を特徴とする、項目3〜5のいずれか一項記載の方法。
7. - 結合パートナーおよび多特異性結合体を含むサンプルを、多特異性結合体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する単特異性結合体と共にインキュベートする工程、
- 遊離結合パートナーの存在または量の決定前に、単特異性結合体・多特異性結合体複合体をサンプルから除去する工程、ならびに
- 多特異性結合体除去サンプル中の結合パートナーの量を決定する工程
を含む点を特徴とする、項目2〜6のいずれか一項記載の方法。
8. 結合パートナーが、抗原、標的および分析物を含む群から選択される点を特徴とする、項目1〜7のいずれか一項記載の方法。
9. 結合パートナーが、複合体化していない結合パートナーまたは遊離結合パートナーである点を特徴とする、項目1〜8のいずれか一項記載の方法。
10. 結合特異性が、結合部位または抗体重鎖可変ドメインと抗体軽鎖可変ドメインとの対である点を特徴とする、項目1〜9のいずれか一項記載の方法。
11. 多特異性結合体が、抗体、抗体もしくは抗体フラグメントおよび非抗体ポリペプチドを含む融合ポリペプチド、抗体もしくは抗体フラグメントおよび可溶性受容体を含む融合ポリペプチド、または抗体もしくは抗体フラグメントおよびペプチド性結合分子を含む融合ポリペプチドから選択される点を特徴とする、項目1〜10のいずれか一項記載の方法。
12. 多特異性結合体が抗体である点を特徴とする、項目1〜11のいずれか一項記載の方法。
13. 抗原の存在および/または量の決定が、
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートして、捕捉抗体・抗原複合体を形成させる工程、および
- 形成された捕捉抗体・抗原複合体を、サンプル中の抗原の量と相関させる工程
を含む点を特徴とする、項目8〜12のいずれか一項記載の方法。
14. 抗原の量の決定が、
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートして、捕捉抗体・抗原複合体を形成させる工程、
- 捕捉抗体・抗原複合体をトレーサー抗体と共にインキュベートする工程であって、それによって、捕捉抗体およびトレーサー抗体が抗原上の重複しないエピトープに結合する、工程、および
- 形成された捕捉抗体・抗原・トレーサー抗体複合体をサンプル中の抗原の量と相関させる工程
を含む点を特徴とする、項目8〜13のいずれか一項記載の方法。
15. 抗原の量の決定が、
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートして、捕捉抗体・抗原複合体を形成させる工程、
- 捕捉抗体・抗原複合体をトレーサー抗体と共にインキュベートする工程であって、それによって、捕捉抗体およびトレーサー抗体が抗原上の重複しないエピトープに結合する、工程、
- 捕捉抗体・抗原・トレーサー抗体複合体を、検出可能な標識を含む検出抗体と共にインキュベートする工程であって、それによって、検出抗体がトレーサー抗体の可変ドメインの外側のエピトープにおいてトレーサー抗体に特異的に結合する、工程、および
- 形成された捕捉抗体・抗原・トレーサー抗体複合体をサンプル中の抗原の量と相関させる工程
を含む点を特徴とする、項目8〜14のいずれか一項記載の方法。
16. 抗体が、2特異性抗体または3特異性抗体または4特異性抗体または5特異性抗体または6特異性抗体である点を特徴とする、項目11〜15のいずれか一項記載の方法。
17. 抗体が2特異性抗体である点を特徴とする、項目11〜16のいずれか一項記載の方法。
18. 抗体が、第1の抗原または抗原上の第1のエピトープに特異的に結合する第1の結合特異性を有し、かつ第2の抗原または抗原上の第2のエピトープに特異的に結合する第2の結合特異性を有する2特異性抗体である点を特徴とする、項目11〜17のいずれか一項記載の方法。
19. 単特異性結合体が抗イディオタイプ抗体である点を特徴とする、項目1〜18のいずれか一項記載の方法。
20. - 多特異性抗体、多特異性抗体に結合した抗原および遊離抗原を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートして、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、ならびに
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程
を含む点を特徴とする、項目19記載の方法。
21. - 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートして、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程、ならびに
- 多特異性抗体除去サンプル中の抗原の量を決定する工程
を含む点を特徴とする、項目19〜20のいずれかに記載の方法。
22. 抗イディオタイプ抗体・多特異性抗体複合体が、抗イディオタイプ抗体・多特異性抗体複合体および抗イディオタイプ抗体・多特異性抗体・抗原複合体の混合物である点を特徴とする、項目20〜21のいずれかに記載の方法。
23. 抗イディオタイプ抗体が、多特異性抗体の第2の結合特異性に対して105 l/mol*sまたはそれ以上の会合定数kaを有する点を特徴とする、項目19〜22のいずれか一項記載の方法。
24. 抗イディオタイプ抗体が、多特異性抗体の第2の結合特異性に対する結合に関して5*10-8 mol/lまたはそれ以下のKD値を有する点を特徴とする、項目19〜23のいずれか一項記載の方法。
25. 抗イディオタイプ抗体とインキュベートすることが、約10分間〜約36時間である点を特徴とする、項目19〜24のいずれか一項記載の方法。
26. サンプルが、約2μg/ml〜約15μg/mlの多特異性抗体濃度に調節される点を特徴とする、項目1〜25のいずれか一項記載の方法。
27. サンプルが、約1ng/ml〜約250ng/mlの総抗原濃度に調節される点を特徴とする、項目1〜26のいずれか一項記載の方法。
28. 抗イディオタイプ抗体が、固相に結合またはコンジュゲートされる点を特徴とする、項目19〜27のいずれか一項記載の方法。
29. 抗イディオタイプ抗体が、特異的結合対を介してコンジュゲート(固定化)される点を特徴とする、項目19〜28のいずれか一項記載の方法。
30. 結合対(第1の要素/第2の要素)が、ストレプトアビジンまたはアビジン/ビオチン、抗体/抗原、レクチン/多糖類、ステロイド/ステロイド結合タンパク質、ホルモン/ホルモン受容体、酵素/基質、IgG/プロテインAおよび/またはGから選択される点を特徴とする、項目29記載の方法。
31. 抗イディオタイプ抗体がビオチンにコンジュゲートされ、かつ固定化が、固定化されたアビジンまたはストレプトアビジンを介して行われる点を特徴とする、項目29〜30のいずれかに記載の方法。
32. 抗イディオタイプ抗体がビオチニル化され、かつ固相がストレプトアビジンコーティングされる点を特徴とする、項目19〜31のいずれか一項記載の方法。
33. 抗イディオタイプ抗体が、多特異性結合体に対するビオチニル化抗イディオタイプ抗体であり、かつストレプトアビジンを介して固相にコンジュゲートされる点を特徴とする、項目19〜31のいずれか一項記載の方法。
34. 固相が、ストレプトアビジンコーティングされた常磁性ビーズまたはストレプトアビジンコーティングされたセファロースビーズである点を特徴とする、項目28〜33のいずれか一項記載の方法。
35. 抗イディオタイプ抗体が、固相にコンジュゲートされる抗体部位が異なる少なくとも2つの抗イディオタイプ抗体を含む混合物である点を特徴とする、項目19〜34のいずれか一項記載の方法。
36. 抗イディオタイプ抗体混合物が、少なくとも2つの異なるアミノ基を介して固相にコンジュゲートされた抗イディオタイプ抗体を含む点を特徴とする、項目19〜35のいずれか一項記載の方法。
37. 抗イディオタイプ抗体とそのコンジュゲートパートナーとのコンジュゲートが、薬物抗体のアミノ酸骨格のN末端および/もしくはε-アミノ基(リシン)、および/もしくは異なるリシンのε-アミノ基、カルボキシ官能基、スルフヒドリル官能基、ヒドロキシル官能基および/もしくはフェノール官能基、ならびに/または薬物抗体の炭水化物構造の糖アルコール基を介した化学結合によって行われる点を特徴とする、項目28〜36のいずれか一項記載の方法。
38. 抗イディオタイプ抗体が、受動的吸着によって固相にコンジュゲートされる点を特徴とする、項目28〜37のいずれか一項記載の方法。
39. サンプルが多特異性抗体、遊離抗原および多特異性抗体・抗原複合体を含み、かつ検出が多特異性抗体の遊離抗原の検出である点を特徴とする、項目1〜38のいずれか一項記載の方法。
40. 多特異性抗体の第2の結合特異性に結合した抗原をサンプルから除去するための、多特異性抗体の第1の結合特異性に特異的に結合する抗イディオタイプ抗体の使用。
実施例1
薬物に結合した標的(抗体に結合した抗原)の除去 - 2特異性薬物分子の場合
サンプルからの抗ANG2/VEGF抗体・VEGF複合体の除去
A)抗ANG2/VEGF抗体およびVEGFの複合体の構築
一定濃度のVEGFを、室温で1時間、第1の結合特異性でANG2に特異的に結合し第2の結合特異性でVEGFに特異的に結合する漸増量の2特異性抗体(抗ANG2/VEGF抗体)と共にインキュベートした。その後、これらのサンプルを、除去工程のための/における陽性対照として使用した。
抗ANG2/VEGF抗体に結合したVEGFの除去のために、ANG2に特異的に結合する結合特異性に対するビオチニル化抗イディオタイプ抗体(抗id ANG2抗体-BI)を、10μg/mlのストレプトアビジンコーティングされた磁気ビーズ(SAビーズ)に結合させた。各サンプルにつき600μlのSAビーズを、磁気分離装置を用いて洗浄しそして上清から分離した。約600μlの抗id ANG2抗体含有溶液をSAビーズと混合し、そして室温で1時間インキュベートした。過剰な未結合の抗体を、磁気分離装置を用いた3回のビーズ洗浄によって取り除いた。その後、抗体でコーティングされたビーズを、抗ANG2/VEGF抗体およびVEGFの複合体を含む250μlのサンプルと共にインキュベートした。サンプルを、室温で1時間、振盪しながらインキュベートした。インキュベート後、ビーズを磁気分離装置によってサンプルから分離した。上清を、ELISAを用いた「遊離」VEGFの分析に利用した(実施例2を参照のこと)。残ったビーズをELECSYS容器に移し、そしてビーズに結合したVEGF(抗ANG2/VEGF抗体に結合したVEGF)を、ELECSYS 2010分析装置を製造元の指示にしたがい用いて分析した(実施例3を参照のこと)。
i)ポリクローナル抗id ANG2抗体Rb-IgG-BI、
ii)モノクローナル抗id ANG2抗体M-2.3.55-BI。
A)抗HER3/c-MET抗体およびc-METの複合体の構築
一定濃度のc-METを、室温で1時間、第1の結合特異性でHER3に特異的に結合し第2の結合特異性でc-METに特異的に結合する漸増量の2特異性抗体(抗HER3/c-MET抗体)と共にインキュベートした。その後、このサンプルを、抗HER3/c-MET抗体・c-MET複合体の除去のためにビーズで処理した。
抗HER3/c-MET抗体に結合したc-METの除去のために、HER3に特異的に結合する結合特異性に対するビオチニル化抗イディオタイプ抗体(抗id HER3抗体-BI)を、約10μg/mlのストレプトアビジンコーティングされた磁気ビーズ(SAビーズ)に結合させた。各サンプルにつき600μlのSAビーズを、磁気分離装置を用いて洗浄しそして上清から分離した。約600μlの抗id HER3抗体M1.1.10-BIを含む溶液をSAビーズと混合し、そして室温で1時間インキュベートした。過剰な未結合の抗体を、磁気分離装置を用いた3回のビーズ洗浄によって取り除いた。その後、抗体でコーティングされたビーズを、抗HER3/c-MET抗体およびc-METの複合体を含む250μlのサンプルと共にインキュベートした。サンプルを、室温で1時間、振盪しながらインキュベートした。インキュベート後、ビーズを磁気分離装置によってサンプルから分離した。上清を、ELISAにおける「遊離」c-METの分析に利用した。
i)モノクローナル抗id HER3抗体M-1.1.10-IgG、
ii)モノクローナル抗id HER3抗体M-2.11.123-IgG、
iii)モノクローナル抗id HER3抗体M-2.5.45-IgG、
iv)モノクローナル抗id HER3抗体M-2.9.55-IgG。
酵素連結免疫吸着アッセイ
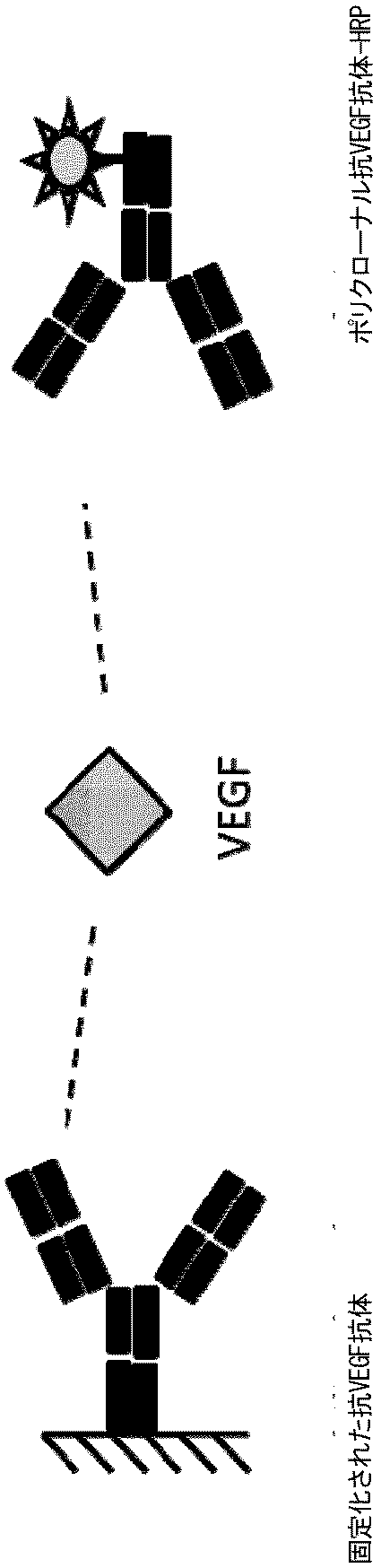
VEGFの検出のためのELISA
市販のサンドイッチ免疫アッセイを、製造元の指示にしたがい使用した(R+D Systems Cat# DVE00)。
市販のサンドイッチ免疫アッセイを使用した(R+D Systems Cat# DY358)。
抗原Xおよび抗X/Y抗体の結合複合体の検出のためのELECSYS
除去工程(実施例1を参照のこと)で使用したビーズを、未結合物質を取り除くために、磁気分離装置を用いてELECSYSアッセイ緩衝液中で3回洗浄および分離した。各サンプルからのビーズを、600μlのELECSYSアッセイ緩衝液に溶解させ、これを分析に利用した。
除去ツールとしての抗イディオタイプ抗体の評価
実施例1に記載された方法にしたがい、異なる速度定数を有する異なる抗イディオタイプ抗体を、抗HER3/c-MET抗体およびその複合体の除去のために使用した。
すべての実験を、BIAcore(登録商標)T100機器においてCM5チップを用いて行った。チップのコーティングは、標準的なアミンカップリングにより行った。それ以外のことが示されていない限り、すべてのインキュベートを、HBS緩衝液(HEPES、NaCl、pH 7.4)中、25℃で行った。飽和量のポリクローナルヤギ抗マウスFcガンマ抗体を、アミンカップリングによりCM5チップの1つのフローセルに固定化した。その後、HER3に特異的に結合する、抗HER3/c-MET抗体の結合特異性に対する異なるモノクローナルマウス抗体を、30μl/分の流速で60秒間注入し、そして抗マウスFc抗体によって結合させた。すべての動物血清を、HBS緩衝液で希釈した。結合(会合)は、抗HER3/c-MET抗体を30μl/分の流速で60秒間注入することによって分析した。解離は、チップ表面をHBS緩衝液で180秒間洗浄することによって測定した。BIAcore(登録商標)のBIAevaluationソフトウェアを用いて、解離定数値(= ka; kd; KD)を1:1ラングミュアフィッティングモデルにより計算した。
抗HER3/c-MET抗体に結合したc-METを、実施例1に記載されるようにして抗イディオタイプ抗体を用いて除去した。上清を、実施例2に記載されるようにおいてc-MET ELISAにおいて測定した。
ヒト血清および緩衝液中の薬物に結合したVEGFの除去
実施例1にしたがい、抗ANG2/VEGF抗体を10/5/1/0.5/0.25および0μg/mlに希釈し、そして50 ng/mlの一定濃度のVEGFと共にインキュベートした。希釈物は、2つの異なるマトリックス:
・Low Cross緩衝液(Candor Bioscience GmbH、#100500)
・Human Pool Serum(Trina、NHS Baseマトリックス)
で生成した。
抗HER3/c-MET抗体を用いて示される除去に対する遊離抗原濃度の影響の評価
実施例1にしたがい、抗HER3/c-MET抗体に結合したc-METの除去を、様々な濃度のc-METを含むサンプルにおいて行った。3つの異なる濃度のc-MET(5、10、50 ng/ml)を、漸増濃度の抗HER3/c-MET抗体と共に室温でインキュベートした。インキュベートは、1時間および一晩行った。その後、実施例1に記載されるようにして、これらのサンプルから抗HER3/c-MET抗体・c-MET複合体を除去した。
除去に対するVEGFの影響
2特異性抗ANG2/VEGF抗体を、100μg/mlとなるよう、500μlのカニクイザルプール血漿に添加した。この添加された血漿を各々100μlの5つのアリコートに分割した。各アリコートに、0 ng/ml〜100 ng/mlの範囲の異なる量のVEGFを添加した。
Claims (14)
- サンプル中の多特異性抗体の抗原の存在および/または量の決定のためのインビトロ方法であって、検出される抗原が、多特異性抗体の第1の結合特異性によって特異的に結合され得るものであり、
- 多特異性抗体、多特異性抗体に結合した抗原および遊離抗原を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートする工程;
- 遊離抗原の存在および/または量の決定前に、抗イディタイプ抗体―多特異性抗体複合体をサンプルから除去する工程;及び、
- 多特異性抗体除去サンプル中の抗原の量を決定する工程
を含み、検出される抗原が、複合体化していない抗原または遊離抗原である点を特徴とする、前記方法。
- 抗原の量の決定が、
- 多特異性抗体除去サンプルを、抗原に特異的に結合する捕捉抗体と共にインキュベートして、捕捉抗体・抗原複合体を形成させる工程、
- 捕捉抗体・抗原複合体をトレーサー抗体と共にインキュベートする工程であって、それによって、捕捉抗体およびトレーサー抗体が抗原上の重複しないエピトープに結合する、工程、
- 捕捉抗体・抗原・トレーサー抗体複合体を、検出可能な標識を含む検出抗体と共にインキュベートする工程であって、それによって、検出抗体がトレーサー抗体の可変ドメインの外側のエピトープにおいてトレーサー抗体に特異的に結合する、工程、および
- 形成された捕捉抗体・抗原・トレーサー抗体複合体をサンプル中の抗原の量と相関させる工程
を含む点を特徴とする、請求項1記載の方法。 - 前記多特異性抗体が、第1の抗原または抗原上の第1のエピトープに特異的に結合する第1の結合特異性を有し、かつ第2の抗原または抗原上の第2のエピトープに特異的に結合する第2の結合特異性を有する2特異性抗体である点を特徴とする、請求項2記載の方法。
- - 多特異性抗体、多特異性抗体に結合した抗原および遊離抗原を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートして、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、ならびに
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程
を含む点を特徴とする、請求項1〜3のいずれか一項記載の方法。 - - 抗原および多特異性抗体を含むサンプルを、多特異性抗体の第1の結合特異性とは異なる第2の結合特異性に特異的に結合する抗イディオタイプ抗体と共にインキュベートして、抗イディオタイプ抗体・多特異性抗体複合体を形成させる工程、
- 抗イディオタイプ抗体・多特異性抗体複合体をサンプルから取り除く工程、ならびに
- 多特異性抗体除去サンプル中の抗原の量を決定する工程
を含む点を特徴とする、請求項1〜4のいずれか一項に記載の方法。 - 抗イディオタイプ抗体・多特異性抗体複合体が、抗イディオタイプ抗体・多特異性抗体複合体および抗イディオタイプ抗体・多特異性抗体・抗原複合体の混合物である点を特徴とする、請求項4または5記載の方法。
- 抗イディオタイプ抗体が、多特異性抗体の第2の結合特異性に対して105 l/mol*sまたはそれ以上の会合定数kaを有する点を特徴とする、請求項1〜6のいずれか一項記載の方法。
- 抗イディオタイプ抗体が、多特異性抗体の第2の結合特異性に対する結合に関して5*10-8 mol/lまたはそれ以下のKD値を有する点を特徴とする、請求項1〜7のいずれか一項記載の方法。
- 抗イディオタイプ抗体とインキュベートすることが、約10分間〜約36時間である点を特徴とする、請求項1〜8のいずれか一項記載の方法。
- サンプルが、約2μg/ml〜約15μg/mlの多特異性抗体濃度に調節される点を特徴とする、請求項1〜9のいずれか一項記載の方法。
- サンプルが、約1ng/ml〜約250ng/mlの総抗原濃度に調節される点を特徴とする、請求項1〜10のいずれか一項記載の方法。
- 抗イディオタイプ抗体が、固相に結合またはコンジュゲートされる点を特徴とする、請求項1〜11のいずれか一項記載の方法。
- サンプルが多特異性抗体、遊離抗原および多特異性抗体・抗原複合体を含み、かつ検出が多特異性抗体の遊離抗原の検出である点を特徴とする、請求項1〜12のいずれか一項記載の方法。
- 請求項1〜13のいずれか一項記載の方法において、多特異性抗体の第2の結合特異性に結合した抗原をサンプルから除去するための、多特異性抗体の第1の結合特異性に特異的に結合する抗イディオタイプ抗体の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP11194350.2 | 2011-12-19 | ||
| EP11194350 | 2011-12-19 | ||
| PCT/EP2012/075991 WO2013092611A2 (en) | 2011-12-19 | 2012-12-18 | Method for the detection of free binding partner of a multispecific binder |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015502547A JP2015502547A (ja) | 2015-01-22 |
| JP2015502547A5 JP2015502547A5 (ja) | 2016-02-04 |
| JP6203747B2 true JP6203747B2 (ja) | 2017-09-27 |
Family
ID=47429825
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014547933A Active JP6203747B2 (ja) | 2011-12-19 | 2012-12-18 | 多特異性結合体の遊離結合パートナーの検出方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US9671394B2 (ja) |
| EP (1) | EP2795335B1 (ja) |
| JP (1) | JP6203747B2 (ja) |
| KR (1) | KR20140099277A (ja) |
| CN (1) | CN104040350B (ja) |
| BR (1) | BR112014011535A2 (ja) |
| CA (1) | CA2853917A1 (ja) |
| MX (1) | MX349003B (ja) |
| RU (1) | RU2633488C2 (ja) |
| WO (1) | WO2013092611A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017223710A (ja) * | 2012-02-01 | 2017-12-21 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性結合物の結合パートナーを検出するための方法 |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8956859B1 (en) | 2010-08-13 | 2015-02-17 | Aviex Technologies Llc | Compositions and methods for determining successful immunization by one or more vaccines |
| JP6226976B2 (ja) | 2012-07-13 | 2017-11-08 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性結合物を検出するための方法 |
| CA2926306C (en) * | 2013-11-05 | 2022-12-06 | F. Hoffmann-La Roche Ag | A method for determining the total amount and/or concentration of an analyte in a sample |
| EP3119805A1 (en) * | 2014-03-20 | 2017-01-25 | Wellstat Diagnostics, LLC | Antibodies and methods for the detection of cell death |
| ES2761427T3 (es) * | 2014-12-18 | 2020-05-19 | Hoffmann La Roche | Procedimientos para reducir interferencias |
| WO2019018828A1 (en) * | 2017-07-20 | 2019-01-24 | Cytomx Therapeutics, Inc. | METHODS OF QUALITATIVE AND / OR QUANTITATIVE ANALYSIS OF ACTIVATABLE ANTIBODY PROPERTIES AND USES THEREOF |
| CN109358192B (zh) * | 2018-02-08 | 2020-05-12 | 中国科学院上海药物研究所 | 一种去除抗药抗体检测样品中游离药物的装置和方法、该装置的制备方法及应用 |
| JP7370322B2 (ja) | 2018-06-04 | 2023-10-27 | 中外製薬株式会社 | 複合体を検出する方法 |
| EP3969907B1 (en) * | 2019-05-13 | 2025-09-24 | F. Hoffmann-La Roche AG | Interference-suppressed pharmacokinetic immunoassay |
| US20200363400A1 (en) * | 2019-05-13 | 2020-11-19 | Regeneron Pharmaceuticals, Inc. | Competitive Ligand Binding Assays |
| CN117805397A (zh) * | 2024-02-29 | 2024-04-02 | 军科正源(北京)药物研究有限责任公司 | 检测游离vegf的方法 |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS56128722A (en) * | 1980-03-14 | 1981-10-08 | Terumo Corp | Removal of antiacetylcholinereceptor antibody and device therefor |
| US5219730A (en) | 1982-09-28 | 1993-06-15 | New York University | Idiotype-anti-idiotype immunoassay |
| US4828981A (en) | 1983-08-24 | 1989-05-09 | Synbiotics Corporation | Immunoassays for determining Dirofilaria immitis infection using antiidiotype monoclonal antibody reagents |
| EP0170302A1 (fr) | 1984-06-27 | 1986-02-05 | l'Association internationale à but scientifique, dite: Institut international de pathologie cellulaire et moléculaire | Procédé de dosage immunologique d'une substance dans un échantillon liquide au moyen d'anticorps anti-idiotypiques |
| US4699880A (en) * | 1984-09-25 | 1987-10-13 | Immunomedics, Inc. | Method of producing monoclonal anti-idiotype antibody |
| US5238808A (en) | 1984-10-31 | 1993-08-24 | Igen, Inc. | Luminescent metal chelate labels and means for detection |
| WO1987002778A1 (en) | 1985-10-22 | 1987-05-07 | Cooper-Lipotech | Solid-phase liposome immunoassay system |
| IL92164A (en) | 1988-11-03 | 1996-01-19 | Igen Inc | Particle-based electrochemiluminescence assay |
| US5068088A (en) | 1988-11-03 | 1991-11-26 | Igen, Inc. | Method and apparatus for conducting electrochemiluminescent measurements |
| IL100866A (en) | 1991-02-06 | 1995-10-31 | Igen Inc | Method and apparatus for magnetic microparticulate based luminescence assay including plurality of magnets |
| AU673190B2 (en) | 1992-07-13 | 1996-10-31 | Bionebraska, Inc. | Method for modification of recombinant polypeptides |
| GB9316369D0 (en) * | 1993-08-06 | 1993-09-22 | Surface Active Ltd | Diagnostic method |
| US6753189B1 (en) * | 1998-06-04 | 2004-06-22 | Mizuho Medy Co., Ltd. | Detection apparatus and method for the same |
| JPH11352129A (ja) * | 1998-06-04 | 1999-12-24 | Mizuho Medeii:Kk | 検出装置及び検出方法 |
| KR100749982B1 (ko) * | 1999-11-16 | 2007-08-16 | 제넨테크, 인크. | 혈관 내피 성장 인자용 elisa |
| EP1288308A1 (en) * | 2001-08-28 | 2003-03-05 | Roche Diagnostics GmbH | A method for the determination of multiple analytes |
| GB0320459D0 (en) * | 2003-09-01 | 2003-10-01 | Selective Antibodies Ltd | Assay methods and materials |
| DE102004052729A1 (de) * | 2004-10-30 | 2006-05-04 | Roche Diagnostics Gmbh | Immunkomplex-spezifsicher Antikörper zur Reduktion des Nullwerts beim Nachweis von Antigen-spezifisch gebundenen Antikörpern einer bestimmten Immunglobulinklasse in Array-Testformaten |
| CA2597996A1 (en) * | 2005-03-08 | 2006-09-14 | Tanox, Inc. | Methods for determining the bivalency of protein and antibody therapeutics |
| AR063125A1 (es) * | 2006-10-04 | 2008-12-30 | Genentech Inc | Ensayo elisa para la deteccion de vegf |
| EP1917854A1 (en) | 2006-11-06 | 2008-05-07 | F. Hoffmann-La Roche Ag | Method for producing anti idiotypic antibodies |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| US8242247B2 (en) | 2007-12-21 | 2012-08-14 | Hoffmann-La Roche Inc. | Bivalent, bispecific antibodies |
| US8227577B2 (en) | 2007-12-21 | 2012-07-24 | Hoffman-La Roche Inc. | Bivalent, bispecific antibodies |
| US9266967B2 (en) | 2007-12-21 | 2016-02-23 | Hoffmann-La Roche, Inc. | Bivalent, bispecific antibodies |
| KR101431318B1 (ko) | 2009-04-02 | 2014-08-20 | 로슈 글리카트 아게 | 전장 항체 및 단일쇄 fab 단편을 포함하는 다중특이성 항체 |
| JP5616428B2 (ja) | 2009-04-07 | 2014-10-29 | ロシュ グリクアート アクチェンゲゼルシャフト | 三価の二重特異性抗体 |
| PE20120540A1 (es) | 2009-05-27 | 2012-05-09 | Hoffmann La Roche | Anticuerpos triespecificos o tetraespecificos |
| US9676845B2 (en) | 2009-06-16 | 2017-06-13 | Hoffmann-La Roche, Inc. | Bispecific antigen binding proteins |
| US8703132B2 (en) | 2009-06-18 | 2014-04-22 | Hoffmann-La Roche, Inc. | Bispecific, tetravalent antigen binding proteins |
| CN102207054B (zh) | 2010-03-31 | 2013-03-13 | 比亚迪股份有限公司 | 一种混合动力车的爆震控制系统及方法 |
| CN102207504A (zh) * | 2011-03-23 | 2011-10-05 | 北京华创远航科技有限公司 | 一种酶联检测试剂盒及其制备方法 |
-
2012
- 2012-12-18 EP EP12806045.6A patent/EP2795335B1/en active Active
- 2012-12-18 CN CN201280063032.5A patent/CN104040350B/zh active Active
- 2012-12-18 BR BR112014011535A patent/BR112014011535A2/pt not_active Application Discontinuation
- 2012-12-18 KR KR1020147016700A patent/KR20140099277A/ko not_active Ceased
- 2012-12-18 JP JP2014547933A patent/JP6203747B2/ja active Active
- 2012-12-18 MX MX2014007095A patent/MX349003B/es active IP Right Grant
- 2012-12-18 RU RU2014128510A patent/RU2633488C2/ru not_active IP Right Cessation
- 2012-12-18 CA CA2853917A patent/CA2853917A1/en not_active Abandoned
- 2012-12-18 WO PCT/EP2012/075991 patent/WO2013092611A2/en not_active Ceased
-
2014
- 2014-06-18 US US14/308,539 patent/US9671394B2/en active Active
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017223710A (ja) * | 2012-02-01 | 2017-12-21 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性結合物の結合パートナーを検出するための方法 |
| US10761097B2 (en) | 2012-02-01 | 2020-09-01 | Hoffmann-La Roche Inc. | Method for the detection of a binding partner of a multispecific binder |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2015502547A (ja) | 2015-01-22 |
| MX349003B (es) | 2017-07-06 |
| BR112014011535A2 (pt) | 2017-05-09 |
| WO2013092611A3 (en) | 2013-10-17 |
| EP2795335A2 (en) | 2014-10-29 |
| CN104040350B (zh) | 2016-05-18 |
| HK1201920A1 (zh) | 2015-09-11 |
| US9671394B2 (en) | 2017-06-06 |
| RU2633488C2 (ru) | 2017-10-12 |
| RU2014128510A (ru) | 2016-02-10 |
| CN104040350A (zh) | 2014-09-10 |
| US20150072359A1 (en) | 2015-03-12 |
| CA2853917A1 (en) | 2013-06-27 |
| WO2013092611A2 (en) | 2013-06-27 |
| MX2014007095A (es) | 2014-07-22 |
| EP2795335B1 (en) | 2017-09-06 |
| KR20140099277A (ko) | 2014-08-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6203747B2 (ja) | 多特異性結合体の遊離結合パートナーの検出方法 | |
| JP6678792B2 (ja) | 多重特異性結合物の結合パートナーを検出するための方法 | |
| CN104471397B (zh) | 用于检测多特异性结合物的方法 | |
| US11340234B2 (en) | Method for the determination of anti-drug antibodies against an effector function suppressed human or humanized drug antibody | |
| HK1230718A1 (en) | Method for the detection of a binding partner of a multispecific binder | |
| HK1230718A (en) | Method for the detection of a binding partner of a multispecific binder | |
| HK1230718B (zh) | 用於检测多特异性结合物的结合搭档的方法 | |
| HK1202921B (en) | Method for the detection of a binding partner of a multispecific binder | |
| HK1201920B (en) | Method for the detection of free binding partner of a multispecific binder |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150318 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151208 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20151208 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20161017 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161024 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170123 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170628 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170803 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170823 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170830 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6203747 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |