JP6100697B2 - グルカゴン受容体に対するヒト抗体 - Google Patents
グルカゴン受容体に対するヒト抗体 Download PDFInfo
- Publication number
- JP6100697B2 JP6100697B2 JP2013541008A JP2013541008A JP6100697B2 JP 6100697 B2 JP6100697 B2 JP 6100697B2 JP 2013541008 A JP2013541008 A JP 2013541008A JP 2013541008 A JP2013541008 A JP 2013541008A JP 6100697 B2 JP6100697 B2 JP 6100697B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- gcgr
- antigen
- seq
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2869—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against hormone receptors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/12—Ophthalmic agents for cataracts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/40—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against enzymes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/64—General methods for preparing the vector, for introducing it into the cell or for selecting the vector-containing host
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/70—Vectors or expression systems specially adapted for E. coli
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/31—Combination therapy
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Diabetes (AREA)
- Microbiology (AREA)
- Endocrinology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Mycology (AREA)
- Neurology (AREA)
- Emergency Medicine (AREA)
- Cell Biology (AREA)
- Ophthalmology & Optometry (AREA)
- Virology (AREA)
Description
(a)配列番号8、24、40、56、76、96、116、および136からなる群から選択されるアミノ酸配列を有するHCDR3ドメインと;
(b)配列番号16、32、48、64、84、104、124、および144からなる群から選択されるアミノ酸配列を有するLCDR3ドメインと
を含む。
(c)配列番号4、20、36、52、72、92、112、および132からなる群から選択されるアミノ酸配列を有するHCDR1ドメインと;
(d)配列番号6、22、38、54、74、94、114、および134からなる群から選択されるアミノ酸配列を有するHCDR2ドメインと;
(e)配列番号12、28、44、60、80、100、120、および140からなる群から選択されるアミノ酸配列を有するLCDR1ドメインと;
(f)配列番号14、30、46、62、82、102、122、および142からなる群から選択されるアミノ酸配列を有するLCDR2ドメインと
をさらに含む。
本明細書ではまた「GCGR」とも称する「グルカゴン受容体」は、Gタンパク質共役受容体クラス2ファミリーに属し、アミノ末端の長い細胞外ドメイン(N末端の細胞外ドメインをコードするDNAについては配列番号158を参照し、N末端の細胞外ドメインのアミノ酸配列については配列番号159を参照されたい)、7回膜貫通セグメント、および細胞内C末端ドメインからなる(Jelinekら、Science 259: 1614〜1616頁(1993)、Segreら、Trends Endocrinol. Metab 4: 309〜314頁(1993))。グルカゴン受容体はとりわけ、肝細胞の表面において発現し、そこで、グルカゴンに結合し、これによりもたらされるシグナルを細胞内に伝達する。したがって、「グルカゴン受容体」という用語はまた、グルカゴンと特異的に相互作用する結果として生物学的シグナルをもたらす1または複数の受容体も指す。当技術分野では、ラット由来およびヒト由来のグルカゴン受容体をコードするDNA配列が単離され、開示されている(EP0658200B1)。また、マウスおよびカニクイザルの相同体も単離され、配列決定されている(Burcelinら、Gene 164 (1995)、305〜310頁; McNallyら、Peptides 25 (2004)、1171〜1178頁)。本明細書で用いられる「グルカゴン受容体」と「GCGR」とは、互換的に用いられる。本明細書で用いられる「GCGR」、「hGCGR」、またはこれらの断片という表現は、ヒト以外の種に由来する、例えば、「マウスGCGR」、「ラットGCGR」、または「サルGCGR」と指定されない限り、ヒトGCGRタンパク質またはその断片を指す。さらに、本明細書で用いられる「GCGR」または「hGCGR」とは、配列番号157に示される核酸配列および配列番号153のアミノ酸配列を有するヒトGCGR、またはその生物学的に活性な断片を指す。以下のGenbank受託番号: NP_000151.1(ヒト)、NP_742089.1(ラット)、XP_001111894.1(アカゲザル)、およびNP_032127.2(マウス)を有するGCGR遺伝子と類縁の多様な配列が存在する。本明細書で開示される他の配列には、ヒトGCGR(配列番号153)、マウスGCGR(配列番号154)、カニクイザルGCGR(配列番号155)、ラットGCGR(配列番号156)が含まれる。特定の実施形態では、本発明において有用な融合タンパク質に、配列番号149(ヒトIgGのFc領域に融合させたNP_000151.1の残基27〜144であるhGCGR-hFc)、配列番号150(ヒトIgGのFc領域に融合させたNP_000151.1の残基27〜144であるhGCGR-hFc)、配列番号151(myc-myc-hisタグに融合させたNP_000151.1の残基27〜144であるhGCGR-mmH)、および配列番号152(受託番号XP_001111894.1を有する、アカゲザルであるMacaca mulattaのGCGRの残基27〜144と同一であり、ヒトIgGのFc領域に融合させた、カニクイザルであるMfのN末端配列を含有するMfGCGR-hFc)が含まれうる。
なる特定の他の残基を維持するか、または異なる生殖細胞系列の配列の対応する残基へと突然変異させる組合せも含有しうる。得られたならば、1または複数の生殖細胞系列突然変異を含有する抗体および抗原結合断片は、結合特異性の改善、結合アフィニティーの増大、アンタゴニスト性またはアゴニスト性の生物学的特性の改善または増強(場合によって)、免疫原性の低減などの1または複数の所望の特性について容易に調べることができる。本発明内には、この一般的な形で得られた抗体および抗原結合断片が包含される。
グルカゴンは、その生理学的効果を、グルカゴン受容体を介するシグナル伝達により及ぼすので、グルカゴン受容体は、糖尿病およびグルカゴンに関連する他の代謝障害の潜在的な治療標的でありうる。本明細書で記載される抗体などのグルカゴン受容体アンタゴニストの使用は、グルコースの正常レベルを達成し、これにより、糖尿病と関連する1もしくは複数の症状または長期にわたる合併症を改善または防止する有効な手段でありうる。本発明の抗体はまた、例えば、耐糖能異常と関連する状態を改善するのに有用な場合もあり、肥満を処置するのに有用な場合もあり、体重の増加を防止するのに有用な場合もあり、メタボリック症候群を処置するのに有用な場合もあり、糖尿病性ケトアシドーシスを含めた糖尿病性状態を処置するのに有用な場合もあり、腎症、神経障害、網膜症、白内障、脳卒中、アテローム性動脈硬化、創傷治癒障害、および糖尿病と関連する他の合併症など、当業者に知られる糖尿病と関連する合併症のうちの任意の1または複数を発症する危険性を防止し、かつ/または低下させるのに有用な場合もある。
とりわけ別段に示さない限り、本明細書で用いられる「抗体」という用語は、2つの免疫グロブリン重鎖および2つの免疫グロブリン軽鎖(すなわち、「完全抗体分子」)ならびにその抗原結合断片を含む抗体分子を包含すると理解するものとする。本明細書で用いられる、抗体の「抗原結合部分」、抗体の「抗原結合断片」などの用語には、抗原に特異的に結合して複合体を形成する、任意の天然ポリペプチド、酵素的に得られるポリペプチド、合成ポリペプチド、もしくは遺伝子操作したポリペプチド、または糖タンパク質が含まれる。本明細書で用いられる、抗体の「抗原結合部分」、または「抗体断片」という用語は、hGCGRに特異的に結合する能力を保持する抗体の1または複数の断片を指す。抗体断片にはFab断片、F(ab')2断片、Fv断片、dAb断片、CDRまたは単離CDRを含有する断片が含まれうる。抗体の抗原結合断片は、例えば、タンパク質分解による消化または抗体の可変ドメインおよび(場合によって)定常ドメインをコードするDNAの操作および発現を伴う組換え遺伝子操作法など、任意の適切な標準的技法を用いて完全抗体分子から派生させることができる。このようなDNAは知られており、かつ/または、例えば、市販の供給源、DNAライブラリー(例えば、ファージ抗体ライブラリーを含めた)から容易に入手可能であり、合成可能な場合もある。DNAは、配列決定し、化学的にまたは分子生物学法を用いて操作し、例えば、1もしくは複数の可変ドメインおよび/もしくは定常ドメインを適切な構成へと配置するか、またはコドンを導入するか、システイン残基を創出するか、アミノ酸を修飾するか、付加するか、もしくは欠失させることなどもできる。
当技術分野では、トランスジェニックマウスにおいてヒト抗体を生成させる方法が知られている。任意のこのような知られた方法を、本発明の文脈で用いて、ヒトGCGRに特異的に結合するヒト抗体を作製することができる。
本発明の抗GCGR抗体および抗体断片は、記載される抗体のアミノ酸配列とは異なるが、ヒトGCGRに結合する能力を保持するアミノ酸配列を有するタンパク質を包含する。このような変異体の抗体および抗体断片は、親配列と比較して1または複数カ所のアミノ酸の付加、欠失、または置換を含むが、記載される抗体と本質的に同等な生物学的活性を示す。同様に、本発明の抗GCGR抗体をコードするDNA配列も、開示された配列と比較した場合、1または複数カ所のヌクレオチドの付加、欠失、または置換を含むが、本発明の抗GCGR抗体または抗体断片と生物学的に本質的に同等な抗GCGR抗体または抗体断片をコードする配列を包含する。
一般に、本発明の抗体は、hGCGRの細胞外領域のうちの少なくとも1つに結合することにより機能しうる。特定の実施形態では、本発明の抗体は、少なくともN末端領域に位置するエピトープに結合する場合もあり、hGCGRの細胞外(EC)ループのうちの少なくとも1つに位置するエピトープに結合する場合もある。
特定のエピトープに結合する抗体についてスクリーニングするためには、「Antibodies」、HarlowおよびLane (Cold Spring Harbor Press、Cold Spring Harb.、NY)により記載されるアッセイなど、日常的な交差遮断アッセイを実施することができる。他の方法には、アラニン走査突然変異誘発、ペプチドブロット(Reineke (2004)、Methods Mol Biol 248: 443〜63頁)、またはペプチド切断解析が含まれる。加えて、エピトープの切出し、エピトープの抽出、および抗原の化学修飾などの方法も用いることができる(Tomer (2000)、Protein Science 9: 487〜496頁)。
本発明の特定の実施形態によれば、抗GCGR抗体は、ヒトGCGRには結合するが、他の種に由来するGCGRには結合しない。代替的に、特定の実施形態では、本発明の抗GCGR抗体は、ヒトGCGRおよび1または複数のヒト以外の種に由来するGCGRに結合する。例えば、本発明の抗GCGR抗体は、ヒトGCGRに結合することが可能であり、場合によって、マウスGCGR、ラットGCGR、モルモットGCGR、ハムスターGCGR、アレチネズミGCGR、ブタGCGR、ネコGCGR、イヌGCGR、ウサギGCGR、ヤギGCGR、ヒツジGCGR、ウシGCGR、ウマGCGR、ラクダGCGR、カニクイザルGCGR、マーモセットGCGR、アカゲザルGCGR、またはチンパンジーGCGRのうちの1または複数に結合する場合もあり、結合しない場合もある。
本発明は、血中グルコースレベルを低減することが可能な薬剤、または放射性同位体、または化学療法剤などの治療用部分にコンジュゲートしたヒト抗GCGRモノクローナル抗体(「イムノコンジュゲート」)を包含する。抗GCGR抗体にコンジュゲートしうる治療用部分の種類は、処置される状態および達成されることが所望される治療効果を考慮に入れる。例えば、糖尿病、または血中グルコースを低下させ、かつ/または正常な血中グルコースレベルを維持することが望ましい他の任意の状態を処置するには、ビグアニド(例えば、メトフォルミン)、スルホニルウレア(例えば、グリブリド、グリピジド)、PPARガンマアゴニスト(例えば、ピオグリタゾン、ロシグリタゾン);アルファグルコシダーゼ阻害剤(例えば、アカルボース、ボグリボース)、糖化最終産物形成阻害剤(例えば、アミノグアニジン)、または第2のGCGR阻害剤などの薬剤を、GCGR抗体にコンジュゲートすることができる。代替的に、所望の治療効果が、糖尿病または血中グルコースレベルの上昇もしくはコントロール不良から結果として生じる他の任意の状態と関連する続発症または症状を処置することである場合は、その状態の続発症または症状を処置するのに適切な薬剤をコンジュゲートすることも有利でありうる。当技術分野では、イムノコンジュゲートを形成するのに適する薬剤の例が知られており、例えば、WO05/103081を参照されたい。
本発明の抗体は、単一特異性の場合もあり、二重特異性の場合もあり、多重特異性の場合もある。多重特異性抗体とは、1つの標的ポリペプチドの異なるエピトープに特異的な場合もあり、複数の標的ポリペプチドに特異的な抗原結合ドメインを含有する場合もある。例えば、Tuttら、1991、J. Immunol. 147: 60〜69頁; Kuferら、2004、Trends Biotechnol. 22: 238〜244頁を参照されたい。本発明の抗GCGR抗体は、別の機能的分子、例えば、別のペプチドまたはタンパク質に連結することもでき、これと共発現させることもできる。例えば、抗体またはその断片は、別の抗体または抗体断片などの1または複数の他の分子的実体に機能的に連結して(例えば、化学的連結、遺伝子融合、非共有結合的会合を介して、または別の形で)、第2の結合特異性を伴う二重特異性抗体または多重特異性抗体を生成させることができる。例えば、本発明は、免疫グロブリンの一方のアームが、ヒトGCGRまたはその断片に特異的であり、免疫グロブリンの他方のアームが、第2の治療標的に特異的であるかまたは治療用部分にコンジュゲートされた二重特異性抗体を包含する。本発明の特定の実施形態では、免疫グロブリンの一方のアームが、hGCGRまたはその断片のN末端ドメインにおけるエピトープに特異的であり、免疫グロブリンの他方のアームが、hGCGRまたはその断片のECループのうちの1つにおけるエピトープに特異的である。特定の実施形態では、免疫グロブリンの一方のアームが、1つのECループまたはその断片に特異的であり、第2のアームが、第2のECループまたはその断片に特異的である。特定の実施形態では、免疫グロブリンの一方のアームが、hGCGRの1つのECループにおける1つのエピトープに特異的であり、他方のアームが、hGCGRの同じECループの第2のエピトープに特異的である。
本発明は、本発明の抗GCGR抗体またはそれらの抗原結合断片を含む治療用組成物を提供する。本発明に従う治療用組成物の投与は、導入、送達、忍容性などの改善をもたらすために処方物に組み込まれる、適切な担体、賦形剤、および他の薬剤と共に施される。適切な処方物の大半は、全ての製薬化学者に知られた処方集である、「Remington's Pharmaceutical Sciences」、Mack Publishing Company、Easton、PAにおいて見出すことができる。これらの処方物には、例えば、粉末、ペースト、軟膏、ゼリー、蝋、油、脂質、脂質(カチオン性脂質またはアニオン性脂質)を含有する小胞(LIPOFECTIN(商標)など)、DNAコンジュゲート、無水吸収ペースト、水中油エマルジョンおよび油中水エマルジョン、カーボワックスエマルジョン(多様な分子量のポリエチレングリコール)、半固体ゲル、およびカーボワックスを含有する半固体混合物が含まれる。また、Powellら、「Compendium of excipients for parenteral formulations」、PDA (1998)、J Pharm Sci Technol 52: 238〜311頁も参照されたい。
それらのグルカゴン受容体との相互作用のために、本抗体は、血中グルコースレベルを低下させるのに有用であり、また、グルカゴンのその受容体との相互作用を遮断することが有益な、広範にわたる状態および障害の治療にも有用である。これらの障害および状態は、グルカゴン受容体によるシグナル伝達を伴い、この結果として障害の病態生理または障害に対するホメオスタシス反応をもたらす、グルカゴンに関連する任意の代謝障害から選択することができる。したがって、抗体は、例えば、内分泌系、中枢神経系、末梢神経系、心血管系、肺系、および消化器系の疾患もしくは状態、または関連する症状もしくは続発症を防止、処置、または緩和する一方で、現行の処置と関連する有害な副作用のうちの1または複数を低減するかまたは消失させるのに用いることができる。グルカゴンに関連する代謝障害には、1型糖尿病および2型糖尿病、糖尿病性ケトアシドーシス、高血糖症、高血糖性高浸透圧症候群、周術期高血糖症、ICU患者高血糖症、高インスリン血症、食後高血糖症、空腹時血糖値異常(IFG)、メタボリック症候群、高/低カリウム血症、LDL/HDL比不良、摂食障害、体重の増加、糖尿病の結果としての肥満、小児性糖尿病、妊娠性糖尿病、糖尿病性後期合併症、微量/顕性アルブミン尿、腎症、網膜症、神経障害、糖尿病性足部潰瘍、創傷治癒障害、耐糖能異常(IGT)、インスリン抵抗性症候群、シンドロームX、グルカゴノーマ、消化器障害、肥満、肥満の結果としての糖尿病などが含まれるがこれらに限定されない。本発明はさらに、哺乳動物におけるグルカゴンの過剰から結果として生じる状態を処置する方法;哺乳動物におけるグルカゴン受容体を阻害する方法;哺乳動物におけるグルカゴン受容体を介する細胞応答を阻害する方法;または哺乳動物における血糖レベルを低減する方法であって、グルカゴン受容体阻害量の抗GCGR抗体またはその生物学的に活性な断片を、このような治療を必要とする哺乳動物に投与する工程を含む方法も提供する。
組合せ療法は、本発明の抗hGCGR抗体、および本発明の抗体または本発明の抗体の生物学的活性断片と組み合わせることが有利でありうる任意のさらなる治療剤を包含しうる。
本発明の抗GCGR抗体はまた、例えば、診断目的で、試料中のGCGRを検出および/または測定するのにも用いることができる。例えば、抗GCGR抗体またはその断片を用いて、GCGR発現の異常(例えば、過剰発現、過小発現、発現の欠如など)を特徴とする状態または疾患を診断することができる。GCGRについての例示的な診断アッセイは、例えば、患者から得た試料を本発明の抗GCGR抗体と接触させる工程を含むことが可能であり、抗GCGR抗体を、検出可能な標識もしくはレポーター分子で標識するか、またはGCGRタンパク質を患者試料から選択的に単離するための捕捉リガンドとして用いる。代替的に、診断適用では、標識されていない抗GCGR抗体を、それ自体検出可能に標識された二次抗体と組み合わせて用いることもできる。検出可能な標識またはレポーター分子は、3H、14C、32P、35S、または125Iなどの放射性同位体の場合もあり、イソチオシアン酸フルオレセインまたはロダミンなどの蛍光部分または化学発光部分の場合もあり、アルカリホスファターゼ、β-ガラクトシダーゼ、西洋ワサビペルオキシダーゼ、またはルシフェラーゼなどの酵素の場合もある。試料中のGCGRを検出または測定するのに用いうる特定の例示的アッセイには、酵素免疫測定アッセイ(ELISA)、ラジオイムノアッセイ(RIA)、および蛍光活性化細胞分取(FACS)が含まれる。
以下の例は、当業者に、本発明の方法および組成物をどのようにして実施および作製し、用いるかについての完全な開示および記載をもたらすために示されるものであり、本発明者らが何を自らの発明と考えるかについての範囲を限定することを意図するものではない。用いられる数字(例えば、量、温度など)に関する精度を確保しようと努めはするが、実験に関しては誤差および偏差を考慮すべきである。別段に示さない限り、部は重量部であり、分子量は平均分子量であり、温度は摂氏温度であり、圧力は大気圧またはその近傍である。
ヒトGCGRに対するヒト抗体の生成
以下のうちのいずれか1つを含む免疫原を用いて、hGCGRに対する抗体を生成させることができる。例えば、特定の実施形態では、hGCGRを発現させる細胞を免疫原として用いて、hGCGRに対する抗体を生成させた。加えて、特定の実施形態では、hGCGRをコードするDNAを免疫原として用いて、本発明の抗体を調製した。さらに、特定の実施形態では、hGCGRのN末端ドメインに由来するアミノ酸配列を含むペプチドを免疫原として用いて、ヒトGCGRに対する抗体を生成させた。加えて、特定の実施形態では、hGCGRの細胞外ループ領域であるEC1、EC2、またはEC3のうちのいずれかに由来するアミノ酸配列を含むペプチドを免疫原として用いて、ヒトGCGRに対する抗体を生成させることもできる。上記で言及した通りに、免疫原として用いた細胞、DNA、またはペプチドを、免疫反応を刺激するアジュバントと共に、ヒト免疫グロブリンの重鎖可変領域およびカッパ軽鎖可変領域をコードするDNAを含むVELOCIMMUNE(登録商標)マウスへと直接投与した。抗体による免疫反応は、GCGR特異的イムノアッセイを介してモニタリングした。所望の免疫反応を達成したら、脾臓細胞を採取し、マウス骨髄腫細胞と融合させて、それらの生存可能性を保存し、ハイブリドーマ細胞系を形成した。GCGR特異的抗体を生成させる細胞系を同定するために、ハイブリドーマ細胞系をスクリーニングして選択した。この技法および上記の多様な免疫原を用いて、複数の抗GCGRキメラ抗体(すなわち、ヒト可変ドメインおよびマウス定常ドメインを保有する抗体)を得、このようにして生成させた特定の例示的な抗体を、H4H1345N、H4H1617N、およびH4H1765Nと称した。
重鎖可変領域および軽鎖可変領域のアミノ酸配列
Table 1(表1)は、選択された抗GCGR抗体の重鎖可変領域および軽鎖可変領域のアミノ酸配列対と、それらの対応する抗体識別子とを示す。抗体名称の番号は同じであるが、接尾文字N、B、またはPが異なる抗体は、CDR配列は同一であるが、CDR配列以外の領域(すなわち、フレームワーク領域)において配列の変化を伴う重鎖および軽鎖を有する抗体を指す。したがって、特定の抗体のN変異体、B変異体、およびP変異体は、それらの重鎖可変領域および軽鎖可変領域内に同一なCDR配列を有するが、それらのフレームワーク領域内では互いに異なる。
V(可変)遺伝子使用についての解析
生成させた抗体の構造を解析するために、抗体の可変領域をコードする核酸をクローニングし、配列決定した。抗体の核酸配列および抗体の予測されるアミノ酸配列から、重鎖可変領域(HCVR)および軽鎖可変領域(LCVR)の各々について、遺伝子使用を同定した。Table 2(表2)は、本発明に従い選択された抗体についての遺伝子使用を示す。
表面プラズモン共鳴により決定される抗体の可溶性GCGRへの結合
抗hGCGRヒトモノクローナル抗体の、ヒトおよびサルの可溶性組換えGCGR細胞外ドメイン(それぞれ、hGCGRおよびMfGCGR)への結合の結合アフィニティーおよび結合反応速度定数を、25℃および37℃の両方における表面プラズモン共鳴を介して決定した。T100 Biacore測定器により測定を実施した。抗体は、共有結合的に連結した抗ヒトカッパ抗体による捕捉表面を介して、Biacoreセンサーチップ表面において捕捉し、可溶性GCGRタンパク質を、この表面に、一価(C末端のmyc-myc-ヘキサヒスチジンタグと共に発現させたhGCGR)フォーマットまたは二価(N末端のFc融合体と共に発現させたhGCGRおよびMfGCGR)フォーマットで適用した。この例で用いた試薬のアミノ酸配列の識別子をTable 3(表3)に示す。
抗GCGR抗体のGCGR活性化に対する効果を測定するバイオアッセイ
GCGRとは、Gタンパク質共役受容体であり、そのリガンドであるグルカゴン(GCG)は、Gαsを介するアデニリルシクラーゼ活性およびGqを介するホスホイノシトール代謝回転を刺激する(JiangおよびZhang、(2003)、Am J Physiol Endocrinol Metab 284: E671〜E678頁)。Gαsを介する活性化、その後のcAMPレベルの上昇、および転写の活性化を検出するバイオアッセイを開発した。全長のヒトGCGR(GenBank受託番号:NP_000151.1;配列番号153)、サル(カニクイザル)GCGR(配列番号155)、およびマウスGCGR(NP_032127.2;配列番号154)を、ルシフェラーゼレポーターアッセイと共に安定的に発現させるHEK293細胞系を生成させた。安定的な細胞系を単離し、10%のFBS、DMEM、NEAA、ペニシリン/ストレプトマイシン、および500mg/mlのG418中で維持した。ラットGCGRにはLipofectamine2000 (Invitrogen)を用いて、レポーター遺伝子[CRE(4×)-ルシフェラーゼ-IRES-GFP]を発現させるHEK293細胞系で、全長ラットGCGR(NP_742089.1;配列番号156)を一過性にトランスフェクトした。
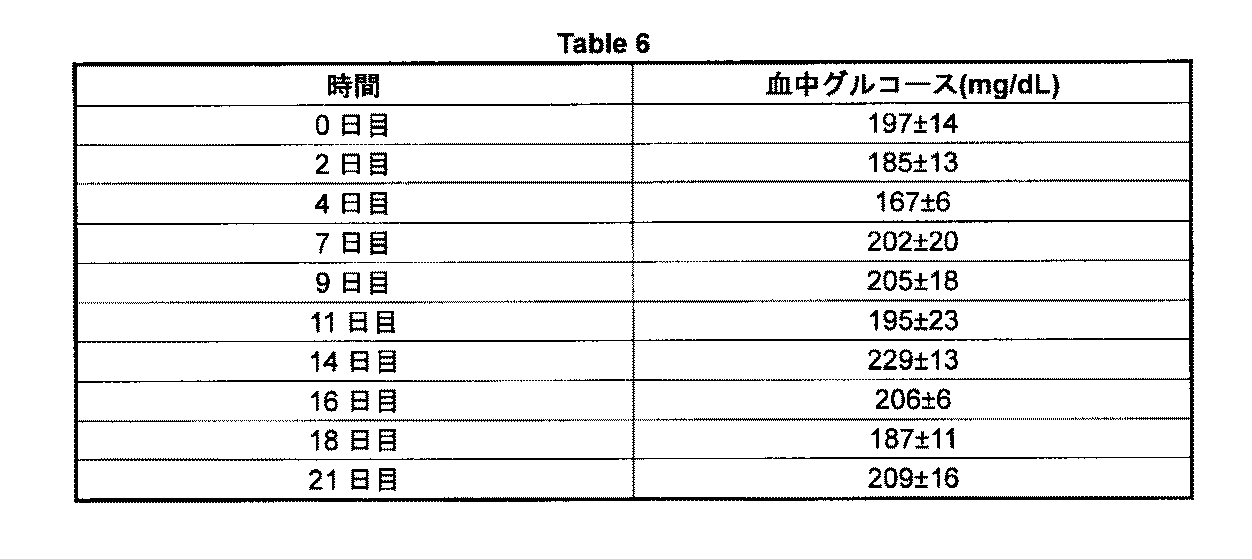
ob/obマウスにおける抗GCGR抗体の効果
それらの全てがマウスGCGRと交差反応する、選択された抗hGCGR抗体を、それらが2型糖尿病のマウスモデルであるob/obマウスにおいて血中グルコースレベルを低減する能力について調べた。ob/obマウスを動物5または6匹ずつの10群に分けた。各群に各抗体の皮下注射を1または10mg/kgで施した。対照群には、知られたマウスタンパク質のいずれにも結合しないhIgGアイソタイプ対照抗体を注射した。1または10mg/kgでの抗体投与それぞれの2または7日後、尾静脈採血を介して得た数滴の血液をマウスから回収した。とりわけ、H4H1327Pと称する抗体を10mg/kgで施した群では、尾静脈血をより高頻度で、投与の2、4、7、9、11、14、16、18、および21日後に回収した。尾静脈血試料に由来する血中グルコースレベルは、ACCU-CHEK(登録商標)Compact Plus(Roche)により決定した。対照群の平均血中グルコースレベルからの血中グルコースの低減百分率は、各時点の各動物について計算した。血中グルコース低減の平均百分率は、各抗体群について計算した。Table 6(表8)は、対照群の平均血中グルコースレベルについてまとめる。血中グルコース低減百分率の平均±SEMとして表した結果を、Table 7aおよび7b(表9および10)に示す。
ヒトGCGRタンパク質を発現させるトランスジェニックマウスにおける抗GCGR抗体の効果
抗hGCGR抗体の血中グルコースおよび血漿脂質レベルに対する効果を、ヒトGCGRタンパク質を発現させるトランスジェニックマウス(「ヒト化GCGRマウス」)において決定した。ヒト化GCGRマウスを、C57BL6/129(F1H4)胚性幹細胞においてマウスGCGR遺伝子をヒトGCGR遺伝子(配列番号157;全長タンパク質であるGenBank受託番号:NP_000151.1をコードする;配列番号153)で置換することにより生成させた。C57BL6バックグラウンドにおいて生殖細胞系列の伝達を確立した後、ヘテロ接合マウス(GCGRhum/+)同士を交配させて、ホモ接合マウス(GCGRhum/hum)を生成させた。ホモ接合ヒト化GCGRマウスを、動物3または4匹ずつの10群に分けた。各群に各抗体の皮下注射を3mg/kgで施した。対照I群には、知られたマウスタンパク質のいずれにも結合しないhIgGアイソタイプ対照抗体を注射した。対照II群には、ヒト化GCGRマウスの血中グルコースレベルを低減することが検証されている抗hGCGR hIgG4抗体を注射した。抗体投与の3日後、マウスから採血し、ACCU-CHEK(登録商標)Compact Plus(Roche)により血中グルコースレベルを決定した。対照I群の平均血中グルコースレベルからの血中グルコースの低減百分率は、各動物について計算した。血中グルコース低減の平均百分率は、各抗体群について計算した。Table 8a(表11)は、対照群の平均血中グルコースレベルについてまとめる。血中グルコース低減百分率の平均±SEMとして表した結果を、Table 8b(表12)に示す。
抗GCGR抗体およびPCSK9(プロタンパク質転換酵素スブチリシン/ケキシン9型)に特異的な抗体による組合せ療法のマウスにおける血中グルコースレベル、血漿脂質レベル、および肝臓トリグリセリドレベルに対する効果
試薬
以下の抗体を用いて、抗GCGR抗体およびPCSK9に特異的な抗体による組合せ療法のC57BL/6マウスにおける血中グルコースレベル、血漿脂質レベル、および肝臓トリグリセリドレベルに対する効果について研究した:hIgG4アイソタイプ対照である、REGN496と称する抗hlL4R抗体;H4H1327Pと称する抗GCGR(hIgG4)抗体;およびH1H316Pと称する抗PCSK9(hIgG1)抗体。HCVR、LCVR、HCDR、およびLCDRのアミノ酸配列の識別子を、Table 9(表14)の下方に示す。
抗hGCGR抗体であるH4H1327Pと、抗hPCSK9抗体であるH1H316Pとの組合せの、血中グルコースレベル、血漿脂質レベル、および肝臓トリグリセリド(TG)レベルに対する効果を、C57BL/6マウスにおいて決定した。
H4H1327P単独で処置したマウスは、対照mAbを施したマウスと比較して、血中グルコースレベルの著明な低減、ならびにLDLレベル、HDLレベル、および総コレステロールレベルの上昇を示した。H1H316P単独で処置したマウスは、コレステロールレベルの著明な低減を示したが、血中グルコースレベルは変化しなかった。H4H1327PとH1H316Pとの組合せで処置したマウスは、対照mAbを施したマウスと比較して血中グルコースレベルの著明な低減を示したが、コレステロールレベルは変化しなかった。肝臓TG含量は、アイソタイプ対照群と比較して、治療群のうちのいずれにおいても変化しなかった。
食餌誘導性肥満マウスモデルにおける抗GCGR抗体の効果
マウスGCGRと交差反応する抗hGCGR抗体であるH4H1327Pの、血中グルコースレベルおよび体重に対する効果を、2型糖尿病(T2D)の食餌誘導性肥満(DIO)マウスモデルにおいて決定した。
H4H1327Pは、全ての被験用量において、DIOマウスの血中グルコースおよび体重を、アイソタイプ対照群と比較して低減および減量した。相対血中グルコースの最大の低減(48.5%)は、10日目の最高用量(30mg/kg)群において生じ、相対体重の最大の減量(12.8%)は、28日目の最高用量群において生じた。最低用量(3mg/kg)群も、平均相対血中グルコースの低下を達成し、平均体重の減量値として、28日目までの全期間(最終回投与の1週間後)において最高用量群により示された値の少なくとも70%を達成した。H4H1327Pの高用量群では、21日目の最終回処置後において(すなわち、28、47、および68日後において)観察された血中グルコースおよび体重の低下効果および減量効果が、低用量群と比較して長期にわたり持続した。
糖尿病性ケトアシドーシスのストレプトゾトシン(STZ)誘導性マウスモデルにおける抗GCGR抗体の効果
マウスGCGRと交差反応する抗hGCGR抗体であるH4H1327Pの、血漿ケトンレベルおよび血漿グルコースレベルに対する効果を、糖尿病性ケトアシドーシス(DKA)のストレプトゾトシン(STZ)誘導性マウスモデルにおいて決定した。STZとは、哺乳動物の膵臓ベータ細胞に毒性の化学物質であり、したがって、齧歯動物に投与すると、この細胞型を破壊する。高用量(200mg/kg)STZをC57BL/6マウスへと単回注射すると、3日後に、ヒトDKAにおいて示される状態である重度の高血糖症およびケトン尿症の発症がもたらされる。Taconic farms, Inc.から購入した9週齢の雄C57BL/6マウスを、動物10匹ずつの2群に分け、各群に、200mg/kg STZ(クエン酸緩衝液中)または媒体(これもまた、クエン酸緩衝液中)の腹腔内注射を施した。3日後、STZで処置した全ての動物において、重度の高血糖症(血中グルコースレベル>400mg/dL)およびケトン尿症を確認した。翌朝、STZ処理マウスを、動物5匹ずつの2群に分け、各群に、10mg/kg H4H1327Pまたは10mg/kg hIgG4アイソタイプ対照の静脈内注射を施した。また、クエン酸緩衝液で処置したマウスも、動物5匹ずつの2群に分け、各群に、10mg/kg H4H1327Pまたは10mg/kg hIgG4アイソタイプ対照の静脈内注射を施した。抗体投与の18時間前(STZ投与の2.5日後)および抗体投与の28時間後、血漿を回収するためのイソフルラン麻酔下でマウスから採血した。血漿ケトンレベルは、ベータヒドロキシ酪酸アッセイ(Biovision)を介して決定し、血漿グルコースレベルは、ADVIA(登録商標)1650 Chemistry System(Siemens)を介して決定した。ベータヒドロキシ酪酸レベルおよびグルコースレベルの測定値の平均は、4つの群各々について計算した。血漿ベータヒドロキシ酪酸濃度および血漿グルコース濃度の平均±SEMとして表した結果を、Table 13(表19)に示す。
H4H1327P処置の28時間後、処置の18時間前における血漿レベルと比較した血漿ベータヒドロキシ酪酸(ケトン)濃度の低減(平均67%)がSTZ誘導性糖尿病性ケトアシドーシスマウスにおいて観察されたことから、H4H1327Pが、DKAのマウスモデルにおける血漿ケトンレベルを低下させるのに有効であったことが示される。アイソタイプ対照抗体を投与されたSTZ処理マウスでは、対照抗体処置の28時間後に回収した血清試料について、抗体処置の18時間前に回収した試料と比較して、血中グルコースの平均14%の増大が観察されたのに対し、STZ処理群においてH4H1327Pを投与されたマウスでは、これらの2つの時点で回収される血清試料の間において観察されるグルコース変化の平均が1%未満であった。
二重特異性抗体の生成
本発明の方法を実施するのに用いるために、多様な二重特異性抗体を生成させる。例えば、GCGR特異的抗体を、GCGRにおける異なる細胞外ドメインエピトープおよび/またはECループエピトープに結合する可変領域を共に連結して、単一の結合分子内に二重ループ特異性を付与する、二重特異性フォーマットで生成させる(「二重特異性」抗体)。適切にデザインされた二重特異性抗体は、GCGRへの特異性および結合アビディティーの両方の増大を介して、グルカゴン受容体に対する遮断有効性の全体を増強しうる。個別の細胞外ドメインエピトープ(例えば、N末端ドメインセグメント、またはEC1 GCGRループセグメント、EC2 GCGRループセグメント、もしくはEC3 GCGRループセグメント)に対する特異性を伴う可変領域、または1つの細胞外ドメインセグメント内もしくは1つのループ内の異なる領域に結合しうる可変領域を、各可変領域が個別のエピトープまたは1つの細胞外ドメイン内もしくは1つのECループ内の異なる領域に同時に結合することを可能とする構造的な足場において対合させる。二重特異性抗体の一例では、1つの細胞外ドメインまたはループに対する特異性を伴う結合体に由来する重鎖可変領域(VH)を、元のVHに対する元の特異性を破壊せずにそのVHと対合しうる、非コグネイトのVLパートナーを同定するための第2の細胞外ドメイン、またはECループに対する特異性を伴う一連の結合体に由来する軽鎖可変領域(VL)と再結合させる。このようにして、単一のVLセグメント(例えば、VL1)を、2つの異なるVHドメイン(例えば、VH1およびVH2)と組み合わせて、2つの結合「アーム」(VH1-VL1およびVH2-VL1)を含む二重特異性抗体を生成させることができる。単一のVLセグメントを用いることにより、系の複雑性が低減および単純化され、これにより、二重特異性抗体(例えば、USSN13/022759およびUS2010/0331527を参照されたい)を生成させるのに用いられるクローニング工程、発現工程、および精製工程の効率性が増大する。
Claims (18)
- ヒトグルカゴン受容体(hGCGR)に特異的に結合する単離ヒト抗体またはその抗原結合断片であって、配列番号86のアミノ酸配列を有する重鎖可変領域(HCVR)の相補性決定領域(CDR)と、配列番号88のアミノ酸配列を有する軽鎖可変領域(LCVR)のCDRとを含む、抗体またはその抗原結合断片。
- ヒトグルカゴン受容体(hGCGR)に特異的に結合する単離ヒト抗体またはその抗原結合断片であって、
(a)配列番号72に示されるアミノ酸配列を有するHCDR1ドメイン;
(b)配列番号74に示されるアミノ酸配列を有するHCDR2ドメイン;
(c)配列番号76に示されるアミノ酸配列を有するHCDR3ドメイン;
(d)配列番号80に示されるアミノ酸配列を有するLCDR1ドメイン;
(e)配列番号82に示されるアミノ酸配列を有するLCDR2ドメイン;及び
(f)配列番号84に示されるアミノ酸配列を有するLCDR3ドメイン
を含む、抗体またはその抗原結合断片。 - 配列番号86/88に示されるHCVR/LCVRの配列対を含む、請求項1または2に記載の抗体またはその抗原結合断片。
- 請求項1から3のいずれか一項に記載の抗体または抗体の抗原結合断片をコードする単離核酸分子。
- 請求項4に記載の核酸分子を含む発現ベクター。
- 抗ヒトGCGR抗体またはその抗原結合断片を生成させる方法であって、請求項5に記載の発現ベクターを単離宿主細胞へと導入する工程と、抗体またはその断片の生成を可能とする条件下で前記細胞を増殖させる工程と、そのように生成させた抗体を回収する工程とを含む方法。
- 請求項1から3のいずれか一項に記載の抗体またはその抗原結合断片と、薬学的に許容可能な担体または希釈剤とを含む医薬組成物。
- 血中グルコースレベルもしくは血中ケトンレベルを低下させるか、または高い血中グルコースレベルもしくは血中ケトンレベルと関連するかもしくはこれを部分的に特徴とする状態もしくは疾患を処置するか、または前記状態もしくは疾患と関連する少なくとも1つの症状もしくは合併症を処置するための請求項7に記載の医薬組成物。
- 前記状態または疾患が、糖尿病、耐糖能異常、肥満、腎症、神経障害、網膜症、白内障、脳卒中、アテローム性動脈硬化、創傷治癒障害、糖尿病性ケトアシドーシス、高血糖症、高血糖性高浸透圧症候群、周術期高血糖症、ICU患者高血糖症、高インスリン血症、メタボリック症候群、インスリン抵抗性症候群、および空腹時血糖値異常からなる群から選択される、請求項8に記載の医薬組成物。
- 前記抗体または抗原結合断片を、第2の治療剤と組み合わせて投与する、請求項8または9に記載の医薬組成物。
- 前記第2の治療剤が、インスリン、ビグアニド(メトフォルミン)、スルホニルウレア(グリブリド、グリピジドなど)、PPARガンマアゴニスト(ピオグリタゾン、ロシグリタゾン)、アルファグルコシダーゼ阻害剤(アカルボース、ボグリボース)、グルカゴン様ペプチド1、プラムリンチド、グルカゴンアンタゴニスト、および第2のGCGRアンタゴニストからなる群から選択される、請求項10に記載の医薬組成物。
- 前記第2の治療剤が、3-ヒドロキシ-3-メチル-グルタリル-CoAレダクターゼ(HMG-CoAレダクターゼ)阻害剤である、請求項10に記載の医薬組成物。
- 前記HMG-CoAレダクターゼ阻害剤が、アトルバスタチン、フルバスタチン、ロバスタチン、ピタバスタチン、プラバスタチン、ロスバスタチン、およびシンバスタチンからなる群から選択されるスタチンである、請求項12に記載の医薬組成物。
- 前記第2の治療剤が、ヒトプロタンパク質転換酵素スブチリシン/ケキシン9型(PCSK9)に特異的に結合する単離抗体またはその抗原結合断片である、請求項10に記載の医薬組成物。
- 請求項1から3のいずれか一項に記載の抗体またはその抗原結合断片と、ヒトPCSK9に特異的に結合する単離抗体またはその抗原結合断片を含む第2の治療剤と、薬学的に許容可能な担体または希釈剤とを含む医薬組成物。
- 血中グルコースレベルもしくは血中ケトンレベルを低下させるのに用いられるか、または糖尿病、耐糖能異常、肥満、腎症、神経障害、網膜症、白内障、脳卒中、アテローム性動脈硬化、創傷治癒障害、糖尿病性ケトアシドーシス、高血糖症、高血糖性高浸透圧症候群、周術期高血糖症、ICU患者高血糖症、高インスリン血症、メタボリック症候群、インスリン抵抗性症候群、および空腹時血糖値異常からなる群から選択される、高い血中グルコースレベルもしくは血中ケトンレベルと関連するかもしくはこれを部分的に特徴とする状態もしくは疾患を有する患者を処置するための、請求項1から3のいずれか一項に記載の単離抗体もしくはその抗原結合断片。
- 血中グルコースレベルもしくは血中ケトンレベルを低下させるのに用いられるか、または糖尿病、耐糖能異常、肥満、腎症、神経障害、網膜症、白内障、脳卒中、アテローム性動脈硬化、創傷治癒障害、糖尿病性ケトアシドーシス、高血糖症、高血糖性高浸透圧症候群、周術期高血糖症、ICU患者高血糖症、高インスリン血症、メタボリック症候群、インスリン抵抗性症候群、および空腹時血糖値異常からなる群から選択される、高い血中グルコースレベルもしくは血中ケトンレベルと関連するかもしくはこれを部分的に特徴とする状態もしくは疾患を有する患者を処置するための、請求項7または15に記載の医薬組成物。
- 血中グルコースレベルもしくは血中ケトンレベルを低下させるか、または糖尿病、耐糖能異常、肥満、腎症、神経障害、網膜症、白内障、脳卒中、アテローム性動脈硬化、創傷治癒障害、糖尿病性ケトアシドーシス、高血糖症、高血糖性高浸透圧症候群、周術期高血糖症、ICU患者高血糖症、高インスリン血症、メタボリック症候群、インスリン抵抗性症候群、および空腹時血糖値異常からなる群から選択される、高い血中グルコースレベルもしくは血中ケトンレベルと関連するかもしくはこれを部分的に特徴とする状態もしくは疾患を有する患者を処置するための医薬の製造における、請求項1から3のいずれか一項に記載の単離抗体もしくはその抗原結合断片、または請求項7もしくは15に記載の医薬組成物の使用。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US41640910P | 2010-11-23 | 2010-11-23 | |
| US61/416,409 | 2010-11-23 | ||
| US201161481958P | 2011-05-03 | 2011-05-03 | |
| US61/481,958 | 2011-05-03 | ||
| US201161551032P | 2011-10-25 | 2011-10-25 | |
| US61/551,032 | 2011-10-25 | ||
| PCT/US2011/061766 WO2012071372A2 (en) | 2010-11-23 | 2011-11-22 | Human antibodies to the glucagon receptor |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014501512A JP2014501512A (ja) | 2014-01-23 |
| JP6100697B2 true JP6100697B2 (ja) | 2017-03-22 |
Family
ID=45065985
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013541008A Active JP6100697B2 (ja) | 2010-11-23 | 2011-11-22 | グルカゴン受容体に対するヒト抗体 |
Country Status (21)
| Country | Link |
|---|---|
| US (8) | US8545847B2 (ja) |
| EP (2) | EP3608338A1 (ja) |
| JP (1) | JP6100697B2 (ja) |
| KR (2) | KR102048666B1 (ja) |
| CN (1) | CN103314011B (ja) |
| AR (1) | AR083972A1 (ja) |
| AU (1) | AU2011331998B2 (ja) |
| BR (2) | BR122020011337B1 (ja) |
| CA (2) | CA3079595C (ja) |
| CL (1) | CL2013001468A1 (ja) |
| EA (1) | EA029669B1 (ja) |
| IL (1) | IL226399A (ja) |
| JO (2) | JO3756B1 (ja) |
| MX (1) | MX336943B (ja) |
| MY (1) | MY170570A (ja) |
| NZ (1) | NZ610734A (ja) |
| PH (1) | PH12013501048A1 (ja) |
| SG (3) | SG190398A1 (ja) |
| TW (1) | TWI586686B (ja) |
| UY (1) | UY33748A (ja) |
| WO (1) | WO2012071372A2 (ja) |
Families Citing this family (81)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JO3672B1 (ar) | 2008-12-15 | 2020-08-27 | Regeneron Pharma | أجسام مضادة بشرية عالية التفاعل الكيماوي بالنسبة لإنزيم سبتيليسين كنفرتيز بروبروتين / كيكسين نوع 9 (pcsk9). |
| JO3756B1 (ar) | 2010-11-23 | 2021-01-31 | Regeneron Pharma | اجسام مضادة بشرية لمستقبلات الجلوكاجون |
| US8771696B2 (en) | 2010-11-23 | 2014-07-08 | Regeneron Pharmaceuticals, Inc. | Method of reducing the severity of stress hyperglycemia with human antibodies to the glucagon receptor |
| MX347602B (es) | 2011-01-28 | 2017-05-03 | Sanofi Biotechnology | Composiciones farmaceuticas que comprenden anticuerpos humanos frente a pcsk9. |
| AR087305A1 (es) | 2011-07-28 | 2014-03-12 | Regeneron Pharma | Formulaciones estabilizadas que contienen anticuerpos anti-pcsk9, metodo de preparacion y kit |
| PL4252857T3 (pl) | 2011-09-16 | 2025-03-03 | Regeneron Pharmaceuticals, Inc. | Sposoby redukowania poziomów lipoproteiny(a) poprzez podawanie inhibitora proproteinowej konwertazy subtylizyny keksyny-9 (pcsk9) |
| US9255154B2 (en) | 2012-05-08 | 2016-02-09 | Alderbio Holdings, Llc | Anti-PCSK9 antibodies and use thereof |
| ES2702315T3 (es) | 2012-08-24 | 2019-02-28 | Univ California | Anticuerpos y vacunas para su uso en tratar cánceres ROR1 e inhibir metástasis |
| AR095196A1 (es) | 2013-03-15 | 2015-09-30 | Regeneron Pharma | Medio de cultivo celular libre de suero |
| RU2015147721A (ru) | 2013-05-07 | 2017-06-15 | Ринат Нейросаенз Корпорэйшн | Антитела против рецептора глюкагона и способы их использования |
| US10111953B2 (en) | 2013-05-30 | 2018-10-30 | Regeneron Pharmaceuticals, Inc. | Methods for reducing remnant cholesterol and other lipoprotein fractions by administering an inhibitor of proprotein convertase subtilisin kexin-9 (PCSK9) |
| CN104231083A (zh) * | 2013-06-09 | 2014-12-24 | 杭州鸿运华宁生物医药工程有限公司 | 抗胰高血糖素受体的抗体及其用途 |
| WO2015189698A2 (en) * | 2014-06-08 | 2015-12-17 | Beijing Cosci-Remd Bio Med Tech Company Ltd | Methods for treating type 1 diabetes using glucagon receptor antagonistic antibodies |
| WO2016010927A1 (en) * | 2014-07-14 | 2016-01-21 | Amgen Inc. | Crystalline antibody formulations |
| CN107001461A (zh) | 2014-09-16 | 2017-08-01 | 瑞泽恩制药公司 | 抗胰高血糖素抗体及其使用方法 |
| CN107683289B (zh) | 2015-01-26 | 2021-08-06 | 芝加哥大学 | IL13Rα2结合剂和其在癌症治疗中的用途 |
| EP3250611B1 (en) | 2015-01-26 | 2021-04-21 | The University of Chicago | Car t-cells recognizing cancer-specific il 13r-alpha2 |
| US10745456B2 (en) * | 2015-04-01 | 2020-08-18 | The Scripps Research Institute | Methods and compositions related to GPCR agonist polypeptides |
| CN108330112A (zh) * | 2015-06-01 | 2018-07-27 | 中国药科大学 | HMG-CoA还原酶的两个B细胞表位及包含其中一个或两个表位的抗原肽 |
| TW202440903A (zh) | 2015-08-04 | 2024-10-16 | 美商再生元醫藥公司 | 補充牛磺酸之細胞培養基及用法(一) |
| TW201713690A (zh) * | 2015-08-07 | 2017-04-16 | 再生元醫藥公司 | 抗angptl8抗體及其用途 |
| US10772956B2 (en) | 2015-08-18 | 2020-09-15 | Regeneron Pharmaceuticals, Inc. | Methods for reducing or eliminating the need for lipoprotein apheresis in patients with hyperlipidemia by administering alirocumab |
| WO2017055966A1 (en) | 2015-10-01 | 2017-04-06 | Pfizer Inc. | Low viscosity antibody compositions |
| TWI752920B (zh) * | 2015-10-12 | 2022-01-21 | 美商再生元醫藥公司 | 活化瘦素受體的抗原結合蛋白 |
| CN107474134B (zh) * | 2016-06-08 | 2021-07-27 | 苏州康乃德生物医药有限公司 | 用于结合白细胞介素4受体的抗体 |
| MX2018016330A (es) | 2016-06-27 | 2020-02-17 | Univ California | Combinaciones para tratamiento del cáncer. |
| EP3504328A1 (en) | 2016-08-24 | 2019-07-03 | Regeneron Pharmaceuticals, Inc. | Host cell protein modification |
| US10995146B2 (en) * | 2016-08-30 | 2021-05-04 | Regeneron Pharmaceuticals, Inc. | Methods of treating severe insulin resistance by interfering with glucagon receptor signaling |
| US20190248888A1 (en) | 2016-10-20 | 2019-08-15 | Regeneron Pharmaceuticals, Inc. | Methods of lowering blood glucose levels |
| JP7133551B2 (ja) | 2016-11-17 | 2022-09-08 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | 抗angptl8抗体を用いて肥満を処置する方法 |
| JP7005638B2 (ja) | 2017-01-27 | 2022-02-04 | エヌジーエム バイオファーマシューティカルス,インコーポレーテッド | グルカゴン受容体結合タンパク質及びその使用方法 |
| EP3967765A1 (en) | 2017-07-06 | 2022-03-16 | FrieslandCampina Nederland B.V. | Cell culture process for making a glycoprotein |
| EP3672620A1 (en) | 2017-08-22 | 2020-07-01 | Regeneron Pharmaceuticals, Inc. | Methods of treating urea cycle disorders by interfering with glucagon receptor signaling |
| US11977081B2 (en) | 2017-12-18 | 2024-05-07 | Regeneron Pharmaceuticals, Inc. | ANGPTL8 assay and uses thereof |
| WO2019126123A1 (en) | 2017-12-22 | 2019-06-27 | Regeneron Pharmaceuticals, Inc. | System and method for characterizing drug product impurities |
| AU2019215363A1 (en) | 2018-01-31 | 2020-07-23 | Regeneron Pharmaceuticals, Inc. | System and method for characterizing size and charge variant drug product impurities |
| TW202311746A (zh) | 2018-02-02 | 2023-03-16 | 美商再生元醫藥公司 | 用於表徵蛋白質二聚合之系統及方法 |
| KR20200127979A (ko) | 2018-02-28 | 2020-11-11 | 리제너론 파마슈티칼스 인코포레이티드 | 바이러스 오염물질을 확인하기 위한 시스템 및 방법 |
| US12253490B2 (en) | 2018-03-19 | 2025-03-18 | Regeneron Pharmaceuticals, Inc. | Microchip capillary electrophoresis assays and reagents |
| US12259355B2 (en) | 2018-03-19 | 2025-03-25 | Regeneron Pharmaceuticals, Inc. | Microchip capillary electrophoresis assays and reagents |
| EP4317959A3 (en) | 2018-03-19 | 2024-03-27 | Regeneron Pharmaceuticals, Inc. | Microchip capillary electrophoresis assays and reagents |
| CN110357959B (zh) * | 2018-04-10 | 2023-02-28 | 鸿运华宁(杭州)生物医药有限公司 | Gcgr抗体及其与glp-1的融合蛋白质,以及其药物组合物和应用 |
| TW202016125A (zh) | 2018-05-10 | 2020-05-01 | 美商再生元醫藥公司 | 用於定量及調節蛋白質黏度之系統與方法 |
| EP3829636A1 (en) | 2018-07-27 | 2021-06-09 | NGM Biopharmaceuticals, Inc. | Use of glucagon receptor antagonists with immunotherapeutic agent |
| MY204234A (en) | 2018-08-27 | 2024-08-16 | Regeneron Pharma | Use of raman spectroscopy in downstream purification |
| BR112020026348A2 (pt) | 2018-08-30 | 2021-03-30 | Regeneron Pharmaceuticals, Inc. | Método para avaliar a estequiometria e distribuição de tamanho de complexos de proteínas, para selecionar um medicamento de proteína principal e para caracterizar complexos de proteínas, e, composição farmacêutica |
| MX2021007444A (es) * | 2018-12-21 | 2021-08-05 | Jiangsu Hengrui Medicine Co | Proteina biespecifica. |
| KR20210114927A (ko) | 2019-01-16 | 2021-09-24 | 리제너론 파마슈티칼스 인코포레이티드 | 이황화 결합을 특징 짓는 방법 |
| CA3154387A1 (en) * | 2019-09-13 | 2021-03-18 | Tri-Institutional Therapeutics Discovery Institute, Inc. | Anti-cd371 antibodies and uses thereof |
| CN114667450B (zh) | 2019-09-24 | 2025-05-02 | 里珍纳龙药品有限公司 | 用于色谱介质的使用和再生的系统及方法 |
| US12297451B1 (en) | 2019-10-25 | 2025-05-13 | Regeneron Pharmaceuticals, Inc. | Cell culture medium |
| CN110694068A (zh) * | 2019-11-06 | 2020-01-17 | 北京市心肺血管疾病研究所 | 一种抑制血管生成素样蛋白8的物质的应用 |
| US11730793B2 (en) | 2019-11-25 | 2023-08-22 | Regeneron Pharmaceuticals, Inc. | Sustained release formulations using non-aqueous emulsions |
| EP4354145B1 (en) | 2020-01-21 | 2025-09-17 | Regeneron Pharmaceuticals, Inc. | Deglycosylation methods for electrophoresis of glycosylated proteins |
| CA3192999A1 (en) | 2020-08-31 | 2022-03-03 | Regeneron Pharmaceuticals, Inc. | Asparagine feed strategies to improve cell culture performance and mitigate asparagine sequence variants |
| KR20230113280A (ko) | 2020-11-25 | 2023-07-28 | 리제너론 파마슈티칼스 인코포레이티드 | 비수성 멤브레인 유화법을 사용한 지속 방출 제형 |
| CN116710124A (zh) | 2020-12-17 | 2023-09-05 | 瑞泽恩制药公司 | 包封蛋白质的微凝胶的制造 |
| US12031151B2 (en) | 2021-01-20 | 2024-07-09 | Regeneron Pharmaceuticals, Inc. | Methods of improving protein titer in cell culture |
| AR125585A1 (es) | 2021-03-03 | 2023-08-02 | Regeneron Pharma | Sistemas y métodos para cuantificar y modificar la viscosidad de proteínas |
| MX2023010794A (es) | 2021-03-26 | 2023-10-25 | Regeneron Pharma | Metodos y sistemas para el desarrollo de protocolos de mezcla. |
| CA3220848A1 (en) | 2021-06-01 | 2022-12-08 | Timothy Riehlman | Microchip capillary electrophoresis assays and reagents |
| TW202326138A (zh) | 2021-09-08 | 2023-07-01 | 美商再生元醫藥公司 | 用於定量抗體及其他含Fc蛋白之高通量及基於質譜之方法 |
| JP2024531800A (ja) | 2021-09-20 | 2024-08-29 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | 抗体の不均一性を制御する方法 |
| KR20240090312A (ko) | 2021-10-07 | 2024-06-21 | 리제너론 파아마슈티컬스, 인크. | Ph 미터 보정 및 교정 |
| TW202323817A (zh) | 2021-10-07 | 2023-06-16 | 美商再生元醫藥公司 | Ph建模及控制之系統及方法 |
| CA3236367A1 (en) | 2021-10-26 | 2023-05-04 | Michelle Lafond | Systems and methods for generating laboratory water and distributing laboratory water at different temperatures |
| JP2025508233A (ja) | 2022-03-18 | 2025-03-21 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | ポリペプチド変異体を分析するための方法およびシステム |
| WO2024130048A1 (en) | 2022-12-16 | 2024-06-20 | Regeneron Pharmaceuticals, Inc. | Methods and systems for assessing chromatographic column integrity |
| TW202445126A (zh) | 2023-01-25 | 2024-11-16 | 美商再生元醫藥公司 | 基於質譜法之體內共表現抗體之表徵 |
| US20240245779A1 (en) | 2023-01-25 | 2024-07-25 | Regeneron Pharmaceuticals, Inc. | Methods of modeling liquid protein composition stability |
| TW202446462A (zh) | 2023-02-22 | 2024-12-01 | 美商再生元醫藥公司 | 系統適用性參數及管柱老化 |
| TW202508625A (zh) | 2023-05-01 | 2025-03-01 | 美商再生元醫藥公司 | 使用苯酚或苯甲醇之多劑量抗體藥物產品 |
| WO2025054406A1 (en) | 2023-09-08 | 2025-03-13 | Regeneron Pharmaceuticals, Inc. | Methods and systems for assessing chromatographic column integrity |
| US20250095773A1 (en) | 2023-09-18 | 2025-03-20 | Regeneron Pharmaceuticals, Inc. | Methods and systems for developing chromatography protocols |
| WO2025072597A2 (en) | 2023-09-29 | 2025-04-03 | Regeneron Pharmaceuticals, Inc. | Lyophilization using controlled nucleation |
| US20250129117A1 (en) | 2023-10-18 | 2025-04-24 | Regeneron Pharmaceuticals, Inc. | Rapid purification of monoclonal antibody from in-process upstream cell culture material |
| WO2025096932A1 (en) | 2023-11-02 | 2025-05-08 | Regeneron Pharmaceuticals, Inc. | Methods for reducing lipase activity using stress |
| WO2025166281A1 (en) | 2024-02-01 | 2025-08-07 | Regeneron Pharmaceuticals, Inc. | Platform for charge-detection mass spectrometry analysis of aavs |
| WO2025175164A1 (en) | 2024-02-16 | 2025-08-21 | Regeneron Pharmaceuticals, Inc. | Methods of producing concentrated formulated drug substances comprising proteins, and concentrated formulated drug substance made by the methods |
| WO2025194043A1 (en) | 2024-03-15 | 2025-09-18 | Regeneron Pharmaceuticals, Inc. | Polysorbate and polyoxyethylene sorbitan as excipients for stable protein formulations |
| WO2025259840A1 (en) | 2024-06-13 | 2025-12-18 | Regeneron Pharmaceuticals, Inc. | Methods and systems for scaled chromatography |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5776725A (en) * | 1992-08-28 | 1998-07-07 | Zymogenetics, Inc. | Recombinant production of glucagon receptors |
| RU2184779C2 (ru) | 1992-08-28 | 2002-07-10 | Ново Нордиск А/С | Изолированная молекула днк, кодирующая рецептор глюкагона, днк-конструкция, линия клеток, способ получения рецептора глюкагона, изолированный пептид рецептора глюкагона, изолированное антитело, зонд, способ обнаружения присутствия антагонистов глюкагона |
| US6596541B2 (en) * | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US20070173473A1 (en) | 2001-05-18 | 2007-07-26 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of proprotein convertase subtilisin Kexin 9 (PCSK9) gene expression using short interfering nucleic acid (siNA) |
| US20030199445A1 (en) | 2002-02-07 | 2003-10-23 | Knudsen Lotte Bjerre | Use of GLP-1 compound for treatment of critically ill patients |
| US20040101920A1 (en) | 2002-11-01 | 2004-05-27 | Czeslaw Radziejewski | Modification assisted profiling (MAP) methodology |
| EP1740946B1 (en) | 2004-04-20 | 2013-11-06 | Genmab A/S | Human monoclonal antibodies against cd20 |
| WO2007131237A2 (en) | 2006-05-05 | 2007-11-15 | Isis Pharmaceuticals, Inc. | Compounds and methods for modulating expression of ptp1b |
| PL2374818T3 (pl) * | 2006-06-02 | 2013-05-31 | Regeneron Pharma | Przeciwciała o wysokim powinowactwie przeciw ludzkiemu receptorowi IL 6 |
| CL2007002668A1 (es) | 2006-09-20 | 2008-05-09 | Amgen Inc | Proteina de union a antigeno que se une al receptor de glucagon humano; acido nucleico que la codifica; metodo de produccion; composicion farmaceutica que la comprende; y su uso para tratar o prevenir la diabetes tipo 2. |
| US20100150937A1 (en) | 2006-11-07 | 2010-06-17 | Sparrow Carl P | Antagonists of pcsk9 |
| US20100041102A1 (en) | 2006-11-07 | 2010-02-18 | Ayesha Sitlani | Antagonists of pcsk9 |
| US20100040611A1 (en) | 2006-11-07 | 2010-02-18 | Sparrow Carl P | Antagonists of pcsk9 |
| WO2008133647A2 (en) | 2006-11-07 | 2008-11-06 | Merck & Co., Inc. | Antagonists of pcsk9 |
| EP2142217B1 (en) | 2007-03-27 | 2014-11-05 | Merck Sharp & Dohme Corp. | Method for detecting autoprocessed, secreted pcsk9 |
| WO2008125623A2 (en) | 2007-04-13 | 2008-10-23 | Novartis Ag | Molecules and methods for modulating proprotein convertase subtilisin/kexin type 9 (pcsk9) |
| US7537903B2 (en) | 2007-04-23 | 2009-05-26 | Board Of Regents, The University Of Texas System | FGF21 upregulates expression of GLUT-1 in a βklotho-dependent manner |
| KR20100017169A (ko) | 2007-05-22 | 2010-02-16 | 노파르티스 아게 | Fgf21-관련 장애의 치료, 진단 및 검출 방법 |
| JOP20080381B1 (ar) | 2007-08-23 | 2023-03-28 | Amgen Inc | بروتينات مرتبطة بمولدات مضادات تتفاعل مع بروبروتين كونفيرتاز سيتيليزين ككسين من النوع 9 (pcsk9) |
| SG2013014352A (en) | 2007-10-26 | 2014-09-26 | Merck Sharp & Dohme | Anti-pcsk9 and methods for treating lipid and cholesterol disorders |
| AR070316A1 (es) | 2008-02-07 | 2010-03-31 | Merck & Co Inc | Antagonistas de pcsk9 (proproteina subtilisina-kexina tipo 9) |
| AR070315A1 (es) | 2008-02-07 | 2010-03-31 | Merck & Co Inc | Anticuerpos 1b20 antagonistas de pcsk9 |
| CN104975020B (zh) | 2008-02-11 | 2020-01-17 | 菲奥医药公司 | 经修饰的RNAi多核苷酸及其用途 |
| CA2716255C (en) | 2008-02-21 | 2016-11-29 | Dermacare Neuroscience Institute | Cosmetic and dermatological formulations of mntf peptides |
| WO2009114475A2 (en) | 2008-03-09 | 2009-09-17 | Intradigm Corporation | Compositions comprising human pcsk9 and apolipoprotein b sirna and methods of use |
| PE20091674A1 (es) | 2008-03-27 | 2009-11-04 | Lilly Co Eli | Antagonistas del receptor de glucagon |
| TWI445716B (zh) | 2008-09-12 | 2014-07-21 | Rinat Neuroscience Corp | Pcsk9拮抗劑類 |
| JO3672B1 (ar) | 2008-12-15 | 2020-08-27 | Regeneron Pharma | أجسام مضادة بشرية عالية التفاعل الكيماوي بالنسبة لإنزيم سبتيليسين كنفرتيز بروبروتين / كيكسين نوع 9 (pcsk9). |
| MX368932B (es) | 2009-06-26 | 2019-10-22 | Regeneron Pharma | Anticuerpos biespecificos facilmente aislados con formato de inmunoglobulina original. |
| US9102732B2 (en) * | 2009-09-08 | 2015-08-11 | Neopharm Co., Ltd. | Antibodies against glucagon receptor and their use |
| JP2013512672A (ja) | 2009-12-02 | 2013-04-18 | アムジエン・インコーポレーテツド | ヒトFGFR1c、ヒトβ−クロト−、ならびにヒトFGFR1cおよびヒトβ−クロト−の両方に結合する結合タンパク質 |
| JO3756B1 (ar) | 2010-11-23 | 2021-01-31 | Regeneron Pharma | اجسام مضادة بشرية لمستقبلات الجلوكاجون |
| US8771696B2 (en) | 2010-11-23 | 2014-07-08 | Regeneron Pharmaceuticals, Inc. | Method of reducing the severity of stress hyperglycemia with human antibodies to the glucagon receptor |
-
2011
- 2011-11-20 JO JOP/2011/0351A patent/JO3756B1/ar active
- 2011-11-22 CA CA3079595A patent/CA3079595C/en active Active
- 2011-11-22 MY MYPI2013700859A patent/MY170570A/en unknown
- 2011-11-22 US US13/301,944 patent/US8545847B2/en active Active
- 2011-11-22 WO PCT/US2011/061766 patent/WO2012071372A2/en not_active Ceased
- 2011-11-22 AU AU2011331998A patent/AU2011331998B2/en active Active
- 2011-11-22 MX MX2013005757A patent/MX336943B/es active IP Right Grant
- 2011-11-22 TW TW100142719A patent/TWI586686B/zh active
- 2011-11-22 BR BR122020011337-5A patent/BR122020011337B1/pt active IP Right Grant
- 2011-11-22 SG SG2013040159A patent/SG190398A1/en unknown
- 2011-11-22 EA EA201370126A patent/EA029669B1/ru unknown
- 2011-11-22 JP JP2013541008A patent/JP6100697B2/ja active Active
- 2011-11-22 PH PH1/2013/501048A patent/PH12013501048A1/en unknown
- 2011-11-22 CN CN201180065144.XA patent/CN103314011B/zh active Active
- 2011-11-22 KR KR1020197005202A patent/KR102048666B1/ko active Active
- 2011-11-22 NZ NZ610734A patent/NZ610734A/en unknown
- 2011-11-22 CA CA2818426A patent/CA2818426C/en active Active
- 2011-11-22 EP EP19197072.2A patent/EP3608338A1/en active Pending
- 2011-11-22 SG SG10201906478VA patent/SG10201906478VA/en unknown
- 2011-11-22 EP EP11790716.2A patent/EP2643355B1/en active Active
- 2011-11-22 SG SG10201500198TA patent/SG10201500198TA/en unknown
- 2011-11-22 KR KR1020137016135A patent/KR101952786B1/ko active Active
- 2011-11-22 BR BR112013012782-1A patent/BR112013012782B1/pt active IP Right Grant
- 2011-11-23 AR ARP110104368 patent/AR083972A1/es active IP Right Grant
- 2011-11-23 UY UY33748A patent/UY33748A/es active IP Right Grant
-
2013
- 2013-05-16 IL IL226399A patent/IL226399A/en active IP Right Grant
- 2013-05-23 CL CL2013001468A patent/CL2013001468A1/es unknown
- 2013-08-30 US US14/014,517 patent/US9127068B2/en active Active
-
2015
- 2015-08-07 US US14/821,652 patent/US9587029B2/en active Active
-
2017
- 2017-01-25 US US15/415,672 patent/US10233250B2/en active Active
-
2019
- 2019-01-24 US US16/256,190 patent/US10640566B2/en active Active
-
2020
- 2020-04-01 US US16/837,930 patent/US11498970B2/en active Active
- 2020-08-24 JO JOP/2020/0202A patent/JOP20200202A1/ar unknown
-
2022
- 2022-10-11 US US18/045,592 patent/US12269889B2/en active Active
-
2025
- 2025-02-26 US US19/063,721 patent/US20250304704A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6100697B2 (ja) | グルカゴン受容体に対するヒト抗体 | |
| US9358287B2 (en) | Method of treating stress hyperglycemia with human antibodies to the glucagon receptor | |
| US9657099B2 (en) | Anti-glucagon antibodies | |
| JP5318965B2 (ja) | Pcsk9に対する高親和性ヒト抗体 | |
| HK40014899A (en) | Human antibodies to the glucagon receptor | |
| HK1190159A (en) | Human antibodies to the glucagon receptor | |
| HK1190159B (en) | Human antibodies to the glucagon receptor |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20141119 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20151207 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160302 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160704 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160930 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170130 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170223 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6100697 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: R3D02 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |