JP5774518B2 - 化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム - Google Patents
化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム Download PDFInfo
- Publication number
- JP5774518B2 JP5774518B2 JP2012036512A JP2012036512A JP5774518B2 JP 5774518 B2 JP5774518 B2 JP 5774518B2 JP 2012036512 A JP2012036512 A JP 2012036512A JP 2012036512 A JP2012036512 A JP 2012036512A JP 5774518 B2 JP5774518 B2 JP 5774518B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- compound
- liquid crystal
- carbon atoms
- independently
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 Cc(cc(cc1)OC(c2cc(*)c(*)c(*)c2)=O)c1OC(c1cc(*)c(*)c(*)c1)=O Chemical compound Cc(cc(cc1)OC(c2cc(*)c(*)c(*)c2)=O)c1OC(c1cc(*)c(*)c(*)c1)=O 0.000 description 3
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/52—Liquid crystal materials characterised by components which are not liquid crystals, e.g. additives with special physical aspect: solvents, solid particles
- C09K19/54—Additives having no specific mesophase characterised by their chemical composition
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/76—Esters of carboxylic acids having a carboxyl group bound to a carbon atom of a six-membered aromatic ring
- C07C69/84—Esters of carboxylic acids having a carboxyl group bound to a carbon atom of a six-membered aromatic ring of monocyclic hydroxy carboxylic acids, the hydroxy groups and the carboxyl groups of which are bound to carbon atoms of a six-membered aromatic ring
- C07C69/92—Esters of carboxylic acids having a carboxyl group bound to a carbon atom of a six-membered aromatic ring of monocyclic hydroxy carboxylic acids, the hydroxy groups and the carboxyl groups of which are bound to carbon atoms of a six-membered aromatic ring with etherified hydroxyl groups
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K19/06—Non-steroidal liquid crystal compounds
- C09K19/08—Non-steroidal liquid crystal compounds containing at least two non-condensed rings
- C09K19/10—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing at least two benzene rings
- C09K19/20—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing at least two benzene rings linked by a chain containing carbon and oxygen atoms as chain links, e.g. esters or ethers
- C09K19/2007—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing at least two benzene rings linked by a chain containing carbon and oxygen atoms as chain links, e.g. esters or ethers the chain containing -COO- or -OCO- groups
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K19/06—Non-steroidal liquid crystal compounds
- C09K19/32—Non-steroidal liquid crystal compounds containing condensed ring systems, i.e. fused, bridged or spiro ring systems
- C09K19/322—Compounds containing a naphthalene ring or a completely or partially hydrogenated naphthalene ring
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K19/06—Non-steroidal liquid crystal compounds
- C09K19/34—Non-steroidal liquid crystal compounds containing at least one heterocyclic ring
- C09K19/3441—Non-steroidal liquid crystal compounds containing at least one heterocyclic ring having nitrogen as hetero atom
- C09K19/3475—Non-steroidal liquid crystal compounds containing at least one heterocyclic ring having nitrogen as hetero atom the heterocyclic ring being a six-membered aromatic ring containing at least three nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/52—Liquid crystal materials characterised by components which are not liquid crystals, e.g. additives with special physical aspect: solvents, solid particles
- C09K19/58—Dopants or charge transfer agents
- C09K19/586—Optically active dopants; chiral dopants
- C09K19/588—Heterocyclic compounds
-
- G—PHYSICS
- G02—OPTICS
- G02F—OPTICAL DEVICES OR ARRANGEMENTS FOR THE CONTROL OF LIGHT BY MODIFICATION OF THE OPTICAL PROPERTIES OF THE MEDIA OF THE ELEMENTS INVOLVED THEREIN; NON-LINEAR OPTICS; FREQUENCY-CHANGING OF LIGHT; OPTICAL LOGIC ELEMENTS; OPTICAL ANALOGUE/DIGITAL CONVERTERS
- G02F1/00—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics
- G02F1/01—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour
- G02F1/13—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour based on liquid crystals, e.g. single liquid crystal display cells
- G02F1/133—Constructional arrangements; Operation of liquid crystal cells; Circuit arrangements
- G02F1/1333—Constructional arrangements; Manufacturing methods
- G02F1/1335—Structural association of cells with optical devices, e.g. polarisers or reflectors
- G02F1/13363—Birefringent elements, e.g. for optical compensation
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K2019/0425—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a specific unit that results in a functional effect
- C09K2019/0429—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a specific unit that results in a functional effect the specific unit being a carbocyclic or heterocyclic discotic unit
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K2019/0425—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a specific unit that results in a functional effect
- C09K2019/044—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a specific unit that results in a functional effect the specific unit being a perfluoro chain used as an end group
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K19/06—Non-steroidal liquid crystal compounds
- C09K19/08—Non-steroidal liquid crystal compounds containing at least two non-condensed rings
- C09K19/10—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing at least two benzene rings
- C09K19/20—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing at least two benzene rings linked by a chain containing carbon and oxygen atoms as chain links, e.g. esters or ethers
- C09K19/2007—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing at least two benzene rings linked by a chain containing carbon and oxygen atoms as chain links, e.g. esters or ethers the chain containing -COO- or -OCO- groups
- C09K2019/2078—Ph-COO-Ph-COO-Ph
-
- G—PHYSICS
- G02—OPTICS
- G02F—OPTICAL DEVICES OR ARRANGEMENTS FOR THE CONTROL OF LIGHT BY MODIFICATION OF THE OPTICAL PROPERTIES OF THE MEDIA OF THE ELEMENTS INVOLVED THEREIN; NON-LINEAR OPTICS; FREQUENCY-CHANGING OF LIGHT; OPTICAL LOGIC ELEMENTS; OPTICAL ANALOGUE/DIGITAL CONVERTERS
- G02F1/00—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics
- G02F1/01—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour
- G02F1/13—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour based on liquid crystals, e.g. single liquid crystal display cells
- G02F1/133—Constructional arrangements; Operation of liquid crystal cells; Circuit arrangements
- G02F1/1333—Constructional arrangements; Manufacturing methods
- G02F1/1335—Structural association of cells with optical devices, e.g. polarisers or reflectors
- G02F1/13363—Birefringent elements, e.g. for optical compensation
- G02F1/133638—Waveplates, i.e. plates with a retardation value of lambda/n
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Crystallography & Structural Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Nonlinear Science (AREA)
- Mathematical Physics (AREA)
- General Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Polarising Elements (AREA)
- Liquid Crystal (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Liquid Crystal Substances (AREA)
Description
[1] 下記一般式(I)で表される化合物。
[2] [1]の化合物は、前記一般式(I)において、Tが
であることが好ましい。
[3] [1]または[2]に記載の化合物は、前記一般式(I)において、L3が−COO−かつ、L4が−OCO−であり、A1およびA2がそれぞれ独立に
[4] [1]〜[3]のいずれか1項に記載の化合物は、前記一般式(I)において、Hbがそれぞれ独立に炭素数2〜30のパーフルオロアルキル基であることが好ましい。
[5] [1]〜[4]のいずれか1項に記載の化合物を用いたヘイズ低下剤。
[6] 重合性液晶分子と下記一般式(I)で表される化合物を含む液晶組成物。
[7] [6]に記載の液晶組成物は、前記重合性液晶分子が棒状液晶分子であることが好ましい。
[8] [6]または[7]に記載の液晶組成物は、少なくとも1種のキラル化合物を含有することが好ましい。
[9] [6]〜[8]のいずれか1項に記載の液晶組成物を重合させてなる高分子材料。
[10] [9]に記載の高分子材料の少なくとも1種を含有するフィルム。
[11] [6]〜[8]のいずれか1項に記載の液晶組成物のコレステリック液晶相を固定してなるフィルム。
[12] [10]または[11]に記載のフィルムは、光学異方性を示すことが好ましい。
[13] [10]〜[12]のいずれか1項に記載のフィルムは、選択反射特性を示すことが好ましい。
[14] [13]に記載のフィルムは、赤外線波長域に選択反射特性を示すことが好ましい。
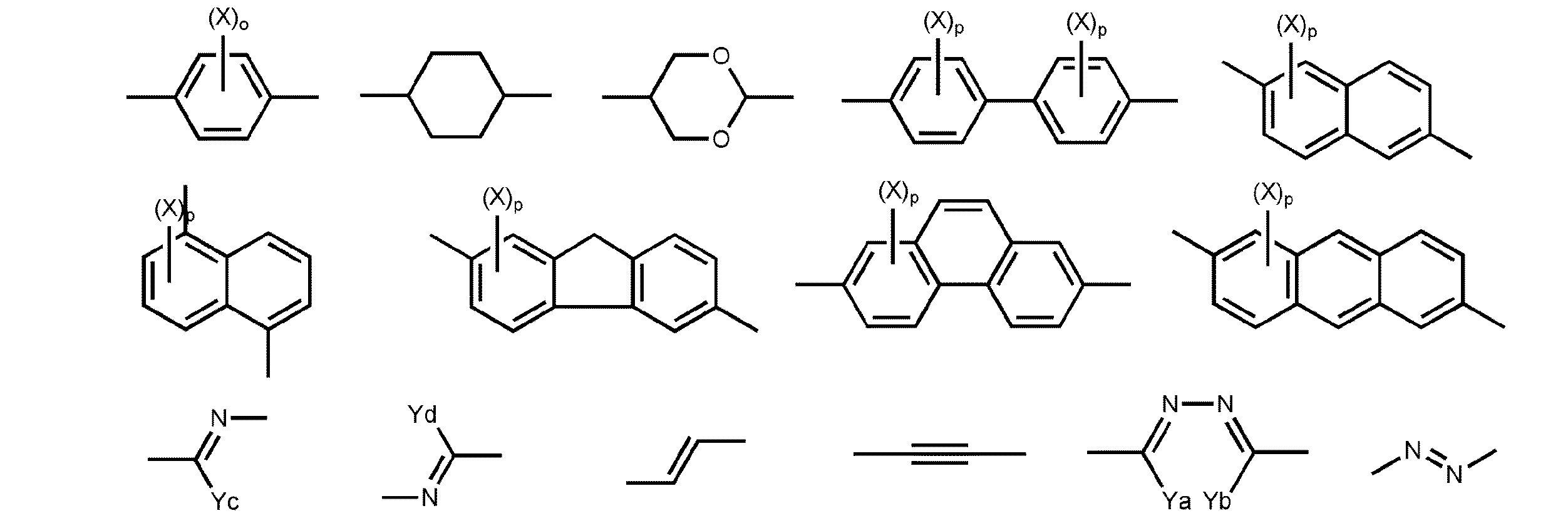
本発明の化合物は、下記一般式(I)で表されることを特徴とする。下記一般式(I)の化合物は二価の基を中心に有し、末端にアルキル基を有することを特徴とする。末端にフッ化アルキル基を有する化合物は配向促進剤として効果的であるが、従来知られている配向促進剤は、使用濃度範囲が狭いといった点や溶解性が低いといった点があり、用途が制限されていた。下記一般式(I)で表される化合物は同等以上の配向性能をより広い濃度範囲かつ良好な溶解性で示すことから、ヘイズ低下剤として好ましく用いることができる。また、液晶配向促進剤としても好ましく用いることができる。そのため、下記一般式(I)で表される化合物を含む組成物は製造において使用しやすいというメリットがある。また重合で硬化可能であることから、光学部材等の種々の用途に有用である。
Xがとりうるアルキル基の炭素数は1〜8であり、1〜5であることが好ましく、1〜3であることがより好ましい。アルキル基は、直鎖状、分枝状、環状のいずれであってもよく、直鎖状または分枝状であることが好ましい。好ましいアルキル基として、メチル基、エチル基、n−プロピル基、イソプロピル基などを例示することができ、その中でもメチル基が好ましい。Xがとりうるアルコキシ基のアルキル部分については、Xがとりうるアルキル基の説明と好ましい範囲を参照することができる。
Xがとりうるハロゲン原子としては、フッ素原子、塩素原子、臭素原子、ヨウ素原子を挙げることができ、塩素原子、臭素原子が好ましい。
Xがとりうる−COOR0としては、R0が水素原子、隣接するCH2がOまたはSで置換されていてもよいアルキル基もしくはフッ化アルキル基、または−Sp5−Pを表す。
R0が隣接するCH2がOまたはSで置換されていてもよいアルキル基もしくはフッ化アルキル基を表す場合、−Sp6−(L7−Sp7)q−CH3で表される基または−Sp8−(L8−Sp9)r−Hb0で表される基であることがより好ましい。
Sp6、Sp7、Sp8、Sp9はそれぞれ独立して単結合または炭素数1〜10のアルキレン基を表し、好ましくは単結合または炭素数1〜7のアルキレン基であり、より好ましくは単結合または炭素数1〜4のアルキレン基である。但し、Sp6、Sp7、Sp8、Sp9が表すアルキレン基の水素原子はフッ素原子で置換されていてもよいが置換されていないことが好ましく、該アルキレン基には分枝があっても無くてもよいが好ましいのは分枝がない直鎖のアルキレン基である。
L7、L8はそれぞれ独立して単結合、−O−、−S−、−CO−、−COO−、−OCO−、−COS−、−SCO−、−NRCO−、−CONR−(L7、L8中におけるRは水素原子または炭素数が1〜6のアルキル基を表す)を表し、−NRCO−、−CONR−は溶解性を減ずる効果があり、膜作成時にヘイズ値が上昇する傾向があることからより好ましくは−O−、−S−、−CO−、−COO−、−OCO−、−COS−、−SCO−であり、化合物の安定性の観点からさらに好ましくは−O−、−CO−、−COO−、−OCO−であり、よりさらに好ましくは−O−である。
qは1〜4の整数を表し、1〜3の整数であることが好ましく、2または3であることがより好ましく、3であることが特に好ましい。rは1〜4の整数を表し、1〜3の整数であることが好ましく、1または2であることがより好ましく、1であることが特に好ましい。qおよびrが2以上の整数である場合、複数のL7、L8、Sp7、Sp9はそれぞれ独立であっても異なっていてもよい。
Hb0は炭素数2〜30のパーフルオロアルキル基またはフルオロアルキル基を表し、より好ましくは炭素数3〜20のパーフルオロアルキル基またはフルオロアルキル基であり、さらに好ましくは3〜10のパーフルオロアルキル基またはフルオロアルキル基である。パーフルオロアルキル基またはフルオロアルキル基は、直鎖状、分枝状、環状のいずれであってもよいが、直鎖状または分枝状であるものが好ましく、直鎖状であることがより好ましい。Hb0は炭素数2〜30のパーフルオロアルキル基と炭素数2〜30のフルオロアルキル基の中では、炭素数2〜30のパーフルオロアルキル基であることが好ましい。
R0が−Sp5−Pを表す場合、Sp5は単結合または炭素数1〜10のアルキレン基を表し、好ましくは単結合または炭素数1〜7のアルキレン基であり、より好ましくは炭素数1〜4のアルキレン基である。但し、Sp5が表すアルキレン基の水素原子はフッ素原子で置換されていてもよく、該アルキレン基には分枝があっても無くてもよいが好ましいのは分枝がない直鎖のアルキレン基である。
前記Pは重合性基を表し、該重合性基としては特に制限はないが、エチレン性不飽和二重結合基であることが好ましく、メタクリロイル基またはアクリロイル基であることがより好ましく、アクリロイル基であることが特に好ましい。
Ya、Yb、Yc、Ydがとりうる炭素数1〜4のアルキル基は、直鎖状であっても分枝状であってもよい。例えば、メチル基、エチル基、n−プロピル基、イソプロピル基などを例示することができる。
前記二価の芳香族複素環基は、5員、6員または7員の複素環を有することが好ましい。5員環または6員環がさらに好ましく、6員環が最も好ましい。複素環を構成する複素原子としては、窒素原子、酸素原子および硫黄原子が好ましい。複素環は、芳香族性複素環であることが好ましい。芳香族性複素環は、一般に不飽和複素環である。最多二重結合を有する不飽和複素環がさらに好ましい。複素環の例には、フラン環、チオフェン環、ピロール環、ピロリン環、ピロリジン環、オキサゾール環、イソオキサゾール環、チアゾール環、イソチアゾール環、イミダゾール環、イミダゾリン環、イミダゾリジン環、ピラゾール環、ピラゾリン環、ピラゾリジン環、トリアゾール環、フラザン環、テトラゾール環、ピラン環、チイン環、ピリジン環、ピペリジン環、オキサジン環、モルホリン環、チアジン環、ピリダジン環、ピリミジン環、ピラジン環、ピペラジン環およびトリアジン環が含まれる。二価の複素環基は置換基を有していてもよい。そのような置換基の例の説明と好ましい範囲については、上記のA1とA2の3価または4価の芳香族炭化水素が取り得る置換基に関する説明と記載を参照することができる。
前記Hbが表すフルオロアルキル基は、末端が−CF2−Hであるフルオロアルキル基が好ましく、パーフルオロアルキレン基の一方の末端に−CF2−Hが連結したフルオロアルキル基であることがより好ましい。
Hbは炭素数2〜30のパーフルオロアルキル基と炭素数2〜30のフルオロアルキル基の中では、炭素数2〜30のパーフルオロアルキル基であることが好ましい。
o、pはそれぞれ独立に0以上の整数であり、oおよびpが2以上であるとき複数のXは互いに同一であっても異なっていてもよい。oは1または2であることが好ましい。pは1〜4のいずれかの整数であることが好ましく、1または2であることがより好ましい。
(CaF2a+1)−(CbH2b)−
(CaF2a+1)−(CbH2b)−O−(CrH2r)−
(CaF2a+1)−(CbH2b)−COO−(CrH2r)−
(CaF2a+1)−(CbH2b)−OCO−(CrH2r)−
上式において、aは2〜30であることが好ましく、3〜20であることがより好ましく、3〜10であることがさらに好ましい。bは0〜20であることが好ましく、0〜10であることがより好ましく、0〜5であることがさらに好ましい。a+bは3〜30である。rは1〜10であることが好ましく、1〜4であることがより好ましい。
また、一般式(I)の末端のHb−Sp1−L1−Sp2−L2−および−L5−Sp3−L6−Sp4−Hbは、以下のいずれかの一般式で表される基であることが好ましい。
(CaF2a+1)−(CbH2b)−O
(CaF2a+1)−(CbH2b)−COO−
(CaF2a+1)−(CbH2b)−O−(CrH2r)−O−
(CaF2a+1)−(CbH2b)−COO−(CrH2r)−COO−
(CaF2a+1)−(CbH2b)−OCO−(CrH2r)−COO−
上式におけるa、bおよびrの定義は直上の定義と同じである。
以下に、一般式(I)で表される化合物の具体例を示す。ただし、本発明で採用することができる一般式(I)で表される化合物は、下記の具体例によって限定的に解釈されるべきものではない。
本発明の液晶組成物は、重合性液晶性分子と前記一般式(I)で表される化合物とを含む。本発明の液晶組成物では、1種類以上の重合性液晶性分子と1種類以上の非重合性液晶性分子を併用してもよい。また、一般式(I)で表される化合物を二種類以上使用してもよく、一般式(I)で表される化合物とそれ以外の化合物を併用してもよい。前記一般式(I)で表される化合物は、液晶性分子の量の0.01〜20質量%の量で使用することが好ましい。前記一般式(I)で表される化合物の使用量は、液晶性分子の量の0.1〜10質量%の量であることがより好ましい。重合性液晶性分子としては、ディスコティック液晶性分子または棒状液晶性分子を用いることが好ましい。
D(−L−Q)d
上式中、Dは円盤状コアであり;Lは二価の連結基であり;Qは重合性基であり;dは4〜12の整数である。上記式の円盤状コア(D)の具体例を以下に示す。以下の各具体例において、LQ(またはQL)は、二価の連結基(L)と重合性基(Q)との組み合わせを意味する。以下の具体例の中では、トリフェニレン(D4)が特に好ましい。
一般式(I)で表される化合物を含む液晶組成物を塗布等の方法により製膜することによりフィルムを形成することができる。液晶組成物を配向膜の上に塗布し、液晶層を形成することにより光学異方性素子を作製することもできる。
液晶組成物の塗布は、公知の方法(例、押し出しコーティング法、ダイレクトグラビアコーティング法、リバースグラビアコーティング法、ダイコーティング法、バーコーティング法)により実施できる。液晶性分子は、配向状態を維持して固定することが好ましい。固定化は、液晶性分子に導入した重合性基(Q)の重合反応により実施することが好ましい。重合反応には、熱重合開始剤を用いる熱重合反応と光重合開始剤を用いる光重合反応とが含まれる。光重合反応が好ましい。光重合開始剤の例には、α−カルボニル化合物(米国特許2367661号、同2367670号の各明細書記載)、アシロインエーテル(米国特許2448828号明細書記載)、α−炭化水素置換芳香族アシロイン化合物(米国特許2722512号明細書記載)、多核キノン化合物(米国特許3046127号、同2951758号の各明細書記載)、トリアリールイミダゾールダイマーとp−アミノフェニルケトンとの組み合わせ(米国特許3549367号明細書記載)、アクリジンおよびフェナジン化合物(特開昭60−105667号公報、米国特許4239850号明細書記載)、オキサジアゾール化合物(米国特許4212970号明細書記載)、アシルフォスフィンオキシド化合物(特公昭63−40799号公報、特公平5−29234号公報、特開平10−95788号公報、特開平10−29997号公報記載)が含まれる。
配向膜は、有機化合物(好ましくはポリマー)のラビング処理、無機化合物の斜方蒸着、マイクログルーブを有する層の形成、あるいはラングミュア・ブロジェット法(LB膜)による有機化合物(例、ω−トリコサン酸、ジオクタデシルメチルアンモニウムクロライド、ステアリル酸メチル)の累積のような手段で、設けることができる。さらに、電場の付与、磁場の付与あるいは光照射により、配向機能が生じる配向膜も知られている。ポリマーのラビング処理により形成する配向膜が特に好ましい。ラビング処理は、ポリマー層の表面を、紙や布で一定方向に、数回こすることにより実施する。配向膜に使用するポリマーの種類は、液晶性分子の配向(特に平均傾斜角)に応じて決定する。液晶性分子を水平(平均傾斜角:0〜50゜)に配向させるためには、配向膜の表面エネルギーを低下させないポリマー(通常の配向膜用ポリマー)を用いる。液晶性分子を垂直(平均傾斜角:50〜90゜)に配向させるためには、配向膜の表面エネルギーを低下させるポリマーを用いる。配向膜の表面エネルギーを低下させるためには、ポリマーの側鎖に炭素数が10〜100の炭化水素基を導入することが好ましい。
本発明のフィルムや本発明のフィルムを有する光学異方性素子は、透明支持体を有していてもよい。透明支持体として、ガラス板またはポリマーフイルム、好ましくはポリマーフイルムが用いられる。支持体が透明であるとは、光透過率が80%以上であることを意味する。透明支持体として、一般には、光学等方性のポリマーフイルムが用いられている。光学等方性とは、具体的には、面内レターデーション(Re)が10nm未満であることが好ましく、5nm未満であることがさらに好ましい。また、光学等方性透明支持体では、厚み方向のレターデーション(Rth)も、10nm未満であることが好ましく、5nm未満であることがさらに好ましい。透明支持体の面内レターデーション(Re)と厚み方向のレターデーション(Rth)は、それぞれ下記式で定義される。
Re=(nx−ny) d
Rth=[{(nx+ny)/2}−nz] d
式中、nxおよびnyは、透明支持体の面内屈折率であり、nzは透明支持体の厚み方向の屈折率であり、そしてdは透明支持体の厚さである。
(1−1)エステル(1b)の合成
塩化メチレン100mlにアルコール(1a)(70.0g,200mmol)を加え、そこへトリエチルアミン(29.2ml,210mmol)を加えた。この溶液を氷水に浸し、トリフルオロメタンスルホン酸無水物(35.3ml,210mmol)を内温が20℃以下になるように滴下し、氷冷下で1時間反応させた。反応液を分液操作に施し、有機層をエバポレーターにより濃縮した。得られた液体を減圧蒸留し、対応するトリフルオロメタンスルホン酸エステル(1b)(85.0g,収率88%)を得た。
1H NMR(300MHz、CDCl3)δ4.8(t,2H)
エステル(1b)(22.4g,46.5mmol)と没食子酸メチルエステル(2.8g,15mmol)を炭酸カリウム(6.4g,46.5mmol)存在下、DMAc15ml中、90℃で2時間反応させた。分液処理の後、カラム精製を行い、エステル(1c)(15.0g, 85%)を得た。
1H NMR(300MHz、CDCl3)δ3.9(s,3H), 4.4−4.6(m,6H), 7.4(s,2H)
エステル(1c)(11.8g, 10mmol)をエタノール30ml、水3ml中に加えた。この溶液に水酸化カリウム(0.84g, 15mmol)を添加し2時間加熱還流した。この反応液を塩酸水溶液に滴下し固体を析出させた。吸引ろ過をし、カルボン酸(1d)(9.8g, 84%)
を得た。
カルボン酸(1d)(2.3g,2.0mmol)をトルエン10mlと触媒量のDMF中で塩化チオニル(0.22ml,3.0mmol)と反応させて酸クロライドとし、過剰の塩化チオニル及びトルエン除去後、THF5ml、触媒量のDMAPを系中に添加した。そこへ、THF5ml及びジイソプロピルエチルアミン0.37mlに溶かしたメチルハイドロキノン(124mg,1.0mmol)を滴下し、室温で3時間反応させた。分液操作後、エバポレーターにて濃縮し、カラム精製を行い、メタノールで再結晶して化合物(1)(0.79g,収率33%)を得た。
1H NMR(400MHz、CDCl3)δ2.3(s,3H), 4.5−4.7(m,12H), 7.0−7.2(s×3,3H), 7.6(s×2,4H)
化合物(8)の合成
1H NMR(400MHz、CDCl3)δ4.4−4.7(m,12H), 7.3(s,4H), 7.6(s,4H)
化合物(2)の合成
(3−1)トシル誘導体(3b)の合成
アルコール(3a)(45.7ml,300mmol)とパラトルエンスルホニルクロライド(60.1g,315mmol)を120mlの塩化メチレン中、氷冷下で1時間反応させた。反応液を分液操作に施し、有機層をエバポレーターにより濃縮し、粗体として黄色液体のトシルエーテル体(3b)を得た。このまま精製せずに次工程の原料として使用した。
1HNMR(300MHz、CDCl3)δ2.4(s,3H), 3.6(d,2H), 4.2(d,2H), 4.4(s,2H), 7.1−7.4(d×3,s×1,7H), 7.8(d,2H)
トシル誘導体(3b)(16.2g,50mmol)と2−(パーフルオロヘキシル)エタノール(12.1ml,55ml)をトルエン100mlに加え、ベンジルトリメチルアンモニウムヒドロキサイド水溶液105ml加えた。70℃に昇温して30分攪拌した後、水酸化カリウム水溶液(3.1g/水20ml)を添加した。その後、80℃に昇温し、5時間反応させた。酢酸エチルを100ml、水を50mlを加えて分液した後濃縮し、粗体としてエーテル(3c)を得た。このまま精製せずに次工程の原料として使用した。
1HNMR(300MHz、CDCl3)δ2.5(m,2H), 3.8(d,2H), 4.0(d,2H), 4.4(s,2H), 7.1−7.4(m,5H)
エーテル(3c)(20.0g,40mmol)を酢酸エチル40ml中で、パラジウム触媒(1.2g,5%パラジウム/活性炭素、デグサタイプE 101 O/W 5%Pd,wako社製)存在下、水素と反応させた。反応終了後、セライトろ過によりパラジウム触媒を除去し、濃縮し、粗体のアルコール(2e)を得た。このまま精製せずに次工程の原料として使用した。
1H NMR(400MHz、CDCl3)δ2.4(m,2H), 3.6(d,2H), 3.7(d,2H), 3.8(d,2H)
アルコール(3d)(18.0g,45mmol)を酢酸エチル30ml中に添加し、氷冷した。反応系内の温度を20℃以下に保って、メタンスルホニルクロライド(3.8ml,49.5mmol)を滴下した。室温で3時間反応させ、酢酸エチルと水によって分液し、濃縮し、粗体のメタンスルホン酸エステル(3e)を得た。このまま精製せずに次工程の原料として使用した。
エステル(3e)(10.6g,21.6mmol)と没食子酸メチルエステル(1.28g,7.0mmol)を炭酸カリウム(3.0g,21.6mmol)存在下、DMAc40ml中、90℃で反応させた。酢酸エチル/水系で分液操作後、カラム精製により、オイル状の没食子酸エステル(3f)(8.0g, 84%)を得た。
1H NMR(400MHz、CDCl3)δ2.3−2.6(m,6H), 3.7−4.0(m,15H), 4.2(m,6H), 7.4(s,2H)
エステル(3f)(7.8g, 5.8mmol)をエタノール40ml、水4ml中に加えた。この溶液に水酸化カリウム(0.48g, 8.6mmol)を添加し2時間加熱還流した。この反応液を酢酸エチル/水系で分液し、有機層を濃縮固化させ、カルボン酸(3g)(5.6g, 72%)
を得た。
カルボン酸(3g)(2.0g,1.5mmol)をトルエン10mlと触媒量のDMF中で塩化チオニル(0.16ml,2.2mmol)と反応させて酸クロライドとし、過剰の塩化チオニル及びトルエン除去後、THF5ml、触媒量のDMAPを系中に添加した。そこへ、THF5ml及びジイソプロピルエチルアミン0.28mlに溶かしたメチルハイドロキノン(93mg,0.76mmol)を滴下した。酢酸エチル/水系で分液操作後、エバポレーターにて濃縮し、カラム精製し、酢酸エチル/メタノール系で再結晶して化合物(2)(1.5g,71%)を得た。
1H NMR(300MHz、CDCl3)δ2.2(s,3H), 2.3−2.5(m,12H), 3.7−3.9(m.24H), 4.2(m,12H), 7.1(m,3H), 7.4−7.5(s×2,4H)
化合物(11)の合成
1H NMR(300MHz、CDCl3)δ2.2−2.5(m,12H), 3.7−3.9(m,24H), 4.2(m,12H), 7.2(s,4H), 7.5(s,4H)
化合物(6)の合成
(5−1)カルボン酸(5a)の合成
2−(パーフルオロヘキシル)エタノール(33.3g,46mmol)に無水コハク酸(9.7g,49mmol)とテトラヒドロフラン10mlとトリエチルアミン(0.2mL)を加え、攪拌しながら100℃に昇温して60分反応させた。その後、30℃まで冷却し、水100mLを加え、さらに15℃まで冷却して析出した結晶をろ過し、カルボン酸(5a)を得た。(39.7g、94%)。
(5−2)カルボン酸(5b)の合成
カルボン酸(5a)(15g,32mmol)をトルエン中、塩化チオニル(2.6mL,36mmol)と反応させ、4bの酸クロリドを調整した。次に、没食子酸一水和物(1.5g,8mmol)をトルエン(10mL)中で加熱還流し脱水を行い、室温に冷却後テトラヒドロフラン(12mL)を加えて溶解させ、さらに先ほど調整した4bの酸クロリドを添加した。反応系を氷冷した後、ピリジン(4mL)をゆっくりと滴下し、室温で1時間反応させた。次にピリジン2mLと水20mLを加え、50℃で1時間攪拌した後に、酢酸エチルを加え分液し、有機層を食塩水で洗浄した。有機層を濃縮し、酢酸エチル/メタノール(1/20)で再結晶を行い、カルボン酸(5b)を得た。(9.5g、84%)
1H NMR(400MHz、CDCl3)δ2.4−2.6(m,6H), 2.7−2.8(m,6H),2.9−3.0(m,6H),4.4−4.5(m,6H),7.8(s,2H)
(5−3)化合物(6)の合成
化合物(1)の合成においてカルボン酸(1d)の代わりにカルボン酸(5b)を用いた以外は同様にして化合物(6)を得た。
1H NMR(300MHz、CDCl3)δ2.2(s,3H), 2.4−2.6(m,12H), 2.7−2.8(m.12H), 2.9−3.0(m, 12H), 4.4−4.5(m,12H), 7.0−7.2(m,3H), 7.9(s×2,4H)
化合物(7)の合成
1H NMR(300MHz、CDCl3)δ2.4−2.6(m,12H), 2.7−2.8(m.12H), 2.9−3.0(m, 12H), 4.4−4.5(m,12H), 7.2(s,4H), 7.9(s,4H)
化合物(9)の合成
(7−1)エステル(7b)の合成
2−(パーフルオロヘキシル)エタノール(18.2g, 50mmol)をトルエン中に加え、水酸化カリウム3.5g/水3.5mlを加えた。氷冷下、アクリル酸ターシャリーブチルエステル(10.3ml, 70mmol)、テトラブチルアンモニウムブロマイド(1.61g, 5mmol)を加え、室温下で3時間攪拌した。希塩酸を加えてクエンチし、酢酸エチル/水系で分液しロータリーエバポレーターで濃縮した。カラムにより精製エステル(7b)(19.0g, 収率77%)を得た。
(7−2)アルコール(7c)の合成
ビス(2−メトキシエトキシ)アルミニウムハイドライドトルエン溶液(アルドリッチ社製)(13.2g, 42.5mmol)をTHF100mlに加え氷冷した。この溶液に、THF30mlに溶解させたエステル(7b)(19.0g, 38.6mmol)を滴下した。滴下後、室温で1時間攪拌させた。酢酸エチルを加えてクエンチし、希塩酸水を加えて分液、濃縮した。カラムにより精製し、アルコール(7c)(9.0g, 収率55%)を得た。
(7−3)化合物(9)の合成
アルコール(7c)以降については、化合物(2)の合成においてアルコール(3d)を用いる代わりに、アルコール(7c)を用いた以外は同様の合成法により、化合物(9)を合成した。
1H NMR(300MHz、CDCl3)δ1.9−2.1(m,12H), 2.2(s, 3H), 2.3−2.5(m.12H), 3.6−3.8(m, 24H), 4.1−4.2(t,12H), 7.0−7.2(m,3H), 7.4−7.5(s×2,4H)
化合物(10)の合成
1H NMR(300MHz、CDCl3)δ1.9−2.2(m,12H), 2.3−2.5(m.12H), 3.6−3.8(m, 24H), 4.1−4.2(t,12H), 7.2(s,4H), 7.4(s,4H)
化合物(5)の合成
1H NMR(300MHz、CDCl3)δ2.0−2.5(m,27H), 4.0−4.2(m, 12H), 7.0−7.2(m,3H), 7.4(s×2,4H)
化合物(14)の合成
1H NMR(300MHz、CDCl3)δ2.0−2.5(m,27H), 4.0−4.2(m, 12H), 7.0−7.2(m,3H), 7.4−7.5(s×2,4H)
化合物(13)の合成
1H NMR(300MHz、CDCl3)δ2.0−2.5(m,24H), 4.0−4.2(m,12H), 7.2(s,4H), 7.4(s,4H)
化合物(4)の合成
1HNMR(300MHz、CDCl3)δ2.2−2.5(m,12H)), 3.7−3.9(m,24H), 4.2(m,12H), 7.2(s,4H), 7.5(s,4H)
化合物(50)の合成
(13−1)アルデヒド(13a)の合成
3,4−ジヒドロキシベンズアルデヒド(2.1g, 15mmol)と炭酸カリウム(4.3g, 30.8mmol)をDMAc10mlに加え、窒素雰囲気下で90℃まで加熱した。合成例1で記載したエステル(1b)(14.8g, 30.8mmol)を滴下し、90℃で2時間攪拌した。室温まで冷却した後、酢酸エチル/水系で分液し、濃縮した後、カラムで精製しアルデヒド(13a)(10.8g, 収率90%)を得た。
1HNMR(300MHz、CDCl3)δ4.4−4.7(q,4H), 7.1(d,1H), 7.5(s,1H) , 7.6(d,1H), 9.9(s,1H)
(13−2)カルボン酸(13b)の合成
アルデヒド(13a)(10.8g,13.5mmol)を特開2002−97170号公報の10頁[0085]〜[0087]に記載の方法でカルボン酸(13b)に誘導した(6.9g、収率78%)。
1HNMR(300MHz、DMSO−d6)δ4.8−5.0(q,4H), 7.2(d,1H), 7.6(s,d,2H) , 12.8−13.0 (brs,1H)
(13−3)化合物(50)の合成
カルボン酸(13b)(2.45g,3.0mmol)をトルエン10mlと触媒量のDMF中で塩化チオニル(0.33ml,4.5mmol)と反応させて酸クロライドとし、過剰の塩化チオニル及びトルエン除去後、THF5ml、触媒量のDMAPを系中に添加した。そこへ、THF5ml及びジイソプロピルエチルアミン0.57mlに溶かしたメチルハイドロキノン(186mg,1.5mmol)を滴下し、室温で3時間反応させた。分液操作後、エバポレーターにて濃縮し、カラム精製を行い、メタノールで再結晶して化合物(50)(1.8g,収率69%)を得た。
1H NMR(400MHz、CDCl3)δ2.3(s,3H), 4.5−4.7(m,8H), 7.0−7.2(s×3,d×2,5H), 7.8(s×2,2H), 8.0(d×2,2H)
化合物(51)の合成
(14−1)エステル(14a)の合成
3,5−ジヒドロキシ安息香酸メチルエステル(2.5g, 15mmol)と炭酸カリウム(4.3g, 30.8mmol)をDMAc10mlに加え、窒素雰囲気下で90℃まで加熱した。合成例1で記載したエステル(1b)(14.8g, 30.8mmol)を滴下し、90℃で2時間
攪拌した。室温まで冷却した後、酢酸エチル/水系で分液し、濃縮した後、カラムで精製しアルデヒド(14a)(11.6g, 収率93%)を得た。
1H NMR(300MHz、CDCl3)δ4.0(s, 3H), 4.4−4.7(t,4H), 6.8(s,1H), 7.3(s,2H)
(14−2)カルボン酸(14b)の合成
エステル(14a)(11.6g,13.9mmol)をエタノール30mlと水3mlに加え、さらに水酸化カリウム(1.2g, 20.9mmol)を加えて2時間加熱還流した。室温まで降温し塩酸水溶液へ滴下した。得られた固体を吸引ろ過し、カルボン酸(14b)を得た(8.6g、収率76%)。
(14−3)化合物(51)の合成
カルボン酸(14b)(2.45g,3.0mmol)をトルエン10mlと触媒量のDMF中で塩化チオニル(0.33ml,4.5mmol)と反応させて酸クロライドとし、過剰の塩化チオニル及びトルエン除去後、THF5ml、触媒量のDMAPを系中に添加した。そこへ、THF5ml及びジイソプロピルエチルアミン0.57mlに溶かしたメチルハイドロキノン(186mg,1.5mmol)を滴下し、室温で3時間反応させた。分液操作後、エバポレーターにて濃縮し、カラム精製を行い、メタノールで再結晶して化合物(51)(1.8g,収率69%)を得た。
1H NMR(300MHz、CDCl3)δ2.3(s,3H), 4.5−4.7(t,8H), 6.9(m, 2H), 7.0−7.2(s×3, 3H), 7.5(dd×2,4H)
化合物(53)の合成
1H NMR(300MHz、THF−d8)δ2.5(s,3H), 4.8−5.0(m,8H), 7.1 (d,1H), 7.2(s,1H), 7.3−7.4(d×2,2H), 7.6(d,1H), 7.8(d,1H), 7.9(s,1H), 8.0(s,1H), 8.1(d,1H), 9.0(s,1H)
化合物(35)の合成
DMAc(8ml)へ2,5−ジヒドロキシ安息香酸(800mg、5.19mmol)とトリエチルアミン(731μl、5.20mmol)、合成例3で記載した(3e)を添加し、外温90℃へ上昇させて5時間攪拌した。室温まで冷却してから酢酸エチルを添加し、1mol/lの塩酸を加えて分液した。水層を除去した後、飽和食塩水を加え再度分液操作を行った後、ロータリーエバポレーターで濃縮した。ヘキサンを添加して加熱還流した後、吸引ろ過により化合物(16a)を得た(1.5g、収率53%)。
(16−2)化合物(35)の合成
合成例3で記載したカルボン酸(3g)(1.0g、0.75mmol)を触媒量のDMFを添加したTHF中(1ml)に溶解させ、塩化チオニル(97.4μl、1.35mmol)を滴下した。室温で一時間攪拌した後、50℃に加熱して塩化チオニルを除去した後、THF(1ml)を添加し、溶液(*)とした。別途、化合物(16a)(194.3mg、0.36mmol)のTHF(1ml)溶液を氷冷し、内温を10℃以下に保ちながら、上記の溶液(*)、ジイソプロピルエチルアミン(141.5μl、0.821mmol)、触媒量のN−メチルイミダゾールを順番に加えた。室温で1時間反応させ、酢酸エチル、水で分液した。有機層を硫酸ナトリウムで乾燥させた後、ロータリーエバポレーターで濃縮、カラム精製を行い、化合物(35)を得た(0.85g、収率75%)
1H NMR(300MHz、CDCl3)δ2.3−2.6(m,14H), 3.5(t,2H),
3.6(t,2H), 3.8−4.0(m,24H), 4.2−4.4(m,14H), 7.3(s,1H), 7.4−7.5(m,5H), 7.9(s,1H)
化合物(39)の合成
1H NMR(300MHz、CDCl3)δ1.6−1.7(brs,4H), 2.3−2.6(m,12H),3.7−3.9(m,24H), 4.1(t,2H), 4.2−4.3(m,14H), 5.8(d,1H), 6.0−6.1(dd,1H), 6.3−6.4(d,1H), 7.3(1H)、 7.4(1H)、7.5(s,2,4H)、 7.9(1H)
化合物(37)の合成
1H NMR(300MHz、CDCl3)δ1.7−1.8(brs,4H), 4.1(t,3H)4.3(t,2H), 4.5−4.7(m、12H), 5.8(d,1H), 6.0−6.1(dd,1H), 6.3−6.4(d,1H), 7.3(1H)、 7.4(1H)、7.5(s×2,4H)、 7.9(1H)
化合物(40)の合成
1H NMR(300MHz、CDCl3)δ2.3−2.6(m,12H), 3.3(s,3H ),
3.5−3.7(m、10H), 3.8−4.0(m,24H), 4.2(m,12H),
4.3(t,2H), 7.3(2H)、 7.5(s×2,4H)、 7.9(1H)
化合物(48)の合成
1H NMR(300MHz、CDCl3)δ4.5−4.7(m,12H), 5.8−6.2( m,6H), 7.3(s,2H), 7.6(s,4H)
化合物(33)の合成
化合物(21b)は化合物(35)の合成において(3e)の代わりにベンジルブロミドを用いた以外は同様にして合成した。
(21−2)化合物(33)の合成
化合物(21b)(457mg,0.158mmol)とパラジウムカーボン(33.5mg,0.0158mmol)を酢酸エチルへ添加し、脱気・水素充填操作を行った。室温で二時間攪拌した後、セライトろ過を行いロータリーエバポレーターで濃縮した。ヘキサンで加熱還流して洗浄し、化合物(33)を得た(260mg、収率59%)。
1H NMR(300MHz、CDCl3)δ2.3−2.6(m,12H), 3.7−3.9(m,24H), 4.2−4.3(m,12H), 7.3(s,1H), 7.4−7.5(m,5H), 7.9(s,1H)
下記表1に記載される化合物を用いて、光学異方性フィルムを形成して評価した。まず、下記組成の塗布液を調製した。化合物の濃度は、棒状液晶化合物に対して0.01質量部、0.02質量%、0.03質量部、0.05質量%、0.10質量部、0.20質量部となるように調製した。
・下記の棒状液晶化合物1 100質量部
・下記のキラル剤(A) 2.8質量部
・IRGACURE819(チバジャパン社製) 3質量部
・表1および表2に記載される化合物 上記の量
・表1および表2に記載される溶媒 溶質濃度が25質量%となる量
配向促進試験では、化合物の濃度が0.01質量%である光学異方性フィルムのヘイズ値の大きさにより、化合物の配向促進作用を下記の4段階で評価した。0.01質量%濃度では化合物は溶媒に完全に溶解しており、測定されたヘイズ値が小さいほど液晶配向促進作用が大きいことを示している。
◎ 5.5未満
○ 5.5以上8.5未満
△ 8.5以上10.0未満
× 10.0以上
溶解・配向促進試験では、化合物の濃度が0.02質量%と、0.03質量%と、0.05質量%と、0.10質量%と、0.20質量%である光学異方性フィルムのヘイズ値により下記の4段階で溶解・配向促進作用を評価した。評価が高いものは、溶解性が良好で配向促進作用も大きいことを示している。評価が低いものは、主として溶解性が低いことを示している。
◎ 0.15未満
○ 0.15以上、0.35未満
△ 0.35以上、0.90未満
× 0.90以上
また、上記表2に示したように、同じフッ化アルキル側鎖を有する骨格同士で比べた場合、すなわち実施例31、32と比較例4を比べた場合、フッ化アルキル側鎖の数が1本の時(一般式(I)においてm=n=1のとき)より2本または3本の時(一般式(I)においてm=n=2またはm=n=3のとき)の方がより低濃度でヘイズが低下していることが分かる。実施例33と比較例5、実施例34と比較例6を比べた場合も、フッ化アルキル側鎖の数が1本のとき(一般式(I)においてm=n=1のとき)よりも3本の時(一般式(I)においてm=n=3のとき)の方が、低濃度でヘイズが低下していることが分かる。このことから、フッ化アルキル側鎖の本数が多いと液晶配向作用が大きく低濃度領域でもヘイズを低下させられ、使用適性が広いことが分かる。
「赤外線反射フィルムの作製」
下記の組成に従って組成液を調整した。
・ 棒状液晶化合物1 100質量部
・キラル剤(A) 5.0質量部
・IRGACURE819(チバジャパン社製) 3.0質量部
・表1に記載される化合物(2) 0.03質量部
・クロロホルム 溶質濃度が25質量%となる量
得られた組成液をマイクロピペッターを用いて50μl量り取り、配向膜付ガラス上(SE―130)に滴下して2000rpmの回転速度でスピンコートした。85℃で2分間加熱し、1分間放冷したのち、窒素雰囲気下で紫外線照射(紫外線強度:500mJ/m2)することで、光学異方性フィルムを形成した。光学異方性フィルムの膜厚は約5μmであった。得られた光学異方性フィルムの透過スペクトルを、SHIMADZU社製分光光度計UV−3100PCを用いて測定した。その結果をそれぞれ図1に示した。
図1に示すように、実施例35で作成したフィルムは900nm付近の近赤外領域に中心波長を有する選択反射膜であり、光学異方性を示すことがわかった。
Claims (13)
- 下記一般式(I)で表される化合物。
- 前記一般式(I)において、L3が−COO−かつ、L4が−OCO−であり、L2およびL5が−O−である請求項1に記載の化合物。
- 前記一般式(I)において、Hbがそれぞれ独立に炭素数2〜30のパーフルオロアルキル基である請求項1または2に記載の化合物。
- 請求項1〜3のいずれか1項に記載の化合物を用いたヘイズ低下剤。
- 重合性液晶分子と下記一般式(I)で表される化合物を含む液晶組成物。
- 前記重合性液晶分子が棒状液晶分子である請求項5に記載の液晶組成物。
- 少なくとも1種のキラル化合物を含有する請求項5または6に記載の液晶組成物。
- 請求項5〜7のいずれか1項に記載の液晶組成物を重合させてなる高分子材料。
- 請求項8に記載の高分子材料の少なくとも1種を含有するフィルム。
- 請求項5〜7のいずれか1項に記載の液晶組成物のコレステリック液晶相を固定してなるフィルム。
- 光学異方性を示す請求項9または10に記載のフィルム。
- 選択反射特性を示す請求項9〜11のいずれか1項に記載のフィルム。
- 赤外線波長域に選択反射特性を示す請求項12に記載のフィルム。
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012036512A JP5774518B2 (ja) | 2011-07-27 | 2012-02-22 | 化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム |
| EP12818188.0A EP2738155B1 (en) | 2011-07-27 | 2012-07-03 | Compound, haze-lowering agent, liquid crystal composition, polymer material, and film |
| PCT/JP2012/066957 WO2013015077A1 (ja) | 2011-07-27 | 2012-07-03 | 化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム |
| CN201280036066.5A CN103702971B (zh) | 2011-07-27 | 2012-07-03 | 化合物、雾度降低剂、液晶组合物、聚合物材料和膜 |
| KR1020147004785A KR101629587B1 (ko) | 2011-07-27 | 2012-07-03 | 화합물, 헤이즈 저하제, 액정 조성물, 고분자 재료 및 필름 |
| US14/163,901 US9481829B2 (en) | 2011-07-27 | 2014-01-24 | Compound, haze-lowering agent, liquid crystal composition, polymer material, and film |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011164777 | 2011-07-27 | ||
| JP2011164777 | 2011-07-27 | ||
| JP2012036512A JP5774518B2 (ja) | 2011-07-27 | 2012-02-22 | 化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2013047204A JP2013047204A (ja) | 2013-03-07 |
| JP5774518B2 true JP5774518B2 (ja) | 2015-09-09 |
Family
ID=47600932
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012036512A Active JP5774518B2 (ja) | 2011-07-27 | 2012-02-22 | 化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9481829B2 (ja) |
| EP (1) | EP2738155B1 (ja) |
| JP (1) | JP5774518B2 (ja) |
| KR (1) | KR101629587B1 (ja) |
| CN (1) | CN103702971B (ja) |
| WO (1) | WO2013015077A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019181247A1 (ja) | 2018-03-23 | 2019-09-26 | 富士フイルム株式会社 | コレステリック液晶層、積層体、光学異方体、反射膜、コレステリック液晶層の製造方法、偽造防止媒体、および、判定方法 |
| WO2019182052A1 (ja) | 2018-03-23 | 2019-09-26 | 富士フイルム株式会社 | コレステリック液晶層の製造方法、コレステリック液晶層、液晶組成物、硬化物、光学異方体、反射層 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5812823B2 (ja) * | 2011-11-25 | 2015-11-17 | 富士フイルム株式会社 | フィルムおよびその製造方法 |
| JP5852469B2 (ja) * | 2012-02-27 | 2016-02-03 | 富士フイルム株式会社 | 化合物、液晶組成物、高分子材料およびフィルム |
| JP5798066B2 (ja) * | 2012-03-08 | 2015-10-21 | 富士フイルム株式会社 | 化合物、液晶組成物、高分子材料およびフィルム |
| TWI634105B (zh) * | 2013-05-29 | 2018-09-01 | 迪愛生股份有限公司 | 聚合性組成物溶液、及使用其之光學異向體 |
| CN105916900B (zh) * | 2014-06-23 | 2018-09-21 | Dic株式会社 | 聚合性液晶组合物和使用该组合物制作的光学各向异性体、相位差膜、图案化相位差膜 |
| US9849654B2 (en) | 2014-10-29 | 2017-12-26 | Solutia Inc. | Polymer interlayers comprising a compatibilizer |
| US9724899B2 (en) | 2014-12-08 | 2017-08-08 | Solutia Inc. | Poly(vinyl acetal) resin compositions, layers and interlayers having enhanced properties |
| JP6869180B2 (ja) * | 2014-12-08 | 2021-05-12 | ソルティア・インコーポレーテッド | 向上した光学特性を有する組成物、層、及び中間膜のためのポリ(ビニルアセタール)樹脂のブレンド |
| US9758662B2 (en) | 2014-12-08 | 2017-09-12 | Solutia Inc. | Poly(vinyl acetal) resin compositions, layers and interlayers having enhanced properties |
| US9926431B2 (en) | 2014-12-08 | 2018-03-27 | Solutia Inc. | Poly(vinyl acetal) resin compositions, layers and interlayers having enhanced properties |
| US10005899B2 (en) | 2014-12-08 | 2018-06-26 | Solutia Inc. | Blends of poly(vinyl acetal) resins for compositions, layers, and interlayers having enhanced optical properties |
| WO2016094204A1 (en) * | 2014-12-08 | 2016-06-16 | Solutia Inc. | Poly(vinyl acetal) resin compositions, layers, and interlayers having enhanced properties |
| US9669605B2 (en) | 2014-12-08 | 2017-06-06 | Solutia Inc. | Poly(vinyl acetal) resin compositions, layers and interlayers having enhanced properties |
| US9840617B2 (en) | 2014-12-08 | 2017-12-12 | Solutia Inc. | Blends of poly(vinyl acetal) resins for compositions, layers, and interlayers having enhanced optical properties |
| DE102017010942A1 (de) * | 2016-12-08 | 2018-06-14 | Merck Patent Gmbh | Additive für Flüssigkristallmischungen |
| CN115461320B (zh) * | 2020-04-28 | 2024-09-13 | 富士胶片株式会社 | 化合物、液晶组合物、固化物及薄膜 |
| WO2021246402A1 (ja) | 2020-06-03 | 2021-12-09 | 富士フイルム株式会社 | 反射フィルム、合わせガラスの製造方法、および、合わせガラス |
| WO2023074732A1 (ja) * | 2021-10-27 | 2023-05-04 | 富士フイルム株式会社 | 光学フィルム及び光学フィルムの製造方法 |
| EP4546017A1 (en) | 2022-06-21 | 2025-04-30 | FUJIFILM Corporation | Image recording material, method for producing image recording material, and decorated molded object |
| WO2025013897A1 (ja) | 2023-07-11 | 2025-01-16 | 富士フイルム株式会社 | 化合物の製造方法、化合物 |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2367661A (en) | 1941-12-31 | 1945-01-23 | Du Pont | Process of photopolymerization |
| US2367670A (en) | 1941-12-31 | 1945-01-23 | Du Pont | Cementing process |
| US2448828A (en) | 1946-09-04 | 1948-09-07 | Du Pont | Photopolymerization |
| US2722512A (en) | 1952-10-23 | 1955-11-01 | Du Pont | Photopolymerization process |
| NL108006C (ja) | 1957-05-17 | |||
| US3046127A (en) | 1957-10-07 | 1962-07-24 | Du Pont | Photopolymerizable compositions, elements and processes |
| US3549367A (en) | 1968-05-24 | 1970-12-22 | Du Pont | Photopolymerizable compositions containing triarylimidazolyl dimers and p-aminophenyl ketones |
| US4212970A (en) | 1977-11-28 | 1980-07-15 | Fuji Photo Film Co., Ltd. | 2-Halomethyl-5-vinyl-1,3,4-oxadiazole compounds |
| JPS5928328B2 (ja) | 1977-11-29 | 1984-07-12 | 富士写真フイルム株式会社 | 光重合性組成物 |
| DE2830927A1 (de) | 1978-07-14 | 1980-01-31 | Basf Ag | Acylphosphinoxidverbindungen und ihre verwendung |
| DE2909992A1 (de) | 1979-03-14 | 1980-10-02 | Basf Ag | Photopolymerisierbare aufzeichnungsmassen, insbesondere zur herstellung von druckplatten und reliefformen |
| DE2909994A1 (de) | 1979-03-14 | 1980-10-02 | Basf Ag | Acylphosphinoxidverbindungen, ihre herstellung und verwendung |
| DE3337024A1 (de) | 1983-10-12 | 1985-04-25 | Hoechst Ag, 6230 Frankfurt | Lichtempfindliche, trichlormethylgruppen aufweisende verbindungen, verfahren zu ihrer herstellung und diese verbindungen enthaltendes lichtempfindliches gemisch |
| DE3443221A1 (de) | 1984-11-27 | 1986-06-05 | ESPE Fabrik pharmazeutischer Präparate GmbH, 8031 Seefeld | Bisacylphosphinoxide, ihre herstellung und verwendung |
| JP2692035B2 (ja) | 1994-05-13 | 1997-12-17 | 富士写真フイルム株式会社 | 薄膜の製造方法 |
| KR100332717B1 (ko) | 1994-05-13 | 2002-09-26 | 후지 샤신 필름 가부시기가이샤 | 액정디스플레이,광학보상시트및그의제조방법 |
| JP2747789B2 (ja) | 1994-06-08 | 1998-05-06 | 富士写真フイルム株式会社 | 光学補償シート及びそれを用いた液晶表示素子 |
| EP0726486B1 (en) | 1995-02-08 | 2005-04-20 | Fuji Photo Film Co., Ltd. | Optical compensatory sheet |
| JP3907735B2 (ja) | 1995-02-08 | 2007-04-18 | 富士フイルム株式会社 | 光学補償シート |
| US6361925B1 (en) | 1996-03-04 | 2002-03-26 | Ciba Specialty Chemicals Corporation | Photoinitiator mixtures and compositions with alkylphenylbisacylphosphine oxides |
| CH691970A5 (de) | 1996-03-04 | 2001-12-14 | Ciba Sc Holding Ag | Alkylphenylbisacylphosphinoxide und Photoinitiatormischungen. |
| SG53043A1 (en) | 1996-08-28 | 1998-09-28 | Ciba Geigy Ag | Molecular complex compounds as photoinitiators |
| EP0911656B1 (en) | 1997-10-20 | 2005-01-26 | Fuji Photo Film Co., Ltd. | Optical compensatory sheet and liquid crystal display |
| US6485798B1 (en) | 1999-03-16 | 2002-11-26 | Fuji Photo Film Co., Ltd. | Optical compensatory sheet comprising substrate and optically anisotropic layer |
| US6338808B1 (en) | 1999-03-31 | 2002-01-15 | Fuji Photo Film Co., Ltd. | Liquid crystal composition comprising liquid crystal molecules and alignment promoter |
| JP2000345164A (ja) | 1999-03-31 | 2000-12-12 | Fuji Photo Film Co Ltd | 液晶配向促進剤、液晶組成物および光学異方性素子 |
| JP2001081465A (ja) * | 1999-09-10 | 2001-03-27 | Fuji Photo Film Co Ltd | ディスコティック液晶組成物、光学補償シートおよび液晶表示装置 |
| US6875483B2 (en) | 2000-07-06 | 2005-04-05 | Fuji Photo Film Co., Ltd. | Liquid crystal composition comprising liquid crystal molecules and alignment promoter |
| JP4592225B2 (ja) * | 2000-07-06 | 2010-12-01 | 富士フイルム株式会社 | 液晶組成物および光学異方性素子 |
| EP1174411B1 (en) | 2000-07-21 | 2003-10-08 | Fuji Photo Film Co., Ltd. | Process for the preparation of aromatic carboxylic acid |
| JP4397550B2 (ja) | 2000-07-21 | 2010-01-13 | 富士フイルム株式会社 | 芳香族カルボン酸の製造方法 |
| US6733883B2 (en) * | 2002-09-18 | 2004-05-11 | The Trustees Of The University Of Pennsylvania | Fluorinated dendrons and self-organizing ultrahigh density nanocylinder compositions |
| US9487631B2 (en) * | 2005-05-21 | 2016-11-08 | University Of Durham | Surface active polymeric systems |
| JP5852469B2 (ja) * | 2012-02-27 | 2016-02-03 | 富士フイルム株式会社 | 化合物、液晶組成物、高分子材料およびフィルム |
-
2012
- 2012-02-22 JP JP2012036512A patent/JP5774518B2/ja active Active
- 2012-07-03 EP EP12818188.0A patent/EP2738155B1/en active Active
- 2012-07-03 CN CN201280036066.5A patent/CN103702971B/zh active Active
- 2012-07-03 KR KR1020147004785A patent/KR101629587B1/ko active Active
- 2012-07-03 WO PCT/JP2012/066957 patent/WO2013015077A1/ja not_active Ceased
-
2014
- 2014-01-24 US US14/163,901 patent/US9481829B2/en active Active
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019181247A1 (ja) | 2018-03-23 | 2019-09-26 | 富士フイルム株式会社 | コレステリック液晶層、積層体、光学異方体、反射膜、コレステリック液晶層の製造方法、偽造防止媒体、および、判定方法 |
| WO2019182052A1 (ja) | 2018-03-23 | 2019-09-26 | 富士フイルム株式会社 | コレステリック液晶層の製造方法、コレステリック液晶層、液晶組成物、硬化物、光学異方体、反射層 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013015077A1 (ja) | 2013-01-31 |
| KR20140049022A (ko) | 2014-04-24 |
| EP2738155B1 (en) | 2016-02-24 |
| EP2738155A1 (en) | 2014-06-04 |
| EP2738155A4 (en) | 2015-04-08 |
| KR101629587B1 (ko) | 2016-06-13 |
| US20140138580A1 (en) | 2014-05-22 |
| CN103702971B (zh) | 2015-12-23 |
| CN103702971A (zh) | 2014-04-02 |
| US9481829B2 (en) | 2016-11-01 |
| JP2013047204A (ja) | 2013-03-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5774518B2 (ja) | 化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム | |
| JP5797132B2 (ja) | 化合物、液晶組成物、高分子材料およびフィルム | |
| WO2014142026A1 (ja) | 重合性液晶化合物、液晶組成物、高分子材料とその製造方法、フィルム、偏光板および液晶表示装置 | |
| JP5816232B2 (ja) | 液晶組成物およびその製造方法ならびにフィルム | |
| JP5798066B2 (ja) | 化合物、液晶組成物、高分子材料およびフィルム | |
| JP2013195630A (ja) | 光反射フィルム、自動車用フロントガラス、建材用ガラス | |
| JP5750069B2 (ja) | 液晶配向促進剤、液晶組成物、高分子材料およびフィルム | |
| JP5852469B2 (ja) | 化合物、液晶組成物、高分子材料およびフィルム | |
| JP4424979B2 (ja) | 化合物、位相差板、及び光学異方性層の形成方法 | |
| JP5804814B2 (ja) | 化合物、ヘイズ低下剤、液晶組成物、高分子材料およびフィルム | |
| JP6511407B2 (ja) | 重合性化合物、重合性組成物、およびフィルム |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140110 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141216 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150209 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150616 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150701 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5774518 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |