JP5591229B2 - 半導体材料並びにその製造方法およびその使用 - Google Patents
半導体材料並びにその製造方法およびその使用 Download PDFInfo
- Publication number
- JP5591229B2 JP5591229B2 JP2011511026A JP2011511026A JP5591229B2 JP 5591229 B2 JP5591229 B2 JP 5591229B2 JP 2011511026 A JP2011511026 A JP 2011511026A JP 2011511026 A JP2011511026 A JP 2011511026A JP 5591229 B2 JP5591229 B2 JP 5591229B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- alkyl
- aryl
- groups
- case
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/06—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B3/00—Dyes with an anthracene nucleus condensed with one or more carbocyclic rings
- C09B3/78—Other dyes in which the anthracene nucleus is condensed with one or more carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B5/00—Dyes with an anthracene nucleus condensed with one or more heterocyclic rings with or without carbocyclic rings
- C09B5/62—Cyclic imides or amidines of peri-dicarboxylic acids of the anthracene, benzanthrene, or perylene series
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
- C09B57/08—Naphthalimide dyes; Phthalimide dyes
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/621—Aromatic anhydride or imide compounds, e.g. perylene tetra-carboxylic dianhydride or perylene tetracarboxylic di-imide
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/655—Aromatic compounds comprising a hetero atom comprising only sulfur as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/656—Aromatic compounds comprising a hetero atom comprising two or more different heteroatoms per ring
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K10/00—Organic devices specially adapted for rectifying, amplifying, oscillating or switching; Organic capacitors or resistors having a potential-jump barrier or a surface barrier
- H10K10/40—Organic transistors
- H10K10/46—Field-effect transistors, e.g. organic thin-film transistors [OTFT]
- H10K10/462—Insulated gate field-effect transistors [IGFETs]
- H10K10/466—Lateral bottom-gate IGFETs comprising only a single gate
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P70/00—Climate change mitigation technologies in the production process for final industrial or consumer products
- Y02P70/50—Manufacturing or production processes characterised by the final manufactured product
Description
有機薄膜トランジスタ(TFT)、有機発光ダイオード(OLED)、印刷可能な回路、有機光起電デバイス、コンデンサ、およびセンサーなどの新世代のオプトエレクトロニクスデバイスは、それらの活性構成要素としての有機半導体上に構築されている。これらのデバイスは、想定されたそれらの用途、例えば、ディスプレイバックプレーン、無線自動識別タグ、印刷されたセンサー、および光起電力素子などに適合する性能を達成する必要がある。無機材料ベースのエレクトロニクスのように、有機半導体ベースのデバイスは、p型およびn型半導体材料が高電荷キャリア移動度および周囲条件での安定性を示す場合、効率的かつ高速で操作可能であり、並びに費用対効果に優れた方式において加工することができる。
上記の観点から、本教示は、上記において概説したものなどの先行技術の様々な不備および短所に対処し得る有機半導体材料およびそれに関連するデバイスを提供する。
Q−L−Q’
[式中、QおよびQ’は、独立して、場合により置換されるリレン部分であり、Lは、本明細書において説明されるような結合基である]を有する化合物を提供する。
本教示は、化合物および組成物などの有機半導体材料を提供する。本明細書において開示される有機半導体材料は、有用な電気特性を示し、並びに溶液加工可能、例えば、スピン−コーティング可能および印刷可能である。さらに、これらの材料としてはn型半導体材料が考えられ、並びに電界効果トランジスタ、ユニポーラ回路、コンプリメンタリ回路、光起電装置、および発光デバイスなどの様々な有機電子物品、構造体およびデバイスを製造するために使用することができる。
Q−L−Q’
I
[式中、
QおよびQ’は、独立して、
Lは結合基であり;
この場合、π−1およびπ−1’は、独立して、場合により1〜8個のRa基で置換されてもよい縮合環部分であり:
Zは、各場合において、a)O、b)S、c)NRb、d)C(O)、およびe)CRcRdから選択され;
Raは、各場合において、a)ハロゲン、b)−CN、c)−NO2、d)−ORf、e)−SRf、f)−NRgRh、g)−N(O)RgRh、h)−S(O)mRg、i)−S(O)mORg、j)−S(O)mNRgRh、k)−C(O)Rg、l)−C(O)ORf、m)−C(O)NRgRh、n)−C(S)NRgRh、o)−SiH3、p)−SiH(C1〜20アルキル)2、q)−SiH2(C1〜20アルキル)、r)−Si(C1〜20アルキル)3、s)C1〜20アルキル基、t)C2〜20アルケニル基、u)C2〜20アルキニル基、v)C1〜20ハロアルキル基、w)−Y−C3〜14シクロアルキル基、x)−Y−C6〜14アリール基、y)−Y−3〜14員環シクロヘテロアルキル基、またはz)−Y−5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により、1〜4つのRi基で置換されていてもよく;
Rbは、各場合において、a)H、b)−(CH2CH2O)qH、c)−(CH2CH2O)q−CH3、d)−C(O)ORf、e)−C(O)Rg、f)−C(O)NRgRh、g)−C(S)ORf、h)−C(S)Rg、i)−C(S)NRgRh、j)−S(O)mRg、k)−S(O)mORg、l)C1〜20アルキル基、m)C2〜20アルケニル基、n)C2〜20アルキニル基、o)C1〜20アルコキシ基、p)−Y−C3〜14シクロアルキル基、q)−Y−C6〜14アリール基、r)−Y−3〜14員環シクロヘテロアルキル基、またはs)−Y−5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C1〜20アルコキシ基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく;
RcおよびRdは、各場合において、独立して、a)H、b)ハロゲン、c)−(CH2CH2O)qH、d)−(CH2CH2O)q−CH3、e)C1〜20アルコキシ基、f)C1〜20アルキル基、g)C2〜20アルケニル基、h)C2〜20アルキニル基、i)−Y−C3〜14シクロアルキル基、j)−Y−C6〜14アリール基、k)−Y−3〜14員環シクロヘテロアルキル基、またはl)−Y−5〜14員環ヘテロアリール基であり、この場合、それぞれのC1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4つのRi基で置換されていてもよく;
Rfは、各場合において、a)H、b)−C(O)Rg、c)−C(O)NRgRh、d)−C(S)Rg、e)−C(S)NRgRh、f)C1〜20アルキル基、g)C2〜20アルケニル基、h)C2〜20アルキニル基、i)C3〜14シクロアルキル基、j)C6〜14アリール基、k)3〜14員環シクロヘテロアルキル基、またはl)5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4つのRi基で置換されていてもよく;
RgおよびRhは、各場合において、独立して、a)H、b)−OH、c)−SH、d)−S(O)2OH、e)−C(O)OH、f)−C(O)NH2、g)−C(S)NH2、h)−OC1〜10アルキル、i)−C(O)−C1〜20アルキル、j)−C(O)−OC1〜20アルキル、k)−C(S)N(C1〜20アルキル)2、l)−C(S)NH−C1〜20アルキル、m)−C(O)NH−C1〜20アルキル、n)−C(O)N(C1〜20アルキル)2、o)−S(O)m−C1〜20アルキル、p)−S(O)m−OC1〜20アルキル、q)C1〜20アルキル基、r)C2〜20アルケニル基、s)C2〜20アルキニル基、t)C1〜20アルコキシ基、u)C3〜14シクロアルキル基、v)C6〜14アリール基、w)3〜14員環シクロヘテロアルキル基、またはx)5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく;
Riは、各場合において、a)ハロゲン、b)−CN、c)−NO2、d)オキソ、e)−OH、f)−NH2、g)−NH(C1〜20アルキル)、h)−N(C1〜20アルキル)2、i)−N(C1〜20アルキル)−C6〜14アリール、j)−N(C6〜14アリール)2、k)−S(O)mH、l)−S(O)m−C1〜20アルキル、m)−S(O)2OH、n)−S(O)m−OC1〜20アルキル、o)−S(O)m−OC6〜14アリール、p)−CHO、q)−C(O)−C1〜20アルキル、r)−C(O)−C6〜14アリール、s)−C(O)OH、t)−C(O)−OC1〜20アルキル、u)−C(O)−OC6〜14アリール、v)−C(O)NH2、w)−C(O)NH−C1〜20アルキル、x)−C(O)N(C1〜20アルキル)2、y)−C(O)NH−C6〜14アリール、z)−C(O)N(C1〜20アルキル)−C6〜14アリール、aa)−C(O)N(C6〜14アリール)2、ab)−C(S)NH2、ac)−C(S)NH−C1〜20アルキル、ad)−C(S)N(C1〜20アルキル)2、ae)−C(S)N(C6〜14アリール)2、af)−C(S)N(C1〜20アルキル)−C6〜14アリール、ag)−C(S)NH−C6〜14アリール、ah)−S(O)mNH2、ai)−S(O)mNH(C1〜20アルキル)、aj)−S(O)mN(C1〜20アルキル)2、ak)−S(O)mNH(C6〜14アリール)、al)−S(O)mN(C1〜20アルキル)−C6〜14アリール、am)−S(O)mN(C6〜14アリール)2、an)−SiH3、ao)−SiH(C1〜20アルキル)2、ap)−SiH2(C1〜20アルキル)、ar)−Si(C1〜20アルキル)3、as)C1〜20アルキル基、at)C2〜20アルケニル基、au)C2〜20アルキニル基、av)C1〜20アルコキシ基、aw)C1〜20アルキルチオ基、ax)C1〜20ハロアルキル基、ay)C3〜14シクロアルキル基、az)C6〜14アリール基、ba)3〜14員環シクロヘテロアルキル基、またはbb)5〜14員環ヘテロアリール基であり;
Yは、各場合において、a)二価のC1〜20アルキル基、b)二価のC1〜20ハロアルキル基、またはc)共有結合であり;
mは、各場合において、0、1、または2であり;並びに
qは、各場合において、1〜20の整数である]を有するビス多環式化合物を提供する。
この場合
Ar1は、各場合において、独立して、5員環または6員環アリール基またはヘテロアリール基であり、それぞれは、場合により1〜4つのRi基で置換されていてもよく;
Ar2は、各場合において、独立して、多環式の8〜22員環アリール基またはヘテロアリール基であり、それぞれは、場合により1〜12つのRi基で置換されていてもよく;
n、n’、およびn’’は、独立して、1、2、3、4、5、6であり;並びに
Riは、本明細書において定義される通りである。
AおよびA’は独立して、a)二価のC1〜20アルキル基、b)二価のC2〜20アルケニル基、c)二価のC2〜20アルキニル基、d)二価のC1〜20ハロアルキル基、e)二価のC1〜20アルコキシ基、およびf)共有結合から選択され、この場合、a)〜e)のそれぞれは、場合により、1〜4つのRi基で置換されていてもよく;
BおよびB’は、独立して、a)−O−、b)−S−、c)−NRe−、d)−C(O)−、e)−C(O)O−、f)−OC(O)−、g)−C(O)NRe−、h)−NReC(O)−、i)二価のC3〜14シクロアルキル基、j)二価のC6〜14アリール基、k)二価の3〜14員環シクロヘテロアルキル基、l)二価の5〜14員環ヘテロアリール基、およびm)共有結合から選択され、この場合、i)〜l)のそれぞれは、場合により1〜4つのRi基で置換されていてもよく;
この場合、Reは、a)H、b)C1〜6アルキル基、c)C6〜14アリール基、またはd)−C1〜6アルキル−C6〜14アリール基であり、C1〜6アルキル基およびC6〜14アリール基のそれぞれは、場合により1〜4つのRi基で置換されていてもよく;並びに
Riは、本明細書において定義される通りである。
LGは脱離基であり、並びに
π−1、π−1’、およびZは、本明細書において定義される通りである]を、カップリング反応に供する工程を含み得る。
工程1.N,N’−ビス(1−メチルペンチル)−1−ブロモ−7−シアノペリレン−3,4:9,10−ビス(ジカルボキシイミド)(PDI(1MP)BrCN)
ジメチルホルムアミド(20mL)中におけるN,N’−ビス(1−メチルペンチル)−1,7−ジブロモペリレン−3,4:9,10−ビス(ジカルボキシイミド)(PDI1MP−Br2、1.01g、1.41mmol)、およびシアン化銅(I)(CuCN)(0.13g、1.45mmol)の混合物を、150℃で2時間攪拌した。室温まで冷却した後、該反応混合物にメタノール(40mL)を加え、濾過により沈殿物を収集し、メタノールで洗浄した。この粗生成物(0.88g)を、シリカゲルのカラムクロトグラフィーにより、クロロホルム:ヘキサン(勾配:2:1〜4:1(v/v))の混合物を用いて精製し、生成物(0.26g、0.39mmol、収率27.7%)として暗赤色の固体を得た。
窒素下において、無水トルエン(20mL)中におけるPDI(1MP)BrCN(305mg、0.46mmol)、5,5’−ビス(トリメチルスタンニル)−2,2’−ビチオフェン(110mg、0.22mmol)、およびジクロロビス(トリフェニルホスフィン)パラジウム(II)(Pd(PPh3)2Cl2)(8.1mg、0.012mmol)の混合物を、90℃で40時間撹拌した。室温まで冷却した後、水(3mL)中におけるフッ化カリウム(1.5g)の溶液を加え、結果として得られた混合物を、室温でさらに2時間撹拌した。該反応混合物を、クロロホルムで抽出し(100mLで2回)、有機層を収集して、水で洗浄し、無水硫酸ナトリウムで乾燥して、濃縮した。残留物を、シリカゲルのカラムクロマトグラフィー(ジクロロメタン:酢酸エチル、勾配100:1〜100:3(v/v))により精製して、生成物(221mg、0.17mmol、収率74.4%)として暗色固体を得た。
工程1.N,N’−ビスオクチル−1−ブロモ−7−シアノペリレン−3,4:9,10−ビス(ジカルボキシイミド)(PDI(8)BrCN)の調製
ジメチルホルムアミド(50mL)中におけるN,N’−ビスオクチル−1,7−ジブロモ−ペリレン−3,4:9,10−ビス(ジカルボキシイミド)(PDI8−Br2、2.15g、2.78mmol)、およびCuCN(0.25g、2.79mmol)の混合物を、150℃で2時間撹拌した。室温まで冷却した後、該反応混合物にメタノール(50mL)を加え、濾過により沈殿物を収集し、メタノールで洗浄した。この粗生成物(1.81g)を、シリカゲルのカラムクロトグラフィー(クロロホルム:ヘキサン、2:1〜4:1(v/v))によって精製し、生成物(0.44g、0.61mmol、収率22.0%)として暗赤色の固体を得た。
窒素下において、無水トルエン(25mL)中におけるPDl(8)BrCN(341mg、0.47mmol)、5,5’−ビス(トリメチルスタンニル)−2,2’−ビチオフェン(116mg、0.24mmol)、およびPd(PPh3)2Cl2(7.1mg、0.010mmol)の混合物を、90℃で44時間撹拌した。室温まで冷却した後、水(3mL)中におけるフッ化カリウム(1.5g)を加え、結果として得られた混合物を、室温でさらに2時間撹拌した。該反応混合物を、クロロホルムで抽出し(100mLで2回)、有機層を収集して、水で洗浄し、無水硫酸ナトリウムで乾燥して、濃縮した。残留物をシリカゲルのカラムクロマトグラフィー(ジクロロメタン:酢酸エチル、100:1〜100:3(v/v))により精製し、生成物(240mg、0.17mmol、収率70.2%)として暗色固体を得た。
工程1.N,N’−ビス(2−エチルヘキシル)−1−ブロモ−7−シアノペリレン−3,4:9,10−ビス(ジカルボキシイミド)(PDI(2EH)BrCN)の調製
ジメチルホルムアミド(45mL)中におけるN,N’−ビス(2−エチルヘキシル)−1,7−ジブロモ−ペリレン−3,4:9,10−ビス(ジカルボキシイミド)(PDI2EH−Br2、1.94g、2.51mmol)およびCuCN(0.23g、2.57mmol)の混合物を、150℃で2時間撹拌した。室温まで冷却した後、該反応混合物にメタノール(50mL)を加え、濾過により沈殿物を収集し、メタノールで洗浄した。この粗生成物(1.66g)を、シリカゲルのカラムクロマトグラフィー(クロロホルム:ヘキサン、2:1〜4:1(v/v))により精製して、生成物(0.38g、0.53mmol、収率21.1%)として暗赤色の固体を得た。
窒素下において、無水トルエン(20mL)中におけるPDT(2EH)BrCN(324mg、0.45mmol)、5,5’−ビス(トリメチルスタンニル)−2,2’−ビチオフェン(110mg、0.23mmol)、およびPd(PPh3)2Cl2(6.4mg、0.009mmol)の混合物を、90℃で44時間撹拌した。室温まで冷却した後、水(3mL)中におけるフッ化カリウム(1.5g)の溶液を加え、結果として得られた混合物を、室温でさらに2時間撹拌した。該反応混合物を、クロロホルムで抽出し(100mLで2回)、有機層を収集して、水で洗浄し、無水硫酸ナトリウムで乾燥して、濃縮した。残留物をシリカゲルのカラムクロマトグラフィー(ジクロロメタン:酢酸エチル、100:1〜100:3(v/v))により精製して、生成物(272mg、0.19mmol、収率83.7%)として暗色固体を得た。
ベンゾチアジアゾ−ルジブロモエステル(38mg、0.098mmol)、PDI1MPBrCN(0.13g、0.19mmol)、Pd(PPh3)4(13mg、0.011mmol)、炭酸カリウム水溶液(2M、4.5mL)、aliquat336(20mg)、および無水トルエン(6mL)の混合物を、Ar下において、105℃で44時間撹拌した。室温まで冷却した後、該反応混合物をCHCl3で抽出した(50mLで2回)。収集した有機層を水で洗浄し、無水Na2SO4で乾燥して、ロータリーエバポレーターで濃縮した。結果として得られた残留物を、シリカゲルのカラムクロマトグラフィーにより、溶離液としてCH2Cl2(CH2Cl2:酢酸エチル=100:5(v/v)への勾配)を用いて精製し、生成物(4.0mg、0.0031mmol、収率3.2%)として燈色/赤色固体を得た。
特定のビス多環式化合物(例えば、二量化ペリレン)の熱特性は、示差走査熱量計によって調べた。BPDI(1MP)−BTでは、吸熱および発熱は、可逆的で容易に再現可能であり、溶融方法および再結晶方法を示す。他の化合物では、不可逆的な熱プロセスが確認された。
モノブロモモノシアノペリレンおよび二量化ペリレンのすべては、処理のために、クロロホルム、キシレン、ジクロロベンゼン、およびアニソールなどの従来の有機溶媒において十分に可溶性である。第1表に、60℃でのジクロロベンゼンに対する本教示の特定の化合物の溶解性のデータを示す。
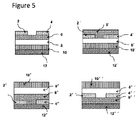
半導体層に本教示の化合物を使用して、ボトムゲート・トップコンタクト型OFETを製造した。デバイス基材として、300nmの熱成長酸化物を有する最上級グレードのn型ドーピングされたシリコンウェハー(100)((Process Specialties社)を使用した。これらは、薄膜を堆積させる前に水、メタノールおよびアセトンで洗浄した。Si/SiO2表面のトリメチルシリル官能化は、シリコンウェハーを、室温で窒素下の密閉容器中において一晩ヘキサメチルジシラザン(HMDS)蒸気に晒すことによって実施した。モノブロモモノシアノペリレンの薄膜は、蒸着およびスピンコーティングにより調製し、二量化ペリレン誘導体の薄膜はスピンコーティングのみで調製した。半導体薄膜の堆積には、様々な溶媒および溶媒混合物を使用することができる。ゲート領域は、オーム接触によってSi基板への接触を取り、金ソースおよびドレイン接触は、半導体層上へのシャドーマスクを通して蒸着することによって調製した。
(IDS)sat=(WCi/2L)μ(VG−Vt)2 (1)
によって得られ、この場合、LおよびWは、それぞれデバイスのチャンネルの長さおよび幅であり、Ciは酸化物絶縁体のキャパシタンスであり(〜300nmのSiO2に対して〜10nF/cm2)、並びにVtは閾値電圧である。移動度(μ)は、式(1)を変形した下記の式:
μsat=(2IDSL)/[WCi(VG−Vt)2] (2)
により、飽和領域において計算した。閾値電圧(Vt)は、VG対(IDS)1/2のプロットの線形領域のX軸切片として予測することができる(VSD=−100Vにおいて)。
Claims (8)
- 式I:
Q−L−Q’
I
[式中、
QおよびQ’は、独立して、
Lは、
この場合:
π−1は、場合により1〜7個のRa基で置換されてもよいペリレン部分であり、
Zは、各場合において、a)O、b)S、c)NRb、d)C(O)、およびe)CRcRdから選択され;
Raは、各場合において、a)ハロゲン、b)−CN、c)−NO2、d)−ORf、e)−SRf、f)−NRgRh、g)−N(O)RgRh、h)−S(O)mRg、i)−S(O)mORg、j)−S(O)mNRgRh、k)−C(O)Rg、l)−C(O)ORf、m)−C(O)NRgRh、n)−C(S)NRgRh、o)−SiH3、p)−SiH(C1〜20アルキル)2、q)−SiH2(C1〜20アルキル)、r)−Si(C1〜20アルキル)3、s)C1〜20アルキル基、t)C2〜20アルケニル基、u)C2〜20アルキニル基、v)C1〜20ハロアルキル基、w)−Y−C3〜14シクロアルキル基、x)−Y−C6〜14アリール基、y)−Y−3〜14員環シクロヘテロアルキル基、またはz)−Y−5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく;
Rbは、各場合において、a)H、b)−(CH2CH2O)qH、c)−(CH2CH2O)q−CH3、d)−C(O)ORf、e)−C(O)Rg、f)−C(O)NRgRh、g)−C(S)ORf、h)−C(S)Rg、i)−C(S)NRgRh、j)−S(O)mRg、k)−S(O)mORg、l)C1〜20アルキル基、m)C2〜20アルケニル基、n)C2〜20アルキニル基、o)C1〜20アルコキシ基、p)−Y−C3〜14シクロアルキル基、q)−Y−C6〜14アリール基、r)−Y−3〜14員環シクロヘテロアルキル基、またはs)−Y−5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C1〜20アルコキシ基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく;
RcおよびRdは、各場合において、独立して、a)H、b)ハロゲン、c)−(CH2CH2O)qH、d)−(CH2CH2O)q−CH3、e)C1〜20アルコキシ基、f)C1〜20アルキル基、g)C2〜20アルケニル基、h)C2〜20アルキニル基、i)−Y−C3〜14シクロアルキル基、j)−Y−C6〜14アリール基、k)−Y−3〜14員環シクロヘテロアルキル基、またはl)−Y−5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく;
Rfは、各場合において、a)H、b)−C(O)Rg、c)−C(O)NRgRh、d)−C(S)Rg、e)−C(S)NRgRh、f)C1〜20アルキル基、g)C2〜20アルケニル基、h)C2〜20アルキニル基、i)C3〜14シクロアルキル基、j)C6〜14アリール基、k)3〜14員環シクロヘテロアルキル基、またはl)5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく;
RgおよびRhは、各場合において、独立して、a)H、b)−OH、c)−SH、d)−S(O)2OH、e)−C(O)OH、f)−C(O)NH2、g)−C(S)NH2、h)−OC1〜10アルキル、i)−C(O)−C1〜20アルキル、j)−C(O)−OC1〜20アルキル、k)−C(S)N(C1〜20アルキル)2、l)−C(S)NH−C1〜20アルキル、m)−C(O)NH−C1〜20アルキル、n)−C(O)N(C1〜20アルキル)2、o)−S(O)m−C1〜20アルキル、p)−S(O)m−OC1〜20アルキル、q)C1〜20アルキル基、r)C2〜20アルケニル基、s)C2〜20アルキニル基、t)C1〜20アルコキシ基、u)C3〜14シクロアルキル基、v)C6〜14アリール基、w)3〜14員環シクロヘテロアルキル基、またはx)5〜14員環ヘテロアリール基であり、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく;
Riは、各場合において、a)ハロゲン、b)−CN、c)−NO2、d)オキソ、e)−OH、f)−NH2、g)−NH(C1〜20アルキル)、h)−N(C1〜20アルキル)2、i)−N(C1〜20アルキル)−C6〜14アリール、j)−N(C6〜14アリール)2、k)−S(O)mH、l)−S(O)m−C1〜20アルキル、m)−S(O)2OH、n)−S(O)m−OC1〜20アルキル、o)−S(O)m−OC6〜14アリール、p)−CHO、q)−C(O)−C1〜20アルキル、r)−C(O)−C6〜14アリール、s)−C(O)OH、t)−C(O)−OC1〜20アルキル、u)−C(O)−OC6〜14アリール、v)−C(O)NH2、w)−C(O)NH−C1〜20アルキル、x)−C(O)N(C1〜20アルキル)2、y)−C(O)NH−C6〜14アリール、z)−C(O)N(C1〜20アルキル)−C6〜14アリール、aa)−C(O)N(C6〜14アリール)2、ab)−C(S)NH2、ac)−C(S)NH−C1〜20アルキル、ad)−C(S)N(C1〜20アルキル)2、ae)−C(S)N(C6〜14アリール)2、af)−C(S)N(C1〜20アルキル)−C6〜14アリール、ag)−C(S)NH−C6〜14アリール、ah)−S(O)mNH2、ai)−S(O)mNH(C1〜20アルキル)、aj)−S(O)mN(C1〜20アルキル)2、ak)−S(O)mNH(C6〜14アリール)、al)−S(O)mN(C1〜20アルキル)−C6〜14アリール、am)−S(O)mN(C6〜14アリール)2、an)−SiH3、ao)−SiH(C1〜20アルキル)2、ap)−SiH2(C1〜20アルキル)、ar)−Si(C1〜20アルキル)3、as)C1〜20アルキル基、at)C2〜20アルケニル基、au)C2〜20アルキニル基、av)C1〜20アルコキシ基、aw)C1〜20アルキルチオ基、ax)C1〜20ハロアルキル基、ay)C3〜14シクロアルキル基、az)C6〜14アリール基、ba)3〜14員環シクロヘテロアルキル基、またはbb)5〜14員環ヘテロアリール基であり;
Yは、各場合において、a)二価のC1〜20アルキル基、b)二価のC1〜20ハロアルキル基、またはc)共有結合であり;
mは、各場合において、0、1、または2であり;
qは、各場合において、1〜20の整数であり;並びに
nおよびn’’のそれぞれが1または2である]を有する化合物。 - Rbが、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、−Y−C3〜14シクロアルキル基、−Y−C6〜14アリール基、−Y−3〜14員環シクロヘテロアルキル基、および−Y−5〜14員環ヘテロアリール基から選択され、この場合、C1〜20アルキル基、C2〜20アルケニル基、C2〜20アルキニル基、C3〜14シクロアルキル基、C6〜14アリール基、3〜14員環シクロヘテロアルキル基、および5〜14員環ヘテロアリール基のそれぞれは、場合により1〜4個のRi基で置換されていてもよく、YおよびRiは、請求項1で定義される通りである、請求項1に記載の化合物。
- 液体媒体中に溶解または分散された請求項1から4までのいずれか1項に記載の1種以上の化合物を含む組成物。
- 請求項1から4までのいずれか1項に記載の1種以上の化合物を有する薄膜半導体を有する、電子デバイス、光学デバイス、又は光電子デバイス。
- 有機電界効果トランジスタデバイス、有機光起電デバイス、または有機発光ダイオードである、請求項6に記載のデバイス。
- 基材上に請求項5の組成物を堆積させる工程を含み、組成物を堆積させる工程が、印刷、スピンコーティング、ドロップキャスティング、ゾーンキャスティング、ディップコーティング、ブレードコーティング、および吹き付けのうちの少なくとも1つを含む、薄膜半導体を有する、電子デバイス、光学デバイス、又は光電子デバイスを作製する方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US5754708P | 2008-05-30 | 2008-05-30 | |
| US61/057,547 | 2008-05-30 | ||
| PCT/EP2009/056624 WO2009144302A1 (en) | 2008-05-30 | 2009-05-29 | Semiconductor materials and methods of preparation and use thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011524862A JP2011524862A (ja) | 2011-09-08 |
| JP2011524862A5 JP2011524862A5 (ja) | 2012-07-12 |
| JP5591229B2 true JP5591229B2 (ja) | 2014-09-17 |
Family
ID=40886722
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011511026A Expired - Fee Related JP5591229B2 (ja) | 2008-05-30 | 2009-05-29 | 半導体材料並びにその製造方法およびその使用 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8569501B2 (ja) |
| EP (1) | EP2313409B1 (ja) |
| JP (1) | JP5591229B2 (ja) |
| KR (1) | KR101680910B1 (ja) |
| CN (1) | CN102066373B (ja) |
| CA (1) | CA2723267A1 (ja) |
| TW (2) | TW201002706A (ja) |
| WO (2) | WO2009144205A1 (ja) |
Families Citing this family (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2368281B1 (en) | 2008-11-24 | 2015-05-20 | Basf Se | Organic thin film transistor comprising a photocurable polymeric dielectric |
| KR101719379B1 (ko) | 2008-12-18 | 2017-03-23 | 바스프 에스이 | 디티에닐비닐렌 공중합체로부터 제조된 반도체 물질 |
| WO2010117449A2 (en) | 2009-04-06 | 2010-10-14 | University Of Kentucky Research Foundation | Semiconducting compounds and devices incorporating same |
| WO2010125011A2 (de) | 2009-04-28 | 2010-11-04 | Basf Se | Verfahren zur herstellung von halbleitenden schichten |
| CN102146151B (zh) * | 2010-02-04 | 2013-10-16 | 海洋王照明科技股份有限公司 | 苝四羧酸二酰亚胺共轭聚合物及其制备方法和应用 |
| WO2012088266A2 (en) | 2010-12-22 | 2012-06-28 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of fgfr3 |
| JP5734456B2 (ja) * | 2010-12-30 | 2015-06-17 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | ペリレンを基礎とする半導体、並びにそれらの製造及び使用方法 |
| US8471020B2 (en) | 2011-03-03 | 2013-06-25 | Basf Se | Perylene-based semiconducting materials |
| KR20130128468A (ko) | 2011-03-03 | 2013-11-26 | 바스프 에스이 | 페릴렌-기재 반도체 물질 |
| TW201302770A (zh) * | 2011-04-15 | 2013-01-16 | Georgia Tech Res Inst | 萘二醯亞胺和相關組合物的甲錫烷基衍生物及方法 |
| CN103732720B (zh) | 2011-05-11 | 2016-02-17 | 巴斯夫欧洲公司 | 卤代苝基半导体材料 |
| JP2015509913A (ja) * | 2011-12-22 | 2015-04-02 | インスティチュート・オブ・ケミストリー・チャイニーズ・アカデミー・オブ・サイエンシズ | ナフタレンジイミド類のスタニル誘導体とリレン化合物との反応生成物 |
| WO2013116956A1 (en) * | 2012-02-10 | 2013-08-15 | Institute Of Chemistry, Chinese Academy Of Sciences | Tetracene tetracarboxylic diimides and their preparation |
| PT3176170T (pt) | 2012-06-13 | 2019-02-05 | Incyte Holdings Corp | Compostos tricíclicos substituídos como inibidores de fgfr |
| EP2680336A1 (en) * | 2012-06-25 | 2014-01-01 | Tata Steel Nederland Technology B.V. | Photoactive material having an imide based conjugated backbone |
| US9388185B2 (en) | 2012-08-10 | 2016-07-12 | Incyte Holdings Corporation | Substituted pyrrolo[2,3-b]pyrazines as FGFR inhibitors |
| US9508937B2 (en) | 2012-08-22 | 2016-11-29 | University Of Washington Through Its Center For Commercialization | Acenaphthylene imide-derived semiconductors |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| CN104045657B (zh) * | 2013-03-14 | 2017-07-21 | 中国科学院化学研究所 | 五元杂环衍生物桥联的苝二酰亚胺二聚体、其制备方法及其在有机光伏器件中的应用 |
| PE20152033A1 (es) | 2013-04-19 | 2016-01-21 | Incyte Holdings Corp | Heterociclos bicicliclos como inhibidores de fgfr |
| CN104177378A (zh) * | 2013-05-21 | 2014-12-03 | 中国科学院化学研究所 | 四取代的苝二酰亚胺二聚体、其制备方法及其在有机光伏器件中的应用 |
| CN105659310B (zh) | 2013-08-13 | 2021-02-26 | 飞利斯有限公司 | 电子显示区域的优化 |
| TWI655807B (zh) | 2013-08-27 | 2019-04-01 | 飛利斯有限公司 | 具有可撓曲電子構件之可附接裝置 |
| WO2015031426A1 (en) | 2013-08-27 | 2015-03-05 | Polyera Corporation | Flexible display and detection of flex state |
| WO2015038671A2 (en) * | 2013-09-10 | 2015-03-19 | University Of Washington | Non-fullerene electron acceptors for organic photovoltaic devices |
| WO2015038684A1 (en) | 2013-09-10 | 2015-03-19 | Polyera Corporation | Attachable article with signaling, split display and messaging features |
| CN104650083B (zh) * | 2013-11-21 | 2016-08-17 | 中国科学院化学研究所 | 基于三苯胺-苝二酰亚胺的星型三维共轭分子及其制备方法和应用 |
| EP3087559B1 (en) | 2013-12-24 | 2021-05-05 | Flexterra, Inc. | Support structures for a flexible electronic component |
| WO2015100333A1 (en) | 2013-12-24 | 2015-07-02 | Polyera Corporation | Support structures for an attachable, two-dimensional flexible electronic device |
| WO2015100224A1 (en) | 2013-12-24 | 2015-07-02 | Polyera Corporation | Flexible electronic display with user interface based on sensed movements |
| WO2015100404A1 (en) | 2013-12-24 | 2015-07-02 | Polyera Corporation | Support structures for a flexible electronic component |
| US20150227245A1 (en) | 2014-02-10 | 2015-08-13 | Polyera Corporation | Attachable Device with Flexible Electronic Display Orientation Detection |
| CN103819482B (zh) * | 2014-03-10 | 2016-05-04 | 山东师范大学 | 一种环戊二烯桥连的二苝二酰亚胺化合物及其制备方法 |
| US10261634B2 (en) | 2014-03-27 | 2019-04-16 | Flexterra, Inc. | Infrared touch system for flexible displays |
| US20170301477A1 (en) | 2016-04-04 | 2017-10-19 | Capacitor Sciences Incorporated | Electro-polarizable compound and capacitor |
| US10347423B2 (en) | 2014-05-12 | 2019-07-09 | Capacitor Sciences Incorporated | Solid multilayer structure as semiproduct for meta-capacitor |
| US10319523B2 (en) | 2014-05-12 | 2019-06-11 | Capacitor Sciences Incorporated | Yanli dielectric materials and capacitor thereof |
| JP6953306B2 (ja) | 2014-05-12 | 2021-10-27 | キャパシター サイエンシズ インコーポレイテッドCapacitor Sciences Incorporated | エネルギー蓄積装置及びその製造方法 |
| US10340082B2 (en) | 2015-05-12 | 2019-07-02 | Capacitor Sciences Incorporated | Capacitor and method of production thereof |
| TWI692272B (zh) | 2014-05-28 | 2020-04-21 | 美商飛利斯有限公司 | 在多數表面上具有可撓性電子組件之裝置 |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| US9580423B2 (en) | 2015-02-20 | 2017-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| EP3617205B1 (en) | 2015-02-20 | 2021-08-04 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| WO2016138356A1 (en) | 2015-02-26 | 2016-09-01 | Polyera Corporation | Attachable device having a flexible electronic component |
| US10254795B2 (en) | 2015-05-06 | 2019-04-09 | Flexterra, Inc. | Attachable, flexible display device with flexible tail |
| US9932358B2 (en) | 2015-05-21 | 2018-04-03 | Capacitor Science Incorporated | Energy storage molecular material, crystal dielectric layer and capacitor |
| US11261181B2 (en) | 2015-07-09 | 2022-03-01 | University Of Utah Research Foundation | Sensor compounds and associated methods and devices |
| US10600574B2 (en) | 2015-10-21 | 2020-03-24 | Capacitor Sciences Incorporated | Organic compound, crystal dielectric layer and capacitor |
| US10636575B2 (en) | 2016-02-12 | 2020-04-28 | Capacitor Sciences Incorporated | Furuta and para-Furuta polymer formulations and capacitors |
| US9978517B2 (en) | 2016-04-04 | 2018-05-22 | Capacitor Sciences Incorporated | Electro-polarizable compound and capacitor |
| US10153087B2 (en) | 2016-04-04 | 2018-12-11 | Capacitor Sciences Incorporated | Electro-polarizable compound and capacitor |
| US10566138B2 (en) | 2016-04-04 | 2020-02-18 | Capacitor Sciences Incorporated | Hein electro-polarizable compound and capacitor thereof |
| CN107304218B (zh) * | 2016-04-22 | 2020-07-14 | 中国科学院化学研究所 | 一种邻位桥联苝二酰亚胺二聚体及其制备方法和在有机光伏器件中的应用 |
| US10395841B2 (en) | 2016-12-02 | 2019-08-27 | Capacitor Sciences Incorporated | Multilayered electrode and film energy storage device |
| AR111960A1 (es) | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| CA3099116A1 (en) | 2018-05-04 | 2019-11-07 | Incyte Corporation | Salts of an fgfr inhibitor |
| CN112867716A (zh) | 2018-05-04 | 2021-05-28 | 因赛特公司 | Fgfr抑制剂的固体形式和其制备方法 |
| WO2020185532A1 (en) | 2019-03-08 | 2020-09-17 | Incyte Corporation | Methods of treating cancer with an fgfr inhibitor |
| WO2021007269A1 (en) | 2019-07-09 | 2021-01-14 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| JOP20220083A1 (ar) | 2019-10-14 | 2023-01-30 | Incyte Corp | حلقات غير متجانسة ثنائية الحلقة كمثبطات لـ fgfr |
| US11566028B2 (en) | 2019-10-16 | 2023-01-31 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| CA3163875A1 (en) | 2019-12-04 | 2021-06-10 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| CA3162010A1 (en) | 2019-12-04 | 2021-06-10 | Incyte Corporation | Derivatives of an fgfr inhibitor |
| US11939331B2 (en) | 2021-06-09 | 2024-03-26 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5086059A (en) | 1990-06-07 | 1992-02-04 | Du Pont Merck Pharmaceutical Company | Bis-naphthalimides as anticancer agents |
| US5641782A (en) * | 1995-02-16 | 1997-06-24 | The Dupont Merck Pharmaceutical Company | 3-aromatic and 3-heteroaromatic substituted bisnaphthalimides |
| US5645965A (en) * | 1996-08-08 | 1997-07-08 | Xerox Corporation | Symmetrical perylene dimers |
| KR101148868B1 (ko) * | 2004-01-26 | 2012-05-29 | 노오쓰웨스턴 유니버시티 | 페릴렌 n-형 반도체 및 관련된 소자 |
| CN1938321B (zh) * | 2004-03-29 | 2010-05-05 | 三井化学株式会社 | 新型化合物及使用该化合物的有机电子元件 |
| JP4993645B2 (ja) * | 2004-12-01 | 2012-08-08 | ジェネンテック, インコーポレイテッド | 抗体薬剤結合体および方法 |
| DE102005018241A1 (de) | 2005-04-19 | 2006-10-26 | Basf Ag | Hexarylen- und Pentarylentetracarbonsäurediimide |
| DE102005037115A1 (de) * | 2005-08-03 | 2007-02-08 | Basf Ag | Mehrfachchromophore |
| US7947837B2 (en) | 2006-10-25 | 2011-05-24 | Polyera Corporation | Organic semiconductor materials and methods of preparing and use thereof |
| WO2008063609A2 (en) | 2006-11-17 | 2008-05-29 | Polyera Corporation | Diimide-based semiconductor materials and methods of preparing and using the same |
| EP2104676A2 (en) | 2007-01-08 | 2009-09-30 | Polyera Corporation | Methods for preparing arene-bis(dicarboximide)-based semiconducting materials and related intermediates for preparing same |
| EP2626359B1 (en) * | 2007-05-09 | 2014-08-06 | Yeda Research and Development Co. Ltd. | Perylene diimides |
| CA2713852A1 (en) * | 2008-02-05 | 2009-08-13 | Basf Se | Naphthalene-imide semiconductor polymers |
-
2009
- 2009-05-26 WO PCT/EP2009/056338 patent/WO2009144205A1/en active Application Filing
- 2009-05-27 TW TW098117835A patent/TW201002706A/zh unknown
- 2009-05-29 KR KR1020107025969A patent/KR101680910B1/ko active IP Right Grant
- 2009-05-29 CA CA2723267A patent/CA2723267A1/en not_active Abandoned
- 2009-05-29 US US12/994,596 patent/US8569501B2/en active Active
- 2009-05-29 WO PCT/EP2009/056624 patent/WO2009144302A1/en active Application Filing
- 2009-05-29 EP EP09753957.1A patent/EP2313409B1/en not_active Not-in-force
- 2009-05-29 JP JP2011511026A patent/JP5591229B2/ja not_active Expired - Fee Related
- 2009-05-29 CN CN2009801202934A patent/CN102066373B/zh active Active
- 2009-06-01 TW TW098118110A patent/TWI477504B/zh active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2009144205A1 (en) | 2009-12-03 |
| CN102066373A (zh) | 2011-05-18 |
| TWI477504B (zh) | 2015-03-21 |
| CN102066373B (zh) | 2013-10-16 |
| EP2313409A1 (en) | 2011-04-27 |
| KR20110028578A (ko) | 2011-03-21 |
| US8569501B2 (en) | 2013-10-29 |
| TW201002706A (en) | 2010-01-16 |
| WO2009144302A1 (en) | 2009-12-03 |
| KR101680910B1 (ko) | 2016-11-29 |
| EP2313409B1 (en) | 2014-11-26 |
| US20110136333A1 (en) | 2011-06-09 |
| JP2011524862A (ja) | 2011-09-08 |
| TW201012819A (en) | 2010-04-01 |
| CA2723267A1 (en) | 2009-12-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5591229B2 (ja) | 半導体材料並びにその製造方法およびその使用 | |
| JP5523351B2 (ja) | ペリレン半導体並びにその製造方法及び使用 | |
| JP5649977B2 (ja) | ナフタレン−イミド半導体ポリマー | |
| US8022214B2 (en) | Organic semiconductor materials and precursors thereof | |
| JP2013515785A (ja) | 有機半導体としてのチオン酸化芳香族ビスイミドおよびそれを組み込む装置 | |
| JP5875709B2 (ja) | 有機半導体デバイスの製造方法 | |
| KR101430945B1 (ko) | 퍼릴렌 기재 반도체 및 그의 제조 방법 및 용도 | |
| US8598575B2 (en) | Semiconducting compounds and related compositions and devices | |
| US8513445B2 (en) | Polycyclic aromatic molecular semiconductors and related compositions and devices |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120528 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120528 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20131128 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131202 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140217 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140224 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140402 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140409 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140502 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140513 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140527 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140630 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140729 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5591229 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313117 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313117 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| LAPS | Cancellation because of no payment of annual fees |