JP5501615B2 - モルホリン化合物の塩 - Google Patents
モルホリン化合物の塩 Download PDFInfo
- Publication number
- JP5501615B2 JP5501615B2 JP2008524814A JP2008524814A JP5501615B2 JP 5501615 B2 JP5501615 B2 JP 5501615B2 JP 2008524814 A JP2008524814 A JP 2008524814A JP 2008524814 A JP2008524814 A JP 2008524814A JP 5501615 B2 JP5501615 B2 JP 5501615B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- methyl
- dichlorobenzyl
- morpholin
- powder
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/14—Decongestants or antiallergics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Description
(1) (2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩。
(2) (2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の結晶。
(3) 粉末X線回折スペクトルにおいて、2θで表される回折角度として24.1゜(±0.2゜)付近にピークを示す(2)に記載の結晶。
(4) 粉末X線回折スペクトルにおいて、2θで表される回折角度として25.6゜(±0.2゜)付近にピークを示す(2)又は(3)に記載の結晶。
(5) 粉末X線回折スペクトルにおいて、2θで表される回折角度として22.3゜(±0.2゜)付近にピークを示す(2)〜(4)のいずれか1項に記載の結晶。
(6) 粉末X線回折スペクトルにおいて、2θで表される回折角度として20.9゜(±0.2゜)付近にピークを示す(2)〜(5)のいずれか1項に記載の結晶。
(7) 粉末X線回折スペクトルにおいて、2θで表される回折角度として20.9゜、22.3゜、24.1゜及び25.6゜(それぞれ±0.2゜)付近にピークを示す(2)〜(6)のいずれか1項に記載の結晶。
(8) 示差走査熱分析による融点(補外開始温度)が約163℃〜約171℃である(2)〜(7)のいずれか1項に記載の結晶。
(9) 示差走査熱分析による融点(補外開始温度)が約169℃である(2)〜(8)のいずれか1項に記載の結晶。
(10) 下記のA及び/又はBで示される物理化学的性質を有する(2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の結晶。
A:図1に示される粉末X線回折パターンを有する。
B:図2に示される示差走査熱分析曲線を有する。
(11) 粉末X線回折スペクトルにおいて、2θで表される回折角度として24.9゜(±0.2゜)付近にピークを示す(2)に記載の結晶。
(12) 粉末X線回折スペクトルにおいて、2θで表される回折角度として21.7゜(±0.2゜)付近にピークを示す(2)又は(11)のいずれか1項に記載の結晶。
(13) 粉末X線回折スペクトルにおいて、2θで表される回折角度として16.0゜(±0.2゜)付近にピークを示す(2)、(11)又は(12)のいずれか1項に記載の結晶。
(14) 粉末X線回折スペクトルにおいて、2θで表される回折角度として16.0゜、21.7゜及び24.9゜(それぞれ±0.2゜)付近にピークを示す(2)、(11)、(12)又は(13)のいずれか1項に記載の結晶。
(15) 示差走査熱分析による融点(補外開始温度)が約135℃〜約143℃である(2)、(11)、(12)、(13)又は(14)のいずれか1項に記載の結晶。
(16) 示差走査熱分析による融点(補外開始温度)が約141℃である(2)、(11)、(12)、(13)、(14)又は(15)のいずれか1項に記載の結晶。
(17) 下記のC及び/又はDで示される物理化学的性質を有する(2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の結晶。
C:図3に示される粉末X線回折パターンを有する。
D:図4に示される示差走査熱分析曲線を有する。
(18) (2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の非晶質体。
(19) 下記のEで示される物理化学的性質を有する(2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の非晶質体。
E:図5に示される粉末X線回折パターンを有する
(20) (1)〜(19)のいずれかに記載の化合物を含む医薬。
(21) (1)〜(19)のいずれかに記載の化合物を有効成分として含むCCR3拮抗剤。
(22) (1)〜(19)のいずれかに記載の化合物と製薬上許容される添加剤とを含有する医薬組成物。
(23) 喘息、副鼻腔炎、アレルギー性鼻炎、アトピー性皮膚炎、アレルギー性結膜炎、アレルギー性脊髄炎、潰瘍性大腸炎、クローン病又は関節リウマチの予防剤及び/又は治療剤である(22)に記載の医薬組成物。
(24) (2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド カリウム塩。
(25) (2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド カリウム塩の結晶。
(26) 粉末X線回折スペクトルにおいて、2θで表される回折角度として23.1゜、29.8゜及び30.7゜(それぞれ±0.2゜)付近にピークを示す請求項25に記載の結晶。
(27) 下記のFで示される物理化学的性質を有する(2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド カリウム塩の結晶。
F:図6に示される粉末X線回折パターンを有する。
1−1 (2S)−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}クロロアセトアミドの合成
(2S)−2−アミノメチル−4−(3,4−ジクロロベンジル)モルホリン・2塩酸塩120gをtert−ブチルメチルエーテル450mlに溶解し、次いで水450mlを加え、氷浴上で冷却した。炭酸水素ナトリウム95.56gをゆっくりと加え、添加後、クロロアセチルクロリド29mlを、内温15℃以下を保ちながら約10分かけて滴下した。滴下終了後、室温で1.5時間攪拌した。1.5時間後、反応混合液に室温下炭酸水素ナトリウム3gと、クロロアセチルクロリド2.7mlを順次追加し、さらに1.5時間攪拌した。反応混合液を静置後分液し、有機層を(2S)−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}クロロアセトアミドのtert−ブチルメチルエーテル溶液として得た。
4−エトキシカルボニルメチル−2−メルカプトチアゾール70.14gを、水300mlとtert−ブタノール250mlの混合溶液に溶解した後、水浴上で、水酸化ナトリウム29.46gを加え、1.5時間攪拌した。この反応混合物に上記1−1で得た(2S)−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}クロロアセトアミドのtert−ブチルメチルエーテル溶液を加えた。次いで65℃で6時間攪拌した。反応混合液にn−ヘプタン50mlおよび水50mlを添加し、室温まで冷却した。反応混合液を静置後分液し、水層はさらにtert−ブチルメチルエーテル200ml/n−ヘプタン20mlの混合溶媒で洗浄した。水層に6N塩酸60mlを加え、酢酸エチル750mlで抽出し、さらに酢酸エチル175ml/tert−ブタノール20mlの混合溶媒で2回抽出した。得られた有機層を無水硫酸ナトリウムで乾燥後、溶媒を減圧留去し、化合物1−2の粗生成物181gを得た。
1−3−1:化合物1−2の粗生成物181gをアセトン800mlに溶解した。セライトフィルターを用いて不溶物を分離し、さらにアセトン200mlおよび水5mlを加えた。種晶を加えた後室温で1時間、さらに氷浴下2時間攪拌し、析出した結晶を濾取し、0.5%含水アセトンで洗浄した後、減圧下で乾燥し、化合物1−3の粗生成物170.6gを得た。
以下の条件でXRDパターンを測定した。
装置:RINT2200/Ultima+(リガク社)
条件:
X線管球:Cu Kα1
管電流:40 mA
管電圧:40 kV
走査速度:4゜/min
書き出し範囲:2θ=2〜35゜
得られた粉末X線回折パターンを図1に示した。
結晶の特徴的なピークは、2θで表される回折角度として20.9°、22.3°、24.1°及び25.6°(それぞれ±0.2゜)付近であった。
得られた化合物 2.8mgを示差走査熱測定装置DSC821e(メトラー・トレド社)にのせ、昇温速度10℃/min(25〜200℃、窒素40mL/min)で測定した。その結果、融点(補外開始温度)は約169℃付近に認められた。得られたDSC曲線を図2に示した。
得られた化合物について元素分析を実施したところ、C:39.99, H:3.70, N:7.39, S:11.19, Cl:12.41, Br:13.60(理論値;C:39.94, H:3.88, N:7.35, S:11.22, Cl:12.41, Br:13.99)であった。
国際公開 WO06/028284号パンフレットの実施例75に記載の方法に準じて製造することができる(2S)−[4−(エトキシカルボニルメチル)チアゾール−2−イルチオ]−N−[(モルホリン−2−イル)メチル]アセトアミド500mgと3,4−ジクロロベンズアルデヒドをジクロロメタン7mlに溶解した後、室温で酢酸0.85mlを添加した。室温で1時間攪拌した後、反応液にトリアセトキシ水素化ホウ素ナトリウム590mgを加え、さらに室温で6時間攪拌した。反応液に飽和炭酸水素ナトリウム水溶液を加え、クロロホルムで抽出した。抽出液を飽和食塩水で洗浄、続いて硫酸ナトリウムで乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィーにより、クロロホルムとメタノールの混合溶媒を溶出液として精製した。溶出液より溶媒を減圧留去し、化合物Aを淡黄色油状物として360mg得た。
350mgの化合物Aをテトラヒドロフラン1.5mlとメタノール1.5mlに溶解した。反応液に1M水酸化ナトリウム水溶液1.5mlを加え、室温で一晩攪拌した。反応液に1M塩酸を2ml加えた後、有機溶媒のみ減圧留去した。得られた残渣に水を加え、クロロホルムで抽出した。抽出液を飽和食塩水で洗浄、続いて硫酸ナトリウムで乾燥後、溶媒を減圧留去することにより、化合物1−2を無色無定形固体として270mg得た。
0.34gの化合物1−3に5%含水アセトン4mlを加えて60℃にて加熱還流して完全に溶解させた。この溶液を急激に0℃まで冷却し、種晶を少量加えると結晶性の白沈が生じた。更に同温度で5分間攪拌し、沈殿物を濾取し、室温で2時間減圧乾燥して化合物2を白色結晶として0.18g得た。
実施例1に記載したXRD分析条件と同条件で測定した粉末X線回折パターンを図3に示した。結晶の特徴的なピークは2θで表される回折角度として16.0°、21.7°及び24.9°(それぞれ±0.2゜)付近であった。
得られた化合物 1.3mgを示差走査熱測定装置DSC821e(メトラー・トレド社)にのせ、昇温速度40℃/min(25〜200℃,窒素40 mL/min)で測定した。その結果、第一融点(補外開始温度)は約141℃付近に認められた。得られたDSC曲線を図4に示した。
元素分析
得られた化合物について元素分析を実施したところ、C:39.33, H:3.75, N:7.20, S:11.06, Cl:12.16, Br:13.38(理論値;C:39.94, H:3.88, N:7.35, S:11.22, Cl:12.41, Br:13.99)であった。
2gの実施例1で得られた化合物1−3を遊星ボールミル粉砕機(FRITSCH社製 P-7型)を用いて、900rpmにて1時間粉砕を行い、化合物3を白色固体として得た。
XRD分析
実施例1に記載したXRD分析条件と同条件で測定した粉末X線回折パターンを図5に示した。特徴的なピークは2θで表される回折角度として全く示すことはなく、非晶質体特有のブロードなパターン(ハロー)を示した。
WO2006/028284号パンフレット実施例2に記載の方法に準じて得られた化合物1−2約5mgにテトラヒドロフラン500μLを添加して溶解し、これに1.7mol/Lの水酸化カリウム水溶液を10μL加えて、十分に混ぜ合わせた後、40℃に加温し、その後、室温にて溶媒を自然蒸散させることにより、白色固体を得た。
XRD分析
走査速度を2゜/minにした以外は実施例1に記載したXRD分析条件と同条件で測定した。得られた粉末X線回折パターンを図6に示した。結晶の特徴的なピークは2θで表される回折角度として23.1°、29.8°及び30.7°(それぞれ±0.2゜)付近であった。
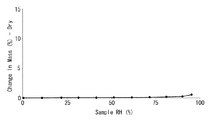
吸湿性の指標となる水分吸着測定を、DVS-1型水分吸着装置(SMS社製)を用い、以下の条件で行った。試料約7mgを用いて、相対湿度0%から90%までの範囲について、10%毎に相対湿度を上昇させた後、最終的に相対湿度95%まで上昇させた。設定した相対湿度毎に重量変化を記録し、相対湿度0%における重量をもとに変化量(%)に換算をした。試料は国際公開 WO2006/028284号パンフレット実施例2に記載の方法に準じて得られた化合物1−2(以下、フリー体という。)、実施例1に記載の方法により得られた化合物1−3(以下、臭化水素酸塩I形結晶という。)及び実施例2に記載の方法により得られた化合物2(以下、臭化水素酸塩II形結晶という。)を用いた。
Claims (7)
- 粉末X線回折スペクトルにおいて、2θで表される回折角度として20.9゜、22.3゜、24.1゜及び25.6゜(それぞれ±0.2゜)にピークを示す(2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の結晶。
- 粉末X線回折スペクトルにおいて、2θで表される回折角度として20.9゜、22.3゜、24.1゜及び25.6゜(それぞれ±0.2゜)にピークを示し、示差走査熱分析による融点(補外開始温度)が163℃〜171℃である(2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の結晶。
- 粉末X線回折スペクトルにおいて、2θで表される回折角度として20.9゜、22.3゜、24.1゜及び25.6゜(それぞれ±0.2゜)にピークを示し、示差走査熱分析による融点(補外開始温度)が169℃である(2S)−[4−(カルボキシメチル)チアゾール−2−イルチオ]−N−{[4−(3,4−ジクロロベンジル)モルホリン−2−イル]メチル}アセトアミド 臭化水素酸塩の結晶。
- 請求項1〜3のいずれかに記載の結晶を含む医薬。
- 請求項1〜3のいずれかに記載の結晶を有効成分として含むCCR3拮抗剤。
- 請求項1〜3のいずれかに記載の結晶と製薬上許容される添加剤とを含有する医薬組成物。
- 喘息、副鼻腔炎、アレルギー性鼻炎、アトピー性皮膚炎、アレルギー性結膜炎、アレルギー性脊髄炎、潰瘍性大腸炎、クローン病又は関節リウマチの予防剤及び/又は治療剤である請求項6に記載の医薬組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008524814A JP5501615B2 (ja) | 2006-07-11 | 2007-07-11 | モルホリン化合物の塩 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006190437 | 2006-07-11 | ||
| JP2006190437 | 2006-07-11 | ||
| JP2008524814A JP5501615B2 (ja) | 2006-07-11 | 2007-07-11 | モルホリン化合物の塩 |
| PCT/JP2007/063801 WO2008007691A1 (fr) | 2006-07-11 | 2007-07-11 | Sels de composé de morpholine |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013225889A Division JP2014015489A (ja) | 2006-07-11 | 2013-10-30 | モルホリン化合物の塩 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2008007691A1 JPWO2008007691A1 (ja) | 2009-12-10 |
| JP5501615B2 true JP5501615B2 (ja) | 2014-05-28 |
Family
ID=38923247
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008524814A Expired - Fee Related JP5501615B2 (ja) | 2006-07-11 | 2007-07-11 | モルホリン化合物の塩 |
| JP2013225889A Pending JP2014015489A (ja) | 2006-07-11 | 2013-10-30 | モルホリン化合物の塩 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013225889A Pending JP2014015489A (ja) | 2006-07-11 | 2013-10-30 | モルホリン化合物の塩 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US8030303B2 (ja) |
| EP (1) | EP2042499B1 (ja) |
| JP (2) | JP5501615B2 (ja) |
| ES (1) | ES2687756T3 (ja) |
| TW (1) | TWI399375B (ja) |
| WO (1) | WO2008007691A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014015489A (ja) * | 2006-07-11 | 2014-01-30 | Mitsubishi Tanabe Pharma Corp | モルホリン化合物の塩 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6382816B2 (ja) * | 2013-07-24 | 2018-08-29 | 田辺三菱製薬株式会社 | 眼科疾患治療剤 |
| WO2020203822A1 (ja) * | 2019-03-29 | 2020-10-08 | 千寿製薬株式会社 | 血管新生を伴う網膜疾患の治療又は予防のための併用医薬 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005097120A (ja) * | 2000-10-06 | 2005-04-14 | Mochida Pharmaceut Co Ltd | 4−ヒドロキシピペリジン誘導体の非潮解性塩 |
| WO2006028284A1 (ja) * | 2004-09-08 | 2006-03-16 | Mitsubishi Pharma Corporation | モルホリン化合物 |
| JP2006514952A (ja) * | 2002-12-23 | 2006-05-18 | ハー・ルンドベック・アクチエゼルスカベット | 臭化水素酸エスシタロプラム(escitalopramhydrobromide)およびその製造方法 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101137880B1 (ko) | 2004-12-31 | 2012-04-20 | 엘지디스플레이 주식회사 | 쉬프트 레지스터 및 그 구동 방법 |
| WO2008007691A1 (fr) * | 2006-07-11 | 2008-01-17 | Mitsubishi Tanabe Pharma Corporation | Sels de composé de morpholine |
-
2007
- 2007-07-11 WO PCT/JP2007/063801 patent/WO2008007691A1/ja active Application Filing
- 2007-07-11 JP JP2008524814A patent/JP5501615B2/ja not_active Expired - Fee Related
- 2007-07-11 US US12/309,196 patent/US8030303B2/en not_active Expired - Fee Related
- 2007-07-11 ES ES07790605.5T patent/ES2687756T3/es active Active
- 2007-07-11 TW TW096125165A patent/TWI399375B/zh not_active IP Right Cessation
- 2007-07-11 EP EP07790605.5A patent/EP2042499B1/en not_active Not-in-force
-
2013
- 2013-10-30 JP JP2013225889A patent/JP2014015489A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005097120A (ja) * | 2000-10-06 | 2005-04-14 | Mochida Pharmaceut Co Ltd | 4−ヒドロキシピペリジン誘導体の非潮解性塩 |
| JP2006514952A (ja) * | 2002-12-23 | 2006-05-18 | ハー・ルンドベック・アクチエゼルスカベット | 臭化水素酸エスシタロプラム(escitalopramhydrobromide)およびその製造方法 |
| WO2006028284A1 (ja) * | 2004-09-08 | 2006-03-16 | Mitsubishi Pharma Corporation | モルホリン化合物 |
Non-Patent Citations (1)
| Title |
|---|
| JPN7012004075; 粟津荘司他, 最新薬剤学, 第7版, 2001, p.199 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014015489A (ja) * | 2006-07-11 | 2014-01-30 | Mitsubishi Tanabe Pharma Corp | モルホリン化合物の塩 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20090264430A1 (en) | 2009-10-22 |
| EP2042499B1 (en) | 2018-06-27 |
| JPWO2008007691A1 (ja) | 2009-12-10 |
| TWI399375B (zh) | 2013-06-21 |
| ES2687756T3 (es) | 2018-10-29 |
| EP2042499A1 (en) | 2009-04-01 |
| WO2008007691A1 (fr) | 2008-01-17 |
| US8030303B2 (en) | 2011-10-04 |
| JP2014015489A (ja) | 2014-01-30 |
| EP2042499A4 (en) | 2009-10-21 |
| TW200817392A (en) | 2008-04-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8318723B2 (en) | Pyrazine compounds, their use and methods of preparation | |
| JP6008937B2 (ja) | 1−(3−シアノ−1−イソプロピル−インドール−5−イル)ピラゾール−4−カルボン酸の結晶形とその製造方法 | |
| RU2434851C1 (ru) | Циклические n, n'-диарилтиомочевины или n, n'-диарилмочевины - антагонисты андрогенных рецепторов, противораковое средство, способ получения и применения | |
| JP2000501728A (ja) | タキキニン受容体の拮抗薬としての3―ベンジルアミノピロリジン及び3―ベンジルアミノピペリジン | |
| EA023955B1 (ru) | Производное аминоалкилзамещенного n-тиенилбензамида | |
| JP2000500154A (ja) | モルホリン誘導体及び治療薬としてのそれらの使用 | |
| MXPA06000850A (es) | Compuesto de acido ciclohexancarboxilico. | |
| AU2019345150A1 (en) | Antibacterial compounds | |
| JP5710490B2 (ja) | (r)−5−((e)−2−(ピロリジン−3−イルビニル)ピリミジンの合成および新規の塩形態 | |
| CN113474339A (zh) | 1-(1-氧代-1,2-二氢异喹啉-5-基)-5-(三氟甲基)-n-(2-(三氟甲基)吡啶-4-基)-1h-吡唑-4-甲酰胺一水合物的结晶形式 | |
| JP5501615B2 (ja) | モルホリン化合物の塩 | |
| JP5282037B2 (ja) | 新規なイソキノリン化合物の塩及びその結晶 | |
| JP6178799B2 (ja) | アプレピタントl−プロリン溶媒和化合物−組成物及び共結晶 | |
| WO2014034626A1 (ja) | N-[2-({2-[(2S)-2-シアノピロリジン-1-イル]-2-オキソエチル}アミノ)-2-メチルプロピル]-2-メチルピラゾロ[1,5-a]ピリミジン-6-カルボキサミドの結晶 | |
| US11932630B2 (en) | Heteroaryl aminopropanol derivatives | |
| TW201206910A (en) | Substituted N-heterocycloalkyl bipyrrolidinylphenyl amide derivatives, preparation and therapeutic use thereof | |
| US9085539B2 (en) | Cyclic N,N′-diarylthiourea—androgen receptor antagonist, anti breast cancer composition and use thereof | |
| CN102666528B (zh) | 晶体cdc7 抑制剂盐 | |
| WO2015049667A1 (en) | Novel compound as a diacylglycerol acyltransferase inhibitor | |
| WO2024077059A1 (en) | Crystalline forms of an mk2 inhibitor | |
| JP4435090B2 (ja) | スルホンアミド含有インドール化合物の結晶およびその製造方法 | |
| WO2018155398A1 (ja) | アミド誘導体 | |
| WO2022237843A1 (zh) | Axl抑制剂 | |
| CN115448978A (zh) | Tgr5-dpp4双重活性化合物及其制备方法、药物组合物和用途 | |
| UA57089C2 (uk) | Поліморфна форма 2-(r)-(1(r)-(3,5-біс(трифторметил)феніл)етокси)-3-(s)-(4-фтор)феніл-4-(3-(5-оксо-1h,4h-1,2,4-триазоло)метил)морфоліну як антагоніст рецептора тахікініну |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100602 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121009 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121206 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130115 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130730 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131030 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20131031 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20131126 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A132 Effective date: 20140107 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140117 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140212 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140312 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5501615 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |