JP5328362B2 - 細孔を使用する方法 - Google Patents
細孔を使用する方法 Download PDFInfo
- Publication number
- JP5328362B2 JP5328362B2 JP2008540686A JP2008540686A JP5328362B2 JP 5328362 B2 JP5328362 B2 JP 5328362B2 JP 2008540686 A JP2008540686 A JP 2008540686A JP 2008540686 A JP2008540686 A JP 2008540686A JP 5328362 B2 JP5328362 B2 JP 5328362B2
- Authority
- JP
- Japan
- Prior art keywords
- pore
- nucleotide
- monophosphate
- nucleotides
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/48707—Physical analysis of biological material of liquid biological material by electrical means
- G01N33/48721—Investigating individual macromolecules, e.g. by translocation through nanopores
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6869—Methods for sequencing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2565/00—Nucleic acid analysis characterised by mode or means of detection
- C12Q2565/60—Detection means characterised by use of a special device
- C12Q2565/631—Detection means characterised by use of a special device being a biochannel or pore
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Medicinal Chemistry (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Urology & Nephrology (AREA)
- Pathology (AREA)
- Hematology (AREA)
- Nanotechnology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Investigating Or Analyzing Materials By The Use Of Electric Means (AREA)
- Solid-Sorbent Or Filter-Aiding Compositions (AREA)
Description
本発明は、貫通膜細孔を使用しての個々のヌクレオチドおよび他のホスフェート含有部分の同定に関する。特に、本発明は、貫通膜細孔を使用しての標的核酸の配列決定に関する。
DNAを配列決定するための現在の方法は、蛍光ddXTP、dXTP、プライマーおよびポリメラーゼ等の多数の高価な試薬を必要とする。この方法は、資格のある技術者によって操作される必要がある、高性能の装置を必要とする。また、この方法は、長さが1千ヌクレオチド未満の配列に限定される。
驚くべきことに、個々のヌクレオチドが、それらが貫通膜細孔と相互作用する際に、それらの電流振幅(current amplitude)から単一分子レベルで同定され得ることが実証された。したがって、個々のヌクレオチドを同定するため、およびエキソヌクレアーゼ配列決定によって核酸配列を決定するために、確率的検知が使用され得る。
(a)該ヌクレオチドを膜貫通タンパク質細孔と接触させ、その結果、該ヌクレオチドが該細孔と相互作用する工程、および
(b)該相互作用の間に該細孔を通過する電流を測定し、それによって該ヌクレオチドの実体を決定する工程
を含む、方法を提供する。
− 標的核酸配列を配列決定する方法であって、以下:
(a)プロセッシブエキソヌクレアーゼ(processive exonuclease)を使用して該標的配列の一方の末端から個々のヌクレオチドを消化する工程;
(b)該ヌクレオチドを膜貫通タンパク質細孔と接触させ、その結果、該ヌクレオチドが該細孔と相互作用する工程;
(c)該相互作用の間に該細孔を通過する電流を測定し、それによって該ヌクレオチドの実体を決定する工程;および
(d)該核酸配列の同一の末端で工程(a)〜(c)を繰り返し、それによって該核酸の配列を決定する工程
を含む、方法;ならびに
− 核酸を配列決定するためのキットであって、以下:
− シクロデキストリン;および
− プロセッシブエキソヌクレアーゼ
を含む、キット。
配列番号1は、α溶血素の1サブユニットをコードするポリヌクレオチド配列を示す。
個々のヌクレオチドを同定する方法
第1の態様において、本発明は、個々のヌクレオチドを同定する方法であって、該ヌクレオチドを膜貫通タンパク質細孔と接触させ、その結果、該ヌクレオチドが該細孔と相互作用する工程、および該相互作用の間に該細孔を通過する電流を測定し、それによって該ヌクレオチドの実体を決定する工程を含む方法に関する。したがって、本発明は、個々のヌクレオチドの確率的検知を含む。本発明は、貫通膜タンパク質細孔を通過する電流に対してそれらが有する異なる効果に基づいて、類似の構造のヌクレオチドを識別するために使用され得る。本発明はまた、特定のヌクレオチドがサンプル中に存在するかどうかを決定するために使用され得る。本発明はまた、サンプル中の特定のヌクレオチドの濃度を測定するために使用され得る。
膜は、イオンおよびヌクレオチドの流れに対してバリアを形成する。膜は、好ましくは、脂質二重層である。本発明に従う使用に好適な脂質二重層は、当該技術分野において公知の方法を使用して作製され得る。例えば、脂質二重層膜は、MontalおよびMueller(1972)の方法を使用して形成され得る。本発明の方法は、リン脂質、糖脂質、コレステロールおよびそれらの混合物を含むがこれらに限定されない任意の膜脂質から形成された脂質二重層を使用して行われ得る。脂質二重層は、好ましくは、1,2-ジフィタノイル-sn-グリセロ-3-ホスホコリンから形成される。
本発明の方法は、貫通膜タンパク質細孔を使用して行われる。貫通膜タンパク質細孔は、イオンが電気化学的勾配に沿って膜の一方の面から他方へ流れることを許容するポリペプチドである。細孔は、好ましくは、ヌクレオチドが電気化学的勾配に沿って膜の一方の面から他方へ流れることを許容する。
ヌクレオチドは、膜のいずれかの面上の細孔と接触され得る。ヌクレオチドは、膜のいずれかの面上の細孔へ導入され得る。ヌクレオチドは、好ましくは、イオンが細孔へ入りそして電気化学的勾配に沿って膜を横切って流れることを可能にする膜の面上の細孔と接触される。ヌクレオチドは、好ましくは、ヌクレオチドが細孔を通って膜の他方の面へ通過することを可能にする膜の面と接触させられる。例えば、ヌクレオチドは、その天然環境においてイオンまたは小分子(例えば、ヌクレオチド)が細孔のバレルまたはチャネル中へ入ることを可能にする細孔の末端と接触させられ、その結果、イオンまたは小分子は細孔を通過し得る。
本方法は、貫通膜タンパク質細孔が膜中へ挿入されている膜/細孔システムを研究するために好適である任意の装置を使用して行われ得る。本方法は、確率的検知のために好適である任意の装置を使用して行われ得る。例えば、装置は、水溶液を含むチャンバおよびチャンバを2つの区域に分離するバリアを備える。バリアは、細孔を含む膜が形成されている開口部を有する。ヌクレオチドは、ヌクレオチドをチャンバ中へ導入することによって、細孔と接触され得る。ヌクレオチドは、チャンバの2つの区域のいずれかの中へ導入され得る。
貫通膜細孔は、好ましくは、細孔とヌクレオチドとの相互作用を促進する分子アダプターを含む。該アダプターは、典型的に、ヌクレオチドとのその相互作用を改善する細孔の物理的または化学的性質に対する効果を有する。アダプターは、典型的に、細孔のバレルまたはチャネルの電荷を変化させるか、または特異的にヌクレオチドと相互作用するかもしくはこれへ結合しそれによって細孔とのその相互作用を促進する。アダプターは、好ましくは、ヌクレオチド上の1以上のリン酸基と相互作用するか、またはp−カチオン相互作用によってヌクレオチド中の塩基と相互作用する。アダプターは、ヌクレオチドと細孔との相互作用を媒介し得る。例えば、ヌクレオチドは、アダプターを介して細孔へ可逆的に結合し得る。または、アダプターは、細孔と共にヌクレオチドと相互作用し得る。例えば、ヌクレオチドは、細孔およびアダプターの両方へ可逆的に結合し得る。アダプターは、好ましくは、バレルまたはチャネルを収縮させ、その結果、それはヌクレオチドと相互作用し得る。
本発明の方法は、任意のヌクレオチドを同定するために使用され得る。ヌクレオチドは、天然のものまたは人工のものであり得る。ヌクレオチドは、典型的に、核酸塩基、糖、および少なくとも1つのリン酸基を含有する。核酸塩基は、典型的に、複素環式のものである。好適な核酸塩基としては、プリンおよびピリミジン、ならびにより具体的には、アデニン、グアニン、チミン、ウラシルおよびシトシンが挙げられる。糖は、典型的に、五炭糖である。好適な糖としては、リボースおよびデオキシリボースが挙げられるが、これらに限定されない。ヌクレオチドは、典型的に、リボヌクレオチドまたはデオキシリボヌクレオチドである。ヌクレオチドは、典型的に、モノホスフェート、ジホスフェート、またはトリホスフェートを含有する。
本発明の方法は、ヌクレオチドとの相互作用の間に細孔を通過する電流の測定を含む。貫通膜タンパク質細孔を通るイオン電流を測定するための好適な条件は、当該技術分野において公知であり、そして実施例に開示される。本方法は、膜および細孔にわたって適用される電圧を用いて行われる。使用される電圧は、典型的に、+50 mV〜+200 mVである。使用される電圧は、好ましくは、+70 mV〜+150 mV、+85 mV〜+145 mV、または+100 mV〜+140 mVである。使用される電圧は、dAMP、dTMP、dGMPおよびdCMP等のデオキシリボヌクレオチド5’モノホスフェートについて約+130 mVであり、そしてAMP、TMP、GMPおよびUMP等のリボヌクレオチド5’モノホスフェートについて+110 mVである。
第2の態様において、本発明は、標的核酸配列を配列決定する方法であって、(a)プロセッシブエキソヌクレアーゼを使用して該標的配列の一方の末端のから個々のヌクレオチドを消化する工程;(b)該ヌクレオチドを膜貫通タンパク質細孔と接触させ、その結果、該ヌクレオチドが該細孔と相互作用する工程;(c)該相互作用の間に該細孔を通過する電流を測定し、それによって該ヌクレオチドの実体を決定する工程;および(d)該核酸配列の同一の末端で工程(a)〜(c)を繰り返し、それによって該核酸の配列を決定する工程を含む、方法に関する。したがって、第2の態様は、核酸を配列決定するための、核酸配列の各々の単一のヌクレオチドの連続した確率的検知を含む。核酸の全部または一部のみが、第2の態様の方法を使用して配列決定され得る。核酸は、天然のものまたは人工のものであり得る。例えば、第2の態様の方法は、製造されたオリゴヌクレオチドの配列を確認するために使用され得る。第2の態様の方法は、典型的にインビトロで行われる。
第2の態様の方法は、核酸配列をプロセッシブエキソヌクレアーゼと接触させ核酸の一方の末端から個々のヌクレオチドを放出する工程を含む。プロセッシブエキソヌクレアーゼは、典型的に核酸配列の一方の末端へ付着しそしてその末端から一度に1つのヌクレオチドで該配列を消化する酵素である。プロセッシブエキソヌクレアーゼは、5’から3’方向でまたは3’から5’方向へ核酸を消化し得る。プロセッシブエキソヌクレアーゼが結合する核酸の末端は、使用される酵素の選択によっておよび/または当該技術分野において公知の方法を使用して、典型的に決定される。核酸配列のいずれかの末端でのヒドロキシル基またはキャップ構造体(cap structures)は、核酸配列の特定の末端へのプロセッシブエキソヌクレアーゼの結合を防止または促進するために典型的に使用され得る。
第3の態様において、本発明はまた、本発明の第2の態様を行うために使用され得るキットに関する。したがって、該キットは、核酸を配列決定するために好適である。キットは、シクロデキストリンおよびプロセッシブエキソヌクレアーゼを含む。シクロデキストリンは、好ましくは、ヘプタキス-6-アミノ-β-シクロデキストリンである。プロセッシブエキソヌクレアーゼは、第2の態様を参照して上記で議論されたもののいずれかであり得る。キットは、好ましくは、貫通膜タンパク質細孔をさらに含む。細孔は、第1の態様を参照して上記で議論されたもののいずれかであり得る。
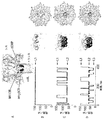
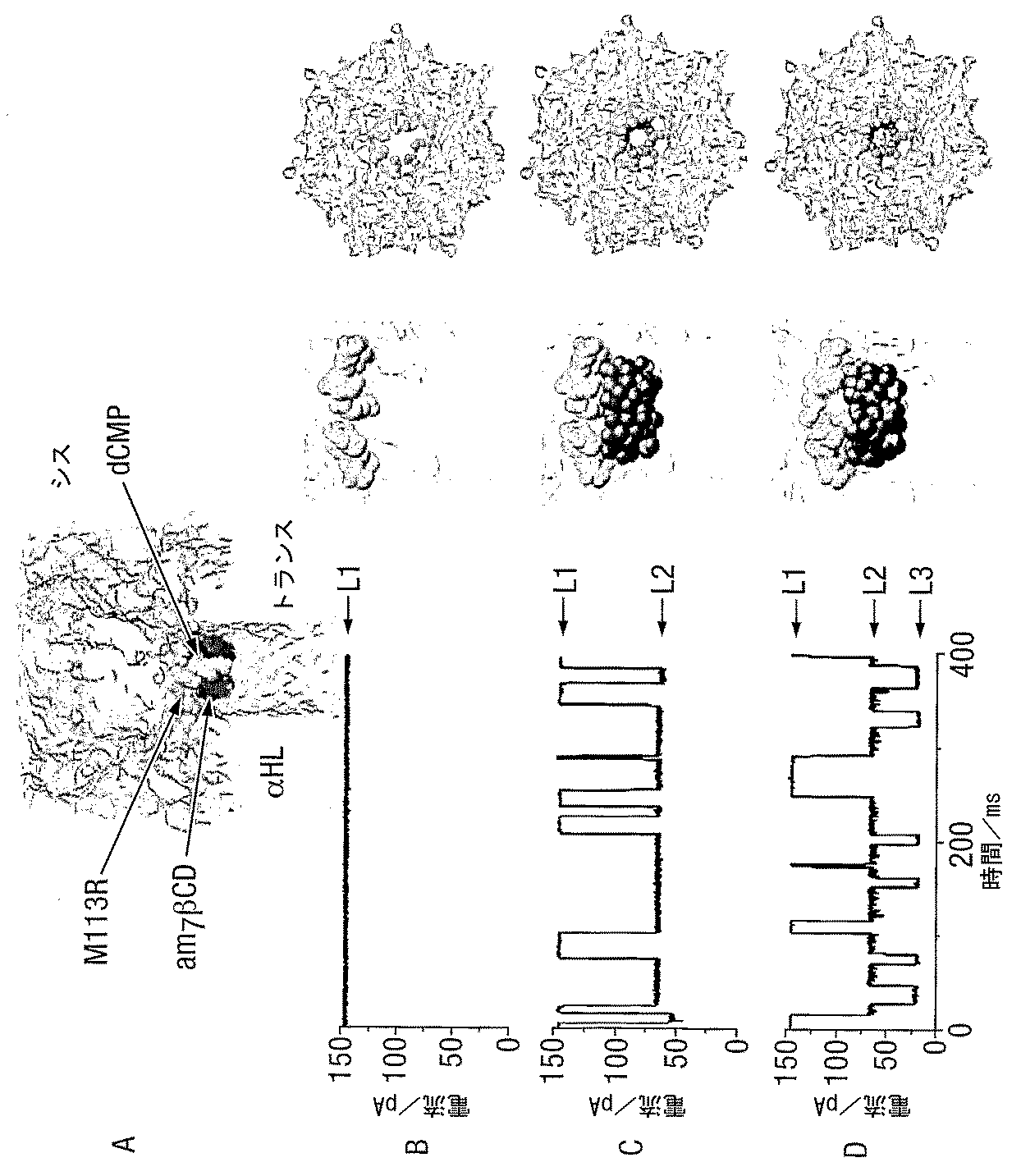
α溶血素(M113R)7突然変異体(図1A)のイオン伝導路のサイズを、検出されるヌクレオチドのサイズへより近づけるために、ナノ細孔の直径を、該細孔の収縮部の近くにシクロデキストリンをフィットさせることによって縮小した。第1級の位置(the primary positions)に7つのアミノ基を有する、ヘプタキス-6-アミノ-β-シクロデキストリン(am7-βCD)(図1B)を使用した。前記タンパク質変異体上の113位の7つのアルギニンと共に、前記シクロデキストリンが細孔内にある場合(図1C)、一方の面上の7つのアミノ基の1つの環、および7つのアルギニン基の第2の環は、細孔を通る通路の最も狭い領域において、互いに短い距離内に存在する。このアミノ/アルギニン環構造は、リン酸基を可逆的に結合しそれによって5〜30ms間細孔中にXMPおよびdXMPを固定する特性を有する。これらの結合事象は、得られる電流振幅変化によって明確に検出可能である。
α溶血素突然変異体(M113R)7を、以前に記載されるように(Cheley, S., L.-Q. Gu, et al. (2002), Chem. & Biol. 9: 829-838)、発現させ、そして精製した。
1,2-ジフィタノイル-sn-グリセロ-3-ホスホコリンはAvanti Polar Lipids Incから購入した。ペンタンをJT Bakerから購入し、そしてヘキサデカン99+%をSigma- Aldrichから購入した。ヘプタキス(6-デオキシ-6-アミノ)-β-シクロデキストリン.HCl>99%をCYCLOLAB Ltd Budapest, Hungaryから購入した。2-デオキシ-グアノシン5’一リン酸ナトリウム塩99%をAcrosから購入し、2-デオキシ-シトシン5’一リン酸二ナトリウム塩>95%、2-デオキシ-チミジン5’一リン酸二ナトリウム塩>97%、および2-デオキシ-アデノシン5’一リン酸二ナトリウム塩>95%をFlukaから購入した。ウリジン5’一リン酸二ナトリウム塩99%、およびシトシン5’一リン酸>98%をFlukaから購入した。アデノシン5’一リン酸99%、およびグアノシン5’一リン酸二ナトリウム塩97%をAcrosから購入した。Trizma Base 99.9%をSigma-Aldrichから購入し、そして濃HCl分析試薬等級をFisher Scientificから購入した。塩化カリウム99%、塩化ナトリウム99.9%をSigma-Aldrichから購入した。ヨウ化カリウム99.5%および塩化セシウム99%をFlukaから購入した。
Axon instruments製のパッチクランプ増幅器Axopatch 200Bを、Digidata 1200 A/Dコンバータ(Axon instruments)を備えたコンピュータと共に使用した。Teflonチャンバを使用した。データをpClamp 9.2において回収し、そしてClampfit 9.0において分析した。プロットおよびグラフをMicrocal Origin 6.0で得、そして積分(integration)を個人用計算機において実行した。
脂質二重層膜を、トランスおよびシスチャンバを隔離する20μmポリカーボネートフィルム(Goodfellow, Malvern PA製の20μm厚)中の100-150μm直径オリフィス(orifice)上に、MontalおよびMueller(1972)の方法によって1,2-ジフィタノイル-sn-グリセロ-3-ホスホコリンから形成した。チャンバのシス側は地面にあり、そしてチャンバのトランス側はヘッドステージ(head stage)へ接続された。電位は、トランス側の電極の電位を指す。アダプター分子をトランス側へ添加し、前記α溶血素突然変異体および被検体分子をシス側へ添加した。dXMP実験を+130mVで行い、XMP実験を+110mVで行った。ここで報告される全ての実験は、1M KCl中pH 8.0 トリス-HCl 25 mMで得られた。ヌクレオチド溶液の新鮮なアリコートを毎日使用した。特に述べない限り、実験を室温22.5 +/- 2℃で行った。
2-デオキシ-ヌクレオチド5’モノホスフェートは、(Ml13R) 7 /ヘプタキス6アミノβ-シクロデキストリンによって形成されたホモ7量体(homoheptameric)細孔を部分的に遮断する
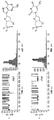
シングルチャネルレコーディング(single-channel recordings)を、トランス側から適用されたam7-βCDと共にαHL-M113Rから形成されたホモ7量体細孔において行った(図2Aおよび2B)。am7-βCDの非存在下において、細孔は、pH 8.0 トリス-HCl 25mM緩衝液中の1M KCl中おいて、145±5 pA(+130 mV)の単位電流(unitary current)(L1)で、常時開いたまま(図2Aおよび2B、B)であった。トランスチャンバのみの中における40 μM am7-βCDの添加は、65±5 pAの電流レベルまで可逆的遮断事象へ導く(図2A、Bおよび図2B、C中のL2)。シスチャンバへの5μM dCMPの添加時に、第3の電流レベルが、電流レベルL2に由来する、22±1 pA(図2A、Cおよび図2B、D中のL3)で観察される。L3は、am7-βCDとの(M113R)7の複合体へのdCMPの結合を示す。チャンバのシス側の代わりにトランス側への300 μMまででのdXMPの添加は、前記シクロデキストリン結合伝導状態(binding conductance states)のいかなる変化へも至らなかった(データは示さず)。
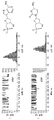
一過性複合体(M113R)7/am7-βCDの部分的遮断は、どのdXMPがシスチャンバへ添加されるかに依存して、振幅が異なった(図3)。シス側へのdGMP(5 μM)の添加は、16 pAの電流レベルへの平均遮断を示した(図3A)。図3Aに示されるトレースの全点振幅ヒストグラム(all points amplitude histogram)は、dGMPの構造と共にトレースの右に示される。他のヌクレオチドは全て、dTMPについての図3B、dAMPについての3C、およびdCMPについての3Dに示されるのとは異なる振幅を示す。前記4つのdXMPうち、dGMPが最も多くの電流を遮断する。
pH 8.0で、突然変異体(M113R)7は、タンパク質チャネルが空いている(unoccupied)場合、2つの電流レベルL1/L1’を示す(図4)。シクロデキストリンアダプターは、前記タンパク質がどの電流レベルL1/L1’にあるかに関わらず、前記タンパク質へ結合し得る。
(M113R)7/am7-βCD細孔の部分的遮断は、どのdXMPがシスチャンバへ添加されるかに依存して、振幅が異なることが分かった。異なる振幅は、dGMP、dTMP、dAMP、およびdCMPが同時にシスチャンバへ添加された場合、分解され(resolve)得た(図5)。
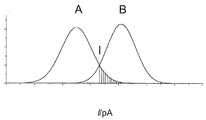
トランス側におけるam7-βCDおよびシス側における被検体ヌクレオチドの1つの存在下での(M113R)7の電流トレースを、300Hz(ローパスガウスフィルター)でデジタル的にフィットさせ、そして全点振幅ヒストグラムを構築した。これらのヒストグラムは、am7-βCDが(M113R)7α溶血素突然変異体へ結合した場合に観察される電流振幅に対応する大きなピークを示す(図1中のL2に対応)。この電流振幅は、実験ごとに5%内で、タンパク質チャネル間で異なる。このため、全点振幅ヒストグラムを、0電流と、65 pAで設定された主要シクロデキストリンピークとの間で標準化した。標準化されたヒストグラムにおいて、ヌクレオチドピークをガウス分布へフィットした。同一のヌクレオチドの平均値およびシグマ(σ)値を、各々1000事象を含む少なくとも3つの独立した実験から平均化した(表2に列挙される値)。
示される結果は、確率的検知は、単一ヌクレオチドの同一についての見込みのある代替法であることを示している。それはまた、エキソヌクレアーゼ配列決定が、安価であり、迅速であり、かつ簡単な、単一分子レベルでのDNA配列決定法として使用され得ることを意味する。エキソヌクレアーゼ配列決定はまた、DNAを配列決定する安価な方法であり、それは何故かと言うと、フルオロフォア等の高価な試薬を必要としないためである。
結合事象は電圧依存性である。50 mVで、非常に少ない結合事象が観察され、これは、dXMPおよびXMPを結合部位へ推進するために最小場(minimum field)が必要とされることを示唆している。+150および+200 mVでの振幅では、ヌクレオチドの識別はもはや可能ではない。+130 mVが、デオキシリボヌクレオチド5’モノホスフェートについて最善な電圧であると分かり、そして+110 mVは、リボヌクレオチド5’モノホスフェートについて最善の分解能を提供した。
トリス-HCl pH 8緩衝液 0.5、1および2M KClを試験した。全点振幅ヒストグラムから、ピーク間の最善の分解能は、1M KClで得られた。
電流振幅はpH依存性であり、トリスHCl緩衝液1M KClを、pH 7.5、8.0、8.2、8.5、9.0、および9.5で、試験した。pH 8.0以上で、上記2つの電流レベルが、am7-βCDの結合時に観察される(図4)。pH 7.5で、ヘプタキス6アミノβ-シクロデキストリンは、第3の電流レベルを示す(示さず)。これは、異なる振幅を有する2つのタイプの事象をdTMPに示させ、その1つはdGMP事象の範囲内にあり、したがって分解能の喪失を導く。pH 9.5で、ヌクレオチド結合事象は、もはや観察されない。最善のピーク分離は、pH 8.0で得られる。
dXMPおよびXMP間の分解能は、NaClまたはCsClを用いるよりも、KClを用いてより良好である。1M KClは、2M KClよりもより良好な分解能を生じる。各結合事象が一過性複合体(M113R)7/am7-βCDの完全な遮断へ導いたため、KBrの使用は、異なるヌクレオチドの同定を可能にしなかった。
温度を14℃へ低下させることまたはそれを50℃へ上昇させることは、dXMP/XMPの検出を妨げなかった。しかし、それは、振幅ヒストグラムの分解能を改善しなかった。
(M113N)7はam7-βCDに結合すると見られたが、ヌクレオチド検出は観察されなかった。(M113F)7および(M113F/147K)7は、am7-βCDが添加されるかどうかに関わらず、検出を生じなかった。(M113K)7を同一条件で試験した。この場合、記録は、図1のそれと非常に類似する。ヌクレオチド結合は、(M113K)7突然変異体およびam7-βCDを用いて検出されたが、ヌクレオチド間のピーク分離は、(M113R)7が使用された場合よりも小さかった。
XMPが本方法で首尾良く同定され、各塩基間の分解能は、U、A、およびCについて1pAよりも小さなピーク分離を伴って、dXMPのそれよりも劣っていた。全点ヒストグラム電流振幅は、dXMPのそれらと同一の順序で現れ、GMPは最も低い電流(最も大きな遮断)を示し、UMP、AMPが続き、そしてCMPは最も高い電流振幅(最も小さな遮断)を伴う。XMP同定についての最適な電圧は、pH 8.0 1M KClで、+110mVであると分かった。
(M113R)7/am7-βCD一過性複合体はまた、グルコースリン酸(グルコース1Pおよびガラクトース1P)に結合しそしてこれを識別することが示された。それは、一方の面上のアルギニン環、他方の面上のam7-βCDからのアミン環およびリン酸基間の強力な相互作用を示唆する。未修飾のβ-シクロデキストリンは、いずれの検出をも生じさせない。XMPおよびdXMP間で僅かな差異が観察され、これは、ヒドロキシル基が結合において大きな役割を果たしていないことを示唆している。
Claims (10)
- 個々のモノホスフェートヌクレオチドを同定する方法であって、
(a)該モノホスフェートヌクレオチドを膜貫通タンパク質細孔と接触させ、その結果、該モノホスフェートヌクレオチドが該細孔と相互作用する工程であって、
前記細孔が、前記モノホスフェートヌクレオチドと前記細孔との相互作用を促進するシクロデキストリンを含み、かつ更に前記細孔が、(i)7つの同一の、配列番号2に示されるサブユニットから形成されているα溶血素、または(ii)7つのサブユニットのうち1つ以上が全配列にわたって配列番号2に対して少なくとも80%の同一性を有し、かつ細孔活性を保持する、その変異体である
前記工程、ならびに
(b)該相互作用の間に該細孔を通過する電流を測定し、それによって該モノホスフェートヌクレオチドの実体を決定する工程
を含む、方法。 - 相互作用が、モノホスフェートヌクレオチドが細孔のチャネルへ可逆的に結合することを伴う、請求項1記載の方法。
- 前記7つのサブユニットのうち1つ以上がM113Rである、請求項1または2記載の方法。
- 前記分子アダプターが、ヘプタキス-6-アミノ-β-シクロデキストリン(am7-β-CD)である、請求項1〜3のいずれか一項記載の方法。
- 前記個々のモノホスフェートヌクレオチドが、モノホスフェートリボヌクレオチドまたはモノホスフェートデオキシリボヌクレオチドである、請求項1〜4のいずれか一項記載の方法。
- 工程(a)の前にリボ核酸(RNA)配列を消化し前記個々のモノホスフェートヌクレオチドを提供する工程をさらに含む、請求項5記載の方法。
- 工程(a)の前にデオキシリボ核酸(DNA)配列を消化し前記個々のモノホスフェートヌクレオチドを提供する工程をさらに含む、請求項5記載の方法。
- 前記RNAまたはDNA配列の2つ以上の前記個々のモノホスフェートヌクレオチドを、連続して、前記細孔と接触させ、その結果、該配列の全部または一部の実体が決定され得る、請求項6または7記載の方法。
- 標的核酸配列を配列決定する方法であって、
(a)プロセッシブエキソヌクレアーゼ(processive exonuclease)を使用して該標的配列の一方の末端から個々のモノホスフェートヌクレオチドを消化する工程;
(b)該モノホスフェートヌクレオチドを膜貫通タンパク質細孔と接触させ、その結果、該モノホスフェートヌクレオチドが該細孔と相互作用する工程であって、
前記細孔が、前記モノホスフェートヌクレオチドと前記細孔との相互作用を促進するシクロデキストリンを含み、かつ更に前記細孔が、(i)7つの同一の、配列番号2に示されるサブユニットから形成されているα溶血素、または(ii)7つのサブユニットのうち1つ以上が全配列にわたって配列番号2に対して少なくとも80%の同一性を有し、かつ細孔活性を保持する、その変異体である
前記工程;
(c)該相互作用の間に該細孔を通過する電流を測定し、それによって該モノホスフェートヌクレオチドの実体を決定する工程;および
(d)該核酸配列の同一の末端で工程(a)〜(c)を繰り返し、それによって該核酸の配列を決定する工程
を含む、方法。 - 核酸を配列決定するためのキットであって、
− シクロデキストリン;
− プロセッシブエキソヌクレアーゼ;および
− 膜貫通タンパク質細孔であって、前記細孔が、(i)7つの同一の、配列番号2に示されるサブユニットから形成されているα溶血素、または(ii)7つのサブユニットのうち1つ以上が全配列にわたって配列番号2に対して少なくとも80%の同一性を有し、かつ細孔活性を保持する、その変異体である、前記膜貫通タンパク質細孔
を含む、キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0523282.2 | 2005-11-15 | ||
| GBGB0523282.2A GB0523282D0 (en) | 2005-11-15 | 2005-11-15 | Methods using pores |
| PCT/GB2006/004265 WO2007057668A1 (en) | 2005-11-15 | 2006-11-15 | Methods using pores |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2009519705A JP2009519705A (ja) | 2009-05-21 |
| JP2009519705A5 JP2009519705A5 (ja) | 2010-01-07 |
| JP5328362B2 true JP5328362B2 (ja) | 2013-10-30 |
Family
ID=35516986
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008540686A Active JP5328362B2 (ja) | 2005-11-15 | 2006-11-15 | 細孔を使用する方法 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US8105846B2 (ja) |
| EP (2) | EP2272981B1 (ja) |
| JP (1) | JP5328362B2 (ja) |
| KR (1) | KR20080083281A (ja) |
| CN (1) | CN101356288B (ja) |
| AT (1) | ATE545712T1 (ja) |
| AU (1) | AU2006314296B2 (ja) |
| BR (1) | BRPI0618391A2 (ja) |
| CA (1) | CA2629009C (ja) |
| GB (1) | GB0523282D0 (ja) |
| IL (1) | IL191319A (ja) |
| MY (1) | MY149161A (ja) |
| NZ (1) | NZ568163A (ja) |
| RU (1) | RU2008123842A (ja) |
| UA (1) | UA95087C2 (ja) |
| WO (1) | WO2007057668A1 (ja) |
Families Citing this family (90)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0523282D0 (en) | 2005-11-15 | 2005-12-21 | Isis Innovation | Methods using pores |
| EP2158476B8 (en) | 2007-05-08 | 2019-10-09 | Trustees of Boston University | Chemical functionalization of solid-state nanopores and nanopore arrays and applications thereof |
| GB2453377A (en) * | 2007-10-05 | 2009-04-08 | Isis Innovation | Transmembrane protein pores and molecular adapters therefore. |
| EP2307540B1 (en) | 2008-07-07 | 2017-04-19 | Oxford Nanopore Technologies Limited | Enzyme-pore constructs |
| WO2010004273A1 (en) * | 2008-07-07 | 2010-01-14 | Oxford Nanopore Technologies Limited | Base-detecting pore |
| US8426807B2 (en) * | 2008-08-01 | 2013-04-23 | Brown University | System and methods for determining molecules using mass spectrometry and related techniques |
| GB0820927D0 (en) * | 2008-11-14 | 2008-12-24 | Isis Innovation | Method |
| US20100148126A1 (en) * | 2008-11-26 | 2010-06-17 | Board Of Regents, The University Of Texas System | Genomic sequencing using modified protein pores and ionic liquids |
| CA2750879C (en) | 2009-01-30 | 2018-05-22 | Oxford Nanopore Technologies Limited | Adaptors for nucleic acid constructs in transmembrane sequencing |
| CA2750874A1 (en) * | 2009-01-30 | 2010-08-05 | Oxford Nanopore Technologies Limited | Hybridization linkers |
| GB0905140D0 (en) | 2009-03-25 | 2009-05-06 | Isis Innovation | Method |
| US9017937B1 (en) | 2009-04-10 | 2015-04-28 | Pacific Biosciences Of California, Inc. | Nanopore sequencing using ratiometric impedance |
| WO2010117470A2 (en) | 2009-04-10 | 2010-10-14 | Pacific Biosciences Of California, Inc. | Nanopore sequencing devices and methods |
| AU2010301128B2 (en) | 2009-09-30 | 2014-09-18 | Quantapore, Inc. | Ultrafast sequencing of biological polymers using a labeled nanopore |
| BR112012013074B1 (pt) | 2009-12-01 | 2018-09-18 | Oxford Nanopore Technologies Limited | instrumento de análise e módulo para realizar análise bioquímica, e, método para operar um instrumento de análise para realizar análise bioquímica |
| US9005425B2 (en) | 2010-03-05 | 2015-04-14 | University Of Utah Research Foundation | Detection of nucleic acid lesions and adducts using nanopores |
| GB2490846A (en) * | 2010-03-05 | 2012-11-14 | Univ Utah Res Found | Detection of nucleic acid lesions and adducts using nanopores |
| US8652779B2 (en) | 2010-04-09 | 2014-02-18 | Pacific Biosciences Of California, Inc. | Nanopore sequencing using charge blockade labels |
| EP2622343B1 (en) | 2010-10-01 | 2016-01-20 | Oxford Nanopore Technologies Limited | Biochemical analysis apparatus using nanopores |
| US8673757B2 (en) | 2010-10-28 | 2014-03-18 | International Business Machines Corporation | Structure and method for using high-k material as an etch stop layer in dual stress layer process |
| CA2826374C (en) | 2011-02-11 | 2024-01-23 | Oxford Nanopore Technologies Limited | Mutant pores |
| EP3633370B1 (en) | 2011-05-27 | 2024-05-01 | Oxford Nanopore Technologies plc | Method and apparatus for determining the presence, absence or characteristics of an analyte |
| RU2467218C1 (ru) * | 2011-06-16 | 2012-11-20 | Закрытое Акционерное Общество "Научно-производственное объединение "Гидравлические аппараты" (ЗАО "НПО "Гидроаппарат") | Гидромуфта |
| CN104774757B (zh) * | 2011-07-20 | 2017-03-01 | 加利福尼亚大学董事会 | 双孔装置 |
| WO2013014451A1 (en) | 2011-07-25 | 2013-01-31 | Oxford Nanopore Technologies Limited | Hairpin loop method for double strand polynucleotide sequencing using transmembrane pores |
| CA2852812A1 (en) | 2011-10-21 | 2013-04-25 | Oxford Nanopore Technologies Limited | Enzyme method |
| WO2013098562A2 (en) | 2011-12-29 | 2013-07-04 | Oxford Nanopore Technologies Limited | Enzyme method |
| EP2798083B1 (en) | 2011-12-29 | 2017-08-09 | Oxford Nanopore Technologies Limited | Method for characterising a polynucelotide by using a xpd helicase |
| US10739341B2 (en) | 2012-02-15 | 2020-08-11 | Oxford Nanopore Technologies Limited | Aptamer method |
| CN104335044B (zh) * | 2012-04-02 | 2018-07-27 | 力士生物集团公司 | 用于分子分离、纯化和检测的装置和方法 |
| EP3192804B1 (en) | 2012-04-10 | 2019-08-28 | Oxford Nanopore Technologies Limited | Mutant lysenin pores |
| BR112015001052B8 (pt) | 2012-07-19 | 2022-12-27 | Oxford Nanopore Tech Ltd | Métodos para distinguir um polinucleotídeo alvo,sensor para distinguir um polinucleotídeo alvo, e, uso de um construto |
| EP3741847A1 (en) | 2012-07-19 | 2020-11-25 | Oxford Nanopore Technologies Limited | Modified helicases |
| EP2875154B1 (en) | 2012-07-19 | 2017-08-23 | Oxford Nanopore Technologies Limited | SSB method for characterising a nucleic acid |
| WO2014041337A1 (en) | 2012-09-14 | 2014-03-20 | Oxford Nanopore Technologies Limited | Sample preparation method |
| US9651539B2 (en) | 2012-10-28 | 2017-05-16 | Quantapore, Inc. | Reducing background fluorescence in MEMS materials by low energy ion beam treatment |
| US9995728B2 (en) | 2012-11-06 | 2018-06-12 | Oxford Nanopore Technologies Ltd. | Quadruplex method |
| EP2964779B1 (en) | 2013-03-08 | 2018-08-29 | Oxford Nanopore Technologies Limited | Use of spacer elements in a nucleic acid to control movement of a helicase |
| GB201314695D0 (en) | 2013-08-16 | 2013-10-02 | Oxford Nanopore Tech Ltd | Method |
| GB201318465D0 (en) | 2013-10-18 | 2013-12-04 | Oxford Nanopore Tech Ltd | Method |
| GB201313477D0 (en) | 2013-07-29 | 2013-09-11 | Univ Leuven Kath | Nanopore biosensors for detection of proteins and nucleic acids |
| CN103267785B (zh) * | 2013-05-14 | 2016-04-13 | 西北大学 | 一种检测药物包裹或释放过程的单分子分析方法 |
| ES2994071T3 (en) * | 2013-05-24 | 2025-01-16 | Illumina Cambridge Ltd | Pyrophosphorolytic sequencing using nanopores |
| WO2014190322A2 (en) | 2013-05-24 | 2014-11-27 | Quantapore, Inc. | Nanopore-based nucleic acid analysis with mixed fret detection |
| GB201316849D0 (en) | 2013-09-23 | 2013-11-06 | Isis Innovation | Method |
| CN117947148A (zh) | 2013-10-18 | 2024-04-30 | 牛津纳米孔科技公开有限公司 | 经修饰的酶 |
| GB201406151D0 (en) | 2014-04-04 | 2014-05-21 | Oxford Nanopore Tech Ltd | Method |
| GB201406155D0 (en) | 2014-04-04 | 2014-05-21 | Oxford Nanopore Tech Ltd | Method |
| CA2937411C (en) | 2014-01-22 | 2023-09-26 | Oxford Nanopore Technologies Limited | Method for attaching one or more polynucleotide binding proteins to a target polynucleotide |
| GB201403096D0 (en) | 2014-02-21 | 2014-04-09 | Oxford Nanopore Tech Ltd | Sample preparation method |
| EP3126515B1 (en) | 2014-04-04 | 2018-08-29 | Oxford Nanopore Technologies Limited | Method for characterising a double stranded nucleic acid using a nano-pore and anchor molecules at both ends of said nucleic acid |
| EP3137490B1 (en) | 2014-05-02 | 2021-01-27 | Oxford Nanopore Technologies Limited | Mutant pores |
| GB201417712D0 (en) | 2014-10-07 | 2014-11-19 | Oxford Nanopore Tech Ltd | Method |
| GB201411285D0 (en) | 2014-06-25 | 2014-08-06 | Prosser Joseph | Sequencer |
| AU2015310913B2 (en) | 2014-09-01 | 2021-04-01 | Oxford Nanopore Technologies Limited | Mutant CsgG pores |
| US10266885B2 (en) | 2014-10-07 | 2019-04-23 | Oxford Nanopore Technologies Ltd. | Mutant pores |
| CN107109472B (zh) | 2014-10-10 | 2021-05-11 | 昆塔波尔公司 | 利用互相猝灭的荧光标记物的基于纳米孔的聚合物分析 |
| GB201418159D0 (en) | 2014-10-14 | 2014-11-26 | Oxford Nanopore Tech Ltd | Method |
| CN107109489B (zh) | 2014-10-17 | 2021-11-30 | 牛津纳米孔技术公司 | 纳米孔rna表征方法 |
| GB201418469D0 (en) | 2014-10-17 | 2014-12-03 | Oxford Nanopore Tech Ltd | Method |
| EP3209800B1 (en) | 2014-10-24 | 2022-02-16 | Quantapore, Inc. | Efficient optical analysis of polymers using arrays of nanostructures |
| US10301361B2 (en) | 2014-10-31 | 2019-05-28 | Genia Technologies, Inc. | α-hemolysin variants with altered characteristics |
| US10060903B2 (en) * | 2014-11-05 | 2018-08-28 | Genia Technologies, Inc. | Exporting measurements of nanopore arrays |
| US9863904B2 (en) | 2014-12-19 | 2018-01-09 | Genia Technologies, Inc. | Nanopore-based sequencing with varying voltage stimulus |
| US9557294B2 (en) | 2014-12-19 | 2017-01-31 | Genia Technologies, Inc. | Nanopore-based sequencing with varying voltage stimulus |
| AU2016215455A1 (en) * | 2015-02-02 | 2017-08-17 | Ontera Inc. | Labile linkers for biomarker detection |
| GB201502810D0 (en) | 2015-02-19 | 2015-04-08 | Oxford Nanopore Tech Ltd | Method |
| GB201502809D0 (en) | 2015-02-19 | 2015-04-08 | Oxford Nanopore Tech Ltd | Mutant pore |
| EP3283887B1 (en) | 2015-04-14 | 2021-07-21 | Katholieke Universiteit Leuven | Nanopores with internal protein adaptors |
| CN108137656A (zh) * | 2015-09-24 | 2018-06-08 | 豪夫迈·罗氏有限公司 | α-溶血素变体 |
| US10126262B2 (en) | 2015-09-24 | 2018-11-13 | Genia Technologies, Inc. | Differential output of analog memories storing nanopore measurement samples |
| CN105259229B (zh) * | 2015-10-22 | 2018-04-20 | 清华大学 | 一种检测药物的单分子分析方法 |
| US10280411B2 (en) | 2015-10-27 | 2019-05-07 | Pacific Biosciences of California, In.c | Methods, systems, and reagents for direct RNA sequencing |
| EP3387432B1 (en) | 2015-12-08 | 2022-09-28 | Katholieke Universiteit Leuven KU Leuven Research & Development | Modified nanopores, compositions comprising the same, and uses thereof |
| JP6579948B2 (ja) * | 2015-12-24 | 2019-09-25 | 株式会社日立ハイテクノロジーズ | 生体ポリマを分析するための測定試薬及び分析デバイス |
| US11186868B2 (en) | 2016-03-02 | 2021-11-30 | Oxford Nanopore Technologies Plc | Mutant pore |
| EP4397970A3 (en) | 2016-04-06 | 2024-10-09 | Oxford Nanopore Technologies PLC | Mutant pore |
| CN109196116B (zh) | 2016-05-25 | 2022-09-27 | 牛津纳米孔科技公开有限公司 | 一种表征靶多核苷酸的方法 |
| GB201609220D0 (en) | 2016-05-25 | 2016-07-06 | Oxford Nanopore Tech Ltd | Method |
| CN109477813A (zh) | 2016-07-05 | 2019-03-15 | 昆塔波尔公司 | 基于光学的纳米孔测序 |
| GB201619930D0 (en) | 2016-11-24 | 2017-01-11 | Oxford Nanopore Tech | Apparatus and methods for controlling insertion of a membrane channel into a membrane |
| AU2018218531B2 (en) * | 2017-02-10 | 2021-01-28 | Oxford Nanopore Technologies Limited | Modified nanopores, compositions comprising the same, and uses thereof |
| EP3612647B1 (en) * | 2017-04-19 | 2022-06-29 | Electronic Biosciences Inc. | Nanopore/nanowell electrode enabled exonuclease sequencing |
| GB201707122D0 (en) | 2017-05-04 | 2017-06-21 | Oxford Nanopore Tech Ltd | Pore |
| SG11201913174PA (en) | 2017-06-30 | 2020-01-30 | Vib Vzw | Novel protein pores |
| CN111615629B (zh) | 2017-11-27 | 2022-09-27 | 豪夫迈·罗氏有限公司 | 纳米孔sbs信号的标准化和基线移位移除 |
| GB201807793D0 (en) | 2018-05-14 | 2018-06-27 | Oxford Nanopore Tech Ltd | Method |
| GB202202716D0 (en) | 2022-02-28 | 2022-04-13 | Oxford Nanopore Tech Plc | Apparatus and methods for controlling insertion of a membrane channel into a membrane |
| KR20250075566A (ko) | 2022-08-02 | 2025-05-28 | 글리픽 바이오테크놀로지스, 인크. | 중합 가능 분자의 커플링을 통한 단백질 서열분석 |
| GB202401864D0 (en) | 2024-02-12 | 2024-03-27 | Fund Centre De Regulacio Genòmica | A method of detecting non-canonical bases in sequencing data |
Family Cites Families (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IE56026B1 (en) | 1982-10-19 | 1991-03-27 | Cetus Corp | Cysteine-depleted muteins of biologically active proteins |
| CA2160909A1 (en) | 1993-04-28 | 1994-11-10 | Hagan Bayley | Cell-targeted lytic pore-forming agents |
| US5777078A (en) | 1993-04-28 | 1998-07-07 | Worcester Foundation For Experimental Biology | Triggered pore-forming agents |
| US6362002B1 (en) | 1995-03-17 | 2002-03-26 | President And Fellows Of Harvard College | Characterization of individual polymer molecules based on monomer-interface interactions |
| US5795782A (en) * | 1995-03-17 | 1998-08-18 | President & Fellows Of Harvard College | Characterization of individual polymer molecules based on monomer-interface interactions |
| WO1999005167A1 (en) | 1997-07-25 | 1999-02-04 | University Of Massachusetts | Designed protein pores as components for biosensors |
| US6087099A (en) | 1997-09-08 | 2000-07-11 | Myriad Genetics, Inc. | Method for sequencing both strands of a double stranded DNA in a single sequencing reaction |
| US6127166A (en) | 1997-11-03 | 2000-10-03 | Bayley; Hagan | Molluscan ligament polypeptides and genes encoding them |
| JPH11137260A (ja) | 1997-11-06 | 1999-05-25 | Soyaku Gijutsu Kenkyusho:Kk | 抗インフルエンザウイルス環状ダンベル型rna−dnaキメラ化合物及び抗インフルエンザウイルス剤 |
| US6123819A (en) | 1997-11-12 | 2000-09-26 | Protiveris, Inc. | Nanoelectrode arrays |
| DE19826758C1 (de) | 1998-06-15 | 1999-10-21 | Soft Gene Gmbh | Darstellung von linearen kovalent geschlossenen DNA-Molekülen als Expressionskonstrukte |
| US6267872B1 (en) | 1998-11-06 | 2001-07-31 | The Regents Of The University Of California | Miniature support for thin films containing single channels or nanopores and methods for using same |
| US6426231B1 (en) | 1998-11-18 | 2002-07-30 | The Texas A&M University System | Analyte sensing mediated by adapter/carrier molecules |
| NO986133D0 (no) | 1998-12-23 | 1998-12-23 | Preben Lexow | FremgangsmÕte for DNA-sekvensering |
| WO2000079257A1 (en) | 1999-06-22 | 2000-12-28 | President And Fellows Of Harvard College | Molecular and atomic scale evaluation of biopolymers |
| WO2001002425A2 (en) | 1999-06-29 | 2001-01-11 | University Health Network | Peptide conjugates for the stabilization of membrane proteins and interactions with biological membranes |
| WO2001040516A2 (en) | 1999-12-02 | 2001-06-07 | Molecular Staging Inc. | Generation of single-strand circular dna from linear self-annealing segments |
| US6916665B2 (en) | 2000-02-11 | 2005-07-12 | The Texas A&M University System | Biosensor compositions and methods of use |
| US7001792B2 (en) | 2000-04-24 | 2006-02-21 | Eagle Research & Development, Llc | Ultra-fast nucleic acid sequencing device and a method for making and using the same |
| AU2002239284A1 (en) | 2000-11-27 | 2002-06-03 | The Regents Of The University Of California | Methods and devices for characterizing duplex nucleic acid molecules |
| US7807408B2 (en) | 2001-03-19 | 2010-10-05 | President & Fellows Of Harvard College | Directed evolution of proteins |
| DE60222404T2 (de) * | 2001-05-29 | 2008-06-19 | Asahi Glass Co., Ltd. | Verfahren zur konstruktion eines wirts und verfahren zur herstellung eines fremdproteins |
| US6863833B1 (en) | 2001-06-29 | 2005-03-08 | The Board Of Trustees Of The Leland Stanford Junior University | Microfabricated apertures for supporting bilayer lipid membranes |
| WO2003095669A1 (en) | 2002-05-10 | 2003-11-20 | The Texas A & M University System | Stochastic sensing through covalent interactions |
| US7163658B2 (en) | 2003-04-23 | 2007-01-16 | Rouvain Bension | Rapid sequencing of polymers |
| WO2005056750A2 (en) | 2003-12-11 | 2005-06-23 | Quark Biotech, Inc. | Inversion-duplication of nucleic acids and libraries prepared thereby |
| WO2006028508A2 (en) | 2004-03-23 | 2006-03-16 | President And Fellows Of Harvard College | Methods and apparatus for characterizing polynucleotides |
| AU2005272823B2 (en) | 2004-08-13 | 2012-04-12 | President And Fellows Of Harvard College | An ultra high-throughput opti-nanopore DNA readout platform |
| EP1842061A4 (en) | 2004-12-21 | 2009-05-13 | Texas A & M Univ Sys | HIGH-TEMPERATURE ION CHANNELS AND ION PORES |
| GB0505971D0 (en) | 2005-03-23 | 2005-04-27 | Isis Innovation | Delivery of molecules to a lipid bilayer |
| GB0523282D0 (en) | 2005-11-15 | 2005-12-21 | Isis Innovation | Methods using pores |
| ATE518010T1 (de) | 2005-12-22 | 2011-08-15 | Pacific Biosciences California | Aktive oberflächengekoppelte polymerasen |
| US7932029B1 (en) | 2006-01-04 | 2011-04-26 | Si Lok | Methods for nucleic acid mapping and identification of fine-structural-variations in nucleic acids and utilities |
| WO2008045575A2 (en) | 2006-10-13 | 2008-04-17 | J. Craig Venter Institute, Inc. | Sequencing method |
| WO2008102120A1 (en) | 2007-02-20 | 2008-08-28 | Oxford Nanopore Technologies Limited | Lipid bilayer sensor system |
| US8500982B2 (en) | 2007-04-04 | 2013-08-06 | The Regents Of The University Of California | Compositions, devices, systems, and methods for using a nanopore |
| GB2453377A (en) | 2007-10-05 | 2009-04-08 | Isis Innovation | Transmembrane protein pores and molecular adapters therefore. |
| AU2009229157B2 (en) | 2008-03-28 | 2015-01-29 | Pacific Biosciences Of California, Inc. | Compositions and methods for nucleic acid sequencing |
| WO2010004273A1 (en) * | 2008-07-07 | 2010-01-14 | Oxford Nanopore Technologies Limited | Base-detecting pore |
| EP2307540B1 (en) | 2008-07-07 | 2017-04-19 | Oxford Nanopore Technologies Limited | Enzyme-pore constructs |
| CA2774710C (en) | 2008-09-22 | 2016-08-02 | University Of Washington | Msp nanopores and related methods |
-
2005
- 2005-11-15 GB GBGB0523282.2A patent/GB0523282D0/en not_active Ceased
-
2006
- 2006-11-15 CA CA2629009A patent/CA2629009C/en active Active
- 2006-11-15 JP JP2008540686A patent/JP5328362B2/ja active Active
- 2006-11-15 BR BRPI0618391-3A patent/BRPI0618391A2/pt not_active IP Right Cessation
- 2006-11-15 NZ NZ568163A patent/NZ568163A/en not_active IP Right Cessation
- 2006-11-15 EP EP10010418A patent/EP2272981B1/en active Active
- 2006-11-15 AU AU2006314296A patent/AU2006314296B2/en active Active
- 2006-11-15 AT AT06808555T patent/ATE545712T1/de active
- 2006-11-15 EP EP06808555A patent/EP1951898B1/en active Active
- 2006-11-15 RU RU2008123842/13A patent/RU2008123842A/ru not_active Application Discontinuation
- 2006-11-15 MY MYPI20081556A patent/MY149161A/en unknown
- 2006-11-15 CN CN200680050878.XA patent/CN101356288B/zh active Active
- 2006-11-15 UA UAA200806147A patent/UA95087C2/ru unknown
- 2006-11-15 WO PCT/GB2006/004265 patent/WO2007057668A1/en not_active Ceased
- 2006-11-15 US US12/093,610 patent/US8105846B2/en active Active
- 2006-11-15 KR KR1020087014358A patent/KR20080083281A/ko not_active Ceased
-
2008
- 2008-05-07 IL IL191319A patent/IL191319A/en not_active IP Right Cessation
-
2011
- 2011-12-28 US US13/338,794 patent/US8785211B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US8785211B2 (en) | 2014-07-22 |
| CN101356288A (zh) | 2009-01-28 |
| EP2272981B1 (en) | 2013-01-09 |
| JP2009519705A (ja) | 2009-05-21 |
| US8105846B2 (en) | 2012-01-31 |
| BRPI0618391A2 (pt) | 2011-08-30 |
| CA2629009A1 (en) | 2007-05-24 |
| WO2007057668A1 (en) | 2007-05-24 |
| US20080311582A1 (en) | 2008-12-18 |
| CN101356288B (zh) | 2016-02-03 |
| EP1951898B1 (en) | 2012-02-15 |
| US20120219960A1 (en) | 2012-08-30 |
| AU2006314296A1 (en) | 2007-05-24 |
| ATE545712T1 (de) | 2012-03-15 |
| UA95087C2 (en) | 2011-07-11 |
| CA2629009C (en) | 2016-02-02 |
| KR20080083281A (ko) | 2008-09-17 |
| NZ568163A (en) | 2011-11-25 |
| EP1951898A1 (en) | 2008-08-06 |
| MY149161A (en) | 2013-07-31 |
| RU2008123842A (ru) | 2009-12-27 |
| EP2272981A1 (en) | 2011-01-12 |
| AU2006314296B2 (en) | 2012-08-23 |
| IL191319A (en) | 2011-10-31 |
| GB0523282D0 (en) | 2005-12-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5328362B2 (ja) | 細孔を使用する方法 | |
| US20250215490A1 (en) | Method for sequencing a heteropolymeric target nucleic acid sequence | |
| KR102106499B1 (ko) | 폴리머의 측정의 분석 | |
| EP2350122B1 (en) | Methods of enhancing translocation of charged analytes through transmembrane protein pores | |
| CN107109490B (zh) | 聚合物的分析 | |
| JP2010539966A (ja) | 分子アダプター | |
| JP2011527191A (ja) | 塩基検出細孔 | |
| US11845779B2 (en) | Mutant aerolysin and uses thereof | |
| EP4362028A1 (en) | Mutant aerolysin and uses thereof | |
| MX2008006277A (en) | Methods using pores |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091111 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20091111 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120319 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120615 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121105 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130129 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130205 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130225 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130304 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130430 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130626 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130723 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5328362 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |