本発明は、微生物もしくは培養細胞の培養液を、分離膜で濾過し濾液から生産物を回収するとともに未濾過液を前記培養液に保持または還流し、かつ、発酵原料を前記培養液に追加する連続発酵であって、前記分離膜として平均細孔径が0.01μm以上1μm未満の多孔性膜を用い、膜間差圧を0.1以上20kPa以下にして濾過処理することを特徴とする連続発酵によるコハク酸の製造方法である。
本発明において分離膜として用いられる多孔性膜は、発酵に使用される微生物による目詰まりが起こりにくく、かつ濾過性能が長期間安定に継続する性能を有するものであることが望ましい。そのため、本発明で使用される多孔性膜は、平均細孔径が、0.01μm以上1μm未満であることが重要である。
本発明で分離膜として用いられる多孔性膜の構成について説明する。本発明における多孔性膜は、被処理水の水質や用途に応じた分離性能と透水性能を有するものであり、阻止性能、透水性能や耐汚れ性という分離性能の点からは、多孔質樹脂層を含む多孔性膜であることが好ましい。この多孔性膜は、多孔質基材の表面に、分離機能層として作用とする多孔質樹脂層を有している。多孔質基材は、多孔質樹脂層を支持して分離膜に強度を与えるものである。
本発明で用いられる多孔性膜が、多孔質基材の表面に多孔質樹脂層を有している場合、多孔質基材に多孔質樹脂層が浸透していても、多孔質基材に多孔質樹脂層が浸透していなくてもどちらでも良く、用途に応じて選択される。
多孔質基材の材質としては、有機材料および無機材料等で特に限定されないが、有機繊維が望ましい。好ましい多孔質基材は、セルロース繊維、セルローストリアセテート繊維、ポリエステル繊維、ポリプロピレン繊維およびポリエチレン繊維などの有機繊維を用いてなる織布や不織布であり、なかでも、密度の制御が比較的容易であり、製造も容易で安価な不織布が好ましく用いられる。
多孔質樹脂層は、上述したように分離機能層として作用するもので、有機高分子膜を好適に使用することができる。有機高分子膜の材質としては、例えば、ポリエチレン系樹脂、ポリプロピレン系樹脂、ポリ塩化ビニル系樹脂、ポリフッ化ビニリデン系樹脂、ポリスルホン系樹脂、ポリエーテルスルホン系樹脂、ポリアクリロニトリル系樹脂、セルロース系樹脂およびセルローストリアセテート系樹脂などが挙げられ、これらの樹脂を主成分とする樹脂の混合物でであってもよい。ここで主成分とは、50重量%以上、好ましくは60重量%以上含有することをいう。なかでも、溶液による製膜が容易で、物理的耐久性や耐薬品性にも優れているポリ塩化ビニル系樹脂、ポリフッ化ビニリデン系樹脂、ポリスルホン系樹脂、ポリエーテルスルホン系樹脂およびポリアクリロニトリル系樹脂が好ましく、ポリフッ化ビニリデン系樹脂またはそれを主成分とする樹脂が最も好ましく用いられる。
ここで、ポリフッ化ビニリデン系樹脂としては、フッ化ビニリデンの単独重合体が好ましく用いられるが、フッ化ビニリデンの単独重合体の他、フッ化ビニリデンと共重合可能なビニル系単量体との共重合体も好ましく用いられる。かかるビニル系単量体としては、テトラフルオロエチレン、ヘキサフルオロプロピレンおよび三塩化フッ化エチレンなどが例示される。
本発明で用いられる多孔性膜は、平膜であっても中空糸膜であっても良い。平膜の場合、その平均厚みは用途に応じて選択されるが、好ましくは20μm以上5000μm以下であり、より好ましくは50μm以上2000μm以下の範囲で選択される。
上述のように、本発明で用いられる分離膜は、多孔質基材と多孔質樹脂層とから形成されている多孔性膜を用いることが望ましい。その際、多孔質基材に多孔質樹脂層が浸透していても、多孔質基材に多孔質樹脂層が浸透していなくてもどちらでも良く、用途に応じて選択される。多孔質基材の平均厚みは、好ましくは50μm以上3000μm以下の範囲で選択される。また、多孔性膜が中空糸膜の場合、中空糸の内径は好ましくは200μm以上5000μm以下の範囲で選択され、膜厚は好ましくは20μm以上2000μm以下の範囲で選択される。また、有機繊維または無機繊維を筒状にした織物や編物を中空糸の内部に含んでいても良い。
まず、多孔性膜のうち、平膜の作成法の概要について説明する。
多孔質基材の表面に、樹脂と溶媒とを含む原液の被膜を形成すると共に、その原液を多孔質基材に含浸させる。その後、被膜を有する多孔質基材の被膜側表面のみを、非溶媒を含む凝固浴と接触させて樹脂を凝固させると共に、多孔質基材の表面に多孔質樹脂層を形成する。
原液は、樹脂を溶媒に溶解させて調整する。原液の温度は、製膜性の観点から、通常、5〜120℃の範囲内で選定することが好ましい。溶媒は、樹脂を溶解するものであり、樹脂に作用してそれらが多孔質樹脂層を形成するのを促すものである。溶媒としては、N−メチルピロリジノン(NMP)、N,N−ジメチルアセトアミド(DMAc)、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、N −メチル− 2− ピロリドン、メチルエチルケトン、テトラヒドロフラン、テトラメチル尿素、リン酸トリメチル、シクロヘキサノン、イソホロン、γ −ブチロラクトン、メチルイソアミルケトン、フタル酸ジメチル、プロピレングリコールメチルエーテール、プロピレンカーボネート、ジアセトンアルコール、グリセロールトリアセテート、アセトンおよびメチルエチルケトンなどを用いることができる。なかでも、樹脂の溶解性の高いN−メチルピロリジノン(NMP)、N,N−ジメチルアセトアミド(DMAc)、N,N−ジメチルホルムアミド(DMF)およびジメチルスルホキシド(DMSO)が好ましく用いられる。これらの溶媒は、単独で用いても良いし2種類以上を混合して用いても良い。原液は、先述の樹脂を好ましくは5重量%以上60重量%以下の濃度で、上述の溶媒に溶解させることにより調整することができる。
また、例えば、ポリエチレングリコール、ポリビニルアルコール、ポリビニルピロリドンおよびグリセリンなどの溶媒以外の成分を溶媒に添加しても良い。溶媒に非溶媒を添加することもできる。非溶媒は、樹脂を溶解しない液体である。非溶媒は、樹脂の凝固の速度を制御して細孔の大きさを制御するように作用する。非溶媒としては、水や、メタノールおよびエタノールなどのアルコール類を用いることができる。なかでも、非溶媒として、価格の点から水やメタノールが好ましく用いられる。溶媒以外の成分および非溶媒は、混合物であってもよい。
原液には、開孔剤を添加することもできる。開孔剤は、凝固浴に浸漬された際に抽出されて、樹脂層を多孔質にする作用を持つものである。開孔剤を添加することにより、平均細孔径の大きさを制御することができる。開孔剤は、凝固浴への溶解性の高いものであることが好ましい。開孔剤としては、例えば、塩化カルシウムや炭酸カルシウムなどの無機塩を用いることができる。また、開孔剤として、ポリエチレングリコールやポリプロピレングリコールなどのポリオキシアルキレン類や、ポリビニルアルコール、ポリビニルブチラールおよびポリアクリル酸などの水溶性高分子化合物や、グリセリンを用いることができる。
次に、多孔性膜のうち、中空糸膜の作成法の概要について説明する。
中空糸膜は、樹脂と溶媒からなる原液を二重管式口金の外側の管から吐出すると共に、中空部形成用流体を二重管式口金の内側の管から吐出して、冷却浴中で冷却固化して作製することができる。
原液は、上述の平膜の作成法で述べた樹脂を好ましくは20重量%以上60重量%以下の濃度で、上述の平膜の生成法で述べた溶媒に溶解させることにより調整することができる。また、中空部形成用流体には、通常気体もしくは液体を用いることができる。また、得られた中空糸膜の外表面に、新たな多孔性樹脂層をコーティング(積層)することもできる。積層は中空糸膜の性質、例えば、親水性・疎水性あるいは細孔径等を所望の性質に変化させるために行うことができる。積層される新たな多孔性樹脂層は、樹脂を溶媒に溶解させた原液を、非溶媒を含む凝固浴と接触させて樹脂を凝固させることによって作製することができる。その樹脂の材質は、例えば、上述有機高分子膜の材質と同様のものが好ましく用いられる。また、積層方法としては、原液に中空糸膜を浸漬してもよいし、中空糸膜の表面に原液を塗布してもよく、積層後、付着した原液の一部を掻き取ったり、エアナイフを用いて吹き飛ばしすることにより積層量を調整することもできる。
本発明で用いられる多孔性膜は、支持体と組み合わせることによって分離膜エレメントとすることができる。多孔性膜を有する分離膜エレメントの形態としては、支持体として支持板を用い、該支持板の少なくとも片面に、本発明で用いられる多孔性膜を配した分離膜エレメントは、本発明で用いられる多孔性膜を有する分離膜エレメントの好適な形態の一つである。この形態で、膜面積を大きくすることが困難な場合には、透水量を大きくするために、支持板の両面に多孔性膜を配することも好ましい態様である。
分離膜の平均細孔径が上記した0.01μm以上1μm未満の範囲内にあると、菌体や汚泥などがリークすることのない高い排除率と、高い透水性を両立させることができ、さらに目詰まりをしにくく、透水性を長時間保持することが、より高い精度と再現性を持って実施することができる。平均細孔径が、上記の範囲内にあれば、微生物として動物細胞、酵母および糸状菌などを用いた場合、目詰まりが少なく、また、細胞の濾液への漏れもなく安定に連続発酵を実施することが可能である。また、動物細胞、酵母および糸状菌より小さな細菌類を用いた場合、多孔性膜の平均細孔径は0.4μm以下であればよく、平均細孔径は0.2μm未満であればなお好適に実施することが可能である。平均細孔径は、小さすぎると透水量が低下することがあるので、本発明では、平均細孔径は0.01μm以上であり、好ましくは0.02μm以上であり、さらに好ましくは0.04μm以上である。
ここで、平均細孔径は、倍率10,000倍の走査型電子顕微鏡観察における、9.2μm×10.4μmの範囲内で観察できる細孔すべての直径を測定し、平均することにより求めることができる。平均細孔径の標準偏差σは、0.1μm以下であることが好ましい。平均細孔径の標準偏差σは、上述の9.2μm×10.4μmの範囲内で観察できる細孔数をNとして、測定した各々の直径をXkとし、細孔直径の平均をX(ave)とした下記の(式1)により算出される。
本発明で用いられる多孔性膜においては、培養液の透過性が重要点の一つであり、透過性の指標として、使用前の多孔性膜の純水透過係数を用いることができる。本発明において、多孔性膜の純水透過係数は、逆浸透膜による25℃の温度の精製水を用い、ヘッド高さ1mで透水量を測定し算出したとき、2×10−9m3/m2/s/pa以上であることが好ましく、純水透過係数が2×10−9m3/m2/s/pa以上6×10−7m3/m2/s/pa以下であれば、実用的に十分な透過水量が得られる。
本発明で用いられる多孔性膜の膜表面粗さは、分離膜の目詰まりに影響を与える因子であり、好ましくは膜表面粗さが0.1μm以下のときに分離膜の剥離係数や膜抵抗を好適に低下させることができ、より低い膜間差圧で連続発酵が実施可能である。また、膜表面粗さが低いことにより、微生物の濾過において、膜表面で発生する剪断力を低下させることが期待でき、微生物の破壊が抑制され、多孔性膜の目詰まりも抑制されることにより、長期間安定な濾過が可能になると考えられる。
ここで、膜表面粗さは、下記の原子間力顕微鏡装置(AFM)を使用して、下記の条件で測定することができる。
・装置 原子間力顕微鏡装置(Digital Instruments(株)製Nanoscope IIIa)
・条件 探針 SiNカンチレバー(Digital Instruments(株)製)
走査モード コンタクトモード(気中測定)
水中タッピングモード(水中測定)
走査範囲 10μm、25μm 四方(気中測定)
5μm、10μm 四方(水中測定)
走査解像度 512×512
・試料調製 測定に際し膜サンプルは、常温でエタノールに15分浸漬後、RO水中に24時間浸漬し洗浄した後、風乾し用いた。RO水とは、濾過膜の一種である逆浸透膜(RO膜)を用いて濾過し、イオンや塩類などの不純物を排除した水を指す。RO膜の孔の大きさは、概ね2nm以下である。
膜表面粗さdroughは、上記AFMにより各ポイントのZ軸方向の高さから、下記の(式2)により算出する。
本発明において、微生物や細胞を濾過処理する際の膜間差圧は、微生物や細胞および培地成分が容易に目詰まりしない条件であればよいが、膜間差圧を0.1kPa以上20kPa以下、好ましくは0.1kPa以上10kPa以下、さらに好ましくは0.1kPa以上5kPaの範囲にして濾過処理することが重要である。上記膜間差圧の範囲を外れた場合、目詰まりが急速に発生し、透過水量の低下を招き、連続発酵運転に不具合を生じることがある。
濾過の駆動力としては、培養液と多孔性膜処理水の液位差(水頭差)を利用したサイホンにより多孔性膜に膜間差圧を発生させることが可能であり、また、濾過の駆動力として多孔性膜処理水側に吸引ポンプを設置してもよいし、多孔性膜の培養液側に加圧ポンプを設置することも可能である。膜間差圧は、培養液と多孔性膜処理水の液位差を変化させることにより制御することができる、また、膜間差圧を発生させるためにポンプを使用する場合には、吸引圧力により膜間差圧を制御することができ、更に培養液側の圧力を導入する気体または液体の圧力によっても膜間差圧を制御することができる。これら圧力制御を行う場合には、培養液側の圧力と多孔性膜処理水側の圧力差をもって膜間差圧とし、膜間差圧の制御に用いることができる。
また、本発明において使用される多孔性膜は、濾過処理する膜間差圧として、0.1kPa以上20kPa以下の範囲で濾過処理することができる性能を有することが好ましい。また、本発明で使用される多孔性膜は、上述のように、使用前の純水透過係数が、逆浸透膜による25℃の温度の精製水を用い、ヘッド高さ1mで透水量を測定し算出したとき、2×10−9m3/m2/s/pa以上であることが好ましく、さらに2×10−9m3/m2/s/pa以上6×10−7m3/m2/s/pa以下の範囲にあることが好ましい。
本発明で使用される発酵原料としては、培養する微生物の生育を促し、目的とする発酵生産物であるコハク酸を良好に生産させ得るものであればよく、例えば、炭素源、窒素源、無機塩類、および必要に応じてアミノ酸、およびビタミンなどの有機微量栄養素を適宜含有する液体培地等が好ましく用いられる。
上記の炭素源としては、例えば、グルコース、シュークロース、フラクトース、ガラクトース、ラクトース等の糖類、これら糖類を含有する澱粉糖化液、甘藷糖蜜、甜菜糖蜜、ハイテストモラセス、更には酢酸、フマル酸等の有機酸、エタノールなどのアルコール類、およびグリセリン等が使用される。ここで糖分とは、多価アルコールの最初の酸化生成物であり、アルデヒド基またはケトン基をひとつ持ち、アルデヒド基を持つ糖をアルドース、ケトン基を持つ糖をケトースと分類される炭水化物のことを指す。
また上記の窒素源としては、例えば、アンモニアガス、アンモニア水、アンモニウム塩類、尿素、硝酸塩類、その他補助的に使用される有機窒素源、例えば油粕類、大豆加水分解液、カゼイン分解物、その他のアミノ酸、ビタミン類、コーンスティープリカー、酵母または酵母エキス、肉エキス、ペプトン等のペプチド類、各種発酵菌体およびその加水分解物などが使用される。
また上記の無機塩類としては、例えば、リン酸塩、マグネシウム塩、カルシウム塩、鉄塩、およびマンガン塩等を適宜添加することができる。
本発明で使用される微生物が生育のために特定の栄養素を必要とする場合には、その栄養物を標品もしくはそれを含有する天然物として添加することができる。また、消泡剤も必要に応じて添加使用することができる。
本発明において、培養液とは、発酵原料に微生物が増殖した結果得られる液のことを言い、追加する発酵原料の組成は、培養開始時の発酵原料組成から適宜変更しても良い。発酵原料組成から追加する発酵原料の組成への変更する場合、その内容は特に限定されないが、目的とするコハク酸の生産性が高くなるような変更が好ましい。例えば、上記炭素源に対する窒素源、無機塩類、アミノ酸、およびビタミンなどの有機微量栄養素の重量比率を低下させることにより、コハク酸の生産コストの低減、すなわち広義でコハク酸の生産性の向上が実現できる場合もある。一方、上記炭素源に対する窒素源、無機塩類、アミノ酸、およびビタミンなどの有機微量栄養素の重量比率を増加させることにより、コハク酸の生産性が向上できる場合もある。
本発明では、培養液中の糖類など発酵原料の濃度は、5g/L以下に保持されるようにすることが好ましい。その理由は、培養液の引き抜きによる発酵原料の流失を最小限にするためである。
微生物の培養は、通常、pH4〜8、温度20〜40℃の範囲で行われることが多い。培養液のpHは、無機の酸あるいは有機の酸、アルカリ性物質、さらには尿素、炭酸カルシウム、およびアンモニアガスなどによって、上記範囲内のあらかじめ定められた値に調節される。
微生物の培養において、酸素の供給速度を上げる必要があれば、空気に酸素を加えて酸素濃度を21%以上に保つ、培養を加圧する、攪拌速度を上げる、あるいは通気量を上げるなどの手段を用いることができる。逆に、酸素の供給速度を下げる必要があれば、炭酸ガス、窒素およびアルゴンなど酸素を含まないガスを空気に混合して供給することも可能である。
本発明においては、培養初期にBatch培養またはFed−Batch培養を行って微生物濃度を高くした後に連続培養(引き抜き)を開始しても良いし、高濃度の菌体をシードし、培養開始とともに連続培養を行っても良い。適当な時期から発酵原料液の供給および培養物の引き抜きを行うことが可能である。発酵原料液供給と培養物の引き抜きの開始時期は、必ずしも同じである必要はない。また、発酵原料液の供給と培養物の引き抜きは連続的であってもよいし、間欠的であってもよい。発酵原料液には、上記に示したような菌体増殖に必要な栄養素を添加し、菌体増殖が連続的に行われるようにすればよい。培養液中の微生物の濃度は、培養液の環境が微生物の増殖にとって不適切となって死滅する比率が高くならない範囲で、高い状態で維持することが効率よい生産性を得るのに好ましく、一例として、乾燥重量として5g/L以上に維持することにより良好な生産効率が得られる。また、連続発酵装置の運転上の不具合、生産効率の低下を招かなければ、微生物の濃度の上限値は特に限定されない。
発酵生産能力のあるフレッシュな菌体を増殖させつつ行う連続培養操作は、培養管理上、通常、単一の発酵反応槽で行うことが好ましい。しかしながら、菌体を増殖しつつ生産物を生成する連続培養法であれば、発酵反応槽の数は問わない。発酵反応槽の容量が小さい等の理由から、複数の発酵反応槽を用いることもあり得る。この場合、複数の発酵反応槽を配管で並列または直列に接続して連続培養を行っても、発酵生産物の高生産性は得られる。
本発明においては、微生物を発酵反応槽に維持したままで、発酵反応槽からの培養液の連続的かつ効率的な抜き出しが可能となることから、微生物を連続的に培養し、十分な増殖を確保した後に、発酵原料液組成を変更し、目的とするコハク酸を効率よく製造することも可能である。また、微生物の増殖に好適な発酵原料を用いて微生物を大量に培養した後、得られた微生物を組成の異なる発酵原料と反応させることにより、より効率よく目的とするコハク酸を製造することが可能となる場合がある。このような場合、通常は、培養で得られた微生物を一度培養液から分離・回収した後、回収した微生物を培養液に再度加えて反応を行うため、微生物の分離・回収に、大型の遠心分離器が必要であるなど分離・回収に時間がかかり、微生物のロスが多いという問題点があった。微生物の分離・回収に濾過膜を用いることも知られているが、従来の分離膜では微生物の分離性能が低いため高圧が必要であり、また、効率良い濾過のためには大きな面積の濾過膜を必要とする課題があった。また、従来技術では、微生物の培養工程と微生物の分離・回収工程および反応工程が区分されていることから、多くの場合、培養槽と反応槽を別々に持つ必要があった。
本発明によれば、微生物の培養に使用する発酵原料を連続的に供給しながら微生物を培養し、十分な菌体量が得られた後に、反応に好適な発酵原料に切り替えることにより、一つのリアクター内を、微生物の培養工程から反応工程に連続的にかつスムーズに変更することが可能となるため、製造設備をコンパクトにすることができる。
本発明で使用される微生物は、本発明の本質が培養の効率化にあることから、コハク酸を生産することが可能な微生物である。すなわち、コハク酸を効率良く生産することが可能な微生物を、好適に利用することができる。微生物としては、例えば、アナエロビオスピリラム(Anaerobiospirillum)属やアクチノバシラス(Actinobacillus)属に属する細菌を好適に利用することができる。具体的には、米国特許第5143833号明細書に記載のアナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)や、James B. Mckinlay (ジェームズ B.マッキンリー)らが開示しているアクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)を挙げることができる(Appl. Microbiol. Biotechnol.(アプライド マイクロバイアル アンド マイクロバイオロジー),71,6651−6656 (2005)。
また、コリネバクテリウム(Corynebacterium)属やブレビバクテリウム(Brevibacterium)属などのコリネ型細菌(Coryneformbacterium)、および大腸菌(Escherichia coli)なども利用可能である。コリネ型細菌では、コリネバクテリウム・グルタミカム(Corynebacterium glutamicum)、ブレビバクテリウム・フラバム(Brevibacterium flavum)およびブレビバクテリウム・ラクトファーメンタム(Brevibacterium lactofermentum)などが好適である。
また、微生物としては、遺伝子組換えによって、コハク酸の生産能力が改善された微生物を用いることができ、これによりコハク酸の生産性を向上させることも可能である。このような微生物としては、コリネ型細菌(Coryneformbacterium)および大腸菌(Escherichia coli)からなる群から選ばれた組換え微生物が挙げられ、例えば、特開2005−27533号公報に記載の乳酸脱水素酵素(lactate dehydrogenase)を欠損したブレビバクテリウム・フラバムMJ233AB−41(FERM BP−1498)、非特許文献1に記載のコリネバクテリウム・グルタミカム(Corynebacterium glutamicum)、および米国特許第5770435号明細書に記載のピルビン酸・ギ酸開裂酵素(pyruvate formatelyase)と乳酸脱水素酵素(lactate dehydrogenase)の欠損株である大腸菌AFP111株などを使用することができる。
本発明の連続発酵によるコハク酸の製造方法により製造された濾液に含まれるコハク酸の分離・精製には、通常のコハク酸の精製法を適用することができる。例えば、特開2005−333886号公報に示されている水分解電気透析処理と減圧濃縮・晶析を組み合わせた精製法を好適に用いることができる。
本発明の連続発酵によるコハク酸の製造方法で用いられる連続発酵装置1つの例は、主に、微生物を保持しコハク酸を製造するための発酵反応槽、および微生物と培養液を濾過分離するための多孔性膜を含む分離膜エレメントから構成される。分離膜エレメントは、発酵反応槽の内部または外部のいずれに設置されてもよい。
本発明の連続発酵によるコハク酸の製造方法は、平均細孔径が0.01μm以上1μm未満の多孔性膜を使用し、濾過圧力である膜間差圧が0.1から20kPaの範囲で濾過処理することを特徴としている。そのため、特別に発酵反応槽内を加圧状態に保つ必要がないことから、濾過分離装置と発酵反応槽間で培養液を循環させる動力手段が不要となり、分離膜エレメントを発酵槽内部に設置して発酵装置をコンパクト化することが可能である。
本発明の連続発酵によるコハク酸の製造方法で用いられる連続発酵装置のうち、分離膜エレメントは、発酵反応槽の内部に設置された代表的な一例を図1の概要図に示す。図1は、本発明で用いられる膜分離型の連続発酵装置の一つの実施の形態を説明するための概略側面図である。図1において、連続発酵装置は、分離膜エレメント2を備えた発酵反応槽1と水頭差制御装置3で基本的に構成されている。発酵反応槽1内の分離膜エレメント2には、多孔性膜が組み込まれている。この多孔性膜としては、例えば、国際公開第2002/064240号パンフレットに開示されている分離膜、および分離膜エレメントを使用することができる。分離膜エレメントに関しては、追って詳述する。
次に、図1の連続発酵装置による連続発酵の形態について説明する。培地供給ポンプ7によって、培地を発酵反応槽1に連続的もしくは断続的に投入する。培地については、入前に必要に応じて加熱殺菌、加熱滅菌あるいはフィルターを用いた滅菌処理を行うことができる。発酵生産時には、必要に応じて、発酵反応槽1内の攪拌機5で発酵反応槽1内の培養液を攪拌し、また必要に応じて、気体供給装置4によって必要とする気体を発酵反応槽1内に供給することができ、また、必要に応じて、pHセンサ・制御装置9およびpH調整溶液供給ポンプ8によって発酵反応槽1内の培養液のpHを調整し、また必要に応じて、温度調節器10によって発酵反応槽1内の培養液の温度を調節することにより生産性の高い発酵生産を行うことができる。ここでは、計装・制御装置による発酵液の物理化学的条件の調節に、pHおよび温度を例示したが、必要に応じて、溶存酸素やORPの制御、更にはオンラインケミカルセンサーなどの分析装置により培養液中のコハク酸の濃度を測定し、それを指標とした物理化学的条件の制御を行うことができる。また、培地の連続的もしくは断続的投入の形態に関しては、上記計装装置による培養液の物理化学的環境の測定値を指標として、培地投入量および速度を適宜調節することができる。
培養液は、発酵反応槽1内に設置された分離膜エレメント2によって、微生物と発酵生産物に濾過・分離され、発酵生産物は装置系から取り出される。また、濾過・分離された微生物は装置系内に留まることにより装置系内の微生物濃度を高く維持することができ、生産性の高い発酵生産を可能としている。ここで、分離膜エレメント2による濾過・分離には発酵反応槽1の水面との水頭差圧によって行い、特別な動力を必要としない。また、必要に応じて、レベルセンサ6および水頭差圧制御装置3によって、分離膜エレメント2の濾過・分離速度およびよび発酵反応槽1内の培養液量を適当に調節することができる。上記の膜分離膜エレメントによる濾過・分離には水頭差圧によって行うことを例示したが、必要に応じて、ポンプ等による吸引濾過あるいは装置系内を加圧することにより、濾過・分離することもできる。
次に、本発明の連続発酵によるコハク酸の製造方法で用いられる連続発酵装置のうち、分離膜エレメントが、発酵反応槽の外部に設置された代表的な一例を図2の概要図に示す。図2は、本発明で用いられる他の膜分離型の連続発酵装置の一つの実施の形態を説明するための概略側面図である。
図2において、連続発酵装置は、発酵反応槽1と、分離膜エレメント2を備えた膜分離槽12と、水頭差制御装置3とで基本的に構成されている。ここで、分離膜エレメント2には、多孔性膜が組み込まれている。この多孔性膜としては、例えば、国際公開第2002/064240号パンフレットに開示されている分離膜、および分離膜エレメントを使用することが好適である。また、膜分離槽12は、培養液循環ポンプ11を介して発酵反応槽1に接続されている。
図2において、培地供給ポンプ7によって培地を発酵反応槽1に投入し、必要に応じて、攪拌機5で発酵反応槽1内の培養液を攪拌し、また必要に応じて、気体供給装置4によって必要とする気体を供給し、また必要に応じて、pHセンサ・制御装置9およびよびpH調整溶液供給ポンプ8によって培養液のpHを調整し、また必要に応じて、温度調節器10によって培養液の温度を調節することにより、生産性の高い発酵生産を行うことができる。さらに、装置内の培養液は、培養液循環ポンプ11によって発酵反応槽1と膜分離槽12の間を循環する。発酵生産物を含む培養液は、分離膜エレメント2によって微生物と発酵生産物に濾過・分離され、発酵生産物は装置系から取り出される。また、濾過・分離された微生物は、装置系内にとどまることにより装置系内の微生物濃度を高く維持することができ、生産性の高い発酵生産を可能としている。ここで、分離膜エレメント2による濾過・分離は、膜分離槽12の水面との水頭差圧によって行い、特別な動力を必要としない。また、必要に応じて、レベルセンサ6および水頭差圧制御装置3によって、分離膜エレメント2の濾過・分離速度および装置系内の培養液量を適当に調節することができる。また必要に応じて、気体供給装置4によって必要とする気体を膜分離槽12内に供給することができる。上記のように、分離膜エレメント2による濾過・分離には水頭差圧によって行うことを例示したが、必要に応じて、ポンプ等による吸引濾過あるいは装置系内を加圧することにより濾過・分離することもできる。
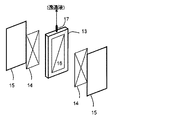
次に、本発明で用いられる分離膜エレメントの好適な形態の例である国際公開第2002/064240号パンフレットに開示されている分離膜および分離膜エレメントを、以下に図を用いてその概略を説明する。図3は、本発明で用いられる分離膜エレメントの一つの実施の形態を説明するための概略斜視図である。
分離膜エレメントは、図3に示すように、剛性有する支持板13の両面に、流路材14と前記の分離膜15とをこの順序で配し構成されている。支持板13は、両面に凹部16を有している。分離膜15は培養液を濾過する。流路材14は、分離膜15で濾過された濾液を効率よく支持板13に流すためのものである。支持板13に流れた濾液は、支持板13の凹部16を通って外部に取り出される。外部へは、集水パイプ17を介して連続発酵装置外部に取り出される。
図4に示す分離膜エレメントについて説明する。図4は、本発明で用いられる別の分離膜エレメントを例示説明するための概略斜視図である。分離膜エレメントは、図4に示すように、中空糸膜(多孔性膜)で構成された分離膜束18と上部樹脂封止層19と下部樹脂封止層20によって主に構成される。分離膜束18は、上部樹脂封止層19および下部樹脂封止層20よって束状に接着・固定化されている。下部樹脂封止層20による接着・固定化は、分離膜束18の中空糸膜(多孔性膜)の中空部を封止しており、培養液の漏出を防ぐ構造になっている。一方、上部樹脂封止層19は、分離膜束18の中空糸膜(多孔性膜)の内孔を封止しておらず、集水パイプ22に濾液が流れる構造となっている。この分離膜エレメントは、支持フレーム21を介して連続発酵装置内に設置することが可能である。分離膜束18によって濾過された濾液は、中空糸膜の中空部を通り、集水パイプ22を介して連続発酵装置外部に取り出される。濾液を取り出すための動力として、水頭差圧、ポンプ、液体や気体等による吸引濾過、あるいは装置系内を加圧するなどの方法を用いることができる。
本発明の連続発酵によるコハク酸の製造方法で用いられる連続発酵装置の分離膜エレメントを構成する部材は、高圧蒸気滅菌操作に耐性の部材であることが好ましい。連続発酵装置内が滅菌可能であれば、連続発酵時に好ましくない微生物による汚染の危険を回避することができ、より安定した連続発酵が可能となる。分離膜エレメントを構成する部材は、高圧蒸気滅菌操作の条件である、121℃で15分間に耐性であることが好ましい。分離膜エレメント部材は、例えば、ステンレスやアルミニウムなどの金属、ポリアミド系樹脂、フッ素系樹脂、ポリカーボネート系樹脂、ポリアセタール系樹脂、ポリブチレンテレフタレート系樹脂、PVDF、変性ポリフェニレンエーテル系樹脂およびポリサルホン系樹脂等の樹脂を好ましく選定できる。
本発明の連続発酵によるコハク酸の製造方法で用いられる連続発酵装置では、分離膜エレメントは、図1のように発酵反応槽内に設置しても良いし、図2のように発酵反応槽外に設置しても良い。分離膜エレメントを発酵反応槽外に設置する場合には、別途、膜分離槽を設けてその内部に分離膜エレメントを設置することができ、発酵反応槽と膜分離槽の間を培養液を循環させながら、分離膜エレメントにより培養液を連続的に濾過することができる。
本発明の連続発酵によるコハク酸の製造方法で用いられる連続発酵装置では、膜分離槽は、高圧蒸気滅菌可能であることが望ましい。膜分離槽が高圧蒸気滅菌可能であると、雑菌による汚染回避が容易である。
本発明の連続発酵によるコハク酸の製造方法に従って連続発酵を行った場合、従来のバッチ式の発酵と比較して、高い体積生産速度が得られ、極めて効率のよい発酵生産が可能となる。ここで、連続培養における発酵生産速度は、次の(式3)で計算される。
・発酵生産速度(g/L/hr)
=抜き取り液中の生産物濃度(g/L)×培養液抜き取り速度(L/hr)
÷装置の運転液量(L) ・・・・(式3)
また、バッチ式培養による発酵生産速度は、原料炭素源をすべて消費した時点の生産物量(g)を、炭素源の消費に要した時間(h)とその時点の培養液量(L)で除して求められる。
本発明の連続発酵によるコハク酸の製造方法により得られるコハク酸およびその誘導体は、界面活性剤、洗剤、可塑剤、キレート剤の他、醸造食品、ハムおよびソーセージなど食品加工品における調味料、香料など幅広い用途に適用される。また、コモディティーケミカルとして、1,4−ブタンジーオール、テトラヒドロフラン、γ−ブチロラクトン、アジピン酸、n−メチルピロリドン、直鎖脂肪族ポリエステルやポリアミド等のポリマーの原料としても好適に用いられる。本発明のコハク酸の製造法を用いることにより、これら幅広い用途のあるコハク酸を効率的に製造できることから、より安価にコハク酸を提供することが可能となる。
以下、本発明の連続発酵によるコハク酸の製造方法をさらに詳細に説明するために、図1および図2に示した連続発酵装置を用いることによる、連続的なコハク酸の発酵生産について、実施例を挙げて説明する。本発明は、これらの実施例に限定されるものではない。
(参考例1)多孔性膜の作製(その1)
樹脂としてポリフッ化ビニリデン(PVDF)樹脂を、また溶媒としてN,N−ジメチルアセトアミド(DMAc)をそれぞれ用い、これらを90℃の温度下に十分に攪拌し、下記組成を有する原液を得た。
[原液]
・PVDF:13.0重量%
・DMAc:87.0重量%
次に、上記の原液を25℃の温度に冷却した後、あらかじめガラス板上に貼り付けて置いた、密度が0.48g/cm3で、厚みが220μmのポリエステル繊維製不織布(多孔質基材)に塗布し、直ちに下記組成を有する25℃の温度の凝固浴中に5分間浸漬して、多孔質基材に多孔質樹脂層が形成された多孔性膜を得た。
[凝固浴]
・水 :30.0重量%
・DMAc:70.0重量%
この多孔性膜をガラス板から剥がした後、80℃の温度の熱水に3回浸漬してDMAcを洗い出し、分離膜を得た。多孔質樹脂層表面の9.2μm×10.4μmの範囲内を、倍率10,000倍で走査型電子顕微鏡観察を行ったところ、観察できる細孔すべての直径の平均は0.1μmであった。次に、上記分離膜について純水透水透過係数を評価したところ、50×10-9m3/m2/s/Paであった。純水透水量の測定は、逆浸透膜による25℃の温度の精製水を用い、ヘッド高さ1mで行った。また、平均細孔径の標準偏差は0.035μmで、膜表面粗さは0.06μmであった。
(参考例2)多孔性膜の作製(その2)
重量平均分子量41.7万のフッ化ビニリデンホモポリマーとγ-ブチロラクトンとを、それぞれ38重量%と62重量%の割合で170℃の温度で溶解し、原液を作製した。この原液をγ-ブチロラクトンを中空部形成液体として随拌させながら口金から吐出し、温度20℃のγ-ブチロラクトン80重量%水溶液からなる冷却浴中で固化して中空糸膜を作製した。
次いで、重量平均分子量28.4万のフッ化ビニリデンホモポリマーを14重量%、セルロースアセテートプロピオネート(イーストマンケミカル社、CAP482−0.5)を1重量%、N-メチル-2-ピロリドンを77重量%、ポリオキシエチレンヤシ油脂肪酸ソルビタン(三洋化成株式会社製、商品名“イオネットT−20C”(登録商標))を5重量%、および水を3重量%の割合で95℃の温度で混合溶解して、原液を調整した。この原液を、上記で得られた中空糸膜の表面に均一に塗布し、すぐに水浴中で凝固させた本発明で用いる中空糸膜(多孔性膜)を製作した。得られた中空糸膜(分離膜)の被処理水側表面の平均細孔径は、0.05μmであった。次に、上記の分離膜である中空糸膜について純水透水量を評価したところ、5.5×10-9m3/m2・s・Paであった。透水量の測定は、逆浸透膜による25℃の温度の精製水を用い、ヘッド高さ1mで行った。また、平均細孔径の標準偏差 は0.006μmであった。
(参考例3)コハク酸など培地成分の定量
コハク酸は、培養液の遠心上清について、HPLC(島津製作所社製、LC10A、RIモニター:RID−10A、カラム:アミネックスHPX−87H)を用いて分析定量した。カラム温度50℃の0.01NのH2SO4濃度の条件でカラムを平衡化した後、サンプルをインジェクションし、0.01NのH2SO4濃度で溶出して分析定量を行った。グルコースは、グルコースセンサー(BF−4、王子計測機器社製)を用いて測定定量した。
(比較例1) アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillumsucciniciproducens)によるコハク酸製造(バッチ発酵)
20g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、3g/LのK2HPO4、1g/LのNaCl、1g/Lの(NH4)2SO4、0.2g/LのMgCl2、および0.2g/LのCaCl2・2H2Oからなる種培養用培地100mLを、125mL容三角フラスコに入れ加熱滅菌した。嫌気グローブボックス内で、30MmNa2CO31mLと180mMH2SO4 0.15mLを加え、さらに、0.25g/L システイン・HClと0.25g/L Na2Sからなる還元溶液0.5mLを加えた後、アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)ATCC53488を接種し、39℃の温度で一晩静置培養した。表1に示す発酵培地1Lを、ミニジャーファメンター(ABLE社製、BMJ型、2L)に加え、120℃の温度で20分間加熱滅菌した。
CO2ガスを、スパージャーから10mL/minで通気し、3MNa2CO3溶液10mLを加えた後、硫酸溶液でpHを6.8に調整した。0.25g/Lのシステイン・HClと0.25g/LのNa2S・9H2Oからなる還元溶液5mLを加えた後、上記の種培養液50mL接種し、撹拌速度200rpm、温度39℃の2MNa2CO3溶液でpH6.4に調整しながら培養を行った。その結果を表2に示す。培養38時間でコハク酸の蓄積量は39gであった。
(実施例1)アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)によるコハク酸の製造(その1)
比較例1と同様の微生物と発酵培地を用いて、図1の連続発酵装置でコハク酸の連続発酵試験を行った。分離膜エレメントの部材としては、ステンレスおよびポリサルホン樹脂の成形品を用いた。分離膜には、参考例1で作成したポリフッ化ビニリデン(PVDF)を主成分とする多孔性膜を用いた。該多孔質膜の平均細孔径は上記のとおり0.1μmであり、純水透過係数は50×10-9m3/m2/s/paである。この実施例1における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・使用分離膜:PVDF濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽CO2通気量:10(mL/min)
・発酵反応槽攪拌速度:200(rpm)
・pH調整:2M Na2CO3でpH6.4に調整
・滅菌:分離膜エレメントを含む発酵反応槽、および使用培地は総て121℃、20minのオートクレーブにより高圧蒸気滅菌。
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、20g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、3g/LのK2HPO4、1g/LのNaCl、1g/Lの(NH4)2SO4、0.2g/LのMgCl2、および0.2g/LのCaCl2・2H2Oからなる種培養用培地100mLを、125mL容三角フラスコに入れ加熱滅菌した。嫌気グローブボックス内で、30MmNa2CO31mLと180mMH2SO4 0.15mLを加え、さらに、0.25g/Lのシステイン・HClと0.25g/LのNa2Sからなる還元溶液0.5mLを加えた後、アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)ATCC53488を接種し、39℃の温度で一晩静置培養した(前々培養)。図1に示した連続発酵装置の1.5Lのコハク酸発酵培地(表1)に、0.25g/Lのシステイン・HClと0.25g/LのNa2S・9H2Oからなる還元溶液5mLを加えた後、前々培養液50mLを植菌し、図1の発酵反応槽1を付属の攪拌機5によって200rpmで攪拌し、発酵反応槽1のCO2通気量の調整、温度調整およびpH調整を行い、24時間培養を行った(前培養)。前培養完了後直ちに、コハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を1.5Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例1の結果と合わせて表2に示した。264時間の発酵試験を行った結果、図1に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(実施例2)アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)によるコハク酸の製造(その2)
比較例1と同様の微生物と発酵培地を用いて、図2の連続発酵装置でコハク酸の連続発酵試験を行った。分離膜エレメントの部材としては、ステンレスおよびポリサルホン樹脂の成形品を用いた。分離膜には、参考例1で作製したポリフッ化ビニリデン(PVDF)を主成分とする多孔性膜を用いた。該多孔質膜の平均細孔径は上記のとおり0.1μmであり、純水透過係数は50×10-9m3/m2/s/paである。この実施例2における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・膜分離槽容量:0.5(L)
・使用分離膜:ポリフッ化ビニリデン濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽通気量CO2:10(mL/min)
・膜分離槽通気量:0.3(L/min)
・発酵反応槽攪拌速度:100(rpm)
・pH調整:2M Na2CO3でpH6.4に調整
・培養液循環装置による循環液量:0.1(L/min)
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、20g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、3g/LのK2HPO4、1g/LのNaCl、1g/Lの(NH4)2SO4、0.2g/LのMgCl2、および0.2g/LのCaCl2・2H2Oからなる種培養用培地100mLを、125mL容三角フラスコに入れ加熱滅菌した。嫌気グローブボックス内で、30MmNa2CO31mLと180mMH2SO4 0.15mLを加え、さらに、0.25g/Lのシステイン・HClと0.25g/LのNa2Sからなる還元溶液0.5mLを加えた後、アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)ATCC53488を接種し、39℃の温度で一晩静置培養した(前々培養)。図2に示した連続発酵装置の2Lのコハク酸発酵培地(表1)に、0.25g/Lのシステイン・HClと0.25g/LのNa2S・9H2Oからなる還元溶液5mLを加えた後、前々培養液50mLを植菌し、図2の発酵反応槽1を付属の攪拌機5によって100rpmで攪拌し、発酵反応槽1のCO2通気量の調整、温度調整およびpH調整を行い、24時間培養を行った(前培養)。前培養完了後直ちに、コハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を2Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例1の結果および実施例1の結果と合わせて表2に示した。265時間の発酵試験を行った結果、図2に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(実施例3)アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)によるコハク酸の製造(その3)
比較例1と同様の微生物と発酵培地を用いて、図1の連続発酵装置でコハク酸の連続発酵試験を行った。分離膜エレメントの部材としては、ステンレスおよびポリサルホン樹脂の成形品を用いた。分離膜には参考例2で作製したポリフッ化ビニリデン(PVDF)を主成分とする中空糸多孔性膜を用いた。該多孔質膜の平均細孔径は上記のとおり0.05μmであり、純水透過係数は5.5×10-9m3/m2・s・Paである。この実施例3における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・使用分離膜:PVDF濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽CO2通気量:10(mL/min)
・発酵反応槽攪拌速度:200(rpm)
・pH調整:2M Na2CO3でpH6.4に調整
・滅菌:分離膜エレメントを含む発酵反応槽、および使用培地は総て121℃、20minのオートクレーブにより高圧蒸気滅菌。
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、20g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、3g/LのK2HPO4、1g/LのNaCl、1g/Lの(NH4)2SO4、0.2g/LのMgCl2、および0.2g/LのCaCl2・2H2Oからなる種培養用培地100mLを、125mL容三角フラスコに入れ加熱滅菌した。嫌気グローブボックス内で、30MmNa2CO31mLと180mMH2SO4 0.15mLを加え、さらに、0.25g/Lのシステイン・HClと0.25g/LのNa2Sからなる還元溶液0.5mLを加えた後、アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)ATCC53488を接種し、39℃の温度で一晩静置培養した(前々培養)。図1に示した連続発酵装置の1.5Lのコハク酸発酵培地(表1)に、0.25g/Lのシステイン・HClと0.25g/LのNa2S・9H2Oからなる還元溶液5mLを加えた後、前々培養液50mLを植菌し、図1の発酵反応槽1を付属の攪拌機5によって200rpmで攪拌し、発酵反応槽1のCO2通気量の調整、温度調整およびpH調整を行い、24時間培養を行った(前培養)。前培養完了後直ちに、コハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を1.5Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例1の結果と合わせて表3に示した。250時間の発酵試験を行った結果、図1に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(実施例4)アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)によるコハク酸の製造(その4)
比較例1と同様の微生物と発酵培地を用いて、図2の連続発酵装置でコハク酸の連続発酵試験を行った。分離膜エレメントの部材としては、ステンレスおよびポリサルホン樹脂の成形品を用いた。分離膜には、参考例2で作製したポリフッ化ビニリデン(PVDF)を主成分とする中空糸多孔性膜を用いた。該多孔質膜の平均細孔径は上記のとおり0.05μmであり、純水透過係数は5.5×10-9m3/m2・s・Paである。この実施例4における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・膜分離槽容量:0.5(L)
・使用分離膜:ポリフッ化ビニリデン濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽通気量CO2:10(mL/min)
・膜分離槽通気量:0.3(L/min)
・発酵反応槽攪拌速度:100(rpm)
・pH調整:2M Na2CO3でpH6.4に調整
・培養液循環装置による循環液量:0.1(L/min)
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、20g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、3g/LのK2HPO4、1g/LのNaCl、1g/Lの(NH4)2SO4、0.2g/LのMgCl2、および0.2g/LのCaCl2・2H2Oからなる種培養用培地100mLを、125mL容三角フラスコに入れ加熱滅菌した。嫌気グローブボックス内で、30MmNa2CO31mLと180mMH2SO4 0.15mLを加え、さらに、0.25g/Lのシステイン・HClと0.25g/LのNa2Sからなる還元溶液0.5mLを加えた後、アナエロビオスピリラム サクシニシプロデュセンス(Anaerobiospirillum succiniciproducens)ATCC53488を接種し、39℃の温度で一晩静置培養した(前々培養)。図2に示した連続発酵装置の2Lのコハク酸発酵培地(表1)に、0.25g/Lのシステイン・HClと0.25g/LのNa2S・9H2Oからなる還元溶液5mLを加えた後、前々培養液50mLを植菌し、図2の発酵反応槽1を付属の攪拌機5によって100rpmで攪拌し、発酵反応槽1のCO2通気量の調整、温度調整およびpH調整を行い、24時間培養を行った(前培養)。前培養完了後直ちに、コハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を2Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例1の結果および実施例3の結果と合わせて表3に示した。240時間の発酵試験を行った結果、図2に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(比較例2)アクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)によるコハク酸製造(バッチ発酵)
表4に示すアクチノバシラス用コハク酸発酵培地50mLとMgCO3 4.0gを、100mL容シーラム試験管に加え、CO2でガス置換した後、加熱滅菌した。あらかじめ、凍結保存していたアクチノバシラス・サクシノジェネス(Actinobacillus succinofenes)ATCC55618の菌体懸濁液5mLを接種し、37℃の温度で24時間培養して種培養を調製した。
表4に示す発酵培地1LをpH6.8に調整後、ミニジャーファメンター(ABLE社製、BMJ型、2L)に加え、120℃の温度で20分間加熱滅菌した。CO2ガスをスパージャーから50mL/minで通気し、温度を39℃に調整した。上記種培養50mLを接種し、付属の撹拌羽根を用いて600rpmで撹拌しながら、5.5M NaCO3でpHを6.8に調整しながら培養した。その結果を表5に示す。培養49時間でコハク酸の生成量は、72gであった。
(実施例5)アクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)によるコハク酸の製造(その1)
比較例2と同様の微生物と発酵培地を用いて、図1に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜には、参考例1で作製した多孔性膜を用いた。この実施例5における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・使用分離膜:PVDF濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽CO2通気量:75(mL/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・滅菌:分離膜エレメントを含む培養槽、および使用培地は総て121℃、20minの
オートクレーブにより高圧蒸気滅菌。
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した。)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、表4に示すアクチノバシラス用コハク酸発酵培地75mLとMgCO3 4.0gを、100mL容シーラム試験管に加え、CO2でガス置換した後、加熱滅菌した。あらかじめ、凍結保存していたアクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)ATCC55618の菌体懸濁液7.5mLを接種し、37℃の温度で24時間培養して種培養を調製した(前々培養)。図1に示した連続発酵装置に1.5Lのコハク酸発酵培地(表4)を仕込み、前々培養液75mLを植菌し、発酵反応槽1を付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を39℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、表4のコハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を1.5Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例2の結果と合わせて表5に示した。254時間の発酵試験を行った結果、1193gのコハク酸が得られ、図1に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(実施例6)アクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)によるコハク酸の製造(その2)
比較例2と同様の微生物と発酵培地を用いて、図2に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜には、参考例1で作製した多孔性膜を用いた。この実施例6における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・膜分離槽容量:0.5(L)
・使用分離膜:ポリフッ化ビニリデン濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽通気量CO2:75(mL/min)
・膜分離槽通気量:0.3(L/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・培養液循環装置による循環液量:0.1(L/min)
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、表4に示すアクチノバシラス用コハク酸発酵培地75mLとMgCO3 4.0gを、100mL容シーラム試験管に加え、CO2でガス置換した後、加熱滅菌した。あらかじめ、凍結保存していたアクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)ATCC55618の菌体懸濁液7.5mLを接種し、37℃の温度で24時間培養して種培養を調製した(前々培養)。図2に示した連続発酵装置に2Lのコハク酸発酵培地(表4)を仕込み、前々培養液75mLを植菌し、発酵反応槽1を付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を39℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、表4のコハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を2Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例2の結果と実施例5の結果を合わせて表5に示した。240時間の発酵試験を行った結果、1444gのコハク酸が得られ、図2に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(実施例7)アクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)によるコハク酸の製造(その3)
比較例2と同様の微生物と発酵培地を用いて、図1に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜には、参考例2で作製した多孔性膜を用いた。この実施例7における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・使用分離膜:PVDF濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽CO2通気量:75(mL/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・滅菌:分離膜エレメントを含む培養槽、および使用培地は総て121℃、20minの
オートクレーブにより高圧蒸気滅菌。
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した。)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、表4に示すアクチノバシラス用コハク酸発酵培地75mLとMgCO3 4.0gを、100mL容シーラム試験管に加え、CO2でガス置換した後、加熱滅菌した。あらかじめ、凍結保存していたアクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)ATCC55618の菌体懸濁液7.5mLを接種し、37℃の温度で24時間培養して種培養を調製した(前々培養)。図1に示した連続発酵装置に1.5Lのコハク酸発酵培地(表4)を仕込み、前々培養液75mLを植菌し、発酵反応槽1を付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を39℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、表4のコハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を1.5Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例2の結果と合わせて表6に示した。220時間の発酵試験を行った結果、図1に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(実施例8)アクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)によるコハク酸の製造(その4)
比較例2と同様の微生物と発酵培地を用いて、図2に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜には、参考例2で作製した多孔性膜を用いた。この実施例8における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・膜分離槽容量:0.5(L)
・使用分離膜:ポリフッ化ビニリデン濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:39(℃)
・発酵反応槽通気量CO2:75(mL/min)
・膜分離槽通気量:0.3(L/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・培養液循環装置による循環液量:0.1(L/min)
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、表4に示すアクチノバシラス用コハク酸発酵培地75mLとMgCO3 4.0gを、100mL容シーラム試験管に加え、CO2でガス置換した後、加熱滅菌した。あらかじめ、凍結保存していたアクチノバシラス・サクシノジェネス(Actinobacillus succinogenes)ATCC55618の菌体懸濁液7.5mLを接種し、37℃の温度で24時間培養して種培養を調製した(前々培養)。図2に示した連続発酵装置に2Lのコハク酸発酵培地(表4)を仕込み、前々培養液75mLを植菌し、発酵反応槽1を付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を39℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、表4のコハク酸発酵培地の連続供給を行い、連続発酵装置の培養液量を2Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、水頭差制御装置6により発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、上記比較例2の結果と実施例7の結果と合わせて表6に示した。234時間の発酵試験を行った結果、図2に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることを確認することができた。
(比較例3)大腸菌(Escherichia coli)によるコハク酸製造(バッチ発酵)
12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなる種培養用培地100mLを1250mL容三角フラスコに入れ、pHを6.8に調整した。MgCO3 5gを添加した後、加熱滅菌し、室温まで冷却した後、嫌気グローブボックス内で、大腸菌B株(Escherichia coli B)ATCC11303を接種し、37℃の温度で一晩静置培養した。12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、および1g/LのNaCl、0.2g/L MgCl2からなる発酵培地1LをpH6.8に調整後、ミニジャーファメンター(ABLE社製、BMJ型、2L)に加え、加熱滅菌(120℃、20min)した。CO2ガスをスパージャーから50mL/minで通気し、温度を37℃に調整した。上記種培養100mLを接種し、付属の撹拌羽根を用いて600rpmで撹拌し、5.5M NaCO3でpHを6.8に調整しながら培養した。培養液中のグルコース濃度が、20g/Lを超えないように、100g/Lグルコース溶液200mLを少量ずつ追加しながら培養を行った。その結果を表7に示す。培養36時間でコハク酸の生成量は、3gであった。
(実施例9)大腸菌(Escherichia coli)によるコハク酸製造(その1)
比較例3と同様の微生物と発酵培地を用いて、図1に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜には、参考例1で作製した多孔性膜を用いた。この実施例9における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・使用分離膜:PVDF濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:37(℃)
・発酵反応槽CO2通気量:75(mL/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・滅菌:分離膜エレメントを含む培養槽、および使用培地は総て121℃、20minの
オートクレーブにより高圧蒸気滅菌。
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した。)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなる種培養用培地150mLを200mL容三角フラスコに入れ、pHを6.8に調整した。MgCO3 7.5gを添加した後、加熱滅菌し、室温まで冷却した後、嫌気グローブボックス内で、大腸菌B株(Escherichia coli B)ATCC11303を接種し、37℃の温度で一晩静置培養した(前々培養)。図1に示した連続発酵装置に、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなるコハク酸発酵培地1.5Lを仕込み、前々培養液150mLを植菌した。図1の発酵反応槽1付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を37℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、30g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2(pH6.8)の組成からなるコハク酸発酵培地の連続供給を行い、図1の膜分離型連続発酵装置の発酵液量を1.5Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、図1の水頭差制御装置3により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過発酵液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、比較例3の結果と合わせて表7に示した。培養180時間で、コハク酸生成量は81gであった。図1に示した膜分離型連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることが確認できた。
(実施例10)大腸菌(Escherichia coli)によるコハク酸製造(その2)
比較例3と同様の微生物と発酵培地を用いて、図2に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜には、参考例1で作製した多孔性膜を用いた。この実施例10における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・膜分離槽容量:0.5(L)
・使用分離膜:ポリフッ化ビニリデン濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:37(℃)
・発酵反応槽通気量CO2:75(mL/min)
・膜分離槽通気量:0.3(L/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・培養液循環装置による循環液量:0.1(L/min)
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
まず、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなる種培養用培地150mLを200mL容三角フラスコに入れ、pHを6.8に調整した。MgCO3 7.5gを添加した後、加熱滅菌し、室温まで冷却した後、嫌気グローブボックス内で、大腸菌B株(Escherichia coli B)ATCC11303を接種し、37℃の温度で一晩静置培養した(前々培養)。図2に示した連続発酵装置に、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなるコハク酸発酵培地2Lを仕込み、前々培養液150mLを植菌した。図2の発酵反応槽1付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を37℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、30g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2(pH6.8)の組成からなるコハク酸発酵培地の連続供給を行い、図2の連続発酵装置の培養液量を2Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、図2の水頭差制御装置3により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、比較例3の結果と実施例9の結果と合わせて表7に示した。培養150時間で、コハク酸生成量は81gであった。図2に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることが確認できた。
(実施例11)大腸菌(Escherichia coli)によるコハク酸製造(その3)
比較例3と同様の微生物と発酵培地を用いて、図1に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜には、参考例2で作製した多孔性膜を用いた。この実施例11における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・使用分離膜:PVDF濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:37(℃)
・発酵反応槽CO2通気量:75(mL/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・滅菌:分離膜エレメントを含む培養槽、および使用培地は総て121℃、20minの
オートクレーブにより高圧蒸気滅菌。
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した。)。
・生産物であるコハク酸およびグルコースは、参考例3に示した方法で測定した。
まず、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなる種培養用培地150mLを200mL容三角フラスコに入れ、pHを6.8に調整した。MgCO3 7.5gを添加した後、加熱滅菌し、室温まで冷却した後、嫌気グローブボックス内で、大腸菌B株(Escherichia coli B)ATCC11303を接種し、37℃の温度で一晩静置培養した(前々培養)。図1に示した連続発酵装置に、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなるコハク酸発酵培地1.5Lを仕込み、前々培養液150mLを植菌した。図1の発酵反応槽1付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を37℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、30g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2(pH6.8)の組成からなるコハク酸発酵培地の連続供給を行い、図1の連続発酵装置の培養液量を1.5Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、図1の水頭差制御装置3により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、比較例3の結果と合わせて表8に示した。培養150時間で、コハク酸生成量は56gであった。図1に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることが確認できた。
(実施例12)大腸菌(Escherichia coli)によるコハク酸製造(その4)
比較例3と同様の微生物と発酵培地を用いて、図2に示した連続発酵装置を用いてコハク酸の連続発酵試験を行った。また、分離膜としては参考例2で作製した多孔性膜を用いた。この実施例12における運転条件は、特に断らない限り下記のとおりである。
・発酵反応槽容量:1.5(L)
・膜分離槽容量:0.5(L)
・使用分離膜:ポリフッ化ビニリデン濾過膜
・膜分離エレメント有効濾過面積:120平方cm
・温度調整:37(℃)
・発酵反応槽通気量CO2:75(mL/min)
・膜分離槽通気量:0.3(L/min)
・発酵反応槽攪拌速度:600(rpm)
・pH調整:5.5M Na2CO3でpH6.8に調整
・培養液循環装置による循環液量:0.1(L/min)
・膜透過水量制御:発酵反応槽水頭差により流量を制御(水頭差は、2m以内で制御した)。
まず、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなる種培養用培地150mLを200mL容三角フラスコに入れ、pHを6.8に調整した。MgCO3 7.5gを添加した後、加熱滅菌し、室温まで冷却した後、嫌気グローブボックス内で、大腸菌B株(Escherichia coli B)ATCC11303を接種し、37℃の温度で一晩静置培養した(前々培養)。図2に示した連続発酵装置に、12g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2からなるコハク酸発酵培地2Lを仕込み、前々培養液150mLを植菌した。図2の発酵反応槽1付属の攪拌機5によって600rpmで攪拌し、発酵反応槽1のCO2通気量を75mL/minに調整し、温度を37℃とし、5.5M NaCO3でpHを6.8に調整しながら、24時間培養を行った(前培養)。前培養が終了後、30g/Lのグルコース、10g/Lのポリペプトン、5g/Lの酵母エキス、1g/LのK2HPO4、1g/LのNaCl、および0.2g/LのMgCl2(pH6.8)の組成からなるコハク酸発酵培地の連続供給を行い、図2の連続発酵装置の培養液量を2Lとなるように膜透過水量の制御を行いながら連続培養し、連続発酵によるコハク酸の製造を行った。連続発酵試験を行うときの膜透過水量の制御は、図2の水頭差制御装置3により、発酵反応槽水頭を最大2m以内、すなわち膜間差圧が20kPa以内となるように適宜水頭差を変化させることにより行った。適宜、膜透過濾液中の生産されたコハク酸濃度および残存グルコース濃度を測定した。また、該コハク酸およびグルコース濃度から算出されたコハク酸生産速度およびコハク酸の生成収率を、比較例3の結果と実施例9の結果と合わせて表8に示した。培養170時間で、コハク酸生成量は88gであった。図2に示した連続発酵装置を用いることにより、コハク酸の生産速度が向上し、かつ、安定したコハク酸の連続発酵生産が可能であることが確認できた。