JP5041766B2 - アントラセン誘導体、アントラセン誘導体を用いた発光素子、発光装置及び電子機器 - Google Patents
アントラセン誘導体、アントラセン誘導体を用いた発光素子、発光装置及び電子機器 Download PDFInfo
- Publication number
- JP5041766B2 JP5041766B2 JP2006231489A JP2006231489A JP5041766B2 JP 5041766 B2 JP5041766 B2 JP 5041766B2 JP 2006231489 A JP2006231489 A JP 2006231489A JP 2006231489 A JP2006231489 A JP 2006231489A JP 5041766 B2 JP5041766 B2 JP 5041766B2
- Authority
- JP
- Japan
- Prior art keywords
- light
- carbon atoms
- anthracene derivative
- layer
- electrode
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 150000001454 anthracenes Chemical class 0.000 title claims description 106
- 125000004432 carbon atom Chemical group C* 0.000 claims description 115
- 125000003118 aryl group Chemical group 0.000 claims description 76
- 239000000126 substance Substances 0.000 claims description 76
- 125000000217 alkyl group Chemical group 0.000 claims description 57
- 239000001257 hydrogen Substances 0.000 claims description 52
- 229910052739 hydrogen Inorganic materials 0.000 claims description 52
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 47
- 150000002431 hydrogen Chemical class 0.000 claims description 34
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 18
- 125000000732 arylene group Chemical group 0.000 claims description 16
- NAWXUBYGYWOOIX-SFHVURJKSA-N (2s)-2-[[4-[2-(2,4-diaminoquinazolin-6-yl)ethyl]benzoyl]amino]-4-methylidenepentanedioic acid Chemical compound C1=CC2=NC(N)=NC(N)=C2C=C1CCC1=CC=C(C(=O)N[C@@H](CC(=C)C(O)=O)C(O)=O)C=C1 NAWXUBYGYWOOIX-SFHVURJKSA-N 0.000 claims description 3
- 239000010410 layer Substances 0.000 description 217
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 75
- 239000010408 film Substances 0.000 description 69
- 239000000758 substrate Substances 0.000 description 59
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 54
- 238000000034 method Methods 0.000 description 48
- 125000001424 substituent group Chemical group 0.000 description 47
- 238000002347 injection Methods 0.000 description 38
- 239000007924 injection Substances 0.000 description 38
- 239000000243 solution Substances 0.000 description 33
- 239000000463 material Substances 0.000 description 31
- 230000015572 biosynthetic process Effects 0.000 description 29
- 238000003786 synthesis reaction Methods 0.000 description 28
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 27
- 150000001875 compounds Chemical class 0.000 description 26
- 238000005160 1H NMR spectroscopy Methods 0.000 description 24
- 230000005525 hole transport Effects 0.000 description 22
- 239000000203 mixture Substances 0.000 description 22
- 239000007787 solid Substances 0.000 description 19
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 18
- 238000006243 chemical reaction Methods 0.000 description 17
- 238000000295 emission spectrum Methods 0.000 description 17
- 229910052751 metal Inorganic materials 0.000 description 17
- 239000002184 metal Substances 0.000 description 17
- 239000000706 filtrate Substances 0.000 description 15
- 238000000862 absorption spectrum Methods 0.000 description 14
- 238000005192 partition Methods 0.000 description 14
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 13
- -1 boronic acid compound Chemical class 0.000 description 13
- 239000003054 catalyst Substances 0.000 description 13
- 239000011259 mixed solution Substances 0.000 description 13
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 12
- 239000011229 interlayer Substances 0.000 description 12
- 239000004065 semiconductor Substances 0.000 description 12
- LDFCHUHQZQRSHF-UHFFFAOYSA-N 9-(4-bromophenyl)-10-phenylanthracene Chemical compound C1=CC(Br)=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 LDFCHUHQZQRSHF-UHFFFAOYSA-N 0.000 description 11
- 238000005259 measurement Methods 0.000 description 11
- 150000002367 halogens Chemical group 0.000 description 10
- 229910003437 indium oxide Inorganic materials 0.000 description 10
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 10
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 10
- 238000007789 sealing Methods 0.000 description 10
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 10
- 238000004544 sputter deposition Methods 0.000 description 10
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 9
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- 239000002585 base Substances 0.000 description 9
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 9
- 229910052794 bromium Inorganic materials 0.000 description 9
- 230000005284 excitation Effects 0.000 description 9
- 229910052736 halogen Inorganic materials 0.000 description 9
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 9
- 235000019341 magnesium sulphate Nutrition 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 239000000565 sealant Substances 0.000 description 9
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 8
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 8
- 239000000956 alloy Substances 0.000 description 8
- 230000005281 excited state Effects 0.000 description 8
- 229910052763 palladium Inorganic materials 0.000 description 8
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 8
- 230000002194 synthesizing effect Effects 0.000 description 8
- 238000007740 vapor deposition Methods 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 7
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 7
- 229910045601 alloy Inorganic materials 0.000 description 7
- 150000001543 aryl boronic acids Chemical class 0.000 description 7
- 238000005859 coupling reaction Methods 0.000 description 7
- 238000001704 evaporation Methods 0.000 description 7
- 239000011521 glass Substances 0.000 description 7
- 239000011777 magnesium Substances 0.000 description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 7
- 229910052710 silicon Inorganic materials 0.000 description 7
- 239000010703 silicon Substances 0.000 description 7
- 239000002356 single layer Substances 0.000 description 7
- FKHIFSZMMVMEQY-UHFFFAOYSA-N talc Chemical compound [Mg+2].[O-][Si]([O-])=O FKHIFSZMMVMEQY-UHFFFAOYSA-N 0.000 description 7
- 239000010409 thin film Substances 0.000 description 7
- 0 *c(cc1)cc(c2cc(N(*)c(cc3)ccc3-c(cc3)ccc3-c(cc3)ccc3-c3c(cccc4)c4c(*)c4c3cc(*)c(*)c4)ccc22)c1[n]2-c1ccccc1 Chemical compound *c(cc1)cc(c2cc(N(*)c(cc3)ccc3-c(cc3)ccc3-c(cc3)ccc3-c3c(cccc4)c4c(*)c4c3cc(*)c(*)c4)ccc22)c1[n]2-c1ccccc1 0.000 description 6
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 238000005481 NMR spectroscopy Methods 0.000 description 6
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 6
- 239000011575 calcium Substances 0.000 description 6
- 239000004020 conductor Substances 0.000 description 6
- 230000005283 ground state Effects 0.000 description 6
- 239000012535 impurity Substances 0.000 description 6
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 6
- 229910052740 iodine Inorganic materials 0.000 description 6
- 239000011630 iodine Substances 0.000 description 6
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 6
- QGLKJKCYBOYXKC-UHFFFAOYSA-N nonaoxidotritungsten Chemical compound O=[W]1(=O)O[W](=O)(=O)O[W](=O)(=O)O1 QGLKJKCYBOYXKC-UHFFFAOYSA-N 0.000 description 6
- 239000012044 organic layer Substances 0.000 description 6
- 238000007254 oxidation reaction Methods 0.000 description 6
- 229910001930 tungsten oxide Inorganic materials 0.000 description 6
- UKSZBOKPHAQOMP-SVLSSHOZSA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 UKSZBOKPHAQOMP-SVLSSHOZSA-N 0.000 description 5
- 229940126062 Compound A Drugs 0.000 description 5
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 5
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 5
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 5
- 229910052782 aluminium Inorganic materials 0.000 description 5
- 150000001412 amines Chemical group 0.000 description 5
- 125000005577 anthracene group Chemical group 0.000 description 5
- 238000010549 co-Evaporation Methods 0.000 description 5
- 239000003086 colorant Substances 0.000 description 5
- 238000002484 cyclic voltammetry Methods 0.000 description 5
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 5
- 229910010272 inorganic material Inorganic materials 0.000 description 5
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- DZRDATNLTUIPAY-UHFFFAOYSA-N n,9-diphenylcarbazol-3-amine Chemical compound C=1C=C2N(C=3C=CC=CC=3)C3=CC=CC=C3C2=CC=1NC1=CC=CC=C1 DZRDATNLTUIPAY-UHFFFAOYSA-N 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 229910052814 silicon oxide Inorganic materials 0.000 description 5
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 5
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 5
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 4
- KUBSCXXKQGDPPD-UHFFFAOYSA-N 3-bromo-9-phenylcarbazole Chemical compound C12=CC=CC=C2C2=CC(Br)=CC=C2N1C1=CC=CC=C1 KUBSCXXKQGDPPD-UHFFFAOYSA-N 0.000 description 4
- FTAVDDVRUTUWNY-UHFFFAOYSA-N 9-[4-(4-bromophenyl)phenyl]-10-phenylanthracene Chemical compound C1=CC(Br)=CC=C1C1=CC=C(C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 FTAVDDVRUTUWNY-UHFFFAOYSA-N 0.000 description 4
- QNZJXQPLZAOZLQ-UHFFFAOYSA-N 9-iodo-10-phenylanthracene Chemical compound C12=CC=CC=C2C(I)=C2C=CC=CC2=C1C1=CC=CC=C1 QNZJXQPLZAOZLQ-UHFFFAOYSA-N 0.000 description 4
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical class CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 4
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 4
- 150000001342 alkaline earth metals Chemical class 0.000 description 4
- XJHCXCQVJFPJIK-UHFFFAOYSA-M caesium fluoride Chemical compound [F-].[Cs+] XJHCXCQVJFPJIK-UHFFFAOYSA-M 0.000 description 4
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 239000011651 chromium Substances 0.000 description 4
- JNGZXGGOCLZBFB-IVCQMTBJSA-N compound E Chemical compound N([C@@H](C)C(=O)N[C@@H]1C(N(C)C2=CC=CC=C2C(C=2C=CC=CC=2)=N1)=O)C(=O)CC1=CC(F)=CC(F)=C1 JNGZXGGOCLZBFB-IVCQMTBJSA-N 0.000 description 4
- 238000002425 crystallisation Methods 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 239000011147 inorganic material Substances 0.000 description 4
- 230000026045 iodination Effects 0.000 description 4
- 238000006192 iodination reaction Methods 0.000 description 4
- 229910052744 lithium Inorganic materials 0.000 description 4
- 229910052749 magnesium Inorganic materials 0.000 description 4
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 4
- 238000005268 plasma chemical vapour deposition Methods 0.000 description 4
- 229910052697 platinum Inorganic materials 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 239000002994 raw material Substances 0.000 description 4
- 238000006722 reduction reaction Methods 0.000 description 4
- 238000010898 silica gel chromatography Methods 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 238000001308 synthesis method Methods 0.000 description 4
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 4
- 229910052721 tungsten Inorganic materials 0.000 description 4
- 239000010937 tungsten Substances 0.000 description 4
- YVTHLONGBIQYBO-UHFFFAOYSA-N zinc indium(3+) oxygen(2-) Chemical compound [O--].[Zn++].[In+3] YVTHLONGBIQYBO-UHFFFAOYSA-N 0.000 description 4
- SPDPTFAJSFKAMT-UHFFFAOYSA-N 1-n-[4-[4-(n-[4-(3-methyl-n-(3-methylphenyl)anilino)phenyl]anilino)phenyl]phenyl]-4-n,4-n-bis(3-methylphenyl)-1-n-phenylbenzene-1,4-diamine Chemical group CC1=CC=CC(N(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=CC(=CC=2)N(C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)=C1 SPDPTFAJSFKAMT-UHFFFAOYSA-N 0.000 description 3
- ZVFQEOPUXVPSLB-UHFFFAOYSA-N 3-(4-tert-butylphenyl)-4-phenyl-5-(4-phenylphenyl)-1,2,4-triazole Chemical compound C1=CC(C(C)(C)C)=CC=C1C(N1C=2C=CC=CC=2)=NN=C1C1=CC=C(C=2C=CC=CC=2)C=C1 ZVFQEOPUXVPSLB-UHFFFAOYSA-N 0.000 description 3
- DHDHJYNTEFLIHY-UHFFFAOYSA-N 4,7-diphenyl-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=CN=C21 DHDHJYNTEFLIHY-UHFFFAOYSA-N 0.000 description 3
- WHGGVVHVBFMGSG-UHFFFAOYSA-N 9-bromo-10-phenylanthracene Chemical compound C12=CC=CC=C2C(Br)=C2C=CC=CC2=C1C1=CC=CC=C1 WHGGVVHVBFMGSG-UHFFFAOYSA-N 0.000 description 3
- LUBXLGUQZVKOFP-UHFFFAOYSA-N 9-phenylanthracene Chemical compound C1=CC=CC=C1C1=C(C=CC=C2)C2=CC2=CC=CC=C12 LUBXLGUQZVKOFP-UHFFFAOYSA-N 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 3
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical group CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- HQAGDFJHKPSZHT-UHFFFAOYSA-N [4-(4-bromophenyl)phenyl]boronic acid Chemical compound C1=CC(B(O)O)=CC=C1C1=CC=C(Br)C=C1 HQAGDFJHKPSZHT-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 229910052783 alkali metal Inorganic materials 0.000 description 3
- 229910001515 alkali metal fluoride Inorganic materials 0.000 description 3
- 150000001340 alkali metals Chemical class 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 230000008025 crystallization Effects 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 230000001747 exhibiting effect Effects 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 238000011049 filling Methods 0.000 description 3
- 238000004770 highest occupied molecular orbital Methods 0.000 description 3
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 3
- 238000004518 low pressure chemical vapour deposition Methods 0.000 description 3
- 238000004020 luminiscence type Methods 0.000 description 3
- DUJHBLBNMJIXGF-UHFFFAOYSA-N n-naphthalen-1-yl-9-phenylcarbazol-3-amine Chemical compound C=1C=CC2=CC=CC=C2C=1NC(C=C1C2=CC=CC=C22)=CC=C1N2C1=CC=CC=C1 DUJHBLBNMJIXGF-UHFFFAOYSA-N 0.000 description 3
- 229910052759 nickel Inorganic materials 0.000 description 3
- 239000012299 nitrogen atmosphere Substances 0.000 description 3
- 239000011368 organic material Substances 0.000 description 3
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 3
- 238000000206 photolithography Methods 0.000 description 3
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 3
- 235000019345 sodium thiosulphate Nutrition 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 239000012780 transparent material Substances 0.000 description 3
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 3
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 3
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- IYZMXHQDXZKNCY-UHFFFAOYSA-N 1-n,1-n-diphenyl-4-n,4-n-bis[4-(n-phenylanilino)phenyl]benzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 IYZMXHQDXZKNCY-UHFFFAOYSA-N 0.000 description 2
- RUFPHBVGCFYCNW-UHFFFAOYSA-N 1-naphthylamine Chemical compound C1=CC=C2C(N)=CC=CC2=C1 RUFPHBVGCFYCNW-UHFFFAOYSA-N 0.000 description 2
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 2
- FQJQNLKWTRGIEB-UHFFFAOYSA-N 2-(4-tert-butylphenyl)-5-[3-[5-(4-tert-butylphenyl)-1,3,4-oxadiazol-2-yl]phenyl]-1,3,4-oxadiazole Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=C(C=CC=2)C=2OC(=NN=2)C=2C=CC(=CC=2)C(C)(C)C)O1 FQJQNLKWTRGIEB-UHFFFAOYSA-N 0.000 description 2
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 2
- 229910004261 CaF 2 Inorganic materials 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 2
- 229910052581 Si3N4 Inorganic materials 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 229960000583 acetic acid Drugs 0.000 description 2
- 229910001618 alkaline earth metal fluoride Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 150000004982 aromatic amines Chemical class 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 2
- 230000031709 bromination Effects 0.000 description 2
- 238000005893 bromination reaction Methods 0.000 description 2
- 229910052792 caesium Inorganic materials 0.000 description 2
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- XCJYREBRNVKWGJ-UHFFFAOYSA-N copper(II) phthalocyanine Chemical compound [Cu+2].C12=CC=CC=C2C(N=C2[N-]C(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2[N-]1 XCJYREBRNVKWGJ-UHFFFAOYSA-N 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 239000002274 desiccant Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000005530 etching Methods 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000012362 glacial acetic acid Substances 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 238000009413 insulation Methods 0.000 description 2
- 239000000395 magnesium oxide Substances 0.000 description 2
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 2
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 2
- 229910052750 molybdenum Inorganic materials 0.000 description 2
- 239000011733 molybdenum Substances 0.000 description 2
- JKQOBWVOAYFWKG-UHFFFAOYSA-N molybdenum trioxide Chemical compound O=[Mo](=O)=O JKQOBWVOAYFWKG-UHFFFAOYSA-N 0.000 description 2
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 2
- 125000000962 organic group Chemical group 0.000 description 2
- YRZZLAGRKZIJJI-UHFFFAOYSA-N oxyvanadium phthalocyanine Chemical compound [V+2]=O.C12=CC=CC=C2C(N=C2[N-]C(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2[N-]1 YRZZLAGRKZIJJI-UHFFFAOYSA-N 0.000 description 2
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 239000003870 refractory metal Substances 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- HQVNEWCFYHHQES-UHFFFAOYSA-N silicon nitride Chemical compound N12[Si]34N5[Si]62N3[Si]51N64 HQVNEWCFYHHQES-UHFFFAOYSA-N 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- XOLBLPGZBRYERU-UHFFFAOYSA-N tin dioxide Chemical compound O=[Sn]=O XOLBLPGZBRYERU-UHFFFAOYSA-N 0.000 description 2
- 229910001887 tin oxide Inorganic materials 0.000 description 2
- TVIVIEFSHFOWTE-UHFFFAOYSA-K tri(quinolin-8-yloxy)alumane Chemical compound [Al+3].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 TVIVIEFSHFOWTE-UHFFFAOYSA-K 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- 239000011787 zinc oxide Substances 0.000 description 2
- QBLFZIBJXUQVRF-UHFFFAOYSA-N (4-bromophenyl)boronic acid Chemical compound OB(O)C1=CC=C(Br)C=C1 QBLFZIBJXUQVRF-UHFFFAOYSA-N 0.000 description 1
- OURODNXVJUWPMZ-UHFFFAOYSA-N 1,2-diphenylanthracene Chemical compound C1=CC=CC=C1C1=CC=C(C=C2C(C=CC=C2)=C2)C2=C1C1=CC=CC=C1 OURODNXVJUWPMZ-UHFFFAOYSA-N 0.000 description 1
- HQJQYILBCQPYBI-UHFFFAOYSA-N 1-bromo-4-(4-bromophenyl)benzene Chemical group C1=CC(Br)=CC=C1C1=CC=C(Br)C=C1 HQJQYILBCQPYBI-UHFFFAOYSA-N 0.000 description 1
- OBMPIWRNYHXYBC-UHFFFAOYSA-N 1-n,1-n,3-n,3-n,5-n,5-n-hexakis(3-methylphenyl)benzene-1,3,5-triamine Chemical compound CC1=CC=CC(N(C=2C=C(C)C=CC=2)C=2C=C(C=C(C=2)N(C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)N(C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)=C1 OBMPIWRNYHXYBC-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- UOCMXZLNHQBBOS-UHFFFAOYSA-N 2-(1,3-benzoxazol-2-yl)phenol zinc Chemical compound [Zn].Oc1ccccc1-c1nc2ccccc2o1.Oc1ccccc1-c1nc2ccccc2o1 UOCMXZLNHQBBOS-UHFFFAOYSA-N 0.000 description 1
- RKVIAZWOECXCCM-UHFFFAOYSA-N 2-carbazol-9-yl-n,n-diphenylaniline Chemical compound C1=CC=CC=C1N(C=1C(=CC=CC=1)N1C2=CC=CC=C2C2=CC=CC=C21)C1=CC=CC=C1 RKVIAZWOECXCCM-UHFFFAOYSA-N 0.000 description 1
- HONWGFNQCPRRFM-UHFFFAOYSA-N 2-n-(3-methylphenyl)-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C(=CC=CC=2)N(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 HONWGFNQCPRRFM-UHFFFAOYSA-N 0.000 description 1
- OBAJPWYDYFEBTF-UHFFFAOYSA-N 2-tert-butyl-9,10-dinaphthalen-2-ylanthracene Chemical compound C1=CC=CC2=CC(C3=C4C=CC=CC4=C(C=4C=C5C=CC=CC5=CC=4)C4=CC=C(C=C43)C(C)(C)C)=CC=C21 OBAJPWYDYFEBTF-UHFFFAOYSA-N 0.000 description 1
- PZLZJGZGJHZQAU-UHFFFAOYSA-N 3-(4-tert-butylphenyl)-4-(4-ethylphenyl)-5-(4-phenylphenyl)-1,2,4-triazole Chemical compound C1=CC(CC)=CC=C1N1C(C=2C=CC(=CC=2)C(C)(C)C)=NN=C1C1=CC=C(C=2C=CC=CC=2)C=C1 PZLZJGZGJHZQAU-UHFFFAOYSA-N 0.000 description 1
- PJUAIXDOXUXBDR-UHFFFAOYSA-N 3-iodo-9-phenylcarbazole Chemical compound C12=CC=CC=C2C2=CC(I)=CC=C2N1C1=CC=CC=C1 PJUAIXDOXUXBDR-UHFFFAOYSA-N 0.000 description 1
- OGGKVJMNFFSDEV-UHFFFAOYSA-N 3-methyl-n-[4-[4-(n-(3-methylphenyl)anilino)phenyl]phenyl]-n-phenylaniline Chemical group CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 1
- AWXGSYPUMWKTBR-UHFFFAOYSA-N 4-carbazol-9-yl-n,n-bis(4-carbazol-9-ylphenyl)aniline Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(N(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 AWXGSYPUMWKTBR-UHFFFAOYSA-N 0.000 description 1
- ZIRVQSRSPDUEOJ-UHFFFAOYSA-N 9-bromoanthracene Chemical compound C1=CC=C2C(Br)=C(C=CC=C3)C3=CC2=C1 ZIRVQSRSPDUEOJ-UHFFFAOYSA-N 0.000 description 1
- VIJYEGDOKCKUOL-UHFFFAOYSA-N 9-phenylcarbazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2C2=CC=CC=C21 VIJYEGDOKCKUOL-UHFFFAOYSA-N 0.000 description 1
- ATHMNHLNWVLWCP-UHFFFAOYSA-N C1C=CC([n]2c(ccc(NC3C=CC=CC3)c3)c3c3ccccc23)=CC1 Chemical compound C1C=CC([n]2c(ccc(NC3C=CC=CC3)c3)c3c3ccccc23)=CC1 ATHMNHLNWVLWCP-UHFFFAOYSA-N 0.000 description 1
- ODINCKMPIJJUCX-UHFFFAOYSA-N Calcium oxide Chemical compound [Ca]=O ODINCKMPIJJUCX-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- 101000837344 Homo sapiens T-cell leukemia translocation-altered gene protein Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 1
- PHXQIAWFIIMOKG-UHFFFAOYSA-N NClO Chemical compound NClO PHXQIAWFIIMOKG-UHFFFAOYSA-N 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241000555745 Sciuridae Species 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- 102100028692 T-cell leukemia translocation-altered gene protein Human genes 0.000 description 1
- 229910008484 TiSi Inorganic materials 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- NRTOMJZYCJJWKI-UHFFFAOYSA-N Titanium nitride Chemical compound [Ti]#N NRTOMJZYCJJWKI-UHFFFAOYSA-N 0.000 description 1
- 229910052769 Ytterbium Inorganic materials 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- XHCLAFWTIXFWPH-UHFFFAOYSA-N [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] XHCLAFWTIXFWPH-UHFFFAOYSA-N 0.000 description 1
- QXCPKOVYHBLWCU-UHFFFAOYSA-N [O-2].[Ti+4].[Sn+2]=O.[In+3] Chemical compound [O-2].[Ti+4].[Sn+2]=O.[In+3] QXCPKOVYHBLWCU-UHFFFAOYSA-N 0.000 description 1
- UGACIEPFGXRWCH-UHFFFAOYSA-N [Si].[Ti] Chemical compound [Si].[Ti] UGACIEPFGXRWCH-UHFFFAOYSA-N 0.000 description 1
- FZEYVTFCMJSGMP-UHFFFAOYSA-N acridone Chemical class C1=CC=C2C(=O)C3=CC=CC=C3NC2=C1 FZEYVTFCMJSGMP-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 229910000272 alkali metal oxide Inorganic materials 0.000 description 1
- 229910000287 alkaline earth metal oxide Inorganic materials 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- CFJRGWXELQQLSA-UHFFFAOYSA-N azanylidyneniobium Chemical compound [Nb]#N CFJRGWXELQQLSA-UHFFFAOYSA-N 0.000 description 1
- GQVWHWAWLPCBHB-UHFFFAOYSA-L beryllium;benzo[h]quinolin-10-olate Chemical compound [Be+2].C1=CC=NC2=C3C([O-])=CC=CC3=CC=C21.C1=CC=NC2=C3C([O-])=CC=CC3=CC=C21 GQVWHWAWLPCBHB-UHFFFAOYSA-L 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000000319 biphenyl-4-yl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- UFVXQDWNSAGPHN-UHFFFAOYSA-K bis[(2-methylquinolin-8-yl)oxy]-(4-phenylphenoxy)alumane Chemical compound [Al+3].C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC([O-])=CC=C1C1=CC=CC=C1 UFVXQDWNSAGPHN-UHFFFAOYSA-K 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- XZCJVWCMJYNSQO-UHFFFAOYSA-N butyl pbd Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=CC(=CC=2)C=2C=CC=CC=2)O1 XZCJVWCMJYNSQO-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- WUKWITHWXAAZEY-UHFFFAOYSA-L calcium difluoride Chemical compound [F-].[F-].[Ca+2] WUKWITHWXAAZEY-UHFFFAOYSA-L 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 238000010281 constant-current constant-voltage charging Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 150000001893 coumarin derivatives Chemical class 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- SPWVRYZQLGQKGK-UHFFFAOYSA-N dichloromethane;hexane Chemical compound ClCCl.CCCCCC SPWVRYZQLGQKGK-UHFFFAOYSA-N 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- XUCJHNOBJLKZNU-UHFFFAOYSA-M dilithium;hydroxide Chemical compound [Li+].[Li+].[OH-] XUCJHNOBJLKZNU-UHFFFAOYSA-M 0.000 description 1
- FZFYOUJTOSBFPQ-UHFFFAOYSA-M dipotassium;hydroxide Chemical compound [OH-].[K+].[K+] FZFYOUJTOSBFPQ-UHFFFAOYSA-M 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 150000004673 fluoride salts Chemical class 0.000 description 1
- 238000005247 gettering Methods 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 238000009815 homocoupling reaction Methods 0.000 description 1
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 1
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 150000002497 iodine compounds Chemical class 0.000 description 1
- 239000005001 laminate film Substances 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 238000005499 laser crystallization Methods 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 229910000476 molybdenum oxide Inorganic materials 0.000 description 1
- SDVOZSYGHFDAKX-UHFFFAOYSA-N n,4-diphenyl-n-[4-[4-(n-(4-phenylphenyl)anilino)phenyl]phenyl]aniline Chemical group C1=CC=CC=C1N(C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C=1C=CC=CC=1)C1=CC=C(C=2C=CC=CC=2)C=C1 SDVOZSYGHFDAKX-UHFFFAOYSA-N 0.000 description 1
- LNFOMBWFZZDRKO-UHFFFAOYSA-N n,9-diphenyl-n-[4-[4-(10-phenylanthracen-9-yl)phenyl]phenyl]carbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 LNFOMBWFZZDRKO-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- HMXVKTQPEQLPOS-UHFFFAOYSA-N n-naphthalen-1-yl-9-phenyl-n-[4-(10-phenylanthracen-9-yl)phenyl]carbazol-3-amine Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(N(C=2C=C3C4=CC=CC=C4N(C=4C=CC=CC=4)C3=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 HMXVKTQPEQLPOS-UHFFFAOYSA-N 0.000 description 1
- 150000004767 nitrides Chemical class 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 150000004866 oxadiazoles Chemical class 0.000 description 1
- 150000007978 oxazole derivatives Chemical class 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 230000033116 oxidation-reduction process Effects 0.000 description 1
- PQQKPALAQIIWST-UHFFFAOYSA-N oxomolybdenum Chemical compound [Mo]=O PQQKPALAQIIWST-UHFFFAOYSA-N 0.000 description 1
- DYIZHKNUQPHNJY-UHFFFAOYSA-N oxorhenium Chemical compound [Re]=O DYIZHKNUQPHNJY-UHFFFAOYSA-N 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 150000002987 phenanthrenes Chemical class 0.000 description 1
- 150000005041 phenanthrolines Chemical class 0.000 description 1
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N phenylbenzene Natural products C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- 230000001699 photocatalysis Effects 0.000 description 1
- 229920000172 poly(styrenesulfonic acid) Polymers 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 150000003220 pyrenes Chemical class 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 150000007660 quinolones Chemical class 0.000 description 1
- 229910052761 rare earth metal Inorganic materials 0.000 description 1
- 150000002910 rare earth metals Chemical class 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 238000006479 redox reaction Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 229910003449 rhenium oxide Inorganic materials 0.000 description 1
- 229910001925 ruthenium oxide Inorganic materials 0.000 description 1
- WOCIAKWEIIZHES-UHFFFAOYSA-N ruthenium(iv) oxide Chemical compound O=[Ru]=O WOCIAKWEIIZHES-UHFFFAOYSA-N 0.000 description 1
- 239000003566 sealing material Substances 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 229910021332 silicide Inorganic materials 0.000 description 1
- FVBUAEGBCNSCDD-UHFFFAOYSA-N silicide(4-) Chemical compound [Si-4] FVBUAEGBCNSCDD-UHFFFAOYSA-N 0.000 description 1
- 239000010944 silver (metal) Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- KKCBUQHMOMHUOY-UHFFFAOYSA-N sodium oxide Chemical compound [O-2].[Na+].[Na+] KKCBUQHMOMHUOY-UHFFFAOYSA-N 0.000 description 1
- 238000003980 solgel method Methods 0.000 description 1
- 230000005236 sound signal Effects 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- 239000003115 supporting electrolyte Substances 0.000 description 1
- 229910052715 tantalum Inorganic materials 0.000 description 1
- GUVRBAGPIYLISA-UHFFFAOYSA-N tantalum atom Chemical compound [Ta] GUVRBAGPIYLISA-UHFFFAOYSA-N 0.000 description 1
- MZLGASXMSKOWSE-UHFFFAOYSA-N tantalum nitride Chemical compound [Ta]#N MZLGASXMSKOWSE-UHFFFAOYSA-N 0.000 description 1
- 239000013076 target substance Substances 0.000 description 1
- JBQYATWDVHIOAR-UHFFFAOYSA-N tellanylidenegermanium Chemical compound [Te]=[Ge] JBQYATWDVHIOAR-UHFFFAOYSA-N 0.000 description 1
- KBLZDCFTQSIIOH-UHFFFAOYSA-M tetrabutylazanium;perchlorate Chemical compound [O-]Cl(=O)(=O)=O.CCCC[N+](CCCC)(CCCC)CCCC KBLZDCFTQSIIOH-UHFFFAOYSA-M 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- WRECIMRULFAWHA-UHFFFAOYSA-N trimethyl borate Chemical compound COB(OC)OC WRECIMRULFAWHA-UHFFFAOYSA-N 0.000 description 1
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 1
- WQJQOUPTWCFRMM-UHFFFAOYSA-N tungsten disilicide Chemical compound [Si]#[W]#[Si] WQJQOUPTWCFRMM-UHFFFAOYSA-N 0.000 description 1
- 229910021342 tungsten silicide Inorganic materials 0.000 description 1
- 238000007738 vacuum evaporation Methods 0.000 description 1
- 229910001935 vanadium oxide Inorganic materials 0.000 description 1
- NAWDYIZEMPQZHO-UHFFFAOYSA-N ytterbium Chemical compound [Yb] NAWDYIZEMPQZHO-UHFFFAOYSA-N 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- GWDUZCIBPDVBJM-UHFFFAOYSA-L zinc;2-(2-hydroxyphenyl)-3h-1,3-benzothiazole-2-carboxylate Chemical compound [Zn+2].OC1=CC=CC=C1C1(C([O-])=O)SC2=CC=CC=C2N1.OC1=CC=CC=C1C1(C([O-])=O)SC2=CC=CC=C2N1 GWDUZCIBPDVBJM-UHFFFAOYSA-L 0.000 description 1
Images
Landscapes
- Indole Compounds (AREA)
- Electroluminescent Light Sources (AREA)
Description
本実施の形態では、本発明のアントラセン誘導体について説明する。
本実施の形態では、本発明のアントラセン誘導体を用いた発光素子について説明する。
本実施の形態では、本発明のアントラセン誘導体をホスト(発光物質と共に発光層に含ませ、発光物質を分散状態にするための物質)として用いた発光素子について、図2を用いて説明する。なお、発光層213以外は実施の形態2と同じ構造であるので、説明は省略する。
本実施の形態では、本発明の発光装置(EL発光装置)の一例について、図3、及び図4を用いて作製方法とともに説明する。なお、本実施の形態では、同一基板上に画素部と駆動回路部とが形成されたアクティブマトリクス型の発光装置の例について説明するが、本発明はこれに限らず、パッシブ型の発光装置に適用しても構わない。
本実施の形態では、本発明の発光装置(EL発光装置)にFPCや、駆動用の駆動ICを実装する例について、図6を用いて説明する。なお、この発光表示パネルに搭載されている発光素子の有する構成は、実施の形態2又は3に示したような構成である。
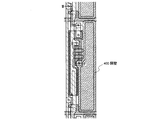
本実施の形態では、パッシブ型の発光装置の例について、図7を用いて説明する。図7(a)、(b)は、それぞれ、本発明を適用したパッシブ型の発光装置の斜視図と上面図である。特に、図7(a)は、図7(b)の点線758で囲まれた部分について斜視した図である。図7(a)、(b)のそれぞれにおいて、対応するものは同一の符号を用いて表している。図7(a)において、基板751上には、複数の第1の電極752が並列に設けられている。第1の電極752それぞれの端部は、隔壁層753で覆われている。なお、図7(a)では、第1の基板751上に設けられた第1の電極752と隔壁層753とが配置されている様子を分かり易くする為に最も手前に位置している第1の電極752を覆う隔壁層については図示していないが、実際には最も手前に位置している第1の電極752においても隔壁層によって端部は覆われている。第1の電極752の上方には複数の第2の電極755が、第1の電極752と交差するように並列に設けられている。第1の電極752と第2の電極755との間には層754が設けられている。なお、層754は、実施の形態2、又は実施の形態3において説明したような本発明のアントラセン誘導体を有する発光層が含まれている。また、層754には発光層の他、正孔注入層、正孔輸送層、電子輸送層、電子注入層等が含まれていてもかまわない。第2の電極755の上には第2の基板759が設けられている。
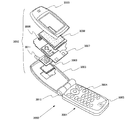
本発明の発光装置、及び電子機器として、ビデオカメラ、デジタルカメラ、ゴーグル型ディスプレイ(ヘッドマウントディスプレイ)、ナビゲーションシステム、音響再生装置(カーオーディオ、オーディオコンポ等)、ノート型パーソナルコンピュータ、ゲーム機器、携帯情報端末(モバイルコンピュータ、携帯電話、携帯型ゲーム機又は電子書籍等)、記録媒体を備えた画像再生装置(具体的にはDigital Versatile Disc(DVD)等の記録媒体を再生し、その画像を表示しうるディスプレイを備えた装置)などが挙げられる。それら電子機器の具体例を図8及び図9に示す。
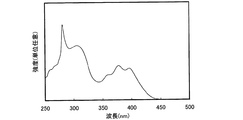
本発明のアントラセン誘導体の一例として構造式(17)で表される化合物、9−フェニル−10−[(4−[N−フェニル]−4−[3−(9−フェニルカルバゾリル)])アミノ]アントラセン(略称:PCAPA)の合成方法について説明する。
(1)9−フェニルアントラセンの合成。
9−ブロモアントラセン5.4g(21.1mmol)、フェニルボロン酸2.6g(21.1mmol)、酢酸パラジウム(II)(略称:Pd(OAc)2)60mg(0.21mmol)、炭酸カリウム水溶液(2mol/L)10mL(20mmol)、トリス(オルトートリル)ホスフィン(略称:P(o−tolyl)3)263mg(0.84mmol)、1,2−ジメトキシエタン(略称:DME)20mLを200mL三口フラスコに入れ、窒素気流下で、80℃、9時間撹拌した。反応後、析出した固体を吸引ろ過で回収してから、トルエンに溶かしフロリジル、セライト、アルミナを通してろ過をした。ろ液を水、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥した。混合溶液を自然ろ過し、ろ液を濃縮したところ目的物である9−フェニルアントラセンの淡褐色固体を21.5g、収率85%で得た(合成スキーム(b―1))。
9−フェニルアントラセン6.0g(23.7mmol)を四塩化炭素80mLに溶かし、その反応溶液へ滴下ロートより、臭素3.80g(21.1mmol)を四塩化炭素10mLに溶かした溶液を滴下した。滴下終了後、室温で1時間撹拌した。反応後、チオ硫酸ナトリウム水溶液を加えて撹拌してから、有機層を水酸化ナトリウム水溶液、飽和食塩水で洗浄し、硫酸マグネシウムで乾燥した。混合溶液を自然ろ過し、ろ液を濃縮しトルエンに溶かしフロリジル、セライト、アルミナを通してろ過を行なった。ろ液を濃縮し、ジクロロメタン、ヘキサンの混合溶液により再結晶を行なったところ、目的物である9−ブロモ−10−フェニルアントラセンの淡黄色固体を7.0g、収率89%で得た。(合成スキーム(b―2))。
9−ブロモ−10−フェニルアントラセン3.33g(10mmol)をテトラヒドロフラン(略称:THF)80mLに溶かし、−78℃にしてから、その反応溶液へ滴下ロートより、n−ブチルリチウム(略称:n−BuLi)(1.6mol/L ヘキサン溶液)7.5mL(12.0mmol)を滴下し、1時間撹拌した。ヨウ素5g(20.0mmol)をTHF20mLに溶かした溶液を滴下し、−78℃でさらに2時間撹拌した。反応後、チオ硫酸ナトリウム水溶液を加えて撹拌してから、有機層をチオ硫酸ナトリウム水溶液、飽和食塩水で洗浄し、硫酸マグネシウムで乾燥した。混合溶液を自然ろ過し、ろ液を濃縮し、得られた固体をエタノールにより再結晶したところ目的物である9−ヨード−10−フェニルアントラセンの淡黄色固体を3.1g、収率83%で得た(合成スキーム(b―3))。
9−ヨード−10−フェニルアントラセン1.0g(2.63mmol)、p−ブロモフェニルボロン酸542mg(2.70mmol)、テトラキス(トリフェニルホスフィン)パラジウム(0)(略称:Pd(PPh3)4)46mg(0.03mmol)、炭酸カリウム水溶液(2mol/L)3mL(6mmol)、トルエン10mLの混合物を80℃、9時間撹拌した。反応後、トルエンを加えてからフロリジル、セライト、アルミナを通してろ過をした。ろ液を水、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥した。混合溶液を自然ろ過し、ろ液を濃縮し、得られた固体をクロロホルム、ヘキサンの混合溶液により再結晶したところ目的物である9−フェニル−10−(4−ブロモフェニル)アントラセン(PA)の淡褐色固体を562mg、収率45%で得た(合成スキーム(b―4))。
(1)3−ブロモ−9−フェニルカルバゾールの合成。
N−フェニルカルバゾール24.3g(100mmol)を氷酢酸600mLに溶かし、N−ブロモコハク酸イミド17.8g(100mmol)をゆっくり加え、室温で約12時間撹拌した。この氷酢酸溶液を氷水1Lに撹拌しながら滴下した。析出した白色固体を水で3回洗浄した。この固体をジエチルエーテル150mLに溶解し、飽和炭酸水素ナトリウム水溶液、水で洗浄した。この有機層を硫酸マグネシウムで乾燥させた。混合溶液をろ過し、得られたろ液を濃縮した。得られた残渣をメタノールにより再結晶したところ、目的物である3−ブロモ−9−フェニルカルバゾールの白色粉末を28.4g、収率88%で得た(合成スキーム(c―1))。
500mL三口フラスコに、3−ブロモ−9−フェニルカルバゾール19g(60mmol)、ビス(ジベンジリデンアセトン)パラジウム(0)(略称:Pd(dba)2)340mg(0.6mmol)、1,1−ビス(ジフェニルホスフィノ)フェロセン(略称:DPPF)1.6g(3.0mmol)、t−ブトキシナトリウム(略称:t−BuONa)13g(180mmol)を入れ、窒素置換してから、脱水キシレン110mL、アニリン7.0g(75mmol)を加え、90℃で7.5時間加熱撹拌した。反応終了後、反応溶液に50℃に温めたトルエンを約500mL加え、これをフロリジル、アルミナ、セライトを通してろ過した。ろ液を濃縮し、得られた固体をヘキサン、酢酸エチルの混合溶液により再結晶したところ、目的物である3−(N−フェニルアミノ)−9−フェニルカルバゾール(PCA)の淡黄色の粉末状固体を15g、収率75%で得た(合成スキーム(c−2))。
1H−NMR(300MHz、CDCl3);δ=6.84(t、J=6.9、1H)、6.97(d、J=7.8、2H)、7.20−7.61(m、13H)、7.90(s、1H)、8.04(d、J=7.8、1H)
1H−NMR(300MHz、DMSO−d6);δ=6.73(t、J=7.5、1H)、7.02(d、J=8.1、2H)、7.16−7.70(m、12H)、7.95(s、1H)、8.06(s、1H)、8.17(d、J=7.8、1H)
13C−NMR(75.5MHz、DMSO−d6):δ=109.55、110.30、110.49、114.71、118.22、119.70、120.14、120.61、122.58、123.35、126.18、126.48、127.37、129.15、130.14、135.71、136.27、137.11、140.41、145.61
100mL三口フラスコに、9−フェニル−10−(4−ブロモフェニル)アントラセン(PA)409mg(1.0mmol)、3−(N−フェニルアミノ)−9−フェニルカルバゾール(PCA)339mg(1.0mmol)、Pd(dba)26mg(0.01mmol)、t−ブトキシナトリウム(略称:t−BuONa)500mg(5.2mol)、トリ(t−ブチル)ホスフィン(10wt% ヘキサン溶液)(略称:P(tBu)3)0.1mL、トルエン10mLを入れ、80℃で4時間撹拌した。反応後、溶液を水で洗浄し、水層をトルエンで抽出し、有機層と併せて飽和食塩水で洗浄後、硫酸マグネシウムで乾燥した。混合溶液を自然ろ過し、濃縮し得られた油状物をシリカゲルカラムクロマトグラフィー(ヘキサン:トルエン=7:3)により精製し、ジクロロメタン、ヘキサンの混合溶液により再結晶したところ目的物の黄色粉末状固体を534mg、収率81%で得た(合成スキーム(d―1))。この化合物を、核磁気共鳴法(NMR)によって測定し、9−フェニル−10−[(4−[N−フェニル]−4−[3−(9−フェニルカルバゾリル)])アミノ]アントラセン(PCAPA)であることを確認した。
1H−NMR(300MHz、CDCl3);δ=8.11−8.08(m、2H)、7.91−7.88(m、2H)、7.70−7.67(m、2H)、7.63−7.30(m、28H)
本発明のアントラセン誘導体の一例として構造式(20)で表される化合物、9−フェニル−10−{4’−[N−フェニル−N−(9−フェニルカルバゾール−3−イル)アミノ]ビフェニル−4−イル}アントラセン(略称:PCAPBA)の合成方法について説明する。
(1)4−(4−ブロモフェニル)フェニルボロン酸の合成。
4,4’−ジブロモビフェニル10.0g(0.032mol)を500mL三口フラスコに入れ窒素置換してから、テトラヒドロフラン200mLを加えて−80℃で攪拌した。反応溶液へn−ブチルリチウム (1.60M ヘキサン溶液)を20mL(0.032mol)を滴下し、−80℃のまま1時間攪拌してから、ホウ酸トリメチル40mL(0.060mol)を加え、室温に戻しながら1時間攪拌した。反応溶液へ塩化水素水(1.0mol/L)200mLを加えて約12時間攪拌した後、有機層を飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄し、硫酸マグネシウムで乾燥した。反応溶液を自然濾過後、濃縮して得られた固体を酢酸エチル、ヘキサンの混合溶液により再結晶したところ、目的物である4−(4−ブロモフェニル)フェニルボロン酸の白色固体を、3.7g、収率41%で得た(合成スキーム(e―1))。
9−ヨード−10−フェニルアントラセン1.0g(2.63mmol)、4−(4−ブロモフェニル)フェニルボロン酸542mg(2.70mmol)、テトラキス(トリフェニルホスフィン)パラジウム(0)46mg(0.03mmol)、炭酸カリウム水溶液(2.0mol/L)3mL(6mmol)、トルエン10mLを80℃、9時間撹拌した。反応後、トルエンを加えてからフロリジル、セライト、アルミナを通してろ過をした。ろ液を水、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥した。自然ろ過後、ろ液を濃縮し、クロロホルム、ヘキサンの混合溶液により再結晶したところ目的物である9−[4−(4−ブロモフェニル)フェニル]−10−フェニルアントラセン(PBA)の淡褐色固体を562mg、収率45%で得た(合成スキーム(e―2))。
9−[4−(4−ブロモフェニル)フェニル]−10−フェニルアントラセン(PBA)730mg(1.5mmol)、3−(N−フェニルアミノ)−9−フェニルカルバゾール(PCA)500mg(1.5mmol)、ビス(ジベンジリデンアセトン)パラジウム(0)58mg(0.1mmol)、トリ(t−ブチル)ホスフィン(10wt% ヘキサン溶液)1mL(0.5mmol)、t−ブトキシナトリウム(t−BuONa)400mg(4.0mmol)の混合物に脱水キシレン15mLを加えた。これを窒素雰囲気下で110℃、5.5時間加熱撹拌した。反応終了後、この懸濁液にトルエン約200mLを加え、これをフロリジル、セライトを通して濾過した。得られたろ液を濃縮し、再結晶を行い、目的物である9−フェニル−10−{4’−[N−フェニル−N−(9−フェニルカルバゾール−3−イル)アミノ]ビフェニル−4−イル}アントラセン(略称:PCAPBA)の淡黄色粉末状固体を得た。さらに、再結晶のろ液を濃縮して得た混合物をシリカゲルカラムクロマトグラフィー(トルエン:ヘキサン=1:1)にて精製した。得られた化合物をヘキサンにより再結晶を行ったところ、目的物であるPCAPBAの淡黄色粉末状固体を得た。最初に得た目的物と合わせて700mgのPCAPBAを得て、収率は63%であった(合成スキーム(f−1))。この化合物を、核磁気共鳴法(NMR)によって測定し、9−フェニル−10−{4’−[N−フェニル−N−(9−フェニルカルバゾール−3−イル)アミノ]ビフェニル−4−イル}アントラセンであることを確認した。
1H−NMR(300MHz、CDCl3);δ=8.51−8.00(m、2H)、7.83−7.78(m、4H)、7.72−7.48(m、16H)、7.41−7.23(m、16H)
本発明のアントラセン誘導体の一例として、構造式(30)で表される化合物、9−{4−[N−(1−ナフチル)−N−(9−フェニルカルバゾール−3−イル)アミノ]フェニル}−10−フェニルアントラセン(略称:PCNPA)の合成方法について説明する。
窒素下で、3−ヨード−9−フェニルカルバゾール3.7g(10mmol)、1−アミノナフタレン1.6g(5 mmol)、ビス(ジベンジリデンアセトン)パラジウム(0)60mg(0.1mmol)、トリ(t−ブチル)ホスフィン(49wt% ヘキサン溶液)200μL(0.5mmol)、t−ブトキシナトリウム(略称:t−BuONa)3g(30mmol)の混合物に、脱水キシレン12mLを加えた。これを窒素雰囲気下にて90℃、7時間加熱撹拌した。反応終了後、この懸濁液に温めたトルエン約200mLを加え、これをフロリジル、アルミナ、セライトを通して濾過した。得られたろ液を濃縮し、この残渣をシリカゲルカラムクロマトグラフィー(トルエン:ヘキサン=1:1)にて分取した。得られた固体を酢酸エチル、ヘキサンの混合溶液で再結晶を行い、目的物である3−[N−(1−ナフチル)アミノ]−9−フェニルカルバゾール(PCN)のクリーム色粉末を1.5g、収率79%で得た(合成スキーム(g−1))。
1H−NMR(300MHz、DMSO−d6);δ=7.13−7.71(m、15H)、7.85−7.88(m、1H)、8.03(s、1H)、8.15(d、J=7.8、1H)、8.24(s、1H)、8.36−8.39(m、1H)
9−フェニル−10−(4−ブロモフェニル)アントラセン(PA)2.0g(5.0mmol)、3−[N−(1−ナフチル)アミノ]−9−フェニルカルバゾール(PCN)1.9g(5.0mmol)、t−ブトキシナトリウム(略称:t−BuONa)2.1g(20mmol)を100mL三口フラスコへ入れ、窒素置換した後、トルエン40mL、トリ(t−ブチル)ホスフィン(10wt% ヘキサン溶液)(略称:P(tBu)3)0.1mLを加えて減圧脱気した。脱気後、ビス(ジベンジリデンアセトン)パラジウム(0)30mg(0.05mmol)を加えてから、80℃で3時間撹拌した。反応後、反応溶液を、水、飽和食塩水の順に洗浄し、有機層を硫酸マグネシウムにより乾燥した。自然濾過後、ろ液を濃縮して得られた固体をシリカゲルカラムクロマトグラフィー(ヘキサン:トルエン=7:3)により精製し、目的物をジクロロメタンヘキサンにより再結晶したところ、目的物の黄色固体を1.5g、収率43%で得た(合成スキーム(g−2))。この化合物を、核磁気共鳴法(NMR)によって測定し、PCNPAであることを確認した。
1H−NMR(300MHz,CDCl3);δ=7.13(d、J=8.7Hz、2H)、7.21−7.23(m、1H)、7.30−7.69(m、26H)、7.80−7.83(m、1H)、7.87−7.96(m、3H)、8.04(d、J=7.5Hz,1H)、8.09(d、J=2.4Hz,1H)、8.28−8.31(m、1H)
102 第2の電極
111 正孔注入層
112 正孔輸送層
113 発光層
114 電子輸送層
115 電子注入層
201 第1の電極
202 第2の電極
211 正孔注入層
212 正孔輸送層
213 発光層
214 電子輸送層
215 電子注入層
300 基板
301 下地絶縁膜
302 ゲート絶縁膜
310 トランジスタ
320 トランジスタ
330 トランジスタ
340 トランジスタ
350 発光素子
351 第1の電極
352 層
353 第2の電極
360 隔壁層
370 シール材
380 封止基板
390 端子部
391 端子電極
392 異方性導電層
393 FPC
500 カソード側電源線
510 トランジスタ
520 トランジスタ
751 基板
752 第1の電極
753 隔壁層
754 層
755 第2の電極
756 第1の駆動回路
757 第2の駆動回路
758 点線
759 基板
2101 本体
2102 表示部
2104 操作キー
2106 シャッター
2201 本体
2202 筐体
2203 表示部
2204 キーボード
2205 外部接続ポート
2206 ポインティングマウス
2301 本体
2302 筐体
2303 表示部A
2304 表示部B
2305 記録媒体(DVD等)読み込み部
2306 操作キー
2307 スピーカー部
2401 筐体
2402 支持台
2403 表示部
2404 スピーカ
2405 ビデオ入力端子
3000 携帯電話機
3001 本体(a)
3002 本体(b)
3003 筐体
3004 操作スイッチ類
3005 マイクロフォン
3006 スピーカ
3007 回路基板
3008 表示パネル(a)
3009 表示パネル(b)
3010 蝶番
3011 アンテナ
303a 層間絶縁膜
303b 層間絶縁膜
503B アノード側電源線(B)
503G アノード側電源線(G)
503R アノード側電源線(R)
550B 発光素子
550G 発光素子
550R 発光素子
6001 第1の駆動回路
6002 画素部
6003 ゲート側駆動回路
6004 封止基板
6005 シール材
6007 接続領域
6008 端子部
6009 FPC
6010 基板
6601 駆動IC
6602 画素部
6604 封止基板
6605 シール材
6607 接続領域
6608 端子部
6609 FPC
6610 基板
Claims (21)
- 請求項1乃至請求項16のいずれか一に記載のアントラセン誘導体を含む層を、一対の電極間に有する発光素子。
- 請求項1乃至請求項16のいずれか一に記載のアントラセン誘導体と、ホストとを含む層を、一対の電極間に有し、
前記ホストは前記アントラセン誘導体のエネルギーギャップよりも大きいエネルギーギャップを有し、また前記アントラセン誘導体の有するイオン化ポテンシャルよりも大きいイオン化ポテンシャルを有する物質であることを特徴とする発光素子。 - 請求項1乃至請求項16のいずれか一に記載のアントラセン誘導体と、発光物質とを含む層を、一対の電極間に有し、
前記発光物質は前記アントラセン誘導体のエネルギーギャップよりも小さなエネルギーギャップを有し、また前記アントラセン誘導体の有するイオン化ポテンシャルよりも小さいイオン化ポテンシャルを有する物質であることを特徴とする発光素子。 - 請求項17乃至請求項19のいずれか一に記載の発光素子を有する発光装置。
- 請求項17乃至請求項19のいずれか一に記載の発光素子を有する電子機器。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006231489A JP5041766B2 (ja) | 2005-09-02 | 2006-08-29 | アントラセン誘導体、アントラセン誘導体を用いた発光素子、発光装置及び電子機器 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005254363 | 2005-09-02 | ||
| JP2005254363 | 2005-09-02 | ||
| JP2006231489A JP5041766B2 (ja) | 2005-09-02 | 2006-08-29 | アントラセン誘導体、アントラセン誘導体を用いた発光素子、発光装置及び電子機器 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007091721A JP2007091721A (ja) | 2007-04-12 |
| JP2007091721A5 JP2007091721A5 (ja) | 2009-10-08 |
| JP5041766B2 true JP5041766B2 (ja) | 2012-10-03 |
Family
ID=37977831
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006231489A Expired - Fee Related JP5041766B2 (ja) | 2005-09-02 | 2006-08-29 | アントラセン誘導体、アントラセン誘導体を用いた発光素子、発光装置及び電子機器 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5041766B2 (ja) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8835018B2 (en) * | 2007-04-25 | 2014-09-16 | Semiconductor Energy Laboratory Co., Ltd. | Organic compound, anthracene derivative, and light-emitting element, light-emitting device, and electronic device in which the anthracene derivative is used |
| WO2009116547A1 (en) | 2008-03-18 | 2009-09-24 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device and electronic device |
| CN101978784B (zh) * | 2008-03-18 | 2012-12-05 | 株式会社半导体能源研究所 | 发光元件、发光装置及电子装置 |
| CN101752514B (zh) | 2008-12-17 | 2015-11-25 | 株式会社半导体能源研究所 | 发光元件、照明装置、发光装置以及电子设备 |
| EP2200407B1 (en) * | 2008-12-17 | 2017-11-22 | Semiconductor Energy Laboratory Co., Ltd. | Light-Emitting element, light emitting device, and electronic device |
| CN101747257A (zh) * | 2008-12-19 | 2010-06-23 | 株式会社半导体能源研究所 | 有机化合物及使用该有机化合物的发光元件 |
| WO2011027653A1 (en) * | 2009-09-04 | 2011-03-10 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, and method for manufacturing the same |
| KR102021273B1 (ko) * | 2011-05-27 | 2019-09-16 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 카바졸 화합물, 발광 소자, 발광 장치, 전자 기기, 및 조명 장치 |
| JP7325731B2 (ja) | 2018-08-23 | 2023-08-15 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| JP7129392B2 (ja) * | 2018-10-26 | 2022-09-01 | キヤノン株式会社 | 組成物、それを有する有機発光素子、表示装置、撮像装置、電子機器及び移動体 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3511825B2 (ja) * | 1996-01-29 | 2004-03-29 | 東洋インキ製造株式会社 | 有機エレクトロルミネッセンス素子用発光材料およびそれを使用した有機エレクトロルミネッセンス素子 |
| JP4407102B2 (ja) * | 2001-08-06 | 2010-02-03 | 三菱化学株式会社 | アントラセン系化合物、その製造方法および有機電界発光素子 |
| KR100478520B1 (ko) * | 2001-08-13 | 2005-03-28 | 삼성에스디아이 주식회사 | 청색 발광 화합물 및 이를 발색재료로 채용하고 있는 유기전계 발광 소자 |
| US20030215667A1 (en) * | 2001-11-02 | 2003-11-20 | Shuang Xie | Electroluminescent devices |
| JP4122901B2 (ja) * | 2002-08-28 | 2008-07-23 | 富士ゼロックス株式会社 | 有機電界発光素子 |
| JP4221973B2 (ja) * | 2002-08-28 | 2009-02-12 | 富士ゼロックス株式会社 | 有機電界発光素子 |
| KR100624407B1 (ko) * | 2003-01-02 | 2006-09-18 | 삼성에스디아이 주식회사 | 디페닐안트라센 유도체 및 이를 채용한 유기 전계 발광 소자 |
| US7651787B2 (en) * | 2003-02-19 | 2010-01-26 | Lg Display Co., Ltd. | Organic electroluminescent device |
| US7541097B2 (en) * | 2003-02-19 | 2009-06-02 | Lg Display Co., Ltd. | Organic electroluminescent device and method for fabricating the same |
| JP4392206B2 (ja) * | 2003-07-30 | 2009-12-24 | 三井化学株式会社 | アントラセン化合物、および該アントラセン化合物を含有する有機電界発光素子 |
| JP4846982B2 (ja) * | 2004-01-26 | 2011-12-28 | 三井化学株式会社 | アントラセン化合物、および該アントラセン化合物を含有する有機電界発光素子 |
-
2006
- 2006-08-29 JP JP2006231489A patent/JP5041766B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2007091721A (ja) | 2007-04-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1928828B1 (en) | Anthracene derivative | |
| US11296280B2 (en) | Anthracene derivative, light emitting element using the same, and light emitting device using the same | |
| JP5041766B2 (ja) | アントラセン誘導体、アントラセン誘導体を用いた発光素子、発光装置及び電子機器 | |
| JP5996704B2 (ja) | カルバゾール誘導体の合成方法 | |
| KR101367616B1 (ko) | 안트라센 유도체, 및 이를 이용한 발광 소자, 발광 장치, 및 전자 기기 | |
| JP5227510B2 (ja) | ピラジン誘導体、及び前記ピラジン誘導体を用いた発光素子、表示装置、電子機器 | |
| JP5311712B2 (ja) | アントラセン誘導体とそれを用いた発光素子、発光装置 | |
| JP2007045816A (ja) | カルバゾール誘導体、及びそれを用いて得られた発光素子用材料、発光素子、電子機器 | |
| US20080145700A1 (en) | Stilbene Derivative, Light Emitting Element, Light Emitting Device, and Electronic Appliance | |
| JP5379965B2 (ja) | スチルベン誘導体、発光素子および発光装置 | |
| JP2007063258A (ja) | カルバゾール誘導体、及びそれを用いて得られた発光素子用材料、発光素子、電子機器 | |
| JP4809666B2 (ja) | 発光素子、発光装置及び電子機器 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090824 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090824 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20090824 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120703 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120710 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5041766 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150720 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150720 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |