JP4918365B2 - フッ素化フェニルピリジン配位子を有するエレクトロルミネセンスイリジウム化合物、およびかかる化合物で製造されたデバイス - Google Patents
フッ素化フェニルピリジン配位子を有するエレクトロルミネセンスイリジウム化合物、およびかかる化合物で製造されたデバイス Download PDFInfo
- Publication number
- JP4918365B2 JP4918365B2 JP2006551605A JP2006551605A JP4918365B2 JP 4918365 B2 JP4918365 B2 JP 4918365B2 JP 2006551605 A JP2006551605 A JP 2006551605A JP 2006551605 A JP2006551605 A JP 2006551605A JP 4918365 B2 JP4918365 B2 JP 4918365B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- layer
- occurrence
- different
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000003446 ligand Substances 0.000 title claims description 71
- 150000001875 compounds Chemical class 0.000 title claims description 45
- 150000002504 iridium compounds Chemical class 0.000 title description 16
- 150000005359 phenylpyridines Chemical class 0.000 title description 3
- VQGHOUODWALEFC-UHFFFAOYSA-N 2-phenylpyridine Chemical compound C1=CC=CC=C1C1=CC=CC=N1 VQGHOUODWALEFC-UHFFFAOYSA-N 0.000 claims description 28
- 229910052739 hydrogen Inorganic materials 0.000 claims description 24
- 229910052741 iridium Inorganic materials 0.000 claims description 20
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 claims description 20
- 125000003118 aryl group Chemical group 0.000 claims description 19
- 229910052799 carbon Inorganic materials 0.000 claims description 19
- FSEXLNMNADBYJU-UHFFFAOYSA-N 2-phenylquinoline Chemical compound C1=CC=CC=C1C1=CC=C(C=CC=C2)C2=N1 FSEXLNMNADBYJU-UHFFFAOYSA-N 0.000 claims description 18
- 125000000217 alkyl group Chemical group 0.000 claims description 15
- JVZRCNQLWOELDU-UHFFFAOYSA-N gamma-Phenylpyridine Natural products C1=CC=CC=C1C1=CC=NC=C1 JVZRCNQLWOELDU-UHFFFAOYSA-N 0.000 claims description 10
- OXPDQFOKSZYEMJ-UHFFFAOYSA-N 2-phenylpyrimidine Chemical compound C1=CC=CC=C1C1=NC=CC=N1 OXPDQFOKSZYEMJ-UHFFFAOYSA-N 0.000 claims description 9
- 125000002877 alkyl aryl group Chemical group 0.000 claims description 8
- 125000000623 heterocyclic group Chemical group 0.000 claims description 8
- 229910052731 fluorine Inorganic materials 0.000 claims description 7
- 239000011737 fluorine Substances 0.000 claims description 7
- 230000007935 neutral effect Effects 0.000 claims description 6
- 150000004678 hydrides Chemical class 0.000 claims description 5
- 239000001257 hydrogen Substances 0.000 claims description 5
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 5
- 125000001424 substituent group Chemical group 0.000 claims description 5
- 150000004703 alkoxides Chemical class 0.000 claims description 4
- 150000007942 carboxylates Chemical class 0.000 claims description 4
- 229910052736 halogen Inorganic materials 0.000 claims description 4
- 150000002367 halogens Chemical class 0.000 claims description 4
- 150000007944 thiolates Chemical class 0.000 claims description 4
- FVZVCSNXTFCBQU-UHFFFAOYSA-N phosphanyl Chemical group [PH2] FVZVCSNXTFCBQU-UHFFFAOYSA-N 0.000 claims description 3
- AYNNSCRYTDRFCP-UHFFFAOYSA-N triazene Chemical compound NN=N AYNNSCRYTDRFCP-UHFFFAOYSA-N 0.000 claims description 3
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims 2
- 239000010410 layer Substances 0.000 description 80
- 239000000463 material Substances 0.000 description 47
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 36
- 238000000034 method Methods 0.000 description 20
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 17
- 239000000203 mixture Substances 0.000 description 15
- 229910052757 nitrogen Inorganic materials 0.000 description 15
- 239000000243 solution Substances 0.000 description 14
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 12
- 238000005481 NMR spectroscopy Methods 0.000 description 11
- -1 hydroxyquinoline compound Chemical class 0.000 description 11
- 229910052751 metal Inorganic materials 0.000 description 11
- 239000002184 metal Substances 0.000 description 11
- 230000005525 hole transport Effects 0.000 description 10
- 125000004429 atom Chemical group 0.000 description 9
- 239000003085 diluting agent Substances 0.000 description 9
- 150000002503 iridium Chemical class 0.000 description 9
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- 150000002739 metals Chemical class 0.000 description 8
- 239000011541 reaction mixture Substances 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 7
- 238000004020 luminiscence type Methods 0.000 description 7
- 239000002243 precursor Substances 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- WHKZBVQIMVUGIH-UHFFFAOYSA-N 3-hydroxyquinoline-2-carboxylic acid Chemical compound C1=CC=C2C=C(O)C(C(=O)O)=NC2=C1 WHKZBVQIMVUGIH-UHFFFAOYSA-N 0.000 description 5
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 5
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 229920001940 conductive polymer Polymers 0.000 description 4
- 229920000547 conjugated polymer Polymers 0.000 description 4
- 239000012044 organic layer Substances 0.000 description 4
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 150000005360 2-phenylpyridines Chemical class 0.000 description 3
- UHBIKXOBLZWFKM-UHFFFAOYSA-N 8-hydroxy-2-quinolinecarboxylic acid Chemical compound C1=CC=C(O)C2=NC(C(=O)O)=CC=C21 UHBIKXOBLZWFKM-UHFFFAOYSA-N 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical class NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 239000002800 charge carrier Substances 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 238000005401 electroluminescence Methods 0.000 description 3
- 125000001072 heteroaryl group Chemical group 0.000 description 3
- 229910021645 metal ion Inorganic materials 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 238000005424 photoluminescence Methods 0.000 description 3
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 3
- 229920000767 polyaniline Polymers 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000010791 quenching Methods 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 150000003384 small molecules Chemical class 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000010981 turquoise Substances 0.000 description 3
- XMGSMOCOWOKNNK-UHFFFAOYSA-N 2-(bromomethyl)-1,1,1,3,3,3-hexafluoropropan-2-ol Chemical compound BrCC(O)(C(F)(F)F)C(F)(F)F XMGSMOCOWOKNNK-UHFFFAOYSA-N 0.000 description 2
- IMRWILPUOVGIMU-UHFFFAOYSA-N 2-bromopyridine Chemical compound BrC1=CC=CC=N1 IMRWILPUOVGIMU-UHFFFAOYSA-N 0.000 description 2
- ZNQVEEAIQZEUHB-UHFFFAOYSA-N 2-ethoxyethanol Chemical compound CCOCCO ZNQVEEAIQZEUHB-UHFFFAOYSA-N 0.000 description 2
- 229940093475 2-ethoxyethanol Drugs 0.000 description 2
- ZVFQEOPUXVPSLB-UHFFFAOYSA-N 3-(4-tert-butylphenyl)-4-phenyl-5-(4-phenylphenyl)-1,2,4-triazole Chemical compound C1=CC(C(C)(C)C)=CC=C1C(N1C=2C=CC=CC=2)=NN=C1C1=CC=C(C=2C=CC=CC=2)C=C1 ZVFQEOPUXVPSLB-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- UKIVSWMRVQEICY-UHFFFAOYSA-N [2,4-difluoro-3-(trifluoromethyl)phenyl]boronic acid Chemical compound OB(O)C1=CC=C(F)C(C(F)(F)F)=C1F UKIVSWMRVQEICY-UHFFFAOYSA-N 0.000 description 2
- 125000000129 anionic group Chemical group 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 229910052788 barium Inorganic materials 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 239000002322 conducting polymer Substances 0.000 description 2
- 230000009849 deactivation Effects 0.000 description 2
- 238000000151 deposition Methods 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 230000001815 facial effect Effects 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 238000004770 highest occupied molecular orbital Methods 0.000 description 2
- MILUBEOXRNEUHS-UHFFFAOYSA-N iridium(3+) Chemical compound [Ir+3] MILUBEOXRNEUHS-UHFFFAOYSA-N 0.000 description 2
- UEEXRMUCXBPYOV-UHFFFAOYSA-N iridium;2-phenylpyridine Chemical compound [Ir].C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1 UEEXRMUCXBPYOV-UHFFFAOYSA-N 0.000 description 2
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 229910003455 mixed metal oxide Inorganic materials 0.000 description 2
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 2
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 2
- 229920000548 poly(silane) polymer Polymers 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 239000011241 protective layer Substances 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 229960001860 salicylate Drugs 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- DANYXEHCMQHDNX-UHFFFAOYSA-K trichloroiridium Chemical compound Cl[Ir](Cl)Cl DANYXEHCMQHDNX-UHFFFAOYSA-K 0.000 description 2
- ODHXBMXNKOYIBV-UHFFFAOYSA-N triphenylamine Chemical compound C1=CC=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 ODHXBMXNKOYIBV-UHFFFAOYSA-N 0.000 description 2
- 238000001771 vacuum deposition Methods 0.000 description 2
- GRHYFDZMGZYXAP-UHFFFAOYSA-N 1,1,1,3,5,5,5-heptafluoropentane-2,4-dione Chemical compound FC(F)(F)C(=O)C(F)C(=O)C(F)(F)F GRHYFDZMGZYXAP-UHFFFAOYSA-N 0.000 description 1
- NKKFHDNJRMWBFS-UHFFFAOYSA-N 1,3-difluoro-2-(trifluoromethyl)benzene Chemical compound FC1=CC=CC(F)=C1C(F)(F)F NKKFHDNJRMWBFS-UHFFFAOYSA-N 0.000 description 1
- AZXFSXZTBNHKHM-UHFFFAOYSA-N 1-cyclohexyl-4-(4-cyclohexylphenyl)benzene phosphane Chemical compound P.C1(CCCCC1)C1=CC=C(C=C1)C1=CC=C(C=C1)C1CCCCC1 AZXFSXZTBNHKHM-UHFFFAOYSA-N 0.000 description 1
- NYZSKEULTVZUAW-UHFFFAOYSA-N 2,2-bis(trifluoromethyl)oxirane Chemical compound FC(F)(F)C1(C(F)(F)F)CO1 NYZSKEULTVZUAW-UHFFFAOYSA-N 0.000 description 1
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 1
- WNTGYJSOUMFZEP-UHFFFAOYSA-N 2-(4-chloro-2-methylphenoxy)propanoic acid Chemical compound OC(=O)C(C)OC1=CC=C(Cl)C=C1C WNTGYJSOUMFZEP-UHFFFAOYSA-N 0.000 description 1
- GORJRRDZPJZJNO-UHFFFAOYSA-N 2-(diphenylphosphanylmethyl)-1,1,1,3,3,3-hexafluoropropan-2-ol Chemical compound C=1C=CC=CC=1P(CC(O)(C(F)(F)F)C(F)(F)F)C1=CC=CC=C1 GORJRRDZPJZJNO-UHFFFAOYSA-N 0.000 description 1
- AQZRARFZZMGLHL-UHFFFAOYSA-N 2-(trifluoromethyl)oxirane Chemical compound FC(F)(F)C1CO1 AQZRARFZZMGLHL-UHFFFAOYSA-N 0.000 description 1
- RIKNNBBGYSDYAX-UHFFFAOYSA-N 2-[1-[2-(4-methyl-n-(4-methylphenyl)anilino)phenyl]cyclohexyl]-n,n-bis(4-methylphenyl)aniline Chemical compound C1=CC(C)=CC=C1N(C=1C(=CC=CC=1)C1(CCCCC1)C=1C(=CC=CC=1)N(C=1C=CC(C)=CC=1)C=1C=CC(C)=CC=1)C1=CC=C(C)C=C1 RIKNNBBGYSDYAX-UHFFFAOYSA-N 0.000 description 1
- CJWZMZPGOUBPEX-UHFFFAOYSA-N 2-[2,4-difluoro-3-(trifluoromethyl)phenyl]pyridine Chemical compound FC1=C(C(F)(F)F)C(F)=CC=C1C1=CC=CC=N1 CJWZMZPGOUBPEX-UHFFFAOYSA-N 0.000 description 1
- OKDGRDCXVWSXDC-UHFFFAOYSA-N 2-chloropyridine Chemical class ClC1=CC=CC=N1 OKDGRDCXVWSXDC-UHFFFAOYSA-N 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- OGGKVJMNFFSDEV-UHFFFAOYSA-N 3-methyl-n-[4-[4-(n-(3-methylphenyl)anilino)phenyl]phenyl]-n-phenylaniline Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 1
- DHDHJYNTEFLIHY-UHFFFAOYSA-N 4,7-diphenyl-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=CN=C21 DHDHJYNTEFLIHY-UHFFFAOYSA-N 0.000 description 1
- YGBCLRRWZQSURU-UHFFFAOYSA-N 4-[(diphenylhydrazinylidene)methyl]-n,n-diethylaniline Chemical compound C1=CC(N(CC)CC)=CC=C1C=NN(C=1C=CC=CC=1)C1=CC=CC=C1 YGBCLRRWZQSURU-UHFFFAOYSA-N 0.000 description 1
- ZOKIJILZFXPFTO-UHFFFAOYSA-N 4-methyl-n-[4-[1-[4-(4-methyl-n-(4-methylphenyl)anilino)phenyl]cyclohexyl]phenyl]-n-(4-methylphenyl)aniline Chemical compound C1=CC(C)=CC=C1N(C=1C=CC(=CC=1)C1(CCCCC1)C=1C=CC(=CC=1)N(C=1C=CC(C)=CC=1)C=1C=CC(C)=CC=1)C1=CC=C(C)C=C1 ZOKIJILZFXPFTO-UHFFFAOYSA-N 0.000 description 1
- MVIXNQZIMMIGEL-UHFFFAOYSA-N 4-methyl-n-[4-[4-(4-methyl-n-(4-methylphenyl)anilino)phenyl]phenyl]-n-(4-methylphenyl)aniline Chemical compound C1=CC(C)=CC=C1N(C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC(C)=CC=1)C=1C=CC(C)=CC=1)C1=CC=C(C)C=C1 MVIXNQZIMMIGEL-UHFFFAOYSA-N 0.000 description 1
- OQDBQPXUKMYECJ-UHFFFAOYSA-N 5-tert-butyl-6,6-dimethylheptane-2,4-dione 2,2,5-trimethyloctane-3,4-dione Chemical compound CCCC(C)C(=O)C(=O)C(C)(C)C.CC(=O)CC(=O)C(C(C)(C)C)C(C)(C)C OQDBQPXUKMYECJ-UHFFFAOYSA-N 0.000 description 1
- VFUDMQLBKNMONU-UHFFFAOYSA-N 9-[4-(4-carbazol-9-ylphenyl)phenyl]carbazole Chemical group C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 VFUDMQLBKNMONU-UHFFFAOYSA-N 0.000 description 1
- SFBHJDZYFDQEEY-UHFFFAOYSA-N 9-cyclobutylcarbazole Chemical compound C1CCC1N1C2=CC=CC=C2C2=CC=CC=C21 SFBHJDZYFDQEEY-UHFFFAOYSA-N 0.000 description 1
- WEIZWMMEUDPBDL-UHFFFAOYSA-N C1(=CC=CC=C1)P(C1=CC=CC=C1)(C1=CC=CC=C1)C(C)O Chemical compound C1(=CC=CC=C1)P(C1=CC=CC=C1)(C1=CC=CC=C1)C(C)O WEIZWMMEUDPBDL-UHFFFAOYSA-N 0.000 description 1
- VKZIZIKRZSYNOK-UHFFFAOYSA-N C1=CC=C2C=CC(C)(C(O)=O)NC2=C1O Chemical compound C1=CC=C2C=CC(C)(C(O)=O)NC2=C1O VKZIZIKRZSYNOK-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 239000006057 Non-nutritive feed additive Substances 0.000 description 1
- GOZPTOHMTKTIQP-UHFFFAOYSA-N OC1=CC=CC2=CC=C3C=CC(=NC3=C21)C(=O)O Chemical compound OC1=CC=CC2=CC=C3C=CC(=NC3=C21)C(=O)O GOZPTOHMTKTIQP-UHFFFAOYSA-N 0.000 description 1
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical compound CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 1
- 206010034972 Photosensitivity reaction Diseases 0.000 description 1
- 229920000265 Polyparaphenylene Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 229910052768 actinide Inorganic materials 0.000 description 1
- 150000001255 actinides Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 150000001543 aryl boronic acids Chemical class 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 150000003851 azoles Chemical class 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- XGRJZXREYAXTGV-UHFFFAOYSA-N chlorodiphenylphosphine Chemical compound C=1C=CC=CC=1P(Cl)C1=CC=CC=C1 XGRJZXREYAXTGV-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 239000004020 conductor Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 150000001893 coumarin derivatives Chemical class 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- IJKVHSBPTUYDLN-UHFFFAOYSA-N dihydroxy(oxo)silane Chemical compound O[Si](O)=O IJKVHSBPTUYDLN-UHFFFAOYSA-N 0.000 description 1
- GPAYUJZHTULNBE-UHFFFAOYSA-N diphenylphosphine Chemical compound C=1C=CC=CC=1PC1=CC=CC=C1 GPAYUJZHTULNBE-UHFFFAOYSA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000012990 dithiocarbamate Substances 0.000 description 1
- 150000004659 dithiocarbamates Chemical class 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 238000001194 electroluminescence spectrum Methods 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 1
- 239000010408 film Substances 0.000 description 1
- 125000003983 fluorenyl group Chemical class C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 1
- 125000004404 heteroalkyl group Chemical group 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- YOLNUNVVUJULQZ-UHFFFAOYSA-J iridium;tetrachloride Chemical compound [Cl-].[Cl-].[Cl-].[Cl-].[Ir] YOLNUNVVUJULQZ-UHFFFAOYSA-J 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 239000002346 layers by function Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 1
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Inorganic materials [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 1
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 125000005395 methacrylic acid group Chemical group 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- JGOAZQAXRONCCI-SDNWHVSQSA-N n-[(e)-benzylideneamino]aniline Chemical compound C=1C=CC=CC=1N\N=C\C1=CC=CC=C1 JGOAZQAXRONCCI-SDNWHVSQSA-N 0.000 description 1
- 229910052755 nonmetal Inorganic materials 0.000 description 1
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 150000002902 organometallic compounds Chemical class 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- 235000012736 patent blue V Nutrition 0.000 description 1
- CBHCDHNUZWWAPP-UHFFFAOYSA-N pecazine Chemical compound C1N(C)CCCC1CN1C2=CC=CC=C2SC2=CC=CC=C21 CBHCDHNUZWWAPP-UHFFFAOYSA-N 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- RYIOLWQRQXDECZ-UHFFFAOYSA-N phosphinous acid Chemical compound PO RYIOLWQRQXDECZ-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 238000000103 photoluminescence spectrum Methods 0.000 description 1
- 230000036211 photosensitivity Effects 0.000 description 1
- SIOXPEMLGUPBBT-UHFFFAOYSA-N picolinic acid Chemical compound OC(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-N 0.000 description 1
- 229920000412 polyarylene Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 229920002098 polyfluorene Polymers 0.000 description 1
- 229920006254 polymer film Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920000123 polythiophene Polymers 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-N pyridine Substances C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 1
- 229910052761 rare earth metal Inorganic materials 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000027756 respiratory electron transport chain Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 150000003872 salicylic acid derivatives Chemical class 0.000 description 1
- KZUNJOHGWZRPMI-UHFFFAOYSA-N samarium atom Chemical compound [Sm] KZUNJOHGWZRPMI-UHFFFAOYSA-N 0.000 description 1
- KZJPVUDYAMEDRM-UHFFFAOYSA-M silver;2,2,2-trifluoroacetate Chemical compound [Ag+].[O-]C(=O)C(F)(F)F KZJPVUDYAMEDRM-UHFFFAOYSA-M 0.000 description 1
- 238000004467 single crystal X-ray diffraction Methods 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 125000005504 styryl group Chemical group 0.000 description 1
- 238000000859 sublimation Methods 0.000 description 1
- 230000008022 sublimation Effects 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 125000004962 sulfoxyl group Chemical group 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 description 1
- 150000003513 tertiary aromatic amines Chemical class 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 238000002230 thermal chemical vapour deposition Methods 0.000 description 1
- 238000002207 thermal evaporation Methods 0.000 description 1
- 150000004867 thiadiazoles Chemical class 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- MJRFDVWKTFJAPF-UHFFFAOYSA-K trichloroiridium;hydrate Chemical compound O.Cl[Ir](Cl)Cl MJRFDVWKTFJAPF-UHFFFAOYSA-K 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- WRECIMRULFAWHA-UHFFFAOYSA-N trimethyl borate Chemical compound COB(OC)OC WRECIMRULFAWHA-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Chemical group 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/341—Transition metal complexes, e.g. Ru(II)polypyridine complexes
- H10K85/342—Transition metal complexes, e.g. Ru(II)polypyridine complexes comprising iridium
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/18—Metal complexes
- C09K2211/185—Metal complexes of the platinum group, i.e. Os, Ir, Pt, Ru, Rh or Pd
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S428/00—Stock material or miscellaneous articles
- Y10S428/917—Electroluminescent
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Organic Chemistry (AREA)
- Crystallography & Structural Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Electroluminescent Light Sources (AREA)
Description
本出願は、2004年1月30日に出願された米国特許出願第10/768,298号明細書の一部継続出願、2003年2月13日に出願された米国特許出願第10/366,295号明細書の一部継続出願である。
R1=H、R4、OR4、N(R4)2
R2=H、CnF2n+1、CnF2n+1SO2、COOR4、CN
R3=H、CnF2n+1、CnF2n+1SO2、COOR4、CN、
R4は、各出現時に、同一または異なっており、H、アルキル、アリールであるか、または隣接したR4基が互いに結合して5または6員環を形成することができ、
L’=二座配位子であり、かつフェニルピリジン、フェニルピリミジン、またはフェニルキノリンでなく;
L’’=一座配位子であり、かつフェニルピリジン、およびフェニルピリミジン、またはフェニルキノリンでなく;
m=1、2または3であり、
nは1〜20の整数であり、
y=0、1または2であり、
z=0または1〜4の整数であり、
ただし、前記化合物が電荷中性であり、かつイリジウムが六座配位である]
を有するイリジウム化合物(一般に「Ir(III)化合物」と称される)に関する。
1,3−ジフェニル−1,3−プロパンジオネート[DI]
2,2,6,6−テトラメチル−3,5−ヘプタンジオネート[TMH]
4,4,4−トリフルオロ−1−(2−チエニル)−1,3−ブタンジオネート[TTFA]
7,7−ジメチル−1,1,1,2,2,3,3−ヘプタフルオロ−4,6−オクタンジオネート[FOD]
1,1,1,3,5,5,5−ヘプタフルオロ−2,4−ペンタンジオネート[F7acac]
1,1,1,5,5,5−ヘキサフロウロ(hexaflouro)−2,4−ペンタンジオネート[F6acac]
1−フェニル−3−メチル−4−i−ブチリル−ピラゾリノネート[FMBP]
8−ヒドロキシキノリネート[8hq]
2−メチル−8−ヒドロキシキノリネート[Me−8hq]
10−ヒドロキシベンゾキノリネート[10−hbq]
親ヒドロキシキノリン化合物は一般に市販されている。
R7は、各出現時に、同一または異なっていてもよく、HおよびCn(H+F)2n+1から選択され、
R8は、各出現時に、同一または異なっていてもよく、Cn(H+F)2n+1およびC6(H+F)5、またはC6H5−b(R9)bから選択され、
R9=CF3、C2F5、n−C3F7、i−C3F7、C4F9、CF3SO2であり、
φは2または3であり、
bは0〜5であり、
nは1〜20である。
3−(ジフェニルホスフィノ)−1−オキシプロパン[dppO]
1,1−ビス(トリフルオロメチル)−2−(ジフェニルホスフィノ)−エトキシド[tfmdpeO]
親ホスフィノアルカノール化合物のいくつかは市販されており、または例えば、(非特許文献4)または(非特許文献5)においてtfmdpeOについて記載された手順などの公知の手順を用いて調製することができる。
Ar[−(CH2)q−Y]p (V)
によって表すことができ、上式中、Arはアリールまたはヘテロアリール基であり、Yは、Irに配位することができるヘテロ原子を有する基であり、qは0または1〜20の整数であり、pは1〜5の整数であり、さらに、(CH2)qの炭素の1つまたは複数がヘテロ原子で置換されてもよく、(CH2)qの水素の1つまたは複数はDまたはFで置換されてもよい。
PAr3 (VI)
で表すことができ、上式中、Arはアリールまたはヘテロアリール基を表す。Ar基は、非置換であるかまたはアルキル、ヘテロアルキル、アリール、ヘテロアリール、ハリド、カルボキシル、スルホキシル、またはアミノ基で置換されてもよい。ホスフィン配位子は一般に市販されている。
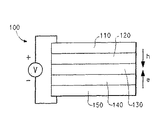
本発明はまた、2つの電気的接触層の間に配置された少なくとも1つの層を含む電子デバイスに関するものであり、ここで、前記デバイスの少なくとも1つの層が、本発明のイリジウム錯体を含有する。デバイスはしばしば、付加的な正孔輸送および電子輸送層を有する。代表的な構造を図1に示す。デバイス100が、アノード層110及びカソード層150を有する。正孔輸送材料を含む層120がアノードに隣接している。電子輸送材料を含む層140がカソードに隣接している。正孔輸送層と電子輸送層との間に光活性層130がある。
この実施例は、式IIの配位子前駆体化合物の調製について説明し、ここでR2=CF3、およびR1=R3=Hである。
この実施例は、式XIIIの本発明の錯体の調製について説明する:
この実施例は、式VIIの配位子のための前駆体ホスフィノ−アルコール化合物1,1−ビス(トリフルオロメチル)−2−ビス(トリフェニルホスフィノ)−エタノール(「PO−1H」)の調製について説明する。化合物を2つの異なった方法によって製造した。
ホスフィノアルカノールを(非特許文献9)の手順によって製造した。窒素下、1,1−ビス(トリフルオロメチル)エチレンオキシド(12g、0.066モル)を、ジフェニルホスフィン(10g、0.053モル)を乾燥THF(50mL)に溶かした予備冷却(10〜15℃)溶液に滴下した。反応混合物を2日間25℃において撹拌し、その後、NMR分析は>90%の変換を示した。溶剤を真空下で除去し、残留した粘性油を真空下で蒸留して、放置時に結晶化する8gの分画(0.05mmHgにおいてb.p.110〜114℃)を生じた。この材料(>95%の純度)のNMRデータおよびm.p.(59〜62℃)の両方が、(非特許文献4)に記載されたものと一致していた。1H NMR(CDCl3、20℃)、δ:7.3〜7.8(m,10H,arom.H);2.8(br.s.;1H,OH);2.2(s,2H,CH2)。19F NMR(CDCl3、20℃)、δ:−77.3(d,JF−P=15.5Hz)。31P NMR(CDCl3、20℃)、δ:−24.4(septet,JP−F=15.5Hz)。
(i)1,1−ビス(トリフルオロメチル)−2−ブロモエタノール、BrCH2C(CF3)2OHの調製。1,1−ビス(トリフルオロメチル)オキシラン(100g;0.55モル;本願特許出願人に対する2000年、(特許文献6)に記載されているように調製された)を、30〜40℃において、ドライアイス冷却器、温度計、および磁気撹拌棒を備えた丸底ガラスフラスコ内に入れた100mlの47% HBr水溶液にゆっくりと添加した。反応混合物を還流しながら3時間、撹拌した。その時点で温度を90℃まで上昇させた。室温に冷却した後、下層を分離し、MgSO4で乾燥させ、蒸留して104g(72%)のBrCH2C(CF3)2OH、b.p.101−103℃を生じた。1H NMR(CDCl3):3.50(brs,1H,−OH)、3.70(s,2H,CH2)。19F NMR(CDCl3):−75.9(s)。この材料を、次の工程の前にか焼したばかりの分子ふるい(4Å)で乾燥させた。
この実施例は、式XIVの本発明の錯体の調製について説明する:
本発明は、特許請求の範囲に記載した発明を含め、以下の発明を包含する。
(1) 式I
R1=H、R4、OR4、N(R4)2
R2=H、CnF2n+1、CnF2n+1SO2、COOR4、CN
R3=H、CnF2n+1、CnF2n+1SO2、COOR4、CN、
R4は、各出現時に、同一または異なっており、H、アルキル、アリールであるか、または隣接したR4基が互いに結合して5または6員環を形成することができ、
L’=二座配位子であり、かつフェニルピリジン、フェニルピリミジン、またはフェニルキノリンでなく;
L’’=一座配位子であり、かつフェニルピリジン、およびフェニルピリミジン、またはフェニルキノリンでなく;
m=1、2または3であり、
nは1〜20の整数であり、
y=0、1または2であり、
z=0または1〜4の整数であり、
ただし、前記化合物が電荷中性であり、かつイリジウムが六座配位である]
を有する化合物を含む少なくとも1つの層を含むことを特徴とする有機電子デバイス。
(2) R2およびR3が独立して、H、CF3、C2F3、n−C3F7、i−C3F7、C4F9、CF3SO2、COOR4およびCNから選択されることを特徴とする(1)に記載のデバイス。
(3) m=3、y=0、およびz=0であることを特徴とする(1)に記載のデバイス。
(4) m=2、y=1、z=0であり、L’がモノアニオン性二座配位子であることを特徴とする(1)に記載のデバイス。
(5) m=1、y=1、およびz=2であることを特徴とする(1)に記載のデバイス。
(6) 少なくとも1つのL’’がハイドライドであることを特徴とする(5)に記載のデバイス。
(7) L’が、アミノ、イミノ、アミド、アルコキシド、カルボキシレート、ホスフィノ、およびチオレートから選択された配位基を有することを特徴とする(4)に記載のデバイス。
(8) L’がβ−エノラート配位子、β−エノラート配位子のN類似体、β−エノラート配位子のS類似体、アミノカルボキシレート配位子、イミノカルボキシレート配位子、サリチレート配位子、ヒドロキシキノリネート配位子、ヒドロキシキノリネート配位子のS類似体、ホスフィノアルコキシド配位子、および芳香族基の一部である炭素原子によって配位された配位子から選択されることを特徴とする(4)に記載のデバイス。
(9) L’が、式III:
R5は、各出現時に、同一または異なっており、水素、ハロゲン、置換または非置換アルキル、アリール、アルキルアリールおよび複素環基から選択されるか、または隣接したR5基が結合して、置換されてもよい5および6員環を形成することができ、
R6はアルキル、アリール、アルキルアリール、複素環基、およびフッ素から選択される]
を有するβ−エノラートであることを特徴とする(8)に記載のデバイス。
(10) L’が、式IV:
R7は、各出現時に、同一または異なっていてもよく、HおよびCn(H+F)2n+1から選択され、
R8は、各出現時に、同一または異なっていてもよく、Cn(H+F)2n+1およびC6(H+F)5、またはC6H5−n(R9)nから選択され、
R9=CF3、C2F5、n−C3F7、i−C3F7、C4F9、CF3SO2であり、
φは2または3である]
を有するホスフィノアルコキシドであることを特徴とする(8)に記載のデバイス。
(11) L’が、式VII:
(12) 前記少なくとも1つの層が発光層であることを特徴とする(1)に記載のデバイス。
(13) 前記発光層が希釈剤をさらに含むことを特徴とする(12)に記載のデバイス。
(14) 前記希釈剤が、ポリマーまたは小分子材料、またはそれらの混合物を含むことを特徴とする(13)に記載のデバイス。
(15) 式I
R1=H、R4、OR4、N(R4)2
R2=H、CnF2n+1、CnF2n+1SO2、COOR4、CN
R3=H、CnF2n+1、CnF2n+1SO2、COOR4、CN、
R4は、各出現時に、同一または異なっており、H、アルキル、アリールであるか、または隣接したR4基が互いに結合して5または6員環を形成することができ、
L’=二座配位子であり、かつフェニルピリジン、フェニルピリミジン、またはフェニルキノリンでなく;
L’’=一座配位子であり、かつフェニルピリジン、およびフェニルピリミジン、またはフェニルキノリンでなく;
m=1、2または3であり、
nは1〜20の整数であり、
y=0、1または2であり、
z=0または1〜4の整数であり、
ただし、前記化合物が電荷中性であり、かつイリジウムが六座配位である]
を有することを特徴とする化合物。
(16) 式IのR2およびR3が独立して、H、CF3、C2F3、n−C3F7、i−C3F7、C4F9、CF3SO2、COOR4およびCNから選択されることを特徴とする(15)に記載の化合物。
(17) 式IX、式X、式XI、および式XII:
(18) 以下の式XIII、式XIV、および式XV:
(19) 式VIII:
Claims (10)
- 式I
R1=H、R4、OR4、N(R4)2
R2=H、CnF2n+1、CnF2n+1SO2、COOR4、CN
R3=H、CnF2n+1、CnF2n+1SO2、COOR4、CN、
R4は、各出現時に、同一または異なっており、H、アルキル、アリールであるか、または隣接したR4基が互いに結合して5または6員環を形成することができ、
L’’=一座配位子であり、かつフェニルピリジン、およびフェニルピリミジン、またはフェニルキノリンでなく;
m=1、2または3であり、
nは1〜20の整数であり、
y=0、1または2であり、
z=0または1〜4の整数であり、
L’が、式IIIを有するβ−エノラートまたは式IVを有するホスフィノアルコキシドであり、
R 5 は、各出現時に、同一または異なっており、水素、ハロゲン、置換または非置換アルキル、アリール、アルキルアリールおよび複素環基から選択されるか、または隣接したR 5 基が結合して、置換されてもよい5および6員環を形成することができ、
R 6 はアルキル、アリール、アルキルアリール、複素環基、およびフッ素から選択される]
R 7 は、各出現時に、同一または異なっていてもよく、HおよびC n (H+F) 2n+1 から選択され、
R 8 は、各出現時に、同一または異なっていてもよく、C n (H+F) 2n+1 およびC 6 (H+F) 5 、またはC 6 H 5-n (R 9 ) n から選択され、
R 9 =CF 3 、C 2 F 5 、n−C 3 F 7 、i−C 3 F 7 、C 4 F 9 、CF 3 SO 2 であり、
φは2または3である]
ただし、前記化合物が電荷中性であり、かつイリジウムが六座配位である]
を有する化合物を含む少なくとも1つの層を含むことを特徴とする有機電子デバイス。 - R2およびR3が独立して、H、CF3、C2F3、n−C3F7、i−C3F7、C4F9、CF3SO2、COOR4およびCNから選択されることを特徴とする請求項1に記載のデバイス。
- 少なくとも1つのL’’がハイドライドであることを特徴とする請求項1に記載のデバイス。
- L’が、アミノ、イミノ、アミド、アルコキシド、カルボキシレート、ホスフィノ、およびチオレートから選択された配位基を有することを特徴とする請求項1に記載のデバイス。
- 前記少なくとも1つの層が発光層であることを特徴とする請求項1に記載のデバイス。
- 式I
R1=H、R4、OR4、N(R4)2
R2=H、CnF2n+1、CnF2n+1SO2、COOR4、CN
R3=H、CnF2n+1、CnF2n+1SO2、COOR4、CN、
R4は、各出現時に、同一または異なっており、H、アルキル、アリールであるか、または隣接したR4基が互いに結合して5または6員環を形成することができ、
L’’=一座配位子であり、かつフェニルピリジン、およびフェニルピリミジン、またはフェニルキノリンでなく;
m=1、2または3であり、
nは1〜20の整数であり、
y=0、1または2であり、
z=0または1〜4の整数であり、
L’が、式IIIを有するβ−エノラートまたは式IVを有するホスフィノアルコキシドであり、
R 5 は、各出現時に、同一または異なっており、水素、ハロゲン、置換または非置換アルキル、アリール、アルキルアリールおよび複素環基から選択されるか、または隣接したR 5 基が結合して、置換されてもよい5および6員環を形成することができ、
R 6 はアルキル、アリール、アルキルアリール、複素環基、およびフッ素から選択される]
R 7 は、各出現時に、同一または異なっていてもよく、HおよびC n (H+F) 2n+1 から選択され、
R 8 は、各出現時に、同一または異なっていてもよく、C n (H+F) 2n+1 およびC 6 (H+F) 5 、またはC 6 H 5-n (R 9 ) n から選択され、
R 9 =CF 3 、C 2 F 5 、n−C 3 F 7 、i−C 3 F 7 、C 4 F 9 、CF 3 SO 2 であり、
φは2または3である]
ただし、前記化合物が電荷中性であり、かつイリジウムが六座配位である]
を有することを特徴とする化合物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US76829804A | 2004-01-30 | 2004-01-30 | |
| US10/768,298 | 2004-01-30 | ||
| US10/774,286 | 2004-02-06 | ||
| US10/774,286 US7476452B2 (en) | 2000-06-30 | 2004-02-06 | Electroluminescent iridium compounds with fluorinated phenylpyridine ligands, and devices made with such compounds |
| PCT/US2005/003338 WO2005075597A2 (en) | 2004-01-30 | 2005-01-28 | Electroluminescent iridium compounds with fluorinated phenylpyridine ligands, and devices made with such compounds |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007524239A JP2007524239A (ja) | 2007-08-23 |
| JP2007524239A5 JP2007524239A5 (ja) | 2008-03-13 |
| JP4918365B2 true JP4918365B2 (ja) | 2012-04-18 |
Family
ID=34841270
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006551605A Active JP4918365B2 (ja) | 2004-01-30 | 2005-01-28 | フッ素化フェニルピリジン配位子を有するエレクトロルミネセンスイリジウム化合物、およびかかる化合物で製造されたデバイス |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US7476452B2 (ja) |
| JP (1) | JP4918365B2 (ja) |
| TW (1) | TWI363792B (ja) |
| WO (1) | WO2005075597A2 (ja) |
Families Citing this family (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7476452B2 (en) * | 2000-06-30 | 2009-01-13 | E. I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with fluorinated phenylpyridine ligands, and devices made with such compounds |
| US7816016B1 (en) * | 2003-02-13 | 2010-10-19 | E. I. Du Pont De Nemours And Company | Electroluminescent iridium compounds and devices made therefrom |
| SE528408C2 (sv) * | 2005-03-07 | 2006-11-07 | Interactive Inst Ii Ab | En metod och en anordning för visuell indikering av ström- eller effektförbrukning i en elkabel |
| EP2036915A1 (en) | 2005-06-30 | 2009-03-18 | Koninklijke Philips Electronics N.V. | Electro luminescent metal complexes |
| JP2007059783A (ja) * | 2005-08-26 | 2007-03-08 | Showa Denko Kk | 有機el素子、その製造方法およびその用途 |
| US8115378B2 (en) * | 2006-12-28 | 2012-02-14 | E. I. Du Pont De Nemours And Company | Tetra-substituted chrysenes for luminescent applications |
| US8257836B2 (en) | 2006-12-29 | 2012-09-04 | E I Du Pont De Nemours And Company | Di-substituted pyrenes for luminescent applications |
| CN105669765A (zh) * | 2007-05-18 | 2016-06-15 | 株式会社半导体能源研究所 | 有机金属配合物,包含该有机金属配合物的组合物和发光元件 |
| WO2008150942A1 (en) * | 2007-06-01 | 2008-12-11 | E.I. Du Pont De Nemours And Company | Blue luminescent materials |
| WO2008150828A2 (en) | 2007-06-01 | 2008-12-11 | E.I. Du Pont De Nemours And Company | Green luminescent materials |
| WO2008150872A1 (en) | 2007-06-01 | 2008-12-11 | E.I. Du Pont De Nemours And Company | Chrysenes for deep blue luminescent applications |
| KR20100024451A (ko) * | 2007-06-01 | 2010-03-05 | 이 아이 듀폰 디 네모아 앤드 캄파니 | 녹색 발광 용도를 위한 크라이센 |
| TW200911821A (en) * | 2007-06-08 | 2009-03-16 | Solvay | Light emitting material |
| US8192848B2 (en) * | 2008-01-11 | 2012-06-05 | E I Du Pont De Nemours And Company | Substituted pyrenes and associated production methods for luminescent applications |
| JP5609022B2 (ja) * | 2008-06-23 | 2014-10-22 | 住友化学株式会社 | 金属錯体の残基を含む高分子化合物及びそれを用いた素子 |
| TW201008374A (en) | 2008-06-26 | 2010-02-16 | Du Pont | Organic light-emitting diode luminaires |
| EP2304823A4 (en) * | 2008-06-26 | 2011-08-10 | Du Pont | ORGANIC LIGHT DIODE LIGHTING DEVICES |
| WO2010059837A2 (en) * | 2008-11-19 | 2010-05-27 | E. I. Du Pont De Nemours And Company | Chrysene compounds for blue or green luminescent applications |
| US8263973B2 (en) * | 2008-12-19 | 2012-09-11 | E I Du Pont De Nemours And Company | Anthracene compounds for luminescent applications |
| US8932733B2 (en) * | 2008-12-19 | 2015-01-13 | E I Du Pont De Nemours And Company | Chrysene derivative host materials |
| US8531100B2 (en) | 2008-12-22 | 2013-09-10 | E I Du Pont De Nemours And Company | Deuterated compounds for luminescent applications |
| KR20110114594A (ko) * | 2008-12-22 | 2011-10-19 | 이 아이 듀폰 디 네모아 앤드 캄파니 | 광활성 조성물 및 그 조성물로 제조된 전자 소자 |
| KR20110131200A (ko) * | 2009-02-06 | 2011-12-06 | 솔베이(소시에떼아노님) | 피리딜트리아졸 리간드를 함유하는 인광성 발광 이리듐 착물 |
| US8759818B2 (en) | 2009-02-27 | 2014-06-24 | E I Du Pont De Nemours And Company | Deuterated compounds for electronic applications |
| US8497495B2 (en) | 2009-04-03 | 2013-07-30 | E I Du Pont De Nemours And Company | Electroactive materials |
| JP2012527470A (ja) | 2009-05-19 | 2012-11-08 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | ルミネセンス用途のクリセン化合物 |
| CN102471677A (zh) | 2009-07-01 | 2012-05-23 | E.I.内穆尔杜邦公司 | 用于发光应用的*化合物 |
| JP5567675B2 (ja) * | 2009-08-13 | 2014-08-06 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | クリセン誘導体材料 |
| TW201121117A (en) * | 2009-08-24 | 2011-06-16 | Du Pont | Organic light-emitting diode luminaires |
| JP2013502701A (ja) * | 2009-08-24 | 2013-01-24 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | 有機発光ダイオード照明器具 |
| CN102484217A (zh) * | 2009-08-24 | 2012-05-30 | E.I.内穆尔杜邦公司 | 有机发光二极管灯具 |
| WO2011028473A2 (en) * | 2009-08-24 | 2011-03-10 | E. I. Du Pont De Nemours And Company | Organic light-emitting diode luminaires |
| CN102484214A (zh) | 2009-08-24 | 2012-05-30 | E.I.内穆尔杜邦公司 | 有机发光二极管灯具 |
| TW201117651A (en) * | 2009-08-24 | 2011-05-16 | Du Pont | Organic light-emitting diode luminaires |
| JP5715142B2 (ja) | 2009-09-29 | 2015-05-07 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | ルミネセンス用途用の重水素化合物 |
| US8648333B2 (en) | 2009-10-19 | 2014-02-11 | E I Du Pont De Nemours And Company | Triarylamine compounds for use in organic light-emitting diodes |
| KR20120086319A (ko) | 2009-10-19 | 2012-08-02 | 이 아이 듀폰 디 네모아 앤드 캄파니 | 전자적 응용을 위한 트라이아릴아민 화합물 |
| JP5784621B2 (ja) | 2009-10-29 | 2015-09-24 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | 電子用途用の重水素化合物 |
| US8716699B2 (en) | 2009-10-29 | 2014-05-06 | E I Du Pont De Nemours And Company | Organic light-emitting diodes having white light emission |
| US8674343B2 (en) | 2009-10-29 | 2014-03-18 | E I Du Pont De Nemours And Company | Organic light-emitting diodes having white light emission |
| US8716700B2 (en) | 2009-10-29 | 2014-05-06 | E I Du Pont De Nemours And Company | Organic light-emitting diodes having white light emission |
| WO2011071507A1 (en) * | 2009-12-09 | 2011-06-16 | E. I. Du Pont De Nemours And Company | Deuterated compound as part of a combination of compounds for electronic applications |
| US8465849B2 (en) * | 2009-12-21 | 2013-06-18 | E I Du Pont De Nemours And Company | Deuterated zirconium compound for electronic applications |
| US8617720B2 (en) | 2009-12-21 | 2013-12-31 | E I Du Pont De Nemours And Company | Electroactive composition and electronic device made with the composition |
| KR20140002614A (ko) | 2010-08-11 | 2014-01-08 | 이 아이 듀폰 디 네모아 앤드 캄파니 | 전기활성 화합물 및 조성물, 및 그 조성물로 제조된 전자 소자 |
| KR20140000672A (ko) | 2010-08-24 | 2014-01-03 | 이 아이 듀폰 디 네모아 앤드 캄파니 | 광활성 조성물 및 그 조성물로 제조된 전자 소자 |
| CN102408448B (zh) * | 2010-09-21 | 2015-04-15 | 中国科学院福建物质结构研究所 | 一种检测次氯酸根的磷光材料 |
| TW201229010A (en) | 2010-12-13 | 2012-07-16 | Du Pont | Electroactive materials |
| WO2012082593A2 (en) | 2010-12-15 | 2012-06-21 | E.I. Du Pont De Nemours And Company | Electroactive material and devices made with such materials |
| TW201229003A (en) | 2010-12-17 | 2012-07-16 | Du Pont | Anthracene derivative compounds for electronic applications |
| WO2012083301A1 (en) | 2010-12-17 | 2012-06-21 | E. I. Du Pont De Nemours And Company | Anthracene derivative compounds for electronic applications |
| TW201229204A (en) | 2010-12-17 | 2012-07-16 | Du Pont | Anthracene derivative compounds for electronic applications |
| US20130264560A1 (en) | 2010-12-20 | 2013-10-10 | E I Du Pont De Nemours And Company | Triazine derivatives for electronic applications |
| EP2655548A2 (en) | 2010-12-20 | 2013-10-30 | E.I. Du Pont De Nemours And Company | Electroactive compositions for electronic applications |
| US9293716B2 (en) | 2010-12-20 | 2016-03-22 | Ei Du Pont De Nemours And Company | Compositions for electronic applications |
| WO2012088192A1 (en) | 2010-12-21 | 2012-06-28 | E. I. Du Pont De Nemours And Company | Electronic device including a pyrimidine compound |
| US9236580B2 (en) | 2011-10-19 | 2016-01-12 | E I Du Pont De Nemours And Company | Organic electronic device for lighting |
| JP2012039161A (ja) * | 2011-11-22 | 2012-02-23 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| EP2828273B1 (en) * | 2012-03-23 | 2019-02-20 | E. I. du Pont de Nemours and Company | Green luminescent materials |
| JP2014529897A (ja) * | 2012-04-30 | 2014-11-13 | ヨル チョン ケミカル カンパニーリミテッドYoul Chon Chemical Co., Ltd. | 新規な金属錯化合物及びそれを含む青色燐光有機発光素子 |
| KR102065586B1 (ko) | 2013-01-30 | 2020-01-14 | 삼성디스플레이 주식회사 | 유기금속 착체 및 이를 포함한 유기 발광 소자 |
| KR102037375B1 (ko) | 2013-02-13 | 2019-10-29 | 삼성디스플레이 주식회사 | 유기금속 착체 및 이를 포함한 유기 발광 소자 |
| KR102154797B1 (ko) | 2013-02-25 | 2020-09-10 | 주식회사 엘지화학 | 다이아자크리센 유도체를 포함하는 전자 소자 |
| CN105981192B (zh) | 2013-12-13 | 2018-10-16 | E.I.内穆尔杜邦公司 | 形成电活性层的体系 |
| US9944846B2 (en) | 2014-08-28 | 2018-04-17 | E I Du Pont De Nemours And Company | Compositions for electronic applications |
| US9972783B2 (en) | 2015-03-25 | 2018-05-15 | E I Du Pont De Nemours And Company | High energy triarylamine compounds for hole transport materials |
| US10804473B2 (en) | 2015-05-21 | 2020-10-13 | Lg Chem, Ltd. | Electron transport materials for electronic applications |
| US9966542B2 (en) | 2016-06-02 | 2018-05-08 | E I Du Pont De Nemours And Company | Electroactive materials |
| RU2657496C1 (ru) * | 2017-07-10 | 2018-06-14 | Сиа Эволед | Разнолигандные фторзамещенные ароматические карбоксилаты лантанидов, проявляющие люминесцентные свойства, и органические светодиоды на их основе |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004503059A (ja) * | 2000-06-30 | 2004-01-29 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | フッ素化フェニルピリジン、フェニルピリミジン及びフェニルキノリンを伴うエレクトロルミネセントイリジウム化合物及びかかる化合物で作られたデバイス |
| JP2005038847A (ja) * | 2003-06-26 | 2005-02-10 | Samsung Sdi Co Ltd | 有機金属錯体およびこれを採用した有機電界発光素子 |
| JP2005154396A (ja) * | 2003-10-30 | 2005-06-16 | Mitsubishi Chemicals Corp | 有機金属錯体およびそれを用いた有機電界発光素子 |
| JP2009246373A (ja) * | 2000-07-17 | 2009-10-22 | Fujifilm Corp | 発光素子及びイリジウム錯体 |
| JP2010161410A (ja) * | 2002-10-09 | 2010-07-22 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1996003410A1 (de) | 1994-07-25 | 1996-02-08 | Boehringer Mannheim Gmbh | Hydrophile metallkomplexe |
| US5552678A (en) | 1994-09-23 | 1996-09-03 | Eastman Kodak Company | AC drive scheme for organic led |
| US6303238B1 (en) | 1997-12-01 | 2001-10-16 | The Trustees Of Princeton University | OLEDs doped with phosphorescent compounds |
| JP4619546B2 (ja) | 1999-03-23 | 2011-01-26 | ザ ユニバーシティー オブ サザン カリフォルニア | 有機ledの燐光性ドーパントとしてのシクロメタル化金属錯体 |
| EP1449238B1 (en) | 1999-05-13 | 2006-11-02 | The Trustees Of Princeton University | Very high efficiency organic light emitting devices based on electrophosphorescence |
| EP3379591A1 (en) | 1999-12-01 | 2018-09-26 | The Trustees of Princeton University | Complexes of form l2mx |
| US6821645B2 (en) | 1999-12-27 | 2004-11-23 | Fuji Photo Film Co., Ltd. | Light-emitting material comprising orthometalated iridium complex, light-emitting device, high efficiency red light-emitting device, and novel iridium complex |
| JP4048521B2 (ja) | 2000-05-02 | 2008-02-20 | 富士フイルム株式会社 | 発光素子 |
| WO2003063555A1 (en) | 2001-12-26 | 2003-07-31 | E. I. Du Pont De Nemours And Company | Electroluminescent iridium compounds wiht fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| US6670645B2 (en) | 2000-06-30 | 2003-12-30 | E. I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| US7476452B2 (en) | 2000-06-30 | 2009-01-13 | E. I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with fluorinated phenylpyridine ligands, and devices made with such compounds |
| ATE482476T1 (de) | 2000-07-17 | 2010-10-15 | Fujifilm Corp | Lichtemittierendes element und azolverbindung |
| US6939624B2 (en) | 2000-08-11 | 2005-09-06 | Universal Display Corporation | Organometallic compounds and emission-shifting organic electrophosphorescence |
| CN102041001B (zh) | 2000-08-11 | 2014-10-22 | 普林斯顿大学理事会 | 有机金属化合物和发射转换有机电致磷光 |
| JP4154140B2 (ja) | 2000-09-26 | 2008-09-24 | キヤノン株式会社 | 金属配位化合物 |
| JP4006335B2 (ja) * | 2000-11-30 | 2007-11-14 | キヤノン株式会社 | 発光素子及び表示装置 |
| AU2002222566A1 (en) | 2000-11-30 | 2002-06-11 | Canon Kabushiki Kaisha | Luminescent element and display |
| JP3812730B2 (ja) * | 2001-02-01 | 2006-08-23 | 富士写真フイルム株式会社 | 遷移金属錯体及び発光素子 |
| US7166368B2 (en) | 2001-11-07 | 2007-01-23 | E. I. Du Pont De Nemours And Company | Electroluminescent platinum compounds and devices made with such compounds |
| US7320833B2 (en) | 2001-11-07 | 2008-01-22 | E.I. Du Pont De Nemours And Company | Electroluminescent platinum compounds and devices made with such compounds |
| US6869695B2 (en) | 2001-12-28 | 2005-03-22 | The Trustees Of Princeton University | White light emitting OLEDs from combined monomer and aggregate emission |
| US6919139B2 (en) | 2002-02-14 | 2005-07-19 | E. I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with phosphinoalkoxides and phenylpyridines or phenylpyrimidines and devices made with such compounds |
| DE10215010A1 (de) | 2002-04-05 | 2003-10-23 | Covion Organic Semiconductors | Rhodium- und Iridium-Komplexe |
| US6916554B2 (en) * | 2002-11-06 | 2005-07-12 | The University Of Southern California | Organic light emitting materials and devices |
| EP1534799A4 (en) * | 2002-08-16 | 2008-02-27 | Univ Southern California | ELECTROLUMINESCENT ORGANIC MATERIALS AND DEVICES |
| US7198730B2 (en) * | 2003-08-28 | 2007-04-03 | E. I. Du Pont De Nemours And Company | Phosphorescent material |
-
2004
- 2004-02-06 US US10/774,286 patent/US7476452B2/en not_active Expired - Fee Related
-
2005
- 2005-01-28 WO PCT/US2005/003338 patent/WO2005075597A2/en active Application Filing
- 2005-01-28 JP JP2006551605A patent/JP4918365B2/ja active Active
- 2005-01-28 TW TW094102739A patent/TWI363792B/zh not_active IP Right Cessation
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004503059A (ja) * | 2000-06-30 | 2004-01-29 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | フッ素化フェニルピリジン、フェニルピリミジン及びフェニルキノリンを伴うエレクトロルミネセントイリジウム化合物及びかかる化合物で作られたデバイス |
| JP2009246373A (ja) * | 2000-07-17 | 2009-10-22 | Fujifilm Corp | 発光素子及びイリジウム錯体 |
| JP2010161410A (ja) * | 2002-10-09 | 2010-07-22 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子 |
| JP2005038847A (ja) * | 2003-06-26 | 2005-02-10 | Samsung Sdi Co Ltd | 有機金属錯体およびこれを採用した有機電界発光素子 |
| JP2005154396A (ja) * | 2003-10-30 | 2005-06-16 | Mitsubishi Chemicals Corp | 有機金属錯体およびそれを用いた有機電界発光素子 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2007524239A (ja) | 2007-08-23 |
| WO2005075597A3 (en) | 2005-12-01 |
| US20070292713A9 (en) | 2007-12-20 |
| US20050037233A1 (en) | 2005-02-17 |
| TW200604312A (en) | 2006-02-01 |
| TWI363792B (en) | 2012-05-11 |
| US7476452B2 (en) | 2009-01-13 |
| WO2005075597A2 (en) | 2005-08-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4918365B2 (ja) | フッ素化フェニルピリジン配位子を有するエレクトロルミネセンスイリジウム化合物、およびかかる化合物で製造されたデバイス | |
| US7675228B2 (en) | Electroluminescent iridium compounds with silylated, germanylated, and stannylated ligands, and devices made with such compounds | |
| KR101233855B1 (ko) | 유기금속 화합물 및 그러한 화합물로 만들어진 장치 | |
| JP4971034B2 (ja) | 赤橙色または赤色発光を有するエレクトロルミネセンスイリジウム化合物及びかかる化合物で製造されたデバイス | |
| KR100879695B1 (ko) | 불소화 페닐퀴놀린과 이리듐의 전기발광 화합물 및 이 화합물로 제조된 장치 | |
| KR100838010B1 (ko) | 플루오르화 페닐피리딘, 페닐피리미딘 및 페닐퀴놀린을갖는 전기발광 이리듐 화합물 및 이러한 화합물로 제조된장치 | |
| US7737277B2 (en) | Electroluminescent bis-cyclometalled iridium compounds and devices made with such compounds | |
| US7816016B1 (en) | Electroluminescent iridium compounds and devices made therefrom | |
| WO2005075601A1 (en) | Electroluminescent platinum compounds and devices made with such compounds | |
| US7402345B2 (en) | Electroluminescent iridium compounds with fluorinated phenylpyridine ligands, and devices made with such compounds | |
| KR100871275B1 (ko) | 불소화 페닐피리딘과 이리듐의 전기발광 화합물 및 이 화합물로 제조된 장치 | |
| AU2002231155A1 (en) | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds | |
| AU2002350128A1 (en) | Electroluminescent iridium compounds having red-orange or red emission and devices made with such compounds | |
| KR20080081209A (ko) | 불소화 페닐피리딘 화합물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080128 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080128 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110517 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110727 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120124 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120130 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150203 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4918365 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |