JP4873207B2 - 光学活性カルボン酸クロリドの精製方法 - Google Patents
光学活性カルボン酸クロリドの精製方法 Download PDFInfo
- Publication number
- JP4873207B2 JP4873207B2 JP2001050020A JP2001050020A JP4873207B2 JP 4873207 B2 JP4873207 B2 JP 4873207B2 JP 2001050020 A JP2001050020 A JP 2001050020A JP 2001050020 A JP2001050020 A JP 2001050020A JP 4873207 B2 JP4873207 B2 JP 4873207B2
- Authority
- JP
- Japan
- Prior art keywords
- acid chloride
- optically active
- carboxylic acid
- formylmandelic
- active carboxylic
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
【発明の属する技術分野】
本発明はラセミ化を抑制し、高い回収率で光学活性カルボン酸クロリドを蒸留精製する方法に関する。
【0002】
【従来の技術】
通常、一般式(1)
【0003】
【化3】
(ここで、Rは炭素数1〜8のアルキル基、炭素数1〜4のアルコキシル基、炭素数1〜4の脂肪酸でエステル化された水酸基、置換フェニル基、芳香環が無置換、あるいは置換されたアラルキル基を示す。また、*は不斉炭素が光学活性であることを意味する。)で表されるカルボン酸クロリドの光学活性体は熱に対して不安定であり、蒸留操作によって化学的な精製をおこなうために熱的履歴を与えると、徐々にラセミ化して光学純度の低い製品しか得られない。例えば式(2)
【0004】
【化4】
で表されるO−ホルミル−D−マンデル酸クロリドは、D−マンデル酸に蟻酸を作用させてO−ホルミル−D−マンデル酸を生成させ、蟻酸を取り除いた後に塩化チオニルを作用させることによって製造できる(特開昭50−126817号公報)。しかしながら、この反応液中には中間体であるO−ホルミル−D−マンデル酸が存在するためにO−ホルミル−D−マンデル酸クロリドの化学純度は低く、高い化学純度の製品を得るためには精製操作が必要である。この精製方法として、例えば蒸留操作をおこなう場合、O−ホルミル−D−マンデル酸クロリドの沸点が高いために、工業生産においては高温で長時間の熱的履歴を与えることになり、その間にラセミ化が進行して低い光学純度の目的物しか得ることができない。
【0005】
【発明が解決しようとする課題】
従って、光学活性カルボン酸クロリドの工業的に大量に生産する際のラセミ化を起こさない化学的な精製方法が望まれていた。しかしながら、工業的な大量生産に適用できる、光学活性カルボン酸クロリドがラセミ化を起こさないような化学的な精製方法は今まで全く知られていなかった。すなわち、本発明の目的は、光学活性カルボン酸クロリドのラセミ化を起こしにくい化学的精製方法を提供することにある。
【0006】
本発明者らはこのような問題を解決すべく鋭意検討を重ねた結果、今まで全く知られていなかった、短時間の熱的履歴で蒸留が可能な薄膜型蒸発缶、或いは分子蒸留装置を使用した蒸留精製を採用することによってほとんどラセミ化することなく目的の化合物が高い化学純度で取得できることを見出した。すなわち本発明は、「光学活性カルボン酸クロリドを薄膜型蒸発缶、或いは分子蒸留装置を使用して蒸留することを特徴とする光学活性カルボン酸クロリドの精製方法であって、光学活性カルボン酸クロリドが光学活性O−ホルミルマンデル酸クロリドである光学活性カルボン酸クロリドの精製方法」である。
【0009】
本発明の精製方法が適用される光学活性カルボン酸クロリドの光学活性体とは、(R)体、(S)体の何れの光学活性体も含むが、光学純度は98%ee以上である。
【0010】
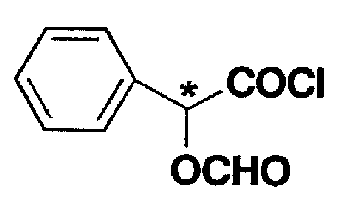
光学活性カルボン酸クロリドは、下記の式で表される光学活性O−ホルミルマンデル酸クロリドである。
【0011】
【化6】
ここで*は不斉炭素が光学活性であることを意味する。
【0012】
薄膜型蒸発缶、或いは分子蒸留装置は特に限定されるものではないが、例えば流下薄膜型蒸発缶、ターバフィルム型蒸発缶(ルーワ型蒸発缶)、流下膜式分子蒸留装置、遠心式分子蒸留装置などが使用できる。
【0013】
薄膜型蒸発缶、或いは分子蒸留装置を使用した蒸留の条件は、通常は665Pa以下、好ましくは30〜399Paの高真空で蒸留する。
【0014】
具体例として、D−マンデル酸を蟻酸に溶解し、氷冷下で塩化チオニルを添加してO−ホルミル−D−マンデル酸を合成し、次いで過剰の蟻酸を留去させたのち再度塩化チオニルを加熱下に添加することによって製造したO−ホルミル−D−マンデル酸クロリドを、伝熱面積50cm2の薄膜型蒸発缶を装着した薄膜式蒸発装置を用いて蒸留する場合には、圧力30〜399Pa、薄膜温度70〜120℃で供給速度を200〜1000g/hrで蒸留することによって、ほとんどラセミ化させることなく、高い光学純度で、且つ高い化学純度のO−ホルミル−D−マンデル酸クロリドが製造できる。
【0015】
以上のように、本発明によれば光学活性O−ホルミルマンデル酸クロリドを、ラセミ化を抑制して精製することが可能である。このようにして得られた光学活性O−ホルミルマンデル酸クロリドは医薬品の中間体として有用な化合物である。
【0016】
【実施例】
以下、実施例により本発明をさらに詳細に説明するが、本発明はこれに限定するものではない。
【0017】
なお、実施例において取得した光学活性O−ホルミルマンデル酸クロリドの光学純度は、比旋光度を測定することによって求めた。
【0018】
参考例(O−ホルミルマンデル酸クロリドの合成)
温度計、攪拌装置、コンデンサー、滴下ロート、および発生ガスの吸収装置を備えた容量2000mlの四つ口フラスコにD−マンデル酸380.2g(2.50モル)と蟻酸413.2g(4.29モル)を仕込んだ。5〜10℃に保ちながら、塩化チオニル509.8g(4.29モル)を滴下ロートから5時間かけて添加した。次いで、2時間かけて70℃まで加熱したのち、同温度下に1時間熟成した。その後、5〜6kPaに減圧して未反応の蟻酸を除去してO−ホルミルマンデル酸の粗体を得た。この粗体を70〜75℃に保ちながら、塩化チオニル410.0g(3.45モル)を滴下ロートから4時間かけて添加したのち、更に同温度下に1時間熟成した。次いで、90〜95℃で4.5〜5.5kPaまで減圧して未反応の塩化チオニルを除去してO−ホルミルマンデル酸クロリドの粗体486.8gを得た。
【0019】
実施例1
参考例に従って合成したO−ホルミルマンデル酸クロリドの粗体300gを、50cm2の伝熱面積を有する薄膜型蒸発缶を装着した薄膜式蒸発装置に1時間ほどでフィードし、蒸留した。薄膜部分の加熱温度は110〜115℃、系内の圧力は130Paとした。その結果、O−ホルミルマンデル酸クロリド278.0gを得た。このO−ホルミルマンデル酸クロリドのガスクロマトグラフィーによる化学純度は99.0%以上(原料マンデル酸からの収率91%)であった。また、20℃での比旋光度は−245.0°(C=1.0、トルエン)であり、光学純度は99.6%e.e.であった。
【0020】
実施例2
参考例に従って合成したO−ホルミルマンデル酸クロリドの粗体300gを、50cm2の伝熱面積を有する薄膜型蒸発缶を装着した薄膜式蒸発装置に1時間ほどでフィードし、蒸留した。薄膜部分の加熱温度は120〜125℃、系内の圧力は270Paとした。その結果、O−ホルミルマンデル酸クロリド275.4gを得た。このO−ホルミルマンデル酸クロリドのガスクロマトグラフィーによる化学純度は99.0%以上(原料マンデル酸からの収率90%)であった。また、20℃での比旋光度は−244.8°(C=1.0、トルエン)であり、光学純度は99.5%e.e.であった。
【0021】
比較例1
参考例に従って合成したO−ホルミルマンデル酸クロリドの粗体200gを容量300mlの減圧単蒸留装置に仕込み、115〜120℃に保った加熱浴中で、圧力約270Paで減圧蒸留してO−ホルミルマンデル酸クロリド185.5gを得た。所要時間は1.8時間であった。このO−ホルミルマンデル酸クロリドのガスクロマトグラフィーによる化学純度は99.0%以上(原料マンデル酸からの収率91%)であった。また、20℃での比旋光度は−237.4°(C=1.0、トルエン)であり、光学純度は96.5%e.e.であった。
【0022】
比較例2
参考例に従って合成したO−ホルミルマンデル酸クロリドの粗体200gを容量300mlの減圧単蒸留装置に仕込み、105〜110℃に保った加熱浴中で圧力約270Paで減圧蒸留してO−ホルミルマンデル酸クロリド183.4gを得た。所要時間は3.5時間であった。このO−ホルミルマンデル酸クロリドのガスクロマトグラフィーによる化学純度は99.0%以上(原料マンデル酸からの収率90.0%)であった。また、20℃での比旋光度は−228.2°(C=1.0、トルエン)であり、光学純度は92.8%e.e.であった。
【0023】
光学活性O−ホルミルマンデル酸クロリドをほとんどラセミ化させないで化学的精製ができる。
Claims (1)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001050020A JP4873207B2 (ja) | 2001-02-26 | 2001-02-26 | 光学活性カルボン酸クロリドの精製方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001050020A JP4873207B2 (ja) | 2001-02-26 | 2001-02-26 | 光学活性カルボン酸クロリドの精製方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002255902A JP2002255902A (ja) | 2002-09-11 |
| JP2002255902A5 JP2002255902A5 (ja) | 2008-03-27 |
| JP4873207B2 true JP4873207B2 (ja) | 2012-02-08 |
Family
ID=18911044
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001050020A Expired - Lifetime JP4873207B2 (ja) | 2001-02-26 | 2001-02-26 | 光学活性カルボン酸クロリドの精製方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4873207B2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150016133A (ko) | 2013-08-02 | 2015-02-11 | 주식회사 엘지화학 | 광반응성 화합물의 정제 방법 및 광반응성 화합물 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3928592A (en) * | 1974-02-22 | 1975-12-23 | Lilly Co Eli | Antibiotic pharmaceutical compositions |
| JPS6450840A (en) * | 1987-08-21 | 1989-02-27 | Nippon Oils & Fats Co Ltd | Method for purifying acyl halide |
| JP3010816B2 (ja) * | 1991-08-22 | 2000-02-21 | ダイセル化学工業株式会社 | 光学分割における光学異性体と溶媒との回収方法、溶媒の循環使用方法、および光学異性体の再利用方法 |
| JP3959777B2 (ja) * | 1997-04-10 | 2007-08-15 | 日本油脂株式会社 | カルボン酸クロリドの製造方法 |
| JP2000247943A (ja) * | 1999-02-23 | 2000-09-12 | Mitsui Chemicals Inc | 光学活性n−カルボニルアミノ酸エステルの製造法 |
-
2001
- 2001-02-26 JP JP2001050020A patent/JP4873207B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP2002255902A (ja) | 2002-09-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010540614A (ja) | モナチン鏡像異性体の生成 | |
| KR100794091B1 (ko) | 2-에톡시-3-(4-히드록시페닐)프로판산 및 그의 유도체의 (s)-거울상이성질체의 제조 방법 | |
| HU184790B (en) | Process for preparing 2-chloro-alkyl-propionates by means of the chlorination of alkyl-lactate | |
| JP4645986B2 (ja) | (4e)−5−クロロ−2−イソプロピル−4−ペンテン酸エステルおよびその光学活性体の製造方法 | |
| EP0182279B1 (en) | Process for the optical resolution of racemic mixtures of alpha-naphtyl-propionic acids | |
| JP4873207B2 (ja) | 光学活性カルボン酸クロリドの精製方法 | |
| JP4503754B2 (ja) | 3−ヒドロキシテトラヒドロフランの製造方法 | |
| CN104203904B (zh) | 制备酰胺的方法 | |
| JPS59175484A (ja) | N−ホルミルアスパラギン酸無水物の製造法 | |
| HUP0201418A2 (en) | Process for preparing r-(-)-carnitine from s-(-)-chlorosuccinic acid or from a derative thereof | |
| JPH029576B2 (ja) | ||
| WO2004005241A1 (en) | Process for producing optically active amide | |
| WO2003051852A1 (en) | Intermediate and process for producing optically active compound from the intermediate | |
| US7094926B2 (en) | Process for producing optically active carboxylic acid substituted in 2-position | |
| JP2000072719A (ja) | 2−ヒドロキシイソ酪酸アリルの製造方法 | |
| JPS59225144A (ja) | ピルビン酸エステルの分離方法 | |
| JPH0720917B2 (ja) | 含窒素ペルフルオロカルボン酸の光学活性体及びその製造方法 | |
| JP4397990B2 (ja) | 3−アルキルフラバノノール誘導体の精製法 | |
| JP2021042130A (ja) | N−ビニルカルボン酸アミドの製造方法 | |
| JP2002105064A (ja) | 高純度オキサゾリジノン類の製造方法 | |
| EP1489066B1 (en) | Process for production of optically active carboxylic acid | |
| KR100654923B1 (ko) | 고순도의 광학활성아미드를 연속적으로 제조하는 방법 | |
| KR100461571B1 (ko) | 고순도 (s)-1,2,4-부탄트리올의 제조방법 | |
| JP2007106702A (ja) | 光学活性含フッ素ベンジルアルコールの製造方法 | |
| JP3036661B2 (ja) | 2−クロロシクロドデカジエノンオキシムの製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20080110 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080111 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080111 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20080110 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20100303 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20100303 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20110308 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110322 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20110427 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20110427 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110518 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20111101 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20111109 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20141202 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4873207 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |