JP4675017B2 - エキソソーム分離によって精製hcvrnaを調製するための方法 - Google Patents
エキソソーム分離によって精製hcvrnaを調製するための方法 Download PDFInfo
- Publication number
- JP4675017B2 JP4675017B2 JP2001538480A JP2001538480A JP4675017B2 JP 4675017 B2 JP4675017 B2 JP 4675017B2 JP 2001538480 A JP2001538480 A JP 2001538480A JP 2001538480 A JP2001538480 A JP 2001538480A JP 4675017 B2 JP4675017 B2 JP 4675017B2
- Authority
- JP
- Japan
- Prior art keywords
- hcv
- exosome
- particles
- cell culture
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 210000001808 exosome Anatomy 0.000 title claims abstract description 72
- 238000000034 method Methods 0.000 title claims abstract description 38
- 238000000926 separation method Methods 0.000 title abstract description 6
- 241000711549 Hepacivirus C Species 0.000 claims abstract description 54
- 239000002245 particle Substances 0.000 claims abstract description 33
- 210000002381 plasma Anatomy 0.000 claims abstract description 23
- 238000000605 extraction Methods 0.000 claims abstract description 4
- 210000004027 cell Anatomy 0.000 claims description 24
- 239000011324 bead Substances 0.000 claims description 23
- 238000002360 preparation method Methods 0.000 claims description 21
- 238000004113 cell culture Methods 0.000 claims description 15
- 239000006228 supernatant Substances 0.000 claims description 13
- 238000001085 differential centrifugation Methods 0.000 claims description 11
- 108090000623 proteins and genes Proteins 0.000 claims description 9
- 102000004169 proteins and genes Human genes 0.000 claims description 8
- 241000700605 Viruses Species 0.000 claims description 7
- 239000012228 culture supernatant Substances 0.000 claims description 7
- 239000004793 Polystyrene Substances 0.000 claims description 4
- 229920002223 polystyrene Polymers 0.000 claims description 4
- 238000011534 incubation Methods 0.000 claims description 3
- 101710165845 CD81 protein Proteins 0.000 claims description 2
- 238000012360 testing method Methods 0.000 claims description 2
- 210000005260 human cell Anatomy 0.000 claims 1
- 238000002955 isolation Methods 0.000 abstract description 4
- 239000008188 pellet Substances 0.000 description 19
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 15
- 238000001262 western blot Methods 0.000 description 11
- 238000005119 centrifugation Methods 0.000 description 9
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 238000000746 purification Methods 0.000 description 6
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 5
- 101000914479 Homo sapiens CD81 antigen Proteins 0.000 description 4
- 102000043131 MHC class II family Human genes 0.000 description 4
- 108091054438 MHC class II family Proteins 0.000 description 4
- 102100027221 CD81 antigen Human genes 0.000 description 3
- 229920001917 Ficoll Polymers 0.000 description 3
- 102000003992 Peroxidases Human genes 0.000 description 3
- 108010076039 Polyproteins Proteins 0.000 description 3
- 210000000612 antigen-presenting cell Anatomy 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 108040007629 peroxidase activity proteins Proteins 0.000 description 3
- 238000003757 reverse transcription PCR Methods 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 2
- 101710091045 Envelope protein Proteins 0.000 description 2
- 101000914469 Homo sapiens CD82 antigen Proteins 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 101710188315 Protein X Proteins 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 102100021696 Syncytin-1 Human genes 0.000 description 2
- 108010067390 Viral Proteins Proteins 0.000 description 2
- 108020000999 Viral RNA Proteins 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 210000001124 body fluid Anatomy 0.000 description 2
- 239000010839 body fluid Substances 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 2
- 230000000984 immunochemical effect Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000007885 magnetic separation Methods 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 102100027217 CD82 antigen Human genes 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 241000282577 Pan troglodytes Species 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 238000010802 RNA extraction kit Methods 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 101710172711 Structural protein Proteins 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 108010003533 Viral Envelope Proteins Proteins 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 238000013378 biophysical characterization Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000002121 endocytic effect Effects 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 208000010710 hepatitis C virus infection Diseases 0.000 description 1
- 102000055772 human CD81 Human genes 0.000 description 1
- 102000045407 human CD82 Human genes 0.000 description 1
- 210000005061 intracellular organelle Anatomy 0.000 description 1
- 238000012804 iterative process Methods 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 210000002741 palatine tonsil Anatomy 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 210000003956 transport vesicle Anatomy 0.000 description 1
- 230000007332 vesicle formation Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/24011—Flaviviridae
- C12N2770/24211—Hepacivirus, e.g. hepatitis C virus, hepatitis G virus
- C12N2770/24222—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/24011—Flaviviridae
- C12N2770/24211—Hepacivirus, e.g. hepatitis C virus, hepatitis G virus
- C12N2770/24251—Methods of production or purification of viral material
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Virology (AREA)
- Medicinal Chemistry (AREA)
- Wood Science & Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Microbiology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Saccharide Compounds (AREA)
- Peptides Or Proteins (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Steroid Compounds (AREA)
Description
本発明は、C型肝炎ウイルスを単離するための方法に関する。この方法は、C型肝炎ウイルス(HCV)に感染した個体の血漿からエキソソーム(exosome)と呼ばれる粒子を分離する工程、およびこれらのエキソソーム粒子からRNAを抽出する工程を包含する。
【0002】
本明細書中に引用される全ての刊行物、マニュアル、特許および特許出願は、参考として完全に援用される。
【0003】
HCV(非A・非B型肝炎−NANBVとして以前に公知である)は、約3000アミノ酸のポリタンパク質をコードする単一のオープンリーディングフレームを有する、約10000ヌクレオチドの陽性センスRNAウイルスである。このウイルスの構造は、組換えDNA技術によって解明されているが(欧州特許出願EP−A−0318216および欧州特許出願EP−A−0388232)、このウイルス自体は、単離されておらず、そしてこのポリタンパク質のタンパク質分解によって生じた種々のウイルスタンパク質の機能のみが、同様のゲノム構造の他の同様のウイルスとの類似性によって推測されている(Chooら、PNAS USA(1991)88:2451−2455)。
【0004】
これらのウイルスタンパク質は、種々の細胞および細胞型(酵母、細菌、昆虫、植物および哺乳動物細胞)において発現される、組換え形態で全て入手可能である(Chien,D.Y.ら、PNAS USA(1992)89:10011−10015およびSpaetc,R.R.らVirology(1992)188:819−830)。
【0005】
E1およびE2と名付けられた(それぞれ、HCV−1単離物に対して番号付けた、HCVポリタンパク質のアミノ酸192〜383および384〜750に対応する)2つのタンパク質が、標的細胞へのウイルスの結合を担う、ウイルスエンベロープの外側のタンパク質であることが示唆されている。
【0006】
HCV研究は、ウイルスの制限された宿主範囲によって、かなり相当に妨げられる。HCV感染についてのただ1つの信頼性のある動物モデルは、チンパンジーである。HCV生活環の研究は、有効な細胞培養系を欠いていることによって制限されてきた。さらに、血漿および肝臓のような生物学的材料からHCVを精製するための試みは、失敗されてきた。
【0007】
本出願人らの同時係属国際特許出願PCT/IB95/00692(WO96/05513)において、本出願人らは、HCVレセプターを保持する細胞を同定するためにフローサイトメトリーを使用する方法を記載する。本出願人らは、組換えE2エンベロープタンパク質で細胞を標識することによって、フローサイトメトリーを使用して、E2に特異的に結合し得、そして従って、HCVレセプターを潜在的に保持し得る細胞を単離することによって、細胞を選別することが可能であることを示した。
【0008】
本出願人らの同時係属国際特許出願PCT/IB96/00943(WO97/09349)において、本出願人らは、HCVのE2エンベロープタンパク質に結合し得るタンパク質を同定した。
【0009】
本出願人らの同時係属国際特許出願PCT/IB98/01628(WO99/18198)において、本出願人らは、HCVに対するレセプターをコードするDNAのクローニングを報告した。このDNAは、公知の細胞タンパク質CD81をコードする遺伝子に対応する。
【0010】
しかし、HCVに対するこのレセプターの同定にもかかわらず、HCVのRNAゲノムの簡単な調製を可能にする方法について、高い必要性が存続する。これは、このウイルスの生物学への研究の進行を非常に促進し、そしてC型肝炎感染に関連する疾患の処置および予防において効果的な治療薬および診断薬の設計を加速する。
【0011】
(発明の要旨)
本発明に従って、HCVに感染した細胞培養物の上清からエキソソーム粒子を分離する工程およびこのエキソソーム粒子からRNAを抽出する工程を包含する、HCVの調製のための方法を提供する。好ましくは、このエキソソーム粒子は、HCVに感染した個体の血漿から分離される。
【0012】
HCVに感染した個体において、このウイルスは、血漿中のエキソソーム粒子に結合し、そしてこれらの粒子において富化されることが発見された。従って、これらの粒子の精製は、複雑な精製手順も高価な精製手順も必要とすることなく、HCV RNAの有意な量を簡単に調製することを可能にする。
【0013】
エキソソームは、MIIC(MHCクラスII富化区画)と呼ばれるエンドサイトーシスの(endocytic)区画の、形質膜との融合から生じる細胞内オルガネラである。これらの区画は、抗原提示細胞(APC)に存在し、そして細胞内MHCクラスII分子の大部分の局在性についての部位を形成することが示された(Neefjesら、1990)。MIICは、内部膜小胞およびシートを有するエンドサイトーシス小胞であり、そしてMHCクラスII分子がペプチドを結合する細胞内部位を示すと考えられる(Hardingら、1993)。MIICは、おそらくその制限されている膜の内側小胞形成から生じる内部小胞(エキソソーム)を含む。MIICが形質膜と融合し、MHCクラスII分子をこの構造へ挿入する場合、エキソソームは、細胞外空間へと放出される。
【0014】
エキソソーム粒子は、現在、種々のAPC(例えば、樹状細胞、扁桃B細胞、単球およびマクロファージ)に由来する細胞培養培地中に見出されている(Raposoら、1996)。これらのエキソソームは、Geuzeおよび共同研究者らにより特徴付けられ(Escola、1998)、そしていくつかの表面分子(特定の4回貫通膜タンパク質(tetraspanin membrane protein)を含む)において選択的に富化されることが見出された。
【0015】
用語「細胞培養物の上清」により、HCVに感染した細胞が増殖された上清または任意の液体が意味される。適切な液体としては、血液のような体液、および細胞がインビトロで培養された増殖培地が挙げられる。
【0016】
1つの実施形態において、エキソソームは、HCVに感染した粒子に由来する細胞株の細胞培養上清から調製され得る。このような細胞株は、HCVに感染した患者から単離され、そしてインビトロで増殖された個々の細胞から増殖され得る。
【0017】
代替的実施形態において、エキソソームは、HCVに感染した個体の血漿画分から単離され得る。血液から血漿を分離するための技術は、当業者に明らかである。
【0018】
血漿がエキソソームの調製のために採取される個体は、HCVによる感染にかかりやすい任意の動物であり得る。適切な動物としては、霊長類、好ましくは高等霊長類(例えば、チンパンジーおよびヒト)が挙げられる。もっとも好ましくは、エキソソームは、ヒト患者から調製される。
【0019】
エキソソーム粒子は、当業者に明らかな任意の適切な技術を用いて細胞培養上清から調製され得る。例としては、分画遠心分離(differential centrifugation)による調製、および以下で議論される免疫化学の技術を用いる調製が挙げられる。好ましくは、エキソソームは、Raposoら(1996)の技術に従って、分画遠心分離により調製される。
【0020】
本発明の実施形態に従って、HCVに感染した個体から得られた血漿を遠心分離して、エキソソームが富化されたペレットを与える工程、およびこのエキソソームからRNAを単離する工程の一連の工程を包含する、HCV RNAの調製のための方法を提供する。
【0021】
好ましくは、この遠心分離は、反復工程において連続的に行われる。これらの工程は、約200×gでの最初の遠心分離、次いで、約500×g、約2000×g、約10000×g、そして約70000×gの遠心分離を伴う。
【0022】
各々の遠心分離工程において得られたペレットのサンプルは、エキソソーム含有量の程度を評価し、従って、エキソソーム調製物の純度を測定するために分析され得る。この調製プロセスは、このようにして最適化され得る。エキソソーム含有量を分析するために適切な1つの技術は、SDS−PAGEおよびエキソソーム粒子に特異的なマーカーであるタンパク質に対する抗体を用いたウエスタンブロッティングによるものである。CD81および/またはCD82に対する抗体は、この点において特に適切である。これらの一次抗体のエキソソームへの結合は、例えば、この一次抗体に結合する標識した二次抗体を用いて評価され得る。例えば、抗CD81モノクローナル抗体が一次抗体として用いられ得、その一方で、標識した抗マウスIgGは、二次抗体として用いられ得る。
【0023】
本発明のこの局面の好ましい実施形態において、エキソソームは、以下のように調製され得る。細胞培養物を最初に200×gで10分間遠心分離し、そして細胞を回収し、ペレットP1とする。除去した上清を500×gで10分間2回遠心分離する;この2つのペレットをプールし、そしてペレットP2とする。上清を、2000×gで2回、15分間連続的に遠心分離し(プールしたペレットをペレットP3とする)、10000×gで30分間1回遠心分離し(回収したペレットをP4とする)、70000×gで60分間遠心分離する(ペレットP5を得る)。次いで、各ペレットのサンプルを、SDS−PAGEおよび抗CD81モノクローナル抗体、続いてペルオキシダーゼ標識抗マウスIgGを用いたウエスタンブロットにより分析する。
【0024】
上記のように、免疫化学の技術は、分画遠心分離の技術の代わりとして用いられ得る。これらの技術はまた、分画遠心分離とともに、エキソソームのより純粋な調製物を与えるために用いられ得る。
【0025】
例えば、細胞培養上清は、エキソソーム粒子の表面上のマーカータンパク質を認識する抗体でコーティングしたビーズとともにインキュベートされ得る。例えば、抗CD81および/または抗CD82抗体は、この点で用いられ得る。当業者に明らかなように、磁性ビーズ(例えば、Dynabeads,Dynal,Oslo,Norwayにより製造される磁性ビーズ)またはポリスチレンビーズ(例えば、Pierceにより作製されるポリスチレンビーズ)は、本発明のこの実施形態において特に適切である。エキソソームの精製のための他の代替方法としては、スクロース密度勾配の使用またはオルガネラ電気泳動が挙げられる(Tulpら、1994)。
【0026】
エンベロープ関連HCV RNAからなる「真正の(Bona fide)」HCV粒子は、エキソソームと会合し得るか、またはエキソソーム中に含まれる。RNAは、当業者に明らかなように、任意の適切な技術によりエキソソームから調製され得る。RNA抽出のための適切な方法は、当該分野で周知である(例えば、Sambrookら(1989)Molecular Cloning:a laboratory manual;Cold Spring Harbor Pressを参照のこと)。Qiagenにより販売されるウイルス抽出キットのような市販のRNA抽出キット(このウイルス抽出キットは、細胞非含有体液からウイルス核酸の精製を可能にするシリカゲルベースのスピンカラムを用いる)は、便宜上用いられ得る。
【0027】
本発明のなおさらなる局面に従って、精製したHCV粒子の調製物を提供する。好ましくは、このHCV粒子は、上記の方法のいずれか1つに従って調製される。HCV粒子の調製に伴う技術的困難性に起因して、精製したHCV粒子の組成物は、未だに生成されていない。従って、本発明の方法は、精製したHCV粒子の調製を初めて可能にする。従って、本発明の方法は、HCV粒子およびタンパク質の生化学的および生物物理学的特徴付けを初めて可能にする。
【0028】
本発明に従って調製した精製HCV粒子は、当業者に明らかなように、多くの適用において用いられ得る。このような適用としては、HCVに感染した個体の診断、予防および処置、ならびに治療において有用な薬剤の開発および設計、この疾患およびその進行の予防および診断が挙げられる。
【0029】
本発明のさらなる局面に従って、HCVに感染していると個体を診断する方法が提供され、この方法は、この個体から細胞の調製物を得る工程、その細胞上清からエキソソーム粒子を調製する工程、およびHCV RNAおよびタンパク質の存在についてこのエキソソーム粒子を試験する工程を包含する。好ましくは、その個体から得られた細胞の調製物は、血漿調製物である。
【0030】
本発明の種々の局面および実施形態が、分画遠心分離および免疫分離の技術を使用するエキソソームの分離に特に関して、ここで例示のためにより詳細に記載される。詳細の改変が、本発明の範囲から逸脱することなくなされ得ることが、理解される。
【0031】
(実施例1:エキソソームの調製)
最初に、エキソソームを、いくつかの細胞株(肝細胞癌細胞株(HepG2およびHuH7)およびEBV形質転換B細胞株を含む)から単離した。まず、細胞培養物を200×gで10分間遠心分離した。そして回収した細胞はペレットP1を示す。除去した上清を500×gで10分間2回遠心分離し;この2つのペレットをプールした。これはペレットP2を示す。上清を2回2000×gで15分間(プールしたペレットをP3と呼ぶ)、1回10000×gで30分間(回収したペレットはペレットP4を示す)、そして1回70000×gで60分間(ペレットP5を生じる)、連続して遠心分離した。
【0032】
次いで、各ペレットのサンプルをSDS−PAGEにおいて、そして抗CD81モノクローナル抗体を使用し、続いてペルオキシダーゼ標識抗マウスIgGを使用するウエスタンブロットにおいて、分析した。ペレットP5が、エキソソームが富化された画分であることが見出された(図1を参照のこと)。本発明者らは、いくつかの細胞株(肝細胞癌細胞株(HepG2およびHuH7)およびEBV形質転換B細胞株を含む)からエキソソームを単離した。
【0033】
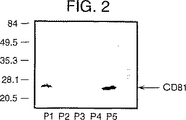
続いて、正常なヒト血漿を、エキソソームの存在について評価した。Ficoll勾配上での血液分離後に回収した希釈血漿を、上記の分画遠心分離プロトコルに従って処理し、そしてエキソソームを、抗CD81モノクローナル抗体(mAb)または抗CD82モノクローナル抗体を使用しそしてペルオキシダーゼ標識抗マウスIgGを使用するウエスタンブロットによって可視化した。健常個体の血漿中にエキソソームが存在することが、見出された(図2を参照のこと)。
【0034】
本発明者らはまた、以前に抗CD81または抗CD82でコートした磁気ビーズとの一晩インキュベーションによって、70000×gでの遠心分離工程の前に上清からエキソソームを単離することにも成功した。抗CD81コートビーズにより捕捉したエキソソーム(図3を参照のこと)または抗CD82コートビーズにより捕捉したエキソソーム(図4を参照のこと)を、Laemmli緩衝液を用いて2回抽出し、そしてSDS−PAGEおよびウエスタンブロッティングによって検出した。
【0035】
(実施例2:HCV RNAの調製)
上記に示される結果を考慮して、ここで、エキソソームを、HCV RNAが富化されたHCV感染患者の血漿から単離し得る。この実験アプローチは以下の通りである。
【0036】
Ficoll分離後に収集したHCV感染ヒト血液からの血漿を、上記の分画遠心分離プロトコルに従って処理する。10000×gでの遠心分離工程から回収したエキソソーム富化上清を、抗CD81コート磁気ビーズとともに一晩インキュベートする。あるいは、2つの清澄(clearing)工程の後、HCV感染血漿を、抗CD81コート磁気ビーズとの一晩インキュベーションの前に、20000×gで遠心分離し得る。次いで、磁気ビーズを、50mM Tris−HCl(pH8.0)、1mM EDTA、および100mM NaCl(TEN)緩衝液中の1% BSAにおいて磁気分離によって3回洗浄し、そしてウイルスRNAを、Viral Extraction Kit(Qiagen)を用いて抽出する。HCV RNAについての定量的RT−PCRを、以前(Pileriら、1998)に記載されたように実施する。
【0037】
HCV感染血漿からエキソソームを捕捉するための別の方法(以前(Pileriら、1998)に記載されたようなポリスチレンビーズ(1/4インチ直径)の使用を含む)を試験し得る。
【0038】
ヒト血漿中のエキソソームは、HCV RNAおよび/または構造タンパク質に富む。
【0039】
(実施例3:HCV感染患者の血液からのエキソソームの単離)
ここで、本発明者らは、正常なヒト血漿について上記で使用したプロトコル採用する、反復遠心分離工程あるいはヒトCD81またはCD82分子に対するモノクローナル抗体での免疫選択のいずれかによる、HCV感染患者の血液からのエキソソームの首尾よい単離を確認する。次いで、エキソソームを、Laemmli緩衝液に抽出し、そしてCD81(エキソソーム中に富むマーカー)を、SDS−PAGEおよびウエスタンブロッティングによって可視化した(図5を参照のこと)。この作業は、HCV患者の血液からのエキソソーム調製物中のCD81タンパク質の存在を確認する。
【0040】
さらに、感染患者から調製したエキソソームにおいて、HCV RNAは、定量的RT PCRを使用して検出された(以下の表を参照のこと)。
【0041】
Ficoll分離後に回収したHCV感染ヒト血液由来の血漿を、上記の分画遠心分離プロトコルに従って処理した。10000×gでのこの遠心分離工程から収集したエキソソーム富化上清を、抗CD81または抗CD82でコートした磁気ビーズ(20μgの精製モノクローナル抗体/2.5×107の磁気ビーズ(Dynal))と共に一晩インキュベートした。次いで、磁気ビーズを、磁気分離によってリン酸緩衝液中1%BSAで3回洗浄し、そしてウイルスRNAを、Trizol試薬(Life Technology)を用いて抽出した。
【0042】
HCV RNAについての定量的RT−PCRを、以前に記載のように行った(Pileriら、1998)。
【0043】
表:感染患者由来のエキソソームからのHCVのRT−PCR
【0044】
【表1】
(参考文献)
Escola J.−M.ら(1998)J.Biol.Chem.273:20121−20127.
Harding C.V.およびGeuze H.J.(1993)J.Immunol.151:3988−3998.
Neefjes J.J.ら(1990)Cell 61:171−183. Pileri P.ら(1998)Science 282:938−941.
Raposo G.ら(1996)J.Exp.Med.183:1161−1172.
Tulp A.ら(1994)Nature 369:120−126.。
【図面の簡単な説明】
【図1】 図1は、分画遠心分離工程によるHepG2細胞培養培地からのエキソソーム精製を示す、ウエスタンブロットを示す。
【図2】 図2は、分画遠心分離工程によるヒト血漿からのエキソソーム精製を示す、ウエスタンブロットを示す。
【図3】 図3は、抗CD81コート磁気ビーズによるエキソソーム捕捉および選別を示す、ウエスタンブロットを示す。
【図4】 図4は、抗CD82コート磁気ビーズによるエキソソーム捕捉および選別を示す、ウエスタンブロットを示す。
【図5】 図5は、HCV感染患者からのエキソソーム捕捉を示す、ウエスタンブロットを示す。
Claims (12)
- 精製HCV RNAを調製するための方法であって、
HCVに感染した細胞培養物の上清からエキソソーム粒子を分離する工程、および
該エキソソーム粒子からRNAを抽出する工程
を包含する、方法。 - 前記エキソソーム粒子が、C型肝炎ウイルスに感染した個体の血漿から分離される、請求項1に記載の方法。
- 前記エキソソーム粒子が、分画遠心分離によって前記細胞培養上清から調製される、請求項1または請求項2に記載の方法。
- 前記細胞培養上清を、抗体でコートしたビーズと共にインキュベートする工程をさらに包含し、該抗体が、抗CD81抗体または抗CD82抗体である、請求項3に記載の方法。
- 前記エキソソーム粒子が、前記細胞培養上清を、抗体でコートしたビーズと共にインキュベートすることによって、前記細胞培養上清から調製され、該抗体が、抗CD81抗体または抗CD82抗体である、請求項1または請求項2に記載の方法。
- 前記ビーズが、磁気ビーズである、請求項4〜5のいずれか1項に記載の方法。
- 前記ビーズが、ポリスチレンビーズである、請求項4〜5のいずれか1項に記載の方法。
- 前記HCV RNAが、ウイルス抽出キットを使用して、前記エキソソーム粒子から抽出される、請求項1〜7のいずれか1項に記載の方法。
- 前記エキソソーム粒子が、CD81タンパク質に富む、請求項1〜8のいずれか1項に記載の方法。
- 前記細胞培養物が、ヒト細胞培養物である、請求項1〜9のいずれか1項に記載の方法。
- 個体から得たサンプル中のHCVを検出するための方法であって、
該個体由来の細胞の調製物の細胞上清からエキソソーム粒子を調製する工程、および
該エキソソーム粒子をHCV RNAおよびHCVタンパク質の存在について試験する工程
を包含する、方法。 - 前記細胞の調製物が、血漿調製物である、請求項11に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB9927320.3 | 1999-11-18 | ||
| GBGB9927320.3A GB9927320D0 (en) | 1999-11-18 | 1999-11-18 | Exosome separation |
| PCT/IB2000/001801 WO2001036601A1 (en) | 1999-11-18 | 2000-11-20 | Method for the preparation of purified hcv rna by exosome separation |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2003514523A JP2003514523A (ja) | 2003-04-22 |
| JP2003514523A5 JP2003514523A5 (ja) | 2007-11-22 |
| JP4675017B2 true JP4675017B2 (ja) | 2011-04-20 |
Family
ID=10864765
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001538480A Expired - Fee Related JP4675017B2 (ja) | 1999-11-18 | 2000-11-20 | エキソソーム分離によって精製hcvrnaを調製するための方法 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US7198923B1 (ja) |
| EP (1) | EP1230347B1 (ja) |
| JP (1) | JP4675017B2 (ja) |
| AT (1) | ATE373084T1 (ja) |
| AU (1) | AU1721801A (ja) |
| CA (1) | CA2392075C (ja) |
| CY (1) | CY1107521T1 (ja) |
| DE (1) | DE60036403T2 (ja) |
| DK (1) | DK1230347T3 (ja) |
| ES (1) | ES2292489T3 (ja) |
| GB (1) | GB9927320D0 (ja) |
| PT (1) | PT1230347E (ja) |
| WO (1) | WO2001036601A1 (ja) |
Families Citing this family (88)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9927320D0 (en) * | 1999-11-18 | 2000-01-12 | Chiron Spa | Exosome separation |
| US8021847B2 (en) | 2004-06-02 | 2011-09-20 | Proxy Life Science Holdings, Inc. | Microvesicle-based compositions and methods |
| JP2008501336A (ja) * | 2004-06-02 | 2008-01-24 | ソースフアーム・インコーポレイテツド | Rnaを含有する微小胞およびそのための方法 |
| US8288172B2 (en) * | 2006-03-09 | 2012-10-16 | Aethlon Medical, Inc. | Extracorporeal removal of microvesicular particles |
| US9085778B2 (en) * | 2006-05-03 | 2015-07-21 | VL27, Inc. | Exosome transfer of nucleic acids to cells |
| US8617806B2 (en) * | 2008-01-25 | 2013-12-31 | Hansabiomed Ou | Method to measure and characterize microvesicles in the human body fluids |
| SG10201609507TA (en) * | 2008-02-01 | 2017-01-27 | Gen Hospital Corp | Use of microvesicles in diagnosis, prognosis and treatment of medical diseases and conditions |
| US20110195426A1 (en) | 2009-07-16 | 2011-08-11 | The General Hospital Corporation | Nucleic acids analysis |
| US11266736B2 (en) | 2008-04-17 | 2022-03-08 | Vin De Bona Trading Company Pte Ltd | Method of painting micro vesicles |
| CN102105598A (zh) * | 2008-06-20 | 2011-06-22 | 代理生命科学控股公司 | 基于微泡的组合物和方法 |
| US10545149B2 (en) * | 2008-10-06 | 2020-01-28 | Morehouse School Of Medicine | Detection of HIV-related proteins in urine |
| US9487837B2 (en) * | 2008-10-06 | 2016-11-08 | Morehouse School Of Medicine | Exosome-mediated diagnosis of hepatitis virus infections and diseases |
| EP2358912B1 (en) | 2008-10-30 | 2016-10-12 | Caris Life Sciences Switzerland Holdings GmbH | Methods for assessing rna patterns |
| GB2463401B (en) | 2008-11-12 | 2014-01-29 | Caris Life Sciences Luxembourg Holdings S A R L | Characterizing prostate disorders by analysis of microvesicles |
| JP5713325B2 (ja) | 2009-04-17 | 2015-05-07 | アイシス イノヴェイション リミテッド | 遺伝物質の送達用の組成物 |
| BRPI0900815A2 (pt) * | 2009-04-23 | 2010-12-28 | Sociedade Benef Israelita Bras Hospital Albert Einstein | método para isolamento de exossomos a partir de soluções biológicas utilizando nanopartìculas de óxido de ferro |
| US20130029339A1 (en) | 2009-09-09 | 2013-01-31 | The General Hospital Corporation | Use of microvesicles in analyzing kras mutations |
| WO2011031877A1 (en) | 2009-09-09 | 2011-03-17 | The General Hospital Corporation | Use of microvesicles in analyzing nucleic acid profiles |
| JPWO2011049059A1 (ja) * | 2009-10-22 | 2013-03-14 | 国立大学法人岐阜大学 | Rna内包キャリア組成物 |
| US20130203061A1 (en) | 2009-11-30 | 2013-08-08 | Michael KLASS | Methods and systems for isolating, storing, and analyzing vesicles |
| KR20130056855A (ko) | 2010-03-01 | 2013-05-30 | 카리스 라이프 사이언스 룩셈부르크 홀딩스 | 치료진단용 생물학적 지표들 |
| AU2011237669B2 (en) | 2010-04-06 | 2016-09-08 | Caris Life Sciences Switzerland Holdings Gmbh | Circulating biomarkers for disease |
| WO2011156763A1 (en) | 2010-06-11 | 2011-12-15 | Hitachi Chemical Co., Ltd. | Methods for characterizing kidney function |
| WO2011156734A2 (en) * | 2010-06-11 | 2011-12-15 | Hitachi Chemical Co., Ltd. | Method of characterizing vascular diseases |
| WO2012006476A2 (en) | 2010-07-07 | 2012-01-12 | Aethlon Medical, Inc. | Methods and compositions for quantifying exosomes |
| US20140045915A1 (en) | 2010-08-31 | 2014-02-13 | The General Hospital Corporation | Cancer-related biological materials in microvesicles |
| JP6219721B2 (ja) | 2010-11-10 | 2017-10-25 | エキソソーム ダイアグノスティックス インコーポレイテッド | 核酸含有粒子の単離および該粒子からの核酸の抽出のための方法 |
| AU2012253366A1 (en) | 2011-05-11 | 2014-01-09 | Exosome Diagnostics, Inc. | Nucleic acid extraction from heterogeneous biological materials |
| JP5823031B2 (ja) | 2011-06-10 | 2015-11-25 | 日立化成株式会社 | 小胞捕捉デバイスおよびそれを用いるための方法 |
| US20140275211A1 (en) | 2011-06-21 | 2014-09-18 | Alnylam Pharmaceuticals, Inc. | Assays and methods for determining activity of a therapeutic agent in a subject |
| WO2013028788A1 (en) | 2011-08-22 | 2013-02-28 | Exosome Diagnostics, Inc. | Urine biomarkers |
| CN103917869A (zh) * | 2011-09-22 | 2014-07-09 | 洛斯安第斯大学 | 用于监测、诊断和/或预后早期急性肾损伤的方法 |
| WO2013071239A1 (en) | 2011-11-10 | 2013-05-16 | Exosome Diagnostics, Inc. | Cerebrospinal fluid assay |
| GB201121070D0 (en) | 2011-12-07 | 2012-01-18 | Isis Innovation | composition for delivery of biotherapeutics |
| WO2014012168A1 (en) | 2012-07-19 | 2014-01-23 | Anirban Ghosh | Method for the isolation of microvesicles |
| CA2883220C (en) | 2012-08-30 | 2022-09-20 | Exosome Diagnostics, Inc. | Controls for nucleic acid assays |
| WO2014055775A1 (en) | 2012-10-03 | 2014-04-10 | Exosome Diagnostics, Inc. | Use of microvesicles in diagnosis, prognosis, and treatment of medical diseases and conditions |
| DK2906717T3 (en) | 2012-10-11 | 2019-04-01 | Vin De Bona Trading Company Pte Ltd | PROCEDURE FOR PAINTING MICROVESICS |
| US10942184B2 (en) | 2012-10-23 | 2021-03-09 | Caris Science, Inc. | Aptamers and uses thereof |
| CN110106229B (zh) | 2013-01-03 | 2023-03-28 | 外来体诊断公司 | 用于分离微囊泡的方法 |
| EP2972193B1 (en) | 2013-03-13 | 2019-12-18 | University Of Miami | Method for isolation and purification of microvesicles from cell culture supernatants and biological fluids |
| WO2014182330A1 (en) | 2013-05-06 | 2014-11-13 | Hitachi Chemical Company Ltd | Devices and methods for capturing target molecules |
| AU2014305994B2 (en) | 2013-08-06 | 2019-02-21 | Exosome Diagnostics, Inc. | Urine biomarker cohorts, gene expression signatures, and methods of use thereof |
| JP2016533752A (ja) | 2013-08-28 | 2016-11-04 | カリス ライフ サイエンシズ スウィッツァーランド ホー | オリゴヌクレオチドプローブおよびその使用 |
| TWI708058B (zh) * | 2013-10-24 | 2020-10-21 | 美商納諾索米克斯公司 | 阿茲海默症及其他神經退化性疾病之生物標記及診斷方法 |
| CN106029898B (zh) * | 2014-01-21 | 2020-02-28 | 莫尔豪斯医学院 | 外来体介导的感染和疾病的检测 |
| EP3125907A4 (en) | 2014-04-01 | 2017-11-29 | Cornell University | Use of double-stranded dna in exosomes: a novel biomarker in cancer detection |
| US11268085B2 (en) | 2014-05-27 | 2022-03-08 | Exosome Diagnostics, Inc. | Methods for isolating microvesicles and extracting nucleic acids from biological samples |
| CA3084920C (en) | 2014-07-09 | 2023-02-28 | Exosome Diagnostics, Inc. | Methods for isolating microvesicles and extracting nucleic acids from biological samples |
| EP3169691B1 (en) | 2014-07-17 | 2020-09-02 | The Trustees Of The University Of Pennsylvania | Methods for using exosomes to monitor transplanted organ status |
| US10266895B2 (en) | 2014-11-05 | 2019-04-23 | Hitachi Chemical Company Ltd. | Exosomes and microvesicles in intestinal luminal fluids and stool and use of same for the assessment of inflammatory bowel disease |
| US10370719B2 (en) | 2014-11-12 | 2019-08-06 | Hitachi Chemical Co., Ltd. | Method and device for diagnosing organ injury |
| EP3112474A1 (en) | 2015-06-29 | 2017-01-04 | Evonik Degussa GmbH | Method of detecting avian necrotic enteritis |
| CA2979361A1 (en) | 2015-03-09 | 2016-09-15 | Caris Science, Inc. | Method of preparing oligonucleotide libraries |
| EP3307890A1 (en) | 2015-06-10 | 2018-04-18 | Board of Regents, The University of Texas System | Use of exosomes for the treatment of disease |
| EP3314027A4 (en) | 2015-06-29 | 2019-07-03 | Caris Science, Inc. | THERAPEUTIC OLIGONUCLEOTIDES |
| CA2993652A1 (en) | 2015-07-28 | 2017-02-02 | Caris Science, Inc. | Targeted oligonucleotides |
| US11028443B2 (en) | 2015-08-31 | 2021-06-08 | Showa Denko Materials Co., Ltd. | Molecular methods for assessing urothelial disease |
| EP3165926A1 (en) | 2015-11-06 | 2017-05-10 | Humanitas Mirasole S.p.A. | Method for characterization of cell specific microvesicles |
| US20190093172A1 (en) | 2016-04-15 | 2019-03-28 | Exosome Diagnostics, Inc. | Plasma-based detection of anaplastic lymphoma kinase (alk) nucleic acids and alk fusion transcripts and uses thereof in diagnosis and treatment of cancer |
| US11702702B2 (en) | 2016-04-15 | 2023-07-18 | Predicine, Inc. | Systems and methods for detecting genetic alterations |
| CN110199019B (zh) | 2016-05-02 | 2024-09-10 | Encodia有限公司 | 采用核酸编码的大分子分析 |
| US11214833B2 (en) | 2016-05-05 | 2022-01-04 | Exosome Diagnostics, Inc. | Profiling microvesicle nucleic acids and uses thereof as signatures in diagnosis of renal transplant rejection |
| US10808240B2 (en) | 2016-05-13 | 2020-10-20 | Exosome Diagnostics, Inc. | Automated and manual methods for isolation of extracellular vesicles and co-isolation of cell-free DNA from biofluids |
| IL247368A0 (en) | 2016-08-18 | 2016-11-30 | Yeda Res & Dev | Diagnostic and therapeutic uses of exosomes |
| US11174503B2 (en) | 2016-09-21 | 2021-11-16 | Predicine, Inc. | Systems and methods for combined detection of genetic alterations |
| WO2018055080A1 (en) | 2016-09-22 | 2018-03-29 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for reprograming immune environment in a subject in need thereof |
| WO2018076018A1 (en) | 2016-10-21 | 2018-04-26 | Exosome Diagnostics, Inc. | Sequencing and analysis of exosome associated nucleic acids |
| CN110446790B (zh) | 2016-11-30 | 2023-03-31 | 外来体诊断公司 | 使用外来体rna和无细胞dna检测血浆中的突变的方法和组合物 |
| GB2559319B (en) * | 2016-12-23 | 2019-01-16 | Cs Genetics Ltd | Reagents and methods for the analysis of linked nucleic acids |
| EP3562959A2 (en) | 2017-01-02 | 2019-11-06 | Exosome Diagnostics, Inc. | Methods to distinguish rna and dna in a combined preparation |
| KR20200006108A (ko) | 2017-05-12 | 2020-01-17 | 에보니크 오퍼레이션즈 게엠베하 | 동물에서 씨. 퍼프린젠스 유발된 질환을 검출하는 방법 |
| JP7225121B2 (ja) | 2017-05-17 | 2023-02-20 | エクソサム ダイアグノスティクス,インコーポレイティド | 微小胞核酸および/またはタンパク質、並びに腎移植拒絶反応マーカーとしてのその使用 |
| US11899024B2 (en) | 2017-07-12 | 2024-02-13 | Exosome Diagnostics, Inc. | Treatment and diagnosis of parkinson's disease using isolated and enriched populations of biofluid-derived extracellular vesicles |
| US11345957B2 (en) | 2017-07-18 | 2022-05-31 | Exosome Diagnostics, Inc. | Methods of treating glioblastoma in a subject informed by exosomal RNA signatures |
| EP3704249A4 (en) | 2017-10-31 | 2021-10-27 | Encodia, Inc. | ANALYSIS KITS USING A NUCLEIC ACID CODING AND / OR LABEL |
| WO2019094578A1 (en) | 2017-11-09 | 2019-05-16 | Alnylam Pharmaceuticals Inc. | Assays and methods for determining expression of the lect2 gene |
| CN110123838B (zh) * | 2018-02-02 | 2022-04-01 | 上海睿泰生物科技股份有限公司 | 负载白藜芦醇的人多能干细胞外泌体及其制备方法与用途 |
| CN110123841A (zh) * | 2018-02-09 | 2019-08-16 | 上海市第六人民医院 | 负载白藜芦醇的人多能干细胞外泌体在制备治疗生殖系统疾病药物的用途 |
| US12031991B2 (en) | 2018-03-02 | 2024-07-09 | Evonik Operations Gmbh | In vitro method for detecting intestinal barrier failure in animals |
| WO2019236853A1 (en) | 2018-06-06 | 2019-12-12 | Exosome Diagnostics, Inc. | Methods for developing urine biomarkers and for detecting bladder cancer |
| US20210403881A1 (en) | 2018-11-20 | 2021-12-30 | Exosome Diagnostics, Inc. | Compositions and methods for internal controls of microvesicle isolations |
| WO2020223000A1 (en) | 2019-04-30 | 2020-11-05 | Encodia, Inc. | Methods for preparing analytes and related kits |
| US20220412971A1 (en) * | 2019-09-18 | 2022-12-29 | Exosome Diagnostics, Inc. | Compositions, methods, and kits for the isolation of extracellular vesicles |
| IL297228A (en) | 2020-04-13 | 2022-12-01 | Exoprother Medical Ltd | Cellular vesicles containing non-mutant p53 for antiviral therapy |
| US20210322483A1 (en) | 2020-04-16 | 2021-10-21 | Ichilov Tech Ltd. | Cell-derived particles presenting heterologous cd24 and use thereof in therapy |
| IL277743A (en) | 2020-10-01 | 2022-04-01 | Yeda Res & Dev | A method for diagnosing breast cancer |
| TW202214851A (zh) * | 2020-10-07 | 2022-04-16 | 國立中央大學 | 外泌體核酸萃取方法 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| HU225068B1 (en) * | 1989-03-17 | 2006-05-29 | Chiron Corp | Process for producing diagnostics and vaccine of nanbh |
| US5372928A (en) * | 1989-09-15 | 1994-12-13 | Chiron Corporation | Hepatitis C virus isolates |
| EP0527786A1 (en) * | 1990-04-03 | 1993-02-24 | Southwest Foundation For Biomedical Research | Purified hcv and hcv proteins and peptides |
| GB9416671D0 (en) | 1994-08-17 | 1994-10-12 | Biocine Spa | Assay |
| AU6632496A (en) | 1995-08-03 | 1997-03-05 | Rijksuniversiteit Te Leiden | Cell derived antigen presenting vesicles |
| GB9517926D0 (en) | 1995-09-01 | 1995-11-01 | Biocine Spa | Binding protein |
| FR2766205B1 (fr) | 1997-07-16 | 2002-08-30 | Inst Nat Sante Rech Med | Nouveau procede de sensibilisation de cellules presentatrices d'antigene et nouveaux moyens pour la mise en oeuvre du procede |
| ES2334727T3 (es) * | 1997-10-06 | 2010-03-15 | Novartis Vaccines And Diagnostics S.R.L. | Proteina receptora cd81 de la hepatitis c. |
| DE69836758T2 (de) | 1997-11-06 | 2007-10-11 | Innogenetics N.V. | Apo b, annexin v und tubulin: medizinische und diagnostische verwendung und verwendung zur purifikation von hcv |
| GB9927320D0 (en) * | 1999-11-18 | 2000-01-12 | Chiron Spa | Exosome separation |
-
1999
- 1999-11-18 GB GBGB9927320.3A patent/GB9927320D0/en not_active Ceased
-
2000
- 2000-11-20 AU AU17218/01A patent/AU1721801A/en not_active Abandoned
- 2000-11-20 CA CA2392075A patent/CA2392075C/en not_active Expired - Lifetime
- 2000-11-20 EP EP00979837A patent/EP1230347B1/en not_active Expired - Lifetime
- 2000-11-20 DE DE60036403T patent/DE60036403T2/de not_active Expired - Lifetime
- 2000-11-20 AT AT00979837T patent/ATE373084T1/de active
- 2000-11-20 DK DK00979837T patent/DK1230347T3/da active
- 2000-11-20 ES ES00979837T patent/ES2292489T3/es not_active Expired - Lifetime
- 2000-11-20 PT PT00979837T patent/PT1230347E/pt unknown
- 2000-11-20 US US10/130,467 patent/US7198923B1/en not_active Expired - Lifetime
- 2000-11-20 WO PCT/IB2000/001801 patent/WO2001036601A1/en active IP Right Grant
- 2000-11-20 JP JP2001538480A patent/JP4675017B2/ja not_active Expired - Fee Related
-
2007
- 2007-01-30 US US11/699,925 patent/US7807438B2/en not_active Expired - Fee Related
- 2007-12-07 CY CY20071101559T patent/CY1107521T1/el unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CA2392075A1 (en) | 2001-05-25 |
| ES2292489T3 (es) | 2008-03-16 |
| CY1107521T1 (el) | 2013-03-13 |
| EP1230347A1 (en) | 2002-08-14 |
| CA2392075C (en) | 2011-01-04 |
| DE60036403T2 (de) | 2008-06-12 |
| WO2001036601A1 (en) | 2001-05-25 |
| US20070254351A1 (en) | 2007-11-01 |
| JP2003514523A (ja) | 2003-04-22 |
| US7198923B1 (en) | 2007-04-03 |
| ATE373084T1 (de) | 2007-09-15 |
| US7807438B2 (en) | 2010-10-05 |
| DE60036403D1 (de) | 2007-10-25 |
| GB9927320D0 (en) | 2000-01-12 |
| PT1230347E (pt) | 2007-12-20 |
| AU1721801A (en) | 2001-05-30 |
| DK1230347T3 (da) | 2007-11-05 |
| EP1230347B1 (en) | 2007-09-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4675017B2 (ja) | エキソソーム分離によって精製hcvrnaを調製するための方法 | |
| US8460912B2 (en) | Nucleic acid construct containing full length genome of human hepatitis C virus, recombinant full length virus genome-replicating cells having the nucleic acid construct transferred thereinto and method of producing hepatitis C virus particle | |
| US5747339A (en) | Non-A, non-B hepatitis virus genomic CDNA and antigen polypeptide | |
| JP4021493B2 (ja) | C型肝炎ウイルス様粒子の合成および精製 | |
| JPH04501203A (ja) | 後―輸血性,非―a,非―b型肝炎ウィルス及び抗原 | |
| JP2003514523A5 (ja) | ||
| AU2008276880B2 (en) | Production and use of epitope-tagged hepatitis C virus particle | |
| KR950012971B1 (ko) | 비-A, 비-B 간염 비루스 게놈 cDNA 및 항원 폴리펩티드 | |
| US5218099A (en) | Post-transfusion, non-A, non-B hepatitis virus polynucleotides | |
| EP0463848A2 (en) | Non-A, non-B hepatitis virus particles | |
| Konishi et al. | Enzyme‐linked immunosorbent assay using recombinant antigens for serodiagnosis of Japanese encephalitis | |
| US9096868B2 (en) | Polynucleotides allowing the expression and secretion of recombinant pseudo-virus containing foreign epitopes, their production, and use | |
| JP3061258B2 (ja) | 非a非b非c非d非e型肝炎試薬及びそれらの使用方法 | |
| EP0527786A1 (en) | Purified hcv and hcv proteins and peptides | |
| WO2019219154A1 (en) | Separation of antigens and hcv by diluted acids | |
| US6548295B2 (en) | Complex of lipo-viro-particles, method of preparation and applications | |
| JPH06303980A (ja) | 非A非B型肝炎ウイルス遺伝子cDNAおよび抗原ポリペプチド | |
| Lew | Infectivity of lymphoid cell-derived woodchuck hepatitis virus in an in vitro experimental system | |
| WO2007069368A1 (ja) | C型肝炎ウイルス由来ペプチド |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071001 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20071001 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100715 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101014 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110118 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110125 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140204 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4675017 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |