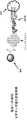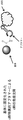JP2016533752A - オリゴヌクレオチドプローブおよびその使用 - Google Patents
オリゴヌクレオチドプローブおよびその使用 Download PDFInfo
- Publication number
- JP2016533752A JP2016533752A JP2016537869A JP2016537869A JP2016533752A JP 2016533752 A JP2016533752 A JP 2016533752A JP 2016537869 A JP2016537869 A JP 2016537869A JP 2016537869 A JP2016537869 A JP 2016537869A JP 2016533752 A JP2016533752 A JP 2016533752A
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- disease
- oligonucleotide
- oligonucleotides
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/115—Aptamers, i.e. nucleic acids binding a target molecule specifically and with high affinity without hybridising therewith ; Nucleic acids binding to non-nucleic acids, e.g. aptamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1034—Isolating an individual clone by screening libraries
- C12N15/1048—SELEX
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/5308—Immunoassay; Biospecific binding assay; Materials therefor for analytes not provided for elsewhere, e.g. nucleic acids, uric acid, worms, mites
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/16—Aptamers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2525/00—Reactions involving modified oligonucleotides, nucleic acids, or nucleotides
- C12Q2525/10—Modifications characterised by
- C12Q2525/205—Aptamer
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/112—Disease subtyping, staging or classification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
Abstract
Description
本出願は、2013年8月28日に出願された米国特許仮出願第61/871,107号;2013年9月6日に出願された同第61/874,621号;2013年11月6日に出願された同第61/900,975号;2013年12月5日に出願された同第61/912,471号;2014年1月6日に出願された同第61/924,192号;2014年3月6日に出願された同第61/949,216号;2014年4月3日に出願された同第61/974,949号;2014年5月7日に出願された同第61/990,085号;2014年5月16日に出願された同第61/994,704号;および2014年7月14日に出願された同第62/024,436号の恩典を主張し、これらの全ての出願は、その全体が参照により本明細書に組み入れられる。
MPEP §1730 II.B.2(a)において認可されかつ明記される米国特許商標庁EFS-WEBサーバを介した配列表の以下の電子的提出物の全内容は、参照によりその全体があらゆる目的のために本明細書に組み入れられる。この配列表は、電子的に提出された、以下に特定されるテキストファイルに包含されている。
ファイル名:37901820601SeqList.txt
作成日:2014年8月27日
サイズ(バイト):101,923,503バイト
本発明は、微小胞表面抗原に結合することが可能なアプタマーの分野に概して関連し、これらのアプタマーは、微小胞が関係する癌および/または他の疾患もしくは障害の治療薬および診断薬として有用である。本発明はさらに、微小胞に結合することが可能なアプタマーの投与のための材料および方法にも関連する。微小胞は、癌、例えば乳癌であることを示す細胞に由来し得る。
アプタマーは、全面的にインビトロプロセスによって作製され、このことは、治療用リードを含む最初のリードの迅速な作製を可能にする。インビトロ選択は、アプタマーの特異性および親和性が厳しく管理されることを可能にし、かつ毒性および非免疫原性の標的の両方に対するリードを含むリードの作製を可能にする。
あるクラスのアプタマーは、毒性も免疫原性もほとんど無いかまたは全くないことが実証されている。高レベルのアプタマーによるラットまたはウッドチャックの長期にわたる投薬(毎日10 mg/kgを90日間)において、臨床的、細胞の、または生化学的測定のどれによっても毒性は観察されない。一方、多くのモノクローナル抗体の有効性は、抗体自身に対する免疫応答によって激しく制限され得る。最も可能性が高い理由としてアプタマーがMHCを介してT細胞に対して提示されず、かつ免疫応答は一般に核酸断片を認識しないようにされていることから、アプタマーに対する抗体を顕在化させることは極めて困難である。
このことから、最近承認された抗体治療薬は、静脈内注入(典型的に2〜4時間にわたる)によって投与され、アプタマーは、皮下注射によって投与することができる(皮下投与によるアプタマーの生物学的利用率は、サルにおける研究では80%を超える(Tucker et al., J. Chromatography B. 732: 203-212, 1999(非特許文献1)))。この違いは、比較的低い溶解性およびこれによる大部分の治療用mAbに必要な多大な量に主に起因する。良好な溶解性(>150 mg/mL)かつ比較的低い分子量(アプタマー:10〜50 kDa;抗体:150 kDa)では、アプタマーの一週間の用量は、注射により0.5 mL未満の量で送達され得る。加えて、小さいサイズのアプタマーは、これらが、抗体または抗体断片は侵入することができない立体構造的に狭窄の領域中に侵入することを可能にする。このことは、アプタマーをベースにした治療薬または予防法のさらに別の利点を示している。
アプタマーは、化学的に合成され、かつ診断的または治療的用途のための生産需要を満たすために必要に応じて容易にスケール変更される。生産のスケール変更における問題は、現在一部の生物製剤の有用性を制限しており、かつ大規模なタンパク質生産プラントの資本コストは莫大であるが、単一の大規模オリゴヌクレオチド合成装置は、100 kg/年を上回って生産することができ、かつ必要とする初期投資は比較的控えめである。キログラムスケールでのアプタマー合成用の製品の現在のコストは$100/gと推定され、これは高度に最適化された抗体用のコストに匹敵する。
アプタマーは、化学的に頑強である。これらは元来、熱および変性剤などの因子に対する暴露に続いて活性を回復するように適合されており、かつ長期の間(>1年)、室温で凍結乾燥粉末として保管することができる。
本明細書で言及したすべての刊行物、特許、および特許出願は、個々の刊行物、特許、または特許出願が参照により本明細書に組み入れられているよう具体的かつ個々に示されているのと同程度に、参照により本明細書に組み入れられる。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害はアルツハイマー病を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。また、疾患または障害は気管支喘息を含み得、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害は慢性閉塞性肺疾患(COPD)を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害は急性心筋梗塞(AMI)または急性心不全を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害はクローン病を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連して、疾患または障害はII型糖尿病を含み得、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連して、疾患または障害は多発性硬化症を含み得、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害はパーキンソン病を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害は潰瘍性大腸炎を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
に対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列を含む;(b)オフセット領域が、以下の配列:5'-T(SEQ ID NO: 510765)、5'-CT(SEQ ID NO: 510766)および5'-ACT(SEQ ID NO: 510767)の少なくとも一つに対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である1、2、3、4、5、6、7、8、9または10ヌクレオチドを含む;(c)可変領域が20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49または50ヌクレオチドを含む;および/または(d)左プライマー領域が、SEQ ID NO: 510768および510769から選択される配列に対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列を含むようなものである。可変領域は、本明細書に提供される「GC」ライブラリー配列を含み得る。
(図2A〜2F)微小胞表面抗原のようなバイオマーカーを評価する方法を示す。図2Aは、捕捉物質の標的抗原を発現する小胞を捕捉する捕捉物質、たとえばアプタマーまたは抗体でコートされた平面基体の模式図である。捕捉物質は、罹病細胞から流出した小胞(「疾患小胞」)の表面に発現するタンパク質に結合し得る。同じくアプタマーまたは抗体であってもよい検出物質は、検出可能な標識、ここでは蛍光シグナルを有する。検出物質は、捕捉された小胞に結合し、その蛍光標識によって検出可能なシグナルを提供する。検出物質は、小胞と広く関連しているかまたは起始細胞もしくは疾患、たとえば癌と関連している抗原を、検出することができる。図2Bは、捕捉物質の標的抗原を発現する小胞を捕捉する、捕捉物質にコンジュゲートした粒子ビーズの模式図である。捕捉物質は、罹病細胞から流出した小胞(「疾患小胞」)の表面に発現するタンパク質に結合し得る。同じくアプタマーまたは抗体であってもよい検出物質は、検出可能な標識、ここでは蛍光シグナルを有する。検出物質は、捕捉された小胞に結合し、その蛍光標識によって検出可能なシグナルを提供する。検出物質は、小胞と広く関連しているかまたは起始細胞もしくは疾患、たとえば癌と関連している抗原を、検出することができる。図2Cは、表記バイオマーカーに対する捕捉物質と検出物質との様々な組み合わせを使用して実施することができるスクリーニングスキームの例である。バイオマーカーの組み合わせは、図2A〜2Bに示すようなアッセイを使用して検出することができる。図2D〜2Eは、表現型を特徴決定するために小胞を捕捉し、かつ検出するための例示的スキームを示す。図2Fは、表現型を特徴決定するために小胞ペイロードを評価するための例示的スキームを示す。
(図3A〜3B)アプタマーヌクレオチド配列の非限定的な例およびその二次構造を示す。図3Aは、配列
を有する32量体オリゴヌクレオチド、アプタマー4の二次構造を示す。図中、配列は、6個のチミンヌクレオチドが端部に付加された状態で示されており、これらのチミンヌクレオチドが、ビオチン分子を付着させるためのスペーサーとして働くことができる。この特定のオリゴは、標的EpCAMに対する高い結合親和性を有する(表5を参照)。配列決定されたオリゴのデータベース全体をこのオリゴの二次構造にモデル化することにより、さらなる候補EpCAM結合物質が同定される。図3Bは、図3Aのアプタマーとは異なる二次構造を有する配列
を有するもう一つの32量体オリゴを示す。このアプタマーもまた、6チミンテールを有する状態で示されている。
(図4)標的が特定の疾患と関連するバイオマーカーであるとき、細胞サブトラクション法を使用して標的特異的なアプタマーのセットを生成するプロセスを示す。工程1において、オリゴヌクレオチドのランダムなプールを正常患者由来の生物学的試験試料と接触させる。工程2において、工程1において結合しなかったオリゴを、疾患患者から単離された生物学試料に加える。次いで、この工程からの結合オリゴを溶離させ、そのビオチン結合によって捕捉したのち、再び正常な生物学的試料と合わせる。次いで、非結合オリゴを再び疾患由来生物学的試料に加え、単離する。このプロセスを反復的に繰り返すことができる。最後の溶離アプタマーを患者試料に対して試験して、セットの感度および特異度を計測する。生物学的試料は、血漿もしくは血清を含む血液または循環系の他の成分、たとえば微小胞を含むことができる。
(図5)様々な標的濃度の標的EpCAMタンパク質への例示的アプタマー(アプタマーID BTX176881(SEQ ID NO: 3))の結合親和性を示す、結合アッセイの結果を示す。試験するアプタマーを、ビオチンテールによって基体に固定し、様々な濃度の標的(125、250および500nM)と共にインキュベートする。試験を表面プラズモン共鳴(SPR)機上で実施する。SPR機は、アプタマーと標的との結合および分離を検出する。標的は、結合イベントと分離イベントとが等しくなり、その結果、曲線のプラトーが現れるまで加える。そして、各濃度で曲線を記述する式を使用して、アプタマーのKDを算出することができる(表5を参照)。
(図6)微小胞集団を検出するための抗EpCAMアプタマー(アプタマー4;SEQ ID NO: 1)の使用を示す。表記の微小胞表面抗原: A)EGFR; B)PBP; C)EpCAM; D)KLK2、に対するビーズコンジュゲート抗体を使用して、患者血漿試料中の小胞を捕捉した。蛍光標識されたアプタマー4をマイクロビーズアッセイにおいて検出物質として使用した。図は、各プロット中、三つの癌試料(C1〜C3)および三つの正常試料(N1〜N3)に関する平均蛍光値(MFI値)を示す。各プロット中、試料は、左から右に、C1、C2、C3、N1、N2、N3の順である。
(図7A)EPCAMアプタマーCAR003(SEQ ID NO: 4)の配列を示す。
(図7B)−30.00kcal/molの最小自由エネルギー(ΔG)を有するCAR003の最適な二次構造を示す。例示のために、アプタマーは、図7AのDNA配列に対応するRNAアプタマー(SEQ ID NO: 5)として示されている。
(図7C)アプタマープール精製を示す。図は、ゲル上で質をチェックしたのちすべての産物および分画がプール中に割り当てられたFPLCクロマトグラムを含む。
(図7D)合成後のCAR003アプタマーの様々なFPLC分画を有するSYBR GOLD染色ゲルを示す。様々な分画を、未完成鎖の量に基づき、高から低の順(プール1〜プール3)でプール中に組み合わせた。プール1〜3は、図7Cに示されたプールに対応する。
(図7E〜7F)25mM HEPESとPBS-BN(図7E)または25mM HEPESと1mM MgCl2(図7F)中の、EPCAMタンパク質へのCAR003の結合を示す。
(図7G)ウシ血清アルブミン(BSA)を添加したおよび添加していない表記塩中の、EpCAMへのCAR003の結合を示す。
(図7H)EPCAMタンパク質へのCAR003結合に対する変性の効果を示す。バー4本の各群中、アプタマーは、左から右に、アプタマー4、CAR003プール1、CAR003プール2、およびCAR003プール3である。
(図7I)EPCAM組み換えタンパク質(一定投入量5μg)に対するアプタマーの滴定を示す。
(図7J)EPCAM hisタグ付きタンパク質、BSAおよびHSA(各5μg)に対してCAR003アプタマーを用いたウェスタンブロットを示す。ゲルは、ブロックされた0.5% F127であり、約50μg/mlのCAR003ビオチン化アプタマー、分画3でプロービングした。ブロットを、NeutrAvidin-HRP、次いでSuperSignal West Femto Chemiluminescent Substrateによって可視化した。
(図8A〜8D)微小胞を基体に取り付ける方法を示す。図8Aは、小胞表面抗原へのカルボキシル化ミクロスフェアの直接コンジュゲートを示す。図8Bは、ビオチン官能化脂質アンカーを介するミクロスフェアへの微小胞の固定を示す。図8Cは、抗体がカルボキシル化ミクロスフェアとコンジュゲートされる、小胞表面抗原への抗体結合を示す。図8Dは、アプタマーがカルボキシル化ミクロスフェアにコンジュゲートされる、小胞表面抗原へのアプタマー結合を示す。
(図9)選択されたアプタマー、たとえば上記プロセスによって選択されたアプタマーの標的を同定するための模式図を含む。図は、基体901につながれた結合物質902、ここでは例としてアプタマーを示す。結合物質902は基体901に共有結合していることができる。結合物質902はまた、非共有結合的に結合していてもよい。たとえば、結合物質902は、基体に引き寄せられることができる標識、たとえば基体に共有結合しているアビジン/ストレプトアビジン分子と一緒に複合体を形成することができるビオチン基を含むことができる。結合物質902は微小胞904の表面抗原903に結合する。矢印(i)によって示される工程において、微小胞が分断されるが、結合物質902と表面抗原903との複合体は無傷のまま残る。分断された微小胞905は、矢印(ii)によって示される工程において、たとえば洗浄またはバッファ交換によって除去される。矢印(iii)によって示される工程において、表面抗原903が結合物質902から解放される。表面抗原903を分析してその正体を決定することができる。
(図10A〜C)様々な投入試料にコンジュゲートしたマイクロビーズに対する選択されたアプタマーの結合を示す。アプタマーは、乳癌由来の微小胞にコンジュゲートしたマイクロビーズに結合するとして、アプタマーライブラリーから選択されたものである。実験の詳細は本明細書において実施例に記載されている。各プロットは、異なるアプタマーを示す。Y軸が結合のレベルを示す。各試料群中、九つの精製されたアプタマー候補の結合が示されている。投入試料が、X軸上、以下のように左から右に示されている:1)癌エキソソーム:乳癌患者由来の血漿試料から単離された微小胞にコンジュゲートしたマイクロビーズに結合するアプタマー;2)癌非エキソソーム:超遠心分離によって微小胞を除去したのち乳癌患者由来の血漿試料にコンジュゲートしたマイクロビーズに結合するアプタマー;3)非癌エキソソーム:正常(すなわち非乳癌)患者由来の血漿試料から単離された微小胞にコンジュゲートしたマイクロビーズに結合するアプタマー;4)非癌非エキソソーム:超遠心分離によって微小胞を除去したのち乳癌患者由来の血漿試料にコンジュゲートしたマイクロビーズに結合するアプタマー。
(図11A〜G)関心対象の標的に対する出発アプタマーライブラリーを富化するために使用される選択スキームを示す。図11Aにおいて、「選択A」は、乳癌患者および非乳癌個人の血漿から単離された微小胞に対する13ラウンドのポジティブ選択を示す。Ca1は癌小胞選択などのラウンド1を指す。nCa1は非癌小胞選択などのラウンド1を指す。「選択B」は、「選択A」における3ラウンドのポジティブ選択後のアプタマープールを、乳癌患者および非乳癌個人の血漿から単離された微小胞に対するさらなる9ラウンドのポジティブおよびネガティブ選択(すなわち、ラウンド4〜12)のための投入物として使用した、派生物を示す。「noE」はネガティブ選択ラウンドを示す。図11Bは、アガロースゲル上で実施された表記ラウンドの富化ののち回収されたアプタマーライブラリーを示す。癌小胞(「Ca」)および非癌微小胞(「nCa」)に対して選択されたアプタマーが示されている。図11Cは、選択ラウンド1(R1)、7(R7)および13(R13)による、癌小胞(左寄り三つのカラム「Ca」)および非癌微小胞(右寄り三つのカラム「nCa」)に結合するアプタマーの富化を示す。表記選択ラウンド後の標識アプタマーをビーズ捕捉微小胞と共にインキュベートした。ビーズ捕捉微小胞に結合するアプタマーの数を決定した。Y軸は、全投入物と比較した結合アプタマーの割合を示す。ラウンド7からラウンド13への低下は非特異的結合物質の除去を示し得る。図11Dおよび図11Eは、「選択B」のラウンド9後にそれぞれ癌および非癌微小胞に関して実施されたさらなる選択を示す。図11Fは図11Dのもう一つの図を提示する。図11Gは、「選択B」のラウンド9後に、癌由来微小胞に対する選択ラウンド(Ca#)および非癌由来微小胞に対する選択ラウンド(nCa#)を交互に実施した第三の選択「選択C」を示す。
(図12)配列GC含量に対する選択工程において認められたアプタマー頻度の分布を示す。この図のライブラリーは、プライマーアニーリング配列が隣接する、30ヌクレオチド長のランダム生成された配列で構成されるものであった。
(図13A〜I)生物学的試料タイプを区別するためのオリゴヌクレオチドプローブライブラリーの開発および使用を示す。
(図14A〜L)血漿由来微小胞をオリゴヌクレオチドプローブライブラリーでプロービングすることによって乳癌試料と正常(すなわち非癌)試料とを区別するために適用された、図13A〜Iで概説した手法の適用を示す。
(図15A〜AN)様々な適応症対正常な試料に関してオリゴヌクレオチドプローブライブラリー分析のクラスター分析を使用して作成されたヒートマップを含む。
(図16A〜C)表現型を特徴決定する方法におけるアプタマーの使用を示す。図16Aは、関心対象の標的を検出および/または定量するために使用することができるアッセイ構成を示す模式図1600である。図中、捕捉アプタマー1602が基体1601に取り付けられている。関心対象の標的1603が捕捉アプタマー1602と結合している。また、検出アプタマー1604も、関心対象の標的1603に結合している。検出アプタマー1604は標識1605を有し、この標識を検出して、捕捉アプタマー1602を介して基体1601に捕捉された標的を同定することができる。図16Bは、表現型を特徴決定するためのアプタマープールの使用を示す模式図1610である。関心対象の標的に対するアプタマーのプールを提供する(1611)。プールを、特徴決定の対象となる試験試料と接触させる(1612)。混合物を洗浄して非結合アプタマーを除去する。残るアプタマーを分離させ、捕集する(1613)。捕集したアプタマーを同定し(1614)、保持されたアプタマーの正体を使用して表現型を特徴決定する(1615)。図16Cは、図16Bの方法の具現化を示す模式図1620である。微小胞集団に結合すると同定されたアプタマーのプールを提供する(1621)。投入試料は、試験試料から単離された微小胞を含む(1622)。プールを、特徴決定の対象となる単離された微小胞と接触させる(1623)。混合物を洗浄して非結合アプタマーを除去し、残るアプタマーを分離させ、捕集する(1625)。捕集したアプタマーを同定し、保持されたアプタマーの正体を使用して表現型を特徴決定する(1626)。
(図17A〜H)ハイスループット(次世代)配列決定のための最適化アプタマーライブラリー設計を示す。
本発明の一つまたは複数の態様の詳細が以下の付随の説明に記載される。本明細書に記載されるものに類似している、または等しい任意の方法および材料を本発明の実施または試験において使用することができるが、ここでは、好ましい方法および材料を記載する。本発明の他の特徴、目的および利点は詳細な説明から明らかになる。本明細書中、別段明らかに指示されない限り、単数形は複数をも含む。別段定義されない限り、本明細書において使用されるすべての専門用語および科学技術用語は、本発明が属する技術分野の当業者によって一般に理解されるものと同じ意味を有する。矛盾する場合、本明細書が優先する。
SELEX法
アプタマーを生成するのに適した方法は、たとえば、1990年6月11日に出願され、今や放棄された米国特許出願第07/536,428号、「Nucleic Acid Ligands」と題する米国特許第5,475,096号および「Nucleic Acid Ligands」と題する米国特許第5,270,163号(WO91/19813も参照)に概して記載されている「Systematic Evolution of Ligands by Exponential Enrichment」(「SELEX法」)と呼ばれるプロセスを用いる方法である。各SELEX同定核酸リガンド、すなわち各アプタマーは、所与の標的化合物または分子に特異的なリガンドである。SELEXプロセスは、核酸が、多様な二次元および三次元構造を形成するのに十分な能力と、モノマーであるかポリマーであるかを問わず事実上いかなる化学物質とでもリガンドとして働く(すなわち、特異的結合対を形成する)のに十分な、それらのモノマー内で利用可能な化学的融通性とを有するという独自の洞察に基づく。任意のサイズまたは組成の分子が標的として働くことができる。
アプタマーが治療剤としての使用に適するためには、好ましくは、インビボで安全かつ安定に合成することが低廉である。野生型RNAおよびDNAアプタマーは一般に、ヌクレアーゼによる分解を受けやすいため、インビボで安定ではない。ヌクレアーゼ分解に対する耐性は、2'位における修飾基の組み込みによって大きく高めることができる。
バイオマーカー検出および診断
本発明のアプタマーは、生物学的試料中のバイオマーカー、たとえば、タンパク質、核酸または微小胞のような関心対象の生物学的実体の存在またはレベルを評価するための様々な方法において使用することができる。アプタマーは、同族標的分子の存在またはレベルを評価するための結合物質として機能する。したがって、診断、予後判定またはセラノーシスに関する本発明の様々な態様において、本発明の1種または複数種のアプタマーは、本発明の1種または複数種のアプタマーを、選択された生物学的試料と接触させ、1種または複数種のアプタマーがその標的分子と結合する、リガンド−標的ベースのアッセイにおいて構成される。本発明のアプタマーは、評価される生物学的試料および検出されるバイオマーカーに基づいて候補バイオシグネチャーを同定するために使用される。さらなる態様において、アプタマーは、それ自体が特定の病状または疾患のバイオシグネチャーを提供し得る。バイオシグネチャーとは、1種または複数種の関心対象のバイオマーカーの存在、レベルまたは評価することができる他の特徴(非限定的に、配列、突然変異、再配列、転座、欠失、後成的修飾、メチル化、翻訳後修飾、対立遺伝子、活性、複合体パートナー、安定性、半減期などを含む)を含む生物学的試料のバイオマーカープロフィールをいう。バイオシグネチャーは、診断および/または予後判定基準、たとえば疾患の存在、病期決定、疾患モニタリング、疾患層別化または疾患の検出、転移もしくは再発もしくは進行の監視を評価するために使用することができる。たとえば、微小胞表面抗原に対するアプタマーを使用する本発明の方法は、微小胞抗原を含むバイオシグネチャーを選択された病状または疾患と相関させるのに有用である。バイオシグネチャーはまた、治療介入を含む治療モダリティに関する決定を下す際に臨床的に使用することもできる。バイオシグネチャーはさらに、手術を実施するかどうか、または手術と共にどの治療標準を使用すべきかを含む治療の決定を下すために臨床的に使用することもできる(たとえば術前または術後に)。説明のための例として、侵攻型の癌を示す循環バイオマーカーのバイオシグネチャーは、患者を治療するために、より積極的な外科処置および/またはより積極的な治療計画を必要とし得る。
バイオシグネチャーは、治療関連の診断において、疾患を診断するのに有用な試験を提供する、または正しい治療計画を選択する、たとえばセラノーシスを提供するために使用することができる。セラノーシスは、罹病状態の治療法または治療に影響する能力を提供する診断試験を含む。セラノーシス試験は、診断または予後判定試験がそれぞれ診断または予後判定を提供するのと同様なやり方でセラノーシスを提供する。本明細書において使用されるセラノーシスは、予測的医療、個別化医療、統合医療、薬理診断学およびDx/Rxパターニングを含む、任意の所望の形態の治療関連の試験を包含する。治療関連の試験は、個々の対象における薬物応答を予測および評価する、すなわち、個別化医療を提供するために使用することができる。薬物応答の予測は、たとえば対象が暴露される、または他のやり方で治療される前にその対象が候補治療物質に対して応答者である可能性が高いのか、非応答者である可能性が高いのかを決定することであることができる。薬物応答の評価は、薬物に対する応答をモニターすること、たとえば治療の開始後、時間経過と共に対象の改善またはその欠如をモニターすることであることができる。治療関連の試験は、治療から恩恵を受ける可能性が特に高い対象をその治療に選択する、または個々の対象において治療効能の早期的かつ客観的指示を提供するのに有用である。このように、本明細書に開示されるバイオシグネチャーは、より有望な治療を選択するために治療を変更すべきであることを示し、それにより、有益な治療を遅らせる多大な損失を避け、効果のない薬物を投与する金銭的および罹患率の犠牲を避け得る。
本発明の組成物および方法は、生物学的試料と関連する表現型を特徴決定するために生物学的試料中の任意の有用なバイオマーカーを評価するために使用することができる。そのようなバイオマーカーは、すべての種類の生物学的実体、たとえばタンパク質、核酸、脂質、糖質、それらのいずれかの複合体および微小胞を含む。微小胞表面と結合した、または微小胞内に包含された様々な分子(本明細書においては「ペイロード」と呼ぶ)がバイオマーカーとして働くことができる。微小胞はまた、それ自体をバイオマーカーとして使用することもできる。
平面アレイに代わるものとして、粒子を使用するアッセイ法、たとえばビーズベースのアッセイ法もまた、本発明のアプタマーを使用することができる。アプタマーは市販のビーズと容易にコンジュゲートする。たとえば、Srinivas et al. Anal. Chem. 2011 Oct. 21, Aptamer functionalized Microgel Particles for Protein Detectionを参照すること。また、治療物質および診断物質としてのアプタマーに関するレビュー文献、Brody and Gold, Rev. Mol. Biotech. 2000, 74:5-13を参照すること。
生物学的試料由来の循環バイオマーカー、たとえばタンパク質抗原またはバイオマーカー包含細胞、細胞断片もしくは小胞の単離または検出はまた、サイトメトリープロセスにおいて本発明のアプタマーを使用して達成されてもよい。非限定的な例として、本発明のアプタマーは、ビーズまたはミクロスフェアのような粒子の使用を含むアッセイ法において使用することができる。本発明は、粒子にコンジュゲートし得るアプタマーを結合物質として提供する。流体流中に懸濁した微視的粒子をソートするためにはフローサイトメトリー法を使用することができる。粒子が通過するとき、粒子は選択的に荷電され、出るとき、別々の流路の中にそらされることができる。したがって、元の混合物、たとえば生物学的試料から高い精度および速度で集団を分離することが可能である。フローサイトメトリー法は、光学/電子検出装置の中を流れる単一細胞の物理的および/または化学的特徴の同時マルチパラメータ分析を可能にする。一つの波長(色)の光ビーム、通常はレーザービームが流体力学的に集束した流体流に向けて送られる。いくつかの検出器:光ビームと平行である一つの検出器(前方散乱またはFSC)、それに対して垂直であるいくつかの検出器(側方散乱またはSSC)および一つまたは複数の蛍光検出器が、流れが光ビームを通過する点に照準を定めている。
本発明の1種または複数種のアプタマーは、任意の有用な平面またはビーズ基体の上に配置することができる。本発明の一つの局面において、本発明の1種または複数種のアプタマーは、マイクロ流体装置上に配置され、それにより、関心対象のポリペプチド抗原またはその機能的断片を含む生物学的試料の成分の評価、特徴決定または単離を容易にする。たとえば、循環抗原またはその抗原を含む細胞、細胞断片もしくは細胞由来の小胞は、本発明の1種または複数種のアプタマーを使用して(または、さらなる結合物質と共に)評価することができる。また、「Lab-on-a-Chip」システム、バイオメディカルマイクロエレクトロメカニカルシステム(Bio-MEM)またはマルチコンポーネント集積システムとも呼ばれ得るマイクロ流体装置を小胞の単離および分析のために使用することができる。そのようなシステムは、小胞の結合、バイオシグネチャーの検出および他のプロセスを可能にするプロセスを小型化し、区画化する。
本明細書に開示されるものは、本発明の方法および組成物を使用して表現型を特徴決定するための生成物およびプロセスである。本明細書において使用される語「表現型」は、本発明の組成物および/または方法を部分的または完全に使用して同定されるバイオマーカープロフィールに帰される任意の特性または特徴を意味することができる。たとえば、表現型とは、対象から得られた試料に関して特徴決定されたバイオマーカープロフィールに基づく診断用、予後判定用、またはセラノーシス用の判断であることができる。表現型は、任意の観測可能な特徴または特性、たとえば疾患もしくは病状、病期もしくは病状期、疾患もしくは病状に対する感受性、病期もしくは病状の予後、生理学的病状または治療剤に対する応答/潜在的応答であることができる。表現型は、対象の遺伝的構成ならびに環境要因の影響および二つの間の相互作用ならびに核酸配列に対する後成的修飾から生じることができる。
対象の1つ以上の表現型を、対象から得られる生体試料中の小胞などの一つまたは複数の小胞を分析することによって決定することができる。対象または患者としては、ウシ、トリ、イヌ、ウマ、ネコ、ヒツジ、ブタ、または霊長類動物(ヒトおよび非ヒト霊長類を含む)等の哺乳動物を挙げることができるが、これらに限定されない。対象はまた、シベリアトラ等の絶滅の危機に瀕しているために重要な哺乳動物、ヒトによって消費用に農場で育てられる動物等の経済的に重要な哺乳動物、またはペットとして、または動物園で飼育されている動物等の、ヒトにとって社会的に重要な動物が含まれ得る。このような動物の例としては、ネコおよびイヌ等の肉食動物、ブタ(pig)、雄ブタ、およびイノシシを含むブタ(swine)、ウシ、雄ウシ、ヒツジ、キリン、シカ、ヤギ、バイソン、およびラクダ、またはウマ等の反芻動物または有蹄動物が挙げられるが、これらに限定されない。また、絶滅の危機に瀕したトリ、または、動物園で飼育されるトリ、ならびに家禽(fowl)、さらに具体的には、家畜化された家禽、すなわち、シチメンチョウ、ニワトリ、アヒル、ガチョウ、ホロホロチョウ等の家禽類(poultry)も含まれる。また、家畜化されたブタおよびウマ(競争馬を含む)も含まれる。加えて、農業および水産、ならびに他の活動と関係がある動物等の、商業活動と関係がある任意の動物種も含まれ、ここで、疾患のモニタリング、診断、および治療の選択は、経済的生産性および/または食物連鎖の安全性のため、畜産において通常の業務である。
本発明の組成物および方法によって使用および/または評価される試料は、非限定的に組織切片、たとえば外科的もしくは他の処置の間に除去された生検材料もしくは組織、体液、検死試料、組織学的目的に採取された凍結切片および細胞培養物を含む、バイオマーカー評価に使用することができる任意の適切な生物学的試料を含む。そのような試料は、血液および血液分画または産物(たとえば血清、バフィーコート、血漿、血小板、赤血球など)、痰、悪性浸出液、頬細胞組織、培養細胞(たとえば初代培養物、外植片および形質転換細胞)、糞便、尿、他の生物学的または体液(たとえば前立腺液、胃液、腸液、腎臓液、肺液、脳脊髄液など)などを含む。試料は、新鮮な凍結ホルマリン固定パラフィン包埋(FFPE)ブロックである、ホルマリン固定パラフィン包埋されている、またはRNA保存液+ホルマリン固定液内にある生物学的材料を含むことができる。患者ごとに一つより多いタイプの一つより多い試料を使用することができる。
試料処理
小胞または小胞の集団は、分析前および/または分析中に単離、精製、濃縮または他のやり方で富化され得る。別段指定されない限り、本明細書の中で小胞またはバイオマーカー成分を参照して使用される用語「精製」、用語「単離」または類似の語は、細胞または有機体からのそのような成分の部分的または完全な精製または単離を含むことを意図する。小胞の分析は、生物学的試料の一つまたは複数の小胞集団の量を定量化することを含むことができる。たとえば、不均一な小胞集団を定量化することができるし、または均一な小胞集団、たとえば特定のバイオマーカープロファイル有する小胞の集団、特定のバイオシグネチャーを有する小胞の集団または特定の細胞型に由来する小胞の集団を不均一な小胞集団から単離し、定量化することができる。小胞の分析はまた、本明細書に記載されるように、小胞の一つまたは複数の特定のバイオマーカープロファイルまたはバイオシグネチャーを定量的または定性的に検出することを含むこともできる。
小胞は、対象からの生物学的試料をろ過モジュールに通してろ過すること、小胞を含む保持物をそのろ過モジュールから捕集すること、それにより生物学的試料から小胞を単離することにより、生物学的試料から単離することができる。方法は、対象からの生物学的試料を、フィルターを含むろ過モジュール(本明細書の中では選択膜とも呼ばれる)に通してろ過する工程;および小胞を含む保持物をそのろ過モジュールから捕集する工程、それによって小胞を生物学的試料から単離する工程を含むことができる。たとえば、一つの態様において、フィルターは、約100キロダルトンよりも大きな分子を保持する。そのような場合、微小胞は概して、ろ過プロセスの保持物中に見いだされるが、一方で、より小さな実体、たとえばタンパク質、タンパク質複合体、核酸などはろ液の中へと通過する。
小胞は、ポリマー沈殿法を使用して単離することができる。この方法は、本明細書に記載される他の単離法と併用することができるし、またはそれに代えて用いることができる。一つの態様において、小胞を含有する試料をポリエチレングリコール(PEG)の製剤と接触させる。ポリマー製剤を、小胞含有試料と共にインキュベートしたのち、遠心分離によって沈殿させる。PEGは、小胞に結合することができ、かつ、捕捉成分、たとえば抗体のようなPEG化結合タンパク質の添加により、小胞を特異的に捕捉するように処理することができる。当業者は、PEGに加えて、他のポリマー、たとえば、メトキシポリエチレングリコール類を含むPEG誘導体、ポリ(エチレンオキシド)および様々な分子量を有する式HO-CH2-(CH2-0-CH2-)n-CH2-OHの様々なポリマーを使用することができることを理解するであろう。単離の効率は、ポリマー鎖の長さおよび使用されるポリマーの濃度をはじめとする様々な要因に依存し得る。好ましい態様においては、PEG4000またはPEG8000が、1%、2%、3%、4%、5%、6%、7%、8%、9%または10%、たとえば4%または8%の濃度で使用され得る。
結合物質(結合試薬とも呼ばれる)は、標的バイオマーカーに結合することができる物質を含む。結合物質は、標的バイオマーカーに特異的であることができる、すなわち、標的バイオマーカーに結合することができる。標的は、本明細書に開示される任意の有用なバイオマーカー、たとえば小胞表面のバイオマーカーであることができる。いくつかの態様において、標的は一つの分子、たとえば一つのタンパク質であり、結合物質はその一つのタンパク質に特異的である。他の態様において、標的は、類似したエピトープまたは部分を有する分子の群、たとえばファミリーまたはタンパク質であることができ、結合物質は、タンパク質のファミリーまたは群に特異的である。分子の群はまた、分子のクラス、たとえばタンパク質、DNAまたはRNAであることもできる。結合物質は、小胞の成分またはバイオマーカーに結合することによって小胞を捕捉するために使用される捕捉物質であることができる。いくつかの態様において、捕捉物質は、小胞上の抗原に結合する抗体もしくはその断片またはアプタマーを含む。捕捉剤は、任意で基体に結合され、本明細書にさらに記載されるように小胞を単離するために使用することができる。
平面アレイに代わるものとして、粒子またはマイクロスフェアを使用するアッセイ法、たとえばビーズベースのアッセイ法を結合物質と共に使用することが可能である。たとえば、抗体またはアプタマーを市販のビーズと容易にコンジュゲートさせる。たとえば、Fan et al., Illumina universal bead arrays. Methods Enzymol. 2006 410:57-73、Srinivas et al. Anal. Chem. 2011 Oct. 21, Aptamer functionalized Microgel Particles for Protein Detectionを参照すること。また、治療および診断物質としてのアプタマーに関するレビュー記事であるBrody and Gold, Rev. Mol. Biotech. 2000, 74:5-13を参照すること。
本発明の様々な態様においては、先にさらに詳細に説明されているフローサイトメトリーを使用して生物学的試料中の微小胞集団を評価する。望むならば、一つまたは複数の一般的小胞バイオマーカーを使用して小胞を標識することにより、微小胞集団を試料中の他の粒子(たとえば細胞デブリ、タンパク質凝集塊など)から分別することができる。一般的小胞マーカーは表3中のマーカーであることができる。一般に使用される小胞マーカーは、CD9、CD63および/またはCD81のようなテトラスパニンを含む。一つまたは複数のテトラスパニンを含む小胞は、その小胞がテトラスパニン陽性であることを示すために、本明細書の中で「Tet+」と呼ばれることもある。分別された微小胞を、本明細書に記載される方法を使用してさらに評価することができる。たとえば、フローまたは他の方法を使用して、分別された微小胞上の表面抗原を検出することができる。いくつかの態様においては、分別された微小胞内のペイロードを評価する。実例として、微小胞の集団を、関心対象の表面抗原への標識された結合物質と接触させ、接触させた微小胞をフローサイトメトリーによって分別し、微小胞内のペイロードを評価する。ペイロードは、所望により、ポリペプチド、核酸(たとえばmRNAまたはマイクロRNA)または他の生物学的実体であり得る。そのような評価は、本明細書に記載される表現型の特徴決定のため、たとえば癌の診断、予後判定またはセラノーシスのために使用される。
多重実験は、一つのアッセイにおいて複数の分析対象物を同時に計測することができる実験を含む。小胞および関連するバイオマーカーを多重に評価することができる。様々な循環バイオマーカー、たとえばマイクロRNA、タンパク質または小胞集団を多重化するために様々な結合物質を使用することができる。異なる結合物質を使用して様々なバイオマーカー、たとえば様々な小胞集団を単離または検出することができる。生物学的試料中の各集団が、上記のような異なるシグナル伝達標識、たとえば蛍光体、量子ドットまたは放射性標識によって標識されることができる。標識は、結合物質に直接コンジュゲートさせることもできるし、または小胞に結合する結合物質を検出するために間接的に使用することもできる。二つ以上のアフィニティー要素に結合する二つよりも多い示差的に標識された小胞集団が合計シグナルを生成することができるため、多重化アッセイにおいて検出される集団の数は標識の分解能およびシグナルの合計に依存する。
小胞は、小胞の新規な成分のための結合物質、たとえば関心対象の小胞に特異的な新規な抗原に対する抗体を使用して単離または検出され得る。関心対象の小胞に特異的である新規な抗原は、アレイまたは複数の粒子のような基体に結合した公知の組成の様々な試験化合物を使用して単離または同定され得、これにより、多大な化学的/構造的空間を、その空間の小さな部分を使用するだけで十分にサンプリングすることが可能になる。同定された新規な抗原はまた、小胞のためのバイオマーカーとして働くことができる。たとえば、起始細胞特異小胞に関して同定された新規な抗原が有用なバイオマーカーであることができる。
小胞を単離または同定する方法は、マイクロ流体装置と組み合わせて使用することができる。本明細書に記載されるような小胞を単離または同定する方法は、マイクロ流体装置を使用して実施することができる。「Lab-on-a-Chip」システム、バイオメディカルマイクロエレクトロメカニカルシステム(Bio-MEM)またはマルチコンポーネント集積システムとも呼ばれ得るマイクロ流体装置を小胞の単離および分析のために使用することができる。そのようなシステムは、小胞の結合、バイオシグネチャーの検出および他のプロセスを可能にするプロセスを小型化し、区画化する。
当業者は、所望により、試料処理ならびに小胞のような循環バイオマーカーの単離および濃縮の様々な方法を組み合わせることができることを理解するであろう。たとえば、生物学的試料は、凝集を防ぐ、望まれない粒子状物質を除去する、および/または極めて豊富なタンパク質を枯渇させるために処理することができる。使用される工程は、下流の分析工程を最適化するように選択することができる。次に、小胞のようなバイオマーカーを、たとえばクロマトグラフィー、遠心分離、密度勾配、ろ過、沈殿またはアフィニティー技術によって単離することができる。任意の数の後続工程を組み合わせることができる。たとえば、すべてまたは大多数の微小胞を単離または濃縮するために、試料を、クロマトグラフィー、遠心分離法、密度勾配、ろ過および沈殿の一つまたは複数に供することもできる。後続の工程において、たとえば、一つまたは複数の関心対象の標的への結合物質を使用するアフィニティー技術を使用して、所望のバイオマーカープロファイルを有する微小胞を単離または同定することができる。マイクロ流体システムを用いてこれらの工程のいくつかまたはすべてを実施することができる。
本明細書に記載されるように、本発明の方法および組成物は、一つまたは複数の関心対象のバイオマーカーの存在またはレベルを検出するためのアッセイにおいて使用することができる。バイオマーカーは、本明細書に開示される、または当技術分野において公知である任意の有用なバイオマーカーであることができる。ある態様において、バイオマーカーはタンパク質またはポリペプチドを含む。本明細書において使用される「タンパク質」、「ポリペプチド」および「ペプチド」は、別段述べられない限り、互換可能に使用される。バイオマーカーは、本明細書に開示される、または当技術分野において公知であるような、DNA、RNAおよびそれらのいずれかの様々な亜種を含む核酸であることができる。バイオマーカーは脂質を含むことができる。バイオマーカーは糖質を含むことができる。バイオマーカーはまた、複合体、たとえばタンパク質、核酸、脂質および/または糖質を含む複合体であることができる。いくつかの態様において、バイオマーカーは微小胞を含む。ある態様において、本発明は、アプタマーのプールを使用して、プールの各メンバーによって標的化される正確な微小胞抗原を知ることなく、関心対象の微小胞集団の存在および/またはレベルを評価する方法を提供する。たとえば図16B〜Cを参照すること。他の場合、微小胞と結合したバイオマーカーが本発明の方法にしたがって評価される。たとえば図2A〜2F;図16Aを参照すること。
本明細書において使用される「治療有効量」とは、哺乳動物における疾患または病状の一つまたは複数の症候を軽減する組成物の量(ある程度、熟練した医療実施者の判断による)をいう。加えて、組成物の「治療有効量」とは、疾患または病状と関連する、またはその原因となる生理学的または生化学的パラメータを部分的または完全のいずれかに正常に戻す量を意味する。医療当業者は、たとえば静脈内投与、皮下投与、腹腔内投与、経口投与または吸入によって投与されたとき特定の病状または障害を治療または予防するために、組成物の治療有効量を決定することができる。治療的に有効であるために求められる組成物の正確な量は、数多くの要因、たとえば活性剤の比活性、用いられる送達装置、剤の物理的特徴、投与の目的、さらには多くの患者固有の考慮事項に依存する。しかし、治療有効量の決定は、本明細書に記載される開示を考慮すると、通常の医療当業者の技能の範囲内である。
これまでの広範な研究が、一定範囲の適応症のための、主に癌の治療に向けられ、第一に血液腫瘍に焦点を当てた潜在的治療としての抗体−毒素コンジュゲート(「免疫コンジュゲート」)の概念を広く展開している。タンパク質毒素、高効力小分子細胞毒、放射性同位体およびリポソーム封入薬物を含む、標的化送達のための多様な異なるペイロードが前臨床および臨床試験において試験されている。これらの努力は血液腫瘍のための三つのFDA承認治療を生み出すことに成功したが、クラスとしての免疫コンジュゲート(特に固形腫瘍のための)は、歴史的に、非ヒト化抗体に対する中和抗体応答を発生させる傾向、固形腫瘍への限られた浸透、毒素コンジュゲートの結果としての標的結合親和性の損失および全体的治療指数を制限する抗体半減期と毒素コンジュゲート半減期との不均衡を含む抗体の複数の異なる性質に帰すことができる、失望させる結果しかもたらしていない(Reff and Heard, Critical Reviews in Oncology/Hematology, 40 (2001):25-35によって考察されている)。
核酸配列は、二次および三次モチーフ、特にそれらのヌクレオチド配列へとフォールディングする。これらのモチーフは、配列が標的分子、たとえばタンパク質および他のアミノ酸配列上の特定の位置に結合することを可能にする位置において核酸配列に正および負の電荷を配置する。これらの結合配列は当技術分野においてアプタマーとして知られている。相対的に短いヌクレオチドの伸長(たとえば10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39または40個のヌクレオチド)においてさえ何兆もの特有のヌクレオチド配列が可能であるせいで、多様なモチーフを生成して、ほぼいかなる所望のタンパク質または他の標的のためのアプタマーも得ることができる。
公知のアプタマー製造法は、結合したすべてのアプタマーを標的配列から溶離させる工程を含み得る。いくつかの場合、これは、所望のアプタマー配列を同定するのに十分ではない。たとえば、アッセイ中に抗体を交換しようとするとき、交換される抗体の特定のエピトープに結合するアプタマーだけを捕集することが望ましい場合もある。本発明は、抗体エピトープに結合するアプタマーの選択的捕集を可能にするために、交換される抗体をアプタマー/標的反応に付加する工程を含む方法を提供する。ある態様において、方法は、ランダムに生成されたオリゴヌクレオチドを含む反応混合物を関心対象の標的と共にインキュベートする工程、標的に結合しない非結合アプタマーを反応混合物から除去する工程、関心対象のエピトープに結合する抗体を反応混合物に加える工程、および抗体によって置換されるアプタマーを捕集する工程を含む。標的はタンパク質であることができる。例えば、EpCamの特定のエピトープに対するアプタマーを同定するための方法を示す、図1を参照すること。
大部分のアプタマー実験においては、標的に結合する複数のアプタマー配列が同定される。これらのアプタマーは様々な結合親和性を有する。これら多くのアプタマーをそれぞれの親和性を評価するのに十分な量で生成するには時間と労力を要する。大きなサブセットを物理的にスクリーニングすることなく最高の親和性を有する多数のアプタマーを同定するために、本発明は、関心対象の標的に対する一つまたは複数の高親和性アプタマーの二次元構造の分析を含む方法を提供する。ある態様において、方法は、類似した二次元構造、すなわちモチーフを有するが、必ずしも類似した一次配列を有するわけではないアプタマーを求めてデータベースをスクリーニングする工程を含む。ある態様において、方法は、本明細書に開示される、または当技術分野において公知であるような従来の方法(たとえば表面プラズモン共鳴結合アッセイ法、図5を参照)を使用して高親和性アプタマーを同定する工程、高親和性アプタマーの二次元構造を近似する工程、および高親和性アプタマーに類似した二次元構造を有すると予測されるアプタマーを配列のプールから同定する工程を含む。これにより、方法は、関心対象の標的にも結合する候補のプールを提供する。オリゴの二次元構造は、当技術分野において公知の方法を使用して、たとえば、内容が参照により全体として本明細書に組み入れられるMathews, D., Sabina, J., Zucker, M. & Turner, H. Expanded sequence dependence of thermodynamic parameters provides robust prediction of RNA secondary structure. J. Mol. Biol. 288, 911-940 (1999);Hofacker et al., Monatshefte f. Chemie 125: 167-188 (1994);およびHofacker, I. L. Vienna RNA secondary structure server. Nucleic Acids Res. 31, 3429-3431 (2003)に記載されているように、市販のソフトウェアプログラム、たとえばViennaまたはmFoldを使用して実施される自由エネルギー(ΔG)算出によって予測することができる。図3を参照すること。配列のプールは、ランダムに生成されたアプタマー候補のプールから、ハイスループット配列決定プラットフォーム、たとえばLife Technologiesのイオントレントプラットフォームを使用して配列決定することができる。高親和性アプタマーに類似した二次元構造を有すると予測されるアプタマーを配列のプールから同定する工程は、得られた配列を好みのソフトウェアプログラムにロードして、高親和性アプタマーと同様な二次元構造を有する配列プールのメンバーを同定する工程を含み得る。そして、配列のプールの親和性をインサイチューで、たとえば表面プラズモン共鳴結合アッセイ法などで測定することができる。
疾患、たとえば癌を検出するためのアッセイ法を開発するためには、一般に、正常および疾患患者由来の既知のバイオマーカーの大きな集団をスクリーニングして、疾患と相関するマーカーを同定する。このプロセスは、弁別マーカーがすでに記載されている場合しかうまく行かない。この問題に対処するために、本発明は、はじめに非標的微小胞または細胞と共にインキュベートすることにより、大きなアプタマープールから非弁別アプタマーを減じる工程を含む方法を提供する。非標的細胞は、正常な細胞または正常な細胞から流出した微小胞であることができる。そして、正常な微小胞または細胞に結合しなかったアプタマーを罹病微小胞または細胞と共にインキュベートする。そして、罹病微小胞または細胞に結合するが、正常細胞には結合しなかったアプタマーが、疾患を検出するためのアッセイ法にとって可能な候補である。このプロセスは、疾患試料中の特定のマーカーの存在を知ることからは独立している。
アプタマーは、結合物質に依存する数多くのタイプのアッセイを含む様々な生物学的アッセイにおいて使用することができる。たとえば、アプタマーは、免疫ベースアッセイにおいて抗体の代わりに、または抗体と共に使用することができる。本発明は、アッセイ工程を通じていかなる面(基体、チューブ、フィルター、ビーズ、他の抗原など)にも結合せず、関心対象の抗原に特異的に結合するアプタマーを同定するアプタマースクリーニング法を提供する。アッセイは、ネガティブ選択に依存して、最終アッセイの非標的抗原成分に結合するアプタマーを除去する。ネガティブ選択に続きポジティブ選択を実施して、所望の抗原に結合するアプタマーを同定する。
上記方法およびキットは、二つのバイオマーカー集団を区別する結合物質を同定するために使用することができる。本発明はさらに、この項に記載されるように、結合物質の標的を同定する方法を提供する。たとえば、方法は、結合物質によって認識される標的微小胞の表面マーカーを同定する工程をさらに含み得る。
本発明のアプタマーは、生物学的試料を特徴決定するために使用することができる。たとえば、アプタマーを使用して、試料中のバイオマーカーに結合させることができる。結合したバイオマーカーの存在またはレベルは、例の特徴、たとえば試料に関連する疾患または障害の診断、予後判定またはセラノーシスを示すことができる。
生物学に存在する複雑性および不均一さが生物学的システムおよび疾患の理解力を試す。様々なレベルで、たとえば細胞、組織、個体および疾患状態の中および間で多様性が存在する。たとえば図13Aを参照すること。図13Bは、そのような試料を特徴決定するために評価することができる様々な生物学的実体を概観する。図に示すように、評価がDNAからRNA、タンパク質、そして最後にタンパク質複合体へと移るにつれ、多様性および複雑性の量は劇的に増す。本発明のオリゴヌクレオチドプローブライブラリー法は、複雑な生物学的ソース、たとえば組織試料、細胞、循環腫瘍細胞、微小胞および複合体、たとえばタンパク質およびタンパク脂質複合体を特徴決定するために使用することができる。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害はアルツハイマー病を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。また、疾患または障害は気管支喘息を含み得、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害は慢性閉塞性肺疾患(COPD)を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害は急性心筋梗塞(AMI)または急性心不全を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害はクローン病を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連して、疾患または障害はII型糖尿病を含み得、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連して、疾患または障害は多発性硬化症を含み得、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害はパーキンソン病を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。関連する態様において、疾患または障害は潰瘍性大腸炎を含み、その特徴決定に有用なオリゴヌクレオチドまたは複数のオリゴヌクレオチドは、SEQ ID NO:
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50個またはすべてを含む。オリゴヌクレオチドは、オリゴヌクレオチドの機能的局面が全体的または部分的に増強または維持される限り、様々な化学的修飾、付加、欠失、挿入、置換または他の修飾を組み込み得る。
本明細書に記載されるように、個々のアプタマーおよびオリゴヌクレオチドプローブライブラリーは、関心対象の一つまたは複数の標的に対して投入オリゴヌクレオチドライブラリーをスクリーニングまたは富化することによって生成される。投入ライブラリーは、出発またはナイーブなオリゴヌクレオチドライブラリーと呼ばれ得、少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、200000、300000、400000、500000、106、107、108、109、1010、1011、1012、1013、1014、1015、1016、1017または少なくとも1018個の異なるオリゴヌクレオチド配列を含み得る。ライブラリーは一般に、プライマー結合、プローブ結合、ハイブリダイゼーション、増幅、配列決定などを容易にするために5'および/または3'末端に公知の配列を含む。これらの隣接領域は、ライブラリー多様性を創製するランダムに生成された配列を含む部分を包囲し得る。本発明は、ライブラリー構築に使用される隣接領域および可変領域の両方を増強するオリゴヌクレオチド配列を提供する。このような構築物は、非限定的に合成、多様性および配列決定を含むスクリーニングおよび富化用途に使用するためのナイーブライブラリーの任意の所望の特性を増強し得る。本発明の増強された隣接領域および可変領域は、別々に使用されてもよいし、または一緒に使用されてもよい。実例に関して、本明細書の実施例19および23を参照すること。
に対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列を含む;(b)オフセット領域が、以下の配列:5'-T(SEQ ID NO: 510765)、5'-CT(SEQ ID NO: 510766)および5'-ACT(SEQ ID NO: 510767)の少なくとも一つに対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である1、2、3、4、5、6、7、8、9または10ヌクレオチドを含む;(c)可変領域が10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50または50よりも多いヌクレオチドを含む;および/または(d)左プライマー領域が、SEQ ID NO: 510768および510769から選択される配列に対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列を含む、ようなものである。可変領域は、本明細書に提供される「GC」ライブラリー配列を含み得る。
本発明はさらに、本明細書の方法を実施するための試薬を含むキットおよび本発明のGCライブラリーまたは均衡オリゴヌクレオチドに関連する方法を実施するための試薬の使用を提供する。たとえば、試薬は、GCライブラリーおよび/または均衡オリゴヌクレオチドライブラリーから導出された配列を有する一つまたは複数のオリゴヌクレオチドを含み得る。試薬は、本明細書に開示される他の有用な成分、たとえば非限定的に、(a)微小胞を単離するように構成された試薬(任意で、微小胞を単離するように構成された少なくとも一つの試薬は、微小胞抗原への結合物質、カラム、基体、ろ過ユニット、ポリマー、ポリエチレングリコール、PEG4000、PEG8000、粒子またはビーズを含む);(b)オリゴヌクレオチドまたは複数のオリゴヌクレオチドを増幅、配列決定、ハイブリダイズまたは検出するためにプライマーまたはプローブとして働くように構成された少なくとも一つのオリゴヌクレオチド;および(c)試料から1種または複数種の豊富なタンパク質を除去するように構成された試薬(任意で、1種または複数種の豊富なタンパク質は、アルブミン、免疫グロブリン、フィブリノーゲンおよびフィブリンのうち少なくとも1種を含む)の少なくとも一つをさらに含み得る。
本発明はまた、本発明の方法を実施するための1種または複数種の試薬を含むキットを提供する。たとえば、1種または複数種の試薬は、1種または複数種のアプタマー、バッファ、ブロッカー、酵素またはそれらの組み合わせであることができる。1種または複数種の試薬は、非限定的にアプタマーライブラリー、基体、たとえばマイクロビーズまたは平面アレイもしくはウェル、(例えば、クロマトグラフィー、ろ過法、限外ろ過法、遠心分離、超遠心分離、フローサイトメトリー、アフィニティー捕捉法(例えば、平面、カラム、またはビーズに対する)、ポリマー沈殿による、および/またはマイクロ流体工学を用いる)バイオマーカーおよび/または微小胞単離のための試薬、特定の標的に対するアプタマー、バイオマーカー/微小胞集団の検出を容易にするアプタマープール、核酸配列決定または増幅のためのプライマーのような試薬、核酸ハイブリダイゼーションのためのアレイ、検出可能な標識、溶媒またはバッファなど、様々なリンカー、様々なアッセイ成分、ブロッカーなどを含む、主題の方法を実施するための任意の有用な試薬を含み得る。1種または複数種の試薬はまた、本発明によって提供される様々な組成物を含み得る。ある態様において、1種または複数種の試薬は本発明の1種または複数種のアプタマーを含む。1種または複数種の試薬は、基体、たとえば平面基体、カラムまたはビーズを含むことができる。キットは、1種または複数種の試薬を使用して様々なアッセイを実施するための取り扱い説明を含むことができる。
標的を、スライドガラスまたは磁気ビーズなどの固体基体に付着させる。磁気ビーズの調製のためには、ビーズを、0.1〜1 mg/mlの範囲の濃度の標的タンパク質とインキュベーションする。特定のビーズ製造業者により提供される化学に従って、標的タンパク質をビーズに結合させる。典型的には、これは、N-ヒドロキシスクシンイミド(NHS)官能基プロセスを介したカップリングを含む。占有されていないNHS基を、標的との結合後に不活性にする。
抗体などの、標的に対する公知のリガンドを、結合したオリゴ種を溶出するために使用する(カオトロピック剤とは対照的に、またはカオトロピック剤に加えて)以外は、上記の実施例1におけるようにプロセスを行う。この場合は、Santa Cruz Biotechnology, Inc.由来の抗EpCAM抗体を、標的EpCAMからアプタマーを溶出するために使用した。
上述の結合アッセイから生成された全てのアプタマーを、Life Technologies由来のIon Torrentなどのハイスループット配列決定プラットフォームを用いて、配列決定する。
実施例3のプロセスに続いて、関心対象の標的に対する高親和性アプタマーを特定する。ひとたび高親和性アプタマーを特定すると、その配列を、次に、その二次元フォールディング構造を推定するためにソフトウェアプログラムを用いて解析する。周知の配列アラインメントプログラムおよびモチーフ特定のためのアルゴリズムを、配列モチーフを特定するため、および配列の一様な大きなデータセットの次元を低減させるために使用することができる。さらに、Viennaおよびmfoldなどのソフトウェアプログラムが、アプタマー選択の当業者に周知であり、二次構造モチーフ(共有される形状)に基づいてさらに配列をグループ化するために使用することができる。例となる構造予測については、図3Aおよび図3Bを参照されたい。共有される二次構造は、当然、同一の三次元構造を保証するものではない。従って、1セットのインシリコのツールではまだ、アプタマー候補のセットの中で最適なアプタマーを完全に予測することができないため、アプタマーの「ウェットラボ」評定が、依然として有用である。
循環微小胞を、以下の方法のうちの1つを用いて正常血漿(例えば、癌を有さない個体由来)から単離する:1)製造業者のプロトコルに従う、ExoQuick試薬を用いる単離;2)50,000〜150,000gでの1〜20時間のスピンを含み、その後沈殿物をPBSに再懸濁する、超遠心分離;3)製造業者のプロトコルに従う、Life Technologies由来のTEXIS試薬を用いた単離;ならびに4)濾過方法論。濾過法を、より詳細に以下に記載する。
アプタマーを、バイオマーカーを検出するための結合物質として使用することができる。本実施例においては、アプタマーを、微小胞と会合したEpCAMタンパク質を検出するための結合物質として使用する。
アプタマーは、結合物質に依拠する多数のタイプのアッセイを含む種々の生物学的アッセイにおいて使用することができる。例えば、アプタマーを、免疫ベースのアッセイにおいて抗体の代わりに使用することができる。本実施例は、アッセイ工程を通していかなる表面(基体、チューブ、フィルター、ビーズ、他の抗原など)にも結合せず、関心対象の抗原に特異的に結合するアプタマーを特定するアプタマースクリーニング法を提供する。アッセイは、最終的なアッセイの非標的抗原成分に結合するアプタマーを除去する、ネガティブ選択に依拠する。ネガティブ選択の後に、所望の抗原に結合するアプタマーを特定するポジティブ選択を行う。
1.ビーズのネガティブ選択ミックスを調製する:1200個の非磁気ビーズを、標準的なブロッキング剤と20分間インキュベーションする。
開始前に、当技術分野において公知の条件を用いて、関心対象のタンパク質バイオマーカー(ここではSSX4、SSX2、PBP、KLK2、SPDEF)を望ましい非磁気マイクロビーズに結合させる。組み換え精製された出発材料には、以下が含まれた:Novus Biologicals (Littleton, CO, USA)、カタログ番号H00025803-P01のSPDEF組み換えタンパク質;Novus、カタログ番号H00003817-P02のKLK2組み換えタンパク質;Novus、カタログ番号H00006757-P01のSSX2組み換えタンパク質;Fitzgerald Industries International (Action, MA, USA)、カタログ番号30R-1382のPBP組み換えタンパク質;GenWay Biotech, Inc. (San Diego, CA, USA)、カタログ番号GWB-E219ACのSSX4組み換えタンパク質。
1.3回目の洗浄(PBS-BN)後に、25μlの試料をフィルターの上部から1.5 mlチューブ中に収集した。
1.工程5)における最終的な洗浄後に、5μg/mlのストレプトアビジン-PEをアプタマー混合物に添加し、30分間室温で、550 rpmで撹拌しながらインキュベーションした。
このラウンドを開始する前に、関心対象の抗原(SSX4、SSX2、PBP、KLK2、SPDEF)を、当技術分野において公知である方法を用いて、カルボキシル化磁気ビーズに結合させた。
本実施例においては、上記の実施例における技術を用いて特定されたEpCAMに対するアプタマーを特徴決定する。上述のようなEpCAM結合アプタマーのプールについての選択後に、Ion Torrent標準プロトコル(Life Technologies, Carlsbad, CA)を用いてアプタマーライブラリーを配列決定した。リード候補を、(a)完全な期待される長さの産物でのすべての読み取り配列にわたる高存在量のモチーフおよび(b)強い二次構造、を有するものとして選択した(図7B)。
CAR003は、上記の方法論を用いて同定されるアプタマー候補である。RNAアプタマーとして、代替的なテール配列を伴うCAR003は、以下のRNA配列(SEQ ID NO: 5)を有する。
選択されたCAR003アプタマーを、AKTA OligoPilot 100 Synthesizer(GE Healthcare Life Sciences Corp., Piscataway, NJ)を用い、3'ビオチンおよび最終的な脱トリチルを伴って再合成した。産物を、FPLCにより陰イオン交換クロマトグラフィーで精製した。FPLC後のいくつかの画分を、図7Cに示されているプール1〜3として示されるように、組み合わせた。図は、すべての産物、および、ゲル上で品質を確認した後にプールに割り当てられた画分でのFPLCクロマトグラムを含む。図7Dは、合成後のCAR003アプタマーの異なるFPLC画分を有するSYBR GOLD染色ゲルを示す。異なる画分を、高から低への順序で(プール1−プール3)未完成の鎖の量に基づいて、プールにおいて組み合わせた。プール1〜3は、図7Cに示されているものに対応する。
精製されたCAR003アプタマーを、以下の内部で開発されたアッセイを用いて、ポリヒスチジンタグを有する(「Hisタグ付加された」)組み換えEPCAMタンパク質への結合について試験した。抗Hisタグ結合ビーズを、EPCAM-Hisタグ付加タンパク質と混合した。試験されるべきアプタマーを、ストレプトアビジン-フィコエリスリン(SA-PE)で標識した。EpCAM-ビーズとSA-PE標識アプタマーとを、混合した。結合を、本明細書に記載されているようなビーズアッセイにおいて中央蛍光値として測定した。MFI値(図7E〜図7F)は、組み換えEpCAMに対するSA-PE標識アプタマーの結合の増大と共に増大する。図7E〜図7Fは、PBS-BN(PBS、1% BSA、0.05%アジド、pH 7.4)を含む25 mM HEPESにおける(図7E)、または1 mM MgCl2を含む25 mM HEPESにおける(図7F)、EPCAMタンパク質へのCAR003の結合を示す。EPCAMアプタマーであるアプタマー4(上記を参照されたい)を、比較のために使用した。図に示されるように、CAR003のプール3は、BSAの存在下(図7E)よりもMgCl2の存在下(図7F)でより効率的に、その標的に結合する。
5人の前立腺癌対象および5人の正常対象由来の血漿試料を、CAR003で試験し、微小胞を捕捉するためのビーズ結合タンパク質、および小胞を検出するためのSA-PE標識アプタマーを用いて微小胞を検出した。SA-PE標識アプタマー4検出物質を、対照として用いた。正常を上回る癌の倍率変化(fold change)を、表7に示す。倍率変化を、正規化を伴わず(「未処理」)、または陰性対照に対する正規化を伴って示す。小胞を、示されるようなSSX4、PBP、SPDEF、EPCAM、KLK2、およびSSX2に対する、ビーズ結合抗体で捕捉した。
アプタマーの特徴(サイズ、安定性、結合親和性、および特異性など)を、EpCAMまたは他の標的に特異的な対照アプタマーに対して比較することができる。例えば、アプタマーを、Kaur and Yung, 2012に記載されているような抗VEGFアプタマー:
と比較する。
本実施例においては、ミクロスフェアに結合させたアプタマーを、上述のようなライブラリースクリーニング法により特定された2個のアプタマーの標的を決定することを手助けするために用いる。全般的なアプローチを、図9に示す。アプローチを、EpCAMを認識するライブラリースクリーニングにより特定されたアプタマーであるCAR003の標的を検証するために使用する。CAR003については、上記の記載を参照されたい。本アプローチにおいては、CAR003の配列を、ミクロスフェアへの連結の前にランダムに再配列させる。ミクロスフェアを、意図される標的分子に類似しているが同一ではない標的に結合する対照として、使用する。
1)候補アプタマー(ここでは、CAR003)および陰性対照アプタマー(ここでは、ランダムに再配列させたCAR003)を、捕捉を可能にする修飾(ここでは、アプタマーをビオチン化する)および架橋を可能にする修飾(ここでは、光架橋を可能にするために、Thermo Fisher Scientific Inc., Rockford, IL由来のSulfo-SBED Biotin Label Transfer Reagent and Kit、カタログ番号33073を用いる)を伴って合成する。
2)アプタマーの各々を、関心対象の標的を有する微小胞(ここでは、BrCa細胞系微小胞)と個々に混合する。
3)アプタマーを標的に結合させるために、インキュベーション後に、アプタマーと微小胞標的との架橋を引き起こすように、紫外線を混合物に適用する。
4)微小胞を溶解させ、それにより架橋されたアプタマー-標的複合体を溶液中に放出する。
5)架橋されたアプタマー-標的複合体を、ストレプトアビジンコーティング基体を用いて溶液から捕捉する。
6)各アプタマーについて架橋されたアプタマー-標的複合体を、SDS-PAGEゲル電気泳動上で個々に流す。捕捉されたタンパク質標的を、クマシーブルー染色で可視化する。
7)架橋工程および結合工程は無差別の可能性があるため、意図される標的を含むが、ランダムなタンパク質もまた含む複数のバンドが、ゲルの各々上に現れるであろう。意図される標的は、候補アプタマー(ここでは、CAR003)を有するゲル上には現れるが、関連する陰性対照アプタマー(ここでは、ランダムに再配列させたCAR003)を有するゲル上には現れないバンド中に見出されるであろう。標的に対応するバンドを、ゲルから切り出す。
8)質量分析(MS)を用いて、切り出されたバンドからアプタマーの標的を特定する。
本実施例においては、アプタマーライブラリーを、乳癌患者の血液中に循環している微小胞と、健康な対照個体(すなわち、乳癌を有していない)の血液中に循環している微小胞とを識別するアプタマーを特定するためにスクリーニングする。
である。アプタマーライブラリーは、3個のセクションからなる:フォワードプライマー- 15ヌクレオチド、可変領域- 40ヌクレオチド;リバースプライマー- 25ヌクレオチド。すべてのピリミジン(CおよびU)は、2'フルオロ修飾されていた。
本実施例は、上記の実施例において行われたSUL1 RNAライブラリー選択についてのプロトコルを提供する。プロトコルは、所望のとおりに、他のアプタマーライブラリーおよび試料投入量に採り入れられ得る。
作業空間を、作業前に80% EtOHで清浄にする。
・MilliQ水
・100mM MgCl2
・5×転写緩衝液(200mMトリス pH 7.9)
・1×PBS
・3mM MgCl2を含む1×PBS
・10×PBS
・選択緩衝液(0.1% BSAおよび3mM MgCl2を含む1×PBS)
略語:TK−転写;NTC−鋳型なし対照。
1.第1ラウンド:1nmolの精製された2'F SUL1 RNAを、20μlの再懸濁されたビーズ(微小胞と結合させたもの)と混合する。10uLの10×PBS+1% BSA、3μl 100 mM MgCl2、および47uL H20。これにより、1×PBS、0.1% BSA、3mM MgCl2の終濃度になる。
1.1 この工程におけるMgCl2の添加により、3mM MgCl2の濃度になる。これは、プロセス全体のための結合濃度である。
1.2 その後のラウンド:20μlの転写産物(内部に15 mM MgCl2)を、20μlの洗浄された微小胞コーティングビーズ、加えて9uLの1% BSAを含む10×PBS、51uL H2Oと混合する。希釈された転写産物(TK)中のMgCl2が3mM MgCl2の終濃度を提供するため、追加のMgCl2は必要とされない。
2.30分間37℃でインキュベーションし、1000rpmで振盪し、10分毎にピペットで混合する。
3.ビーズを洗浄する:
3.1 1回の洗浄サイクルは以下を含む:
3.1.1 ビーズを磁石から取り外す。
3.1.2 ビーズを磁石から外して、100μlの1×PBS+3mM MgCl2に再懸濁する。
3.1.3 試料を磁石から外して、30秒間インキュベーションする。
3.1.4 試料を磁石上に戻して置き、ビーズが側面に寄るまで待つ。
3.1.5 上清を除去して廃棄する。
3.1.6 磁石から外して、100μlの1×PBS+3mM MgCl2+0.1% BSAに再懸濁する。
3.1.7 試料を磁石から外して、3分間インキュベーションする。
3.1.8 試料を磁石上に戻して置き、ビーズが側面に寄るまで待つ。
3.1.9 上清を除去して廃棄する。
3.2 第1ラウンド:ビーズ混合物を磁石上に置き、上清を除去する。100μlの1×PBS+3mM MgCl2+0.1% BSAで1回洗浄し(ビーズをピペットで混合することにより)、緩衝液を廃棄する。
3.3 その後のラウンド:洗浄工程を、1ラウンドおきに、1回多い洗浄工程により3回の洗浄工程まで増大させる。
4.55μlのMilliQ水をビーズ試料に添加する。
5.ビーズ試料を5分間80℃でインキュベーションすることにより、RNAを溶出する。
5.1 50μlあるかどうかを確認し、ない場合は、凝縮された水を上部から離してスピンダウンするために、試料をスピンする。
5.2 上清を新たなバイアルに移す。鎖がビーズに再結合することを回避するために素早く作業する。
5.2.1 その後のRT-PCRに50μlの溶出液を使用し、残りを-20℃で保存する。
参考事項
・RT-PCR試料およびTK-PCR試料の残りは、-20℃で保存する。
・RNAは、4℃で約1時間保存することができる。
・RT-PCR産物は、一晩4℃で保存することができる。
・最適なRNA品質のために、転写後直ちに次の選択サイクルに進む。
・RNAをボルテックスすることは回避する。
・氷上で混合する。
・0.5ml PCRチューブを使用する。
・すべてのRT-PCRは、鋳型の代わりに水を含む鋳型なし対照(NTC)を有する。
・DTTを、1回より多くは凍結融解しない。
6.第1ラウンドの前にマスターミックスを調製し、それを0.5 pmol RNAで確認し、48μlのアリコートを使用まで-20℃で保存する。
8.65℃で5分間、インキュベーションする。
9.4℃に冷却した後に、以下を添加する:
9.1 1μl Superscript II Reverse Transcriptase(Invitrogen、カタログ番号18064)(200 U/μl)
9.2 1μl GoTaqFlexi DNA polymerase(5単位/μl)Promegaカタログ番号M8305。
a)10分、54℃
(この工程は、逆転写酵素のためだけであり、より多くのラウンドが必要とされる場合、工程Aは繰り返さない。)
b)1分、95℃
c)1分、60℃
d)1分、72℃
10.工程b〜dのサイクルを行う。
10.1 第1ラウンドはb〜dを4サイクル。5μLのPCR産物を4%アガロースゲル上で泳動する。
10.1.1 その後のラウンド:RNAの量は第1ラウンド後に減少し、必要とされるPCRサイクルの増大をもたらす。各々の時に必要とされるサイクルの回数を決定するために、前のラウンドの選択から、アガロースゲル由来のバンドの強度を確認する。その回数のサイクルを用いて、次のラウンドのRT-PCRを開始する。注意:常にアガロースゲル上の結果を確認する。
10.1.1.1 アガロースゲルの結果:産物のバンドが、標的の長さで見られるであろう。バンドの強度は、50bpラダーのバンドとほぼ同じであろう(同じでない場合は、少し強度が低い)。バンドが十分な強度ではない(かろうじて見える)場合は、適切な量より多くサイクルを行い、アガロースゲル上で再確認する。
すべての混合を氷上で行う。転写マスターミックスを調製し、85.7μlのアリコートを使用まで-20℃で保存する。
11.使用前に、ストックの200 mMトリス pH 7.9のpHを検証する。経時的なpHの変化は、転写で問題を引き起こす可能性がある。
13.1μlのRNasin(40単位/μl)を添加する。
13.1 Promega Recombinant RNasin Ribonuclease Inhibitor カタログ番号N2515/N2511
14.4μlのT7 Y639F変異ポリメラーゼを添加する(25U/μl使用:反応当たり全部で100U)。
15.反応を30分間、37℃で行う。
16.転写産物を、次の選択ラウンドに直接使用する。次の工程が実行可能ではない場合は、転写産物を-20Cで凍結する。
ビーズのインキュベーション、RT-PCRおよび転写を、必要に応じてしばしば繰り返す。上述したように、すべてのラウンドにおいて試料について類似したバンド強度のRT-PCR産物を有するように努める。
癌で選択されたアプタマーの対照ビーズ(血漿超遠心分離由来の上清に結合させたもの、上記を参照されたい)への非特異的な結合を決定して評価するために、望ましいラウンドの選択後に結合アッセイを行い、同様に非癌対照試料についても行う。結合アッセイはまた、選択されたアプタマーの意図される標的微小胞に対する結合を評価するために行うこともできる。
1.-80℃冷凍庫から微小胞試料を取り出して、融解する。
2.ビーズを磁石上に置き(試料実験当たり200,000個)、ビーズ保存緩衝液を除去する。
3.1×PBS、3mM MgCl2緩衝液で各々1分間、1×200μLで洗浄する。1チューブ中に200,000個になるようにビーズをプールする。
4.ビーズを70μLの選択緩衝液に再懸濁する。(試料当たり10μlの10×PBS、1% BSA+3μL 100mM MgCl2+57μL H2O)。
5.30μLの放射性標識されたRNAアプタマーライブラリーを、それぞれの試料に添加する。
6.1000 rpmで振盪しながら、37℃で30分間インキュベーションする。
7.試料を磁石上に置く。
8.上清を除去して取っておく。
9.ビーズを、200μLの洗浄緩衝液1×PBS 3mM MgCl2 pH 7.4で、磁石から外して3分間インキュベーションし、洗浄する。
10.試料を磁石上に置き、洗浄溶液を除去して取っておく。
11.工程9、10を繰り返す。
12.100μLの水を試料に添加し、ピペットで混合する。
13.80℃で5分間、加熱する。
14.試料を磁石上に置き、上清を除去して取っておく。
15.ビーズを、100μLの水に再懸濁する。
16.シンチレーションカウンターを用いて、すべての画分の放射活性を測定する。
17.存在するバックグラウンド結合の量を解析する。
所望のとおり、ネガティブ選択工程を、アプタマーライブラリーを標的微小胞に結合させたビーズとインキュベーションする前に追加する(すなわち、上記の「微小胞コーティング磁気ビーズへの2'F SUL1 RNAプールの結合」の手順)。ネガティブ選択は、微小胞を試料から濾過または遠沈させた後の上清または投入試料(例えば、血漿)に結合させたビーズ(「非微小胞コーティングビーズ」、「微小胞枯渇試料」、または類似して呼ばれる)を用いて行うことができる。工程は、以下である。
1)上述のような転写後の望ましいラウンド由来のアプタマーライブラリー産物で開始する。開始前にビーズを洗浄する:保存緩衝液を除去し、ビーズを200μLの洗浄緩衝液で洗浄し、その後、下記に述べるような緩衝液に置換する。
2)ネガティブ選択工程:20μlの新たに洗浄された非微小胞コーティングビーズを伴う転写産物(15 mM MgCl2)と、10μLの1% BSAを含む10×PBS、70μL H2Oとを添加し、ピペットで混合する。希釈された転写産物(TK)中のMgCl2が3mM MgCl2の終濃度を提供するため、追加のMgCl2は必要とされない。
3)30分間37℃でインキュベーションし、1000rpmで振盪する。
4)上清を除去して、それを、洗浄された微小胞コーティングビーズであるポジティブ選択ビーズに(直接)添加する。
本実施例においては、アプタマーライブラリーを、乳癌患者の血液中に循環している微小胞と、健康な対照個体(すなわち、乳癌を有していない)の血液中に循環している微小胞とを識別するアプタマーを特定するためにスクリーニングする。この手順は、上記の実施例10におけるものと同じ試料およびアプタマーライブラリーを使用した。本実施例の手順は、ネガティブ選択を第3ラウンドのポジティブ選択後に開始して、各ポジティブ選択の前に行った点で異なる。
である。アプタマーライブラリーは、3個のセクションからなる:フォワードプライマー- 15ヌクレオチド、可変領域- 40ヌクレオチド;リバースプライマー- 25ヌクレオチド。すべてのピリミジン(CおよびU)は、2'フルオロ修飾されていた。
本実施例は、増殖性疾患を診断するための本発明のアプタマーの使用を例証する。
本実施例は、マウスにおいて増殖性疾患を治療するための本発明のアプタマーの使用を例証する。
本実施例は、関心対象の表現型を示す微小胞を検出するためのオリゴヌクレオチドプールの使用を例証する。方法は、関心対象の表現型を示す関心対象の標的に対して富化されているオリゴヌクレオチドのプールを使用する。本実施例における方法により、標的実体を優先的に認識するためのオリゴヌクレオチドのライブラリーの効率的な使用が可能になる。
1)未知の医学的語源を有する患者の試料(血漿、血清、尿、または任意の他の生物学的試料)を取得し、関心対象の標的の利用可能性を確実にするために、それに応じて前処理する(下記を参照されたい)。関心対象の標的が微小胞集団である場合は、微小胞を単離することができ、任意で、マイクロビーズなどの固体支持体につなげることができる。
2)前処理した試料を、関心対象の標的に対してある特定の特異性を保有するオリゴヌクレオチドプールに曝露する。本明細書に記載されているように、関心対象の標的に対してある特定の特異性を保有するオリゴヌクレオチドプールは、種々の選択スキームを用いて、例えば、上述のようなネガティブ選択のための非癌微小胞およびポジティブ選択のための癌微小胞を用いて、富化することができる。DNAオリゴヌクレオチドまたはRNAオリゴヌクレオチドを、所望のとおりに使用することができる。
3)オリゴヌクレオチドライブラリーを試料と接触させる。
4)標的に結合した任意のオリゴヌクレオチドを溶出する。
5)溶出されたオリゴヌクレオチドを配列決定する。次世代配列決定法を使用することができる。
6)配列決定由来のオリゴヌクレオチドプロファイルを解析する。関心対象の標的に結合することが公知のオリゴヌクレオチドのプロファイルにより、投入試料内に標的が存在することが示される。プロファイルを、例えば、癌または非癌として、試料を特徴決定するために使用することができる。
様々な構成のアッセイが実施されうる。以下は、オリゴヌクレオチド-配列決定アッセイの目的を果たす4種の例示的プロトコルである。試料は、任意の生物学的試料であることができる。
微小胞を単離するための、沈殿の2回の洗浄を伴う、1〜5 mlの体液試料(例えば、血漿/血清/尿)の超遠心分離(120K×g、スクロースなし)。
この代替的なプロトコルは、微小胞単離工程、ビーズへの微小胞の結合、または分離した分配工程を含まない。これは、投入試料に対するオリゴヌクレオチドの非特異的結合を示す可能性がある。
このプロトコルは、超遠心分離の代わりに濾過を使用し、より少ない時間および試料容積を必要とするものである。
微小胞を単離するための、沈殿の2回の洗浄を伴う、1〜5 mlの体液試料の超遠心分離(120K×g、スクロースなし)。
上記の実施例15における方法を、乳癌細胞に由来する体液試料において微小胞を検出するために使用する。オリゴヌクレオチドライブラリーは、非癌個体に対して乳癌患者由来の微小胞に優先的に結合する、上記の実施例12に記載されているオリゴヌクレオチドのサブセットを含む。配列を、SEQ ID NO: 24〜10527として本明細書に列挙する。方法を、乳癌を示す微小胞の有無を検出するために使用する。
古典的なアプタマー選択技術(すなわち、SELEX)は、典型的に、非標的分子(競合相手)での干渉が最小化されている「きれいな」条件において、特定の標的についてアプタマーを富化するために行われる。しかしながら、選択されたアプタマーについての種々の用途は、アプタマーが、多様な環境において、例えば豊富な潜在的干渉分子を伴う生物学的試料または組織培養培地において、その標的に結合するように働くことを必要としている。この場合には、選択プロセス中に存在しなかったそのような干渉分子が、より理想的な条件において選択されたアプタマーによる標的に認識を干渉する可能性がある。本実施例は、標的に対して非常に特異的なアプタマーを選択するためにアプタマーライブラリーをスクリーニングし、かつまた、潜在的干渉分子を含む生物学的試料において行うことができるアプタマー選択プロセスを提供する。
→微小胞を、超遠心分離を用いて癌および正常の血漿試料から単離する。微小胞枯渇試料を構成する上清を、陰性対照試料として保存する。
→単離された微小胞を、磁気ビーズに捕捉/結合させる。
→上記由来の上清(すなわち、微小胞枯渇血漿)と混合された微小胞結合ビーズを用いて、アプタマースクリーニングおよび選択プロセスを開始する。上清にMgCl2を補給する。癌由来および正常(非癌由来)の微小胞についてのアプタマースクリーニングおよび選択を、並行して行うことができる。各ラウンドは、所望のとおりにネガティブ選択およびポジティブ選択からなる。
→微小胞を、超遠心分離を用いて癌および正常の血漿試料から単離する。
→単離された癌由来の微小胞を、磁気ビーズに捕捉/結合させる。
→MgCl2を補給した正常微小胞(非結合)と混合された癌微小胞結合ビーズを用いて、アプタマースクリーニングおよび選択プロセスを開始する。アプタマースクリーニングおよび選択を、磁気ビーズで保持されているアプタマーのみを保持することにより、癌由来の微小胞のみについて行う。
→微小胞を、超遠心分離を用いて癌血漿試料から単離する。
→単離された癌由来の微小胞を、磁気ビーズに捕捉/結合させる。
→MgCl2を補給した正常血漿(非結合)と混合された癌微小胞結合ビーズを用いて、アプタマースクリーニングおよび選択プロセスを開始する。アプタマースクリーニングおよび選択を、磁気ビーズで保持されているアプタマーのみを保持することにより、癌微小胞のみについて行う。
→癌由来の微小胞を、磁気ビーズに捕捉/結合させる。
→正常(非癌)微小胞を、非磁気ビーズに捕捉/結合させる。
→両方のビーズセットを混合し、開始アプタマーライブラリーでアプタマースクリーニングおよび選択プロセスを行う。
→アプタマーライブラリーとのインキュベーション後に、磁気ビーズと非磁気ビーズとを分離する。磁石を用いて磁気ビーズを捕捉し、その後、遠心分離して非磁気ビーズを分離する。
→分離された磁気ビーズおよび非磁気ビーズを、別々に洗浄する。
→両方のタイプのビーズから別々に、アプタマーを溶出および再増幅する。
→ラウンド2:両方のタイプのビーズから増幅されたアプタマープールを混合し、混合されたビーズに添加する。
→上記を繰り返す。
この実施例においては、アプタマーライブラリーをスクリーニングして、乳癌患者の血液中を循環する微小胞と、健康な対照個人(すなわち、乳癌ではない)の血液中を循環する微小胞とを区別するアプタマーを同定する。手順は、上記実施例12と類似した試料、出発アプタマーライブラリーならびにポジティブおよびネガティブ選択のラウンドを使用した。この実施例における手順は、以下に提示する分析論理およびワークフローにおいて異なる。
実施例12におけるものに代わる配列決定データ分析のバリアントを、癌/非癌エキソソームおよび対応する微小胞枯渇血漿に対してプロービングされた10ラウンドのポジティブおよびネガティブ選択(R10)後の癌/非癌富化SUL1 RNAライブラリーからのデータに適用した(実施例12を参照)。この実施例に使用された配列決定データを分析するための具体的な変更は以下のとおりである。
1)全読み取り数中の正しいプライマーとの各アプタマーの頻度を計算する。
2)癌微小胞と投入ライブラリーとの結合から回収された配列と、他の三つのタイプの試料(微小胞を枯渇させた癌小胞上清、非癌微小胞、微小胞を枯渇させた非癌上清)への結合から回収された配列と、dsDNA結合から回収された配列とを重ね合わせる。
3)投入ライブラリーと比較して、癌微小胞に結合したRNAライブラリー中の特定のアプタマーの「富化」を計算する。投入集団と結合集団との間のアプタマー頻度における差(投入物と比較して頻度が2〜5倍、5〜10倍および10倍超)に基づく三つのしきい値クラスを考慮する。
4)癌微微小胞に結合したRNAライブラリー中の特定のアプタマーを、微小胞を枯渇させた癌血漿、非癌微小胞および微小胞を枯渇させた非癌血漿に結合したライブラリー中の同じ配列と比較したときの「倍率変化」を計算する。2以上の倍率変化を考慮する。
5)癌微小胞上の特定のRNAアプタマーを、対応するDNAアプタマーの富化と比較したときの頻度の差を計算する。0.5〜1.5のRNA/dsDNA頻度比を有するアプタマーは、dsDNAおよびRNAの両形態中の微小胞に結合している場合がある。2以上のRNA/dsDNA頻度比を有するアプタマーは、RNAアプタマーとしてより効率的に結合し得る。
6)10よりも大きい「富化」に関してデータをフィルタリングする。三つの対照試料タイプ(微小胞を枯渇させた癌血漿上清、非癌微小胞、微小胞を枯渇させた非癌上清)の倍率変化は>=2である。これが第一のアプタマーリストを提供する。5〜10および2〜5の範囲の「富化」に関してフィルタリングを繰り返すと、相応に、第二および第三のアプタマーリストが得られる。
7)どちらのアプタマー形態(すなわちDNAまたはRNA)がより効率的な結合を有し得るかを識別するために、最終のアプタマーリスト中のRNA/dsDNA比を考慮する。
この実施例においては、一般的な等モル濃度ではなく様々な濃度のヌクレオチドを使用して、高い多様性を有するアプタマーライブラリーを生成する。図12を参照すること。そのような様々なヌクレオチド濃度を提供する中で、得られるランダム配列ライブラリーは、投入されるヌクレオチドの特定の濃度に依存して、A/TとG/Cとの間の様々な比を有するオリゴヌクレオチドを含む。さらには、得られるライブラリーは、オリゴヌクレオチド分子のより大きな化学的および構造的多様性を、複合投入試料中に存在するであろう複数の標的(たとえば組織または組織成分、細胞または細胞成分、細胞外小胞など)に対するより多くの潜在的結合パートナーを提供する利点と共に提供する。そのような非常に多様なランダムライブラリーは、投入試料中に存在する所望の標的に対して高いアフィニティーを有するオリゴヌクレオチドを富化するための投入物として使用される。予想外に、標準的な等モル濃度のヌクレオチドを使用する場合には不可能である、疾患試料と非疾患試料(たとえば癌と非癌)との間で示差的な結合を示すアプタマーが見いだされる。
この実施例においては、オリゴヌクレオチド検出法(たとえば上記実施例15を参照)を適用して、乳癌患者試料を正常な(すなわち、陰性生検によって確認された、乳癌ではない)生物学的試料と区別する。試料を検出および/または区別するために使用されるオリゴヌクレオチドライブラリーは本明細書の中で「オリゴヌクレオチドプローブライブラリー」または「オリゴヌクレオチドプロファイリングライブラリー」と呼ばれ得る。ランダム化オリゴヌクレオチドライブラリーを、乳癌患者血液由来の微小胞および正常な(非癌)個人由来の微小胞に対してトレーニングした。図13Dを参照して上述した手法を適用した。図14Aを参照すること。
(ここで、nは、A、T、C、G、Uまたは他のヌクレオチドを含む)を有する3'リン酸化ssDNAオリゴヌクレオチドライブラリーからなるものであった。図示するように、各オリゴヌクレオチドは、18ヌクレオチドプライマー領域および中央の30ヌクレオチド可変領域を有する。唯一の修飾は一つの3'リン酸化ヌクレオチドである。乳癌患者由来の血漿試料をトレーニングされていない投入ライブラリーと接触させるポジティブ選択を実施した。試料中の微小胞を超遠心分離によって捕集し、微小胞と共に保持されたオリゴを溶出させ、捕集した。保持されたオリゴを次のラウンドの選択のための投入物として使用しながらこれらの工程を繰り返した。そして、部分的にトレーニングされたライブラリーを非癌患者血漿と接触させることによってネガティブ選択に供した。試料中の微小胞を超遠心分離によって捕集し、非癌微小胞に結合したオリゴを捨て、超遠心分離上清中に見られるオリゴ(すなわち、非癌微小胞に結合しなかったオリゴ)を保持した。癌患者由来の微小胞に対してポジティブ選択を繰り返し実施した。トレーニングされたライブラリーを処理してPCRおよび他の非特異アーチファクトを除去した。残るオリゴは、癌由来微小胞を優先的に認識するトレーニングされたオリゴヌクレオチドプローブライブラリーを含むものであった。この同じプロセスを逆に繰り返して、非癌由来微小胞を優先的に認識するトレーニングされたオリゴヌクレオチドプローブライブラリーを同定した(すなわち、非癌試料に対するポジティブ選択および癌試料に対するネガティブ選択)。各ライブラリーの重量単位の半分を混合することによって連合ライブラリーを創製した。このプロセスを使用し、次世代配列決定(Illumina HiSeqプラットフォーム)によってライブラリー構成を決定することにより、1,395,706の固有配列のオリゴヌクレオチドプールを創製した。このうち、843,729の配列が一回で検出された。最高から最低の出現率の順でランク付けした、オリゴヌクレオチドプール中でもっとも一般的に見られる500,000の配列をSEQ ID NO: 10559〜510558として本明細書に組み入れる。
この実施例においては、先に実施例20に記載したオリゴヌクレオチドプローブライブラリーを、正常(すなわち無疾患)試料に対して複数のタイプの癌および他の疾患を区別するその能力に関して試験した。この実施例に関しては、試料の入手しやすさに基づき、血漿および血清を投入試料として使用した。
オリゴヌクレオチドプローブライブラリーを使用して、たとえば上記実施例15および20〜21におけるように血漿または血清試料のような体液をプロービングするために、以下のプロトコルが使用される。
1試料あたり2ngのオリゴヌクレオチドライブラリー投入物を使用する。
投入オリゴヌクレオチドライブラリーは、二つのライブラリー、すなわち癌富化ライブラリーおよび非癌富化ライブラリーの混合物であり、濃度は16.3ng/ulである。
アプタマーバッファー(1×PBS中3mM MgCl2)を使用して0.2ng/ul作業原液に希釈する。
作業原液から10ul(2ngライブラリーに等しい)を各Optiseal管に加える。
PBS、Hyclone SH30256.01, LN:AYG165629、ボトル#8237、使用期限7/2015
丸底遠心分離管、Beckman 326820, LN:P91207
OptiSeal遠心分離管および栓、ポリアロマーKonical、Beckman 361621、ロット#Z10804SCA
遠心分離ローター:50.4 TI
遠心分離ローター:50.4 TI、Beckman Caris ID#0478
1 卓上遠心分離機、超遠心分離機、バケットおよびローターを4℃で予冷する。
2 血漿または血清試料を解凍する
3 試料1mlをアプタマーバッファー(1×PBS中3mM MgCl2)で1:2に希釈する
4 4℃で30分間、2000×gでスピン処理してデブリを除去する(卓上遠心分離機)
5 全試料の上清を丸底コニカルに移す
6 超遠心分離機中、4℃で45分間、12,000×gでスピン処理してさらなるデブリを除去する。
7 全試料の上清約1.8mlを新たなOptiSealベルトップ管(個別に印を付けた)に移す。
8 DNAプロービングライブラリー2ng(10ul中)を各Optiseal管に加える
9 全体で4.5mlになるまでアプタマーバッファを加える
10 OptiSealベルトップ管にキャップを固定する
11 漏れを防ぐためにキャップの周囲にパラフィルムを貼る
12 血漿およびオリゴヌクレオチドプローブライブラリーを室温で1時間、回転させながらインキュベートする
13 パラフィルムを剥がす(キャップは取らない)
14 栓をした各管の上に正しいスペーサーを配置する
15 管上のペレット区域をマークし、このマークが中心から外を向くことを確かめる。
16 管を4℃で2時間、120,000×gでスピン処理して(内列は33,400rpm)、微小胞をペレット化する。
17 マーキングがまだ中心から外を向いていることを確認する。
18 ペレットマーカーの両側から液体を捕集し、10mlシリンジバレルおよび21G2針を使用することにより、ペレットから上清を完全に除去する
19 上清を適切なバイオハザード廃棄容器に捨てる
20 1×PBSで希釈した3mM MgCl2 1mlを加える
21 1600rpmで5秒間やさしくボルテックスし、室温で5分間インキュベートする。
22 全体で約4.5mLになるまで1×PBSで希釈した3mM MgCl2を加える
23 OptiSealベルトップ管にキャップを固定する。
24 栓をした各管の上に正しいスペーサーを配置する。
25 管上のペレット区域をマークし、このマークが中心から外を向くことを確かめる。
26 管を4℃で70分間、120,000×gでスピン処理して(内列は33,400rpm)、微小胞をペレット化する
27 マーキングがまだ中心から外を向いていることを確認する。
28 ペレットマーカーの両側から液体を捕集し、10mlシリンジバレルおよび21G2針を使用することにより、ペレットから上清を完全に除去する
29 上清を適切なバイオハザード廃棄容器に捨てる
30 1×PBSで希釈した3mM MgCl2 1mlを加える
31 1600rpmで5秒間やさしくボルテックスし、室温で5分間インキュベートする。
32 全体で約4.5mLになるまで1×PBSで希釈した3mM MgCl2を加える
33 OptiSealベルトップ管にキャップを固定する。
34 栓をした各管の上に正しいスペーサーを配置する。
35 管上のペレット区域をマークし、このマークが中心から外を向くことを確かめる。
36 管を4℃で70分間、120,000×gでスピン処理して(内列は33,400rpm)、微小胞をペレット化する
37 マーキングがまだ中心から外を向いていることを確認する。
38 上清のアリコートを保存する(100ulを1.5ml管に)
39 ペレットマーカーの両側から液体を捕集し、10mlシリンジバレルおよび21G2針を使用することにより、ペレットから上清を完全に除去する
40 RNアーゼフリーの水50ulをペレットの側に加える
41 ベンチトップで15分間インキュベートする
42 清浄なはさみを使用して管を開封する。
43 ペレットを再懸濁させ、ピペットを用いてペレット側で上下に動かす
44 量を計測し、全試料を正規化するために量を記録する
45 オリゴヌクレオチドが結合した、計測し、再懸濁させ、溶出させた微小胞をRNアーゼフリーの1.5mlエッペンドルフ管に移す
46 全試料を100ulに正規化して、それを試料間および実験間で均一に維持する。
I)H2O 100ul中に再懸濁させた、微小胞/オリゴ複合体を含有する上記からの試料50ulをトランスポゾンPCR、14サイクルにおける鋳型として使用する。
II)トランスポゾンPCR産物をAMPureで処理し、全回収物をインデックスPCR、10サイクルのために使用する。
III)インデックスPCR産物をゲル上で確認し、バンドが見えるならばAMPureを実施する。バンドが見えないならば、3サイクルを追加し、ゲル上で確認する。精製後、産物をQuBitで定量化し、HiSeqフローセル(Illumina Inc., San Diego, CA)に装填するために変性および希釈を実施する。
IV)1フローセルあたり五つの試料が多重化される。HiSeq1回で10試料。
両プライマー配列にマッチするHiSeq分析からのすべての配列読み取りを互いに比較する。各固有の配列読み取りのカウントを計算し、結合のためのシグナルとして使用する。試料ごとの配列読み取りの総数によって配列カウントを正規化する。固有の配列ごとの正規化カウントを比較して、疾患状態と正常対照との間で同じ試料タイプ、すなわち血清および血漿由来の試料への異なる結合レベルを示すオリゴヌクレオチドを同定する。全試料で100を超える平均カウントを有する配列だけを考慮する。示差的な結合を示すアプタマーからのオリゴヌクレオチドデータを階層クラスタリングによってクラスター化し、試料間の類似度をヒートマップおよびデンドログラムに示す。
たとえばSELEXのような選択目的のための旧来のアプタマーライブラリー構造において、ライブラリーの各メンバーは、二つの保存された隣接配列の間に挿入された可変ヌクレオチド配列領域を含む。様々な用途の中で、保存領域は、選択ラウンド間の増幅、たとえばPCR増幅のためのプライミング部位として、配列決定のためのプライミング部位として、およびハイブリダイゼーションのために使用され得る。フォワードおよびリバースプライマーは本明細書の中で左(5')および右(3')末端プライマーと呼ばれ得る。アプタマーライブラリー配列の両端は同一であるため、ライブラリーは、配列決定目的に関して多様度が低いとみなされる。これは、増幅の偏りまたは他のそのような偏りの取り込みを生じさせ得る。いくつかのハイスループット配列決定法、たとえばIlluminaベースの次世代配列決定(NGS)の場合、最初の配列決定読み取りがクローン増幅後にフローセルの表面にクラスターを確立する。ライブラリーメンバーの始まりに同一塩基の領域を有することは、蛍光シグナルを区別すること、ひいては配列決定を進めることをより困難にする。Illuminaは、低多様度ライブラリーを配列決定する場合の様々な解決手段を提案している:(i)試料を含むライブラリーを50%のバクテリオファージPhiXゲノムと混合して多様性を導入する;(ii)対照試料を同じフローセルの異なるレーンに加える;および(iii)一つの試料内でライブラリーを互い違いに配列させる。オプション(i)および(ii)は配列決定総出力を半分に減らし、したがって、最適ではない。オプション(iii)は可変性の結果を示す:MiSeq NGS計器ではうまく使用されたが、HiSeq NGS計器ではそうはいかない。
Claims (199)
- SEQ ID NO: 10558に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同であるオリゴヌクレオチド。
- 少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、200000、300000、400000、500000、106、107、108、109、1010、1011、1012、1013、1014、1015、1016、1017または少なくとも1018個の異なるオリゴヌクレオチド配列を含み、各オリゴヌクレオチド配列またはその部分がSEQ ID NO: 10558に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である、複数のオリゴヌクレオチド。
- 少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、200000、300000、400000または500000個の異なるオリゴヌクレオチド配列を含み、各オリゴヌクレオチド配列またはその部分がSEQ ID NO: 10559〜510558から選択される配列に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である、複数のオリゴヌクレオチド。
- SEQ ID NO: 10559〜510558にリストされたオリゴヌクレオチドの少なくとも50%、60%、70%、80%、90%、95%、96%、97%、98%または少なくとも99%を含む、オリゴヌクレオチドプローブライブラリー。
- SEQ ID NO: 510559〜510578から選択される配列に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列またはその部分を含む、オリゴヌクレオチド。
- 少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20個の異なるオリゴヌクレオチド配列を含み、各オリゴヌクレオチド配列またはその部分がSEQ ID NO: 510559〜510578に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である、複数のオリゴヌクレオチド。
- SEQ ID NO: 510579〜510598から選択される配列に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列またはその部分を含む、オリゴヌクレオチド。
- 少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20個の異なるオリゴヌクレオチド配列を含み、各オリゴヌクレオチド配列またはその部分がSEQ ID NO: 510579〜510598に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である、複数のオリゴヌクレオチド。
- SEQ ID NO: 510599〜510763から選択される配列に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列またはその部分を含む、オリゴヌクレオチド。
- 少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、125、130、140、150、160または165個の異なるオリゴヌクレオチド配列を含み、各オリゴヌクレオチド配列またはその部分がSEQ ID NO: 510599〜510763に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である、複数のオリゴヌクレオチド。
- 少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、125、130、140、150、160または165個の異なるオリゴヌクレオチド配列を含み、各オリゴヌクレオチド配列またはその部分が表16中の行中の配列番号に対して少なくとも50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である、複数のオリゴヌクレオチド。
- DNA、RNA、非天然のヌクレオチド、欠失、挿入、付加、および化学的修飾からなる群より選択される少なくとも一つの機能的修飾を含む、請求項1〜12のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチド。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドを試料と接触させる工程および試料中の標的へのオリゴヌクレオチドまたは複数のオリゴヌクレオチドの結合の存在またはレベルを検出する工程を含み、任意で、オリゴヌクレオチドまたは複数のオリゴヌクレオチドが請求項1〜12のいずれか一項記載のものである、方法。
- 試料が、生物学的試料、有機試料、無機試料、組織、細胞培養物、体液、血液、血清、細胞、微小胞、タンパク質複合体、脂質複合体、糖質またはそれらの任意の組み合わせ、部分もしくは変種を含む、請求項13記載の方法。
- 標的が、細胞、オルガネラ、タンパク質複合体、リポタンパク質、糖質、微小胞、膜断片、小分子、重金属、毒素または薬物を含む、請求項13記載の方法。
- (a)微小胞を含む生物学的試料をオリゴヌクレオチドプローブライブラリーと接触させる工程であって、任意で、オリゴヌクレオチドプローブライブラリーが、請求項1〜12のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドを含む、工程;
(b)微小胞の少なくとも一部分に結合したオリゴヌクレオチドを同定する工程;および
(c)同定されたオリゴヌクレオチドのプロファイルに基づいて試料を特徴決定する工程
を含む、方法。 - (a)溶解状態の混合物を形成するために、試料を、少なくとも106、107、108、109、1010、1011、1012、1013、1014、1015、1016、1017または少なくとも1018個の異なるオリゴヌクレオチド配列のオリゴヌクレオチドを含むオリゴヌクレオチドプローブライブラリーと接触させる工程であって、オリゴヌクレオチドが、試料中の複数の実体に結合して複合体を形成することができ、任意で、オリゴヌクレオチドプローブライブラリーが、請求項1〜12のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドを含む、工程;
(b)工程(a)で形成された複合体を混合物から分割する工程;および
(c)試料に関するオリゴヌクレオチドプロファイルを同定するために、工程(b)で分割された複合体中に存在するオリゴヌクレオチドを検出する工程
を含む、方法。 - 検出する工程が、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの配列決定、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの増幅、および/または、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの、アレイへのハイブリダイゼーションを実施する工程を含む、請求項17記載の方法。
- (a)第一のオリゴヌクレオチドライブラリーを生物学的試験試料および生物学的対照試料と接触させる工程であって、生物学的試料中に存在する生物学的実体と、第一のオリゴヌクレオチドライブラリー中に存在する複数のオリゴヌクレオチドとの間に複合体が形成される、工程;
(b)生物学的試験試料および生物学的対照試料それぞれに関してオリゴヌクレオチドのサブセットを生成するために、工程(a)で形成された複合体を分割して、複合体中のオリゴヌクレオチドを単離する工程;
(c)(b)におけるオリゴヌクレオチドのサブセットを生物学的試験試料および生物学的対照試料と接触させる工程であって、生物学的試料中に存在する生物学的実体と、オリゴヌクレオチドのサブセット中に存在する第二の複数のオリゴヌクレオチドとの間に複合体が形成されて、オリゴヌクレオチドの第二のサブセット群を生成する、工程;ならびに
(d)オリゴヌクレオチドのそれぞれ第三、第四、第五またはそれ以降のサブセット群を生成するために、任意で、工程(b)〜(c)を一回、二回、三回またはより多く繰り返して、それによって、富化されたオリゴヌクレオチドプローブライブラリーを生成する工程
を含む、富化されたオリゴヌクレオチドプローブライブラリーを生成する方法。 - 少なくとも2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、200000、300000、400000または500000個の異なるオリゴヌクレオチド配列を含む複数のオリゴヌクレオチドであって、該複数が、請求項19記載の方法から得られ、ライブラリーが第一の表現型を第二の表現型と区別することができる、複数のオリゴヌクレオチド。
- 第一の表現型が疾患もしくは障害を含み、第二の表現型が健康な状態を含む;または第一の表現型が疾患もしくは障害を含み、第二の表現型が異なる疾患もしくは障害を含む;または第一の表現型が疾患もしくは障害のある病期もしくは進行を含み、第二の表現型が同じ疾患もしくは障害の異なる病期もしくは進行を含む;または第一の表現型が治療に対する正の応答を含み、第二の表現型が同じ治療に対する負の応答を含む、請求項20記載の複数。
- (a)生物学的試験試料を請求項1〜12のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドと接触させる工程;
(b)工程(a)で請求項1〜12のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドと生物学的試験試料中の標的との間に形成された複合体の存在またはレベルを検出する工程;および
(c)工程(b)で検出された存在またはレベルを、生物学的対照試料からの参照レベルと比較し、それによって疾患または障害を特徴決定する工程
を含む、疾患または障害を特徴決定する方法。 - 検出する工程が、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの配列決定、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの増幅、および/または複合体中のすべてもしくはいくつかのオリゴヌクレオチドの、アレイへのハイブリダイゼーションを実施する工程を含み得る、請求項22記載の方法。
- 配列決定がハイスループット配列決定を含む、請求項23記載の方法。
- 生物学的試験試料および生物学的対照試料がそれぞれ、組織試料、細胞培養物、または生物学的流体を含む、請求項19または22〜24のいずれか一項記載の方法。
- 生物学的流体が体液を含む、請求項25記載の方法。
- 体液が、末梢血、血清、血漿、腹水、尿、脳脊髄液(CSF)、痰、唾液、骨髄、滑液、眼房水、羊水、耳垢、母乳、気管支肺胞洗浄液、精液、前立腺液、カウパー腺液もしくは尿道球腺液、女性射精液、汗、糞便、体毛、涙液、嚢胞液、胸膜液および腹膜液、心膜液、リンパ液、糜粥、乳糜、胆汁、間質液、月経分泌物、膿、皮脂、嘔吐物、膣分泌液、粘膜分泌液、水便、膵液、鼻腔からの洗浄液、気管支肺吸引液、胚盤胞腔液、または臍帯血を含む、請求項26記載の方法。
- 体液が、血液、血清、または血漿を含む、請求項26記載の方法。
- 生物学的流体が微小胞を含む、請求項25記載の方法。
- 複合体が、オリゴヌクレオチドまたは複数のオリゴヌクレオチドと少なくとも一つの微小胞との間で形成される、請求項29記載の方法。
- 生物学的試験試料および生物学的対照試料が、単離された微小胞を含み、任意で、微小胞が、クロマトグラフィー、ろ過、限外ろ過、遠心分離、超遠心分離、フローサイトメトリー、アフィニティー捕捉(たとえば平面、カラムまたはビーズへの)、ポリマー沈殿の少なくとも一つを使用しかつマイクロ流体工学を使用して単離される、請求項19または22〜30のいずれか一項記載の方法。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドがポリペプチドまたはその断片に結合する、請求項22〜31のいずれか一項記載の方法。
- ポリペプチドまたはその断片が可溶性または膜結合状態であり、任意で、膜が微小胞膜を含む、請求項32記載の方法。
- ポリペプチドまたはその断片が表3または表4中のバイオマーカーを含む、請求項33記載の方法。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドが、生物学的試料中の微小胞表面抗原に結合する、請求項22〜34のいずれか一項記載の方法。
- 疾患または障害が、乳癌、アルツハイマー病、気管支喘息、膀胱移行上皮癌、巨細胞オステオブラストクラストーマ、脳腫瘍、結腸直腸腺癌、慢性閉塞性肺疾患(COPD)、子宮頸部扁平上皮癌、急性心筋梗塞(AMI)/急性心不全、クローン病、II型糖尿病、食道癌、喉頭扁平上皮癌、急性および慢性骨髄白血病、肺癌、悪性リンパ腫、多発性硬化症、卵巣癌、パーキンソン病、前立腺腺癌、乾癬、関節リウマチ、腎細胞癌、皮膚有棘細胞癌、胃腺癌、甲状腺癌、精巣癌、潰瘍性大腸炎または子宮腺癌を含む、請求項22〜35のいずれか一項記載の方法。
- 疾患または障害が、癌、前癌状態、炎症性疾患、免疫疾患、自己免疫疾患もしくは障害、心血管疾患もしくは障害、神経疾患もしくは障害、感染症、または疼痛を含む、請求項22〜35のいずれか一項記載の方法。
- 癌が、急性リンパ芽球性白血病;急性骨髄性白血病;副腎皮質癌;AIDS関連癌;AIDS関連リンパ腫;肛門癌;虫垂癌;星状細胞腫;非定型奇形腫様/ラブドイド腫瘍;基底細胞癌;膀胱癌;脳幹神経膠腫;脳腫瘍(脳幹神経膠腫、中枢神経系非定型奇形腫様/ラブドイド腫瘍、中枢神経系胚芽腫、星状細胞腫、頭蓋咽頭腫、上衣芽腫、上衣腫、髄芽腫、髄上皮種、中間型松果体実質腫瘍、テント上原始神経外胚葉性腫瘍、および松果体芽腫を含む);乳癌;気管支腫瘍;バーキットリンパ腫;原発不明癌;カルチノイド腫瘍;原発不明癌腫;中枢神経系非定型奇形腫様/ラブドイド腫瘍;中枢神経系胚芽腫;子宮頸癌;小児癌;脊索腫;慢性リンパ球性白血病;慢性骨髄性白血病;慢性骨髄増殖性障害;結腸癌;結腸直腸癌;頭蓋咽頭腫;皮膚T細胞リンパ腫;内分泌膵島細胞腫瘍;子宮内膜癌;上衣芽腫;上衣腫;食道癌;鼻腔神経芽細胞腫;ユーイング肉腫;頭蓋外胚細胞腫瘍;性腺外胚細胞腫瘍;肝外胆管癌;胆嚢癌;胃癌;消化管カルチノイド腫瘍;消化管間質細胞腫瘍;消化管間質腫瘍(GIST);妊娠性絨毛性腫瘍;神経膠腫;毛様細胞性白血病;頭頸部癌;心臓癌;ホジキンリンパ腫;下咽頭癌;眼内黒色腫;膵島腫瘍;カポジ肉腫;腎臓癌;ランゲルハンス細胞組織球症;喉頭癌;口唇癌;肝臓癌;肺癌;悪性線維性組織球腫;骨癌;髄芽腫;髄上皮種;黒色腫;メルケル細胞癌;メルケル細胞皮膚癌;中皮腫;原発不明転移性扁平上皮性頸部癌;口腔癌;多発性内分泌腫瘍症候群;多発性骨髄腫;多発性骨髄腫/形質細胞腫瘍;菌状息肉腫;骨髄異形成症候群;骨髄増殖性腫瘍;鼻腔癌;鼻咽頭癌;神経芽細胞腫;非ホジキンリンパ腫;非黒色腫皮膚癌;非小細胞肺癌;口腔癌;口腔癌;口腔咽頭癌;骨肉腫;その他の脳および脊髄の腫瘍;卵巣癌;卵巣上皮癌;卵巣胚細胞腫瘍;卵巣低悪性度腫瘍;膵臓癌;乳頭腫症;副鼻腔癌;副甲状腺癌;骨盤癌;陰茎癌;咽頭癌;中間型松果体実質腫瘍;松果体芽腫;下垂体腫瘍;形質細胞腫瘍/多発性骨髄腫;胸膜肺芽腫;原発性中枢神経系(CNS)リンパ腫;原発性肝細胞肝癌;前立腺癌;直腸癌;腎臓癌;腎細胞(腎臓)癌;腎細胞癌;気道癌;網膜芽細胞腫;横紋筋肉腫;唾液腺癌;セザリー症候群;小細胞肺癌;小腸癌;軟部組織肉腫;扁平上皮癌;扁平上皮性頸部癌;胃癌;テント上原始神経外胚葉性腫瘍;T細胞リンパ腫;精巣癌;咽喉癌;胸腺癌;胸腺腫;甲状腺癌;移行上皮癌;腎盂尿管移行上皮癌;絨毛性腫瘍;尿管癌;尿道癌;子宮癌;子宮肉腫;膣癌;外陰癌;ワルデンシュトレームマクログロブリン血症;またはウィルムス腫瘍を含む、請求項37記載の方法。
- 前癌状態がバレット食道を含む、請求項37記載の方法。
- 自己免疫疾患が、炎症性腸疾患(IBD)、クローン病(CD)、潰瘍性大腸炎(UC)、骨盤炎症、血管炎、乾癬、糖尿病、自己免疫性肝炎、多発性硬化症、重症筋無力症、I型糖尿病、関節リウマチ、乾癬、全身性エリテマトーデス(SLE)、橋本甲状腺炎、グレーブス病、強直性脊椎炎、シェーグレン病、CREST症候群、強皮症、リウマチ性疾患、臓器拒絶反応、原発性硬化性胆管炎、または敗血症を含む、請求項37記載の方法。
- 心血管疾患が、アテローム性動脈硬化症、うっ血性心不全、不安定プラーク、脳卒中、虚血、高血圧症、狭窄症、血管閉塞、または血栓性イベントを含む、請求項37記載の方法。
- 神経疾患が、多発性硬化症(MS)、パーキンソン病(PD)、アルツハイマー病(AD)、統合失調症、双極性障害、うつ病、自閉症、プリオン病、ピック病、認知症、ハンチントン病(HD)、ダウン症候群、脳血管疾患、ラズムッセン脳炎、ウイルス性髄膜炎、神経精神全身性エリテマトーデス(NPSLE)、筋萎縮性側索硬化症、クロイツフェルト-ヤコブ病、ゲルストマン・ストロイスラー・シャインカー病、伝達性海綿状脳症、虚血再灌流傷害(例えば脳卒中)、脳損傷、微生物感染、または慢性疲労症候群を含む、請求項37記載の方法。
- 疼痛が、線維筋痛症、慢性神経因性疼痛、または末梢性神経因性疼痛を含む、請求項37記載の方法。
- 感染症が、細菌感染、ウイルス感染、酵母菌感染、ウィップル病、プリオン病、肝硬変、メチシリン耐性黄色ブドウ球菌、HIV、HCV、肝炎、梅毒、髄膜炎、マラリア、結核、インフルエンザを含む、請求項37記載の方法。
- 疾患または障害が乳癌を含み、オリゴヌクレオチドまたは複数のオリゴヌクレオチドが、SEQ ID NO: 510559〜510598のうち少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30または少なくとも40個を含む、請求項22〜35のいずれか一項記載の方法。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドのうちの少なくとも一つが、DNA、RNA、非天然のヌクレオチド、欠失、挿入、付加、および化学的修飾からなる群より選択される少なくとも一つの機能的修飾を含む、請求項45〜85のいずれか一項記載の方法。
- 請求項13〜19または22〜86のいずれか一項記載の方法を実施するための試薬を含むキット。
- 請求項13〜19または22〜86のいずれか一項記載の方法を実施するための試薬の使用。
- 試薬がオリゴヌクレオチドまたは複数のオリゴヌクレオチドを含む、請求項87記載のキットまたは請求項88記載の使用。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドが請求項1〜12のいずれか一項記載のものである、請求項89記載のキットまたは使用。
- 試薬が、
(a)微小胞を単離するように構成された試薬であって、任意で、微小胞を単離するように構成された少なくとも一つの該試薬が、微小胞抗原への結合物質、カラム、基体、ろ過ユニット、ポリマー、ポリエチレングリコール、PEG4000、PEG8000、粒子またはビーズを含む、該試薬;
(b)オリゴヌクレオチドまたは複数のオリゴヌクレオチドを増幅、配列決定、ハイブリダイズまたは検出するためにプライマーまたはプローブとして働くように構成された少なくとも一つのオリゴヌクレオチド;ならびに
(c)試料から1種または複数種の豊富なタンパク質を除去するように構成された試薬であって、任意で、1種または複数種の豊富なタンパク質が、アルブミン、免疫グロブリン、フィブリノーゲンおよびフィブリンのうち少なくとも1種を含む、該試薬
のうちの少なくとも一つをさらに含む、請求項89または90記載のキットまたは使用。 - (a)表8に記載される、SEQ ID NO: 8〜21もしくはそれらの可変配列;
(b)表11に記載される、SEQ ID NO: 24〜43もしくはそれらの可変配列;
(c)SEQ ID NO: 44〜10527;
(d)表12に記載される、SEQ ID NO: 10528〜10557もしくはそれらの可変配列;または
(e)任意の上記配列の機能的断片
のいずれかと、少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99、または100パーセント相同である核酸配列を含むアプタマー。 - 少なくとも一つの化学修飾を含むようにさらに改変されている、請求項92記載のアプタマー。
- 前記修飾が、核酸の、糖位置での化学的置換;リン酸位置での化学的置換;および塩基位置での化学的置換からなる群より選択される、請求項93記載のアプタマー。
- 前記修飾が、ビオチン化、蛍光標識の取り込み、修飾ヌクレオチドの取り込み、3'キャッピング、アミンリンカーへの結合、非免疫原性の高分子量化合物への結合、親油性化合物への結合、薬物への結合、細胞傷害性部分への結合、および放射性同位体を用いた標識からなる群より選択される、請求項93記載のアプタマー。
- ビオチン化、蛍光標識、または細胞傷害性部分が、前記アプタマーの5'末端に結合している、請求項95記載のアプタマー。
- ビオチン化、蛍光標識、または細胞傷害性部分が、前記アプタマーの3'末端に結合している、請求項95記載のアプタマー。
- 細胞傷害性部分がナノ粒子中に封入されている、請求項95記載のアプタマー。
- ナノ粒子が、リポソーム、デンドリマー、および櫛形ポリマーからなる群より選択される、請求項98記載のアプタマー。
- 細胞傷害性部分が小分子の細胞傷害性部分を含む、請求項95記載のアプタマー。
- 小分子の細胞傷害性部分が、ビンブラスチンヒドラジド、カリチアマイシン、ビンカアルカロイド、クリプトフィシン、ツブリシン、ドラスタチン-10、ドラスタチン-15、アウリスタチンE、リゾキシン、エポチロンB、エポチロンD、タキソイド、メイタンシノイド、ならびにそれらの任意のバリアントおよび誘導体からなる群より選択される、請求項100記載のアプタマー。
- 放射性同位体が、イットリウム-90、インジウム-111、ヨウ素-131、ルテチウム-177、銅-67、レニウム-186、レニウム-188、ビスマス-212、ビスマス-213、アスタチン-211、およびアクチニウム-225からなる群より選択される、請求項95記載のアプタマー。
- 細胞傷害性部分がタンパク毒素である、請求項95記載のアプタマー。
- タンパク毒素が、ジフテリア毒素、リシン、アブリン、ゲロニン、およびシュードモナス外毒素Aからなる群より選択される、請求項103記載のアプタマー。
- 非免疫原性の高分子量化合物がポリアルキレングリコールである、請求項95記載のアプタマー。
- ポリアルキレングリコールがポリエチレングリコールである、請求項105記載のアプタマー。
- γ線放出放射性同位体によって標識されている、請求項92記載のアプタマー。
- 活性物質が前記アプタマーに結合している、請求項92記載のアプタマー。
- 活性物質が治療物質または診断物質を含む、請求項108記載のアプタマー。
- 治療物質または診断物質が、チロシンキナーゼ阻害剤、キナーゼ阻害剤、生物学的活性物質、生物学的分子、放射性核種、アドリアマイシン、アンサマイシン系抗生物質、アスパラギナーゼ、ブレオマイシン、ブスルファン、シスプラチン、カルボプラチン、カルムスチン、カペシタビン、クロラムブチル、シタラビン、シクロホスファミド、カンプトセシン、ダカルバジン、ダクチノマイシン、ダウノルビシン、デクスラゾキサン、ドセタキセル、ドキソルビシン、エトポシド、エポチロン、フロクスウリジン、フルダラビン、フルオロウラシル、ゲムシタビン、ヒドロキシ尿素、イダルビシン、イホスファミド、イリノテカン、ロムスチン、メクロレタミン、メルカプトプリン、メルファラン、メトトレキサート、ラパマイシン(シロリムス)、マイトマイシン、ミトタン、ミトキサントロン、ニトロソ尿素、パクリタクセル、パミドロナート、ペントスタチン、プリカマイシン、プロカルバジン、リツキシマブ、ストレプトゾシン、テニポシド、チオグアニン、チオテパ、タキサン、ビンブラスチン、ビンクリスチン、ビノレルビン、タキソール、コンブレタスタチン、ディスコデルモリド、トランスプラチナ(transplatinum)、抗血管内皮成長因子化合物(「抗VEGF」)、抗上皮細胞成長因子受容体化合物(「抗EGFR」)、5-フルオロウラシルおよび誘導体、放射性核種、ポリペプチド毒素、アポトーシス誘導物質、治療増感物質、酵素またはその活性断片、ならびにこれらの組み合わせからなる群より選択される治療物質である、請求項108〜109のいずれか一項記載のアプタマー。
- 治療的有効量の請求項92〜110のいずれか一項記載のアプタマーまたはその塩、および薬学的に許容される担体または希釈剤を含む、薬学的組成物。
- それを必要とする対象に請求項111記載の組成物を投与する工程を含む、疾患または障害を治療するかまたは寛解させる方法。
- 対象に治療的有効量の前記組成物を投与する工程が以下をもたらす、請求項112記載の方法:
(a)活性物質単独の送達と比較した、疾患部位への活性物質の送達の増大;または(b)微小胞クリアランスの増大による、アプタマーの標的となる微小胞の血中濃度の少なくとも10%、20%、30%、40%、50%、60%、70%、80%、もしくは90%の低下;または(c)該アプタマーの標的となる微小胞の生物学的活性の、少なくとも10%、20%、30%、40%、50%、60%、70%、80%、もしくは90%の低下。 - 微小胞の生物学的活性が、免疫抑制または遺伝情報の伝達を含む、請求項113記載の方法。
- 疾患または障害が、新生物性の、増殖性の、または炎症性の疾患または障害を含む、請求項112〜114のいずれか一項記載の方法。
- 治療的有効量の請求項103記載のアプタマーまたはその塩、および薬学的に許容される担体または希釈剤を含む、薬学的組成物。
- 請求項92〜110のいずれか一項記載のアプタマーまたはその薬学的組成物を含む、キット。
- 請求項92〜110のいずれか一項記載のアプタマーを生物学的試料と接触させる工程および該生物学的試料中の微小胞に対する該アプタマーの結合の有無を検出する工程を含む、方法。
- 生物学的試料が血液または血液成分を含む、請求項118記載の方法。
- アプタマーが、生物学的試料と接触させる工程の前に基体に結合している、請求項118記載の方法。
- 基体がビーズを含む、請求項120記載の方法。
- アプタマーが、検出可能な標識に結合している、請求項118記載の方法。
- 微小胞集団を含有することが疑われる生物学的試料中の該微小胞集団の存在またはレベルを検出する方法であって、該生物学的試料を、該微小胞集団に特異的な1種または複数種の結合物質および請求項92〜110のいずれか一項記載の1種または複数種のアプタマーと接触させる工程、ならびに、該1種または複数種の結合物質および該1種または複数種のアプタマーの両方によって認識された微小胞を検出し、それによって、該生物学的試料中の該微小胞集団の存在またはレベルを検出する工程を含む、方法。
- 1種または複数種の結合物質が、表3および表4から選択される微小胞表面抗原ならびにそれらの組み合わせに対する抗体またはアプタマーを含む、請求項123記載の方法。
- 1種または複数種の結合物質が、生物学的試料と接触させる工程の前に基体に結合している、請求項123記載の方法。
- 1種または複数種の結合物質が、検出可能な標識に結合している、請求項123記載の方法。
- 1種または複数種のアプタマーが、生物学的試料と接触させる工程の前に基体に結合している、請求項123記載の方法。
- 1種または複数種のアプタマーが、検出可能な標識に結合している、請求項123記載の方法。
- 1種または複数種のアプタマーが、生物学的試料と接触させる工程の前に基体に結合している、請求項126記載の方法。
- 1種または複数種のアプタマーが、検出可能な標識に結合している、請求項125記載の方法。
- 生物学的試料中の微小胞集団の存在またはレベルを検出する工程が、疾患の診断、予後判定、またはセラノーシス(theranosis)を提供する、請求項123〜130のいずれか一項記載の方法。
- 疾患が癌を含む、請求項131記載の方法。
- 癌が乳癌を含む、請求項132記載の方法。
- (a)生物学的試験試料を、請求項92〜110のいずれか一項記載の1種または複数種のアプタマーと接触させる工程;
(b)工程(a)で形成された、該生物学的試験試料における1種または複数種のアプタマーと該1種または複数種のアプタマーに結合された標的との間の複合体の存在またはレベルを検出する工程;
(c)生物学的対照試料を、1種または複数種のアプタマーと接触させる工程;
(d)工程(c)で形成された、該生物学的対照試料における1種または複数種のアプタマーと該1種または複数種のアプタマーに結合された標的との間の複合体の存在またはレベルを検出する工程;ならびに
(e)工程(b)および(d)で検出された存在またはレベルを比較し、それによって、疾患または障害を特徴決定する工程
を含む、疾患または障害を特徴決定する方法。 - 生物学的試験試料および生物学的対照試料がそれぞれ、組織試料、細胞培養物、または生物学的流体を含む、請求項134記載の方法。
- 生物学的流体が体液を含む、請求項135記載の方法。
- 体液が、末梢血、血清、血漿、腹水、尿、脳脊髄液(CSF)、痰、唾液、骨髄、滑液、眼房水、羊水、耳垢、母乳、気管支肺胞洗浄液、精液、前立腺液、カウパー腺液もしくは尿道球腺液、女性射精液、汗、糞便、体毛、涙液、嚢胞液、胸膜液および腹膜液、心膜液、リンパ液、糜粥、乳糜、胆汁、間質液、月経分泌物、膿、皮脂、嘔吐物、膣分泌液、粘膜分泌液、水便、膵液、鼻腔からの洗浄液、気管支肺吸引液、胚盤胞腔液、または臍帯血を含む、請求項136記載の方法。
- 体液が、血液、血清、または血漿を含む、請求項136記載の方法。
- 生物学的流体が微小胞を含む、請求項135記載の方法。
- 1種または複数種のアプタマーがポリペプチドまたはその断片に結合する、請求項134記載の方法。
- ポリペプチドまたはその断片が可溶性であるか膜結合性である、請求項134記載の方法。
- ポリペプチドまたはその断片が表3または表4のバイオマーカーを含む、請求項134記載の方法。
- 1種または複数種のアプタマーが、生物学的試料中の微小胞表面抗原に結合する、請求項134または139記載の方法。
- 特徴決定する工程が、疾患または障害の診断、予後判定、またはセラノーシスを含む、請求項134〜143のいずれか一項記載の方法。
- 疾患または障害が癌を含む、請求項144記載の方法。
- 癌が乳癌を含む、請求項145記載の方法。
- 請求項118〜146のいずれか一項記載の方法を実施するための試薬を含むキット。
- 請求項118〜146のいずれか一項記載の方法を実施するための試薬の使用。
- 試薬が請求項92〜110のいずれか一項記載のアプタマーを含む、請求項147記載のキットまたは請求項148記載の使用。
- 試薬が、
(a)微小胞を単離するように構成された試薬であって、任意で、微小胞を単離するように構成された少なくとも一つの該試薬が、微小胞抗原への結合物質、カラム、基体、ろ過ユニット、ポリマー、ポリエチレングリコール、PEG4000、PEG8000、粒子またはビーズを含む、該試薬;
(b)オリゴヌクレオチドまたは複数のオリゴヌクレオチドを増幅、配列決定、ハイブリダイズまたは検出するためにプライマーまたはプローブとして働くように構成された少なくとも一つのオリゴヌクレオチド;ならびに
(c)試料から1種または複数種の豊富なタンパク質を除去するように構成された試薬であって、任意で、1種または複数種の豊富なタンパク質が、アルブミン、免疫グロブリン、フィブリノーゲンおよびフィブリンのうち少なくとも1種を含む、該試薬
のうちの少なくとも一つをさらに含む、請求項149記載のキットまたは使用。 - 細胞のまたは細胞外の小胞試料を評価するための投入オリゴヌクレオチドライブラリーを含む組成物であって、投入オリゴヌクレオチドライブラリーを生成するための少なくとも二つのサブセットオリゴヌクレオチドライブラリーを含み、少なくとも二つのサブセットオリゴヌクレオチドライブラリーの少なくとも一つが、50%に等しくない全G+C含量(total G and C content)を有するヌクレオチドの量で製造される、組成物。
- 全G+C含量が50%未満である、請求項151記載の組成物。
- 全G+C含量が50%超である、請求項151記載の組成物。
- 少なくとも一つのサブセットライブラリーが、50%超の全G+C含量で製造され、もう一つのサブセットライブラリーが、50%未満の全G+C含量で製造される、請求項151記載の組成物。
- 少なくとも二つのサブセットライブラリーが、それぞれ25%、50%および75%のG+C含量で製造された三つのサブセットライブラリーを含む、請求項151記載の組成物。
- 少なくとも二つのサブセットライブラリーが、表13中の少なくとも二つの行に類似する、または等しい量のヌクレオチドで製造される、請求項151記載の組成物。
- ヌクレオチドが、天然のヌクレオチドからなる、請求項151記載の組成物。
- ヌクレオチドが、修飾された天然のヌクレオチドを含む、請求項151記載の組成物。
- ヌクレオチドが、非天然のヌクレオチドを含む、請求項151記載の組成物。
- 投入ライブラリーを生成するために少なくとも二つのサブセットライブラリーを接触させる工程を含む、請求項151〜159のいずれか一項記載の投入ライブラリーを生成する方法。
- 5'トランスポゾンアダプター領域と、トランスポゾンアダプター領域に対して5'に位置する0またはより多くのヌクレオチドを含むオフセット領域と、オフセット領域に対して5'に位置する可変領域と、可変領域に対して5'に位置する左プライマー領域とを含む配列を有するオリゴヌクレオチド。
- 少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、200000、300000、400000、500000、106、107、108、109、1010、1011、1012、1013、1014、1015、1016、1017または少なくとも1018個の異なるオリゴヌクレオチド配列を含み、各オリゴヌクレオチド配列が、5'トランスポゾンアダプター領域と、トランスポゾンアダプター領域に対して5'に位置する0またはより多くのヌクレオチドを含むオフセット領域と、オフセット領域に対して5'に位置する可変領域と、可変領域に対して5'に位置する左プライマー領域とを含む、複数のオリゴヌクレオチド。
- (a)トランスポゾンアダプター領域が20〜40ヌクレオチドを含み;
(b)オフセット領域が0、1、2、3、4、5、6、7、8、9または10ヌクレオチドを含み;
(c)可変領域が20〜50ヌクレオチドを含み;かつ/または
(d)左プライマー領域が20〜40ヌクレオチドを含む
、請求項161〜162のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチド。 - (a)トランスポゾンアダプター領域が、配列
に対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列を含み;
(b)オフセット領域が、以下の配列:5'-T(SEQ ID NO: 510765)、5'-CT(SEQ ID NO: 510766)および5'-ACT(SEQ ID NO: 510767)の少なくとも一つに対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である1、2、3、4、5、6、7、8、9または10ヌクレオチドを含み;
(c)可変領域が15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49または50ヌクレオチドを含み;
(d)可変領域が請求項151〜159のいずれか一項記載の投入オリゴヌクレオチドライブラリーを含み;かつ/または
(e)左プライマー領域が、SEQ ID NO: 510768および510769から選択される配列に対して少なくとも約50、55、60、65、70、75、80、85、90、95、96、97、98、99または100%相同である核酸配列を含む
、請求項161〜163のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチド。 - 請求項161〜164のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドを使用してSELEX選択プロセスを実施する工程を含む、アプタマーを同定する方法。
- 選択プロセスが、関心対象の標的に対する少なくとも1ラウンドのポジティブ選択および任意で関心対象の標的以外の標的に対する少なくとも1ラウンドのネガティブ選択を含む、請求項165記載の方法。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドを試料と接触させる工程、および試料中の標的へのオリゴヌクレオチドまたは複数のオリゴヌクレオチドの結合の存在またはレベルを検出する工程を含み、任意で、オリゴヌクレオチドまたは複数のオリゴヌクレオチドが請求項161〜164のいずれか一項記載のものである、方法。
- 試料が、生物学的試料、有機試料、無機試料、組織、細胞培養物、体液、血液、血清、細胞、微小胞、タンパク質複合体、脂質複合体、糖質またはそれらの任意の組み合わせ、部分もしくは変種を含む、請求項167記載の方法。
- 標的が、細胞、オルガネラ、タンパク質複合体、リポタンパク質、糖質、微小胞、膜断片、小分子、重金属、毒素または薬物を含む、請求項167記載の方法。
- (a)微小胞を含む生物学的試料をオリゴヌクレオチドプローブライブラリーと接触させる工程であって、オリゴヌクレオチドプローブライブラリーが請求項161〜164のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドを含む、工程;
(b)微小胞の少なくとも一部分に結合したオリゴヌクレオチドを同定する工程;および
(c)同定されたオリゴヌクレオチドのプロファイルに基づいて試料を特徴決定する工程
を含む、方法。 - (a)溶解状態の混合物を形成するために、試料を、少なくとも106、107、108、109、1010、1011、1012、1013、1014、1015、1016、1017または少なくとも1018個の異なるオリゴヌクレオチド配列のオリゴヌクレオチドを含むオリゴヌクレオチドプローブライブラリーと接触させる工程であって、オリゴヌクレオチドが、試料中の複数の実体に結合して複合体を形成することができ、オリゴヌクレオチドプローブライブラリーが請求項161〜164のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドを含む、工程;
(b)工程(a)で形成された複合体を混合物から分割する工程;および
(c)試料に関するオリゴヌクレオチドプロファイルを同定するために、工程(b)で分割された複合体中に存在するオリゴヌクレオチドを検出する工程
を含む、方法。 - 検出する工程が、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの配列決定、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの増幅、および/または複合体中のすべてもしくはいくつかのオリゴヌクレオチドの、アレイへのハイブリダイゼーションを実施する工程を含む、請求項171記載の方法。
- (a)生物学的試験試料を請求項161〜164のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドと接触させる工程;
(b)工程(a)で請求項161〜164のいずれか一項記載のオリゴヌクレオチドまたは複数のオリゴヌクレオチドと生物学的試験試料中の標的との間に形成された複合体の存在またはレベルを検出する工程;および
(c)工程(b)で検出された存在またはレベルを、生物学的対照試料からの参照レベルと比較し、それによって疾患または障害を特徴決定する工程
を含む、疾患または障害を特徴決定する方法。 - 検出する工程が、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの配列決定、複合体中のすべてもしくはいくつかのオリゴヌクレオチドの増幅、および/または複合体中のすべてもしくはいくつかのオリゴヌクレオチドの、アレイへのハイブリダイゼーションを実施する工程を含み得る、請求項173記載の方法。
- 配列決定がハイスループット配列決定を含む、請求項174記載の方法。
- 生物学的試験試料および生物学的対照試料がそれぞれ、組織試料、細胞培養物、または生物学的流体を含む、請求項173記載の方法。
- 生物学的流体が体液を含む、請求項176記載の方法。
- 体液が、末梢血、血清、血漿、腹水、尿、脳脊髄液(CSF)、痰、唾液、骨髄、滑液、眼房水、羊水、耳垢、母乳、気管支肺胞洗浄液、精液、前立腺液、カウパー腺液もしくは尿道球腺液、女性射精液、汗、糞便、体毛、涙液、嚢胞液、胸膜液および腹膜液、心膜液、リンパ液、糜粥、乳糜、胆汁、間質液、月経分泌物、膿、皮脂、嘔吐物、膣分泌液、粘膜分泌液、水便、膵液、鼻腔からの洗浄液、気管支肺吸引液、胚盤胞腔液、または臍帯血を含む、請求項177記載の方法。
- 体液が、血液、血清、または血漿を含む、請求項177記載の方法。
- 生物学的流体が微小胞を含む、請求項176記載の方法。
- 複合体が、オリゴヌクレオチドまたは複数のオリゴヌクレオチドと少なくとも一つの微小胞との間で形成される、請求項180記載の方法。
- 生物学的試験試料および生物学的対照試料が、単離された微小胞を含み、任意で、微小胞が、クロマトグラフィー、ろ過、限外ろ過、遠心分離、超遠心分離、フローサイトメトリー、アフィニティー捕捉(たとえば平面、カラムまたはビーズへの)、ポリマー沈殿の少なくとも一つを使用しかつマイクロ流体工学を使用して単離される、請求項173記載の方法。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドがポリペプチドまたはその断片に結合する、請求項173記載の方法。
- ポリペプチドまたはその断片が可溶性または膜結合状態であり、任意で、膜が微小胞膜を含む、請求項183記載の方法。
- ポリペプチドまたはその断片が表3または表4中のバイオマーカーを含む、請求項184記載の方法。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドが、生物学的試料中の微小胞表面抗原に結合する、請求項173記載の方法。
- 疾患または障害が、乳癌、アルツハイマー病、気管支喘息、膀胱移行上皮癌、巨細胞オステオブラストクラストーマ、脳腫瘍、結腸直腸腺癌、慢性閉塞性肺疾患(COPD)、子宮頸部扁平上皮癌、急性心筋梗塞(AMI)/急性心不全、クローン病、II型糖尿病、食道癌、喉頭扁平上皮癌、急性および慢性骨髄白血病、肺癌、悪性リンパ腫、多発性硬化症、卵巣癌、パーキンソン病、前立腺腺癌、乾癬、関節リウマチ、腎細胞癌、皮膚有棘細胞癌、胃腺癌、甲状腺癌、精巣癌、潰瘍性大腸炎または子宮腺癌を含む、請求項173記載の方法。
- 疾患または障害が、癌、前癌状態、炎症性疾患、免疫疾患、自己免疫疾患もしくは障害、心血管疾患もしくは障害、神経疾患もしくは障害、感染症、または疼痛を含む、請求項173記載の方法。
- 癌が、急性リンパ芽球性白血病;急性骨髄性白血病;副腎皮質癌;AIDS関連癌;AIDS関連リンパ腫;肛門癌;虫垂癌;星状細胞腫;非定型奇形腫様/ラブドイド腫瘍;基底細胞癌;膀胱癌;脳幹神経膠腫;脳腫瘍(脳幹神経膠腫、中枢神経系非定型奇形腫様/ラブドイド腫瘍、中枢神経系胚芽腫、星状細胞腫、頭蓋咽頭腫、上衣芽腫、上衣腫、髄芽腫、髄上皮種、中間型松果体実質腫瘍、テント上原始神経外胚葉性腫瘍、および松果体芽腫を含む);乳癌;気管支腫瘍;バーキットリンパ腫;原発不明癌;カルチノイド腫瘍;原発不明癌腫;中枢神経系非定型奇形腫様/ラブドイド腫瘍;中枢神経系胚芽腫;子宮頸癌;小児癌;脊索腫;慢性リンパ球性白血病;慢性骨髄性白血病;慢性骨髄増殖性障害;結腸癌;結腸直腸癌;頭蓋咽頭腫;皮膚T細胞リンパ腫;内分泌膵島細胞腫瘍;子宮内膜癌;上衣芽腫;上衣腫;食道癌;鼻腔神経芽細胞腫;ユーイング肉腫;頭蓋外胚細胞腫瘍;性腺外胚細胞腫瘍;肝外胆管癌;胆嚢癌;胃癌;消化管カルチノイド腫瘍;消化管間質細胞腫瘍;消化管間質腫瘍(GIST);妊娠性絨毛性腫瘍;神経膠腫;毛様細胞性白血病;頭頸部癌;心臓癌;ホジキンリンパ腫;下咽頭癌;眼内黒色腫;膵島腫瘍;カポジ肉腫;腎臓癌;ランゲルハンス細胞組織球症;喉頭癌;口唇癌;肝臓癌;肺癌;悪性線維性組織球腫;骨癌;髄芽腫;髄上皮種;黒色腫;メルケル細胞癌;メルケル細胞皮膚癌;中皮腫;原発不明転移性扁平上皮性頸部癌;口腔癌;多発性内分泌腫瘍症候群;多発性骨髄腫;多発性骨髄腫/形質細胞腫瘍;菌状息肉腫;骨髄異形成症候群;骨髄増殖性腫瘍;鼻腔癌;鼻咽頭癌;神経芽細胞腫;非ホジキンリンパ腫;非黒色腫皮膚癌;非小細胞肺癌;口腔癌;口腔癌;口腔咽頭癌;骨肉腫;その他の脳および脊髄の腫瘍;卵巣癌;卵巣上皮癌;卵巣胚細胞腫瘍;卵巣低悪性度腫瘍;膵臓癌;乳頭腫症;副鼻腔癌;副甲状腺癌;骨盤癌;陰茎癌;咽頭癌;中間型松果体実質腫瘍;松果体芽腫;下垂体腫瘍;形質細胞腫瘍/多発性骨髄腫;胸膜肺芽腫;原発性中枢神経系(CNS)リンパ腫;原発性肝細胞肝癌;前立腺癌;直腸癌;腎臓癌;腎細胞(腎臓)癌;腎細胞癌;気道癌;網膜芽細胞腫;横紋筋肉腫;唾液腺癌;セザリー症候群;小細胞肺癌;小腸癌;軟部組織肉腫;扁平上皮癌;扁平上皮性頸部癌;胃癌;テント上原始神経外胚葉性腫瘍;T細胞リンパ腫;精巣癌;咽喉癌;胸腺癌;胸腺腫;甲状腺癌;移行上皮癌;腎盂尿管移行上皮癌;絨毛性腫瘍;尿管癌;尿道癌;子宮癌;子宮肉腫;膣癌;外陰癌;ワルデンシュトレームマクログロブリン血症;またはウィルムス腫瘍を含む、請求項188記載の方法。
- 前癌状態がバレット食道を含む、請求項188記載の方法。
- 自己免疫疾患が、炎症性腸疾患(IBD)、クローン病(CD)、潰瘍性大腸炎(UC)、骨盤炎症、血管炎、乾癬、糖尿病、自己免疫性肝炎、多発性硬化症、重症筋無力症、I型糖尿病、関節リウマチ、乾癬、全身性エリテマトーデス(SLE)、橋本甲状腺炎、グレーブス病、強直性脊椎炎、シェーグレン病、CREST症候群、強皮症、リウマチ性疾患、臓器拒絶反応、原発性硬化性胆管炎、または敗血症を含む、請求項188記載の方法。
- 心血管疾患が、アテローム性動脈硬化症、うっ血性心不全、不安定プラーク、脳卒中、虚血、高血圧症、狭窄症、血管閉塞、または血栓性イベントを含む、請求項188記載の方法。
- 神経疾患が、多発性硬化症(MS)、パーキンソン病(PD)、アルツハイマー病(AD)、統合失調症、双極性障害、うつ病、自閉症、プリオン病、ピック病、認知症、ハンチントン病(HD)、ダウン症候群、脳血管疾患、ラズムッセン脳炎、ウイルス性髄膜炎、神経精神全身性エリテマトーデス(NPSLE)、筋萎縮性側索硬化症、クロイツフェルト-ヤコブ病、ゲルストマン・ストロイスラー・シャインカー病、伝達性海綿状脳症、虚血再灌流傷害(例えば脳卒中)、脳損傷、微生物感染、または慢性疲労症候群を含む、請求項188記載の方法。
- 疼痛が、線維筋痛症、慢性神経因性疼痛、または末梢性神経因性疼痛を含む、請求項188記載の方法。
- 感染症が、細菌感染、ウイルス感染、酵母菌感染、ウィップル病、プリオン病、肝硬変、メチシリン耐性黄色ブドウ球菌、HIV、HCV、肝炎、梅毒、髄膜炎、マラリア、結核、インフルエンザを含む、請求項188記載の方法。
- 請求項165〜195のいずれか一項記載の方法を実施するための試薬を含むキット。
- 請求項165〜195のいずれか一項記載の方法を実施するための試薬の使用。
- 試薬がオリゴヌクレオチドまたは複数のオリゴヌクレオチドを含む、請求項196記載のキットまたは請求項197記載の使用。
- オリゴヌクレオチドまたは複数のオリゴヌクレオチドが、請求項151〜159または161〜164のいずれか一項記載のオリゴヌクレオチドまたはライブラリーに由来するオリゴヌクレオチドの少なくとも一つを含む、請求項198記載のキットまたは使用。
Applications Claiming Priority (21)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361871107P | 2013-08-28 | 2013-08-28 | |
| US61/871,107 | 2013-08-28 | ||
| US201361874621P | 2013-09-06 | 2013-09-06 | |
| US61/874,621 | 2013-09-06 | ||
| US201361900975P | 2013-11-06 | 2013-11-06 | |
| US61/900,975 | 2013-11-06 | ||
| US201361912471P | 2013-12-05 | 2013-12-05 | |
| US61/912,471 | 2013-12-05 | ||
| US201461924192P | 2014-01-06 | 2014-01-06 | |
| US61/924,192 | 2014-01-06 | ||
| US201461949216P | 2014-03-06 | 2014-03-06 | |
| US61/949,216 | 2014-03-06 | ||
| US201461974949P | 2014-04-03 | 2014-04-03 | |
| US61/974,949 | 2014-04-03 | ||
| US201461990085P | 2014-05-07 | 2014-05-07 | |
| US61/990,085 | 2014-05-07 | ||
| US201461994704P | 2014-05-16 | 2014-05-16 | |
| US61/994,704 | 2014-05-16 | ||
| US201462024436P | 2014-07-14 | 2014-07-14 | |
| US62/024,436 | 2014-07-14 | ||
| PCT/US2014/053306 WO2015031694A2 (en) | 2013-08-28 | 2014-08-28 | Oligonucleotide probes and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016533752A true JP2016533752A (ja) | 2016-11-04 |
| JP2016533752A5 JP2016533752A5 (ja) | 2017-10-05 |
Family
ID=52587490
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016537869A Pending JP2016533752A (ja) | 2013-08-28 | 2014-08-28 | オリゴヌクレオチドプローブおよびその使用 |
Country Status (10)
| Country | Link |
|---|---|
| US (2) | US20160319361A1 (ja) |
| EP (1) | EP3039174B1 (ja) |
| JP (1) | JP2016533752A (ja) |
| KR (1) | KR20160080815A (ja) |
| CN (1) | CN105980615A (ja) |
| AU (2) | AU2014312211A1 (ja) |
| BR (1) | BR112016004153A2 (ja) |
| CA (1) | CA2922689A1 (ja) |
| IL (2) | IL244236A0 (ja) |
| WO (1) | WO2015031694A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108866215A (zh) * | 2017-12-01 | 2018-11-23 | 苏州百源基因技术有限公司 | 一种用于产气肠杆菌检测的实时荧光定量pcr试剂盒 |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006116362A2 (en) | 2005-04-25 | 2006-11-02 | The Trustees Of Boston University | Structured substrates for optical surface profiling |
| US10942184B2 (en) | 2012-10-23 | 2021-03-09 | Caris Science, Inc. | Aptamers and uses thereof |
| ES2912033T3 (es) | 2012-10-23 | 2022-05-24 | Caris Science Inc | Aptámeros y usos de los mismos |
| EP2935628B1 (en) | 2012-12-19 | 2018-03-21 | Caris Life Sciences Switzerland Holdings GmbH | Compositions and methods for aptamer screening |
| HUE051159T2 (hu) * | 2013-12-20 | 2021-03-01 | Univ Lausanne | Hosszú, nem kódoló RNS-ek diagnosztikai, prognosztikai és terápiás alkalmazásai szívbetegségekre és regeneráló gyógyszerhez |
| CN106716134A (zh) * | 2014-09-17 | 2017-05-24 | 沃拉克有限公司 | 确定早产风险的方法 |
| CA2979361A1 (en) | 2015-03-09 | 2016-09-15 | Caris Science, Inc. | Method of preparing oligonucleotide libraries |
| KR20180010245A (ko) | 2015-05-21 | 2018-01-30 | 인디애나 유니버시티 리서치 앤드 테크놀로지 코퍼레이션 | 저산소증 신호전달 유전자를 저해하기 위한 ape1/ref-1을 표적화하는 방법 |
| WO2017004243A1 (en) | 2015-06-29 | 2017-01-05 | Caris Science, Inc. | Therapeutic oligonucleotides |
| WO2017019918A1 (en) | 2015-07-28 | 2017-02-02 | Caris Science, Inc. | Targeted oligonucleotides |
| EP3353528B1 (en) | 2015-09-22 | 2023-11-29 | Trustees of Boston University | Multiplexed phenotyping of nanovesicles |
| WO2017112921A1 (en) * | 2015-12-24 | 2017-06-29 | The Arizona Board Of Regents On Behalf Of The University Of Arizona | Systems and methods for characterizing sepsis |
| CN108885210B (zh) | 2016-02-05 | 2022-07-19 | 纳诺韦尔生物科学有限公司 | 具有表面标记物的外来体的检测 |
| EP4339288A2 (en) * | 2016-03-18 | 2024-03-20 | Caris Science, Inc. | Oligonucleotide probes and uses thereof |
| MX2018013341A (es) | 2016-05-02 | 2019-09-18 | Encodia Inc | Analisis de macromoleculas que emplea la codificacion de acido nucleico. |
| AU2017271579B2 (en) * | 2016-05-25 | 2023-10-19 | Caris Science, Inc. | Oligonucleotide probes and uses thereof |
| MA45496A (fr) * | 2016-06-17 | 2019-04-24 | Hoffmann La Roche | Molécules d'acide nucléique pour la réduction de l'arnm de padd5 ou pad7 pour le traitement d'une infection par l'hépatite b |
| WO2018081193A1 (en) * | 2016-10-25 | 2018-05-03 | Purdue Research Foundation | Conjugates for sensing |
| JP2019537443A (ja) * | 2016-11-02 | 2019-12-26 | バイオイズ カンパニー リミテッド | 次世代配列決定法を用いた標的タンパク質の集団的定量方法とその用途 |
| CN110913910A (zh) * | 2017-05-08 | 2020-03-24 | 奥曼尼提纳米有限公司 | 快速进化的生物实体的治疗 |
| US11408887B2 (en) | 2017-05-22 | 2022-08-09 | The National Institute for Biotechnology in the Negev Ltd. | Biomarkers for diagnosis of lung cancer |
| CN109251980A (zh) * | 2017-07-14 | 2019-01-22 | 中国人民解放军第八医院 | 膀胱癌组织t细胞图谱模型及其构建方法和构建系统 |
| JP2019020206A (ja) * | 2017-07-14 | 2019-02-07 | 株式会社島津製作所 | 質量分析を用いた認知機能障害疾患バイオマーカーの定量方法及び質量分析装置 |
| JP7298929B2 (ja) * | 2017-09-27 | 2023-06-27 | ロゼッタ エクソソーム | サイズ排除クロマトグラフィーを利用した細胞外小胞体の分析方法及びその用途 |
| BR122020018622A2 (pt) | 2017-10-16 | 2021-02-09 | F. Hoffmann-La Roche Ag | Molécula de ácido nucleico para redução de papd5 e papd7 de mrna para o tratamento de infecção hepatite b |
| WO2019089836A1 (en) | 2017-10-31 | 2019-05-09 | Encodia, Inc. | Kits for analysis using nucleic acid encoding and/or label |
| CN111684078B (zh) * | 2018-02-12 | 2024-04-19 | 豪夫迈·罗氏有限公司 | 通过评价肿瘤遗传异质性来预测对治疗的应答的方法 |
| GB201810571D0 (en) * | 2018-06-27 | 2018-08-15 | Cs Genetics Ltd | Reagents and methods for the analysis of circulating microparticles |
| EP3818159A1 (en) | 2018-07-03 | 2021-05-12 | F. Hoffmann-La Roche AG | Oligonucleotides for modulating tau expression |
| WO2020020947A1 (en) * | 2018-07-26 | 2020-01-30 | Bracco Imaging Spa | Icam-1 aptamers, diagnostic and therapeutic uses thereof |
| US11608356B1 (en) * | 2019-02-22 | 2023-03-21 | Base Pair Biotechnologies, Inc. | Functional ligands to colistin |
| CN109880903B (zh) * | 2019-03-01 | 2021-12-14 | 南京医科大学 | 一种用于非小细胞肺癌辅助诊断的snp标志物及其应用 |
| SG11202109423TA (en) * | 2019-03-01 | 2021-09-29 | Mercy Bioanalytics Inc | Systems, compositions, and methods for target entity detection |
| CN110045099B (zh) * | 2019-04-01 | 2022-03-04 | 四川大学华西医院 | 一种慢性阻塞性肺疾病检测试剂盒 |
| BR112021020411A2 (pt) * | 2019-04-11 | 2022-03-15 | Univ Arkansas | Aptâmeros de dna específicos para cd40 como adjuvantes de vacina |
| WO2020219923A1 (en) * | 2019-04-26 | 2020-10-29 | The Johns Hopkins University | Methods and materials for treating cancer |
| CA3138367A1 (en) | 2019-04-30 | 2020-11-05 | Encodia, Inc. | Methods for preparing analytes and related kits |
| CN110412281B (zh) * | 2019-06-26 | 2022-09-09 | 四川大学华西医院 | Begain自身抗体检测试剂在制备肺癌筛查试剂盒中的用途 |
| WO2021076808A1 (en) * | 2019-10-15 | 2021-04-22 | Cornell University | Methods for detecting and inhibiting brain metastasis |
| WO2021183893A1 (en) * | 2020-03-13 | 2021-09-16 | The Translational Genomics Research Institute | Methods and kits for the detection of sars-cov-2 |
| CN111621588A (zh) * | 2020-06-08 | 2020-09-04 | 华中农业大学 | 光亮果皮番茄品种选育的分子标记及其应用 |
| BR112022025763A2 (pt) | 2020-06-25 | 2023-01-10 | Procter & Gamble | Aptâmeros para aplicações de cuidados com a saúde pessoal |
| CN111830289B (zh) * | 2020-07-24 | 2023-01-03 | 长春理工大学 | 一种利用原子力显微术对生物素化抗体-IgE免疫复合物直接成像的方法 |
| WO2022032227A1 (en) * | 2020-08-07 | 2022-02-10 | The Board Of Trustees Of The University Of Arkansas | Nasal microbiome biomarkers for predicting the onset of bovine respiratory disease and treating the same |
| CN112535886B (zh) * | 2020-11-12 | 2022-07-12 | 杭州苏铂科技有限公司 | 去除金纳米棒溶液中的ctab的方法 |
| WO2023028035A1 (en) * | 2021-08-23 | 2023-03-02 | University Of Florida Research Foundation, Incorporated | Lipid enveloped recombinant aav particles for gene therapy use |
| CN117451995A (zh) * | 2021-12-06 | 2024-01-26 | 上海市精神卫生中心(上海市心理咨询培训中心) | 用于预测应激后精神心理症状发生的免疫检测试剂盒及应用 |
| WO2023143328A1 (zh) * | 2022-01-27 | 2023-08-03 | 宁波大学 | 用于预测或诊断抑郁症复发的标志物组合及其应用 |
| WO2023143327A1 (zh) * | 2022-01-27 | 2023-08-03 | 宁波大学 | 缺氧诱导因子1α作为标志物在抑郁症复发诊断中的应用 |
| WO2023225106A1 (en) * | 2022-05-18 | 2023-11-23 | Bio-Rad Laboratories, Inc. | System and method for automated digital polymerase chain reaction |
| CN117230203B (zh) * | 2023-11-14 | 2024-02-06 | 首都医科大学附属北京儿童医院 | 检测myod1基因突变的引物探针组及其试剂盒 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012507300A (ja) * | 2008-10-30 | 2012-03-29 | カリス ライフ サイエンシズ ルクセンブルク ホールディングス | Rnaパターンを評価する方法 |
| JP2013521502A (ja) * | 2010-03-01 | 2013-06-10 | カリス ライフ サイエンシズ ルクセンブルク ホールディングス | セラノーシスのためのバイオマーカー |
| JP2013526852A (ja) * | 2010-04-06 | 2013-06-27 | カリス ライフ サイエンシズ ルクセンブルク ホールディングス | 疾患に対する循環バイオマーカー |
Family Cites Families (133)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4551435A (en) | 1983-08-24 | 1985-11-05 | Immunicon, Inc. | Selective removal of immunospecifically recognizable substances from solution |
| US4666828A (en) | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4801531A (en) | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| US4795698A (en) | 1985-10-04 | 1989-01-03 | Immunicon Corporation | Magnetic-polymer particles |
| US4925788A (en) | 1986-10-24 | 1990-05-15 | Immunicon Corporation | Immunoassay system and procedure based on precipitin-like interaction between immune complex and Clq or other non-immunospecific factor |
| US5158871A (en) | 1988-02-12 | 1992-10-27 | University Of Connecticut | Method of using magnetic particles for isolating, collecting and assaying diagnostic ligates |
| US5108933A (en) | 1988-09-16 | 1992-04-28 | Immunicon Corporation | Manipulation of colloids for facilitating magnetic separations |
| US5272057A (en) | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| US5800992A (en) * | 1989-06-07 | 1998-09-01 | Fodor; Stephen P.A. | Method of detecting nucleic acids |
| US5192659A (en) | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| SE470347B (sv) | 1990-05-10 | 1994-01-31 | Pharmacia Lkb Biotech | Mikrostruktur för vätskeflödessystem och förfarande för tillverkning av ett sådant system |
| US6011020A (en) | 1990-06-11 | 2000-01-04 | Nexstar Pharmaceuticals, Inc. | Nucleic acid ligand complexes |
| US5707796A (en) | 1990-06-11 | 1998-01-13 | Nexstar Pharmaceuticals, Inc. | Method for selecting nucleic acids on the basis of structure |
| US5683867A (en) | 1990-06-11 | 1997-11-04 | Nexstar Pharmaceuticals, Inc. | Systematic evolution of ligands by exponential enrichment: blended SELEX |
| US5637459A (en) | 1990-06-11 | 1997-06-10 | Nexstar Pharmaceuticals, Inc. | Systematic evolution of ligands by exponential enrichment: chimeric selex |
| CA2084987C (en) | 1990-06-11 | 2007-02-13 | Larry Gold | Nucleic acid ligands |
| US5861254A (en) | 1997-01-31 | 1999-01-19 | Nexstar Pharmaceuticals, Inc. | Flow cell SELEX |
| US5580737A (en) | 1990-06-11 | 1996-12-03 | Nexstar Pharmaceuticals, Inc. | High-affinity nucleic acid ligands that discriminate between theophylline and caffeine |
| US5648214A (en) | 1990-06-11 | 1997-07-15 | University Research Corporation | High-affinity oligonucleotide ligands to the tachykinin substance P |
| US5567588A (en) | 1990-06-11 | 1996-10-22 | University Research Corporation | Systematic evolution of ligands by exponential enrichment: Solution SELEX |
| US5705337A (en) | 1990-06-11 | 1998-01-06 | Nexstar Pharmaceuticals, Inc. | Systematic evolution of ligands by exponential enrichment: chemi-SELEX |
| US5496938A (en) | 1990-06-11 | 1996-03-05 | Nexstar Pharmaceuticals, Inc. | Nucleic acid ligands to HIV-RT and HIV-1 rev |
| US5763177A (en) | 1990-06-11 | 1998-06-09 | Nexstar Pharmaceuticals, Inc. | Systematic evolution of ligands by exponential enrichment: photoselection of nucleic acid ligands and solution selex |
| US5270163A (en) | 1990-06-11 | 1993-12-14 | University Research Corporation | Methods for identifying nucleic acid ligands |
| US5660985A (en) | 1990-06-11 | 1997-08-26 | Nexstar Pharmaceuticals, Inc. | High affinity nucleic acid ligands containing modified nucleotides |
| US5200084A (en) | 1990-09-26 | 1993-04-06 | Immunicon Corporation | Apparatus and methods for magnetic separation |
| DE552178T1 (de) | 1990-10-12 | 1994-02-03 | Max Planck Gesellschaft | Abgeänderte ribozyme. |
| US6582908B2 (en) * | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| US5186827A (en) | 1991-03-25 | 1993-02-16 | Immunicon Corporation | Apparatus for magnetic separation featuring external magnetic means |
| US5541061A (en) | 1992-04-29 | 1996-07-30 | Affymax Technologies N.V. | Methods for screening factorial chemical libraries |
| US5817635A (en) | 1993-08-09 | 1998-10-06 | Max-Planck-Gesellschaft Zur Forderung Der Wissenschaften E.V. | Modified ribozymes |
| US5736330A (en) | 1995-10-11 | 1998-04-07 | Luminex Corporation | Method and compositions for flow cytometric determination of DNA sequences |
| US5612473A (en) | 1996-01-16 | 1997-03-18 | Gull Laboratories | Methods, kits and solutions for preparing sample material for nucleic acid amplification |
| US6051698A (en) | 1997-06-06 | 2000-04-18 | Janjic; Nebojsa | Vascular endothelial growth factor (VEGF) nucleic acid ligand complexes |
| IL129497A0 (en) | 1996-10-25 | 2000-02-29 | Nexstar Pharmaceuticals Inc | Vascular endothelial growth factor (vegf) nucleic acid ligand complexes |
| KR20010031140A (ko) | 1997-10-14 | 2001-04-16 | 루미넥스 코포레이션 | 정밀 형광염료 입자 및 그의 제조방법 그리고 그의 사용 |
| US6719868B1 (en) | 1998-03-23 | 2004-04-13 | President And Fellows Of Harvard College | Methods for fabricating microfluidic structures |
| US6406921B1 (en) | 1998-07-14 | 2002-06-18 | Zyomyx, Incorporated | Protein arrays for high-throughput screening |
| EP1144094B1 (en) | 1998-12-04 | 2004-03-17 | Orbital Biosciences, L.L.C. | Ultrafiltration device and method of forming same |
| US6623526B1 (en) | 1999-01-08 | 2003-09-23 | Corin Limited | Knee prosthesis |
| FR2788780B1 (fr) | 1999-01-27 | 2001-03-30 | Ap Cells Inc | Procede de preparation de vesicules membranaires |
| US6811668B1 (en) | 1999-06-22 | 2004-11-02 | Caliper Life Sciences, Inc. | Apparatus for the operation of a microfluidic device |
| US6899137B2 (en) | 1999-06-28 | 2005-05-31 | California Institute Of Technology | Microfabricated elastomeric valve and pump systems |
| US7501245B2 (en) | 1999-06-28 | 2009-03-10 | Helicos Biosciences Corp. | Methods and apparatuses for analyzing polynucleotide sequences |
| US7195670B2 (en) | 2000-06-27 | 2007-03-27 | California Institute Of Technology | High throughput screening of crystallization of materials |
| US7144616B1 (en) | 1999-06-28 | 2006-12-05 | California Institute Of Technology | Microfabricated elastomeric valve and pump systems |
| US7601270B1 (en) | 1999-06-28 | 2009-10-13 | California Institute Of Technology | Microfabricated elastomeric valve and pump systems |
| US6929030B2 (en) | 1999-06-28 | 2005-08-16 | California Institute Of Technology | Microfabricated elastomeric valve and pump systems |
| AUPQ147799A0 (en) | 1999-07-07 | 1999-07-29 | Medvet Science Pty. Ltd. | Mesenchymal precursor cell |
| GB9927320D0 (en) | 1999-11-18 | 2000-01-12 | Chiron Spa | Exosome separation |
| AU2001232805A1 (en) | 2000-01-12 | 2001-07-24 | Ut-Battelle, Llc | A microfluidic device and method for focusing, segmenting, and dispensing of a fluid stream |
| US7452713B2 (en) | 2000-02-29 | 2008-11-18 | Stmicroelectronics S.R.L. | Process for manufacturing a microfluidic device with buried channels |
| US7867763B2 (en) | 2004-01-25 | 2011-01-11 | Fluidigm Corporation | Integrated chip carriers with thermocycler interfaces and methods of using the same |
| US6773812B2 (en) | 2000-04-06 | 2004-08-10 | Luminex Corporation | Magnetically-responsive microspheres |
| US6812023B1 (en) | 2000-04-27 | 2004-11-02 | Anosys, Inc. | Methods of producing membrane vesicles |
| US6645432B1 (en) | 2000-05-25 | 2003-11-11 | President & Fellows Of Harvard College | Microfluidic systems including three-dimensionally arrayed channel networks |
| AU2001282786A1 (en) | 2000-08-23 | 2002-03-04 | Imego Ab | A sample preparing arrangement and a method |
| US20020048821A1 (en) | 2000-08-24 | 2002-04-25 | David Storek | Sample preparing arrangement and a method relating to such an arrangement |
| AU2002241595A1 (en) | 2000-12-01 | 2002-07-24 | Protasis Corporation | Microfluidic device with multiple microcoil nmr detectors |
| US7323140B2 (en) | 2001-03-28 | 2008-01-29 | Handylab, Inc. | Moving microdroplets in a microfluidic device |
| US6802342B2 (en) | 2001-04-06 | 2004-10-12 | Fluidigm Corporation | Microfabricated fluidic circuit elements and applications |
| WO2002099077A2 (en) | 2001-06-06 | 2002-12-12 | Proteologics, Inc. | Methods and compositions related to tagging of membrane surface proteins |
| US7390463B2 (en) | 2001-09-07 | 2008-06-24 | Corning Incorporated | Microcolumn-based, high-throughput microfluidic device |
| US7189368B2 (en) | 2001-09-17 | 2007-03-13 | Gyros Patent Ab | Functional unit enabling controlled flow in a microfluidic device |
| US7253003B2 (en) | 2001-10-19 | 2007-08-07 | Wisconsin Alumni Research Foundation | Method for monitoring the environment within a microfluidic device |
| US7189580B2 (en) | 2001-10-19 | 2007-03-13 | Wisconsin Alumni Research Foundation | Method of pumping fluid through a microfluidic device |
| EP1463796B1 (en) | 2001-11-30 | 2013-01-09 | Fluidigm Corporation | Microfluidic device and methods of using same |
| US7691333B2 (en) | 2001-11-30 | 2010-04-06 | Fluidigm Corporation | Microfluidic device and methods of using same |
| EP1461606A4 (en) | 2001-12-05 | 2005-06-29 | Univ Washington | MICROFLUIDIC DEVICE AND SURFACE DECORATION METHOD FOR SOLID PHASE AFFINITY BINDING ASSAYS |
| US7238255B2 (en) | 2001-12-31 | 2007-07-03 | Gyros Patent Ab | Microfluidic device and its manufacture |
| US6958119B2 (en) | 2002-02-26 | 2005-10-25 | Agilent Technologies, Inc. | Mobile phase gradient generation microfluidic device |
| US7195986B1 (en) | 2002-03-08 | 2007-03-27 | Caliper Life Sciences, Inc. | Microfluidic device with controlled substrate conductivity |
| GB2388189B (en) | 2002-04-29 | 2006-01-11 | Robert Jeffrey Geddes Carr | Optical detection and analysis of particles |
| US7189581B2 (en) | 2002-04-30 | 2007-03-13 | Wisconsin Alumni Research Foundation | Method of obtaining a sample concentration of a solution in a microfluidic device |
| DE60228685D1 (de) | 2002-05-16 | 2008-10-16 | Micronit Microfluidics Bv | Verfahren zur Herstellung eines mikrofluidischen Bauteiles |
| WO2004007582A2 (en) | 2002-07-15 | 2004-01-22 | University Of Virginia Patent Foundation | Hybrid polymers for functional tuning of microfluidic device surfaces |
| US7135147B2 (en) | 2002-07-26 | 2006-11-14 | Applera Corporation | Closing blade for deformable valve in a microfluidic device and method |
| US7201881B2 (en) | 2002-07-26 | 2007-04-10 | Applera Corporation | Actuator for deformable valves in a microfluidic device, and method |
| US7452509B2 (en) | 2002-07-26 | 2008-11-18 | Applied Biosystems Inc. | Microfluidic device including displaceable material trap, and system |
| KR100480338B1 (ko) | 2002-08-08 | 2005-03-30 | 한국전자통신연구원 | 극소량의 유체제어를 위한 미세 유체제어소자 |
| TW536524B (en) | 2002-09-17 | 2003-06-11 | Fan-Gen Tzeng | Network-type micro-channel device for micro-fluid |
| US7118661B2 (en) | 2002-09-30 | 2006-10-10 | The Regents Of The University Of California | Nanolaminate microfluidic device for mobility selection of particles |
| ES2588905T3 (es) | 2002-10-04 | 2016-11-07 | The Regents Of The University Of California | Dispositivo microfluídico de compartimentos múltiples para investigación en neurociencias |
| FR2848125B1 (fr) | 2002-12-04 | 2006-06-09 | Commissariat Energie Atomique | Dispositif microfluidique dans lequel l'interface liquide/fluide est stabilisee |
| US7467928B2 (en) | 2002-12-12 | 2008-12-23 | Board Of Trustees Of The University Of Arkansas | Microfluidic device utilizing magnetohydrodynamics and method for fabrication thereof |
| US7125711B2 (en) | 2002-12-19 | 2006-10-24 | Bayer Healthcare Llc | Method and apparatus for splitting of specimens into multiple channels of a microfluidic device |
| US7338637B2 (en) | 2003-01-31 | 2008-03-04 | Hewlett-Packard Development Company, L.P. | Microfluidic device with thin-film electronic devices |
| US7413709B2 (en) | 2003-02-12 | 2008-08-19 | Agilent Technologies, Inc. | PAEK-based microfluidic device with integrated electrospray emitter |
| JP3856763B2 (ja) | 2003-03-11 | 2006-12-13 | 財団法人川村理化学研究所 | マイクロ流体素子の製造方法 |
| US7604965B2 (en) | 2003-04-03 | 2009-10-20 | Fluidigm Corporation | Thermal reaction device and method for using the same |
| US7476363B2 (en) | 2003-04-03 | 2009-01-13 | Fluidigm Corporation | Microfluidic devices and methods of using same |
| US20050145496A1 (en) | 2003-04-03 | 2005-07-07 | Federico Goodsaid | Thermal reaction device and method for using the same |
| AU2004228678A1 (en) | 2003-04-03 | 2004-10-21 | Fluidigm Corp. | Microfluidic devices and methods of using same |
| US7422725B2 (en) | 2003-05-01 | 2008-09-09 | Enplas Corporation | Sample handling unit applicable to microchip, and microfluidic device having microchips |
| CN1812839A (zh) | 2003-06-06 | 2006-08-02 | 精密公司 | 在微流体装置上的加热、冷却和热循环的系统与方法 |
| FR2862007B1 (fr) | 2003-11-12 | 2005-12-23 | Commissariat Energie Atomique | Dispositif microfluidique muni d'un nez d'electronebulisation. |
| US7329391B2 (en) | 2003-12-08 | 2008-02-12 | Applera Corporation | Microfluidic device and material manipulating method using same |
| EP1547688A1 (en) | 2003-12-23 | 2005-06-29 | STMicroelectronics S.r.l. | Microfluidic device and method of locally concentrating electrically charged substances in a microfluidic device |
| US7099778B2 (en) | 2003-12-30 | 2006-08-29 | Caliper Life Sciences, Inc. | Method for determining diffusivity and molecular weight in a microfluidic device |
| US7351380B2 (en) | 2004-01-08 | 2008-04-01 | Sandia Corporation | Microfluidic structures and methods for integrating a functional component into a microfluidic device |
| CA2554240A1 (en) | 2004-01-25 | 2005-08-11 | Fluidigm Corporation | Crystal forming devices and systems and methods for making and using the same |
| US7402229B2 (en) | 2004-03-31 | 2008-07-22 | Intel Corporation | Fabrication and use of semipermeable membranes and gels for the control of electrolysis in a microfluidic device |
| EP1744986A2 (en) | 2004-04-02 | 2007-01-24 | Eksigent Technologies, LLC | Microfluidic device |
| US7419639B2 (en) | 2004-05-12 | 2008-09-02 | The Board Of Trustees Of The Leland Stanford Junior University | Multilayer microfluidic device |
| CN102680440A (zh) | 2004-06-07 | 2012-09-19 | 先锋生物科技股份有限公司 | 用于微流体器件的光学透镜系统和方法 |
| JP2008523354A (ja) | 2004-11-17 | 2008-07-03 | ルミネックス・コーポレーション | フロー・アナライザからデータを管理するための装置と方法 |
| US7488596B2 (en) | 2004-12-17 | 2009-02-10 | Samsung Electronics Co., Ltd. | Microfluidic device comprising electrolysis device for cell lysis and method for electrochemically lysing cells using the same |
| EP1880197B1 (en) | 2005-04-12 | 2019-06-12 | Caliper Life Sciences, Inc. | Microfluidic device for use with a compact optical detection system |
| KR100590581B1 (ko) | 2005-05-10 | 2006-06-19 | 삼성전자주식회사 | 미세유동장치 및 그 제조방법 |
| JP4992201B2 (ja) | 2005-06-07 | 2012-08-08 | 富士ゼロックス株式会社 | マイクロ流体制御方法、マイクロ流体素子およびその製造方法 |
| TWI274040B (en) | 2005-12-23 | 2007-02-21 | Ind Tech Res Inst | Microfluidic device and method of manufacturing the same |
| US7568399B2 (en) | 2006-01-05 | 2009-08-04 | Integrated Sensing Systems, Inc. | Microfluidic device |
| US7581429B2 (en) | 2006-01-06 | 2009-09-01 | Integrated Sensing Systems, Inc. | Microfluidic device and method of operation |
| US8124015B2 (en) | 2006-02-03 | 2012-02-28 | Institute For Systems Biology | Multiplexed, microfluidic molecular assay device and assay method |
| CA2644855C (en) | 2006-03-09 | 2019-11-19 | Aethlon Medical, Inc. | Extracorporeal removal of microvesicular particles |
| EP2857526B1 (en) | 2006-12-13 | 2016-08-17 | Luminex Corporation | Systems and methods for multiplex analysis of PCR in real time |
| US8008019B2 (en) | 2007-11-28 | 2011-08-30 | Luminex Molecular Diagnostics | Use of dual-tags for the evaluation of genomic variable repeat regions |
| WO2011109451A1 (en) * | 2010-03-01 | 2011-09-09 | Aptamatrix, Inc. | Library compositions and methosds for acyclic identification of aptamers |
| WO2010056337A2 (en) * | 2008-11-12 | 2010-05-20 | Caris Mpi, Inc. | Methods and systems of using exosomes for determining phenotypes |
| WO2010065765A2 (en) | 2008-12-04 | 2010-06-10 | Aethlon Medical, Inc. | Affinity capture of circulating biomarkers |
| EP2202522A1 (en) | 2008-12-23 | 2010-06-30 | Universiteit Leiden | Methods for immobilizing microvesicles, means and methods for detecting them, and uses thereof |
| EP3722810A3 (en) | 2009-02-11 | 2021-01-13 | Caris MPI, Inc. | Molecular profiling of tumors |
| US20120077263A1 (en) | 2009-06-05 | 2012-03-29 | Mayo Foundation For Medical Education And Research | Methods and materials for isolating exosomes |
| WO2011056688A2 (en) | 2009-10-27 | 2011-05-12 | Caris Life Sciences, Inc. | Molecular profiling for personalized medicine |
| US20130203061A1 (en) * | 2009-11-30 | 2013-08-08 | Michael KLASS | Methods and systems for isolating, storing, and analyzing vesicles |
| US20140148348A1 (en) * | 2010-01-13 | 2014-05-29 | Christine Kuslich | Dectection of gastrointestinal disorders |
| WO2011106376A2 (en) * | 2010-02-23 | 2011-09-01 | The General Hospital Corporation | Use of microvesicles in the treatment of medical conditions |
| KR20140072014A (ko) | 2011-06-16 | 2014-06-12 | 카리스 라이프 사이언스 룩셈부르크 홀딩스, 에스.에이.알.엘. | 생물지표 조성물 및 방법 |
| EP2742154A4 (en) | 2011-08-08 | 2015-08-12 | Caris Life Sciences Switzerland Holdings Gmbh | BIOMARKER COMPOSITIONS AND METHODS |
| US20150301058A1 (en) | 2012-11-26 | 2015-10-22 | Caris Science, Inc. | Biomarker compositions and methods |
-
2014
- 2014-08-28 KR KR1020167007928A patent/KR20160080815A/ko not_active Application Discontinuation
- 2014-08-28 CN CN201480063091.1A patent/CN105980615A/zh active Pending
- 2014-08-28 US US14/915,249 patent/US20160319361A1/en not_active Abandoned
- 2014-08-28 EP EP14840036.9A patent/EP3039174B1/en active Active
- 2014-08-28 WO PCT/US2014/053306 patent/WO2015031694A2/en active Application Filing
- 2014-08-28 CA CA2922689A patent/CA2922689A1/en not_active Abandoned
- 2014-08-28 BR BR112016004153A patent/BR112016004153A2/pt not_active IP Right Cessation
- 2014-08-28 AU AU2014312211A patent/AU2014312211A1/en not_active Abandoned
- 2014-08-28 JP JP2016537869A patent/JP2016533752A/ja active Pending
-
2016
- 2016-02-22 IL IL244236A patent/IL244236A0/en unknown
-
2019
- 2019-01-09 AU AU2019200115A patent/AU2019200115A1/en not_active Abandoned
- 2019-09-26 IL IL26969319A patent/IL269693A/en unknown
-
2020
- 2020-07-23 US US16/936,618 patent/US20210062270A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012507300A (ja) * | 2008-10-30 | 2012-03-29 | カリス ライフ サイエンシズ ルクセンブルク ホールディングス | Rnaパターンを評価する方法 |
| JP2013521502A (ja) * | 2010-03-01 | 2013-06-10 | カリス ライフ サイエンシズ ルクセンブルク ホールディングス | セラノーシスのためのバイオマーカー |
| JP2013526852A (ja) * | 2010-04-06 | 2013-06-27 | カリス ライフ サイエンシズ ルクセンブルク ホールディングス | 疾患に対する循環バイオマーカー |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108866215A (zh) * | 2017-12-01 | 2018-11-23 | 苏州百源基因技术有限公司 | 一种用于产气肠杆菌检测的实时荧光定量pcr试剂盒 |
| CN108866215B (zh) * | 2017-12-01 | 2022-02-08 | 苏州百源基因技术有限公司 | 一种用于产气肠杆菌检测的实时荧光定量pcr试剂盒 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3039174A4 (en) | 2017-09-27 |
| CN105980615A (zh) | 2016-09-28 |
| AU2019200115A1 (en) | 2019-01-31 |
| US20160319361A1 (en) | 2016-11-03 |
| US20210062270A1 (en) | 2021-03-04 |
| AU2014312211A1 (en) | 2016-03-10 |
| WO2015031694A3 (en) | 2015-06-04 |
| KR20160080815A (ko) | 2016-07-08 |
| IL244236A0 (en) | 2016-04-21 |
| WO2015031694A2 (en) | 2015-03-05 |
| EP3039174B1 (en) | 2019-10-16 |
| EP3039174A2 (en) | 2016-07-06 |
| IL269693A (en) | 2019-11-28 |
| CA2922689A1 (en) | 2015-03-05 |
| BR112016004153A2 (pt) | 2019-09-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7442483B2 (ja) | アプタマーおよびその使用 | |
| EP3039174B1 (en) | Oligonucleotide probes and uses thereof | |
| US11332748B2 (en) | Oligonucleotide probes and uses thereof | |
| AU2016229076A1 (en) | Oligonucleotide probes and uses thereof | |
| AU2013361323B2 (en) | Compositions and methods for aptamer screening | |
| US20220290124A1 (en) | Oligonucleotide probes and uses thereof | |
| EP3577127A1 (en) | Targeted oligonucleotides | |
| WO2019173799A1 (en) | Oligonucleotide probes and uses thereof | |
| JP2024059757A (ja) | アプタマーおよびその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170823 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170823 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180905 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20181017 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20181017 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181204 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190301 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190722 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191017 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200304 |