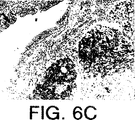
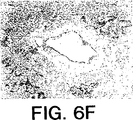
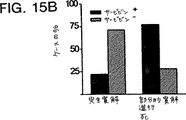
JP4672092B2 - 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 - Google Patents
細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 Download PDFInfo
- Publication number
- JP4672092B2 JP4672092B2 JP52400798A JP52400798A JP4672092B2 JP 4672092 B2 JP4672092 B2 JP 4672092B2 JP 52400798 A JP52400798 A JP 52400798A JP 52400798 A JP52400798 A JP 52400798A JP 4672092 B2 JP4672092 B2 JP 4672092B2
- Authority
- JP
- Japan
- Prior art keywords
- survivin
- nucleic acid
- acid molecule
- protein
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 108010002687 Survivin Proteins 0.000 title claims abstract description 710
- 102000000763 Survivin Human genes 0.000 title claims abstract description 676
- 108090000623 proteins and genes Proteins 0.000 title claims abstract description 190
- 230000006907 apoptotic process Effects 0.000 title claims abstract description 128
- 102000004169 proteins and genes Human genes 0.000 title claims abstract description 127
- 230000033228 biological regulation Effects 0.000 title description 9
- 230000014509 gene expression Effects 0.000 claims abstract description 151
- 238000000034 method Methods 0.000 claims abstract description 103
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 101
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 95
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 95
- 150000001413 amino acids Chemical class 0.000 claims abstract description 68
- 210000004027 cell Anatomy 0.000 claims description 280
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 65
- 206010028980 Neoplasm Diseases 0.000 claims description 60
- 241000282414 Homo sapiens Species 0.000 claims description 56
- 108020004414 DNA Proteins 0.000 claims description 50
- 239000012634 fragment Substances 0.000 claims description 49
- 239000013598 vector Substances 0.000 claims description 47
- 201000011510 cancer Diseases 0.000 claims description 38
- 239000002299 complementary DNA Substances 0.000 claims description 38
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 35
- 239000000284 extract Substances 0.000 claims description 29
- 229920001184 polypeptide Polymers 0.000 claims description 29
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 24
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 23
- 108020004999 messenger RNA Proteins 0.000 claims description 20
- 239000000203 mixture Substances 0.000 claims description 20
- 201000010099 disease Diseases 0.000 claims description 18
- 238000004519 manufacturing process Methods 0.000 claims description 15
- 239000003814 drug Substances 0.000 claims description 14
- 210000004881 tumor cell Anatomy 0.000 claims description 14
- 210000004369 blood Anatomy 0.000 claims description 12
- 239000008280 blood Substances 0.000 claims description 12
- 239000002773 nucleotide Substances 0.000 claims description 12
- 125000003729 nucleotide group Chemical group 0.000 claims description 12
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 10
- 230000000295 complement effect Effects 0.000 claims description 10
- 230000002829 reductive effect Effects 0.000 claims description 10
- 241001465754 Metazoa Species 0.000 claims description 9
- 108700019146 Transgenes Proteins 0.000 claims description 9
- 230000002401 inhibitory effect Effects 0.000 claims description 8
- 238000012360 testing method Methods 0.000 claims description 8
- 108091007065 BIRCs Proteins 0.000 claims description 7
- 241000124008 Mammalia Species 0.000 claims description 7
- 230000002950 deficient Effects 0.000 claims description 7
- 101000896234 Homo sapiens Baculoviral IAP repeat-containing protein 5 Proteins 0.000 claims description 6
- 230000012010 growth Effects 0.000 claims description 6
- 230000001613 neoplastic effect Effects 0.000 claims description 6
- 108700026244 Open Reading Frames Proteins 0.000 claims description 5
- 239000013060 biological fluid Substances 0.000 claims description 5
- 230000010261 cell growth Effects 0.000 claims description 5
- 230000002596 correlated effect Effects 0.000 claims description 5
- 102000047803 human BIRC5 Human genes 0.000 claims description 5
- 230000003053 immunization Effects 0.000 claims description 5
- 230000010076 replication Effects 0.000 claims description 5
- 125000000539 amino acid group Chemical group 0.000 claims description 4
- 230000002163 immunogen Effects 0.000 claims description 4
- 238000012544 monitoring process Methods 0.000 claims description 4
- 230000004614 tumor growth Effects 0.000 claims description 4
- 210000004899 c-terminal region Anatomy 0.000 claims description 3
- 108020001507 fusion proteins Proteins 0.000 claims description 3
- 102000037865 fusion proteins Human genes 0.000 claims description 3
- 239000008194 pharmaceutical composition Substances 0.000 claims description 3
- 210000002700 urine Anatomy 0.000 claims description 3
- 239000013603 viral vector Substances 0.000 claims description 3
- 210000004408 hybridoma Anatomy 0.000 claims description 2
- 210000003296 saliva Anatomy 0.000 claims description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims 2
- 102100024319 Intestinal-type alkaline phosphatase Human genes 0.000 claims 1
- 238000001574 biopsy Methods 0.000 claims 1
- 238000012258 culturing Methods 0.000 claims 1
- 230000004927 fusion Effects 0.000 claims 1
- 230000000644 propagated effect Effects 0.000 claims 1
- 239000003795 chemical substances by application Substances 0.000 abstract description 66
- 230000000694 effects Effects 0.000 abstract description 33
- 230000001404 mediated effect Effects 0.000 abstract description 25
- 230000005764 inhibitory process Effects 0.000 abstract description 23
- 208000037273 Pathologic Processes Diseases 0.000 abstract description 18
- 230000009054 pathological process Effects 0.000 abstract description 18
- 230000031018 biological processes and functions Effects 0.000 abstract description 14
- 230000027455 binding Effects 0.000 description 85
- 230000000692 anti-sense effect Effects 0.000 description 73
- 210000001519 tissue Anatomy 0.000 description 62
- 239000000523 sample Substances 0.000 description 48
- 230000001965 increasing effect Effects 0.000 description 29
- 238000011282 treatment Methods 0.000 description 26
- 238000009396 hybridization Methods 0.000 description 24
- 230000004663 cell proliferation Effects 0.000 description 20
- 230000001105 regulatory effect Effects 0.000 description 19
- 238000001727 in vivo Methods 0.000 description 16
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 15
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 15
- 210000000349 chromosome Anatomy 0.000 description 15
- 230000001640 apoptogenic effect Effects 0.000 description 13
- 238000002474 experimental method Methods 0.000 description 13
- 210000004072 lung Anatomy 0.000 description 13
- 238000003752 polymerase chain reaction Methods 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- 238000010186 staining Methods 0.000 description 13
- 238000013518 transcription Methods 0.000 description 13
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 12
- 239000013604 expression vector Substances 0.000 description 12
- 238000007901 in situ hybridization Methods 0.000 description 12
- 239000003550 marker Substances 0.000 description 12
- 210000002569 neuron Anatomy 0.000 description 12
- 230000035897 transcription Effects 0.000 description 12
- 108010006696 Neuronal Apoptosis-Inhibitory Protein Proteins 0.000 description 11
- 108091034117 Oligonucleotide Proteins 0.000 description 11
- 238000002105 Southern blotting Methods 0.000 description 11
- 239000003112 inhibitor Substances 0.000 description 11
- 230000035772 mutation Effects 0.000 description 11
- 230000001225 therapeutic effect Effects 0.000 description 11
- 102100021676 Baculoviral IAP repeat-containing protein 1 Human genes 0.000 description 10
- 241000283973 Oryctolagus cuniculus Species 0.000 description 10
- 150000001875 compounds Chemical class 0.000 description 10
- 238000009826 distribution Methods 0.000 description 10
- 230000006654 negative regulation of apoptotic process Effects 0.000 description 10
- 210000000056 organ Anatomy 0.000 description 10
- 241000894007 species Species 0.000 description 10
- 238000006467 substitution reaction Methods 0.000 description 10
- 239000011710 vitamin D Substances 0.000 description 10
- 108091026890 Coding region Proteins 0.000 description 9
- 108091029523 CpG island Proteins 0.000 description 9
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 9
- 206010025323 Lymphomas Diseases 0.000 description 9
- 239000002671 adjuvant Substances 0.000 description 9
- 238000003556 assay Methods 0.000 description 9
- 239000011324 bead Substances 0.000 description 9
- 230000030833 cell death Effects 0.000 description 9
- 230000004069 differentiation Effects 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 230000001605 fetal effect Effects 0.000 description 9
- 210000002950 fibroblast Anatomy 0.000 description 9
- 230000006870 function Effects 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 230000001939 inductive effect Effects 0.000 description 9
- 230000003993 interaction Effects 0.000 description 9
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 9
- 210000001744 T-lymphocyte Anatomy 0.000 description 8
- 230000002424 anti-apoptotic effect Effects 0.000 description 8
- 230000001413 cellular effect Effects 0.000 description 8
- 230000007423 decrease Effects 0.000 description 8
- 230000001419 dependent effect Effects 0.000 description 8
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 238000003780 insertion Methods 0.000 description 8
- 230000037431 insertion Effects 0.000 description 8
- 239000012528 membrane Substances 0.000 description 8
- 239000002953 phosphate buffered saline Substances 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 238000001890 transfection Methods 0.000 description 8
- 229960005486 vaccine Drugs 0.000 description 8
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 7
- 102000040104 IAP family Human genes 0.000 description 7
- 108091069885 IAP family Proteins 0.000 description 7
- 206010029260 Neuroblastoma Diseases 0.000 description 7
- 239000002246 antineoplastic agent Substances 0.000 description 7
- 238000013459 approach Methods 0.000 description 7
- 238000002512 chemotherapy Methods 0.000 description 7
- 229940127089 cytotoxic agent Drugs 0.000 description 7
- 230000003247 decreasing effect Effects 0.000 description 7
- 238000011161 development Methods 0.000 description 7
- 230000018109 developmental process Effects 0.000 description 7
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 7
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 7
- 238000010790 dilution Methods 0.000 description 7
- 239000012895 dilution Substances 0.000 description 7
- 238000001415 gene therapy Methods 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- 238000013519 translation Methods 0.000 description 7
- 238000002054 transplantation Methods 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 6
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 6
- 241000283707 Capra Species 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 108700024394 Exon Proteins 0.000 description 6
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 6
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 6
- 102000055031 Inhibitor of Apoptosis Proteins Human genes 0.000 description 6
- 102000003792 Metallothionein Human genes 0.000 description 6
- 108090000157 Metallothionein Proteins 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- 240000002390 Pandanus odoratissimus Species 0.000 description 6
- 235000005311 Pandanus odoratissimus Nutrition 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 238000003782 apoptosis assay Methods 0.000 description 6
- 210000001072 colon Anatomy 0.000 description 6
- 238000012217 deletion Methods 0.000 description 6
- 230000037430 deletion Effects 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 210000003527 eukaryotic cell Anatomy 0.000 description 6
- 238000003119 immunoblot Methods 0.000 description 6
- 238000003364 immunohistochemistry Methods 0.000 description 6
- 230000006698 induction Effects 0.000 description 6
- 210000004698 lymphocyte Anatomy 0.000 description 6
- 210000004962 mammalian cell Anatomy 0.000 description 6
- 230000007246 mechanism Effects 0.000 description 6
- 210000001616 monocyte Anatomy 0.000 description 6
- 238000002703 mutagenesis Methods 0.000 description 6
- 231100000350 mutagenesis Toxicity 0.000 description 6
- 208000015122 neurodegenerative disease Diseases 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 238000012216 screening Methods 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 238000011144 upstream manufacturing Methods 0.000 description 6
- 238000005406 washing Methods 0.000 description 6
- 229920000936 Agarose Polymers 0.000 description 5
- 241000972773 Aulopiformes Species 0.000 description 5
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 5
- 206010059866 Drug resistance Diseases 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- 208000031886 HIV Infections Diseases 0.000 description 5
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 5
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 5
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 5
- 238000000636 Northern blotting Methods 0.000 description 5
- 108700020796 Oncogene Proteins 0.000 description 5
- 108091005804 Peptidases Proteins 0.000 description 5
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 5
- 239000000427 antigen Substances 0.000 description 5
- 108091007433 antigens Proteins 0.000 description 5
- 102000036639 antigens Human genes 0.000 description 5
- 229940098773 bovine serum albumin Drugs 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 229940022399 cancer vaccine Drugs 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 210000000981 epithelium Anatomy 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 238000002372 labelling Methods 0.000 description 5
- 239000002502 liposome Substances 0.000 description 5
- 210000000496 pancreas Anatomy 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 235000019515 salmon Nutrition 0.000 description 5
- 230000011664 signaling Effects 0.000 description 5
- 150000003384 small molecules Chemical class 0.000 description 5
- 230000004083 survival effect Effects 0.000 description 5
- 230000001052 transient effect Effects 0.000 description 5
- 230000035899 viability Effects 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- 102000014914 Carrier Proteins Human genes 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- AHCYMLUZIRLXAA-SHYZEUOFSA-N Deoxyuridine 5'-triphosphate Chemical compound O1[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C[C@@H]1N1C(=O)NC(=O)C=C1 AHCYMLUZIRLXAA-SHYZEUOFSA-N 0.000 description 4
- 102100037024 E3 ubiquitin-protein ligase XIAP Human genes 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- 239000004677 Nylon Substances 0.000 description 4
- 102000035195 Peptidases Human genes 0.000 description 4
- 102000007079 Peptide Fragments Human genes 0.000 description 4
- 108010033276 Peptide Fragments Proteins 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- 108091081024 Start codon Proteins 0.000 description 4
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 4
- 230000005856 abnormality Effects 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 239000005557 antagonist Substances 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 230000009286 beneficial effect Effects 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 210000000481 breast Anatomy 0.000 description 4
- 238000009566 cancer vaccine Methods 0.000 description 4
- -1 cationic lipid Chemical class 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 230000000875 corresponding effect Effects 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 208000032839 leukemia Diseases 0.000 description 4
- 230000003211 malignant effect Effects 0.000 description 4
- 229920001778 nylon Polymers 0.000 description 4
- 102000013415 peroxidase activity proteins Human genes 0.000 description 4
- 108040007629 peroxidase activity proteins Proteins 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 230000035945 sensitivity Effects 0.000 description 4
- 238000001086 yeast two-hybrid system Methods 0.000 description 4
- 239000011701 zinc Substances 0.000 description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 3
- 229940088872 Apoptosis inhibitor Drugs 0.000 description 3
- 102100026189 Beta-galactosidase Human genes 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- 230000007067 DNA methylation Effects 0.000 description 3
- 102100033215 DNA nucleotidylexotransferase Human genes 0.000 description 3
- 108010008286 DNA nucleotidylexotransferase Proteins 0.000 description 3
- 206010061818 Disease progression Diseases 0.000 description 3
- 238000004435 EPR spectroscopy Methods 0.000 description 3
- 208000031637 Erythroblastic Acute Leukemia Diseases 0.000 description 3
- 208000036566 Erythroleukaemia Diseases 0.000 description 3
- 229920000181 Ethylene propylene rubber Polymers 0.000 description 3
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 101000987581 Homo sapiens Perforin-1 Proteins 0.000 description 3
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 3
- 241000725303 Human immunodeficiency virus Species 0.000 description 3
- PWKSKIMOESPYIA-BYPYZUCNSA-N L-N-acetyl-Cysteine Chemical compound CC(=O)N[C@@H](CS)C(O)=O PWKSKIMOESPYIA-BYPYZUCNSA-N 0.000 description 3
- 125000000415 L-cysteinyl group Chemical group O=C([*])[C@@](N([H])[H])([H])C([H])([H])S[H] 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 101100494126 Mus musculus Birc5 gene Proteins 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 108010027206 Nucleopolyhedrovirus inhibitor of apoptosis Proteins 0.000 description 3
- 239000004365 Protease Substances 0.000 description 3
- 101710149951 Protein Tat Proteins 0.000 description 3
- 238000012300 Sequence Analysis Methods 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 3
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 3
- 108700031544 X-Linked Inhibitor of Apoptosis Proteins 0.000 description 3
- 229960004308 acetylcysteine Drugs 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 208000021841 acute erythroid leukemia Diseases 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 238000001042 affinity chromatography Methods 0.000 description 3
- 230000003321 amplification Effects 0.000 description 3
- 238000000137 annealing Methods 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 239000000158 apoptosis inhibitor Substances 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 108010005774 beta-Galactosidase Proteins 0.000 description 3
- 108091008324 binding proteins Proteins 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 230000011712 cell development Effects 0.000 description 3
- 230000024245 cell differentiation Effects 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 230000001276 controlling effect Effects 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 210000004748 cultured cell Anatomy 0.000 description 3
- 230000001120 cytoprotective effect Effects 0.000 description 3
- 239000002254 cytotoxic agent Substances 0.000 description 3
- 231100000599 cytotoxic agent Toxicity 0.000 description 3
- 238000004925 denaturation Methods 0.000 description 3
- 230000036425 denaturation Effects 0.000 description 3
- 230000029087 digestion Effects 0.000 description 3
- 230000005750 disease progression Effects 0.000 description 3
- 230000003828 downregulation Effects 0.000 description 3
- 238000004520 electroporation Methods 0.000 description 3
- 230000013020 embryo development Effects 0.000 description 3
- 210000002889 endothelial cell Anatomy 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 230000008175 fetal development Effects 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 238000013467 fragmentation Methods 0.000 description 3
- 238000006062 fragmentation reaction Methods 0.000 description 3
- 230000000762 glandular Effects 0.000 description 3
- 101150100002 iap gene Proteins 0.000 description 3
- 230000000415 inactivating effect Effects 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 230000006882 induction of apoptosis Effects 0.000 description 3
- 238000002955 isolation Methods 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 201000005249 lung adenocarcinoma Diseases 0.000 description 3
- 230000036210 malignancy Effects 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 3
- 230000031864 metaphase Effects 0.000 description 3
- 239000003094 microcapsule Substances 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 230000004770 neurodegeneration Effects 0.000 description 3
- 238000012758 nuclear staining Methods 0.000 description 3
- 238000003199 nucleic acid amplification method Methods 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 239000013610 patient sample Substances 0.000 description 3
- 230000035699 permeability Effects 0.000 description 3
- 230000005522 programmed cell death Effects 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 238000003906 pulsed field gel electrophoresis Methods 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 230000001177 retroviral effect Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 238000007910 systemic administration Methods 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 230000009466 transformation Effects 0.000 description 3
- 230000014621 translational initiation Effects 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- 239000011534 wash buffer Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- 102000007469 Actins Human genes 0.000 description 2
- 108010085238 Actins Proteins 0.000 description 2
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 208000024827 Alzheimer disease Diseases 0.000 description 2
- 206010003445 Ascites Diseases 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- 102000011727 Caspases Human genes 0.000 description 2
- 108010076667 Caspases Proteins 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 2
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 2
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 2
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 101000928788 Drosophila melanogaster Death-associated inhibitor of apoptosis 2 Proteins 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 108010067770 Endopeptidase K Proteins 0.000 description 2
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 108010074860 Factor Xa Proteins 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- 244000068988 Glycine max Species 0.000 description 2
- 235000010469 Glycine max Nutrition 0.000 description 2
- 101000804865 Homo sapiens E3 ubiquitin-protein ligase XIAP Proteins 0.000 description 2
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 2
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- 102100022338 Integrin alpha-M Human genes 0.000 description 2
- 102100025390 Integrin beta-2 Human genes 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 108091092195 Intron Proteins 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 229930182816 L-glutamine Natural products 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- 108010047956 Nucleosomes Proteins 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 108010047620 Phytohemagglutinins Proteins 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 206010063837 Reperfusion injury Diseases 0.000 description 2
- 108700008625 Reporter Genes Proteins 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 208000037065 Subacute sclerosing leukoencephalitis Diseases 0.000 description 2
- 206010042297 Subacute sclerosing panencephalitis Diseases 0.000 description 2
- 102000019197 Superoxide Dismutase Human genes 0.000 description 2
- 108010012715 Superoxide dismutase Proteins 0.000 description 2
- 108091036066 Three prime untranslated region Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 229930003316 Vitamin D Natural products 0.000 description 2
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- QPMSXSBEVQLBIL-CZRHPSIPSA-N ac1mix0p Chemical compound C1=CC=C2N(C[C@H](C)CN(C)C)C3=CC(OC)=CC=C3SC2=C1.O([C@H]1[C@]2(OC)C=CC34C[C@@H]2[C@](C)(O)CCC)C2=C5[C@]41CCN(C)[C@@H]3CC5=CC=C2O QPMSXSBEVQLBIL-CZRHPSIPSA-N 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 208000009956 adenocarcinoma Diseases 0.000 description 2
- 239000011543 agarose gel Substances 0.000 description 2
- 230000032683 aging Effects 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- 230000003042 antagnostic effect Effects 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000000340 anti-metabolite Effects 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 229940100197 antimetabolite Drugs 0.000 description 2
- 239000002256 antimetabolite Substances 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 238000002619 cancer immunotherapy Methods 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 230000005779 cell damage Effects 0.000 description 2
- 210000002230 centromere Anatomy 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 210000000038 chest Anatomy 0.000 description 2
- 238000012761 co-transfection Methods 0.000 description 2
- 201000010897 colon adenocarcinoma Diseases 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 239000000824 cytostatic agent Substances 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 229960002086 dextran Drugs 0.000 description 2
- 229960000633 dextran sulfate Drugs 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 108010030074 endodeoxyribonuclease MluI Proteins 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 108010088342 factor X receptors Proteins 0.000 description 2
- 108010052621 fas Receptor Proteins 0.000 description 2
- 102000018823 fas Receptor Human genes 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 210000003754 fetus Anatomy 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000001502 gel electrophoresis Methods 0.000 description 2
- 239000011544 gradient gel Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 238000003018 immunoassay Methods 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 229960000905 indomethacin Drugs 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 108010027775 interleukin-1beta-converting enzyme inhibitor Proteins 0.000 description 2
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 2
- 101150066555 lacZ gene Proteins 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000001638 lipofection Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 210000005265 lung cell Anatomy 0.000 description 2
- 229960001428 mercaptopurine Drugs 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- 235000013336 milk Nutrition 0.000 description 2
- 239000008267 milk Substances 0.000 description 2
- 210000004080 milk Anatomy 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 230000000877 morphologic effect Effects 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 230000009826 neoplastic cell growth Effects 0.000 description 2
- 210000001623 nucleosome Anatomy 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 230000008520 organization Effects 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 239000000816 peptidomimetic Substances 0.000 description 2
- 230000010412 perfusion Effects 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 230000001885 phytohemagglutinin Effects 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 230000002028 premature Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 239000003223 protective agent Substances 0.000 description 2
- 208000022074 proximal spinal muscular atrophy Diseases 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 230000008844 regulatory mechanism Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 239000012465 retentate Substances 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 210000000130 stem cell Anatomy 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000030968 tissue homeostasis Effects 0.000 description 2
- 239000012049 topical pharmaceutical composition Substances 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 238000011426 transformation method Methods 0.000 description 2
- 230000001131 transforming effect Effects 0.000 description 2
- 238000011830 transgenic mouse model Methods 0.000 description 2
- 230000010415 tropism Effects 0.000 description 2
- 230000004565 tumor cell growth Effects 0.000 description 2
- 210000003606 umbilical vein Anatomy 0.000 description 2
- 241000701447 unidentified baculovirus Species 0.000 description 2
- 241000701366 unidentified nuclear polyhedrosis viruses Species 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- 235000019166 vitamin D Nutrition 0.000 description 2
- 150000003710 vitamin D derivatives Chemical class 0.000 description 2
- 229940046008 vitamin d Drugs 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 1
- DXOFMKNITCKTIS-QXMHVHEDSA-N (z)-2-ethyloctadec-9-enoic acid Chemical compound CCCCCCCC\C=C/CCCCCCC(CC)C(O)=O DXOFMKNITCKTIS-QXMHVHEDSA-N 0.000 description 1
- GMRQFYUYWCNGIN-ZVUFCXRFSA-N 1,25-dihydroxy vitamin D3 Chemical compound C1([C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=CC=C1C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-ZVUFCXRFSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- KZMAWJRXKGLWGS-UHFFFAOYSA-N 2-chloro-n-[4-(4-methoxyphenyl)-1,3-thiazol-2-yl]-n-(3-methoxypropyl)acetamide Chemical compound S1C(N(C(=O)CCl)CCCOC)=NC(C=2C=CC(OC)=CC=2)=C1 KZMAWJRXKGLWGS-UHFFFAOYSA-N 0.000 description 1
- GHCZTIFQWKKGSB-UHFFFAOYSA-N 2-hydroxypropane-1,2,3-tricarboxylic acid;phosphoric acid Chemical compound OP(O)(O)=O.OC(=O)CC(O)(C(O)=O)CC(O)=O GHCZTIFQWKKGSB-UHFFFAOYSA-N 0.000 description 1
- NKDFYOWSKOHCCO-YPVLXUMRSA-N 20-hydroxyecdysone Chemical compound C1[C@@H](O)[C@@H](O)C[C@]2(C)[C@@H](CC[C@@]3([C@@H]([C@@](C)(O)[C@H](O)CCC(C)(O)C)CC[C@]33O)C)C3=CC(=O)[C@@H]21 NKDFYOWSKOHCCO-YPVLXUMRSA-N 0.000 description 1
- 238000005084 2D-nuclear magnetic resonance Methods 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- QRXMUCSWCMTJGU-UHFFFAOYSA-N 5-bromo-4-chloro-3-indolyl phosphate Chemical compound C1=C(Br)C(Cl)=C2C(OP(O)(=O)O)=CNC2=C1 QRXMUCSWCMTJGU-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 108020005544 Antisense RNA Proteins 0.000 description 1
- 102000010565 Apoptosis Regulatory Proteins Human genes 0.000 description 1
- 108010063104 Apoptosis Regulatory Proteins Proteins 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108010077805 Bacterial Proteins Proteins 0.000 description 1
- 102000051819 Baculoviral IAP Repeat-Containing 3 Human genes 0.000 description 1
- 108700032588 Baculovirus p35 Proteins 0.000 description 1
- 102000051485 Bcl-2 family Human genes 0.000 description 1
- 108700038897 Bcl-2 family Proteins 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 238000011735 C3H mouse Methods 0.000 description 1
- 208000004652 Cardiovascular Abnormalities Diseases 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 108091033380 Coding strand Proteins 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000029816 Collagenase Human genes 0.000 description 1
- 108060005980 Collagenase Proteins 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 206010011086 Coronary artery occlusion Diseases 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241001635274 Cydia pomonella Species 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 241000255601 Drosophila melanogaster Species 0.000 description 1
- 101000928792 Drosophila melanogaster Death-associated inhibitor of apoptosis 1 Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000672609 Escherichia coli BL21 Species 0.000 description 1
- 108091060211 Expressed sequence tag Proteins 0.000 description 1
- 101150064015 FAS gene Proteins 0.000 description 1
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 1
- 102100031706 Fibroblast growth factor 1 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 208000001034 Frostbite Diseases 0.000 description 1
- 102100029974 GTPase HRas Human genes 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 206010019196 Head injury Diseases 0.000 description 1
- 108010068250 Herpes Simplex Virus Protein Vmw65 Proteins 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 1
- 101000584633 Homo sapiens GTPase HRas Proteins 0.000 description 1
- 101000976075 Homo sapiens Insulin Proteins 0.000 description 1
- 101100264173 Homo sapiens XIAP gene Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010025815 Kanamycin Kinase Proteins 0.000 description 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 206010064912 Malignant transformation Diseases 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 206010028289 Muscle atrophy Diseases 0.000 description 1
- 102100030856 Myoglobin Human genes 0.000 description 1
- 108010062374 Myoglobin Proteins 0.000 description 1
- SUAKHGWARZSWIH-UHFFFAOYSA-N N,N‐diethylformamide Chemical compound CCN(CC)C=O SUAKHGWARZSWIH-UHFFFAOYSA-N 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 108091093105 Nuclear DNA Proteins 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 206010033799 Paralysis Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 108700039882 Protein Glutamine gamma Glutamyltransferase 2 Proteins 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 102100038095 Protein-glutamine gamma-glutamyltransferase 2 Human genes 0.000 description 1
- 108020004518 RNA Probes Proteins 0.000 description 1
- 239000003391 RNA probe Substances 0.000 description 1
- 230000004570 RNA-binding Effects 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 208000007660 Residual Neoplasm Diseases 0.000 description 1
- 230000018199 S phase Effects 0.000 description 1
- 108091081021 Sense strand Proteins 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 108700026226 TATA Box Proteins 0.000 description 1
- 108020005038 Terminator Codon Proteins 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 1
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 1
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 1
- 206010054094 Tumour necrosis Diseases 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 101000740510 Xenopus tropicalis Baculoviral IAP repeat-containing protein 5.2 Proteins 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- PMMURAAUARKVCB-UHFFFAOYSA-N alpha-D-ara-dHexp Natural products OCC1OC(O)CC(O)C1O PMMURAAUARKVCB-UHFFFAOYSA-N 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 230000019552 anatomical structure morphogenesis Effects 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 229940038444 antibody-based vaccine Drugs 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 230000005756 apoptotic signaling Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 238000007846 asymmetric PCR Methods 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 238000000376 autoradiography Methods 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012148 binding buffer Substances 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000003123 bronchiole Anatomy 0.000 description 1
- 235000010633 broth Nutrition 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 230000009702 cancer cell proliferation Effects 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 150000003943 catecholamines Chemical class 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 210000004671 cell-free system Anatomy 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- 208000026106 cerebrovascular disease Diseases 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 210000002987 choroid plexus Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000014107 chromosome localization Effects 0.000 description 1
- 238000002983 circular dichroism Methods 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 229960002424 collagenase Drugs 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 238000011254 conventional chemotherapy Methods 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000012136 culture method Methods 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 230000000093 cytochemical effect Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000001085 cytostatic effect Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- RGWHQCVHVJXOKC-SHYZEUOFSA-J dCTP(4-) Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)C1 RGWHQCVHVJXOKC-SHYZEUOFSA-J 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229940026692 decadron Drugs 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 230000002074 deregulated effect Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 238000012631 diagnostic technique Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000001085 differential centrifugation Methods 0.000 description 1
- 230000003292 diminished effect Effects 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000011978 dissolution method Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 238000013399 early diagnosis Methods 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 210000002308 embryonic cell Anatomy 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000004528 endothelial cell apoptotic process Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 210000003020 exocrine pancreas Anatomy 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 235000013861 fat-free Nutrition 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 230000003325 follicular Effects 0.000 description 1
- 201000003444 follicular lymphoma Diseases 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000003209 gene knockout Methods 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 230000009395 genetic defect Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 102000054766 genetic haplotypes Human genes 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- ZJYYHGLJYGJLLN-UHFFFAOYSA-N guanidinium thiocyanate Chemical compound SC#N.NC(N)=N ZJYYHGLJYGJLLN-UHFFFAOYSA-N 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 239000012133 immunoprecipitate Substances 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 229940032219 immunotherapy vaccine Drugs 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000010249 in-situ analysis Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- PBGKTOXHQIOBKM-FHFVDXKLSA-N insulin (human) Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 PBGKTOXHQIOBKM-FHFVDXKLSA-N 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 208000030776 invasive breast carcinoma Diseases 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 230000007040 lung development Effects 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 201000005243 lung squamous cell carcinoma Diseases 0.000 description 1
- 208000017830 lymphoblastoma Diseases 0.000 description 1
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L magnesium chloride Substances [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000036212 malign transformation Effects 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 102000006240 membrane receptors Human genes 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 210000002161 motor neuron Anatomy 0.000 description 1
- 230000036457 multidrug resistance Effects 0.000 description 1
- 229940031348 multivalent vaccine Drugs 0.000 description 1
- 230000020763 muscle atrophy Effects 0.000 description 1
- 201000000585 muscular atrophy Diseases 0.000 description 1
- 108091008800 n-Myc Proteins 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 210000000933 neural crest Anatomy 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000016273 neuron death Effects 0.000 description 1
- JPXMTWWFLBLUCD-UHFFFAOYSA-N nitro blue tetrazolium(2+) Chemical compound COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC(=CC=2)[N+]([O-])=O)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=C([N+]([O-])=O)C=C1 JPXMTWWFLBLUCD-UHFFFAOYSA-N 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000002997 ophthalmic solution Substances 0.000 description 1
- 230000005789 organism growth Effects 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229940127084 other anti-cancer agent Drugs 0.000 description 1
- 229940092253 ovalbumin Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 108010091748 peptide A Proteins 0.000 description 1
- 229940023041 peptide vaccine Drugs 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 230000001817 pituitary effect Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229940063179 platinol Drugs 0.000 description 1
- 230000004983 pleiotropic effect Effects 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 230000003334 potential effect Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000002947 procoagulating effect Effects 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000002250 progressing effect Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 230000002633 protecting effect Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000013777 protein digestion Effects 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000009396 radiation induced apoptosis Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000025053 regulation of cell proliferation Effects 0.000 description 1
- 230000010410 reperfusion Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 238000010008 shearing Methods 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- FQENQNTWSFEDLI-UHFFFAOYSA-J sodium diphosphate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]P([O-])(=O)OP([O-])([O-])=O FQENQNTWSFEDLI-UHFFFAOYSA-J 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 229940048086 sodium pyrophosphate Drugs 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 210000003594 spinal ganglia Anatomy 0.000 description 1
- 208000002320 spinal muscular atrophy Diseases 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 210000005127 stratified epithelium Anatomy 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000000516 sunscreening agent Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 235000019818 tetrasodium diphosphate Nutrition 0.000 description 1
- 239000001577 tetrasodium phosphonato phosphate Substances 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 230000002992 thymic effect Effects 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 229960001005 tuberculin Drugs 0.000 description 1
- 201000008827 tuberculosis Diseases 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 1
- 238000010396 two-hybrid screening Methods 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 230000004572 zinc-binding Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3015—Breast
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4747—Apoptosis related proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3023—Lung
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/303—Liver or Pancreas
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3046—Stomach, Intestines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3061—Blood cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3069—Reproductive system, e.g. ovaria, uterus, testes, prostate
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5011—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing antineoplastic activity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5014—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing toxicity
- G01N33/5017—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing toxicity for testing neoplastic activity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2510/00—Detection of programmed cell death, i.e. apoptosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Cell Biology (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Urology & Nephrology (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Pathology (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Toxicology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Tropical Medicine & Parasitology (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Reproductive Health (AREA)
- Pregnancy & Childbirth (AREA)
- Hospice & Palliative Care (AREA)
Description
本出願は、1996年11月20日に出願された、米国仮出願第60/031,435号に基づき、その開示は、本明細書中に参考として援用される。
発明の分野
本発明は、細胞アポトーシスを調節する分野、特にアポトーシスを阻害するために有用な薬剤の分野に関し、ならびにアポトーシスのインヒビターの発現によって媒介される状態に関与する診断学的および予防的なアッセイに関する。本発明は特に、仮にサービビン(Survivin)と命名された、新規なヒト遺伝子の同定に関する。サービビンは、特にガン細胞および胚細胞において、細胞アポトーシスを阻害するタンパク質である、サービビンをコードする。
発明の背景
プログラム細胞死(アポトーシス)による細胞増殖の調節は、発生および分化の間の組識ホメオスタシスを維持する(Raff, M.D.、Nature(1992)356:397-400;Vaux, D.L.ら、Cell(1994)76:777-779)。このプロセスは、進化的に保存された多段階のカスケードを含み(Oltvai, Z.ら、Cell(1994)79:189-192)、そしてアポトーシス性細胞死を促進するか、または中和するタンパク質によって制御される。アポトーシスはまた、細胞表面レセプター(Smith, Aら、Cell(1994)76, 959-962)、および関連のシグナル伝達物質(Tartaglia, L.A.ら、Immunol Today(1992)13:151-153)、プロテアーゼ遺伝子ファミリー(Martin, S.J.ら、Cell(1995)82:349-352)、細胞内第2メッセンジャー(Kroemer, G.ら、FASEB J(1995)9:1277-1287)、腫瘍抑制遺伝子(Haffner, R.ら、Curr Op Gen Dev(1995)5:84-90)、およびアポトーシス性の細胞死を中和するネガティブな調節タンパク質(Hockenbery, D.ら、Nature(1990)348:334-336)を含む。異常に増加したアポトーシスまたは異常に延長した細胞生存(Oltvai, Z.N.ら、Cell(1994)79:189-192)は、ヒト疾患(自己免疫異常、神経退行性のプロセス、およびガンを含む)の病因論に貢献し得る(Steller, H.,Science(1995)267:1445-1449);Thompson, C.B.、Science(1995)267:1456-1462)。
具体的には、例えば、アポトーシスのインヒビター、最も特に、bcl-2ファミリー(Reed、J.、J Cell Biol(1994)124:1-6、およびYang, E.ら、Blood(1996)88:386-401)は、成体(Hockenbery、D.ら、Proc Natl Acad Sci USA(1991)88:6961-6965)および胎児(LeBrun, D.ら(1993)142:743-753)の組識におけるリンパ球のホメオスタシスおよび形態発生を維持する。bcl-2の脱調節された発現はまた、細胞生存を異常に延長し、およびトランスフォーミング変異の反乱を容易にすることによって、ガンに関与している。
bcl-2に加えて、バキュロウイルスIAP遺伝子(Birnbaum, M.J.ら、J Virology(1994)68:2521-2528;Clem, R.J.ら、Mol Cell Biol(1994)14:5212-5222)に関連するアポトーシスのインヒビター新規な遺伝子ファミリーのいくつかのメンバーが、ショウジョウバエおよび哺乳動物の細胞において同定されてきた(Duckett, C.S.ら、EMBO J(1996)15:2685-2694;Hay, B.A.ら、Cell(1995)83:1253-1262;Liston, P.ら、Nature(1996)379:349-353;Rothe, M.ら、Cell(1995)83:1243-1252;Roy, N.ら、Cell(1995)80:167-178)。これらの分子は、進化的に高度に保存され;これらは、2つまたは3つの約70アミノ酸のアミノ末端のCys/HisバキュロウイルスIAP反復(BIR)において、およびRINGフィンガーと称される、カルボキシ末端の亜鉛結合ドメインによって、組織される類似の構造を共有する(Duckett, C.S.ら、EMBO J(1996)15:2685-2694;Hay, B.A.ら、Cell(1995)83:1253-1262;Liston, P.ら、Nature(1996)379:349-353;Rothe, M.ら、Cell(1995)83:1243-1252;Roy, N.ら、Cell(1995)80:167-178)。IAPタンパク質の組換え発現は、インビトロで、種々の刺激によって誘導されるアポトーシスをブロックし、(Duckett, C.S.ら、EMBO J(1996)15:2685-2694;Liston, P.ら、Nature(1996)379:349-353)、およびインビボで、ショウジョウバエの目の発生的に調節されるモデルにおいて、異常に延長した細胞生存を促進する(Hay, B.A.ら、Cell(1995)83:1253-1262)。最後に、アポトーシスのIAPニューロンインヒビターであるNAIPにおける欠失が、脊髄の筋肉萎縮を伴う患者の75%において報告されており、従って、ヒト疾患におけるこの遺伝子ファミリーの潜在的な役割を示唆する(Roy, N.ら、Cell(1995)80:167-178)。
IAPファミリーのメンバーに関連する、アポトーシスの種々のインヒビターをコードする核酸の治療学的なおよび診断学的な使用は、特許文献において記載されている。例えば、国際特許出願第WO97/06255号、同第WO97/26331号、および同第WO97/32601号を参照のこと。特に、このような遺伝子および遺伝子産物の使用は、以下に考察される新規なタンパク質およびそれをコードする核酸について意図される。
近年、構造的に独特なIAPアポトーシスインヒビターをコードする、サービビンと称される、新規な遺伝子が同定された。サービビンは、単一のBIR、およびRINGフィンガーの代わりに高度に荷電されたカルボキシ末端のコイルド-コイル領域を含む、約16.5kDの細胞質タンパク質であり、これは、B細胞前駆体に移された場合、増殖因子(IL-3)の投与中止によって誘導されるアポトーシスを阻害する(Ambrosini, G.ら、Nature Med.(1997)3:917-921)。bcl-2または他のIAPタンパク質とは異なり、サービビンは成体組識において検出可能ではないが、インビボで、肺、結腸、胸、膵臓、および前立腺の最も一般的なヒトガンの全てにおいて、ならびに高い悪性度分類の非ホジキンリンパ腫の約50%において、優勢に発現されるようになる。興味深いことに、サービビン遺伝子のコード鎖は、エフェクター細胞プロテアーゼレセプター-1(EPR-1)の配列(Altieri, D.C., FASEB J(1995)9:860-865)に高度に相同であったが、反対の方向に配向され、従って頭−頭配座において重複される2つの別々の遺伝子の存在を示唆する。
本発明は、EPR-1にほぼ同一であるが、反対の方向に配向される、新規なヒト遺伝子の同定に基づく。サービビンと称される、アンチセンスEPR-1遺伝子産物は、アポトーシスのインヒビターのIAPファミリーのメンバー(Duckett,C.S.ら、EMBO J(1996)15:2685−2694;Hay, B.A.ら、Cell(1995)83:1253-1262;Liston, P.ら、Nature(1996)379:349−353;Rothe, M.ら、Cell(1995)83:1243−1252;Roy, N.ら、Cell(1995)80:167−178)に関係が遠いメンバーであり、そして活発に増殖する形質転換された細胞において、およびインビボで一般的なヒトガンにおいて、優勢に発現されるが、近傍の正常な細胞においては発現されない。機能的に、その天然のアンチセンスEPR-1転写物をアップレギュレートすることによるサービビン発現の阻害は、広範囲に及ぶアポトーシスを生じ、細胞増殖を減少した。
発明の要旨
本発明は、ほとんどのガン細胞において発現され、および細胞アポトーシスを阻害するタンパク質(本明細書中以後、サービビンまたはサービビンタンパク質)の単離および同定に、一部、基づく。この観察に基づいて、本発明は、精製されたサービビンタンパク質を提供する。
本発明はさらに、サービビンタンパク質をコードする核酸分子を提供する。このような核酸分子は、単離された形態においてであり得るか、または発現制御エレメントもしくはベクター配列に作動可能に連結され得る。
本発明はさらに、サービビンファミリーのタンパク質の他のメンバーを同定する方法を提供する。具体的には、サービビンの核酸配列は、プローブとして、またはPCRプライマーを作製するために、サービビンファミリーのタンパク質の他のメンバーをコードする核酸分子を同定するための方法において、使用され得る。
本発明はさらに、サービビンに結合する抗体を提供する。このような抗体は、ポリクローナルまたはモノクローナルのいずれかであり得る。抗サービビン抗体は、多様な診断学的形式において、および種々の治療学的方法のために、使用され得る。
本発明はさらに、サービビン結合パートナーを単離するための方法を提供する。サービビン結合パートナーは、捕獲プローブとしてサービビンタンパク質を用いて、単離される。あるいは、サービビンは、発現ライブラリーをスクリーニングし、そしてサービビンタンパク質に結合するタンパク質をコードする遺伝子を同定するために、酵母ツーハイブリッド系において餌(bait)として使用され得る。これらの方法によって単離された結合パートナーは、抗体を調製するにおいて有用であり、および薬剤開発についての標的としてもまた作用する。
本発明はさらに、サービビンと結合パートナーとの会合をブロックまたは調節し得る薬剤を同定するための方法を提供する。具体的には、サービビン、またはそのフラグメント、および結合パートナーと、試験薬剤とを接触し、そして試験薬剤が、結合パートナーへのサービビンタンパク質の結合をブロックまたは減少するか否かを測定することによって、サービビンと結合パートナーとの会合を、ブロック、減少、またはそうでなければ調節する能力について、薬剤が試験され得る。
本発明はさらに、サービビンとその結合パートナーの1つ以上との会合を、減少またはブロックするための方法を提供する。具体的には、サービビンと結合パートナーとの会合は、サービビン、または結合パートナーと、結合パートナーへのサービビンの結合をブロックする薬剤とを接触することによって、ブロックまたは減少され得る。方法は、サービビンに、または結合パートナーに結合する薬剤を利用し得る。
本発明はさらに、細胞内のサービビンの発現を調節する方法を提供する。細胞内のサービビンの発現は、サービビンの産生を生成または阻害するように調節され得る。
サービビン/結合パートナーの会合、またはサービビンの発現を阻害することは、サービビンを必要とする生物学的または病理学的プロセスを調節するために使用され得る。例えば、サービビン産生を減少する方法は、腫瘍細胞のアポトーシスを誘導する。サービビン産生の刺激は、細胞または組識の培養能力を拡張する手段として使用され得る。
サービビンまたはサービビン/結合パートナー相互作用を必要とする生物学的および病理学的プロセスはさらに、遺伝子治療方法を用いて調節され得る。生物内のさらなる遺伝子操作は、動物モデルにおけるサービビン遺伝子の発現またはサービビンタンパク質の産生を改変するために使用され得る。例えば、サービビン遺伝子は、遺伝子欠損を矯正するために改変され得;サービビン活性のペプチド調節因子は、標的細胞へ調節因子をコードする核酸分子を導入するための遺伝子形質転換法を用いて、標的細胞内に産生され得る、など。アンチセンスおよび三重らせんの治療および介入についての核酸の使用は、特に意図される。
本発明はさらに、サービビンを必要とする病理学的プロセスの重篤度を低減する方法を提供する。サービビンの発現または結合パートナーとのサービビンの会合は、サービビン媒介性の生物学的プロセスのために必要とされるので、サービビンの発現、サービビン活性、またはサービビンと結合パートナーとの会合をブロックする薬剤は、治療学的方法において使用され得る。
【図面の簡単な説明】
図1は、相補的なEPR-1遺伝子の同定を示す。A、B.染色体の位置。EPR-1 cDNAとのハイブリダイゼーションによって選択された、ジゴキシゲニン標識化ヒトP1ゲノムクローンは、50%ホルムアミド、10%デキストラン硫酸、および2×SSC中のフィトヘマグルチニン刺激化PBMCから単離された中期の染色体とインキュベートした。EPR-1ハイブリダイズ遺伝子は、単色標識において、E群染色体の長いアームにマップされ(A、緑色染色)、そしてプローブD17Z1(第17染色体のセントロメアに特異的)との2色の染色において(B、赤染色)、第17染色体の長いアームに(B、緑色染色)、バンド17q25にマップされた。C.アンチセンスEPR-1遺伝子のマップにマップされた。14796bpにわたるコンティグは、pBSKS-にサブクローン化された2つのEPR-1ハイブリダイズP1クローンに由来し、そして両方の鎖に対して完全に配列決定された。マップの配向は、イントロン−エクソン境界の位置に関して5’→3’である(以下を参照のこと)。エクソンは、黒塗りの四角であり、エクソン1の上流の推定のCpG島は、白抜きの四角である。翻訳開始コドン(ATG)が示される。制限部位は:B、BamHI、H、HindIII;P、PstI;S、SmaI;X、XbaIである。D.アンチセンスEPR-1遺伝子のイントロン−エクソン境界。塩基対におけるイントロン−エクソン境界の位置は、括弧内に示される。
図2は、EPR-1関連配列の複雑性および進化的な保存を示す。A.ヒトゲノムDNAのサザンブロット。サンプルは、示される制限酵素で消化され、GeneScreenナイロンメンブレンに移され、そして5×SSC、0.5% SDS、5×デンハルト、および0.1%ピロリン酸ナトリウム中で、65℃にて、EPR-1 cDNAとハイブリダイズされた。矢印によって示される放射能バンド(7.6kb BamHIフラグメント、7.5kb XbaIフラグメント、ならびに15、7.5、6.4、および3.7kbのHindIIIフラグメント)は、図1CにおけるアンチセンスEPR-1遺伝子に由来しない。B.パルス化フールドゲル電気泳動のサザンブロット。高分子量のヒトゲノムDNAは、示される制限酵素で消化され、75秒間のパルス時間を伴う、20時間、200Vでのパルス化フィールドゲル電気泳動によって分離され、ナイロンメンブレンに移され、そしてAにおいて記載されるように、EPR-1 cDNAとハイブリダイズされた。C.複数の種のサザンブロット。示された種からの、EcoRI消化されたゲノムDNAは、Aに記載されるように、EPR-1 cDNAの3’548bpフラグメントとハイブリダイズされた。全てのパネルについて、kbでの分子量マーカーが、左側に示される。
図3は、センス/アンチセンスEPR-1転写物の一致しない組識分布を示す。ノーザンハイブリダイゼーションが、60℃で14時間、5×SSPE、10×デンハルト溶液2% SDS、100mg/ml変性サケ精子DNAにおいて1本鎖の特異的プローブを用いて、複数の組織の成体または胎児のmRNAブロットに対して行われた。2×SSCにおいて60℃での、および0.2×SSCにおいて22℃での、洗浄後、放射能バンドは、オートラジオグラフィーによって可視化された。A.EPR-1特異的1本鎖プローブ。B.アンチセンスEPR-1特異的1本鎖プローブ。C.コントロールアクチンプローブ。kbでの分子量マーカーが、左側に示される。
図4は、サービビンの配列分析および細胞株における発現を示す。A.アンチセンスEPR-1遺伝子産物の予測される翻訳(サービビン)(配列番号34)。B.Clustal法による、サービビンにおける(配列番号8および21)、ならびに他のIAPタンパク質における、BIRの配列アラインメント。IAPタンパク質は、アクセス番号、L49433(配列番号9および22)、TNFR2-TRAFシグナリング複合体会合IAP;L49441(配列番号10および23)、アポトーシス2インヒビター(ショウジョウバエ);P41436(配列番号11および24)および、Cydia pomonella顆粒症ウイルスからのIAP遺伝子;P41437(配列番号12および25)、Orgya pseudotsugata核多角体病ウイルスからのIAP遺伝子;U19251(配列番号13および26)、NAIP、アポトーシスのニューロンインヒビター;U32373(配列番号14および27)、ショウジョウバエメラノガスター(melanogaster)からのIAP様タンパク質ILP;U32974(配列番号15および28)、ヒトIAP様タンパク質ILP;U36842(配列番号16および29)、アポトーシスのマウスインヒビター;U45878(配列番号17および30)、アポトーシス1のヒトインヒビター;U45879(配列番号18および31)、アポトーシス2のヒトインヒビター;U45880(配列番号19および32)、アポトーシスのX連結インヒビター;U45881(配列番号20および33)、アポトーシスのショウジョウバエインヒビターによって同定される。保存される残基は、四角で囲まれ、サービビンとNAIP(U19251)(配列番号13および26)との間の同一性は、四角で囲まれおよび編み掛けされる。C.抗サービビン抗体JC700とのイムノブロッティング。細胞株HEL(赤白血病)DaudiおよびJY(Bリンパ腫)、THP-1(単球)、JurkatおよびMOLT13(T白血病)、または非形質転換ヒト肺Lu18線維芽細胞、HUVECもしくはPBMCの、SDS抽出物のタンパク質基準化アリコートは、5〜20%のSDS勾配ゲル上で電気泳動により分離され、Immobilonに移され、そしてコントロール非免疫ウサギIgG(RbIgG)、または抗サービビン抗体JC700(サービビン)でイムノブロットされた。タンパク質バンドは、アルカリホスファターゼ結合ヤギ抗ウサギIgGおよびテトラゾリウム塩によって可視化された。kDaでの分子量マーカーが、左側に示される。
図5は、細胞の増殖/分化によるサービビン発現の調節を示す。HL-60細胞は、0.1mMビタミンD3+17.8mg/mlインドメタシンとの、72時間の培養によって、成熟単球表現型に、末端的に分化した。ビタミンD3分化の前のまたは後のサービビン発現は、JC700抗体とのイムノブロッティングによって、またはサービビン特異的1本鎖プローブとのノーザンハイブリダイゼーションによって、検出された。RbIgG、コントロール非免疫ウサギIgG。kDaでのタンパク質分子量マーカー、およびリボソームバンドの位置が、各ブロットの左側に示される。
図6は、インビボでのヒトガンにおけるサービビンの過剰発現を示す。A.アフィニティー精製された抗サービビン抗体JC700(20μg/ml)での、ヒト肺腺ガン腫の免疫組識化学的染色。B.免疫化サービビン3-19ペプチドでの予備吸収による、肺腺ガン腫のJC700染色の阻害。C.鱗状肺細胞ガン腫におけるサービビンの免疫組識化学的発現(しかし、隣接する肺の正常な腺上皮においては発現しない)(C、矢印)。D.鱗状肺細胞ガン腫における、サービビン特異的リボプローブとの、サービビンmRNAのインサイチュハイブリダイゼーション。E.JC700との免疫組識化学による、膵臓腺ガン腫におけるサービビンの発現。F.免疫組識化学による、サービビン発現についてネガティブな、正常な膵臓。G.結腸腺ガン腫におけるサービビンmRNA発現のインサイチュハイブリダイゼーション(しかし、H、隣接する非新生物結腸腺上皮においては発現しない(H、矢印))。倍率は、×200である(ただし、Gは×400)。
図7は、アポトーシス/増殖に対するサービビンの効果を示す。A.サービビン発現のEPR-1調節。HeLa細胞は、エレクトロポレーションによって、コントロールベクターpML1またはEPR-1 cDNA(これは、サービビンに対してアンチセンスである)でトランスフェクトされ、そしてハイグロマイシン(0.4mg/ml)において選択された。ベクターコントロールHeLa細胞(Vector)またはサービビンアンチセンストランスフェクト体(Antisense)のアリコートは、200mM ZnSO4で誘導されて界面活性剤で可溶化され、そして抗サービビンJC700抗体でイムノブロットされた。分子量マーカーが、左側に示される。B.アポトーシスに対するサービビンの効果。サービビンアンチセンストランスフェクト体(1、2)、またはベクターコントロールHeLa細胞(3、4)を、24時間、0% FBS中のZn2+イオンで誘導し、そして3’OH DNA末端のTdT触媒化dUTP標識およびイムノペルオキシダーゼ(1、3)を用いるAptoTag法によって、またはヘマトキシリン−エオシン(HE)(2、4)によって、染色された。1.血清涸渇されたサービビンアンチセンストランスフェクト体におけるApto Tag染色によって検出された顕著な核DNAフラグメント化;2.アンチセンストランスフェクト体のHE染色は、多数のアポトーシス体の存在を示す(矢印);3.ベクターコントロールHeLa細胞のApto Tag染色は、いくつかのまばらなアポトーシス細胞を検出する(矢印);4.ベクターコントロールHeLa細胞のHE染色。矢印は、単一のアポトーシス体を示す。倍率、×400.C.細胞増殖に対するサービビンの効果。2万個のベクターコントロールのHeLa細胞(Vector)またはサービビンアンチセンストランスフェクト体(Antisense)が、24ウェルプレートに播種され、ZnSO4で誘導され、示される時点で採集され、そして細胞集団は、直接的な細胞計数によって、顕微鏡によって測定された。データは、7回の独立した測定のうちの代表的な実験の反復の平均±SEMである。
図8は、HL-60細胞におけるサービビンの発現を示す。HL-60細胞は、サービビン発現についてのウェスタンブロットおよびノーザンブロットを介して試験された。
図9は、サービビンの構造分析を表す。サービビンタンパク質は、Chou-Fasman、Garnier-Robson、Kyle-Doolittle、Eisenberg、Karplus-Schultz、Jameson-Wolf、およびEminiの分析法を用いて、分析された。
図11は、ELISAおよびイムノブロッティングによる、サービビンの発現、および抗サービビンmAb 8E2の生成および特徴づけを示す。
図12は、サービビンの部位特異的変異誘発、およびアポトーシス阻害に関与する重要な機能的残基の同定を示す。
図13は、内皮細胞アポトーシスに対する、サービビン添加の細胞防御的な効果を示す。
図14は、サービビンの存在が、神経芽腫において、ネガティブな推定の予後因子であることを示す。
図15は、サービビンの存在が、高い悪性度分類の非ホジキンリンパ腫において、ネガティブな推定の予後因子であることを示す。
図16は、炎症性および細胞増殖抑制性のサイトカインによって誘導されるサービビンのダウンレギュレーションを示す。
図17は、過酸化水素によって、NIH3T3細胞において誘導されるアポトーシスに対する、サービビン構築物またはXIAPの効果を示す。
好ましい実施態様の詳細な説明
I.一般的な記載
本発明は、腫瘍細胞において発現され、および細胞アポトーシスを阻害する新規なタンパク質(本明細書中以後、サービビンタンパク質またはサービビン)の同定に、一部、基づく。サービビンはまた、胚組識において発現されることが、見出される。
サービビンタンパク質は、薬剤として使用され得るか、または薬剤についての標識として作用し得、薬剤は、細胞アポトーシスのサービビン媒介性の阻害を阻害もしくは刺激するために、例えば、異常な細胞増殖をブロックするために、または培養における細胞増殖を延長するために、使用され得る。
本明細書中で使用されるように、アポトーシスの調節は、所定の細胞集団において、そうでなければアポトーシスを受ける細胞の数を増加または減少することを意味する。これは、細胞に存在するサービビンの量を増加もしくは減少することによって、またはサービビンの活性を増加もしくは減少することによって、達成され得る。好ましくは、アポトーシスが調節されるべき所定の細胞集団は、有益な効果がその調節から生じる腫瘍もしくは他の組識、または細胞の群において見出される。また、好ましくは、所定の細胞集団における、そうでなければアポトーシスを受ける細胞の数の増加または減少は、この集団における細胞のうちの、少なくとも約10%、20%、40%、またはより好ましくは少なくとも約50%である。
本発明はさらに、サービビンに結合するタンパク質を単離するための方法の開発に基づく。以下に考察されるようなサービビンタンパク質またはサービビンのフラグメントに基づくプローブは、サービビン結合タンパク質を単離するための捕獲プローブとして使用される。ドミナントネガティブタンパク質、これらのタンパク質をコードするDNA、これらの結合タンパク質に対する抗体、これらのタンパク質のペプチドフラグメント、またはこれらのタンパク質の模倣物は、サービビン機能を影響するために細胞へ導入され得る。さらに、これらのタンパク質は、サービビン機能を調節するための新規な治療学を発見するための、合成小分子および組み合わせ化合物のライブラリー、または天然の化合物ライブラリーのスクリーニングについての新規な標的を提供する。
II.サービビンの同定、一般的な特徴づけ、および組識分布
本発明は、サービビンと称される、アポトーシスのインヒビターのIAPファミリーの新規なメンバーの、染色体17q25における同定に基づき、これはガン細胞増殖に対して選択的な利点を付与し得る。サービビン遺伝子の関連の特徴は、その発生的および分化的に調節された発現、第Xa因子レセプターEPR-1とのそのほとんど同一のおよび相補的なDNA配列、ならびに一般的なヒト悪性腫瘍におけるその豊富なインビボ発現(しかし、隣接の非新生物集団においては発現しない)を含む。以下に記載されるように、EPR-1 mRNAのメタロチオネイン誘導による標的化サービビン発現は、アポトーシス、およびHeLa細胞トランスフェクト体の増殖の阻害を生じる。
ホメオスタシスへのそれらの貢献に加えて、血液プロテアーゼについての細胞レセプターは、胚発生学的な発生(Connolly, A.J.ら、Nature(1996)381:516-519)および脈管形成(Carmeliet, P.ら、Nature(1996)383:73-75)において非常に重要な役割を果たす、多面発現性のシグナル伝達分子として、近年明らかになった。この情況において、サービビン遺伝子は、EPR-1(凝血促進性の活性(Altieri, D.C.、FASEB J(1995)9:860-865)、およびT細胞活性化(Duchosal, M.A.ら、Nature(1996)380:352-356)に貢献する第Xa因子についてのレセプター)であるEPR-1のcDNAとのハイブリダイゼーションによって単離された。サービビンコード配列は、EPR-1 cDNAとほとんど同一であることが見出されたが、その配向は、イントロン−エクソン境界でのコンセンサススプライス部位の位置(Padgett, R.A.ら、Ann Rev Biochem(1986)55:1119-1150)について、アンチセンスEPR-1鎖に対して明白に指定された。他方、EPR-1「センス」鎖の真正物は、哺乳動物細胞が、EPR-1 cDNAでまたはキメラEPR-1構築物でトランスフェクトされた場合(Ambrosini, G.ら、J Biol Chem(1996)271:1243-1248、およびAltieri, D.C.、FASEB J(1995)9:860-865)、抗EPR-1 mAbによって認識され、そして特定のおよび飽和可能な反応において第Xa因子に結合したことが、以前の研究において実証された。
これらの知見は、反対の方向に配向される、複数の、高度に相同な、EPR-1転写物の存在によって、一致され得た。EPR-1 mRNAの不均一性、およびサザンハイブリダイゼーションの複雑なパターンは、この仮説を支持する。以前に、2本鎖EPR-1プローブは、EPR-1+細胞のmRNAにおいて、1.9、3.4、および約1.5kbの、3つの強力にハイブリダイズするバンドを検出した(Altieri, D.C.、FASEB J(1995)9:860-865)。ここで、1本鎖の特異的プローブは、複数の成熟なおよびポリアデニル化されたEPR-1関連メッセージの存在を確認し、そして1.9および3.4kbバンドは、2つの非常に調節された、アンチセンスEPR-1転写物に対応し、一方1.5kbバンドは、1.2kbとしてより正確に規定される、真性のEPR-1コードメッセージと一致したことを示した。1.9kbアンチセンス転写物は、本明細書中に記載されるサービビン遺伝子から明らかに生じたが、1.2kbの「センス」EPR-1メッセージをコードする遺伝子は未だ同定されていない。
しかし、(i)サービビン遺伝子に関連しない、いくつかのゲノムEPR-1ハイブリダイズバンドの存在、(ii)種々の種におけるEPR-1配列の異なる制限パターン、および(iii)ポジティブ(アクセス番号W46267)、またはネガティブ(アクセス番号W34764、W83810、T29149)EPR-1鎖をマッチングする(P=0.018〜7×10-11)多数の発現される配列タグデータベース登録は、全体で、ここで記載される遺伝子に対して反対の方向に配向され、および以前に特徴付けられた第Xa因子レセプター(Altieri, D.C.、FASEB J(1995)9:860-865)をコードする、少なくとも第2の、高度に関連する、EPR-1遺伝子の存在を示唆する。
類似の状況は、EPR-1配列を含む遺伝子複製事象から生じ得る。興味深いことに、染色体17q25上に検出される単一のハイブリダイゼーションシグナル、および高分子量のゲノムDNAのサザンブロットにおいて同定された単一のハイブリダイズハンドは、反対の方向に潜在的に配向されるEPR-1関連配列が、75〜130kbの物理的間隔内で、密接に接近して隣接し得ることを示唆する。
反対の方向で配向される複数のEPR-1転写物の存在は、天然のアンチセンスによる相互調節機構を意味する。これは、インビボでの発生中の組識または成体組識における、およびHL-60細胞の末端分化の間の、センスおよびアンチセンスEPR-1メッセージの優勢な不一致および相互に排他的な分布に一致する。アンチセンス調節は、原核生物において共通であるが(Green, P.J.ら、Annu Rev Biochem(1986)55:569-597)、益々多くの真核生物遺伝子産物が、遺伝子調節に潜在的に関与する機能的なアンチセンス転写物の出現について近年特徴付けられており、塩基性線維芽細胞増殖因子(Kimmelman, D.ら、Cell(1989)59:687-696;Murphy, P.R.ら、Molecular Endocrinology(1994)8:852-859)a1(I)コラーゲン(Farrell, C.M.ら、J Biol Chem(1995)270:3400-3408およびLukens、1995)、n-myc(Krystal, G.W.ら、Mol Cell Biol(1990)10:4180-4191)、c-myc(Celano, P.ら、J Biol Chem(1992)267:15092-15096)、p53(Khochbin, S.ら、EMBO J(1989)8:4107-4114)、c-erbAa(Lazar、M.A.ら、Mol Cell Biol(1989)9:1128-1136)、およびCD3ζ/η/θ遺伝子座(Lerner, A.ら、J Immunol(1993)151:3152-3162)を含む。
以下に記載されるように、機能的なアンチセンスによって調節されるEPR-1/サービビン遺伝子のバランスの存在は、HeLa細胞トランスフェクト体において、EPR-1「センス」鎖のメタロチオネイン誘導性の転写が、サービビンの発現を抑制し、そしてアポトーシス/細胞増殖を十分に影響した場合、実証された(以下を参照のこと)。これらの実験について使用されたEPR-1が翻訳開始コドンを欠損したので、この調節機構は、EPR-1とサービビンとの間の潜在的なタンパク質会合に起因しなかった。さらなる実験は、細胞増殖を阻害するサービビンアンチセンスの能力を評価した。これは、lacZレポート化プラスミドとサービビンアンチセンスとを一過性に同時トランスフェクトし、そしてβ-ガラクトシダーゼ発現細胞における、トランスフェクションの48時間後の細胞生存性を測定することによって行われた。結果は、サービビンアンチセンストランスフェクト体の生存性が、空のベクターでトランスフェクトされたコントロール細胞の20%未満であったことを示した。HeLa細胞において同様に同時トランスフェクトされた、ICAM-1(細胞内接着分子-1)のコントロールアンチセンスは、効果的でなかった。
サービビンは、EPR-1にアミノ酸配列相同性を有しない、142アミノ酸(約16.5kDa)の小タンパク質であることが見出され、アポトーシスのIAPインヒビター(Duckett, C.S.ら、EMBO J(1996)15:2685-2694;Hay, B.A.ら、Cell(1995)83:1253-1262;Liston, P.ら、Nature(1996)379:349-353;Rothe, Mら、Cell(1995)83:1243-1252;Roy, N.ら、Cell(1995)80:167-178)において見出される、BIR相同ドメイン(Birnbaum, M.J.ら、J Virology(1994)68:2521-2528;Clem, R.J.ら、Mol Cell Biol(1994)14:5212-5222)の存在のためにサービビンと称された。全体の配列保存、カルボキシ末端RINGフィンガーの不在、および単一の、部分的に保存された、BIRドメインの存在に基づいて、サービビンは、IAPファミリーの最も離れて関連するメンバーであり、NAIPと最も高い程度の類似性を共有する(Roy, N.ら、Cell(1995)80:167-178)。従って、bcl-2または他のIAPタンパク質とは異なり、サービビンは、成体組識において検出可能ではないが、肺、結腸、胸、膵臓、および前立腺の最も一般的なヒトガンの全てにおいて、ならびに高い悪性度分類の非ホジキンリンパ腫の約50%において、インビボで顕著に発現されるようになる。さらに他のIAPタンパク質とは異なり(Deveraux, Q.ら、Nature(1997)388:300-304)、サービビンは、無細胞系においてカスパーゼ(caspase)に結合しない(Roy,Nら、Blood(1997)595:2645)。
インビトロでの(Duckett, C.S.ら、EMBO J(1996)15:2685-2694;Liston, P.ら、Nature(1996)379:349-353)およびインビボでの(Hay, B.A.ら、Cell(1995)83:1253-1262)IAPタンパク質の抗アポトーシスタンパク質と一致して、EPR-1転写物(これは、当然ながらサービビンに対するアンチセンスである)によるサービビン発現の阻害は、HaLa細胞トランスフェクト体におけるインサイチュでのヌクレオソーム間のDNAフラグメント化により測定されるように、増加されたアポトーシスを生じた。RINGフィンガーがないIAPタンパク質が、アポトーシスを中和する能力は、NAIPによって媒介されるアポトーシスの抑制によって(Liston, P.ら、Nature(1996)379:349-353)、およびRINGフィンガーの欠失後の、ショウジョウバエIAPタンパク質のインビボ機能獲得によって(Hay, B.A.ら、Cell(1995)83:1253-1262)実証されるように、先例がないわけではない。抗アポトーシス遺伝子は、異常に長期間生存する細胞におけるガン遺伝子変異の蓄積を有利にすることによって、細胞増殖において間接的な役割を果たすと考えられるが(Reed, J.C.、J Cell Biol(1994)124:1-6)、サービビンのダウンレギュレーションは、HeLa細胞増殖の十分な阻害を生じた。これは、アポトーシスによって高レベルのアンチセンス転写物を発現するHeLa細胞の消失に由来し得るが、腫瘍細胞増殖の類似の減少が、bcl-2のアンチセンス阻害後にインビボで報告されている(Reed, J.C.ら、Proc Natl Acad Sci USA(1990)87:3660-3664)。
IAPタンパク質が、細胞増殖においてより一般的な役割を果たし得るが、アポトーシス阻害に排他的に制限されない可能性が、以前に提唱されている。Rotheらは、2つのIAPタンパク質(cIAP)におけるアミノ末端BIRが、アポトーシスシグナル伝達(Tartaglia, L.A.ら、Immunol Today(1992)13:151-153)ではなく、細胞増殖および生存に主に影響を与える分子である、75kDaのTNFレセプターに会合されるシグナル伝達因子(Rothe, M.ら、Cell(1995)83:1243-1252)と物理的に相互作用することを、近年、実証した。サービビンがシグナル伝達分子(Rothe, M.ら、Cell(1995)83:1243-1252)に物理的に結合されるか否かは知られていないが、他のIAPタンパク質と比較されるように、そのBIRの構造的多様性(Duckett, C.S.ら、EMBO J(1996)15:2685-2694;Hay, B.A.ら、Cell(1995)83:1253-1262;Liston, P.ら、Nature(1996)379:349-353;Rothe, M.ら、Cell(1995)83:1243-1252;Roy, N.ら、Cell(1995)80:167-178)は、アポトーシス阻害/細胞増殖のその特定の機構に潜在的に関連する、超分子相互作用に特性を付与し得る。
プログラム細胞死(アポトーシス)の脱調節(dysregulation)は、ガンを含む種々のヒト疾患の病理学に貢献する主な機構として、近年、明らかになってきた(Steller, H.、Science(1995)267:1445-1449;Thompson, C.B.、Science(1995)267:1456-1462)。新形成における抗アポトーシス遺伝子の影響は、濾胞性リンパ腫におけるbcl-2の役割(Korsmeyer, S.J.、Blood(1992)80:879-886)によって強調されるが、ガンにおけるIAPタンパク質の潜在的な分布は、以前には調査されていなかった。この情況において、サービビンの最も目立つ特徴の1つは、活発に増殖する形質転換された細胞株における、およびインビボで肺、結腸、膵臓、および胸の最も一般的なヒト悪性腫瘍の全てにおける(しかし、隣接の非新生物集団においては発現しない)、その豊富な発現である。複数のヒトガンにおけるこの分布は、新生物におけるアポトーシス/細胞増殖機構における、この分子の基本的な役割を、表示し得る。bcl-2の範例との類似によって、ガンにおけるサービビンの過剰発現は、異常なプログラム細胞生存(Veis, D.J.ら、Cell(1993)75:229-240)、化学療法誘導性のアポトーシスに対する増加された耐性(Miyashita、T.ら、Blood(1993)81:151-157)を導き得、および上述に報告されるインビトロ研究によって示唆されるように、形質転換された細胞の増殖について直接的な利点を指揮(lead in)し得る。
他方、インビボでの正常なPBMCおよび良性の乳腺ガンにおけるその存在について(未発表の観察)、サービビン発現は、悪性の形質転換のマーカーとして、それ自身解釈され得ないが、ある刺激に対するより一般的な、発生または細胞型特異的応答を反映し得る。このことは、インビボでの、正常な胚発生(本発明者らの未発表の観察)および胎児発生の間のサービビンの存在、ならびに増殖が阻止された細胞型(すなわち、ビタミンD3で処理されたHL-60)、および末端的に分化された組織における迅速なその消失と一致する。成体の成熟組識において構成的に見出される他のIAPタンパク質(Duckett, C.S.ら、EMBO J(1996)15:2685-2694;Liston, P.ら、Nature(1996)379:349-353;Rothe, M.ら、Cell(1995)83:1243-1252)とは異なり、その発現のパターンは、胎児組識におけるbcl-2の分布(LeBrun, D.P.ら、Am J Pathol(1993)142:743-753)、およびアポトーシスに対する感受性と相関する、分化された細胞におけるその制限された存在(Hockenbery, D.M.ら、Proc Natl Acad Sci USA(1991)88:6961-6965)を暗示する。
まとめると、これらの知見は、インビボでの、IAPタンパク質とガン細胞との間の新規な関連物として、サービビンを同定する。以下に示されるデータの重要な意味は、EPR-1の発現に集中される(Altieri, D.C.FASEB J(1995)9:860-865)、正常な細胞調節機構を操作することにより、この強力な抗アポトーシス遺伝子の効果を平衡する可能性である。次いで、サービビンを標的化することは、形質転換された細胞の増殖についての選択的な利点を除去し得、および化学療法誘導性のアポトーシスに対するガン細胞の感受性を増加するために、治療学的に有益である。同じ方針に沿って、多型マーカーの同定およびEPR-1/サービビン遺伝子座内またはその周辺の伸長されたアプロタイプ(aplotype)の構築は、化学療法に対する感受性の集団遺伝学に対する、新しい洞察を提供し得る。
III.特定の実施態様
A.サービビンタンパク質
本発明は、単離されたサービビンタンパク質、ならびにサービビンタンパク質の対立遺伝子改変体、およびサービビンタンパク質の保存的なアミノ酸置換物を提供する。本明細書中で使用されるように、サービビンタンパク質(またはサービビン)は、図4に示されるヒトサービビンのアミノ酸配列を有するタンパク質をいう。用語「サービビンタンパク質」はまた、サービビンの天然に存在する対立遺伝子変異体、上述で具体的に引用されるアミノ酸配列よりもわずかに異なるアミノ酸配列を有する、天然に存在するタンパク質を含む。対立遺伝子改変体は、上述で引用されるアミノ酸配列よりもわずかに異なるアミノ酸配列を保有するが、細胞アポトーシスを阻害するために必要な能力をなお有する。
本明細書中で使用されるように、サービビンファミリーのタンパク質は、ヒトに加えて、生物から単離されているサービビンタンパク質をいう。サービビンファミリーの他のメンバーを同定および単離するために使用される方法は、以下に記載される。
サービビンは、IAP(阻害性アポトーシスタンパク質)ファミリーのタンパク質のメンバーである。しかし、サービビンは、有意な方法において、他のIAPタンパク質から異なる独特なサブファミリーのIAPタンパク質の第1のメンバーである。サービビンとこの遺伝子ファミリーの他のメンバーとの間の、BIRモジュールにおける相同性および配列保存性にも関わらず、サービビンファミリーのタンパク質のメンバーに対して独特な、重要な構造的差異がある。第一に、任意の他のIAPタンパク質とは異なり、サービビンはわずか1つのBIRモジュールを有する(他の分子のほとんどは、2〜3個有する)。さらに、サービビンは、カルボキシ末端のRINGフィンガーを含まないが、その代わりに予測されるコイルドコイルを有する。IAPファミリーにおけるニューロンアポトーシス阻害性タンパク質(NAIP)は、RINGフィンガーを欠損するが、カルボキシ末端のコイルドコイルを含まない。最後に、サービビンと他のIAPタンパク質との間にDNA配列類似性は存在しない(サービビンに対して設計されたPCRプライマーは、他のIAPタンパク質を検出しないようであり、その逆も当てはまる)。
本発明のサービビンタンパク質は、好ましくは単離された形態においてである。本明細書中で使用されるように、物理的な、機械的な、または化学的な方法が用いられて、サービビンと通常関連される細胞成分から、サービビンタンパク質を回収する場合、タンパク質は単離されるといわれる。当業者は、単離されたサービビンタンパク質を得るために標準的な生成方法を、容易に用い得る。
本発明のサービビンタンパク質はさらに、本明細書中に記載されるサービビンタンパク質の保存的改変体を含む。本明細書中で使用されるように、保存的改変体は、サービビン結合パートナーに結合する、および/または細胞アポトーシスを阻害するサービビンタンパク質の能力を、不都合に阻害しない、アミノ酸配列の変化をいう。変化した配列が、サービビン結合パートナーを会合することからサービビンタンパク質を妨げる、および/または細胞アポトーシスを阻害することからサービビンタンパク質を妨げる場合、置換、挿入、または欠失はサービビンタンパク質に不利に影響するといわれる。例えば、サービビンの全体の電荷、構造、または疎水性/親水性特性は、サービビンの活性に不利に影響することなく変化され得る。従って、サービビンのアミノ酸配列は、サービビンの活性を不都合に影響することなく、例えば、より多くの疎水性または親水性を、ペプチドに付与するために、変化され得る。
対立遺伝子改変体、保存的置換改変体、およびサービビンファミリーのタンパク質のメンバーは、細胞アポトーシスを阻害する能力を有する。このようなタンパク質は、通常、ヒトサービビン配列と少なくとも約75%の、より好ましくは少なくとも約80%の、さらにより好ましくは少なくとも約90%の、および最も好ましくは少なくとも約95%の、アミノ酸配列同一性を有しする。このような配列に関する同一性または相同性は、配列を整列させ、そしてギャップを導入し(必要であれば)、最大の相同パーセントを達成し、そして相同であるとして任意の保存的置換を含ませた後の、公知のペプチドと同一である、候補配列におけるアミノ酸残基のパーセントとして、本明細書中に規定される。ペプチド配列への、N末端の、C末端の、または内部の伸長、欠失、または挿入は、相同性を影響すると解釈されない。
従って、本発明のサービビンタンパク質は、図1に開示されるアミノ酸配列を有する分子;サービビンタンパク質の少なくとも約3、5、10、または15アミノ酸残基の連続的な配列を有するそれらのフラグメント;このような配列のアミノ酸配列改変体(ここでは、アミノ酸残基が、開示されるサービビン配列のNまたはC末端に挿入されるか、または開示されるサービビン配列の中に挿入される);開示されるサービビン配列のアミノ酸配列改変体、または上述で規定されるようなそれらのフラグメント(これらは、別の残基によって置換されている)を含む。意図される改変体はさらに、例えば、相同組換え、部位特異的またはPCR変異誘発によって予め決定された変異を含む改変体、および他の動物種(ウサギ、ラット、マウス、ブタ、ウシ、ヒツジ、ウマ、および非ヒト霊長類種を含むがこれらに制限されない)の対応のサービビンタンパク質、ならびにサービビンファミリーのタンパク質の対立遺伝子改変体または他の天然の改変体;ならびに誘導体(ここでは、サービビンタンパク質は、天然に存在するアミノ酸以外の部分(例えば、酵素または放射性同位体のような検出可能な部分)を用いる、置換、化学的、酵素学的、または他の適切な手段によって、共有結合的に改変されている)を含む。組換えサービビンタンパク質はまた、2D-NMR、円二色性、およびX線結晶学により、サービビンの分子構造を解明するために使用され得、従って、部位特異的変異誘発アプローチおよび特異的な小分子インヒビターの合理的な設計を統合し得る。
以下に記載されるように、サービビンファミリーのタンパク質のメンバーは:1)細胞アポトーシスのサービビン媒介性阻害をブロックするための標的として、2)サービビンを結合する結合パートナーを同定および単離するために、3)サービビンとサービビン結合パートナーとの会合をブロックする薬剤を同定するための方法において、4)細胞アポトーシスのサービビン媒介性の阻害をアッセイするための標的として、5)単独で、または組合せ療法の一部として投与される、細胞アポトーシスをブロックする薬剤として、6)抗サービビン抗体の循環レベルを定量するためのアッセイにおける結合パートナーとして、7)次いでサービビンの循環レベルを定量するためのアッセイにおいて使用され得る、および/または免疫組識学的目的のために使用され得る抗サービビン抗体の産生を誘発するための、抗原として、ならびに8)治療学的な抗ガンワクチン、または多価のワクチンの成分として、使用され得る。
B.抗サービビン抗体
本発明はさらに、サービビンタンパク質に選択的に結合する抗体を提供する。特に意図される抗サービビン抗体は、モノクローナル抗体およびポリクローナル抗体、ならびに抗原結合ドメインおよび/または1つ以上の完全な決定領域を含むフラグメントを含む。
抗体は、一般に、サービビンタンパク質、またはフラグメントを用いて、適切な哺乳動物宿主を免疫することによって、単離された免疫結合された形態で調製される(Harlow、Antibodies、Cold Spring Harbor Press, NY(1989))。図9は、サービビンの種々の領域の抗原指標のJameson-Wolfプロットを提供する。このような領域は、図9に提供される他の構造解析と組合わせて、サービビン特異的抗体を作製するにおいて使用するための適切なフラグメントを提供する。タンパク質とキャリア(例えば、BSA、KLH、または他のキャリアタンパク質)との免疫原性結合体を調製するための方法は、当該分野において周知である。いくつかの情況において、例えば、カルボジイミド試薬を使用する直接的な結合が、使用され得;他の例において、連結試薬(例えば、Pierce Chemical Co., Rockford, ILによって供給される連結試薬)が、効果的であり得る。
サービビン免疫原の投与は、当該分野において一般的に理解されるように、適切な期間にわたって、および適切なアジュバントとともに注入することによって、一般に行われる。免疫スケジュールの間、抗体形成の十分性を決定するために、抗体の力価が使用され得る。
この方法において産生されるポリクローナル抗血清は、いくつかの適用について満足なものであり得るが、薬学的組成物についてはモノクローナル抗体調製物が好ましい。所望の抗体を分泌する不死化細胞株は、KohlerおよびMilsteinの標準的な方法、または一般的に知られるような、リンパ球または脾臓細胞の不死化を達成する改変を使用して、調製され得る。所望の抗体を分泌する不死化細胞株は、抗体がサービビンペプチドであるイムノアッセイによって、スクリーニングされる。所望ののモクローナル抗体を分泌する適切な不死化細胞培養物が同定される場合、細胞は、インビトロで、または腹水液における産生のいずれかによって、培養され得る。
次いで、所望されるモノクローナル抗体は、培養上清から、または腹水上清から、回収される。免疫学的に有意な部分を含む、モノクローナルのフラグメントまたはポリクローナル抗血清は、アンタゴニストとして、ならびに無傷の抗体として、使用され得る。免疫学的に反応性のフラグメント(例えば、Fab、Fab’、またはf(ab’)2フラグメント)の使用は、これらのフラグメントは一般に、完全な免疫グロブリンよりも免疫原性が低いので、特に、治療学的情況において、しばしば好ましい。
抗体またはフラグメントはまた、組換え手段によって、現在の技術を用いて、生成され得る。レセプターの所望の領域に特異的に結合する領域はまた、複数の種起源のキメラまたはCDR移植された抗体の情況において、生成され得る。
このようにして生成された抗体は、サービビンとサービビン結合パートナーとの会合の調節因子としてのみでなく、サービビン発現/活性を検出するための、ならびにサービビンおよび会合される結合パートナーの精製のための、イムノアッセイにおいてもまた有用である。
C.サービビンをコードする核酸分子
本発明はさらに、サービビン、および本明細書中に記載される関連のサービビンタンパク質をコードする核酸分子を、好ましくは単離された形態で、提供する。簡便のために、全てのサービビンをコードする核酸分子は、サービビンをコードする核酸分子、サービビン遺伝子、またはサービビンと呼ばれる。本明細書中で使用されるように、「核酸」は、上述で規定されるようなペプチドをコードする、またはこのようなペプチドをコードする核酸配列に相補的である、またはこのような核酸配列にハイブリダイズし、およびストリンジェントな条件下でその核酸配列に結合したままである、またはこのペプチド配列と、少なくとも75%の、好ましくは少なくとも80%の、およびより好ましくは少なくとも85%の配列同一性を共有するポリペプチドをコードする、RNAまたはDNAとして規定される。具体的に意図されるものは、ゲノムDNA、cDNA、mRNA、およびアンチセンス分子、ならびに代替の骨格に基づくか、または天然の供給源に由来するかもしくは合成されるかのいずれかの代替の塩基を含む核酸分子である。しかし、このようなハイブリダイズするまたは相補的な核酸はさらに、任意の先行技術の核酸配列に対して、新規でありおよび自明でないとして規定され、本発明のサービビンタンパク質をコードする核酸分子をコードするか、またはこれにストリンジェンシー条件下でハイブリダイズするか、またはこれに相補的である核酸を含む。
本明細書中で使用されるように、核酸分子は、この核酸分子が、核酸分子の供給源からの他のポリペプチドをコードする混入する核酸から、実質的に分離される場合、「単離」されているといわれる。
本発明はさらに、サービビンをコードする核酸分子のフラグメントを提供する。本明細書中で使用されるように、サービビンをコードする核酸分子のフラグメントは、完全なタンパク質をコードする配列の小部分をいう。フラグメントのサイズは、意図される使用によって決定される。例えば、フラグメントはサービビンタンパク質の活性な部分(例えば、C末端のβコイル、またはIAPモチーフ)をコードするように選択される場合、フラグメントは、サービビンタンパク質の機能的な領域をコードするのに十分に大きくある必要がある。フラグメントが核酸プローブまたはPCRプライマーとして使用される場合、フラグメントの長さは、プローブ化/プライマー化の間、比較的小さな数の偽ポジティブを得るように選択される。図1は、選択的なハイブリダイゼーションプローブまたはPCRプライマーとして、特に有用であるサービビン遺伝子のフラグメントを示す。
プローブとして、もしくはポリメラーゼ連鎖反応(PCR)についての特異的なプライマーとして、またはサービビンタンパク質をコードする遺伝子配列を合成するために使用される、本発明のサービビンをコードする核酸分子のフラグメント(すなわち、合成オリゴヌクレオチド)は、化学的な技術(例えば、Matteucciら、J Am Chem Soc(1981)103:3185-3191のホスホトリエステル法)によって、または自動化合成法を用いて、容易に合成され得る。さらに、より大きなDNAフラグメントは、周知の方法(例えば、サービビン遺伝子の種々のモジュラーセグメントを規定するオリゴヌクレオチドの群の合成後、オリゴヌクレオチドを連結して、完全に改変されたサービビン遺伝子を組み立てる)によって、容易に調製され得る。
本発明のサービビンをコードする核酸分子はさらに、診断のおよびプローブの目的のために検出可能な標識を含むように、改変され得る。上記のように、このようなプローブは、サービビンファミリーのタンパク質の他のメンバーを同定するために使用され得、ならびに以下に記載されるように、このようなプローブは、サービビン発現および腫瘍増殖潜在性を検出するために、使用され得る。多様なこのような標識は、当該分野において公知であり、および本明細書中に記載されるサービビンをコードする分子とともに、容易に用いられ得る。適切な標識としては、ビオチン、放射標識されたヌクレオチドなどが挙げられるが、これらに制限されない。当業者は、標識された、サービビンをコードする核酸分子を得るために、当該分野で公知の任意の標識を用い得る。
サービビン遺伝子は、EPR-1遺伝子のアンチセンスすなわち逆の方向にあるので、特に好ましいのは、診断の目的において使用するための1本鎖のプローブである。具体的には、1本鎖の診断プローブは、サービビンをコードするmRNAに選択的にハイブリダイズするように使用され得る。1本鎖のプローブは、2本鎖化プローブのうちの1本鎖を単離するか、または1本鎖化RNAプローブが作製される公知の方法を用いて作製され得る。
翻訳の間、タンパク質配列に取り込まれるアミノ酸配列の欠失、付加、または変更による、一次構造自身に対する改変は、タンパク質の活性を破壊することなく、なされ得る。このような置換または他の変更は、本発明の意図される範囲内にあるDNAによってコードされるアミノ酸配列を有するタンパク質を生じる。
D.他のサービビンをコードする核酸分子の単離
上記のように、ヒトサービビンをコードする核酸分子の同定は、当業者が、本明細書中に記載されるヒト配列に加えて、サービビンファミリーのタンパク質の他のメンバーをコードする核酸分子を単離することを可能にする。
本質的に、当業者は容易に、細胞から調製された発現ライブラリーをスクリーニングするための抗体プローブを作製するために、サービビンのアミノ酸配列を使用し得る。代表的に、精製サービビンタンパク質(以下に記載される)で免疫された、ウサギのような哺乳動物からのポリクローナル抗血清、またはモノクローナル抗体は、哺乳動物のcDNAまたはゲノム発現ライブラリー(例えば、λgt11ライブラリー)をプローブして、サービビンまたはサービビンファミリーのタンパク質の他のメンバーの、適切なコード配列を得るために使用され得る。クローン化されたcDNA配列は、融合タンパク質として発現され得るか、その自分自身の制御配列を使用して直接的に発現され得るか、または酵素の発現のために使用される特定の宿主に対して適切である、制御配列を使用する構築物によって発現され得る。図1は、サービビンタンパク質配列において見出される、重要な抗原性ドメインおよび/または推定の作動性ドメインを同定する。このような領域は、プローブ、診断学的抗体、および治療学的抗体の生成のための、サービビンタンパク質の抗原性部分の好ましい供給源である。
あるいは、本明細書中に記載される配列をコードするサービビンの部分は、このようなタンパク質を含む任意の哺乳動物生物から、サービビンファミリーのタンパク質のメンバーをコードするDNAを回収するためのプローブとして合成され、そして使用され得る。約18〜20ヌクレオチドを含む(約6〜7アミノ酸範囲をコードする)オリゴマーが調製され、そしてゲノムDNAライブラリーまたはcDNAライブラリーをスクリーニングして、ストリンジェントな条件下のハイブリダイゼーションを得るために使用される。
さらに、オリゴヌクレオチドプライマーの対は、サービビンをコードする核酸分子を選択的にクローン化するためのポリメラーゼ連鎖反応(PCR)において使用するために、調製され得る。このようなPCRプライマーを使用するための、PCR変性/アニール/伸長のサイクルは、当該分野において周知であり、および他のサービビンをコードする核酸分子を単離するにおける使用のために、容易に適合され得る。図1は、プローブとしてまたはプライマーとして使用するために特に十分適切である、ヒトサービビン遺伝子の領域を同定する。
E.サービビンをコードする核酸分子を含むrDNA分子
本発明はさらに、サービビンをコードする配列を含む組換えDNA分子(rDNA)を提供する。本明細書中で使用されるように、rDNA分子は、インビトロでの分子操作に供されたDNA分子である。rDNA分子を作製するための方法は、当該分野において周知であり、例えば、Sambrookら、Molecular Cloning(1989)を参照のこと。好ましいrDNA分子において、サービビンをコードするDNA配列は、発現制御配列および/またはベクター配列に作動可能に連結される。
本発明のサービビンをコードする配列のうちの1つが作動可能に連結される、ベクターおよび/または発現制御配列の選択は、当該分野において周知であるように、所望される機能特性(例えば、タンパク質発現)、および形質転換される宿主細胞に、直接的に依存する。本発明によって意図されるベクターは、rDNA分子に含まれるサービビン遺伝子の、複製、または宿主染色体への挿入を少なくとも指向し得、そして好ましくは発現もまた指向し得る。
作動可能に連結された、タンパク質をコードする配列の発現を調節するために使用される発現制御エレメントは、当該分野において公知であり、そしてエレメントとしては、誘導性プロモーター、構成的なプロモーター、分泌シグナル、および他の調節エレメントが挙げられるが、これらに制限されない。好ましくは、誘導性プロモータは、容易に制御される(例えば、宿主細胞の培養液中の栄養素に反応する)。
1つの実施態様において、サービビンをコードする核酸分子を含むベクターは、原核生物レプリコン(すなわち、形質転換された原核生物宿主細胞(例えば、細菌宿主細胞)において、自律性の複製および組換えDNA分子の維持を、染色体外で指向する能力を有する、DNA配列)を含む。このようなレプリコンは、当該分野において周知である。さらに、原核生物レプリコンを含むベクターは、その発現が検出可能なマーカー(例えば、薬剤耐性)もまた付与する遺伝子を含み得る。代表的な細菌の薬剤耐性遺伝子は、アンピシリンまたはテトラサイクリンに対する耐性を付与する遺伝子である。
原核生物レプリコンを含むベクターはさらに、細菌宿主細胞(例えば、E.coli)においてサービビンをコードする遺伝子配列の発現(転写および翻訳)を指向し得る、原核生物プロモーターまたはウイルスプロモーターを含み得る。プロモーターは、RNAポリメラーゼの結合および転写が生じることを可能にするDNA配列によって形成される発現制御エレメントである。細菌宿主と適合性のプロモーター配列は、代表的に、本発明のDNAセグメントを挿入するために都合の良い制限部位を含有するプラスミドベクター中に提供される。代表的なこのようなベクタープラスミドは、Biorad Laboratories(Richmond、CA)から利用可能なpUC8、pUC9、pBR322、およびpBR329、Pharmacia、Piscataway、NJから利用可能なpPLおよびpKK223である。
真核生物細胞と適合性な発現ベクター、好ましくは脊椎動物細胞と適合性な発現ベクターはまた、サービビンをコードする配列を含むrDNA分子を形成するために使用され得る。真核生物細胞発現ベクターは、当該分野において周知であり、そして種々の市販の供給源から利用可能である。代表的に、このようなベクターは、所望のDNAセグメントの挿入のために都合の良い制限部位を含んで提供される。このようなベクターの代表例は、PSVLおよびpKSV-10(Pharmacia)、pBPV-1/pML2d(International Biotechnologies, Inc.)、pTDT1(ATCC、番号31255)、本明細書中に記載されるベクターpCDM8、および類似の真核生物発現ベクターである。
本発明のrDNA分子を構築するために使用される、真核生物細胞発現ベクターはさらに、真核生物細胞において効果的である選択マーカー、好ましくは薬剤耐性選択マーカーを含み得る。好ましい薬剤耐性マーカーは、その発現がネオマイシン耐性を生じる遺伝子、すなわち、ネオマイシンホスホトランスフェラーゼ(neo)遺伝子である。Southernら、J Mol Anal Genet(1982)1:327-341。あるいは、選択マーカーは、別々のプラスミドに存在し得、そして2つのベクターは、宿主細胞の同時トランスフェクションによって導入され、選択マーカーについての適切な薬剤中で培養することによって選択される。
F.外因的に供給されたサービビンをコードする核酸分子を含む宿主細胞
本発明はさらに、本発明のサービビンタンパク質をコードする核酸分子で形質転換された宿主細胞を提供する。宿主細胞は、原核生物または真核生物のいずれかであり得る。サービビンタンパク質の発現に有用である真核生物細胞は、細胞株が細胞培養法に適合性であり、ならびに発現ベクターの増殖およびサービビン遺伝子産物の発現に適合性である限り、制限されない。好ましい真核生物宿主細胞としては、酵母、昆虫、および哺乳動物の細胞、好ましくは脊椎動物の細胞(例えば、マウス、ラット、サル、またはヒト線維芽細胞株からの細胞)が挙げられるが、これらに制限されず、最も好ましくは、天然でサービビンタンパク質を発現しない細胞である。好ましい真核生物宿主細胞としては、マウスIL-3依存性の細胞株BaF3、および類似の真核生物組織培養細胞株が挙げられる。
任意の真核生物宿主は、サービビンをコードするrDNA分子を発現するために使用され得る。好ましい原核生物宿主は、E.coliである。
本発明のrDNA分子での、適切な細胞宿主の形質転換は、使用されるベクター型および用いられる宿主系に代表的に依存する、周知の方法によって達成される。原核生物宿主細胞の形質転換に関して、エレクトロポレーションおよび塩処理法が、代表的に用いられ得、例えば、Cohenら、Proc Natl Acad Sci USA(1972)69:2110;およびManiatisら、Molecular Cloning、A Laboratory Manual、Cold Spring Harbor Laboratory、Cold Spring Harbor, NY(1982)を参照のこと。rDNAを含有するベクターでの、脊椎動物細胞の形質転換に関して、エレクトロポレーション、カチオン性脂質処理法、または塩処理法が、代表的に用いられ、例えば、Grahamら、Virol(1973)52:456;Wiglerら、Proc Natl Acad Sci USA(1979)76:1373-76を参照のこと。
首尾良く形質転換された細胞(すなわち、本発明のrDNA分子を含有する細胞)は、周知の技術によって同定され得る。例えば、本発明のrDNAの導入から生じる細胞は、クローン化されて、単一のコロニーを生成し得る。これらのコロニーからの細胞は、採集され得、溶解され得、そしてそのDNA成分は、Southern、J Mol Biol(1975)98:503、もしくはBerentら、Biotech(1985)3:208に記載されるような方法を用いて、rDNAの存在について試験され得か、またはタンパク質が免疫学的方法を介してアッセイされた細胞から産生され得る。
G.サービビンタンパク質をコードするrDNA分子を使用するサービビンの生成
本発明はさらに、本明細書中に記載されるサービビンをコードする核酸分子のうちの1つを使用する、サービビンタンパク質を生成するための方法を提供する。一般的な用語において、サービビンタンパク質の組換え形態の生成は、代表的に、以下の工程を包含する。
先ず、図1に記載される核酸分子のような、サービビンタンパク質をコードする核酸分子が得られる。サービビンをコードする配列がイントロンによって中断されない場合、これは任意の宿主における発現について、直接的に適切である。次いで、そうでない場合、サービビンをコードする核酸分子のスプライスされた形態が、生成され得、そして使用され得るか、またはイントロン含有核酸分子は、適合性の真核生物発現系において使用され得る。
次いで、サービビンをコードする核酸分子は、上記のように、好ましくは、適切な発現制御配列との作動可能な連結において配置され、サービビンをコードする配列を含む発現単位を形成する。発現単位は、適切な宿主を形質転換するために使用され、そして形質転換された宿主は、サービビンタンパク質の産生を可能にする条件下で培養される。必要に応じて、サービビンタンパク質は、培地からまたはまたは細胞から単離され;タンパク質の回収および精製は、いくらかの不純物が可能にされ得るいくつかの例において、必要とされなくてもよい。
上述の工程のそれぞれは、多様な方法においてなされ得る。例えば、所望されるコード配列は、ゲノムフラグメントから得られ得、そして適切な宿主において直接的に使用され得る。多様な宿主において作動可能である、発現ベクターの構築は、上記のように、適切なレプリコンおよび制御配列を用いて達成される。制御配列、発現ベクター、および形質転換法は、遺伝子を発現するために使用される宿主細胞の型に依存し、ならびに以前に詳細に記載された。適切な制限部位が、通常利用可能でない場合、これらのベクターへ挿入するための切り出し可能な遺伝子を提供するように、コード配列の末端に付加され得る。当業者は、サービビンタンパク質を生成するために、サービビンコード配列とともに使用するための、当該分野において公知の、任意の宿主/発現系を、容易に適合し得る。
H.サービビンを使用する細胞死の阻害
上述で提供されるように、サービビンが、細胞アポトーシスを阻害することが示されている。従って、サービビンは、細胞の寿命を延ばすための方法において使用され得る。一般に、細胞アポトーシスは、細胞とサービビンとを接触することによって阻害され得る。
細胞アポトーシスを阻害することが所望される多くの状況がある。例えば、輸送および移植のために調製される組識または器官における細胞死は、サービビンタンパク質を用いて阻害され得る。あるいは、細胞株は、細胞株において発現される、サービビンをコードする核酸分子を用いる長期間の培養のために樹立され得る。
これゆえ、サービビンタンパク質またはサービビン遺伝子発現は、細胞アポトーシスを阻害するための手段として使用され得る。細胞培養系において、サービビンタンパク質は、アポトーシスを阻害するために、例えば、リポソームの、Penetrin-1送達を介して、細胞に導入され得るか、または細胞増殖培地中の封入物であり得る。あるいは、サービビン遺伝子は、培養における細胞の寿命を増加するために細胞に導入され得、そして発現され得る。これらは、培養された細胞が、所望される化合物を産生する能力を増加するための手段および方法を提供し、ならびに細胞および組識の初代外殖片の長期の培養を樹立する方法を提供する。
組識移植片において、代表的に、組識および器官は、移植の前に、保存および輸送される。アポトーシスに類似の機構による、細胞死は、組識または器官の生存性の損失を導き得る。この設定において、サービビンタンパク質での注入は、このような組識および器官における細胞死を阻害するための方法として使用され得る。
早発のおよび非所望の細胞アポトーシスによって特徴付けられる病理学的状態が、例えば、加速された老化異常において、存在する。IAPタンパク質における不活性化変異が、ヒト疾患を引き起こし得ることは、既に知られている。この例は、NAIPについてである(上述を参照のこと)。SMA(脊髄の筋肉萎縮、異常に増加されたアポトーシスによって引き起こされると考えられる、神経退行性疾患)を伴う患者の研究によって、NAIP遺伝子が不活性化され、そしてこれらの患者の75%において欠失されることが実証された(Royら、1995、Cell 80:167)。拡張して、サービビンにおける変異を不活性化することは、異常に増加される細胞死によって特徴付けられる退行性疾患を生じ得る。染色体17q25上のサービビン遺伝子座内、またはその周辺のハプロタイプなマーカーは、その遺伝子座が、増加されたアポトーシスを伴う疾患に既に関係しているか否かを決定するための、集団遺伝学の研究において使用され得る。このような場合において、サービビン遺伝子またはサービビンタンパク質は、その状態を処置するために使用され得る。従って、サービビンタンパク質、またはサービビンをコードする核酸分子は、異常なアポトーシスを処置する手段として、個体に投与される。
I.サービビン結合パートナーを同定するための方法
本発明の別の実施態様は、サービビンの結合パートナーを単離および同定するにおいて使用するための方法を提供する。具体的には、サービビンタンパク質は、サービビン結合パートナーを同定するための捕獲プローブとして使用され得る。本明細書中で使用されるように、サービビン結合パートナーは、サービビンに結合し、そして細胞アポトーシスのサービビン阻害を媒介する、生体分子(例えば、タンパク質、DNA、または他の補因子)である。
詳細には、サービビンタンパク質は、結合パートナーとサービビンとの会合を可能にする条件下で、サービビンを発現する細胞の抽出物または画分と混合される。混合後、サービビンと会合するようになったペプチドは、混合物から分離される。次いで、サービビンを結合する結合パートナーは、回収され得、そしてさらに分析され得る。
結合パートナーを同定および単離するために、完全なサービビンタンパク質が使用され得る。あるいは、サービビンタンパク質のフラグメントが使用され得る。
本明細書中で使用されるように、細胞抽出物は、溶解されたまたは破壊された細胞から作製される、調製物または画分をいう。細胞抽出物の好ましい供給源は、サービビンを天然で発現する細胞である。このような細胞の例としては、腫瘍細胞および胚組識が挙げられるが、これらに制限されない。
細胞の抽出物を得るために、多様な方法が使用され得る。細胞は、物理的または化学的な破壊法のいずれかを用いて、破壊され得る。物理的破壊法の例としては、超音波処理および機械的剪断が挙げられるが、これらに限定されない。化学的溶解法の例としては、界面活性剤溶解および酵素溶解が挙げられるが、これらに限定されない。さらに、細胞抽出物は、被験体から新鮮に単離された細胞から、または培養されている細胞もしくは細胞株から、調製され得る。当業者は、本発明の方法において使用するための抽出物を得るために、細胞抽出物を調製するための方法を、容易に適合し得る。
いったん細胞の抽出物が調製されると、抽出物は、サービビンと結合パートナーとの会合が生じ得る条件下で、サービビンタンパク質とともに混合される。多様な条件が使用され得、最も好ましいのは、サービビンを発現する細胞の細胞質において見出される条件に密接に類似する条件である。浸透圧、pH、温度、および使用される細胞抽出物の濃度のような特徴は、サービビンと結合パートナーとの会合を至適化するために変化され得る。
適切な条件下での混合後、サービビンは混合物から分離される。混合物を分離するために、多様な技術が利用され得る。例えば、サービビンに特異的な抗体が、サービビンおよび会合された結合パートナーを免疫沈降するために使用され得る。あるいは、標準的な化学分離技術(例えば、クロマトグラフィーおよび密度/沈殿物遠心分離)が使用され得る。
抽出物において見出される非会合の細胞成分の除去後、結合パートナーは、従来の方法を用いて、サービビンタンパク質から解離され得る。例えば、解離は、混合物の塩濃度またはpHを変化することによって、達成され得る。
混合された抽出物から、会合されたサービビン/結合パートナー対を分離するのを補助するために、サービビンタンパク質は、固相支持体上で固定化され得る。例えば、サービビンは、ニトロセルロースマトリクスまたはアクリル性ビーズに付着され得る。固相支持体へのサービビンの付着はさらに、抽出物において見出される他の成分から、ペプチド/結合パートナー対を分離するのを補助する。
あるいは、サービビンをコードする核酸分子は、酵母ツーハイブリッド系において使用され得る。酵母ツーハイブリッド系は、他のタンパク質パートナー対を同定するために使用されており、および本明細書中に記載されるサービビンをコードする分子を用いるために、容易に適合され得る。
J.サービビン結合パートナーの使用
いったん単離されたら、上記の方法を用いて得られたサービビン結合パートナーは、多様な目的のために使用され得る。結合パートナーは、当該分野において公知の技術を用いて、サービビン結合パートナーに結合する抗体を作製するために使用され得る。サービビンに結合するパートナーを結合する抗体は、サービビン活性をアッセイするために、サービビンによって媒介される生物学的もしくは病理学的プロセスを調節するための、または結合パートナーを精製するための治療学的薬剤として、使用され得る。これらの使用は、以下に詳細に記載される。
K.サービビン/結合パートナー相互作用をブロックする薬剤を同定するための方法
本発明の別の実施態様は、サービビンとサービビン結合パートナーとの会合を減少またはブロックする薬剤を同定するための方法を提供する。具体的には、サービビンは、試験される薬剤の存在下または非存在下で、サービビン結合パートナーとともに混合される。サービビンとサービビン結合パートナーとの会合を許容する条件下での混合後、2つの混合物は、薬剤が、サービビンとサービビン結合パートナーとの会合を減少またはブロックしたか否かを決定するために、分析および比較される。サービビンとサービビン結合パートナーとの会合を減少またはブロックする薬剤は、試験される薬剤を含むサンプルに存在する会合の量を減少するとして、同定される。
本明細書中で使用されるように、薬剤の存在が、サービビン結合パートナーがサービビンと会合されるようになる程度を減少するか、またはこれを妨げる場合、薬剤は、サービビン/サービビン結合パートナー会合を減少またはブロックするといわれる。一方のクラスの薬剤は、サービビン結合パートナーに結合することによって、会合を減少またはブロックするのに対し、他方のクラスの薬剤は、サービビンに結合することによって会合を減少またはブロックする。
上述のアッセイにおいて使用されるサービビン結合パートナーは、単離および十分に特徴付けられたタンパク質であり得るか、またはサービビン、もしくは細胞抽出物に存在するとして同定されているサービビン結合パートナーに結合する部分的に特徴付けられたタンパク質であり得るかのいずれかである。サービビン結合パートナーが、同定可能な特性(例えば、分子量)によって特徴付けられている限り、本アッセイが使用され得ることは、当業者に明らかである。
上述の方法においてアッセイされる薬剤は、ランダムに選択され得るか、または合理的に選択もしくは設計され得る。本明細書中に記載されるように、薬剤が、サービビンとサービビン結合パートナーとの会合に関与する特定の配列を考慮しないで、ランダムに選択される場合、薬剤は、ランダムに選択されるといわれる。ランダムに選択された薬剤の例は、化学ライブラリーもしくはペプチドコンビナトリアルライブラリー、または生物の増殖ブロスの使用である。
本明細書中で使用されるように、薬剤が、薬剤の作用と関連する、標的部位の配列および/またはその配座を考慮するランダムでない基準に基づいて選択される場合、薬剤は、合理的に選択または設計されるといわれる。上記のように、サービビン/サービビン結合パートナー相互作用をブロックする薬剤について、作用の2つの部位が存在する:サービビンにおける結合パートナー接触部位、およびサービビン結合パートナーにおけるサービビン接触部位。薬剤は、サービビン/サービビン結合パートナー対の接触部位を構成するペプチド配列を利用することによって、合理的に選択されるか、または合理的に設計され得る。例えば、合理的に選択されるペプチド薬剤は、そのアミノ酸配列が、サービビン結合パートナーにおけるサービビン接触部位に同一であるペプチドであり得る。このような薬剤は、サービビン結合パートナーに結合することによって、サービビンと結合パートナーとの会合を減少またはブロックする。
本発明の薬剤は、例示されるように、ペプチド、小分子、ビタミン誘導体、ならびに炭水化物であり得る。当業者は、本発明の薬剤の構造的性質に関して制限はないことを、容易に認識し得る。本発明のあるクラスの薬剤は、そのアミノ酸配列がサービビンタンパク質のアミノ酸配列に基づいて選択される、ペプチド薬剤である。
本発明のペプチド薬剤は、当該分野において知られるように、標準的な固相(または液相)ペプチド合成法を使用して、調製され得る。さらに、これらのペプチドをコードするDNAは、市販のオリゴヌクレオチド合成装置を使用して合成され得、および標準的な組換え産生系を使用して、組換え的に産生され得る。固相ペプチド合成法を使用する生成は、遺伝子コードされないアミノ酸が含まれる場合、必要とされる。
本発明の別のクラスの薬剤は、サービビンまたはサービビン結合パートナーの重要な位置と免疫応答性の抗体である。上記のように、抗体は、抗原性領域として、抗体によって標的されることが意図される、サービビンまたは結合パートナーのそれらの部分を含むペプチドでの、適切な哺乳動物被験体の免疫によって得られる。重要な領域は、サービビンとサービビン結合パートナーとの会合に関与する接触部位を含む。
以下に考察されるように、サービビン活性に関与する残基の重要な最小の配列は、潜在的なサービビン会合分子のツーハイブリッドスクリーニングおよび同定についてのベイト(bait)として効果的に使用され得る、機能的な線状のドメインを規定する。このようなサービビンフラグメントの使用は、完全長の分子または完全なBIRドメインの使用とは対照的に、スクリーニングの特異性を有意に増加し、それゆえ好ましい。同様に、この線状の配列はまた、生化学的アフィニティー精製戦略を用いてサービビン結合タンパク質を単離するためのアフィニティーマトリクスとしてもまた、使用され得る。
L.サービビンとサービビン結合パートナーとの会合をブロックする薬剤についての使用
背景の節において提供されるように、サービビンは、細胞アポトーシスを阻害する。サービビンとサービビン結合パートナーとの相互作用を減少またはブロックする薬剤は、サービビンの機能および活性と関連する生物学的および病理学的プロセスを調節するために使用され得る。
詳細には、サービビンによって媒介される生物学的または病理学的プロセスは、サービビンとサービビン結合パートナーとの相互作用をブロックする薬剤を、被験体に投与することによって調節され得る。
本明細書中で使用されるように、被験体は、哺乳動物が、サービビンによって媒介される生物学的または病理学的プロセスの調節を必要とする限り、任意の哺乳動物であり得る。用語「哺乳動物」は、哺乳類に属する個体を意味する。本発明は、ヒト被験体の処置において特に有用である。
本明細書中で使用されるように、サービビン、またはサービビン結合パートナーへのサービビン結合によって媒介される生物学的または病理学的プロセスは、サービビンによって媒介される広範に多様な細胞事象をいう。病理学的プロセスは、有害な影響を生じる生物学的プロセスのカテゴリーをいう。例えば、サービビンによって媒介される病理学的プロセスは、腫瘍細胞における細胞アポトーシスの阻害である。この病理学的プロセスは、サービビン/サービビン結合パートナー会合を減少もしくはブロックする、またはサービビン発現をブロックする薬剤を用いて、調節され得る。
本明細書中で使用されるように、薬剤は、薬剤が病理学的プロセスの程度または重篤度を減少する場合、この病理学的プロセスを調節するといわれる。例えば、薬剤が細胞分裂の速度または程度を減少する場合、薬剤は、腫瘍細胞増殖を調節するといわれる。
M.サービビン、またはサービビン活性に影響する薬剤の投与
本発明の薬剤は、サービビン/結合パートナー会合またはサービビンタンパク質をブロックする薬剤であり、非経口経路、皮下経路、静脈内経路、筋肉内経路、腹腔内経路、経皮経路、または頬内経路を介して投与され得る。あるいは、または同時に、投与は経口経路によってであり得る。投与される投薬量は、レシピエントの年齢、健常度、および体重、同時処置される種類(もしあれば)、処置の頻度、ならびに所望される効果の性質に依存する。例えば、アポトーシスのサービビン阻害をブロックする手段として、腫瘍細胞を処置するために、サービビン発現またはサービビンと結合パートナーとの相互作用をブロックする薬剤が、処置される個体に全身的にまたは局所的に投与される。以下に記載されるように、このような薬剤を投与するために容易に適合され得る多くの方法がある。
本発明はさらに、サービビン、またはサービビン/結合パートナー会合をブロックする1つ以上の薬剤を含有する、組成物を提供する。個体の必要性は変化するが、各成分の有効な量の至適な範囲の決定は、当業者の範囲内である。典型的な投薬量は、0.1〜100μg/kg体重を含む。好ましい投薬量は、0.1〜10μg/kg体重を含む。最も好ましい投薬量は、0.1〜1μg/kg体重を含む。
薬理学的に活性な薬剤に加えて、本発明の組成物は、薬学的に受容可能な適切なキャリアを含み得、これは、作用の部位に送達するために薬学的に使用され得る調製物への活性な化合物のプロセシングを容易にする、賦形剤および補助剤を含む。非経口投与のために適切な処方物は、水溶性形態の活性化合物(例えば、水溶性の塩)の水溶液を含む。さらに、適切な油性の注入懸濁液としての活性化合物の懸濁液が、投与され得る。適切な親油性溶媒またはベヒクルは、脂肪油(例えば、ゴマ油)または合成の脂肪酸エステル(例えば、エチルオレイン酸またはトリグリセリド)を含む。水性注入懸濁液は、懸濁液の粘度を増加する物質(例えば、ナトリウムカルボキシメチルセルロース、ソルビトール、および/またはデキストランを含む)を含み得る。必要に応じて、懸濁液はまた、安定剤を含み得る。リポソームはまた、細胞への送達のために、薬剤をカプセル化するために使用され得る。
本発明に従う全身性投与についての薬学的組成物は、腸投与、非経口投与、または局所投与について処方され得る。実際、処方物の全ての3つのタイプは、有効成分の全身性投与を達成するために、同時に使用され得る。
経口投与のための適切な処方物は、堅質または軟質ゼラチンカプセル、丸剤、錠剤(コートされた錠剤を含む)、エリキシル、懸濁液、シロップ、または吸入薬、およびそれらの制御された放出形態を含む。
本発明の方法を実施するために、本発明の化合物は、単独でもしくは組合わせて、または他の治療剤または診断剤と組合わせて、使用され得る。特定の好ましい実施態様において、本発明の化合物は、一般的に受容されている医療の実施に従って、これらの状態について典型的に処方される他の化合物(例えば、化学療法剤)とともに同時投与され得る。
N.組合せ療法
サービビン、ならびにサービビン活性を調節する本発明の薬剤は、単独で、または特定の生物学的または病理学的プロセスを調節する別の薬剤と組合わせて、提供され得る。例えば、サービビンで阻害されるアポトーシスを減少する本発明の薬剤は、ガン細胞増殖を制御するための方法において、他の抗ガン剤と組合わせて投与され得る。あるいは、サービビンは、細胞アポトーシスを減少するための手段として、他の防御的な薬剤とともに投与され得る。本明細書中で使用されるように、2つの薬剤が、同時に投与される場合、または薬剤が同時に作用するような様式で独立して投与される場合、2つの薬剤は、組合わせて投与されるといわれる。
サービビン活性/発現の阻害は、従来の化学療法と組合わせて使用され得る。サービビン活性/発現の阻害と組合わせて化学療法剤を使用するためのタイミングは、使用される化学療法剤および処置される腫瘍細胞型に依存する。サービビン活性/発現を達成する薬剤と組合わせて使用され得る化学療法剤の例としては、アルキル化剤(例えば、シクロホスファミド(CTX;シトキサン)、クロラムブシル(CHL;ロイケラン)、シスプラチン(CisP;プラチノール)、ブスルファン(ミレラン)、メルファラン、カルムスチン(BCNU)、ストレプトゾトシン、トリエチレンメルアミン(TEM)、マイトマイシンC、および類似のアルキル化剤);抗代謝剤(例えば、メトトレキセート(MTX)、エトポシド(VP16;ベペシド(vepesid))、6-メルカプトプリン(6MP)、6-チオクグアニン(6-thiocguanine)(6TG)、シタラビン(Ara-C)、5-フルオロウラシル(5FU)、ダカルバジン(DTIC)、および類似の抗代謝剤);抗生物質(例えば、アクチノマイシンD、ドキソルビシン(DXR;アドリアマイシン)、ダウノルビシン(ダウノマイシン)、ブレオマイシン、ミトラマイシン、および類似の抗生物質);アルカロイド(例えば、ビニカアルカロイド(例えば、ビンクリスチン(VCR)、ビンブラスチンなど);ならびに他の抗腫瘍剤(例えば、タキソールおよびタキソール誘導体)、細胞増殖抑制性の薬剤の糖質コルチコイド(例えば、デキサメタゾン(DEX;デカドロン)およびコルチコステロイド(例えば、プレドニゾン)、ヌクレオシド酵素インヒビター(例えば、ヒドロキシ尿素)、アミノ酸欠失化酵素(例えば、アスパラギナーゼ)および類似の多様な抗腫瘍剤を含むが、これらに限定されない。
化学療法レジメンにおける上記の細胞傷害性薬剤の使用は、一般に、ガン治療の分野において十分に特徴付けられており、およびそれらの本明細書中での使用は、いくつかの調整を伴って、耐性および有効性をモニターすることについて、および投与経路および投薬量を制御することについて、同じ考慮下にある。例えば、細胞傷害性薬剤の実際の投薬量は、本発明の組織培養法を用いることによって決定される、患者の培養された細胞の応答に依存して、変化し得る。一般に、投薬量は、サービビン活性/発現を達成する薬剤の非存在下で使用される量に比べて、減少される。
有効な細胞傷害性薬剤の典型的な投薬量は、製造業者によって推奨される範囲内であり得、そしてインビトロ応答、または動物モデルにおける応答によって示される場合、約一桁の等級まで、濃度または量を減少され得る。従って、実際の投薬量は、臨床医の判断、患者の状態、および初代培養された悪性細胞もしくは組織培養された組織サンプルのインビトロ応答、または適切な動物モデルにおいて観察される応答に基づく治療方法の有効性に依存する。
O.サービビン発現およびアポトーシスのサービビン媒介性の阻害を同定するための方法
本発明はさらに、アポトーシスのサービビン媒介性の阻害に関与する細胞を同定するための方法、ならびにサービビン活性と関連する生物学的および病理学的プロセス、このような状態の進行、処置に対するこのような状態の感受性、およびこのような状態についての処置の有効性を診断するために適用され得る技術を提供する。具体的には、アポトーシスのサービビン媒介性の阻害は、サービビンタンパク質が細胞において発現されるか否かを決定することによって同定され得る。サービビンを発現する細胞は、天然の細胞アポトーシスから阻害されると考えられる。
多様な免疫学的技術および核酸技術が、サービビンタンパク質、またはサービビンをコードするmRNAが、特定の細胞において産生されるか否かを決定するために使用され得る。1つの例において、細胞の抽出物が調製される。次いで、調製物は、サービビンが細胞において発現されるか否かを決定するために、アッセイされる。発現の程度は、アポトーシスの阻害の程度の測定を提供する。発現の増加は、アポトーシスの増加された阻害の測定である。
サービビン発現の測定は、多様な目的についてのマーカーとして使用され得る。腫瘍において、サービビン発現の存在は、腫瘍の増殖可能性と相関する。実施例において、リンパ腫が、サービビン発現の種々のレベルを示すことが示され;サービビン発現をほとんど〜全く示さないリンパ腫は、効果的に処置され得る低い悪性度分類のリンパ腫であるが、サービビン発現の高いレベルを示すリンパ腫は、典型的に効果的に処置され得ない高い悪性度分類の攻撃的なリンパ腫である。従って、リンパ腫または他の腫瘍におけるサービビン発現のレベルは、腫瘍の攻撃性および処置可能性の予測的な測定として使用され得;サービビン発現のレベルが高いほど、腫瘍の攻撃性がより高くなり、そして処置がより困難になる。
例えば、腫瘍の増殖可能性または処置の容易性/予後を決定するために、抽出物が、腫瘍細胞から作製され、次いで抽出物は、例えば、ゲル電気泳動によって分析されて、サービビンタンパク質が存在すか否かを決定する。サービビンの存在およびレベルは、ガンの増殖可能性および処置の容易性と相関する。あるいは、上記のように、一本鎖プローブが、細胞抽出物におけるサービビンをコードするmRNAを同定するために使用され得る。
腫瘍攻撃性および処置可能性のマーカーであることに加えて、サービビン発現は、抗腫瘍治療の有効性の測定として使用され得る。実施例において、HL-60(前骨髄球細胞株)は、高レベルのサービビン発現を有したことが示される。レチノール酸(retenoic acid)、および腫瘍細胞の分化を引き起こすことにより作用する抗ガン剤でのHL-60細胞の処置は、サービビン発現の減少および排除を生じた。発現の減少は、分化の程度と相関し、分化が進むほど、サービビンの発現のレベルは低くなった。従って、サービビン発現は、抗腫瘍処置の有効性を測定するために使用され:処置の間にサービビン発現が減少する場合、処置プロトコルは有効であり、そして継続され得、一方サービビン発現が変化しないままである場合、異なる治療レジメン(regime)またはプロトコルが、行われることが必要とされる。
P.サービビン発現を制御するための他の方法
本発明はさらに、細胞におけるサービビン発現を制御するために使用され得る、さらなる方法を提供する。上述および以下に考察されるように、サービビンプロモーターは、そのプロモーターから上流のCPG島を有する。CPG島は、DNAメチル化の公知の標的である。CPG島におけるDNAメチル化部位は、サービビン発現を調節するための手段として作用し:CPG島のメチル化は、プロモーターから下流に見出される遺伝子の転写の抑制を生じる。従って、DNAをメチル化する薬剤(例えば、DNAメチラーゼ)、および内因性メチラーゼの産生を刺激する薬剤は、サービビン発現を制御するために使用され得る。具体的には、細胞におけるサービビン発現は、細胞に、DNAメチル化のレベルを、特にサービビン遺伝子から上流において見出されるCPG島で、増加させることによって、減少または排除され得る。
別の方法において、サービビン発現は、EPR-1発現のレベルを増加することによって減少され得る。実施例において示されるように、サービビン発現およびEPR-1発現は、一般的に相互に排他的であり、EPR-1の発現は、サービビン発現の減少または排除を生じ、そしてその逆も当てはまる。従って、サービビン発現は、細胞に、EPR-1発現を増加させることによって、減少され得る。
Q.動物モデル
本発明者らは、マウスサービビン遺伝子のほとんど完全な構造を単離した。遺伝子は、そのヒト対応物に関して非常に保存されている(イントロン、エクソンの大きさ、およびイントロン−エクソン境界を含む)。マウスサービビン遺伝子のコード領域は、88%であり、配列決定された限り、ヒトタンパク質と同一であり、それによって、強力な進化的保存が実証される。本発明者らはまた、ヒトおよびマウスの両方の発生の間の、サービビンの分化、および発生的に調節される分布を決定した。マウスサービビン遺伝子およびタンパク質の完全の構造の利用可能性は、遺伝子ノックアウト実験についての標的化ベクターの調製、および組識特異的プロモーターの制御下でサービビンを発現するトランスジェニックマウスの作製についてのより合理的なアプローチを許容する。
サービビン遺伝子およびサービビンタンパク質は、多様な情況における遺伝子治療の標的として作用し得る。例えば、1つの適用において、サービビン欠損非ヒト動物が、サービビン遺伝子を不活性化するための標準的なノックアウト手順を使用して作製され得るか、またはこのような動物が生存可能でない場合、誘導性のサービビンアンチセンス分子が、サービビン活性/発現を調節するために使用され得る。あるいは、動物は、組織特異的な様式において、サービビンまたはアンチセンス分子の発現を指向する、サービビンまたはアンチセンスサービビンの発現単位を含むように変化され得る。このような使用において、サービビン遺伝子の発現が、不活性化または活性化によって変化される、非ヒト哺乳動物(例えば、マウスまたはラット)が作製される。これは、当該分野で公知の多様な手順(例えば、標的化組換え)を用いて、達成され得る。いったん作製されたら、サービビン欠損動物、組織特異的な様式においてサービビンを発現する動物、またはアンチセンス分子を発現する動物は、1)サービビンによって媒介される生物学的および病理学的プロセスを同定するために、2)サービビンと相互作用するタンパク質および他の遺伝子を同定するために、3)サービビン欠損を克服するために外因的に供給され得る薬剤を同定するために、ならびに4)活性を増加または減少するサービビン内の変異を同定するための適切なスクリーニングとして作用するために、使用され得る。
例えば、組織特異的な様式においてサービビンのヒトミニ遺伝子を発現するトランスジェニックマウスを作製し、そして通常はサービビンを含まない区域における、このタンパク質の過剰発現の効果を試験することが可能である。このストラテジーは、別のファミリーのアポトーシスインヒビター、すなわちbcl-2について、首尾良く使用されている(Veisら、Cell(1993)75:229)。このようなアプローチは、サービビンタンパク質に容易に適合され得、そして、アポトーシスから細胞を防御するために、特定の組識領域(移植片)においてサービビンの潜在的な有益な効果の問題に取り組むために使用され得る。
R.サービビン遺伝子治療
別の実施態様において、遺伝子治療は、サービビン媒介性の生物学的または病理学的プロセスを調節するための手段として使用され得る。例えば、腫瘍治療において、サービビン発現の調節因子をコードする遺伝子発現単位(例えば、アンチセンスをコードする核酸分子)を、処置される被験体に、導入することが所望され得る。このような調節因子は、細胞もしくは特定の標的細胞内で、構成的に産生され得るか、または誘導性であるかのいずれかであり得る。これは、被験体内でのサービビン発現の調節因子の、継続的なまたは誘導性の供給を許容する。サービビン発現をブロックすることは、腫瘍細胞増殖の制御を許容する。同様に、細胞は、例えば、移植のために同種移植片膵臓β細胞において、サービビンを発現するように、遺伝子操作され得る。
サービビン遺伝子の発現のレベルは、アポトーシスに対する耐性のレベルと相関し得る。従って、サービビン遺伝子はまた、抗アポトーシス遺伝子治療における使用を見出す。特に、機能的なサービビン遺伝子は、神経退行性疾患の過程においてアポトーシスを受けるニューロン細胞、リンパ球(すなわち、T細胞およびB細胞)、または虚血によって傷害されている細胞を維持するために使用され得る。
レトロウイルスベクター、アデノウイルスベクター、アデノ随伴ウイルスベクター、またはアポトーシスに関与する傾向がある細胞(例えば、上皮細胞)についての適切な向性を有する他のウイルスベクターは、治療学的なサービビン遺伝子構築物についての遺伝子移入送達系として使用され得る。この目的のために有用な多数のベクターが、一般的に公知である(Miller、Human Gene Therapy 15-14、1990;Friedman、Science 244:1275-1281、1989;EglitisおよびAnderson、Bio Techniques 6:608-614、1988;TolstoshevおよびAnderson、current opinion in biotechnology 1:55-61、1990;Sharp、The Lancet 337:1277-1278、1991;Cornettaら、Nucleic Acid Research and Molecular Biology 36:311-322、1987;Anderson、Science 226:401-409、1984;Moen、blood Cells 17:407-416、1991;Millerら、Biotechniques 7:980-990、1989;Le Gal La Salleら、Science 259:988-990、1993;およびJohnson、Chest 107:77S-83S、1995)。レトロウイルスベクターは、特に十分に開発され、そして臨床的設定において使用されている(Rosenbergら、N.Engl.J.Med 323:370、1990;Andersonら、米国特許第5,399,346号)。
非ウイルスアプローチはまた、そうでなければアポトーシスを受けることが予測される細胞へ、治療学的DNAを導入するために用いられ得る。例えば、サービビンは、リポフェクション(Feignerら、Proc. Natl. Acad. Sci. USA 84:7413、1987;Onoら、Neurosci. Lett. 117:259、190;Brighamら、Meth. Enz. 101:512、1983)、アシアロロソヌコイド(asialorosonucoid)-ポリリジン結合(Wuら、J. Biol. Chem. 263:14621、1988;Wuら、J. Biol. Chem. 264:16985、1989);またはあまり好ましくないが、外科的条件下でのマイクロインジェクション(Wolffら、Science 247:1465、1990)によって、ニューロンまたはT細胞に導入され得る。
上記の適用の任意の方法について、治療学的サービビン核酸構築物は、好ましくは、予測されるアポトーシス事象の部位に(例えば、注入によって)適用される。しかし、構築物はまた、予測されるアポトーシス事象の近傍における組識に、またはアポトーシスを受けることが予測される細胞を供給する血管に、適用され得る。
記載される構築物において、サービビンcDNA発現は、任意の適切なプロモーター(例えば、ヒトサイメトガロウィルス(CMV)、シミアンウイルス40(SV40)、またはメタロチオネインのプロモーター)から指向され得、そして任意の適切な哺乳動物調節エレメントによって調節され得る。例えば、所望される場合、神経細胞、T細胞、B細胞における遺伝子発現を優先的に指向することが知られるエンハンサーが、サービビン発現を指向するために使用され得る。使用されるエンハンサーとしては、それらの発現において組識または細胞に特異的であるとして特徴付けられるエンハンサーが挙げられるが、これらに制限されない。あるいは、サービビンゲノムクローンが、治療学的構築物として(例えば、上記のサービビンcDNAとのハイブリダイゼーションによる単離後に)使用される場合、調節は、同起源の調節配列によって、または、所望される場合、異種供給源に由来する調節配列(上記の任意のプロモーターまたは調節エレメントを含む)によって、媒介され得る。
S.遺伝子発現を指向するためのサービビンプロモーターの使用
本発明はさらに、発現ベクターの作製に使用され得る形態のサービビン遺伝子のプロモーターを提供する。具体的には、サービビンプロモーターは、サービビンのATG開始コドンから5’であるとして同定され、作動可能に連結された、タンパク質をコードするDNA配列の発現を指向するために使用され得る。サービビンプロモーターは、TATAボックスを有しないので、当業者は、5’フラグメント(例えば、ヌクレオチド2560〜2920(エキソン1を含む))を使用する。サービビンプロモーターは、胎児組識において発現され、それゆえ、発生の特定の段階の間、特異的な細胞型における、タンパク質発現を標的するために使用され得る。以下に考察されるように、c-mycガン遺伝子での、3T3細胞のトランスフェクションは、ノザンブロットによって検出されるように、サービビンmRNAのアップレギュレーションを生じる。従って、サービビンプロモーターの制御下で抗腫瘍ポリペプチドをコードするDNAは、それらが発現される腫瘍細胞をトランスフェクトするために使用され得る。当業者は、当該分野において公知の方法を用いて、発現ベクターにおいてサービビンプロモーターを容易に使用し得る。
T.予防的な抗アポトーシス療法
サービビン変異についてヘテロ接合性であること、もしくはサービビン変異に感受性であること(これらの変異がサービビン生物学的活性の変化もしくは欠損を未だ生じていない場合であっても)が診断される患者において、または退行性疾患(例えば、運動ニューロン退行性疾患(例えば、SMA疾患もしくはALS疾患)を伴うことが診断された患者、またはHIVポジティブとして診断された患者において、疾患の表現型の出現の前に、任意の開示される治療薬が投与され得る。例えば、この治療は、HIVポジティブであるが、減少されたT細胞数またはAIDSの他の明白な徴候を未だ示さない患者に提供され得る。特に、サービビン発現またはサービビンの生物学的な活性を増加することが示される化合物は、任意の標準的な投薬量および投与の経路によって、投与され得る。あるいは、サービビン発現構築物を使用する遺伝子治療は、退行性疾患の発症の前に、細胞欠損を逆転または防止するために、着手され得る。
本発明の方法は、任意の哺乳動物(例えば、ヒト、家庭のペット、または家畜)において、本明細書中に記載される異常を低減または診断するために使用され得る。非ヒト哺乳動物が、処置または診断される場合、用いられるサービビンポリペプチド、核酸、または抗体は、好ましくはその種について特異的である。
U.さらなるアポトーシスアッセイの例
上述の考察に加えて、アポトーシスアッセイの特定の例がまた、以下の参考文献において提供される。リンパ球におけるアポトーシスについてのアッセイは:Liら、「HIV-1 Tatタンパク質による、未感染のリンパ球におけるアポトーシスの誘導」、Science 268:429-431、1995;Gibelliniら、「Tat発現Jurkat細胞は、異なるアポトーシス刺激(急性ヒト免疫不全ウイルスI型(HIV-1)感染を含む)に対する増加された抵抗性を示す」、Br. J. Haematol. 89:24-33、1995;Martinら、「インビトロでのヒトCD4+T細胞のHIV-1感染。これらの細胞におけるアポトーシスの示差的な誘導」J.Immunol. 152:330-42、1994;Teraiら、「HIV-1で急性感染された、培養Tリンパ芽球における細胞死の機構としてのアポトーシス」、J. Clin Invest. 87:1710-5、1991;Dheinら、「APO-1/(Fas/CD95)11によって媒介されるオートクラインT細胞自殺」、Nature 373:438-441、1995;Katsikisら、「Fas抗原刺激は、ヒト免疫不全ウイルスで感染された個体においてTリンパ球の顕著なアポトーシスを誘導する」、J. Exp. Med. 1815:2029-2036、1995;Westendropら、「HIV-1 Tatおよびgp120による、CD95媒介性のアポトーシスに対するT細胞の感作」、Nature 375:497、1995;DeRossiら、Virology 198:234-44、1994によって開示される。
線維芽細胞におけるアポトーシスについてのアッセイは:Vossbeckら、「ラット線維芽細胞における、TGF-βの直接的なトランスフォーミング活性」、Int. J. Cancer 61:92-97、1995;Goruppiら、「HIH3T3線維芽細胞のS期誘導に関与するc-mycドメインの切除」、Oncogene 9:1537-44、1994;Fernandezら、「正常なおよびHa-rasで形質転換されたC3Hマウス胚線維芽細胞腫瘍壊死因子の示差的な感受性;耐性細胞におけるbcl-2、c-myc、およびマンガンスーパーオキシドジスムターゼの誘導」、Oncogene 9:2009-17、1994;Harringtonら、「線維芽細胞におけるc Myc誘導性のアポトーシスは、特定のサイトカインによって阻害される」、EMBO J.、13:3286-3295、1994;Itohら、「アポトーシスについて必要とされる新規なタンパク質ドメイン。ヒトFas抗原の変異分析」、J. Biol. Chem. 268:10932-7、1993)によって開示される。
ニューロン細胞におけるアポトーシスについてのアッセイは:Melinoら、「組識トランスグルタミナーゼおよびアポトーシス:ヒト神経芽腫細胞を用いるセンスおよびアンチセンストランスフェクション研究」、Mol. Cell Biol. 14:6584-6596、1994;Rosenblaumら、「培養されたニューロンの低酸素誘導性の、プログラム細胞死についての証明」、Ann. Neurol. 36:864-870、1994;Satoら、「bcl-2による細胞死の防止の結果としての、PC12細胞のニューロン分化」、J. Neurobiol. 25:1227-1234、1994;Ferrariら、「N-アセチルシステインD-およびL-立体異性体は、ニューロン細胞のアポトーシス死を防止する」、J. Neurosci. 1516:2857-2866、1995;Talleyら、「ヒトニューロン細胞における腫瘍壊死因子α誘導性のアポトーシス:酸化防止剤のN-アセチルシステイン、ならびにbcl-2およびcrma遺伝子による防御」、Mol. Cell Biol. 1585:2359-2366、1995;Talleyら、「ヒトニューロン細胞における腫瘍壊死因子α誘導性のアポトーシス:酸化防止剤のN-アセチルシステイン、ならびにbcl-2およびcrma遺伝子による防御」、Mol. Cell Biol. 15:2359-2366、1995;Walkinshawら、「L-DOPAによる、カテコールアミン放出PC12細胞におけるアポトーシスの誘導。パーキンソン病の処置のための含意」、J. Clin. Invest. 95:2458-2464、1995によって開示される。
昆虫細胞におけるアポトーシスについてのアッセイは:Clemら、「昆虫細胞に対する感染の間の、バキュロウイルス遺伝子によるアポトーシスの防止」、Science 254:1388-90、1991;Crookら、「亜鉛フィンガー様モチーフを有する、アポトーシスを阻害するバキュロウイルス遺伝子」、J. Virol: 67:2168-74、1993;Rabizadehら、「バキュロウイルスp35遺伝子の発現は、哺乳動物神経細胞死を阻害する」、J. Neurochem. 61:2318-21、1993;Birnbaumら、「Cys/His配列モチーフを有するポリペプチドをコードする、核多角体病ウイルスからの、アポトーシス阻害遺伝子」、J. Virol. 68:2521-8、1994;Clemら、Mol. Cell. Biol. 14:5212-5222、1994によって開示される。
V.組識および器官の移植におけるサービビンの使用
本発明は、被験体における組識または器官の移植片拒絶を阻害または防止する方法を含み、サービビンポリペプチド、サービビンポリペプチドフラグメント、アポトーシスを阻害するそれらのペプチド模倣物、サービビンポリペプチドをコードする導入遺伝子、またはサービビンポリペプチドフラグメントをコードする導入遺伝子を、組識、器官への、または移植片に近位の部位への、局所投与を包含する。組識、器官への、または移植片に近位の部位への、ポリペプチド、ペプチド模倣物の局所送達は、一般的に利用可能な任意の手段によって達成され、これらとしては、直接的な局所灌流、注入、マイクロスポンジ(microsponge)、マイクロカプセル、リポソーム、または時間放出送達ベヒクルが挙げられるが、これらに制限されない。
組織、器管への、またはまたは移植片に近位の部位への、サービビンポリペプチドをコードする導入遺伝子、またはサービビンポリペプチドフラグメントをコードする導入遺伝子の局所送達は、任意の利用可能なベクターを用いて、リポフェクションを介して、または直接的なプラスミドDNA注入を介して、達成され得る。Qinら(1995)Transplantation 59(6):809-816;Le Coultreら(1997)Eur. J. Pediatr. Surg. 7(4):221-226;Wangら(1992)Transplantation 53(3):703-705;Wangら(1996)Transplantation 61(12):1726-1729;Schmidら(1997)Eur. J. Cardiothorac. Surg. 11(6):1023-28;およびBoasquevisque, C.ら(1997)Ann. Thorac. Surg. 63(6):1556-1561を参照のこと。導入遺伝子をコードするベクターは、複製可能なベクターおよび複製欠陥ベクターの両方(例えば、レトロウイルスベクター、アデノウイルスベクター、またはアポトーシスに関与する傾向がある細胞もしくはアポトーシスの部位に近位の細胞についての適切な向性を有する、他のベクター)を含む。導入遺伝子構築物について、発現は、任意の適切なプロモーター(ヒトインスリンプロモーターのような、特定の細胞型における遺伝子発現を指向する組織特異的プロモーターを含む)から指向され得る。組識、器官への、または移植片に近位の部位への、導入遺伝子の局所送達は、一般に利用可能な任意の手段によって達成され、これらとしては、直接的な局所灌流、注入、マイクロスポンジ、マイクロカプセル、リポソーム、または時間放出送達ベヒクルが挙げられるが、これらに制限されない。
さらなる記載を伴うことなく、当業者は、上述の記載および以下の説明的な実施例を用いて、本発明の化合物を作製および利用し得、そして本発明の方法を実施し得ることが考えられる。それゆえ、以下の実用的な実施例は、本発明の好ましい実施態様を具体的に指摘し、そして開示の残余をいかなるようにも制限するとして解釈されない。他の一般的な構成は、当業者に明らかである。全ての雑誌文献および他の刊行された書類(例えば、特許および特許出願)は、その全体が参考として本明細書中に援用される。
実施例
実施例1 実験手順およびクローニング
細胞および細胞株。以下の細胞株を、アメリカンタイプカルチャーコレクション(ATCC、Rockville、MD)から得た。赤白血病HEL、Bリンパ腫DaudiおよびJY、単球THP-1、T白血病Jurkat、上皮ガン腫HeLa、前骨髄球HL-60、および非形質転換ヒト肺線維芽細胞Lu18。T白血病細胞株MOLT13は、以前に特徴付けられた(Altieri, D.C.、FASEB J(1995)9:860-865)。細胞を、10%熱不活化胎児ウシ血清(FBS、Whittaker)、2mM L-グルタミン、および10mM HEPESを補充した、完全培地RPMI 1640またはDMEM(HeLa、Lu18)(Bio Whittaker、Walkersville、MD)中で培養において維持した。ヒト臍静脈内皮細胞(HUVEC)は、コラゲナーゼ処理によって単離され、そして20% FBS、2mM L-グルタミン、および内皮細胞増殖因子(Biomedical Technologies, Stoughton, MA)を補充されたDMEM培地中の培養において維持された。
末梢血単核細胞(PBMC)は、正常な同意を得たボランティアから、400gで22℃でのFicoll-Hypaque(Pharmacia、Piscataway、NJ)における示差的な遠心分離によって回収し、そしてリン酸緩衝化生理食塩水(PBS)、pH7.4中で洗浄した。いくつかの実験において、HL-60細胞を、0.1μM 1,25-ジヒドロキシ-ビタミンD3および17.8μg/mlインドメタシン(Sigma Chemical Co., St. Louis, MO)の存在下での、72時間の培養によって、成熟な単球表現型に末端的に分化した。ビタミンD3処理したHL-60細胞上での分化依存的マーカー(CD11b/CD18インテグリン(Hickstein, D.D.ら、J Immunol(1987)138:513-519を含む)の新規誘導を、抗CD11b mAb LM2/1を用いるフローサイトメトリーによって測定した。
ゲノムおよびcDNAのクローニング、染色体局在性、およびサザンブロット。
ヒトP1ゲノムライブラリー(Genome Systems, St.Louis, MO)を、完全なヒトEPR-1 cDNA(Altieri, D.C.、FASEB J(1995)9:860-865)を含む、1.6kbフラグメントでハイブリダイズすることによって、スクリーニングした。3つの重複するクローンを単離し、精製し、そしてEPR-1 cDNAとのサザンハイブリダイゼーションによって確認した。BamHI、HindIII、およびXbaI(Boehringer Mannheim、Indianapolis, IN)での制限消化によって作製される、ハイブリダイズするフラグメントを、さらなる分析のために、pBluescript(pBSKS-、Stratagene、San Diego、CA)にクローン化した。2つのEPR-1ハイブリダイズP1クローンからの、14796bpに及ぶ重複するコンティグを配列し、制限分析によって特徴付けし、そしてApplied BioSystem Prism 377自動化シーケンサー(Foster City、CA)を用いて、Taq FSポリメラーゼベースの自動化配列決定によって、両方の鎖に対して完全に配列決定した。いくつかの実験において、グアニジニウムイソチオシアネート法によってHeLa細胞から抽出された10mgの全RNAを、EPR-1正方向「センス」オリゴヌクレオチドC3/27(bp80〜102)でプライムし、200UのSuperscript II(Life Science, Grand Island, NY)の存在下、50分間、42℃にて逆転写した。
得られたcDNAを、50mlの全容量中の0.5mgのEPR-1由来のプライマーT5/27(bp161-184)およびG11/16(1124-1098、EPR-1コード配列からの番号付)、200mM dNTP(New England Biolabs、Beverly, MA)、ならびに2UベントDNAポリメラーゼ(New England Biolabs)の存在下で、PCRによって増幅した。58℃で1分間のアニーリング、94℃で1分間の変性、および72℃で1分間の伸長での35サイクルの増幅後、産物をアガロースゲル電気泳動によって分析し、pCRII(Invitrogen Corp.、San Diego、CA)にサブクローン化し、そして両方の鎖に対して完全に配列決定した。コンティグアセンブリ、ならびにDNAおよびタンパク質の配列解析を、Lasergene(DNASTAR、Madison、WI)およびMac Vector(Eastman Kodack、Rochester、NY)ソフトウェアパッケージを使用して行った。EPR-1をハイブリダイズする遺伝子の染色体の位置を、蛍光インサイチュハイブリダイゼーションによって行った。EPR-1をハイブリダイズするP1クローンからの精製DNAを、ニック翻訳によって、ジゴキシゲニンdUTP(Amersham Corp.、Arlington Heights、IL)で標識した。
標識化プローブを、剪断されたヒトDNAと合わせ、そして50%ホルムアミド、10%デキストラン硫酸、および2×SSCを含有する溶液中で、フィトヘマグルチニンで刺激されたPBMCに由来する正常な中期染色体にハイブリダイズした。2色染色のために、ビオチン結合化プローブD17Z1(第17染色体のセントロメアに特異的)を、ジゴキシゲニン標識化P1クローンと同時ハイブリザイズした。特異的な染色が、ハイブリダイズされた切片を、フルオレセイン化された抗ディグオキシゲニン抗体およびテキサスレッドアビジンとともにインキュベートすることによって検出した。切片を、単色標識化について、プロピジウムヨウ化物で、または2色標識化について、DAPIで、対比染色した。総計80個の中期細胞を分析し、69個の細胞が特異的な標識化を示した。サザンハイブリダイゼーションについて、ヒトゲノムDNAを、刊行されたプロトコルに従ってHaLa細胞から抽出し、EcoRI、BamHI、XbaI、またはHindIIIで消化し、0.8%アガロースゲル上で分離し、そしてGeneScreenナイロンメンブレン(New England Nuclear、Boston、MA)に移した。
UV架橋後(Stratalinker、Stratagene、San Diego、CA)、回転式ハイブリダイゼーションオーブン(Hoefer Scientific San Francisco、CA)において、65℃にて、5×SSC、0.5% SDS、5×デンハルト溶液、および0.1%リン酸ナトリウム中の100mg/mlの変性サケ精子DNA(Promega Corp. Madison、WI)で、メンブレンをプレハイブリダイズした。ハイブリダイゼーションを、ゲル精製された(GeneClean Bio101、Vista、CA)、32P-dCTP(Amersham)ランダムプライム化標識された(Boehringer-Mannheim、Indianapolis、IN)1.6kb EPR-1 cDNAを用いて、16時間、65℃にて行った。
30分間、65℃で、2×SSC、1% SDSにおいて、および22℃で0.2×SSCにおいての2回の洗浄後、放射能バンドを、Kodack X-Omat AR X線フィルムを用いて、オートラジオグラフィーによって可視化し、そしてスクリーンを増強した(DuPont de Nemours、Wilmington、DE)。他の実験において、培養されたリンパ芽腫細胞を、2×106/220μlブロックの濃度で、LMPアガロース(Bio Rad, Richmond、CA)に包埋し、そしてDNAを標準的な手順によって抽出した。MluIまたはNotIでのブロック消化後、サンプルを、Bio-Rad CHEF DRII装置(Hercules、CA)を用いて、75秒間のパルス時間を伴う、20分間、200Vでの、1%アガロースゲルにおけるパルス化フィールドゲル電気泳動によって分離した。ナイロンメンブレンに移し、そしてUV架橋した後、EPR-1 cDNAでのハイブリダイゼーション、および洗浄を、上記のように行った。
別の一連の実験において、いくつかの種から単離されたゲノムDNA(Clontech、San Francisco、CA)のアリコートを含有するブロットを、上記のように、EPR-1 cDNAの3’548bpフラグメントでハイブリダイズした。
ノザンブロット。 センスまたはアンチセンスEPR-1配列に特異的な1本鎖プローブを、EPR-1 cDNAの301bpフラグメントの非対称なPCR増幅によって、作製した。第1の5’226bpのEPR-1コード領域+75bpの保持された調節イントロン(Altieri, D.C.、FASEB J(1995)9:860-865)を含む鋳型を、EcoRI(クローニング部位)およびSacIIでのEPR-1 cDNAの制限消化によって作製し、ゲル精製し、そして20mM Tris HCl、50mM KCl、pH8.4、1.5mM MgCl2、および2.5UのTag DNAポリメラーゼ(Life Science)の存在下、15pmol dNTP(New England Biolabs)、7.5pmol dCTP、および25mCi32P-dCTP(Amercham)とともに、10mlの全容量で混合した。
EPR-1特異的アンチセンスプローブの作製を、0.2mg/mlの「SacII」逆方向オリゴヌクレオチド5’TGCTGGCCGCTCCTCCCTC3’の付加によって行い、一方EPR-1ポジティブ鎖の伸長およびサービビン特異的プローブの作製を、0.2mg/mlの正方向F11オリゴヌクレオチド5’ATGACCTCCAGAGGTTTC3’を用いて行った。94℃で1分間の変性、52℃で1分間のアニーリング、および72℃で1分間の伸長を伴う、25サイクルの増幅を行った。EPR-1センスまたはアンチセンスプローブを、Sephadex G-50スピンカラム(Worthington Biochemical Corp.、Freehold、NJ)を介して、14,000gで、5分間、遠心分離し、組込まれた放射能から分離し、100℃で、2分間、加熱し、そしてハイブリダイゼーション反応物に迅速に添加した。
同一の鎖特異的プローブを、60℃にて、14時間の、5×SSPE、10×デンハルト溶液、2% SDS、100mg/ml変性サケ精子DNA中での、成体または胎児ヒトmRNAの複数の組識ブロット(Clontech)のハイブリダイゼーションのために使用し、そして洗浄を、60℃にて、上記のように行った。未分化のHL-60細胞、またはビタミンD3で末端的に分化されたHL-60細胞から抽出された、全RNAのアリコートを、上記のように、サービビン特異的な1本鎖プローブを用いるノーザンハイブリダイゼーションについて、プロセスした。
実施例2 抗サービビン抗体の生成
JC700と呼ばれる、サービビン配列特異的抗体を、以下のように生成および特徴付けした。サービビン配列に対応する17マーのペプチドA3PTLPPAWQPFLKDHRI19を合成し、そして質量分析によって特徴付けした。100mgのサービビンペプチドを、キーホールリンペットヘモシアニンに対して1:1の比率で結合させ、そして完全Freundアジュバント中で、ウサギに皮下注射した。4週間の後、動物を、不完全Freundアジュバント中の100mgのペプチドの皮下注射で、追加免疫し、そして1週間毎に、連続的に追加免疫および採血した。
抗サービビン抗体の精製を、ペプチドSepharoseマトリクスに対するアフィニティークロマトグラフィー(5mg/mlのペプチド)によって、1mMグリシン、pH2.5における特定のIgG画分の溶出を伴って、行った。アフィニティー精製された抗サービビン抗体(JC700と呼ばれる)の特異性を、OD405での吸光度により、固定化されたサービビンペプチドまたはコントロールEPR-1ペプチドに対するELISAによって、測定した。
実施例3 サービビン融合タンパク質に対するモノクローナル抗体の生成
サービビンcDNAを、E.Coli BL21株においてGST-融合タンパク質として発現させ、そして、GSTフレームが除去された同質物まで精製した。精製タンパク質をマウスに注射するために使用し、そして標準的なハイブリドーマ技術を使用して、モノクローナル抗体を作製した。3つの別々のmAbを単離し、限界希釈によって二回クローン化し、そしてさらに特徴付けした。新規な抗サービビンのmAbのうちの1つ(8E2と称される)は、固定化された精製組換えサービビンを、ELISAによって認識し、そして、図11に示されるように、イムノブロットにおいてサービビンに結合した。
実施例4 イムノブロッティングおよびインサイチュハイブリダイゼーション
イムノブロッティングのために、種々の形質転換された細胞株、非形質転換HUVEC、PBMC、もしくはLu18、または未分化のもしくはビタミンD3で分化されたHL60細胞のSDS可溶化抽出物のアリコートを、OD280での吸光度によってタンパク質含量について正規化し、非還元条件下での5〜20% SDSポリアクリルアミド勾配ゲルにおける電気泳動によって分離し、そして1.1Aで、30分間、22℃にて、Immobilonメンブレン(Millipore Corp.、New Bedford, MA)にエレクトロブロットした。メンブレンを、TBS、pH7.4+5%ミルク中でブロックし、そして、20mg/mlのコントロール非免疫ウサギIgGまたは抗サービビン抗体JC700とともに、1時間、22℃にてインキュベートし、次いでTBS、pH7.4中で洗浄し、そして1:7500希釈のアルカリホスファターゼ結合ヤギ抗ウサギIgG(Promega)を、30分間、22℃で添加した。一次抗体の結合を、70%ジエチルホルムアミド中の75mg/mlニトロブルーテトラゾリウム(Sigma Chemical Co.、St. Louis, MO)および100%ジメチルホルムアミド中の50mg/ml 5-ブロモ-4-クロロ-3-インドイルリン酸(Sigma)の添加によって明らかにした。
組識サンプル、免疫組識化学、およびインサイチュハイブリダイゼーション。結腸腺ガン腫(6症例)、肺鱗状細胞ガン腫(6症例)、肺腺ガン腫(9症例)、膵臓腺ガン腫(2症例)、侵襲性の乳腺ガン腫(7症例)からのからの組識サンプルを、Yale-New Haven Hospitalの保管所から得、そして本研究に使用した。44個の高い悪性度分類のリンパ腫組識のサンプル、および7個の低い悪性度分類のリンパ腫組識のサンプルもまた入手した。組識サンプルを、ホルマリン中に固定化し、パラフィン中に包埋し、5μmの切片に切断し、キシレン中でパラフィン除去し、そして特級アルコール中で再水和し、次いで内因性ペルオキシダーゼ活性を、メタノール中の2% H2O2での処理によって、クエンチングした。
免疫染色について、切片を、標準的な圧力調理器中で、5分間煮沸し、10%の通常ヤギ血清中でブロックし、そしてアフィニティー精製された抗サービビン抗体JC700(20μg/ml)とともに、14時間、4℃にて、インキュベートした。PBS、pH7.4中での洗浄後、切片をさらに、ビオチン結合ヤギ抗ウサギIgG(Vector Laboratories、Burlingame、CA)とともに、30分間、22℃にてインキュベートし、そしてPBS、pH7.4中で洗浄した。ストレプトアビジン−ビオチン結合ペルオキシダーゼ(Boehringer Mannheim)の、30分間、22℃での添加後、切片を洗浄し、そして一次mAbの結合を、3’-3’-ジアミノベンジジン(DAB)の添加、およびヘマトキシリンでの対比染色によって明らかにした。
ネガティブコントロールを、一次抗体を通常のヤギ血清に置換えることによって、同じ実験条件下で、行った。いくつかの実験において、組識染色の前に、JC700抗体のアリコートを、25mg/mlのサービビン3-19ペプチドで予め吸収した。インサイチュハイブリダイゼーションについて、pcDNA3(Invitrogen)において完全なコード配列+271bpの3’非翻訳領域を含有する1μgのサービビンcDNAを、EcoRIで完全に消化し、そしてジゴキシゲニン11-ウリジン-5’三リン酸(Boehringer Mannheim)の存在下で、T7 RNAポリメラーゼを用いて、アンチセンスの方向に転写した。組識切片を、1%ゼラチン、0.1%クロムアルミニウムでコートし、120℃で、2時間、ベーキングし、そして22℃で無屑的に保存した。切片を、パラフィン除去し、そして特級アルコールにより再水和し、プロテイナーゼK(100mM Tris HCl pH8.7、50mM EDTA中の1μg/ml)で、30分間、37℃で消化し、そして0.25%無水酢酸および100mMトリエタノールアミンpH8.0中で、10分間、22℃でアセチル化した。
ヒト組識におけるサービビンmRNAの検出を、4×SSC、1×デンハルト溶液、50%脱イオン化ホルムアミド、250μg/ml酵母tRNA、500μg/mlサケ精子DNA、および5%デキストランを含有する緩衝液中での、16時間、50℃にての、サービビンアンチセンスリボプローブのインサイチュハイブリダイゼーションによって、行った。2×SSC中で、90分間、48℃での洗浄後、固定化したジゴキシゲニンを、1:3000希釈の抗ジゴキシゲニンmAb(Boehringer Mannheim)を用いて検出し、そしてNBT/BCIP細胞化学染色でのアルカリホスファターゼ染色によって明らかにした。
実施例5 ヒトガンにおけるサービビンの発現
サービビンは、ヒトガン細胞において顕著に発現される。形質転換された細胞型におけるその豊富な分布について、新形成におけるサービビンの潜在的な発現を、インビボで調査した。アフィニティー精製された抗サービビンJC700抗体を用いる、ホルマリン固定され、パラフィンに包埋された組識切片の免疫組識化学的分析は、ヒト肺ガンの試験された全ての症例(腺ガン腫(図6A)、および鱗状細胞ガン腫(図6C)を含む)において、サービビンの豊富な発現を実証した。他のIAPタンパク質の形態学(Duckett, C.S.ら、EMBO J(1996)15:2685-2694)と一致して、タンパク質の発現は腫瘍細胞の細胞質に排他的に局在したが、隣接の正常な肺の腺上皮は、サービビンを発現しなかった(図6C、矢印)。抗サービビン抗体を、コントロールヤギ血清で置換えた場合(示さず)、または免疫したサービビン3-19ペプチドで予め吸収した後(図6B)は、染色は何も観察されず、従って観察された認識の特異性を確認した。
鱗状肺細胞におけるサービビンmRNAの顕著な蓄積は、サービビン特異的1本鎖リボプローブでのインサイシュハイブリダイゼーションによって、独立して実証された(図6D)。サービビンはまた、免疫組識化学によって膵臓(図6E)、および胸(示さず)の、ならびにインサイチュハイブリダイゼーションによって結腸(図6G)の、腺ガン腫の試験された全ての症例において、豊富に検出された。しかし、非形質転換細胞型のHUVECおよびLu18において(図4C)、成熟組識(図3)、および末端的に分化されたHL-60細胞(図5)におけるその不在と一致して、抗サービビンJC700抗体の反応性は、免疫組識化学によって、正常な外分泌腺膵臓上皮細胞で観察何もされず(図6F)、そしてサービビンmRNAは、インサイチュハイブリダイゼーションによって、隣接の非新生物結腸腺上皮において何も見出されなかった(図6H)。
リンパ腫組識におけるサービビンの発現。 組識サンプルを、攻撃性の、高い悪性度分類のリンパ腫を伴う44人の患者から得、そして7個のサンプルを、非攻撃性の、低い悪性度分類のリンパ腫を伴う7人の患者から得た。サンプルを、上記のように処理し、そしてサービビン発現について試験した。低い悪性度分類のリンパ腫サンプルのいずれも、サービビン発現を示さなかったが、高い悪性度分類のリンパ腫を伴う患者からの27サンプル(61%)は、サービビンを発現した。
実施例6 他のガンにおけるサービビンの発現
上述で考察した悪性形態に加えて、他のタイプのガンにおけるサービビンの発現を、本発明者らの実験室において、または他の大学の発明者との共同研究で、調査した。サービビンは、ほとんどの攻撃的なおよび転移の形態の悪性胸腺種(試験した100症例)において、頭部および頚部鱗状細胞ガン腫(140症例)において、および前立腺ガンの全ての形態(15症例)において(良性前立腺過形成の遷移病変を含む)、顕著に発現されることが見出された。神経芽腫の最も前進的な形態はまた、以下に考察されるように、サービビンについてポジティブである。
実施例7 サービビンの組織特異的発現
サービビンは、近年、最も一般的なヒトガンの全てにおいて見出されたが、正常な、最終的に分化した成体組織においては見出されなかった。胚発生および胎児発生におけるサービビンの発現を、調査した。免疫組識化学およびインサイシュハイブリダイゼーション研究は、いくつかのアポトーシスが調製された胎児組識(層化された上皮、外分泌腺膵臓、および胸腺骨髄の幹細胞層を含む)における、別のアポトーシスインヒビター(すなわち、bcl-2)のパターンとは重複しないパターンを伴って、サービビンの強力な発現を実証した。サービビンに対する配列特異的抗体は、ヒト胎児の肺、肝臓、心臓、腎臓、および胃腸管において、単一の約16.5kDのサービビンバンドをイムノブロットした。マウス胚において、サービビンの顕著なおよびほぼ偏在的な分布が、胚日数(E)11.5で見出されたが、E15-20で、サービビン発現は、肺および神経堤由来細胞の遠位の細気管支上皮(背面根神経節ニューロン、下垂体、および脈絡叢を含む)に制限された。これらのデータは、肺および胎児の発生におけるサービビンの発現が、bcl-2に独立して、組識ホメオスタシスおよび分化に貢献し得ることを示唆する。
実施例8 サービビントランスフェクト体の調製
誘導性サービビンアンチセンストランスフェクト体およびアポトーシス/増殖実験。 EPR-1 cDNAのヌクレオチド379〜1087を含む、708bpのSmaI-EcoRIフラグメントを、哺乳動物細胞発現ベクターpML1(R.Pytela博士、Cardiovascular Research Institute、University of California、San Franciscoによって好意的に提供された)に、センス方向に、指向的にクローン化した。このベクターは、サイトメガロウイルスプロモーターカセットを、mMT1プロモーター(哺乳動物細胞において、組換えタンパク質のZn2+依存性の発現を指向する(Lukashev, M.E.ら、J Biol Chem(1994)269:18311-18314))で置換えることによって、外分泌的哺乳動物細胞発現ベクターpCEP4に由来した。
1000万個のHeLa細胞を、サービビンアンチセンス構築物を含有する10mgのpML1 DNA+50mgのサケ精子DNAとともに、15分間氷上でインキュベートし、次いで、Gene Pulser機器(Bio-Rad)によって、350Vで、960μFにて送達される、単一の電気パルスを行った。トランスフェクションの48時間後、細胞を、15倍希釈して、100mm直径の組織培養ディッシュ上にプレートし、そして0.4mg/mlハイグロマイシンを含有する完全増殖培地中で、4週間選択した。コントロール培養物またはサービビンアンチセンスHeLa細胞形質転換体におけるアポトーシスを、血清涸渇条件下でのEPR-1転写のZn2+依存性の誘導後、核染色体内のDNA分解のインサイシュ検出によって、評価した。
簡潔には、コントロールまたはアンチセンスサービビン形質転換体を、0% FBS中の200mM ZnSO4で、24時間、37℃で処理した。細胞を採集し、800gで、10分間、4℃にて遠心分離し、そしてペレットを10%ホルマリン中で、一晩固定し、脱水し、パラフィンブロック内に包埋し、そして3〜5mmの切片を、接着性の高いスライド上においた。サンプルを、20mg/mlプロテイナーゼKで、15分間、22℃で処理し、蒸留水中で洗浄し、PBS中の2%H2O2において、内因性ペルオキシダーゼをクエンチングし、そして続いて、ターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT)の存在下でジゴキシゲニン標識化dUTPと混合し、次いでペルオキシダーゼ結合抗ジゴキシゲニン抗体と混合した。
アポトーシス細胞における核染色を、製造業者の指示(AptoTag、Oncor、Gaithersburg、MD)に従って、DABによって検出した。コントロール実験を、酵素インキュベーション工程を省略することによって行った。試験した種々の条件下でのアポトーシス細胞の形態学的特徴(アポトーシス体)を、同じ切片のヘマトキシリン/エオシン染色によって検出した。
増殖実験について、ベクターコントロールHeLa細胞またはサービビンアンチセンストランスフェクト体を、20×104/ウェルで、24ウェル組織培養プレート(Costar)上にプレートし、200mM ZnSO4とともに、16時間、37℃でインキュベートし、24時間の間隔で採集し、そして試験した種々の条件下での細胞増殖を、直接的な細胞計数によって、顕微鏡で測定した。これらの実験条件下でのサービビン発現のダウンレギュレーションを、JC700抗体でのイムノブロッティングによって評価した。
実施例9 EPR-1相補遺伝子の同定
3つの重複するクローンを、EPR-1 cDNAを用いる、ヒトP1プラスミドゲノムライブラリーのハイブリダイゼーションスクリーニングによって単離し、そしてサザンブロットによって確認した。この遺伝子は、第17染色体の長腕に位置づけられ、蛍光インサイチュハイブリダイゼーションによってバンド17q25に位置づけられた(図1A、B)。
14796bpに及ぶP1フラグメントのコンティグを、pBSKS-中にクローン化し、そして両方の鎖に対して完全に配列決定した(図1C)。3つの推定スプライス部位は、真核生物のイントロン−エキソン境界についてのコンセンサス配列(Padgett, P.A.ら、Ann Rev Biochem(1986)55:1119-1150)と完全にマッチし、第2922位、3284位、および5276位(ドナー)、ならびに3173、5157、および11954(アクセプター)で同定され、従って4つのエキソン、ならびにそれぞれ、252、1874、および6678bpの3つのイントロンに、遺伝子構成を規定した(図1D)。
推定のコード領域の配列分析は、5ヌクレオチドの変化および6ヌクレオチドの挿入以外は、EPR-1 cDNA(Altieri, D.C., FASEB J(1995)9:860-865)とのほぼ完全な同一性を実証した。しかし、3つのスプライス部位が、EPR-1コード配列の相補的な、アンチセンス鎖に見出された。この予期されない配向と一致して、EPR-1相補的遺伝子は、5’GCリッチ領域を明らかにし、これはヌクレオチド2560-2920を含み、そしてエキソン1(以下を参照のこと)を含み、これは、CpG島の塩基組成基準(Gardiner-Garde, M.ら、J Mol Biol(1987)196:261-282およびFrommer、1987)を満たした。CpG島の2.5kb上流の配列決定は、多数のSp1部位を有するTATA欠損プロモーターを明らかにした(示さず)。
複合体のハイブリダイゼーションパターンおよびEPR-1配列の進化的保存。 EPR-1 cDNAでのヒトゲノムDNAのプローブ化は、いくつかのハイブリダイズするフラグメントを明らかにした(図2A)。これらのうち、約7.5kb XbaI、7.6kb BamHI、ならびに約15、7.5、6.4、および3.7kbの4つのHindIIIフラグメント(図2A、矢印)は、それぞれ、アンチセンスEPR-1遺伝子の制限マップによって再現され得なかった(図1C)。対照的に、比較可能な強度の他のバンド(5.15kb XbaIフラグメントおよび7.1kb BamHIフラグメントを含む)は、アンチセンスEPR-1遺伝子から真正に由来し、そして初めの2または3つのエキソンを、それぞれ含んだ(図2A)。
この複雑なハイブリダイゼーションパターンとは異なり、MluIまたはNotIで消化され、そしてパルス化フィールドゲル電気泳動によって分離された高分子量のヒトゲノムDNAのサザンブロットは、それぞれ、約75kbおよび130kbの、単一のEPR-1にハイブリダイズするバンドを明らかにした(図2B)。最後に、高いストリンジェンシーハイブリダイゼーション条件下で、哺乳動物種における多数の強力なハイブリダイズバンド、ならびにウサギまたはニワトリのゲノムDNAにおける弱いシグナルを伴って、複数の種のゲノムDNAのサザンブロットは、EPR-1関連配列の、有意に進化的保存を明らかにした(図2C)。
センス/アンチセンスEPR-1転写物の一致しない組識分布。異なるセンスまたはアンチセンスEPR-1転写物の潜在的な発現を、1本鎖特異的プローブでのノザンブロットにおいて調査した。スプライスされたEPR-1メッセージの大きさ(Altieri, D.C.、FASEB J(1995)9:860-865)と一致して、EPR-1鎖特異的プローブは、試験した全ての成体および末端的に分化したヒト組識から抽出されたmRNAにおいて、顕著な約1.2kbのバンドを検出した(図3A)。対照的に、同じ実験条件下、成体組織において、EPR-1アンチセンス特異的1本鎖プローブと、特異的バンドはハイブリダイズされなかった(図3B)。類似の約1.2kbバンドが、胎児腎臓において1本鎖のEPR-1特異的プローブによって検出され、そしてより少ない程度で、胎児の肺、肝臓および脳において検出された(図3A)。成体組織におけるハイブリダイゼーションの不在とは異なり、EPR-1アンチセンス特異的プローブは、胎児肝臓において、顕著な約1.9kbのバンド、およびより大きな3.2kb種(不完全にプロセスされた転写物の大きさに対応する)を認識したが、胎児腎臓、肺、および脳においてより弱いハイブリダイゼーションバンドがまた検出された(図3B)。アクチンプローブでのコントロールハイブリダイゼーションは、成体または胎児のサンプルにおけるmRNAの比較可能なローディングを確認した(図3C)。
アンチセンスEPR-1遺伝子産物の特徴づけ。アンチセンスEPR-1遺伝子における5’CpG島の調査は、第2811位での推定のATG開始コドンを明らかにし、これは真核生物翻訳開始のコンセンサスに十分適合される配列(CGGCATGG)(Kozak, M., Nucleic Acids Res(1984)12:857-872)よって囲まれた。イントロン−エキソン境界の位置によって指図される5’→3’方向におけるアンチセンスEPR-1配列の分析は、426bpのオープンリーディングフレームを明らかにし、これは全ての4つのエキソンに及び、そしてエキソン4における12042位にてTGAコドンで終結する。模範的なポリアデニル化シグナル(AATAAA)が、13166位で見られた。EPR-1「センス」オリゴヌクレオチドでプライムされた、逆転写されたHeLa細胞RNAから増幅されたPCR産物は、ゲノム配列に完全にマッチし、そしてオープンリーディングフレームおよび推定イントロン−エキソン境界を確認した(示さず)。
EPR-1 cDNAを用いる、HELライブラリーのハイブリダイゼーションによって単離された、2つのλgt11 cDNAクローンはまた、コンセンサスゲノム配列とマッチし、13186位にてアンチセンスEPR-1鎖上でのホモ多型Aテイルを明らかにし、これはポリアデニル化シグナルの14bp下流であり、1144bpの3’非翻訳領域を生成した。これらのクローンにおいて、開始ATGから上流の5’非翻訳領域は、49bpであり、ゲノム配列の2762位で始まり、そしてインフレーム終結コドンを含んだ。アンチセンスEPR-1オープンリーディングフレームの翻訳は、142アミノ酸の新規なタンパク質を予測し、これは、16.389の見積り分子量および5.74の酸性pIを有し、アミノ末端シグナルペプチドまたは膜挿入のためのカルボキシ末端の疎水性ストレッチを欠損した(図4A)。
最後の40カルボキシ末端残基について、コイルドコイルが予測された(Lupas, A.ら、Science(1991)252:1162-1164)。BLASTデータベース検索は、アンチセンスEPR-1遺伝子産物の残基18〜88と、アポトーシスのインヒビターのIAPファミリーにおけるBIR分子との間の、有意な程度の類似性を明らかにした(Bimbaum, M.J.ら、J Virology(1994)68:2521-2528;Clem, R.J.ら、Mol Cell Biol(1994)14:5212-5222)。この類似性について、アンチセンスEPR-1遺伝子産物は、サービビンと称された。他のIAPタンパク質とは異なり、サービビンは、わずかに1つのBIRを含み、遺伝子の最初の3つのエキソンによってコードされ、そしてカルボキシ末端RINGフィンガーを欠損し、このドメインを潜在的にコードする付加的/代替的エキソンを有さなかった(図1C)。
Clustal法による、サービビンBIRと、他の公知のIAPタンパク質のBIRとの間のアラインメントを、図4Bに示す。コンセンサスおよびいくつかの保存的な置換の全体的なマッチにも関わらず、統計学的分析は、サービビンがIAPファミリーとわずかに関連したメンバーである(ここで、NAIP(これはまた、RINGフィンガー(図4B、影を付した四角)を欠損する)に最も密接に関連した)ことを示した(Roy, Nら、Cell(1995)80:167-178)。
JC700と称されるウサギポリクローナル抗血清を、サービビンの残基A3PTLPPAWQPFLKDHRI19(配列番号13)に対して惹起し、ペプチド−Sepharoseカラムにおけるアフィニティークロマトグラフィーによって精製し、そしてウエスタンブロットにおいて使用した。サービビンの推定分子量と一致して、JC700抗体は、試験した全ての形質転換された細胞株(Bリンパ腫DaudiおよびJY、T白血病JurkatおよびMOLT13、単球THP-1、ならびに赤白血病HELを含む)の界面活性剤可溶化抽出物からの約16.5kDaの単一のバンドをイムノブロットした(図4C)。
サービビンはまた、単離された抹消血単核細胞(PBMC)において見出された。対照的に、非形質転換Lu 18ヒト肺線維芽細胞またはヒト臍静脈内皮細胞(HUVEC)において、サービビンの発現は検出されなかった(図4C)。同じ実験条件下で、コントロール非免疫ウサギIgGによって、非特異的バンドは何もイムノブロットされなかった(図4C)。
EPR-1遺伝子の転写を調節する薬剤の同定。EPR-1遺伝子の転写を増加する薬剤は、EPR-1の従来の技術によって同定され得る。好ましくは、候補薬剤を、EPR-1遺伝子産物を発現する細胞と接触させ、そしてこの産物の発現のレベルまたは転写のレベルを測定し、そしてEPR-1遺伝子転写物を増加または減少する薬剤が、容易に同定され得る。あるいは、EPR-1転写調節エレメントは、CATまたはβ-ガラクトシダーゼのようなレポーター遺伝子の上流に配置され得る。
実施例10 細胞増殖/分化によるサービビン発現の調節
形質転換された細胞株(図4C)におけるサービビンの発現と一致して、未分化で活発に増殖する前骨髄球HL-60細胞は、JC700抗体での単一の約16.5kDaバンドのイムノブロッティング、および一本鎖特異的プローブでの約1.9kb転写物のノザンハイブリダイゼーションによって実証されるように、高レベルのサービビンを構成的に発現した(図5)。対照的に、同じ実験条件下で、コントロール非免疫ウサギIgGによって、特異的バンドは何も認識されなかった(図5)。
成熟単球表現型への、HL-60細胞のビタミンD3誘導性の末端分化は、これらの細胞の増殖停止、および分化特異的マーカーのデノボ誘導(フローサイトメトリーによって検出される、白血球CD11b/CD18インテグリンの約200倍増加した発現(示さず)を含む)を生じ、そして以前の観察(Hickstein, D.D.ら、J Immunol(1987)138:513-519)との一致を生じた。これらの実験条件下で、抗サービビンJC700抗体は、ビタミンD3処置されたHL60抽出物からの特異的バンドをイムノブロットできず、そして一本鎖特異的プローブとのノザンハイブリダイゼーションによって、サービビン転写物は何も検出されなかった(図5)。
対照的に、抗EPR-1ポリクローナル抗体は、同じ実験条件下で、ビタミンD3で分化されたHL60抽出物において、EPR-1に対応する単一の約62kDaのバンドをイムノブロットした(示さず)。さらに、ビタミンD3で分化されたHL60細胞におけるサービビンのダウンレギュレーションは、抗EPR-1モノクローナル抗体B6または12H1でのフローサイトメトリーによって検出されるように、これらの細胞における5〜10倍増加したEPR-1の表面発現によって達成された(図8)。
図16において示されるように、サービビンは、サイトカインγインターフェロンと腫瘍壊死因子αとの組み合わせによってダウンレギュレートされるが、いずれのサイトカイン単独によってもダウンレギュレートされない。同様に、c-mycガン遺伝子での3T3細胞のトランスフェクションは、ノザンブロットによって検出されるように、サービビンmRNAのアップレギュレーションを生じる。
実施例11 サービビンで促進されるアポトーシス
サービビンを標的化することは、アポトーシスを促進し、および細胞増殖を阻害する。
マウスまたはハムスターの細胞株(NIH 3T3、CHO)におけるサービビンcDNAのトランスフェクションは、これらの細胞における、免疫化学的に区別できない内因性ホモログの存在のために、適切ではなかった(示さず)。同様に、安定なアンチセンストランスフェクト体におけるサービビン遺伝子を標的するための最初の試みは、遅い細胞増殖および生存性の迅速な喪失のために、失敗した(示さず)。それゆえ、サービビン+HeLa細胞を、メタロチオネイン誘導性プロモータ(Lukashev, M.E.ら、J Biol Chem(1994)269:18311-18314)の制御下、EPR-1 cDNAの3’末端(サービビンアンチセンス)でトランスフェクトし、ハイグロマイシンにおいて選択し、そして転写のZn2+依存性活性化後に、アポトーシスおよび細胞増殖について分析した。
形質転換された細胞株(図4C)におけるサービビンの発現と一致して、JC700抗体は、ベクター単独でトランスフェクトされたコントロールHeLa細胞の抽出物において、約16.5kDaの単一の分子種をイムノブロットした(図7A)。対照的に、EPR-1 cDNA(サービビンアンチセンス)でトランスフェクトされた、メタロチオネイン誘導性のHeLa細胞において、JC700抗体によって、特異的なバンドは何も認識されなかった(図7A)。これらの実験条件下、AptoTag染色による、ヌクレオソーム間のDNAフラグメント化のインサイチュ分析は、血清涸渇された、Zn2+誘導性の、ベクターコントロールHaLa細胞において、わずかに数個のアポトーシス細胞を明らかにした(図7B)。
対照的に、上述で考察したように、Zn2+誘導性のアンチセンスHaLa細胞トランスフェクト体において試験した細胞のかなりの大多数において、顕著な核染色に関連した(図7B)。ジゴキシゲニン標識化dUTPのTdTタギングの非存在下で、核染色は何も検出されなかった(示さず)。アポトーシスの代表的な形態学的特徴(多数のアポトーシス体を含む)はまた、ヘマトキシリン/エオシン染色によって、誘導されたアンチセンスHaLa細胞トランスフェクト体において実証されたのに対し、同じ実験条件下で、ベクターコントロールHeLa培養物において、わずかに時折、アポトーシス体が観察されたのみであった(図7B)。
細胞増殖に対するサービビンの潜在的な効果をまた、調査した。これらの実験において、メタロチオネイン制御されたEPR-1依存性の、サービビン発現の阻害は、血清依存性のHaLA細胞増殖の十分な減少を引き起こした(図7C)。Zn2+誘導の3日後、ベクターコントロールHeLa培養物における細胞数は、288%増加し、対照的に、同じ実験条件下で、サービビンアンチセンストランスフェクト体は、わずかに20%の増加であった(図7C)。
実施例12 サービビンの構造−機能の関係
アポトーシスのサービビン媒介性の阻害に関与する最低限の構造要件を、単一のサービビンBIR(バキュロウイルスIAP反復)モジュールにおいて最も進化的に保存されている残基のAla置換の変異誘発戦略を通して同定した。これらの残基は、サービビンBIRのアミノ末端側の半分に含まれた:Arg18、Phe22、Trp25、Pro26、Pro35、Ala39、Ala41、Gly42、およびCys46。サービビンBIRのカルボキシル末端側の半分において、Ala変異体は、Cys57X2Cys60X16His77X6Cys84の推定の亜鉛結合モチーフで、先ず標的化された。変異誘発によって標的化されるさらなる保存残基は、Asp53、Leu64、Trp67、Pro69、Asp71、Asp72、およびPro73を含む。
サービビン変異体を、安定におよび一過性にトランスフェクトされた細胞(それぞれ、IL-3依存性BaF3細胞およびNIH3T3)において、特徴づけした。これらの点変異体に加えて、カルボキシル末端のRINGフィンガーを含むサービビンキメラ分子をまた作製し、そしてアポトーシス阻害についてスクリーニングした(RINGフィンガーは、ほとんどの他のIAPタンパク質において見出されるが、サービビンにおいては見出されないドメインである)。第2に、サービビンの短縮形態をまた、作製し、ここでは予測されるコイルドコイル構造を含む、最後の40個のカルボキシ末端残基を欠失させた。図12において示されるように、サービビンにおいて重要な保存された残基Trp67-Pro73-Cys84のAla変異誘発は、IL-3の投与中止によって誘導されるアポトーシスからBaF3細胞を防御する能力を欠く組換え分子を生成した。
実施例13 サービビンの細胞防御効果
アポトーシスによって媒介される安定な細胞集団に対する細胞障害の伝統的な例は、リンパ球を浸潤することによる同種移植片拒絶、アルツハイマー病、および、心筋梗塞後の再灌流傷害を含む。ガンにおいて発現され、それによってガン細胞に対する増殖有利な因子として機能することに加えて、サービビンの標的化発現は、安定な細胞集団を、アポトーシスおよび他の細胞性傷害から防御するために有用である。サービビンのこの適用を、漸増濃度の精製組換えサービビンを、古典的なアポトーシス誘導刺激物質である過酸化水素(H2O2)で傷害したヒト内皮細胞の単層に添加することによって試験した。結果を、図13にまとめる。添加された漸増濃度のサービビンは、コントロールタンパク質ミオグロビンで処置されたコントロール培養物とは異なり、処置された細胞の有意に増加された生存性を生じた。同様に、アポトーシスからサービビン防御されたNIH3T3細胞は、図17に示されるように、LacZレポーター遺伝子との一過性の同時トランスフェクション後、過酸化水素によって誘導された。
実施例14 予測的予後因子としてのサービビン
サービビンの存在は、神経芽腫および非ホジキンリンパ腫において、ならびに他のガンにおいて、予測的な予後のネガティブな因子として利用され得る。
神経芽腫。 多くの一連の神経芽腫の症例(72)を、多中心の研究においてサービビン発現についてスクリーニングした。図14に示されるように、サービビン発現は、患者が、攻撃的なおよび迅速に進行する疾患についての少なくとも1つのネガティブな予後因子を含む場合、劇的に増加した。第2に、サービビンの発現は、より攻撃的な疾患および好ましくない組識学と、強く相関した。重要なことに、サービビンの発現は、単純な組識学よりも感受性の予後指標であった。好ましい組識学の早期診断を伴うサービビンポジティブな症例は、疾患進行および転移についての少なくとも1つのネガティブな予後因子を含むことが見出された。
ホジキンリンパ腫。類似の多中心の研究を、近年、高い悪性度分類の非ホジキンリンパ腫(n=48)におけるサービビン発現の分析において完了した。結果は、神経芽腫について観察される結果に類似する。図15に示されるように、サービビンの発現は、第IV期に優勢なより広範に及ぶ疾患と強く相関した。臨床学的に、サービビンを発現する患者は、サービビンネガティブな患者に比べて、完全な緩解のより少ないエピソード、および不完全な緩解、緩解なし、または再発のより多くのエピソードを有した。
潜在的な関与。これらの2つの発生学的に異なるタイプのガンにおけるネガティブな予測的予後因子としての、サービビンの実証された役割は、疾患進行および治療に対する応答をモニターするための診断的な(dinnostic)道具としてこの分子の潜在的な使用を反復する。これはまた、病気分類の目的のために、および多剤耐性に潜在的に感受性の患者の集団(緩解なしまたは不完全な緩解を伴う群)を同定するために、使用され得る。また、サービビン遺伝子の完全な配列から容易に設計された、サービビン由来のプライマーは、サービビン遺伝子が欠失または変異されているガンの潜在的な症例を同定するためのスクリーニング道具として使用され得る。サービビン遺伝子の標的化不活性化が、ガン患者に対する好ましい予後因子を付与し、潜在的な薬物耐性遺伝子を除去するので、これらの症例は、同定するために非常に重要である。サービビン遺伝子における変異を不活性化することは、Alaベースの変異誘発の本発明者らの最初のスクリーニングにおいて同定された同じ重要な残基を標的し得るか、または翻訳の未熟な終結のために不全型または短縮型のタンパク質を生じ得る。
実施例15 サービビンガンワクチン
サービビンに対して指向されるワクチンは、ガンの種々のタイプにおいて見出されるように、他の疾患関連性の細胞内タンパク質標的とともに開発され得る。これらの技術は、一般的に利用可能であり、そして代表的なアプローチは、以下に引用される参考文献によって記載される。ワクチンはまた、サービビンのペプチドフラグメントの全身性投与を含み得、そしてサービビンペプチドをコードするミニ遺伝子を、腫瘍細胞標的に送達するためのベクターの使用が意図される。上記のように、サービビンは正常な細胞において、さらに骨髄における増殖幹細胞において発現されない。これは、サービビンに対してマウントされる免疫応答が、非常に選択的および特異的であり、そして正常な細胞を含まないことを確実にする。
ポリペプチドベースのワクチンの開発および投与
一価または多価のガン免疫療法ワクチン産物におけるペプチド成分の使用の方法は、Nardi, N.ら、Mol.Med.(1995)1(5):563-567によって記載される。現在使用される異なるガンワクチンおよびガン免疫療法を考察するさらなる参考文献としては、以下が挙げられる:N.P.RestifoおよびM.Sznol 「Cancer Vaccines」、De Vita’s Cancerにおいて:Principles & Practice of Oncology 3023-3043(Lippincott-Raven、Philadelphia、1997);J. Galea-Lauriら、Cancer Gene Ther.(1996)3(3):202-214;D.C. Linehanら、Ann. Surg. Oncol.(1996)3(2):219-228;およびJ.Viewegら、Cancer Invest.(1995)13(2):193-201。
上述のアプローチと一致して、サービビンポリペプチドまたは完全長サービビンは、公知の技術によって化学的に、または原核生物もしくは真核生物の細胞において適切なcDNAを発現することによって組換え的にのいずれかで、合成される。次いで、このように生成されたサービビンタンパク質は、混入するタンパク質(例えば、血清または細菌タンパク質)を除去するために必要とされる場合、精製される。サービビンはさらに、サービビンを結合する抗体(例えば、サービビンを認識し、これに結合するモノクローナル抗体JC700または抗体8E2(両方ともに先に記載された))を含むカラムを用いて、精製され得る。抗体ベースのワクチンを精製するにおいて、組換え的に生成されたサービビンは、抗体に結合するが、他のタンパク質および細胞残渣は、洗浄して取り除かれる。次いで、サービビンポリペプチドは、単離され、そして所望の強度に濃縮される。
あるいは、サービビンタンパク質は、1つ以上のプロテアーゼ(例えば、トリプシン)を用いてネイティブなサービビンを切断することによって作製される。次いで、タンパク質溶解性フラグメントは、SDS-PAGE、高分離/高圧分離技術、または逆相HPLCを使用して、分離および回収される。R.J. Beynon and J.S. Bond、Proteolytic Enzymes:A Practical Approach(Oxford University Press, New York 1989)を参照のこと。次いで、単離されたこれらのペプチドは、所望の最終濃度に濃縮される。
いったん精製されたら、次いで、サービビンポリペプチドまたは完全長サービビン分子は、アジュバント含有乳濁液中に置かれ得る。サービビンとともに使用するために意図されるアジュバントとしては、アルミニウムアジュバント、Freundアジュバント、結核菌およびインターロイキン-2(IL-2)を含有する水中油乳濁液が挙げられる。さらなる調製物は、サービビンポリペプチドと他の適切な腫瘍関連抗原との、および必要に応じて、他の免疫調節因子(例えば、サイトカイン)との組合せを包含する。他の適切なキャリアまたは賦形剤が使用され得、ウシ血清アルブミンを含み、ハプテン、キーホールリンペットヘモシアニン、オボアルブミン、およびツベルクリンの精製タンパク質誘導体で、サービビンポリペプチドを結合する。Ed HarlowおよびDavid Lane、Antibodies:A Laboratory Manual(Cold Spring Harbor Laboratory、1988)に記載される技術のような技術を用いて、ペプチドは、キャリアに結合され得る。
ヒト被験体におけるワクチンは、皮下、皮膚内、または筋肉内(IM)注入される乳濁液の形態で投与され得;適切に処方されたワクチンは、経口的に用いられ得る。アジュバント含有ワクチンを用いて、ワクチンは、一般に好ましくは、IM(例えば、三角筋)に与えられる。
患者に投与される、サービビンワクチンまたはサービビンペプチドワクチンの量は、他のガンワクチンについて使用される代表的な量に相当する。投薬濃度は、1日あたり約0.25g〜約1000gの範囲である。より好ましい範囲は、1日当たり約10μg〜約500μgである。
実施例16 抗サービビン抗体の診断学的使用
頻繁に、腫瘍関連抗原(TAA)は、腫瘍細胞から、周辺の血漿中に、または血液中に流れる。その結果、TAAは、しばしば、血液中に見出され、そして患者から得られた血液サンプルは、ガンの存在を検出するにおいて使用され得、ならびにガンを病気分類(例えば、第I、II、III、またはIV期)する因子であるとして使用され得る。サービビンはTAAのようなものであり、そして健常な、正常な個体はサービビンを発現しない。いくつかのガンの研究からの結果は、サービビン(またはサービビンフラグメント)の存在がこれと相関すること、および疾患が攻撃性であり得るか、または転移されてい得るかを予測することを示した。サービビンまたはサービビンフラグメントのレベルの検出および定量の同様な戦略は、ガン処置のために化学療法または放射線療法を受ける患者における残余の腫瘍荷重を測定するために使用され得る。サービビンの上昇されるまたは増加するレベルは、後期の段階の新生物疾患を反映し得る。
診断の使用について、血液が、公知のガン負荷を有する患者から、またはガンを有することが疑われる患者から、周知の技術によって、採取される。血液サンプルは、公知の技術によって調製され、そして上述のように調製され、そして必要に応じて標識される、サービビンに対する抗体との結合について試験される。このような一般的な抗体検出プロトコル、および関連の試薬は、当該分野において十分に確立されている。他の生物学的液体サンプル(例えば、精液、尿、または唾液)はまた、サービビンの存在についてモニターされ得る。この診断学的技術はまた、疾患進行、および個別的な治療に対する応答をモニターするために使用され得る。この方法は、ガン進行または緩解を追跡する、比較的非侵襲性の手段を提供する。
実施例17 イムノバイオアッセイによるサービビンの検出
患者の血液中のサービビンの存在について試験するためのイムノバイオアッセイの説明的な例は、サービビンを結合し、検出可能なサービビンを、免疫沈降によって、溶液から回収する、サービビンに対するモノクローナル抗体の能力に依存する。このようなイムノバイオアッセイは、推測されるガン患者において、および分画化カラムから溶出された画分において、サービビンを検出するために使用される。各患者サンプルのアリコートは、上記の、サービビンを特異的に認識して、そしてこれに結合するモノクローナル抗体(例えば、上記のMab 8E2)とともに、2時間、4℃でインキュベートされる。モノクローナル抗体は、抗マウスIgGアガロースビーズ(これは、Sigma Chemical Co.、St. Louis、MOから獲得され得る)に対して不溶化される。
アガロースビーズ抗マウス(IgG(H+L))−サービビン複合体は、0.01Mリン酸緩衝液(pH7.2)、およびO.25M NaClを含有する結合緩衝液で、アガロースビーズを先ず洗浄し、次いでビーズをサービビンモノクローナル抗体とともに、18時間、4℃で、同じ緩衝液中でインキュベートすることによって、調製される。次いで、アガロースビーズは、マイクロ遠心管における、30秒間、16,000×gでの遠心分離によって沈殿され得、そして非特異的部分は、0.5M NaCl-TMK中の2%脱脂粉乳とともに、30分間、4℃で、インキュベートすることによってブロックされ得る。ブロッキング後、ビーズは、3回、0.5M NaCl-TMKで洗浄され得、そして等容量の同じ緩衝液中に再懸濁され得る。次いで、20:1のアガロースビーズ−モノクローナル抗体の複合体は、各250:1の患者試験サンプルとともに、2時間、4℃で、インキュベートされ得る。患者の試験サンプルに存在する任意のサービビンが、ビーズ上のサービビンモノクローナル抗体によって見出される。ここでサービビン結合されている、ビーズ複合体は、30秒間、16,000×gでの遠心分離によって回収され得る。次いで、上清は、以下に記載されるようなバイオアッセイにおいてサービビン活性についてアッセイされる。コントロールサンプルは、サービビンモノクローナル抗体を欠損したブロックされたビーズとともに処理され、そしてバイオアッセイにおいてサービビン活性について試験される。
実施例16 直接的なELISA試験を使用するサービビンの検出
正常な血漿(コントロール)およびガン患者血漿のサンプルを、リン酸緩衝化生理食塩水(PBS)で1:1に希釈する。各混合液の1容量を、10kD分子量制限を有するセントリコン-10フィルターに添加し、そして5000×g(7000rpm)で、1時間、遠心分離する。1容量のPBSを、保持物(retentate)に添加し、そして30分間遠心分離する。最終希釈は、約1:3である。次いで、ELISAプレートウェルを、1:6、1:12、1:24、1:48、および1:96の最終希釈にて、ジカルボン酸コーティング緩衝液(pH9.6を有する)中、一晩、4℃にて、保持物でコートする。次いで、リン酸緩衝化生理食塩水中の5% Tween 20を含有する洗浄緩衝液で、プレートを2回洗浄する。残余の結合部位を、4%ウシ血清アルブミン(BSA)、300μ/ウェルで、2時間、ブロックする。次いで、プレートを洗浄緩衝液で2回洗浄する。次いで、サービビンを特異的に認識して、これに結合する100μlのモノクローナル抗体(例えば、Mab 8E2)を1%BSA中の1:200希釈で使用し、ウェルに添加し、そして1時間、振盪しながらインキュベートする。プレートを、洗浄緩衝液で、5回洗浄する。次いで、100μl西洋ワサビペルオキシダーゼ結合二次抗体を、代表的に1:2,000希釈で、各ウェルに添加し、そして1時間インキュベートする。プレートを再度、洗浄液で5回洗浄する。次いで、5μgのサービビンおよび5μl H2O2/10mlクエン酸−リン酸緩衝液を含有する基質の、100μl/ウェルを、各ウェルに添加し、そして5分間インキュベートする。酵素反応を、50μl/ウェル 2M H2SO4を添加することによって、停止する。光の吸光度を、EIA読み取り器において、492nmで測定する。サービビンを含む患者サンプルは、ポジティブな読み取り値を生じ、一方、サービビンを含まない患者のサンプルは、ネガティブである。
実施例18 サービビンフラグメント、ペプチドおよび小分子アンタゴニスト
上記のように、アポトーシスに必要とされる重要な機能残基が、サービビンにおいて同定された。これらのデータは、合成ペプチド、および小分子アンタゴニスト、ならびにサービビン機能の拮抗性インヒビターを作製する際の鋳型を提供する。好ましくは、ペプチドは、ネイティブなサービビンから作製されるか、または機能的に等価な残基Trp67−Pro73−Cys84を含むネイティブなサービビンペプチド骨格からの置換を含む。ネイティブなサービビンのペプチドフラグメントは、標準的な技術(タンパク質消化を含む)によって作製され得る。どのフラグメントがサービビンと競合するかの決定は、上記のアポトーシス測定系およびアポトーシスアッセイ系を使用することによって、容易になされ得る。これらの結果は、アポトーシスの阻害に必須である、サービビンにおける別個の線状配列を同定するための独特な機会を提供する。
アポトーシスのIAPタンパク質依存性阻害の一般的な範例と一致して、抗アポトーシス機能について必要とされる分子の構造領域は、他の分子(例えば、結合パートナー)との相互作用の部位であることについての重要な候補であることがまた、予測された。サービビンにおける機能的に関連するペプチド配列は、変異誘発データに基づいて:EGWEPDDDPIEEHKKHSSGC(配列番号4)である。下線を付した残基のAla置換は、トランスフェクトされた細胞においてサービビンの完全な機能の消失を生じる。この線状配列は合成され得、そしてアフィニティークロマトグラフィーの標準的な生化学的手順を用いて関連分子を単離するための、非常によりストリンジェントなおよび特異的な試薬として、または酵母ツーハイブリッド系についてのベイトとして、使用され得る。
また、好ましくは、サービビンのβCOOHコイルドコイル領域が、サービビンフラグメントおよびペプチドに含まれる。近年のデータは、このサービビンドメインが、サービビンの抗アポトーシス機能に重要であることを示す。本発明者らは、コイルドコイルドメインを含む最後の40βCOOH末端アミノ酸を欠損するサービビンの組換え短縮形態を作製した。この短縮形態を、NIT3T3細胞において、野生型サービビンおよびXIAP(IAP遺伝子ファミリーの別のメンバー)と同様に、LacZとともに同時トランスフェクトした。結果は、図17に示され、過酸化水素によって誘導される、トランスフェクトされた細胞におけるアポトーシスを防ぐにおいて、短縮されたサービビンは、殆ど(約80%)の細胞防御的効果を欠損したことを示す。明らかに、この系において、サービビンは、アポトーシスを防ぐにおいて、NAIPよりも強力であった。
サービビンのアゴニストまたはアンタゴニストはまた、従来の技術を介して容易に同定され得る。ネイティブな線状配列に基づく、設計された、合成ペプチドはまた、未だ同定されていないパートナー分子とのサービビンの相互作用の、拮抗的なインヒビターとして機能する。しかし、この阻害は、サービビンの抗アポトーシス機能をブロックするのに十分であるべきである。
同様のペプチドベースのストラテジーは、カスパーゼ(caspase)活性化をインビトロおよびインビボで、首尾良くブロックしており、アポトーシスから細胞を防御する。例えば、Milligan, C.E.ら(1995)Neuron 15:385-393を参照のこと。
実施例19 アンチセンスサービビンDNAの治療学的使用
上記のように、サービビンアンチセンス配列の転写は、EPR-1/サービビン遺伝子均衡を変化した。これは、HeLa細胞トランスフェクト体において実証され、ここでは、EPR-1「センス」鎖のメタロチオネイン誘導性の転写は、サービビンの発現を抑制し、そしてアポトーシス/細胞増殖に十分に影響を及ぼした。さらに、サービビンアンチセンス構築物と、lacZレポート化プラスミドとを一過性に同時トランスフェクトすることは、βガラクトシダーゼ発現細胞において、トランスフェクションの48時間後、サービビンアンチセンストランスフェクト体の生存性を減少した。従って、サービビンを発現する細胞または組織(例えば、腫瘍)におけるサービビンの発現のレベルは、EPR-1センス鎖のDNAで細胞または組織をトランスフェクトすることによって、減少される。あるいは、サービビンアンチセンスをコードするDNAは、標的細胞または組織をトランスフェクトするために、使用される。このような治療は、サービビンをコードするmRNAのサービビンタンパク質への翻訳を、効率よく減少する。
実施例20 アポトーシスに対する防御剤としてのサービビンの使用
サービビンは、過酸化水素または典型的にアポトーシスを誘導する他の薬剤に曝露されている細胞に投与される場合、アポトーシスから細胞を防御することが示されている。アポトーシスを減少するのに有効なサービビンまたはそのフラグメントの送達を容易にするために、好ましくは、一過性の様式で、細胞浸透性が、増加することが必要とされ得ることが、意図される。一過性の代謝阻害または一過性の低酸素症を包含するある状態は、さらなる、外因的な薬剤を必要としないで、細胞の透過性を増加するようである。適切であり得る薬剤は、2-デオキシグルコースおよびアジ化ナトリウムのような代謝インヒビターを包含する。しかし、細胞透過性の一過性の増加の間に細胞防御を媒介するサービビンの能力は、心筋梗塞および発作の間の再灌流傷害および細胞障害を減少するための、組換えサービビンの治療学的注入を用いる可能性を提供する。このようなプロセスは、アポトーシスに起因する増加した組織の障害によって媒介されることが意図される。サービビンでの処置は、傷害される組織の程度および大きさを減少し得る。
細胞死に関連するアポトーシスを調節または防止するための、被験体におけるサービビンまたはサービビンの対立遺伝子改変体の使用は、多様なアポトーシス関連性の徴候の影響を処置または改善するにおいて有益である。これらの徴候としては、老化の皮膚科学的影響(例えば、頭部濾胞細胞の細胞のアポトーシスによって引き起こされる禿頭)、免疫抑制のような異常または疾患、胃腸管摂動(例えば、消化管の内層の障害、潰瘍、および放射線または化学療法誘導性の障害)、心血管異常、再灌流障害に関連するアポトーシス(例えば、冠状動脈閉塞、脳梗塞、脊髄/頭部外傷および付随する重篤な麻痺、凍傷または火傷のような傷害に起因する障害、ならびにスーパーオキシドジスムターゼによって処置可能であると以前に考えられている任意の徴候)、組織移植の拒絶(例えば、対宿主性移植片病)、ならびにアルツハイマー病が挙げられるが、これらに制限されない。サービビンの投与はまた、化学療法または放射線誘導性のアポトーシスに対して細胞防御的であり得る。
投与のためのサービビンタンパク質は、例えば、本明細書中に記載されるcDNAを用いて、上記のように生成され得る。タンパク質は、薬学的投与の目的のための精製を必要とし得、このような精製工程は、好ましくは、また上記のような、モノクローナル抗体分離および精製技術を利用する。
臨床学的設定において、サービビンは、薬学的に有効な投薬量において、例えば、そうでなければ存在するアポトーシスのレベルまたは程度を減少するのに有効な投薬量において、いくつかの経路を介して、投与される。例えば、アポトーシスを包含する皮膚科学的病気を処置するために、サービビンは、膏薬、クリーム、軟膏、または粉末の形態において投与され得る。局所的な処方物は、さらなる薬学的または化粧用の組成物(例えば、保湿剤、湿潤剤、芳香緩和剤、緩衝液、顔料、保存剤、ビタミン(例えば、A、C、またはE)、乳化剤、分散化剤、湿潤剤、安定化剤、推進剤、抗微生物剤、日焼け止め剤、酵素など)を含み得る。患者に投与され得るサービビンの典型的な投薬量は、0.01重量%〜1.0重量%である。さらなる局所的な薬学的組成物は、S. Nakaiら、米国特許第5,672,603号に記載される。
サービビンはまた、処置される条件に適切であり得る場合、丸剤、溶液、懸濁液、乳濁液、顆粒、またはカプセルの形態で、投与され得る。サービビンは、経口的に投与され得;単独でまたは非経口注入のための従来の液体(例えば、グルコース、アミノ酸などを含む液体)と混合して静脈内投与される溶液において注入され得;筋肉内、皮膚内、皮下、または腹腔内注入され得;坐薬を用いて;ならびに点眼薬のような眼用溶液の形態であり得る。サービビンはまた、遅延された放出のキャリア(例えば、リポソーム、マイクロスポンジ、ミクロスフェア、またはマイクロカプセル)を用いて投与され得、これらはアポトーシス関連性の細胞死の防止のために処置される組織にほぼ近接して配置される。
局所投与以外の経路を介して投与される、サービビンまたはサービビンの機能的対立遺伝子改異体の濃度は、代表的に、1日あたり約10μg〜1日あたり25mgの範囲であり、投与の経路に依存する。もちろん、特定の患者に必要とされる場合ように医師のような当業者が、、一件ごとの基準に対してこれらの値を変化し得ることが予測される。
配列表
(1)一般的情報:
(i)出願人:
(A)名前:エール大学
(B)番地:451 カレッジ ストリート
(C)市:ニュー ヘブン
(D)州:コネチカット州
(E)国:アメリカ合衆国
(F)郵便番号:06510
(ii)発明の名称:細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節
(iii)配列数:35
(iv)コンピューター読み出し形態:
(A)媒体型:フロッピー ディスク
(B)コンピューター:IBM PC互換用
(C)OS:PC-DOS/MS-DOS
(D)ソフトウェア:パテントイン リリース#1.0,バージョン#1.30
(v)現在の出願データ:
(A)出願番号:PCT/US97/21880
(B)出願日:1997年11月20日
(vi)先願データ
(A)出願番号:US 60/031,435
(B)出願日:1996年11月20日
(2)配列番号1の情報:
(i)配列の特徴:
(A)長さ:19塩基対
(B)型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:他の核酸
(A)記載:/desc=「オリゴヌクレオチド」
(xi)配列:配列番号1:
(2)配列番号2の情報:
(i)配列の特徴:
(A)長さ:18塩基対
(B)型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:他の核酸
(A)記載:/desc=「オリゴヌクレオチド」
(xi)配列:配列番号2:
(2)配列番号3の情報:
(i)配列の特徴:
(A)長さ:17アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:ペプチド
(xi)配列:配列番号3:
(2)配列番号4の情報:
(i)配列の特徴:
(A)長さ:20アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:ペプチド
(xi)配列:配列番号4:
(2)配列番号5の情報:
(i)配列の特徴:
(A)長さ:27塩基対
(B)型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:ゲノムDNA
(xi)配列:配列番号5:
(2)配列番号6の情報:
(i)配列の特徴:
(A)長さ:27塩基対
(B)型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:ゲノムDNA
(xi)配列:配列番号6
(2)配列番号7の情報:
(i)配列の特徴:
(A)長さ:27塩基対
(B)型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:ゲノムDNA
(xi)配列:配列番号7:
(2)配列番号8の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号8:
(2)配列番号9の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号9:
(2)配列番号10の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号10:
(2)配列番号11の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号11:
(2)配列番号12の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号12:
(2)配列番号13の情報:
(i)配列の特徴:
(A)長さ:47アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号13:
(2)配列番号14の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号14:
(2)配列番号15の情報:
(i)配列の特徴:
(A)長さ:46アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号15:
(2)配列番号16の情報:
(i)配列の特徴:
(A)長さ:46アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号16:
(2)配列番号17の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号17:
(2)配列番号18の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号18:
(2)配列番号19の情報:
(i)配列の特徴:
(A)長さ:46アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号19:
(2)配列番号20の情報:
(i)配列の特徴:
(A)長さ:45アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号20:
(2)配列番号21の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号21:
(2)配列番号22の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号22:
(2)配列番号23の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号23:
(2)配列番号24の情報
(i)配列の特徴:
(A)長さ:49アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号24
(2)配列番号25の情報:
(i)配列の特徴:
(A)長さ:49アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)核の種類:タンパク質
(xi)配列:配列番号25:
(2)配列番号26の情報
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号26:
(2)配列番号27の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号27:
(2)配列番号28の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号28:
(2)配列番号29の情報:
(i)配列の特徴
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号29:
(2)配列番号30の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号30:
(2)配列番号31の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号31:
(2)配列番号32の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号32:
(2)配列番号33の情報:
(i)配列の特徴:
(A)長さ:50アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号33:
(2)配列番号34の情報:
(i)配列の特徴:
(A)長さ:142アミノ酸
(B)型:アミノ酸
(C)鎖の数:
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号34:
(2)配列番号35の情報:
(i)配列の特徴:
(A)長さ:14796塩基対
(B)型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:ゲノムDNA
(xi)配列:配列番号35:
Claims (59)
- 細胞のアポトーシスを阻害する哺乳動物のサービビンタンパク質をコードする単離された核酸分子であって、該サービビンタンパク質は、一つのBIRおよびβCOOHコイルドコイルを含み、そして、該核酸分子は、ストリンジェントな条件下で、配列番号35のヌクレオチド2811〜2921、3174〜3283、5108〜5225、および、11955〜12041からなる核酸分子の相補物にハイブリダイズする、核酸分子。
- 配列番号34に示されるアミノ酸配列をコードする、請求項1に記載の単離された核酸分子。
- 配列番号35のヌクレオチド2811〜2921、3174〜3283、5108〜5225、および、11955〜12041を直接連結した連続する配列を含む、請求項2に記載の単離された核酸分子。
- 配列番号35のヌクレオチド2811〜2921、3174〜3283、5108〜5225、および、11955〜12044を直接連結した連続する配列を含む、請求項2に記載の単離された核酸分子。
- 配列番号35のヌクレオチド2811〜2921、3174〜3283、5108〜5225、および、11955〜12041を直接連結した連続する配列からなる、請求項2に記載の単離された核酸分子。
- 配列番号35のヌクレオチド2811〜2921、3174〜3283、5108〜5225、および、11955〜12044を直接連結した連続する配列からなる、請求項2に記載の単離された核酸分子。
- 配列番号35のサービビンオープンリーディングフレームを含む、請求項2に記載の単離された核酸分子。
- 配列番号35のサービビンオープンリーディングフレームからなる、請求項2に記載の単離された核酸分子。
- 前記核酸が、DNAまたはcDNAである、請求項1〜8のいずれか一項に記載の単離された核酸分子。
- 少なくとも1つの発現制御エレメントに作動可能に連結された、請求項9に記載の単離された核酸分子。
- 融合パートナーの核酸配列に同一フレームで融合された、請求項1〜10のいずれか一項に記載の単離された核酸分子。
- 請求項1〜11のいずれか一項に記載の単離された核酸分子を含むベクター。
- 請求項12に記載のベクターを含むようにトランスフェクションされた、宿主細胞。
- 原核生物宿主細胞および真核生物宿主細胞からなる群より選択される、請求項13に記載の宿主細胞。
- 請求項14に記載の宿主細胞を、サービビンタンパク質が発現する条件下で培養する工程を包含する、哺乳動物サービビンタンパク質を生産する方法。
- 前記単離された核酸分子が、ヒトサービビンタンパク質をコードする、請求項1に記載の単離された核酸分子。
- 請求項1または2に記載の核酸分子によってコードされるアミノ酸配列を含む、単離されたポリペプチド。
- 請求項1または2に記載の核酸分子によってコードされるアミノ酸配列からなる、請求項17に記載の単離されたポリペプチド。
- 哺乳動物ポリペプチドである、請求項17または請求項18に記載の単離されたポリペプチド。
- ヒトポリペプチドである、請求項19に記載の単離されたポリペプチド。
- 配列EGWEPDDDPIEEHKKHSSGCからなるポリペプチドまたはその保存的に置換されたホモログである、請求項18に記載のポリペプチドのフラグメント。
- 請求項17または請求項18に記載のポリペプチドを含む、融合タンパク質。
- IAPタンパク質のC末端RINGフィンガーをさらに含む、請求項22に記載の融合タンパク質。
- 配列番号34に示されるアミノ酸配列において、アミノ酸残基の少なくとも1残基がPro26、Leu64、Trp67、Pro73、および、Cys84からなる群から選択されるアミノ酸で置換されているアミノ酸配列を含む、低下したアポトーシス阻害活性を示すサービビンの変異体である、変異ポリペプチド。
- 前記少なくとも1残基がAlaで置換される、請求項24に記載の変異ポリペプチド。
- 請求項17〜25のいずれか一項に記載のポリペプチドまたはタンパク質を含む、組成物。
- 薬学的組成物であり、さらに、キャリアを含む、請求項26に記載の組成物。
- 免疫原性組成物である、請求項26に記載の組成物。
- 請求項17〜25のいずれか一項に記載のポリペプチドに結合する、単離された抗体または抗体フラグメント。
- ポリクローナル抗体である、請求項29に記載の単離された抗体。
- モノクローナル抗体である、請求項29に記載の単離された抗体。
- ヒト化モノクローナル抗体である、請求項31に記載のモノクローナル抗体。
- 配列APTLPPAWQPFLKDHRIからなるポリペプチドに結合する、請求項29に記載の単離された抗体。
- 配列APTLPPAWQPFLKDHRIからなるポリペプチドを用いて動物を免疫することによって産生される、ヒトサービビンに結合する、単離された抗体。
- 配列APTLPPAWQPFLKDHRIからなるポリペプチドを用いて動物を免疫することによって産生される、単離された抗体。
- Fab、Fab’、および、F(ab’)2からなる群から選択される、請求項29に記載の抗体のフラグメント。
- 請求項29および33〜35のいずれか一項に記載の抗体を含む組成物。
- 請求項29および33〜35のいずれか一項に記載の抗体を産生する、ハイブリドーマ細胞。
- 細胞のアポトーシスを阻害するための医薬の製造のための、請求項17に記載のポリペプチド、または、請求項17に記載のポリペプチドをコードするトランスジーンの使用であって、ここで、該トランスジーンは、サービビンポリペプチドの発現を生じるのに有効である、使用。
- 前記トランスジーンがウイルスベクターを介して送達されることが意図される、請求項39に記載の使用。
- 前記ベクターが複製欠損である、請求項40に記載の使用。
- 前記トランスジーンが、裸の核酸として送達されることが意図される、請求項39に記載の使用。
- サンプルにおける、請求項1に記載の核酸分子または請求項17もしくは請求項18に記載のポリペプチドの存在をアッセイする方法であって、該ポリペプチドまたは核酸分子が該サンプル中に存在するか否かを決定する工程を包含する、方法。
- 前記サンプルが、組識バイオプシー、便、血液、尿、および唾液からなる群より選択される、請求項43に記載の方法。
- 請求項43に記載の方法であって、さらに、以下の工程:
a)前記サンプル内の細胞の抽出物を調製する工程、および、
b)該細胞抽出物のタンパク質を試験して、前記ポリペプチドの存在を決定する工程、
を包含する、方法。 - 請求項43に記載の方法であって、さらに、以下の工程:
a)前記サンプル内の細胞の抽出物を調製する工程、および、
b)該細胞抽出物のmRNAを試験して、前記核酸分子の存在を決定する工程、
を包含する、方法。 - 請求項43に記載の方法であって、前記ポリペプチドの発現レベルをコントロールサンプルと相関させて腫瘍増殖潜在性を示すことによって、腫瘍細胞の増殖潜在性を決定するために使用される、方法。
- 請求項43に記載の方法であって、前記サンプルを前記ポリペプチドに結合する抗体と接触させ、それによって、前記サンプル中のサービビンの存在を決定する工程を包含する、方法。
- 請求項43に記載の方法であって、前記サンプルを請求項1に記載の核酸分子に特異的にハイブリダイズする少なくとも一つの核酸と接触させ、それによって、前記サンプル中のサービビンの存在を決定する工程を包含する、方法。
- 請求項49に記載の方法であって、請求項1に記載の核酸分子に特異的に結合する少なくとも1つのプライマーを用いて前記核酸分子を増殖させ、それによって、前記サンプル中のサービビンを検出する工程を包含する、方法。
- 前記抗体がモノクローナル抗体である、請求項48に記載の方法。
- サービビンタンパク質をコードする核酸の存在を検出するための、請求項1に記載のサービビン核酸分子の相補物を含むキット。
- 請求項29に記載の抗体を包含する、サンプル中のサービビンタンパク質の存在を検出するためのキット。
- ガンをモニターまたは検出するための方法であって、
被験体の生物学的液体サンプルを、請求項1に記載のサービビン核酸分子の相補物と接触させて、該サンプル中のサービビンをコードする核酸の存在を決定する工程であって、ここで、該サンプル内の該サービビンをコードする核酸の存在がガンの存在を予測する、工程、
を包含する方法。 - ガンをモニターまたは検出するための方法であって、
被験体の生物学的液体サンプルを、請求項29に記載の抗体と接触させて、該抗体が、該サンプル中における請求項1に記載の核酸分子によってコードされるサービビンを認識して結合するか否かを決定し、これによって、サービビンの存在がガンの存在を予測する、工程、
を包含する方法。 - 請求項1に記載の核酸分子によってコードされるサービビンの存在が、後期の新生物疾患を予測する、請求項55に記載の方法。
- 培養における細胞の増殖を保つための方法であって、アポトーシスを減少するのに有効である請求項1に記載の核酸分子によってコードされるサービビンの量と、該細胞とを接触させる工程を包含する、方法。
- 前記サンプルが生物学的液体を含む、請求項48〜50のいずれか一項に記載の方法。
- 前記生物学的液体が尿である、請求項58に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US3143596P | 1996-11-20 | 1996-11-20 | |
| US60/031,435 | 1996-11-20 | ||
| US08/975,080 | 1997-11-20 | ||
| PCT/US1997/021880 WO1998022589A2 (en) | 1996-11-20 | 1997-11-20 | Survivin, a protein that inhibits cellular apoptosis, and its modulation |
| US08/975,080 US6245523B1 (en) | 1996-11-20 | 1997-11-20 | Survivin, a protein that inhibits cellular apoptosis, and its modulation |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008328816A Division JP2009073860A (ja) | 1996-11-20 | 2008-12-24 | 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002514060A JP2002514060A (ja) | 2002-05-14 |
| JP2002514060A5 JP2002514060A5 (ja) | 2005-12-08 |
| JP4672092B2 true JP4672092B2 (ja) | 2011-04-20 |
Family
ID=26707241
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP52400798A Expired - Lifetime JP4672092B2 (ja) | 1996-11-20 | 1997-11-20 | 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 |
| JP2008328816A Pending JP2009073860A (ja) | 1996-11-20 | 2008-12-24 | 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008328816A Pending JP2009073860A (ja) | 1996-11-20 | 2008-12-24 | 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 |
Country Status (11)
| Country | Link |
|---|---|
| US (7) | US6245523B1 (ja) |
| EP (1) | EP0950103B1 (ja) |
| JP (2) | JP4672092B2 (ja) |
| KR (1) | KR100645448B1 (ja) |
| AT (1) | ATE414149T1 (ja) |
| AU (1) | AU736587B2 (ja) |
| CA (1) | CA2271783C (ja) |
| DE (1) | DE69739105D1 (ja) |
| HK (1) | HK1027112A1 (ja) |
| IL (1) | IL130036A (ja) |
| WO (1) | WO1998022589A2 (ja) |
Families Citing this family (98)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6365787B1 (en) | 1994-09-30 | 2002-04-02 | The Johns Hopkins University | Compounds for the suppression of HIV TAT transactivation |
| JP4672092B2 (ja) * | 1996-11-20 | 2011-04-20 | イェール ユニバーシティ | 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 |
| US7226730B1 (en) * | 1997-02-26 | 2007-06-05 | The General Hospital Corporation | Transgenic animals and cell lines for screening drugs effective for the treatment or prevention of Alzheimer's Disease |
| AU749348B2 (en) * | 1997-02-26 | 2002-06-27 | General Hospital Corporation, The | Transgenic animals and cell lines for screening drugs effective for the treatment or prevention of Alzheimer's disease |
| US20030033621A1 (en) * | 1997-02-26 | 2003-02-13 | De La Monte Suzanne | Transgenic animals and cell lines for screening drugs effective for the treatment or prevention of Alzheimer's disease |
| AU768834B2 (en) * | 1998-04-01 | 2004-01-08 | Yale University | A method for selectively modulating the interactions between survivin and tubulin |
| AU4990999A (en) * | 1998-07-14 | 2000-02-07 | Jenner Biotherapies, Inc. | Survivin, and peptides thereof, as an anti-cancer vaccine |
| US6335194B1 (en) * | 1998-09-29 | 2002-01-01 | Isis Pharmaceuticals, Inc. | Antisense modulation of survivin expression |
| US6838283B2 (en) | 1998-09-29 | 2005-01-04 | Isis Pharmaceuticals Inc. | Antisense modulation of survivin expression |
| AU2003205017B2 (en) * | 1998-09-29 | 2005-12-15 | Isis Pharmaceuticals, Inc. | Antisense modulation of survivin expression |
| US6077709A (en) * | 1998-09-29 | 2000-06-20 | Isis Pharmaceuticals Inc. | Antisense modulation of Survivin expression |
| US6773911B1 (en) | 1998-11-23 | 2004-08-10 | Amgen Canada Inc. | Apoptosis-inducing factor |
| US6608108B2 (en) * | 1999-10-15 | 2003-08-19 | Johns Hopkins University | Method for treatment of tumors using nordihydroguaiaretic acid derivatives |
| CA2392477A1 (en) | 1999-11-30 | 2001-06-07 | Mayo Foundation For Medical Education And Research | B7-h1, a novel immunoregulatory molecule |
| KR100809312B1 (ko) | 1999-12-10 | 2008-03-04 | 안티캔서, 인코포레이티드 | 포유동물 피험체속에 유전자를 도입하는 방법 |
| US6509162B1 (en) * | 2000-02-29 | 2003-01-21 | Yale University | Methods for selectively modulating survivin apoptosis pathways |
| WO2002002622A2 (en) * | 2000-06-29 | 2002-01-10 | The Salk Institute For Biological Studies | Crystal structure of survivin |
| US7776518B2 (en) | 2001-01-12 | 2010-08-17 | Yale University | Detection of survivin in the biological fluids of cancer patients |
| WO2002057787A2 (en) * | 2001-01-12 | 2002-07-25 | Yale University | Detection of survivin in the biological fluids of cancer patients |
| DE10102722A1 (de) * | 2001-01-22 | 2002-08-14 | Medinnova Ges Med Innovationen | Verfahren und Testsystem zum Auffinden von Nervenzell-schützenden Substanzen |
| WO2003061519A2 (en) * | 2002-01-18 | 2003-07-31 | Massachusetts Eye And Ear Infirmary | Methods and compositions for preserving the viability of photoreceptor cells |
| US20040210035A1 (en) * | 2002-01-30 | 2004-10-21 | Straten Eivind Per Thor | Survivin-derived peptides and use thereof |
| US7892559B2 (en) | 2002-01-30 | 2011-02-22 | Survac Aps | Survivin-derived peptides and use thereof |
| US7332580B2 (en) * | 2002-04-05 | 2008-02-19 | The Regents Of The University Of California | Bispecific single chain Fv antibody molecules and methods of use thereof |
| US7332585B2 (en) | 2002-04-05 | 2008-02-19 | The Regents Of The California University | Bispecific single chain Fv antibody molecules and methods of use thereof |
| US20040102395A1 (en) * | 2002-11-22 | 2004-05-27 | Isis Pharmaceuticals Inc. | Modulation of IAP-like expression |
| US8008003B2 (en) | 2002-11-15 | 2011-08-30 | Genomic Health, Inc. | Gene expression profiling of EGFR positive cancer |
| WO2004058293A1 (en) * | 2002-12-24 | 2004-07-15 | Northern Therapeutics Inc. | Methods of diagnosing, preventing, and treating early onset of pulmonary hypertension |
| US20040231909A1 (en) | 2003-01-15 | 2004-11-25 | Tai-Yang Luh | Motorized vehicle having forward and backward differential structure |
| ES2661082T3 (es) | 2003-01-30 | 2018-03-27 | Survac Aps | Péptidos derivados de survivina y uso de los mismos |
| WO2004071572A2 (en) * | 2003-02-06 | 2004-08-26 | Genomic Health, Inc. | Gene expression markers for response to egfr inhibitor drugs |
| US7713738B2 (en) | 2003-02-10 | 2010-05-11 | Enzon Pharmaceuticals, Inc. | Oligomeric compounds for the modulation of survivin expression |
| CA2516553C (en) * | 2003-02-20 | 2013-04-16 | Genomic Health, Inc. | Use of intronic rna to measure gene expression |
| PL1622648T3 (pl) * | 2003-03-24 | 2010-11-30 | Scripps Research Inst | Szczepionki DNA przeciwko wzrostowi nowotworów i sposoby ich stosowania |
| WO2004111273A2 (en) * | 2003-05-30 | 2004-12-23 | Genomic Health, Inc. | Gene expression markers for response to egfr inhibitor drugs |
| JP4579911B2 (ja) * | 2003-06-03 | 2010-11-10 | アイシス・ファーマシューティカルズ・インコーポレイテッド | スルビビン発現の調節 |
| DK3470535T3 (da) * | 2003-06-24 | 2020-06-29 | Genomic Health Inc | Forudsigelse af sandsynlighed for tilbagevenden af cancer |
| WO2005008213A2 (en) * | 2003-07-10 | 2005-01-27 | Genomic Health, Inc. | Expression profile algorithm and test for cancer prognosis |
| WO2005040396A2 (en) * | 2003-10-16 | 2005-05-06 | Genomic Health, Inc. | qRT-PCR ASSAY SYSTEM FOR GENE EXPRESSION PROFILING |
| PL2087904T3 (pl) | 2003-11-19 | 2014-01-31 | Survac Aps | Zastosowanie terapeutyczne peptydów pochodzących z białek BcL-XL u pacjentów z rakiem |
| ES2360113T3 (es) * | 2003-12-23 | 2011-06-01 | Genomic Health, Inc. | Amplificación universal de rna fragmentado. |
| DK2163650T3 (en) * | 2004-04-09 | 2015-11-02 | Genomic Health Inc | Genekspressionsmarkører for prediction of response to chemotherapy |
| JP2007530075A (ja) * | 2004-04-23 | 2007-11-01 | エグザジェン ダイアグノスティクス インコーポレイテッド | 乳がんの予後診断のための組成物および方法 |
| US7342093B2 (en) * | 2004-07-23 | 2008-03-11 | University Of Massachusetts | Compounds that inhibit Hsp90 protein-protein interactions with IAP proteins |
| CA2583257C (en) | 2004-10-06 | 2017-01-17 | Mayo Foundation For Medical Education And Research | B7-h1 and methods of diagnosis, prognosis, and treatment of cancer |
| EP1815014B1 (en) * | 2004-11-05 | 2012-03-21 | Genomic Health, Inc. | Molecular indicators of breast cancer prognosis and prediction of treatment response |
| HUE051605T2 (hu) | 2004-11-05 | 2021-03-01 | Nsabp Found Inc | Kemoterápiára adott válasz elõrejelzése génexpressziós markereket alkalmazva |
| NZ555645A (en) | 2004-11-09 | 2009-08-28 | Santaris Pharma As | LNA oligonucleotides and the treatment of cancer |
| ES2317330T3 (es) * | 2004-11-12 | 2009-04-16 | Vib Vzw | Uso de survivina para tratar el fallo renal. |
| MX2007007624A (es) * | 2004-12-22 | 2007-08-03 | Gillette Co | Reduccion del crecimiento del pelo con inhibidores de survivina. |
| EP2329840A1 (en) | 2005-02-04 | 2011-06-08 | Survac ApS | Survivin peptide vaccine |
| US7803375B2 (en) * | 2005-02-23 | 2010-09-28 | Massachusetts Eye And Ear Infirmary | Methods and compositions for treating conditions of the eye |
| US20060276423A1 (en) * | 2005-04-18 | 2006-12-07 | Rachel Altura | Survivin-directed RNA interference-compositions and methods |
| AU2006247134B2 (en) | 2005-05-18 | 2012-05-10 | Novartis Ag | Methods for diagnosis and treatment of diseases having an autoimmune and/or inflammatory component |
| US7272013B1 (en) * | 2005-07-28 | 2007-09-18 | American Megatrends, Inc. | Interchangeable design support system |
| WO2007019427A2 (en) * | 2005-08-08 | 2007-02-15 | Massachusetts Eye & Ear Infirmary | Methods and compositions for preserving the viability of photoreceptor cells |
| US7812173B2 (en) * | 2005-08-23 | 2010-10-12 | E.I. Du Pont De Nemours And Company | Tetrahydro-1,8-dioxa-4a-aza-naphthalenes in coating applications |
| US20070049752A1 (en) * | 2005-08-23 | 2007-03-01 | Drysdale Neville E | Preparation of 2,6-dioxa-7-aza-bicyclo[2.2.2] octanes |
| US20070104689A1 (en) * | 2005-09-27 | 2007-05-10 | Merck Patent Gmbh | Compositions and methods for treating tumors presenting survivin antigens |
| US20090215084A1 (en) * | 2006-01-05 | 2009-08-27 | Mayo Foundation For Medical Education And Research | B7-h1 and b7-h4 in cancer |
| US20100015642A1 (en) * | 2006-01-05 | 2010-01-21 | Kwon Eugene D | B7-h1 and survivin in cancer |
| WO2007124361A2 (en) * | 2006-04-20 | 2007-11-01 | Mayo Foundation For Medical Education And Research | Soluble b7-h1 |
| WO2008140493A2 (en) * | 2006-11-21 | 2008-11-20 | The Regents Of The University Of Californina | Anti-egfr family antibodies, bispecific anti-egfr family antibodies and methods of use thereof |
| US8974526B2 (en) | 2007-08-27 | 2015-03-10 | Amo Groningen B.V. | Multizonal lens with extended depth of focus |
| US9216080B2 (en) | 2007-08-27 | 2015-12-22 | Amo Groningen B.V. | Toric lens with decreased sensitivity to cylinder power and rotation and method of using the same |
| WO2009036092A2 (en) | 2007-09-10 | 2009-03-19 | University Of Massachusetts | Mitochondria-targeted anti-tumor agents |
| ATE523810T1 (de) | 2008-02-15 | 2011-09-15 | Amo Regional Holdings | System, brillenglas und verfahren zur erweiterung der fokustiefe |
| US8439498B2 (en) | 2008-02-21 | 2013-05-14 | Abbott Medical Optics Inc. | Toric intraocular lens with modified power characteristics |
| WO2009111315A2 (en) * | 2008-02-29 | 2009-09-11 | Mayo Foundation For Medical Education And Research | Methods for reducing granulomatous inflammation |
| AU2009228146B2 (en) | 2008-03-28 | 2015-06-04 | Johnson & Johnson Surgical Vision, Inc. | Systems for ocular measurements |
| KR101648146B1 (ko) * | 2008-03-31 | 2016-08-16 | 텔라 가부시키가이샤 | Mhc 클래스 ⅱ 분자에 제시되는 서바이빈의 부분 펩타이드 및 그의 용도 |
| US8862447B2 (en) | 2010-04-30 | 2014-10-14 | Amo Groningen B.V. | Apparatus, system and method for predictive modeling to design, evaluate and optimize ophthalmic lenses |
| CA2784771C (en) | 2009-12-18 | 2018-12-04 | Hendrik A. Weeber | Single microstructure lens, systems and methods |
| EP2560629B1 (en) | 2010-04-23 | 2020-06-03 | Massachusetts Eye & Ear Infirmary | Methods and compositions for preserving photoreceptor and retinal pigment epithelial cells |
| WO2012061045A2 (en) | 2010-11-01 | 2012-05-10 | Massachusetts Eye And Ear Infirmary | Methods and compositions for preserving retinal ganglion cells |
| WO2012073112A1 (en) | 2010-12-01 | 2012-06-07 | Amo Groningen B.V. | A multifocal lens having an optical add power progression, and a system and method of providing same |
| WO2013059791A2 (en) | 2011-10-21 | 2013-04-25 | Massachusetts Eye And Ear Infirmary | Methods and compositions for promoting axon regeneration and nerve function |
| AU2013353764B2 (en) | 2012-12-04 | 2018-12-06 | Amo Groningen B.V. | Lenses systems and methods for providing binocular customized treatments to correct presbyopia |
| US9302005B2 (en) | 2013-03-14 | 2016-04-05 | Mayo Foundation For Medical Education And Research | Methods and materials for treating cancer |
| ES2886999T3 (es) | 2013-03-27 | 2021-12-21 | Immunovaccine Technologies Inc | Procedimiento para mejorar la eficacia de una vacuna de survivina en el tratamiento de cáncer |
| EP3470081A1 (en) | 2013-10-01 | 2019-04-17 | Mayo Foundation for Medical Education and Research | Methods for treating cancer in patients with elevated levels of bim |
| US20160279213A1 (en) * | 2013-12-16 | 2016-09-29 | Merck Patent Gmbh | Survivin-Directed Cancer Vaccine Therapy |
| US10302653B2 (en) | 2014-05-22 | 2019-05-28 | Mayo Foundation For Medical Education And Research | Distinguishing antagonistic and agonistic anti B7-H1 antibodies |
| WO2016014148A1 (en) | 2014-07-23 | 2016-01-28 | Mayo Foundation For Medical Education And Research | Targeting dna-pkcs and b7-h1 to treat cancer |
| JP2018509384A (ja) | 2015-01-06 | 2018-04-05 | イミューノヴァクシーン テクノロジーズ インコーポレイテッドImmunovaccine Technologies Inc. | リピドa模倣体、調製方法、及びその使用 |
| US10414810B2 (en) | 2015-05-07 | 2019-09-17 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Double mutant survivin vaccine |
| US10167340B2 (en) | 2015-09-04 | 2019-01-01 | Health Research, Inc. | Anti-survivin antibodies for cancer therapy |
| US10875923B2 (en) | 2015-10-30 | 2020-12-29 | Mayo Foundation For Medical Education And Research | Antibodies to B7-H1 |
| US11160861B2 (en) | 2015-11-18 | 2021-11-02 | Immunovaccine Technologies Inc. | Adjuvanting systems and water-free vaccine compositions comprising a polyI:C polynucleotide adjuvant and a lipid-based adjuvant |
| EP3413839A1 (en) | 2016-02-09 | 2018-12-19 | AMO Groningen B.V. | Progressive power intraocular lens, and methods of use and manufacture |
| AU2017237090B2 (en) | 2016-03-23 | 2021-10-21 | Johnson & Johnson Surgical Vision, Inc. | Ophthalmic apparatus with corrective meridians having extended tolerance band by modifying refractive powers in uniform meridian distribution |
| WO2017165700A1 (en) | 2016-03-23 | 2017-09-28 | Abbott Medical Optics Inc. | Ophthalmic apparatus with corrective meridians having extended tolerance band |
| US11060087B2 (en) * | 2016-06-15 | 2021-07-13 | The Regents Of The University Of California | Synthetic promoters for high throughput screening and gene modulation |
| US11013594B2 (en) | 2016-10-25 | 2021-05-25 | Amo Groningen B.V. | Realistic eye models to design and evaluate intraocular lenses for a large field of view |
| US10739227B2 (en) | 2017-03-23 | 2020-08-11 | Johnson & Johnson Surgical Vision, Inc. | Methods and systems for measuring image quality |
| CA3082053A1 (en) | 2017-11-30 | 2019-06-06 | Amo Groningen B.V. | Intraocular lenses that improve post-surgical spectacle independent and methods of manufacturing thereof |
| FR3087448B1 (fr) | 2018-10-23 | 2023-10-13 | Pdc Line Pharma | Lignee pdc modifiee pour secreter une cytokine |
| US11886046B2 (en) | 2019-12-30 | 2024-01-30 | Amo Groningen B.V. | Multi-region refractive lenses for vision treatment |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1995020655A1 (en) * | 1994-01-28 | 1995-08-03 | The Scripps Research Institute | Novel cell surface receptor, antibody compositions, and methods of using same |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6582908B2 (en) * | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| US6070969A (en) * | 1994-03-23 | 2000-06-06 | Hewlett-Packard Company | Thermal inkjet printhead having a preferred nucleation site |
| US6133437A (en) * | 1997-02-13 | 2000-10-17 | Apoptogen, Inc. | Modulation of IAPs for the treatment of proliferative diseases |
| JP4672092B2 (ja) * | 1996-11-20 | 2011-04-20 | イェール ユニバーシティ | 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 |
| AU768834B2 (en) * | 1998-04-01 | 2004-01-08 | Yale University | A method for selectively modulating the interactions between survivin and tubulin |
| US6783961B1 (en) * | 1999-02-26 | 2004-08-31 | Genset S.A. | Expressed sequence tags and encoded human proteins |
| US6509162B1 (en) * | 2000-02-29 | 2003-01-21 | Yale University | Methods for selectively modulating survivin apoptosis pathways |
| US6277640B1 (en) * | 2000-07-31 | 2001-08-21 | Isis Pharmaceuticals, Inc. | Antisense modulation of Her-3 expression |
| US6608026B1 (en) * | 2000-08-23 | 2003-08-19 | Board Of Regents, The University Of Texas System | Apoptotic compounds |
| US6992063B2 (en) * | 2000-09-29 | 2006-01-31 | The Trustees Of Princeton University | Compositions and method for regulating apoptosis |
| WO2002057787A2 (en) * | 2001-01-12 | 2002-07-25 | Yale University | Detection of survivin in the biological fluids of cancer patients |
| US6949558B2 (en) * | 2001-11-07 | 2005-09-27 | Yale University | Enhancement of taxane-based chemotherapy by a CDK1 antagonist |
| US6995244B2 (en) * | 2002-12-13 | 2006-02-07 | The Ohio State University | Antagonists for human prolactin |
| US7342093B2 (en) * | 2004-07-23 | 2008-03-11 | University Of Massachusetts | Compounds that inhibit Hsp90 protein-protein interactions with IAP proteins |
-
1997
- 1997-11-20 JP JP52400798A patent/JP4672092B2/ja not_active Expired - Lifetime
- 1997-11-20 EP EP97949685A patent/EP0950103B1/en not_active Expired - Lifetime
- 1997-11-20 AU AU73018/98A patent/AU736587B2/en not_active Expired
- 1997-11-20 DE DE69739105T patent/DE69739105D1/de not_active Expired - Lifetime
- 1997-11-20 WO PCT/US1997/021880 patent/WO1998022589A2/en not_active Application Discontinuation
- 1997-11-20 IL IL130036A patent/IL130036A/en not_active IP Right Cessation
- 1997-11-20 KR KR1019997004445A patent/KR100645448B1/ko not_active IP Right Cessation
- 1997-11-20 US US08/975,080 patent/US6245523B1/en not_active Expired - Lifetime
- 1997-11-20 AT AT97949685T patent/ATE414149T1/de not_active IP Right Cessation
- 1997-11-20 CA CA2271783A patent/CA2271783C/en not_active Expired - Lifetime
-
2000
- 2000-04-20 HK HK00102427.9A patent/HK1027112A1/xx not_active IP Right Cessation
- 2000-10-18 US US09/690,825 patent/US6943150B1/en not_active Expired - Lifetime
-
2002
- 2002-05-06 US US10/138,618 patent/US6800737B2/en not_active Expired - Lifetime
-
2005
- 2005-02-24 US US11/064,496 patent/US20050143308A1/en not_active Abandoned
- 2005-09-26 US US11/234,308 patent/US20060068453A1/en not_active Abandoned
- 2005-09-26 US US11/234,225 patent/US20060069025A1/en not_active Abandoned
-
2008
- 2008-12-24 JP JP2008328816A patent/JP2009073860A/ja active Pending
-
2009
- 2009-10-05 US US12/588,122 patent/US20110136743A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1995020655A1 (en) * | 1994-01-28 | 1995-08-03 | The Scripps Research Institute | Novel cell surface receptor, antibody compositions, and methods of using same |
Also Published As
| Publication number | Publication date |
|---|---|
| US6800737B2 (en) | 2004-10-05 |
| US20030100525A1 (en) | 2003-05-29 |
| US6943150B1 (en) | 2005-09-13 |
| JP2002514060A (ja) | 2002-05-14 |
| CA2271783C (en) | 2013-04-16 |
| CA2271783A1 (en) | 1998-05-28 |
| ATE414149T1 (de) | 2008-11-15 |
| AU736587B2 (en) | 2001-08-02 |
| KR20000057159A (ko) | 2000-09-15 |
| DE69739105D1 (de) | 2008-12-24 |
| HK1027112A1 (en) | 2001-01-05 |
| US20060069025A1 (en) | 2006-03-30 |
| AU7301898A (en) | 1998-06-10 |
| US20110136743A1 (en) | 2011-06-09 |
| KR100645448B1 (ko) | 2006-11-13 |
| JP2009073860A (ja) | 2009-04-09 |
| WO1998022589A3 (en) | 1998-10-29 |
| EP0950103A2 (en) | 1999-10-20 |
| US20050143308A1 (en) | 2005-06-30 |
| US6245523B1 (en) | 2001-06-12 |
| IL130036A (en) | 2010-04-15 |
| US20060068453A1 (en) | 2006-03-30 |
| IL130036A0 (en) | 2000-02-29 |
| WO1998022589A2 (en) | 1998-05-28 |
| EP0950103B1 (en) | 2008-11-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4672092B2 (ja) | 細胞アポトーシスを阻害するタンパク質であるサービビン(Survivin)、およびその調節 | |
| WO1998022589A9 (en) | Survivin, a protein that inhibits cellular apoptosis, and its modulation | |
| Gutierrez et al. | The Fas/Fas‐ligand system: a mechanism for immune evasion in human breast carcinomas | |
| KR20010086070A (ko) | 혈관신생 및 심혈관형성의 촉진 또는 억제 | |
| CA2420867C (en) | Methods for enhancing the efficacy of cancer therapy | |
| JP4429269B2 (ja) | アポトーシス誘導遺伝子およびその利用 | |
| EP1241179B1 (en) | Human protein having in vitro antiproliferative activity | |
| EP1241186B2 (en) | Human growth arrest specific gene 6 (gas-6) and nucleic acids encoding the same | |
| AU2002313838B2 (en) | Novel PRO866 polypeptides and nucleic acids encoding same | |
| EP1241251B1 (en) | Human prostasin-like protein and nucleic acids encoding the same | |
| EP1241252B1 (en) | Nucleic acid that is amplified in tumour and related materials and methods | |
| AU2002317529C1 (en) | Novel PRO618 polypeptides and nucleic acids encoding same | |
| EP1241180A2 (en) | Human A33 antigen-like protein and nucleic acids encoding it | |
| EP1247817A2 (en) | Human CD23-like protein and nucleic acids encoding it | |
| NZ525914A (en) | Novel polypeptides and nucleic acids encoding the same | |
| MXPA99004677A (en) | Survivin, a protein that inhibits cellular apoptosis, and its modulation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041119 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050617 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080624 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080918 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081027 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081224 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091117 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100216 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100329 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100316 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100416 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100517 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100531 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100517 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101102 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101109 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20101221 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110119 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140128 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |