JP4659695B2 - フルオレン化合物及び有機発光素子 - Google Patents
フルオレン化合物及び有機発光素子 Download PDFInfo
- Publication number
- JP4659695B2 JP4659695B2 JP2006188155A JP2006188155A JP4659695B2 JP 4659695 B2 JP4659695 B2 JP 4659695B2 JP 2006188155 A JP2006188155 A JP 2006188155A JP 2006188155 A JP2006188155 A JP 2006188155A JP 4659695 B2 JP4659695 B2 JP 4659695B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- compound
- light emitting
- organic light
- emitting device
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 Cc1c(ccc2c3c(cc4)cc(*)c2)c3c4c(-c(cc2)cc(C(*)(c3c4)I)c2-c3ccc4N(*)*)c1 Chemical compound Cc1c(ccc2c3c(cc4)cc(*)c2)c3c4c(-c(cc2)cc(C(*)(c3c4)I)c2-c3ccc4N(*)*)c1 0.000 description 2
- MESMZMMMABYUJB-UHFFFAOYSA-N CC(C)(C)c(cc1)ccc1N(c1ccc(C(C)(C)C)cc1)c(cc1C2(C)C)ccc1-c(cc1)c2cc1-c1cc(C)c(cc2)c3c1ccc1cc(C(C)(C)C)cc2c31 Chemical compound CC(C)(C)c(cc1)ccc1N(c1ccc(C(C)(C)C)cc1)c(cc1C2(C)C)ccc1-c(cc1)c2cc1-c1cc(C)c(cc2)c3c1ccc1cc(C(C)(C)C)cc2c31 MESMZMMMABYUJB-UHFFFAOYSA-N 0.000 description 1
- TZHPPSBEOSFQPR-UHFFFAOYSA-N CC1C=C(c(cc2)cc(C(C)(C)c3c4)c2-c3ccc4N(C(CC2)CC=C2C(C)(C)C)C2C=CC(C(C)(C)C)=CC2)c2ccc3c4c2C1CCC4CC(C)=C3 Chemical compound CC1C=C(c(cc2)cc(C(C)(C)c3c4)c2-c3ccc4N(C(CC2)CC=C2C(C)(C)C)C2C=CC(C(C)(C)C)=CC2)c2ccc3c4c2C1CCC4CC(C)=C3 TZHPPSBEOSFQPR-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/125—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers specially adapted for multicolour light emission, e.g. for emitting white light
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/622—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing four rings, e.g. pyrene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/324—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising aluminium, e.g. Alq3
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/621—Aromatic anhydride or imide compounds, e.g. perylene tetra-carboxylic dianhydride or perylene tetracarboxylic di-imide
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/656—Aromatic compounds comprising a hetero atom comprising two or more different heteroatoms per ring
- H10K85/6565—Oxadiazole compounds
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
Description
R51及びR52は、それぞれ独立に、水素原子、アルキル基から選ばれる。
Ar3及びAr4は、4−ターシャルブチルフェニル基または4−トリメチルシリルフェニル基を表わす。Ar3とAr4は同じであっても異なっても良い。)
本発明のフルオレン化合物は、下記一般式[I]で示されることを特徴とする。
Ar 1 及びAr 2 は、置換あるいは無置換のアルキレン基、アラルキレン基、アリーレン基、または複素環基を表わし、直接単結合でも良い。Ar 1 及びAr 2 は、同じでも異なっていてもよい。
Ar 3 及びAr 4 は、4位に炭素数2以上のアルキル基を少なくとも一つ有する置換あるいは無置換のフェニル基を表わす。Ar 3 とAr 4 は同じであっても異なっても良い。
nは1乃至10の整数を表し、a及びbは0乃至3の整数、cは0乃至9までの整数を表わす。
a,b,cが2以上の整数であるとき、R 3 同士、R 4 同士及びR 5 同士は各々同一でも異なっていても良い。nが2以上の場合、異なるフルオレン基上のR 1 同士、R 2 同士、R 3 同士及びR 4 同士は同じでも異なっていても良い。)
また、本発明の有機発光素子は、陽極及び陰極からなる一対の電極と、該一対の電極間に挟持された有機化合物を含む一層または複数の層により構成される有機発光素子において、前記有機化合物を含有する層のうち少なくとも一層が、上記一般式[I]で示されるフルオレン化合物を少なくとも1種類含有することを特徴とする。
また、本発明の有機発光素子は、陽極及び陰極からなる一対の電極と、該一対の電極間に挟持された有機化合物を含む一層または複数層の有機化合物層により構成される有機発光素子において、前記有機化合物層のうち少なくとも一層が第1化合物と第2化合物を含有し、該第1化合物が下記一般式[III]で示されるフルオレン化合物の少なくとも一種であり、該第2化合物が下記一般式[IV]で示される化合物の少なくとも一種であることを特徴とする。
Ar 5 及びAr 6 は、置換あるいは無置換のアルキレン基、アラルキレン基、アリーレン基、または複素環基を表わし、直接単結合でも良い。Ar 5 及びAr 6 は、同じでも異なっていてもよい。
Ar 7 及びAr 8 は、置換あるいは無置換のアルキル基、アラルキル基、アリール基、複素環基を表わす。Ar 7 とAr 8 は同じであっても異なっても良く、互いに結合し環を形成しても良い。
mは1乃至10の整数を表し、d及びeは0乃至3の整数、fは0乃至9までの整数を表わす。
d,e,fが2以上の整数であるとき、R 8 同士、R 9 同士及びR 10 同士は各々同一でも異なっていても良い。nが2以上の場合、異なるフルオレン基上のR 6 同士、R 7 同士、R 8 同士及びR 9 同士は同じでも異なっていても良い。)
R 13 およびR 14 は、重水素原子、アルキル基、置換あるいは無置換のアラルキル基、置換あるいは無置換のアリール基、置換あるいは無置換の複素環基、置換アミノ基、シアノ基またはハロゲン原子を表す。R 13 およびR 14 は、互いに同じであっても異なっていてもよい。
Ar 9 およびAr 10 は、置換あるいは無置換のピレンを表す。Ar 9 およびAr 10 は互いに同じであっても異なっていても良い。
rは1乃至10の整数、g及びhはそれぞれ0乃至3の整数を表わす。
g、hが2以上の整数であるとき、R 13 同士及びR 14 同士は各々同一でも異なっていても良い。rが2以上の場合、異なるフルオレン基上のR 11 同士、R 12 同士、R 13 同士及びR 14 同士は同じでも異なっていても良い。)
(1)第1の化合物の会合による濃度消光を抑える、
(2)第2の化合物の混合により膜の安定性が向上する、
(3)2種類の化合物を用いることにより、電子とホールのキャリアバランスをとることが容易になる、
等が挙げられ、発光の高効率化や長寿命化に効果がある。
図3に示す構造の有機発光素子を以下に示す方法で作成した。
第2化合物であるC−5に代えて、下記に示す比較化合物K−1を用いた他は実施例1と同様に素子を作成し、同様な評価を行った。
第1化合物、第2化合物として、表13に示す化合物を用いた他は実施例1と同様に素子を作成し、同様な評価を行った。その結果を表13,14に示す。
第1化合物として例示化合物No.A−90、第2化合物として例示化合物C−6を用い、電子輸送層6として2,9−ビス[2−(9、9−ジメチルフルオレニル)]フェナントロリンを用いた以外は実施例1と同様に有機発光素子を作成した。
第1化合物、第2化合物として、表15に示す化合物を用いた他は実施例5と同様に素子を作成し、同様な評価を行った。その結果を表15,16に示す。
第1の化合物と第2の化合物の重量比を35:65に変えた以外は実施例5と同様に有機発光素子を作成した。
第1化合物、第2化合物として、表17に示す化合物を用いた他は実施例10と同様に素子を作成し、同様な評価を行った。その結果を表17,18に示す。
第1化合物に代えて下記比較化合物No.K−2を用い、第2の化合物として例示化合物No.C−5を共蒸着して20nmの発光層3を設けた他は実施例10と同様に素子を作成し、同様な評価を行った。
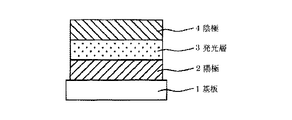
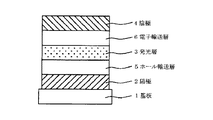
2 陽極
3 発光層
4 陰極
5 ホール輸送層
6 電子輸送層
7 ホール注入層
8 ホール/エキシトンブロッキング層
Claims (12)
- 前記R1及びR2がメチル基であることを特徴とする請求項1に記載のフルオレン化合物。
- 前記R51がターシャルブチル基であることを特徴とする請求項1または2に記載のフルオレン化合物。
- 前記Ar3及びAr4が4−ターシャルブチルフェニル基であることを特徴とする請求項1乃至3のいずれか一項に記載のフルオレン化合物。
- 前記R11及びR12がメチル基であることを特徴とする請求項7に記載の有機発光素子。
- 前記rは1または2であることを特徴とする請求項7または8に記載の有機発光素子。
- 前記Ar9及びAr10は、1位または9位でフルオレン環と結合することを特徴とする請求項7乃至9のいずれか一項に記載の有機発光素子。
- 前記Ar9及びAr10 は、2位、3位、7位のいずれかにアルキル基またはアルコキシ基を有するピレン環であることを特徴とする請求項7乃至10のいずれか一項に記載の有機発光素子。
- 前記Ar9及びAr10は、ターシャルブチル基を有するピレン環であることを特徴とする請求項11に記載の有機発光素子。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006188155A JP4659695B2 (ja) | 2005-11-01 | 2006-07-07 | フルオレン化合物及び有機発光素子 |
| US11/554,142 US20070111029A1 (en) | 2005-11-01 | 2006-10-30 | Fluorene compound and organic light-emitting device |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005317935 | 2005-11-01 | ||
| JP2006188155A JP4659695B2 (ja) | 2005-11-01 | 2006-07-07 | フルオレン化合物及び有機発光素子 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007145799A JP2007145799A (ja) | 2007-06-14 |
| JP2007145799A5 JP2007145799A5 (ja) | 2010-11-18 |
| JP4659695B2 true JP4659695B2 (ja) | 2011-03-30 |
Family
ID=38041212
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006188155A Expired - Fee Related JP4659695B2 (ja) | 2005-11-01 | 2006-07-07 | フルオレン化合物及び有機発光素子 |
Country Status (2)
| Country | Link |
|---|---|
| US (1) | US20070111029A1 (ja) |
| JP (1) | JP4659695B2 (ja) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4950460B2 (ja) * | 2005-08-26 | 2012-06-13 | キヤノン株式会社 | 有機発光素子 |
| JP2007169182A (ja) * | 2005-12-20 | 2007-07-05 | Canon Inc | フルオレニレン化合物およびそれを使用した有機発光素子 |
| US20090066227A1 (en) * | 2005-12-20 | 2009-03-12 | Canon Kabushiki Kaisha | Organic light-emitting device |
| JP2007332127A (ja) * | 2005-12-20 | 2007-12-27 | Canon Inc | 化合物及び有機発光素子 |
| JP5031238B2 (ja) * | 2006-02-02 | 2012-09-19 | キヤノン株式会社 | フルオレン化合物及びそれを用いた有機発光素子 |
| JP5164389B2 (ja) * | 2006-03-28 | 2013-03-21 | キヤノン株式会社 | 有機発光素子用アミノ化合物およびそれを有する有機発光素子 |
| JP4933127B2 (ja) * | 2006-03-31 | 2012-05-16 | キヤノン株式会社 | フルオレン誘導体およびそれを用いた有機エレクトロルミネッセンス素子 |
| JP2007308477A (ja) * | 2006-04-20 | 2007-11-29 | Canon Inc | 化合物および有機発光素子 |
| JP4819655B2 (ja) * | 2006-04-27 | 2011-11-24 | キヤノン株式会社 | 4−アリールフルオレン化合物及びそれを用いた有機発光素子 |
| JP4994802B2 (ja) * | 2006-11-17 | 2012-08-08 | キヤノン株式会社 | ピレン化合物および有機発光素子 |
| JP5111135B2 (ja) * | 2007-03-09 | 2012-12-26 | キヤノン株式会社 | 有機発光素子 |
| US8227094B2 (en) * | 2007-04-27 | 2012-07-24 | Canon Kabushiki Kaisha | Organic electroluminescent device |
| JP5127300B2 (ja) * | 2007-05-28 | 2013-01-23 | キヤノン株式会社 | フルオレン化合物及びそれを用いた有機発光素子並びに表示装置 |
| JP5424681B2 (ja) * | 2008-04-01 | 2014-02-26 | キヤノン株式会社 | 有機発光素子 |
| JP5618495B2 (ja) * | 2008-05-16 | 2014-11-05 | キヤノン株式会社 | 有機発光素子 |
| JP5366505B2 (ja) | 2008-11-06 | 2013-12-11 | キヤノン株式会社 | インデノピレン化合物及びこれを用いた有機発光素子 |
| US8815415B2 (en) * | 2008-12-12 | 2014-08-26 | Universal Display Corporation | Blue emitter with high efficiency based on imidazo[1,2-f] phenanthridine iridium complexes |
| WO2010087840A1 (en) | 2009-01-30 | 2010-08-05 | Hewlett-Packard Development Company | Uv light-emissive fluorene-based copolymers |
| CN102300890B (zh) | 2009-01-30 | 2014-03-26 | 惠普开发有限公司 | 嵌段共聚物和嵌段共聚物纳米粒子组合物 |
| JP5523016B2 (ja) * | 2009-08-20 | 2014-06-18 | キヤノン株式会社 | 複素環化合物及びこれを用いた有機発光素子 |
| JP2012238544A (ja) * | 2011-05-13 | 2012-12-06 | Sony Corp | 表示素子および表示装置ならびに電子機器 |
| JP6444046B2 (ja) | 2013-04-03 | 2018-12-26 | キヤノン株式会社 | 有機化合物及び有機発光素子 |
| JP7417350B2 (ja) * | 2017-03-28 | 2024-01-18 | キヤノン株式会社 | 光学素子、光学材料、光学機器及びトリアリールアミン化合物 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004018588A1 (ja) * | 2002-07-19 | 2004-03-04 | Idemitsu Kosan Co., Ltd. | 有機エレクトロルミネッセンス素子及び有機発光媒体 |
| JP2004083481A (ja) * | 2002-08-27 | 2004-03-18 | Canon Inc | フルオレン化合物及びそれを用いた有機発光素子 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE69704239T2 (de) * | 1996-08-08 | 2001-08-09 | Canon Kk | Elektrophotographisches lichtempfindliches Element, Prozesskartusche und elektrophotographisches Gerät, die dieses Element enthalten |
| JP3848262B2 (ja) * | 2002-03-27 | 2006-11-22 | キヤノン株式会社 | オリゴフルオレニレン化合物及び有機発光素子 |
| JP4125076B2 (ja) * | 2002-08-30 | 2008-07-23 | キヤノン株式会社 | モノアミノフルオレン化合物およびそれを使用した有機発光素子 |
| JP4065547B2 (ja) * | 2004-04-12 | 2008-03-26 | キヤノン株式会社 | フルオレン化合物及びそれを用いた有機発光素子 |
| JP4086817B2 (ja) * | 2004-07-20 | 2008-05-14 | キヤノン株式会社 | 有機el素子 |
| JP4429149B2 (ja) * | 2004-11-26 | 2010-03-10 | キヤノン株式会社 | フルオレン化合物及び有機発光素子 |
| CN103193697B (zh) * | 2005-09-08 | 2015-11-18 | 东丽株式会社 | 发光元件材料和发光元件 |
| JP2007169182A (ja) * | 2005-12-20 | 2007-07-05 | Canon Inc | フルオレニレン化合物およびそれを使用した有機発光素子 |
-
2006
- 2006-07-07 JP JP2006188155A patent/JP4659695B2/ja not_active Expired - Fee Related
- 2006-10-30 US US11/554,142 patent/US20070111029A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004018588A1 (ja) * | 2002-07-19 | 2004-03-04 | Idemitsu Kosan Co., Ltd. | 有機エレクトロルミネッセンス素子及び有機発光媒体 |
| JP2004083481A (ja) * | 2002-08-27 | 2004-03-18 | Canon Inc | フルオレン化合物及びそれを用いた有機発光素子 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2007145799A (ja) | 2007-06-14 |
| US20070111029A1 (en) | 2007-05-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4659695B2 (ja) | フルオレン化合物及び有機発光素子 | |
| JP4955971B2 (ja) | アミノアントリル誘導基置換ピレン化合物および有機発光素子 | |
| JP4429149B2 (ja) | フルオレン化合物及び有機発光素子 | |
| JP4677221B2 (ja) | 有機発光素子 | |
| JP5618753B2 (ja) | 有機発光素子 | |
| JP5089235B2 (ja) | 縮合複素環化合物および有機発光素子 | |
| US20080116789A1 (en) | 1, 5-naphthyridine compound and organic light-emitting device | |
| KR101098704B1 (ko) | 벤조〔a〕플루오란텐 화합물 및 그것을 사용한 유기 발광 소자 | |
| JP2007186449A (ja) | アミノビスアントリル誘導基置換化合物、及びそれを使用した有機発光素子 | |
| JP2005015418A (ja) | アントリル誘導基置換化合物およびそれを使用した有機発光素子 | |
| JP2005015419A (ja) | アミノアントリル誘導基置換化合物およびそれを使用した有機発光素子 | |
| JP2007191465A (ja) | アミン化合物および有機発光素子および青色有機発光素子 | |
| JP5153127B2 (ja) | アミン化合物及び有機発光素子 | |
| US20080286611A1 (en) | Benzo(ghi)fluoranthene derivative and organic light emitting device using the same | |
| JP2008294404A (ja) | 有機電界発光素子 | |
| JP2007169182A (ja) | フルオレニレン化合物およびそれを使用した有機発光素子 | |
| JP2007261969A (ja) | 2,6−フルオレニル置換ピリジン化合物及びそれを用いた有機発光素子 | |
| KR101098612B1 (ko) | 벤조[a]플루오란텐 화합물 및 그것을 이용한 유기 발광 소자 | |
| JP5523060B2 (ja) | 新規ビクリセン化合物及びこれを有する有機発光素子 | |
| KR101198175B1 (ko) | 디벤조[c,g]플루오렌 화합물 및 그것을 사용한 유기 발광 소자 | |
| JP4950460B2 (ja) | 有機発光素子 | |
| JP4280618B2 (ja) | 有機発光素子 | |
| US8318326B2 (en) | Fused polycyclic compounds and organic light-emitting device using the same | |
| JP2008288270A (ja) | 有機発光素子用材料及びそれを用いた有機発光素子 | |
| JP2011236158A (ja) | 縮合多環化合物及びこれを用いた有機発光素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090703 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090703 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100930 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20100930 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101001 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20101122 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101130 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101202 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20101221 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101227 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140107 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |