JP4635155B2 - シクロトリホスファゼン誘導体の製造方法 - Google Patents
シクロトリホスファゼン誘導体の製造方法 Download PDFInfo
- Publication number
- JP4635155B2 JP4635155B2 JP2005258751A JP2005258751A JP4635155B2 JP 4635155 B2 JP4635155 B2 JP 4635155B2 JP 2005258751 A JP2005258751 A JP 2005258751A JP 2005258751 A JP2005258751 A JP 2005258751A JP 4635155 B2 JP4635155 B2 JP 4635155B2
- Authority
- JP
- Japan
- Prior art keywords
- reaction
- cyclotriphosphazene
- solution
- group
- general formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 *P1(*)=NP(*)(*)=NP(*)(*)=NP(*)(*)=N1 Chemical compound *P1(*)=NP(*)(*)=NP(*)(*)=NP(*)(*)=N1 0.000 description 2
Description
4−シアノフェノールとフェノールとの混合物をヘキサハロゲン化シクロトリホスファゼンと反応させる方法。
◎特許文献7
ヘキサハロゲン化シクロトリホスファゼンに対し、フェノールのアルカリ金属塩を反応させる方法。
◎特許文献8
アルカリ金属の水酸化物または炭酸塩を脱酸剤として用い、ヘキサハロゲン化シクロトリホスファゼンとフェノールとを反応させる方法。
◎特許文献9
フェノール類とアルカリ金属水酸化物とで調製したフェノラート類を、ヘキサハロゲン化シクロトリホスファゼンと共沸脱水で水を除きながら反応させる方法。
◎特許文献10
相間移動触媒を使用し、ヘキサハロゲン化シクロトリホスファゼンとフェノール等とを水、塩基および水と非混合性の溶媒中で反応させる方法。
◎特許文献11
無機塩類、第三級アミンおよびジメチルアミノピリジンのような有機強塩基の存在下において、ヘキサハロゲン化シクロトリホスファゼンとフェノールとを反応させる方法。
◎特許文献12
鎖状または環式の三級アミン類またはアミド化合物の存在下、アルカリ金属フェノラートとヘキサハロゲン化シクロトリホスファゼンとを反応させる方法。
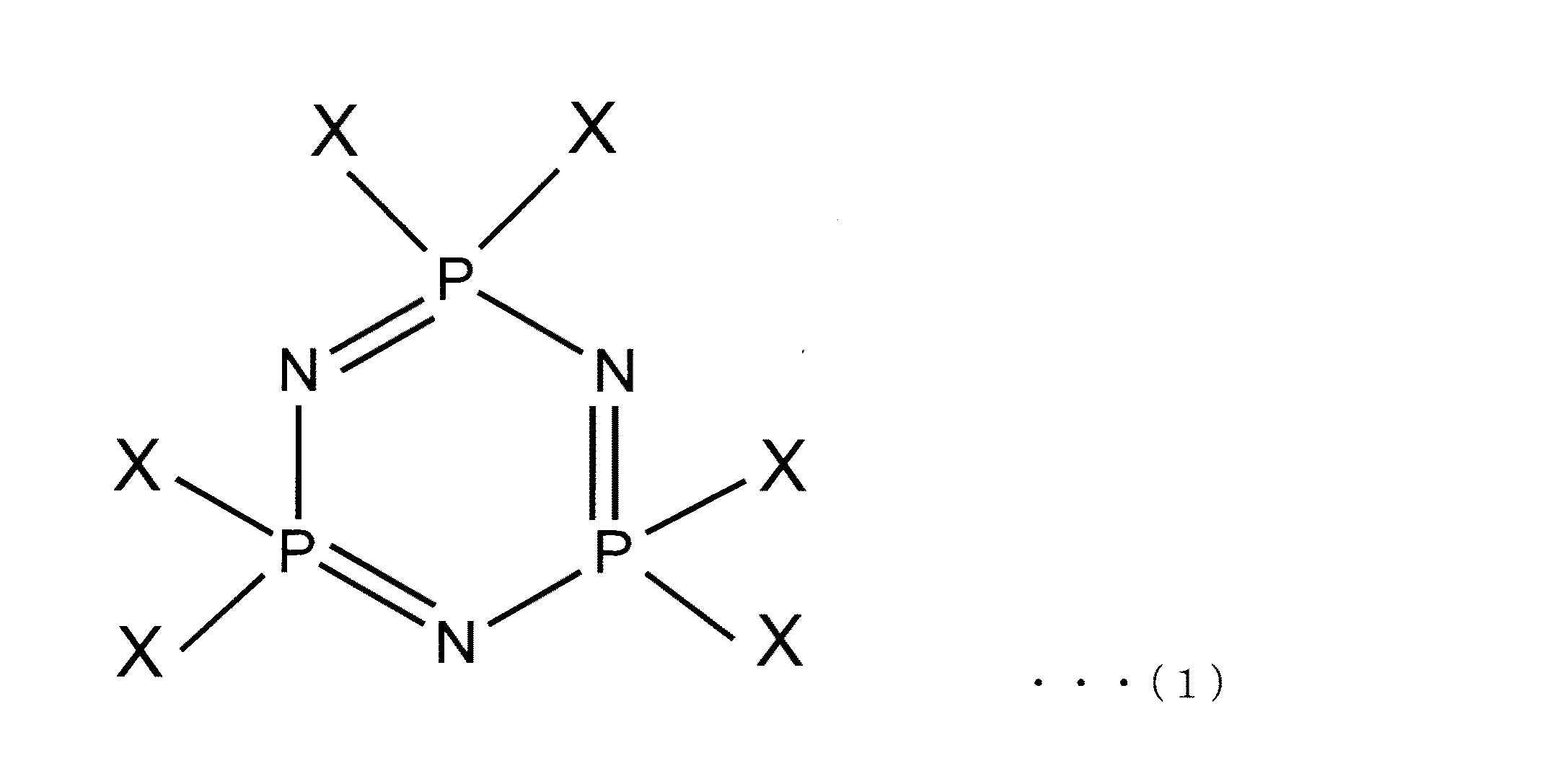
◎下記の一般式(1)で示されるヘキサハロゲン化シクロトリホスファゼンと、下記の一般式(2)で示される第一の有機塩とを第一の溶媒中において−30〜80℃の温度範囲で反応させ、部分置換ハロゲン化シクロトリホスファゼンを得る第一反応工程。
この反応工程では、上述のヘキサハロゲン化シクロトリホスファゼンと有機塩(第一の有機塩)とを溶媒(第一の溶媒)中で反応させる。ここで用いられる第一の有機塩は、下記の一般式(2)で示されるものである。
この反応工程では、第一反応工程により得られた部分置換ハロゲン化シクロトリホスファゼンと有機塩(第二の有機塩)とを溶媒(第二の溶媒)中で反応させる。ここで用いられる第二の有機塩は、下記の一般式(5)で示されるものである。
C:残留活性ハロゲン原子量(ppm)
V:測定用サンプルの滴定量(ml)
B:ブランク用サンプルの滴定量(ml)
f:0.01mol/硝酸銀水溶液のファクター
0.3545:0.01mol/硝酸銀水溶液1mlに対するハロゲンの量(mg/ml)
S:試料の採取量(mg)
溶離液:アセトニトリル
検出器:UV 254nm
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにモノクロロベンゼン300g、塩化アンモニウム38.6g(0.72モル)および酸化亜鉛0.81g(9.9×10−3モル)を仕込んだ。また、滴下ロートには、モノクロロベンゼン300gに五塩化リン125g(0.6モル)を溶解した溶液を仕込んだ。
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにモノクロロベンゼン300g、塩化アンモニウム38.6g(0.72モル)、酸化亜鉛0.81g(9.9×10−3モル)およびピリジン47.4g(0.6モル)を仕込んだ。また、滴下ロートには、モノクロロベンゼン300gに五塩化リン125g(0.6モル)を溶解した溶液を仕込んだ。
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにモノクロロベンゼン300g、塩化アンモニウム38.6g(0.72モル)および酸化亜鉛0.81g(9.9×10−3モル)を仕込んだ。また、滴下ロートには、モノクロロベンゼン300gに五塩化リン125g(0.6モル)を溶解した溶液を仕込んだ。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにフェノール49g(0.52モル)を加え、これを200mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートにナトリウムメトキシドを28重量%含むメタノール溶液100.3g(ナトリウムメトキシド換算で0.52モル)を仕込んだ。そして、滴下ロートの内容物を45分かけて四頚フラスコ内に滴下した。その後、四頚フラスコの内容物を106℃まで加熱してメタノールとシクロペンチルメチルエーテルの一部とを留去し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第三溶液を0±5℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら2時間反応させた。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を150分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で2時間反応させたところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した食塩と未反応の4−シアノフェノールナトリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収した。残留物に含水メタノールを加えて濾過し、得られた結晶を乾燥したところ、その重量は139gであった(収率96.2%)。この結晶の融点は103〜125℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン16.10%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン80.20%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン3.08%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールナトリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器および温度計を備えた1リットルのフラスコにフェノール52.7g(0.56モル)を加え、これを200mlのシクロペンチルメチルエーテルに溶解した。そして、攪拌下のこの溶液に対し、粉末状のナトリウムメトキシド30.2g(0.56モル)を加えた。フラスコの内容物をシクロペンチルメチルエーテルの沸点まで昇温させてメタノールを留去し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を得た。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第三溶液を0±5℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら2時間反応させた。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込んだ。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を約25℃に維持しつつ、当該内容物に対して反応液を150分かけて滴下した。滴下終了後、四頚フラスコの内容物を25℃に維持しながら1時間反応させ、さらに、当該内容物を80℃まで昇温して2時間反応させたところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収した。残留物に含水メタノールを加えて放置したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は137.4gであった(収率95.8%)。この結晶の融点は80〜120℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン2.40%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン89.40%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン5.50%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器および温度計を備えた1リットルのフラスコにフェノール35.1g(0.373モル)を加え、これを200mlのシクロペンチルメチルエーテルに溶解した。そして、攪拌下のこの溶液に対し、粉末状のナトリウムメトキシド20.1g(0.373モル)を加えた。フラスコの内容物をシクロペンチルメチルエーテルの沸点まで昇温させてメタノールを留去し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を得た。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第三溶液を0±5℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら2時間反応させた。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込んだ。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を約25℃に維持しつつ、当該内容物に対して反応液を150分かけて滴下した。滴下終了後、四頚フラスコの内容物を25℃に維持しながら1時間反応させ、さらに、当該内容物を80℃まで昇温して2時間反応させたところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収した。残留物に含水メタノールを加えて放置したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は142gであった(収率95.8%)。この結晶の融点は115〜144℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、フェノキシ−ペンタ4−シアノフェノキシ−シクロトリホスファゼン10.10%、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン85.90%およびトリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン3.90%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにメタノール370ml、フェノール53.6g(0.57モル)および28重量%CH3ONa/メタノール溶液110g(CH3ONa換算で0.57モル)を加えて室温で1時間攪拌し、その後、四頚フラスコの内容物からメタノールを完全に留去した。これにより得られた白色結晶にテトラヒドロフラン690mlを加えて溶解し、溶液を10〜15℃に冷却した。これにより、フェノールナトリウム塩のテトラヒドロフラン溶液(第一溶液)を得た。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第三溶液を0±5℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を30〜40℃に維持しながら2時間反応させた。反応終了後、反応液からテトラヒドロフランの全量を留去し、残留物に500mlのシクロペンチルメチルエーテルを加えて攪拌し、均一に溶解した。このようにして得られたシクロペンチルメチルエーテル溶液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第第一反応工程で得られたシクロペンチルメチルエーテル溶液を仕込み、また、滴下ロートに第二溶液を仕込んだ。そして、四頚フラスコの内容物の温度を20〜25℃に維持しつつ、当該内容物に対して第二溶液の半量を加えて1時間攪拌した。その後、滴下ロート内に残留している第二溶液にトリメチルベンジルアンモニウムクロライド1gを加えて溶解し、滴下ロート内に残留している第二溶液の全量を四頚フラスコ内に滴下した。そして、滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で6時間反応させた。
第二反応工程後の反応液を25℃まで冷却した後に濾過し、反応で生成した食塩と未反応の4−シアノフェノールナトリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収した。残留物に含水メタノールを加えて濾過し、得られた結晶を乾燥したところ、その重量は135.8gであった(収率96.8%)。また、結晶の融点を測定したところ、98.9〜120.3℃であった。さらに、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン2.1%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン91.9%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン4.3%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールナトリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール47.2g(0.502モル)を加え、これを290mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートに液状苛性ソーダ(NaOH20g/水20g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第三溶液を仕込んだ。そして、第一溶液を0〜10℃に維持しながら、第一溶液に対して第三溶液を80分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、同温度で4時間反応した。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で2時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを完全に回収した。残留物に含水メタノールを加えて80℃に加熱し、1時間攪拌して25℃まで冷却してから濾過したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は122gであった(収率84.2%)。この結晶の融点は107〜112℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、フェノキシ−ペンタ4−シアノフェノキシ−シクロトリホスファゼン3.2%、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン42.6%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン43.7%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン5.0%を含むシクロトリホスファゼン誘導体混合物であり、オクタクロロシクロテトラホスファゼン9.0%を含むヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼンとトリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンとを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)を加え、これを290mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートに液状苛性ソーダ(NaOH22.4g/水23g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第三溶液を仕込んだ。そして、第一溶液を0〜10℃に維持しながら、第一溶液に対して第三溶液を80分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、同温度で10時間反応した。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込んだ。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、テトラブチルアンモニウムブロマイド1gを添加し、シクロペンチルメチルエーテルとトルエンとの還流下で2時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルとトルエンとの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルとトルエンとを完全に回収した。残留物に含水メタノールを加えて80℃に加熱し、1時間攪拌して25℃まで冷却してから濾過したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は123gであった(収率85.5%)。この結晶の融点は89〜93℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン17.6%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン64.2%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン14.0%を含むシクロトリホスファゼン誘導体混合物であり、オクタクロロシクロテトラホスファゼン9.0%を含むヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにハイドロキノンモノメチルエーテル37.2g(0.3モル)およびシクロペンチルメチルエーテル300mlを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH16.8g/水17g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、ハイドロキノンモノメチルエーテルカリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第三溶液を仕込んだ。そして、第一溶液を20〜25℃に維持しながら、第一溶液に対して第三溶液を60分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、60℃まで1時間かけて昇温し、同温度で10時間反応した。反応終了後、反応液を濾過して塩化カリウムを分離し、この塩化カリウムを少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を30〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、テトラブチルアンモニウムブロマイド1gを添加して四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で3時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応のフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを完全に回収したところ、69.2g(収率88.4%)のペースト状物が得られた。このペースト状物は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−メトキシフェノキシ−シクロトリホスファゼン17.8%、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼン70.8%およびテトラフェノキシ−ジ4−メトキシフェノキシ−シクロトリホスファゼン8.8%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールカリウム塩とハイドロキノンモノメチルエーテルカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにハイドロキノンモノメチルエーテル37.2g(0.3モル)およびシクロペンチルメチルエーテル300mlを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH16.8g/水17g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、ハイドロキノンモノメチルエーテルカリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第三溶液を仕込んだ。そして、第一溶液を20〜25℃に維持しながら、第一溶液に対して第三溶液を60分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、60℃まで1時間かけて昇温し、同温度で10時間反応した。反応終了後、反応液を濾過して塩化カリウムを分離し、この塩化カリウムを少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を30〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で2時間反応させた後、シクロペンチルメチルエーテルの全量を回収した。
第二反応工程で得られた反応液の温度を120℃以上に維持して溶融状態で10時間反応した。反応終了後、100℃まで冷却し、シクロペンチルメチルエーテル450mlを加えて反応混合物を溶解した。
第三反応工程で得られた反応混合物溶液を25℃まで冷却した後にろ過し、反応で生成した塩化カリウムと未反応フェノールのカリウム塩とを分離した。このように処理した反応混合物溶液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応混合物溶液からシクロペンチルメチルエーテルを完全に回収したところ、74.4g(収率95%)のペースト状物が得られた。このペースト状物は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−メトキシフェノキシ−シクロトリホスファゼン8.9%、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼン75.8%およびテトラフェノキシ−ジ4−メトキシフェノキシ−シクロトリホスファゼン13.5%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールカリウム塩と4−メトキシフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−メトキシフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、20ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール28.2g(0.3モル)とシクロペンチルメチルエーテル300mlとを仕込んだ。一方、滴下ロートに液状苛性カリ(KOH16.8g(0.3モル)/水17g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールカリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第三溶液を仕込んだ。そして、第一溶液を20〜25℃に維持しながら、第一溶液に対して第三溶液を60分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、テトラブチルアンモニウムブロマイド0.5gを加えて同温度で2時間反応した。反応終了後、反応液を濾過して塩化カリウムを分離し、この塩化カリウムを少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を30〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、テトラブチルアンモニウムブロマイド1gを添加し、シクロペンチルメチルエーテルの還流下で3時間反応したところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−ヒドロキシ安息香酸エチルカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを完全に回収したところ、82.6g(収率96%)の無色ペースト状物質が得られた。この無色ペースト状物質は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−エトキシカルボニルフェノキシ−シクロトリホスファゼン3.9%、トリフェノキシ−トリ4−エトキシカルボニルフェノキシ−シクロトリホスファゼン89.9%およびテトラフェノキシ−ジ4−エトキシカルボニルフェノキシ−シクロトリホスファゼン8.8%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールカリウム塩と4−ヒドロキシ安息香酸エチルカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−エトキシカルボニルフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)を加え、これを290mlのシクロペンチルメチルエーテルに溶解した。一方、滴下ロートに液状苛性ソーダ(NaOH22.4g/水23g)を仕込んだ。そして、シクロペンチルメチルエーテルの還流下において、四頚フラスコ内に滴下ロートの内容物を滴下して共沸脱水し、全量が250mlに調整された、フェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第一溶液を仕込み、また、滴下ロートに第三溶液を仕込んだ。そして、第一溶液を10〜20℃に維持しながら、第一溶液に対して第三溶液を90分かけて滴下した。滴下終了後、温度を20〜30℃に維持しながら1時間反応させた。さらに、50℃まで1時間かけて昇温し、テトラブチルアンモニウムブロマイド0.5gを添加して同温度で2時間反応した。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のトルエンを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を25〜50℃に維持しつつ、当該内容物に対して反応液を30分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルとトルエンとを内温が120℃になるまで回収し、反応液の温度を120〜125℃に維持して5時間反応した。
第二反応工程で得られた反応液にトルエン300mlを加えて25℃まで冷却した後に濾過し、反応で生成した塩化カリウムと未反応の4−シアノフェノールカリウム塩とを分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からトルエンを完全に回収した。残留物にメタノールを加えて80℃に加熱し、1時間攪拌して20℃まで冷却してから濾過したところ、結晶が得られた。得られた結晶を乾燥したところ、その重量は136.2gであった(収率95%)。この結晶の融点は97〜112℃であった。また、この結晶は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン12.3%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン82.5%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン5.1%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールカリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、20ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器および温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)、シクロペンチルメチルエーテル250mlおよび60%NaH22.4g(0.56モル)を加えて還流下に3時間反応した後、25℃まで冷却してフェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)250mlを調製した。
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第三溶液を20±5℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を50〜60℃に維持しながら10時間反応させた。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を50〜60℃に維持しつつ、当該内容物に対して反応液を150分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で2時間反応させたところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した食塩、未反応のフェノールナトリウム塩およびp−クレゾールナトリウム塩を分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収したところ、ペースト状物131g(収率95.4%)が得られた。このペースト状物は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−メチルフェノキシ−シクロトリホスファゼン8.6%、トリフェノキシ−トリ4−メチルフェノキシ−シクロトリホスファゼン88.4%およびテトラフェノキシ−ジ4−メチルフェノキシ−シクロトリホスファゼン2.0%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩とp−クレゾールナトリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−メチルフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
(反応材料の調製)
攪拌装置、還流冷却器および温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)、シクロペンチルメチルエーテル250mlおよび60%NaH22.4g(0.56モル)を加えて還流下に3時間反応した後、25℃まで冷却してフェノールナトリウム塩のシクロペンチルメチルエーテル溶液(第一溶液)250mlを調製した。
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第三溶液を20±5℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を50〜60℃に維持しながら10時間反応させた。反応終了後、反応液を濾過して食塩を分離し、この食塩を少量のシクロペンチルメチルエーテルを用いて洗浄した。
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに第二溶液を仕込み、これにテトラブチルアンモニウムブロマイド1gを添加して溶解した。また、滴下ロートに第一反応工程で得られた反応液を仕込んだ。そして、四頚フラスコの内容物の温度を50〜60℃に維持しつつ、当該内容物に対して反応液を150分かけて滴下した。滴下終了後、四頚フラスコを加熱し、シクロペンチルメチルエーテルの還流下で2時間反応させたところ、この反応液のピリジン/アニリン呈色反応がマイナスになった。シクロペンチルメチルエーテルの還流下で反応をさらに4時間継続し、反応を終了した。
第二反応工程で得られた反応液を25℃まで冷却した後に濾過し、反応で生成した食塩、未反応のフェノールナトリウム塩およびp−ベンジルオキシフェノールナトリウム塩を分離した。このように処理した反応液を希アルカリ水溶液と水とで数回洗浄し、洗浄後の反応液からシクロペンチルメチルエーテルを回収したところ、ペースト状物183g(収率97%)が得られた。このペースト状物は、高速液体クロマトグラフィーにより分析したところ、ジフェノキシ−テトラ4−ベンジルオキシフェノキシ−シクロトリホスファゼン9.4%、トリフェノキシ−トリ4−ベンジルオキシフェノキシ−シクロトリホスファゼン82.2%およびテトラフェノキシ−ジ4−ベンジルオキシフェノキシ−シクロトリホスファゼン6.5%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩とp−ベンジルオキシフェノールナトリウム塩との比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−ベンジルオキシフェノキシ−シクロトリホスファゼンを主に含むことが判明した。また、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、50ppm未満であった。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに4−シアノフェノール20.9g(0.175モル)、フェノール16.5g(0.175モル)およびトルエン135mlを仕込んだ。そして、四頚フラスコの内容物を攪拌しながら固形水酸化ナトリウム14g(0.35モル)を添加して還流下において反応させ、6時間かけて、生成した水を共沸脱水により除去した。その後、反応液を20℃まで冷却した。
エポキシ樹脂(JER株式会社の商品名“エピコート828”)、変性ポリフェニレンエーテル樹脂(日本G.E.プラスチックス株式会社の商品名“ノリル640−111”)、硬化剤(ジアミノジフェニルメタン)並びに実験例2〜6および実験例9(以下、これらを「評価実験例」と云う)のいずれかにおいて得られたシクロトリホスファゼン誘導体混合物を表1−Aおよび表1−Bに示す割合で混合し、エポキシ樹脂組成物を調製した(試料1〜6)。また、比較のため、シクロトリホスファゼン誘導体混合物を添加せずに、同様のエポキシ樹脂組成物を調製した(試料7)。さらに、比較のため、評価実験例で得られたシクロトリホスファゼン誘導体混合物に代えてケミプロ化成株式会社の商品名“KD−302S”(ホスファゼン系難燃剤)を用いて同様のエポキシ樹脂組成物を調製した(試料8)。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにフェノール59.2g(0.629モル)を加え、これを390mlのメタノールに溶解した。一方、滴下ロートにナトリウムメトキシドを28重量%含むメタノール溶液121.5g(ナトリウムメトキシド換算で0.629モル)を仕込んだ。そして、滴下ロートの内容物を45分かけて四頚フラスコ内に滴下した。四頚フラスコの内容物を30℃で1時間攪拌し、その後、メタノールの全量を留去した。これにより、88.3gのフェノールナトリウム塩を得た。得られたフェノールナトリウム塩をテトラヒドロフラン725mlに溶解し、フェノールナトリウム塩のテトラヒドロフラン溶液(第一溶液)を得た。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第一溶液を−5〜0℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を0〜5℃に維持しながら2時間反応させた。反応終了後、反応液を濾過し、少量のテトラヒドロフランを用いて洗浄した。反応液からテトラヒドロフランの全量を除去したところ、126.5gの白濁ペースト状物が得られた。
攪拌装置、還流冷却器および温度計を備えた1リットルのフラスコに第一反応工程で得られた白濁ペースト状物を仕込み、これに第二液を加えた。そして、フラスコの内容物を還流下において10時間反応させたところ、反応液のピリジン/アニリン呈色反応がマイナスになった。
第二反応工程の反応終了後、反応液を1,500mlの冷水中に投入し、固液分離した。そして、分離された固相を希アルカリ水溶液と水とで数回洗浄し、さらにメタノール400mlで2回洗浄して乾燥したところ、65.5gの白色結晶が得られた(収率47.2%)。この結晶の融点は60〜102℃であった。また、得られた結晶を高速液体クロマトグラフィーにより分析したところ、この結晶は、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン1.69%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン76.08%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン18.72%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールとの比率に近いシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。但し、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、2,400ppmであり、樹脂材料の改質剤としての利用は困難であった。
(反応材料の調製)
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコにフェノール52.7g(0.56モル)を加え、これを390mlのメタノールに溶解した。一方、滴下ロートにナトリウムメトキシドを28重量%含むメタノール溶液108g(ナトリウムメトキシド換算で0.56モル)を仕込んだ。そして、滴下ロートの内容物を45分かけて四頚フラスコ内に滴下した。四頚フラスコの内容物を30℃で1時間攪拌した後、メタノールの全量を留去し、残留物を725mlのテトラヒドロフランに溶解してフェノールナトリウム塩のテトラヒドロフラン溶液(第一溶液)を調製した。
攪拌装置、還流冷却器、滴下ロート及び温度計を備えた1リットルの四頚フラスコに第三溶液を仕込み、また、滴下ロートに第一溶液を仕込んだ。そして、第一溶液を−5〜0℃に維持しながら、第三溶液に対して第一溶液を150分かけて滴下した。滴下終了後、温度を0〜5℃に維持しながら2時間反応させた。反応終了後、反応液を濾過し、少量のテトラヒドロフランを用いて洗浄した。反応液からテトラヒドロフランの全量を除去したところ、白濁ペースト状物が得られた。
攪拌装置、還流冷却器、滴下ロートおよび温度計を備えた1リットルの四頚フラスコに第一反応工程で得られた白濁ペースト状物を加え、これを200mlのトリエチルアミンに溶解した。また、滴下ロートに第二液を仕込んだ。そして、四頚フラスコの内容物に対して第二液を滴下し、さらに、1gの4−ジメチルアミノピリジンを加えて還流下で25時間反応させたところ、ピリジン/アニリン呈色反応がマイナスになった。
第二反応工程の反応終了後、反応液を2,000mlの冷水中に投入し、固液分離した。そして、分離された固相をトルエンに溶解し、この溶液を希アルカリ水溶液と希硫酸とで数回洗浄し、さらに水洗した。洗浄後の溶液からトルエンを除去し、残留物に対してメタノールによる精製を数回繰り返して乾燥したところ、58.2gの結晶が得られた(収率40.6%)。この結晶の融点は100〜121.8℃であった。また、得られた結晶を高速液体クロマトグラフィーにより分析したところ、この結晶は、ジフェノキシ−テトラ4−シアノフェノキシ−シクロトリホスファゼン1.90%、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼン93.10%およびテトラフェノキシ−ジ4−シアノフェノキシ−シクロトリホスファゼン4.90%を含むシクロトリホスファゼン誘導体混合物であり、ヘキサクロロシクロトリホスファゼンに対して使用したフェノールナトリウム塩と4−シアノフェノールとの比率に対応したシクロトリホスファゼン誘導体、すなわち、トリフェノキシ−トリ4−シアノフェノキシ−シクロトリホスファゼンを主に含むことが判明した。但し、このシクロトリホスファゼン誘導体混合物は、既述の方法により残留活性ハロゲン原子量(残留活性塩素量)を測定したところ、800ppmであり、樹脂材料の改質剤としての利用は困難であった。
Claims (8)
- 下記の一般式(1)で示されるヘキサハロゲン化シクロトリホスファゼンと、下記の一般式(2)で示される第一の有機塩とを第一の溶媒中において−30〜80℃の温度範囲で反応させ、部分置換ハロゲン化シクロトリホスファゼンを得る第一反応工程と、
前記第一反応工程により得られた前記部分置換ハロゲン化シクロトリホスファゼンと、下記の一般式(5)で示される第二の有機塩とを第二の溶媒中において20℃から前記第二の溶媒の沸点の温度範囲で反応させる第二反応工程と、
前記第二反応工程の反応系から前記第二の溶媒を除去し、前記第二反応工程での反応生成物を溶融状態で反応させる第三反応工程と、
を含むシクロトリホスファゼン誘導体の製造方法。 - 前記ヘキサハロゲン化シクロトリホスファゼンが15重量%未満の割合でオクタハロゲン化シクロテトラホスファゼンを含む、請求項1に記載のシクロトリホスファゼン誘導体の製造方法。
- 前記一般式(2)のY1と前記一般式(5)のY2とが同一である、請求項1から4のいずれかに記載のシクロトリホスファゼン誘導体の製造方法。
- 前記一般式(5)のY2が前記一般式(2)のY1と異なる、請求項1から4のいずれかに記載のシクロトリホスファゼン誘導体の製造方法。
- 前記一般式(2)のY1がフェニル基であり、かつ、前記一般式(5)のY2が4−シアノフェニル基である、請求項6に記載のシクロトリホスファゼン誘導体の製造方法。
- 前記ヘキサハロゲン化シクロトリホスファゼン1.0モルに対し、前記第一の有機塩を2.5〜3.5モル用い、前記第二の有機塩を少なくとも3.0モル用いる、請求項7に記載のシクロトリホスファゼン誘導体の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005258751A JP4635155B2 (ja) | 2004-09-27 | 2005-09-07 | シクロトリホスファゼン誘導体の製造方法 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004279025 | 2004-09-27 | ||
| JP2005258751A JP4635155B2 (ja) | 2004-09-27 | 2005-09-07 | シクロトリホスファゼン誘導体の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006117637A JP2006117637A (ja) | 2006-05-11 |
| JP4635155B2 true JP4635155B2 (ja) | 2011-02-16 |
Family
ID=36535863
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005258751A Expired - Fee Related JP4635155B2 (ja) | 2004-09-27 | 2005-09-07 | シクロトリホスファゼン誘導体の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4635155B2 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008045045A (ja) * | 2006-08-17 | 2008-02-28 | Mitsubishi Plastics Ind Ltd | 難燃性乳酸系樹脂組成物 |
| KR101450928B1 (ko) * | 2006-12-01 | 2014-10-14 | 교세라 케미카르 가부시키가이샤 | 감광성 열경화형 수지 조성물 및 플렉시블 프린트 배선판 |
| CN115636851B (zh) * | 2022-09-13 | 2024-06-04 | 云南云天化股份有限公司 | 一种单烷氧基取代的五氟环三磷腈的制备方法 |
| CN119331377B (zh) * | 2024-11-05 | 2025-06-20 | 杭州富阳科威钢业有限公司 | 一种改性聚丙烯hppm方形电力波纹管 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR900701802A (ko) * | 1988-06-23 | 1990-12-04 | 로버트 에프. 캠프 | 이성질화 트리스아릴옥시시클로트리포스파젠고분자 전구물질 및 중간물질의 제조방법 |
| JPH11181429A (ja) * | 1997-02-14 | 1999-07-06 | Otsuka Chem Co Ltd | 難燃剤、難燃性樹脂組成物及び難燃性樹脂成形体 |
| JP2001192392A (ja) * | 2000-01-11 | 2001-07-17 | Chemiprokasei Kaisha Ltd | 環状ホスファゼン化合物、環状ホスファゼン混合組成物、ホスファゼン組成物、それを有効成分とする難燃剤およびそれを含む難燃性組成物 |
-
2005
- 2005-09-07 JP JP2005258751A patent/JP4635155B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006117637A (ja) | 2006-05-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10329231B2 (en) | Epoxy compound, method for producing the same, epoxy resin composition, and cured product thereof | |
| JPH11166035A5 (ja) | ||
| US8779162B2 (en) | Cyanate ester compounds and cured products thereof | |
| JP5812222B2 (ja) | ビフェニル骨格含有エポキシ樹脂の製造方法 | |
| JP6138607B2 (ja) | エポキシ樹脂及び該エポキシ樹脂の製造方法 | |
| JP5662695B2 (ja) | 新規なジエポキシ化合物 | |
| JP4635155B2 (ja) | シクロトリホスファゼン誘導体の製造方法 | |
| JP4635157B2 (ja) | シクロトリホスファゼン誘導体の製造方法 | |
| JP4635156B2 (ja) | シクロトリホスファゼン誘導体の製造方法 | |
| JP2009107991A (ja) | 新規なヒドロキシメチル置換又はアルコキシメチル置換ビスフェノール化合物 | |
| JPS6031516A (ja) | エポキシ樹脂の製造方法 | |
| JP6190256B2 (ja) | 新規なビス(ヒドロキシフェニル)ベンゾオキサゾール化合物 | |
| WO2017186881A1 (en) | Methods for making poly(aryl ether sulfone) polymers and polymer compositions and articles including the same | |
| JP4383180B2 (ja) | 結晶性エポキシ化合物の製造方法 | |
| JP6512970B2 (ja) | 6−ヒドロキシ−2−ナフトエ酸グリシジルエーテルエステルの精製方法 | |
| JP2000034345A (ja) | 多官能シアン酸エステル樹脂組成物および硬化物 | |
| KR20140141496A (ko) | 유기 인 화합물, 에폭시 수지 조성물, 및 유기 인 화합물의 제조 방법 | |
| JP3621996B2 (ja) | エポキシ樹脂およびその製造方法 | |
| WO2003089442A1 (en) | A method of preparing phosphoric ester | |
| JP4336501B2 (ja) | 新規な4,4”−ジアルコキシターフェニル類 | |
| US11499012B2 (en) | Methods for making poly(aryl ether sulfone) polymers and polymer compositions and articles including the same | |
| KR20230052507A (ko) | 2-시아노에틸기를 포함하는 유기화합물 및 이의 제조방법 | |
| JP2005272632A (ja) | シリル基含有ヨウ素化エポキシ化合物及びその製造方法 | |
| JP6017363B2 (ja) | 新規なジエポキシ化合物 | |
| JPH0621150B2 (ja) | エポキシ樹脂の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080731 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100311 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100323 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100519 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100928 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101021 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131203 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4635155 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |