JP4368424B2 - 官能性の挿入法 - Google Patents
官能性の挿入法 Download PDFInfo
- Publication number
- JP4368424B2 JP4368424B2 JP53844698A JP53844698A JP4368424B2 JP 4368424 B2 JP4368424 B2 JP 4368424B2 JP 53844698 A JP53844698 A JP 53844698A JP 53844698 A JP53844698 A JP 53844698A JP 4368424 B2 JP4368424 B2 JP 4368424B2
- Authority
- JP
- Japan
- Prior art keywords
- matrix
- group
- groups
- reagent
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000012966 insertion method Methods 0.000 title 1
- 230000001953 sensory effect Effects 0.000 title 1
- 239000011159 matrix material Substances 0.000 claims abstract description 84
- 238000006243 chemical reaction Methods 0.000 claims abstract description 43
- 239000003153 chemical reaction reagent Substances 0.000 claims abstract description 39
- 238000000034 method Methods 0.000 claims abstract description 19
- 230000008569 process Effects 0.000 claims abstract description 6
- 238000000926 separation method Methods 0.000 claims description 38
- 150000001875 compounds Chemical class 0.000 claims description 22
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 13
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical group BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 13
- 229910052794 bromium Inorganic materials 0.000 claims description 13
- 238000004587 chromatography analysis Methods 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 11
- 229920000642 polymer Polymers 0.000 claims description 10
- 238000005342 ion exchange Methods 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 238000004132 cross linking Methods 0.000 claims description 5
- 125000000524 functional group Chemical group 0.000 claims description 5
- 125000001165 hydrophobic group Chemical group 0.000 claims description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 5
- 230000003993 interaction Effects 0.000 claims description 5
- 229910052736 halogen Chemical group 0.000 claims description 4
- 150000002367 halogens Chemical group 0.000 claims description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 238000002523 gelfiltration Methods 0.000 claims description 3
- 150000004676 glycans Chemical class 0.000 claims description 3
- 229910052739 hydrogen Inorganic materials 0.000 claims description 3
- 239000001257 hydrogen Substances 0.000 claims description 3
- 229920001282 polysaccharide Polymers 0.000 claims description 3
- 239000005017 polysaccharide Substances 0.000 claims description 3
- 229910052717 sulfur Inorganic materials 0.000 claims description 3
- 239000011593 sulfur Substances 0.000 claims description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 claims description 2
- 239000012736 aqueous medium Substances 0.000 claims description 2
- 125000003118 aryl group Chemical group 0.000 claims description 2
- 239000000460 chlorine Substances 0.000 claims description 2
- 229910052801 chlorine Inorganic materials 0.000 claims description 2
- 229910052740 iodine Inorganic materials 0.000 claims description 2
- 239000011630 iodine Substances 0.000 claims description 2
- 125000001309 chloro group Chemical group Cl* 0.000 claims 1
- 230000007812 deficiency Effects 0.000 abstract description 2
- 238000009792 diffusion process Methods 0.000 abstract 1
- 230000001747 exhibiting effect Effects 0.000 abstract 1
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 36
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 30
- 239000010410 layer Substances 0.000 description 28
- 229920002307 Dextran Polymers 0.000 description 27
- 239000012153 distilled water Substances 0.000 description 23
- 229920002684 Sepharose Polymers 0.000 description 19
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 18
- 238000003756 stirring Methods 0.000 description 18
- 239000000499 gel Substances 0.000 description 16
- 229920000936 Agarose Polymers 0.000 description 14
- 239000011324 bead Substances 0.000 description 12
- 239000002245 particle Substances 0.000 description 12
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 11
- 239000011521 glass Substances 0.000 description 9
- 230000002209 hydrophobic effect Effects 0.000 description 9
- 239000007788 liquid Substances 0.000 description 9
- 235000018102 proteins Nutrition 0.000 description 9
- 102000004169 proteins and genes Human genes 0.000 description 9
- 108090000623 proteins and genes Proteins 0.000 description 9
- 239000011780 sodium chloride Substances 0.000 description 9
- 230000031709 bromination Effects 0.000 description 8
- 238000005893 bromination reaction Methods 0.000 description 8
- 239000000872 buffer Substances 0.000 description 8
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 7
- 238000003780 insertion Methods 0.000 description 7
- 239000003446 ligand Substances 0.000 description 7
- 150000002500 ions Chemical class 0.000 description 6
- 238000003786 synthesis reaction Methods 0.000 description 6
- 102000004407 Lactalbumin Human genes 0.000 description 5
- 108090000942 Lactalbumin Proteins 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 238000005349 anion exchange Methods 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 5
- 230000037431 insertion Effects 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 235000021241 α-lactalbumin Nutrition 0.000 description 5
- MPNXSZJPSVBLHP-UHFFFAOYSA-N 2-chloro-n-phenylpyridine-3-carboxamide Chemical compound ClC1=NC=CC=C1C(=O)NC1=CC=CC=C1 MPNXSZJPSVBLHP-UHFFFAOYSA-N 0.000 description 4
- 229910004373 HOAc Inorganic materials 0.000 description 4
- 102000009843 Thyroglobulin Human genes 0.000 description 4
- 108010034949 Thyroglobulin Proteins 0.000 description 4
- 239000011203 carbon fibre reinforced carbon Chemical group 0.000 description 4
- MSQACBWWAIBWIC-UHFFFAOYSA-N hydron;piperazine;chloride Chemical compound Cl.C1CNCCN1 MSQACBWWAIBWIC-UHFFFAOYSA-N 0.000 description 4
- -1 hydroxy, amino Chemical group 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 229960002175 thyroglobulin Drugs 0.000 description 4
- STMDPCBYJCIZOD-UHFFFAOYSA-N 2-(2,4-dinitroanilino)-4-methylpentanoic acid Chemical compound CC(C)CC(C(O)=O)NC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O STMDPCBYJCIZOD-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 102100033468 Lysozyme C Human genes 0.000 description 3
- 108010014251 Muramidase Proteins 0.000 description 3
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 3
- 108010058846 Ovalbumin Proteins 0.000 description 3
- 102000004338 Transferrin Human genes 0.000 description 3
- 108090000901 Transferrin Proteins 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 230000007717 exclusion Effects 0.000 description 3
- 238000007306 functionalization reaction Methods 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 229920001477 hydrophilic polymer Polymers 0.000 description 3
- 239000004325 lysozyme Substances 0.000 description 3
- 235000010335 lysozyme Nutrition 0.000 description 3
- 229960000274 lysozyme Drugs 0.000 description 3
- 238000006386 neutralization reaction Methods 0.000 description 3
- 229940092253 ovalbumin Drugs 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000012581 transferrin Substances 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- 102000008192 Lactoglobulins Human genes 0.000 description 2
- 108010060630 Lactoglobulins Proteins 0.000 description 2
- 241000192130 Leuconostoc mesenteroides Species 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 229910021607 Silver chloride Inorganic materials 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 238000005937 allylation reaction Methods 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 239000013522 chelant Substances 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 125000002228 disulfide group Chemical group 0.000 description 2
- 239000012039 electrophile Substances 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 238000001000 micrograph Methods 0.000 description 2
- 238000007431 microscopic evaluation Methods 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 239000012038 nucleophile Substances 0.000 description 2
- 239000003495 polar organic solvent Substances 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- HKZLPVFGJNLROG-UHFFFAOYSA-M silver monochloride Chemical compound [Cl-].[Ag+] HKZLPVFGJNLROG-UHFFFAOYSA-M 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 2
- 239000002344 surface layer Substances 0.000 description 2
- 125000003396 thiol group Chemical class [H]S* 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- CHRJZRDFSQHIFI-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;styrene Chemical compound C=CC1=CC=CC=C1.C=CC1=CC=CC=C1C=C CHRJZRDFSQHIFI-UHFFFAOYSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 102000028555 IgG binding proteins Human genes 0.000 description 1
- 108091009325 IgG binding proteins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 229920001218 Pullulan Polymers 0.000 description 1
- 239000004373 Pullulan Substances 0.000 description 1
- 239000012506 Sephacryl® Substances 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 239000012505 Superdex™ Substances 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 229910021536 Zeolite Inorganic materials 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- XKMRRTOUMJRJIA-UHFFFAOYSA-N ammonia nh3 Chemical compound N.N XKMRRTOUMJRJIA-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O ammonium group Chemical group [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- OTBHHUPVCYLGQO-UHFFFAOYSA-N bis(3-aminopropyl)amine Chemical compound NCCCNCCCN OTBHHUPVCYLGQO-UHFFFAOYSA-N 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- HNPSIPDUKPIQMN-UHFFFAOYSA-N dioxosilane;oxo(oxoalumanyloxy)alumane Chemical compound O=[Si]=O.O=[Al]O[Al]=O HNPSIPDUKPIQMN-UHFFFAOYSA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 125000003700 epoxy group Chemical group 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 150000003944 halohydrins Chemical class 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 230000005660 hydrophilic surface Effects 0.000 description 1
- 229920001600 hydrophobic polymer Polymers 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 229920000592 inorganic polymer Polymers 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 239000002346 layers by function Substances 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- MVBJSQCJPSRKSW-UHFFFAOYSA-N n-[1,3-dihydroxy-2-(hydroxymethyl)propan-2-yl]prop-2-enamide Chemical compound OCC(CO)(CO)NC(=O)C=C MVBJSQCJPSRKSW-UHFFFAOYSA-N 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 239000012454 non-polar solvent Substances 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 229920000620 organic polymer Polymers 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 229920001390 poly(hydroxyalkylmethacrylate) Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 1
- 235000019423 pullulan Nutrition 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical group [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-O sulfonium group Chemical group [SH3+] RWSOTUBLDIXVET-UHFFFAOYSA-O 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 150000003568 thioethers Chemical group 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 239000010457 zeolite Substances 0.000 description 1
- 229910001928 zirconium oxide Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/0006—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar, e.g. colominic acid
- C08B37/0036—Galactans; Derivatives thereof
- C08B37/0039—Agar; Agarose, i.e. D-galactose, 3,6-anhydro-D-galactose, methylated, sulfated, e.g. from the red algae Gelidium and Gracilaria; Agaropectin; Derivatives thereof, e.g. Sepharose, i.e. crosslinked agarose
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/30—Processes for preparing, regenerating, or reactivating
- B01J20/32—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating
- B01J20/3202—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating characterised by the carrier, support or substrate used for impregnation or coating
- B01J20/3206—Organic carriers, supports or substrates
- B01J20/3208—Polymeric carriers, supports or substrates
- B01J20/3212—Polymeric carriers, supports or substrates consisting of a polymer obtained by reactions otherwise than involving only carbon to carbon unsaturated bonds
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/30—Processes for preparing, regenerating, or reactivating
- B01J20/32—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating
- B01J20/3231—Impregnating or coating ; Solid sorbent compositions obtained from processes involving impregnating or coating characterised by the coating or impregnating layer
- B01J20/3234—Inorganic material layers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/0006—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar, e.g. colominic acid
- C08B37/0009—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar, e.g. colominic acid alpha-D-Glucans, e.g. polydextrose, alternan, glycogen; (alpha-1,4)(alpha-1,6)-D-Glucans; (alpha-1,3)(alpha-1,4)-D-Glucans, e.g. isolichenan or nigeran; (alpha-1,4)-D-Glucans; (alpha-1,3)-D-Glucans, e.g. pseudonigeran; Derivatives thereof
- C08B37/0021—Dextran, i.e. (alpha-1,4)-D-glucan; Derivatives thereof, e.g. Sephadex, i.e. crosslinked dextran
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Polymers & Plastics (AREA)
- Analytical Chemistry (AREA)
- Materials Engineering (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Inorganic Chemistry (AREA)
- Solid-Sorbent Or Filter-Aiding Compositions (AREA)
- Treatment Of Liquids With Adsorbents In General (AREA)
- Polyurethanes Or Polyureas (AREA)
- Chemical Treatment Of Fibers During Manufacturing Processes (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
Description
本発明は、多官能性多孔性マトリックスの製造法に関する。現在、本発明のマトリックスの主な使用は、液体に溶解したまたは分散した成分の混合物からの1個またはそれ以上の成分の分離である。マトリックスは、a)オリゴペプチドおよびオリゴヌクレオチドの合成、b)親和性反応を使用した分析および測定法等に、固相としても使用できる。また他の使用も存在する。
現在の分離は、成分(複数も有る)を含む液体をマトリックスと接触させ、分離する成分(複数もある)をマトリックスに分配し、それにより、マトリックスへの分配が異なる(全く分配されないものも含む)残りの成分から除去することを含む。
“マトリックスへの分配”なる表現は、成分がマトリックスに結合するか、そうでなければマトリックス上/内に吸着されることを意味する。
成分は、全細胞およびその一部を含む、個々の物質/複合体構造を意味する。
技術的背景−分離マトリックスの合成および関連する問題
十分に高い純度の成分を得るために、異なる官能の数個のマトリックスがしばしば分離工程で使用されなければならない。これが、分離工程の数の減少をさせる多官能性マトリックスの製造という考えを導いている。例えば、本願と共に現在出願されている我々の特許出願“分離用マトリックスおよび該マトリックスを利用した分離法”参照。我々は、それで、異なる関連する分離特性の二個またはそれ以上の別の相を含むマトリックスを記載している。
一定の分離特性のマトリックスの合成は、しばしば、官能基Aを提示するベースマトリックスと、試薬Iとの反応を含み、基Aとの反応を介して、マトリックスは新規官能性を得る。Aはしばしばヒドロキシ、アミノ(1級、2級および3級)、チオール、カルボキシ(−COOH/−COO-)、アリルの中ようなアルケニル、ハロゲン等および対応する活性化(反応性)形である。基Aがしばしばマトリックスにくまなく存在するため、以前に既知の方法は、挿入した官能性がマトリックス全体に渡り同様に位置することに関連している。挿入した官能性は、反応性基またはマトリックスの分離特性に寄与する基を意味する。挿入された反応性基は、マトリックスの分離特性、またはマトリックス結合形で使用することが望まれる他の特性に寄与する基の形成に利用される。
以前に既知の方法に従っては、多孔性マトリックスに層状官能性を挿入することは不可能であった。
本発明の目的
本発明の主な目的は、内部に異なる官能性の層を示す、通常異なる分離官能性の層となる(分離層)分離マトリックスのための多孔性マトリックスの製造を可能にすることである。
本発明
本発明は、技術的背景に記載の方法に従った多孔性マトリックスへの官能性の挿入法である。本発明は、マトリックス内の1個またはそれ以上の十分に定義された層に所望の官能性を挿入することを可能にする。本発明は、
a)マトリックスが接触する試薬Iの量が、試薬Iとの反応に先立って存在する基Aと比較して不足している、そして
b)試薬Iと基Aの間の反応が、試薬Iのマトリックス内への輸送と比較して速いように、試薬Iと反応条件を選択する(基Aとの反応が、試薬Iのマトリックス内への分散と比較して速い)
ことを特徴とする。
不足しているは、試薬Iの用量がマトリックス内の全A基との反応に不充分であることを意味する。新規官能性の層が試薬Iにより挿入される際に、同時にマトリックスの内部層は未反応のまま残る。不足を計算するとき、試薬Iが、蒸発などを介した副反応により不足し得ることを考慮しなければならない。
基Aと試薬Iの間の速い反応は、また試薬Iが速い物理化学的反応で基Aに局所的に吸着されると理解される。この場合、試薬Iは、マトリックスへの局所結合を促進する1個またはそれ以上の反応物の添加によりマトリックスに安定化できる。
本発明の基Aの典型的例は、ヒドロキシ、アミノ、カルボキシ(−COOH/−COO-)、メルカプト、炭素−炭素二重結合などである。
試薬Iは、意図される官能基を挿入する限り、マトリックスに分配するよりも速くマトリックスに結合できる任意の化合物であり得る。分配の速度とAとの反応の速度の比は、層官能化が試薬Iの基Aに対する反応性の増加により、また試薬Iのサイズの増加により促進されることを考慮して、試薬Iの適当な選択により最適化できる。反応はしばしば溶媒、pH、温度等に影響される。適当な条件は、各試薬および行う反応のタイプの慣用の経験により選択される。非極性および極性有機溶媒および中間の極性の有機溶媒およびそれらの混合物、および適当な場合また水との混合物が、本発明の工程で純水よりも適している場合がしばしばある。
試薬Iは、起こるための適当な条件に適合する限り(マトリックス内の輸送と比較して、速い基との反応)、所望の官能性を挿入する化合物であり得る。分離マトリックスの合成のために、試薬IとAとの反応の場合、予定された層に分離特性を挿入する。
試薬Iはまたいわゆる活性化試薬でもよい。これらは、通常更なる官能化、および導入部に従ったマトリックスの使用に必要な反応性基の挿入に利用する。活性化試薬は求電子剤、求核剤、遊離ラジカルに基づくものであり得る。
優先日当時、我々は求電子試薬の形の試薬Iでほとんど作業している。例は、X2またはXOH(Xは塩素、臭素、ヨウ素のようなハロゲン)または陽性荷電または非荷電ハロゲンを容易に分配するハロゲン化試薬である。ほとんどのハロゲン化試薬、特にX2またはXOHは、炭素−炭素二重結合と瞬時の反応をする。炭素−炭素二重結合はまた反応性基として近接ジハライドまたはハロヒドリンをもたらし得、それは容易に反応性エポキシ基に変換する。
通常、反応性基それ自体は有用な分離特性に寄与しない。従って、それらはしばしば更に本発明に従って活性化された層内に所望の分離特性を挿入する化合物Bと反応する。化合物Bの使用により挿入できる特定の分離特性は、下記の“導入された分離特性”の標題の場所に記載する。化合物Bは、反応性基を挿入し、次ぎに化合物Cとの反応を介した分離特性の挿入に利用できるように選択し得る。理論的に、長い反応シーケンスを使用することが可能であり得る。化合物B、C等が先に挿入された基との反応よりも遅く分散されるように配置できる限り、本発明はまた化合物B、Cなどと先に挿入された反応基の間の反応の各々にも適応できる。
必要な場合、後に除去できる保護基の挿入が適していることがある。例えば、試薬(試薬I、化合物B、C等)が、その中にそれらが存在する層を介して輸送される際に、基が試薬を破壊する場合である。
架橋の程度、マトリックスの密度または多孔性は、官能性の特別な種類である。化合物Bの添加無しに、層様に変化できる。基Aとしての炭素−炭素二重結合と試薬IとしてのX2またはXOHの組み合わせに関して、架橋は、本発明に従った、活性化後(実際にはOH-(=化合物B)の添加)の単純なpHの変化による層活性化で達成できる。あるいは、ある場合、活性化は架橋を可能にするpHで達成できる。
親水性表面層が、化合物Bが水、OH-または挿入された反応基と反応できる他の親水性低分子求核剤である場合、通常得られる。所望により、マトリックスの内部の残りの基Aは、次いで、例えば、本発明に従った官能化に利用できる。
分離特性を層に挿入した後、他の分離特性の層を挿入できる。例えば、マトリックスの更新された活性化により、化合物Bで得られる以外の分離特性を挿入する化合物B’と反応させる。付加層は、必ずしも本発明の工程に従って挿入される必要はない。この場合、また、保護基の挿入が必要であり得る。
本発明で使用し得るベースマトリックス。
適当なベースマトリックスは、しばしば粒子の形である。それらは不溶性でなければならないが、濡らすことができ、しばしばそれらをその中で使用する液体媒体中で膨張性でもある。その内部および外部表面は、疎水性から親水性のものであり得る。親水性特性は、その内部および外部表面がヒドロキシ(−OH)、アミノ−(NH2)、カルボキシ(−COOH/−COO-)、アミド(−CONH2)、反復基−OCH2CH2−および−OCH2−CH2CH2−、−OCH2CH2(CH3)−等のような親水性基を提示する場合、達成される。疎水性特性は、疎水性基、例えば、2個またはそれ以上の炭素原子を有する炭化水素基が対応して存在する場合、達成できる。中間の親水性/疎水性に関して、マトリックスの表面がしばしば両方のタイプの基を提示する。
マトリックスは、典型的に合成または生物学的起源であり得る有機または無機ポリマーの構築物である。特に、いわゆるバイオポリマーを特記し得る。
既知の親水性有機マトリックスは、多くの上記のタイプの親水性基を提示するポリマーである。既知の親水性ポリマーは、いわゆるポリヒドロキシポリマーおよびポリアミドであり、水性媒体に不溶性であり、例えばポリビニリックアルコール、ポリ(ヒドロキシアルキルメタクリレート)および対応するアクリレート、ポリアクリル酸およびポリメタクリル酸アミド(例えば、トリスアクリル酸アミドおよびトリスメタクリル酸アミド(トリス=(HOCH2CH2)3CNH3)、アガロース、デキストラン、プルランおよびセルロースのようなポリサッカライドを基本にしており、所望により分離マトリックスとして適するように架橋する。
既知の疎水性有機マトリックスは、スチレンジビニルベンゼンポリマー、ポリ(アルキルメタクリレート)、過フッ素化炭化水素(PFC)のポリマー等の多孔性形である。
分離マトリックスの無機変異体は、ガラス、ゼオライト、シリカゲル、混成物質、酸化ジルコニウム等の多孔性形を基本にし得る。
親水性マトリックス、疎水性マトリックス、無機マトリックス等は親水化/疎水化を介して所望の親水性/疎水性とし得る。
優先日当時の最も好ましいマトリックスは、
a)所望により架橋し、所望によりまたデキストランで孔中を誘導体化された、例えば、それぞれSepharose▲R▼およびSuperdex▲R▼の名前で市販されている等級のビーズの形のアガロース、
b)例えば、Sephadex▲R▼の名前で市販されている等級のビーズの形の架橋デキストラン、
c)例えば、Sephacel▲R▼の名前で市販されている等級のセルロース、
d)デキストランで孔を誘導体化されたポリアクリルアミドの架橋多孔性粒子、例えば、Sephacryl▲R▼、そして
e)例えば、MonoBeads▲R▼およびSource▲R▼の名前で市販されている等級の、親水化された、とりわけ、実質的に疎水性物質、例えばスチレン−ジミビルベンゼンポリマーの単分散および多分散多孔性粒子
に基づいている。
これらの商標は、Amersham Pharmacia Biotech AB, Uppsala, Swedenの製品に対応する。
マトリックスの密度はそれらをその中で使用する液体媒体より高い、低いまたは同じであり得る(液体媒体で飽和されたマトリックスの密度)。粒子の形のマトリックスは、その密度を決める充填剤を含み得る。例えば、WO-A-9200799(Kem-En-Tek-Upfront Chromatography)およびWO9118237(Pharmacia Biotech AB)参照。
分離マトリックスの多孔性(排除限界)に関する要求は、主に分離する化合物のモル重量および形により決定される。本発明に関して、多孔性が試薬Iおよびまたしばしば化合物Bのマトリックス内の輸送を可能にしなければならないことも重要である。
興味深い排除限界は、一般に3−106Åの間である。本出願人、および将来の特許権者の技術的分野内で、少なくとも10Åの排除限界が特に有利であり得る。
挿入された分離特性
マトリックスの分離特性は、しばしばそれが担持する基により決定される。この意味で一般的な基は:
1.イオン交換基
2.バイオアフィニティー基
3.疎水性基
4.共有結合クロマトグラフィーに使用できる基
5.例えば、いわゆるチオフィリック相互作用の硫黄含有基
6.キレートまたはキレート形成基
7.異なる化合物といわゆるπ−π相互作用を発生させる芳香族系を有する基
8.水素結合を供与する基
9.架橋基
10.親水性基等
11.重合基である。
本発明の内容で、化合物BまたはB’または対応する物質が、連続反応中で1−11の基のいずれかを示すように、しばしば配置される。これらの基は、また化合物Bと先の工程で本発明に従って層内に挿入された反応性基の間の反応の結果としても製造される。後者は特にタイプ1またはタイプ3−9のより小さい基で当てはまる。ある場合、基はまた直接試薬Iにより挿入できる。
イオン交換基は、1級、2級、3級、4級アンモニウム基、スルホニウム基等のようなアニオン交換またはカルボキシレート(−COO-)、ホスホネートまたはホスフェート(それぞれ−PO3 2-および−OPO3 2-)、スルホネートまたはスルフェート(それぞれ、−SO3 -および−OSO3 -)等のカチオン交換であり得る。基−COO-、−PO3 2-、OPO3 2-、−SO3 -および−OSO3 -において、遊離原子価は直接炭素原子に結合する。
既知のバイオアフィニティー基は、a)抗原/ハプテンおよび抗体(その抗原またはハプテン結合フラグメントを含む)、b)核酸およびその相補的対応物、c)レクチンおよび炭素水和物(carbonhydrate)構造、d)IgG結合タンパク質およびこのようなタンパク質に結合するIgGの一部を提示するタンパク質、e)センスおよびアンチセンスをベースにしたアフィニティーシステム等のペアの一つのメンバーである。バイオアフィニティー基はまた合成的に製造した有機分子由来の基であり、天然に存在する生物特異的親和性を“模倣”する、いわゆる“模倣物”も含む。
疎水性基は、しばしば数個の酸素、窒素または硫黄原子を含むか、含まない炭化水素基である。疎水性基の典型的な例は、直鎖、分枝鎖および環状飽和、不飽和または芳香族炭化水素基である。
共有結合クロマトグラフィーに使用できる基の中で、ジスルフィド基、主に反応性ジスルフィド基(−S−S−R1)および遊離チオール基(−SH)を特記できる。R1の例は2−ピリジルである。R1の更なる例は、例えば、US4,647,655(Pharmacia AB)参照。
チオフィリック相互作用に利用できる硫黄含有基の中で、特記できる基は、本質的に疎水性であるが、1個またはそれ以上のチオエーテル構造がその中に存在するものである。例えば、Oscarsson & Porath WO-A-9533557 ; Porath EP-A-165912;およびPorath EP-A-168363参照。
水素結合基は、先に使用されている
(引用して包含させる)。このタイプの基は、しばしばアンモニウム窒素と2または3炭素原子の距離のヒドロキシ基と共に、弱いアニオン交換アンモニウム基(1級、2級または3級)を示す。
架橋基は、試薬Iの使用により直接挿入できる。上記参照。あるいは、同時に2個またはそれ以上の反応性基と結合できる化合物Bを使用できる。
本発明の親水性基は、主に1個のヒドロキシおよび1個またはそれ以上のヒドロキシまたは反復基−CH2CH2O−を有する低級ヒドロキシアルキルである。この基は、しばしば低級分子、例えば、25炭素原子より小さい。
リガンド有りまたは無しの重合基は、ゲル濾過特性を付与できる。ポリマーは架橋できる。
適当な基は、典型的に、既知の方法に従って種々の構造であり得る架橋を介してマトリックスに結合する。橋構造は、上記の1−11の1個またはそれ以上の基を各橋に有する、重合、例えば、親水性または疎水性ポリマーであり得る。一般的な橋名は、触手、“エクステンダ”、フルーフ、“リンカー”、“スペーサー”等である。疎水性橋は主に疎水性液体媒体に適し、しばしば1−11の基の挿入に良好な有用性および能力を有する。親水性液体媒体と組み合わせた疎水性橋も対応が当てはまる。親水性ポリマー橋の例は、デキストランのようなポリサッカライドおよび他の水溶性ポリヒドロキシポリマーである。
本発明の更なる態様
本発明の一つの態様は、本発明に従って製造できるマトリックスである。これらのマトリックスは異なる官能性を有する1個またはそれ以上の層を含む。一つの層における少なくとも一つのリガンドの1−11の基での置換の程度は、他の層での同じリガンドの置換の程度としばしば異なる。本発明のマトリックスの多くの態様において、表面層の置換の程度は0かほとんど0であるが、同時に内部層に同じリガンドが存在する。またこの逆も真実であり得る。
本発明の別の態様は、導入部に従った分離のためのマトリックスの使用である。
マトリックスの選択および挿入された基(上記参照)に依存する分離は、アフィニティークロマトグラフィーとしてまたは分離する化合物のサイズおよび形に基づいたクロマトグラフィーとして(ゲル濾過)、または対応するバッチ式方法として設計できる。充填床および安定化流動/伸長床が使用できる。アフィニティークロマトグラフィーの例は、イオン交換クロマトグラフィー(アニオン交換、カチオン交換)、バイオアフィニティークロマトグラフィー、疎水性相互作用クロマトグラフィー(HIC)、共有結合クロマトグラフィー、チオフィリッククロマトグラフィー、キレートをベースにしたクロマトグラフィー、π−π相互作用を基本にしたクロマトグラフィー等である。原則として、条件およびプロトコールは分離法の各々のタイプの先の知識に従って選択する。
分離は、類似のまたは非常に異なる成分を含む混合物から行い得、すべて一つの小分子から、粒子凝集、バイオアフィニティー複合体、動物および植物細胞ならびにその一部、微生物およびその一部等においてのように、互いに複合的に結合した個々の成分である。関心の物質は、取り分け、オリゴヌクレオチドを含む核酸、ペプチドを含むタンパク質、脂質および他の有機および無機化合物である。
分離は、興味の成分がa)マトリックスに分配されるが、望まない物質は液体媒体に残ったままであるかまたはb)液体媒体に残るが、望まない物質がマトリックスに分配されることを含み得る。
本発明を多くの非限定的実施例と共に示す。本発明は、明細書の一部を構成する添付の請求の範囲に定義される。
実験部分
実施例1:ビーズの外部層内にロックを有するQセファロース4ファーストフローイオン交換体の製造
A.粒子形の架橋アリル化アガロースの製造(アリル化セファロース4ファーストフロー)。セファロース4ファーストフローはAmersham Pharmacia Biotech AB, Uppsala, Sweden由来であった。平均粒子サイズ90μmの架橋アガロースを含むマトリックスを、エピクロロヒドリンとアガロースのNaOH存在下でのPorath et al.(J. Chromatog. 60(1971)167-77およびUS-A-3,959,251)に従った反応により製造した。アリル化は、完成した粒子とアリルグリシジルエーテルと塩基としてのNaOHを、0.26mmole/mLゲルのアリルレベル(CH2=CHCH2OCH2CHOHCH2−)まで反応させて達成させる。
B.秤量平均分子量500000のデキストランの溶解。デキストランT500は、Amersham Pharmacia Biotech ABから商品として入手可能であり、Leuconostoc mesenteroides由来の加水分解および分画粗デキストランを含む。デキストランT500 12.8gを、三首フラスコ内の蒸留水250mLに撹拌しながら溶解する。
C.架橋アリル化アガロースの部分的臭素化。工程Aに従って製造した排出したアリル化アガロース30mL、蒸留水30mLおよび無水NaOAc 0.64gを100mL反応容器中に入れる。続いて、臭素化を、激しく撹拌しながら臭素0.25mLを添加することにより達成する。臭素の量の計算において、一部の揮発性臭素が蒸発することを考慮する。反応は、混合物が純水に白色になるまで数分続ける。臭素化後、ゲルをガラスフィルター上で蒸留水で洗浄する。
D.デキストランT500の結合。工程C由来のゲルを吸引乾燥し、工程B由来の溶解デキストランT500を含む反応容器に注意深く撹拌しながら添加する。混合物を1時間平衡化させる。続いて、反応を蒸留H2O 27.2mLに溶解したNaOH 2.98gおよびNaBH4 0.12gの添加により開始する。温度を35℃に調節し、反応を一晩(例えば16時間)、注意深く撹拌しながら続ける。撹拌を停止し、反応混合物をガラスフィルターで濾過する。ほとんどのデキストランT500が、蒸留水で洗い出された後、数mLの濃HOAcで、直接濾過漏斗をpH<7に、好ましくは5−6にして中和を行い、次いでゲルを再び蒸留水で洗浄する。結合後、残りのアリルレベルは0.19mmole/mLであった。
E.残りのアリル基の臭素化。工程Dに従って製造した、ビーズの外部のデキストランT500の層で修飾させた吸引されたアリル化アガロース20mL、蒸留水4.53mLおよび無水NAOAc 0.8gおよび臭素0.4mLを、激しく撹拌しながら三首フラスコに添加する。撹拌を黄色着色/過剰の臭素が無くなるまで続ける。
F.残りのアリル基を介したイオン交換基の挿入。アニオン交換4級アミン基(CH3)3N+CH2CHOHCH2−の挿入を、Eと同じ三首フラスコで直接続ける。65%トリメチルアンモニウムクロライド(TMAC)9.9gをフラスコに入れる。10分撹拌し、次いで蒸留水3.0gに溶解したNaOH 3.0gを入れる。この50%NaOH溶液の添加において、混合物は薄黄色になる。その直後、NaBH4 0.06gをそれに入れる。温度を24℃に調節し、撹拌を開始する。反応を一晩(例えば16時間)続ける。反応を、数mLの濃HOAcでの直接フラスコ内のpH<7、好ましくはpH5−6への中和により停止し、次いでゲルを蒸留水および数ゲル容量の1.0M NaClで繰り返し洗浄する。最後に、ゲルを再び蒸留水で繰り返し洗浄する。イオン交換の能力を、0.132mmole/mLへの塩化銀滴定により測定する。
G.ビーズの外部層内にロックを有するQセファロース4ファーストフローイオン交換体の顕微鏡評価。全顕微鏡評価は、200の倍率での相コントラストの可変調節可能な顕微鏡で行った。実施例1の出発マトリックスであるセファロース4ファーストフローおよび完成した実施例1のロックを有するQセファロース4ファーストフローイオン交換体を、比較のためにヘマトキシリンで染色した。後者の場合、ロックは撮った顕微鏡写真で、ビーズの外部相に明らかに見えた。ロックビーズが働く光学の観察を可能にするために、完成したQセファロース4ファーストフローロックイオン交換体を数分ウシCO−ヘモグロビンと、pH8.2;0.020Mトリス−HCl緩衝液でインキュベートした。過剰のCO−ヘモグロビンを同じ緩衝液で洗い出した。次いでビーズを先の付加的染色無しに顕微鏡で観察した。顕微鏡写真において、ビーズの内部の赤色CO−ヘモグロビンが見られたが、ビーズのデキストランT500ロック層では見られない。
実施例2:ビーズの外部層内にロックを有するQセファロース6ファーストフローイオン交換体の製造
A.粒子形の架橋アリル化アガロースの製造(アリル化セファロース6ファーストフロー)。セファロース6ファーストフローはAmersham Pharmacia Biotech AB, Uppsala, Sweden由来であった。平均粒子サイズ90μmの架橋アガロースを含むマトリックスを、エピクロロヒドリンとアガロースのNaOH存在下でのPorath et al.(J. Chromatog. 60(1971)167-77およびUS-A-3,959,251)に従った反応により製造した。アリル化は、完成した粒子とアリルグリシジルエーテルと塩基としてのNaOHを、0.27mmole/mLゲルのアリルレベル(CH2=CHCH2OCH2CHOHCH2−)まで反応させて達成させる。
B.秤量平均分子量500000のデキストランの溶解。デキストランT500は、Amersham Pharmacia Biotech ABから商品として入手可能であり、Leuconostoc mesenteroides由来の加水分解および分画粗デキストランを含む。デキストランT500 57.7gを、三首フラスコ内の蒸留水157mLにゆっくり撹拌しながら溶解する。
C.架橋アリル化アガロースの部分的臭素化。工程Aに従って製造した排出したアリル化アガロース90mL、蒸留水90mLおよび無水NaOAc 1.92gを500mL三首フラスコに入れる。続いて、臭素化を、激しく撹拌しながら臭素0.69mLを添加することにより達成する。臭素の量の計算において、一部の揮発性臭素が蒸発することを考慮する。反応は、混合物が純水に白色になるまで数分続ける。臭素化後、ゲルをガラスフィルター上で蒸留水で洗浄する。
D.デキストランT500の結合。工程C由来のゲルを吸引乾燥し、工程B由来の溶解デキストランT500を含む反応容器に注意深く撹拌しながら添加する。混合物を1時間平衡化させる。続いて、反応を蒸留H2O 41.6mLに溶解したNaOH 10.39gおよびNaBH4 0.36gの添加により開始する。温度を35℃に調節し、反応を一晩(例えば16時間)、注意深く撹拌しながら続ける。撹拌を停止し、反応混合物をガラスフィルターで濾過する。ほとんどのデキストランT500が、蒸留水で洗い出された後、数mLの濃HOAcで、直接濾過漏斗をpH<7に、好ましくは5−6にして中和を行い、次いでゲルを再び蒸留水で洗浄する。結合後、残りのアリルレベルは0.18mmole/mLであった。
E.残りのアリル基の臭素化。工程Dに従って製造した、ビーズの外部のデキストランT500の層で修飾させた吸引されたアリル化アガロース20mL、蒸留水9.06mLおよび無水NAOAc 1.6gおよび臭素1.0mLを、激しく撹拌しながら250mL三首フラスコに添加する。撹拌を黄色着色/過剰の臭素が無くなるまで続ける。
F.残りのアリル基を介したイオン交換基の挿入。アニオン交換4級アミン基(CH3)3N+CH2CHOHCH2−の挿入を、Eと同じ三首フラスコで直接続ける。65%トリメチルアンモニウムクロライド(TMAC)19.9gをフラスコに入れる。10分撹拌し、次いで蒸留水6.0gに溶解したNaOH 6.0gを入れる。この50%NaOH溶液の添加において、混合物は薄黄色になる。その直後、NaBH4 0.12gを入れる。温度を24℃に調節し、撹拌を130RPMで開始し、反応を一晩(例えば16時間)続ける。反応を、数mLの濃HOAcでの直接フラスコ内のpH<7、好ましくはpH5−6への中和により停止し、次いでゲルを蒸留水および数ゲル容量の1.0M NaClで繰り返し洗浄する。最後に、ゲルを再び蒸留水で繰り返し洗浄する。イオン交換の能力を、0.142mmole/mLへの塩化銀滴定により測定する。
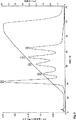
G.デキストランT500Qセファロース6FFのクロマトグラフィー評価。外部デキストラン層の硬化は、約1mLのイオン交換体を充填されたHR5/5カラム(Amersham Pharmacia Biotech AB)で、勾配流を使用して行った。大きなタンパク質チオグロブリン660kDおよび小さなα−ラクトアルブミン14.4kDを、サンプルとして両方とも陰性に荷電しているpH8.2で使用した。図1は、慣用の強度のアニオン交換体であるQセファロースHPで流した勾配での両方のタンパク質の分離を、陽性に荷電したQリガンドの利用性のサイズに基づいた制限無しで示す。ここで、α−ラクトアルブミン(ピーク1)は、チログロブリン(ピーク2)より前に溶出する。図2は、本実施例に従ったデキストランT500Qセファロース6FFイオン交換体上での、チログロブリンの勾配流の結果を示す。この大きなタンパク質は、吸着させることなくカラムを通して右に移動する。同様の方法で流した小さいα−ラクトアルブミンは、吸着され、勾配で溶出する(ピーク2)。図3参照。
実施例3:層活性化を使用したcat-アニオン交換体の合成
A.合成。実施例1および2の方法と同様にして、セファロースHPとアリルグリシジルエーテルを水中で、塩基としての水酸化ナトリウムと共に反応させることにより製造したアリルレベル約0.2mmole/mLのアリル化セファロースHPを、ガラス反応容器中の蒸留水20mLに懸濁し、それを0.3mmole元素状態臭素と激しく撹拌して臭素化した。次いで、部分的に臭素化したゲルを、亜硫酸ナトリウムで飽和した0.1M水酸化ナトリウム溶液25mLと反応させた。反応は40℃で一晩であった。反応を酢酸で中和して停止させ、続いて約100mL蒸留水でガラスフィルター漏斗で洗浄した。部分的に官能化されたマトリックスの残りのアリル基を、ゲル懸濁液の残存する黄色着色が得られるまで元素状態臭素を滴下することにより、20mL蒸留水中、過剰の臭素で臭素化した。臭素化され部分的に官能化されたマトリックスを次いでガラスフィルター漏斗で蒸留水で洗浄し、次いでビス−(3−アミノプロピル)アミンの50%溶液25mLに入れた。反応を50%塩酸で中和することにより停止させ、続いて約100mL蒸留水でガラスフィルター漏斗で洗浄した。
B.層状cat-アニオン交換体のクロマトグラフィー評価。上記の詳述に従って製造したcat-アニオン交換体約1mLをHR5/5カラム(Amersham Pharmacia Biotech AB)に充填し、FPLCシステムに接続し、pH6.0緩衝液で平衡化した。タンパク質サンプルを吸着させ、次いでまたpH6.0の塩勾配を使用して溶出した。
サンプルA.pH6.0で陽性に荷電したタンパク質であるリソザイムを上記に従って流した。リソザイムがマトリックスの陰性スルフォネートリガンドに結合でき、次いで溶出できることを示す図4のクロマトグラム参照。
サンプルB.pH6.0で陰性に荷電したタンパク質であるトランスフェリン、卵白アルブミンおよびβ−ラクトグロブリンを上記に従って流した。ランスフェリン、卵白アルブミンおよびβ−ラクトグロブリンがマトリックスの陽性荷電アミンリガンドに結合でき、次いで溶出できることを示す図5のクロマトグラム参照。
クロマトグラフィー試験AおよびBの結果は、粒子内に陽性荷電基のみを含む領域/層および陰性荷電基のみの領域/層が存在することを示す。
図
図1.QセファロースHPを含み、ベッド高5.9cmのHR5/5カラム(Amersham Pharmacia Biotech)の0.5mg/mL α−ラクトアルブミン(ピーク1)および0.5mg/mLチログロブリン(ピーク2)を含む50μlサンプル流のクロマトグラム。
緩衝液A:20mMトリス−HCl pH8.2。
緩衝液B:20mMトリス−HCl+0.5M NaCl
流速:1mL/分
図2.実施例2のデキストランT500Qセファロース6FFを含み、ベッド高6.5cmのHR5/5カラム(Amersham Pharmacia Biotech)の0.25mg/mLα−ラクトアルブミンを含む200μlサンプル流のクロマトグラム。
緩衝液A:20mMトリス−HCl、50mM NaCl pH8.2。
緩衝液B:20mMトリス−HCl+1 NaCl
流速:0.2mL/分
図3.実施例2のデキストランT500Qセファロース6FFを含み、ベッド高6.5cmのHR5/5カラム(Amersham Pharmacia Biotech)の1mg/mLチログロブリンを含む200μlサンプル流のクロマトグラム。
緩衝液A:20mMトリス−HCl、50mM NaCl pH8.2。
緩衝液B:20mMトリス−HCl+1 NaCl
流速:0.2mL/分
図4.実施例3のcat-アニオン交換体を含み、ベッド高4.2cmのHR5/5カラム(Amersham Pharmacia Biotech)の1mg/mLリソザイムを含む50μlサンプル流のクロマトグラム。
緩衝液A:20mMピペラジン−HCl pH6.0。
緩衝液B:20mMピペラジン−HCl+1 NaCl
流速:0.5mL/分
図5.実施例3のcat-アニオン交換体で、ベッド高4.2cmの0.1mg/mLトランスフェリン(ピーク1)、0.2mg/mL卵白アルブミン(ピーク2および3)および0.2mg/mL β−ラクトグロブリン(ピーク4)を含む50μlサンプル流のクロマトグラム。
緩衝液A:20mMピペラジン−HCl pH6.0。
緩衝液B:20mMピペラジン−HCl+1 NaCl
流速:0.5mL/分
Claims (10)
- 基Aを提示する多孔性マトリックスに基Aと試薬Iとの反応で官能基を導入することによる多孔性マトリックスの製造方法であって、基Aと比較して不足した量の試薬Iにマトリックスを接触させて、官能基の異なる1以上の層を内部に有するマトリックスを生じさせ、基Aが炭素−炭素二重結合であり、試薬IがX 2 又はXOH(式中、Xは塩素、臭素及びヨウ素から選択されるハロゲンである。)であることを特徴とする方法。
- マトリックスが親水性であり、親水性基をその内部表面及び外部表面に提示することを特徴とする、請求項1記載の方法。
- マトリックスがヒドロキシル基をその内部表面及び外部表面に提示することを特徴とする、請求項2記載の方法。
- マトリックスがポリヒドロキシポリマーから構築されたものであることを特徴とする、請求項1乃至請求項3のいずれか1項記載の方法。
- マトリックスがポリサッカライドから構築されたものであることを特徴とする、請求項4記載の方法。
- 基Aと試薬Iの反応を水性媒体中で行うことを特徴とする、請求項1乃至請求項5のいずれか1項記載の方法。
- 導入される官能基が、続く段階でマトリックスに、イオン交換基、バイオアフィニティー基、疎水性基、共有結合クロマトグラフィーに使用できる基、硫黄含有基、キレートもしくはキレート形成基、π−π相互作用を発生させる芳香族系を有する基、水素結合を供与する基、架橋基、親水性基又は重合基のいずれかの基を生じる化合物Bと反応する反応性基であることを特徴とする、請求項1乃至請求項6のいずれか1項記載の方法。
- 化合物Bが親和性及び/又はゲル濾過を基本にした1以上の分離特性を導入することを特徴とする、請求項7記載の方法。
- 請求項7又は請求項8記載の方法で製造したマトリックスを、分離に際して成分混合物から1種類の成分を捕獲するのに使用する方法。
- 前記分離がクロマトグラフィーを用いることを特徴とする、請求項9記載の使用方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE9700768A SE9700768D0 (sv) | 1997-03-04 | 1997-03-04 | Förfarande för att introducera funktionalitet |
| SE9700768-6 | 1997-03-04 | ||
| PCT/SE1998/000386 WO1998039364A1 (en) | 1997-03-04 | 1998-03-04 | Process for introducing a functionality |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001516376A JP2001516376A (ja) | 2001-09-25 |
| JP2001516376A5 JP2001516376A5 (ja) | 2005-11-10 |
| JP4368424B2 true JP4368424B2 (ja) | 2009-11-18 |
Family
ID=20406013
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP53844698A Expired - Lifetime JP4368424B2 (ja) | 1997-03-04 | 1998-03-04 | 官能性の挿入法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US6426315B1 (ja) |
| EP (1) | EP0966488B1 (ja) |
| JP (1) | JP4368424B2 (ja) |
| AT (1) | ATE342284T1 (ja) |
| AU (1) | AU6644198A (ja) |
| DE (1) | DE69836126T2 (ja) |
| ES (1) | ES2273407T3 (ja) |
| SE (1) | SE9700768D0 (ja) |
| WO (1) | WO1998039364A1 (ja) |
Families Citing this family (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE9700769D0 (sv) | 1997-03-04 | 1997-03-04 | Pharmacia Biotech Ab | Matriser för separation och separation som utnyttjar matriserna |
| WO2000023478A1 (en) * | 1998-10-16 | 2000-04-27 | Amersham Pharmacia Biotech Ab | Squaric acid activated carrier usable for immobilisation of compounds containing amine groups |
| SE9904272D0 (sv) * | 1999-11-25 | 1999-11-25 | Amersham Pharm Biotech Ab | A method for selective removal of a substance from samples containing compounds having nucleic acid structure |
| AU2002211669A1 (en) * | 2000-10-12 | 2002-04-22 | Robert Corcoran | Purification of substance by reaction affinity chromatography |
| SE0202551D0 (sv) * | 2002-08-27 | 2002-08-27 | Amersham Biosciences Ab | Chromatographic two-layer particles |
| SE0302509D0 (sv) * | 2003-09-19 | 2003-09-19 | Amersham Biosciences Ab | Matrix for separation of polyethers and method of separation |
| SE0302911D0 (sv) * | 2003-10-31 | 2003-10-31 | Amersham Biosciences Ab | Novel separation matrix |
| US20070015002A1 (en) * | 2005-07-14 | 2007-01-18 | Ut-Battele, Llc | Oxygen-donor and catalytic coatings of metal oxides and metals |
| WO2007139470A1 (en) * | 2006-05-30 | 2007-12-06 | Ge Healthcare Bio-Sciences Ab | A method of preparing an immobilised metal ion chromatography adsorbent and methods of purifying proteins, peptides or polynucleotides. |
| BRPI0719208A2 (pt) | 2006-10-12 | 2017-09-26 | C 3 Int Llc | métodos para obtenção de tratamento de superfície profilático para sistemas de processamento de fluido e componentes do mesmo. |
| WO2009014481A1 (en) * | 2007-07-25 | 2009-01-29 | Ge Healthcare Bio-Sciences Ab | Separation matrix |
| US20090098289A1 (en) * | 2007-10-12 | 2009-04-16 | Deininger Mark A | Pig and Method for Applying Prophylactic Surface Treatments |
| US8623301B1 (en) | 2008-04-09 | 2014-01-07 | C3 International, Llc | Solid oxide fuel cells, electrolyzers, and sensors, and methods of making and using the same |
| US20110045574A1 (en) | 2008-04-22 | 2011-02-24 | Jan Bergstrom | Chromatography medium |
| WO2010005364A1 (en) * | 2008-07-08 | 2010-01-14 | Ge Healthcare Bio-Sciences Ab | Separation medium for chromatography of various biomolecules |
| EP2315839A4 (en) * | 2008-08-25 | 2012-03-21 | Ge Healthcare Bio Sciences | EASY LOADING AND ELONGATION METHOD FOR CLEANING GENOMIC DNA |
| WO2011100361A2 (en) | 2010-02-10 | 2011-08-18 | C3 International. Llc | Low temperature electrolytes for solid oxide cells having high ionic conductivity |
| EP2748181B1 (en) * | 2011-09-30 | 2016-03-30 | GE Healthcare BioProcess R&D AB | Method for purification of cleaved pro-insulin |
| KR102226564B1 (ko) * | 2012-09-17 | 2021-03-10 | 더블유.알. 그레이스 앤드 캄파니-콘. | 작용화된 미립자 지지체 물질 및 이의 제조 및 사용 방법 |
| CA2885263C (en) | 2012-09-17 | 2021-11-16 | W. R. Grace & Co.-Conn. | Chromatography media and devices |
| US9441051B2 (en) | 2012-11-26 | 2016-09-13 | Albert Ludwigs Universitäfreiburg | Matrices comprising modified polysaccharides and modified polysaccharides |
| EP2735318A1 (en) * | 2012-11-26 | 2014-05-28 | Albert-Ludwigs-Universität Freiburg | Matrices comprising modified polysaccharides and modified polysaccharides |
| US9905871B2 (en) | 2013-07-15 | 2018-02-27 | Fcet, Inc. | Low temperature solid oxide cells |
| SG11201605712SA (en) | 2014-01-16 | 2016-08-30 | Grace W R & Co | Affinity chromatography media and chromatography devices |
| CN107847907A (zh) | 2014-05-02 | 2018-03-27 | 格雷斯公司 | 官能化载体材料以及制备和使用官能化载体材料的方法 |
| PL3302784T3 (pl) | 2015-06-05 | 2022-01-17 | W.R. Grace & Co.-Conn. | Adsorbentowe środki klarujące do bioprzetwarzania oraz sposoby ich wytwarzania i stosowania |
| DE102016014946A1 (de) | 2016-12-14 | 2018-06-14 | Dürr Systems Ag | Druckkopf zur Applikation eines Beschichtungsmittels auf ein Bauteil |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3959251A (en) * | 1970-06-25 | 1976-05-25 | Exploaterings Aktiebolaget T.B.F. | Stabilized agar product and method for its stabilization |
| US3947352A (en) * | 1974-05-31 | 1976-03-30 | Pedro Cuatrecasas | Polysaccharide matrices for use as adsorbents in affinity chromatography techniques |
| US4663163A (en) * | 1983-02-14 | 1987-05-05 | Hou Kenneth C | Modified polysaccharide supports |
| JPS60226829A (ja) * | 1984-03-29 | 1985-11-12 | Daicel Chem Ind Ltd | 多糖誘導体より成る分離剤 |
| JPS60226832A (ja) * | 1984-04-02 | 1985-11-12 | Daicel Chem Ind Ltd | 多糖の脂肪族エステルを含む分離剤 |
| SE458525B (sv) * | 1985-05-23 | 1989-04-10 | Pharmacia Ab | Foerfarande foer tvaerbindning av en poroes agar- eller agarosgel |
| US4874520A (en) * | 1986-04-23 | 1989-10-17 | Battelle Development Corporation | Chromatographic process |
| US6039876A (en) * | 1992-07-24 | 2000-03-21 | Yang; Yan-Bo | Hydrophilic polystrene divinylbenzene based matrixes for chromatography |
| US5561097A (en) * | 1994-04-28 | 1996-10-01 | Minnesota Mining And Manufacturing Company | Method of controlling density of ligand coupled onto supports and products produced therefrom |
| US5801116A (en) * | 1995-04-07 | 1998-09-01 | Rhodia Inc. | Process for producing polysaccharides and their use as absorbent materials |
| US5865994A (en) * | 1997-03-13 | 1999-02-02 | Dionex Corporation | Bifunctional crown ether-based cation-exchange stationary phase for liquid chromatography |
| US6114466A (en) * | 1998-02-06 | 2000-09-05 | Renal Tech International Llc | Material for purification of physiological liquids of organism |
| US6136424A (en) * | 1998-02-06 | 2000-10-24 | Renal Tech International, Llc | Method of and material for purification of physiological liquids of organism, and method of producing the material |
-
1997
- 1997-03-04 SE SE9700768A patent/SE9700768D0/xx unknown
-
1998
- 1998-03-04 AT AT98908406T patent/ATE342284T1/de not_active IP Right Cessation
- 1998-03-04 JP JP53844698A patent/JP4368424B2/ja not_active Expired - Lifetime
- 1998-03-04 ES ES98908406T patent/ES2273407T3/es not_active Expired - Lifetime
- 1998-03-04 DE DE69836126T patent/DE69836126T2/de not_active Expired - Lifetime
- 1998-03-04 WO PCT/SE1998/000386 patent/WO1998039364A1/en active IP Right Grant
- 1998-03-04 AU AU66441/98A patent/AU6644198A/en not_active Abandoned
- 1998-03-04 US US09/380,105 patent/US6426315B1/en not_active Expired - Lifetime
- 1998-03-04 EP EP98908406A patent/EP0966488B1/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| AU6644198A (en) | 1998-09-22 |
| WO1998039364A1 (en) | 1998-09-11 |
| DE69836126D1 (de) | 2006-11-23 |
| EP0966488A1 (en) | 1999-12-29 |
| SE9700768D0 (sv) | 1997-03-04 |
| ES2273407T3 (es) | 2007-05-01 |
| US6426315B1 (en) | 2002-07-30 |
| EP0966488B1 (en) | 2006-10-11 |
| JP2001516376A (ja) | 2001-09-25 |
| ATE342284T1 (de) | 2006-11-15 |
| DE69836126T2 (de) | 2007-08-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4368424B2 (ja) | 官能性の挿入法 | |
| JP4135812B2 (ja) | 分離用マトリックスおよび該マトリックスを利用した分離法 | |
| JP4440771B2 (ja) | 表面改質ベースマトリックス | |
| KR101279305B1 (ko) | 크로마토그래피 매질 | |
| US5316680A (en) | Multimodal chromatographic separation media and process for using same | |
| AU735537B2 (en) | An adsorption/separation method and a medium for adsorption/separation | |
| EP3570974B1 (en) | Multimodal chromatographic media for protein separation | |
| JPH044018B2 (ja) | ||
| JPS60500539A (ja) | 変性多糖支持体 | |
| JP5643642B2 (ja) | 分離マトリクス | |
| JP2002529714A (ja) | クロマトグラフィー分離法および選択吸着体 | |
| KR20080039951A (ko) | 크로마토그래피 매트릭스의 제조 | |
| CN100406114C (zh) | 色谱双层颗粒 | |
| JP2004532182A5 (ja) | ||
| EP1345694A2 (en) | A method for the manufacture of compositions containing low concentrations of salts | |
| US6664305B2 (en) | Chromatography material and a process of manufacturing that material | |
| JP2007506095A (ja) | ポリエーテル分離用マトリックス及び分離方法 | |
| EP1954392A2 (en) | Activated solid support and method | |
| JP4643006B2 (ja) | カチオン交換体による分離方法 | |
| JP2007510153A (ja) | 新規分離マトリックス | |
| Kubota et al. | Study of the adsorption of some amino acids by silica chemically modified with aminobenzenesulfonic and phosphate groups | |
| Jiang | Surface Modifications of Capillary-Channeled Polymer (C-CP) Fiber Stationary Phases for Protein Separations | |
| Walshe | Some novel approaches to chromatographic and electrophoretic separations in biopharmaceutical analysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20041124 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20041216 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050302 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050302 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080930 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081226 |
|
| A72 | Notification of change in name of applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A721 Effective date: 20081226 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090224 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090525 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090619 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20090723 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090728 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090826 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120904 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130904 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |