JP4058631B2 - ケイ素系アルカリ可溶性樹脂 - Google Patents
ケイ素系アルカリ可溶性樹脂 Download PDFInfo
- Publication number
- JP4058631B2 JP4058631B2 JP2003189051A JP2003189051A JP4058631B2 JP 4058631 B2 JP4058631 B2 JP 4058631B2 JP 2003189051 A JP2003189051 A JP 2003189051A JP 2003189051 A JP2003189051 A JP 2003189051A JP 4058631 B2 JP4058631 B2 JP 4058631B2
- Authority
- JP
- Japan
- Prior art keywords
- organosilicon compound
- silicon
- soluble resin
- general formula
- represented
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000011347 resin Substances 0.000 title claims description 59
- 229920005989 resin Polymers 0.000 title claims description 59
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 title claims description 27
- 229910052710 silicon Inorganic materials 0.000 title claims description 27
- 239000010703 silicon Substances 0.000 title claims description 27
- 150000003961 organosilicon compounds Chemical class 0.000 claims description 67
- 125000000217 alkyl group Chemical group 0.000 claims description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 14
- 239000000203 mixture Substances 0.000 claims description 13
- 125000004432 carbon atom Chemical group C* 0.000 claims description 8
- 150000001875 compounds Chemical class 0.000 claims description 6
- 230000003301 hydrolyzing effect Effects 0.000 claims description 6
- 125000005372 silanol group Chemical group 0.000 claims description 5
- 239000003513 alkali Substances 0.000 claims description 4
- 230000007062 hydrolysis Effects 0.000 claims description 4
- 238000006460 hydrolysis reaction Methods 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- 239000011342 resin composition Substances 0.000 claims description 3
- 125000003545 alkoxy group Chemical group 0.000 claims description 2
- 239000002253 acid Substances 0.000 claims 1
- 238000002156 mixing Methods 0.000 claims 1
- FFUAGWLWBBFQJT-UHFFFAOYSA-N hexamethyldisilazane Chemical compound C[Si](C)(C)N[Si](C)(C)C FFUAGWLWBBFQJT-UHFFFAOYSA-N 0.000 description 16
- 239000002904 solvent Substances 0.000 description 14
- -1 trichlorosilyl group Chemical group 0.000 description 13
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 11
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 10
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 10
- 239000002585 base Substances 0.000 description 10
- BOTDANWDWHJENH-UHFFFAOYSA-N Tetraethyl orthosilicate Chemical compound CCO[Si](OCC)(OCC)OCC BOTDANWDWHJENH-UHFFFAOYSA-N 0.000 description 9
- 238000003756 stirring Methods 0.000 description 9
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- WGTYBPLFGIVFAS-UHFFFAOYSA-M tetramethylammonium hydroxide Chemical compound [OH-].C[N+](C)(C)C WGTYBPLFGIVFAS-UHFFFAOYSA-M 0.000 description 6
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 5
- 238000009833 condensation Methods 0.000 description 5
- 238000000034 method Methods 0.000 description 5
- 230000007935 neutral effect Effects 0.000 description 5
- 239000002994 raw material Substances 0.000 description 5
- SCPYDCQAZCOKTP-UHFFFAOYSA-N silanol Chemical compound [SiH3]O SCPYDCQAZCOKTP-UHFFFAOYSA-N 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000005494 condensation Effects 0.000 description 4
- 239000010410 layer Substances 0.000 description 4
- 239000012044 organic layer Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 206010034972 Photosensitivity reaction Diseases 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 230000036211 photosensitivity Effects 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 239000005046 Chlorosilane Substances 0.000 description 2
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 239000006087 Silane Coupling Agent Substances 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 239000003377 acid catalyst Substances 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- KOPOQZFJUQMUML-UHFFFAOYSA-N chlorosilane Chemical class Cl[SiH3] KOPOQZFJUQMUML-UHFFFAOYSA-N 0.000 description 2
- 238000005695 dehalogenation reaction Methods 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000004528 spin coating Methods 0.000 description 2
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 0 *C(OC(CCC[S+](Cl)(Cl)Cl)(C(F)(F)F)C(F)(F)F)=O Chemical compound *C(OC(CCC[S+](Cl)(Cl)Cl)(C(F)(F)F)C(F)(F)F)=O 0.000 description 1
- NZUPFZNVGSWLQC-UHFFFAOYSA-N 1,3,5-tris(2,3-dibromopropyl)-1,3,5-triazinane-2,4,6-trione Chemical compound BrCC(Br)CN1C(=O)N(CC(Br)CBr)C(=O)N(CC(Br)CBr)C1=O NZUPFZNVGSWLQC-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- WGGNJZRNHUJNEM-UHFFFAOYSA-N 2,2,4,4,6,6-hexamethyl-1,3,5,2,4,6-triazatrisilinane Chemical compound C[Si]1(C)N[Si](C)(C)N[Si](C)(C)N1 WGGNJZRNHUJNEM-UHFFFAOYSA-N 0.000 description 1
- GVHIREZHTRULPT-UHFFFAOYSA-N 2-methyl-n-trimethylsilylpropan-2-amine Chemical compound CC(C)(C)N[Si](C)(C)C GVHIREZHTRULPT-UHFFFAOYSA-N 0.000 description 1
- CKNCVRMXCLUOJI-UHFFFAOYSA-N 3,3'-dibromobisphenol A Chemical compound C=1C=C(O)C(Br)=CC=1C(C)(C)C1=CC=C(O)C(Br)=C1 CKNCVRMXCLUOJI-UHFFFAOYSA-N 0.000 description 1
- MCYZJQMSKIDSGN-UHFFFAOYSA-N N[SiH3].CN(C)[Si](C)(C)N(C)C Chemical class N[SiH3].CN(C)[Si](C)(C)N(C)C MCYZJQMSKIDSGN-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- GJWAPAVRQYYSTK-UHFFFAOYSA-N [(dimethyl-$l^{3}-silanyl)amino]-dimethylsilicon Chemical compound C[Si](C)N[Si](C)C GJWAPAVRQYYSTK-UHFFFAOYSA-N 0.000 description 1
- WYUIWUCVZCRTRH-UHFFFAOYSA-N [[[ethenyl(dimethyl)silyl]amino]-dimethylsilyl]ethene Chemical compound C=C[Si](C)(C)N[Si](C)(C)C=C WYUIWUCVZCRTRH-UHFFFAOYSA-N 0.000 description 1
- PEGHITPVRNZWSI-UHFFFAOYSA-N [[bis(trimethylsilyl)amino]-dimethylsilyl]methane Chemical compound C[Si](C)(C)N([Si](C)(C)C)[Si](C)(C)C PEGHITPVRNZWSI-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- OVHDZBAFUMEXCX-UHFFFAOYSA-N benzyl 4-methylbenzenesulfonate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)OCC1=CC=CC=C1 OVHDZBAFUMEXCX-UHFFFAOYSA-N 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 238000001879 gelation Methods 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- ZSMNRKGGHXLZEC-UHFFFAOYSA-N n,n-bis(trimethylsilyl)methanamine Chemical compound C[Si](C)(C)N(C)[Si](C)(C)C ZSMNRKGGHXLZEC-UHFFFAOYSA-N 0.000 description 1
- BDSUYTOTVCEJPO-UHFFFAOYSA-N n-(dimethylamino-methyl-phenylsilyl)-n-methylmethanamine Chemical compound CN(C)[Si](C)(N(C)C)C1=CC=CC=C1 BDSUYTOTVCEJPO-UHFFFAOYSA-N 0.000 description 1
- XIFOKLGEKUNZTI-UHFFFAOYSA-N n-[diethylamino(dimethyl)silyl]-n-ethylethanamine Chemical compound CCN(CC)[Si](C)(C)N(CC)CC XIFOKLGEKUNZTI-UHFFFAOYSA-N 0.000 description 1
- FTURFVPIEOKJBC-UHFFFAOYSA-N n-[dimethylamino(diphenyl)silyl]-n-methylmethanamine Chemical compound C=1C=CC=CC=1[Si](N(C)C)(N(C)C)C1=CC=CC=C1 FTURFVPIEOKJBC-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 239000012454 non-polar solvent Substances 0.000 description 1
- NIXKBAZVOQAHGC-UHFFFAOYSA-N phenylmethanesulfonic acid Chemical compound OS(=O)(=O)CC1=CC=CC=C1 NIXKBAZVOQAHGC-UHFFFAOYSA-N 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000004886 process control Methods 0.000 description 1
- LLHKCFNBLRBOGN-UHFFFAOYSA-N propylene glycol methyl ether acetate Chemical compound COCC(C)OC(C)=O LLHKCFNBLRBOGN-UHFFFAOYSA-N 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000004819 silanols Chemical class 0.000 description 1
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000003459 sulfonic acid esters Chemical class 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- AAPLIUHOKVUFCC-UHFFFAOYSA-N trimethylsilanol Chemical compound C[Si](C)(C)O AAPLIUHOKVUFCC-UHFFFAOYSA-N 0.000 description 1
- WLOQLWBIJZDHET-UHFFFAOYSA-N triphenylsulfonium Chemical class C1=CC=CC=C1[S+](C=1C=CC=CC=1)C1=CC=CC=C1 WLOQLWBIJZDHET-UHFFFAOYSA-N 0.000 description 1
- FAYMLNNRGCYLSR-UHFFFAOYSA-M triphenylsulfonium triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F.C1=CC=CC=C1[S+](C=1C=CC=CC=1)C1=CC=CC=C1 FAYMLNNRGCYLSR-UHFFFAOYSA-M 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Landscapes
- Materials For Photolithography (AREA)
- Silicon Polymers (AREA)
Description
【発明の属する技術分野】
本発明は、t−ブチルエステルを有するアルコキシシラン、3官能以上の多官能アルコキシシランおよびヘキサフルオロカルビノール基を有するアルコキシシランの加水分解共縮合を用いて調製される、感光性を有するアルカリ可溶性樹脂に関する。
【0002】
【従来の技術】
下記一般式(4)で表される有機ケイ素化合物の加水分解縮合物は、Loyらにより報告されている(非特許文献1)。
【0003】
【化4】
【0004】
(式中、R1は、炭素数1または2のアルキル基を示す)
【0005】
しかし、上記一般式(4)で表される有機ケイ素化合物は、縮合速度が遅く、製膜性を有する程度に縮合させるには1週間以上の縮合時間を要する。従って、上記一般式(4)で表される有機ケイ素化合物単独では、成膜材料の原料として実用的でなく、工業的な面を考えると、より短時間で縮合させることができる材料が望まれている。
一方、ヘキサフルオロカルビノール基を有するケイ素系アルカリ可溶性樹脂として、種々の樹脂が知られている(例えば、特許文献1、特許文献2)。
【0006】
【非特許文献1】
マクロモレキュールズ(Macromolecules),2002, 35, P2452-2454。
【特許文献1】
特開2002−55456号公報
【特許文献2】
特開2002−268227号公報
【0007】
しかし、これらの樹脂の製法では、下記化合物(5)の加水分解縮合を利用している。これは、トリクロロシリル基を加水分解性基として用いているため、ヘキサフルオロカルビノール基を保護する必要が生じるためである。
【0008】
【化5】
【0009】
また、塩素が問題となり易い分野で生成物を用いる場合には、生成物における塩素の含有率を極めて小さくする必要があり、原料の取り扱いにも注意を要する。
【0010】
【発明が解決しようとする課題】
本発明は、上記一般式(4)で表される有機ケイ素化合物の縮合速度が遅い点を克服すると共に、アルカリ可溶性基を含むクロロシラン類を用いて合成される従来の樹脂の問題点、即ち以下の2点を解消したケイ素系アルカリ可溶性樹脂を提供するものである。
・目的の樹脂を得るには、脱ハロゲン化工程が必要である。
・ヘキサフルオロカルビノール基の保護および脱保護反応が必要であり、工程が複雑である。
【0011】
【課題を解決するための手段】
本発明は、下記一般式(1)で表される有機ケイ素化合物(1)、下記一般式(2)で表される有機ケイ素化合物(2)及び下記一般式(3)で表される有機ケイ素化合物(3)とを加水分解共縮合してなるケイ素系アルカリ可溶性樹脂である。
【0012】
【化6】
【0013】
(式中、R1は、炭素数1から3のアルキル基を示し、3個のアルキル基は互いに同一であっても異なっていても良い。)
【0014】
【化7】
【0015】
(式中、R2は、炭素数1から3のアルキル基を示し、4個のアルキル基は互いに同一であっても異なっていても良い。nは0又は1である。)
【0016】
【化8】
【0017】
(式中、R3は、炭素数1から3のアルキル基を示し、3個のアルキル基は互いに同一であっても異なっていても良い。)
以下、本発明について詳述する。
【0018】
【発明実施の形態】
「アルコキシシラン」
上記一般式(1)、一般式(2)および一般式(3)におけるR1、R2およびR3は、炭素数1から3のアルキル基である。その中でも、原料が得易く、合成が容易なことから、一般的にエチル基が好ましい。
最も好ましい有機ケイ素化合物(1)は、以下の構造式で示される化合物(I)(以下、TEStBuと略す)である。
【0019】
【化9】
【0020】
最も好ましい有機ケイ素化合物(2)は、テトラエトキシシランである。
最も好ましい有機ケイ素化合物(3)は、以下の構造式で示される化合物(II)(以下、TESHFC-OHと略す)である。
【0021】
【化10】
【0022】
「ケイ素系アルカリ可溶性樹脂」
本発明のケイ素系アルカリ可溶性樹脂は、例えば次のようにして製造することができる。
樹脂骨格を形成させる有機ケイ素化合物(1)、有機ケイ素化合物(2)、有機ケイ素化合物(3)、触媒、水及び溶媒を反応器に加え、これらを攪拌することにより、ベース樹脂が得られる。
【0023】
好ましい触媒としては、塩酸、硫酸、硝酸及び酢酸等の酸触媒、並びに水酸化ナトリウム、水酸化カリウム及びテトラメチルアンモニウムヒドロキシド等がある。
好ましい溶媒としては、水、アセトン、メチルイソブチルケトン、ジエチルエーテル、ジイソプロピルエーテル、ジブチルエーテル、テトラヒドロフラン、メタノール、エタノール、イソプロピルアルコール及びブタノール等の極性溶媒、並びにヘキサン、ベンゼン、トルエン、キシレン、クロロホルム及び塩化メチレン等の非極性溶媒がある。
【0024】
有機ケイ素化合物(2)及び有機ケイ素化合物(3)の好ましい仕込み割合は、各々、有機ケイ素化合物(1)1モル当たり0.01〜10モルであり、より好ましくは、0.01〜4モルであり、最も好ましくは、0.1〜3モルである。もし、有機ケイ素化合物(2)の仕込み割合を有機ケイ素化合物(1)の1モル当たり10モルより大きくすると、これらの加水分解共縮合物はゲル化物となってしまう恐れがある。
【0025】
有機ケイ素化合物(1)、有機ケイ素化合物(2)及び有機ケイ素化合物(3)の加水分解共縮合を行う際、これらの化合物におけるアルコキシ基の全てを加水分解共縮合するのに必要な理論量以上の水を存在させることが好ましい。
【0026】
樹脂末端にフリーのシラノール基が残る場合、予期せぬ反応が起こることを防止するため、フリーのシラノールの水素を保護基で置換しておくことが望ましい。
【0027】
好ましい保護基として、トリメチルシリル基、ジメチルシリル基、t−ブチルジメチルシリル基、トリエチルシリル基、トリシクロへキシルシリル基、ジシクロヘキシルメチルシリル基、シクロヘキシルジメチルシリル基、トリフェニルシリル基、ジフェニルメチルシリル基、ジメチルフェニルシリル基、トリビニルシリル基、ジビニルメチルシリル基及びジメチルビニルシリル基等がある。
フリーのシラノール基をトリメチルシリル基で保護する場合、1,1,1,3,3,3-ヘキサメチルジシラザン(HMDS)等のシランカップリング剤で処理することにより、容易にトリメチルシリル化することができる。
好ましいシランカップリング剤としては、1,1,1,3,3,3-ヘキサメチルジシラザン、1,1,3,3-テトラメチルジシラザン、ヘプタメチルジシラザン、1,3-ジビニル-1,1,3,3-テトラメチルジシラザン、1,1,3,3,5,5-ヘキサメチルシクロトリシラザン、トリス(トリメチルシリル)アミン、ビス(ジエチルアミノ)ジメチルシラン、ビス(ジメチルアミノ)ジメチルシラン、ビス(ジメチルアミノ)ジフェニルシラン、ビス(ジメチルアミノ)メチルフェニルシラン、トリメチルシラノール及びt−ブチルアミノトリメチルシラン等のアミノシラン類並びにシラノール類がある。
【0028】
上記のように十分な水を存在させて加水分解共縮合を行い、樹脂末端に生成したフリーのシラノール基を保護することにより、原料として仕込んだ三種類の有機ケイ素化合物を完全に反応させることができ、安定な樹脂として組成を制御することができる。
【0029】
ケイ素系アルカリ可溶性樹脂の好ましい数平均分子量は、500〜100,000である。本発明において、有機ケイ素化合物(2)、有機ケイ素化合物(3)を併用することにより、成膜性を有するケイ素系アルカリ可溶性樹脂を短時間で合成することができる。
【0030】
本発明の樹脂は、酸性またはアルカリ性で放置されると、予期せぬ反応が起こることがあるので、所定の合成反応が終了した後、十分に水洗し、樹脂のpHをほぼ中性にすることが好ましい。
【0031】
〔光酸発生剤の配合と成膜化〕
本発明のケイ素系アルカリ可溶性樹脂に光酸発生剤を配合することにより、本発明の樹脂に感光性を付与することができる。
好ましい光酸発生剤としては、ジフェニルヨード二ウム塩、トリフェニルスルホ二ウム塩等のオニウム塩、ベンジルトシレート、ベンジルスルホネート等のスルホン酸エステル、ジブロモビスフェノールA、トリスジブロモプロピルイソシアヌレート等のハロゲン類が例示されるが、特にこれらに限定されるものではない。
【0032】
光酸発生剤の好ましい添加量は、ケイ素系アルカリ可溶性樹脂100重量部に対して0.1〜20重量部であるのが好ましく、添加量がこれより少ないと実用的な光感度が得られないことがあり、これより多い場合には膜質や解像性が低下することがある。
【0033】
成膜材料として用いるには、通常、本発明の樹脂に溶剤を配合する。好ましい溶剤としては、プロピレングリコールモノメチルエーテルアセテート、n−ブチルエーテル、メチルイソブチルケトン等がある。
【0034】
光酸発生剤及び溶剤を配合したケイ素系アルカリ可溶性樹脂を被加工基板上に塗布する場合、スピンコート法が使用可能である。塗布膜厚は、0.01〜1.0μmが好ましい。
【0035】
〔露光−現像工程〕
光酸発生剤を含有したケイ素系アルカリ可溶性樹脂は、露光により光酸発生剤から発生する酸触媒により、樹脂中の保護基であるt−ブチル基が脱保護し、アルカリ可溶性が発現する。露光後さらに加熱することにより、脱保護反応が促進される。
【0036】
【発明の効果】
本発明によって、簡便な製法にて、組成の明確なケイ素系アルカリ可溶性樹脂が提供される。
本発明の樹脂を得る製造工程では、クロロシラン類を用いないため、脱ハロゲン化工程を省略することができる。また、ヘキサフルオロカルビノール基の保護および脱保護反応を省略することができる結果、本発明の樹脂は簡便な工程管理により合成可能になった。
また、有機ケイ素化合物(1)、有機ケイ素化合物(2)、有機ケイ素化合物(3)からなる三種類の原料の仕込み比により樹脂の組成が決定されるため、樹脂組成の設計を容易に行うことができる。
また、末端シラノール基を保護しているため、経時に対しても安定であり、樹脂末端の架橋によるゲル化(不溶化)を抑制することができる。
本発明のケイ素系アルカリ可溶性樹脂は、化学増幅型レジストのレジスト樹脂としても有用である。露光部の官能基が脱保護することにより、フリーのカルボン酸が生成し、優れたアルカリ可溶性を発現する。
【0037】
【実施例】
以下、本発明を参考例および実施例によって具体的に説明する。
以下、本発明のケイ素系アルカリ可溶性樹脂をベース樹脂と略す。
【0038】
〔ベース樹脂の合成〕
実施例1
磁気攪拌子を備えた反応器にTEStBu(75g、245mmol)、テトラエトキシシラン(51g、245mmol)、TESHFC-OH (9.0g、24.5 mmol)、1.5%塩酸水溶液(27.6g)、アセトン(60g)を加え、室温にて12時間攪拌した。GPCを用いて、TEStBu、テトラエトキシシランおよびTESHFC-OHが完全に消費されていることを確認した。減圧下にて、溶媒および揮発成分を留去し、ジイソプロピルエーテル(90g)を加えた。1,1,1,3,3,3-ヘキサメチルジシラザン(HMDS)(39.6g、244.8mmol)をゆっくり加え、樹脂中の残存シラノールをトリメチルシリル化させた。室温にて2時間攪拌後、減圧下、揮発成分と過剰のHMDSを留去した。ジイソプロピルエーテル(90g)、水(150g)を加え、水層が中性になるまで水洗した。有機層を回収し、無水硫酸マグネシウムで乾燥後、減圧下、溶媒を留去し、ベース樹脂を合成した(43g、69%)。分子量:Mn = 7100、Mw/Mn = 2.2
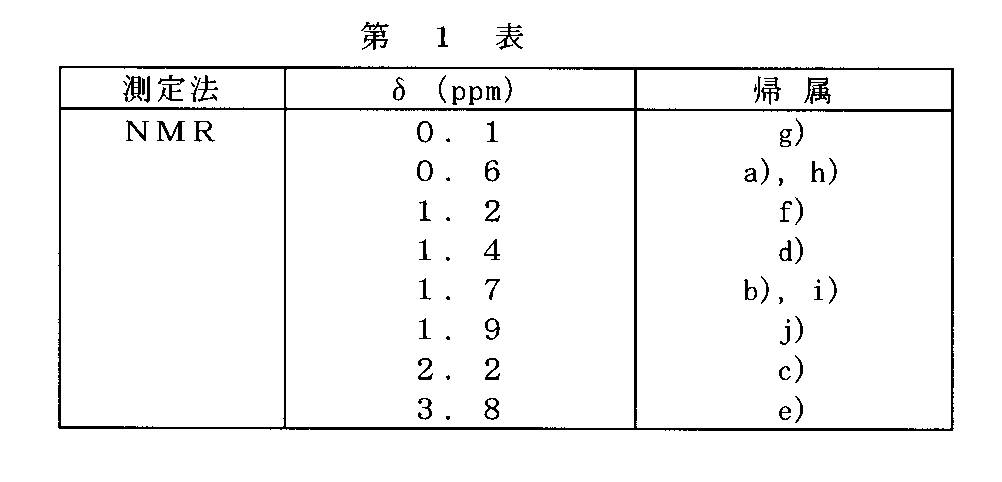
この樹脂について、270MHzの1H-NMRの測定を行ったところ、第1図のスペクトルを得た。δ値とその帰属は第1表のとおりであった。これにより得られた樹脂は、t−ブチルエステル、ヘキサフルオロカルビノールを含有するケイ素樹脂であることが確認できた。
【0039】
【表1】
【0040】
【化11】
【0041】
実施例2
磁気攪拌子を備えた反応器にTEStBu(75g、245mmol)、テトラエトキシシラン(51g、245mmol)、TESHFC-OH (18.0g、49.0 mmol)、1.5%塩酸水溶液(27.6g)、アセトン(60g)を加え、室温にて12時間攪拌した。GPCを用いて、TEStBu、テトラエトキシシランおよびTESHFC-OHが完全に消費されていることを確認した。減圧下にて、溶媒および揮発成分を留去し、ジイソプロピルエーテル(90g)を加えた。1,1,1,3,3,3-ヘキサメチルジシラザン(HMDS)(39.6g、244.8mmol)をゆっくり加え、樹脂中の残存シラノールをトリメチルシリル化させた。室温にて2時間攪拌後、減圧下、揮発成分と過剰のHMDSを留去した。ジイソプロピルエーテル(90g)、水(150g)を加え、水層が中性になるまで水洗した。有機層を回収し、無水硫酸マグネシウムで乾燥後、減圧下、溶媒を留去し、ベース樹脂を合成した(27g、43%)。分子量:Mn = 6100、Mw/Mn = 1.9
【0042】
実施例3
磁気攪拌子を備えた反応器にTEStBu(2.5g、8.16 mmol)、テトラエトキシシラン(3.4 g、16.3 mmol)、TESHFC-OH (0.30g、0.82 mmol)、1.5%塩酸水溶液(0.92g)、アセトン(2.0g)を加え、室温にて12時間攪拌した。GPCを用いて、TEStBu、テトラエトキシシランおよびTESHFC-OHが完全に消費されていることを確認した。ジイソプロピルエーテル(15g)を加え、硫酸マグネシウムを加え、1.5時間放置した。減圧下にて、溶媒および揮発成分を留去し、ジイソプロピルエーテル(15g)を加えた。1,1,1,3,3,3-ヘキサメチルジシラザン(HMDS)(1.32g、8.16mmol)をゆっくり加え、樹脂中の残存シラノールをトリメチルシリル化させた。室温にて2時間攪拌後、減圧下、揮発成分と過剰のHMDSを留去した。ジイソプロピルエーテル(15g)、水(20g)を加え、水層が中性になるまで水洗した。有機層を回収し、無水硫酸マグネシウムで乾燥後、減圧下、溶媒を留去し、ベース樹脂を合成した(0.88g、34%)。分子量:Mn = 7700、Mw/Mn = 5.8
【0043】
〔光酸発生剤の配合と製膜化〕
実施例4
実施例1にて合成したベース樹脂(1.0g)にMIBK(15.6g)を加え、6wt%のMIBK溶液を調製した。調製したベース樹脂の6wt%MIBK溶液にトリフェニルスルホ二ウムトリフレート(0.05g)を加え、溶解させた。この溶液を0.5mLシリンジに取り、3インチシリコンウエハーにスピンコートした(スピンコート条件:2500rpm、10秒)。スピンコートしたシリコンウエハーをホットプレートで、110℃、2分ベークし、溶媒を揮発させた。膜厚は、0.27μmであった。
【0044】
〔露光−現像工程〕
実施例5
実施例4にて調製したシリコンウエハーにマスクを設置し、UV(254nm)を用いて露光した(17mJ/cm2)。シリコンウエハーを110℃、2分ベークし、2.38%のテトラメチルアンモニウムヒドロキシド(TMAH)溶液に浸漬させた(室温、2分)。シリコンウエハーを水洗し、露光部分がアルカリ可溶性を示したことを目視にて確認した。
【0045】
比較例1(テトラエトキシシランが存在しない場合)
磁気攪拌子を備えた反応器にTEStBu(75g、245mmol)、TESHFC-OH (9.0g、24.5 mmol)、1.5%塩酸水溶液(27.6g)、アセトン(60g)を加え、室温にて12時間攪拌した。GPCを用いて、TEStBu、テトラエトキシシランおよびTESHFC-OHが完全に消費されていることを確認した。減圧下にて、溶媒および揮発成分を留去し、ジイソプロピルエーテル(90g)を加えた。1,1,1,3,3,3-ヘキサメチルジシラザン(HMDS)(39.6g、244.8mmol)をゆっくり加え、樹脂中の残存シラノールをトリメチルシリル化させた。室温にて2時間攪拌後、減圧下、揮発成分と過剰のHMDSを留去した。ジイソプロピルエーテル(90g)、水(150g)を加え、水層が中性になるまで水洗した。有機層を回収し、無水硫酸マグネシウムで乾燥後、減圧下、溶媒を留去し、ベース樹脂を合成した(40g、84%)。分子量:Mn = 1300、Mw/Mn = 1.2
実施例5と同様に、得られたベース樹脂の成膜を試みたが、ハジキが多く、成膜が困難であった。
【図面の簡単な説明】
【図1】第1図は実施例1で得られた各生成物の1H-NMRスペクトルを示す。
Claims (7)
- 有機ケイ素化合物(2)及び有機ケイ素化合物(3)の仕込み割合が、各々有機ケイ素化合物(1)1モル当たり、0.01〜10モルであることを特徴とする請求項1記載のケイ素系アルカリ可溶性樹脂。
- 数平均分子量が500〜100,000であることを特徴とする請求項1又は請求項2記載のケイ素系アルカリ可溶性樹脂。
- 有機ケイ素化合物(1)、有機ケイ素化合物(2)及び有機ケイ素化合物(3)におけるアルコキシ基の全てを加水分解共縮合するのに必要な理論量以上の水を存在させて加水分解共縮合させてなることを特徴とする請求項1〜3の何れかの請求項に記載のケイ素系アルカリ可溶性樹脂。
- 樹脂末端シラノール基をトリメチルシリル化してなる請求項1〜4の何れかの請求項に記載のケイ素系アルカリ可溶性樹脂。
- 請求項1〜5の何れかの請求項に記載のケイ素系アルカリ可溶性樹脂に光酸発生剤を配合してなる感光性アルカリ可溶性樹脂組成物。
- 上記一般式(1)で表される有機ケイ素化合物(1)、上記一般式(2)で表される有機ケイ素化合物(2)及び上記一般式(3)で表される有機ケイ素化合物(3)とを加水分解共縮合するに際して、有機ケイ素化合物(2)及び有機ケイ素化合物(3)の仕込み割合を、有機ケイ素化合物(1)の1モル当たり、0.01〜10モルとするケイ素系アルカリ可溶性樹脂の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003189051A JP4058631B2 (ja) | 2003-06-30 | 2003-06-30 | ケイ素系アルカリ可溶性樹脂 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003189051A JP4058631B2 (ja) | 2003-06-30 | 2003-06-30 | ケイ素系アルカリ可溶性樹脂 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005023175A JP2005023175A (ja) | 2005-01-27 |
| JP4058631B2 true JP4058631B2 (ja) | 2008-03-12 |
Family
ID=34187381
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003189051A Expired - Fee Related JP4058631B2 (ja) | 2003-06-30 | 2003-06-30 | ケイ素系アルカリ可溶性樹脂 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4058631B2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4568668B2 (ja) * | 2005-09-22 | 2010-10-27 | 富士フイルム株式会社 | 液浸露光用ポジ型レジスト組成物及びそれを用いたパターン形成方法 |
-
2003
- 2003-06-30 JP JP2003189051A patent/JP4058631B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2005023175A (ja) | 2005-01-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6927270B2 (en) | Process for the functionalization of polyhedral oligomeric silsesquioxanes | |
| EP1208105B1 (en) | Process for the formation of polyhedral oligomeric silsesquioxanes | |
| US6972312B1 (en) | Process for the formation of polyhedral oligomeric silsesquioxanes | |
| JPH0718077A (ja) | カルビノール・官能シロキサンの製造法 | |
| JP2010519397A5 (ja) | ||
| KR20110096063A (ko) | 실세스퀴옥산 수지 | |
| JP3598749B2 (ja) | 光カチオン硬化性組成物の製造方法及び光カチオン硬化性ハードコート剤組成物 | |
| JP4281305B2 (ja) | 3層レジスト中間層用樹脂組成物 | |
| JP4058631B2 (ja) | ケイ素系アルカリ可溶性樹脂 | |
| JP3906393B2 (ja) | ケイ素系アルカリ可溶性樹脂 | |
| JPH08311078A (ja) | オキサゾリジンシリルエーテル化合物の製造方法 | |
| JP4400241B2 (ja) | ケイ素系アルカリ可溶性樹脂 | |
| JP3153373B2 (ja) | シリコーンレジンの製造方法 | |
| JP3218872B2 (ja) | 有機ケイ素樹脂の製造方法 | |
| US7402648B2 (en) | Method for producing cyclic organic silicon compound and organic silicon resin having alcoholic hydroxyl group | |
| JPH05310942A (ja) | シルセスキオキサンラダーポリマー及びその製造方法 | |
| JP4039704B2 (ja) | アルカリ可溶性シロキサン重合体 | |
| JP4013520B2 (ja) | 新規なハロゲノシランおよびアルカリ可溶性樹脂 | |
| KR101064063B1 (ko) | 알코올성 수산기를 갖는 규소계 수지 및 그의 제조 방법 | |
| JP3908509B2 (ja) | ゲルマニウム原子ならびにシリコン原子含有ラダー型耐熱性樹脂およびその製造方法 | |
| JPH0717752B2 (ja) | アルコキシ官能性オルガノポリシロキサンの製造方法 | |
| JP2004083883A (ja) | オルガノポリシロキサンレジンの製造方法 | |
| JP5382000B2 (ja) | オキセタニル基を有するケイ素化合物の製造方法 | |
| JPS6313446B2 (ja) | ||
| JPH10251269A (ja) | ポリアルコキシシロキサン及びその製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050825 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20070719 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070724 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070914 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20071121 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20071204 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101228 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101228 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101228 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111228 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111228 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121228 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121228 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131228 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |