JP4000397B2 - モルヒネ−6−グルクロニドの新しい結晶形熊 - Google Patents
モルヒネ−6−グルクロニドの新しい結晶形熊 Download PDFInfo
- Publication number
- JP4000397B2 JP4000397B2 JP51483697A JP51483697A JP4000397B2 JP 4000397 B2 JP4000397 B2 JP 4000397B2 JP 51483697 A JP51483697 A JP 51483697A JP 51483697 A JP51483697 A JP 51483697A JP 4000397 B2 JP4000397 B2 JP 4000397B2
- Authority
- JP
- Japan
- Prior art keywords
- morphine
- glucuronide
- water
- preparation
- solvent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- GNJCUHZOSOYIEC-GAROZEBRSA-N Morphine-6-glucuronide Chemical compound O([C@H]1C=C[C@H]2[C@H]3CC=4C5=C(C(=CC=4)O)O[C@@H]1[C@]52CCN3C)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O GNJCUHZOSOYIEC-GAROZEBRSA-N 0.000 title claims abstract description 48
- 239000013078 crystal Substances 0.000 title description 6
- 238000002360 preparation method Methods 0.000 claims abstract description 10
- 238000000034 method Methods 0.000 claims abstract description 7
- 238000000634 powder X-ray diffraction Methods 0.000 claims abstract description 6
- 238000002329 infrared spectrum Methods 0.000 claims abstract description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 20
- 238000001816 cooling Methods 0.000 claims description 4
- 238000010438 heat treatment Methods 0.000 claims description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 20
- 239000012453 solvate Substances 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- 239000000243 solution Substances 0.000 description 8
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 238000002425 crystallisation Methods 0.000 description 6
- 230000008025 crystallization Effects 0.000 description 6
- 150000001875 compounds Chemical class 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 238000003756 stirring Methods 0.000 description 4
- 239000002775 capsule Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical class O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- -1 alkali metal salts Chemical class 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 229910001385 heavy metal Inorganic materials 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- YQLJMXCBZXPULR-OUPJPUQNSA-N (2S,3S,4S,5R,6R)-6-[[(4R,4aR,7S,7aR,12bS)-9-[(2S,3R,4S,5S,6S)-6-carboxy-3,4,5-trihydroxyoxan-2-yl]oxy-3-methyl-2,4,4a,7,7a,13-hexahydro-1H-4,12-methanobenzofuro[3,2-e]isoquinolin-7-yl]oxy]-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound O([C@H]1C=C[C@H]2[C@H]3CC=4C5=C(C(=CC=4)O[C@H]4[C@@H]([C@@H](O)[C@H](O)[C@H](O4)C(O)=O)O)O[C@@H]1[C@]52CCN3C)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O YQLJMXCBZXPULR-OUPJPUQNSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-M 4-hydroxybenzoate Chemical compound OC1=CC=C(C([O-])=O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 238000006994 Koenigs-Knorr glycosidation reaction Methods 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- OYHQOLUKZRVURQ-HZJYTTRNSA-N Linoleic acid Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(O)=O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical class CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000011549 crystallization solution Substances 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- CEIPQQODRKXDSB-UHFFFAOYSA-N ethyl 3-(6-hydroxynaphthalen-2-yl)-1H-indazole-5-carboximidate dihydrochloride Chemical compound Cl.Cl.C1=C(O)C=CC2=CC(C3=NNC4=CC=C(C=C43)C(=N)OCC)=CC=C21 CEIPQQODRKXDSB-UHFFFAOYSA-N 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 235000020778 linoleic acid Nutrition 0.000 description 1
- OYHQOLUKZRVURQ-IXWMQOLASA-N linoleic acid Natural products CCCCC\C=C/C\C=C\CCCCCCCC(O)=O OYHQOLUKZRVURQ-IXWMQOLASA-N 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 229950004819 morphine glucuronide Drugs 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000002834 transmittance Methods 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H17/00—Compounds containing heterocyclic radicals directly attached to hetero atoms of saccharide radicals
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Analysing Materials By The Use Of Radiation (AREA)
Description
モルヒネの代謝物であるモルヒネ-6-グルクロニドは、強力な鎮痛作用を有する。
ケーニッヒス-クノール
合成によるモルヒネ-6-グルクロニドの調製は、既にエイチ.ヨシムラ(H. Yoshimura)ら(Chem. Pharm. Bull. 1968、16、2114-2119およびTetrahedron Letters 1968、4、483-486)、ピー.エー.カーラプト(P.A. Carrupt)ら(J. Med. Chem. 1991、34、1272-1275)およびシー.レイシー(C. Lacy)ら(Tetrahedron Letters 1995、36、22、3939-3950)に記載されている。
エフ.シャインマン(F. Scheinmann)ら(EP 597915)は、イミデート法(フィッシャー(Fischer)ら、J. Org. Chem. 1984、49、4988を参照)を用いるその調製を記載しており、それは重金属の混入の減少をもたらすと推測されている。
エー.メルツ(A. Mertz)ら(WO 93/05057)は、モルヒネおよび保護されたハロゲン化グルクロン酸エステルからの、後にアルカリ金属塩での加水分解によるモルヒネグルクロニドの合成を記載している。
また、モルヒネ-6-グルクロニドは、モルヒネ-3,6-ジグルクロニドの選択的酵素触媒加水分解によって調製された(アール.ティー.ブラウン(R.T. Brown)ら、Tetrahedron Letters 1995、36、1117-1120)。
記載されている無機不純物を全面的に取り除き精製する方法は、カラムクロマトグラフィー(シー.レイシー(C. Lacy)ら)およびアルコール/水混合物からの再結晶化(エイチ.ヨシムラら、ピー.エー.カーラプトら)からなる。
上述の作製方法の結果として、モルヒネ-6-グルクロニドは結晶化合物の形態で得られ、それは精製に使用される溶媒(メタノール、エタノール、ジオキサンまたはアセトニトリル)とともに安定な溶媒和物を形成する。記載された再結晶化は、むしろ沈殿法(アルコールの添加は水溶液の極性を低下させ、結晶化を導く)に対応するので、無機塩は限られた除去しかできず、それらも晶出する。
このようにして得られた溶媒形態は、非常に吸湿性であり、20%までの水を吸収する。しかしながら、高い量の残留溶媒−数重量%まで−故に、問題となる溶媒がメタノール、ジオキサンまたはアセトニトリルのような毒性溶媒であるときは特に、溶媒和物は薬学的使用に適さない。
従って、モルヒネ-6-グルクロニドを、溶媒を含まない結晶形態で作製する必要がある。モルヒネ-6-グルクロニドのこの溶媒を含まない形態は、その純度、安定性、および物理的/化学的特性において、溶媒形態よりも優れるべきである。さらに、モルヒネ-6-グルクロニドを作製する方法はまた、工業的規模で実行可能であるべきである。特に、使用される溶媒は、水であるべきである。
現在、上述の要請事項に合致する調製方法により、改善された特性を有する新しい結晶形態でのモルヒネ-6-グルクロニドが作製できることが予期せずして見い出された。従って、本発明によれば、モルヒネ-6-グルクロニドが、A型として公知の新しい結晶形態で調製される。水中でのその優れた溶解性にもかかわらず、モルヒネ-6-グルクロニドは、特定の条件下で水から結晶化できることが見い出された。このようにして作製されたA型は、溶媒を含む形態と比較すると、より低い量の重金属残留物ならびに溶媒残留物および関連する有機物質のような有機不純物を有し、そのより低い吸湿性および水吸着性により、それはより安定であり操作がより容易である。
新しいA型のモルヒネ-6-グルクロニドは、以下で説明されるように、その赤外スペクトルおよびそのX線粉末回折像によって特徴付けることができる。
従って、本発明は、下記の主なピークを有する赤外スペクトル(KBrプレート)を有する、A型として公知のモルヒネ-6-グルクロニドの新しい結晶形態に関する:
実施例1により得られる、このA型の赤外スペクトルは、図1に示されており、そこでは、X軸は波数(cm-1)を示し、Y軸は透過率を示す。
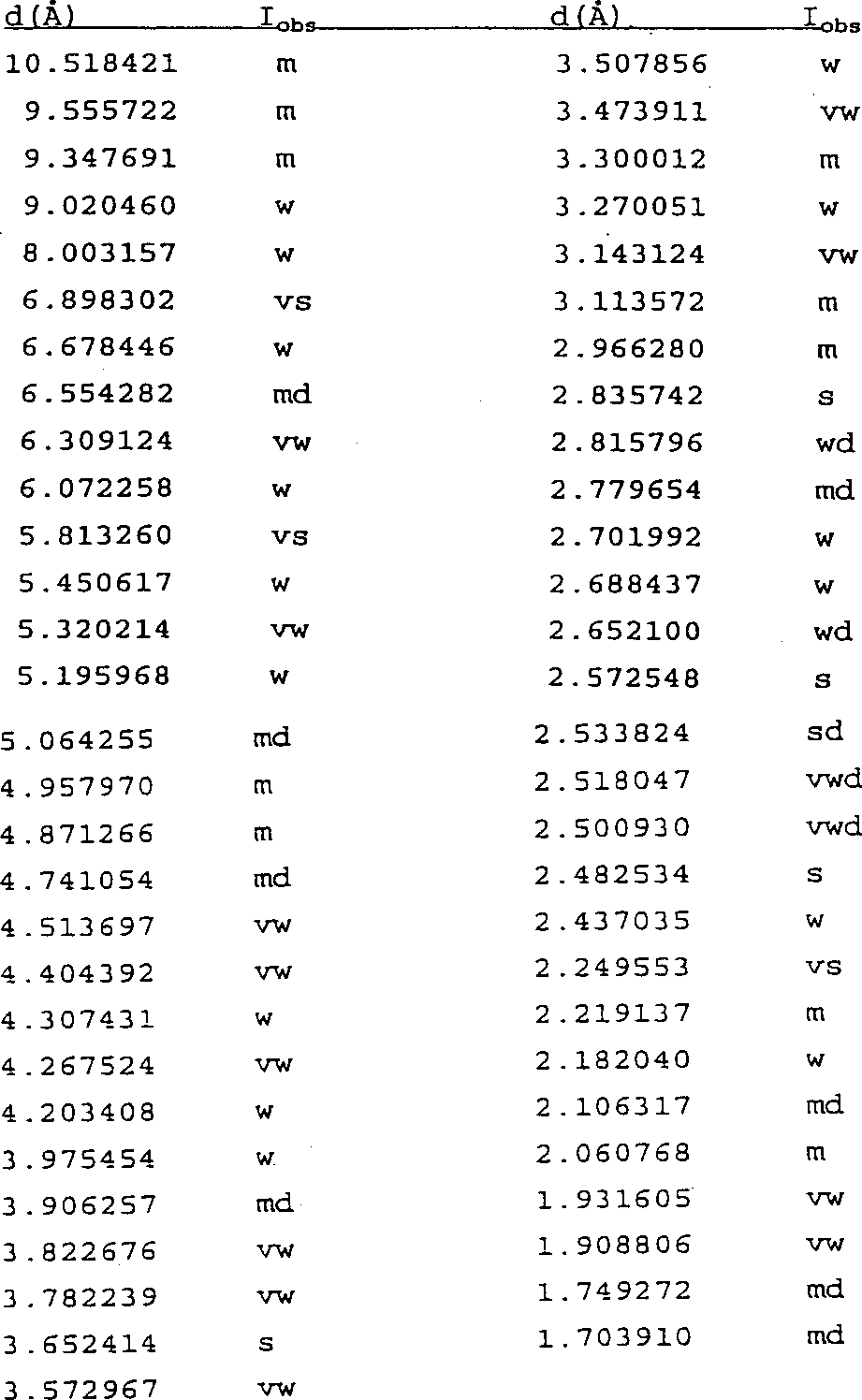
A型のモルヒネ-6-グルクロニドのX線粉末回折パターンは、X線透過性担体の上に材料を固定し、グイニエル・ド・ウルフ(Guinier-de Wolff)カメラでCuKα1−照射を6時間照射して画像またはパターンを写真撮影することによって得ることができる。計算に使用されたX線波長について測定された平均値は、1.54050Åであった。"d"間隔および相対的観察強度(Iobs)として表されるA型のモルヒネ-6-グルクロニドのX線粉末回折像を、以下に示す(s=強い、m=中程度、w=弱い、v=非常に、d=拡散):
上記のA型の粉末回折像と対照的に、モルヒネ-6-グルクロニドのエタノール溶媒和物は、同じ条件下で撮影すると下記のX線粉末回折パターンを有する:
本発明によるA型のモルヒネ-6-グルクロニドは、溶媒形態と比較すると、15重量%未満のより低い水の取り込み、および97重量%を超える改善された6ヶ月間安定性を有する。
A型のモルヒネ-6-グルクロニドは、投与のために任意の所望のタイプの製剤に処方され得る。本発明によるA型のモルヒネ-6-グルクロニドは、従って、ヒトまたは獣医学に好適な薬学的組成物を調製するために使用される。そのような薬学的組成物は、慣用されているガレヌス賦形剤および/または担体または希釈剤を用いて作製されても良く、必要ならば、他の治療的に有用な活性物質を含んでいても良い。
A型のモルヒネ-6-グルクロニドは、単一用量の化合物を賦形剤および希釈剤、例えば、コーンスターチ、炭酸カルシウム、ジカルシウムホスフェート、アルギン酸、ラクトース、ステアリン酸マグネシウム、プリモゲル(Primogel)またはタルクとともに含む錠剤またはカプセル剤の形態で、経口経路で投与され得る。錠剤は、成分を造粒してそれらを圧縮する慣用されている方法で作製され、カプセル剤は、好適なサイズの硬ゼラチンカプセルに詰めて作製される。A型のモルヒネ-6-グルクロニドはまた、蜜ろう誘導体、ポリエチレングリコールまたはポリエチレングリコール誘導体、リノール酸またはリノレン酸エステルのような賦形剤を単一用量の化合物とともに含む座剤の形態で投与され得、直腸経路で投与される。
A型のモルヒネ-6-グルクロニドはまた、非経口的に、例えば筋肉内、静脈内または皮下注射によって投与され得る。非経口投与のためには、滅菌水溶液の形態で使用されるのが最適であり、それは等張化剤、pH調節剤、保存剤および安定化剤のような他の溶解される物質を含み得る。化合物は、蒸留水に添加され得、pHは、例えばクエン酸、乳酸または塩酸を用いて3〜6に調整され得る。デキストロースまたは食塩水溶液のような適切に溶解された物質が添加されて、溶液を等張にし得る。さらに、p-ヒドロキシベンゾエートのような保存剤およびEDTAのような安定化剤は、溶液が十分に安定で耐久性であることを確実にするよう添加され得る。このようにして得られた溶液は、次に滅菌され、好適なサイズの滅菌されたガラス製アンプルに移されて、所望の容量の溶液を含むようにすることができる。A型のモルヒネ-6-グルクロニドはまた、上述のような非経口的製剤の注入によって投与し得る。
本発明によるA型のモルヒネ-6-グルクロニドはまた、油性調製物、緩衝化された又は緩衝化されていない乳剤、ゲルまたはクリームの形態、或いは経皮硬膏剤により投与し得る。
ヒトの経口投与のために、日用量は、体重70kgの典型的な成人患者に対して、1日につき0.001〜100mgの範囲であると仮定される。従って、錠剤またはカプセル剤は一般に、0.0003〜30mgの活性な化合物を含み得、例えば1日に3回までの経口投与には、0.01〜5mgを含み得る。非経口投与のためには、投与量は、1日につき70kg当り0.001〜100mgの範囲、例えば、約0.5mgであり得る。
本発明は、A型のモルヒネ-6-グルクロニドの調製方法にも関する。
A型のモルヒネ-6-グルクロニドは、制御された条件下で結晶化によって調製され得る。出発物質は、溶媒和物を含まないモルヒネ-6-グルクロニドまたは任意の所望されるモルヒネ-6-グルクロニド溶媒和物のいずれかであって良い。
再結晶化のために、モルヒネ-6-グルクロニドは、加熱および攪拌しながら、2〜10倍の量の水に溶解される。出発物質がモルヒネ-6-グルクロニド溶媒和物である場合、いかなる残留溶媒も蒸発させるために、それは還流され得る。このようにして調製された溶液は、不溶性成分の完全な除去を確実にするために、例えばグラスフィルターまたはメンブランフィルターを用いて濾過できる。結晶の粒度は、冷却速度および攪拌速度を適切に選択してコントロールし得る。
所望の形状の種結晶を結晶化溶液に加え、結晶化が開始するときに攪拌を止めることが推奨されると判明した。結晶化は、溶液を、例えば40〜80℃から約0〜30℃に、かなり長い時間、例えば15〜360分間かけて冷却することによって行われる。このようにして得られたA型のモルヒネ-6-グルクロニドは、遠心分離または濾過して分離され、水で洗浄できる。
実施例
実施例1
モルヒネ-6-グルクロニド溶媒和物からのA型の調製
1.12kgのモルヒネ-6-グルクロニドを、加熱しながら4000mlの水に溶解し、攪拌しながら5-10分間沸騰まで加熱する。溶液を濾過し、フィルターを500mlの水で洗浄する。溶液を、50分間かけて4℃に冷却し、4℃で8時間維持する。得られた結晶を濾過し、トータルで700mlの氷冷水で3回洗浄し、減圧下に4-10時間75℃で乾燥して、A型のモルヒネ-6-グルクロニド(0.92kgの結晶粉末)を得る。
Mp:243-246℃(分解)。
実施例2
モルヒネ-6-グルクロニドの溶媒和物形態の調製
1.17kgのモルヒネ-6-グルクロニドを、5800mlの水に沸点温度で溶解し、5分間沸騰させ、濾過し、7600mlの熱い(70℃)エタノールと混合すると、それによって結晶化(沈殿)が非常に速く起こる。30分以内に、混合物を周囲温度に冷却し、2時間周囲温度に維持し、その後20時間4℃に維持する。得られた固体を濾過し、トータルで2200mlのエタノール/水混合物(4:3)および1000mlのエタノールで3回洗浄し、減圧下に3時間乾燥する。
収量:1.05kgの結晶粉末
Mp:250-252℃(分解)。
実施例3
安定性
新しい結晶形態の異なるサンプルおよび同質の公知の溶媒和物形態(エタノール)を、ポリエチレン製ボトル中で、温度25℃および相対湿度60%で保存する。含量の測定は、HPLCを用いて行った。
実施例4
吸湿性
サンプルを、一定重量に達するまで、一定の相対湿度で保存した。データは、水の重量%で与えられ、使用された形態の水分量に関して修正される。
Claims (6)
- モルヒネ-6-グルクロニドが、それを加熱により溶解し冷却によりA型を晶出させることにより水から結晶化することを特徴とする、請求項1に記載の新しいA型のモルヒネ-6-グルクロニドの調製方法。
- 請求項1に記載の新しいA型のモルヒネ-6-グルクロニドの請求項2に記載の調製方法であって、モルヒネ-6-グルクロニドを2-10倍の量の水に温度40-100℃で溶解し、その後0-30℃まで15-360分間かけて冷却することによりA型が晶出されることを特徴とする方法。
- 請求項2または3に記載の方法により調製される、請求項1に記載のA型のモルヒネ-6-グルクロニド。
- 相対湿度10-90%でそれが15%未満の水を取り込むことを特徴とする、請求項1に記載のA型のモルヒネ-6-グルクロニド。
- 6ヶ月間安定性が温度25℃および相対湿度60%で少なくとも97%であることを特徴とする、請求項1に記載のA型のモルヒネ-6-グルクロニド。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AT0168395A AT403162B (de) | 1995-10-11 | 1995-10-11 | Neue kristallform von morphin-6-glucuronid |
| AT1683/95 | 1995-10-11 | ||
| PCT/GB1996/002502 WO1997013775A1 (en) | 1995-10-11 | 1996-10-11 | New crystalline form of morphine-6-glucuronide |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH11513402A JPH11513402A (ja) | 1999-11-16 |
| JP4000397B2 true JP4000397B2 (ja) | 2007-10-31 |
Family
ID=3518738
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP51483697A Expired - Fee Related JP4000397B2 (ja) | 1995-10-11 | 1996-10-11 | モルヒネ−6−グルクロニドの新しい結晶形熊 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US6172206B1 (ja) |
| EP (1) | EP0873346B1 (ja) |
| JP (1) | JP4000397B2 (ja) |
| AT (2) | AT403162B (ja) |
| AU (1) | AU725655B2 (ja) |
| CA (1) | CA2234344C (ja) |
| DE (1) | DE69621253T2 (ja) |
| DK (1) | DK0873346T3 (ja) |
| EA (1) | EA000755B1 (ja) |
| ES (1) | ES2176496T3 (ja) |
| NO (1) | NO309607B1 (ja) |
| PT (1) | PT873346E (ja) |
| SI (1) | SI0873346T1 (ja) |
| WO (1) | WO1997013775A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20140271788A1 (en) | 2013-03-15 | 2014-09-18 | Monosol Rx, Llc | Sublingual and buccal film compositions |
| US7771298B2 (en) | 2006-08-18 | 2010-08-10 | Field Logic, Inc. | Expandable broadhead with rear deploying blades |
| USD776782S1 (en) | 2015-05-22 | 2017-01-17 | Feradyne Outdoors, Llc | Broadhead arrowhead having both expandable and fixed cutting blades |
| CN106554377B (zh) * | 2015-09-25 | 2019-04-12 | 宜昌人福药业有限责任公司 | 吗啡衍生物晶型iii及其制备方法和用途 |
| CN106554357B (zh) * | 2015-09-25 | 2018-09-11 | 宜昌人福药业有限责任公司 | 吗啡衍生物晶型i及其制备方法和用途 |
| CN106554376B (zh) * | 2015-09-25 | 2019-04-12 | 宜昌人福药业有限责任公司 | 吗啡衍生物晶型ii及其制备方法和用途 |
| CN107028968B (zh) * | 2016-02-03 | 2020-12-04 | 江苏恒瑞医药股份有限公司 | 一种含有葡萄糖醛酸吗啡或其可药用盐的药物组合物 |
| US20180110725A1 (en) | 2016-10-21 | 2018-04-26 | Somniferum Labs LLC | Compositions, methods and kits for the safe inhaled delivery of targeted opioids for the treatment of pain and addiction |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5977326A (en) * | 1991-08-06 | 1999-11-02 | Salford Ultrafine Chemicals And Research Limited | Process for making morphine-6-glucuronide or substituted morphine-6-glucuronide |
| GB9116909D0 (en) * | 1991-08-06 | 1991-09-18 | Salford Ultrafine Chem & Res | Morphine derivatives |
| FR2680786B1 (fr) * | 1991-09-04 | 1995-03-10 | Irepa | Procede de synthese de glucuronides d'epoxy-4,5 morphinanes. |
-
1995
- 1995-10-11 AT AT0168395A patent/AT403162B/de not_active IP Right Cessation
-
1996
- 1996-10-11 SI SI9630496T patent/SI0873346T1/xx unknown
- 1996-10-11 ES ES96933550T patent/ES2176496T3/es not_active Expired - Lifetime
- 1996-10-11 CA CA002234344A patent/CA2234344C/en not_active Expired - Fee Related
- 1996-10-11 PT PT96933550T patent/PT873346E/pt unknown
- 1996-10-11 WO PCT/GB1996/002502 patent/WO1997013775A1/en not_active Ceased
- 1996-10-11 AT AT96933550T patent/ATE217632T1/de active
- 1996-10-11 EP EP96933550A patent/EP0873346B1/en not_active Expired - Lifetime
- 1996-10-11 DE DE69621253T patent/DE69621253T2/de not_active Expired - Lifetime
- 1996-10-11 DK DK96933550T patent/DK0873346T3/da active
- 1996-10-11 EA EA199800364A patent/EA000755B1/ru not_active IP Right Cessation
- 1996-10-11 AU AU72247/96A patent/AU725655B2/en not_active Ceased
- 1996-10-11 JP JP51483697A patent/JP4000397B2/ja not_active Expired - Fee Related
-
1998
- 1998-04-01 NO NO981465A patent/NO309607B1/no not_active IP Right Cessation
-
1999
- 1999-11-04 US US09/433,555 patent/US6172206B1/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| PT873346E (pt) | 2002-10-31 |
| AT403162B (de) | 1997-11-25 |
| DE69621253D1 (de) | 2002-06-20 |
| NO981465D0 (no) | 1998-04-01 |
| EP0873346A1 (en) | 1998-10-28 |
| CA2234344A1 (en) | 1997-04-17 |
| EA199800364A1 (ru) | 1999-02-25 |
| WO1997013775A1 (en) | 1997-04-17 |
| US6172206B1 (en) | 2001-01-09 |
| NO309607B1 (no) | 2001-02-26 |
| CA2234344C (en) | 2005-03-15 |
| AU725655B2 (en) | 2000-10-19 |
| DE69621253T2 (de) | 2002-12-19 |
| ATE217632T1 (de) | 2002-06-15 |
| ES2176496T3 (es) | 2002-12-01 |
| EA000755B1 (ru) | 2000-04-24 |
| AU7224796A (en) | 1997-04-30 |
| ATA168395A (de) | 1997-04-15 |
| SI0873346T1 (en) | 2002-12-31 |
| JPH11513402A (ja) | 1999-11-16 |
| EP0873346B1 (en) | 2002-05-15 |
| NO981465L (no) | 1998-06-08 |
| DK0873346T3 (da) | 2002-08-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5159788B2 (ja) | 1−(β−D−グルコピラノシル)−4−メチル−3−[5−(4−フルオロフェニル)−2−チエニルメチル]ベンゼン1/2水和物の結晶形 | |
| KR101470715B1 (ko) | 다사티닙 다결정체 및 그의 제조방법과 약물 조성물 | |
| RU2414470C2 (ru) | Кристаллические формы соединения тиазолидиндиона и способ его получения | |
| CA2584365A1 (en) | Ascomycin crystalline forms and preparation thereof | |
| HRP20010132A2 (en) | CRYSTALLINE FORMS OF EtO<->2<P>C-CH<->2<P>-(R)Cgl-Aze-Pab-OH | |
| EP0579681A1 (en) | Crystalline tiagabine hydrochloride monohydrate, its preparation and use | |
| JP4000397B2 (ja) | モルヒネ−6−グルクロニドの新しい結晶形熊 | |
| WO2018049632A1 (zh) | 奥扎莫德的晶型、其制备方法及药物组合物 | |
| ES2863586T3 (es) | Sal del ácido mesílico de un compuesto de aciltiourea, cristal de la misma y proceso para su producción | |
| AU2018349284B2 (en) | New salt and solid state forms of escitalopram | |
| WO2020049598A2 (en) | Apalutamide polymorphs | |
| JP2007524569A (ja) | ナテグリニドの結晶形 | |
| JP2020500887A (ja) | ベンゾジアゼピン誘導体の臭化水素酸塩、その調製方法及び使用 | |
| TWI680983B (zh) | 一種鈉-葡萄糖共同轉運蛋白2抑制劑的l-脯胺酸複合物、其一水合物及晶體 | |
| EP2083010A1 (en) | Polymorphic Forms of Moxifloxacin hydrochloride and processes for preparation thereof | |
| CN100427499C (zh) | 一种阿奇霉素的可溶性盐及其制备方法 | |
| JP3068175B2 (ja) | イソチアゾロ〔5,4―b〕ピリジン誘導体 | |
| CN102108076B (zh) | 制备无定形右兰索拉唑的方法 | |
| JP2677906B2 (ja) | パラ−アミノベンゼンスルファニルアミドの物理的に安定した結晶性α−変態の調製方法 | |
| CN108218936B (zh) | 联苯核苷氨基磷酸酯化合物的异构体及其无定型物 | |
| RU2074858C1 (ru) | Кристаллический дигидрат (5r, 6s)-2-карбамоилоксиметил-6-[(1r)-гидроксиэтил]-2-пенем-3-карбоновой кислоты, способ его получения, фармацевтическая композиция | |
| RU2826745C1 (ru) | СПОСОБ ПОЛУЧЕНИЯ НАТРИЕВОЙ СОЛИ (4R,12aS)-N-(2,4-ДИФТОРБЕНЗИЛ)-7-ГИДРОКСИ-4-МЕТИЛ-6,8-ДИОКСО-3,4,6,8,12,12a-ГЕКСАГИДРО-2Н-ПИРИДО[1',2':4,5]ПИРАЗИНО[2,1-b][1,3]ОКСАЗИН-9-КАРБОКСАМИДА | |
| RU2826759C1 (ru) | Способ очистки (4r,12as)-n-(2,4-дифторбензил)-7-гидрокси-4-метил-6,8-диоксо-3,4,6,8,12,12а-гексагидро-2н-пиридо[1',2':4,5]пиразино[2,1-b][1,3]оксазин-9-карбоксамида натрия | |
| JPS5936696A (ja) | 2′―デオキシ―5―置換ウリジン誘導体及びそれを含有する抗腫瘍剤 | |
| JP3002507B2 (ja) | 四環式化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20070703 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20070725 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100824 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110824 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120824 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120824 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130824 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |