JP3831005B2 - カルボキシル基を有するベンゾピリジンの製造方法 - Google Patents
カルボキシル基を有するベンゾピリジンの製造方法 Download PDFInfo
- Publication number
- JP3831005B2 JP3831005B2 JP06132996A JP6132996A JP3831005B2 JP 3831005 B2 JP3831005 B2 JP 3831005B2 JP 06132996 A JP06132996 A JP 06132996A JP 6132996 A JP6132996 A JP 6132996A JP 3831005 B2 JP3831005 B2 JP 3831005B2
- Authority
- JP
- Japan
- Prior art keywords
- reaction
- benzopyridine
- carboxyl group
- mol
- methylquinoline
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Quinoline Compounds (AREA)
- Other In-Based Heterocyclic Compounds (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
【産業上の利用分野】
本発明は医薬・農薬等の原料として有用なキノリンカルボン酸やイソキノリンカルボン酸等、カルボキシル基を有するベンゾピリジンの製造方法に関する。更に詳しくはアルキルベンゾピリジンの酸化によりカルボキシル基を有するベンゾピリジンを製造する方法に関する。
【0002】
【従来の技術】
キノリンカルボン酸やイソキノリンカルボン酸は医薬・農薬等の原料として有用であり、その製造方法は従来から種々検討されているが、下記の2種の製造法に大別される。
【0003】
(1)アミノ基等を含有するベンゼン誘導体の閉環反応による方法
(2)キノリン又はイソキノリン骨格上の置換基の変換による方法
【0004】
このうちキノリン又はイソキノリン骨格にカルボキシル基以外の置換基を有するカルボン酸を製造する場合にはアミノ基等を含有するベンゼン誘導体の閉環反応による(1)の方法が(2)の方法に比較して有利であると考えられる。しかしキノリン又はイソキノリン骨格上にカルボキシル基のみを有するカルボン酸の製造の場合には、メチルキノリン等の置換キノリン類が工業的に入手可能であるので、(2)の方法が(1)の方法より有利であると言える。
【0005】
上記(2)の方法では工業的に入手が可能なアルキルベンゾピリジンを出発原料として各種の方法が提案されている。即ち、アルキルベンゾピリジンのアルキル基を酸化する方法、ハロゲン化加水分解方法、ハロゲン加水分解法によりメチル基を一度、アルコール、アルデヒドに変換した後、酸化する方法などである。
【0006】
しかし、例えばメチルキノリンを臭素等を用いてトリハロゲン化した後、酸触媒を用いた加水分解により対応するキノリンカルボン酸を得る方法(D.L.Hammick,J.Chem.Soc.,123 2882(1923) )は、収率も比較的高いが、高価で、しかも激しい腐食性を有する臭素等のハロゲンを使用する点、反応したハロゲンと等モルのハロゲン化水素が副生し、最終的にはこれを臭化ナトリウム等のハロゲン金属塩等として廃棄物処理が必要など、工業的な製造においては問題点が多く、安価にキノリンカルボン酸を製造することは困難であった。
【0007】
また下記のごとく種々の酸化剤を用いて各種メチルキノリンのメチル基を酸化して、対応するカルボン酸に変換する方法も知られている。
2−メチルキノリン→2−キノリンカルボン酸
酸化剤:二クロム酸カリウム(O.Doebner らBer.15 3075(1882) )
3−メチルキノリン→3−キノリンカルボン酸
酸化剤:クロム酸(C.K.Cainら,J.Org.Chem.,20,466(1955) )
6−メチルキノリン→6−キノリンカルボン酸
酸化剤:過マンガン酸カリウム(G.V.Goergievicks,Mnnatsch 12,304(1891) )
【0008】
しかしこれらの方法は概して収率も低く、またこれらの酸化剤が高価な上にクロム、マンガン等の重金属を含む廃棄物の処理費用がかさむため、キノリンカルボン酸を安価に製造することができなかった。
【0009】
更に安価な酸化剤として、過酸化水素や空気を使用する下記の方法も各種提案されている。
S.Paraskewas(Synthesis,1974,819(1974))は2−メチルキノリンと塩化パラジウムとの反応で生じる錯体(塩)を過酸化水素で酸化してメチル基をカルボキシル基に変換した後、塩化パラジウムと2−キノリンカルボン酸の塩を酸で分解して2−キノリンカルボン酸を得ることを報告しているが、収率も低く、高価なパラジウムを使用するため、その回収・再生に費用がかさみ工業的な製造方法とは言い難い。
【0010】
小松勝男(室蘭工業大学研究報告,3,41(1958))は2−メチルキノリンを五酸化バナジウム触媒上410℃付近で空気を用いて接触酸化して、収率約60%で2−キノリンカルボン酸を得ている。
【0011】
これらの気相酸化による製造方法は大量生産には適した方法であると言えるが、年間生産量が数十トンから百数十トン程度の少量生産においては、製造設備に多大の投資を必要とするため、酸化剤として安価な空気が使用できる利点を有するものの、キノリンカルボン酸を安価に製造することは難しい。また酸化中間体としてアルデヒドが多量に副生するため、これらの分離にも問題がある。
【0012】
液相酸化については、A.N.Christyakov ら(USSR Pat.457,701(1975))は苛性カリ水溶液中で2−メチルキノリンを反応温度250℃、反応圧力80気圧で、空気で酸化して2−キノリンカルボン酸を収率72%で得られることを報告している。この方法は酸化剤として安価な空気を使用していること、液相酸化のため、少量酸化にも適した方法であると言えるが、酸化条件が250℃−80気圧と非常に厳しいため、特殊な反応器を必要とする、また空気圧縮機を大型化するため、この面での製造設備投資がかさむ。
【0013】
また本発明出願人は先にアルカリ金属アルコラートの存在下、分子状酸素を用いて酸化することにより、カルボキシル基を有するベンゾピリジンの製造方法を提案した(特開平7−48353号公報)。しかし、この方法では高価なアルカリ金属アルコラートを多量に使用するため、必ずしも安価な製造方法とは言い難い。
【0014】
【発明が解決しようとする課題】
本発明の目的は、これら従来法の問題点を解決し、分子状酸素を用いてアルキルベンゾピリジンを酸化し、対応するカルボキシル基を有するベンゾピリジンを温和な条件下で安価に製造する方法を提供することにある。
【0015】
【課題を解決するための手段】
本発明はアルキルベンゾピリジンをアルカリ金属水酸化物の存在下、反応開始時における反応系中の水分を2重量%以下にして、分子状酸素を用いて酸化することを特徴とするカルボキシル基を有するベンゾピリジンの製造方法である。以下本発明を具体的に説明する。
【0016】
【発明の実施の形態】
ここにベンゾピリジンとはキノリン及びイソキノリンを言い、カルボキシル基を有するベンゾピリジンにはキノリンカルボン酸、イソキノリンカルボン酸のほか、キノリン又はイソキノリン骨格にカルボキシル基以外の置換基を有するカルボン酸も包含される。またアルキルベンゾピリジンとはアルキルキノリン及びアルキルイソキノリンを言う。
【0017】
本発明で原料として用いるアルキルベンゾピリジンとしてはキノリン骨格、もしくはイソキノリン骨格にメチル基、エチル基、プロピル基等のアルキル基を少なくとも1つ有する化合物であり、アミノ基含有ベンゼン誘導体から閉環反応によって製造されたものや、コールタールから抽出−蒸留等の操作を経て分離されたもの等その由来を問わずに使用できる。しかし一般的にはコールタールから分離されたものが工業的に入手が容易な為、原料としてより適している。この意味で工業的入手が特に容易なメチルキノリンが出発原料として特に適している。また原料中の不純物は酸化後の回収・精製工程により許容量が異なるが、コールタールから分離して得られるアルキルベンゾピリジンに混入する恐れのある、メチルナフタレン等の中性油分は酸化反応に余り影響を与えないため少量であれば通常問題にならない。
【0018】
またアルキルベンゾピリジンにはキノリン又はイソキノリン骨核におけるアルキル基の置換位置の異なる各種の異性体があるが、本発明の原料としては目的とするキノリンカルボン酸又はイソキノリンカルボン酸に対応するアルキルキノリン又はアルキルイソキノリンを選択すればよく、1−置換体(イソキノリン)、2−置換体(キノリン)、3〜8−置換体(キノリン及びイソキノリン)等、窒素原子の位置以外にアルキル基の入った任意のものが使用でき、これらの混合物も使用できる。
【0019】
アルキル基を2以上有するアルキルベンゾピリジン、例えばジアルキルキノリンを原料とした場合でも、本発明の酸化反応によって主として生成するものはアルキル基とカルボキシル基を有するベンゾピリジンであるが、これも勿論本発明の原料として使用できる。
【0020】
酸化反応は原料となるアルキルベンゾピリジン自身を溶媒として行うこともできるが、原料以外の有機溶媒を使用してもよい。原料以外に用いる有機溶媒としてはキノリン、ピリジン、イソキノリン、ナフタレン、ビフェニル、メチルナフタレン、ベンゼン、トルエン等の芳香族溶媒、ジメチルホルムアミド、ジメチルスルホキシド、スルホラン、ヘキサメチルホスホルアミド等の極性非プロトン溶媒、及びこれらの混合物が使用できるが、芳香族溶媒の方が、より好ましい。
アルキルベンゾピリジン自身を溶媒とすると、他の有機溶媒を用いる場合より反応速度が増して反応時間を短縮することができる利点があるが、転化率向上の点からは、上記のごとき原料以外の溶媒の存在下に行なうことが好ましい。このような溶媒を用いる場合、添加量は任意に選択できるが、通常原料アルキルベンゾピリジンの1〜10倍重量部程度使用する。
【0021】
本発明においては触媒として、アルカリ金属水酸化物を用いる。アルカリ金属水酸化物としては、水酸化ナトリウム、水酸化カリウム、水酸化ルビジウム、水酸化リチウム、水酸化セシウム等が使用できるが、安価で工業的入手が容易な、水酸化ナトリウム、水酸化カリウム及びこれらの混合物が好ましい。
【0022】
この反応においては、水分の存在により反応速度が低下するため、反応系中における水分を少量に保つことが必要であり、反応開始時における原料アルキルベンゾピリジン、溶媒、アルカリ金属水酸化物中のトータルの水分を2重量%以下、好ましくは1%以下とする。2重量%を超える水分を含有する反応系で反応を行うと、反応速度が低下するので、反応速度を上げるためには高温、高圧の過酷な条件が必要となるので好ましくない。
本発明においては酸化反応であるため、反応の進行に伴う水の生成による反応速度の低下を防止するため、生成した水を系外に除去しながら行うのが好ましい。
【0023】
反応系中における水分を少量に保つためには、原料、溶媒、触媒等に含有される水分をできるだけ少量に抑える必要があり、そのため触媒として使用する上記アルカリ金属水酸化物も水分含有量の少ないものを用いるべきであり、実質的に無水のフレーク状、ペレット状のものを用いるのが好ましい。
【0024】
アルカリ金属水酸化物の使用量はアルキルベンゾピリジン自身を溶媒とする場合、アルキルベンゾピリジン1モルに対して0.1〜2.0モル、好ましくは0.2〜1.0モルである。原料とは別に溶媒を使用する場合は、アルキルベンゾピリジン1モルに対して1〜20モル、好ましくは2〜10モルである。使用量が上記それぞれの下限未満では反応速度が遅く、アルキルベンゾピリジン類の転化率が低く、また上限以上の量を添加しても、収率の向上は少なく、経済的な利点はない。
【0025】
反応温度は80〜250℃、好ましくは100〜200℃である。80℃以下では酸化反応が遅く工業的ではない。また250℃以上では重質化が顕著になり、目的物の選択率が低下する。
【0026】
反応圧力は、反応温度で反応液が液状を保つ圧力であれば良いが、通常0〜30kg/cm2 Gである。
【0027】
本発明では酸化剤として分子状酸素を用いるが、分子状酸素を含んでいれば、純酸素、空気、燃焼排ガス等いずれも使用できる。通常は入手の容易な空気を使用する。
【0028】
反応時間は使用する原料アルキルベンゾピリジン、水酸化アルカリの種類及び添加量、溶媒の有無、種類及び添加量、反応温度、反応圧力等によって異なるが、1〜30時間、通常は2〜15時間である。
【0029】
本発明における酸化方式は、使用する原料、アルカリ金属水酸化物および分子状酸素が充分に混合できれば、撹拌槽式、気泡塔式等、特に制限はなく、回分式、半回分式、連続式いずれの方式も採用できる。
【0030】
酸化反応終了後の目的物の回収方法に特別な制約はなく、得られる目的物の物性に応じて、濃縮、濾過、抽出等の方法により回収すれば良い。ただし酸化反応後、目的物はアルカリ金属塩を形成しているので、必要に応じて酸により中和を行う。
【0031】
回収した粗カルボキシル基を有するベンゾピリジンは常法により必要な純度に精製する。未反応の原料は脱水処理後、酸化反応系に戻し、繰り返し使用することができる。
【0032】
【実施例】
以下実施例により本発明を具体的に説明する。なおここで転化率、選択率、収率とは、2−メチルキノリンからの2−キノリンカルボン酸製造を例にとると下記を意味する。
【数1】
【0033】
[実施例1]
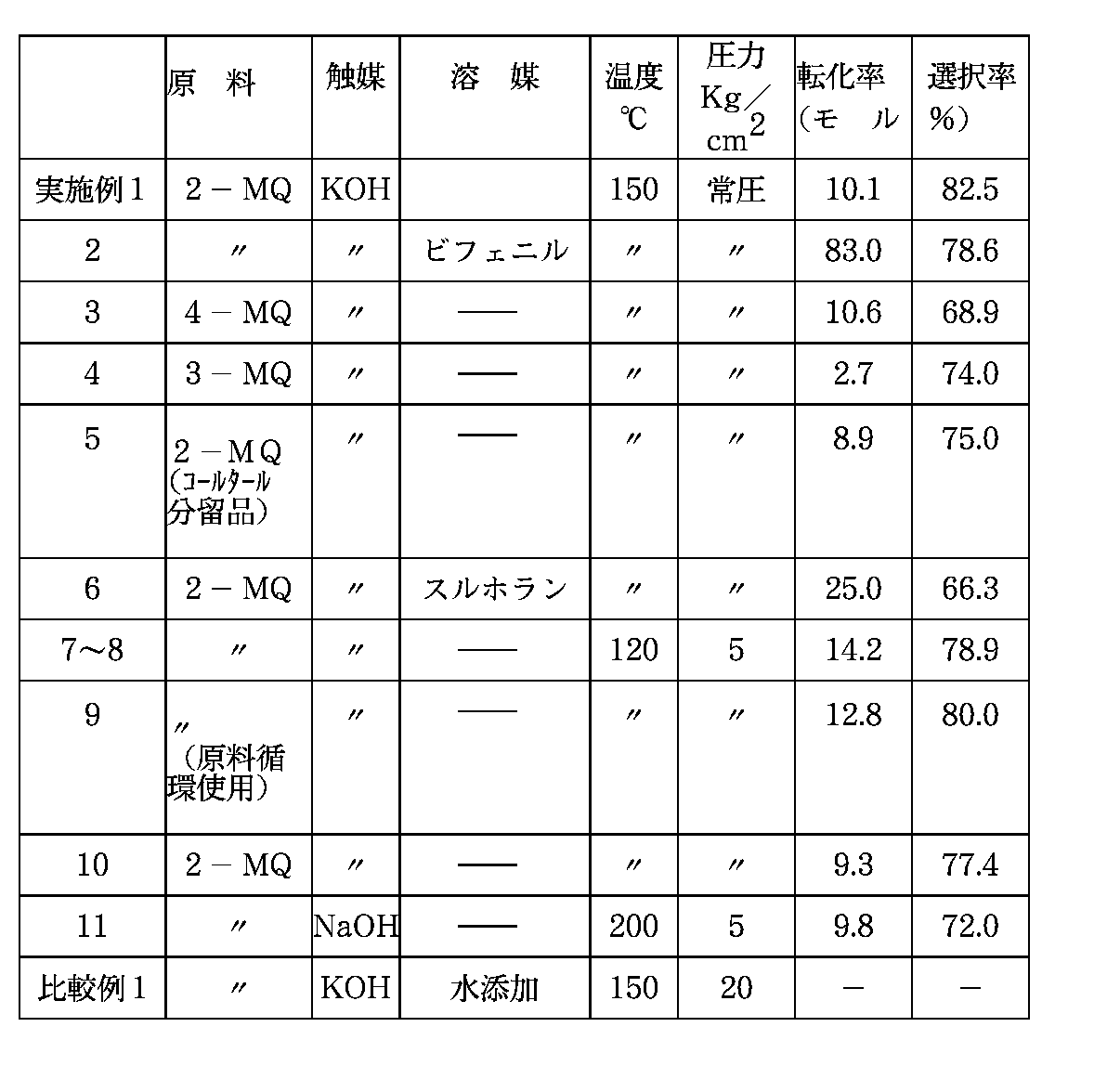
100mlの丸底フラスコに2−メチルキノリン(純度99%)50g(10.346モル)、水酸化カリウム(純度95%、フレーク状)7.5g(0.127モル)を加え、大気圧下、純酸素雰囲気で激しく撹拌し、150℃で、3時間反応させた。反応終了後、水40mlを加え、生成物を溶解、分液し、油層中の2−メチルキノリンをガスクロマトグラフで、水層中の2−メチルキノリン、2−キノリンカルボン酸カリウムを液体クロマトグラフで分析し、転化率、選択率を求めたところ、転化率10.1モル%、選択率82.5モル%であった。
【0034】
[実施例2]
2−メチルキノリンを5g(0.0346モル)、溶媒としてビフェニルを45g(0.271モル)、水酸化カリウムを15g(0.254モル)とし、150℃で7時間反応させた以外は、実施例1と同様にして2−キノリンカルボン酸カリウムを製造した。結果を表1に示す。
【0035】
[実施例3]
2−メチルキノリンの替わりに、4−メチルキノリン(純度99%)5g(0.0346モル)を使用した以外は、実施例1と同様にして4−キノリンカルボン酸カリウムを製造した。結果を表1に示す。
【0036】
[実施例4]
2−メチルキノリンの替わりに3−メチルキノリン(純度99%)5g(0.346モル)を使用した以外は、実施例1と同様にして3−キノリンカルボン酸カリウムを製造した。結果を表1に示す。
【0037】
[実施例5]
原料2−メチルキノリンを純度80%のコールタールからの分留品(0.279モル)に変更した以外は実施例1と同様にして2−キノリンカルボン酸カリウムを製造した。結果を表1に示す。
【0038】
[実施例6]
実施例2において溶媒としてビフェニルの替わりにスルホラン45g(0.375モル)を用い、水酸化カリウム添加量を6g(0.102モル)とし、150℃で3時間反応させて、2−キノリンカルボン酸カリウムを製造した。結果を表1に示す。
【0039】
[実施例7]
ガス導入管、撹拌機、温度計を有する1Lのガラス製オートクレーブに2−メチルキノリン(純度99%)400g(2.769モル)、水酸化カリウム90g(1.527モル)を仕込み、120℃まで昇温した。反応圧力5kg/cm2 Gで空気を400ml/min.流し、8時間反応させた。反応後水500gを加え、生成した2−キノリンカルボン酸カリウムを水層へ溶解させ分液により分離した。2−メチルキノリンの転化率、2−キノリンカルボン酸カリウムの収率を実施例1と同様にもとめた。結果を表1に示す。
【0040】
[実施例8](2−キノリンカルボン酸の回収)
実施例7において、反応終了後水180gを加え40℃まで冷却し析出した結晶をろ過した。濾液は分液、脱水し、未反応の原料335gを回収した。一方、反応生成物を含有するケーキは、酢酸中へ投入、加熱、溶解後、冷却し、析出した2−キノリンカルボン酸の結晶をろ過、乾燥し淡黄色の精製2−キノリンカルボン酸43.7gを得た。純度は99.6wt%、収率は9.0モル%であった。
【0041】
[実施例9](未反応原料の循環使用)
実施例8において回収した2−メチルキノリン335g(2.308モル)(純度98.5%)に新たに2−メチルキノリン(純度99%)を65g(0.450モル)加え、実施例7,8と同様に操作を行ったところ、淡黄色の2−キノリンカルボン酸42.0gを得た。純度は99.3%、収率は8.7モル%であった。転化率は12.8モル%、選択率は80.0モル%であった。
【0042】
[実施例10]
実施例7において、仕込み時に、水を8g加えた以外は実施例7と同様にして2−キノリンカルボン酸カリウムを製造した。メチルキノリンの転化率は9.3モル%、キノリンカルボン酸カリウムの選択率は77.4モル%であった。結果を表1に示す。
【0043】
[実施例11]
実施例7において、水酸化カリウムを水酸化ナトリウムに、反応温度を120℃から200℃に変更した以外は実施例7と同様にして2−キノリンカルボン酸ナトリウムを製造した。結果を表1に示す。
【0044】
[比較例1]
ガス導入管、攪拌機、温度計を有する1Lのステンレス製オートクレーブに2−メチルキノリン(純度99%)28.9g(0.20モル)、水酸化カリウム(95%)11.8g(0.20モル)、水250mLを仕込み150℃まで昇温した。反応圧力20kg/cm2 Gで空気を300ml/min流し、5時間反応させたが、酸素吸収が見られず、2−キノリンカルボンの生成は認められなかった。結果を表1に示す。
【0045】
【表1】
MQ:メチルキノリン
【0046】
【発明の効果】
本発明によればメチルキノリン等のアルキルベンゾピリジンから、分子状酸素による簡単な酸化方法により、しかも比較的温和な条件下で、キノリンカルボン酸等のカルボキシル基を有するベンゾピリジンを収率よく製造することができるため、その工業的意義は非常に大きい。
Claims (4)
- アルキルベンゾピリジンをアルカリ金属水酸化物の存在下、反応開始時における反応系中の水分が2重量%以下にして、分子状酸素を用いて酸化することを特徴とするカルボキシル基を有するベンゾピリジンの製造方法。
- アルカリ金属水酸化物が水酸化カリウム又は水酸化ナトリウムであることを特徴とする請求項1に記載のカルボキシル基を有するベンゾピリジンの製造方法。
- 有機溶媒の存在下で酸化することを特徴とする請求項1又は2記載のカルボキシル基を有するベンゾピリジンの製造方法。
- 有機溶媒が芳香族化合物であることを特徴とする請求項3記載のカルボキシル基を有するベンゾピリジンの製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP06132996A JP3831005B2 (ja) | 1996-03-18 | 1996-03-18 | カルボキシル基を有するベンゾピリジンの製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP06132996A JP3831005B2 (ja) | 1996-03-18 | 1996-03-18 | カルボキシル基を有するベンゾピリジンの製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH09249649A JPH09249649A (ja) | 1997-09-22 |
| JP3831005B2 true JP3831005B2 (ja) | 2006-10-11 |
Family
ID=13167999
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP06132996A Expired - Fee Related JP3831005B2 (ja) | 1996-03-18 | 1996-03-18 | カルボキシル基を有するベンゾピリジンの製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3831005B2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4925503B2 (ja) * | 2000-09-18 | 2012-04-25 | エア・ウォーター株式会社 | 複素環式芳香族カルボン酸類の製造方法 |
| CN117821033A (zh) * | 2023-10-31 | 2024-04-05 | 中国石油天然气集团有限公司 | 一种页岩气井防腐用固体缓蚀剂及其制备方法和用途 |
-
1996
- 1996-03-18 JP JP06132996A patent/JP3831005B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JPH09249649A (ja) | 1997-09-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JPS6247864B2 (ja) | ||
| JP7141303B2 (ja) | 5,5’-メチレンジサリチル酸の製造方法 | |
| US4328374A (en) | Process for the production of aromatic dialdehydes | |
| CN114436929B (zh) | 一种n-保护的3,4-去氢-l-脯氨酸酯的合成方法 | |
| CN114773316B (zh) | 2-(2,6-二氧代-哌啶-3-基)-5-氟-异吲哚-1,3-二酮的制备方法 | |
| JP3831005B2 (ja) | カルボキシル基を有するベンゾピリジンの製造方法 | |
| CN107311960A (zh) | 1,2,3‑苯并噻二唑类化合物的合成方法 | |
| CN113248432A (zh) | 高收率制备罗沙司他中间体的新方法 | |
| JP2001039913A (ja) | ビナフトールの精製方法 | |
| CN117776973A (zh) | 一种4-甲酰基-3-甲氧基苯甲腈的制备方法 | |
| CN111620788B (zh) | 一种制备(2s,3s)-3-氨基-二环[2.2.2]辛烷-2-甲酸酯的方法 | |
| JPH0748353A (ja) | カルボキシル基を有するベンゾピリジンの製造方法 | |
| CN113121435B (zh) | 一种2,4-二氯喹啉类化合物的合成方法 | |
| US7598415B2 (en) | Process for the preparation of p-toluic acid by liquid phase oxidation of p-xylene in water | |
| CN109369357B (zh) | 一种催化氧化羰基化制备对称二芳基酮的方法 | |
| CN113651684A (zh) | 4-羟基-2-丁炔酸的制备方法 | |
| US4288635A (en) | Method for the preparation of (E)-4-bromo-2-methylbut-2-en-1-al | |
| JPH07188175A (ja) | キナルジン酸の製造方法 | |
| JPH07233150A (ja) | ニコチン酸の製造方法 | |
| JP4168457B2 (ja) | 6−ヒドロキシ−2−ナフトアルデヒドと関連化合物の製造方法 | |
| JP3841886B2 (ja) | 1,2−インダンジオール類の製造方法 | |
| JPH03279347A (ja) | 4,4’―ジフェニルジカルボン酸の精製方法 | |
| CN116199624A (zh) | 一种2,5,6-三氯烟酸的合成方法 | |
| JPS6230975B2 (ja) | ||
| JPS63154644A (ja) | アシロキシ安息香酸の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060314 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060512 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20060612 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20060711 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20060713 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090721 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100721 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110721 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110721 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120721 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120721 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130721 Year of fee payment: 7 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |