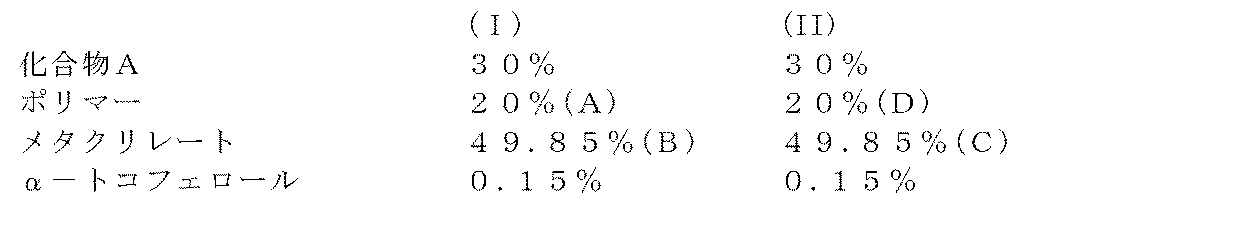JP3820103B2 - 抗酸化剤含有tts - Google Patents
抗酸化剤含有tts Download PDFInfo
- Publication number
- JP3820103B2 JP3820103B2 JP2000527233A JP2000527233A JP3820103B2 JP 3820103 B2 JP3820103 B2 JP 3820103B2 JP 2000527233 A JP2000527233 A JP 2000527233A JP 2000527233 A JP2000527233 A JP 2000527233A JP 3820103 B2 JP3820103 B2 JP 3820103B2
- Authority
- JP
- Japan
- Prior art keywords
- pharmaceutical composition
- ethyl
- weight
- transdermal device
- amount
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000003963 antioxidant agent Substances 0.000 title claims abstract description 13
- 230000003078 antioxidant effect Effects 0.000 title claims abstract description 11
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 52
- 235000006708 antioxidants Nutrition 0.000 claims abstract description 12
- 239000012458 free base Substances 0.000 claims abstract description 11
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims abstract description 10
- 239000002253 acid Substances 0.000 claims abstract description 9
- 150000003839 salts Chemical group 0.000 claims abstract description 6
- 239000000853 adhesive Substances 0.000 claims description 24
- 230000001070 adhesive effect Effects 0.000 claims description 23
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 claims description 20
- 229920001577 copolymer Polymers 0.000 claims description 8
- 229940087168 alpha tocopherol Drugs 0.000 claims description 7
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 claims description 7
- 229960000984 tocofersolan Drugs 0.000 claims description 7
- 229930003799 tocopherol Natural products 0.000 claims description 7
- 239000011732 tocopherol Substances 0.000 claims description 7
- 235000010384 tocopherol Nutrition 0.000 claims description 7
- 229960001295 tocopherol Drugs 0.000 claims description 7
- 235000004835 α-tocopherol Nutrition 0.000 claims description 7
- 239000002076 α-tocopherol Substances 0.000 claims description 7
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 claims description 4
- 229920000193 polymethacrylate Polymers 0.000 claims description 4
- 150000002148 esters Chemical class 0.000 claims description 3
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 claims description 2
- 235000010323 ascorbic acid Nutrition 0.000 claims description 2
- 229960005070 ascorbic acid Drugs 0.000 claims description 2
- 239000011668 ascorbic acid Substances 0.000 claims description 2
- 239000002585 base Substances 0.000 claims description 2
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 claims description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 claims 2
- 125000001020 α-tocopherol group Chemical group 0.000 claims 1
- 230000037317 transdermal delivery Effects 0.000 abstract 1
- 229920000642 polymer Polymers 0.000 description 40
- 229940126062 Compound A Drugs 0.000 description 38
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 38
- 239000010410 layer Substances 0.000 description 32
- 239000000203 mixture Substances 0.000 description 19
- 239000011159 matrix material Substances 0.000 description 11
- -1 Polyoxyethylene Polymers 0.000 description 9
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 9
- 229910052710 silicon Inorganic materials 0.000 description 9
- 239000010703 silicon Substances 0.000 description 9
- 239000000654 additive Substances 0.000 description 7
- 229920000139 polyethylene terephthalate Polymers 0.000 description 7
- 239000005020 polyethylene terephthalate Substances 0.000 description 7
- 229920005989 resin Polymers 0.000 description 7
- 239000011347 resin Substances 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 239000007857 degradation product Substances 0.000 description 6
- 229920000058 polyacrylate Polymers 0.000 description 6
- 235000014113 dietary fatty acids Nutrition 0.000 description 5
- 239000003085 diluting agent Substances 0.000 description 5
- 125000004185 ester group Chemical group 0.000 description 5
- 239000000194 fatty acid Substances 0.000 description 5
- 229930195729 fatty acid Natural products 0.000 description 5
- 239000011888 foil Substances 0.000 description 5
- 229920001477 hydrophilic polymer Polymers 0.000 description 5
- 239000004820 Pressure-sensitive adhesive Substances 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 3
- 239000004606 Fillers/Extenders Substances 0.000 description 3
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 3
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 3
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 125000002091 cationic group Chemical group 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N ethylene glycol Natural products OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 239000003961 penetration enhancing agent Substances 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 239000013464 silicone adhesive Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 2
- RFVNOJDQRGSOEL-UHFFFAOYSA-N 2-hydroxyethyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCO RFVNOJDQRGSOEL-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- MMOXZBCLCQITDF-UHFFFAOYSA-N N,N-diethyl-m-toluamide Chemical compound CCN(CC)C(=O)C1=CC=CC(C)=C1 MMOXZBCLCQITDF-UHFFFAOYSA-N 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 239000012790 adhesive layer Substances 0.000 description 2
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 2
- 125000005907 alkyl ester group Chemical group 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 2
- 150000002734 metacrylic acid derivatives Chemical class 0.000 description 2
- 238000000034 method Methods 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- BSCCSDNZEIHXOK-UHFFFAOYSA-N phenyl carbamate Chemical compound NC(=O)OC1=CC=CC=C1 BSCCSDNZEIHXOK-UHFFFAOYSA-N 0.000 description 2
- 239000004014 plasticizer Substances 0.000 description 2
- 239000008389 polyethoxylated castor oil Substances 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- FFJCNSLCJOQHKM-CLFAGFIQSA-N (z)-1-[(z)-octadec-9-enoxy]octadec-9-ene Chemical compound CCCCCCCC\C=C/CCCCCCCCOCCCCCCCC\C=C/CCCCCCCC FFJCNSLCJOQHKM-CLFAGFIQSA-N 0.000 description 1
- FDCJDKXCCYFOCV-UHFFFAOYSA-N 1-hexadecoxyhexadecane Chemical compound CCCCCCCCCCCCCCCCOCCCCCCCCCCCCCCCC FDCJDKXCCYFOCV-UHFFFAOYSA-N 0.000 description 1
- GOXQRTZXKQZDDN-UHFFFAOYSA-N 2-Ethylhexyl acrylate Chemical compound CCCCC(CC)COC(=O)C=C GOXQRTZXKQZDDN-UHFFFAOYSA-N 0.000 description 1
- XLMXUUQMSMKFMH-UZRURVBFSA-N 2-hydroxyethyl (z,12r)-12-hydroxyoctadec-9-enoate Chemical compound CCCCCC[C@@H](O)C\C=C/CCCCCCCC(=O)OCCO XLMXUUQMSMKFMH-UZRURVBFSA-N 0.000 description 1
- HBTAOSGHCXUEKI-UHFFFAOYSA-N 4-chloro-n,n-dimethyl-3-nitrobenzenesulfonamide Chemical compound CN(C)S(=O)(=O)C1=CC=C(Cl)C([N+]([O-])=O)=C1 HBTAOSGHCXUEKI-UHFFFAOYSA-N 0.000 description 1
- 102000012440 Acetylcholinesterase Human genes 0.000 description 1
- 108010022752 Acetylcholinesterase Proteins 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 229920002799 BoPET Polymers 0.000 description 1
- QYOVMAREBTZLBT-KTKRTIGZSA-N CCCCCCCC\C=C/CCCCCCCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO Chemical compound CCCCCCCC\C=C/CCCCCCCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO QYOVMAREBTZLBT-KTKRTIGZSA-N 0.000 description 1
- ZAKOWWREFLAJOT-CEFNRUSXSA-N D-alpha-tocopherylacetate Chemical compound CC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-CEFNRUSXSA-N 0.000 description 1
- XTJFFFGAUHQWII-UHFFFAOYSA-N Dibutyl adipate Chemical compound CCCCOC(=O)CCCCC(=O)OCCCC XTJFFFGAUHQWII-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical class CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 229920003149 Eudragit® E 100 Polymers 0.000 description 1
- 229920003155 Eudragit® RL 100 Polymers 0.000 description 1
- 229920003159 Eudragit® RS 100 Polymers 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- 229920002685 Polyoxyl 35CastorOil Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 229940022698 acetylcholinesterase Drugs 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- SOGAXMICEFXMKE-UHFFFAOYSA-N alpha-Methyl-n-butyl acrylate Natural products CCCCOC(=O)C(C)=C SOGAXMICEFXMKE-UHFFFAOYSA-N 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- JPNZKPRONVOMLL-UHFFFAOYSA-N azane;octadecanoic acid Chemical class [NH4+].CCCCCCCCCCCCCCCCCC([O-])=O JPNZKPRONVOMLL-UHFFFAOYSA-N 0.000 description 1
- NEDGUIRITORSKL-UHFFFAOYSA-N butyl 2-methylprop-2-enoate;2-(dimethylamino)ethyl 2-methylprop-2-enoate;methyl 2-methylprop-2-enoate Chemical compound COC(=O)C(C)=C.CCCCOC(=O)C(C)=C.CN(C)CCOC(=O)C(C)=C NEDGUIRITORSKL-UHFFFAOYSA-N 0.000 description 1
- CQEYYJKEWSMYFG-UHFFFAOYSA-N butyl acrylate Chemical compound CCCCOC(=O)C=C CQEYYJKEWSMYFG-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 239000001913 cellulose Chemical class 0.000 description 1
- 229920002678 cellulose Chemical class 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- DTPCFIHYWYONMD-UHFFFAOYSA-N decaethylene glycol Polymers OCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO DTPCFIHYWYONMD-UHFFFAOYSA-N 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 229940031578 diisopropyl adipate Drugs 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 239000000806 elastomer Substances 0.000 description 1
- YMBNBZFZTXCWDV-UHFFFAOYSA-N ethane-1,2-diol;propane-1,2,3-triol Chemical compound OCCO.OCC(O)CO YMBNBZFZTXCWDV-UHFFFAOYSA-N 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940074047 glyceryl cocoate Drugs 0.000 description 1
- 125000003976 glyceryl group Chemical group [H]C([*])([H])C(O[H])([H])C(O[H])([H])[H] 0.000 description 1
- 229940100242 glycol stearate Drugs 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 235000019426 modified starch Nutrition 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- BARWIPMJPCRCTP-CLFAGFIQSA-N oleyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCCOC(=O)CCCCCCC\C=C/CCCCCCCC BARWIPMJPCRCTP-CLFAGFIQSA-N 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 238000010525 oxidative degradation reaction Methods 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- QUANRIQJNFHVEU-UHFFFAOYSA-N oxirane;propane-1,2,3-triol Chemical compound C1CO1.OCC(O)CO QUANRIQJNFHVEU-UHFFFAOYSA-N 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 239000012466 permeate Substances 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical class OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 1
- 239000011505 plaster Substances 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- WBHHMMIMDMUBKC-QJWNTBNXSA-M ricinoleate Chemical compound CCCCCC[C@@H](O)C\C=C/CCCCCCCC([O-])=O WBHHMMIMDMUBKC-QJWNTBNXSA-M 0.000 description 1
- 229940066675 ricinoleate Drugs 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000000935 solvent evaporation Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229940042585 tocopherol acetate Drugs 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 230000037303 wrinkles Effects 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
- A61K9/7038—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer
- A61K9/7046—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds
- A61K9/7053—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds obtained by reactions only involving carbon to carbon unsaturated bonds, e.g. polyvinyl, polyisobutylene, polystyrene
- A61K9/7061—Polyacrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/27—Esters, e.g. nitroglycerine, selenocyanates of carbamic or thiocarbamic acids, meprobamate, carbachol, neostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Emergency Medicine (AREA)
- Neurology (AREA)
- General Chemical & Material Sciences (AREA)
- Hospice & Palliative Care (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Psychiatry (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Food Preservation Except Freezing, Refrigeration, And Drying (AREA)
- Anti-Oxidant Or Stabilizer Compositions (AREA)
- Fats And Perfumes (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Dental Preparations (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
本発明は、フェニルカルバメートの、例えば、経皮投与による全身投与のための医薬組成物に関する。特に、本発明は、その内容を本明細書に引用して包含させる公開イギリス特許出願GB2203040に記載の遊離塩基または酸付加塩形のフェニルカルバメート − (S)−N−エチル−3−[1−ジメチルアミノ)エチル]−N−メチル−フェニル−カルバメート(以後化合物Aと呼ぶ) − の医薬組成物に関する。
【0002】
化合物Aは、例えば、アルツハイマー病の処置のための、中枢神経系におけるアセチルコリンエステラーゼの阻害に有用である。
パッチの形の経皮組成物は、GB2,203,040の実施例2に記載され、それによると化合物Aを二つのポリマーおよび可塑剤と混合し、粘性塊を形成させる。この塊を、パッチに切断するホイルに適用する。
【0003】
徹底的な試験の後、化合物Aが、特に酸素の存在下、分解に感受性であることが、判明した。GB2203040に記載の経皮組成物は、化合物Aの周りの封鎖的ポリマーマトリックスの形成および気密包装内での貯蔵にかかわらず、恐らく酸化的分解により、分解されることが判明した。
【0004】
本発明は、化合物Aを含む安定な医薬組成物が得られ、それは、標準試験、例えば、ストレス試験により示されるように、長期間、例えば、2年間にわたり化合物Aの有意でない分解を示すことを発見した。
【0005】
一つの態様において、本発明は遊離塩基または酸付加塩形の化合物Aおよび抗酸化剤を含む、医薬組成物を提供する。
本発明の医薬組成物は、ストレス安定性試験において、分解副産物の減少を示す。
【0006】
本発明の医薬組成物は、例えば、1から40重量%、例えば、10−35%、より具体的には20−35%、例えば、30%の高用量の化合物Aを含み得る。
化合物Aは、当分野で既知の任意の広範な薬学的希釈剤および担体中に存在し得る。希釈剤または担体は、本発明の医薬組成物の安定性に影響することなく、痕跡量の遊離ラジカルを含み得る。
【0007】
希釈剤または担体は、好ましくは1個またはそれ以上のポリマー、より好ましくは親水性ポリマーまたは複数のポリマーである。好ましい態様において、希釈剤または担体は、アクリレートポリマーから選択される少なくとも一つのポリマー、およびポリメタクリレートポリマーから選択される。ポリマーは、好ましくは、約50,000から約300,000ダルトン、例えば、100,000から200,000ダルトンの平均分子量を有する。ポリマーは、好ましくはフィルムを形成でき、したがって、皮膚に適合する。
【0008】
ポリマーとして、特に、アクリレートコポリマー、例えば、ブチルアクリレート、エチルヘキシルアクリレートおよびビニルアセテートのコポリマーを特記できる。好ましくは、ポリマーは架橋している。好ましいアクリレートポリマーは、National Starch and Chemical Company, Zutphen, Hollandから入手可能なDurotak銘柄の一つ、例えばDurotak 87-2353(以後、ポリマーA)、387-2051または387-2052(以後、ポリマーD)である。
【0009】
希釈剤または担体は、医薬組成物の総重量を基本にして、好ましくは90重量%まで、より好ましくは70重量%の量で存在する。
ポリマーは、親水性ポリマーのとき、簡便には水を吸収し、水、例えば、皮膚からの水分を透過するが、ポリマーは水に不溶性であり得る。ポリマーは膨張し得、大量の薬理活性剤の放出を提供し、4から7のpH、好ましくは皮膚pH、例えば、5.5付近で、皮膚表面と解質層の間に薬理活性剤の高い濃度勾配を導く。所望により、このようなポリマーは有機溶媒に可溶性であり得る。
【0010】
適当なポリマーの例は、ポリアクリルアミドおよびそのコポリマー、ポリビニルピロリドン(PVP)、ビニルアセテート/ビニルアルコールコポリマー、ポリビニルアルコール(PVA)および誘導体、エチルセルロースならびに他のセルロース誘導体および澱粉誘導体を含む。
【0011】
親水性ポリアクリレートが好ましいポリマーである。ポリアクリレートは置換され得、例えば、メタクリレートである。それらは、商品として入手可能なアクリレート/メタクリレートコポリマーであり得る。酸基のいくつか、または全てを、例えば、アルキル(C1−10)基、より具体的にはメチル基またはエチル基のような1から4個の炭素原子を有するアルキル基でエステル化し得る。
【0012】
商品として入手可能なこのタイプのポリマーの例は以下のものを含む:
1)アルキル(C1−4)エステル基を含むメタクリレートのポリマー。好ましくは、ポリマーマトリックスはアクリレートポリマーとメタクリレートポリマーの、例えば、5:1から1:1、例えば、4:1から2:1、例えば、3:1の重量比の混合物、例えば、ブチルメチルアクリレートとメチルメチルアクリレートの混合物である。MW20000、例えば、Roehm, Darmstadt, GermanyのPlastoid B(以後、ポリマーB)。
【0013】
2)メチルおよびエチル中性エステル基ならびにトリメチルアミノエチルカチオン性エステル基を含む、アクリレートおよびメタクリレートエステルのポリマー。塩化物イオンが存在し得る。平均分子量150000ダルトン。粘性(20℃)、最大15cP。屈折率1.380−1.385。密度0.815−0.835g/cm3。アルキル基を中和するためのカチオン性エステル基の比率1:20は28.1mg KOH/gポリマーのアルカリ価となり(Eudragit RL 100、Roehmから入手可能な登録商標)または1:40は15.2mg KOH/gポリマーのアルカリ価となる(Eudragit RS 100、またRoehmから入手可能な登録商標)。
【0014】
3)トリメチルアミノエチルカチオン性エステル基および他の中性(C1−4)アルキルエステル基を含むメタクリレートエステルのポリマー。塩化物イオンが存在し得る。平均分子量150,000。粘性(20℃)10cP。屈折率1.38。密度0.815。180mg KOH/gポリマーのアルカリ価(Eudragit E 100、登録商標、またRoehmから入手可能であり、以後ポリマーCと呼ぶ)。
【0015】
所望により、本医薬組成物は、例えば、医薬組成物に柔軟性を提供するための、および/または化合物Aを部分的にまたは完全に溶解するための、可塑剤および/または柔軟剤、好ましくは皮膚適合性界面活性剤のような他の添加剤を含み得る。
【0016】
添加剤の例は以下のものを含む:
1)ポリオキシエチレン脂肪族アルコールエーテル。アルコールは、例えば、C12−C18アルコールであり得る。HLB値は、例えば10から18であり得る。好ましい例は、ポリオキシエチレン−(10)オレイルエーテルである。適当なエーテルは、約100cPの粘性(25℃)、約16℃の凝固点、12.4のHLB値および最大1.0の酸価を有し得る(Brij 97, Atlas Chemie, Germanyから入手可能な登録商標)。
【0017】
2)ポリオキシエチレンソルビタン脂肪酸エステル。脂肪酸は、例えば、C12−C18脂肪酸であり得る。HLB値は、例えば、10から18であり得る。好ましい例は、ポリオキシエチレン−(20)ソルビタンモノオレエート、例えば、Atlas Chemie, Germanyの登録商標、Tween 80である。
【0018】
3)ポリオキシエチレン−(5−40)ステアリン酸エステル、例えば、Atlas Chemie, Germanyから入手可能なMyrj(登録商標)。
4)ポリオキシエチレングリコール脂肪族アルコールエーテル、例えば、ポリエチレングリコール(6−25)セチルエーテル、グリセリンポリエチレンリシノレート、グリセリンポリエチレングリコールステアレート(Cremophor銘柄、BASF Germanyから入手可能な登録商標)。
【0019】
5)MW200から600ダルトン、例えば、300または400ダルトンのポリオキシエチレングリコール。
6)少なくとも一つのヒドロキシ基および脂肪族(C6−22)カルボン酸を有するポリ(2−7)エチレングリコールグリセロールエーテルのエステル、例えば、ポリエチレングリコール−(7)グリセリルココエート、例えば、Cetiol HE, Henkel, Germanyから入手可能な登録商標)。
【0020】
7)アジピン酸低級アルキルエステル、例えば、アジビン酸ジ−n−ブチルおよびアジビン酸ジイソプロピル。
8)グリセリンポリエチレングリコールリシノレート、例えば、35モル酸化エチレンとヒマシ油の製品、例えば、銘柄Cremophor EL, BASF, Germanyから入手可能な登録商標。
【0021】
9)トリアセチン−(1,2,3)。
10)脂肪酸、例えば、C12−18脂肪酸。
11)脂肪族アルコール、例えば、C12−18脂肪族アルコール。
【0022】
必要な添加剤の量およびタイプは、多くの因子、例えば、界面活性剤のHLB値および必要な医薬の柔軟性に依存し得る。添加剤の量は、ポリアクリレートがフィルムを形成する能力に有意に影響しない。一般に、界面活性剤対ポリマーの重量比は約1:10から5:1、例えば、1:10から1:3であり得る。
【0023】
好ましくは、しかし、このような添加剤は存在しないか、または、医薬組成物の総重量を基本にして、1重量%より少ない量でのみ存在する。
医薬組成物は、皮膚浸透促進剤、例えば、1−ドデシルアザシクロヘプタン−2−オン(アゾン)およびN,N−ジエチル−m−トルアミド(DEET)を含み得る。
【0024】
存在する皮膚浸透プロモーターおよび/または添加剤の量およびタイプは、多くの因子に依存し得る。一般に、皮膚浸透促進剤対親水性ポリマーの重量比は約1:1から1:10である。好ましくは、界面活性剤および/または皮膚浸透促進剤の量は、医薬組成物の約3から約50重量%、好ましくは20から40重量%であり得る。
好ましくは、しかし、このような添加剤は存在しないか、または、医薬組成物の総重量を基本にして、1重量%より少ない量でのみ存在する。
【0025】
所望により、医薬組成物は疎水性エラストマー、例えば、合成樹脂を含み得る。このような樹脂は、硬膏分野で慣用である。適当な樹脂は、非膨張性アクリレート樹脂を含み得る。これらは、所望により粘着性であり得る。ポリマー、例えば親水性ポリマー対樹脂の重量比は、例えば、1:0.5から1:10であり得る。樹脂は、例えば、約50から100℃の軟化点の修飾剤、エクステンダーを含み得る。このようなエクステンダーは、粘着性または軟化特性を有し得る。このようなエクステンダーの例は、樹脂酸、樹脂酸のグリセリルおよびフタレートエステルを含み得る。
【0026】
本発明の好ましい医薬組成物は
a)20から40重量%の量の、遊離塩基形の化合物Aである(S)−N−エチル−3−[1−ジメチルアミノ)エチル]−N−メチル−フェニル−カルバメート、
b)10から30重量%の量のポリメタクリレート、
c)40から60重量%の量のアクリレートコポリマー、および
d)0.05から0.3重量%の間の量のα−トコフェロール
(医薬組成物の合計重量は100%である)
を含む。
【0027】
本発明の他の態様において、化合物Aを含む医薬組成物の安定化のための抗酸化剤の使用を提供する。
【0028】
抗酸化剤が本発明の組成物に必要であるという本出願人による発見の前は、従来不要であると考えられていた。
【0029】
本出願人は、有効な安定化作用が、抗酸化剤を、トコフェロール、酢酸トコフェロールのようなそのエステル、アスコルビルパルミテート、アスコルビン酸、ブチルヒドロキシトルエン、ブチルヒドロキシアニソールまたは没食子酸プロピル、好ましくはα−トコフェロールまたはアスコルビルパルミテートから選択したとき、驚くべきことに達成されることを発見した。抗酸化剤は、簡便には、医薬組成物の重量を基本にして、約0.01から約0.5%、例えば、0.05から0.20、例えば、0.15%、より具体的には0.1重量%で存在し得る。
【0030】
例として、0.1%トコフェロールを含む、下記の実施例1の方法と同様に製造した本発明の医薬組成物は、60℃で、2ヶ月ストレス試験で、トコフェロールを含まない同等な組成物の4.46%の分解産物と比較して、わずか1.3%の分解産物を示す。0.15%トコフェロールを含む、下記の実施例1の方法と同様に製造した本発明の医薬組成物は、40℃で75%室内湿度の、3ヶ月ストレス試験で、トコフェロールを含まない同等な組成物の1.09%の分解産物と比較して、わずか0.25%の分解産物を示す。
本発明の医薬組成物は、好ましくは経皮適用に使用される。
【0031】
本発明の他の態様において、化合物Aを含む医薬組成物、当該医薬組成物の支持を提供する裏打ち層、医薬組成物を裏打ち層に固定するための接着剤および当該接着剤と剥離可能に接着した剥離性ライナーを含む、化合物Aの投与のための経皮デバイスを提供する。
【0032】
医薬組成物は、簡便には別の薄層に含まれ、その上部および下部表面は接着剤の層で被覆され得、次にその表面は裏打ち層および剥離性ライナー接触表面を提供する。
【0033】
別の層に包含された医薬組成物は、ポリマーマトリックス内に化合物Aおよび他の賦形剤を含み得、そのためのポリマーマトリックスは上記の希釈剤または担体により提供される。所望により、化合物Aは該ポリマーマトリックスを通って分散するか、その中に溶解し得る。
【0034】
経皮デバイスは、あるいは、医薬組成物を含むポリマーマトリックスが、更に、接着剤を含むより単純な構造であり得る。このような単純な構造において、裏打ち層および剥離性ライナーを、各々固定するまたは離せるように固定するための上記接着剤の層は、化合物A含有ポリマーマトリックスが、自己接着剤であるため、必要ではない。
【0035】
経皮デバイス内の医薬組成物層の厚さは、20から100μm、より好ましくは60から100の範囲であり得る。
【0036】
裏打ち層は、好ましくはポリ(エチレンテレフタレート)PETホイルから成る。裏打ち層は、長期間の貯蔵において、および患者の皮膚への移動を通して発生し得るしわに十分耐性でなければならない。典型的に、裏打ち層は、例えば、約10μmから15μmの厚さである。
【0037】
好ましい態様において、裏打ち層は、前記のPET層およびEVA層から成る2重層、例えば、Scotch Pack 1012である。
剥離性ライナーは、その適用前の医薬組成物の保護のために働く使い捨てエレメントであり得る。典型的に、剥離性ライナーは化合物Aおよび接着剤を透過しない物質から製造する。この剥離性ライナーは、容易に接着剤から剥ぎ取り得る。好ましい剥離性ライナーは、ポリ(エチレンテレフタレート)PETホイルから成る。例えば、約50から250μm、例えば、100μmの厚さのPETフィルムの剥離性ライナーを、医薬組成物上に適用し得る。
【0038】
放出ライナーは、シリコンコーティングし得る。該コーティングは、好ましくは、当分野で慣用的に使用されるフルオロシリコン化合物の形、例えば、ポリフルオロアルキルシロキサンである。
【0039】
医薬組成物を剥離性ライナーに貼るのに使用する接着剤が、それ自体シリコン接着剤でないとき、このようなフルオロシリコンコーティングを用いることが特に好ましい。
【0040】
接着剤は皮膚接触に適した接着剤から選択され得、好ましくは、少なくとも部分的に化合物Aが溶解する接着剤である。好ましくは、接着剤は感圧性である接触接着剤である。好ましい接着剤は、当分野で既知のアミン耐性シリコン感圧性接着剤から選択され、例えば、Dow Corning Corporationが製造のBIO-PSA接着剤、特にBIO-PSA Q7-4302である。
経皮デバイスの非常に単純な構造において、接着剤は実際ポリマーマトリックスのポリマーであり得る。
【0041】
更なる態様において、本発明は裏打ち層、ポリマーマトリックス内に化合物Aを含む層、剥離性ライナーおよび、ポリマーマトリックス内の化合物A含有層と剥離性ライナーの間に位置する、該経皮デバイスを患者の皮膚に剥離可能に固定するための接着物質の別個の層を含む、経皮デバイスを提供する。
好ましくは、接着物質は上記のようなアミン耐性シリコン感圧性接着剤から選択されるシリコン接着剤である。
【0042】
典型的に、該更なる態様の経皮デバイスは:
a)ポリメタクリレート裏打ち層
b)アクリレートコポリマー内の遊離塩基形の化合物A
c)BIO-PSA Q7-4302シリコン接着層
d)剥離性ライナー
を含む。
【0043】
一般に、本発明の経皮デバイスは、単純な方法で製造し得る。溶媒蒸発法を該組成物に使用し得る。このように、医薬組成物の全ての成分を溶媒、例えば、アセトン、酢酸エチルまたはヘキサン中で混合し、裏打ち層または放出ライナーとして作用し得る支持体上で成型し得る。
【0044】
上記経皮デバイスは、簡便には連続シートに形成し、使用前に所望のサイズまたは形態のパッチに切る。しかし、このように形成したパッチは、積層物の医薬組成物含有層を、パッチの端で大気に曝し得る。
【0045】
しかし、別の態様において、パッチをそこから形成し、医薬組成物を貯蔵中または適用中に大気に曝さない経皮デバイスが提供される。このようなパッチは、化合物Aが酸化的作用に曝される可能性を更に減少させる。経皮デバイスは、例えば、とぎれていない裏打ち層、とぎれていない剥離性ライナーおよびその間の別個に位置に位置する医薬組成物部分、裏打ち層の内部表面と剥離性ライナーの内部表面により画定されるポケットに該医薬組成物を密封するために、接着剤で剥離性ライナーとはなせるように固定し得るように形成された裏打ち層を含む。本態様は、簡便にはカバーパッチと呼ばれ得る。
【0046】
上記のポケットは、好ましくは接着剤で充填され、医薬組成物の別個の部分を完全に封入する。好ましくは、接着剤は上記のようなシリコン感圧性接着剤である。
【0047】
それらが医薬組成物と剥離性ライナーの間に接着層を含むのは、全ての上記経皮デバイスの任意の性質である。剥離性ライナーをデバイスの残りと接触させて固定する主な機能を有し、したがって、使用前に医薬組成物を保護する。しかし、接着剤がシリコン接着剤の場合、層は、化合物Aが制御された速度で皮膚を介して患者まで通過し得る膜として更に働き得る。特定の理論に縛られることなく、ポリマーマトリックス内に分散されている化合物Aが、貯蔵の間にシリコン接着層に移動する傾向が殆どないことが示される。したがって、シリコン層に相対的に低い濃度の化合物Aが存在する。使用に際し、患者皮膚は、しかし、化合物Aにシリコン層より高い親和性を示し得、シリコン層中の最初の低い濃度の化合物Aは患者体内に進む。シリコン層は、驚くべきことに、デバイスの適用により、患者が急激に高濃度の化合物Aを受けることを防止し、代わりに、患者における徐々の増加を促進する。
【0048】
カバーパッチ経皮デバイスは、簡便には連続シートまたは力布として形成され得、使用前にパッチに切断し得、または各デバイスを分ける壊れやすい領域に沿って裂け得るが、このようなパッチは別個のパッチで提供し得る。
【0049】
本発明の経皮デバイスは、一般に、例えば、約1から約80cm2、好ましくは約10cm2の皮膚上の医薬組成物の有効な接触部位を有し、1から7日毎、好ましくは1−3日毎に一度の間隔での適用が意図される。化合物Aは、12mgが吸収された36mg化合物Aを含む本発明のパッチの80cm2中で、遊離塩基形で36mgの用量で十分耐容性である。化合物Aは、例えば、約10cm2のパッチに8mgの用量で、1日1回投与し得る。パッチは、例えば、腹部、腿、耳の後ろ、または肩または上腕に適用し得る。
【0050】
本発明の、所望により経皮デバイスとして形成される医薬組成物は、化合物Aを含む既知の組成物と同じ処方に有用である。投与する化合物Aの正確な量は、多くの因子、例えば、組成物の医薬放出特性、インビトロおよびインビボ試験で観察される医薬浸透速度、必要な作用の期間、化合物Aの形および、経皮組成物に関して、皮膚接触領域のサイズおよびユニットを固定する体の部分に依存し得る。組成物の量および、例えば、領域等は、無傷の皮膚への本発明の組成物中の化合物Aの投与後の活性剤の血中濃度および本化合物の治療的有効量の経口投与後に観察される化合物Aの血中濃度を含む慣用のバイオアベイラビリティー試験により決定し得る。
【0051】
経口では、化合物Aは1日2回、経口投与の1.5mgの最初の投与量で耐容性であり、投与量は2週目に3mg、1日2回まで段階的に増加し得る。高投与量、例えば、4.5mg、1日2回および6mg1日2回でさえ可能である。耐容性は、24mgが24時間で吸収される経皮デバイスで幾分良好に見える。
以下の実施例は、本発明を説明する。
【0052】
実施例1
以下の成分(重量)を含む組成物を製造する
【表1】
【0053】
成分を酢酸エチルに添加し、混合して粘性の塊を得る。塊を100μm透明PETホイルに広げ、60μm厚のフィルムを作る。15μm厚のPETホイル剥離性ライナーを乾燥した塊の上に適用する。該パッチを10、20、30または40cm2の面積に切る。
ライナーを皮膚への適用前に除く。
本発明の組成物およびデバイスは、貯蔵安定システムを提供する。室温で6ヶ月貯蔵後に、分解がほとんど検出されない。
【0054】
実施例2
組成物を、α−トコフェロールの代わりにアスコルビルパルミテートで、実施例1にしたがって製造する。有意でない量の分解産物が、室温で少なくとも4ヶ月の貯蔵後に検出される。
【0055】
実施例3
組成物を、α−トコフェロール単独の代わりに、アスコルビルパルミテートとα−トコフェロールの混合物で、実施例1にしたがって製造する。有意でない量の分解産物が、室温で少なくとも4ヶ月の貯蔵後に検出される。
Claims (9)
- 遊離塩基形または酸付加塩形の(S)−N−エチル−3−[1−ジメチルアミノ)エチル]−N−メチル−フェニル−カルバメートおよび抗酸化剤を含む医薬組成物を含んでなる、経皮デバイス。
- ( S ) −N−エチル−3− [ 1−ジメチルアミノ ) エチル ] −N−メチル−フェニル−カルバメートが遊離塩基形である、請求項1に記載の経皮デバイス。
- 医薬組成物が1から40重量%の遊離塩基形または酸付加塩形の( S ) −N−エチル−3− [ 1−ジメチルアミノ ) エチル ] −N−メチル−フェニル−カルバメートを含む、請求項1または2に記載の経皮デバイス。
- 抗酸化剤がトコフェロール、そのエステル、アスコルビン酸、ブチルヒドロキシトルエン、ブチルヒドロキシアニソールまたは没食子酸プロピルである、請求項1から3のいずれかに記載の経皮デバイス。
- 抗酸化剤がα−トコフェロールである、請求項1から4のいずれかに記載の経皮デバイス。
- 抗酸化剤が、医薬組成物の重量を基本にして、0.01から0.5重量%の量で存在する、請求項1から5のいずれかに記載の経皮デバイス。
- 抗酸化剤としてのトコフェロールが医薬組成物の重量を基本にして0.1重量%の量で存在する、請求項1から6のいずれかに記載の経皮デバイス。
- a)20から40重量%の量の、遊離塩基形の(S)−N−エチル−3−[1−ジメチルアミノ)エチル]−N−メチル−フェニル−カルバメート、
b)10から30重量%の量のポリメタクリレート、
c)40から60重量%の量のアクリレートコポリマー、および
d)0.05から0.3重量%の量のα−トコフェロール
ただし、医薬組成物の合計重量は100%である
からなる医薬組成物を含む、請求項1記載の経皮デバイス。 - 遊離塩基形または酸付加塩形の ( S ) −N−エチル−3− [ 1−ジメチルアミノ ) エチル ] −N−メチル−フェニル−カルバメートおよび抗酸化剤を含む医薬組成物、当該医薬組成物の支持のための裏打ち層、当該医薬組成物を裏打ち層に接触させ、固定するための接着剤および当該接着剤に剥離可能に接触した剥離性ライナーを含む、経皮デバイス。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB9800526.7 | 1998-01-12 | ||
| GBGB9800526.7A GB9800526D0 (en) | 1998-01-12 | 1998-01-12 | Organic compounds |
| PCT/EP1999/000078 WO1999034782A1 (en) | 1998-01-12 | 1999-01-08 | Tts containing an antioxidant |
Publications (4)
| Publication Number | Publication Date |
|---|---|
| JP2002500178A JP2002500178A (ja) | 2002-01-08 |
| JP2002500178A5 JP2002500178A5 (ja) | 2006-06-22 |
| JP3820103B2 true JP3820103B2 (ja) | 2006-09-13 |
| JP3820103B6 JP3820103B6 (ja) | 2006-11-22 |
Family
ID=
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014034939A1 (ja) | 2012-09-03 | 2014-03-06 | ニプロパッチ株式会社 | 貼付剤 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014034939A1 (ja) | 2012-09-03 | 2014-03-06 | ニプロパッチ株式会社 | 貼付剤 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6335031B1 (en) | TTS containing an antioxidant | |
| KR101674240B1 (ko) | 리바스티그민 또는 그의 유도체 투여용 경피 치료 시스템 | |
| ES2657887T3 (es) | Preparación adhesiva | |
| EP0155229B1 (en) | Pharmaceutical compositions | |
| KR101942677B1 (ko) | 첩부제 | |
| JP4874486B2 (ja) | 気管支拡張剤ツロブテロールを皮膚から投与するための塩酸ツロブテロールを含む経皮治療システム | |
| KR20180054833A (ko) | 첩부제 | |
| US6316023B1 (en) | TTS containing an antioxidant | |
| EP1731143B1 (en) | Percutaneous absorption-type pharmaceutical preparation using a metal chloride, preferably sodium chloride, for preventing cohesive failure | |
| US20140336253A1 (en) | Composition for transdermal administration of rivastigmine | |
| CN112915071A (zh) | 一种含有美金刚的透皮贴剂 | |
| JP3820103B6 (ja) | 抗酸化剤含有tts | |
| KR101764930B1 (ko) | 셀레길린-함유 접착 제제 | |
| RU2618413C1 (ru) | Трансдермальная система, содержащая нестероидное противовоспалительное лекарственное средство | |
| JP2002500178A5 (ja) | ||
| EP2371360B1 (en) | Selegiline-containing adhesive preparation | |
| HK1034036B (en) | Tts containing an antioxidant | |
| US20030175330A1 (en) | Transdermal therapeutical system with a reduced tendency of the active substance to crystallize | |
| HK1170945A (en) | Transdermal therapeutic system for administering rivastigmine or derivatives thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20051201 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20060104 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060117 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20060413 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20060413 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20060613 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20060616 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 3820103 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R154 | Certificate of patent or utility model (reissue) |
Free format text: JAPANESE INTERMEDIATE CODE: R154 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100623 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110623 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110623 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120623 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120623 Year of fee payment: 6 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120623 Year of fee payment: 6 |
|
| S202 | Request for registration of non-exclusive licence |
Free format text: JAPANESE INTERMEDIATE CODE: R315201 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120623 Year of fee payment: 6 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| S202 | Request for registration of non-exclusive licence |
Free format text: JAPANESE INTERMEDIATE CODE: R315201 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120623 Year of fee payment: 6 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120623 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130623 Year of fee payment: 7 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130623 Year of fee payment: 7 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |