JP2025511684A - 新規ペプチドベースの免疫抗癌剤 - Google Patents
新規ペプチドベースの免疫抗癌剤 Download PDFInfo
- Publication number
- JP2025511684A JP2025511684A JP2024559077A JP2024559077A JP2025511684A JP 2025511684 A JP2025511684 A JP 2025511684A JP 2024559077 A JP2024559077 A JP 2024559077A JP 2024559077 A JP2024559077 A JP 2024559077A JP 2025511684 A JP2025511684 A JP 2025511684A
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- tumor
- macrophages
- melittin
- itgb2
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/55—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound the modifying agent being also a pharmacologically or therapeutically active agent, i.e. the entire conjugate being a codrug, i.e. a dimer, oligomer or polymer of pharmacologically or therapeutically active compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1767—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/6425—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the peptide or protein in the drug conjugate being a receptor, e.g. CD4, a cell surface antigen, i.e. not a peptide ligand targeting the antigen, or a cell surface determinant, i.e. a part of the surface of a cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/65—Peptidic linkers, binders or spacers, e.g. peptidic enzyme-labile linkers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68031—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being an auristatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/43504—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates
- C07K14/43563—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from insects
- C07K14/43572—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from insects from bees
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4747—Apoptosis related proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70546—Integrin superfamily
- C07K14/70553—Integrin beta2-subunit-containing molecules, e.g. CD11, CD18
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2839—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the integrin superfamily
- C07K16/2845—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the integrin superfamily against integrin beta2-subunit-containing molecules, e.g. CD11, CD18
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57492—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving compounds localized on the membrane of tumor or cancer cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70546—Integrin superfamily, e.g. VLAs, leuCAM, GPIIb/GPIIIa, LPAM
- G01N2333/70553—Integrin beta2-subunit-containing molecules, e.g. CD11, CD18
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/04—Screening involving studying the effect of compounds C directly on molecule A (e.g. C are potential ligands for a receptor A, or potential substrates for an enzyme A)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Cell Biology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Oncology (AREA)
- Toxicology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Hospice & Palliative Care (AREA)
- Insects & Arthropods (AREA)
- Tropical Medicine & Parasitology (AREA)
Abstract
本発明は、新規ペプチドベースの免疫抗癌剤に関するものであって、メリチン、その変異体またはこれらの類似体、またはこれらと薬物が連結された複合体の免疫抗癌剤用途に関するものであって、本発明におけるメリチン、その変異体またはこれらの類似体は、M2腫瘍関連マクロファージの細胞膜に発現されるITGB2に特異的に結合し、M2腫瘍関連マクロファージを死滅させ、メリチン、その変異体またはこれらの類似体に薬物としてプロアポトーシス性ペプチドまたは抗癌剤が結合された複合体が前記のM2腫瘍関連マクロファージのアポトーシス効果を著しく増加させるため、これを腫瘍の生長と転移を抑制用抗癌組成物として活用することができる。
【選択図】図17
【選択図】図17
Description
本発明は、新規ペプチドベースの免疫抗癌剤に関するものであって、メリチン、その変異体またはこれらの類似体、またはこれらと薬物が結合された複合体の免疫抗癌剤の用途に関するものである。
既存の抗癌治療は、癌細胞を直接攻撃したり、癌細胞を攻撃する体内の免疫細胞の活性を強化させる方向で研究されてきた。しかし、このような抗癌剤は、癌細胞以外の他の正常な細胞もまた攻撃をし、脱毛、吐き気、嘔吐などの多くの副作用を引き起こし、免疫細胞の過度な増加による付加的な反応をもたらす。既存の化学的療法や放射線療法に比べて副作用を最小化することができる抗癌免疫療法は、体内の免疫システムを用いて癌を治療する方法であり、このような抗癌免疫療法の内には、治療用免疫細胞であるT細胞(CAR-T含む)、樹状細胞(Dendritic Cells)、ナチュラルキラー細胞(Natural Killer Cells)などを体外で活性化させた後に、体内に直接注入する細胞療法と癌抗原と免疫活性化物質を体内に注入することによって、体内に存在する免疫細胞を直接活性化することで抗癌効能を高める抗癌ワクチンに対する方法などが活発に進められている。しかし、このような細胞療法や癌ワクチンは、主に血液癌関連の疾患に主に用いられており、固形癌ではほとんどがその治療効能が極めて低いという短所がある。このような理由のうちの一つは、固形癌の周囲で免疫機能を抑制する微小環境要因に起因する。実際、腫瘍微小環境において、免疫細胞の機能を低下させる細胞(MDSC:myeoloid-derived stromal cells、Treg:regulatory T cell、TAM:tumor-assocaited macrophages)や免疫抑制誘発サイトカイン、代謝物などが活発に作用することによって、免疫活性化物質と治療用免疫細胞の活性を急激に低下させるものである。したがって、腫瘍細胞および免疫細胞に直接的な影響なしに腫瘍細胞の周囲の微小環境のみを調節し、腫瘍細胞への影響分供給、腫瘍細胞周囲の血管新生などを遮断し、抗癌効果を有する治療剤の開発が重要となっている。腫瘍微小環境は、悪性細胞の増殖および生存、血管新生、転移、異常な適応免疫およびホルモンおよび化学療法剤に対する反応減少に寄与し、治療目標として大いに考慮されている。
腫瘍周囲の微小環境(microenvironment)は、内皮細胞、炎症性細胞および線維芽細胞から構成されており、1970年代に腫瘍関連マクロファージ(tumor-associated macrophage、TAM)が腫瘍の成長において重要な役割を果たすことが明らかになった。腫瘍関連マクロファージは、癌の成長、転移などの全般的な腫瘍微小環境と関連し、重要な役割を担っており、腫瘍抑制M1型マクロファージまたは腫瘍支持M2型マクロファージの二つの表現型に分類される。M1型マクロファージは、抗原を提示する強力な能力を有し、一般にインターフェロン-γ、リポ多糖(LPS)、腫瘍壊死因子(TNF)-αによって活性化され、炎症誘発性作用および殺菌作用をする。M2型マクロファージは、多様な細胞外マトリックス成分、血管新生および走化性因子を放出することによって、免疫抑制、腫瘍形成および血管形成を促進することが知られている。一般に、IL-4とIL-13によって誘導され、アルギナーゼ-1、mannose(MMR、CD206)、スカベンジャー受容体(SR-A、CD204)、CD163、IL-10などのようなマーカーを発現することにより、M1型腫瘍関連マクロファージと区別される。腫瘍周囲に存在する腫瘍関連マクロファージは、腫瘍細胞の成長、転移と密接に関連しており、癌患者において、多数のM2型腫瘍関連マクロファージが腫瘍周囲に存在すると、患者の予後および生存率が良くないことが報告されている。2型マクロファージは、癌の成長を促進するIL-10、TGFβおよびCCL18のようなサイトカインを生成し、M2型腫瘍関連マクロファージの表面に存在するPDL1およびB7-1/2のような受容体は、T細胞、NK細胞の抗腫瘍活性を抑制することが報告されている。M2型腫瘍関連マクロファージが多量存在する微小環境では、腫瘍の成長、分化および転移が活発になされるので、M2型腫瘍関連マクロファージを標的とする標的治療剤の開発が必要である。
本発明の目的は、腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物を提供することである。
また、本発明の目的は、癌の予防または治療用薬学的組成物を提供することである。
また、本発明の目的は、癌の治療方法を提供することである。
併せて、本発明の目的は、本発明における結合体の癌の予防および治療用薬学的組成物の製造に用いるための用途を提供することである。
前記目的を達成するために、本発明は、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を有効成分として含む、腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物を提供する。
また、本発明は、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を有効成分として含む、癌の予防または治療用薬学的組成物を提供する。
また、本発明は、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を薬学的に有効な量で癌に罹患したオブジェクトに投与する段階を含む、癌の治療方法を提供する。
併せて、本発明は、癌の予防および治療用薬学的組成物の製造に用いるための、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体の用途を提供する。
本発明におけるメリチン、その変異体またはこれらの類似体は、M2腫瘍関連マクロファージの細胞膜に発現されるITGB2に特異的に結合し、M2腫瘍関連マクロファージを死滅させ、メリチン、その変異体またはこれらの類似体に薬物としてプロアポトーシス性ペプチドまたは抗癌剤が結合された複合体が、前記のM2腫瘍関連マクロファージのアポトーシス効果を著しく増加させるので、これを腫瘍の生長と転移の抑制用抗癌組成物として活用することができる。
以下、添付された図面を参照して本発明の具現例でもって本発明を詳細に説明する。但し、下記の具現例は、本発明に対する例示として提示されるものであり、当業者に周知著名な技術または構成に対する具体的な説明が本発明の要旨を不要に曖昧にするおそれがあると判断された場合には、その詳細な説明を省略することができ、これによって本発明が制限されるものではない。本発明は後述する特許請求の範囲の記載およびそれより解釈される均等範疇内で多様な変形及び応用が可能である。
また、本明細書にて使用される用語(terminology)は、本発明の好ましい実施例を適切に表現するために使用された用語であって、これは使用者、運用者の意図または本発明が属する分野の慣例などによって異なり得る。したがって、本用語に対する定義は、本明細書の全般にわたった内容に基づいて下されるべきである。明細書全体において、ある部分がある構成要素を「含む」とした時、これは特に相反する記載がない限り、他の構成要素を除外するものではなく、他の構成要素をさらに含むことができることを意味する。
本発明にて使用される全ての技術用語は、特に断りがない限り、本発明の関連分野における通常の当業者が一般に理解されることと同様の意味で使用される。また、本明細書には好適な方法または試料が記載されるが、これと類似または同等のものも本発明の範疇に含まれる。本明細書に参考文献として記載される全ての刊行物の内容は、本発明に組み込まれる。
本明細書の全体を通して、天然に存在するアミノ酸に対する通常の1文字および3文字のコードが用いられるだけでなく、Aib(α-アミノイソ酪酸)、Sar(N-methylglycine)などのような他のアミノ酸に対して一般的に許容される3文字のコードが使用される。また、本発明において、略語として言及されたアミノ酸は、次のようにIUPAC-IUB命名法に基づいて記載された:
アラニン:A、アルギニン:R、アスパラギン:N、アスパラギン酸:D、システイン:C、グルタミン酸:E、グルタミン:Q、グリシン:G、ヒスチジン:H、イソロイシン:I、ロイシン:L、リジン:K、メチオニン:M、フェニルアラニン:F、プロリン:P、セリン:S、トレオニン:T、トリプトファン:W、チロシン:Yおよびバリン:V。
アラニン:A、アルギニン:R、アスパラギン:N、アスパラギン酸:D、システイン:C、グルタミン酸:E、グルタミン:Q、グリシン:G、ヒスチジン:H、イソロイシン:I、ロイシン:L、リジン:K、メチオニン:M、フェニルアラニン:F、プロリン:P、セリン:S、トレオニン:T、トリプトファン:W、チロシン:Yおよびバリン:V。
一側面において、本発明は、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を有効成分として含む、腫瘍微小環境における腫瘍関連マクロファージ(tumor associated macrophages、TAM)を除去するための薬学的組成物に関するものである。
一具現例において、前記腫瘍関連マクロファージは、IGBT2(Integrin beta 2)を発現するM2腫瘍関連マクロファージであってもよい。
一具現例において、前記組成物は、M1マクロファージは、除去することなく、M2マクロファージのみを除去することができる。
一具現例において、メリチンは、配列番号1のアミノ酸配列を含むことができる。
一具現例において、メリチンの変異体は、配列番号1のアミノ酸配列において、1~7位のアミノ酸が欠失したペプチドであってもよく、配列番号2のアミノ酸配列を含むことができる。
一具現例において、ITGB2は、配列番号7または8のアミノ酸配列を含むことができる。
一具現例において、前記メリチン、その変異体またはこれらの類似体は、ITGB2(CD18)が拡張された(extended)活性型構造(Active conformation)に特異的に結合することができる。
一具現例において、メリチン、その変異体またはこれらの類似体がITGB2の466~565のアミノ酸と結合することができる。
一具現例において、前記組成物は、配列番号5または6のアミノ酸配列を含むペプチドを含むことができる。
一具現例において、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体は、ペプチド-薬物複合体(peptide-drug conjugate、PDC)であってもよく、PDCは、配列番号5のアミノ酸配列を含むMelittin-dKLAであってもよく、配列番号6のアミノ酸配列を含むTB511であってもよく、マレイミド-修飾されたメリチンに薬物DM1がコンジュゲートされたM-DM1であってもよい。
一具現例において、TB511のLEU(6)は、ITGB2のLEU(528)、THR(538)、LEU(556)、CYS(557)、およびPHE(558)部位と結合(bindin)することができ、TB511のTRP(12)は、ITGB2のGLU(466)、ILE(469)、CYS(470)、およびARG(471)と結合することができる。
一具現例において、メリチン、その変異体またはこれらの類似体とプロアポトーシス性ペプチドまたは抗癌剤は、リンカーを媒介に共有結合するか、リンカーの媒介なしに非共有結合することができる。
一具現例において、前記リンカーは、配列番号3のアミノ酸配列を含むことができる。
一具現例において、メリチン、その変異体またはこれらの類似体に半減期または安定性を増加させるための特定の目的のために設計された標的配列、タグ、標識残基またはアミノ酸配列をさらに含むことができる。
一具現例において、前記プロアポトーシス性ペプチドは、KLA、アルファ-ディフェンシン-1(alpha-defensin-1)、BMAP-28、Brevenin-2R、ブフォリンIIb(Buforin IIb)、セクロピンA-マガイニン2(cecropin A-Magainin 2、CA-MA-2)、セクロピンA(Cecropin A)、セクロピンB(Cecropin B)、クリソフィシン-1(chrysophsin-1)、D-K6L9、ゴメシン(Gomesin)、ラクトフェリシンB(Lactoferricin B)、LLL27、LTX-315、マガイニン2(Magainin 2)、マガイニンII-ボンベシン結合体(Magainin II-bombesin conjugate、MG2B)、パルダキシン(Pardaxin)およびこれらの組み合わせからなる群から選択されることができ、D型異性体KLAであることがより好ましく、配列番号4のアミノ酸配列を含むことができる。
一具現例において、前記抗癌剤は、SN-38(7-エチル-10-ヒドロキシ-カンプトテシン、7-Ethyl-10-hydroxy-camptothecin)、ダウノルビシン(daunorubicin)、ドキソルビシン(doxorubicin)、エピルビシン(epirubicin)、イダルビシン(idarubicin)、ピクサントロン(pixantrone)、サバルビシン(sabarubicin)、バルルビシン(valrubicin)、パクリタキセル(paclitaxel)、ドセタキセル(docetaxel)、メクロレタミン(mechloethamine)、クロラムブシル(chlorambucil)、フェニルアラニン(phenylalanine)、マスタード(mustard)、シクロホスファミド(cyclophosphamide)、イホスファミド(ifosfamide)、カルムスチン(carmustine:BCNU)、ロムスチン(lomustine:CCNU)、ストレプトゾトシン(streptozotocin)、ブスルファン(busulfan)、チオテパ(thiotepa)、シスプラチン(cisplatin)、カルボプラチン(carboplatin)、ダクチノマイシン(dactinomycin:actinomycin D)、プリカマイシン(plicamycin)、マイトマイシンC(mitomycin C)、ビンクリスチン(vincristine)、ビンブラスチン(vinblastine)、テニポシド(teniposide)、トポテカン(topotecan)、イリノテカン(iridotecan)、ウラムスチン(uramustine)、メルファラン(melphalan)、ベンダムスチン(bendamustine)、ダカルバジン(dacarbazine)、テモゾロミド(temozolomide)、アルトレタミン(altretamine)、デュオカルマイシン(duocarmycin)、ネダプラチン(nedaplatin)、オキサリプラチン(oxaliplatin)、サトラプラチン(satraplatin)、トリプラチンテトラナイトレート(triplatin tetranitrate)、5-フルオロウラシル(5-fluorouracil)、6-メルカプトプリン(6-mercaptopurine)、カペシタビン(capecitabine)、クラドリビン(cladribine)、クロファラビン(clofarabine)、シスタルビン(cystarbine)、フロクスウリジン(floxuridine)、フルダラビン(fludarabine)、ゲムシタビン(gemcitabine)、ヒドロキシウレア(hydroxyurea)、メトトレキサート(methotrexate)、ペメトレキセド(pemetrexed)、ペントスタチン(pentostatin)、チオグアニン(thioguanine)、エトポシド(etoposide)、ミトキサントロン(mitoxantrone)、イキサベピロン(izabepilone)、ビンデシン(vindesine)、ビノレルビン(vinorelbine)、エストラムスチン(estramustine)、メイタンシン(maytansine)、DM1(mertansine、メルタンシン)、DM4、ドラスタチン(dolastatin)、アウリスタチンE(auristatin E)、アウリスタチンF(auristatin F)、モノメチルアウリスタチンE(monomethyl auristatin E、MMAE)、モノメチルアウリスタチンF(monomethyl auristatin F)およびこれらの誘導体からなる群から選択されることができ、DM1またはMMAEであってもよい。
一具現例において、前記メリチン、その変異体またはこれらの類似体とプロアポトーシス性ペプチドまたは抗癌剤は、化学的リンカーまたは直接結合により連結されることができ、化学的リンカーは、メリチン、その変異体またはこれらの類似体とプロアポトーシス性ペプチドまたは抗癌剤上のアミン基(amine)、カルボキシ基(carboxyl)またはスルフィドリル基(sulfhydryl)を介して連結されることができる。
一具現例において、前記化学的リンカーは、両末端にカルボジイミド基(carbodiimide)、N-ヒドロキシスクシンイミドエステル(N-hydroxysuccinimide ester;NHS ester)、イミドエステル(imidoester)、ペンタフルオロフェニルエステル(pentafluorophenyl ester)、ヒドロキシメチルホスフィン(hydroxymethyl phosphine)、マレイミド(maleimide)、ハロアセチル(haloacetyl)、ピリジルジスルフィド(pyridyldisulfide)、チオスルホナート(thiosulfonate)、ビニルスルホン(vinylsulfone)およびこれらの組み合わせから選択される作用基を含むことができ、EDC(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide)、DCC(N,N’-dicyclohexylcarbodiimide)、SATA(succinimidyl acetylthioacetate)、スルホ-SMCC(sulfosuccinimidyl-4-(NDmaleimidomethyl)cyclohexane-1-carboxylate)、DMA(dimethyladipimidate 2HCl)、DMP(dimethylpimelimidate 2HCl)、DMS(dimethylSuberimidate 2HCl)、DTBP(dimethyl 3,3’-dithiobispropionimidate 2HCl)、スルホ-SIAB(sulfosuccinimidyl(4-iodoacetyl)aminobenzoate)、SIAB(succinimidyl(4-iodoacetyl)aminobenzoate)、SBAP(succinimidyl 3-(bromoacetamido)propionate)、SIA(succinimidyl iodoacetate)、SM(PEG)n(succinimidyl-([N-maleimidopropionamido]-#ethyleneglycol ester、n=2、4、6、8、12または24)、SMCC(succinimidyl-4-(N-Dmaleimidomethyl)cyclohexane-1-carboxylate)、LCSMCC(succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxy-(6-amidocaproate))、スルホ-EMCS(N-εester)、EMCS(N-εスルホ-GMBS(N-γester)、GMBS(N-γester)、スルホ-KMUS(N-κester)、スルホ-MBS(m-maleimidobenzoyl-Nhydroxysulfosuccinimide ester)、MBS(m-maleimidobenzoyl-N-hydroxysuccinimide ester)、スルホ-SMPB(sulfosuccinimidyl 4-(p-maleimidophenyl)butyrate)、SMPB(succinimidyl 4-(pmaleimidophenyl)butyrate)、AMAS(N-α-maleimidoacet-oxysuccinimide ester)、BMPS(N-β-maleimidopropyloxysuccinimide ester)、SMPH(succinimidyl6-[(β-maleimidopropionamido)hexanoate])、PEG12-SPDP(2-pyridyldithiol-tetraoxaoctatriacontane-N-hydroxysuccinimide)、PEG4-SPDP、スルホ-LCSPDP(sulfosuccinimidyl6-[3’-(2-pyridyldithio)propionamido]hexanoate)、SPDP(succinimidyl 3-(2-pyridyldithio)propionate)、LC-SPDP(succinimidyl 6-[3’-(2-pyridyldithio)propionamido]hexanoate)、SMPT(4-succinimidyloxycarbonyl-alpha-methyl-alpha(2-pyridyldithio)toluene)、DSS(disuccinimidylsuberate)、BS(PEG)5(bis(succinimidyl)penta(ethylene glycol))、BS(PEG)9(bis(succinimidyl)nona(ethylene glycol))、BS3(bis[sulfosuccinimidyl]suberate)、BSOCOES(bis[2-(succinimidooxycarbonyloxy)ethyl]sulfone)、PDPH(3-(2-pyridyldithio)propionyl hydrazide)、DSG(disuccinimidyl glutarate)、DSP(dithiobis[succinimidyl propionate])、BM(PEG)n(1,8-bismaleimido-ethyleneglycol、n=2または3)、BMB(1,4-bismaleimidobutane)、BMDB(1,4-bismaleimidyl-2,3-dihydroxybutane)、BMH(bismaleimidohexane)、BMOE(bismaleimidoethane)、DTME(dithiobismaleimidoethane)、TMEA(tris(2-maleimidoethyl)amine)、DSS(disuccinimidyl suberate)、DST(disuccinimidyl tartarate)、DTSSP(3,3’-dithiobis[sulfosuccinimidylpropionate])、EGS(ethylene glycol bis[succinimidylsuccinate])、スルホ-EGS(ethylene glycol bis[sulfosuccinimidylsuccinate])およびTSAT(tris-succinimidylaminotriacetate)、DFDNB(1,5-difluoro-2,4-dinitrobenzene)およびこれらの組み合わせから選択されることができる。
本発明において、前記ペプチドは、前記アミノ酸配列を有することが好ましいが、これらに限定されるものではない。本発明の好ましい具現例によれば、前記ペプチドは、前記アミノ酸の割合が50%以上、好ましくは60%以上、より好ましくは70%以上、より好ましくは80%以上、さらに好ましくは90%以上、最も好ましくは100%と高いことが好ましい。
本発明において、前記ペプチドは、標的化配列、タグ(tag)、標識された残基、半減期またはペプチドの安定性を増加させるための特定の目的で考案された追加のアミノ酸配列も含むことができる。また、本発明のペプチドは、エフェクター(effectors)、薬物、プロドラッグ、毒素、ペプチド、伝達分子などのカップリングパートナーと連結されることができる。
本発明において、前記ペプチドは、薬学的に許容可能な塩の形態で製造されることができる。具体的には、酸を添加することで塩を形成することができ、例えば、無機酸(例:塩酸、臭化水素酸、リン酸、硝酸、硫酸など)、有機カルボン酸(例:酢酸、トリフルオロ酢酸のようなハロ酢酸、プロピオン酸、マレイン酸、コハク酸、リンゴ酸、クエン酸、酒石酸、サリチル酸)、および酸性糖(グルクロン酸、ガラクツロン酸、グルコン酸、アスコルビン酸)、酸性多糖類(例:ヒアルロン酸、コンドロイチン硫酸、アルギニン酸)、コンドロイチン硫酸などのスルホン酸糖エステルを含む有機スルホン酸(例:メタンスルホン酸、p-トルエンスルホン酸)などを添加して塩を形成することができる。
本発明の用語、「結合体」は、メリチン、その変異体またはこれらの類似体ペプチドとプロアポトーシス性ペプチドまたは抗癌剤が結合された複合体であって、M2型腫瘍関連マクロファージを標的とすることができる。前記結合体は、ターゲティングするM2型マクロファージに結合し、マクロファージのミトコンドリアを損傷させることで腫瘍の生長と転移を抑制し、周囲の血管新生を選択的に抑制することによって癌を抑制することができる。
すなわち、本発明の複合体は、抗癌剤に比べて抗癌活性が向上したものであってもよいが、これに制限されるものではない。
本発明において、前記結合体は、メリチン、その変異体またはこれらの類似体をGGGGSリンカー(配列番号3)を介してプロアポトーシス性ペプチドと連結することができ、またはSPDPリンカーを介してDoxorubicin、Methotrexate、Entinostat、Cladribine、PralatrexateおよびLorlatinibのような抗癌剤と連結するものであってもよい。また、抗癌剤中、Maytansine DM1、Maytansine DM3およびMaytansine DM4は、リンカーなしに直接連結して結合されることができるが、これらに制限されるものではない。
すなわち、本発明の結合体は、メリチン、その変異体またはこれらの類似体が化学的リンカーを介したり、または、直接抗癌剤と連結された形態であってもよいが、これに制限されるものではない。
本発明の用語、「メリチン(Melittin;MEL)」は、ハチ毒の主要成分を構成するペプチドである。前記本明細書にて使用される用語「ハチ毒(bee venom;BV)」は、ミツバチ(Apismellifera)の腹部で生成される酸性および塩基性分泌物の混合物であって、苦い無色の液体形態を帯び、その主な成分は、ペプチドであるメリチン(melittin)、アパミン(apamin)、マスト細胞脱顆粒(mast cell degranulating;MCD)ペプチド、および酵素であるホスホリパーゼA2(phospholipase A2;PLA2)などであり、この他に多様な微量の成分を含む。したがって、本発明のメリチンは、ミツバチ(Apismellifera)のハチ毒から分離されるものであってもよいが、これに制限されるものではない。
本発明にて用いられた用語「ペプチド」は、アミノ酸重合体であって、天然アミノ酸だけでなく、非タンパク質性アミノ酸も構成要素として含むことができる。
本発明にて使用された、用語「変異体」は、基準物質と比較したとき、最低1個のアミノ酸の差(置換、挿入または欠損)を含む対応するアミノ酸配列を指す。特定の具体例において、「変異体」は、基準配列と比較したとき、高いアミノ酸配列相同性(homology)および/または保存的アミノ酸置換、欠損および/または挿入を有する。
本発明にて使用された、用語「ペプチド類似体」は、アミノ酸の側鎖またはアルファ-アミノ酸バッグボーンに対して、一つ以上の他の機能基で置換された類似体を含むことができる。側鎖若しくはバッグボーンが改質化されたペプチド類似体の例としては、ピロリジン環がヒドロキシ基で置換されたヒドロキシプロリンや、N-メチルグリシン「ペプトイド」が挙げられるが、これに制限されるものではない。ペプチド類似体の種類については、当業界に公知されている。
本発明によるタンパク質変異体は、特定のアミノ酸残基位置でアミノ酸残基が保存的に置換された変異体も含む意味として解釈される。
本発明にて「保存的置換」とは、1個以上のアミノ酸を当該メリチンタンパク質変異体の生物学的または生化学的機能の損失を惹起しない類似する生化学的特性を有するアミノ酸で置換することを含む変異体の変形を意味する。「保存的アミノ酸置換」は、アミノ酸残基を類似する側鎖を有するアミノ酸残基に代替させる置換である。類似する側鎖を有するアミノ酸残基部類は、当該技術分野に規定されており、広く知られている。これらの部類は、塩基性側鎖を有するアミノ酸(例えば、リジン、アルギニン、ヒスチジン)、酸性側鎖を有するアミノ酸(例えば、アスパラギン酸、グルタミン酸)、帯電しない極性側鎖を有するアミノ酸(例えば、グリシン、アスパラギン、グルタミン、セリン、トレオニン、チロシン、システイン)、非-極性側鎖を有するアミノ酸(例えば、アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン)、ベタ-分枝の側鎖を有するアミノ酸(例えば、トレオニン、バリン、イソロイシン)および芳香族側鎖を有するアミノ酸(例えば、チロシン、フェニルアラニン、トリプトファン、ヒスチジン)を含む。
本発明によるペプチドは、標準合成方法、再組み合わせ発現システム、または任意の他の当該分野の方法により製造されることができる。したがって、本発明によるペプチドは、例えば、次を含む方法を含む多数の方法により合成されることができる:
(a)ペプチドを固相法または液相法の手段で段階的にまたは断片組立により合成し、最終ペプチド生成物を分離し精製する方法;または
(b)ペプチドをインコーディングする核酸作製物を宿主細胞内で発現させ、発現生成物を宿主細胞培養物から回収する方法;または
(c)ペプチドをインコーディングする核酸作製物の無細胞in vitro発現を行い、発現生成物を回収する方法;または
(a)、(b)および(c)の任意の組み合わせによりペプチドの断片を得て、次いで断片を連結させてペプチドを得て、当該ペプチドを回収する方法。
一側面において、本発明は、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を有効成分として含む、癌の予防または治療用薬学的組成物に関するものである。
(a)ペプチドを固相法または液相法の手段で段階的にまたは断片組立により合成し、最終ペプチド生成物を分離し精製する方法;または
(b)ペプチドをインコーディングする核酸作製物を宿主細胞内で発現させ、発現生成物を宿主細胞培養物から回収する方法;または
(c)ペプチドをインコーディングする核酸作製物の無細胞in vitro発現を行い、発現生成物を回収する方法;または
(a)、(b)および(c)の任意の組み合わせによりペプチドの断片を得て、次いで断片を連結させてペプチドを得て、当該ペプチドを回収する方法。
一側面において、本発明は、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を有効成分として含む、癌の予防または治療用薬学的組成物に関するものである。
一具現例において、前記癌は、脳腫瘍、黒色腫、骨髄腫、非小細胞性肺癌、口腔癌、肝臓癌、胃癌、結腸癌、乳癌、三重陰性乳癌(Triple Negative Breast Cancer、TNBC)、肺癌、骨癌、膵臓癌、皮膚癌、頭部または頸部癌、子宮頸部癌、卵巣癌、大腸癌、小腸癌、直腸癌、卵管癌、肛門癌、子宮内膜癌、膣癌、外陰癌、ホジキン病(Hodgkin’sdisease)、食道癌、リンパ腺癌、膀胱癌、胆嚢癌、内分泌腺癌、甲状腺癌、副甲状腺癌、副腎癌、軟組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性または急性白血病、リンパ球リンパ腫、腎臓または尿管癌、腎細胞癌、腎臓骨盤癌、中枢神経系腫瘍、一次中枢神経系リンパ腫、脊髄腫瘍、脳幹神経膠腫および下垂体腺腫からなる群から選択されるいずれか一つ以上であることができ、抗癌剤耐性癌であってもよい。
一具現例において、前記組成物は、M0マクロファージおよびM1マクロファージに比べて、M2マクロファージにてITGB2の発現が上方制御された患者を対象に投与することができる。
一具現例において、前記組成物は、標的抗癌剤であってもよい。
本発明における薬学的組成物は、単独の療法で用いられることができるが、他の通常の生物学的療法、化学療法または放射療法と共に用いられることもでき、このような並行療法を実施する場合には、より効果的に癌を治療することができる。本発明を癌の予防および治療に用いる場合、前記組成物と共に用いられることができる化学療法剤は、シスプラチン(cisplatin)、カルボプラチン(carboplatin)、プロカルバジン(procarbazine)、メクロレタミン(mechlorethamine)、シクロホスファミド(cyclophosphamide)、イホスファミド(ifosfamide)、メルファラン(melphalan)、クロラムブシル(chlorambucil)、ブスルファン(bisulfan)、ニトロソウレア(nitrosourea)、ダクチノマイシン(dactinomycin)、ダウノルビシン(daunorubicin)、ドキソルビシン(doxorubicin)、ブレオマイシン(bleomycin)、プリカマイシン(plicomycin)、マイトマイシン(mitomycin)、エトポシド(etoposide)、タモキシフェン(tamoxifen)、タキソール(taxol)、トランスプラチナ(transplatinum)、5-フルオロウラシル(5-fluorouracil)、ビンクリスチン(vincristin)、ビンブラスチン(vinblastin)およびメトトレキサート(methotrexate)などを含む。本発明の組成物と共に用いられることができる放射療法は、X-線照射およびγ-線照射などである。
本発明において、用語「予防」とは、本発明による組成物の投与により癌の発生、拡散および再発を抑制または遅延させるあらゆる行為を意味する。
本発明の組成物の治療的に有効な量は、多様な要素、例えば、投与方法、目的部位、患者の状態などによって異なり得る。したがって、人体に使用時の投与量は、安全性および効率性を共に考慮し、適正量で決定されるべきである。動物実験を通じて決定した有効量からヒトに使用される量を推定することも可能である。有効な量を決定する際に、考慮すべきこのような事項は、例えば、Hardman and Limbird、eds.、Goodman and Gilman’s The Pharmacological Basis of Therapeutics、10th ed.(2001)、Pergamon Press;およびE.W.Martin ed.、Remington’s Pharmaceutical Sciences、18th ed.(1990)、Mack Publishing Co.に記述されている。
本発明における薬学的組成物は、薬学的に有効な量で投与する。本発明にて使される用語、「薬学的に有効な量」は、医学的治療に適用可能な合理的な恩恵/リスク比で疾患を治療するのに十分であり、副作用を引き起こさない程度の量を意味し、有効用量レベルは患者の健康状態、疾患の種類、重症度、薬物の活性、薬物に対する感度、投与方法、投与時間、投与経路および排出率、治療期間、配合または同時に使用される薬物を含む要素およびその他の医学分野で公知の要素によって決定されることができる。本発明の組成物は、個別の治療剤として投与することができるか、または他の治療剤と併用して投与することができ、従来の治療剤と順次または同時に投与することができ、単回または複数回投与することができる。前記した要素を全て考慮して、副作用なく最小限の量で最大の効果が得られる量を投与することが重要であり、これは当業者によって容易に決定され得る。
本発明における薬学的組成物は、生物学的製剤に通常使用される担体、希釈剤、賦形剤または二つ以上のこれらの組み合わせを含むことができる。本発明にて使用される用語、「薬学的に許容可能な」とは、前記組成物に露出される正常な細胞やヒトに毒性のない特性を示すことを意味する。前記担体は、組成物を生体内送達に適したものであれば、特に制限されず、例えば、Merck Index、13th ed.、Merck & Co.Inc.に記載された化合物、食塩水、滅菌水、リンガー液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エタノール、およびこれらの成分中、1成分以上を混合して用いることができ、必要に応じて抗酸化剤、緩衝液、静菌剤などの他の通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤および潤滑剤を付加的に添加し、水溶液、懸濁液、乳濁液などのような注射用剤形、丸薬、カプセル、顆粒または錠剤に製剤化することができる。さらに、当分野の適正な方法によりまたはRemington’s Pharmaceutical Science(Mack Publishing Company、Easton PA、18th、1990)に開示されている方法を用いて各疾患に応じてまたは成分に応じて好ましく製剤化することができる。
一具現例において、前記薬学組成物は、経口型剤形、外用剤、坐剤、滅菌注射溶液および噴霧剤を含む群から選択される一つ以上の剤形であってもよい。
本発明における組成物はまた、生物学的製剤に通常使用される担体、希釈剤、賦形剤または二つ以上のこれらの組み合わせを含むことができる。薬学的に許容可能な担体は、組成物を生体内送達に適したものであれば、特に制限されず、例えば、Merck Index、13th ed.、Merck & Co.Inc.に記載された化合物、食塩水、滅菌水、リンガー液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エタノールおよびこれらの成分中、1成分以上を混合して用いることができ、必要に応じて抗酸化剤、緩衝液、静菌剤などの他の通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤および潤滑剤を付加的に添加し、水溶液、懸濁液、乳濁液などのような注射用製剤、丸薬、カプセル、顆粒または錠剤に製剤化することができる。さらに当分野の適正な方法によりまたはRemington’s Pharmaceutical Science(Mack Publishing Company、Easton PA、18th、1990)に開示されている方法を用いて各疾患に応じてまたは成分に応じて好ましく製剤化することができる。
本発明における組成物はまた、生物学的製剤に通常使用される担体、希釈剤、賦形剤または二つ以上のこれらの組み合わせを含むことができる。薬学的に許容可能な担体は、組成物を生体内送達に適したものであれば、特に制限されず、例えば、Merck Index、13th ed.、Merck & Co.Inc.に記載された化合物、食塩水、滅菌水、リンガー液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エタノールおよびこれらの成分中、1成分以上を混合して用いることができ、必要に応じて抗酸化剤、緩衝液、静菌剤などの他の通常の添加剤を添加することができる。また、希釈剤、分散剤、界面活性剤、結合剤および潤滑剤を付加的に添加し、水溶液、懸濁液、乳濁液などのような注射用製剤、丸薬、カプセル、顆粒または錠剤に製剤化することができる。さらに当分野の適正な方法によりまたはRemington’s Pharmaceutical Science(Mack Publishing Company、Easton PA、18th、1990)に開示されている方法を用いて各疾患に応じてまたは成分に応じて好ましく製剤化することができる。
本発明における組成物にさらに同一または類似する機能を示す有効成分を1種以上含有することができる。本発明における組成物は、組成物の総重量に対して前記タンパク質を0.0001~10重量%、好ましくは0.001~1重量%を含む。
本発明における薬学的組成物は、薬剤学的に許容可能な添加剤をさらに含むことができ、このとき、薬剤学的に許容可能な添加剤としては、デンプン、ゼラチン化デンプン、微結晶セルロース、乳糖、ポビドン、コロイド状二酸化ケイ素、リン酸水素カルシウム、ラクトース、マンニトール、飴、アラビアゴム、アルファ化デンプン、トウモロコシデンプン、粉末セルロース、ヒドロキシプロピルセルロース、オパドライ、デンプングリコール酸ナトリウム、カルナウバロウ、合成ケイ酸アルミニウム、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸アルミニウム、ステアリン酸カルシウム、白糖、デキストロース、ソルビトールおよびタルクなどが用いられることができる。本発明による薬剤学的に許容可能な添加剤は、前記組成物に対して0.1重量部~90重量部含まれることが好ましいが、これらに限定されるものではない。
本発明における組成物は、目的とする方法に従って、非経口投与(例えば、静脈内、皮下、腹腔内または局所に適用)するか、経口投与することができ、投与量は、患者の体重、年齢、性別、健康状態、食餌、投与時間、投与方法、排泄率および疾患の重症度などによってその範囲が多様である。本発明による組成物の一日の投与量は、0.0001~10mg/mlであり、好ましくは0.0001~5mg/mlであり、一日に1回~数回に分けて投与することがより好ましい。
本発明における組成物の経口投与のための液状製剤としては、懸濁剤、内服液剤、乳剤、シロップ剤などが該当するが、通常使用される単純な希釈剤である水、液体パラフィン以外に多様な賦形剤、例えば、湿潤剤、甘味剤、芳香剤、保存剤などが共に含まれることができる。非経口投与のための製剤には、滅菌された水溶液、非水性溶剤、懸濁剤、乳剤、凍結乾燥製剤、坐剤などが含まれる。
一側面において、本発明は、本発明における組成物を試験管のM2腫瘍関連マクロファージに処理する段階を含む、M2型腫瘍関連マクロファージ除去方法に関するものである。
一側面において、本発明は、本発明における組成物を含む癌診断用組成物に関するものである。
一側面において、本発明は、本発明における癌診断用組成物を含む、癌診断キットに関するものである。
本発明において、用語「癌診断キット」とは、本発明の癌診断用組成物が含まれたキットを意味する。したがって、前記表現「癌診断キット」とは、「癌診断用組成物」と互いに交差または混用して使用が可能である。本明細書にて用語「診断」とは、特定の疾病または疾患に対する一つのオブジェクトの感受性(susceptibility)を判定すること、一つのオブジェクトが特定の疾病または疾患を現在有しているか否かを判定すること、特定の疾病または疾患に罹患したオブジェクトの予後(prognosis)(例えば、前-転移性または転移性癌状態の同定、癌のステージ決定または治療に対する癌の反応性決定)を判定すること、またはテラメトリクス(therametrics)(例えば、治療効能に対する情報を提供するために、オブジェクトの状態をモニタリングすること)を含む。
本発明におけるメリチン、その変異体またはこれらの類似体は、M2腫瘍関連マクロファージの細胞膜に発現されるITGB2に特異的に結合することによって、これら自体またはこれらと連結された薬物(プロアポトーシス性ペプチドまたは抗癌剤)がM2腫瘍関連マクロファージを死滅させることによって、腫瘍の生長と転移を抑制し、周囲の血管新生を選択的に抑制することによって抗癌活性を有し、M2腫瘍関連マクロファージを特異的に結合するため、癌の診断にも使われるテラノスティック製剤として使用されることができる。また、抗癌剤と共に同時に、別途にまたは順次投与される抗癌補助剤としても使用されることができる。併せて、メリチン、その変異体またはこれらの類似体がM2腫瘍関連マクロファージと特異的に結合するため、これを標的化する薬物伝達体としても用いられることができる。
一側面において、本発明は、対象から分離された生物学的試料と本発明の組成物を接触させる段階;および正常対照群試料と比較する段階を含む、癌診断のための情報提供方法に関するものである。
一具現例において、対象から分離された生物学的試料でのM2腫瘍関連マクロファージレベルが正常対照群試料に比べて高い場合、前記検査対象が癌であると判断する段階をさらに含むことができる。
本発明にて用いられた用語、「試料(サンプル)」とは、対象または患者から得た生物学的試料を意味する。生物学的試料の供給源は、新鮮な、凍結されたおよび/または保存された臓器または組織サンプルまたは生検または吸引物からの固形組織;血液または任意の血液成分;対象の妊娠または発生の任意の時点の細胞であってもよい。
一側面において、本発明は、本発明におけるメリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を薬学的に有効な量で癌に罹患したオブジェクトに投与する段階を含む、癌の治療方法に関するものである。
一具現例において、前記オブジェクトは、M0マクロファージおよびM1マクロファージに比べて、M2マクロファージにてITGB2の発現が上方制御された患者であってもよい。
一側面において、本発明は、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体の癌の予防および治療用薬学的組成物の製造に用いるための用途に関するものである。
下記の実施例を通じて本発明をより詳しく説明する。しかし、下記実施例は、本発明の内容を具体化するためのものに過ぎず、これにより本発明が限定されるものではない。
実施例1.M2腫瘍関連マクロファージ(M2TAM)標的化ペプチドの合成
下記表1のメリチン(Melittin)およびTAMpep826をGenScript(Piscataway、NJ、USA)に合成依頼して供給を受け、その後、実験にてD-PBSに5mg/mlで溶かし、用いられた。
下記表1のメリチン(Melittin)およびTAMpep826をGenScript(Piscataway、NJ、USA)に合成依頼して供給を受け、その後、実験にてD-PBSに5mg/mlで溶かし、用いられた。
実施例2.M2 TAM標的化の分析
2-1.メリチンのM2 TAMに対する親和度(Affinity)の確認
前記実施例1にて作製したメリチンが、M2腫瘍関連マクロファージ(M2 TAM)に特異的に結合するか否かを確認するため、ヒト単球細胞株THP-1をM0、M1、およびM2マクロファージに分化させ、FITCコンジュゲートされたメリチンを処理し、フローサイトメトリーにより確認した。具体的に、THP-1細胞は、100nMのPMA(phorbol 12-myristate 13-acetate)を37℃で24時間処理し(M0マクロファージ)、分化されたM0マクロファージを100nMのLPSおよび20ng/mlのIFN-γと37℃で72時間培養し、M1マクロファージ(M1)に分化させ、20ng/mlのIL-4およびIL-13と37℃で72時間培養し、M2マクロファージ(M2)に分化させた。分化された細胞にFITCコンジュゲートされたメリチン50nMを1時間処理し、BD FACS CantoII instruments(BD biosciences、San Jose、CA、USA)で細胞を検出し、FlowJosoftware(BDbiosciences)により分析した。
2-1.メリチンのM2 TAMに対する親和度(Affinity)の確認
前記実施例1にて作製したメリチンが、M2腫瘍関連マクロファージ(M2 TAM)に特異的に結合するか否かを確認するため、ヒト単球細胞株THP-1をM0、M1、およびM2マクロファージに分化させ、FITCコンジュゲートされたメリチンを処理し、フローサイトメトリーにより確認した。具体的に、THP-1細胞は、100nMのPMA(phorbol 12-myristate 13-acetate)を37℃で24時間処理し(M0マクロファージ)、分化されたM0マクロファージを100nMのLPSおよび20ng/mlのIFN-γと37℃で72時間培養し、M1マクロファージ(M1)に分化させ、20ng/mlのIL-4およびIL-13と37℃で72時間培養し、M2マクロファージ(M2)に分化させた。分化された細胞にFITCコンジュゲートされたメリチン50nMを1時間処理し、BD FACS CantoII instruments(BD biosciences、San Jose、CA、USA)で細胞を検出し、FlowJosoftware(BDbiosciences)により分析した。
その結果、FITC陽性細胞は、M0およびM2マクロファージに比べて、M2マクロファージにおいて、著しく増加した(図1aおよびb)。これを通じて、メリチンがM2マクロファージに優先的に結合することが確認された。
2-2.メリチンのM2 TAM結合標的タンパク質の識別
M2マクロファージのあるタンパク質がメリチンとM2マクロファージの特異的結合に関連しているか否かを確認するため、ビオチン-コンジュゲートされたメリチン(メリチン-biotin)を合成した。THP-1細胞(5Х106 cells)をM0、M1、およびM2マクロファージに分化させた後、スクレーパーを用いて細胞を集めて、遠心分離(300Хg、5分)を通じて細胞を洗浄し、細胞膜タンパク質抽出キット(membrane protein extraction kit)(Thermo Fisher scientific)を用いてマクロファージの細胞膜タンパク質を得た。メリチンにビオチン(biotin)が結合されたメリチン-ビオチン(200μg)と常温(20~24℃)で1時間反応させた後、ストレプトアビジン・レジン(streptavidin resin)(Thermo Fisher scientific)を用いてメリチンと結合したタンパク質を得た。塩を除去するため、100%のメタノール、0.1%のギ酸および80%のCANをそれぞれ100μlずつ18 Micro Spin-Columnに添加して用意し、用意したカラムに試料をロードし、50μlの0.1%のギ酸を添加し、不要な物質を除去した。その後、80%のCAN 100μlを添加し、ペプチドを溶離させた。脱塩が終わると、Speed-vacで乾燥させ、溶液を全部除去し、下記表2の条件でUPLC-Exactive equipment(Thermo Fisher Scientific)を用いて、LC-MS/MSにより分析した。MaxQuantおよびMPP(Mass Profiler Professional)を用いて、M0マクロファージに比べて、M1およびM2マクロファージにおいて、上方制御されたタンパク質に対してデータを分析した。データを分析するために、各指標別にLC-MS/MSデータを、Proteome Discovererを用いて分析し、データベースは、Uniprotのhuman databaseを用いて、LFQ(Label-Free Quantification)により進めた。Modificaitonは、Oxidation(M)、Carbamyl(N-term)、Carbamidomethyl(C)を追加し、Baseline optionは、noneとした。
M2マクロファージのあるタンパク質がメリチンとM2マクロファージの特異的結合に関連しているか否かを確認するため、ビオチン-コンジュゲートされたメリチン(メリチン-biotin)を合成した。THP-1細胞(5Х106 cells)をM0、M1、およびM2マクロファージに分化させた後、スクレーパーを用いて細胞を集めて、遠心分離(300Хg、5分)を通じて細胞を洗浄し、細胞膜タンパク質抽出キット(membrane protein extraction kit)(Thermo Fisher scientific)を用いてマクロファージの細胞膜タンパク質を得た。メリチンにビオチン(biotin)が結合されたメリチン-ビオチン(200μg)と常温(20~24℃)で1時間反応させた後、ストレプトアビジン・レジン(streptavidin resin)(Thermo Fisher scientific)を用いてメリチンと結合したタンパク質を得た。塩を除去するため、100%のメタノール、0.1%のギ酸および80%のCANをそれぞれ100μlずつ18 Micro Spin-Columnに添加して用意し、用意したカラムに試料をロードし、50μlの0.1%のギ酸を添加し、不要な物質を除去した。その後、80%のCAN 100μlを添加し、ペプチドを溶離させた。脱塩が終わると、Speed-vacで乾燥させ、溶液を全部除去し、下記表2の条件でUPLC-Exactive equipment(Thermo Fisher Scientific)を用いて、LC-MS/MSにより分析した。MaxQuantおよびMPP(Mass Profiler Professional)を用いて、M0マクロファージに比べて、M1およびM2マクロファージにおいて、上方制御されたタンパク質に対してデータを分析した。データを分析するために、各指標別にLC-MS/MSデータを、Proteome Discovererを用いて分析し、データベースは、Uniprotのhuman databaseを用いて、LFQ(Label-Free Quantification)により進めた。Modificaitonは、Oxidation(M)、Carbamyl(N-term)、Carbamidomethyl(C)を追加し、Baseline optionは、noneとした。
その結果、M2/M0にて53個のタンパク質が、M1/M0にて123個のタンパク質が上方制御された(図2a)。M2マクロファージよりもより多くの上方制御されたタンパク質がM1マクロファージと相互作用したが、細胞膜に存在するタンパク質はその限りでない。膜タンパク質中、ITGB2がM2マクロファージにおいて、上方制御されることが示された(図2b)。また、M1マクロファージのマーカーとして知られたIL-10およびCXCL10のようなサイトカインがM1マクロファージにおいて、上方制御された(図2v)。また、タンパク質がM1に比べてM2にて上方制御されたタンパク質が確認されたが、膜タンパク質中、ITGB2のみがM2マクロファージにおいて、上方制御されることが確認された(図2d)。これを通じて、メリチンがM2マクロファージの膜タンパク質ITGB2と相互作用し、結合することが確認された。
2-3.TAMpep826のM2 TAM結合標的タンパク質の識別
前記実施例2-2からみられるように、M0、M1およびM2マクロファージからそれぞれ抽出した細胞膜タンパク質とTAMpep826-ビオチンを反応させて、LC-MS/MSproteomicsを通じてターゲットタンパク質を確認した。
前記実施例2-2からみられるように、M0、M1およびM2マクロファージからそれぞれ抽出した細胞膜タンパク質とTAMpep826-ビオチンを反応させて、LC-MS/MSproteomicsを通じてターゲットタンパク質を確認した。
その結果,細胞膜タンパク質中、ITGB2がM0およびM1マクロファージに比べて、M2マクロファージにおいて、より高いレベルで発現されることが示され(図4)、TAMpep826のM2マクロファージ結合標的タンパク質として選別された。
実施例3.M2マクロファージのITGB2発現の確認
3-1.ITGB2 mRNA発現の確認
M0、M1、M2マクロファージおよびTAMsにおいて、ITGB2のmRNA発現レベルを評価するために、リアルタイム重合酵素連鎖反応を行った。具体的には、M0、M1またはM2マクロファージに分化された細胞において、easy-BLUE total RNA Extraction Kit(iNtRON)を用いてRNAを抽出し、CycleScript-Reverse Transcriptase(Bioneer)を用いてcDNAで合成した。ActinまたはITGB2遺伝子のプライマー(表3)を用い、図5の条件でreal-time PCR(CFX96、Bio-rad)を進め、Actinに比べて各遺伝子の発現量を相対定量(Relative quantification)により比較および分析した。
3-1.ITGB2 mRNA発現の確認
M0、M1、M2マクロファージおよびTAMsにおいて、ITGB2のmRNA発現レベルを評価するために、リアルタイム重合酵素連鎖反応を行った。具体的には、M0、M1またはM2マクロファージに分化された細胞において、easy-BLUE total RNA Extraction Kit(iNtRON)を用いてRNAを抽出し、CycleScript-Reverse Transcriptase(Bioneer)を用いてcDNAで合成した。ActinまたはITGB2遺伝子のプライマー(表3)を用い、図5の条件でreal-time PCR(CFX96、Bio-rad)を進め、Actinに比べて各遺伝子の発現量を相対定量(Relative quantification)により比較および分析した。
その結果、ITGB2のmRNA発現は、M0およびM1に比べてM2マクロファージおよびTAMにおいて、有意に増加したことが示された(図6)。
3-2.ITGB2タンパク質発現の確認
M0、M1、M2マクロファージおよびTAMsにおいて、ITGB2のタンパク質発現レベルを評価するために、ウェスタンブロット解析を行った。具体的には、M0、M1およびM2マクロファージに分化されたそれぞれの細胞からProprep solution(iNtRON)を用いてタンパク質を抽出し、電気泳動法によりメンブレンにタンパク質をトランスファーした。メンブレンを5%のBSAに浸してブロックした後、1次抗体(ITGB2)を24時間4℃で処理し、2次抗体を1時間常温で処理した後、D-Plus(商標出願)ECL Pico System(Doning LS)を処理し、Davinch-Chemi(商標出願)imaging system(Intoxia)でタンパク質バンド写真を撮影した。
M0、M1、M2マクロファージおよびTAMsにおいて、ITGB2のタンパク質発現レベルを評価するために、ウェスタンブロット解析を行った。具体的には、M0、M1およびM2マクロファージに分化されたそれぞれの細胞からProprep solution(iNtRON)を用いてタンパク質を抽出し、電気泳動法によりメンブレンにタンパク質をトランスファーした。メンブレンを5%のBSAに浸してブロックした後、1次抗体(ITGB2)を24時間4℃で処理し、2次抗体を1時間常温で処理した後、D-Plus(商標出願)ECL Pico System(Doning LS)を処理し、Davinch-Chemi(商標出願)imaging system(Intoxia)でタンパク質バンド写真を撮影した。
その結果、ITGB2のタンパク質発現は、M0およびM1に比べて、M2マクロファージおよびTAMにおいて、有意に増加したことが示された(図7)。
3-3.免疫蛍光法によるITGB2タンパク質発現の確認
M0、M1、M2マクロファージおよびTAMsにおいて、ITGB2のタンパク質発現レベルを評価するために、免疫蛍光分析を行った。具体的には、M0、M1およびM2マクロファージに分化されたそれぞれの細胞を4%のホルマリンで固定させた後、PBSで洗浄し、5%のBSAに浸してブロックした後、1次抗体(ITGB2)を24時間4℃で処理し、2次抗体を2時間常温で処理し、染色を行った。染色した細胞は、DAPI mounting後、LSM800(Zeiss)で蛍光写真を撮影した。
M0、M1、M2マクロファージおよびTAMsにおいて、ITGB2のタンパク質発現レベルを評価するために、免疫蛍光分析を行った。具体的には、M0、M1およびM2マクロファージに分化されたそれぞれの細胞を4%のホルマリンで固定させた後、PBSで洗浄し、5%のBSAに浸してブロックした後、1次抗体(ITGB2)を24時間4℃で処理し、2次抗体を2時間常温で処理し、染色を行った。染色した細胞は、DAPI mounting後、LSM800(Zeiss)で蛍光写真を撮影した。
その結果、ITGB2のタンパク質は、M0およびM1に比べて、M2マクロファージおよびTAMにて高い発現レベルを示した(図8)。
実施例4.M2 TAM標的化ペプチドとITGB2の相互作用の確認
4-1.M2マクロファージ細胞膜におけるITGB2の発現の確認
ITGB2がM2マクロファージの細胞膜にて発現されるか否かを確認するため、M2マクロファージから細胞膜タンパク質およびサイトゾル(cytosol)タンパク質をそれぞれ分離抽出し、ビオチン化されたTAMpep826と反応させ、ITGB2の発現をウェスタンブロット解析により評価した。その結果、ITGB2タンパク質は、M2マクロファージの細胞膜にて発現されることが示された(図9)。
4-1.M2マクロファージ細胞膜におけるITGB2の発現の確認
ITGB2がM2マクロファージの細胞膜にて発現されるか否かを確認するため、M2マクロファージから細胞膜タンパク質およびサイトゾル(cytosol)タンパク質をそれぞれ分離抽出し、ビオチン化されたTAMpep826と反応させ、ITGB2の発現をウェスタンブロット解析により評価した。その結果、ITGB2タンパク質は、M2マクロファージの細胞膜にて発現されることが示された(図9)。
4-2.TAMpep826およびITGB2の相互作用の確認
M2マクロファージにおいて、TAMpep826がITGB2と相互作用するか否かを確認するために、TAMpep826およびビオチン化されたTAMpep826の競争的な反応を通じてITGB2の発現を評価した。具体的には、M2マクロファージに分化された細胞をスクレーパーで集めて、遠心分離(300Хg、5分)により細胞を洗浄し、細胞膜タンパク質抽出キット(Thermo Fisher scientific)を用いてマクロファージの細胞膜タンパク質を得た。TAMpep826またはscrambleペプチドを濃度別(0.001、0.01、0.1、1および10μg)に1時間前処理した後、タンパク質にビオチンが結合されたTAMpep826(200μg)と常温(20~24℃)で1時間反応させた後、Dynabeads(商標出願)M-280 Streptavidin(Thermo Fisher scientific)を用いて、TAMpep826と結合したタンパク質を得た。タンパク質をウェスタンブロット解析して、ITGB2の発現を確認した。
M2マクロファージにおいて、TAMpep826がITGB2と相互作用するか否かを確認するために、TAMpep826およびビオチン化されたTAMpep826の競争的な反応を通じてITGB2の発現を評価した。具体的には、M2マクロファージに分化された細胞をスクレーパーで集めて、遠心分離(300Хg、5分)により細胞を洗浄し、細胞膜タンパク質抽出キット(Thermo Fisher scientific)を用いてマクロファージの細胞膜タンパク質を得た。TAMpep826またはscrambleペプチドを濃度別(0.001、0.01、0.1、1および10μg)に1時間前処理した後、タンパク質にビオチンが結合されたTAMpep826(200μg)と常温(20~24℃)で1時間反応させた後、Dynabeads(商標出願)M-280 Streptavidin(Thermo Fisher scientific)を用いて、TAMpep826と結合したタンパク質を得た。タンパク質をウェスタンブロット解析して、ITGB2の発現を確認した。
その結果、scrambledペプチドを前処理したとき、ビオチン化されたTAMpep826と結合されたITGB2の発現は、影響がないことが示されたのに対し、TAMpep826で前処理したときは、濃度によってITGB2発現が抑制されることが示された(図10)。このことから、TAMpep826がM2マクロファージの細胞膜において、ITGB2と相互作用することを確認することができた。
4-3.免疫蛍光法を用いたTAMpep826およびITGB2の相互作用の確認
M2マクロファージの細胞膜において、ITGB2およびTAMpep826がco-localizationするか否かを確認するために、FITCが結合されたTAMpep826を用いて免疫蛍光分析を行った。その結果、TAMpep826とITGB2は、M2マクロファージの細胞膜に集中的に分布されていることが示された(図11)。
M2マクロファージの細胞膜において、ITGB2およびTAMpep826がco-localizationするか否かを確認するために、FITCが結合されたTAMpep826を用いて免疫蛍光分析を行った。その結果、TAMpep826とITGB2は、M2マクロファージの細胞膜に集中的に分布されていることが示された(図11)。
4-4.TB511とITGB2の結合部位の確認
CD18(ITGB2)のシステイン(cysteine)rich部分の配列を基に(uniport_p05107、Cystein-rich tandem repeats region:449-617)、trRosettaアルゴリズム(algorithm)を用いて、3次構造(teritiary structure)を構成した(https://yanglab.nankai.edu.cn/trRosetta/)。その後、TB511とCD18のドッキングシミュレーション(Docking simulation)は、trRosettaで作ったCD18PDBファイルとTB511のアミノ酸配列を有し、CABS-dock serverを通じて行われた(http://biocomp.chem.uw.edu.pl/CABSdock/)。ドッキングシミュレーションの結果、作られた10個のモデルのうち、TB511配列のアラニン置換の結果を基に代表モデルを選定した(図12)。
CD18(ITGB2)のシステイン(cysteine)rich部分の配列を基に(uniport_p05107、Cystein-rich tandem repeats region:449-617)、trRosettaアルゴリズム(algorithm)を用いて、3次構造(teritiary structure)を構成した(https://yanglab.nankai.edu.cn/trRosetta/)。その後、TB511とCD18のドッキングシミュレーション(Docking simulation)は、trRosettaで作ったCD18PDBファイルとTB511のアミノ酸配列を有し、CABS-dock serverを通じて行われた(http://biocomp.chem.uw.edu.pl/CABSdock/)。ドッキングシミュレーションの結果、作られた10個のモデルのうち、TB511配列のアラニン置換の結果を基に代表モデルを選定した(図12)。
その結果、TB511のLEU(6)は、CD18のLEU(528)、THR(538)、LEU(556)、CYS(557)およびPHE(558)部位と結合(bindin)することが予測され、TB511のTRP(12)は、CD18のGLU(466)、ILE(469)、CYS(470)およびARG(471)と結合することが予測された。また、TB511のLEU(6)およびTRP(12)をそれぞれアラニンで置換し、CD18との結合をシミュレーションすると、二つの部位全部CD18のどの配列とも結合しないことが示された。したがって、TB511のLEU(6)およびTRP(12)は、TB511とCD18間のドッキングにおいて核心的な部分であり、TB511は、CD18の466~565に結合することが予測され得る(図13)。
実施例5.ITGB2結合部分の合成
5-1.ITGB2結合PDC(peptide-drug conjugate)の合成
下記表4のMelittin-dKLAおよびTB511ペプチドをGenScript(Piscataway、NJ、USA)に合成依頼して供給を受け、その後、実験にてD-PBSに5mg/mlで溶かし、用いられた。dKLAは、ペプチド間アミド結合を通じて連結しており、メリチンまたはTAMpep826とdKLA間の相互作用および折り畳みを最小化するため、真ん中に4個のグリシンおよび1個のセリンで構成されたリンカーを配置し、両端を区分し、KLAは、体内の分解を最小化するために、L型でないD型異性体を用いた。また、M-DM1を作製するために、25mMのホウ酸ナトリウム緩衝液(25mM NaCl、1mM EDTA、pH8.0)に溶かしたマレイミド(Maleimide)-修飾されたメリチン(GenScript、Beijing、China)(100μM、1mL、0.1mmoL)にDM1(Mertansine)(MedChem Express、Princeton)(1.1当量、DMF中10mM)およびDMF(Dimethylformamide)を添加し、37℃で1時間反応させた後、生成物をDulbeccoのリン酸緩衝食塩水(DPBS;Welgene)で限外濾過により3回濾過することによって、マレイミド(Maleimide)-修飾されたメリチンMのN-末端にDM1を結合させてPDCを作製し、M-DM1として命名した。作製したM-DM1は、Poroshell 120 C18 column(2.7μm、3×50mm、Agilent、Santa Clara、CA、USA)にて逆相高性能液体クロマトグラフィー(HPLC)を5μL、0.5mL/分の速度で注入し、特性を分析した。
5-1.ITGB2結合PDC(peptide-drug conjugate)の合成
下記表4のMelittin-dKLAおよびTB511ペプチドをGenScript(Piscataway、NJ、USA)に合成依頼して供給を受け、その後、実験にてD-PBSに5mg/mlで溶かし、用いられた。dKLAは、ペプチド間アミド結合を通じて連結しており、メリチンまたはTAMpep826とdKLA間の相互作用および折り畳みを最小化するため、真ん中に4個のグリシンおよび1個のセリンで構成されたリンカーを配置し、両端を区分し、KLAは、体内の分解を最小化するために、L型でないD型異性体を用いた。また、M-DM1を作製するために、25mMのホウ酸ナトリウム緩衝液(25mM NaCl、1mM EDTA、pH8.0)に溶かしたマレイミド(Maleimide)-修飾されたメリチン(GenScript、Beijing、China)(100μM、1mL、0.1mmoL)にDM1(Mertansine)(MedChem Express、Princeton)(1.1当量、DMF中10mM)およびDMF(Dimethylformamide)を添加し、37℃で1時間反応させた後、生成物をDulbeccoのリン酸緩衝食塩水(DPBS;Welgene)で限外濾過により3回濾過することによって、マレイミド(Maleimide)-修飾されたメリチンMのN-末端にDM1を結合させてPDCを作製し、M-DM1として命名した。作製したM-DM1は、Poroshell 120 C18 column(2.7μm、3×50mm、Agilent、Santa Clara、CA、USA)にて逆相高性能液体クロマトグラフィー(HPLC)を5μL、0.5mL/分の速度で注入し、特性を分析した。
5-2.ITGB2結合ADC(Antibody-drug conjugate)の合成
5-2-1.抗-CD18抗体およびDM1のADCの作製
マクロファージ-1抗原(Macrophage-1 antigen、Mac-1)のうちの一つである、CD18のM2 TAMにおける活性型構造(Active conformation)に特異的に結合する抗体(図14)を作製するために、抗-CD18抗体を分泌するハイブリドーマ(MM18/2.a.8)細胞の培養液を集めて、2,500rpm、4℃で10分間遠心分離し、上澄み液を得た後、タンパク質G-セファロースカラムクロマトグラフィー方法により精製した。PBSで予め平衡化させたタンパク質G-セファロースカラム(Pharmacia、スウェーデン)に抗体溶液をゆっくりと通過させ、カラムをペリスタルティックポンプ(peristatic pump)に連結し、PBSで十分に洗浄した。洗浄完了後、0.2Mのグリシン(glycin)-HCl(pH2.7)で抗体を溶出した。このとき、予め用意した1MのTris(pH9.0)を含むチューブに前記溶出液を緩衝させた。この抗体をPBSに透析(dialysis)した後、用いた。BCAタンパク質分析キット(BCA(商標出願)Protein Assay Kit、Pierce)を用いて精製された抗体量を測定し、Flow cytometry分析を通じて、抗体の結合能を確認した。精製した抗-CD18抗体をPBS(pH7.4)にバッファー交換し、抗-CD18抗体(1mg/ml、6.67μM)にDMSOに溶かしたSMCC-DM1(mertansine、120μM)(MedChemExpress)を1:18の比率で混ぜ、常温で4~20時間反応させた。未反応のDM1を除去するため、10KDa cutoff centrifugal filterを用いて、CD18-DM1をPBS(pH7.4)にバッファー交換し、0.2μmシリンジフィルターでろ過した。UV-Vis spectroscopyを用いて、抗-CD18抗体(280nm)に結合されたDM1(252nm)の量を測定し、DM1と抗-CD18抗体の比率(drug antibody ratio、DAR)を計算し、DAR値は5.8として示された。このように作製された抗-CD18抗体とDM1が結合されたADCをCD18-DM1と命名した。
5-2-1.抗-CD18抗体およびDM1のADCの作製
マクロファージ-1抗原(Macrophage-1 antigen、Mac-1)のうちの一つである、CD18のM2 TAMにおける活性型構造(Active conformation)に特異的に結合する抗体(図14)を作製するために、抗-CD18抗体を分泌するハイブリドーマ(MM18/2.a.8)細胞の培養液を集めて、2,500rpm、4℃で10分間遠心分離し、上澄み液を得た後、タンパク質G-セファロースカラムクロマトグラフィー方法により精製した。PBSで予め平衡化させたタンパク質G-セファロースカラム(Pharmacia、スウェーデン)に抗体溶液をゆっくりと通過させ、カラムをペリスタルティックポンプ(peristatic pump)に連結し、PBSで十分に洗浄した。洗浄完了後、0.2Mのグリシン(glycin)-HCl(pH2.7)で抗体を溶出した。このとき、予め用意した1MのTris(pH9.0)を含むチューブに前記溶出液を緩衝させた。この抗体をPBSに透析(dialysis)した後、用いた。BCAタンパク質分析キット(BCA(商標出願)Protein Assay Kit、Pierce)を用いて精製された抗体量を測定し、Flow cytometry分析を通じて、抗体の結合能を確認した。精製した抗-CD18抗体をPBS(pH7.4)にバッファー交換し、抗-CD18抗体(1mg/ml、6.67μM)にDMSOに溶かしたSMCC-DM1(mertansine、120μM)(MedChemExpress)を1:18の比率で混ぜ、常温で4~20時間反応させた。未反応のDM1を除去するため、10KDa cutoff centrifugal filterを用いて、CD18-DM1をPBS(pH7.4)にバッファー交換し、0.2μmシリンジフィルターでろ過した。UV-Vis spectroscopyを用いて、抗-CD18抗体(280nm)に結合されたDM1(252nm)の量を測定し、DM1と抗-CD18抗体の比率(drug antibody ratio、DAR)を計算し、DAR値は5.8として示された。このように作製された抗-CD18抗体とDM1が結合されたADCをCD18-DM1と命名した。
5-2-2.抗-CD18抗体およびMMAE(Monomethyl auristatin E)のADCの作製
前記実施例にて精製した抗-CD18抗体をPBS(pH7.4)にバッファー交換し、CD18抗体のジスルフィド結合(disulfide bond)を部分的に還元するために、抗-CD18抗体(1mg/ml、6.67μM)に1mM DTT(66.7μM)を1:10の比率で混ぜ、37℃で1~2時間反応させ、PBS(pH7.4)にバッファー交換した。部分的に還元された抗-CD18抗体(1mg/ml、6.67μM)に10mM Suo-Val-Cit-PAB-MMAE(MedChemExpress)を1:20~1:40の比率で混ぜ、4℃で12時間反応させ、PBS(pH7.4)にバッファー交換した。UV-Vis spectroscopyを用いて、抗-CD18抗体(280nm)に結合されたvc-MMAE(248nm)の量を測定し、vc-MMAEと抗-CD18抗体の比率(drug antibody ratio、DAR)を計算し、DAR値は、2.8~5.4として示された。このように作製された抗-CD18抗体とMMAEが結合されたADCをCD18-MMAEと命名した。
前記実施例にて精製した抗-CD18抗体をPBS(pH7.4)にバッファー交換し、CD18抗体のジスルフィド結合(disulfide bond)を部分的に還元するために、抗-CD18抗体(1mg/ml、6.67μM)に1mM DTT(66.7μM)を1:10の比率で混ぜ、37℃で1~2時間反応させ、PBS(pH7.4)にバッファー交換した。部分的に還元された抗-CD18抗体(1mg/ml、6.67μM)に10mM Suo-Val-Cit-PAB-MMAE(MedChemExpress)を1:20~1:40の比率で混ぜ、4℃で12時間反応させ、PBS(pH7.4)にバッファー交換した。UV-Vis spectroscopyを用いて、抗-CD18抗体(280nm)に結合されたvc-MMAE(248nm)の量を測定し、vc-MMAEと抗-CD18抗体の比率(drug antibody ratio、DAR)を計算し、DAR値は、2.8~5.4として示された。このように作製された抗-CD18抗体とMMAEが結合されたADCをCD18-MMAEと命名した。
実施例6.ITGB2結合PDCのM2 TAM結合の確認
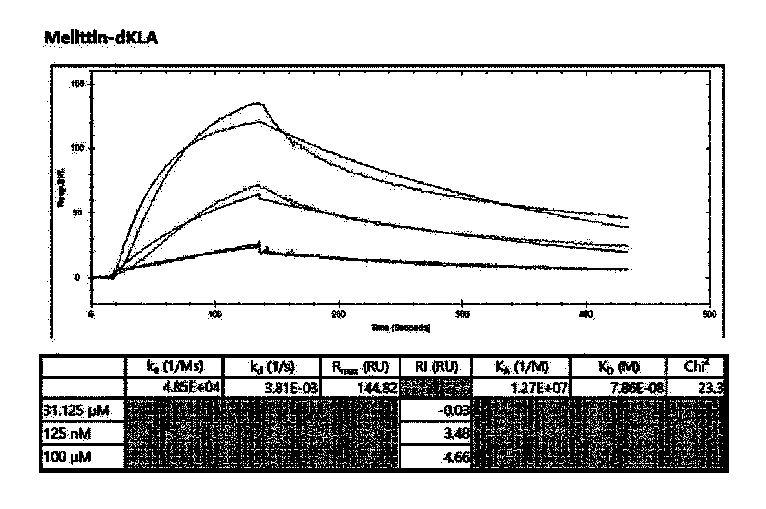
ITGB2およびMelittin-dKLAの結合力を確認するために、ITGB2タンパク質を金薄膜センサーチップ上にコーティングした後、陽性対照群としてITGB2抗体およびMelittin-dKLAをそれぞれ流し、反射光を測定し、表面プラズモン共鳴(Surface plasmon resonance、SPR)分析を行った。具体的に、センサーチップ表面にITGB2を固定させた後、アミンカップリング(amine coupling)を用いて、下記表5の条件で固定化(immobilization)を行った(図15)。その後、ITGB2がコーティングされたセンサチップに多様な濃度のITGB2抗体およびMelittin-dKLAを流し、結合(association)および解離(dissociation)区間を観察し、センサーグラムを通じて下記表6の分子間結合速度定数分析(kinetic evoluation)条件で分子間結合速度定数(kinetic prarmeter)を計算した。
ITGB2およびMelittin-dKLAの結合力を確認するために、ITGB2タンパク質を金薄膜センサーチップ上にコーティングした後、陽性対照群としてITGB2抗体およびMelittin-dKLAをそれぞれ流し、反射光を測定し、表面プラズモン共鳴(Surface plasmon resonance、SPR)分析を行った。具体的に、センサーチップ表面にITGB2を固定させた後、アミンカップリング(amine coupling)を用いて、下記表5の条件で固定化(immobilization)を行った(図15)。その後、ITGB2がコーティングされたセンサチップに多様な濃度のITGB2抗体およびMelittin-dKLAを流し、結合(association)および解離(dissociation)区間を観察し、センサーグラムを通じて下記表6の分子間結合速度定数分析(kinetic evoluation)条件で分子間結合速度定数(kinetic prarmeter)を計算した。
その結果、陽性対照群であるITGB2抗体の二つの分子間の結合力を評価する解離速度定数(kd;dissociation rate constant)を結合速度定数(ka;association rate constant)に分けて得る平衡解離定数(KD;equilibrium dissociation constant)が1.14-8で、Melittin-dKLAの平衡解離定数は、7.86-8で示された(図16および17)。したがって、Melittin-dKLAがITGB2と結合力を有していることが確認された。
実施例7.PDCのITGB2によるM2 TAM細胞死滅効果の確認
7-1.ITGB2の発現抑制細胞モデルの作製
M2マクロファージにおいて、ITGB2を通じて細胞死滅を誘導するか否かを確認することに使用するための細胞モデルとして、Crispr/cas9を用い、M2マクロファージにてITGB2の発現が抑制された細胞モデルを作製した。具体的には、M2マクロファージに分化された細胞をOpti-MEM培地で培養した。Crispr/cas9は、CRISPRMAX(商標出願)Reagent kit(Thermo Fisher scientific)のCas9 protein V2(Thermo Fisher scientific)とgRNA(Genscript;ITGB2;表7)をCas9 Plus(商標出願)Reagent(Thermo Fisher scientific)と共に混ぜ、CRISPRMAX(商標出願)ReagentをOpti-MEM培地に希釈した後、全部混ぜて5-10分間反応させた後、M2マクロファージに分化された細胞に添加し、37℃で2~3日間培養した。その後、ITGB2のmRNA発現レベルを確認した。
7-1.ITGB2の発現抑制細胞モデルの作製
M2マクロファージにおいて、ITGB2を通じて細胞死滅を誘導するか否かを確認することに使用するための細胞モデルとして、Crispr/cas9を用い、M2マクロファージにてITGB2の発現が抑制された細胞モデルを作製した。具体的には、M2マクロファージに分化された細胞をOpti-MEM培地で培養した。Crispr/cas9は、CRISPRMAX(商標出願)Reagent kit(Thermo Fisher scientific)のCas9 protein V2(Thermo Fisher scientific)とgRNA(Genscript;ITGB2;表7)をCas9 Plus(商標出願)Reagent(Thermo Fisher scientific)と共に混ぜ、CRISPRMAX(商標出願)ReagentをOpti-MEM培地に希釈した後、全部混ぜて5-10分間反応させた後、M2マクロファージに分化された細胞に添加し、37℃で2~3日間培養した。その後、ITGB2のmRNA発現レベルを確認した。
その結果、ITGB2 sgRNAを注入したM2マクロファージは、ITGB2の発現が対照群に比べて有意に減少することが示された(図18)。
7-2.Melittin-dKLAのITGB2によるM2 TAM細胞死滅の確認
Melittin-dKLAがM2マクロファージにおいて、ITGB2に結合し、細胞アポトーシス(apoptosis)を誘導するか否かを確認するために、前記実施例7-1にて作製したCrispr/cas9によりITGB2発現が抑制されたM2マクロファージにMelittin-dKLA(1μM)を24時間処理し、CCK-8分析方法を用いて細胞生存率を分析した。具体的には、前記実施例7-1にて作製したITGB2ロックダウンマクロファージにMelittin-dKLA(1μM)を1時間反応させた。反応後、培地を交換し、37℃で24時間培養した。細胞生存能を確認するために、CCK-8 reagent(Enzo Life Sciences)を培地の1/10入れ、37℃で3時間反応させた。吸光度は、microplate leader(Molecular Devices)で450nmにて測定した。
Melittin-dKLAがM2マクロファージにおいて、ITGB2に結合し、細胞アポトーシス(apoptosis)を誘導するか否かを確認するために、前記実施例7-1にて作製したCrispr/cas9によりITGB2発現が抑制されたM2マクロファージにMelittin-dKLA(1μM)を24時間処理し、CCK-8分析方法を用いて細胞生存率を分析した。具体的には、前記実施例7-1にて作製したITGB2ロックダウンマクロファージにMelittin-dKLA(1μM)を1時間反応させた。反応後、培地を交換し、37℃で24時間培養した。細胞生存能を確認するために、CCK-8 reagent(Enzo Life Sciences)を培地の1/10入れ、37℃で3時間反応させた。吸光度は、microplate leader(Molecular Devices)で450nmにて測定した。
その結果、対照群M2マクロファージにおいて、Melittin-dKLAにより細胞生存率が著しく減少したが、ITGB2がロックダウンされたM2マクロファージでは、Melittin-dKLAによる細胞生存率の減少が抑制されることが示された(図19)。したがって、これを通じて、Melittin-dKLAがM2マクロファージのITGB2と特異的に結合することによってM2マクロファージの細胞アポトーシスを誘導することを確認することができた。
7-3.TB511のITGB2によるM2 TAM細胞死滅の確認
TB511(TAMpep826-dKLA)がM2マクロファージにおいて、ITGB2により細胞死滅を誘導するか否かを確認するために、前記実施例7-1にて作製したCrispr/cas9によりITGB2発現が抑制されたM2マクロファージにTB511を反応させた。その結果、M2マクロファージは、TB511により50%程度の細胞生存能を示したが、ITGB2発現が抑制された細胞からは細胞生存能が有意に増加することが示された(図20)。
TB511(TAMpep826-dKLA)がM2マクロファージにおいて、ITGB2により細胞死滅を誘導するか否かを確認するために、前記実施例7-1にて作製したCrispr/cas9によりITGB2発現が抑制されたM2マクロファージにTB511を反応させた。その結果、M2マクロファージは、TB511により50%程度の細胞生存能を示したが、ITGB2発現が抑制された細胞からは細胞生存能が有意に増加することが示された(図20)。
7-4.ITGB2抗体によるTB511の細胞死滅誘導減少の確認
TB511がM2マクロファージにおいて、ITGB2により細胞死滅を誘導するか否かを確認するために、前記実施例7-1にて作製したITGB2発現が抑制されたM2マクロファージに抗-ITGB2抗体(Polyclonal Rabbit anti-Human ITGB2/CD18抗体)(LS-C312785;LS Bio)(1μg)を1時間前処理した後、TB511(1μM)を1時間反応させた後,細胞死滅誘発するか否かをCCK-8分析を用いた細胞生存能分析により、細胞死滅マーカーであるcaspase-3のタンパク質発現をウェスタンブロット解析により、caspase-3、caspase-8、caspase-9の遺伝子発現をReal-time PCRにより、およびcaspase-3のタンパク質発現誘導を免疫蛍光法により確認した。
TB511がM2マクロファージにおいて、ITGB2により細胞死滅を誘導するか否かを確認するために、前記実施例7-1にて作製したITGB2発現が抑制されたM2マクロファージに抗-ITGB2抗体(Polyclonal Rabbit anti-Human ITGB2/CD18抗体)(LS-C312785;LS Bio)(1μg)を1時間前処理した後、TB511(1μM)を1時間反応させた後,細胞死滅誘発するか否かをCCK-8分析を用いた細胞生存能分析により、細胞死滅マーカーであるcaspase-3のタンパク質発現をウェスタンブロット解析により、caspase-3、caspase-8、caspase-9の遺伝子発現をReal-time PCRにより、およびcaspase-3のタンパク質発現誘導を免疫蛍光法により確認した。
その結果、M2マクロファージは、ITGB2抗体によっては細胞生存能には影響がなく、TB511によっては細胞生存能が有意に減少した。その反面、ITGB2抗体を前処理したM2マクロファージでは、TB511による細胞生存能が有意に増加したことが示された(図21)。また、M2マクロファージは、TB511によりcaspase-3発現が有意に増加するのに対し、ITGB2抗体を前処理したM2マクロファージでは、TB511によるcaspase-3発現が有意に減少した(図21)。また、M2マクロファージは、TB511によりcaspase-3、caspase-8およびcaspase-9の発現が有意に増加するのに対し、ITGB2抗体を前処理したM2マクロファージでは、TB511によるcaspase-3、caspase-8およびcaspase-9の発現が有意に減少した(図21)。M2マクロファージは、TB511によりcaspase-3発現が増加するのに対し、ITGB2抗体を前処理したM2マクロファージでは、TB511によるcaspase-3発現が減少した(図21)。さらに、TB511のミトコンドリア標的化を確認した結果、ITGB2抗体を前処理したM2マクロファージは、ITGB2前処理していない細胞に比べて、ミトコンドリアとTB511のco-localizationが減少した(図21)。
実施例8.3D癌オルガノイドにおけるPDCの効能の確認
8-1.乳癌3DオルガノイドにおけるTB511の効果の確認
in vitroでの限界点を補完し、in vivoを代替すべく乳癌の癌微小環境(Tumor microenvironment;TME)を模擬した3Dオルガノイドを作製し、これに対するTB511の効果を確認した。具体的には、RPMI-1640培養液にマトリゲル(matrigel)が3%となるように混合し、MDA-MB-231ヒト乳癌細胞、CAF(Cancer-associated Fibroblast)およびIncucyte(登録商標)Nuclight Lentivirus Reagents(Sartorius)を用いて、GFPが発現されるように作製したTHP-1細胞を計数し、5:1:1の比率で200μlとなるように96u-bottom 3-Dcultue plate(Sbio)に分注した。培養後、1200rpmで3分間遠心分離し、細胞を集めた後、37℃のインキュベーターで48時間培養し、スフェロイド(spheroid)を形成した。スフェロイド形成2日目からTB511を1μM、2μM、4μMおよび8μMの濃度で3日毎にそれぞれ処理し、蛍光顕微鏡で画像を撮影し、Bright-field画像を撮影した後、ペレットの直径を測定方法により、スフェロイド領域(spheroid area)を測定した。また、平均腫瘍回転楕円体直径は、オープンソースを用いて、スフェロイド当たり平均3個の直径を測定し、ImageJ(software version1.47m)によりサイズを分析し、スフェロイドの大きさは、Bright-field画像を撮影した後、(20X)、平均腫瘍回転楕円体直径をスフェロイド当たり平均3個ずつ測定し、ImageJ(software version 1.47m)により分析した。併せて、薬物処理10日目にスフェロイドを固定し、腫瘍増殖因子であるki-67に対する抗体(abcam)を反応させて免疫蛍光染色を行った(対照染色:DAPI)。THP-1の場合、別途の染色を進めず、細胞内に発現するGFP蛍光を共焦点顕微鏡で画像を撮影し、蛍光を発現する細胞の数を測定した。
8-1.乳癌3DオルガノイドにおけるTB511の効果の確認
in vitroでの限界点を補完し、in vivoを代替すべく乳癌の癌微小環境(Tumor microenvironment;TME)を模擬した3Dオルガノイドを作製し、これに対するTB511の効果を確認した。具体的には、RPMI-1640培養液にマトリゲル(matrigel)が3%となるように混合し、MDA-MB-231ヒト乳癌細胞、CAF(Cancer-associated Fibroblast)およびIncucyte(登録商標)Nuclight Lentivirus Reagents(Sartorius)を用いて、GFPが発現されるように作製したTHP-1細胞を計数し、5:1:1の比率で200μlとなるように96u-bottom 3-Dcultue plate(Sbio)に分注した。培養後、1200rpmで3分間遠心分離し、細胞を集めた後、37℃のインキュベーターで48時間培養し、スフェロイド(spheroid)を形成した。スフェロイド形成2日目からTB511を1μM、2μM、4μMおよび8μMの濃度で3日毎にそれぞれ処理し、蛍光顕微鏡で画像を撮影し、Bright-field画像を撮影した後、ペレットの直径を測定方法により、スフェロイド領域(spheroid area)を測定した。また、平均腫瘍回転楕円体直径は、オープンソースを用いて、スフェロイド当たり平均3個の直径を測定し、ImageJ(software version1.47m)によりサイズを分析し、スフェロイドの大きさは、Bright-field画像を撮影した後、(20X)、平均腫瘍回転楕円体直径をスフェロイド当たり平均3個ずつ測定し、ImageJ(software version 1.47m)により分析した。併せて、薬物処理10日目にスフェロイドを固定し、腫瘍増殖因子であるki-67に対する抗体(abcam)を反応させて免疫蛍光染色を行った(対照染色:DAPI)。THP-1の場合、別途の染色を進めず、細胞内に発現するGFP蛍光を共焦点顕微鏡で画像を撮影し、蛍光を発現する細胞の数を測定した。
その結果、薬物を処理していない群は、時間が経つにつれてスフェロイドの大きさがだんだん大きくなり、単球(monocyte)であるTHP-1細胞が癌細胞およびCAFと共培養時、癌細胞およびTMEによってTAMに分化され、腫瘍成長を促進することが示された。その反面、TB511を処理した群では、10日目に1μMの濃度で濃度依存的にスフェロイドの大きさが減少することが確認され(図22)、GFP蛍光を発現するTHP-1細胞の数が薬物無処理群に比べて濃度依存的に著しく減少することが示された(***p<0.001)(図23)。したがって、ITGB2結合PDCであるTB511がTHP-1細胞に選択的に結合し、MDA-MB-231ヒト乳癌の細胞死滅を誘導することが確認された。
8-2.肺癌3DオルガノイドにおけるTB511の効果の確認
前記実施例8-1の方法によりA549ヒト肺癌細胞、CAFおよびTHP-1細胞を混合し、肺癌3Dスフェロイドを作製した後、TB511を1μM、2μMおよび4μMの濃度でそれぞれ処理し、その効果を前記実施例8-1と同様に分析した。スフェロイド作製時、癌細胞単独または癌細胞+CAF細胞のみを混合して、3Dスフェロイドも作製し、スフェロイドの大きさを比較した。
前記実施例8-1の方法によりA549ヒト肺癌細胞、CAFおよびTHP-1細胞を混合し、肺癌3Dスフェロイドを作製した後、TB511を1μM、2μMおよび4μMの濃度でそれぞれ処理し、その効果を前記実施例8-1と同様に分析した。スフェロイド作製時、癌細胞単独または癌細胞+CAF細胞のみを混合して、3Dスフェロイドも作製し、スフェロイドの大きさを比較した。
その結果、A549細胞単独またはA549+CAF細胞のみでスフェロイドを形成したときよりもA549+CAF+THP-1細胞でスフェロイドを形成したときのスフェロイドの大きさが著しく増加することが示された。また、TB511を処理していない群に比べて、TB511を処理した群において、スフェロイドの大きさがTB511の濃度依存的に著しく減少することが示された(***p<0.001)(図24)。また、薬物を処理してから10日目にスフェロイドを蛍光染色し、関連マーカーを確認した結果、TB511を処理していない群に比べて、THP-1細胞の数が濃度依存的に著しく減少しており、腫瘍増殖因子ki-67も濃度依存的に減少することが示された(***p<0.001)(図25)。
8-3.肺癌3DオルガノイドにおけるM-DM1の効果の確認
肺癌に対するM-DM1(Mel-DM1)の効能を確認するため、前記実施例8-1の方法によりA549ヒト肺癌細胞、CAFおよびTHP-1細胞を混合して、肺癌3Dスフェロイドを作製した後、M-DM1を1μM、2μMおよび4μMの濃度でそれぞれ処理し、その効果を前記実施例8-1と同様に分析した。
肺癌に対するM-DM1(Mel-DM1)の効能を確認するため、前記実施例8-1の方法によりA549ヒト肺癌細胞、CAFおよびTHP-1細胞を混合して、肺癌3Dスフェロイドを作製した後、M-DM1を1μM、2μMおよび4μMの濃度でそれぞれ処理し、その効果を前記実施例8-1と同様に分析した。
その結果、M-DM1を処理していない群に比べて、M-DM1を処理した群において、濃度依存的にスフェロイドの大きさが減少することが示された(***p<0.001)(図26)。
実施例9.抗癌剤耐性3D癌オルガノイドにおけるPDCの効能の確認
9-1.抗癌剤耐性肺癌3DオルガノイドにおけるTB511の効果の確認
カルボプラチン(Carboplatin)耐性肺癌に対するTB511の効能を確認するため、前記実施例8-1の方法によりカルボプラチン耐性A549細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、TB511を1μM、2μMおよび4μMの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
9-1.抗癌剤耐性肺癌3DオルガノイドにおけるTB511の効果の確認
カルボプラチン(Carboplatin)耐性肺癌に対するTB511の効能を確認するため、前記実施例8-1の方法によりカルボプラチン耐性A549細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、TB511を1μM、2μMおよび4μMの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
その結果、A549耐性細胞単独またはA549+CAF細胞のみでスフェロイドを形成したときよりも、A549+CAF+THP-1細胞でスフェロイドを形成したときのスフェロイドの大きさが著しく増加することが示され、TB511を処理していない群に比べて、TB511を処理した群において、スフェロイドの大きさがTB511濃度依存的に著しく減少することが示された(***p<0.001)(図27)。また、薬物を処理してから10日目にスフェロイドを免疫蛍光染色し、関連マーカーを確認した結果、TB511無処理群に比べて、TB511を処理した群において、THP-1細胞の数が濃度依存的に著しく減少しており、腫瘍増殖因子ki-67も2μMから有意的に減少したことが示された(***p<0.001)(図28)。
9-2.抗癌剤耐性前立腺癌3DオルガノイドにおけるTB511の効果の確認
ドセタキセル(Docetaxel)耐性前立腺癌に対するTB511の効能を確認するため、前記実施例8-1の方法によりドセタキセル耐性PC3前立腺癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、TB511を1μM、2μMまたは4μMの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
ドセタキセル(Docetaxel)耐性前立腺癌に対するTB511の効能を確認するため、前記実施例8-1の方法によりドセタキセル耐性PC3前立腺癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、TB511を1μM、2μMまたは4μMの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
その結果、PC3耐性細胞単独またはPC3+CAF細胞のみでスフェロイドを形成したときよりも、PC3+CAF+THP-1細胞でスフェロイドを形成したとき、その大きさが著しく増加しており、TB511を処理していない群に比べて、TB511を処理した群において、スフェロイドの大きさがTB511濃度依存的に著しく減少することが示された(***p<0.001)(図29)。また、薬物を処理してから10日目にスフェロイドを免疫蛍光染色し、関連マーカーを確認した結果、TB511無処理群に比べて、TB511を処理した群において、THP-1細胞の数が濃度依存的に著しく減少しており、腫瘍増殖因子ki-67も減少する傾向を示した(**p<0.01、***p<0.001)(図30)。
実施例10.3D癌オルガノイドにおけるADCの効能の確認
10-1.乳癌3DオルガノイドにおけるADCの効果の確認
乳癌に対するITGB2結合ADC(Antibody-drug conjugate)の効能を確認するため、前記実施例8-1の方法によりMDA-MB-231ヒト乳癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、本発明のADCであるCD18-DM1またはCD18-MMAEを10μgおよび20μgの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
10-1.乳癌3DオルガノイドにおけるADCの効果の確認
乳癌に対するITGB2結合ADC(Antibody-drug conjugate)の効能を確認するため、前記実施例8-1の方法によりMDA-MB-231ヒト乳癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、本発明のADCであるCD18-DM1またはCD18-MMAEを10μgおよび20μgの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
その結果、ADCを処理していない群は、時間が経つにつれて乳癌スフェロイドの大きさがだんだん大きくなったが、ADCを処理した群では、8日目にスフェロイドの大きさが減少することが示された(図31および32)。また、ADCを処理していない群において、GFP陽性THP-1細胞が強く増加したが、CD18-DM1またはCD18-MMAE処理群では、濃度依存的に減少することが示された(***p<0.001)(図31および32)。
10-2.肺癌3DオルガノイドにおけるADCの効果の確認
肺癌に対するADCの効能を確認するため、前記実施例8-1の方法によりA549ヒト肺癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、本発明のADCであるCD18-DM1またはCD18-MMAEを10μgの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
肺癌に対するADCの効能を確認するため、前記実施例8-1の方法によりA549ヒト肺癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、本発明のADCであるCD18-DM1またはCD18-MMAEを10μgの濃度でそれぞれ処理した後、その効果を前記実施例8-1と同様に分析した。
その結果、ADCを処理していない群は、時間が経つにつれてスフェロイドの大きさがだんだん大きくなるのに対し、CD18-DM1またはCD18-MMAEを処理した群では、8日目にスフェロイドの大きさが減少することが示された(図33)。また、薬物を処理してから8日目にスフェロイドを免疫蛍光染色し、関連マーカーを確認した結果、ADCを処理していない群において、THP-1細胞が強く増加するのに対し、ADC処理群では、著しく減少することが示された(***p<0.001)(図34)。
実施例11.抗癌剤耐性3D癌オルガノイドにおけるADCの効能の確認
11-1.抗癌剤耐性肺癌3DオルガノイドにおけるADCの効果の確認
カルボプラチン耐性肺癌に対するADCの効能を確認するため、前記実施例8-1の方法によりカルボプラチン耐性A549細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、CD18-DM1またはCD18-MMAEをそれぞれ10μgの濃度で処理した後、その効果を前記実施例8-1と同様に分析した。
11-1.抗癌剤耐性肺癌3DオルガノイドにおけるADCの効果の確認
カルボプラチン耐性肺癌に対するADCの効能を確認するため、前記実施例8-1の方法によりカルボプラチン耐性A549細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、CD18-DM1またはCD18-MMAEをそれぞれ10μgの濃度で処理した後、その効果を前記実施例8-1と同様に分析した。
その結果、ADCを処理していない群は、時間が経つにつれてスフェロイドの大きさがだんだん大きくなるのに対し、CD18-DM1またはCD18-MMAEを処理した群では、8日目にスフェロイドの大きさが減少することが示された(図35)。また、薬物を処理してから8日目にスフェロイドを免疫蛍光染色し、関連マーカーを確認した結果、ADCを処理していない群に比べて、CD18-DM1またはCD18-MMAEを処理した群において、THP-1細胞の数が有意に減少し、腫瘍増殖因子ki-67も減少することが示された(***p<0.001)(図36)。
11-2.抗癌剤耐性前立腺癌3DオルガノイドにおけるADCの効果の確認
ドセタキセル耐性前立腺癌に対するADCの効能を確認するため、前記実施例8-1の方法によりドセタキセル耐性PC3前立腺癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、CD18-DM1またはCD18-MMAEをそれぞれ10μgの濃度で処理した後、その効果を前記実施例8-1と同様に分析した。
ドセタキセル耐性前立腺癌に対するADCの効能を確認するため、前記実施例8-1の方法によりドセタキセル耐性PC3前立腺癌細胞、CAFおよびTHP-1細胞を混合し、3D-スフェロイドを形成し、CD18-DM1またはCD18-MMAEをそれぞれ10μgの濃度で処理した後、その効果を前記実施例8-1と同様に分析した。
その結果、ADCを処理していない群は、時間が経つにつれてスフェロイドの大きさがだんだん大きくなるのに対し、CD18-DM1またはCD18-MMAEを処理した群では、8日目にスフェロイドの大きさが減少することが示された(図37)。また、薬物を処理してから8日目にスフェロイドを免疫蛍光染色し、関連マーカーを確認した結果、ADCを処理していない群では、蛍光が強く増加するのに対し、CD18-DM1またはCD18-MMAEを処理した群では、THP-1細胞の数が著しく減少しており、腫瘍増殖因子ki-67も減少することが示された(***p<0.001)(図38)。
Claims (17)
- メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を有効成分として含む、腫瘍微小環境における腫瘍関連マクロファージ(tumor associated macrophages、TAM)を除去するための薬学的組成物。
- 腫瘍関連マクロファージは、IGBT2(Integrin beta 2)を発現するM2腫瘍関連マクロファージである、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- メリチン、その変異体またはこれらの類似体がCD18が拡張された(extended)活性型構造(Active conformation)に特異的に結合する、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- メリチン、その変異体またはこれらの類似体がITGB2の449466~565のアミノ酸に結合する、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- メリチンは、配列番号1のアミノ酸配列を含む、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- メリチンの変異体は、配列番号2のアミノ酸配列を含む、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- リンカーにより結合された、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- リンカーは、配列番号3のアミノ酸配列を含む、請求項7に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- 配列番号5または6のアミノ酸配列を含むペプチドを含む、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- プロアポトーシス性ペプチドは、KLA、アルファ-ディフェンシン-1(alpha-defensin-1)、BMAP-28、Brevenin-2R、ブフォリンIIb(Buforin IIb)、セクロピンA-マガイニン2(cecropin A-Magainin 2、CA-MA-2)、セクロピンA(Cecropin A)、セクロピンB(Cecropin B)、クリソフィシン-1(chrysophsin-1)、D-K6L9、ゴメシン(Gomesin)、ラクトフェリシン B(Lactoferricin B)、LLL27、LTX-315、マガイニン2(Magainin 2)、マガイニンII-ボンベシン結合体(Magainin II-bombesin conjugate、MG2B)、パルダキシン(Pardaxin)およびこれらの組み合わせからなる群から選択される、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- 抗癌剤は、SN-38(7-エチル-10-ヒドロキシ-カンプトテシン、7-Ethyl-10-hydroxy-camptothecin)、ダウノルビシン(daunorubicin)、ドキソルビシン(doxorubicin)、エピルビシン(epirubicin)、イダルビシン(idarubicin)、ピクサントロン(pixantrone)、サバルビシン(sabarubicin)、バルルビシン(valrubicin)、パクリタキセル(paclitaxel)、ドセタキセル(docetaxel)、メクロレタミン(mechloethamine)、クロラムブシル(chlorambucil)、フェニルアラニン(phenylalanine)、マスタード(mustard)、シクロホスファミド(cyclophosphamide)、イホスファミド(ifosfamide)、カルムスチン(carmustine:BCNU)、ロムスチン(lomustine:CCNU)、ストレプトゾトシン(streptozotocin)、ブスルファン(busulfan)、チオテパ(thiotepa)、シスプラチン(cisplatin)、カルボプラチン(carboplatin)、ダクチノマイシン(dactinomycin:actinomycin D)、プリカマイシン(plicamycin)、マイトマイシンC(mitomycin C)、ビンクリスチン(vincristine)、ビンブラスチン(vinblastine)、テニポシド(teniposide)、トポテカン(topotecan)、イリノテカン(iridotecan)、ウラムスチン(uramustine)、メルファラン(melphalan)、ベンダムスチン(bendamustine)、ダカルバジン(dacarbazine)、テモゾロミド(temozolomide)、アルトレタミン(altretamine)、デュオカルマイシン(duocarmycin)、ネダプラチン(nedaplatin)、オキサリプラチン(oxaliplatin)、サトラプラチン(satraplatin)、トリプラチンテトラナイトレート(triplatin tetranitrate)、5-フルオロウラシル(5-fluorouracil)、6-メルカプトプリン(6-mercaptopurine)、カペシタビン(capecitabine)、クラドリビン(cladribine)、クロファラビン(clofarabine)、シスタルビン(cystarbine)、フロクスウリジン(floxuridine)、フルダラビン(fludarabine)、ゲムシタビン(gemcitabine)、ヒドロキシウレア(hydroxyurea)、メトトレキサート(methotrexate)、ペメトレキセド(pemetrexed)、ペントスタチン(pentostatin)、チオグアニン(thioguanine)、エトポシド(etoposide)、ミトキサントロン(mitoxantrone)、イキサベピロン(izabepilone)、ビンデシン(vindesine)、ビノレルビン(vinorelbine)、エストラムスチン(estramustine)、メイタンシン(maytansine)、DM1(mertansine、メルタンシン)、DM4、ドラスタチン(dolastatin)、アウリスタチンE(auristatin E)、アウリスタチンF(auristatin F)、モノメチルアウリスタチンE(monomethyl auristatin E、MMAE)、モノメチルアウリスタチンF(monomethyl auristatin F)およびこれらの誘導体からなる群から選択される、請求項1に記載の腫瘍微小環境における腫瘍関連マクロファージを除去するための薬学的組成物。
- メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を有効成分として含む、癌の予防または治療用薬学的組成物。
- 癌は、脳腫瘍、黒色腫、骨髄腫、非小細胞性肺癌、口腔癌、肝臓癌、胃癌、結腸癌、乳癌、三重陰性乳癌(Triple Negative Breast Cancer、TNBC)、肺癌、骨癌、膵臓癌、皮膚癌、頭部または頸部癌、子宮頸部癌、卵巣癌、大腸癌、小腸癌、直腸癌、卵管癌、肛門付近癌、子宮内膜癌、膣癌、外陰癌、ホジキン病(Hodgkin’s disease)、食道癌、リンパ腺癌、膀胱癌、胆嚢癌、内分泌腺癌、甲状腺癌、副甲状腺癌、副腎癌、軟組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性または急性白血病、リンパ球リンパ腫、腎臓または尿管癌、腎細胞癌、腎臓骨盤癌、中枢神経系腫瘍、一次中枢神経系リンパ腫、脊髄腫瘍、脳幹神経膠腫および下垂体腺腫からなる群から選択されるいずれか一つ以上である、請求項12に記載の癌の予防または治療用薬学的組成物。
- 癌は、抗癌剤耐性癌である、請求項12に記載の癌の予防または治療用薬学的組成物。
- M0マクロファージおよびM1マクロファージに比べて、M2マクロファージにてITGB2の発現が上方制御された患者を対象として投与するものである、請求項12に記載の癌の予防または治療用薬学的組成物。
- メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体を薬学的に有効な量で癌に罹患したオブジェクトに投与する段階を含む、癌の治療方法。
- 癌の予防および治療用薬学的組成物の製造に用いるための、メリチン、その変異体またはこれらの類似体にプロアポトーシス性ペプチドまたは抗癌剤が結合された結合体の用途。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20220043200 | 2022-04-07 | ||
| KR20220043573 | 2022-04-07 | ||
| KR10-2022-0043200 | 2022-04-07 | ||
| KR10-2022-0043573 | 2022-04-07 | ||
| PCT/KR2023/004674 WO2023195802A1 (ko) | 2022-04-07 | 2023-04-06 | 신규 펩타이드 기반 면역항암제 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2025511684A true JP2025511684A (ja) | 2025-04-16 |
Family
ID=88243260
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024559077A Pending JP2025511684A (ja) | 2022-04-07 | 2023-04-06 | 新規ペプチドベースの免疫抗癌剤 |
| JP2024559502A Pending JP2025511909A (ja) | 2022-04-07 | 2023-04-06 | Itgb2媒介薬物伝達システム |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024559502A Pending JP2025511909A (ja) | 2022-04-07 | 2023-04-06 | Itgb2媒介薬物伝達システム |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20250228951A1 (ja) |
| EP (2) | EP4512411A2 (ja) |
| JP (2) | JP2025511684A (ja) |
| KR (2) | KR20230144960A (ja) |
| CN (1) | CN119072327A (ja) |
| AU (2) | AU2023249001A1 (ja) |
| CA (2) | CA3247696A1 (ja) |
| WO (2) | WO2023195805A2 (ja) |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4444887A (en) | 1979-12-10 | 1984-04-24 | Sloan-Kettering Institute | Process for making human antibody producing B-lymphocytes |
| US4716111A (en) | 1982-08-11 | 1987-12-29 | Trustees Of Boston University | Process for producing human antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| JP3720353B2 (ja) | 1992-12-04 | 2005-11-24 | メディカル リサーチ カウンシル | 多価および多重特異性の結合タンパク質、それらの製造および使用 |
| DE69637481T2 (de) | 1995-04-27 | 2009-04-09 | Amgen Fremont Inc. | Aus immunisierten Xenomäusen stammende menschliche Antikörper gegen IL-8 |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| DE69738539T2 (de) | 1996-12-03 | 2009-03-26 | Amgen Fremont Inc. | Vollkommen humane Antikörper die EGFR binden |
| ES2172149T3 (es) | 1997-04-14 | 2002-09-16 | Micromet Ag | Nuevo metodo para la produccion de receptores de antigeno anti-humano y sus usos. |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| US6884869B2 (en) | 2001-04-30 | 2005-04-26 | Seattle Genetics, Inc. | Pentapeptide compounds and uses related thereto |
| ES2456325T3 (es) | 2003-11-06 | 2014-04-22 | Seattle Genetics, Inc. | Compuestos de monometilvalina capaces de conjugación con ligandos |
| US8288352B2 (en) | 2004-11-12 | 2012-10-16 | Seattle Genetics, Inc. | Auristatins having an aminobenzoic acid unit at the N terminus |
| US8609105B2 (en) | 2008-03-18 | 2013-12-17 | Seattle Genetics, Inc. | Auristatin drug linker conjugates |
| CN103068405A (zh) | 2010-04-15 | 2013-04-24 | 西雅图基因公司 | 靶向吡咯并苯并二氮杂卓结合物 |
| ES2623057T3 (es) | 2010-04-15 | 2017-07-10 | Medimmune Limited | Pirrolobenzodiazepinas usadas para tratar enfermedades proliferativas |
| KR20200120743A (ko) * | 2011-07-06 | 2020-10-21 | 젠맵 비. 브이 | 항체 변이체 및 그의 용도 |
| CA2850373C (en) | 2011-10-14 | 2019-07-16 | Seattle Genetics, Inc. | Pyrrolobenzodiazepines and targeted conjugates |
| WO2013121175A1 (en) | 2012-02-16 | 2013-08-22 | Ucl Business Plc | Lysosome-cleavable linker |
| US9504756B2 (en) | 2012-05-15 | 2016-11-29 | Seattle Genetics, Inc. | Self-stabilizing linker conjugates |
| RS58921B1 (sr) | 2012-10-12 | 2019-08-30 | Medimmune Ltd | Pirolobenzodiazepini i njihovi konjugati |
| JP6133431B2 (ja) | 2012-11-24 | 2017-05-24 | ハンジョウ ディーエーシー バイオテック シーオー.,エルティディ.Hangzhou Dac Biotech Co.,Ltd. | 親水性連結体及び薬物分子と細胞結合分子との共役反応における親水性連結体の使用 |
| PT2935259T (pt) | 2012-12-21 | 2019-04-04 | Abgenomics Int Inc | Ligantes de autoimolação hidrofílicos e conjugados dos mesmos |
| EP2968593B1 (en) | 2013-03-15 | 2024-11-20 | Regeneron Pharmaceuticals, Inc. | Biologically active molecules, conjugates thereof, and therapeutic uses |
| US9295731B2 (en) | 2013-04-01 | 2016-03-29 | Mark Quang Nguyen | Cleavable drug conjugates, compositions thereof and methods of use |
| US20180104349A9 (en) | 2013-04-28 | 2018-04-19 | Gang Qin | Novel linker, preparation method, and application thereof |
| WO2014197854A1 (en) | 2013-06-06 | 2014-12-11 | Igenica Biotherapeutics, Inc. | Novel linkers for antibody-drug conjugates and related compounds, compositions, and methods of use |
| WO2015038426A1 (en) | 2013-09-13 | 2015-03-19 | Asana Biosciences, Llc | Self-immolative linkers containing mandelic acid derivatives, drug-ligand conjugates for targeted therapies and uses thereof |
| JP6747971B2 (ja) | 2013-10-15 | 2020-08-26 | シアトル ジェネティックス, インコーポレイテッド | 改善されたリガンド−薬物コンジュゲート薬物動態のためのpeg化薬物−リンカー |
| US9209965B2 (en) | 2014-01-14 | 2015-12-08 | Microsemi Semiconductor Ulc | Network interface with clock recovery module on line card |
| KR102073273B1 (ko) * | 2017-08-23 | 2020-03-02 | (주) 레느스랩 | 멜리틴을 포함하는 m2형 종양관련 대식세포 제거용 조성물 |
| AU2019264092B2 (en) * | 2018-05-04 | 2024-02-15 | Twinpigbiolab. Inc. | Targeting M2-like tumor-associated macrophages by using melittin-based pro-apoptotic peptide |
| WO2020155017A1 (en) * | 2019-01-31 | 2020-08-06 | Hangzhou Dac Biotech Co., Ltd | A conjugate of an amanita toxin with branched linkers |
-
2023
- 2023-04-06 JP JP2024559077A patent/JP2025511684A/ja active Pending
- 2023-04-06 US US18/854,337 patent/US20250228951A1/en active Pending
- 2023-04-06 AU AU2023249001A patent/AU2023249001A1/en active Pending
- 2023-04-06 KR KR1020230045429A patent/KR20230144960A/ko active Pending
- 2023-04-06 EP EP23785029.2A patent/EP4512411A2/en active Pending
- 2023-04-06 KR KR1020230045437A patent/KR20230144961A/ko active Pending
- 2023-04-06 WO PCT/KR2023/004678 patent/WO2023195805A2/ko not_active Ceased
- 2023-04-06 CN CN202380032964.1A patent/CN119072327A/zh active Pending
- 2023-04-06 JP JP2024559502A patent/JP2025511909A/ja active Pending
- 2023-04-06 EP EP23785026.8A patent/EP4512410A1/en not_active Withdrawn
- 2023-04-06 CA CA3247696A patent/CA3247696A1/en active Pending
- 2023-04-06 WO PCT/KR2023/004674 patent/WO2023195802A1/ko not_active Ceased
- 2023-04-06 CA CA3247699A patent/CA3247699A1/en active Pending
- 2023-04-06 AU AU2023250165A patent/AU2023250165A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2023195805A9 (ko) | 2024-07-11 |
| JP2025511909A (ja) | 2025-04-16 |
| EP4512411A2 (en) | 2025-02-26 |
| US20250228951A1 (en) | 2025-07-17 |
| WO2023195805A3 (ko) | 2024-05-30 |
| KR20230144960A (ko) | 2023-10-17 |
| CA3247699A1 (en) | 2025-02-03 |
| WO2023195802A1 (ko) | 2023-10-12 |
| AU2023249001A1 (en) | 2024-11-28 |
| AU2023250165A1 (en) | 2024-11-28 |
| CN119072327A (zh) | 2024-12-03 |
| CA3247696A1 (en) | 2025-02-03 |
| KR20230144961A (ko) | 2023-10-17 |
| WO2023195805A2 (ko) | 2023-10-12 |
| EP4512410A1 (en) | 2025-02-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN112533640B (zh) | 利用基于蜂毒肽的细胞凋亡诱导肽的m2型肿瘤相关巨噬细胞的靶向 | |
| JP6030622B2 (ja) | 癌の阻害剤としてのmuc−1細胞質ドメインペプチド | |
| CN113646008A (zh) | pHLIP®肽介导的细胞表面的表位束缚 | |
| CN108137671B (zh) | 可溶性pdl-1分子 | |
| HUE029132T2 (en) | JNK signal transduction synthesis pathway is a cell-permeable peptide inhibitor | |
| JP6876618B2 (ja) | 治療目的のための抗体−ウレアーゼコンジュゲート | |
| JP6574175B2 (ja) | 細胞透過性ペプチド、及びそれを含むコンジュゲート | |
| CN102695722A (zh) | 对错误折叠的朊病毒蛋白具有特异性的抗体和表位 | |
| EP2885321A1 (en) | Conjugates including an antibody moiety, a polypeptide that traverses the blood-brain barrier, and a cytotoxin | |
| CN110981941A (zh) | 生物模拟肽和生物可降解的递送平台 | |
| WO2012079088A2 (en) | Mimetic peptides derived from collagen type iv and their use for treating angiogenesis- and lymphangiogenesis- dependent diseases | |
| EP3652195A1 (en) | A peptide saporin conjugate for the treatment of cancer | |
| JP2025010144A (ja) | 環状プロサポシンペプチドおよびその使用 | |
| JP2024517518A (ja) | マクロファージを標的とするペプチド、ならびにそのコンジュゲート、組成物、および使用 | |
| JP2020501513A (ja) | 治療用多標的コンストラクトおよびその使用 | |
| JP2025511684A (ja) | 新規ペプチドベースの免疫抗癌剤 | |
| US20240293500A1 (en) | Peptide having anticancer activity, and use thereof | |
| JP2021506330A (ja) | 低pH挿入ペプチド及びその組成物 | |
| CN106632613A (zh) | 与柯萨奇病毒腺病毒受体相关的亲和肽 | |
| JPWO2019045025A1 (ja) | ワクチン組成物 | |
| WO2023204329A1 (ko) | 신규 펩타이드 기반 면역항암제 | |
| CN120590505A (zh) | 一种重组补体蛋白及在制备抗白血病药物中的应用 | |
| Chavez-Cortez et al. | Research Article Production and Evaluation of an Avian IgY Immunotoxin against CD133+ for Treatment of Carcinogenic Stem Cells in Malignant Glioma: IgY Immunotoxin for the Treatment of Glioblastoma | |
| MX2015004554A (es) | Produccion de una inmunotoxina igy anti cd133 acoplada a abrina para tratamiento de tumores del sistema nervioso central y/o neoplasias relacionadas con celulas madre carcinogenicas. | |
| HK40022338A (en) | A biomimetic peptide and biodegradable delivery platform |