JP2012506702A - 非ウイルス性再プログラムによる多能性幹細胞 - Google Patents
非ウイルス性再プログラムによる多能性幹細胞 Download PDFInfo
- Publication number
- JP2012506702A JP2012506702A JP2011533384A JP2011533384A JP2012506702A JP 2012506702 A JP2012506702 A JP 2012506702A JP 2011533384 A JP2011533384 A JP 2011533384A JP 2011533384 A JP2011533384 A JP 2011533384A JP 2012506702 A JP2012506702 A JP 2012506702A
- Authority
- JP
- Japan
- Prior art keywords
- promoter
- vector
- cells
- ires2
- human
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0696—Artificially induced pluripotent stem cells, e.g. iPS
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
- C12N2501/602—Sox-2
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
- C12N2501/603—Oct-3/4
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
- C12N2501/604—Klf-4
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
- C12N2501/605—Nanog
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
- C12N2501/606—Transcription factors c-Myc
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/60—Transcription factors
- C12N2501/608—Lin28
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
Abstract
【選択図】図1A及び図1B
Description
本明細書は、米国仮特許出願第61/108.362(出願日2008年10月24日)を参照によりその全体を説明したものとしてここに含める。
本発明は、NIH GM081629及びRR000167の機関を通してアメリカ合衆国政府助成を受けた。アメリカ合衆国は本発明にある一定の権利を保有する。
発現カセットの設計と作製
プライマーとして、かつ表1に収載の配列内リボソーム進入部位から得られるコード領域の最初と最後の20〜22の塩基を使用して、して、導入遺伝子の一部または全てから得られるオープン・リーディング・フレーム(ORF)をポリメラーゼ連鎖反応(PCR)法で直接増幅するという従来の方法を使って、適した発現カセットを作製した。SV40T抗原とヒトテロメラーゼ逆転写酵素、プラスミドpBABE−puro SV40 LT、および、pBABE−hygro−hTERT(ヒトテロメラーゼ逆転写酵素)の供給源は、プラスミド1390および1773としてそれぞれAddgene,Inc,Cambridge、MAから市販されている。 IRES1とIRES2、プラスミドpIRESpuro3とプラスミドpIRES2EGFPの供給源は、Clontech Laboratories,Inc.,Mountain View,CA.から市販されている。
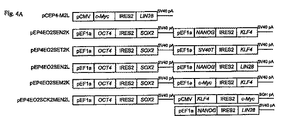
口蹄疫ウイルスセグメント2を化学的に合成した。インフレームの発現カセットは、下記表1記載のコードを使って記述する。例えば、「E−O2S」とは、OCT4とSOX2コード領域(両者の間にIRES2)の上流に位置するEF1αプロモータを有する発現カセットを意味する。同様に、C−M2Kとは、c−MycとKlf4コード領域(両者の間にIRES2)の上流に位置するCMVプロモータを有する発現カセットを意味する。
いくつかのコンストラクトでは、上記のカセットは、一連の再プログラム中では使わなかった。O2Sとは異なるO2S変異体発現カセット(「O2S(2)」)を採用した。この変異体は、TKプロモータ−Hyg −TK polyAカセット(図5Aおよび図5Bを比較せよ)を含んでいた。指示した構造を有するカセットは、様々な因子の発現レベルを実験的に測定することによる再プログラムの方法で、後に使用するために選択した。
EF2(配列番号:12)として設計されたプロモータは、既知のEF1αプロモータ(配列番号:11)とはわずかに異なる変異体であったが、活性化中のEF1αとは異ならず、また後に以下のエピソームのベクターの再プログラムの試行には使用しなかった。F2Aは、単一のトランスクリプトから発現した異なるコード領域を同時翻訳するのを促進するペプチド・リンカーである。F2Aを試用したが、後のエピソームのベクターを使った再プログラム試行には使わなかった。IRES1を試用したが、後のエピソームのベクターを使った再プログラム試行には使わなかった。
この系統は、ネオマイシン選択(ジェネテシン:100μg/ml,Invitrogen Corp.)下で維持した。形質導入16日後にヒトiPS細胞コロニーを計数した。遺伝子組み合わせは、pSIN4−EF2−OCT4−IRES1−SOX2(O1S)、pSIN4−EF2−OCT4−IRES2−SOX2(O2S)、pSIN4−EF2−OCT4−F2A−SOX2(OF2AS)、pSIN4−EF2−NANOG−IRES1−LIN28(N1L)pSIN4−EF2−NANOG−IRES2−LIN28(N2L)、pSIN4−EF2−OCT4−IRES1−PURO(O)、pSIN4−EF2−SOX2−IRES1−PURO(S)、pSIN4−EF2−NANOG−IRES1−PURO(N)、pSIN4−EF2−LIN28−IRES1−PURO(L)であった。レンチウイルスのプラスミドベクターの各々の略語は、ベクターの名称の後に、括弧で囲んでいる。
レンチウイルス・コンストラクトを使用したヒト新生児包皮線維芽細胞の再プログラム化
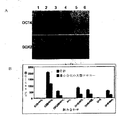
予備的再プログラムの実験は、レンチウイルスベクターをヒト新生児の包皮線維芽細胞に導入することによって行った。図2Aは、OCT4、SOX2、LIN28、および、さらにc−MYCを導入する場合、NANOGが再プログラム効率にかなりのプラス効果をもたらすことを示し、 また、OCT4、SOX2、および、LIN28との組み合わせでは、c−MYCまたはKLF4が無い場合でもNANOGが再プログラムを補助できることを示す。使用したレンチウイルスのコンストラクトは、pSIN4−EF2−OCT4−IRES2−SOX2(O2S)、pSIN4−EF2−NANOG−IRES2−LIN28 (N2L)、pSIN4−EF2−LIN28−IRES1−PURO(L)、pSIN4−CMV−c−Myc−IRES1−PURO(M)、pSIN4−EF2−KLF4−IRES1−PURO(K)であった。形質移入20日後、アルカリ・ホスファターゼ-陽性ヒトiPS細胞コロニーを計数した。iPS細胞コロニーの数は、2.5×104個のヒト新生児包皮線維芽細胞(継代数9)の入力由来であった。薄灰色の棒は、再プログラムされて形成した、代表的なヒトES細胞形態を有するコロニーの合計数を表し、濃い灰色棒は、分化が最も少なかった大型コロニーの数を表す。
非ウイルス性エピソームのベクターを使ったヒト新生児包皮線維芽細胞の再プログラム
ヒト新生児包皮線維芽細胞(Cat# CRL−2097(商標),ATCC)は、10%熱失活したウシ胎仔血清(FBS,HyClone Laboratories,Logan,UT)、2mMのグルタマックス、0.1mMの非必須アミノ酸、および、0.1mMのβ−メルカプトエタノールを添加した包皮線維芽細胞培地(DMEM(Cat# 11965,Invitrogen))で維持した。
Claims (24)
- 霊長類の体細胞を再プログラムする方法であって、
前記細胞を再プログラムするのに充分な条件の下で前記霊長類体細胞を複数の能力決定因子に曝露する工程と、
前記曝露された細胞を培養して前記霊長類体細胞より高い能力レベルを有する再プログラムされた細胞を得る工程と、
を含み、
前記再プログラムされた細胞は、前記体細胞に曝露する前記能力決定因子に関連するどのような構成要素も実質的に含まない再プログラム方法。 - 前記霊長類体細胞が胎児または出生後の個体から得られたものである、請求項1に記載の方法。
- 前記霊長類が、ヒトである、請求項1に記載の方法。
- 前記再プログラムされた細胞が、胎児または出生後の個体と遺伝的に同一である、請求項1に記載の方法。
- 前記曝露する工程が、1つまたは複数個の能力決定因子をコードする少なくとも1個のベクターを前記霊長類の体細胞に導入する工程を含む、請求項1に記載の方法。
- 前記ベクターが非ウイルス性エピソームのベクターである、請求項5に記載の方法。
- 前記1つまたは複数個の能力決定因子が、ヒトOCT−4、ヒトSOX2、ヒトLIN28、ヒトNANOG、ヒトc−Myc、およびヒトKLF4を含み、前記ベクターがc−Mycを含む場合、前記方法はさらに前記霊長類体細胞をSV40T抗原に曝露する工程を含む、請求項5に記載の方法。
- 前記少なくとも1つのベクターが単一ベクターである、請求項5に記載の方法。
- 前記単一ベクターが、少なくとも1つの配列内リボソーム進入部位を含む、請求項に記載の方法。
- 前記単一ベクターが、順番に、第一のプロモータ、OCT4、IRES2、SOX2、第二のプロモータ、SV40T抗原、IRES2、およびKLF4を含む、請求項8に記載の方法。
- 前記ベクターが、順番に、第一のプロモータ、OCT4、IRES2、SOX2、第二のプロモータ、c−Myc、IRES2、KLF4、第三のプロモータ、NANOG、IRES2、およびLN28を含む、請求項8に記載の方法。
- 第一のベクターが、順番に、第一のプロモータ、OCT4、IRES2、SOX2、第二のプロモータ、SV40T抗原、IRES2、およびKLF4を含み、第二のベクターが、順番に、第三のプロモータ、OCT4、IRES2、SOX2、第四のプロモータ、NANOG、IRES2、KLF4を含み、第三のベクターが、順番に、第五のプロモータ、c−Myc、IRES2、LN28を含み、前記プロモータは同一である必要がない、請求項5に記載の方法。
- 前記第一の、第二の、第三の、および第四の各プロモータが伸長因子1α(EF1α)遺伝子プロモータである、請求項12に記載の方法。
- 第一のベクターが、順番に、第一のプロモータ、OCT4、IRES2、SOX2、第二のプロモータ、KLF4、IRES2、c−Myc、第三のプロモータ、NANOG、IRES2、およびLN28を含み、第二のベクターが、順番に、第四のプロモータ、OCT4、IRES2、SOX2、第五のプロモータ、SV40T抗原、IRES2、およびKLF4を含み、前記プロモータは同一である必要がない、請求項5に記載の方法。
- 前記第一の、第三の、第四の、および第五の、各プロモータが、EF1α遺伝子プロモータであり、また第二のプロモータが、サイトメガロウイルス・前初期遺伝子(CMV)プロモータである、請求項14に記載の方法。
- 第一のベクターが、順番に、第一のプロモータ、OCT4、IRES2、SOX2、第二のプロモータ、NANOG、IRES2、およびLN28を含み、第二のベクターが、順番に、第三のプロモータ、OCT4、IRES2、SOX2、第四のプロモータ、SV40T抗原、IRES2、およびKLF4を含み、ならびに、第三のベクターが、順番に、第五のプロモータ、OCT4、IRES2、SOX2、第六のプロモータ、c−Myc、IRES2、およびKLF4を含み、前記プロモータは同一である必要がない、請求項5に記載の方法。
- 霊長類多能性細胞の濃縮された集団であって、
能力決定因子を発現するのに充分な条件の下で霊長類体細胞を能力決定因子に曝露することにより、前記体細胞を再プログラムして前記霊長類体細胞を産生する工程を含む方法により産生され、
前記細胞が、前記体細胞に曝露する前記能力決定因子に関連するどのような構成要素も実質的に含まない霊長類多能性細胞の濃縮された集団。 - 前記霊長類体細胞が、胎児または出生後の個体から得られたものである、請求項17に記載の前記集団。
- 霊長類が、ヒトである、請求項17に記載の前記集団。
- 前記多能性細胞が、実質的に出生後の個体と遺伝的に同一である、請求項17に記載の集団。
- 前記曝露する工程が、1つまたは複数個の能力決定因子をコードする少なくとも1個のベクターを前記霊長類体細胞に導入する工程を含む、請求項17に記載の集団。
- 前記ベクターが、非ウイルス性のエピソームのベクターである、請求項21に記載の集団。
- 1つまたは複数個の能力決定因子が、ヒトOCT−4、ヒトSOX2、ヒトLIN28、ヒトNANOG、ヒトc−Myc、およびヒトKLF4を含み、前記ベクターが、c−Mycを含む場合、前記方法は、さらに前記霊長類体細胞をSV40T抗原に曝露する工程を含む、請求項21に記載の集団。
- 多能性の誘導に関連するどのような構成要素も実質的に含まない霊長類誘導多能性細胞。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10836208P | 2008-10-24 | 2008-10-24 | |
| US61/108,362 | 2008-10-24 | ||
| PCT/US2009/061935 WO2010048567A1 (en) | 2008-10-24 | 2009-10-23 | Pluripotent stem cells obtained by non-viral reprogramming |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015165051A Division JP6312638B2 (ja) | 2008-10-24 | 2015-08-24 | 非ウイルス性再プログラムによる多能性幹細胞 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012506702A true JP2012506702A (ja) | 2012-03-22 |
| JP2012506702A5 JP2012506702A5 (ja) | 2014-12-25 |
Family
ID=41698343
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011533384A Withdrawn JP2012506702A (ja) | 2008-10-24 | 2009-10-23 | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP2015165051A Active JP6312638B2 (ja) | 2008-10-24 | 2015-08-24 | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP2016165793A Pending JP2016220686A (ja) | 2008-10-24 | 2016-08-26 | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP2018155983A Active JP6861189B2 (ja) | 2008-10-24 | 2018-08-23 | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP2021055183A Active JP7165228B2 (ja) | 2008-10-24 | 2021-03-29 | 非ウイルス性再プログラムによる多能性幹細胞 |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015165051A Active JP6312638B2 (ja) | 2008-10-24 | 2015-08-24 | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP2016165793A Pending JP2016220686A (ja) | 2008-10-24 | 2016-08-26 | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP2018155983A Active JP6861189B2 (ja) | 2008-10-24 | 2018-08-23 | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP2021055183A Active JP7165228B2 (ja) | 2008-10-24 | 2021-03-29 | 非ウイルス性再プログラムによる多能性幹細胞 |
Country Status (10)
| Country | Link |
|---|---|
| US (4) | US8268620B2 (ja) |
| EP (2) | EP2356221B1 (ja) |
| JP (5) | JP2012506702A (ja) |
| CN (2) | CN102239249A (ja) |
| CA (1) | CA2741090C (ja) |
| DK (2) | DK2356221T3 (ja) |
| ES (1) | ES2959327T3 (ja) |
| IL (1) | IL212433B (ja) |
| SG (1) | SG10201600234PA (ja) |
| WO (1) | WO2010048567A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017012145A (ja) * | 2015-07-02 | 2017-01-19 | 株式会社豊田中央研究所 | 遺伝的組換えを誘発する方法及びその利用 |
| US10260048B2 (en) | 2010-06-15 | 2019-04-16 | FUJIFILM Cellular Dynamics, Inc. | Generation of induced pluripotent stem cells from small volumes of peripheral blood |
| JP2021094040A (ja) * | 2008-10-24 | 2021-06-24 | ウイスコンシン アラムニ リサーチ ファンデーション | 非ウイルス性再プログラムによる多能性幹細胞 |
Families Citing this family (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA018039B1 (ru) * | 2005-12-13 | 2013-05-30 | Киото Юниверсити | Ядерный фактор перепрограммирования |
| US8129187B2 (en) | 2005-12-13 | 2012-03-06 | Kyoto University | Somatic cell reprogramming by retroviral vectors encoding Oct3/4. Klf4, c-Myc and Sox2 |
| US20090227032A1 (en) * | 2005-12-13 | 2009-09-10 | Kyoto University | Nuclear reprogramming factor and induced pluripotent stem cells |
| US8278104B2 (en) * | 2005-12-13 | 2012-10-02 | Kyoto University | Induced pluripotent stem cells produced with Oct3/4, Klf4 and Sox2 |
| US8440461B2 (en) | 2007-03-23 | 2013-05-14 | Wisconsin Alumni Research Foundation | Reprogramming somatic cells using retroviral vectors comprising Oct-4 and Sox2 genes |
| JP2008307007A (ja) * | 2007-06-15 | 2008-12-25 | Bayer Schering Pharma Ag | 出生後のヒト組織由来未分化幹細胞から誘導したヒト多能性幹細胞 |
| US9213999B2 (en) * | 2007-06-15 | 2015-12-15 | Kyoto University | Providing iPSCs to a customer |
| WO2009133971A1 (en) * | 2008-05-02 | 2009-11-05 | Kyoto University | Method of nuclear reprogramming |
| ES2587395T3 (es) | 2008-06-04 | 2016-10-24 | Cellular Dynamics International, Inc. | Procedimientos para la producción de células IPS usando un enfoque no vírico |
| EP3330371A1 (en) * | 2008-08-12 | 2018-06-06 | Cellular Dynamics International, Inc. | Methods for the production of ips cells |
| CN105925535A (zh) | 2009-06-05 | 2016-09-07 | 细胞动力国际有限公司 | 重编程t细胞和造血细胞的方法 |
| US8048675B1 (en) * | 2010-05-12 | 2011-11-01 | Ipierian, Inc. | Integration-free human induced pluripotent stem cells from blood |
| BR112013002811A8 (pt) * | 2010-08-05 | 2020-01-28 | Wisconsin Alumni Res Found | meios básicos simplificados para cultura celular pluripotente de humano |
| US9279107B2 (en) | 2010-08-05 | 2016-03-08 | Wisconsin Alumni Research Foundation | Simplified basic media for human pluripotent cell culture |
| EP2616554A1 (en) | 2010-09-17 | 2013-07-24 | President and Fellows of Harvard College | Functional genomics assay for characterizing pluripotent stem cell utility and safety |
| US9133266B2 (en) | 2011-05-06 | 2015-09-15 | Wisconsin Alumni Research Foundation | Vitronectin-derived cell culture substrate and uses thereof |
| EP2732029B1 (en) * | 2011-07-11 | 2019-01-16 | FUJIFILM Cellular Dynamics, Inc. | Methods for cell reprogramming and genome engineering |
| US10391126B2 (en) | 2011-11-18 | 2019-08-27 | Board Of Regents, The University Of Texas System | CAR+ T cells genetically modified to eliminate expression of T-cell receptor and/or HLA |
| US8497124B2 (en) | 2011-12-05 | 2013-07-30 | Factor Bioscience Inc. | Methods and products for reprogramming cells to a less differentiated state |
| EP2788033B1 (en) | 2011-12-05 | 2017-05-31 | Factor Bioscience Inc. | Methods and products for transfecting cells |
| WO2013090919A1 (en) | 2011-12-16 | 2013-06-20 | Wisconsin Alumni Research Foundation | Fgf-2 having enhanced stability |
| US20130266541A1 (en) * | 2012-04-06 | 2013-10-10 | The Johns Hopkins University | Human induced pluripotent stem cells |
| CN104769112A (zh) | 2012-11-01 | 2015-07-08 | 菲克特生物科学股份有限公司 | 用于在细胞中表达蛋白质的方法和产品 |
| EP3323884A1 (en) | 2013-02-01 | 2018-05-23 | The United States Of America as Represented by the Secretary, Department of Health an Human Service | Method for generating retinal pigment epithelium (rpe) cells from induced pluripotent stem cells (ipscs) |
| EP3008229B1 (en) | 2013-06-10 | 2020-05-27 | President and Fellows of Harvard College | Early developmental genomic assay for characterizing pluripotent stem cell utility and safety |
| WO2015006725A2 (en) | 2013-07-12 | 2015-01-15 | Cedars-Sinai Medical Center | Generation of induced pluripotent stem cells from normal human mammary epithelial cells |
| KR101551926B1 (ko) | 2013-09-06 | 2015-09-10 | 가톨릭대학교 산학협력단 | 인간 유래 역분화 줄기세포 및 이를 이용한 인간의 면역계가 발현된 동물 제조 방법 |
| US11377639B2 (en) | 2013-11-15 | 2022-07-05 | Wisconsin Alumni Research Foundation | Lineage reprogramming to induced cardiac progenitor cells (iCPC) by defined factors |
| MX2016009771A (es) | 2014-01-31 | 2016-11-14 | Factor Bioscience Inc | Metodos y productos para la produccion y administracion de acido nucleico. |
| US20170044500A1 (en) | 2014-04-24 | 2017-02-16 | Board Of Regents, The University Of Texas System | Application of induced pluripotent stem cells to generate adoptive cell therapy products |
| EP3215168B1 (en) * | 2014-10-31 | 2023-08-02 | The Trustees of the University of Pennsylvania | Altering gene expression in modified t cells and uses thereof |
| WO2016131052A1 (en) | 2015-02-13 | 2016-08-18 | Factor Bioscience Inc. | Nucleic acid products and methods of administration thereof |
| JP6873898B2 (ja) * | 2015-04-14 | 2021-05-19 | 国立大学法人京都大学 | 体細胞への分化誘導に適した幹細胞クローンを製造する方法 |
| US20190169569A1 (en) | 2015-09-08 | 2019-06-06 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Serv | Method for reproducible differentiation of clinical-grade retinal pigment epithelium cells |
| ES2903442T3 (es) | 2015-09-08 | 2022-04-01 | Fujifilm Cellular Dynamics Inc | Purificación basada en MACS del epitelio pigmentario de la retina derivado de células madre |
| CN105219729B (zh) * | 2015-09-28 | 2018-09-25 | 首都医科大学宣武医院 | 一种利用非整合质粒载体诱导神经干细胞的方法及其用途 |
| WO2017070337A1 (en) | 2015-10-20 | 2017-04-27 | Cellular Dynamics International, Inc. | Methods for directed differentiation of pluripotent stem cells to immune cells |
| WO2017196175A1 (en) | 2016-05-12 | 2017-11-16 | Erasmus University Medical Center Rotterdam | A method for culturing myogenic cells, cultures obtained therefrom, screening methods, and cell culture medium. |
| CN105861447B (zh) * | 2016-06-13 | 2017-12-19 | 广州市搏克生物技术有限公司 | 一种非病毒iPSCs诱导组合物及其试剂盒 |
| US11572545B2 (en) | 2016-06-16 | 2023-02-07 | Cedars-Sinai Medical Center | Efficient method for reprogramming blood to induced pluripotent stem cells |
| US10221395B2 (en) | 2016-06-16 | 2019-03-05 | Cedars-Sinai Medical Center | Efficient method for reprogramming blood to induced pluripotent stem cells |
| CA3029582A1 (en) | 2016-07-01 | 2018-01-04 | Research Development Foundation | Elimination of proliferating cells from stem cell-derived grafts |
| WO2018026723A1 (en) | 2016-08-01 | 2018-02-08 | University Of Pittsburgh - Of The Commonwealth System Of Higher Education | Human induced pluripotent stem cells for high efficiency genetic engineering |
| WO2018035377A1 (en) | 2016-08-17 | 2018-02-22 | Factor Bioscience Inc. | Nucleic acid products and methods of administration thereof |
| CN110050061A (zh) | 2016-10-05 | 2019-07-23 | 富士胶片细胞动力公司 | 从具有MeCP2破坏的诱导多能干细胞生成成熟谱系 |
| EP3538168A1 (en) | 2016-11-09 | 2019-09-18 | The United States of America, as represented by The Secretary, Department of Health and Human Services | 3d vascularized human ocular tissue for cell therapy and drug discovery |
| US11530388B2 (en) | 2017-02-14 | 2022-12-20 | University of Pittsburgh—of the Commonwealth System of Higher Education | Methods of engineering human induced pluripotent stem cells to produce liver tissue |
| MX2019011897A (es) | 2017-04-18 | 2019-11-28 | Fujifilm Cellular Dynamics Inc | Celulas efectoras inmunitarias especificas de antigenos. |
| US11572544B2 (en) | 2017-06-14 | 2023-02-07 | The Children's Medical Center Corporation | Hematopoietic stem and progenitor cells derived from hemogenic endothelial cells by episomal plasmid gene transfer |
| US10760057B2 (en) | 2017-07-06 | 2020-09-01 | Wisconsin Alumni Research Foundation | Human pluripotent stem cell-based screening for smooth muscle cell differentiation and disease |
| NL2019517B1 (en) | 2017-09-08 | 2019-03-19 | Univ Erasmus Med Ct Rotterdam | New therapy for Pompe disease |
| US20190100730A1 (en) | 2017-10-03 | 2019-04-04 | Wallkill BioPharma, Inc. | Treating diabetes with genetically modified beta cells |
| AU2019256723A1 (en) | 2018-04-20 | 2020-11-05 | FUJIFILM Cellular Dynamics, Inc. | Method for differentiation of ocular cells and use thereof |
| AU2019336221A1 (en) | 2018-09-07 | 2021-03-04 | Wisconsin Alumni Research Foundation | Generation of hematopoietic progenitor cells from human pluripotent stem cells |
| JP2022513073A (ja) | 2018-11-19 | 2022-02-07 | ザ ユナイテッド ステイツ オブ アメリカ アズ リプリゼンテッド バイ ザ セクレタリー、デパートメント オブ ヘルス アンド ヒューマン サービシーズ | 生分解性組織置換インプラントおよびその使用 |
| CA3121027A1 (en) | 2018-11-28 | 2020-06-04 | Board Of Regents, The University Of Texas System | Multiplex genome editing of immune cells to enhance functionality and resistance to suppressive environment |
| EP3886874A1 (en) | 2018-11-29 | 2021-10-06 | Board of Regents, The University of Texas System | Methods for ex vivo expansion of natural killer cells and use thereof |
| US10501404B1 (en) | 2019-07-30 | 2019-12-10 | Factor Bioscience Inc. | Cationic lipids and transfection methods |
| EP4118234A1 (en) | 2020-03-09 | 2023-01-18 | FUJIFILM Corporation | Markers specific for pluripotent stem cells, and methods of using the same |
| IL298085A (en) | 2020-05-29 | 2023-01-01 | Fujifilm Cellular Dynamics Inc | Retinal pigment epithelium and bicellular photoreceptor aggregates and methods of using them |
| US20230212509A1 (en) | 2020-05-29 | 2023-07-06 | FUJIFILM Cellular Dynamics, Inc. | Bilayer of retinal pigmented epithelium and photoreceptors and use thereof |
| EP3922431A1 (en) | 2020-06-08 | 2021-12-15 | Erasmus University Medical Center Rotterdam | Method of manufacturing microdevices for lab-on-chip applications |
| CA3201499A1 (en) | 2020-11-13 | 2022-05-19 | Catamaran Bio, Inc. | Genetically modified natural killer cells and methods of use thereof |
| WO2022115611A1 (en) | 2020-11-25 | 2022-06-02 | Catamaran Bio, Inc. | Cellular therapeutics engineered with signal modulators and methods of use thereof |
| BR112023018844A2 (pt) | 2021-04-07 | 2023-10-10 | Century Therapeutics Inc | Composições e métodos para geração de células t gama-delta de células-tronco pluripotentes induzidas |
| CA3214473A1 (en) | 2021-04-07 | 2022-10-13 | Century Therapeutics, Inc. | Compositions and methods for generating alpha-beta t cells from induced pluripotent stem cells |
| EP4347796A1 (en) | 2021-05-26 | 2024-04-10 | Fujifilm Cellular Dynamics, Inc. | Methods to prevent rapid silencing of genes in pluripotent stem cells |
| CA3220433A1 (en) | 2021-05-28 | 2022-12-01 | Arvydas Maminishkis | Biodegradable tissue scaffold with secondary matrix to host weakly adherent cells |
| EP4347795A1 (en) | 2021-05-28 | 2024-04-10 | The United States of America, as represented by The Secretary, Department of Health and Human Services | Methods to generate macular, central and peripheral retinal pigment epithelial cells |
| CA3231501A1 (en) | 2021-09-13 | 2023-03-16 | Steven Kattman | Methods for the production of committed cardiac progenitor cells |
| WO2023172514A1 (en) | 2022-03-07 | 2023-09-14 | Catamaran Bio, Inc. | Engineered immune cell therapeutics targeted to her2 and methods of use thereof |
| WO2023240147A1 (en) | 2022-06-08 | 2023-12-14 | Century Therapeutics, Inc. | Genetically engineered cells expressing cd16 variants and nkg2d and uses thereof |
| US20240003871A1 (en) | 2022-06-29 | 2024-01-04 | FUJIFILM Cellular Dynamics, Inc. | Ipsc-derived astrocytes and methods of use thereof |
| WO2024073776A1 (en) | 2022-09-30 | 2024-04-04 | FUJIFILM Cellular Dynamics, Inc. | Methods for the production of cardiac fibroblasts |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003506075A (ja) * | 1999-08-05 | 2003-02-18 | エムシーエル エルエルシー | 多能性成人幹細胞およびそれを単離する方法 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9223084D0 (en) | 1992-11-04 | 1992-12-16 | Imp Cancer Res Tech | Compounds to target cells |
| US5925333A (en) * | 1995-11-15 | 1999-07-20 | Massachusetts Institute Of Technology | Methods for modulation of lipid uptake |
| AU2004211654B2 (en) | 2003-02-07 | 2009-03-05 | Wisconsin Alumni Research Foundation | Directed genetic modifications of human stem cells |
| US8278104B2 (en) * | 2005-12-13 | 2012-10-02 | Kyoto University | Induced pluripotent stem cells produced with Oct3/4, Klf4 and Sox2 |
| US8440461B2 (en) * | 2007-03-23 | 2013-05-14 | Wisconsin Alumni Research Foundation | Reprogramming somatic cells using retroviral vectors comprising Oct-4 and Sox2 genes |
| JP2008307007A (ja) * | 2007-06-15 | 2008-12-25 | Bayer Schering Pharma Ag | 出生後のヒト組織由来未分化幹細胞から誘導したヒト多能性幹細胞 |
| EP2072618A1 (en) | 2007-12-14 | 2009-06-24 | Johannes Gutenberg-Universität Mainz | Use of RNA for reprogramming somatic cells |
| CN101250502A (zh) * | 2008-04-01 | 2008-08-27 | 中国科学院上海生命科学研究院 | 一种诱导的多潜能干细胞的制备方法 |
| WO2009133971A1 (en) | 2008-05-02 | 2009-11-05 | Kyoto University | Method of nuclear reprogramming |
| ES2587395T3 (es) * | 2008-06-04 | 2016-10-24 | Cellular Dynamics International, Inc. | Procedimientos para la producción de células IPS usando un enfoque no vírico |
| WO2009157201A1 (en) * | 2008-06-26 | 2009-12-30 | Osaka University | Method and kit for preparing ips cells |
| WO2010012077A1 (en) * | 2008-07-28 | 2010-02-04 | Mount Sinai Hospital | Compositions, methods and kits for reprogramming somatic cells |
| WO2010048567A1 (en) * | 2008-10-24 | 2010-04-29 | Wisconsin Alumni Research Foundation | Pluripotent stem cells obtained by non-viral reprogramming |
-
2009
- 2009-10-23 WO PCT/US2009/061935 patent/WO2010048567A1/en active Application Filing
- 2009-10-23 CA CA2741090A patent/CA2741090C/en active Active
- 2009-10-23 ES ES18200217T patent/ES2959327T3/es active Active
- 2009-10-23 US US12/605,220 patent/US8268620B2/en active Active
- 2009-10-23 DK DK09744285.9T patent/DK2356221T3/en active
- 2009-10-23 SG SG10201600234PA patent/SG10201600234PA/en unknown
- 2009-10-23 EP EP09744285.9A patent/EP2356221B1/en active Active
- 2009-10-23 CN CN2009801480130A patent/CN102239249A/zh active Pending
- 2009-10-23 EP EP18200217.0A patent/EP3450545B1/en active Active
- 2009-10-23 JP JP2011533384A patent/JP2012506702A/ja not_active Withdrawn
- 2009-10-23 DK DK18200217.0T patent/DK3450545T3/da active
- 2009-10-23 CN CN201610213440.4A patent/CN105802917A/zh active Pending
-
2011
- 2011-04-17 IL IL212433A patent/IL212433B/en active IP Right Grant
-
2012
- 2012-09-07 US US13/607,072 patent/US20130217117A1/en not_active Abandoned
-
2015
- 2015-08-24 JP JP2015165051A patent/JP6312638B2/ja active Active
-
2016
- 2016-08-26 JP JP2016165793A patent/JP2016220686A/ja active Pending
-
2018
- 2018-08-23 JP JP2018155983A patent/JP6861189B2/ja active Active
- 2018-12-04 US US16/209,722 patent/US20190330654A1/en not_active Abandoned
-
2021
- 2021-03-29 JP JP2021055183A patent/JP7165228B2/ja active Active
- 2021-06-21 US US17/352,873 patent/US20220010331A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003506075A (ja) * | 1999-08-05 | 2003-02-18 | エムシーエル エルエルシー | 多能性成人幹細胞およびそれを単離する方法 |
Non-Patent Citations (6)
| Title |
|---|
| JPN6013061508; REN,C. et al.: 'Establishment and applications of epstein-barr virus-based episomal vectors in human embryonic stem' Stem Cells Vol.24, No.5, 200605, pp.1338-47 * |
| JPN6014018592; Science Vol.318, 2007, p.1917-1920 * |
| JPN6014018594; Science Vol.322, 20081009, p.949-953 * |
| JPN6014018597; Nature Vol.451, 2007, p.141-147 * |
| JPN6015015668; Molecular Biology Reports Vol.31, 2004, p.85-90 * |
| JPN6015015670; PNAS Vol.103, No.47, 2006, p.17672-17677 * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021094040A (ja) * | 2008-10-24 | 2021-06-24 | ウイスコンシン アラムニ リサーチ ファンデーション | 非ウイルス性再プログラムによる多能性幹細胞 |
| JP7165228B2 (ja) | 2008-10-24 | 2022-11-02 | ウイスコンシン アラムニ リサーチ ファンデーション | 非ウイルス性再プログラムによる多能性幹細胞 |
| US10260048B2 (en) | 2010-06-15 | 2019-04-16 | FUJIFILM Cellular Dynamics, Inc. | Generation of induced pluripotent stem cells from small volumes of peripheral blood |
| JP2017012145A (ja) * | 2015-07-02 | 2017-01-19 | 株式会社豊田中央研究所 | 遺伝的組換えを誘発する方法及びその利用 |
| US11464182B2 (en) | 2015-07-02 | 2022-10-11 | Kabushiki Kaisha Toyota Chuo Kenkyusho | Method of inducing genetic recombination, and use therefor |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2959327T3 (es) | 2024-02-23 |
| JP2018174945A (ja) | 2018-11-15 |
| CA2741090A1 (en) | 2010-04-29 |
| WO2010048567A1 (en) | 2010-04-29 |
| SG10201600234PA (en) | 2016-02-26 |
| JP6861189B2 (ja) | 2021-04-21 |
| DK3450545T3 (da) | 2023-10-02 |
| EP2356221B1 (en) | 2018-11-21 |
| US20130217117A1 (en) | 2013-08-22 |
| EP3450545B1 (en) | 2023-08-23 |
| DK2356221T3 (en) | 2019-02-18 |
| JP7165228B2 (ja) | 2022-11-02 |
| US8268620B2 (en) | 2012-09-18 |
| US20190330654A1 (en) | 2019-10-31 |
| IL212433B (en) | 2019-08-29 |
| EP3450545A1 (en) | 2019-03-06 |
| CA2741090C (en) | 2018-10-16 |
| US20100184227A1 (en) | 2010-07-22 |
| US20220010331A1 (en) | 2022-01-13 |
| IL212433A0 (en) | 2011-06-30 |
| JP6312638B2 (ja) | 2018-04-18 |
| CN102239249A (zh) | 2011-11-09 |
| JP2015213522A (ja) | 2015-12-03 |
| EP2356221A1 (en) | 2011-08-17 |
| CN105802917A (zh) | 2016-07-27 |
| JP2021094040A (ja) | 2021-06-24 |
| JP2016220686A (ja) | 2016-12-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7165228B2 (ja) | 非ウイルス性再プログラムによる多能性幹細胞 | |
| US9850499B2 (en) | Vectors and methods for the efficient generation of integration/transgene-free induced pluripotent stem cells from peripheral blood cells | |
| Eminli et al. | Reprogramming of neural progenitor cells into induced pluripotent stem cells in the absence of exogenous Sox2 expression | |
| JP5813321B2 (ja) | 体細胞の再プログラム化 | |
| JP6530452B2 (ja) | 合成メッセンジャーrnaを使用したヒト人工多能性幹細胞のフィーダーフリー誘導 | |
| US10435711B2 (en) | Feeder-free derivation of human-induced pluripotent stem cells with synthetic messenger RNA | |
| EP3904504A1 (en) | Feeder-free derivation of human-induced pluripotent stem cells with synthetic messenger rna | |
| Pfaff et al. | Efficient hematopoietic redifferentiation of induced pluripotent stem cells derived from primitive murine bone marrow cells | |
| JP2019170405A (ja) | 合成メッセンジャーrnaによるヒト人工多能性幹細胞のフィーダーフリー誘導 | |
| KR102361849B1 (ko) | 합성 메신저 rna를 사용한 인간-유도된 만능 줄기 세포의 무-피더 유래 | |
| MAHMAUD | GENERATION OF MOUSE INDUCED PLURIPOTENT STEM CELLS USING POLYCISTRONIC LENTIVIRAL VECTOR IN FEEDER-AND SERUM-FREE CULTURE |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20121022 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140507 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140807 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140814 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20141107 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150422 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150824 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150924 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20151019 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20151218 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20160404 |