JP2011517676A - インビボでrna干渉を媒介するための組成物および方法 - Google Patents
インビボでrna干渉を媒介するための組成物および方法 Download PDFInfo
- Publication number
- JP2011517676A JP2011517676A JP2011502065A JP2011502065A JP2011517676A JP 2011517676 A JP2011517676 A JP 2011517676A JP 2011502065 A JP2011502065 A JP 2011502065A JP 2011502065 A JP2011502065 A JP 2011502065A JP 2011517676 A JP2011517676 A JP 2011517676A
- Authority
- JP
- Japan
- Prior art keywords
- oligonucleotide
- dsrna
- nucleotides
- stranded
- tissue
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/554—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound the modifying agent being a steroid plant sterol, glycyrrhetic acid, enoxolone or bile acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Abstract
Description
本出願は、2008年3月27日に出願された欧州出願第08005800.1号および2008年3月28日に出願された米国仮出願第61/040,386号の利益を主張する。これらの優先出願の全体の内容は、出典明示により本明細書に組み込まれる。
本発明は、1本鎖および2本鎖の両方のオリゴヌクレオチドを含有する組成物と、RNA干渉の媒介におけるその使用とに関する。より具体的には、本発明は、組織特異的送達と製剤されたオリゴヌクレオチドによる標的発現の低減とを可能にするオリゴヌクレオチドの特定の製剤に関する。
(a)生物または生物の組織にFLiPを導入する工程であって、FLiPのオリゴヌクレオチドが、標的遺伝子を発現する細胞との接触時に、標的遺伝子の発現を抑制する工程、次いで
(c)工程(a)における細胞を、標的遺伝子のmRNA転写物の分解を得るのに十分な時間維持し、それにより該細胞における標的遺伝子の発現を抑制する工程。
便宜上、明細書、実施例、および添付の特許請求の範囲で用いられる特定の用語および語句の意味は、下記に提示される。本明細書の他の部分における用語の用法と、本項で提示されるその定義との間に明らかな矛盾がある場合、本項の定義が優先されるものとする。
IIa.2本鎖オリゴヌクレオチド
一実施形態では、本発明は、細胞または哺乳類の標的遺伝子の発現を抑制するための2本鎖リボ核酸(dsRNA)分子を提供し(単独で、または第2の標的遺伝子の発現を抑制するための第2のdsRNAと組み合わせて)、該dsRNAは、標的遺伝子の発現において形成されるmRNAの少なくとも一部に相補的である相補性領域を含むアンチセンス鎖を含み、該相補性領域は、長さが30ヌクレオチドより短く、概して長さが19〜24のヌクレオチドであり、該dsRNAは、該標的遺伝子を発現する細胞との接触時に、該標的遺伝子の発現を抑制する。該dsRNAは、2本鎖構造を形成するためにハイブリダイズするのに十分相補的である2つのRNA鎖を含む。概して、該2本鎖構造は、長さが15から30の間、より概して18から25の間、さらにより概して19から24の間、最も概して19から21の間の塩基対である。一定の実施形態では、長さが25から30の間の塩基対のより長いdsRNAが典型的である。同様に、該標的配列への相補性領域は、長さが15から30の間、より概して18から25の間、さらにより概して19から24の間、最も概して19から21の間のヌクレオチドである。いくつかの実施形態では、該dsRNAは、長さが10から15のヌクレオチドであり、他の実施形態では、該dsRNAは、長さが25から30のヌクレオチドである。本明細書で特徴とされるdsRNAは、1つもしくは複数の1本鎖ヌクレオチドオーバーハングをさらに含み得る。該dsRNAは、さらに後述する当技術分野において既知の標準的な方法、例えば、例えばBiosearch,Applied Biosystems, Inc.より市販されるような自動DNA合成装置を使用することによって合成可能である。一実施形態では、該標的遺伝子は、ヒトの標的遺伝子である。
式中、
Xは、N(CO)R7またはNR7であり、
R3、R5、およびR9の各々は、R3、R5、またはR9のうちの1つのみがOH、ORa、またはORbであるという条件で、独立してH、OH、ORa、ORbであり、
R7は、NRcRdまたはNHC(O)Rdで置換されるC1〜C20アルキルであり、
Raは、
Rbは、
AおよびCの各々は、独立してOまたはSであり、
Bは、OH、O−、または
Rcは、HまたはC1−C6アルキルであり、および、
Rdは、例えば、コレステロール;胆汁酸;または脂肪酸(例えば、リトコール−オレイル酸、ラウロイル酸、デカノイル(docosnyl)酸、ステアロイル酸、パルミトイル酸、リストイル酸、オレオイル酸、またはリノレオイル酸)を含む脂溶性リガンドである。いくつかの実施形態では、該脂溶性リガンドは、炭水化物ラジカルにさらにテザーされることが可能である。本明細書に説明するオリゴヌクレオチドに組み込まれることが可能であり、かつ脂溶性部分に共有結合される他の例示的単量体が、例えば、参照によりその全体が本明細書に組み込まれる米国2005/0107325号に説明されている。
マイクロRNAつまりmirとして説明および/または識別されるものを含む1本鎖オリゴヌクレオチドであって、標的物として使用され得るか、または本明細書で特徴とされるオリゴヌクレオチドの設計のテンプレートとしての役割を果たし得る1本鎖オリゴヌクレオチドについては、例えば、名称が「Oligomeric compounds and compositions for use in modulation small non−coding RNAs」であるEsau et al.への米国公開第20050261218号(USSN:10/909125)において教示されており、その全体の内容は、参照により本明細書に組み込まれる。上述の2本鎖オリゴヌクレオチドに適用する任意の化学的な修正または変形が、1本鎖オリゴヌクレオチドにも適用することを、当業者は理解する。したがって、ここでは繰り返し説明しない。
FLiPは、(a)1本鎖または2本鎖オリゴヌクレオチドのうちの少なくとも1つであって、脂溶性物質に抱合されている該オリゴヌクレオチドと、(b)該抱合されたオリゴヌクレオチドが凝集、混合、または会合されているエマルションまたはリポソームのうちの少なくとも1つとを含む。
例示的分画方法には、クロマトグラフィー、例えば、液体クロマトグラフィーおよび超遠心分離法が含まれる。
a)脂質エマルションを化学的に修飾され得る1つまたは複数の1本鎖または2本鎖脂溶性物質(例えば、コレステロール)抱合オリゴヌクレオチドと混合する工程と、
b)この混合物を分画する工程と、
c)サイズが約40nm等の30〜50nmの粒子を有する分画を選択する工程と、
を含む。
一実施形態では、本発明は、本明細書に説明するようなオリゴヌクレオチドと、医薬的に許容可能な担体とを含有する医薬組成物を提供する。このような組成物は、標的遺伝子発現が媒介する病理過程等の、標的遺伝子の発現または活性に関連する病気または疾患を治療するのに有用である。
本明細書で特徴とされる医薬組成物には、溶液、エマルション、およびリポソーム含有製剤が含まれるが、これらに限定されない。これらの組成物は、多種多様の成分から生成され、この成分には、事前形成液体、自己乳化固体、および自己乳化半固体が含まれるが、これらに限定されない。肺、心臓、および他の筋肉を標的とする製剤が特に好適である。
FLiP組成物は、エマルションとして調製および製剤化され得る。エマルションは、典型的には、液滴の形態で別の液体中に分散される、ある液体の不均一系である。(Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., Volume 1, p. 245; Block in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 2, p. 335; Higuchi et al., in Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301)。エマルションは、しばしば、相互に密接に混合および分散された2つの不混和性の液体相を含む2相系である。概して、エマルションは、油中水(w/o)または水中油(o/w)種のいずれかであり得る。水相が、大量の油相に細かく分割されて、微細な液滴として分散される場合、生じた組成物は、油中水(w/o)エマルションと呼ばれる。代替として、油相が、大量の水相に細かく分割されて、微細な液滴として分散される場合、生じた組成物は、水中油(o/w)エマルションと呼ばれる。エマルションは、該分散された相の他に追加の成分を含有し得、および水相、油相、またはそれ自体を別の相とするいずれかの相に、溶液として存在し得る活性薬物を含有し得る。また、乳化剤、安定剤、色素、および抗酸化剤等の医薬的賦形剤も、必要に応じて、エマルション中に存在し得る。また、医薬的エマルションは、例えば、油中水中油(o/w/o)エマルションおよび水中油中水(w/o/w)エマルションの場合等の、2つより多くの相で構成される多重エマルションであり得る。このような複雑な製剤は、しばしば単純な2成分のエマルションが提供しない一定の利点を提供する。o/wエマルションの個々の油滴が、小さい水滴を囲む多重エマルションは、w/o/wエマルションを構成する。同様に、油の連続相中に安定化された水の小球中に囲まれた油滴の系は、o/w/oエマルションを提供する。
本発明において使用する「リポソーム」という用語は、球形の一つの2重層または複数の2重層に配置された両親媒性脂質から構成される小胞を意味する。
また、非イオンリポソーム系も、非イオン性界面活性剤およびコレステロールを含む特定の系において、皮膚への薬物の送達におけるその有用性を判断するために試験された。Novasome(登録商標)I(ジラウリン酸グリセリル/コレステロール/ポリオキシエチレン−10−ステアリルエーテル)およびNovasome(登録商標)II(ジステアリン酸グリセリル/コレステロール/ポリオキシエチレン−10−ステアリルエーテル)を含む、非イオン性リポソーム製剤を使用して、マウス皮膚の真皮中にシクロスポリンAを送達した。その結果、このような非イオン性リポソーム系が、皮膚の異なる層中へのシクロスポリンAの沈着の促進に有効であったことが示された(Hu et al. S.T.P.Pharma. Sci., 1994, 4, 6, 466)。
いくつかの実施形態では、FLiPは、浸透促進剤を用いて、動物の皮膚に、核酸、特にdsRNAの効率的な送達を行う。大部分の薬物は、イオン化形態および非イオン化形態の両方で存在する。しかしながら、通常、脂質可溶性または脂溶性薬物のみが容易に細胞膜を通過する。通過される膜が浸透促進剤で処理される場合、非脂溶性薬物でも、細胞膜を通過することができることが発見された。細胞膜を通過する非脂溶性薬物の拡散を支援することに加え、浸透促進剤は、脂溶性薬剤の透過性も強化する。
FLiPの一定の組成物は、製剤中に担体化合物も含む。本明細書において使用する「担体化合物」または「担体」は、核酸またはその類似体を指し、これは、不活性(すなわち、それ自体が生物活性を持たない)であるが、例えば、生物的に活性な核酸を分解すること、または血液循環から生物学的に活性な核酸の除去を促進することによって、生物活性を有する核酸のバイオアベイラビリティーを低減させるインビボプロセスにより、核酸として認識される。核酸と担体化合物との同時投与であって、典型的には、後者の物質を過剰に含む同時投与によって、恐らく、共通の受容体に対する担体化合物と核酸との間の競合に起因して、肝臓、腎臓、または他の外部循環の貯蔵部において回収される核酸の量が実質的に減少し得る。例えば、肝臓組織における部分的なホスホロチオエートdsRNAの回収は、それが、ポリイノシン酸、硫酸デキストラン、ポリシチジン酸、または4−アセトアミド−4’イソチオシアノ−スチルベン−2,2’−ジスルホン酸と同時投与される場合に減少され得る(Miyao et al., DsRNA Res. Dev., 1995, 5, 115−121; Takakura et al., DsRNA & Nucl. Acid Drug Dev., 1996, 6, 177−183)。
担体化合物とは対照的に、「医薬担体」または「賦形剤」は、医薬的に許容可能な溶媒、懸濁剤、または動物に1つもしくは複数の核酸を送達するための任意の他の薬理学的に不活性なビヒクルである。該賦形剤は、液体でも固体でもよく、核酸および所定の医薬組成物の他の成分と組み合わせる場合、所望のバルク、稠度等を提供するように考慮して計画された投与様式によって選択される。典型的な医薬担体には、結合剤(例えば、予備糊化トウモロコシでんぷん、ポリビニルピロリドンまたはヒドロキシプロピルメチルセルロース等);充填剤(例えば、ラクトースおよび他の糖、微結晶性セルロース、ペクチン、ゼラチン、硫酸カルシウム、エチルセルロース、ポリアクリル酸塩、またはリン酸水素カルシウム等);潤滑剤(例えば、ステアリン酸マグネシウム、タルク、シリカ、コロイド状2酸化ケイ素、ステアリン酸、ステアリン酸金属、水素化植物油、コーンスターチ、ポリエチレングリコール、安息香酸ナトリウム、酢酸ナトリウム等);崩壊剤(例えば、でんぷん、でんぷんグリコール酸ナトリウム等);および湿潤剤(例えば、ラウリル硫酸ナトリウム等)が含まれるが、これらに限定されない。
また、核酸と有害に反応しない、非経口外投与に適切な医薬的に許容可能な有機賦形剤または無機賦形剤も、組成物を製剤化するために使用可能である。適適切な医薬的に許容可能な担体には、水、塩溶液、アルコール、ポリエチレングリコール、ゼラチン、ラクトース、アミロース、ステアリン酸マグネシウム、タルク、ケイ酸、粘性パラフィン、ヒドロキシメチルセルロース、ポリビニルピロリドン、およびその同等物が含まれるが、これらに限定されない。
FLiP組成物は、医薬組成物中に慣習的に見出される他の補助的な成分を、当技術分野で確立された使用レベルで付加的に含有してもよい。したがって、例えば、該組成物は、かゆみ止め薬、収れん薬、局部麻酔剤、または抗炎症剤等の、追加の適合する医薬的に活性な物質を含有し得るか、あるいは色素、香味剤、防腐剤、抗酸化剤、乳白剤、増粘剤、および安定剤等の、FLiP組成物の種々の投薬形態の物理的な製剤に有用な追加の物質を含有し得る。しかしながら、このような物質は、添加時に、該組成物の成分の生物活性を過度に干渉するべきではない。該製剤は、滅菌することが可能であり、所望に応じて、該製剤の核酸と有害に相互作用しない補助剤、例えば、潤滑剤、防腐剤、安定剤、湿潤剤、乳化剤、浸透圧に影響する塩、緩衝剤、着色料、香味料、および/または芳香物質、およびその同等物と混合されることが可能である。
本発明は、具体的には、(a)1本鎖または2本鎖オリゴヌクレオチドのうちの少なくとも1つであって、脂溶性物質に抱合されている該オリゴヌクレオチドと、(b)該抱合されたオリゴヌクレオチドが、心臓、肺、または筋肉の病気または疾患または病状の治療のために凝集、混合、または会合するエマルションまたはリポソームのうちの少なくとも1つとを有するFLiP組成物に関する。
本発明は、標的遺伝子の発現がサイレンスされるようにFLiP組成物を哺乳類に投与することによって、哺乳類の標的遺伝子の発現を抑制するための方法を提供する。
試薬の供給源
本明細書に試薬源が具体的に提示されない場合、このような試薬は、分子生物学での適用に標準的な品質/純度において分子生物学用の試薬の任意の供給業者から入手してもよい。
Expedite 8909シンセサイザー(Applied Biosystems, Applera Deutschland GmbH, Darmstadt, Germany)と、固相担体として制御多孔性ガラス(CPG, 500Å, Proligo Biochemie GmbH, Hamburg, Germany)とを使用して、1μモルの尺度で固相合成により1本鎖RNAを生成した。それぞれ対応するホスホルアミダイトおよび2’−O−メチルホスホルアミダイトを用いて(Proligo Biochemie GmbH, Hamburg, Germany)、固相合成によりRNAおよび2’−O−メチルヌクレオチドを含有するRNAを生成した。Current protocols in nucleic acid chemistry, Beaucage, S.L. et al. (Edrs.), John Wiley & Sons, Inc., New York, NY, USAに説明されているような標準ヌクレオチドホスホルアミダイト化学を使用して、これらの構成単位をオリゴリボヌクレオチド鎖の配列内の選択部位に組み込んだ。ヨウ素酸化溶液をアセトニトリル(1%)中のBeaucage試薬(Chruachem Ltd, Glasgow, UK)に置き換えることにより、ホスホロチオエート結合を導入した。さらなる補助試薬をMallinckrodt Baker(Griesheim, Germany)から入手した。
ジエチル−2−アザブタン−1,4−ジカルボキシレートAA
3−{エトキシカルボニルメチル−[6−(9H−フルオレン−9−イルメトキシカルボニル−アミノ)−ヘキサノイル]−アミノ}−プロピオン酸エチルエステル AB
3−[(6−アミノ−ヘキサノイル)−エトキシカルボニルメチル−アミノ]−プロピオン酸エチルエステル AC
3−({6−[17−(1,5−ジメチル−ヘキシル)−10,13−ジメチル−2,3,4,7,8,9,10,11,12,13,14,15,16,17−テトラデカヒドロ−1H−シクロペンタ[a]フェナントレン−3−イルオキシカルボニルアミノ]−ヘキサノイル}エトキシカルボニルメチル−アミノ)−プロピオン酸エチルエステル AD
1−{6−[17−(1,5−ジメチル−ヘキシル)−10,13−ジメチル−2,3,4,7,8,9,10,11,12,13,14,15,16,17−テトラデカヒドロ−1H−シクロペンタ[a]フェナントレン−3−イルオキシカルボニルアミノ]−ヘキサノイル}−4−オキソ−ピロリジン−3−カルボン酸エチルエステル AE
[6−(3−ヒドロキシ−4−ヒドロキシメチル−ピロリジン−1−イル)−6−オキソ−ヘキシル]−カルバミン酸17−(1,5−ジメチル−ヘキシル)−10,13−ジメチル−2,3,4,7,8,9,10,11,12,13,14,15,16,17−テトラデカヒドロ−1H−シクロペンタ[a]フェナントレン−3−イルエステル AF
(6−{3−[ビス−(4−メトキシ−フェニル)−フェニル−メトキシメチル]−4−ヒドロキシ−ピロリジン−1イル}−6−オキソ−ヘキシル)−カルバミン酸17−(1,5−ジメチル−ヘキシル)−10,13−ジメチル−2,3,4,7,8,9,10,11,12,13,14,15,16,17−テトラデカヒドロ−1H−シクロペンタ[a]フェナントレン−3−イルエステル AG
スクシン酸モノ−(4−[ビス−(4−メトキシ−フェニル)−フェニル−メトキシメチル]−1−{6−[17−(1,5−ジメチル−ヘキシル)−10,13−ジメチル2,3,4,7,8,9,10,11,12,13,14,15,16,17−テトラデカヒドロ−1Hシクロペンタ[a]フェナントレン−3−イルオキシカルボニルアミノ]−ヘキサノイル}−ピロリジン−3−イル)エステル AH
コレステロール誘導化CPG AI
Intralipid(登録商標)(シグマ20%)濃度は、200mg/ml(約570μM)である。Intralipid(登録商標)を133μMに希釈し、室温で30分間、Chol抱合RNA(Chol−RNA)(定量化のために少量の32P標識Chol−RNAを加えた4mg/ml、266μM)と1:2でインキュベートする。FPLC泳動緩衝剤(0.15M NaCl、0.01M Na2HPO4、0.1mM EDTA、pH7.5)とともに2つのSuprose6カラム(流出入体積:0.5ml)(Pharmacia HR10/30コード#17−0537−01)を使用して、非結合Chol−RNAをゲルろ過により分離する。Intralipid(登録商標)/chol−RNA分画(30nmから50nmの粒子)を収集し、Chol−RNA含有物をシンチレーション計測により定量化する。
Chol−apoB1−siRNA、つまり、化学的に修飾された脂溶性物質抱合siRNA−apoB1を、対応するセンス鎖:5’−GUCAUCACACUGAAUACCAAUsHyp−L−3’(配列番号:1)から構成し、Soutschek et al. 2004, Nature 432, 173−8に説明するように、アンチセンス鎖:5’−AUUGGUAUUCAGUGUGAUGACsAsC−3’(配列番号:2)を得た。該コレステロール抱合センス鎖を、ヒドロキシプロリノール脂溶性固体担体から合成した。6−アミノヘキサン酸結合を介して、コレステロールをトランス−4−ヒドロキシプロリノールにテザーして、ヒドロキシプロリノール脂溶性部分(Hyp)を得て、その後、これを官能化制御多孔性ガラスに結合させて、固体担体を得た。文字の「L」は、脂溶性を表し、小文字は、2’−O−メチル糖修飾を表し、下付き文字「s」は、ホスホロチオエート結合を表す。
Intralipid(登録商標)/antagomir−16およびIntralipid(登録商標)/chol−apoB1−siRNAの血漿クリアランスを、尾注射の後で調査した。antagomir−16の血液t1/2を、約20分であると決定し、chol−apoB1−siRNAの血液t1/2を約40分であると決定した(図2)。当該実験により、全身注射の後に、Intralipid(登録商標)/RNA複合体の血液からの迅速な除去が示された。
マウスにおけるIntralipid(登録商標)/miRNAの注射
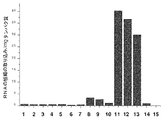
50mg/体重kgにおけるantagomir−133a/Intralipid(登録商標)#1を単回注射によりマウスに注射した。心臓および大腿四頭筋におけるマイクロRNA−133a(miR−133a)のレベルを、注射の24時間後にノーザンブロット法により測定した。治療毎に複製物を測定した。当該実験により、心臓および大腿四頭筋におけるmiR−133aのインビボサイレンシングが明らかになった(図5)。
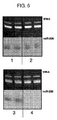
PBS(対照)、antagomir−206、またはIntralipid(登録商標)#1で複合体化されたantagomir−206を、それぞれ3x80mg/体重kg(bw)または3x50mg/kgの投与量で、重複してマウスに注射した。マウスは、4日目(最終注射の24時間後)に殺処分し、全てのRNAを大腿四頭筋から単離し、miR−206レベルをノーザンブロット法により分析した。tRNAは、負荷対照として示される。
当該実験により、大腿四頭筋におけるantagomir−206/Intralipid(登録商標)#1の注射の後にmiR−206の完全なインビボサイレンシングが示される(図6)。
Intralipid(登録商標)をHPLCにより分画した。タンパク質を、標示される分画から抽出し、12%のポリアクリルアミドゲルで分離した。タンパク質を銀染色により可視化した。10kDから20kDの分子量(MW)の2つのタンパク質バンドを、分画38〜50(Intralipid(登録商標)#1を含有する分画に対応する)において検出した(図7)(図1も参照)。
Claims (33)
- (a)1本鎖または2本鎖オリゴヌクレオチドのうちの少なくとも1つであって、脂溶性物質に抱合されている前記オリゴヌクレオチドと、
(b)前記脂溶性物質に抱合されたオリゴヌクレオチドが凝集、混合、または会合されているエマルションと、
を含む組成物であって、少なくとも100nmのサイズを有する組成物。 - 前記脂溶性物質に抱合されたオリゴヌクレオチドが、2本鎖オリゴヌクレオチドを含む、請求項1に記載の組成物。
- 前記2本鎖オリゴヌクレオチドが、相互に相補的である少なくとも2本鎖を含む2本鎖RNA(dsRNA)であって、前記2本鎖のうちの各々が、少なくとも15ヌクレオチドの長さであって、センス鎖が、第1の配列を含み、アンチセンス鎖が、標的遺伝子のうちの少なくとも一部に実質的に相補的である相補性領域を含む第2の配列を含み、前記相補性領域が、30ヌクレオチドの長さより短いものである、請求項2に記載の組成物。
- 前記dsRNAが、少なくとも1つの修飾ヌクレオチドを含む、請求項3に記載の組成物。
- 前記修飾ヌクレオチドのうちの少なくとも1つが、2’−O−メチル修飾ヌクレオチド、5’−ホスホロチオエート基を含むヌクレオチド、およびコレステリル誘導体またはドデカン酸ビスデシルアミド基に結合される末端ヌクレオチドから成る群から選択される、請求項3に記載の組成物。
- 前記修飾ヌクレオチドが、2’−デオキシ−2’−フルオロ修飾ヌクレオチド、2’−デオキシ−修飾ヌクレオチド、ロックされたヌクレオチド、脱塩基ヌクレオチド、2’−アミノ−修飾ヌクレオチド、2’−アルキル−修飾ヌクレオチド、モルホリノヌクレオチド、ホスホルアミド酸、およびヌクレオチドを含む非天然塩基の群から選択される、請求項3に記載の組成物。
- 前記相補性領域が、19から21ヌクレオチドの長さの間である、請求項3に記載の組成物。
- 前記dsRNAが、前記dsRNAの片方または両方の末端に1本鎖オーバーハングを含む、請求項3に記載の組成物。
- 前記センス鎖およびアンチセンス鎖の各々が、19個の塩基対相補性を有する21ヌクレオチドの長さであり、前記dsRNAが、各鎖の3’末端に2ヌクレオチドの1本鎖オーバーハングを有する、請求項3に記載の組成物。
- 前記脂溶性物質抱合体が、コレステロール部分である、請求項1に記載の組成物。
- 前記脂溶性物質が抱合されたオリゴヌクレオチドが、1本鎖オリゴヌクレオチドを含み、前記1本鎖オリゴヌクレオチドが、マイクロRNAまたはマイクロRNA標的化合物である、請求項1に記載の組成物。
- オリゴヌクレオチドを哺乳類の組織に選択的に標的化または送達するための方法であって、哺乳類を前記オリゴヌクレオチドに接触させ、前記オリゴヌクレオチドが、製剤脂質粒子(FLiP)エマルションで製剤化されており、前記エマルションが、少なくとも100nmのサイズである、方法。
- 前記哺乳類の組織が、心臓組織、肺組織、および/または筋肉組織である、請求項12に記載の方法。
- 前記オリゴヌクレオチドが、2本鎖を有する2本鎖RNA(dsRNA)を含み、各鎖が、19個の塩基対相補性を有する21ヌクレオチドの長さであり、各鎖が、3’末端に2ヌクレオチドの1本鎖オーバーハングを有する、請求項12に記載の方法。
- 前記オリゴヌクレオチドが、コレステロール部分で修飾される、請求項14に記載の方法。
- 前記オリゴヌクレオチドが、ApoBまたはRhoAを標的とする、請求項12に記載の方法。
- 前記オリゴヌクレオチドが、miRNA拮抗薬またはantagomirを含む、請求項12に記載の方法。
- 前記組織を請求項1に記載の組成物に接触させることを含む、哺乳類の組織における遺伝子の発現を低減させる方法。
- 前記哺乳類の組織が、心臓組織、肺組織、および/または筋肉組織である、請求項18に記載の方法。
- 前記組織における遺伝子の発現が、哺乳類のインビボで低減され、前記接触させることが、前記哺乳類への全身送達を介するものである、請求項19に記載の方法。
- トリアシルグリセロール、リン脂質、グリセロール、および脂溶性リンカー分子を介して1本鎖または2本鎖オリゴヌクレオチドと凝集する1つまたは複数の脂質結合タンパク質を含むリポソームであって、心臓組織、肺組織、および/または筋肉組織に対して親和性を有する、リポソーム。
- 前記オリゴヌクレオチドが、1つもしくは複数のオリゴヌクレオチド修飾によって安定化されるものである、請求項21に記載のリポソーム。
- 約20%のトリアシルグリセロール、約1.2%のリン脂質、ならびに約2.25%のグリセロールおよび1つまたは複数の脂質結合タンパク質を含む、請求項21または22のいずれかに記載のリポソーム。
- 20〜50nm、好ましくは、約35nmの粒子サイズを有する、請求項21から23のいずれかに記載のリポソーム。
- 前記オリゴヌクレオチドが、RNA干渉を媒介するオリゴヌクレオチド、RNAを標的とするオリゴヌクレオチド、またはタンパク質を標的とするオリゴヌクレオチドである、請求項21から24のいずれかに記載のリポソーム。
- 前記オリゴヌクレオチドが、RNAである、請求項21から25のいずれかに記載のリポソーム。
- 脂質粒子のエマルションを分画し、次いで20〜50nm、好ましくは約35nmの粒子サイズについて選択することによって取得することができる、請求項21から26のいずれかに記載のリポソーム。
- 請求項21から27のいずれかに記載のリポソーム凝集体を生成するための方法であって、
a.脂質エマルションを1つまたは複数の1本鎖または2本鎖オリゴヌクレオチドと混合する工程と、
b.工程a)の混合物を分画する工程と、
c.20〜50nm、好ましくは約35nmの粒子サイズを有する分画を選択する工程と、
を含む、方法。 - 請求項21から27のいずれかに記載のリポソーム凝集体を生成するための方法であって、トリアシルグリセロール、リン脂質、グリセロール、および1つまたは複数の脂質結合タンパク質を含む前記脂質粒子が、第一に、脂質エマルションから単離され、次いで、2倍を超えるモル過剰の1つまたは複数の脂溶性物質に抱合された1本鎖または2本鎖オリゴヌクレオチドと混合される、方法。
- 医薬として使用するための請求項21から27のいずれかに記載のリポソーム。
- 心臓、肺、および/または筋肉の病気の治療のための請求項21から27のいずれかに記載のリポソーム。
- 心臓、肺、および/または筋肉の病気の治療のための医薬の製造のための請求項21から27のいずれかに記載のリポソームの使用。
- 請求項21から27のいずれかに記載のリポソームを含む凍結乾燥物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08005800A EP2105145A1 (en) | 2008-03-27 | 2008-03-27 | Method for muscle-specific delivery lipid-conjugated oligonucleotides |
| EP08005800.1 | 2008-03-27 | ||
| US4038608P | 2008-03-28 | 2008-03-28 | |
| US61/040,386 | 2008-03-28 | ||
| PCT/US2009/038437 WO2009120887A2 (en) | 2008-03-27 | 2009-03-26 | Compositions and methods for mediating rnai in vivo |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011517676A true JP2011517676A (ja) | 2011-06-16 |
| JP2011517676A5 JP2011517676A5 (ja) | 2012-05-17 |
Family
ID=39683892
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011502065A Pending JP2011517676A (ja) | 2008-03-27 | 2009-03-26 | インビボでrna干渉を媒介するための組成物および方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US8148344B2 (ja) |
| EP (2) | EP2105145A1 (ja) |
| JP (1) | JP2011517676A (ja) |
| WO (1) | WO2009120887A2 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013256452A (ja) * | 2012-06-11 | 2013-12-26 | Kawaken Fine Chem Co Ltd | メラニン産生抑制剤とその組成物 |
| JP2016540777A (ja) * | 2013-12-03 | 2016-12-28 | ノースウェスタン ユニバーシティ | リポソーム粒子、前述のものを作製する方法及びその使用 |
| JP2018534275A (ja) * | 2015-10-07 | 2018-11-22 | コーメディクス・インコーポレーテッド | タウロリジンの皮膚浸透製剤 |
| US10837018B2 (en) | 2013-07-25 | 2020-11-17 | Exicure, Inc. | Spherical nucleic acid-based constructs as immunostimulatory agents for prophylactic and therapeutic use |
| JP2022537987A (ja) * | 2019-07-02 | 2022-08-31 | アルゴノート アールエヌエー リミテッド | アポリポタンパク質bアンタゴニスト |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2914775T3 (es) | 2007-10-26 | 2022-06-16 | Academisch Ziekenhuis Leiden | Medios y métodos para contrarresta trastornos del músculo |
| BRPI0818901A2 (pt) | 2007-11-09 | 2015-05-12 | Univ Texas | Micro-rnas da família mir-15 modulam sobrevivência de cardiomiócitos e reparo cardíaco |
| WO2009117418A2 (en) | 2008-03-17 | 2009-09-24 | The Board Of Regents Of The University Of Texas System | Identification of micro-rnas involved in neuromuscular synapse maintenance and regeneration |
| EP2105145A1 (en) | 2008-03-27 | 2009-09-30 | ETH Zürich | Method for muscle-specific delivery lipid-conjugated oligonucleotides |
| EP2119783A1 (en) | 2008-05-14 | 2009-11-18 | Prosensa Technologies B.V. | Method for efficient exon (44) skipping in Duchenne Muscular Dystrophy and associated means |
| US20100233270A1 (en) | 2009-01-08 | 2010-09-16 | Northwestern University | Delivery of Oligonucleotide-Functionalized Nanoparticles |
| JP5863670B2 (ja) | 2010-01-19 | 2016-02-17 | ノースウェスタン ユニバーシティ | 核酸および/または他の構成要素を含有している合成ナノ構造体 |
| AU2013212758A1 (en) | 2012-01-27 | 2014-08-14 | Biomarin Technologies B.V. | RNA modulating oligonucleotides with improved characteristics for the treatment of Duchenne and Becker muscular dystrophy |
| US9163235B2 (en) | 2012-06-21 | 2015-10-20 | MiRagen Therapeutics, Inc. | Inhibitors of the miR-15 family of micro-RNAs |
| WO2015023797A1 (en) | 2013-08-13 | 2015-02-19 | Northwestern University | Lipophilic nanoparticles for drug delivery |
| JP6621409B2 (ja) | 2013-11-22 | 2019-12-18 | ミナ セラピューティクス リミテッド | C/EBPα小分子活性化RNA組成物 |
| EP3132044B1 (en) | 2014-04-18 | 2020-04-08 | University of Massachusetts | Exosomal loading using hydrophobically modified oligonucleotides |
| CN106535876B (zh) | 2014-06-04 | 2020-09-11 | 埃克西奎雷股份有限公司 | 免疫调节剂通过脂质体球形核酸的多价递送以用于预防或治疗应用 |
| EA201790802A1 (ru) | 2014-10-06 | 2017-08-31 | Экзикьюр, Инк. | Соединения против tnf |
| CA2968531A1 (en) | 2014-11-21 | 2016-05-26 | Northwestern University | The sequence-specific cellular uptake of spherical nucleic acid nanoparticle conjugates |
| CN108064295A (zh) | 2015-01-14 | 2018-05-22 | 埃克西奎雷股份有限公司 | 具有核心基序的核酸纳米结构 |
| US10967072B2 (en) | 2016-04-27 | 2021-04-06 | Northwestern University | Short interfering RNA templated lipoprotein particles (siRNA-TLP) |
| JP7186094B2 (ja) | 2016-05-06 | 2022-12-08 | イグジキュア オペレーティング カンパニー | インターロイキン17受容体mRNAの特異的ノックダウンのためのアンチセンスオリゴヌクレオチド(ASO)を提示するリポソーム系球状核酸(SNA)構築物 |
| US11364304B2 (en) | 2016-08-25 | 2022-06-21 | Northwestern University | Crosslinked micellar spherical nucleic acids |
| WO2018152327A1 (en) * | 2017-02-15 | 2018-08-23 | Northwestern University | Enhancing stability and immunomodulatory activity of liposomal spherical nucleic acids |
| US11696954B2 (en) | 2017-04-28 | 2023-07-11 | Exicure Operating Company | Synthesis of spherical nucleic acids using lipophilic moieties |
| MX2020000387A (es) | 2017-07-13 | 2020-08-17 | Univ Northwestern | Método general y directo para preparar nanopartículas de estructura organometálica funcionalizadas con oligonucleotidos. |
| EP3679140B1 (en) | 2017-09-08 | 2022-11-16 | MiNA Therapeutics Limited | Stabilized cebpa sarna compositions and methods of use |
| EP3679139B1 (en) | 2017-09-08 | 2022-11-02 | MiNA Therapeutics Limited | Stabilized hnf4a sarna compositions and methods of use |
| EP4242307A3 (en) | 2018-04-12 | 2023-12-27 | MiNA Therapeutics Limited | Sirt1-sarna compositions and methods of use |
| WO2020208361A1 (en) | 2019-04-12 | 2020-10-15 | Mina Therapeutics Limited | Sirt1-sarna compositions and methods of use |
| GB2603454A (en) | 2020-12-09 | 2022-08-10 | Ucl Business Ltd | Novel therapeutics for the treatment of neurodegenerative disorders |
| CA3214137A1 (en) | 2021-03-26 | 2022-09-29 | Mina Therapeutics Limited | Tmem173 sarna compositions and methods of use |
| WO2023099884A1 (en) | 2021-12-01 | 2023-06-08 | Mina Therapeutics Limited | Pax6 sarna compositions and methods of use |
| GB202117758D0 (en) | 2021-12-09 | 2022-01-26 | Ucl Business Ltd | Therapeutics for the treatment of neurodegenerative disorders |
| WO2023170435A1 (en) | 2022-03-07 | 2023-09-14 | Mina Therapeutics Limited | Il10 sarna compositions and methods of use |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008004058A2 (en) * | 2006-04-06 | 2008-01-10 | Polyplus-Transfection Sa | Compositions for transfection of oligonucleotides active for gene silencing and their biological and therapeutical applications |
Family Cites Families (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4426330A (en) * | 1981-07-20 | 1984-01-17 | Lipid Specialties, Inc. | Synthetic phospholipid compounds |
| US4534899A (en) * | 1981-07-20 | 1985-08-13 | Lipid Specialties, Inc. | Synthetic phospholipid compounds |
| JPS5927900A (ja) * | 1982-08-09 | 1984-02-14 | Wakunaga Seiyaku Kk | 固定化オリゴヌクレオチド |
| FR2540122B1 (fr) * | 1983-01-27 | 1985-11-29 | Centre Nat Rech Scient | Nouveaux composes comportant une sequence d'oligonucleotide liee a un agent d'intercalation, leur procede de synthese et leur application |
| US4605735A (en) * | 1983-02-14 | 1986-08-12 | Wakunaga Seiyaku Kabushiki Kaisha | Oligonucleotide derivatives |
| US4948882A (en) * | 1983-02-22 | 1990-08-14 | Syngene, Inc. | Single-stranded labelled oligonucleotides, reactive monomers and methods of synthesis |
| US4824941A (en) * | 1983-03-10 | 1989-04-25 | Julian Gordon | Specific antibody to the native form of 2'5'-oligonucleotides, the method of preparation and the use as reagents in immunoassays or for binding 2'5'-oligonucleotides in biological systems |
| US4587044A (en) * | 1983-09-01 | 1986-05-06 | The Johns Hopkins University | Linkage of proteins to nucleic acids |
| US5118802A (en) * | 1983-12-20 | 1992-06-02 | California Institute Of Technology | DNA-reporter conjugates linked via the 2' or 5'-primary amino group of the 5'-terminal nucleoside |
| US5430136A (en) * | 1984-10-16 | 1995-07-04 | Chiron Corporation | Oligonucleotides having selectably cleavable and/or abasic sites |
| US5258506A (en) * | 1984-10-16 | 1993-11-02 | Chiron Corporation | Photolabile reagents for incorporation into oligonucleotide chains |
| US4828979A (en) * | 1984-11-08 | 1989-05-09 | Life Technologies, Inc. | Nucleotide analogs for nucleic acid labeling and detection |
| US4762779A (en) * | 1985-06-13 | 1988-08-09 | Amgen Inc. | Compositions and methods for functionalizing nucleic acids |
| US5317098A (en) | 1986-03-17 | 1994-05-31 | Hiroaki Shizuya | Non-radioisotope tagging of fragments |
| JPS638396A (ja) * | 1986-06-30 | 1988-01-14 | Wakunaga Pharmaceut Co Ltd | ポリ標識化オリゴヌクレオチド誘導体 |
| US4904582A (en) * | 1987-06-11 | 1990-02-27 | Synthetic Genetics | Novel amphiphilic nucleic acid conjugates |
| US5585481A (en) * | 1987-09-21 | 1996-12-17 | Gen-Probe Incorporated | Linking reagents for nucleotide probes |
| US5525465A (en) * | 1987-10-28 | 1996-06-11 | Howard Florey Institute Of Experimental Physiology And Medicine | Oligonucleotide-polyamide conjugates and methods of production and applications of the same |
| DE3738460A1 (de) * | 1987-11-12 | 1989-05-24 | Max Planck Gesellschaft | Modifizierte oligonukleotide |
| US5082830A (en) * | 1988-02-26 | 1992-01-21 | Enzo Biochem, Inc. | End labeled nucleotide probe |
| US5109124A (en) * | 1988-06-01 | 1992-04-28 | Biogen, Inc. | Nucleic acid probe linked to a label having a terminal cysteine |
| US5262536A (en) * | 1988-09-15 | 1993-11-16 | E. I. Du Pont De Nemours And Company | Reagents for the preparation of 5'-tagged oligonucleotides |
| GB8824593D0 (en) | 1988-10-20 | 1988-11-23 | Royal Free Hosp School Med | Liposomes |
| US5512439A (en) * | 1988-11-21 | 1996-04-30 | Dynal As | Oligonucleotide-linked magnetic particles and uses thereof |
| US5457183A (en) * | 1989-03-06 | 1995-10-10 | Board Of Regents, The University Of Texas System | Hydroxylated texaphyrins |
| US5599923A (en) * | 1989-03-06 | 1997-02-04 | Board Of Regents, University Of Tx | Texaphyrin metal complexes having improved functionalization |
| ATE104857T1 (de) * | 1989-03-07 | 1994-05-15 | Genentech Inc | Kovalente konjugate von lipiden und oligonukleotiden. |
| US5391723A (en) * | 1989-05-31 | 1995-02-21 | Neorx Corporation | Oligonucleotide conjugates |
| US4958013A (en) * | 1989-06-06 | 1990-09-18 | Northwestern University | Cholesteryl modified oligonucleotides |
| US5032401A (en) * | 1989-06-15 | 1991-07-16 | Alpha Beta Technology | Glucan drug delivery system and adjuvant |
| US5451463A (en) * | 1989-08-28 | 1995-09-19 | Clontech Laboratories, Inc. | Non-nucleoside 1,3-diol reagents for labeling synthetic oligonucleotides |
| US5254469A (en) * | 1989-09-12 | 1993-10-19 | Eastman Kodak Company | Oligonucleotide-enzyme conjugate that can be used as a probe in hybridization assays and polymerase chain reaction procedures |
| US5225212A (en) * | 1989-10-20 | 1993-07-06 | Liposome Technology, Inc. | Microreservoir liposome composition and method |
| US5356633A (en) * | 1989-10-20 | 1994-10-18 | Liposome Technology, Inc. | Method of treatment of inflamed tissues |
| US5013556A (en) * | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5292873A (en) * | 1989-11-29 | 1994-03-08 | The Research Foundation Of State University Of New York | Nucleic acids labeled with naphthoquinone probe |
| US5486603A (en) * | 1990-01-08 | 1996-01-23 | Gilead Sciences, Inc. | Oligonucleotide having enhanced binding affinity |
| US5578718A (en) * | 1990-01-11 | 1996-11-26 | Isis Pharmaceuticals, Inc. | Thiol-derivatized nucleosides |
| AU7579991A (en) * | 1990-02-20 | 1991-09-18 | Gilead Sciences, Inc. | Pseudonucleosides and pseudonucleotides and their polymers |
| US5214136A (en) * | 1990-02-20 | 1993-05-25 | Gilead Sciences, Inc. | Anthraquinone-derivatives oligonucleotides |
| EP0455905B1 (en) * | 1990-05-11 | 1998-06-17 | Microprobe Corporation | Dipsticks for nucleic acid hybridization assays and methods for covalently immobilizing oligonucleotides |
| US5608046A (en) * | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5218105A (en) * | 1990-07-27 | 1993-06-08 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5138045A (en) * | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5688941A (en) * | 1990-07-27 | 1997-11-18 | Isis Pharmaceuticals, Inc. | Methods of making conjugated 4' desmethyl nucleoside analog compounds |
| US5245022A (en) * | 1990-08-03 | 1993-09-14 | Sterling Drug, Inc. | Exonuclease resistant terminally substituted oligonucleotides |
| US5512667A (en) * | 1990-08-28 | 1996-04-30 | Reed; Michael W. | Trifunctional intermediates for preparing 3'-tailed oligonucleotides |
| WO1992008728A1 (en) * | 1990-11-08 | 1992-05-29 | Hybridon, Inc. | Incorporation of multiple reporter groups on synthetic oligonucleotides |
| US5371241A (en) * | 1991-07-19 | 1994-12-06 | Pharmacia P-L Biochemicals Inc. | Fluorescein labelled phosphoramidites |
| US5595726A (en) * | 1992-01-21 | 1997-01-21 | Pharmacyclics, Inc. | Chromophore probe for detection of nucleic acid |
| US5565552A (en) * | 1992-01-21 | 1996-10-15 | Pharmacyclics, Inc. | Method of expanded porphyrin-oligonucleotide conjugate synthesis |
| US5272250A (en) * | 1992-07-10 | 1993-12-21 | Spielvogel Bernard F | Boronated phosphoramidate compounds |
| US5217098A (en) * | 1992-10-19 | 1993-06-08 | Adams Rite Manufacturing Company | Apparatus for integrating transmission control and brake control |
| US5574142A (en) * | 1992-12-15 | 1996-11-12 | Microprobe Corporation | Peptide linkers for improved oligonucleotide delivery |
| JP3351476B2 (ja) * | 1993-01-22 | 2002-11-25 | 三菱化学株式会社 | リン脂質誘導体及びそれを含有するリポソーム |
| US5395619A (en) | 1993-03-03 | 1995-03-07 | Liposome Technology, Inc. | Lipid-polymer conjugates and liposomes |
| CA2137297C (en) * | 1993-12-06 | 2000-04-18 | Tsuyoshi Miyazaki | Reactive vesicle and functional substance-fixed vesicle |
| US5597696A (en) * | 1994-07-18 | 1997-01-28 | Becton Dickinson And Company | Covalent cyanine dye oligonucleotide conjugates |
| US5580731A (en) * | 1994-08-25 | 1996-12-03 | Chiron Corporation | N-4 modified pyrimidine deoxynucleotides and oligonucleotide probes synthesized therewith |
| US5820873A (en) | 1994-09-30 | 1998-10-13 | The University Of British Columbia | Polyethylene glycol modified ceramide lipids and liposome uses thereof |
| CA2294988C (en) * | 1997-07-01 | 2015-11-24 | Isis Pharmaceuticals Inc. | Compositions and methods for the delivery of oligonucleotides via the alimentary canal |
| WO1999060012A1 (en) * | 1998-05-21 | 1999-11-25 | Isis Pharmaceuticals, Inc. | Compositions and methods for non-parenteral delivery of oligonucleotides |
| EP1156812A4 (en) * | 1999-02-23 | 2004-09-29 | Isis Pharmaceuticals Inc | MULTIPARTICULAR FORMULATION |
| GB9930533D0 (en) * | 1999-12-23 | 2000-02-16 | Mitsubishi Tokyo Pharm Inc | Nucleic acid delivery |
| US20070026394A1 (en) * | 2000-02-11 | 2007-02-01 | Lawrence Blatt | Modulation of gene expression associated with inflammation proliferation and neurite outgrowth using nucleic acid based technologies |
| KR100909681B1 (ko) * | 2000-12-01 | 2009-07-29 | 막스-플랑크-게젤샤프트 츄어 푀르더룽 데어 비쎈샤프텐 에.파우. | Rna 간섭을 매개하는 작은 rna 분자 |
| US20030166593A1 (en) * | 2001-04-30 | 2003-09-04 | Kenneth Chien | Non-viral vesicle vector for cardiac specific gene delivery |
| US20050277133A1 (en) * | 2001-05-18 | 2005-12-15 | Sirna Therapeutics, Inc. | RNA interference mediated treatment of polyglutamine (polyQ) repeat expansion diseases using short interfering nucleic acid (siNA) |
| GB0118517D0 (en) * | 2001-07-30 | 2001-09-19 | Mitsubishi Tokyo Pharm Inc | Compound |
| US7956176B2 (en) * | 2002-09-05 | 2011-06-07 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| EP1560931B1 (en) * | 2002-11-14 | 2011-07-27 | Dharmacon, Inc. | Functional and hyperfunctional sirna |
| DE10302421A1 (de) | 2003-01-21 | 2004-07-29 | Ribopharma Ag | Doppelsträngige Ribonukleinsäure mit verbesserter Wirksamkeit |
| US20060003976A1 (en) | 2004-06-04 | 2006-01-05 | Yuehua Zhang | Cholesterol/bile acid/bile acid derivative-modified therapeutic drug compounds |
| US7740861B2 (en) * | 2004-06-16 | 2010-06-22 | University Of Massachusetts | Drug delivery product and methods |
| FR2894582B1 (fr) * | 2005-12-12 | 2008-02-22 | Fabre Pierre Dermo Cosmetique | Sirna anti myosine va et depigmentation de la peau |
| CA3024953A1 (en) * | 2006-04-03 | 2007-10-11 | Roche Innovation Center Copenhagen A/S | Pharmaceutical composition comprising anti-mirna antisense oligonucleotides |
| EP2105145A1 (en) | 2008-03-27 | 2009-09-30 | ETH Zürich | Method for muscle-specific delivery lipid-conjugated oligonucleotides |
-
2008
- 2008-03-27 EP EP08005800A patent/EP2105145A1/en not_active Withdrawn
-
2009
- 2009-03-26 US US12/412,206 patent/US8148344B2/en active Active
- 2009-03-26 WO PCT/US2009/038437 patent/WO2009120887A2/en active Application Filing
- 2009-03-26 JP JP2011502065A patent/JP2011517676A/ja active Pending
- 2009-03-26 EP EP09724197A patent/EP2265289A2/en not_active Withdrawn
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008004058A2 (en) * | 2006-04-06 | 2008-01-10 | Polyplus-Transfection Sa | Compositions for transfection of oligonucleotides active for gene silencing and their biological and therapeutical applications |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013256452A (ja) * | 2012-06-11 | 2013-12-26 | Kawaken Fine Chem Co Ltd | メラニン産生抑制剤とその組成物 |
| US10837018B2 (en) | 2013-07-25 | 2020-11-17 | Exicure, Inc. | Spherical nucleic acid-based constructs as immunostimulatory agents for prophylactic and therapeutic use |
| US10894963B2 (en) | 2013-07-25 | 2021-01-19 | Exicure, Inc. | Spherical nucleic acid-based constructs as immunostimulatory agents for prophylactic and therapeutic use |
| JP2016540777A (ja) * | 2013-12-03 | 2016-12-28 | ノースウェスタン ユニバーシティ | リポソーム粒子、前述のものを作製する方法及びその使用 |
| JP2018534275A (ja) * | 2015-10-07 | 2018-11-22 | コーメディクス・インコーポレーテッド | タウロリジンの皮膚浸透製剤 |
| JP2022537987A (ja) * | 2019-07-02 | 2022-08-31 | アルゴノート アールエヌエー リミテッド | アポリポタンパク質bアンタゴニスト |
| JP7463410B2 (ja) | 2019-07-02 | 2024-04-08 | アルゴノート アールエヌエー リミテッド | アポリポタンパク質bアンタゴニスト |
Also Published As
| Publication number | Publication date |
|---|---|
| US20100003317A1 (en) | 2010-01-07 |
| EP2265289A2 (en) | 2010-12-29 |
| WO2009120887A2 (en) | 2009-10-01 |
| EP2105145A1 (en) | 2009-09-30 |
| WO2009120887A3 (en) | 2009-12-10 |
| US8148344B2 (en) | 2012-04-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8148344B2 (en) | Compositions and methods for mediating RNAi in vivo | |
| US8324366B2 (en) | Compositions and methods for delivering RNAI using lipoproteins | |
| JP5704741B2 (ja) | Eg5遺伝子発現の抑制のための組成物および方法 | |
| JP2021152023A (ja) | 修飾RNAi剤 | |
| ES2656516T3 (es) | Composiciones y métodos para inhibir la expresión de transtiretina | |
| JP5723378B2 (ja) | トランスサイレチン(ttr)を阻害する脂質製剤化組成物及び方法 | |
| US8114984B2 (en) | RNAi modulation of Aha and therapeutic uses thereof | |
| JP5431940B2 (ja) | SCAPのRNAi調節およびその治療的使用 | |
| TW202342750A (zh) | TMPRSS6 iRNA組成物及其使用方法 | |
| US20120245076A1 (en) | Compositions and methods for delivering rnai using apoe | |
| CN117561334A (zh) | 人染色体9开放阅读框72(C9ORF72)iRNA药剂组合物和其使用方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120326 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120326 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130917 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20131213 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20131220 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140108 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140116 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20140120 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140610 |