JP2011511933A - 一体型マイクロ流体バイオマーカー光学検出アレイデバイスを用いた発見ツールおよび使用方法 - Google Patents
一体型マイクロ流体バイオマーカー光学検出アレイデバイスを用いた発見ツールおよび使用方法 Download PDFInfo
- Publication number
- JP2011511933A JP2011511933A JP2010541421A JP2010541421A JP2011511933A JP 2011511933 A JP2011511933 A JP 2011511933A JP 2010541421 A JP2010541421 A JP 2010541421A JP 2010541421 A JP2010541421 A JP 2010541421A JP 2011511933 A JP2011511933 A JP 2011511933A
- Authority
- JP
- Japan
- Prior art keywords
- sample
- enzyme substrate
- substrate
- chamber
- microfluidic
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/65—Raman scattering
- G01N21/658—Raman scattering enhancement Raman, e.g. surface plasmons
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/50273—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means or forces applied to move the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29D—PRODUCING PARTICULAR ARTICLES FROM PLASTICS OR FROM SUBSTANCES IN A PLASTIC STATE
- B29D11/00—Producing optical elements, e.g. lenses or prisms
- B29D11/0074—Production of other optical elements not provided for in B29D11/00009- B29D11/0073
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/581—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances with enzyme label (including co-enzymes, co-factors, enzyme inhibitors or substrates)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/585—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances with a particulate label, e.g. coloured latex
- G01N33/587—Nanoparticles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0636—Integrated biosensor, microarrays
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0654—Lenses; Optical fibres
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0877—Flow chambers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502707—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the manufacture of the container or its components
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/65—Raman scattering
- G01N2021/651—Cuvettes therefore
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Hematology (AREA)
- Immunology (AREA)
- Analytical Chemistry (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Urology & Nephrology (AREA)
- Pathology (AREA)
- Biotechnology (AREA)
- Organic Chemistry (AREA)
- Microbiology (AREA)
- General Physics & Mathematics (AREA)
- Medicinal Chemistry (AREA)
- Cell Biology (AREA)
- Wood Science & Technology (AREA)
- Dispersion Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Food Science & Technology (AREA)
- Nanotechnology (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Manufacturing & Machinery (AREA)
- Ophthalmology & Optometry (AREA)
- Mechanical Engineering (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Optical Measuring Cells (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
本開示はマルチプレックス分光法のための増強ラマン表面を有するマイクロ流体光学チャンバーを備えたマイクロチップの分野に関する。本発明の態様は、分光法で使用される従来のキュベットまたはデバイスに比較して、検出速度が速く、ハイスループットなだけでなく、極微量の試料の使用も可能である。特定の態様は、科学的および医学的研究、がん、心血管疾患、糖尿病などの疾患の診断、特にバイオマーカーの検出および関連性のある科学的および医学的用途を有するタンパク質活性の測定に関する。
Description
技術分野
本開示の態様は、がん、心血管疾患、糖尿病、腎疾患、肺疾患、ウイルス性および細菌性感染症、ならびに神経変性疾患、免疫疾患、代謝疾患などの科学的および医学的研究および疾患の診断に関し、特に、バイオマーカーの検出および関連する科学的および医学的用途を有するおよびタンパク質および酵素の活性、相互作用、阻害、活性化の測定を提供する。
本開示の態様は、がん、心血管疾患、糖尿病、腎疾患、肺疾患、ウイルス性および細菌性感染症、ならびに神経変性疾患、免疫疾患、代謝疾患などの科学的および医学的研究および疾患の診断に関し、特に、バイオマーカーの検出および関連する科学的および医学的用途を有するおよびタンパク質および酵素の活性、相互作用、阻害、活性化の測定を提供する。
背景
分子生理学における近年の急速な科学的理解の向上は、とりわけ、ヒトゲノムの配列決定が完了し、生物学的にまたは医学的に興味深い被分析物の検出を目的とした高感度かつ大規模並行処理システムが登場したことが理由となっている。特に、そういった対象となる生物学的被分析物またはバイオマーカーの検出システムについては、科学的研究において、そして臨床における患者にとっても次第に重要性が増してきている。分光検出システムを用いる分析方法はバイオマーカーの検出および定量において頻用され、バイオマーカーとさまざまな被験分子との相互作用に関する情報を提供することが多い。そういった分析方法は、分子診断の同定、特性決定、開発において初期に利用することができ、かつ生物学的試料の分析に用いる分子診断検査として利用することができる。したがって、こういった分析方法を患者の健康状態の評価または医学的判断の裏づけとなりうる情報の提供に利用することができる。
分子生理学における近年の急速な科学的理解の向上は、とりわけ、ヒトゲノムの配列決定が完了し、生物学的にまたは医学的に興味深い被分析物の検出を目的とした高感度かつ大規模並行処理システムが登場したことが理由となっている。特に、そういった対象となる生物学的被分析物またはバイオマーカーの検出システムについては、科学的研究において、そして臨床における患者にとっても次第に重要性が増してきている。分光検出システムを用いる分析方法はバイオマーカーの検出および定量において頻用され、バイオマーカーとさまざまな被験分子との相互作用に関する情報を提供することが多い。そういった分析方法は、分子診断の同定、特性決定、開発において初期に利用することができ、かつ生物学的試料の分析に用いる分子診断検査として利用することができる。したがって、こういった分析方法を患者の健康状態の評価または医学的判断の裏づけとなりうる情報の提供に利用することができる。
ラマン分光法は単色光の非弾性散乱(ラマン散乱として知られる)を測定する分光技術であり、一般に試料分子の振動状態または回転状態を調べるために使用される。一般的に、可視、近赤外、または近紫外領域のレーザーを使用して試料/システムを励起する。次に、レーザー光子のエネルギーがシフトアップまたはシフトダウンされ(ラマン効果またはラマンシフトとして知られる)、このエネルギーのシフト(波長、周波数、または波数)によりシステムの分子の振動状態または回転状態に関する情報が得られる。ラマン効果が生じるのは、光が分子または複数の分子または原子を有する分子複合体の結合の電子雲と相互作用する時である。 入射光によって生じる電子雲の歪みの大きさは、反射エネルギーの強度および周波数ならびに特徴的で指紋のようなラマンスペクトルを決定する分子の分極率を反映している。
表面増強ラマン分光法(SERS)は少量の試料から放射される低確率または微弱なラマンスペクトルのシグナル強度を増幅することが可能な感度の高い方法である。SERSは実際、単一分子のラマンスペクトルを検出することが証明されている。生物学的または医学的に興味深い被分析物の検出を目的としたSERSシステムでは一般に、対象となる被分析物、基質、または複合体が、ラマン増強能、抑制能、または調整能を備えた固体、通常は、金属表面または合金表面、または他の非金属物質との複合金属に固定または固着される。これはしばしばSERS活性構造と呼ばれる。対象となる被分析物、基質、または複合体と金属表面および金属表面誘導体との相互作用により、ラマン散乱放射の強度および特定のプロファイルの増強または変調が生じる。結果的に、リン酸化および脱リン酸化のようなさまざまな結合事象および化学的反応は、それらの事象や反応によって生み出される特徴的で指紋のようなラマンスペクトルに基づいて、検出し比較することが可能である。
生物学的および医学的用途におけるSERSの使用には、医学的および科学的に興味深い分子相互作用ならびにタンパク質および酵素活性の直接測定において極めて高い可能性がある。特に、例えば、タンパク質-タンパク質、タンパク質-小分子、小分子-小分子、核酸-タンパク質、リボタンパク質-核酸の相互作用を伴うものなどのタンパク質-基質の結合事象および反応の測定にSERSを利用してもよい。そういった用途の感度は、おそらく単一分子検出を可能にし、したがって極めてコピー数の少ないタンパク質および希少な細胞の溶解物成分を検出できる可能性を提供する。近年、今日までにDNA (塩基配列決定)、RNA (遺伝子発現技術)、タンパク質(プロテオミクス)のハイスループットな測定において進歩がなされてきたが、タンパク質活性、特に酵素活性のハイスループットな測定は依然として技術的に手の届く範囲にない。そういった情報は医学的にも科学的にも貴重であることは明白である。例えば、ある患者の完全なDNA配列または細胞1個における全遺伝子または全タンパク質の発現レベルを知ることが有用であることは明白であるが、細胞1個における全タンパク質の活性を理解することは実際、それよりも情報価値があり、高次の生物学的情報になる。これはプロテオミクスレベルの情報が機能および細胞の表現型に直接結び付くためである。
マイクロ流体デバイスおよび一体型マイクロ流体デバイスのシステムでは、固体基板と連結または一体化された細い管またはマイクロ流路を利用し、極小の規模で数多くの分析的、化学的、生化学的用途においてさまざまな作業を行う。例えば、一体型マイクロ流体デバイスではまず電場を利用して、対象となる核酸、タンパク質、またはそれ以外の高分子を効率的に分離し、次に微小規模の検出システムにより分離産物の特性決定および分析を行うことができる。そのようなマイクロ流体デバイスは著しく少ない反応量を用いてこれらの作業を遂行するが、この反応量は従来の方法よりも少なくとも数桁少ない量となりうる。これらのシステムは小規模であることから、反応速度の向上が可能となり、使用する試薬量は少なく、研究、臨床、産業において占有するスペースがはるかに小さくなる。このようにして、マイクロ流体システムは魅力的な効率上昇の可能性を提供し、その結果として、多大な経済的利点を提供する。
マイクロ流体デバイスは分光検出システムを利用する分析法の実施に特に適している。マイクロ流体デバイスと併せて、ラマン分光法のような散乱分光法を含め、さまざまな分光技術を利用することができる。研究または産業の場において、マイクロ流体デバイスは、分光検出システムを用いて対象となる標識または非標識分子を定量する生化学的アッセイまたは細胞ベースのアッセイにおいて利用されることが一般的である。例えば、そのようなアッセイでは、対象となる候補小分子または生物学的製剤によって処理した後、哺乳動物細胞における緑色蛍光タンパク質の発現を測定する。別の例は、分光指標として挿入蛍光色素を用いる遺伝子増幅および分析のためのマイクロ流体デバイスにおける定量的ポリメラーゼ連鎖反応法(PCR)の使用である。その他の例としては、一般的な酵素および生化学的反応、化学的反応、相転移検出などが含まれるが、これらに限定されることはない。
マイクロ流体デバイスは一般的に物質が搬送、混合、分離、検出される微小規模の一体型流路およびリザーバのネットワークを利用し、定量用のさまざまな検出器およびセンサーが内蔵または外付けされ、アクチュエータおよびその他の流体試料操作用付属品を備えている。高性能の物質搬送システムの開発により、直ちに自動化可能で、高度に再現可能なシステムの開発が可能となった。そういった作業は自動化できる可能性があり、数々の産業および研究用途において多大な利点を有するハイスループットなシステムに組み込むこともできる。マイクロ流体デバイスでは基板としてプラスチックを使用することが多い。高分子物質は容易な製造、低コスト、入手しやすさという利点を提供するが、蛍光を発する傾向がある。例えば、試料に励起光を照射すると、特に励起経路および放射経路が同一である場合、光錯乱によって顕著なバックグラウンドシグナルが生じる。ガラス、シリコン、金属、金属酸化物のような他の物質を使用してもよい。
バイオマーカーの分析は、疾患の早期発見、患者の層化、治療有効性のモニタリングにとって好まれる方法に急速になりつつある。バイオマーカーの変化を高速かつ高感度で検出することは技術的に不可能であることが多いか、あるいは複数の処理段階を伴う煩雑な手順を必要とし、大量の試料および長期間の診断/予後スケジュールを要する場合がある。多くの場合、患者から採取した試料は量が限られており、処理時間を延長するような複数の段階を必要とする処理または手順には適していない。本願のデバイスおよび方法はこれらの問題を軽減するのに役立つ多大な利点を提供することから、生物学的および化学的試料のSERSスペクトル検出をリアルタイムのマイクロ流体環境で実施することが可能である。
概要
1つの態様では、マイクロ流体システムへのSERS基板の一体化を伴う。SERS基板にはナノピラー、ナノリング、ナノトライアングル、ナノボウタイ、ナノスフェア、ナノロッド、および/またはナノスパイラルのようなさまざまなナノスケール構造が含まれる。
1つの態様では、マイクロ流体システムへのSERS基板の一体化を伴う。SERS基板にはナノピラー、ナノリング、ナノトライアングル、ナノボウタイ、ナノスフェア、ナノロッド、および/またはナノスパイラルのようなさまざまなナノスケール構造が含まれる。
1つの態様では、本発明は表面増強ラマン分光法(SERS)システムを用いて標的生体分子の活性を測定する方法を提供する。この方法は流体試料をマイクロ流体光学チャンバーに導入する段階を含み、光学チャンバーは、そこから伸長している多数の基質を有するラマン活性表面を備える。流体試料がマイクロ流体光学チャンバーを通過することにより、流体試料中の生体分子と多数の前記基質との特異的な結合および/または相互作用が可能になる。流体試料中の酵素またはタンパク質は化学基の開裂または付加のいずれかにより、表面に固定化された生体分子に作用を及ぼす。SERSを用いて表面上のラマンシグナルを読み取ることにより、これらの変性作用を検出することが可能である。
1つの態様では、本発明は流体試料の洗浄をほとんど、または全く必要としない。流体試料中の分子から顕著な干渉を受けることなく、表面に結合された生体分子に対する変化を測定することが可能である。
いくつかの態様では、マイクロ流体光学チャンバー内の流体試料へとレーザーを方向付け、そこでレーザーと流体試料との相互作用により、生体分子と基質との間の相互作用に特異的なSERSシグナルがもたらされる。
いくつかの態様では、生体分子が多数の基質に結合する際、そのラマン散乱スペクトルの変化を記録することにより、生体分子の存在、量、および/または活性を検出してもよい。
1つの態様では、細胞を溶解し、その溶解物をSERS表面上の標的分子に適用し、溶解物由来の酵素の精製は行わない。酵素の精製段階が存在しないため、酵素活性を直接高速に測定すること、さらに試料操作による結果のばらつきを軽減することが可能である。
1つの態様では、標的タンパク質をさらなる標識で標識化する必要がない。
さらなる態様では、例えば、マイクロアレイフォーマット、直線状の列、または蛇行流路のような折り畳み流路などの表面に一連のプロテアーゼ基質ペプチドを固定する。
別の態様では、ラマン標識分子、金属イオン、および/またはナノコンポジットを酵素基質に結合させ、ラマンシグナルを増強する。ラマンシグナルを増強するために、試料に有機溶媒を添加してもよい。
1つの態様では、例えば、マイクロアレイフォーマット、直線状の列、または蛇行流路のような折り畳み流路などの表面に一連のキナーゼ基質ペプチドを固定する。
1つの態様では、試料量は10μL以下であり、好ましくは、試料量は1μL未満である。検出に必要な濃度範囲は1μM以下としてもよい。
1つの態様では、当技術分野における標識方法が必要とするように、反応ダイナミクスおよびキネティクスの測定をエンドポイント法ではなくリアルタイムで検出してもよい。1回の測定につき約1ミリ秒〜1分間のデータ速度、1分間〜24時間の期間で、複数のデータポイントを反応から得てもよい。
さらなる態様では、SERS検出は近接場光学的検出法であるため、リアルタイム測定において洗浄段階を必要としないことから、SERS基板表面における分子反応事象のみを検出することができる。表面からおよそ100 nm離れたところで起こる反応はシグナルに顕著には寄与しない。この態様では、SERS基板表面からのバックグラウンド化合物の自然なまたは促進された拡散により、バックグラウンド化合物から生じるノイズの除去が実現される。
別の態様では、多重流路マイクロ流体システムを利用することにより、多重流路測定を実施することが可能である。これらの測定は互いに干渉しあうことなく、同時に完了できる。
1つの態様では、適時に走査複数流路において高速光学的走査システムを用いることが可能である。特定の態様では、高速光学システムでは複数試料の走査に電動式ガルボミラーの使用を伴う。
1つの態様では、試料の導入、試料の混合、試薬の交換、試料の加熱、温度調節などを含むマイクロ流体の作業が完全に自動化される。流体のアクチュエーション法には機械的ポンピング、光学的ポンピング、熱ポンピングなどを含むが、これらに限定されることはない。
1つの態様では、試薬の混合を容易にするため、表面からの溶解性反応最終産物の拡散を亢進するため、分子の沈降を防止するためなどに、光学的測定中に流体の流動を制御することができる。
さらなる態様では、励起源として偏光レーザーを使用してもよく、シグナル対ノイズ比を高くすることにより分子キラリティを測定してもよい。
特定の態様は、以下の詳細な説明を添付の図面と合わせて読めば最もよく理解される。一般の慣行に従って、図面の様々な形状は原寸に必ずしも比例していないことを強調しておく。いくつかの例では、見やすいように、様々な形状の寸法は任意に拡大縮小されている。
詳細な説明
本発明の態様の方法およびデバイスについて記述する前に、本発明は、記述する任意の特定の態様に限定されることはなく、したがって、当然ながら、変更可能であることが理解されるべきである。本明細書において用いられる専門用語は、特定の態様のみを記述することを目的とするものであり、添付の特許請求の範囲によってのみ限定される本発明の範囲を限定することを意図するものではないことも理解されるべきである。
本発明の態様の方法およびデバイスについて記述する前に、本発明は、記述する任意の特定の態様に限定されることはなく、したがって、当然ながら、変更可能であることが理解されるべきである。本明細書において用いられる専門用語は、特定の態様のみを記述することを目的とするものであり、添付の特許請求の範囲によってのみ限定される本発明の範囲を限定することを意図するものではないことも理解されるべきである。
ある範囲の値が与えられた場合、文脈に明記されていない限り、下限値の単位の10分の1までの各介在値が、また、その範囲の上限および下限の間で明確に開示されることも理解されたい。ある規定された範囲における任意の規定値または介在値の間の、より小さい各々の範囲、および、その規定された範囲におけるその他任意の規定値または介在値が、本発明の範囲内に包含される。これらのより小さい範囲における上限および下限は、個別にこの範囲に含まれるようにすることも、含まれないようにすることもでき、より小さい範囲内にいずれかの限界が含まれ、いずれの限界も含まれず、または両方の限界が含まれるといった各範囲も本発明の範囲内に包含されるものであり、規定された範囲において任意の限界を明確に除外することができる。規定された範囲が一方または両方の限界を含む場合、含まれるこれらの限界の一方または両方を除外する範囲も本発明に含まれる。
別段の定義がなければ、本明細書において用いられる全ての技術的および科学的用語は、本発明が属する技術分野の当業者によって一般に理解されるものと同じ意味を有する。本明細書において記述されるものと同様または同等の任意の方法および材料を本発明の実践または試験において用いることができるが、好ましい方法および材料をこれから記述する。本明細書において言及される全ての刊行物は、引用した刊行物と関連する方法および/または材料を開示および記述するために、参照により本明細書に組み入れられる。本開示と参照により組み入れられる刊行物との間に矛盾がある範囲では、本開示が優先する。
本明細書においておよび添付の特許請求の範囲において用いられる場合、単数形「1つの(a)」、「1つの(an)」および「その(the)」とは、文脈から明らかにそうでないと分かる以外、複数の指示対象を含むことに留意されたい。したがって、例えば、「1つのペプチド」への言及は多数のそのようなペプチドを含み、「その方法」への言及は1つまたは複数の方法および当業者に公知のその同等物への言及を含み、以下同様である。
本明細書において論じられる刊行物は、本出願の出願日以前のその内容の開示のためにのみ提供される。本明細書において、先行発明に基づき本発明がそのような刊行物の内容に先行する資格を有しないことを認めるものと解釈されるべきものは何もない。さらに、提供される刊行物の日付は、実際の刊行日と異なる可能性があり、個別に確認する必要のある場合がある。
定義
「核酸」および「ポリヌクレオチド」という用語は、一本鎖または二本鎖の形態のいずれかの、デオキシリボヌクレオチドまたはリボヌクレオチドおよびそれらの重合体をいうよう本明細書において互換的に用いられる。これらの用語は、公知のヌクレオチド類似体または改変された骨格残基もしくは結合を含有する核酸であって、合成の、天然のおよび非天然のものであり、参照核酸と同様の結合特性を有し、かつ参照ヌクレオチドと同じように代謝されるものを広く包含する。そのような類似体の例としては、非限定的に、ホスホロチオエート、ホスホロアミデート、メチルホスホネート、キラル-メチルホスホネート、2-O-メチルリボヌクレオチド、ペプチド-核酸(PNA)が挙げられる。
「核酸」および「ポリヌクレオチド」という用語は、一本鎖または二本鎖の形態のいずれかの、デオキシリボヌクレオチドまたはリボヌクレオチドおよびそれらの重合体をいうよう本明細書において互換的に用いられる。これらの用語は、公知のヌクレオチド類似体または改変された骨格残基もしくは結合を含有する核酸であって、合成の、天然のおよび非天然のものであり、参照核酸と同様の結合特性を有し、かつ参照ヌクレオチドと同じように代謝されるものを広く包含する。そのような類似体の例としては、非限定的に、ホスホロチオエート、ホスホロアミデート、メチルホスホネート、キラル-メチルホスホネート、2-O-メチルリボヌクレオチド、ペプチド-核酸(PNA)が挙げられる。
「アミノ酸」という用語は、天然アミノ酸および合成アミノ酸、ならびに天然アミノ酸と同じように機能するアミノ酸類似体およびアミノ酸模倣体をいう。天然アミノ酸は、遺伝暗号によってコードされるもの、ならびに後で改変されるそれらのアミノ酸、例えば、ヒドロキシプロリン、γ-カルボキシグルタメート、およびO-ホスホセリンである。アミノ酸類似体とは、天然アミノ酸と同じ基礎化学構造、例えば、水素、カルボキシル基、アミノ基およびR基に結合しているα炭素を有する化合物、例えば、ホモセリン、ノルロイシン、メチオニンスルホキシド、メチオニンメチルスルホニウムをいう。そのような類似体は、改変されたR基(例えば、ノルロイシン)または改変されたペプチド骨格を有するが、天然アミノ酸と同じ基礎化学構造を保持する。アミノ酸模倣体とは、アミノ酸の一般的な化学構造と異なる構造を有するが、天然アミノ酸と同じように機能する化合物をいう。
本明細書において用いられる「生物学的試料」とは、関心対象の分析物を含有することが疑われる生体組織または化学的流体の試料である。例えば、試料は、体液、例えば全血、血清、血漿、脳脊髄液、尿、リンパ液、ならびに呼吸器、腸管および尿生殖器管のさまざまな外分泌液、例えば涙液、唾液、精液、乳など; および他の生体液、例えば細胞培養懸濁液、細胞抽出物、細胞培養上清を含む。試料は、例えば肺、肝臓、脳、目、舌、結腸、腎臓、筋肉、心臓、胸部、皮膚、膵臓、子宮、頸部、前立腺、唾液腺などからの、組織生検を含むこともできる。試料は微量生検、小試料、または患者から抽出され、その後、例えば、レーザー捕捉顕微解剖を用いて処理された単一細胞でさえあってもよい。試料は、例えば、緩衝液、抽出液、溶媒などに懸濁または溶解されてもよい。試料は、例えば、ウイルス、原核生物または真核生物、および哺乳動物(例えば、げっ歯類、ネコ科の動物、イヌ科の動物、および霊長類)を含む、任意の天然の生物または組み換え生物に由来してもよい。生物は罹患していない生物、罹患していることが疑われる生物、または罹患している生物であってよい。試料が採取される哺乳動物被験体は、例えば、がん、自己免疫疾患、または心血管疾患、肺疾患、胃腸疾患、筋骨格障害、中枢神経系障害、感染性疾患(例えば、ウイルス、真菌または細菌の感染症)などの疾患を有する可能性があるか、有することが疑われるか、または有する。生物学的試料という用語は、生物学的過程の研究または薬物候補の発見もしくはスクリーニングのために意図的に作出された研究試料もいう。そのような例としては、細菌、ウイルス、DNA、ポリペプチド、天然タンパク質もしくは組み換えタンパク質、金属イオンまたは薬物候補およびそれらの混合物を添加した水性試料が挙げられるが、これらに限定されることはない。
「ペプチド」および「ペプチド化合物」という用語は、コードおよび非コードアミノ酸、化学的もしくは生化学的に修飾されたアミノ酸または誘導体化されたアミノ酸、L-アミノ酸またはD-アミノ酸、修飾ペプチド骨格を有するペプチド、ならびにアミノ酸類似体を含むペプチドを含みうる、約10〜約50アミノ酸の重合体型アミノ酸(少なくとも10アミノ酸かつ50アミノ酸以下からなりうる)をいうよう本明細書において互換的に用いられる。アミノ酸は、ヒトにおいて天然に存在するアミノ酸だけに限定されうる。ペプチド化合物は、(a) 天然アミノ酸残基; (b) 非天然アミノ酸残基、例えば、N-置換グリシン、アミノ酸置換体など; または(c) 天然および非天然アミノ酸残基/置換体の両方の重合体であってよい。換言すると、本ペプチド化合物はペプチドまたはペプトイドであってよい。ペプトイド化合物およびその調製方法はWO 91/19735に記述されており、その開示はその全体が参照により本明細書に組み入れられる。本発明のペプチド化合物は、23アミノ酸または18〜28アミノ酸または20〜26アミノ酸を含むか、またはそれからなることができる。本発明の活性なアミノ酸配列は、インテグリン結合モチーフ配列、グリコサミノグリカン結合モチーフ配列およびカルシウム結合モチーフである、重複してよい3つのモチーフを含むか、またはそれからなる。
「タンパク質」とは、より高レベルの三次および/または四次構造を生じるのに十分な鎖長であるアミノ酸の配列を意味する。これはそのような構造を持たない「ペプチド」または他の小分子量薬物と区別するためである。典型的には、タンパク質は約15〜20 kDから約20 kDの分子量を有すると考えられる。
「ポリペプチド」、「ペプチド」および「タンパク質」という用語は、アミノ酸残基の重合体をいうよう本明細書において互換的に用いられる。これらの用語は、天然アミノ酸重合体および非天然アミノ酸重合体にあてはまるほかに、1つまたは複数のアミノ酸残基が、対応する天然アミノ酸の人工的な化学模倣体であるアミノ酸重合体にもあてはまる。
「基質(substrate)」という用語は、生化学に関連して用いられる場合、酵素が作用する分子を意味する。酵素は、基質を伴う化学反応を触媒する。基質は酵素の活性部位に結合し、酵素-基質複合体が形成される。基質は生成物に分解され、活性部位から放出される。
「基板(substrate)」という用語は、材料科学に関連して用いられる場合、コーティングの沈着、核酸、ペプチド、糖および脂肪酸の付着などのような、新しい材料膜または層をもたらすよう加工処理が行われる基礎の材料または表面を記述するために用いられる。
「キナーゼ」とは、キナーゼ基質のような標的分子への(例えば、ATPまたはGTPからの)リン酸基の転移を触媒し、基質のリン酸化をもたらす酵素である。
「キナーゼ基質」とは、キナーゼによって部分的にまたは完全にリン酸化されうる分子をいう。
「ホスファターゼ」とは、ホスファターゼ基質からのリン酸基の除去を触媒し、それによってその基質の部分的なまたは完全な脱リン酸化を引き起こす酵素である。
「ホスファターゼ基質」とは、ホスフェート(phosphate)によって部分的にまたは完全に脱リン酸化されうる分子をいう。
「処置」、「処置する」などの用語は、治療的処置も予防的措置もともにいうよう本明細書において用いられる。処置を必要とするものは、障害を既に有するもの、および障害が予防されるべきものを含む。総じて、これは所望の薬理学的効果および/または生理学的効果、例えば、血管新生の刺激を得ることを包含する。効果は、疾患もしくはその症状を完全にもしくは部分的に予防するという点で予防的であってもよく、ならびに/または疾患および/もしくは疾患に起因する副作用を部分的にもしくは完全に治癒するという点で治療的であってもよい。本明細書において用いられるこれらの用語は、哺乳動物、特にヒトにおける疾患の任意の処置を網羅し、(a) 疾患の素因を持ちうるが、疾患を有すると未だ診断されていない被験体において疾患もしくは病態の発症を予防すること(例えば、軟骨の喪失を予防すること); (b) 疾患を抑制すること、例えば、軟骨の喪失を抑止すること; または(c) 疾患を緩和すること(例えば、軟骨の発達を強化すること)を含む。
「被験体」、「個体」、「患者」および「宿主」という用語は本明細書において互換的に用いられ、任意の脊椎動物、詳細には任意の哺乳動物および最も詳細にはヒト被験体、家畜および哺乳類愛玩動物を含むことをいう。被験体は、医者のような医療専門家の看護の下にありうるが、必ずしもそうであるとは限らない。
処置の目的で「哺乳動物」とは、ヒト、家畜および酪農動物、ならびにイヌ、ウマ、ネコ、ウシなどのような、動物園動物、競技動物または愛玩動物を含む、哺乳類として分類される任意の動物をいう。好ましくは、哺乳動物はヒトである。
「障害」とは、ペプチドによる処置から恩恵を受けうる任意の病態である。これには、対象とする障害に哺乳動物をかかりやすくさせる病的状態を含む慢性および急性の障害または疾患が含まれる。本明細書において処置される障害の非限定的な例は、骨格の喪失または弱まりおよび骨の欠損または破損を含む。
多くの場合SERSと略される「表面増強ラマン分光法」または「表面増強ラマン散乱」は、粗い金属表面に吸着された分子によるラマン散乱の増強をもたらす表面高感度技術である。増強係数は1014〜1015もありえ、これにより、この技術は単一分子を検出するのに十分に高感度でありうる。
「ラマン散乱」または「ラマン効果」は、光子の非弾性散乱である。原子または分子から光が散乱する場合、ほとんどの光子は弾性的に散乱する。散乱光子は入射光子と同じエネルギー(周波数)および波長を有する。しかしながら、散乱光のごく一部が励起によって散乱し、散乱光子は入射光子の周波数とは異なる周波数、通常は、入射光子の周波数よりも低い周波数を有する。
好ましい態様の説明
本発明の特定の態様には、マルチプレックス光学検出を目的としたマイクロ流体試料の流路、活性ナノ構造表面、光学窓、付属の分子プローブアレイを有するマイクロチップを含む。試料量が極少量であること、従来の分子診断法およびデバイスよりも検出速度、スループット、感度、信頼性、完全性が高いこと、コストが2〜3桁低いことなどが利点である。これは研究および臨床の環境における分子レベルでの疾患診断に適用することが可能であり、前例のない感度および精度を持ち、これまでになく入手しやすい価格である。
本発明の特定の態様には、マルチプレックス光学検出を目的としたマイクロ流体試料の流路、活性ナノ構造表面、光学窓、付属の分子プローブアレイを有するマイクロチップを含む。試料量が極少量であること、従来の分子診断法およびデバイスよりも検出速度、スループット、感度、信頼性、完全性が高いこと、コストが2〜3桁低いことなどが利点である。これは研究および臨床の環境における分子レベルでの疾患診断に適用することが可能であり、前例のない感度および精度を持ち、これまでになく入手しやすい価格である。
方法およびデバイスは、シリコンまたはプラスチックの基板におけるマイクロ流路からの表面増強ラマン散乱(SERS)検出を目的としたデバイスに提供される。シリコンデバイスは、適切なマスキングおよびさまざまな保護膜および保護層を用いて(深い微細構造を提供する最終エッチング前に個々に除去してもよい)、さまざまな微細構造のエッチングおよびマシニングを別途施すことにより、またSERS基板として独特なナノ構造を作製するため、化学的および物理的表面粗面化を施すことにより形成することが可能である。デバイスは平行な流体流に対応することが可能であり、集光レーザー光をSERS基板表面に照射させる。高分子物質を用いる成形において、シリコンデバイスを二度複製してもよく、所望の結果を得るためにポリマーとともに使用してもよい。
本発明は、μL以下(sub-micro liter)の容量で、SERS分光法のためのナノ構造表面を備える一体型マイクロスケール流体チャンバーを示す。マイクロスケール光学チャンバーは一面の透明な表面を有しており、これによりチャンバー内へ光が透過され、SERS基板表面上に照射される。また、これによりラマン散乱光はチャンバーの外へ透過され、集光される。ラマン測定に使用される従来の光学チャンバーまたはキュベットに比較し、本ラマン検出流体チャンバーの容量は1μL未満となる。マイクロ流路をより短く、あるいは狭くすることで、チップにおける検出モジュールのさらなる小型化が可能となる。分光カメラによりSERSシグナルを検出することができるが、必要量は従来のラマン分光法で使用される量の1000分の1未満とすることが可能である。光学チャンバーが微小寸法であることから、1個のチップに複数の個々の光学チャンバーを組み込むことが可能となり、したがって一度にすべての試料を収容する単一デバイスを使用し、2、3、8、16、32、48、96、192、384、768、さらには1536の試料を用いたマルチプレックスSERS分光法を行うことが可能である。
したがって、特定の態様は、SERSスペクトルの同時検出によるチップ上における高感度生体分子検出を呈示する。マイクロスケールのチャンバー内の流体試料の流動および反応温度は外部の電子機器および/または機械的マイクロポンプによって制御可能である。マイクロチップおよび流体試料の容量が比較的少ないため、流速および加熱/冷却速度は大容量規模のチップおよび試料よりも数桁速くなり、これらによってオンチップPCRおよび高速流体交換などの多くの特別な用途が可能になる。
特定の態様は、継ぎ目なく作製されたナノ構造SERS基板を含んでおり、マイクロ流体環境において生物学的/化学的試料のSERSスペクトル検出を実施できるよう、その基板はさらにマイクロ流体チャンバーに封入されている。本明細書中に記載されるとおり、独特のマイクロ加工、ナノ加工、パッケージにより擬似水性生物学的環境におけるSERSスペクトルの検出が可能である。
小さいペプチドおよびヌクレオチドのような複数の生物学的基質または酵素基質伸長物をマイクロ流体チャンバー内のSERS基板に付着させてもよく、これらを例えば、がん、心血管疾患、糖尿病、神経疾患に関連する酵素のような複数種のバイオマーカーに特異的なものとしてもよい。ヒトおよび動物の流体試料をマイクロ流体チャンバーに導入し、付着されたプローブと反応させることができる。このプローブの化学的変化をSERSスペクトル検出により検出することができる。
従来、ラマン分光分析を行うには、化学的または生物学的試料をSERS基板に滴下し乾燥させる。しかし、リアルタイムの生物学的事象は水溶液内でのみ生じうる。本発明の特定の態様は、静的、動的双方の生化学的反応について擬似生物流体環境における生体分子ラマンシグナルの検出を可能にする。
ナノ構造は、光学的シグナルの増強を提供するために、あるいは検出用に標的分子または粒子を捕獲する目的で酵素基質伸長物を固定するために、マイクロ流体流路の表面に設けてもよい。抗体、アプタマー、DNAまたはRNAオリゴヌクレオチドなどの基質伸長物、およびペプチド、多糖、ポリマー、小分子などを含むさらに長い伸長物をチップ内のマイクロ流体チャンバーの表面に化学的に結合させることができる。酵素基質伸長物を、物理的に作製されたナノ構造に結合させ、マイクロ流体チャンバー内でナノバイオハイブリッドプローブを作製してもよい。
本明細書において記述される特定の態様には、とりわけ、診断検査および分子診断における用途がある。例えば、分子診断、および具体的には、がんに関連するバイオマーカーを検出する分子診断では、小分子代謝体もしくは代謝中間体、核酸、炭水化物、タンパク質、タンパク質断片、タンパク質複合体および/もしくは誘導体またはそれらの組み合わせを含むバイオマーカーを測定する。分光学的検出システムを利用する分析的方法のような化学的アッセイは、そのようなバイオマーカーの検出および定量化において用いることができ、小分子、酵素、炭水化物、核酸プローブ、核酸もしくはタンパク質アプタマー、ペプチド核酸、ペプチド、またはポリクローナルもしくはモノクローナル抗体のような試験分子とのバイオマーカーの相互作用に関する情報を与えることができる。そのようなアッセイ法は、分子診断薬の特定、特徴付けおよび開発中の初期に利用されてもよく、生物学的試料をアッセイし、かくして患者の健康状態を測定するために、または医学的決断を支持しうる情報を提供するために用いられる分子診断検査として利用されてもよい。
特定の態様には、とりわけ、分子治療における用途もある。例えば、薬物標的の特定および特徴付けは、生物学的試料におけるそのような薬物標的の検出および定量化を伴いうる。分光学的検出システムを利用する化学的アッセイおよび分析的方法は、タンパク質、例えば細胞表面タンパク質、細胞外タンパク質、ペプチドホルモン、膜貫通タンパク質、受容体タンパク質、シグナル伝達タンパク質、サイトゾルタンパク質もしくは酵素、核タンパク質、DNA結合タンパク質、伝令RNAもしくはマイクロRNAを含むRNA分子、および/またはDNAを含む潜在的な薬物標的を検出かつ定量化するために用いることができる。そのようなアッセイおよび方法は、薬物、例えば小分子、ポリクローナルもしくはモノクローナル抗体、治療用タンパク質もしくは治療用酵素、アンチセンス核酸、低分子干渉RNA、核酸もしくはタンパク質アプタマー、ペプチド核酸、または他の薬物および潜在的な薬物との薬物標的の相互作用に関する情報を与えることもできる。そのようなアッセイ法は、分子治療薬の特定、特徴付けおよび開発中の初期に利用されてもよく、薬物または潜在的な薬物による処置に対する個々の患者の応答を特定し、かくして医学的決断を支持しうる有益な情報を提供するために試験のなかで利用されてもよい。
シリコンウエハは、濃度しか検出できない従来の抗体親和性結合アッセイ基板よりも好ましい。他の半導体ウエハ(例えば、GaAs、InP、GaP、GaSb、InSb、InAs、CaF2、LaAl2O3、LiGaO2、MgO、SrTiOq、YSZおよびZnO)をある種の態様において用いることもできる。ウエハに適した半導体材料は周期表のII〜VI族元素(ZnS、ZnSe、ZnTe、CdS、CdSe、CdTe、HgS、HgSe、HgTe、MgS、MgSe、MgTe、CaS、CaSe、CaTe、SrS、SrSe、SrTe、BaS、BaSe、BaTeなど)およびIII〜V族元素(GaN、GaP、GaAs、GaSb、InN、InP、InAs、InSbなど)およびIV族元素(Ge、Siなど)、ならびにそれらの合金または混合物を含むが、これらに限定されることはない。表面コーティングに適した金属および金属酸化物は、Au、Ag、Co、Ni、Fe2O3、TiO2などを含むが、これらに限定されることはない。表面コーティングに適したカーボンナノ粒子は、例えば、カーボンナノスフィア、カーボンナノオニオン、カーボンナノチューブおよびフラーレンを含む。
特定の態様では、タンパク質濃度に加え、酵素活性を検出することができる。例えば、前立腺腫瘍との関連で、現在、前立腺特異抗原(PSA)の濃度が検出されうるが、そのようなアッセイは、抗原が活性であるかそうでないかを必ずしも明確にせず、誤解を招く測定結果を与える可能性がある。本発明のある種の態様の局面は、濃度にだけでなく、活性にも関する情報をもたらすことを含む。さらに、特定の態様ではチップスキャナの代わりとなる検出システムも含む。
特定の態様における流体試料顕微分光法のシステムには通常、マイクロ流体光学デバイス(例えばチップまたは集積回路(IC)部分)と連結している検出器(例えば器具部分)を含んでもよい。検出器には、特性決定を行う流体試料に光を透過させるための光源ならびにスペクトログラフおよび/または試料の分子による影響を受ける光(例えば蛍光、吸光など)を分析するための分析ユニットを含むことができる。マイクロ流体光学デバイスは半導体製造技術を用いて作製することが可能であり、その半導体を保護するため、および流体試料の入口/出口ポートを収容するためにこれをパッケージしてもよい。
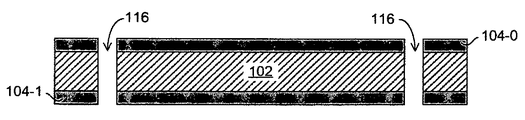
図1A〜図1Fを参照すると、本発明の態様によるシリコンベースの表面増強ラマン散乱(SERS)基板デバイスの作製工程の一例が示されている。
図1Aは、単結晶ウエハ102の上部表面および下部表面への比較的薄い多結晶シリコン層104-0および104-1の熱成長を示す。例えば、多結晶シリコン層104-0および104-1は約200 nm〜約400 nm、より具体的には約300 nmというように、約100 nm厚から約500 nm厚の範囲にできる。
図1Bは、ウエハ102および多結晶シリコン104-0/104-1を貫通するビアホール116のレーザー穿孔または化学的エッチングを示す。エッチング剤は加熱した水酸化カリウムであってもよく、30Wの炭酸ガスレーザーを利用してもよい。1つの態様では、ビアホール116の直径/幅を約100μmとしてもよい。もちろん、特定の態様では、これらのビアホールにとってあらゆる適切な幅(例えば約80μm〜約120μmの範囲、または約50μm〜約150μmの範囲など)を利用することができる。例えば、以下で詳細に説明するように、大きな分子をマイクロ流体光学チャンバーへ流入させないようにするなどして、フィルタリング機能をもたらすようにこれらのビアホールの幅を構成してもよい。
図1Cは、エッチングを施す領域のフォトリソグラフィによるパターニングを可能にするため、多結晶シリコン104-0の部分に塗布されるフォトレジスト106を示す。
図1Dは、シリコンナノ構造110を形成するための多結晶層104-0のプラズマエッチング108を示す。プラズマエッチング108には、シリコンナノ構造110の表面に幾何学的形状または他の適切な「粗さ」を形成するために、複数の段階を含むことができる。例えば、HBr + O2を含むプラズマ処理を最長約10秒施すことによりナノピラミッドアレイを作製することができる。HBrによるプラズマエッチングを約10秒〜約20秒間行うことで、ナノピラーアレイを作製することができる。その後、SF6などを含むプラズマエッチングによりピラーから酸化部分を除去することができる。次に、HBrプラズマを用いて約1分〜約2分間、表面にプラズマエッチングを施すことができる。そういった方法により、約50 nm〜約200 nm、より具体的には約100 nmの高さを有するナノピラミッドを形成することができる。
特定の態様において、あらゆる適切なタイプのナノ構造を実施することができる。以下で詳細に説明する酵素基質の調節などにより、基質の変化後に固有の、あるいは出現する特定の周波数の増強に対応するあらゆる形状を利用することができる。その他のナノ構造の例には、増強特性を有するさまざまな形状、ナノリング、ナノスクエア、ナノワイヤ、パラレルワイヤ、ナノグルーブなどを含めてもよく、電子ビーム、リソグラフィ、またはあらゆる適切な処理方法を用いてこれらの構造を形成することができる。
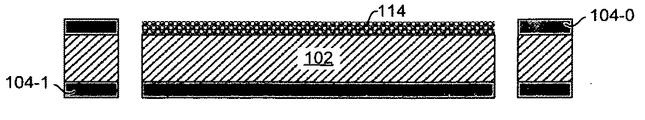
図1Eは、薄膜114の金属堆積112を示す。例えば、堆積される金属114には金、銀、プラチナ、パラジウム、銅などを含むことができ、薄膜114の厚さは例えば約20 nm〜約60 nm、より具体的には約40 nmのように、約10 nm〜約80 nmの範囲とすることができる。
図1Fは、層114の平坦な金属被膜表面を形成するためのフォトレジスト106の除去および金属薄膜化ナノ粒子114のアニール処理を示す。適切なアニール処理温度は約200〜300℃、より好ましくは250℃としてもよい。
特定の態様における層114の表面は、比較的粗くてもよく、あるいは、鋭利な縁端/先端などの周辺に増強電磁場を発生させるために、そのような縁端/先端などの他の幾何学的特性を備えてもよい。
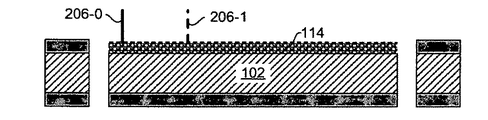
図2A〜図2Fを参照すると、本発明の態様によるSERSチップ上にさまざまな分子プローブをプリンティングする工程図が示されている。マイクロコンタクトピンまたは注入器を用いて、金属で被覆されたナノ構造SERS基板上に、異なる種類のペプチドまたはヌクレオチドを滴下してもよい。形成された酵素基質伸長物はSERS基板表面と共有結合することができる。
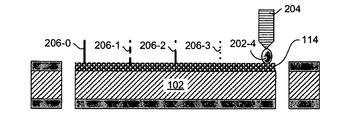
図2Aは、単結晶ウエハ102のいずれかの表面上の多結晶シリコン104-0および104-1、金属ナノ粒子114、ビアホール116を示す。ペプチドまたはヌクレオチド202-0を滴下するようプローブ204を配置することができる。図2Bは、金属ナノ粒子114とペプチド/ヌクレオチドの液滴202-0の共有結合から形成される酵素基質伸長物206-0を示す。
図2Cは、さまざまな液滴202-1を有するプローブ204の再位置決めを示す。図2Dは、対応する酵素基質伸長物206-1を示す。金属ナノ粒子114に結合した多数の酵素基質伸長物を形成するため、プローブ204の再位置決めは多数回行ってもよい。
図2Eは、酵素基質伸長物206-0、206-1、206-2、206-3を示す。示すように、次にプローブ204の再位置決めを行い、液滴202-4を遊離することができる。図2Fは、液滴202-4に対応する伸長物206-4を含む、SERS基板チップ210における酵素基質伸長物の完成した一群を示す。さらに、それぞれの酵素基質伸長物の周辺で電磁場を変化させてもよく、金属114は特定の周波数の電磁励起または光子励起を増強させるものとして使用してもよい。
図3Aおよび図3Bを参照すると、本発明の態様によるマイクロ流体分子診断デバイスの組立工程の一例ならびに完成組立体の一例が示されている。一般に、これらの別個のユニットを組立工程に含むことができる。上部層はポリジメチルシロキサン(PDMS)部分306-0および流体試料の入口302および出口304により形成することができる。光学装置または器具部分は入口/出口流路(例えば上部側)に対してチップの反対側(例えば下部側)に配置してもよいため、光学的分析の状態に干渉することなく、入口流路および出口流路を設置することについてはかなりの余裕がある。中央部のユニットには酵素基質伸長物を有するSERS基板チップ210を含むことができる。下部層にはマイクロ流体流路を設けるために、PDMS部分306-1および透明窓310を含むことができる。
特定の態様では、透明窓310は通常比較的薄いため、窓への吸収による光学損失を最小限に抑えることができる(例えば約10%未満)。一般的な窓の実装は約1〜3 mm厚の範囲とすることができるが、特定の態様ではそのような窓の厚さを約200μm〜約300μmとすることもできる。さらに、特定の態様における透明窓は光のスペクトルを通す適切な物質(例えばSiO2、PDMS、環状オレフィンコポリマー(COC)ポリマー、またはあらゆる紫外(UV)透過プラスチックなど)により形成することができる。
図3Bは、組み立てられた発見ツールデバイスの一例を示す。図3Aに示す3個の別個のユニットを結合して図3Bの組立体にするのに、シリコン表面上(例えば多結晶シリコン層104-0、104-1)にある二酸化ケイ素とPDMS表面上(例えば306-0および306-1)にある活性シロキサン基との共有結合を利用することができる。組立には、入口302から受け取られ、出口304から排出される流体試料の分析を行うためのマイクロ流体光学チャンバー318の作製を含むこともできる。
一般に、特定の態様は、集積回路(IC)部分210ならびに下記でさらに詳しく解説する器具部分を含むことができる。透明窓310は器具部分からIC部分210を分離するのに使用してもよい。IC部分には半導体物質102と、そこに入口ポート302および出口ポート304を設けるためのビアホール116を含むことができる。半導体物質102にはシリコン(Si)、ゲルマニウム、二酸化ケイ素、砒化ガリウム(GaAs)のような適切な半導体物質を含むことができる。ウエハの適切な半導体物質には、周期表のII〜VI族(ZnS、ZnSe、ZnTe、CdS、CdSe、CdTe、HgS、HgSe、HgTe、MgS、MgSe、MgTe、CaS、CaSe、CaTe、SrS、SrSe、SrTe、BaS、BaSe、BaTeなど)、III〜V族(GaN、GaP、GaAs、GaSb、InN、InP、InAs、InSbなど)、IV族(Ge、Siなど)の元素およびそれらの合金または混合物を含むが、これらに限定されることはない。
特定の態様では、同時に入口へ注入される異なる化学物質および/または複数の成分のリアルタイム反応を観察できるように、光学チャンバー318における試料溶液の混合を制御することができる。さらに、入口302および/または出口304はあらゆる適切なタイプの管(例えばプラスチック管)に連結することができ、ビアホールの直径は約100μm〜約1 mmの範囲とすることができる。さらに、入口および出口の流路またはポートのサイズは変更できるため、特定の用途に応じて、異なる試料量、分子サイズなどを可能にすることにより、フィルタリング機能を提供する。
1つの態様では、スルーホールはマイクロ流体光学チャンバー318内を流れる流体試料のための管路を提供できるため、その流体処理ユニットをマイクロスケール光学チャンバーが配置されている側ではなく、シリコンチップの側に設置することができる。流体処理ユニット(例えばリザーバ、コネクター、管、またはポンプ)がマイクロスケール光学チャンバーを遮らないので、光学システムはチャンバー318を十分照射できる。また、特定の態様におけるチャンバー318は、さまざまな酵素基質伸長物206に対応するために、例えば約500μm〜約2 cm、より具体的には約1 cmのように、約10μm〜約10 cmの範囲で長さを延長してもよい。チャンバー318の深さは、μLまたはμL以下の試料量を提供するために約10μm〜約200μmの範囲とすることができる。例えば、チャンバー318は約0.10μL〜約2μLの範囲で流体の試料量を保持することができる。
入口302および/または出口304は、複数流路の経路設定が可能な場合、複数流路に連結させてもよく、また、ロボットによる容易な導入ができるように(例えばそういった導入にとって標準的な距離を設けるために)、アレイフォーマットの中に配置してもよい。ポリマー結合層は組立に使用されてもよく、適切な軟性および硬性プラスチックの層を含んでもよい(例えばPDMS、エポキシ、粘着性ゴム、金属など)。シリコンデバイスの表面はプラズマ増強化学気相成長(PECVD)または電子ビーム蒸着によって酸化させてもよい。さらに、シーリング材(例えばエポキシ、PDMS、ゴム、ガラス、石英など)で上部を覆うとともに、流体処理パッケージで本構造の左端および右端を取り囲むことができる。
図4Aを参照すると、本発明の態様による2流路デバイスを作製するためのマイクロ加工マスクの平面図例が示されている。この例では、シリコンウエハ402をデバイスマスキング、入口/出口リザーバ404マスキング、マイクロ流体光学チャンバー406マスキング、ビアホールマスキングの層により定義することができる。図4Bのマスク構造の拡大平面図に示されるように、ビアホールマスキング層408はマイクロ流体光学チャンバー406の端部にかつ入口/出口リザーバ404のマスキング層内に並置することができる。
図5Aおよび図5Bを参照すると、本発明の態様によるマイクロ流体SERSチップの一例におけるプロテアーゼおよびヌクレアーゼバイオマーカー検出の原理が示されている。SERS基板表面114上のさまざまなタイプの線は、206-3および206-4のようなペプチド/ヌクレオチド酵素基質伸長物を示す。三角形のペア(例えば502および504)は、生物流体試料中のプロテアーゼおよび/またはヌクレアーゼバイオマーカーの例を示す。
図5Bは、510(バイオマーカー酵素502および504の導入)、512(バイオマーカー酵素502および504と酵素基質伸長物206-3および206-4の特異的結合)、514(酵素基質伸長物の限定的切断)、516(変化した酵素基質伸長物206-3'および206-4'を残すための反応残留物の洗浄)という一連の順序に従うバイオマーカー酵素反応の工程分解図である。
図6Aおよび図6Bを参照すると、本発明の態様によるマイクロ流体SERSチップの別の一例におけるキナーゼバイオマーカー検出の原理が示されている。SERS基板表面114上のさまざまなタイプの線は、206-1および206-2のような酵素基質伸長物の例を示す。三角形のペア(例えば602および604)は生物流体試料中のキナーゼバイオマーカーを示す。基質伸長物は酵素に限定されることはないが、本明細書で言及されるさまざまな他の分子、例えば、抗体、アプタマー、DNAまたはRNAオリゴヌクレオチド、より長い伸長物(非酵素ペプチド、多糖、ポリマー、小分子など)を含んでもよく、それらはいずれも流入する生物流体試料中の分子により作用および/または変化を受ける可能性があることに注意する。そういった基質伸長物はいずれも、チップにあるマイクロ流体チャンバーの表面に化学的に結合する能力を有する。同様に、602および604は必ずしも本発明のすべての態様における酵素バイオマーカーを示すものではない。むしろ、分析対象となる流入バイオマーカーは、核酸(DNAおよびRNA)、その他の非酵素タンパク質、ペプチド、糖/炭水化物、代謝産物、小化合物を含んでもよい。
図6Bは、610(バイオマーカー酵素602および604の導入)、612(バイオマーカー酵素602および604と酵素基質伸長物206-1および206-2の特異的結合)、614(酵素基質伸長物のリン酸化606)、616(反応残留物の洗浄)という一連の順序に従う、バイオマーカー酵素反応の例の工程分解図である。
図7Aを参照すると、本発明の態様による一体型ウェルプレートおよびシリコンマイクロ流体デバイス構造の平面図例が示されている。図7Bは、図7Aの構造例の断面図を示す。シリコンデバイス704の上にマイクロ流体ネットワーク層(例えばPDMS)706およびウェルプレート702を置いてもよい。したがって、そういった多重流路バージョンは、マイクロ流体流路またはルーティング層の構造の上部へ貫通するアクセスホールを備えることが可能である。この方法では、マイクロ流体光学チップを標準マイクロウェルプレートの寸法に適合しうる96ウェル、384ウェル、1536ウェルなどのマイクロウェルプレートと一体化させることができる。マイクロ流体光学チップとマイクロウェルプレートの組立体は標準ロボット流体処理システムに適合するものであってもよい。
図8を参照すると、本発明の態様によるマイクロ流体プロテアーゼ/ヌクレアーゼバイオマーカー診断デバイスにおける蛍光検出システムの構成の一例が示されている。それぞれのペプチド/ヌクレオチドの遊離した末端にある蛍光酵素基質伸長物をタンパク質分解/核酸分解反応により除去してもよく、バイオマーカー診断の光学的標識として使用してもよい。
この方法では、酵素基質伸長物は試料溶液中の酵素に標的を提供することができ、それによってプロテアーゼが動的に認識して付着した後、触媒作用が生じうる。したがって、特定の態様では、化学的反応は酵素基質伸長物(例えば206-3、206-4など)において生じる。対照的に、従来の方法では一般的に表面上のDNAプローブを含み、このプローブは溶液中の他のDNAを測定するが、基質を実際に変化させることなく、代わりに結合または認識の結果を提供する。特定の態様では、初期の結合が生じるが、この後に触媒作用が観察されることもある。これは、分析対象となる溶液中の酵素が効率的に基質を変化させる(例えば、基質からリン酸基を除去することによって)という事実が原因である。
図8において、光源802は蛍光励起フィルター814を用いてフィルタリングされた光ビームを提供できる。次に、フィルタリングされた光ビームをダイクロイックミラー822により反射させ、集束のために対物レンズ820を透過させて、光学透明窓310よりマイクロ流体光学チャンバー318へ入射させることができる。光源802は、白色光、レーザー光(例えば可視レーザー、紫外(UV)レーザー、近赤外(IR)レーザーなど)、発光ダイオード(LED)、スーパールミネッセントダイオード、偏光、ハロゲンランプが発する光、連続またはパルスキセノンランプ、水銀光源、アルゴン光源、重水素光源、タングステン光源、重水素-タングステン-ハロゲン混合光源などの適切な形態の光であり得る照明/励起光ビームを提供することができる。一般に、流体が入口ポート302を通して受け取られ、出口ポート304を通して排出できる場合、マイクロ流体光学チャンバー318は特性決定の対象となる流体または試料の分子を収容することができる。
マイクロ流体光学チャンバー318内で、選択された酵素基質伸長物から光が反射されると、吸光は対物レンズ820により生じ、ミラー822を通過して、蛍光発光フィルター824に送られ、検出器830で受け取ることが可能である。検出器830には、受け取った光ビームに含まれるさまざまな波長を分析するための電荷結合デバイス(CCD)を含んでもよい。この方法では、検出器830で受け取った蛍光および/または吸光の分析に基づき、チャンバー318で確認される試料の1以上の特性を決定することができる。さらに、以下で詳細に説明するように、本明細書で提示される光学チャンバーが微小寸法であることから、複数の個々の光学チャンバーを1個のチップに組み込むことが可能であり、それによって、2、96、さらには384もの試料を用いたマルチプレックス分光法を行うことが可能である。
図9を参照すると、本発明の態様によるマイクロ流体プロテアーゼ/ヌクレアーゼおよび/またはキナーゼ/ホスホリラーゼバイオマーカー診断デバイスの一例におけるラマン検出システムの構築の一例が示されている。それぞれのペプチド/ヌクレオチドの遊離した末端にあるラマン酵素基質伸長物は、タンパク質分解/核酸分解反応の結果として除去することができる。また、それらをリン酸化/脱リン酸化反応によって変化させてもよい。したがって、それらをバイオマーカー診断の光学的標識として使用してもよい。
この特定の例では、ポイント検出法により1度に1個の酵素基質伸長物の検出が可能となる。したがって、マイクロ流体光学デバイスおよび/または関連器具をそれぞれの酵素基質伸長物を検出するために平行移動させてもよい。さらに、他のマイクロ流体光学デバイス(例えば図4Aに示すように配置されたもの)も、器具部分を平行移動または角回転させることにより利用することができる。ここで、器具部分にはレーザー902を含み、これはミラー906から反射させるためのレーザービームを照射することができる。ビームスプリッター908はミラー906から反射されたレーザービームを受け取ることができ、レンズ904を通してスプリットビームをマイクロ流体光学チャンバー318に入射させてもよい。反射光はレンズ904を通して戻り、ビームスプリッター908、ミラー912、ミラー910を通過し、分光計914に入射して分析される。
この例では、分光計914は反応を示さないスペクトルまたは波長範囲を示すが、異なるスペクトルは特定の酵素基質伸長物上で反応が生じたことを示すこともある。反応が生じたかどうかの判定、または流体試料の別の特徴の決定には、新しいピークの出現、既存のピークの消失、既存のピークの変化、複数のピークの合体、ピークの分割、または分光計での測定が可能なあらゆる変化を含むことができる。この方法では、酵素基質伸長物および周辺領域の光学的および/または電磁的特性を用いて、化学的変化を検出することが可能である。したがって、特定の態様では酵素基質の蛍光標識を必要としなくてもよい。そのような態様では、化学的特性、電磁的特性、音響的特性、または観察に関する複雑な情報を有するあらゆる適切な特性の検出が利用される。
観察可能な変化は比較的微細なものである場合もあるため、酵素基質伸長物(例えば206-3、206-4など)付近の局所的電磁場を増強し、それによって検出を向上させるために、適切なナノ構造の組み合わせ(例えば層114の表面上のナノピラミッド)を加えてもよい。さらに、標識段階を必ずしも利用せず、特定の態様における分析をリアルタイムで行ってもよい。この理由は、基質が精製を必要としなくてもよいため、そして、あらゆる蛍光反応の発生に時間を必要としなくてもよいためである。
1つの例では、腫瘍が血液で転移することがあり、腫瘍は正常細胞に比較してキナーゼ活性プロファイルに影響を与える。キナーゼ活性を測定することにより、がんの特定の分類または病期を明らかにすることができるため、例えば適切な化学療法および/または免疫療法によりがんの処置を行うことが可能である。がんでは、特定のプロテアーゼがアップレギュレートされることがある。また、これらは変化した酵素特性を呈することもあり、請求項記載の発明の特定の態様を用いて同特性を同定することができる。生検材料を溶液に入れ、中性洗剤を使用して細胞を溶解し、溶解物における分析にμL範囲の容量を提供することができる。溶解物には多数の酵素(例えばプロテアーゼ、ヌクレアーゼ、キナーゼ、ホスファターゼなど)を含んでもよい。さまざまな酵素を観察するために、それに対応してさまざまな酵素基質伸長物をマイクロアレイに配置する(例えば図4Aの配置を参照)。複数の酵素反応を同時に測定するために、それぞれ異なる酵素基質伸長物をマイクロアレイに配置してもよい。さらに、請求項記載の発明の特定の態様は、酵素反応に加えて結合反応を測定することもできる。そのような態様では、例えば、表面プラズモン共鳴(SPR)を用いて、タンパク質とタンパク質の結合および/または相互作用を検出してもよい。
本発明の特定の態様は、抗体に応じてスペクトルシグネチャが異なる可能性があるため(例えば、切断など異なる事象のピーク、異なる化学的反応、結合および/または認識事象)、抗体アレイを利用してもよい。特定の態様では、実質的な処理または試料調製を行わずに使用できるあらゆるプラズマまたは流体(例えば唾液、尿、髄液など)を分析することができる。しかし、干渉の可能性がある流体構成要素のため、調製された試料ではそれに対応する未調製試料に比較してプロセスの測定が改善される可能性がある。分光計914は比較的広い範囲に対応し、妨害バックグラウンドノイズからの測定可能なシグナルの分離を可能にしている。
図10を参照すると、本発明の態様によるマイクロ流体プロテアーゼ/ヌクレアーゼバイオマーカー診断デバイスにおけるハイスループットなラマン検出システムの構成の一例が示されている。点状レーザー励起を線状レーザー励起に変換するために、高速走査ミラー1006を光路で使用してもよく、それによってSERS基板表面上の複数の酵素基質伸長物を励起することができ、2次元スペクトログラフ1014を用いて1回に基質伸長物のSERSスペクトルを記録することにより、これらの基質伸長物を同時に検出することができる。
上述のように、特定の態様にはさまざまな酵素基質伸長物を一つずつ走査するために走査プラットフォームを含んでもよい。器具部分の1以上の構成材のための移動台とともに、走査ミラー1006が含まれる。高精度を期すため、そのそれぞれをモーター駆動式としてもよい。さらに、特定の態様は分析対象となる酵素基質伸長物に対する適正な光ビーム位置調整のために、自動焦点および/または他のパターン認識を含むことができる。
特定の態様では、光の入射角をコンピュータフィードバック制御により微調整するために、デジタル光処理(「DLP」)デバイスを使用することができる。例えば、図10に示す構成例に記載の走査ミラー1006をそういったDLPと置き換えることも可能である。
SERSに加えて、例えば、機械的、電磁および/または光学的など、散乱の他の分光法モジュールおよび/またはタイプを用いることができる。例えば、測定対象となる分子の内部周波数に関して回転または反転を測定するのに、さまざまな周波数の電磁方式または音響方式およびIRを使用してもよい場合、分子の振動はさまざまな化学的反応により変化する可能性がある(例えば電磁波周波数のように、非常に低いものから高いものまで)。
図11を参照すると、本発明の態様によるキナーゼバイオマーカー検出におけるペプチドプローブのラマンシグナル増強の一例が示されている。特定の態様におけるSERS基板にはポリシリコンおよび金属が含まれるため、図示された基質伸長物を有する基板は導電性である。リン酸化検出については、正の直流電圧をSERS基板(例えば金属部分114)に印加してもよく、負の直流電圧を関連する反応バッファに印加することもできる。1102では、負電荷のキナーゼ酵素を正電荷のペプチドに近づける一方で、正電荷のペプチド伸長物を反発させてまっすぐにさせてもよい。1104では、キナーゼ酵素はその近接性によりペプチドに結合できる。1106では、リン酸化反応後、ペプチドは負電荷のリン酸基を有しているため、SERS基板表面に引き付けられ、一方、キナーゼ酵素は負電荷を失い、反発される可能性がある。リン酸化反応後に生じるペプチドの比較的大きな立体配置的変化は、分析対象となるSERSスペクトルのより劇的な変化を誘起する可能性が高い。
検出または器具モジュールにおいて、供給される光の吸光および/または蛍光を分析することができる。一般的に、蛍光は励起光よりも波長が長い。特定の態様は、励起波長が発光波長よりも長い場合、光子励起または多光子励起を補助することができ、さらに別個のフィルターを利用してもよい落射蛍光の利用も補助することができる。
特定の態様は、散乱光の測定にも対応可能である(例えばX線小角散乱分光法)。円二色性(CD)の利用における偏光を用いて測定を行うこともでき、これにより試料分子の角度の動きの反応程度が測定される。フーリエ変換赤外分光(FTIR)の使用ならびにラマン散乱および発光において、蛍光の寿命を測定することもできる。
特定の態様では、SPRおよび核磁気共鳴(NMR)分光法にも対応可能である。そういった用途においては、照明窓は光学的にポンピングされた超偏光を受け取ることができ、そのような光学的ポンピングは光学的実現とともに一般に近接して生じる。NMRは一般に測定に均質な場を利用してもよいが、これは磁場が逆転しうる場合、この方法が通常金属コイルを使用するからであり、チャンバー318の周辺に磁場が存在する場合、光学的ポンピングはチャンバー318を介することも可能である。この方法では、マイクロ流体光学チャンバーを光学的に活性化できる。
材料の試料を操作するため、その他の電磁源をマイクロ流体光学チャンバーに組み込むこともできる。例えば、特定の態様は熱性、電磁性、光学性、誘電性、不均質性などの試料の物理的特性の操作を行うことができる。
本発明の特定の態様の別の局面は、シリコン物質102の比較的高い熱伝導性を伴うため、熱デバイス(加熱および/または冷却)と連結することにより、チャンバー318の温度を制御することが可能となる。例えば、室温においてだけではなく、約0℃もの低温から最高約300℃において、またはそれ以外の場合は試料物質自体の限界による定めに応じて、金属ブロックまたは金属接合を使用して試料物質を測定することができる。したがって、タンパク質が活性である場合、高温における変性を防ぐために、試料の測定を約37℃で行うことができる。別の態様では、耐熱性酵素(例えばTaqポリメラーゼ、好熱性微生物から分離または作製された他の耐熱性酵素)によりさらに高温(例えば最高約99℃)での測定が可能である。このタイプの測定は、比較的大規模な加熱/冷却部品を連結せずに標準キュベットを用いる場合、可能ではないこともある。
特定の態様において、そういった温度制御および関連する検出ユニットをマイクロ流体光学デバイスと一体化させることができる。例えば、そういった一体型温度制御および検出ユニットはペルチェ接合型加熱器または金属線抵抗加熱器とすることができる。この方法により、タンパク質の熱変性を防ぐための比較的低温やポリメラーゼ連鎖反応(PCR)を使用したリアルタイム遺伝子増幅のための高温のように、さまざまな温度における試料の熱サイクル分析が可能となる。
この方法では、チャンバー318における温度に対する化学的、生物学的、および/または物理的反応の測定に対応することができる。化学純度を測定するための化学物質の融点の測定のように、あらゆる温度依存性特徴を分離することが可能である。さらに、いくつかの用途にはカメラを含んでもよい。PCRは反応の蛍光の観察とともに(例えば約10ミリ秒/フレーム〜約1秒/フレーム)、リアルタイムのPCRシグナルを観察するためにサイクル温度(例えば約55℃〜約95℃)を含むことができる。さらに、本発明の特定の態様のマイクロ流体光学チャンバーを用いて、ヌクレアーゼ、プロテアーゼ、キナーゼ、ポリメラーゼ、グリコシラーゼ、トポイソメラーゼ、リガーゼ、ホスファターゼなど、これらに限られるものではないが、あらゆる数のさまざまな酵素の濃度および活性を測定することができる。
図12を参照すると、本発明の態様によるマイクロ流体光学デバイスにおける構造の作製方法の一例のフロー図が示されている。フローは(1202)から始まり、単結晶シリコンウエハの各側面に多結晶シリコン層を堆積させることができる(1204)。次に、例えば、化学的エッチングまたはレーザー穿孔により、ビアホールを形成することができる(1206)。次に、続いてエッチングを施すウエハの前面の領域に対し、フォトリソグラフィを用いてパターニングを施すことができる(1208)。次に、パターニングを施した領域において、シリコンナノ構造にエッチングを施すことができる(例えばプラズマを使用して)(1210)。例えば、そのようなナノ構造はナノピラミッドアレイのような適切な形状の表面の粗さを提供することができる。次に、エッチングを施した領域に金属(例えば金、銀など)を堆積させることができる(1212)。残りのフォトレジストを除去することができ、薄い金属ナノ粒子にアニール処理を施すことができ(1214)、フローが完了する(1216)。
図13を参照すると、本発明の態様による流体試料の特徴の発見のためのデバイスを作製する方法の一例のフロー図が示されている。フローは(1302)から始まり、少なくとも1つの酵素基質伸長物を、金属で被覆されたナノ構造表面に配置してもよい(1304)。マイクロ流体光学チャンバーに伸長物が存在できるように、酵素基質伸長物を含む構造を逆さにすることができる(1306)。次に、入口および出口ポートを有する上部層を構造に結合させることができる(1308)。次に、マイクロ流体分析用の光学チャンバーを有する発見デバイスを形成するために、構造に対して透明窓を有する下部層をそこに結合させることができ(1310)、フローが完了する(1312)。
図14を参照すると、本発明の態様による流体試料分析用の発見デバイスの使用方法の一例のフロー図が示されている。フローは(1402)から始まり、流体試料を分析のためにマイクロ流体光学チャンバー内に受け取ることができる(1404)。次に、マイクロ流体光学チャンバーの透明窓を通して励起光(例えばレーザーから)を酵素基質伸長物に提供することができる(1406)。次に、酵素基質伸長物からの戻り光(return light)を受け取ることができる(1408)。例えば、そのような戻り光を集光するのにレンズ、ミラー、スプリッターを利用することができる。次に、戻り光を分析し(例えば分光計またはスペクトログラフを使用して)、酵素基質伸長物を変化させる反応が生じたかどうかを判定することができ(1410)、フローが完了する(1412)。
図15を参照すると、本発明の態様による高速システムを使用する方法の一例のフロー図が示されている。電動式回転式ガルボミラー(1506)によりSERS表面上の複数の組み合わせの高速な走査が可能になる。それぞれの組み合わせはさまざまな生体分子により結合されてもよく(1518)、例えば、関心対象の酵素または他の分子により標的とされてもよい。レーザーなどからの励起光(1502)がミラー(1504)に接し、回転式ガルボミラーに転送される(1506)。ここから光がダイクロイックミラー(1508)へ通過し、対物レンズ(1510)を透過する。ラマンフィルター(ロングパス)(1512)はスペクトログラフ(1514)の前に置く。それぞれの生体分子(1518)はチップ表面(1516)に結合する。
図15に描かれているように、特定の態様には、表面に結合された生体分子が含まれる。例えば、そのような生体分子は核酸(DNAおよびRNA)、タンパク質、ペプチド、糖/炭水化物、代謝産物および小化合物を含むことができる。さらに、表面に結合された生体分子および化学分子は、生化学的アッセイの微小規模アレイを形成するようにパターニングされてもよい。さまざまな生化学的ライブラリがコンビナトリアル検出のためマイクロ流体光学チャンバーの表面に堆積されてもよい。官能基は反応基を含むことができる。官能基は、2つまたはそれ以上の異なる機能的標的(例えば、ペプチド、タンパク質、巨大分子、表面コーティング/表面など)と結合を形成できる2つの反応基を有する二官能性架橋剤を含むこともできる。いくつかの態様では、二官能性架橋剤は、2つの異なる反応基を有するヘテロ二官能性架橋剤である。表面への生体分子の共有結合を可能とするために、適した反応基は、例えば、チオール(-SH)、カルボキシレート(COOH)、カルボキシル(-COOH)、カルボニル、アミン(NH2)、ヒドロキシル(-OH)、アルデヒド(-CHO)、アルコール(ROH)、ケトン(R2CO)、活性水素、エステル、スルフヒドリル(SH)、ホスフェート(-PO3)または光反応性部分を含む。アミン反応基は、例えば、イソチオシアネート、イソシアネート、アシルアジド、NHSエステル、スルホニルクロリド、アルデヒドおよびグリオキサル、エポキシドおよびオキシラン、カルボネート、アリール化剤、イミドエステル、カルボジイミド、ならびに無水物を含むことができる。チオール反応基は、例えば、ハロアセチルおよびアルキルハライド誘導体、マレイミド、アジリジン、アクリロイル誘導体、アリール化剤およびチオール-ジスルフィド交換試薬を含む。カルボキシレート反応基は、例えば、ジアゾアルカンおよびジアゾアセチル化合物、例えばカルボニルジイミダゾールおよびカルボジイミドを含む。ヒドロキシル反応基は、例えば、エポキシドおよびオキシラン、カルボニルジイミダゾール、ペリオデートによる酸化、N,N'-ジスクシンイミジルカルボネートまたはN-ヒドロキシルスクシミジル(hydroxylsuccimidyl)クロロホルメート、酵素的酸化、アルキルハロゲンおよびイソシアネートを含む。アルデヒドおよびケトン反応基は、例えば、シッフ塩基形成または還元アミノ化のためのヒドラジン誘導体を含む。活性水素反応基は、例えば、マンニッヒ縮合およびヨウ素化反応のためのジアゾニウム誘導体を含む。光反応性基は、例えば、アリールアジドおよびハロゲン化アリールアジド、ベンゾフェノン、ジアゾ化合物ならびにジアジリン誘導体を含む。
1つの態様では、ヘテロ二官能性架橋剤は、基質ペプチドと相互作用しうる複素環を形成する2つの異なる反応基を含む。例えば、システインのような、ヘテロ二官能性架橋剤は、誘導体化ペプチドのアルデヒドと相互作用するアミン反応基およびチオール反応基を含むことができる。ヘテロ二官能性架橋剤のための反応基のさらなる組み合わせは、例えば、アミンおよびスルフヒドリル反応基、カルボニルおよびスルフヒドリル反応基、アミンおよび光反応基、スルフヒドリルおよび光反応基、カルボニルおよび光反応基、カルボキシレートおよび光反応基、ならびにアルギニンおよび光反応基を含む。
同様に特定の態様では、マイクロ流体光学チップは、自動的に運搬され、関連した分光学的結像システムと整列されてもよい。例えば、そのような輸送および/または整列は、コンピュータにより最適化アルゴリズムを用いて制御することができる。同様に、特別なマーカーがマイクロ流体チップに含まれてもよく、自動パターン認識において用いられてもよい。
ある種の態様では、マイクロ流体光学チャンバーに電位差を印加して、キャピラリ電気泳動システムを形成できるようなチャネルに集積された電極を提供することもできる。ひいては、例えば、電気泳動および等電点電気泳動を用いたDNAおよびタンパク質の分離を実現することができ、生体分子の光学スペクトルをリアルタイムでモニターすることができる。
同様にある種の態様では、マイクロ流体光学チャンバー内の内容物は、液体ではなく、気相材料であってもよい。気体の光学的特性をリアルタイムで継続的に測定またはモニターすることができる。例えば、空気中の微粒子の濃度をモニターすることができる。
ある種の態様では、抗体をチップ表面に結合させる。試料中の対応抗原の存在および/または濃度を測定することができる。がん診断を対象にする態様では、ある種のがんバイオマーカーに特異的な抗体を表面に結合させる。受容体チロシンキナーゼの中には、ヒトのがんに最も高い頻度で関係している、EGFRおよびerb B2を含むEGF受容体遺伝子ファミリーがある。例えば、ヒト胃がんの場合にEGFRおよびerb B2の増幅が、それぞれ約3〜5%および10〜20%で確認されている(Albino et al., (1995) Eur. J. Surg. Oncol., 21:56-60; Sato et al., (1997) Pathol. Int., 47, 179-182; Hung and Lao, (1999) Semin. Oncol., 26:51-59)。腸型胃がんの場合にはガストリンおよびerb B2の同時増幅が報告されている(Vidgren et al., (1999) Genes Chromosomes Cancer, 24, 24-29)。このように、ガストリンのレベル上昇を伴ったEGFRおよびerb B2タンパク質のレベルの増加は、腸がんを示している。本発明の感度は、これらのタンパク質のレベルのわずかな増加の検出を容易にする。大部分の胃がんは一層深刻な段階に進むまで診断されないので、この感度改善は意義深い。さらに、本発明の方法におけるタンパク質レベルの測定は、わずかな試料容量を必要とするだけであり、生検試料の検査に適している。本発明で用いるのに適した多くの抗体がAbCam、BioMol、Sigmaなどのような製造供給元から市販されている。
特定の態様では、酵素活性および濃度を検出することもできる。酵素に対する基質を表面のナノ構造に結合し、酵素を含む試験試料を、触媒反応の発生につながる条件において基質に通す/基質とともにインキュベートする。基質は、プロテアーゼ、キナーゼ、ホスファターゼ、ヌクレアーゼ、メチルトランスフェラーゼ、アセチルトランスフェラーゼ、アシルトランスフェラーゼ、トランスアミナーゼ、グリコシルトランスフェラーゼなどに対するものでありうる。
基質は、典型的には、長さが少なくとも約4残基から約10、30、50、200または500残基に及ぶ。したがって、プロテアーゼに対する基質は約4アミノ酸であり、約50、200または500アミノ酸までであってよい。そのような基質は、酵素によって認識される1つまたは複数の認識配列を持ってもよい。そのような基質はさらに、非天然のアミノ酸、ヌクレオチド、および/または糖残基で構成されてもよい。さらに、そのような基質は、官能基を付加または除去するために酵素または化学的過程によって修飾されてもよい。
プロテアーゼ活性の検出
特定の態様では、本発明は、プロテアーゼ活性を検出するために用いられる。プロテアーゼは正常な細胞機能の維持に必要であるだけでなく、さまざまなヒト疾患の発病の中核をなすことも多い。寄生虫感染症、真菌感染症、ウイルス感染症、がん、炎症性疾患、呼吸器疾患、心血管疾患および神経変性疾患は進行のためにはタンパク質分解活性を要する。プロテアーゼ濃度および/または活性の検出は、疾患の存在または可能性に対する診断/予後診断マーカーとして価値がある。さらに、プロテアーゼ活性の阻害の検出は、いくつかの病態の処置のためのプロテアーゼ阻害剤をスクリーニングする際に有用である。
特定の態様では、本発明は、プロテアーゼ活性を検出するために用いられる。プロテアーゼは正常な細胞機能の維持に必要であるだけでなく、さまざまなヒト疾患の発病の中核をなすことも多い。寄生虫感染症、真菌感染症、ウイルス感染症、がん、炎症性疾患、呼吸器疾患、心血管疾患および神経変性疾患は進行のためにはタンパク質分解活性を要する。プロテアーゼ濃度および/または活性の検出は、疾患の存在または可能性に対する診断/予後診断マーカーとして価値がある。さらに、プロテアーゼ活性の阻害の検出は、いくつかの病態の処置のためのプロテアーゼ阻害剤をスクリーニングする際に有用である。
本発明によって検出および/または定量化できる「プロテアーゼ」は、典型的には、タンパク質/ペプチドにおける一対のアミノ酸の間のペプチド結合を加水分解し、より短いタンパク質/ペプチドを産生する酵素である。この活性はタンパク質分解ともいわれる。タンパク質/ペプチド基質のタンパク質分解は、SERS、電磁共鳴測定または音響測定によって得られたスペクトルの変化により検出可能である。プロテアーゼは、典型的には、酵素の触媒中心における求核基を参照することによって定義される。最も一般的な求核基は、セリン、アスパラギン酸およびシステインの側鎖から生じる。したがって、プロテアーゼは、セリンプロテアーゼ(Paetzel et al. (1997) Trends Biochem. Sci. 22:28-31)、アスパルチルプロテアーゼ(Spinelli et al. (1991) Biochemie 73: 1391-1396)およびシステインプロテアーゼ(Altschuh et al. (1994) Prot. Eng. 7:769-75, 1994)のようなプロテアーゼファミリーに分類される。メタロプロテアーゼは、通常、触媒中心に亜鉛触媒金属イオンを含む(Klimpel et al. (1994) Mol. Microbiol. 13: 1093-1100)。
「プロテアーゼ認識部位」は、特定のプロテアーゼによって加水分解される一対のアミノ酸を含んだペプチドまたはタンパク質におけるアミノ酸の配列である。プロテアーゼ認識部位におけるアミノ酸の特定の配列は、プロテアーゼの活性部位における官能基の性質によって定義されるプロテアーゼの触媒機構に典型的には依存する。すなわち、トリプシンのようなプロテアーゼは、ペプチド/タンパク質の長さまたはアミノ酸配列とは無関係に、そのカルボニル官能基がリジンまたはアルギニン残基のいずれかによって与えられるペプチド結合を加水分解する。その他のプロテアーゼは、より高い特異性を有し、例えば、第Xa因子は配列Ile-Glu-Gly-Argを認識し、ArgのC末端側のペプチド結合を加水分解する。
種々の好ましいプロテアーゼ認識部位は、セリンプロテアーゼファミリー由来のプロテアーゼ、もしくはメタロプロテアーゼ由来のプロテアーゼ、もしくはシステインプロテアーゼ由来のプロテアーゼ、ならびに/またはアスパラギン酸プロテアーゼファミリー由来のプロテアーゼ、および/もしくはグルタミン酸プロテアーゼファミリー由来のプロテアーゼに対するプロテアーゼ認識部位を含むが、これらに限定されることはない。
プロテアーゼ認識部位は当業者には周知である。ほぼ全ての公知のプロテアーゼについて認識部位が特定されている。したがって、例えば、カスパーゼに対する認識部位(ペプチド基質)は、参照により本明細書に組み入れられるEarnshaw et al. (1999) Annu. Rev. Biochem. 68: 383-424により記述されている。
ある種の態様では、キナーゼまたはホスファターゼに対する基質がデバイスのナノ構造表面に付着される。付着はコンタクトピン、注入器または共有結合によって達成される。異なるキナーゼまたはホスファターゼ基質を表面上の特定の位置に配置し、それによって、1つもしくは複数のキナーゼおよび/もしくはホスファターゼの検出ならびに/または1つもしくは複数のキナーゼおよび/もしくはホスファターゼの活性の定量化のためのアレイを提供することができる。基質のリン酸化を検出することに関して器具、方法および組成物を記述するが、これらの器具、方法および組成物は基質の脱リン酸化を検出する際にも有用であることが認識されると考えられる。
キナーゼ/ホスファターゼ活性の検出
リン酸化は、タンパク質の一般的な翻訳後修飾であり、タンパク質の構造および機能に対してならびに細胞生理学の全ての局面において重要な役割を果たす。タンパク質キナーゼは、よく保存されたモチーフを含み、ヒトゲノムにおいて最大のタンパク質ファミリーを成す。タンパク質キナーゼの突然変異は、発がんおよびいくつかの他の病的状態に関わる。他の生体分子のリン酸化も細胞の生理機能および病態において重要な役割を果たす。ホスホイノシチド-3キナーゼファミリーメンバーのような脂質キナーゼは、増殖因子、ホルモンおよび神経伝達物質に対する細胞応答の重要な調節因子であり、がんに関わる。ヌクレオチドおよびヌクレオシドキナーゼは、リン酸供与体および核酸前駆体の細胞内レベルを制御し、損傷および虚血に対する細胞応答に関わる。糖キナーゼは糖代謝、エネルギー生成および転写活性化の速度を制御し、細胞の形質転換およびアポトーシスの過程に関わる。したがって、キナーゼ活性の検出および/または測定は、細胞/組織恒常性、生理機能の変化の検出、疾患状態の診断などにおいて有用である。
リン酸化は、タンパク質の一般的な翻訳後修飾であり、タンパク質の構造および機能に対してならびに細胞生理学の全ての局面において重要な役割を果たす。タンパク質キナーゼは、よく保存されたモチーフを含み、ヒトゲノムにおいて最大のタンパク質ファミリーを成す。タンパク質キナーゼの突然変異は、発がんおよびいくつかの他の病的状態に関わる。他の生体分子のリン酸化も細胞の生理機能および病態において重要な役割を果たす。ホスホイノシチド-3キナーゼファミリーメンバーのような脂質キナーゼは、増殖因子、ホルモンおよび神経伝達物質に対する細胞応答の重要な調節因子であり、がんに関わる。ヌクレオチドおよびヌクレオシドキナーゼは、リン酸供与体および核酸前駆体の細胞内レベルを制御し、損傷および虚血に対する細胞応答に関わる。糖キナーゼは糖代謝、エネルギー生成および転写活性化の速度を制御し、細胞の形質転換およびアポトーシスの過程に関わる。したがって、キナーゼ活性の検出および/または測定は、細胞/組織恒常性、生理機能の変化の検出、疾患状態の診断などにおいて有用である。
キナーゼによりリン酸化されかつ/またはホスファターゼにより脱リン酸化されうる任意の分子を、本明細書において記述される器具、方法および組成物におけるキナーゼ/ホスファターゼ基質として用いることができる。これらの分子は、タンパク質、ペプチド、糖(例えば、ヘキソース、グルコース、フルクトースなど)、核酸、アセテート、ブチレート、脂質、セラミドなどを含む。表1は、本発明の方法を利用することにより検出できる公知のキナーゼおよびその酵素番号(EC番号)の例示的なリストを提供する。キナーゼの名称から、通常、酵素が作用する基質が特定される。リン酸化によって修飾される大部分の基質をホスファターゼによって脱リン酸化できることは周知である。したがって、基質をリン酸化することによってそれらを最初に修飾することにより、キナーゼ基質が付着された表面をホスファターゼアッセイにおいて用いることができる。
大多数のキナーゼおよびホスファターゼに対する基質および/または基質共通配列が公知である。共通モチーフに基づく短い合成ペプチドは、典型的には、キナーゼおよびホスファターゼに対する優れた基質である。表2は、本発明の方法を利用することにより検出できる、特定のタンパク質における公知のリン酸化部位の例とともに、よく研究されている各種タンパク質キナーゼの特定のモチーフに関する公知データのいくつかをまとめたものである。さらに広範なリストは、参照により本明細書に組み入れられるPearson and Kemp (1991) Meth. Enzymol., 200:68-82の中に含まれる。
(表2)いくつかの公知のキナーゼに対する認識モチーフおよび基質配列を列挙する。対応するキナーゼによってリン酸化されるアミノ酸に下線を引いた。スラッシュ(/)は、互いに機能的に置き換えることができるアミノ酸を示す。基質認識配列に寄与しないアミノ酸を「X」で示す。
多くのキナーゼ基質がSigma、BioMol International、Bio-Radなどのような種々の製造供給元から市販されている。好ましいキナーゼ基質はヒスチジン、セリン、トレオニンおよびチロシンキナーゼ、ならびに/または対応するホスファターゼに対する基質を含むが、これらに限定されることはない。これらのキナーゼに対する多数の基質が当技術分野において周知である。さらに、基質の特定のための方法も知られている。例えば、キナーゼ触媒ドメインの一次配列に基づいてセリン/トレオニンタンパク質キナーゼに対する基質を予測するためにプログラムPREDIKINが用いられる。基質をデザインするためにPREDIKINを用いる方法は、参照により本明細書に組み入れられるRoss et al. (2003) PNAS, USA, 100 (1): 74-79によって記述されている。同じ機能を果たす他のプログラムが、当技術分野において周知である。
ある種のタンパク質キナーゼに特異的ないくつかの基質が公知である。表3に周知のチロシンキナーゼ基質を列挙した。
上記のキナーゼ/ホスファターゼ基質は、例証となることを意図しており、限定することは意図していない。本明細書において提供される教示および当技術分野において周知のものを用いて、当業者は他のキナーゼ基質を、本明細書において記述される器具、方法および組成物において用いるために容易に利用することができると考えられる。
SERS基板デバイスへのキナーゼ/ホスファターゼ基質の付着
キナーゼおよび/またはホスファターゼ基質は当業者に周知のいくつかの方法のいずれかによってナノ粒子に、または表面上に存在する特徴(例えば、ラマン活性表面)に付着させることができる。そのような方法は、微小のコンタクトピンまたは注入器または共有結合の使用を含むが、これらに限定されることはない。
キナーゼおよび/またはホスファターゼ基質は当業者に周知のいくつかの方法のいずれかによってナノ粒子に、または表面上に存在する特徴(例えば、ラマン活性表面)に付着させることができる。そのような方法は、微小のコンタクトピンまたは注入器または共有結合の使用を含むが、これらに限定されることはない。
例えば、金ナノ構造を含むある種の態様では、キナーゼおよび/またはホスファターゼ基質は、基質(例えば、ペプチド)の末端のシステイン基と金表面との間の金-チオール反応によって形成される共有結合により金ナノ構造に結合される。種々の態様では、アレイ表面ならびに/またはキナーゼおよび/もしくはホスファターゼ基質は、ペプチド(または他の基質)が表面に直接結び付けられ、またはリンカーを通じてカップリングされうるように、例えば、アミン、カルボキシル基、アルキル基、アルキレン(alkyene)基、ヒドロキシル基または他の官能基で誘導体化することができる。他の態様では、表面は、例えば、キナーゼおよび/またはホスファターゼ基質との付着のためにアミン、カルボキシルまたは他の官能基で官能性をもたせることができる。
適当なリンカーは、それぞれが各結合パートナー(キナーゼ/ホスファターゼ基質、表面、または表面上の官能基など)と共有結合を形成できる2つまたはそれ以上の反応部位を含んだヘテロ二官能性分子またはホモ二官能性分子を含むが、これらに限定されることはない。そのような部分を連結するのに適したリンカーは、当業者に周知である。例えば、タンパク質分子は、ペプチドリンカー、直鎖もしくは分枝鎖の炭素鎖リンカーを含むが、これらに限定されない種々のリンカーのいずれかによって、または複素環炭素リンカーによって容易に結び付けることができる。N-エチルマレイミドの活性エステルのようなヘテロ二官能性架橋試薬が、タンパク質を他の部分に結び付けるために広く使われている(例えば、Lerner et al. (1981) Proc. Nat Acad. Sci. (USA), 78: 3403-3407; Kitagawa et al. (1976) J. Biochem., 79: 233-236; Birch and Lennox (1995) Chapter 4 in Monoclonal Antibodies: Principles and Applications, Wiley-Liss, N.Y.などを参照のこと)。
ある種の態様では、キナーゼおよび/またはホスファターゼ基質は、ビオチン/アビジン相互作用を利用して表面に付着させることができる。ある種の態様では、例えば光解離性の保護基を有するアビジンまたはビオチンを、表面におよび/またはキナーゼ/ホスファターゼ基質に付けることができる。対応するアビジンもしくはストレプトアビジン、またはビオチンを持つ所望のキナーゼおよび/またはホスファターゼ基質の存在下での表面の照射は、基質と表面とのカップリングを引き起こす。
種々の態様では、複数のキナーゼおよび/またはホスファターゼ基質、通常は少なくとも約5個、好ましくは少なくとも10個、または少なくとも20個、50個、100個、500個、1000個、10,000個もしくは100,1000個のものが表面に付着される。キナーゼ/ホスファターゼ基質は、表面上へ複数のコピーで付着された、または表面の全体にさまざまな密度で付着された単一の基質であってよい。基質の密度を変化させることでキナーゼ/ホスファターゼ活性の定量化が容易になると考えられる。すなわち、リン酸化反応の発生によって新しいピークが現れるなら、ナノ構造表面のさまざまな位置に対応するピークの振幅は、付着された基質の密度の増加にしたがって増すと考えられる。あるいは、多数の基質が表面上のさまざまな位置に付着される。すなわち、いくつかの位置に陽性対照基質を、種々の密度で、かつ他の位置に陰性対照基質を、同様に種々の密度で結合させる。
ある種の態様では、表面は、キナーゼおよび/またはホスファターゼ基質の高密度アレイを提供する。種々の態様では、そのようなアレイは少なくとも100種もしくは少なくとも200種の異なる基質/cm2、好ましくは少なくとも300種、400種、500種または1000種の異なる基質/cm2、およびより好ましくは少なくとも1,500種、2,000種、4,000種、10,000種、または50,000種、または100,000種の異なる基質/cm2を含むことができる。
分子を表面上に高密度でパターニングするための方法は当業者に周知である。そのような方法は、例えば、高密度マイクロアレイプリンタの使用を含む(例えば、Heller (2002) Ann. Rev. Biomed. Eng. 4: 129-153を参照のこと)。他のマイクロアレイプリンタでは、参照により本明細書に組み入れられる「オンデマンド」の圧電液滴発生器(例えば、インクジェットプリンタ)を利用する(例えば、米国特許第6,395,562号、同第6,365,378号、同第6,228,659号、ならびにWO 95/251116およびWO/2003/028868を参照のこと)。他の手法ではデノボ合成を伴う(例えば、参照により本明細書に組み入れられるFodor et al. (1991) Science, 251:767-773ならびに米国特許第6,269,846号、同第6,271,957号および同第6,480,324号を参照のこと)。いくつかのプリンタが市販されている(例えば、Aurora BiomedのVERSAミニスポット・プリンティング・ワークステーション、Bio-RadのBIOODYSSEY CALLIGRAPHER MiniArrayer、Genomic SolutionsのOmniGrid Accentなどを参照のこと)。
基質リン酸化/脱リン酸化アッセイ
試料中の単一種のキナーゼおよび/またはホスファターゼの活性を検出および/または測定することが望ましい場合には、単一種の基質がマイクロ流体デバイスのSERS表面に結合される。試料中の多数のキナーゼおよび/またはホスファターゼの検出に関連する態様では、多数の基質がマイクロ流体デバイスのSERS表面に結合される。
試料中の単一種のキナーゼおよび/またはホスファターゼの活性を検出および/または測定することが望ましい場合には、単一種の基質がマイクロ流体デバイスのSERS表面に結合される。試料中の多数のキナーゼおよび/またはホスファターゼの検出に関連する態様では、多数の基質がマイクロ流体デバイスのSERS表面に結合される。
本明細書において記述されるキナーゼおよび/またはホスファターゼ活性の検出/測定は、いくつかの異なる試料のいずれかに関して行うことができる。例えば、キナーゼアンタゴニストまたはアゴニストの特定のためのスクリーニングシステムにおいては、細胞/細胞株および/もしくはその溶解物、または関心対象のキナーゼを含む適切な緩衝系を1つまたは複数の試験化合物として接触させる/投与することができる。次いで、それに由来する試料を、どの試験化合物が、例えばキナーゼ阻害剤および/またはホスファターゼアゴニストとしての、活性を示すかを、ならびにそれらの化合物が阻害および/または作動するキナーゼ/ホスファターゼ酵素がどれかを特定することによりキナーゼ活性についてスクリーニングすることができる。
種々の診断に関する態様では、キナーゼおよび/もしくはホスファターゼ酵素の存在、ならびに/またはその濃度、および/もしくは活性が生物学的試料において判定される。生物学的試料は、アッセイの対象となる本質的にすべての生体材料を含むことができる。そのような生体材料は、生体液、例えば血液または血液分画、血漿、リンパ液、涙液、髄液および肺液、脳脊髄液、精液、尿、唾液など、組織試料、細胞試料、組織または臓器の生検または吸引物、組織学的標本などを含むが、これらに限定されることはない。
ある種の態様では、未加工の細胞溶解物をマイクロ流体デバイスに直接導入することができ、測定をインキュベーション中に行うことができる。試料はマイクロ流体チャンバーを通じて反応チャンバーに導入される。試料全容量はマイクロリットル以下の容量まで減らすことができる。
キナーゼ基質のリン酸化またはホスファターゼ基質の脱リン酸化は、SERS、電磁共鳴測定または音響測定によって得られたスペクトルの変化により検出可能である。対照(試料なしまたは対照試料)と比較したSERS表面のスペクトルの変化はキナーゼ/ホスファターゼ活性を示すことができる。スペクトルの変化は、既存のピークの消失を伴う新しいピークの出現、ピークの移動、ならびにピークの融合および/または分裂でありうる。
そのような表面は1つもしくは多数のキナーゼおよび/もしくはホスファターゼの濃度および/もしくは活性のリアルタイムスクリーニングのために、ならびに/または1つもしくは複数のキナーゼおよび/もしくはホスファターゼの動態の定量化のために有効なツールを提供する。1つまたは多数の試験剤(例えば化学的ライブラリ)のキナーゼおよび/またはホスファターゼ阻害剤活性をスクリーニングするために、そのような表面を容易に用いることもできる。
ある種の態様では、キナーゼ/ホスファターゼ活性の検出および/または測定は、医師および病院職員によるがんの個人向け分子診断において用いることができる。1つの態様では、本発明は、特定の種類のがんに特異的な分子マーカーの存在を検出するために用いられる。
実施例1
変化したプロテアーゼ活性の検出
プロテアーゼのリアルタイムインサイチュー検出は、早期がんのスクリーニングに、および処置方法の有効性の評価に欠かせない。1つの例示的な実例において、本発明は、生物学的試料中のプロテアーゼ、前立腺特異抗原(PSA)の活性を検出するために用いられる。PSAレベルは前立腺がんにおいて増大する。したがって、PSAは前立腺がんのバイオマーカーとなる。血漿PSA濃度の測定では、前立腺がん患者と良性前立腺過形成を有する患者とが区別されず、偽陽性率が高くなる。前立腺がんの早期検出マーカーとしてのPSAの臨床的価値を高めるための努力の中には、PSAの各種の分子アイソフォームの特徴付けが含まれてきた。各種のアイソフォームのなかで、タンパク質分解活性を有するPSA亜集団は、血清中PSA濃度よりも有用な腫瘍マーカーおよび悪性予測因子として受け入れられている(Wu et al. (2004) Prostate 58: 345-353; Wu et al. (2004) Clin. Chem., 50: 125-129)。
変化したプロテアーゼ活性の検出
プロテアーゼのリアルタイムインサイチュー検出は、早期がんのスクリーニングに、および処置方法の有効性の評価に欠かせない。1つの例示的な実例において、本発明は、生物学的試料中のプロテアーゼ、前立腺特異抗原(PSA)の活性を検出するために用いられる。PSAレベルは前立腺がんにおいて増大する。したがって、PSAは前立腺がんのバイオマーカーとなる。血漿PSA濃度の測定では、前立腺がん患者と良性前立腺過形成を有する患者とが区別されず、偽陽性率が高くなる。前立腺がんの早期検出マーカーとしてのPSAの臨床的価値を高めるための努力の中には、PSAの各種の分子アイソフォームの特徴付けが含まれてきた。各種のアイソフォームのなかで、タンパク質分解活性を有するPSA亜集団は、血清中PSA濃度よりも有用な腫瘍マーカーおよび悪性予測因子として受け入れられている(Wu et al. (2004) Prostate 58: 345-353; Wu et al. (2004) Clin. Chem., 50: 125-129)。
PSAプロテアーゼ活性の検出に用いられるペプチド基質は、PSAにより認識されうるフランキング配列とセリン残基とを有するPSA特異的ペプチドの活性部位のアミノ酸配列を包含する。したがって、ペプチドは、タンパク質分解活性を有するPSAに対して非常に高い特異性を有することが知られている配列HSSKLQ-LAAACを含む(Denmeade et al., (1997) Cancer Res 57:4924-4930)。HSSKLQ-LはマウスモデルにおいてインビボでPSAにより切断されるが、その他任意のプロテアーゼにより切断されないことも示されている(Denmeade et al., (2003) J. Natl. Cancer Inst. 95: 990-1000)。したがって、無作為または公知の配列部分、およびPSA特異的配列HSSKLQ-LAAACまたはHSSKLQ-Lをそれぞれが有する複数のペプチドを、SERS基板表面のナノ構造に付着させて、スクリーニングを行うことができる。PSA加水分解部位はQとLとの間である。加水分解はペプチドの短縮をもたらし、これはペプチドに関連したスペクトルの変化によって検出可能である。ひいては、得られたスペクトログラフにおいてこれを観察することができる。
この特定の実施例では、SERS基板表面は金ナノ構造を有する。ペプチドは、ペプチドのカルボキシル末端のシステインと金ナノ構造との間で形成される金-チオール共有結合を介して表面に付着される。温度を37℃に維持したマイクロ流体チャンバーに、試験する試料を導入する。試料を約2時間、デバイス内のSERS表面のペプチド基質と接触させた状態で維持する。前立腺がんが疑われる患者由来の血漿試料から得られたスペクトルを、年齢を適合させた非罹患者のものと比較する。検出アッセイ用の陽性対照として精製PSAを用いる。
さらに、時間分解スペクトルの取得によりリアルタイムでタンパク質分解動態をモニターすることもできる。したがって、ピークの消失、出現、移動、融合または分裂をリアルタイムで追跡することができる。
ナノ構造を用いることで、SERS表面に付着された特定の分子に関連したスペクトルの変化の検出が容易になる。したがって、酵素基質を蛍光タグまたは放射性タグに融合する必要はない。
実施例2
変化したキナーゼ活性の検出
タンパク質キナーゼは、全てのヒト遺伝子のおよそ1.7%に相当し、驚くことではないが、重要な細胞調節タンパク質である(Manning et al. (2002) Science 298: 1912-1934)。30種の公知の腫瘍抑制遺伝子および100種を超える優性がん遺伝子の大部分は、タンパク質キナーゼである(Futreal et al. (2001) Nature 409: 850-852)。チロシンキナーゼ受容体は、正常細胞の増殖および分化に通じるシグナル伝達経路において鍵になる分子である。ある種のチロシンキナーゼの不活性化およびそれ以外の活性増大をもたらす突然変異は、腫瘍細胞の顕著な特徴である。関心対象のある種の組織に関連するチロシンキナーゼ活性プロファイルを提供するために、本発明を用いることができる。本実施例では、組織は、(正常のキナーゼ活性プロファイルを得るために)結腸がんのない者から得られた、および(陽性対照のキナーゼ活性プロファイルを得るために)結腸がんに罹患した患者から得られた結腸の生検試料である。正常組織および対照組織に対するチロシンキナーゼ活性プロファイルが得られたら、結腸がんを有することが疑われる患者由来の結腸生検試料で同じ手順を行う。正常のキナーゼ活性プロファイルスペクトルからの顕著な逸脱および/または陽性対照のキナーゼ活性プロファイルスペクトルとの類似性は、結腸がんを示す。
変化したキナーゼ活性の検出
タンパク質キナーゼは、全てのヒト遺伝子のおよそ1.7%に相当し、驚くことではないが、重要な細胞調節タンパク質である(Manning et al. (2002) Science 298: 1912-1934)。30種の公知の腫瘍抑制遺伝子および100種を超える優性がん遺伝子の大部分は、タンパク質キナーゼである(Futreal et al. (2001) Nature 409: 850-852)。チロシンキナーゼ受容体は、正常細胞の増殖および分化に通じるシグナル伝達経路において鍵になる分子である。ある種のチロシンキナーゼの不活性化およびそれ以外の活性増大をもたらす突然変異は、腫瘍細胞の顕著な特徴である。関心対象のある種の組織に関連するチロシンキナーゼ活性プロファイルを提供するために、本発明を用いることができる。本実施例では、組織は、(正常のキナーゼ活性プロファイルを得るために)結腸がんのない者から得られた、および(陽性対照のキナーゼ活性プロファイルを得るために)結腸がんに罹患した患者から得られた結腸の生検試料である。正常組織および対照組織に対するチロシンキナーゼ活性プロファイルが得られたら、結腸がんを有することが疑われる患者由来の結腸生検試料で同じ手順を行う。正常のキナーゼ活性プロファイルスペクトルからの顕著な逸脱および/または陽性対照のキナーゼ活性プロファイルスペクトルとの類似性は、結腸がんを示す。
予冷したTLysis緩衝液0.1 mLとともにセラミックビーズを含有する特殊な遠心管(Roche, Penzberg, Germany)に生検試料を移す。組織を、MagNA Lyser機で作った振動に6500 r/分で120秒間供することができる。次いで溶解物を4℃で1時間、100,000 gで遠心分離し、上清を取っておき、タンパク質濃度についてアッセイする(Lowry法)。
本発明のナノ構造表面に表3のチロシンキナーゼ基質を結合させる。37℃に維持したマイクロ流体チャンバーに、組織溶解物を導入することができる。溶解物を1時間チロシンキナーゼ基質とともにインキュベートする。溶解物の導入の前に、インキュベーションの間におよび溶解物を洗い流した後に、ナノ構造表面に付着された酵素基質に関連するスペクトルを測定する。このように、時間分解スペクトルの取得によりリアルタイムでリン酸化動態をモニターする。この時間依存性のチロシンキナーゼ活性プロファイルは、データ解釈の精度を高める。
実施例3
転写因子活性プロファイリング
腫瘍生検のような細胞試料を特徴付けるために、遺伝子発現プロファイリングが用いられることが多くなっている。試料中の選択された伝令RNAのレベルを測定することによって、試料のサブタイプまたは分子プロファイルに関する推論を引き出し、処置代替案を含む、医学的決断を支持しうる情報を提供することができる。RNAレベルを測定することに代わる潜在的により情報価値のある代替案は、腫瘍生検または他の細胞試料におけるタンパク質の活性を直接測定することである。DNA結合転写因子は、分子プロファイリングに関して特に情報価値のあるタンパク質のクラスであり、試料における細胞の詳細な転写状態に関する情報を提供する。
転写因子活性プロファイリング
腫瘍生検のような細胞試料を特徴付けるために、遺伝子発現プロファイリングが用いられることが多くなっている。試料中の選択された伝令RNAのレベルを測定することによって、試料のサブタイプまたは分子プロファイルに関する推論を引き出し、処置代替案を含む、医学的決断を支持しうる情報を提供することができる。RNAレベルを測定することに代わる潜在的により情報価値のある代替案は、腫瘍生検または他の細胞試料におけるタンパク質の活性を直接測定することである。DNA結合転写因子は、分子プロファイリングに関して特に情報価値のあるタンパク質のクラスであり、試料における細胞の詳細な転写状態に関する情報を提供する。
本実施例では、細胞試料におけるDNA結合転写因子の活性がマイクロ流体SERS検出装置を用いて動力学的に測定される。この装置は、1つのまたは潜在的に多くの個々にアドレスされたオリゴヌクレオチドプローブがSERS基板表面のナノ構造に付着され、それぞれのオリゴヌクレオチドが関心対象の特定の転写因子に対する結合部位を含んだ配列を有するように調製される。例えば、E-ボックス六量体配列CACGTGを含む25-merの二本鎖DNAオリゴヌクレオチドを用いて、塩基性ヘリックス・ループ・ヘリックス転写因子のサブクラスの活性を調べることができる。ミスマッチオリゴヌクレオチドを非特異的結合の対照として用いることもでき、同一配列を重複して配置して測定精度を高めることができる。SERSスペクトルの評価は、転写因子とオリゴヌクレオチドプローブとの結合、ならびにさらなる転写補助因子およびTAFタンパク質を含みうるDNA-転写因子超複合体の形成に関する動的情報を提供する。
細胞1×104個を含有する針生検を採取し、Sigma NXTRACT CELLYTIC NUCLEAR抽出キットを用い4℃で核抽出物を単離する。次いで核抽出物を、1 mM DTTを含有する冷10 mM Tris-HCL緩衝液19μlに再懸濁する。Sigmaプロテアーゼ阻害剤カクテルP8340 1μlを加え、溶液をマイクロ流体SERS検出装置に移す。25℃で、試料は微小規模のチャンバーに入り、入射レーザー光および透過したSERSスペクトルの検出を用いリアルタイムでDNA結合事象を測定する。転写因子結合活性プロファイルを各オリゴヌクレオチド(oligonucelotide)配列について、以下の測定結果の1つまたは複数から作成または計算する: (1) 利用可能なすべての部位のうちの一部分としての結合オリゴヌクレオチドの占有率; (2) 秒単位でのDNA-タンパク質複合体の平均安定度; および(3) 単位時間当たりの結合事象の総数。組織型の全体にわたるおよび病変組織 vs 正常組織の全体にわたる転写因子結合活性プロファイルの比較は、組織試料の分子病態を特徴付け、処置代替案に対する診断指標となる可能性がある。
上記のものは本発明の原理を例証しているにすぎない。本明細書において明記または明示されていなくとも、本発明の原理を具現化し、かつ本発明の趣旨および範囲のなかに含まれる種々の構成を当業者なら考案できることが理解されると考えられる。さらに、本明細書に記載した全ての例および条件つきの表現は、主に、本発明の原理と、技術の進歩に対して本発明者らが貢献する発想とを読者が理解する助けとなるよう意図されており、具体的に記載したそれらの例および条件に限定するものではないと解釈されるべきである。また、本発明の原理、局面および態様、ならびに本発明の具体例に関して述べている本明細書の全ての記載は、本発明の構造的等価物も機能的等価物もともに包含するよう意図される。さらに、そのような等価物は、現在公知の等価物も将来開発される等価物、すなわち、構造に関係なく同じ機能を実行する任意の開発要素もともに含むことも意図される。それゆえ、本発明の範囲は、本明細書に示され記述される例示的な態様に限定されるよう意図されるものではない。むしろ、本発明の範囲および趣旨は、添付の特許請求の範囲によって具現化される。
Claims (29)
- 入口ポートを通して試料を受け取り、かつ出口ポートを通して試料を排出するように構成されたチャンバーであって、入口ポートおよび出口ポートがチャンバーの第1側面に配置されている、チャンバー;
チャンバーの第1側面のナノ粒子構造を有する表面と連結している多数の酵素基質伸長物;
チャンバーの第1側面の反対側にある第2側面に配置され、かつ多数の酵素基質伸長物のうちの選択された1つに励起ビームを提供するように配置されている照明器; ならびに
選択された酵素基質伸長物から反射されたビームを受け取り、かつ選択された酵素基質伸長物が試料によって変化を生じたかどうかをそこから判定するように構成された分析モジュール
を含む、試料の分析のために構成された装置。 - 選択された酵素基質伸長物に対して照明器および分析モジュールを配置するように構成されたステップ制御モーターをさらに含む、請求項1記載の装置。
- 分析モジュールがミラーおよび分光計を含む、請求項1記載の装置。
- 分光計における波形ピークが、選択された酵素基質伸長物の、試料による変化を示す、請求項3記載の装置。
- ナノ粒子構造が、ナノピラミッドアレイに堆積された金属を含む、請求項1記載の装置。
- 励起ビームがレーザーを含む、請求項1記載の装置。
- 分析モジュールがデジタル光処理機(DLP)を含む、請求項1記載の装置。
- 多数の酵素基質伸長物の少なくとも1つがポリペプチドを含む、請求項1記載の装置。
- 多数の酵素基質伸長物の少なくとも1つが核酸を含む、請求項1記載の装置。
- 多数の酵素基質伸長物の少なくとも1つが多糖を含む、請求項1記載の装置。
- 変化が、選択された酵素基質伸長物と試料由来の酵素との間のリン酸化事象を含む、請求項1記載の装置。
- 変化が、選択された酵素基質伸長物と試料由来の酵素との間の脱リン酸化事象を含む、請求項1記載の装置。
- 変化が、選択された酵素基質伸長物と試料由来の酵素との間の開裂事象を含む、請求項1記載の装置。
- シリコンウエハの各側面に多結晶シリコン層を堆積させる段階;
シリコンウエハを貫通するビアホールを形成する段階;
シリコンウエハの前面にパターニングを施す段階;
前面のパターニングにより形成された領域においてシリコンナノ構造にエッチングを施す段階;
エッチングを施したシリコンナノ構造により形成された領域に金属を堆積させる段階;
残りのフォトレジストを除去し、かつ堆積された金属にアニール処理を施す段階; および
シリコンウエハから切り離されたチップを、処理ユニットと、マイクロ流体光学デバイスのチャンバーに連結された透明窓とに一体化させる段階
を含む、マイクロ流体光学デバイスを作製する方法。 - ビアホールの形成が化学的エッチングの使用を含む、請求項14記載の方法。
- ビアホールの形成がレーザー穿孔の使用を含む、請求項14記載の方法。
- チップの一体化が、ビアホール形成のための入口ポートと出口ポートとの連結を含む、請求項14記載の方法。
- 入口ポートを通して液体試料を受け取り、かつ出口ポートを通して試料を排出する段階であって、入口ポートおよび出口ポートがチャンバーの第1側面に配置されている、段階;
多数の酵素基質伸長物のうちの選択された1つに励起ビームを提供する段階であって、該酵素基質伸長物が、チャンバーの第1側面の表面と連結しており、該表面がナノ粒子構造を有する、段階;
選択された酵素基質伸長物から反射されたビームを分析モジュールにおいて受け取る段階; ならびに
選択された酵素基質伸長物が試料によって変化を生じたかどうかを、受け取った反射ビームから判定する段階
を含む、液体試料の特徴付けを行う方法。 - 選択された酵素基質伸長物に最も近い電圧を調整する段階をさらに含む、請求項18記載の方法。
- 選択された酵素基質伸長物に対して分析モジュールを配置する段階をさらに含む、請求項18記載の方法。
- マイクロ流体光学チャンバーに流体試料を導入する段階であって、該マイクロ流体光学チャンバーが、そこから伸長している多数の基質を有するラマン活性表面を備える、段階;
流体試料中の生体分子と多数の前記基質との間の特異的な相互作用を可能にする段階;
レーザーを流体試料へと方向付ける段階であって、レーザーと流体試料との相互作用が、生体分子と基質との間の相互作用に特異的なSERSシグナルをもたらす、段階; および
対照試料のラマン散乱スペクトルと比較した場合の、生体分子のラマン散乱スペクトルの変化を検出することにより、生体分子の活性を検出する段階
を含む、表面増強ラマン分光法(SERS)システムを用いて標的生体分子の活性を測定するための方法。 - 標的生体分子がタンパク質である、請求項21記載の方法。
- 標的生体分子が酵素である、請求項21記載の方法。
- 標的生体分子がキナーゼである、請求項21記載の方法。
- 標的生体分子が抗体である、請求項21記載の方法。
- 標的生体分子が酵素反応の基質である、請求項21記載の方法。
- 標的生体分子がDNA結合タンパク質であり、かつ基質が核酸である、請求項21記載の方法。
- 標的生体分子と多数の基質との間の相互作用が、タンパク質-リガンド結合相互作用である、請求項21記載の方法。
- 標的生体分子と多数の基質との間の相互作用が、タンパク質-タンパク質結合相互作用である、請求項21記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/970,451 US7952705B2 (en) | 2007-08-24 | 2008-01-07 | Integrated microfluidic optical device for sub-micro liter liquid sample microspectroscopy |
| US12/191,812 US20090097022A1 (en) | 2007-08-24 | 2008-08-14 | Discovery tool with integrated microfluidic biomarker optical detection array device and methods for use |
| PCT/US2008/012369 WO2009088408A1 (en) | 2008-01-07 | 2008-10-31 | Discovery tool with integrated microfluidic biomarker optical detection array device and methods for use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011511933A true JP2011511933A (ja) | 2011-04-14 |
| JP2011511933A5 JP2011511933A5 (ja) | 2011-06-02 |
Family
ID=40854774
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010541421A Pending JP2011511933A (ja) | 2008-01-07 | 2008-10-31 | 一体型マイクロ流体バイオマーカー光学検出アレイデバイスを用いた発見ツールおよび使用方法 |
Country Status (6)
| Country | Link |
|---|---|
| EP (1) | EP2229578A4 (ja) |
| JP (1) | JP2011511933A (ja) |
| CN (1) | CN101978248A (ja) |
| AU (1) | AU2008347152A1 (ja) |
| CA (1) | CA2710828A1 (ja) |
| WO (1) | WO2009088408A1 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017003500A (ja) * | 2015-06-12 | 2017-01-05 | 浜松ホトニクス株式会社 | 表面増強ラマン散乱ユニット |
| JP2017009344A (ja) * | 2015-06-18 | 2017-01-12 | 浜松ホトニクス株式会社 | 表面増強ラマン散乱ユニット |
| JP2017531165A (ja) * | 2014-07-29 | 2017-10-19 | ユニバーシティ−インダストリー コーオペレイション グループ オブ キョンヒ ユニバーシティUniversity−Industry Cooperation Group Of Kyung Hee University | 涙滴を用いたウイルス感染診断方法及び機器 |
| WO2023106372A1 (ja) * | 2021-12-08 | 2023-06-15 | 国立研究開発法人理化学研究所 | 酵素の測定方法、マイクロチャンバーアレイ、キット、ラマン散乱像の撮影方法、及び目的分子の測定方法 |
| JP7481346B2 (ja) | 2019-01-07 | 2024-05-10 | ザルトリウス オートメーテッド ラボ ソリューションズ ゲーエムベーハー | 試料を収容するための空洞を有する試料容器 |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9855735B2 (en) | 2009-11-23 | 2018-01-02 | Cyvek, Inc. | Portable microfluidic assay devices and methods of manufacture and use |
| US10022696B2 (en) | 2009-11-23 | 2018-07-17 | Cyvek, Inc. | Microfluidic assay systems employing micro-particles and methods of manufacture |
| ES2649559T3 (es) | 2009-11-23 | 2018-01-12 | Cyvek, Inc. | Método y aparato para realizar ensayos |
| US9500645B2 (en) | 2009-11-23 | 2016-11-22 | Cyvek, Inc. | Micro-tube particles for microfluidic assays and methods of manufacture |
| US9759718B2 (en) | 2009-11-23 | 2017-09-12 | Cyvek, Inc. | PDMS membrane-confined nucleic acid and antibody/antigen-functionalized microlength tube capture elements, and systems employing them, and methods of their use |
| US9700889B2 (en) | 2009-11-23 | 2017-07-11 | Cyvek, Inc. | Methods and systems for manufacture of microarray assay systems, conducting microfluidic assays, and monitoring and scanning to obtain microfluidic assay results |
| US10065403B2 (en) | 2009-11-23 | 2018-09-04 | Cyvek, Inc. | Microfluidic assay assemblies and methods of manufacture |
| WO2013134744A2 (en) | 2012-03-08 | 2013-09-12 | Cyvek, Inc | Microfluidic assay assemblies and methods of manufacture |
| JP2013528379A (ja) * | 2010-05-21 | 2013-07-11 | オームクス コーポレーション | Psa酵素活性アッセイによる癌の検出 |
| EP2686154B1 (en) * | 2011-03-15 | 2018-11-14 | National Research Council of Canada | Microfluidic system having monolithic nanoplasmonic structures |
| CN103649759B (zh) | 2011-03-22 | 2016-08-31 | 西维克公司 | 微流体装置以及制造方法和用途 |
| EP2717052A4 (en) * | 2011-05-29 | 2014-10-29 | Korea Res Inst Chem Tech | HIGH SPEED SCREENING DEVICE FOR A MULTI AND HIGH SPEED MEDICINE BASED ON RAMAN ANALYZES |
| TWI618901B (zh) * | 2012-11-30 | 2018-03-21 | 凱特伊夫公司 | 用於維護工業用列印系統的方法 |
| EP2972236A4 (en) * | 2013-03-14 | 2016-09-28 | Hewlett Packard Development Co | DEVICES FOR DETECTING A SUBSTANCE AND METHOD FOR PRODUCING SUCH A DEVICE |
| CN103499534B (zh) * | 2013-07-25 | 2015-09-09 | 中国科学院苏州纳米技术与纳米仿生研究所 | 高灵敏太赫兹微流通道传感器及其制备方法 |
| EP2878373A1 (en) * | 2013-11-29 | 2015-06-03 | IMEC vzw | Capillary flow plasmonic sensor |
| EP2942390B1 (en) * | 2014-05-07 | 2017-10-04 | Commissariat À L'Énergie Atomique Et Aux Énergies Alternatives | Green microalgae lacking a functional DYRKP-1 gene, for use for increased production of feedstock |
| JP6491425B2 (ja) * | 2014-05-21 | 2019-03-27 | Towa株式会社 | 電子部品パッケージ側面撮影装置 |
| CN104880391B (zh) * | 2015-06-23 | 2018-03-06 | 好来化工(中山)有限公司 | 用于检测唾液中颗粒物质的装置 |
| CN108291867B (zh) * | 2015-07-01 | 2021-07-16 | 堀场仪器株式会社 | 用于液体中纳米颗粒的显微观察的专用试管组件和方法 |
| US10228367B2 (en) | 2015-12-01 | 2019-03-12 | ProteinSimple | Segmented multi-use automated assay cartridge |
| CN109313137A (zh) | 2016-07-22 | 2019-02-05 | 惠普发展公司,有限责任合伙企业 | 衬底支撑的表面增强发光台和壳体 |
| CN107144620A (zh) * | 2017-03-31 | 2017-09-08 | 兰州百源基因技术有限公司 | 糖尿病肾病检测标志物 |
| CN107179309B (zh) * | 2017-05-22 | 2019-06-07 | 厦门大学 | 一种精氨酸激酶的检测方法 |
| WO2019164962A1 (en) * | 2018-02-20 | 2019-08-29 | EMULATE, Inc. | Human microphysiological cell system for liver disease conversion with prov 1-18585 and prov 2-19154 |
| CN108982826B (zh) * | 2018-09-28 | 2024-03-26 | 广东工业大学 | 一种斑马鱼检测纳米颗粒对胚胎毒性的测试装置和测试方法 |
| US20210404967A1 (en) * | 2018-12-14 | 2021-12-30 | Hewlett-Packard Development Company, L.P. | An analysis chip |
| GB2582619A (en) * | 2019-03-28 | 2020-09-30 | Sumitomo Chemical Co | Enzyme linked assay methods and apparatuses |
| CN110327996B (zh) * | 2019-09-03 | 2019-12-24 | 中国科学院上海高等研究院 | 微流控芯片、微流控系统及红外微流控分析方法 |
| CN112626200B (zh) * | 2021-01-12 | 2022-07-22 | 复旦大学附属妇产科医院 | 血清微囊泡-天冬酰胺内肽酶假基因1在子宫内膜异位症诊断及复发预测中的用途 |
| US20220236261A1 (en) * | 2021-01-26 | 2022-07-28 | IceMos Technology Limited | Semiconductor Device Providing a Biosensor to Test for Pathogen |
| CN114034683A (zh) * | 2021-12-01 | 2022-02-11 | 吉林大学 | 一种快速诊断1型糖尿病的多重免疫芯片及其制备方法和应用 |
| CN117844932A (zh) * | 2024-03-07 | 2024-04-09 | 珠海圣美生物诊断技术有限公司 | 人类3号和10号染色体异常细胞检测试剂盒及其制备方法 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU5794498A (en) * | 1996-12-10 | 1998-07-03 | Genetrace Systems, Inc. | Releasable nonvolatile mass-label molecules |
| US20040005582A1 (en) * | 2000-08-10 | 2004-01-08 | Nanobiodynamics, Incorporated | Biospecific desorption microflow systems and methods for studying biospecific interactions and their modulators |
| US7033910B2 (en) * | 2001-09-12 | 2006-04-25 | Reveo, Inc. | Method of fabricating multi layer MEMS and microfluidic devices |
| US7795388B2 (en) * | 2001-11-08 | 2010-09-14 | The United States Of America As Represented By The Administrator Of The National Aeronautics And Space Administration (Nasa) | Versatile platform for nanotechnology based on circular permutations of chaperonin protein |
| US7355716B2 (en) * | 2002-01-24 | 2008-04-08 | The General Hospital Corporation | Apparatus and method for ranging and noise reduction of low coherence interferometry LCI and optical coherence tomography OCT signals by parallel detection of spectral bands |
| EP1556506A1 (en) * | 2002-09-19 | 2005-07-27 | The Chancellor, Masters And Scholars Of The University Of Oxford | Molecular arrays and single molecule detection |
| US7138330B2 (en) * | 2002-09-27 | 2006-11-21 | Medtronic Minimed, Inc. | High reliability multilayer circuit substrates and methods for their formation |
| US6975402B2 (en) * | 2002-11-19 | 2005-12-13 | Sandia National Laboratories | Tunable light source for use in photoacoustic spectrometers |
| US20060068412A1 (en) * | 2004-03-05 | 2006-03-30 | Cha-Mei Tang | Integrated multistep bioprocessor and sensor |
| JP4806411B2 (ja) * | 2004-05-19 | 2011-11-02 | ブィピー ホールディング、エルエルシー | 可視光レーザ励起ビーム及びラマン分光検出器と共に使用する光センサ、及び分析物の化学基を検出する方法 |
| US20060046277A1 (en) * | 2004-09-01 | 2006-03-02 | Belyaev Alexander S | Protein kinase and phosphatase substrates and multiplex assays for identifying their activities |
| US20060115536A1 (en) * | 2004-11-12 | 2006-06-01 | Board Of Regents, The University Of Texas System | Glycerin based synthesis of silver nanoparticles and nanowires |
| EP1946083B1 (en) * | 2005-10-17 | 2011-06-01 | Sword Diagnostics, Inc. | Method for detection of biological organisms using raman scattering |
| GB0606088D0 (en) * | 2006-03-27 | 2006-05-03 | E2V Biosensors Ltd | Improved serrs substrate |
-
2008
- 2008-10-31 CA CA2710828A patent/CA2710828A1/en not_active Abandoned
- 2008-10-31 AU AU2008347152A patent/AU2008347152A1/en not_active Abandoned
- 2008-10-31 JP JP2010541421A patent/JP2011511933A/ja active Pending
- 2008-10-31 WO PCT/US2008/012369 patent/WO2009088408A1/en active Application Filing
- 2008-10-31 CN CN2008801245973A patent/CN101978248A/zh active Pending
- 2008-10-31 EP EP08869969A patent/EP2229578A4/en not_active Withdrawn
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017531165A (ja) * | 2014-07-29 | 2017-10-19 | ユニバーシティ−インダストリー コーオペレイション グループ オブ キョンヒ ユニバーシティUniversity−Industry Cooperation Group Of Kyung Hee University | 涙滴を用いたウイルス感染診断方法及び機器 |
| JP2017003500A (ja) * | 2015-06-12 | 2017-01-05 | 浜松ホトニクス株式会社 | 表面増強ラマン散乱ユニット |
| JP2017009344A (ja) * | 2015-06-18 | 2017-01-12 | 浜松ホトニクス株式会社 | 表面増強ラマン散乱ユニット |
| JP7481346B2 (ja) | 2019-01-07 | 2024-05-10 | ザルトリウス オートメーテッド ラボ ソリューションズ ゲーエムベーハー | 試料を収容するための空洞を有する試料容器 |
| WO2023106372A1 (ja) * | 2021-12-08 | 2023-06-15 | 国立研究開発法人理化学研究所 | 酵素の測定方法、マイクロチャンバーアレイ、キット、ラマン散乱像の撮影方法、及び目的分子の測定方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2229578A1 (en) | 2010-09-22 |
| AU2008347152A1 (en) | 2009-07-16 |
| EP2229578A4 (en) | 2011-02-23 |
| CA2710828A1 (en) | 2009-07-16 |
| WO2009088408A1 (en) | 2009-07-16 |
| CN101978248A (zh) | 2011-02-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2011511933A (ja) | 一体型マイクロ流体バイオマーカー光学検出アレイデバイスを用いた発見ツールおよび使用方法 | |
| US10928319B2 (en) | Digital LSPR for enhanced assay sensitivity | |
| JP4607127B2 (ja) | 多孔性バイオセンサーおよびラマン分光法を用いる生体分子の検出 | |
| US8852955B2 (en) | Methods and systems for detecting biomolecular binding using terahertz radiation | |
| JP2022058772A (ja) | 試料分析のためのデバイスおよび方法 | |
| Yoo et al. | A highly sensitive plasma-based amyloid-β detection system through medium-changing and noise cancellation system for early diagnosis of the Alzheimer’s disease | |
| US7811754B2 (en) | Detection of single nucleotide polymorphisms using planar waveguides | |
| JP5260339B2 (ja) | 核酸分析デバイス、及び核酸分析装置 | |
| WO2014144133A1 (en) | Analyte detection enhancement by targeted immobilization, surface amplification, and pixelated reading and analysis | |
| US20110140706A1 (en) | Particle-Based Electrostatic Sensing and Detection | |
| US20050221507A1 (en) | Method to detect molecular binding by surface-enhanced Raman spectroscopy | |
| WO2017066537A1 (en) | Multiplexed detection of circulating tumor antigens and epigenetic markers using plasmon-enhanced raman spectroscopic assays | |
| Kumar et al. | Ultrasensitive melanoma biomarker detection using a microchip SERS immunoassay with anisotropic Au–Ag alloy nanoboxes | |
| US20050214789A1 (en) | Sensors for biomolecular detection and cell classification | |
| WO2009137713A2 (en) | Particle-based electrostatic sensing and detection | |
| US8119350B2 (en) | Method of surface plasmon resonance (SPR) to detect genomic aberrations in patients with multiple myeloma | |
| US20060024230A1 (en) | Customized therapeutics and in situ diagnostics | |
| Herron et al. | Planar waveguide biosensors for nucleic acid hybridization reactions | |
| WO2003093790A2 (en) | Sensors for biomolecular detection and cell classification | |
| US20090311699A1 (en) | Method of surface plasmon resonance (spr) to detect genomic aberrations in patients with chronic lymphocytic leukemia | |
| US20090081799A1 (en) | Analyte evaluation device and analyte evaluation method | |
| KR20100081539A (ko) | 혼성화 반응의 모니터링이 가능한 바이오칩 | |
| Carloni | A novel optical chip for affinity biosensors based on fluorescence anisotropy | |
| JP2003254968A (ja) | 生体成分検出方法および生体成分検出用マイクロアレイ | |
| KR20100081541A (ko) | 바이오칩 상의 혼성화 모니터링 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110304 |
|
| A524 | Written submission of copy of amendment under section 19 (pct) |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20110304 |