JP2008540367A - 新規結晶性臭化チオトロピウム - Google Patents
新規結晶性臭化チオトロピウム Download PDFInfo
- Publication number
- JP2008540367A JP2008540367A JP2008509409A JP2008509409A JP2008540367A JP 2008540367 A JP2008540367 A JP 2008540367A JP 2008509409 A JP2008509409 A JP 2008509409A JP 2008509409 A JP2008509409 A JP 2008509409A JP 2008540367 A JP2008540367 A JP 2008540367A
- Authority
- JP
- Japan
- Prior art keywords
- tiotropium bromide
- crystalline
- solvate
- ray powder
- crystalline tiotropium
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D451/00—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof
- C07D451/02—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof
- C07D451/04—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof with hetero atoms directly attached in position 3 of the 8-azabicyclo [3.2.1] octane or in position 7 of the 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring system
- C07D451/06—Oxygen atoms
- C07D451/10—Oxygen atoms acylated by aliphatic or araliphatic carboxylic acids, e.g. atropine, scopolamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Pulmonology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
本発明は、臭化チオトロピウムの新規な結晶物、その製造方法、及び、呼吸器系疾患の治療用、とりわけ慢性閉塞性肺疾患(COPD)や喘息の治療用の医薬組成物を製造するための前記臭化チオトロピウムの新規な結晶物の使用に関する。
Description
本発明は、新規な臭化チオトロピウム結晶物、その調製方法、及び、呼吸器系疾患の治療用、とりわけ慢性閉塞性肺疾患(COPD)や喘息の治療用の医薬組成物を製造するための前記新規な臭化チオトロピウムの結晶物の使用に関する。
(発明の背景)
臭化チオトロピウムは、欧州特許出願EP418716A1から公知であり、下記の化学構造を有する。
(発明の背景)
臭化チオトロピウムは、欧州特許出願EP418716A1から公知であり、下記の化学構造を有する。
臭化チオトロピウムは効力が長く持続する非常に効果的な抗コリン作用薬であり、呼吸器系の症状、特に慢性閉塞性肺疾患(COPD)及び喘息の治療に使用できる。チオトロピウムという用語は遊離アンモニウムカチオンを意味する。
臭化チオトロピウムは吸入による投与が好ましい。好適な吸入性粉末を適切なカプセルに充填したもの(インハレット)を使用することができる。あるいは、好適な吸入エアロゾルを使って投与することができる。このエアロゾルには、例えば、HFA134a、HFA227又はその混合物を噴射剤ガスとして含有する粉末状の吸入エアロゾルも含まれる。
医薬有効成分を吸入投与するのに適した前記医薬組成物を正確に製造する基礎となるのは、有効成分自体の性状に関連した様々なパラメータである。臭化チオトロピウムのように吸入粉末又は吸入可能なエアロゾル状態にして使用する医薬組成物においては、製剤を調製するのに結晶性の有効成分を粉砕(微粉砕)した状態で用いる。医薬製剤の製薬上の品質として有効成分の結晶改質(crystalline modification)が常に同じであることが要求されるので、結晶性有効成分の安定性及び特性は、この観点から厳しい要求の影響を受けることになる。有効成分については、均一かつ明確に規定された結晶改質を有する状態に調製することがとりわけ望ましい。また、長期にわたる保存期間中も高い安定性を有することを特徴とする結晶物として有効成分を調製することも特に望ましい。たとえば、結晶改質の吸湿傾向が低いほど、その結晶構造の物理的安定性は向上する。
そこで本発明の目的は、前記記載の高い要求を満足する新規な臭化チオトロピウム化合物の安定した結晶物であって、医薬的に有効な成分で構成される結晶物を提供することである。
臭化チオトロピウムは吸入による投与が好ましい。好適な吸入性粉末を適切なカプセルに充填したもの(インハレット)を使用することができる。あるいは、好適な吸入エアロゾルを使って投与することができる。このエアロゾルには、例えば、HFA134a、HFA227又はその混合物を噴射剤ガスとして含有する粉末状の吸入エアロゾルも含まれる。
医薬有効成分を吸入投与するのに適した前記医薬組成物を正確に製造する基礎となるのは、有効成分自体の性状に関連した様々なパラメータである。臭化チオトロピウムのように吸入粉末又は吸入可能なエアロゾル状態にして使用する医薬組成物においては、製剤を調製するのに結晶性の有効成分を粉砕(微粉砕)した状態で用いる。医薬製剤の製薬上の品質として有効成分の結晶改質(crystalline modification)が常に同じであることが要求されるので、結晶性有効成分の安定性及び特性は、この観点から厳しい要求の影響を受けることになる。有効成分については、均一かつ明確に規定された結晶改質を有する状態に調製することがとりわけ望ましい。また、長期にわたる保存期間中も高い安定性を有することを特徴とする結晶物として有効成分を調製することも特に望ましい。たとえば、結晶改質の吸湿傾向が低いほど、その結晶構造の物理的安定性は向上する。
そこで本発明の目的は、前記記載の高い要求を満足する新規な臭化チオトロピウム化合物の安定した結晶物であって、医薬的に有効な成分で構成される結晶物を提供することである。
(発明の詳細な説明)
工業生産により得られた粗生成物を精製する工程で採用する条件の選択により、臭化チオトロピウムは異なる結晶改質で得られることがわかった。
この結晶改質の違いは、結晶化の際に使用する溶媒の選択や結晶化工程で採用する操作条件の選択により決定されて得ることができることもわかってきた。
臭化チオトロピウム一水和物は特定の反応条件を選択することにより結晶性の状態で得ることができることが、従来技術のなかでもWO02/30928に最初の記載がみられるが、驚くべきことに、これを出発物質として、前記記載の高い要求を満たす臭化チオトロピウムのいくつかの結晶改質が得られ、それにより本発明に存在する問題を解決することができることがわかった。
したがって、本発明は新規な結晶性臭化チオトロピウム無水物に関するものである。本発明の範囲で臭化チオトロピウム無水物という用語に言及するときは、本発明による新規な結晶性臭化チオトロピウム無水物に言及するものとみなされる。
本発明の別の態様は、この新規な無水臭化チオトロピウムの結晶物の調製方法に関するもので、後述の説明セクションで例を挙げて説明する。
工業生産により得られた粗生成物を精製する工程で採用する条件の選択により、臭化チオトロピウムは異なる結晶改質で得られることがわかった。
この結晶改質の違いは、結晶化の際に使用する溶媒の選択や結晶化工程で採用する操作条件の選択により決定されて得ることができることもわかってきた。
臭化チオトロピウム一水和物は特定の反応条件を選択することにより結晶性の状態で得ることができることが、従来技術のなかでもWO02/30928に最初の記載がみられるが、驚くべきことに、これを出発物質として、前記記載の高い要求を満たす臭化チオトロピウムのいくつかの結晶改質が得られ、それにより本発明に存在する問題を解決することができることがわかった。
したがって、本発明は新規な結晶性臭化チオトロピウム無水物に関するものである。本発明の範囲で臭化チオトロピウム無水物という用語に言及するときは、本発明による新規な結晶性臭化チオトロピウム無水物に言及するものとみなされる。
本発明の別の態様は、この新規な無水臭化チオトロピウムの結晶物の調製方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウム無水物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=9.84Å、8.89Å、8.10Å、7.54Å、5.89Å、4.90Å、4.84Å及び4.05Åを有することを特徴とする。詳細については表1参照。
この発明の結晶性臭化チオトロピウム無水物の粉末X線ダイアグラムを図1に示す。
さらに、この発明の結晶性臭化チオトロピウム無水物は、DSCによる熱分析において230℃で吸熱ピークが現れ、この結晶形の融解を示すことを特徴とする。
この発明の結晶性臭化チオトロピウム無水物のDSCダイアグラムを図2に示す。
本発明の別の態様は、新規な臭化チオトロピウムの結晶性溶媒和物に関する。この発明の態様の1つは、結晶性臭化チオトロピウムのメタノール溶媒和物に関する。本発明の別な態様は、この新規な結晶性臭化チオトロピウムのメタノール溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのメタノール溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=9.00Å、8.10Å、6.58Å、5.77Å、4.94Å、4.50Å、4.24Å及び4.14Åを有することを特徴とする。詳細については表2参照。
結晶性臭化チオトロピウムのメタノール溶媒和物の粉末X線ダイアグラムを、図3に示す。
さらに、この発明の結晶性臭化チオトロピウムのメタノール溶媒和物は、DSCによる熱分析において226℃で強い吸熱ピークが現れ、この結晶物の融解を示すことを特徴とする。さらに、小さな吸熱事象が132℃で現れ、脱溶媒和が観察される。この発明の結晶性臭化チオトロピウムのメタノール溶媒和物のDSCダイアグラムを図4に示す。
この発明の結晶性臭化チオトロピウム無水物の粉末X線ダイアグラムを図1に示す。
さらに、この発明の結晶性臭化チオトロピウム無水物は、DSCによる熱分析において230℃で吸熱ピークが現れ、この結晶形の融解を示すことを特徴とする。
この発明の結晶性臭化チオトロピウム無水物のDSCダイアグラムを図2に示す。
本発明の別の態様は、新規な臭化チオトロピウムの結晶性溶媒和物に関する。この発明の態様の1つは、結晶性臭化チオトロピウムのメタノール溶媒和物に関する。本発明の別な態様は、この新規な結晶性臭化チオトロピウムのメタノール溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのメタノール溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=9.00Å、8.10Å、6.58Å、5.77Å、4.94Å、4.50Å、4.24Å及び4.14Åを有することを特徴とする。詳細については表2参照。
結晶性臭化チオトロピウムのメタノール溶媒和物の粉末X線ダイアグラムを、図3に示す。
さらに、この発明の結晶性臭化チオトロピウムのメタノール溶媒和物は、DSCによる熱分析において226℃で強い吸熱ピークが現れ、この結晶物の融解を示すことを特徴とする。さらに、小さな吸熱事象が132℃で現れ、脱溶媒和が観察される。この発明の結晶性臭化チオトロピウムのメタノール溶媒和物のDSCダイアグラムを図4に示す。
本発明の別の実施形態は、新規な結晶性臭化チオトロピウムのエタノール溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムのエタノール溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのエタノール溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.91Å、8.01Å、6.60Å、5.78Å、4.90Å、4.46Å、4.24Å及び4.15Åを有することを特徴とする。詳細については表3参照。
結晶性臭化チオトロピウムのエタノール溶媒和物の粉末X線ダイアグラムを、図5に示す。
さらに、この発明の結晶性臭化チオトロピウムのエタノール溶媒和物は、DSCによる熱分析において226℃で吸熱ピークが現れ、この結晶物の融解を示すことを特徴とする。さらに、小さな吸熱事象が157℃で現れ、脱溶媒和が観察される。
この発明の結晶性臭化チオトロピウムのエタノール溶媒和物のDSCダイアグラムを図6に示す。
本発明のさらに別の実施形態は新規な結晶性臭化チオトロピウムのイソプロパノール溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムのイソプロパノール溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのエタノール溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.91Å、8.01Å、6.60Å、5.78Å、4.90Å、4.46Å、4.24Å及び4.15Åを有することを特徴とする。詳細については表3参照。
結晶性臭化チオトロピウムのエタノール溶媒和物の粉末X線ダイアグラムを、図5に示す。
さらに、この発明の結晶性臭化チオトロピウムのエタノール溶媒和物は、DSCによる熱分析において226℃で吸熱ピークが現れ、この結晶物の融解を示すことを特徴とする。さらに、小さな吸熱事象が157℃で現れ、脱溶媒和が観察される。
この発明の結晶性臭化チオトロピウムのエタノール溶媒和物のDSCダイアグラムを図6に示す。
本発明のさらに別の実施形態は新規な結晶性臭化チオトロピウムのイソプロパノール溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムのイソプロパノール溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのイソプロパノール溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.96Å、8.06Å、6.66Å、5.80Å、4.91Å、4.48Å、4.28Å及び4.17Åを有することを特徴とする。詳細については表4参照。
結晶性臭化チオトロピウムのイソプロパノール溶媒和物の粉末X線ダイアグラムを図7に示す。
さらに、この発明の結晶性臭化チオトロピウムのイソプロパノール溶媒和物は、DSCによる熱分析において264℃で発熱ピークが現れ、この結晶物の熱分解を示すことを特徴とする。さらに、小さな2つの吸熱事象が117℃と214℃で現れ、脱溶媒和及び融解が観察される。
この発明の結晶性臭化チオトロピウムのイソプロパノール溶媒和物のDSCダイアグラムを図8に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムのテトラヒドロフラン(THF)溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムのTHF溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのTHF溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.97Å、8.03Å、6.60Å、5.80Å、4.92Å、4.48Å、4.30Å及び4.15Åを有することを特徴とする。詳細については表5参照。
結晶性臭化チオトロピウムのTHF溶媒和物の粉末X線ダイアグラムを図9に示す。
結晶性臭化チオトロピウムのイソプロパノール溶媒和物の粉末X線ダイアグラムを図7に示す。
さらに、この発明の結晶性臭化チオトロピウムのイソプロパノール溶媒和物は、DSCによる熱分析において264℃で発熱ピークが現れ、この結晶物の熱分解を示すことを特徴とする。さらに、小さな2つの吸熱事象が117℃と214℃で現れ、脱溶媒和及び融解が観察される。
この発明の結晶性臭化チオトロピウムのイソプロパノール溶媒和物のDSCダイアグラムを図8に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムのテトラヒドロフラン(THF)溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムのTHF溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのTHF溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.97Å、8.03Å、6.60Å、5.80Å、4.92Å、4.48Å、4.30Å及び4.15Åを有することを特徴とする。詳細については表5参照。
結晶性臭化チオトロピウムのTHF溶媒和物の粉末X線ダイアグラムを図9に示す。
さらに、この発明の結晶性臭化チオトロピウムのTHF溶媒和物は、DSCによる熱分析において、この結晶物の融解を示す216℃での吸熱ピークと熱分解を示す275℃での発熱ピークを特徴とする。さらに、小さな吸熱事象が125℃で現れ、脱溶媒和が観察される。
この発明の結晶性臭化チオトロピウムのTHF溶媒和物のDSCダイアグラムを図10に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.92Å、8.08Å、6.59Å、5.79Å、4.92Å、4.51Å、4.27Å及び4.15Åを有することを特徴とする。詳細については表6参照。
結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の粉末X線ダイアグラムを図11に示す。
さらに、この発明の結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物は、DSCによる熱分析において、223℃でこの結晶物の融解を示す吸熱ピークが現れることを特徴とする。さらに、小さな吸熱事象が191℃で現れ、脱溶媒和が観察される。
この発明の結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物のDSCダイアグラムを図12に示す。
この発明の結晶性臭化チオトロピウムのTHF溶媒和物のDSCダイアグラムを図10に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.92Å、8.08Å、6.59Å、5.79Å、4.92Å、4.51Å、4.27Å及び4.15Åを有することを特徴とする。詳細については表6参照。
結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の粉末X線ダイアグラムを図11に示す。
さらに、この発明の結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物は、DSCによる熱分析において、223℃でこの結晶物の融解を示す吸熱ピークが現れることを特徴とする。さらに、小さな吸熱事象が191℃で現れ、脱溶媒和が観察される。
この発明の結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物のDSCダイアグラムを図12に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムのジメチルホルムアミド(DMF)溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムのDMF溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムのDMF溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=10.03Å、8.95Å、8.02Å、7.54Å、6.82Å、6.55Å、5.78Å、5.69Å、5.00Å、4.94Å、4.48Å、4.21Å及び4.11Åを有することを特徴とする。詳細については表7参照。
結晶性臭化チオトロピウムのDMF溶媒和物の粉末X線ダイアグラムを図13に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.91Å、8.02Å、6.56Å、5.79Å、5.43Å、4.91Å、4.45Å、4.22Å及び4.13Åを有することを特徴とする。詳細については表8参照。
結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の粉末X線ダイアグラムを図14に示す。
さらに、この発明の結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物は、DSCによる熱分析において、218℃でこの結晶物の融解を示す吸熱ピークが現れることを特徴とする。さらに、小さな吸熱事象が136℃で現れ、脱溶媒和が観察される。この発明の結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物のDSCダイアグラムを図15に示す。
本発明による結晶性臭化チオトロピウムのDMF溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=10.03Å、8.95Å、8.02Å、7.54Å、6.82Å、6.55Å、5.78Å、5.69Å、5.00Å、4.94Å、4.48Å、4.21Å及び4.11Åを有することを特徴とする。詳細については表7参照。
結晶性臭化チオトロピウムのDMF溶媒和物の粉末X線ダイアグラムを図13に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=8.91Å、8.02Å、6.56Å、5.79Å、5.43Å、4.91Å、4.45Å、4.22Å及び4.13Åを有することを特徴とする。詳細については表8参照。
結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の粉末X線ダイアグラムを図14に示す。
さらに、この発明の結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物は、DSCによる熱分析において、218℃でこの結晶物の融解を示す吸熱ピークが現れることを特徴とする。さらに、小さな吸熱事象が136℃で現れ、脱溶媒和が観察される。この発明の結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物のDSCダイアグラムを図15に示す。
本発明のさらに別の実施形態は、新規な結晶性臭化チオトロピウムの1−ブタノール溶媒和物に関する。本発明の別な態様は、新規な結晶性臭化チオトロピウムの1−ブタノール溶媒和物の製造方法に関するもので、後述の説明セクションで例を挙げて説明する。
本発明による結晶性臭化チオトロピウムの1−ブタノール溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=9.00Å、8.12Å、6.66Å、5.80Å、5.40Å、4.94Å、4.51Å、4.29Å及び4.17Åを有することを特徴とする。詳細については表9参照。
結晶性臭化チオトロピウムの1−ブタノール溶媒和物の粉末X線ダイアグラムを図16に示す。
粉末X線回折パターンをよく見ると、溶媒和物は異なるがダイアグラムが非常に類似していることがわかる。これは、臭化チオトロピウムが互いに同型構造となる数種の溶媒和物を形成することを示している。
また、本発明は、呼吸器系疾患の治療用の、とりわけCOPD及び/又は喘息の治療用の医薬組成物を製造するための、本発明の臭化チオトロピウム結晶物の使用に関する。
また、本発明は、本発明の臭化チオトロピウム結晶物の製造方法に関する。
本発明は、結晶性臭化チオトロピウム一水和物のジメチルホルムアミド溶液をアセトニトリルに添加し、得られた混合物を20℃未満、好ましくは10℃未満に冷却し、得られた結晶を単離することを特徴とする、本発明による結晶性臭化チオトロピウム無水物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウム無水物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明による結晶性臭化チオトロピウムの1−ブタノール溶媒和物は、粉末X線ダイアグラムにおいて以下の特性ピーク値(最も顕著なピーク値):d=9.00Å、8.12Å、6.66Å、5.80Å、5.40Å、4.94Å、4.51Å、4.29Å及び4.17Åを有することを特徴とする。詳細については表9参照。
結晶性臭化チオトロピウムの1−ブタノール溶媒和物の粉末X線ダイアグラムを図16に示す。
粉末X線回折パターンをよく見ると、溶媒和物は異なるがダイアグラムが非常に類似していることがわかる。これは、臭化チオトロピウムが互いに同型構造となる数種の溶媒和物を形成することを示している。
また、本発明は、呼吸器系疾患の治療用の、とりわけCOPD及び/又は喘息の治療用の医薬組成物を製造するための、本発明の臭化チオトロピウム結晶物の使用に関する。
また、本発明は、本発明の臭化チオトロピウム結晶物の製造方法に関する。
本発明は、結晶性臭化チオトロピウム一水和物のジメチルホルムアミド溶液をアセトニトリルに添加し、得られた混合物を20℃未満、好ましくは10℃未満に冷却し、得られた結晶を単離することを特徴とする、本発明による結晶性臭化チオトロピウム無水物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウム無水物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
また、本発明は、無水臭化チオトロピウムをメタノール含有溶媒、好ましくはメタノールとアセトンとを含む溶媒混合物、さらに好ましくはメタノールとアセトンと水とを含む溶媒混合物から再結晶させるることを特徴とする、結晶性臭化チオトロピウムのメタノール溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのメタノール溶媒和物を調製するための出発物質としての、無水臭化チオトロピウムの使用に関するものである。
また、本発明は、無水臭化チオトロピウムのエタノール含有溶媒からの再結晶を、好ましくは加熱下で行い、引き続き冷却することを特徴とする結晶性臭化チオトロピウムのエタノール溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのエタノール溶媒和物を調製するための出発物質としての、無水臭化チオトロピウムの使用に関する。
また、本発明は、結晶性臭化チオトロピウム一水和物のイソプロパノール溶液を20℃未満、好ましくは10℃未満の温度に冷却し、得られた結晶を単離することを特徴とする結晶性臭化チオトロピウムのイソプロパノール溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのイソプロパノール溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
また、本発明は、無水臭化チオトロピウムのエタノール含有溶媒からの再結晶を、好ましくは加熱下で行い、引き続き冷却することを特徴とする結晶性臭化チオトロピウムのエタノール溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのエタノール溶媒和物を調製するための出発物質としての、無水臭化チオトロピウムの使用に関する。
また、本発明は、結晶性臭化チオトロピウム一水和物のイソプロパノール溶液を20℃未満、好ましくは10℃未満の温度に冷却し、得られた結晶を単離することを特徴とする結晶性臭化チオトロピウムのイソプロパノール溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのイソプロパノール溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物を好適なアルコール、好ましくはベンジルアルコールに溶解させた溶液をTHF含有溶媒、好ましくは、純粋なTHFに添加することを特徴とする結晶性臭化チオトロピウムのTHF溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのTHF溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物を好適なアルコール、好ましくはベンジルアルコールに溶解させた溶液を1,4−ジオキサン含有溶媒、好ましくは、純粋な1,4−ジオキサンに添加することを特徴とする結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物のDMF溶液をメチルt−ブチルエーテルに添加することを特徴とする結晶性臭化チオトロピウムのDMF溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのDMF溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物を好適なアルコール、好ましくはベンジルアルコールに溶解させた溶液を、塩化メチレンとメチルエチルケトンとを含む溶媒に添加し、得られた混合物をさらに20℃未満、好ましくは10℃未満の温度に冷却してもよいことを特徴とする結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物を好適なアルコール、好ましくはベンジルアルコールに溶解させた溶液を1,4−ジオキサン含有溶媒、好ましくは、純粋な1,4−ジオキサンに添加することを特徴とする結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物のDMF溶液をメチルt−ブチルエーテルに添加することを特徴とする結晶性臭化チオトロピウムのDMF溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムのDMF溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物を好適なアルコール、好ましくはベンジルアルコールに溶解させた溶液を、塩化メチレンとメチルエチルケトンとを含む溶媒に添加し、得られた混合物をさらに20℃未満、好ましくは10℃未満の温度に冷却してもよいことを特徴とする結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
本発明は、結晶性臭化チオトロピウム一水和物を好適なアルコール、好ましくはベンジルアルコールに溶解させた溶液を、1−ブタノール含有溶媒、好ましくは純粋な1−ブタノールに添加し、得られた混合物をさらに20℃未満、好ましくは10℃未満の温度に冷却してもよいことを特徴とする結晶性臭化チオトロピウムの1−ブタノール溶媒和物の調製方法に関する。さらに本発明は、結晶性臭化チオトロピウムの1−ブタノール溶媒和物を調製するための出発物質としての、結晶性臭化チオトロピウム一水和物の使用に関する。
下記の実施例は本発明をさらに詳細に説明することを意図とするものであって、本発明の範囲を以下の例としての実施形態に制限するものではない。
A)本発明による結晶物の合成例
実施例1:結晶性臭化チオトロピウム無水物
臭化チオトロピウム一水和物(WO02/30928より調製)の無水ジメチルホルムアミド溶液(21μL、70mg/mL)を、無水アセトニトリル(100μL)に添加した。この溶液を5℃に冷却し、一晩温度を保った(incubate)。結晶が形成され、母液を取り除いて回収した。
実施例2:結晶性臭化チオトロピウム無水物
臭化チオトロピウム一水和物(WO02/30928より調製、54.3mg)を無水ジメチルホルムアミド(0.6mL)に溶解させ、無水アセトニトリル(3.0mL)に添加した。上記実施例1の結晶から結晶化させた。5℃で一晩おいて結晶が形成されたので、濾過により回収した。結晶性の固体を別の無水アセトニトリル(2mL)ですぐに洗浄し、風乾させた。
下記の実施例は本発明をさらに詳細に説明することを意図とするものであって、本発明の範囲を以下の例としての実施形態に制限するものではない。
A)本発明による結晶物の合成例
実施例1:結晶性臭化チオトロピウム無水物
臭化チオトロピウム一水和物(WO02/30928より調製)の無水ジメチルホルムアミド溶液(21μL、70mg/mL)を、無水アセトニトリル(100μL)に添加した。この溶液を5℃に冷却し、一晩温度を保った(incubate)。結晶が形成され、母液を取り除いて回収した。
実施例2:結晶性臭化チオトロピウム無水物
臭化チオトロピウム一水和物(WO02/30928より調製、54.3mg)を無水ジメチルホルムアミド(0.6mL)に溶解させ、無水アセトニトリル(3.0mL)に添加した。上記実施例1の結晶から結晶化させた。5℃で一晩おいて結晶が形成されたので、濾過により回収した。結晶性の固体を別の無水アセトニトリル(2mL)ですぐに洗浄し、風乾させた。
実施例3:結晶性臭化チオトロピウムのメタノール溶媒和物
無水臭化チオトロピウム(5.0mg、WO03/000265より得ることができる)を、メタノール/アセトン/水混合物50μL(66:33:1)から再結晶させた。再結晶は、溶液の部分的な蒸発(約25μL)と-20℃での保温により誘導した。溶媒和物も無水メタノールからの再結晶で作製する。
実施例4:結晶性臭化チオトロピウムのエタノール溶媒和物
無水臭化チオトロピウム(50mg、WO03/000265より得ることができる)を加熱してエタノール(500μL)から再結晶させた後、冷却し、実施例3の結晶を用いて結晶化させた。
実施例5:結晶性臭化チオトロピウムのイソプロパノール溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.070mL、100mg/mL)を、イソプロパノール(1mL、無水イソプロパノール、分子ふるい上に用意したもの)に添加し、5℃で一晩置く。得られた結晶を母液から単離した。
実施例6:結晶性臭化チオトロピウムのTHF溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.08mL、100mg/mL)を、攪拌しながらテトラヒドロフラン(1mL)に滴下した。混合によりすぐに溶媒和物が形成されたので、濾過して回収した。
無水臭化チオトロピウム(5.0mg、WO03/000265より得ることができる)を、メタノール/アセトン/水混合物50μL(66:33:1)から再結晶させた。再結晶は、溶液の部分的な蒸発(約25μL)と-20℃での保温により誘導した。溶媒和物も無水メタノールからの再結晶で作製する。
実施例4:結晶性臭化チオトロピウムのエタノール溶媒和物
無水臭化チオトロピウム(50mg、WO03/000265より得ることができる)を加熱してエタノール(500μL)から再結晶させた後、冷却し、実施例3の結晶を用いて結晶化させた。
実施例5:結晶性臭化チオトロピウムのイソプロパノール溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.070mL、100mg/mL)を、イソプロパノール(1mL、無水イソプロパノール、分子ふるい上に用意したもの)に添加し、5℃で一晩置く。得られた結晶を母液から単離した。
実施例6:結晶性臭化チオトロピウムのTHF溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.08mL、100mg/mL)を、攪拌しながらテトラヒドロフラン(1mL)に滴下した。混合によりすぐに溶媒和物が形成されたので、濾過して回収した。
実施例7:結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(1.1mL、50mg/mL)を、攪拌しながら1,4−ジオキサン(5mL)に滴下した。溶媒和物が形成されたので、濾過して回収し、風乾させた。
実施例8:結晶性臭化チオトロピウムのDMF溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のDMF溶液(0.15mL、83mg/mL)を、メチルt−ブチルエーテル(2mL)に添加した。非晶質固形物が形成されたので、2日間放置した。得られた結晶質溶媒和物を濾過して特性を調べた(characterize)。
実施例9:結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.17mL、90mg/mL)を、塩化メチレン(0.5mL)及びメチルエチルケトン(0.5mL)に滴下した。5℃で溶液を一晩置いた。混合溶媒和の大きく透明な結晶が形成されたので、余分な母液を取り除いた。
実施例10:結晶性臭化チオトロピウムの1−ブタノール溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.17mL、90mg/mL)を、1−ブタノール(0.5mL)及びメチルt−ブチルエーテル(0.5mL)に滴下した。5℃で溶液を一晩置いた。結晶性の白色固体として溶媒和物が形成されたので、濾過を行い分析した。
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(1.1mL、50mg/mL)を、攪拌しながら1,4−ジオキサン(5mL)に滴下した。溶媒和物が形成されたので、濾過して回収し、風乾させた。
実施例8:結晶性臭化チオトロピウムのDMF溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のDMF溶液(0.15mL、83mg/mL)を、メチルt−ブチルエーテル(2mL)に添加した。非晶質固形物が形成されたので、2日間放置した。得られた結晶質溶媒和物を濾過して特性を調べた(characterize)。
実施例9:結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.17mL、90mg/mL)を、塩化メチレン(0.5mL)及びメチルエチルケトン(0.5mL)に滴下した。5℃で溶液を一晩置いた。混合溶媒和の大きく透明な結晶が形成されたので、余分な母液を取り除いた。
実施例10:結晶性臭化チオトロピウムの1−ブタノール溶媒和物
WO02/30928に準拠して得られた臭化チオトロピウム一水和物のベンジルアルコール溶液(0.17mL、90mg/mL)を、1−ブタノール(0.5mL)及びメチルt−ブチルエーテル(0.5mL)に滴下した。5℃で溶液を一晩置いた。結晶性の白色固体として溶媒和物が形成されたので、濾過を行い分析した。
B)分析方法
B.1 粉末X線回折
銅をX線源(Cu/Kα 1.54056Å)とし、マニュアルXY軸ステージ及び0.3mmコリメータを備えたRigaku D/Max 高速X線回折計(Rapid X-ray Diffractometer)を使用して、粉末X線回折パターンを得た。0.3mmのホウ素リッチなガラス製毛管の一端を切り取り、開口部を作り、その一端をサンプルの層中に入れてサンプルを毛管に充填した。サンプルを充填した毛管をXY軸ステージに固定されたホルダに搭載した。周囲条件下、電源設定を40mAで46kVの反射モードに設定し、オメガ軸のまわりを1°/秒の割合で0〜5°振動させ、ファイ(phi)軸の周りを2°/秒の割合でスピンさせてX線回折図形を得た。得られたX線回折図形を、装置に備えられているRINT Rapid displayソフトウェアのcylint utilityを用いて、ステップサイズ0.02°で2〜40°の2θにわたり、また、0〜360°のカイ(chi)(1セグメント)で積分した。ダークカウント値はシステムキャリブレーションごとに8に設定し、ノーマライゼーションは平均に設定し、オメガオフセットは180°に設定した。カイオフセット又はファイオフセットは積分には用いなかった。回折パターンはJadeソフトウェアを用いて見たが、このソフトウェアは回折パターンからバックグラウンド放射線を取り除きピーク位置を指定するために用いられた。
B.1 粉末X線回折
銅をX線源(Cu/Kα 1.54056Å)とし、マニュアルXY軸ステージ及び0.3mmコリメータを備えたRigaku D/Max 高速X線回折計(Rapid X-ray Diffractometer)を使用して、粉末X線回折パターンを得た。0.3mmのホウ素リッチなガラス製毛管の一端を切り取り、開口部を作り、その一端をサンプルの層中に入れてサンプルを毛管に充填した。サンプルを充填した毛管をXY軸ステージに固定されたホルダに搭載した。周囲条件下、電源設定を40mAで46kVの反射モードに設定し、オメガ軸のまわりを1°/秒の割合で0〜5°振動させ、ファイ(phi)軸の周りを2°/秒の割合でスピンさせてX線回折図形を得た。得られたX線回折図形を、装置に備えられているRINT Rapid displayソフトウェアのcylint utilityを用いて、ステップサイズ0.02°で2〜40°の2θにわたり、また、0〜360°のカイ(chi)(1セグメント)で積分した。ダークカウント値はシステムキャリブレーションごとに8に設定し、ノーマライゼーションは平均に設定し、オメガオフセットは180°に設定した。カイオフセット又はファイオフセットは積分には用いなかった。回折パターンはJadeソフトウェアを用いて見たが、このソフトウェアは回折パターンからバックグラウンド放射線を取り除きピーク位置を指定するために用いられた。
B.2 示差走査熱分析(DSC)
サンプルの一部をアルミ製の密封型試料皿で秤量した後、試料皿を圧着により封止した。オートサンプラー(autosampler)を装備した装置に試料皿を充填した。空のアルミ製密封型皿を参照用として使用し、Tmin(通常、室温)からTmax(通常、350℃)まで10℃/分の速度でサンプルを個々に加熱して、温度記録図を得た。乾燥窒素を試料のパージガスとして使用し、流量50mL/分に設定した。装置に搭載した分析用ソフトウェアを使って温度遷移を観察した。
結晶性臭化チオトロピウム無水物の粉末X線回折パターン
前記方法により得られた臭化チオトロピウム無水物の結晶性は高い。これをさらにX線粉末回折により調べた。本発明による臭化チオトロピウム無水物について得られたX線粉末ダイアグラムを図1に示す。
下表1は特性ピーク及び標準化強度(standardised intensities)を示す。
サンプルの一部をアルミ製の密封型試料皿で秤量した後、試料皿を圧着により封止した。オートサンプラー(autosampler)を装備した装置に試料皿を充填した。空のアルミ製密封型皿を参照用として使用し、Tmin(通常、室温)からTmax(通常、350℃)まで10℃/分の速度でサンプルを個々に加熱して、温度記録図を得た。乾燥窒素を試料のパージガスとして使用し、流量50mL/分に設定した。装置に搭載した分析用ソフトウェアを使って温度遷移を観察した。
結晶性臭化チオトロピウム無水物の粉末X線回折パターン
前記方法により得られた臭化チオトロピウム無水物の結晶性は高い。これをさらにX線粉末回折により調べた。本発明による臭化チオトロピウム無水物について得られたX線粉末ダイアグラムを図1に示す。
下表1は特性ピーク及び標準化強度(standardised intensities)を示す。
上記表において、「2θ[°]」の値は回折角度を「度」で表し、d[Å]の値は指定の格子面間隔を「Å」で表す。
結晶性臭化チオトロピウムのメタノール溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムのメタノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのメタノール溶媒和物について得られたX線粉末ダイアグラムを図3に示す。下表2は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムのメタノール溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムのメタノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのメタノール溶媒和物について得られたX線粉末ダイアグラムを図3に示す。下表2は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムのエタノール溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムのメタノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのメタノール溶媒和物について得られたX線粉末ダイアグラムを図5に示す。下表3は特性ピーク及び標準化強度を示す。
前記方法により得られた結晶性臭化チオトロピウムのメタノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのメタノール溶媒和物について得られたX線粉末ダイアグラムを図5に示す。下表3は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムのイソプロパノール溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムのイソプロパノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのイソプロパノール溶媒和物について得られたX線粉末ダイアグラムを図7に示す。下表4は特性ピーク及び標準化強度を示す。
前記方法により得られた結晶性臭化チオトロピウムのイソプロパノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのイソプロパノール溶媒和物について得られたX線粉末ダイアグラムを図7に示す。下表4は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムのTHF溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムのTHF溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのTHF溶媒和物について得られたX線粉末ダイアグラムを図9に示す。下表5は特性ピーク及び標準化強度を示す。
前記方法により得られた結晶性臭化チオトロピウムのTHF溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのTHF溶媒和物について得られたX線粉末ダイアグラムを図9に示す。下表5は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物について得られたX線粉末ダイアグラムを図11に示す。下表6は特性ピーク及び標準化強度を示す。
前記方法により得られた結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物について得られたX線粉末ダイアグラムを図11に示す。下表6は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムのDMF溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムのDMF溶媒和物を、さらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのDMF溶媒和物について得られたX線粉末ダイアグラムを図13に示す。下表7は特性ピーク及び標準化強度を示す。
前記方法により得られた結晶性臭化チオトロピウムのDMF溶媒和物を、さらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムのDMF溶媒和物について得られたX線粉末ダイアグラムを図13に示す。下表7は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物について得られたX線粉末ダイアグラムを図14に示す。下表8は特性ピーク及び標準化強度を示す。
前記方法により得られた結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物について得られたX線粉末ダイアグラムを図14に示す。下表8は特性ピーク及び標準化強度を示す。
結晶性臭化チオトロピウムの1−ブタノール溶媒和物の粉末X線回折パターン
前記方法により得られた結晶性臭化チオトロピウムの1−ブタノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムの1−ブタノール溶媒和物について得られたX線粉末ダイアグラムを図16に示す。下表9は特性ピーク及び標準化強度を示す。
前記方法により得られた結晶性臭化チオトロピウムの1−ブタノール溶媒和物をさらにX線粉末回折により調べた。本発明による結晶性臭化チオトロピウムの1−ブタノール溶媒和物について得られたX線粉末ダイアグラムを図16に示す。下表9は特性ピーク及び標準化強度を示す。
C: 本発明のチオトロピウム臭化物を含む製剤
本発明による結晶質チオトロピウム臭化物は、例えば吸入可能粉末等の吸入投与用医薬製剤、又は、例えば噴射剤含有エアロゾル製剤、とりわけ、吸入可能粉末及び噴射剤含有エアロゾル懸濁剤の調製に非常に適している。このような医薬製剤又は組成物には、本発明の結晶質チオトロピウム臭化物に加えて、ベータ受容体刺激薬(betamimetics)、EGFR阻害剤、PDEIV-阻害剤、ステロイド類及びLTD4拮抗薬から選択される1種以上の更なる有効成分が含まれていてもよく、さらに、医薬的に許容される賦形剤を一緒に含んでいてもよい。
C.1:吸入可能粉末
本発明は、生理的に許容される賦形剤とともに、本発明による結晶質状態のチオトロピウム臭化物を0.001〜3%含む吸入可能な粉末に関するものでもある。チオトロピウムはアンモニウムカチオンを意味する。
本発明では、チオトロピウムを0.01〜2%含有する吸入可能粉末が好ましい。特に、チオトロピウムを約0.03〜1%、好ましくは0.05〜0.6%、特に好ましくは0.06〜0.3%含有する吸入可能粉末が好ましい。最終的には、チオトロピウムを約0.08〜0.22%含有する吸入可能粉末が本発明では特に重要である。
前記に示したチオトロピウムの量は、含有するチオトロピウムカチオンの量を基準とする。
本発明の目的のために使用する賦形剤は、この分野で既知の現行方法を用いて好適な粉砕及び/又は篩分けにより調製される。本発明で使用する賦形剤は、異なる平均粒径を有する賦形剤画分を混合して得た賦形剤混合物でもよい。
本発明による結晶質チオトロピウム臭化物は、例えば吸入可能粉末等の吸入投与用医薬製剤、又は、例えば噴射剤含有エアロゾル製剤、とりわけ、吸入可能粉末及び噴射剤含有エアロゾル懸濁剤の調製に非常に適している。このような医薬製剤又は組成物には、本発明の結晶質チオトロピウム臭化物に加えて、ベータ受容体刺激薬(betamimetics)、EGFR阻害剤、PDEIV-阻害剤、ステロイド類及びLTD4拮抗薬から選択される1種以上の更なる有効成分が含まれていてもよく、さらに、医薬的に許容される賦形剤を一緒に含んでいてもよい。
C.1:吸入可能粉末
本発明は、生理的に許容される賦形剤とともに、本発明による結晶質状態のチオトロピウム臭化物を0.001〜3%含む吸入可能な粉末に関するものでもある。チオトロピウムはアンモニウムカチオンを意味する。
本発明では、チオトロピウムを0.01〜2%含有する吸入可能粉末が好ましい。特に、チオトロピウムを約0.03〜1%、好ましくは0.05〜0.6%、特に好ましくは0.06〜0.3%含有する吸入可能粉末が好ましい。最終的には、チオトロピウムを約0.08〜0.22%含有する吸入可能粉末が本発明では特に重要である。
前記に示したチオトロピウムの量は、含有するチオトロピウムカチオンの量を基準とする。
本発明の目的のために使用する賦形剤は、この分野で既知の現行方法を用いて好適な粉砕及び/又は篩分けにより調製される。本発明で使用する賦形剤は、異なる平均粒径を有する賦形剤画分を混合して得た賦形剤混合物でもよい。
本発明によるインハレット(inhalettes)に使用する吸入可能粉末の製造に用いられる医薬的に許容される賦形剤の例としては、単糖類(例えば、グルコース、フラクトース又はアラビノース)、二糖類(例えば、ラクトース、サッカロース、マルトース、トレハロース)、オリゴ糖類及び多糖類(例えば、デキストラン、デキストリン、マルトデキストリ、デンプン、セルロース)、多価アルコール(例えば、ソルビトール、マンニトール、キシリトール)、シクロデキストリン類(例えば、α−シクロデキストリン、β−シクロデキストリン、χ−シクロデキストリン、メチル−β−シクロデキストリン、ヒドロキシプロピル−β−シクロデキストリン)、アミノ酸類(例えばアルギニン塩酸塩)又は塩類(例えば、塩化ナトリウム、炭酸カルシウム)あるいは、これらの混合物が挙げられる。好ましくは、単糖類又は二糖類が使用され、ラクトース又はグルコースの使用が特に好ましく、限定はされないが、その水和物の形が好ましい。本発明の目的のためには、ラクトースが特に好ましい賦形剤である。
本発明による吸入可能粉末の範囲において、賦形剤の最大平均粒子径は250μmまで、好ましくは10〜150μm、最も好ましくは15〜80μmの範囲である。上記の賦形剤に平均粒径1〜9μmのより微細な賦形剤画分を添加することが適切と考えられる場合もあろう。このより微細な賦形剤も、本願明細書中で既に列挙した使用可能な賦形剤の群から選択される。平均粒子径はこの分野では既知の方法を用いて求めることができる(例えば、WO02/30389のパラグラフA及びC参照)。本発明の吸入可能粉末を作製するためには、最終的に、微粉化した結晶質の無水臭化チオトロピウム、これは0.5〜10μm、特に好ましくは1〜5μmの平均粒子径を有することを好ましくは特徴とするものであるが、この微粉化した結晶質の無水臭化チオトロピウムを賦形剤混合物に添加する(例えば、WO02/30389のパラグラフB参照)。有効成分の粉砕及び微粉砕の方法については、従来技術より公知である。
本発明による吸入可能粉末の範囲において、賦形剤の最大平均粒子径は250μmまで、好ましくは10〜150μm、最も好ましくは15〜80μmの範囲である。上記の賦形剤に平均粒径1〜9μmのより微細な賦形剤画分を添加することが適切と考えられる場合もあろう。このより微細な賦形剤も、本願明細書中で既に列挙した使用可能な賦形剤の群から選択される。平均粒子径はこの分野では既知の方法を用いて求めることができる(例えば、WO02/30389のパラグラフA及びC参照)。本発明の吸入可能粉末を作製するためには、最終的に、微粉化した結晶質の無水臭化チオトロピウム、これは0.5〜10μm、特に好ましくは1〜5μmの平均粒子径を有することを好ましくは特徴とするものであるが、この微粉化した結晶質の無水臭化チオトロピウムを賦形剤混合物に添加する(例えば、WO02/30389のパラグラフB参照)。有効成分の粉砕及び微粉砕の方法については、従来技術より公知である。
指定により調製された賦形剤混合物を賦形剤として使用しない場合は、平均粒径10〜50μmで、0.5〜6μmの10%微細分を含む賦形剤の使用が特に好ましい。
平均粒径とは、レーザー回折計を用いて乾式分散法により測定した体積分布の50%の値を本願明細書では指す。平均粒径は、当該分野で公知の方法を用いて求めることができる(例えば、WO02/30389のパラグラフA及びC参照)。同様に、本件における10%微細分とは、レーザー回折計を用いて測定した体積分布の10%の値を指す。言い換えると、本発明の目的のための10%微細分とは、その数値未満の粒径の範囲に粒子の量の10%(体積分布基準)が存在する粒径を指す。
本発明の範囲においてパーセンテージを示す場合は、特にそれと異なる記載のない限り常に質量%である。
特に好ましい吸入可能粉末においては、賦形剤は平均粒径が12〜35μm、とりわけ好ましくは13〜30μmであることを特徴とする。
また、10%微細分が約1〜4μm、好ましくは約1.5〜3μmである吸入可能粉末が特に好ましい。
本発明の吸入可能粉末は、本発明の基礎となる問題点に応じて、単回投与量の精度という意味において均質性が高いことを特徴とする。この均質性は8%未満の範囲、好ましくは6%未満、もっとも好ましくは4%未満の範囲である。
平均粒径とは、レーザー回折計を用いて乾式分散法により測定した体積分布の50%の値を本願明細書では指す。平均粒径は、当該分野で公知の方法を用いて求めることができる(例えば、WO02/30389のパラグラフA及びC参照)。同様に、本件における10%微細分とは、レーザー回折計を用いて測定した体積分布の10%の値を指す。言い換えると、本発明の目的のための10%微細分とは、その数値未満の粒径の範囲に粒子の量の10%(体積分布基準)が存在する粒径を指す。
本発明の範囲においてパーセンテージを示す場合は、特にそれと異なる記載のない限り常に質量%である。
特に好ましい吸入可能粉末においては、賦形剤は平均粒径が12〜35μm、とりわけ好ましくは13〜30μmであることを特徴とする。
また、10%微細分が約1〜4μm、好ましくは約1.5〜3μmである吸入可能粉末が特に好ましい。
本発明の吸入可能粉末は、本発明の基礎となる問題点に応じて、単回投与量の精度という意味において均質性が高いことを特徴とする。この均質性は8%未満の範囲、好ましくは6%未満、もっとも好ましくは4%未満の範囲である。
出発物質を秤量した後、当該分野で公知の方法を用いて賦形剤と有効成分とから吸入可能粉末を作製する。例えば、WO02/30390の開示を参照することができる。すなわち、本発明の吸入可能粉末は、たとえば以下記載の方法にしたがって得ることができる。本願明細書で後述の製造方法においては、吸入可能粉末についての前記組成に記載の質量比率で各成分が用いられる。
まず、賦形剤と有効成分とを好適な混合容器に投入する。使用する有効成分の平均粒径は0.5〜10μm、好ましくは1〜6μm、特に好ましくは2〜5μmである。好ましくは、賦形剤と有効成分は、メッシュサイズ0.1〜2mm、好ましくは0.3〜1mm、最も好ましくは0.3〜0.6mmの篩又は造粒用篩を使って加えるとよい。混合容器には最初に賦形剤から投入し、そのあと有効成分を加えることが好ましい。混合工程中、この2種の成分は小分けにして加えることが好ましい。とりわけ2種の成分が交互の層になるよう篩で投入するとよい。賦形剤と有効成分という2種の成分は、添加しながら混合を行ってもよい。しかしながら、いったん2種の成分を交互の層になるよう篩で加えてから混合を行うことが好ましい。
また、本発明は、呼吸器系疾患の治療用の、特にCOPD及び/又は喘息の治療用の医薬組成物を調製するための、本発明の吸入粉末の使用に関する。
本発明の吸入粉末は、例えば、計量チャンバーによってリザーバーから1回分の投与量を計量する吸入器(例えば、US4570630A)によって、あるいは、他の手段(例えばDE3625685A)によって投与することができる。
しかしながら、好ましくは、本発明の吸入可能粉末は、カプセルに充填(所謂インハレットを作製)し、例えばWO94/28958に記載されているような吸入器で使用することが好ましい。
まず、賦形剤と有効成分とを好適な混合容器に投入する。使用する有効成分の平均粒径は0.5〜10μm、好ましくは1〜6μm、特に好ましくは2〜5μmである。好ましくは、賦形剤と有効成分は、メッシュサイズ0.1〜2mm、好ましくは0.3〜1mm、最も好ましくは0.3〜0.6mmの篩又は造粒用篩を使って加えるとよい。混合容器には最初に賦形剤から投入し、そのあと有効成分を加えることが好ましい。混合工程中、この2種の成分は小分けにして加えることが好ましい。とりわけ2種の成分が交互の層になるよう篩で投入するとよい。賦形剤と有効成分という2種の成分は、添加しながら混合を行ってもよい。しかしながら、いったん2種の成分を交互の層になるよう篩で加えてから混合を行うことが好ましい。
また、本発明は、呼吸器系疾患の治療用の、特にCOPD及び/又は喘息の治療用の医薬組成物を調製するための、本発明の吸入粉末の使用に関する。
本発明の吸入粉末は、例えば、計量チャンバーによってリザーバーから1回分の投与量を計量する吸入器(例えば、US4570630A)によって、あるいは、他の手段(例えばDE3625685A)によって投与することができる。
しかしながら、好ましくは、本発明の吸入可能粉末は、カプセルに充填(所謂インハレットを作製)し、例えばWO94/28958に記載されているような吸入器で使用することが好ましい。
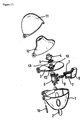
本発明の吸入可能粉末を収容するカプセルが、図17に示すような吸入器を使って投与されることが特に好ましい。この吸入器は、2個の窓2を有するハウジング1と、空気導入口を有し、スクリーンハウジング4を介して固定されたスクリーン5を備えたデッキ3と、デッキ3に連結し、2本の尖ったピン7を備えバネ8に対向して可動する押しボタン9を有する吸入チャンバー6と、スピンドル10を介してハウジング1、デッキ3及びカバー11と連結し、跳ね上げ式で開閉可能なマウスピース12と、流動抵抗を調整するための空気穴13とによって特徴づけられる。
また、本発明は、呼吸器系疾患治療用の、特にCOPD及び/又は喘息の治療用の医薬組成物を調製するための、本発明の結晶質チオトロピウム臭化物の1種又は数種、好ましくは1種を含む吸入可能粉末の使用に関するもので、前記で説明した図17に示す吸入器を使用することを特徴とする。
本発明の結晶質チオトロピウム臭化物を含有する吸入可能粉末を、粉末充填型カプセルを利用して投与するには、カプセル材料が合成プラスチック類、特に好ましくはポリエチレン、ポリカーボネート、ポリエステル、ポリプロピレン及びポリエチレンテレフタレートから選択される材料のカプセルを使用することが特に推奨される。とりわけ好ましい合成プラスチック材料は、ポリエチレン、ポリカーボネート又はポリエチレンテレフタレートである。カプセル材料の1つとして、本発明で特に好ましいポリエチレンを用いる場合、密度が900〜1000kg/m3、好ましくは940〜980kg/m3、さらに好ましくは約960〜970kg/m3のポリエチレン(高密度ポリエチレン)の使用が好ましい。
また、本発明は、呼吸器系疾患治療用の、特にCOPD及び/又は喘息の治療用の医薬組成物を調製するための、本発明の結晶質チオトロピウム臭化物の1種又は数種、好ましくは1種を含む吸入可能粉末の使用に関するもので、前記で説明した図17に示す吸入器を使用することを特徴とする。
本発明の結晶質チオトロピウム臭化物を含有する吸入可能粉末を、粉末充填型カプセルを利用して投与するには、カプセル材料が合成プラスチック類、特に好ましくはポリエチレン、ポリカーボネート、ポリエステル、ポリプロピレン及びポリエチレンテレフタレートから選択される材料のカプセルを使用することが特に推奨される。とりわけ好ましい合成プラスチック材料は、ポリエチレン、ポリカーボネート又はポリエチレンテレフタレートである。カプセル材料の1つとして、本発明で特に好ましいポリエチレンを用いる場合、密度が900〜1000kg/m3、好ましくは940〜980kg/m3、さらに好ましくは約960〜970kg/m3のポリエチレン(高密度ポリエチレン)の使用が好ましい。
本発明による合成プラスチック類は、この分野で公知の製造方法を用いて様々なやり方で加工することができる。本発明ではプラスチック類の射出成形が推奨される。離型剤を使わない射出成形が特に好ましい。この製造方法は十分に定義されており、とりわけ再現可能であるという特徴を有している。
本発明のまた別の態様では、本発明による前記吸入可能粉末を収容する前記カプセルに関するものである。カプセルには吸入可能粉末を約1〜20mg、好ましくは約3〜15mg、最も好ましくは約4〜12mg収容するとよい。本発明による好適な製剤は4〜6mgの吸入可能粉末を含む。本発明によると、本発明の製剤を8〜12mg収容する吸入用カプセルが同様な重要性を有する。
さらに、本発明は、本発明の吸入可能粉末の内容物に特徴がある1個以上の上記カプセルと、図17に準ずる吸入器との組み合わせで構成される吸入キットに関する。
また、本発明は、呼吸器系疾患の治療用の、特にCOPD及び/又は喘息の治療用の医薬組成物を調製するための、本発明による吸入可能粉末の内容物に特徴がある上記カプセルの使用に関する。
本発明による吸入可能粉末を収容する充填済みカプセルは、この分野では公知の方法で空のカプセルに本発明の吸入可能粉末を充填することによって製造される。
本発明のまた別の態様では、本発明による前記吸入可能粉末を収容する前記カプセルに関するものである。カプセルには吸入可能粉末を約1〜20mg、好ましくは約3〜15mg、最も好ましくは約4〜12mg収容するとよい。本発明による好適な製剤は4〜6mgの吸入可能粉末を含む。本発明によると、本発明の製剤を8〜12mg収容する吸入用カプセルが同様な重要性を有する。
さらに、本発明は、本発明の吸入可能粉末の内容物に特徴がある1個以上の上記カプセルと、図17に準ずる吸入器との組み合わせで構成される吸入キットに関する。
また、本発明は、呼吸器系疾患の治療用の、特にCOPD及び/又は喘息の治療用の医薬組成物を調製するための、本発明による吸入可能粉末の内容物に特徴がある上記カプセルの使用に関する。
本発明による吸入可能粉末を収容する充填済みカプセルは、この分野では公知の方法で空のカプセルに本発明の吸入可能粉末を充填することによって製造される。
C.1.1:本発明の吸入可能粉末の例
以下の実施例は本発明をさらに詳細に説明することを意図するものであり、下記の具体的な実施形態に本発明の範囲を限定するものではない。
有効成分
本発明の結晶質チオトロピウム臭化物を用いて、本発明の吸入可能粉末を調製する。こ結晶物はこの分野で公知の方法と同様にして微粉砕する(例えばWO03/078429 A1参照)。本発明の範囲で本発明による結晶質チオトロピウム臭化物の平均粒径に言及する場合、当該分野で公知の測定方法により求められている(例えば、WO03/078429A1、パラグラフD.2参照)。
賦形剤
以下の実施例では、賦形剤としてラクトース一水和物を使用する。このラクトース一水和物は、例えば、Borculo Domo Ingredients社(ボルクロ/オランダ)から、「Lactochem Extra Fine Powder」という製品名で入手することができる。このグレードのラクトースが粒径や比表面積に関する本発明の仕様を満たす。例えば、下記実施例では以下の仕様を有するラクトースのバッチを用いた。
以下の実施例は本発明をさらに詳細に説明することを意図するものであり、下記の具体的な実施形態に本発明の範囲を限定するものではない。
有効成分
本発明の結晶質チオトロピウム臭化物を用いて、本発明の吸入可能粉末を調製する。こ結晶物はこの分野で公知の方法と同様にして微粉砕する(例えばWO03/078429 A1参照)。本発明の範囲で本発明による結晶質チオトロピウム臭化物の平均粒径に言及する場合、当該分野で公知の測定方法により求められている(例えば、WO03/078429A1、パラグラフD.2参照)。
賦形剤
以下の実施例では、賦形剤としてラクトース一水和物を使用する。このラクトース一水和物は、例えば、Borculo Domo Ingredients社(ボルクロ/オランダ)から、「Lactochem Extra Fine Powder」という製品名で入手することができる。このグレードのラクトースが粒径や比表面積に関する本発明の仕様を満たす。例えば、下記実施例では以下の仕様を有するラクトースのバッチを用いた。
粉末製剤の調製
装置
吸入粉末を調製するのに、例えば下記の装置類を使用することができる。
混合容器又は粉体ミキサー:Turbulamischer 2L Type 2C(Willy A. Bachofen AG社製、CH-4500、バーゼル)
手持ち型の篩:メッシュサイズ0.135mm
チオトロピウム含有吸入粉末を、空の吸入用カプセルに手動又は機械的に充填すればよい。下記の装置を使用することができる。
カプセル充填機:MG2 Type G100、MG2 S.r.l社製(1-40065 Pian di Macina di Pianoro (BO)、イタリア)
処方例
処方例1−粉体混合物
粉体混合物を調製するために、299.39gの賦形剤と、0.61gの微粉化した結晶質臭化チオトロピウム無水物とを用いる。
約40〜45gの賦形剤をメッシュサイズ0.315mmの手持ち型篩に通して好適な混合容器に仕込む。約90〜110mgずつに小分けした結晶質臭化チオトロピウム無水物と、約40〜45gずつに小分けした賦形剤を篩にかけ、交互の層になるようにする。賦形剤と有効成分を添加して、それぞれが7層と6層になるようにする。
篩で添加した後、成分同士を混合する(混合速度900rpm)。最終混合物を手持ち型篩にさらに2回通して、再度900rpmで混合する。
処方例1記載の方法を用いて吸入粉末を得ることができ、それを使用して好適なプラスチック製カプセルに充填すれば、例えば以下のような吸入用カプセルを形成することができる。
装置
吸入粉末を調製するのに、例えば下記の装置類を使用することができる。
混合容器又は粉体ミキサー:Turbulamischer 2L Type 2C(Willy A. Bachofen AG社製、CH-4500、バーゼル)
手持ち型の篩:メッシュサイズ0.135mm
チオトロピウム含有吸入粉末を、空の吸入用カプセルに手動又は機械的に充填すればよい。下記の装置を使用することができる。
カプセル充填機:MG2 Type G100、MG2 S.r.l社製(1-40065 Pian di Macina di Pianoro (BO)、イタリア)
処方例
処方例1−粉体混合物
粉体混合物を調製するために、299.39gの賦形剤と、0.61gの微粉化した結晶質臭化チオトロピウム無水物とを用いる。
約40〜45gの賦形剤をメッシュサイズ0.315mmの手持ち型篩に通して好適な混合容器に仕込む。約90〜110mgずつに小分けした結晶質臭化チオトロピウム無水物と、約40〜45gずつに小分けした賦形剤を篩にかけ、交互の層になるようにする。賦形剤と有効成分を添加して、それぞれが7層と6層になるようにする。
篩で添加した後、成分同士を混合する(混合速度900rpm)。最終混合物を手持ち型篩にさらに2回通して、再度900rpmで混合する。
処方例1記載の方法を用いて吸入粉末を得ることができ、それを使用して好適なプラスチック製カプセルに充填すれば、例えば以下のような吸入用カプセルを形成することができる。
処方例2:
臭化チオトロピウム無水物 0.0113mg
ラクトース一水和物 5.4887mg
カプセル 100.0mg
合計 105.5mg
処方例3:
臭化チオトロピウム無水物 0.0225mg
ラクトース一水和物 5.4775mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
処方例4:
臭化チオトロピウム無水物 0.0056mg
ラクトース一水和物 5.4944mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
臭化チオトロピウム無水物 0.0113mg
ラクトース一水和物 5.4887mg
カプセル 100.0mg
合計 105.5mg
処方例3:
臭化チオトロピウム無水物 0.0225mg
ラクトース一水和物 5.4775mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
処方例4:
臭化チオトロピウム無水物 0.0056mg
ラクトース一水和物 5.4944mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
処方例5:
臭化チオトロピウム無水物 0.0113mg
ラクトース一水和物* 5.4887mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
*)ラクトースには、平均粒径約4μmの微粉砕ラクトース一水和物が5%指定で添加された微細分として含まれている。
処方例6:
臭化チオトロピウム無水物 0.0225mg
ラクトース一水和物* 5.4775mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
*)ラクトースには、平均粒径約4μmの微粉砕ラクトース一水和物が5%指定で添加された微細分として含まれている。
処方例7:
臭化チオトロピウム無水物 0.0056mg
ラクトース一水和物* 5.4944mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
*)ラクトースには、平均粒径約4μmの微粉砕ラクトース一水和物が5%指定で添加された微細分として含まれている。
臭化チオトロピウム無水物 0.0113mg
ラクトース一水和物* 5.4887mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
*)ラクトースには、平均粒径約4μmの微粉砕ラクトース一水和物が5%指定で添加された微細分として含まれている。
処方例6:
臭化チオトロピウム無水物 0.0225mg
ラクトース一水和物* 5.4775mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
*)ラクトースには、平均粒径約4μmの微粉砕ラクトース一水和物が5%指定で添加された微細分として含まれている。
処方例7:
臭化チオトロピウム無水物 0.0056mg
ラクトース一水和物* 5.4944mg
ポリエチレンカプセル 100.0mg
合計 105.5mg
*)ラクトースには、平均粒径約4μmの微粉砕ラクトース一水和物が5%指定で添加された微細分として含まれている。
当該分野の当業者であれば、本願明細書前記記載の臭化チオトロピウムの他の結晶物の1つから類推してして上記実施例を適用することができることは明らかである。本発明による他の溶媒和物の1つを含む製品を得るには、臭化チオトロピウム無水物のかわりに本発明による他の結晶質溶媒和物の1つを用いて処方例1や処方例2〜7にしたがって粉体混合物を容易に得ることができる。
C.2:噴射剤含有エアロゾル懸濁剤
本発明の結晶質チオトロピウム臭化物は、噴射剤含有吸入エアロゾルの状態で投与することもできる。エアロゾル懸濁剤が特に好適である。
そこで、本発明は、噴射剤ガスHFA227及び/又はHFA134a中に本発明の結晶質チオトロピウム臭化物を含む懸濁剤に関するもので、1種以上の他の噴射剤ガス、好ましくはプロパン、ブタン、ペンタン、ジメチルエーテル、CHClF2、CH2F2、CF3CH3、イソブタン、イソペンタン及びネオペンタンからなる群から選択される噴射剤ガスを混合していてもよい。
本発明によると、噴射剤ガスとしてHFA227のみを含有するもの、HFA227とHFA134aの混合物を含有するもの、又は、HFA134aのみを含有する懸濁剤が好適である。
C.2:噴射剤含有エアロゾル懸濁剤
本発明の結晶質チオトロピウム臭化物は、噴射剤含有吸入エアロゾルの状態で投与することもできる。エアロゾル懸濁剤が特に好適である。
そこで、本発明は、噴射剤ガスHFA227及び/又はHFA134a中に本発明の結晶質チオトロピウム臭化物を含む懸濁剤に関するもので、1種以上の他の噴射剤ガス、好ましくはプロパン、ブタン、ペンタン、ジメチルエーテル、CHClF2、CH2F2、CF3CH3、イソブタン、イソペンタン及びネオペンタンからなる群から選択される噴射剤ガスを混合していてもよい。
本発明によると、噴射剤ガスとしてHFA227のみを含有するもの、HFA227とHFA134aの混合物を含有するもの、又は、HFA134aのみを含有する懸濁剤が好適である。
本発明の懸濁系製剤で噴射剤ガスHFA227とHFA134aの混合物を用いる場合、この2つの噴射剤ガス成分の質量比は自由に変えることができる。
本発明の懸濁系製剤において、噴射剤ガスHFA227及び/又はHFA134aに加えて、1種以上の他の噴射剤ガスをプロパン、ブタン、ペンタン、ジメチルエーテル、CHClF2、CH2F2、CF3CH3、イソブタン、イソペンタン及びネオペンタンからなる群から選択して使用する場合は、この添加する噴射剤ガス成分の量は50%未満が好ましく、40%未満がさらに好ましく、30%未満がとりわけ好ましい。
本発明の懸濁剤は、チオトロピウムカチオンの量が0.001〜0.8%、好ましくは0.08〜0.5%、特に好ましくは0.2〜0.4%となるような量のチオトロピウム臭化物が含まれていることが好ましい。
特に変更の記載がないかぎり、本発明の範囲において記載のパーセンテージは、常に質量パーセントを示す。
本発明の範囲において、懸濁系製剤という用語を懸濁剤の代わりに使用する場合もある。この2つの用語は本発明の範囲において均等であるとみなされる。
本発明の噴射剤含有吸入用エアロゾル又は懸濁系製剤には、界面活性剤、アジュバント、酸化防止剤又は香味付与剤等の他の構成成分を含有させてもよい。
本発明の懸濁系製剤において、噴射剤ガスHFA227及び/又はHFA134aに加えて、1種以上の他の噴射剤ガスをプロパン、ブタン、ペンタン、ジメチルエーテル、CHClF2、CH2F2、CF3CH3、イソブタン、イソペンタン及びネオペンタンからなる群から選択して使用する場合は、この添加する噴射剤ガス成分の量は50%未満が好ましく、40%未満がさらに好ましく、30%未満がとりわけ好ましい。
本発明の懸濁剤は、チオトロピウムカチオンの量が0.001〜0.8%、好ましくは0.08〜0.5%、特に好ましくは0.2〜0.4%となるような量のチオトロピウム臭化物が含まれていることが好ましい。
特に変更の記載がないかぎり、本発明の範囲において記載のパーセンテージは、常に質量パーセントを示す。
本発明の範囲において、懸濁系製剤という用語を懸濁剤の代わりに使用する場合もある。この2つの用語は本発明の範囲において均等であるとみなされる。
本発明の噴射剤含有吸入用エアロゾル又は懸濁系製剤には、界面活性剤、アジュバント、酸化防止剤又は香味付与剤等の他の構成成分を含有させてもよい。
本発明の懸濁剤に含有させることができる界面活性剤としては、ポリソルベート20、ポリソルベート80、Myvacet 9-45、Myvacet 9-08、ミリスチン酸イソプロピル、オレイン酸、プロピレングリコール、ポリエチレングリコール、Brij、オレイン酸エチル、トリオレイン酸グリセリン、モノラウリン酸グリセリン、モノオレイン酸グリセリン、モノステアリン酸グリセリン、モノリシノール酸グリセリン、セチルアルコール、ステアリルアルコール、塩化セチルピリジニウム、ブロック重合体、天然油、エタノール及びイソプロパノールからなる群から選択されることが好ましい。前記懸濁剤アジュバントのなかでも、ポリソルベート20、ポリソルベート80、Myvacet 9-45、Myvacet 9-08又はミリスチン酸イソプロピルが好適に使用される。Myvacet 9-45又はミリスチン酸イソプロピルが最も好ましく使用される。
本発明による懸濁剤が界面活性剤を含む場合、界面活性剤は好ましくは0.0005〜1%、特に好ましくは0.005〜0.5%の量で用いられることが好ましい。
本発明の懸濁剤中に任意で含有させることができるアジュバントは、アラニン、アルブミン、アスコルビン酸、アスパルテーム、ベタイン、システイン、リン酸、硝酸、塩酸、硫酸及びクエン酸からなる群から選択されることが好ましい。アスコルビン酸、リン酸、塩酸又はクエン酸が好適に使用され、塩酸又はクエン酸が特に好ましい。
本発明による懸濁剤が界面活性剤を含む場合、界面活性剤は好ましくは0.0005〜1%、特に好ましくは0.005〜0.5%の量で用いられることが好ましい。
本発明の懸濁剤中に任意で含有させることができるアジュバントは、アラニン、アルブミン、アスコルビン酸、アスパルテーム、ベタイン、システイン、リン酸、硝酸、塩酸、硫酸及びクエン酸からなる群から選択されることが好ましい。アスコルビン酸、リン酸、塩酸又はクエン酸が好適に使用され、塩酸又はクエン酸が特に好ましい。
アジュバントが本発明の懸濁剤中に存在する場合、アジュバントは、0.0001〜1.0%、好ましくは0.0005〜0.1%、特に好ましくは0.001〜0.01%の量で使用され、とりわけ0.001〜0.005%の量が本発明では重要である。
本発明の懸濁剤中に使用することができる酸化防止剤は、アスコルビン酸、クエン酸、エデト酸ナトリウム、エデト酸、トコフェロール類、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール及びアスコルビン酸パルミチン酸エステルからなる群から選択されることが好ましく、トコフェロール類、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール又はアスコルビン酸パルミチン酸エステルの使用が好適である。
本発明の懸濁剤には香味付与剤を任意で含有させることができるが、香味付与剤はペパーミント、サッカリン、Dentomint、アスパルテーム及び精油類(例えば、シナモン油、アニス油、メントール、樟脳油等)からなる群から選択されることが好ましく、なかでもペパーミント又はDentomint(登録商標)が特に好ましい。
吸入投与を意図する場合は、有効成分を微粉状態で提供することが必須である。そのため、本発明の結晶質チオトロピウム臭化物は従来技術から公知である方法を用いて微粉状態にして得る。有効成分の微粉砕方法についてはこの分野では公知である。微粉化後の有効成分の平均粒径は、0.5〜10μm、好ましくは1〜6μm、特に好ましくは1.5〜5μmであると好ましい。有効成分粒子の少なくとも50%、好ましくは少なくとも60%、特に好ましくは少なくとも70%が、前記粒径範囲内の径を有することが好ましい。特に好ましくは少なくとも80%、最も好ましくは少なくとも90%の有効成分粒子が前記粒径範囲内の粒径であることが好ましい。
本発明の懸濁剤中に使用することができる酸化防止剤は、アスコルビン酸、クエン酸、エデト酸ナトリウム、エデト酸、トコフェロール類、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール及びアスコルビン酸パルミチン酸エステルからなる群から選択されることが好ましく、トコフェロール類、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール又はアスコルビン酸パルミチン酸エステルの使用が好適である。
本発明の懸濁剤には香味付与剤を任意で含有させることができるが、香味付与剤はペパーミント、サッカリン、Dentomint、アスパルテーム及び精油類(例えば、シナモン油、アニス油、メントール、樟脳油等)からなる群から選択されることが好ましく、なかでもペパーミント又はDentomint(登録商標)が特に好ましい。
吸入投与を意図する場合は、有効成分を微粉状態で提供することが必須である。そのため、本発明の結晶質チオトロピウム臭化物は従来技術から公知である方法を用いて微粉状態にして得る。有効成分の微粉砕方法についてはこの分野では公知である。微粉化後の有効成分の平均粒径は、0.5〜10μm、好ましくは1〜6μm、特に好ましくは1.5〜5μmであると好ましい。有効成分粒子の少なくとも50%、好ましくは少なくとも60%、特に好ましくは少なくとも70%が、前記粒径範囲内の径を有することが好ましい。特に好ましくは少なくとも80%、最も好ましくは少なくとも90%の有効成分粒子が前記粒径範囲内の粒径であることが好ましい。
本発明のもう一つの態様は、本発明による2種の有効成分のうち1種のみを含み、他の添加剤を何も含まない懸濁剤に関する。
本発明の懸濁剤は、この分野では公知の方法で調製することができる。調製するには処方成分を噴射剤ガス(1種又は複数の噴射剤ガス)と共に混合し(任意であるが低温で)、適当な容器に充填する。
本発明による前記噴射剤含有懸濁剤は、この分野では公知の吸入器(加圧式定量噴霧吸入器(pMDI))を使って投与することができる。したがって、もう一つの態様では、本発明は、本願明細書前記のとおりの懸濁剤状態の医薬組成物と、この懸濁剤を投与するのに適した吸入器1種以上との組み合わせに関する。さらに本発明は、本願明細書前記記載の噴射剤含有懸濁剤を収容することを特徴とする吸入器に関する。
また、本発明は、適切なバルブを装着することで好適な吸入器中で使用することができる、前記本発明による噴射剤含有懸濁剤の1種を収容する容器(カートリッジ)に関するものである。好適な容器(カートリッジ)及びこれらのカートリッジに本発明による噴射剤含有懸濁剤を充填する方法については、この分野では公知である。
チオトロピウムの医薬的活性を考慮し、本発明は、吸入又は鼻からの投与用医薬組成物を製造するための本発明の懸濁剤の使用に関するものでもあり、好ましくは、抗コリン作用薬が治療効果を引き出すことができる疾病の吸入治療又は鼻からの治療用の医薬組成物を製造するための本発明の懸濁剤の使用に関する。
本発明の懸濁剤は、この分野では公知の方法で調製することができる。調製するには処方成分を噴射剤ガス(1種又は複数の噴射剤ガス)と共に混合し(任意であるが低温で)、適当な容器に充填する。
本発明による前記噴射剤含有懸濁剤は、この分野では公知の吸入器(加圧式定量噴霧吸入器(pMDI))を使って投与することができる。したがって、もう一つの態様では、本発明は、本願明細書前記のとおりの懸濁剤状態の医薬組成物と、この懸濁剤を投与するのに適した吸入器1種以上との組み合わせに関する。さらに本発明は、本願明細書前記記載の噴射剤含有懸濁剤を収容することを特徴とする吸入器に関する。
また、本発明は、適切なバルブを装着することで好適な吸入器中で使用することができる、前記本発明による噴射剤含有懸濁剤の1種を収容する容器(カートリッジ)に関するものである。好適な容器(カートリッジ)及びこれらのカートリッジに本発明による噴射剤含有懸濁剤を充填する方法については、この分野では公知である。
チオトロピウムの医薬的活性を考慮し、本発明は、吸入又は鼻からの投与用医薬組成物を製造するための本発明の懸濁剤の使用に関するものでもあり、好ましくは、抗コリン作用薬が治療効果を引き出すことができる疾病の吸入治療又は鼻からの治療用の医薬組成物を製造するための本発明の懸濁剤の使用に関する。
特に好ましいのは、呼吸器系疾患の、とりわけ喘息又はCOPDの吸入治療用医薬組成物を製造するための本発明の懸濁剤の使用に関する。
以下の実施例は、例を挙げて本発明をさらに詳細に説明することを目的とするものであり、その内容に本発明を限定するものではない。
エアロゾル懸濁系製剤の実施例
有効成分及び噴射ガスに加えて他の成分を含む懸濁剤
処方例8:
以下の実施例は、例を挙げて本発明をさらに詳細に説明することを目的とするものであり、その内容に本発明を限定するものではない。
エアロゾル懸濁系製剤の実施例
有効成分及び噴射ガスに加えて他の成分を含む懸濁剤
処方例8:
前述の実施例が、本願明細書で記載した臭化チオトロピウムの他の結晶物のそれぞれに類推して適用可能であることは、当該分野の当業者であれば明らかである。本発明による他の溶媒和物のいずれかを含有する製品を得るには、臭化チオトロピウム無水物の代わりに本発明の他の結晶質溶媒和物のいずれかを用いることにより処方例8〜24で容易に得ることができる。
Claims (32)
- 以下からなる群から選択される臭化チオトロピウムの結晶物:
- X線粉末ダイアグラムにおいてd=5.89Åであることを特徴とする、結晶性臭化チオトロピウム無水物、
- X線粉末ダイアグラムにおいてd=4.14Åであることを特徴とする、結晶性臭化チオトロピウムのメタノール溶媒和物、
- X線粉末ダイアグラムにおいてd=4.15Åであることを特徴とする、結晶性臭化チオトロピウムのエタノール溶媒和物、
- X線粉末ダイアグラムにおいてd=4.17Åであることを特徴とする、結晶性臭化チオトロピウムのイソプロパノール溶媒和物、
- X線粉末ダイアグラムにおいてd=4.92Åであることを特徴とする、結晶性臭化チオトロピウムのTHF溶媒和物、
- X線粉末ダイアグラムにおいてd=4.15Åであることを特徴とする、結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物、
- X線粉末ダイアグラムにおいてd=5.69Åであることを特徴とする、結晶性臭化チオトロピウムのジメチルホルムアミド溶媒和物、
- X線粉末ダイアグラムにおいてd=6.56Åであることを特徴とする、結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物、及び
- X線粉末ダイアグラムにおいてd=4.94Åであることを特徴とする、結晶性臭化チオトロピウムの1−ブタノール溶媒和物。 - X線粉末ダイアグラムにおいてd=5.89Å及び4.90Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウム無水物。
- X線粉末ダイアグラムにおいてd=5.89Å、4.90Å及び4.84Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウム無水物。
- X線粉末ダイアグラムにおいてd=4.94Å及び4.14Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのメタノール溶媒和物。
- X線粉末ダイアグラムにおいてd=4.94Å、4.50Å及び4.14Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのメタノール溶媒和物。
- X線粉末ダイアグラムにおいてd=4.46Å及び4.15Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのエタノール溶媒和物。
- X線粉末ダイアグラムにおいてd=4.90Å、4.46Å及び4.15Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのエタノール溶媒和物。
- X線粉末ダイアグラムにおいてd=4.91Å及び4.17Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのイソプロパノール溶媒和物。
- X線粉末ダイアグラムにおいてd=4.91Å、4.48Å及び4.17Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのイソプロパノール溶媒和物。
- X線粉末ダイアグラムにおいてd=4.92Å及び4.15Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのTHF溶媒和物。
- X線粉末ダイアグラムにおいてd=5.80Å、4.92Å及び4.15Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのTHF溶媒和物。
- X線粉末ダイアグラムにおいてd=4.92Å及び4.15Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物。
- X線粉末ダイアグラムにおいてd=5.79Å、4.92Å及び4.15Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物。
- X線粉末ダイアグラムにおいてd=5.69Å及び4.94Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのDMF溶媒和物。
- X線粉末ダイアグラムにおいてd=5.69Å、4.94Å及び4.11Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのDMF溶媒和物。
- X線粉末ダイアグラムにおいてd=6.56Å及び4.13Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物。
- X線粉末ダイアグラムにおいてd=6.56Å、4.22Å及び4.13Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物。
- X線粉末ダイアグラムにおいてd=4.94Å及び4.17Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの1−ブタノール溶媒和物。
- X線粉末ダイアグラムにおいてd=4.94Å、4.51Å及び4.17Åであることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの1−ブタノール溶媒和物。
- 結晶性臭化チオトロピウム一水和物のジメチルホルムアミド溶液をアセトニトリルに添加し、得られた混合物を20℃未満に冷却し、できた結晶を単離させることを特徴とする、請求項1記載の結晶性臭化チオトロピウム無水物の製造方法。
- 無水臭化チオトロピウムをメタノール含有溶媒から再結晶させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのメタノール溶媒和物の製造方法。
- 無水臭化チオトロピウムをエタノール含有溶媒から再結晶させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのエタノール溶媒和物の製造方法。
- 結晶性臭化チオトロピウム一水和物のイソプロパノール溶液を20℃未満に冷却し、できた結晶を単離させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのイソプロパノール溶媒和物の製造方法。
- 結晶性臭化チオトロピウム一水和物の好適なアルコール溶液をTHF含有溶液に添加し、できた結晶を単離させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのTHF溶媒和物の製造方法。
- 結晶性臭化チオトロピウム一水和物の好適なアルコール溶液を1,4−ジオキサン含有溶液に添加し、できた結晶を単離させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの1,4−ジオキサン溶媒和物の製造方法。
- 結晶性臭化チオトロピウム一水和物のDMF溶液をメチルt−ブチルエーテルに添加し、できた結晶を単離させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムのDMF溶媒和物の製造方法。
- 結晶性臭化チオトロピウム一水和物の好適なアルコール溶液を、塩化メチレン及びメチルエチルケトンを含む溶媒に添加し、得られた混合物を20℃未満に冷却してもよく、できた結晶を単離させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの塩化メチレン/メチルエチルケトン混合溶媒和物の製造方法。
- 結晶性臭化チオトロピウム一水和物の好適なアルコール溶液を、1−ブタノールを含む溶媒に添加して、得られた混合物を20℃未満、好ましくは10℃未満に冷却してもよく、できた結晶を単離させることを特徴とする、請求項1記載の結晶性臭化チオトロピウムの1−ブタノール溶媒和物の製造方法。
- 請求項1〜19のいずれか1項記載のチオトロピウムを含有することを特徴とする医薬組成物。
- 前記医薬組成物が、請求項1〜19のいずれか1項記載のチオトロピウムと共に、ベータ受容体刺激薬(betamimetics)、EGFR阻害剤、PDEIV-阻害剤、ステロイド類及びLTD4拮抗薬から選択される1種以上の有効成分とを含み、さらに、医薬的に許容される賦形剤を一緒に含んでいてもよい、請求項29記載の医薬組成物。
- 請求項1記載のチオトロピウム結晶物を製造するための、出発物質としての結晶性臭化チオトロピウム一水和物の使用。
- 請求項1記載のチオトロピウム結晶物を製造するための、出発物質としての結晶性臭化チオトロピウム無水物の使用。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US67676005P | 2005-05-02 | 2005-05-02 | |
| PCT/EP2006/061765 WO2006117300A2 (en) | 2005-05-02 | 2006-04-21 | Crystalline forms of tiotropium bromide |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008540367A true JP2008540367A (ja) | 2008-11-20 |
| JP2008540367A5 JP2008540367A5 (ja) | 2009-06-18 |
Family
ID=36617384
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008509409A Pending JP2008540367A (ja) | 2005-05-02 | 2006-04-21 | 新規結晶性臭化チオトロピウム |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20060246009A1 (ja) |
| EP (1) | EP1879888A2 (ja) |
| JP (1) | JP2008540367A (ja) |
| KR (1) | KR20080007656A (ja) |
| CN (1) | CN101203513A (ja) |
| AU (1) | AU2006243239A1 (ja) |
| BR (1) | BRPI0611091A2 (ja) |
| CA (1) | CA2606552A1 (ja) |
| IL (1) | IL187054A0 (ja) |
| MX (1) | MX2007013691A (ja) |
| RU (1) | RU2007144531A (ja) |
| WO (1) | WO2006117300A2 (ja) |
| ZA (1) | ZA200708175B (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013501041A (ja) * | 2009-08-07 | 2013-01-10 | ジェネリクス・(ユーケー)・リミテッド | チオトロピウム臭化物の無水物 |
| JP2016502518A (ja) * | 2012-11-05 | 2016-01-28 | ゼンティーバ,カー.エス. | チオトロピウム溶媒和物の安定化 |
| JP2017506631A (ja) * | 2014-02-27 | 2017-03-09 | ユーティカルズ・ソチエタ・ペル・アツィオーニEuticals Spa | 臭化チオトロピウムとラクトースの結晶形態 |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9108962B2 (en) | 2005-12-19 | 2015-08-18 | Sicor, Inc. | Forms of tiotropium bromide and processes for preparation thereof |
| TW200734333A (en) * | 2005-12-19 | 2007-09-16 | Sicor Inc | Pure and stable tiotropium bromide |
| EP2123650B1 (en) | 2005-12-19 | 2012-04-04 | Sicor, Inc. | Novel form of tiotropium bromide and process for preparation thereof |
| US20070167480A1 (en) * | 2005-12-19 | 2007-07-19 | Sicor Inc. | Pure and stable tiotropium bromide |
| CN100999521B (zh) * | 2006-01-13 | 2010-12-08 | 江苏正大天晴药业股份有限公司 | 结晶性抗胆碱药噻托溴铵 |
| US20080051582A1 (en) | 2006-07-10 | 2008-02-28 | Sicor Inc. | Process for the preparation of tiotropium bromide |
| EP1923393A1 (en) * | 2006-11-17 | 2008-05-21 | Boehringer Ingelheim Pharma GmbH & Co. KG | Crystalline form of tiotropium bromide and urea |
| GB0716026D0 (en) * | 2007-08-16 | 2007-09-26 | Norton Healthcare Ltd | An inhalable medicament |
| WO2010101538A2 (en) | 2009-03-06 | 2010-09-10 | Bilgic Mahmut | New crystal forms |
| WO2011015883A1 (en) | 2009-08-07 | 2011-02-10 | Generics [Uk] Limited | Dichloromethane solvate of tiotropium bromide and its use |
| TR201007108A2 (tr) * | 2010-08-25 | 2012-03-21 | B�Lg�� Mahmut | Yeni tiotropyum bromür kristali ve üretim yöntemi.@ |
| TR201101897A2 (tr) * | 2011-02-28 | 2012-09-21 | Bi̇lgi̇ç Mahmut | Tiotropyum bromür içeren kristal madde |
| CZ304368B6 (cs) | 2011-11-28 | 2014-04-02 | Zentiva, K.S. | Směsný solvát tiotropium bromidu a způsob jeho přípravy |
| CN103130798B (zh) * | 2011-11-30 | 2015-12-02 | 连云港润众制药有限公司 | 噻托溴铵的结晶 |
| GB201200525D0 (en) | 2011-12-19 | 2012-02-29 | Teva Branded Pharmaceutical Prod R & D Inc | An inhalable medicament |
| PT106142B (pt) | 2012-02-10 | 2014-07-18 | Hovione Farmaci Ncia S A | Processo para a preparação de brometo de tiotrópio |
| WO2014042605A1 (en) * | 2012-09-11 | 2014-03-20 | Mahmut Bilgic | New tiotropium bromide crystalline form |
| EP2789611A1 (en) * | 2013-04-08 | 2014-10-15 | Cerbios-Pharma S.A. | A crystalline form of tiotropium bromide |
| CN104341412A (zh) * | 2013-07-29 | 2015-02-11 | 天津金耀集团有限公司 | 一种无水噻托溴铵结晶的制备方法 |
| CN104341413A (zh) * | 2013-07-29 | 2015-02-11 | 天津金耀集团有限公司 | 一种无水噻托溴铵的新晶型 |
| US10034866B2 (en) | 2014-06-19 | 2018-07-31 | Teva Branded Pharmaceutical Products R&D, Inc. | Inhalable medicament comprising tiotropium |
| WO2017138896A1 (en) | 2016-02-11 | 2017-08-17 | Sima Patent Ve Lisanslama Hizmetleri Ltd. Şti | Crystalline form of tiotropium bromide anhydrate |
| PT115583B (pt) * | 2019-06-17 | 2022-05-02 | Hovione Farm S A | Processo contínuo para a preparação de medicamentos anticolinérgicos |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003000265A1 (de) * | 2001-06-22 | 2003-01-03 | Boehringer Ingelheim Pharma Gmbh & Co.Kg | Kristallines anticholinergikum, verfahren zu dessen herstellung und dessen verwendung zur herstellung eines arzneimittels |
| WO2003082244A2 (de) * | 2002-03-28 | 2003-10-09 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Hfa-suspensionsformulierungen eines anhydrats |
| WO2004054580A1 (en) * | 2002-12-16 | 2004-07-01 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Tiotropium containing hfc solution formulations |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3931041C2 (de) * | 1989-09-16 | 2000-04-06 | Boehringer Ingelheim Kg | Ester von Thienylcarbonsäuren mit Aminoalkoholen, ihre Quaternierungsprodukte, Verfahren zu ihrer Herstellung und diese enthaltende Arzneimittel |
| PL207870B1 (pl) * | 2000-10-12 | 2011-02-28 | Boehringer Ingelheim Pharma | Krystaliczny monohydrat bromku tiotropium, sposób jego wytwarzania, środek leczniczy i zastosowanie |
| DE10064816A1 (de) * | 2000-12-22 | 2002-06-27 | Boehringer Ingelheim Pharma | Verfahren zur Herstellung eines Anticholinergikums |
| US6608055B2 (en) * | 2001-06-22 | 2003-08-19 | Boehringer Ingelheim Pharma Kg | Crystalline anticholinergic, processes for preparing it and its use for preparing a pharmaceutical composition |
| DE10212264A1 (de) * | 2002-03-20 | 2003-10-02 | Boehringer Ingelheim Pharma | Kristallines Mikronisat, Verfahren zu dessen Herstellung und dessen Verwendung zur Herstellung eines Arzneimittels |
| US7244415B2 (en) * | 2002-03-28 | 2007-07-17 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | HFA suspension formulations of an anhydrate |
| DK1682542T3 (da) * | 2003-11-03 | 2010-05-10 | Boehringer Ingelheim Int | Nyt krystallinsk anhydrat med anticholinerg effekt |
-
2006
- 2006-04-21 CN CNA2006800139215A patent/CN101203513A/zh active Pending
- 2006-04-21 KR KR1020077028066A patent/KR20080007656A/ko not_active Application Discontinuation
- 2006-04-21 MX MX2007013691A patent/MX2007013691A/es not_active Application Discontinuation
- 2006-04-21 RU RU2007144531/04A patent/RU2007144531A/ru not_active Application Discontinuation
- 2006-04-21 EP EP06763053A patent/EP1879888A2/en not_active Withdrawn
- 2006-04-21 AU AU2006243239A patent/AU2006243239A1/en not_active Abandoned
- 2006-04-21 JP JP2008509409A patent/JP2008540367A/ja active Pending
- 2006-04-21 WO PCT/EP2006/061765 patent/WO2006117300A2/en active Application Filing
- 2006-04-21 BR BRPI0611091-6A patent/BRPI0611091A2/pt not_active IP Right Cessation
- 2006-04-21 CA CA002606552A patent/CA2606552A1/en not_active Abandoned
- 2006-05-01 US US11/381,079 patent/US20060246009A1/en not_active Abandoned
-
2007
- 2007-09-25 ZA ZA200708175A patent/ZA200708175B/xx unknown
- 2007-10-31 IL IL187054A patent/IL187054A0/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003000265A1 (de) * | 2001-06-22 | 2003-01-03 | Boehringer Ingelheim Pharma Gmbh & Co.Kg | Kristallines anticholinergikum, verfahren zu dessen herstellung und dessen verwendung zur herstellung eines arzneimittels |
| WO2003082244A2 (de) * | 2002-03-28 | 2003-10-09 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Hfa-suspensionsformulierungen eines anhydrats |
| WO2004054580A1 (en) * | 2002-12-16 | 2004-07-01 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Tiotropium containing hfc solution formulations |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013501041A (ja) * | 2009-08-07 | 2013-01-10 | ジェネリクス・(ユーケー)・リミテッド | チオトロピウム臭化物の無水物 |
| JP2015214574A (ja) * | 2009-08-07 | 2015-12-03 | ジェネリクス・[ユーケー]・リミテッド | チオトロピウム臭化物の無水物 |
| JP2016502518A (ja) * | 2012-11-05 | 2016-01-28 | ゼンティーバ,カー.エス. | チオトロピウム溶媒和物の安定化 |
| JP2017506631A (ja) * | 2014-02-27 | 2017-03-09 | ユーティカルズ・ソチエタ・ペル・アツィオーニEuticals Spa | 臭化チオトロピウムとラクトースの結晶形態 |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2007013691A (es) | 2008-01-21 |
| IL187054A0 (en) | 2008-02-09 |
| CN101203513A (zh) | 2008-06-18 |
| RU2007144531A (ru) | 2009-06-10 |
| US20060246009A1 (en) | 2006-11-02 |
| ZA200708175B (en) | 2008-09-25 |
| EP1879888A2 (en) | 2008-01-23 |
| WO2006117300A3 (en) | 2007-04-26 |
| WO2006117300A2 (en) | 2006-11-09 |
| AU2006243239A1 (en) | 2006-11-09 |
| KR20080007656A (ko) | 2008-01-22 |
| BRPI0611091A2 (pt) | 2010-08-03 |
| CA2606552A1 (en) | 2006-11-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2008540367A (ja) | 新規結晶性臭化チオトロピウム | |
| JP5227790B2 (ja) | 新規結晶性臭化チオトロピウム | |
| JP4553902B2 (ja) | 抗コリン作用を有する新規結晶性無水物 | |
| ZA200602343B (en) | Novel tiotropium salts, methods for the production thereof, and pharmaceutical formulations containing the same | |
| US7968717B2 (en) | Crystalline anhydrate with anticholinergic efficacy | |
| JP2010510186A (ja) | 臭化チオトロピウムと尿素との結晶物 | |
| KR20060117334A (ko) | 티오트로피움 염의 제조방법, 티오트로피움 염 및 이를함유하는 약제학적 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090421 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090421 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120409 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120924 |