JP2008516632A - 血液製剤、尿、および他の液体中の迅速かつ高感度な細菌の検出 - Google Patents
血液製剤、尿、および他の液体中の迅速かつ高感度な細菌の検出 Download PDFInfo
- Publication number
- JP2008516632A JP2008516632A JP2007537980A JP2007537980A JP2008516632A JP 2008516632 A JP2008516632 A JP 2008516632A JP 2007537980 A JP2007537980 A JP 2007537980A JP 2007537980 A JP2007537980 A JP 2007537980A JP 2008516632 A JP2008516632 A JP 2008516632A
- Authority
- JP
- Japan
- Prior art keywords
- bacterial
- cells
- atp
- intact
- bacterial cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000012530 fluid Substances 0.000 title claims abstract description 39
- 210000002700 urine Anatomy 0.000 title claims abstract description 9
- 230000014670 detection of bacterium Effects 0.000 title claims description 9
- 239000010836 blood and blood product Substances 0.000 title claims description 7
- 229940125691 blood product Drugs 0.000 title claims description 7
- 238000011896 sensitive detection Methods 0.000 title 1
- -1 urine Substances 0.000 title 1
- 230000001580 bacterial effect Effects 0.000 claims abstract description 364
- 210000004027 cell Anatomy 0.000 claims abstract description 220
- 239000007788 liquid Substances 0.000 claims abstract description 212
- 210000003527 eukaryotic cell Anatomy 0.000 claims abstract description 148
- 241000894006 Bacteria Species 0.000 claims abstract description 131
- 238000000034 method Methods 0.000 claims abstract description 104
- 108090000790 Enzymes Proteins 0.000 claims abstract description 51
- 102000004190 Enzymes Human genes 0.000 claims abstract description 51
- 230000002934 lysing effect Effects 0.000 claims abstract description 33
- 238000006243 chemical reaction Methods 0.000 claims abstract description 30
- 238000001514 detection method Methods 0.000 claims abstract description 26
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical group OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 claims abstract description 22
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 claims abstract description 22
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 claims abstract description 22
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 claims abstract description 22
- 238000012544 monitoring process Methods 0.000 claims abstract description 21
- 238000006555 catalytic reaction Methods 0.000 claims abstract description 15
- 210000004369 blood Anatomy 0.000 claims abstract description 12
- 239000008280 blood Substances 0.000 claims abstract description 12
- 239000000523 sample Substances 0.000 claims description 177
- 238000005259 measurement Methods 0.000 claims description 127
- 239000006166 lysate Substances 0.000 claims description 63
- 239000005089 Luciferase Substances 0.000 claims description 52
- 108060001084 Luciferase Proteins 0.000 claims description 51
- 239000011148 porous material Substances 0.000 claims description 27
- 238000000926 separation method Methods 0.000 claims description 26
- 239000011324 bead Substances 0.000 claims description 21
- 238000012360 testing method Methods 0.000 claims description 21
- 238000004891 communication Methods 0.000 claims description 20
- 238000001914 filtration Methods 0.000 claims description 19
- 230000008569 process Effects 0.000 claims description 11
- 241000894007 species Species 0.000 claims description 10
- 210000001124 body fluid Anatomy 0.000 claims description 9
- 239000012141 concentrate Substances 0.000 claims description 9
- 239000010839 body fluid Substances 0.000 claims description 8
- 230000001332 colony forming effect Effects 0.000 claims description 8
- 238000004140 cleaning Methods 0.000 claims description 7
- 241000588724 Escherichia coli Species 0.000 claims description 6
- 210000002381 plasma Anatomy 0.000 claims description 6
- 239000000047 product Substances 0.000 claims description 6
- 241000186216 Corynebacterium Species 0.000 claims description 5
- 241000193996 Streptococcus pyogenes Species 0.000 claims description 5
- 239000002253 acid Substances 0.000 claims description 5
- 239000003795 chemical substances by application Substances 0.000 claims description 5
- 239000002699 waste material Substances 0.000 claims description 5
- 241000193755 Bacillus cereus Species 0.000 claims description 4
- 244000063299 Bacillus subtilis Species 0.000 claims description 4
- 235000014469 Bacillus subtilis Nutrition 0.000 claims description 4
- 241000193468 Clostridium perfringens Species 0.000 claims description 4
- 241000588914 Enterobacter Species 0.000 claims description 4
- 241000589517 Pseudomonas aeruginosa Species 0.000 claims description 4
- 241000607715 Serratia marcescens Species 0.000 claims description 4
- 241000191967 Staphylococcus aureus Species 0.000 claims description 4
- 241000191963 Staphylococcus epidermidis Species 0.000 claims description 4
- 239000000203 mixture Substances 0.000 claims description 4
- 239000002245 particle Substances 0.000 claims description 4
- 230000000717 retained effect Effects 0.000 claims description 4
- 241000588749 Klebsiella oxytoca Species 0.000 claims description 3
- 241000124008 Mammalia Species 0.000 claims description 3
- 210000001185 bone marrow Anatomy 0.000 claims description 3
- 210000003555 cloaca Anatomy 0.000 claims description 3
- 239000003599 detergent Substances 0.000 claims description 3
- 239000011521 glass Substances 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 239000000463 material Substances 0.000 claims description 3
- 239000003566 sealing material Substances 0.000 claims description 3
- 210000002966 serum Anatomy 0.000 claims description 3
- 210000000130 stem cell Anatomy 0.000 claims description 3
- 206010008631 Cholera Diseases 0.000 claims description 2
- 102000008186 Collagen Human genes 0.000 claims description 2
- 108010035532 Collagen Proteins 0.000 claims description 2
- 102000016359 Fibronectins Human genes 0.000 claims description 2
- 108010067306 Fibronectins Proteins 0.000 claims description 2
- 102000007547 Laminin Human genes 0.000 claims description 2
- 108010085895 Laminin Proteins 0.000 claims description 2
- 108010038807 Oligopeptides Proteins 0.000 claims description 2
- 102000015636 Oligopeptides Human genes 0.000 claims description 2
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 claims description 2
- 230000000903 blocking effect Effects 0.000 claims description 2
- 210000001175 cerebrospinal fluid Anatomy 0.000 claims description 2
- 229920001436 collagen Polymers 0.000 claims description 2
- 210000003743 erythrocyte Anatomy 0.000 claims description 2
- 239000003960 organic solvent Substances 0.000 claims description 2
- 108010016184 phenylalanyl-histidyl-arginyl-arginyl-isoleucyl-lysyl-alanine Proteins 0.000 claims description 2
- 238000005086 pumping Methods 0.000 claims description 2
- 206010011985 Decubitus ulcer Diseases 0.000 claims 1
- 208000004210 Pressure Ulcer Diseases 0.000 claims 1
- 241000282898 Sus scrofa Species 0.000 claims 1
- 239000012466 permeate Substances 0.000 claims 1
- 238000011109 contamination Methods 0.000 abstract description 11
- 229940021317 other blood product in atc Drugs 0.000 abstract description 2
- 239000000243 solution Substances 0.000 description 43
- 229940088598 enzyme Drugs 0.000 description 36
- 230000027455 binding Effects 0.000 description 13
- 230000009089 cytolysis Effects 0.000 description 12
- 230000029586 bacterial cell surface binding Effects 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 230000035945 sensitivity Effects 0.000 description 7
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- 206010040047 Sepsis Diseases 0.000 description 6
- 238000004020 luminiscence type Methods 0.000 description 6
- 231100000582 ATP assay Toxicity 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 230000008901 benefit Effects 0.000 description 4
- 239000000306 component Substances 0.000 description 4
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 238000004401 flow injection analysis Methods 0.000 description 4
- 102000007347 Apyrase Human genes 0.000 description 3
- 108010007730 Apyrase Proteins 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 238000011955 best available control technology Methods 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- LIYGYAHYXQDGEP-UHFFFAOYSA-N firefly oxyluciferin Natural products Oc1csc(n1)-c1nc2ccc(O)cc2s1 LIYGYAHYXQDGEP-UHFFFAOYSA-N 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- JJVOROULKOMTKG-UHFFFAOYSA-N oxidized Photinus luciferin Chemical compound S1C2=CC(O)=CC=C2N=C1C1=NC(=O)CS1 JJVOROULKOMTKG-UHFFFAOYSA-N 0.000 description 3
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 3
- 208000002874 Acne Vulgaris Diseases 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 241000194017 Streptococcus Species 0.000 description 2
- 241000607734 Yersinia <bacteria> Species 0.000 description 2
- 206010000496 acne Diseases 0.000 description 2
- 238000005415 bioluminescence Methods 0.000 description 2
- 230000029918 bioluminescence Effects 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 238000000504 luminescence detection Methods 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 238000007747 plating Methods 0.000 description 2
- 235000019260 propionic acid Nutrition 0.000 description 2
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 210000001082 somatic cell Anatomy 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- 241000589291 Acinetobacter Species 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 241000588807 Bordetella Species 0.000 description 1
- 241000589968 Borrelia Species 0.000 description 1
- 241000606161 Chlamydia Species 0.000 description 1
- 241000193403 Clostridium Species 0.000 description 1
- 208000004232 Enteritis Diseases 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 241000589989 Helicobacter Species 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 241000588748 Klebsiella Species 0.000 description 1
- 241000186781 Listeria Species 0.000 description 1
- 208000016604 Lyme disease Diseases 0.000 description 1
- 241000192041 Micrococcus Species 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 241000186359 Mycobacterium Species 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- 241000588653 Neisseria Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 241000588769 Proteus <enterobacteria> Species 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 241000607720 Serratia Species 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- DPKHZNPWBDQZCN-UHFFFAOYSA-N acridine orange free base Chemical compound C1=CC(N(C)C)=CC2=NC3=CC(N(C)C)=CC=C3C=C21 DPKHZNPWBDQZCN-UHFFFAOYSA-N 0.000 description 1
- GZCGUPFRVQAUEE-SLPGGIOYSA-N aldehydo-D-glucose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O GZCGUPFRVQAUEE-SLPGGIOYSA-N 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 229940089206 anhydrous dextrose Drugs 0.000 description 1
- 238000002617 apheresis Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-N benzoquinolinylidene Natural products C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 1
- 208000034158 bleeding Diseases 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 238000009640 blood culture Methods 0.000 description 1
- 238000010322 bone marrow transplantation Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000011978 dissolution method Methods 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 206010043554 thrombocytopenia Diseases 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 241001148471 unidentified anaerobic bacterium Species 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/66—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving luciferase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Toxicology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
本発明は、輸血用の血液、血小板、および他の血液製剤、ならびに尿を含む、液体中の細菌を検出する方法を提供する。本方法は、細菌を溶解させてATPを放出し、そのATPを検出することに基づくものである。真核細胞が大量のATPを含むことから、真核細胞の汚染が解決すべき問題である。したがって、本方法の一部は、細菌細胞を溶解させてATPを放出する前に、無傷の細菌細胞から無傷の真核細胞(例えば血小板)を分離、そのATPを、反応を触媒するATP消費酵素と接触させて、酵素触媒反応をモニタリングすることを伴う。一般に、この酵素はルシフェリンであり、反応はルシフェリンが発する検出光によってモニタリングする。本発明の他の方法では、液体試料を、細菌細胞を結合する担持表面と接触させ、細菌細胞を溶解させてATPを放出させ、ATPをATP消費酵素と接触させて、酵素触媒反応をモニタリングするステップ、ことを伴う。また、本方法を実行するための装置も開示する。
Description
(a)細菌細胞を溶解させて細菌ATPを液体中に放出し、細菌溶解液を生成し、(b)細菌溶解液中の細菌ATPをATP消費酵素と接触させて、酵素が反応を触媒するATP測定液を生成し、(c)ATP測定液における酵素触媒反応をモニタリングするステップで構成されるステップを実行する装置を提供する。
本明細書において使用される「真核細胞」という用語は、液体中に含有されることが疑われる有核細胞および、自然発生的な膜に囲まれた真核細胞由来の、例えば血小板などのような、核を持たないATP含有体を含むものとする。
本発明の実施形態の一部は、細菌細胞を溶解してATPを放出するのに先立って無傷の真核細胞(例えば血小板)を無傷の細菌細胞から分離し、反応を触媒するATP消費酵素にATPを接触させ、および酵素触媒反応をモニタリングすることを含む。
E+LH2+ATP+Mg2+→E−LH2−AMP+Mg2++PPi
E−LH2−AMP+O2→E+CO2+AMP+oxyluciferin+photon
該方法の特定の実施形態は、細菌細胞を結合する担持表面と液体試料を接触させるステップの前に、液体試料に存在する可能性のある細菌細胞を実質的に溶解することなく、液体試料に存在する可能性のある真核細胞を選択的に溶解することを含む。例えば、室温、中性pH、および適度な濃度のTRITON−X−100は、細菌を溶解することなく血小板と他の体細胞を溶解する。
細菌結合ビーズを使用した細菌汚染に関する濃厚血小板の測定
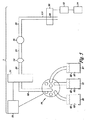
真核細胞を細菌から分離し細菌を濃縮する器具
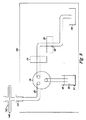
コンピュータ制御細菌検出器具
実施例3の器具を使用した細菌汚染の測定
1. Epstein JS, Williams AE, Biswas R, Vostal J. FDA Update at the AABB Annual Meeting 10/15/2001 2001.
2. Morrow JF, Braine HG, Kickler TS, Ness PM, Dick JD, Fuller AK. Septic reactions to platelet transfusions. A persistent problem. JAMA. 1991;266(4):555−558.
3. Barrett BB, Andersen JW, Anderson KC. Strategies for the avoidance of bacterial contamination of blood components. Transfusion. Mar 1993;33(3):228−233.
4. Dumont L. Bacterial Contamination of Platelet Components. Lakewood: COBE BCT Inc.; 1996.
5. Mitchell K−M T, Brecher ME. 1999. Transfusion Medicine Reviews 13:132−144.
6. Chaney R., et al. 1999. Transfusion Medicine 9:177−188.
7. Hanna BA. 1986. Methods in Enzymology 133:22−27.
8. Nilsson LE et al. 1989. J. Bioluminescence and Chemiluminescence 3:101−104.
9. Stanley PE 1989. J. Bioluminescence and Chemiluminescence 4:375−380.
10. Lundin A, Thore A. 1975. Applied Microbiology 30:713−721.
11. Ruzicka J, Hansen EH. 1981. Flow Injection Analysis. J. Wiley and Sons.
12. Karlberg B, Pacey GE. 1989. Flow Injection Analysis: A Practical Guide. Elsevier.
13. Valcarcel M and Luque De Castro MD, Flow−Injection Analysis. Principles and Applications. John Wiley & Sons, New York.
14. U.S. Patent No. 6,613,579.
15. U.S. Patent No. 6,716,391.
16. Lemasters JJ, Hackenbrock CR. 1979. Meth. Enzymol. 56:530−544.
17. Higashi T, et al. 1985. Thrombosis and Haemostasis 53:65−69.
Claims (82)
- 細菌を含有する疑いのある液体試料中の細菌を検出する方法であって、
(a)前記液体試料中に存在する可能性のある無傷の細菌細胞から無傷の真核細胞を分離するステップと、
(b)前記細菌細胞を溶解して液体中に細菌ATPを放出し、細菌溶解液を生成するステップと、
(c)前記細菌溶解液中の前記細菌ATPをATP消費酵素と接触させて、前記酵素が反応を触媒するATP測定液を生成するステップと、
(d)前記ATP測定液中の酵素触媒反応をモニタリングするステップと、を含む方法。 - 前記無傷の真核細胞は、血小板を含む、請求項1に記載の方法。
- 前記細菌細胞から無傷の真核細胞を分離するステップは、前記真核細胞を阻止して細菌細胞が通過できるようにするフィルターを使用して、前記真核細胞をろ過し、前記細菌細胞を含むろ過された液体試料を生成するステップを含む、請求項1に記載の方法。
- 前記フィルターは、1〜10ミクロンの細孔サイズである、請求項3に記載の方法。
- 前記フィルターは、2〜10ミクロンの細孔サイズである、請求項4に記載の方法。
- 前記フィルターは、4〜10ミクロンの細孔サイズである、請求項5に記載の方法。
- 前記真核細胞をろ過する前記ステップの後に、
前記ろ過した液体試料を、前記細菌を結合する担持表面と接触させるステップをさらに含む、請求項3に記載の方法。 - 前記担持表面は、ガラス、フィブロネクチン、ラミニン、コラーゲン、Arg−Gly−Aspオリゴペプチド、またはPhe−His−Arg−Arg−Ile−Lys−Ala(SEQ ID No.1)オリゴペプチドを含む、請求項7に記載の方法。
- 前記担持表面は、真核細胞を結合しない、請求項7に記載の方法。
- 前記細菌細胞は、前記担持表面に結合しながら溶解され、液体中に細菌ATPを放出して細菌溶解液を生成する、請求項7に記載の方法。
- 前記細菌細胞を溶解させるステップの前に、前記担持表面からの前記細胞を溶出液に溶出させるステップをさらに含む、請求項7に記載の方法。
- 前記真核細胞をろ過するステップの後に、1ミクロン未満の細孔サイズのフィルターを通して前記ろ過した液体試料をろ過するステップを含むプロセスによって、前記ろ過した液体試料中の前記細菌細胞を濃縮するステップをさらに含む、請求項3に記載の方法。
- 細菌細胞から無傷の真核細胞を分離するステップは、
前記液体試料を、前記細菌細胞を結合して前記真核細胞を結合しない担持表面と接触させるステップを含む、請求項1に記載の方法。 - 前記担持表面は、大部分の細菌種を結合する、請求項13に記載の方法。
- 前記担持表面は、ポリカチオンを含む、請求項14に記載の方法。
- 前記液体試料中に存在する可能性のある無傷の細菌細胞から無傷の真核細胞を分離するステップは、前記液体試料を、前記細菌を結合する担持表面と接触させるステップの前に、
前記真核細胞を阻止して前記細菌細胞が通過できるようにするフィルターを使用して、前記液体試料から前記真核細胞をろ過するステップをさらに含む、請求項13に記載の方法。 - 前記細菌細胞は、前記担持表面に結合しながら溶解され、液体中に細菌ATPを放出して細菌溶解液を生成する、請求項13に記載の方法。
- 前記細菌細胞を溶解させるステップの前に、前記担持表面から前記細菌細胞を溶出液に溶出させるステップをさらに含む、請求項13に記載の方法。
- 前記細菌細胞を溶解させるステップの前に、前記細菌細胞を濃縮するステップをさらに含む、請求項1に記載の方法。
- 前記ATP測定液の容量は、前記液体試料の容量の少なくとも10分の1である、請求項19に記載の方法。
- 前記細菌細胞は、熱または洗浄剤、あるいはその両方によって溶解される、請求項1に記載の方法。
- 前記細菌細胞は、酸または塩基によって溶解される、請求項1に記載の方法。
- 前記細菌細胞は、音響エネルギーまたは粒子との接触、あるいはその両方によって溶解される、請求項1に記載の方法。
- 前記細菌細胞は、有機溶媒によって溶解される、請求項1に記載の方法。
- 前記細菌細胞は、酵素、凍結融解、フレンチプレスまたはその組み合わせによって溶解される、請求項1に記載の方法。
- 前記酵素触媒反応をモニタリングするステップは、前記反応によって生成される生成物をモニタリングするステップを含む、請求項1に記載の方法。
- 前記生成物は、光である、請求項26に記載の方法。
- 前記酵素はルシフェラーゼであり、前記方法は、前記細菌ATPおよびルシフェラーゼをルシフェリンと接触させるステップをさらに含む、請求項27に記載の方法。
- 前記液体試料は、哺乳類の体液を含む、請求項1に記載の方法。
- 前記体液は、血液製剤である、請求項29に記載の方法。
- 前記血液製剤は、濃厚血小板である、請求項30に記載の方法。
- 前記血液製剤は、全血、血清、血漿、濃厚骨髄幹細胞、または濃厚赤血球である、請求項30に記載の方法。
- 前記血液製剤は、哺乳類への輸血用である、請求項30に記載の方法。
- 前記体液は、尿である、請求項29に記載の方法。
- 前記体液は、髄液である、請求項29に記載の方法。
- 前記方法は、前記液体試料1mlにつき10,000の細菌コロニー形成単位レベルにおいて、少なくとも3つの細菌属を検出する、請求項1に記載の方法。
- 前記方法は、前記液体試料1mlにつき1000の細菌コロニー形成単位レベルにおいて、少なくとも3つの細菌属を検出する、請求項36に記載の方法。
- 前記方法は、前記液体試料1mlにつき100の細菌コロニー形成単位レベルにおいて、少なくとも3つの細菌属を検出する、請求項37に記載の方法。
- 前記方法は、セレウス菌、枯草菌、ウェルシュ菌、コリネバクテリウム種、大腸菌、エンテロバクタークロアカ、クレブシエラオキシトカ、挫瘡プロピオンバクテリウム、緑膿菌、豚コレラ菌、セラチアマルセッセンス、黄色ブドウ球菌、表皮ブドウ球菌、化膿レンサ球菌、および緑色連鎖球菌の細菌種1mlにつき10,000またはそれ以下の細菌コロニー形成単位を検出する、請求項36に記載の方法。
- 前記液状試料は、5ml未満である、請求項1に記載の方法。
- ステップ(b)、(c)、および(d)は、自動化される、請求項1に記載の方法。
- ステップ(b)および(c)は、前記細菌細胞を、溶解剤、ルシフェラーゼ、およびルシフェリンを含有する混合物と接触させるステップを含む、請求項1に記載の方法。
- 前記自動化ステップは、2分未満で完了する、請求項41に記載の方法。
- 細菌を含有する疑いのある液体試料中の細菌を検出する方法であって、
前記液体試料を、前記細菌細胞を結合する担持表面と接触させて、前記細菌細胞を濃縮する、および/または前記液体試料中の他の成分から前記細菌細胞を分離するステップと、
前記細菌細胞を溶解して液体中に細菌ATPを放出し、細菌溶解液を生成するステップと、
前記細菌溶解液中の前記細菌ATPをATP消費酵素と接触させて、前記酵素が反応を触媒するATP測定液を生成するステップと、
前記ATP測定液中の酵素触媒反応をモニタリングするステップと、を含む方法。 - 前記液体試料を、細菌細胞を結合する担持表面と接触させるステップの前に、
前記液体試料中に存在する可能性のある細菌細胞を実質上溶解せずに、前記液体試料中に存在する可能性のある真核細胞を選択的に溶解するステップをさらに含む、請求項44に記載の方法。 - 前記液体試料を、細菌細胞を結合する担持表面と接触させるステップの前に、
前記真核細胞を阻止して前記細菌細胞が通過できるようにするフィルターを使用して、前記液体試料から、前記液体試料中に存在する可能性のある無傷の真核細胞をろ過するステップをさらに含む、請求項44に記載の方法。 - 前記担持表面は、細菌細胞を結合して真核細胞を結合しない、請求項44に記載の方法。
- 液状試料中の細菌を検出するためのシステムであって、
(a)液体試料中の無傷の細菌細胞から無傷の真核細胞を分離するための器具を受けるための保持手段と、
(b)液体試料中の無傷の細菌細胞から無傷の真核細胞を分離するための前記器具からの流体を受けるように構成された測定容器を形成する流体密封材料と、
(c)前記測定容器に機能的に接続して前記測定容器内に放射される光を検出する光検出器と、を備えるシステム。 - 保持手段(a)内の無傷の細菌細胞から無傷の真核細胞を分離するための器具をさらに備える、請求項48に記載のシステム。
- 無傷の細菌細胞から無傷の真核細胞を分離するための器具は、細菌を結合して真核細胞を結合しない担持表面を備える、請求項49に記載のシステム。
- 無傷の細菌細胞から無傷の真核細胞を分離するための器具は、真核細胞を阻止して細菌細胞が通過できるようにするフィルターを備える、請求項49に記載のシステム。
- 前記測定容器内にルシフェラーゼをさらに備える、請求項49に記載のシステム。
- (d)無傷の細菌細胞から無傷の真核細胞を分離するための前記器具と流体連通する液体試料貯蔵器を受けるための保持手段と、
(e)前記液体試料貯蔵器と、無傷の細菌細胞から無傷の真核細胞を分離するための前記器具(分離器具)と、前記測定容器とに機能的に連結して、液体を前記液体試料貯蔵器から前記分離器具に、および前記分離器具から前記測定容器に送り込むポンプとをさらに備える、請求項48に記載のシステム。 - 洗浄液受容器を受けるための保持手段と、
前記無傷の細菌細胞から無傷の真核細胞を分離するための器具と、前記測定容器と、前記液体試料貯蔵器と、前記洗浄液受容器と流体連通するマルチポート選択弁であって、ある位置にある前記液体試料貯蔵器から、および別の位置にある前記洗浄液受容器から、液体を透過させるために構成される前記マルチポート選択弁とをさらに備える、請求項53に記載のシステム。 - 前記ポンプおよび前記マルチポート選択弁に操作可能に連結し、前記液体試料貯蔵器から前記分離器具に、前記分離器具から前記測定容器に、および前記洗浄液受容器から前記測定容器に、所定の量の液体を供給するようにプログラムしたプロセッサをさらに備える、請求項54に記載のシステム。
- 前記光検出器からの処理済または未加工のデータを表示するための、前記光検出器に機能的に連結するディスプレイをさらに備える、請求項48に記載のシステム。
- 前記光検出器によって得られた光検出データを、関連する光ユニットに、または前記ディスプレイ上に表示される細菌細胞数に変換するようにプログラムしたプロセッサをさらに備える、請求項56に記載のシステム。
- 無傷の細菌細胞から無傷の真核細胞を分離するための器具と前記測定容器との間を流体連通する、無傷の細菌細胞を濃縮するための前記器具をさらに備える、請求項49に記載のシステム。
- 無傷の細菌細胞を濃縮するための前記器具は、細菌細胞の通過を阻止するフィルターを備える、請求項58に記載のシステム。
- 無傷の細菌細胞を濃縮するための前記器具は、細菌細胞を結合する担持表面を備える、請求項58に記載のシステム。
- 前記測定容器は、フロースルー細胞である、請求項48に記載のシステム。
- 液状試料中の細菌を検出するためのシステムであって、
(a)液体試料中の無傷の細菌細胞を結合する担持表面を受けるための保持手段と、
(b)液体試料中の無傷の細菌細胞を結合する前記担持表面からの流体を受けるように構成された測定容器を形成する流体密封材料と、
(c)前記測定容器に機能的に接続して前記測定容器内に放射される光を検出する光検出器と、を備えるシステム。 - 保持手段(a)内の無傷の細菌細胞を結合する前記担持表面をさらに備える、請求項62に記載のシステム。
- 前記担持表面は、ATPを結合しない、請求項63に記載のシステム。
- 前記担持表面は、前記液体試料中に存在する可能性のある無傷の真核細胞を結合しない、請求項63に記載のシステム。
- 細菌を検出するための、前記細菌を含有する疑いのある液体試料を調製するためのプロセスであって、
前記液体試料中に存在する可能性のある無傷の細菌細胞から無傷の真核細胞を分離し、その後の細菌検出試料中の細菌の検出のために、実質上真核細胞を含まない、前記細菌検出試料を生成するステップを含み、
前記細菌検出試料中の細菌の検出は、前記細菌を溶解するステップと、前記溶解細菌から放出されるATPをモニタリングするステップとを含むプロセス。 - 無傷の細菌細胞から無傷の真核細胞を分離するステップは、前記真核細胞を阻止して前記細菌細胞が通過できるようにするフィルターを使用して、前記真核細胞をろ過するステップを含む、請求項66に記載のプロセス。
- 前記真核細胞をろ過するステップの後に、前記液体試料中の前記無傷の細菌細胞を濃縮するステップをさらに含む、請求項67に記載のプロセス。
- 無傷の細菌細胞から無傷の真核細胞を分離するステップは、前記液体試料を、前記細菌細胞を結合して前記真核細胞を結合しない担持表面と接触させるステップを含む、請求項66に記載のプロセス。
- 細菌細胞を含有する疑いのある試料を受けるように構成された装置であって、
(a)前記細菌細胞を溶解して液体中に細菌ATPを放出し、細菌溶解液を生成するステップと、
(b)前記細菌溶解液中の前記細菌ATPをATP消費酵素と接触させて、前記酵素が反応を触媒するATP測定液を生成するステップと、
(c)前記ATP測定液中の酵素触媒反応をモニタリングするステップと、を含むステップを実行するように構成された装置。 - 細菌細胞を含有する疑いのある前記試料は液体試料であり、前記装置は、前記細菌細胞を溶解するステップの前に、前記液体試料内に存在する可能性のある無傷の細菌細胞から無傷の真核細胞を分離する更なるステップを実行する、請求項70に記載の装置。
- 前記細菌溶解液および前記ATP測定液は、それぞれ1ml未満である、請求項70に記載の装置。
- 前記装置は、ステップ(a)、(b)、および(c)を2分未満で実行する、請求項70に記載の装置。
- 前記装置は、前記ステップを2分未満で実行する、請求項71に記載の装置。
- (a)細菌細胞を含有する疑いのある試料を保持する容器を受けるように構成されたポートであって、前記容器は、(i)液体通過可能フィルターおよび細菌細胞を結合する担持表面、または(ii)細孔サイズが1ミクロン未満であり、無傷の細菌細胞への通過が不可能である液体通過可能フィルターを備える容器である、ポートと、
(b)前記ポートと流体連通し、(c)と流体連通する通路と、
(c)測定容器と、
(d)前記測定容器に機能的に接続して、前記測定容器内で放射された光を検出する光検出器と、
(e)前記通路および測定容器に機能的に接続し、液体を、前記通路を通して前記測定容器にポンピングするように構成されたポンプと、を備える装置であって、
(I)前記容器を前記ポート上で受けたときに、前記通路からの溶解液を、前記ポートおよび前記容器の前記液体通過可能フィルターを通して送り込み、前記容器中の細菌を溶解することによって、前記容器中に細菌ATPを含有する細菌溶解物を生成し、(II)前記容器からの前記細菌溶解物を、前記容器の前記液体通過可能フィルターを通して前記通路に送り込み、(III)前記細菌溶解物中の前記細菌ATPを、ルシフェラーゼおよびルシフェリンと接触させて、ATP測定液を形成し、(IV)前記測定容器中の前記ATP測定液からの光の放射をモニタリングするように構成された装置。 - 前記装置は、前記ポート上で受ける前記容器をさらに備える、請求項75に記載の装置。
- 前記通路および前記測定容器と流体連通するマルチポート選択弁と、
前記マルチポート選択弁と流体連通する溶解液容器を受けるための保持手段と、
前記マルチポート選択弁と流体連通する廃液用容器を受けるための保持手段とをさら備える、請求項75に記載の装置。 - 液体試料中に存在する可能性のある無傷の細菌細胞から真核細胞を分離して、細菌細胞を検査するための検査試料を生成するように構成された器具であって、
(a)(b)に連結する液体容器と、
(b)細菌分離部であって、(i)細孔サイズが1ミクロン未満であり、無傷の細菌細胞を阻止する第2のフィルターに連結する、真核細胞を阻止して前記細菌細胞が通過できるようにする第1のフィルター、および(ii)前記細菌細胞を結合するが前記真核細胞を結合しない担持表面から選択される細菌分離部とを備え、
使用時に、前記液体試料は、前記液体容器から細菌分離部を通って流れ、前記液体試料中に存在した可能性のある細菌細胞を含有する検査試料を生成し、前記検査試料は、実質上真核細胞を含まない器具。 - 前記細菌分離部は(i)であり、前記第1のフィルターは1〜10ミクロンの細孔サイズであり、前記第2のフィルターは1ミクロン未満の細孔サイズである、請求項78に記載の器具。
- 前記細菌分離部は(i)であり、細菌細胞を結合する担持表面を有するビードが、前記第1および第2のフィルター間に保持される、請求項78に記載の器具。
- 細菌を含有する疑いのある試料中の細菌の有無を決定するための装置であって、
(a)(b)に接続される、細菌細胞を含有する疑いのある試料を受けるための受容手段と、
(b)(c)に接続される、前記細菌細胞を溶解して細菌ATPを液体に放出し、細菌溶解液を生成するための手段と、
(c)(d)に接続される、前記細菌溶解液中の前記細菌ATPをATP消費発光酵素と接触させて、前記酵素が発光反応を触媒するATP測定液を生成するための手段と、
(d)前記ATP測定液中の前記酵素によって生じる光を検出するための光検出手段と、を備える装置。 - 液体試料中の無傷の細菌細胞から前記液体試料中の無傷の真核細胞を分離して、実質上真核細胞を含まない検査試料を生成するための細菌分離手段であって、前記細菌分離手段は、前記受容手段に連結する細菌分離手段をさらに備える、請求項81に記載の装置。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/968,203 US7419798B2 (en) | 2004-10-19 | 2004-10-19 | Rapid and sensitive detection of bacteria in blood products, urine, and other fluids |
| PCT/US2005/037449 WO2006044895A1 (en) | 2004-10-19 | 2005-10-19 | Rapid and sensitive detection of bacteria in blood products, urine, and other fluids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008516632A true JP2008516632A (ja) | 2008-05-22 |
| JP2008516632A5 JP2008516632A5 (ja) | 2011-10-20 |
Family
ID=36181241
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007537980A Pending JP2008516632A (ja) | 2004-10-19 | 2005-10-19 | 血液製剤、尿、および他の液体中の迅速かつ高感度な細菌の検出 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US7419798B2 (ja) |
| EP (1) | EP1812584A4 (ja) |
| JP (1) | JP2008516632A (ja) |
| CA (1) | CA2611448A1 (ja) |
| WO (1) | WO2006044895A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012525850A (ja) * | 2009-05-07 | 2012-10-25 | ビオメリュー・インコーポレイテッド | 抗生物質耐性測定方法 |
| WO2019097752A1 (ja) * | 2017-11-15 | 2019-05-23 | 国立大学法人 富山大学 | 血液検体の前処理方法 |
| WO2022239867A1 (ja) * | 2021-05-14 | 2022-11-17 | 株式会社堀場アドバンスドテクノ | 微生物検出装置及び微生物検出方法 |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7419798B2 (en) * | 2004-10-19 | 2008-09-02 | Zybac Llc | Rapid and sensitive detection of bacteria in blood products, urine, and other fluids |
| US8518069B2 (en) | 2005-09-07 | 2013-08-27 | Cabochon Aesthetics, Inc. | Dissection handpiece and method for reducing the appearance of cellulite |
| US9358033B2 (en) | 2005-09-07 | 2016-06-07 | Ulthera, Inc. | Fluid-jet dissection system and method for reducing the appearance of cellulite |
| US9011473B2 (en) | 2005-09-07 | 2015-04-21 | Ulthera, Inc. | Dissection handpiece and method for reducing the appearance of cellulite |
| US9486274B2 (en) | 2005-09-07 | 2016-11-08 | Ulthera, Inc. | Dissection handpiece and method for reducing the appearance of cellulite |
| US10548659B2 (en) | 2006-01-17 | 2020-02-04 | Ulthera, Inc. | High pressure pre-burst for improved fluid delivery |
| US7885793B2 (en) | 2007-05-22 | 2011-02-08 | International Business Machines Corporation | Method and system for developing a conceptual model to facilitate generating a business-aligned information technology solution |
| US9248317B2 (en) | 2005-12-02 | 2016-02-02 | Ulthera, Inc. | Devices and methods for selectively lysing cells |
| EP2021018A4 (en) * | 2006-05-18 | 2009-06-03 | Daniel G Ericson | Rapid detection of mycobacterial tuberculosis and resistance to antimicrobic acid |
| DE102006027114A1 (de) * | 2006-06-12 | 2007-12-13 | Robert Bosch Gmbh | Steuergerät und Verfahren zur Fahrerunterstützung |
| US20080131955A1 (en) * | 2006-11-30 | 2008-06-05 | Canon U.S. Life Sciences, Inc. | Method of Separating Target DNA from Mixed DNA |
| WO2008118390A2 (en) * | 2007-03-23 | 2008-10-02 | Wayne State University | Biomarkers for diagnostic and therapeutic methods |
| WO2008118387A2 (en) * | 2007-03-23 | 2008-10-02 | Wayne State University | Erythrocyte atp-release modulators |
| US20090093723A1 (en) * | 2007-10-05 | 2009-04-09 | Cabochon Aesthetics, Inc. | Ultrasound device including dispenser |
| US8439940B2 (en) | 2010-12-22 | 2013-05-14 | Cabochon Aesthetics, Inc. | Dissection handpiece with aspiration means for reducing the appearance of cellulite |
| WO2009129646A1 (en) * | 2008-04-21 | 2009-10-29 | Honeywell International Inc. | Luciferin-luciferase based microdevice for biosensing |
| FI20086237A0 (fi) * | 2008-12-23 | 2008-12-23 | Marko Pudas | Menetelmä ja laite mikro-organismien havaitsemiseksi nesteestä |
| US8518658B1 (en) * | 2009-04-27 | 2013-08-27 | University Of South Florida | ATP-bioluminescence immunoassay |
| TWI417388B (zh) * | 2009-05-08 | 2013-12-01 | Ind Tech Res Inst | 腺苷三磷酸再生循環的方法、偵測樣本中微生物的方法與其套組 |
| US20110076706A1 (en) * | 2009-06-26 | 2011-03-31 | Genprime, Inc. | Methods and kits for the rapid detection of microorganisms |
| US9358064B2 (en) | 2009-08-07 | 2016-06-07 | Ulthera, Inc. | Handpiece and methods for performing subcutaneous surgery |
| US11096708B2 (en) | 2009-08-07 | 2021-08-24 | Ulthera, Inc. | Devices and methods for performing subcutaneous surgery |
| WO2012075508A2 (en) * | 2010-12-03 | 2012-06-07 | Blood Cell Storage, Inc. | Processes for isolating microorganisms |
| DE102011077238B4 (de) * | 2011-06-09 | 2016-03-31 | Bayerische Motoren Werke Aktiengesellschaft | Verfahren zum Nachweis von Mikroorganismen in einem Hohlraumkonservierungsmittel |
| WO2013023198A2 (en) * | 2011-08-11 | 2013-02-14 | Zybac, Llc | Rapid and sensitive detection of bacteria in blood products, urine, and other fluids |
| DE102012109026A1 (de) * | 2012-09-25 | 2014-03-27 | Eads Deutschland Gmbh | Detektionsvorrichtung und Detektionsverfahren zur automatischen Bestimmung von Biomasse |
| US9228996B2 (en) | 2013-05-31 | 2016-01-05 | Empire Technology Development Llc | Method and device for detecting device colonization |
| WO2014193401A1 (en) | 2013-05-31 | 2014-12-04 | Empire Technology Development Llc | Color change indicator of biofilm formation |
| JP7062552B2 (ja) | 2018-08-06 | 2022-05-06 | 株式会社日立製作所 | 微生物検査 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6035262A (ja) * | 1983-05-16 | 1985-02-23 | パッカ−ド・インストルメント・カンパニ−・インコ−ポレ−テッド | Atpの分解及び測定並びに細胞の分解及び濃縮方法 |
| JP2000157295A (ja) * | 1998-11-25 | 2000-06-13 | Kikkoman Corp | 生細胞数の測定方法 |
| JP2002514916A (ja) * | 1997-01-15 | 2002-05-21 | ニュー ホライズンズ ダイアグノスティックス コーポレーション | 汚染物質の検出方法 |
| JP2003284589A (ja) * | 2002-03-29 | 2003-10-07 | D M L:Kk | 食品中の微生物の測定法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3933592A (en) | 1965-02-17 | 1976-01-20 | Hazleton Laboratories, Incorporated | Method of detecting living microorganisms |
| US3745090A (en) * | 1970-08-04 | 1973-07-10 | Nasa | Method of detecting and counting bacteria in body fluids |
| US4385113A (en) | 1978-03-20 | 1983-05-24 | Nasa | Rapid, quantitative determination of bacteria in water |
| US4283490A (en) | 1978-07-28 | 1981-08-11 | Plakas Chris J | Method for detection of low level bacterial concentration by luminescence |
| US4704355A (en) | 1985-03-27 | 1987-11-03 | New Horizons Diagnostics Corporation | Assay utilizing ATP encapsulated within liposome particles |
| DK258787D0 (da) * | 1987-05-21 | 1987-05-21 | Foss Electric As N | Fremgangsmaade til bestemmelse af bakteriekoncentration i en proeve |
| US5624810A (en) | 1995-01-09 | 1997-04-29 | New Horizons Diagnostics Corp. | Method for detection of surfaces contaminants |
| GB9709728D0 (en) | 1997-05-13 | 1997-07-02 | Dynal As | Single step method |
| US20020019062A1 (en) * | 1999-06-18 | 2002-02-14 | Peter Lea | Assay devices |
| GB0001450D0 (en) * | 2000-01-21 | 2000-03-08 | Genpoint As | Cell isolation method |
| US6332049B1 (en) | 2000-01-22 | 2001-12-18 | Global Fia, Inc. | Luminescence detector with liquid-core waveguide |
| US6395504B1 (en) | 2000-09-01 | 2002-05-28 | New Horizons Diagnostics Corp. | Use of phage associated lytic enzymes for the rapid detection of bacterial contaminants |
| US6613579B2 (en) | 2001-02-02 | 2003-09-02 | Global Fia, Inc. | Sequential injection liquid-liquid extraction |
| US6716391B1 (en) | 2003-03-20 | 2004-04-06 | Global Fia, Inc. | Automated chemiluminescence analyzer |
| US7419798B2 (en) * | 2004-10-19 | 2008-09-02 | Zybac Llc | Rapid and sensitive detection of bacteria in blood products, urine, and other fluids |
-
2004
- 2004-10-19 US US10/968,203 patent/US7419798B2/en not_active Expired - Fee Related
-
2005
- 2005-10-19 CA CA002611448A patent/CA2611448A1/en not_active Abandoned
- 2005-10-19 WO PCT/US2005/037449 patent/WO2006044895A1/en not_active Ceased
- 2005-10-19 JP JP2007537980A patent/JP2008516632A/ja active Pending
- 2005-10-19 EP EP05812518A patent/EP1812584A4/en not_active Withdrawn
-
2008
- 2008-08-14 US US12/228,602 patent/US20090239248A1/en not_active Abandoned
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6035262A (ja) * | 1983-05-16 | 1985-02-23 | パッカ−ド・インストルメント・カンパニ−・インコ−ポレ−テッド | Atpの分解及び測定並びに細胞の分解及び濃縮方法 |
| JP2002514916A (ja) * | 1997-01-15 | 2002-05-21 | ニュー ホライズンズ ダイアグノスティックス コーポレーション | 汚染物質の検出方法 |
| JP2000157295A (ja) * | 1998-11-25 | 2000-06-13 | Kikkoman Corp | 生細胞数の測定方法 |
| JP2003284589A (ja) * | 2002-03-29 | 2003-10-07 | D M L:Kk | 食品中の微生物の測定法 |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012525850A (ja) * | 2009-05-07 | 2012-10-25 | ビオメリュー・インコーポレイテッド | 抗生物質耐性測定方法 |
| WO2019097752A1 (ja) * | 2017-11-15 | 2019-05-23 | 国立大学法人 富山大学 | 血液検体の前処理方法 |
| JPWO2019097752A1 (ja) * | 2017-11-15 | 2020-12-03 | 国立大学法人富山大学 | 血液検体の前処理方法 |
| WO2022239867A1 (ja) * | 2021-05-14 | 2022-11-17 | 株式会社堀場アドバンスドテクノ | 微生物検出装置及び微生物検出方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20060084127A1 (en) | 2006-04-20 |
| WO2006044895A1 (en) | 2006-04-27 |
| EP1812584A1 (en) | 2007-08-01 |
| EP1812584A4 (en) | 2008-05-21 |
| US7419798B2 (en) | 2008-09-02 |
| US20090239248A1 (en) | 2009-09-24 |
| CA2611448A1 (en) | 2006-04-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2008516632A (ja) | 血液製剤、尿、および他の液体中の迅速かつ高感度な細菌の検出 | |
| US9260737B2 (en) | Rapid and sensitive detection of bacteria in blood products, urine, and other fluids | |
| Palavecino et al. | Detecting bacterial contamination in platelet products | |
| CA1125152A (en) | Selective determination of viable somatic and microbial cells | |
| EP2649193B1 (en) | Microorganism concentration process and device | |
| US9068976B2 (en) | Integrated filtration bioanalyzer | |
| US10119114B2 (en) | Device for the lysis of microorganisms present in an environmental or clinical sample and the extraction of nucleic acids from said microorganisms for analysis | |
| TW565616B (en) | Method and apparatus for detecting bacteria | |
| US20090162891A1 (en) | Effective Monitoring System or Anthrax, Smallpox, or Other Pathogens | |
| CN101819200A (zh) | 微生物检测装置、检测方法、以及用于该装置的试样容器 | |
| US9677981B2 (en) | Sample concentrator and method of use | |
| KR20200062321A (ko) | 샘플에서 온전한 미생물의 농도를 결정하는 방법 | |
| CN113684118B (zh) | 一种集成核酸分析芯片 | |
| US8846384B2 (en) | System for detecting microbial contamination | |
| EP1593747B2 (en) | Process for the enumeration and identification of microorganisms | |
| US9962694B2 (en) | Multiwell plate | |
| US9428787B2 (en) | Apparatus and method for processing a sample | |
| US20080305538A1 (en) | Rapid and Sensitive Detection of Bacteria in Blood Products, Urine, and Other Fluids | |
| US20160017274A1 (en) | Device and method for treating a filtration medium | |
| US5416002A (en) | Near-real-time microbial monitor | |
| EP0126019A2 (en) | High resolution method of measuring ATP, and concentrating and measuring unicellular organisms | |
| US20240376515A1 (en) | Method and apparatus for rapidly testing microorganism | |
| Wallis et al. | Rapid, colorimetric method for the detection of microorganisms in blood culture | |
| JP2022528909A (ja) | 流体内の細菌汚染物の存在を特定するための装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081015 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110517 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110817 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110826 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20110831 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110927 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120306 |