JP2007517841A - 1,3−ジフェニルプロプ−2−エン−1−オン誘導体化合物、その調製方法およびその使用 - Google Patents
1,3−ジフェニルプロプ−2−エン−1−オン誘導体化合物、その調製方法およびその使用 Download PDFInfo
- Publication number
- JP2007517841A JP2007517841A JP2006548344A JP2006548344A JP2007517841A JP 2007517841 A JP2007517841 A JP 2007517841A JP 2006548344 A JP2006548344 A JP 2006548344A JP 2006548344 A JP2006548344 A JP 2006548344A JP 2007517841 A JP2007517841 A JP 2007517841A
- Authority
- JP
- Japan
- Prior art keywords
- dimethylphenyl
- prop
- compound
- carboxydimethylmethyloxy
- tert
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000000034 method Methods 0.000 title claims abstract description 17
- -1 1,3-diphenylprop-2-en-1-one derivative compound Chemical class 0.000 title claims abstract description 16
- 238000002360 preparation method Methods 0.000 title description 10
- 230000008569 process Effects 0.000 title description 4
- 150000001875 compounds Chemical class 0.000 claims abstract description 343
- 239000000203 mixture Substances 0.000 claims abstract description 35
- 239000002537 cosmetic Substances 0.000 claims abstract description 19
- 238000011282 treatment Methods 0.000 claims description 47
- 125000000217 alkyl group Chemical group 0.000 claims description 27
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 23
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 15
- DQFBYFPFKXHELB-VAWYXSNFSA-N trans-chalcone Chemical class C=1C=CC=CC=1C(=O)\C=C\C1=CC=CC=C1 DQFBYFPFKXHELB-VAWYXSNFSA-N 0.000 claims description 15
- 229910052717 sulfur Inorganic materials 0.000 claims description 13
- 208000024172 Cardiovascular disease Diseases 0.000 claims description 12
- 206010012601 diabetes mellitus Diseases 0.000 claims description 12
- 230000001225 therapeutic effect Effects 0.000 claims description 12
- 208000006673 asthma Diseases 0.000 claims description 11
- 125000004434 sulfur atom Chemical group 0.000 claims description 11
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 10
- 208000008589 Obesity Diseases 0.000 claims description 9
- 125000003118 aryl group Chemical group 0.000 claims description 9
- 235000020824 obesity Nutrition 0.000 claims description 9
- 230000036542 oxidative stress Effects 0.000 claims description 9
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 9
- 208000032928 Dyslipidaemia Diseases 0.000 claims description 8
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 8
- 125000001424 substituent group Chemical group 0.000 claims description 8
- 206010020772 Hypertension Diseases 0.000 claims description 7
- 208000017170 Lipid metabolism disease Diseases 0.000 claims description 7
- 125000005843 halogen group Chemical group 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 230000002378 acidificating effect Effects 0.000 claims description 6
- 208000035475 disorder Diseases 0.000 claims description 6
- 229910052736 halogen Inorganic materials 0.000 claims description 6
- 150000002367 halogens Chemical class 0.000 claims description 6
- 125000000623 heterocyclic group Chemical group 0.000 claims description 6
- 208000027866 inflammatory disease Diseases 0.000 claims description 6
- 230000007170 pathology Effects 0.000 claims description 6
- YZJHPDOUIGUCCH-UHFFFAOYSA-N 4-[3-(2,5-dimethoxyphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound COC1=C(C=C(C=C1)OC)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O YZJHPDOUIGUCCH-UHFFFAOYSA-N 0.000 claims description 5
- 201000004681 Psoriasis Diseases 0.000 claims description 5
- 230000032683 aging Effects 0.000 claims description 5
- 125000003545 alkoxy group Chemical group 0.000 claims description 5
- 229920006395 saturated elastomer Polymers 0.000 claims description 5
- 208000011580 syndromic disease Diseases 0.000 claims description 5
- 208000002874 Acne Vulgaris Diseases 0.000 claims description 4
- 206010012438 Dermatitis atopic Diseases 0.000 claims description 4
- 206010000496 acne Diseases 0.000 claims description 4
- 201000008937 atopic dermatitis Diseases 0.000 claims description 4
- 230000009759 skin aging Effects 0.000 claims description 4
- 208000017520 skin disease Diseases 0.000 claims description 4
- IOXYBFKVJCXHMG-UHFFFAOYSA-N 1-(2,5-dimethoxyphenyl)-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound COC1=CC=C(OC)C(C(=O)C=CC=2C=C(C)C(O)=C(C)C=2)=C1 IOXYBFKVJCXHMG-UHFFFAOYSA-N 0.000 claims description 3
- MLNXZIPKXFVQSH-UHFFFAOYSA-N 1-(3-fluoro-4-methoxyphenyl)-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound C1=C(F)C(OC)=CC=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 MLNXZIPKXFVQSH-UHFFFAOYSA-N 0.000 claims description 3
- XJTNFNPERFLFPE-UHFFFAOYSA-N 1-(4-bromophenyl)-3-(3,5-difluoro-4-hydroxyphenyl)prop-2-en-1-one Chemical compound C1=C(F)C(O)=C(F)C=C1C=CC(=O)C1=CC=C(Br)C=C1 XJTNFNPERFLFPE-UHFFFAOYSA-N 0.000 claims description 3
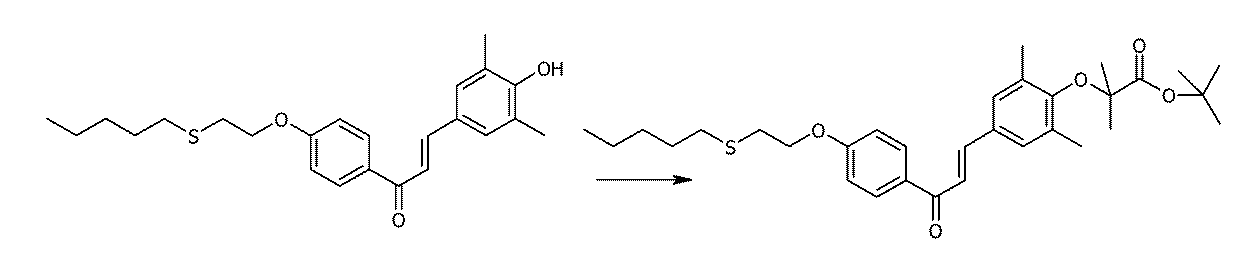
- ZBDFHQYORKQJBC-UHFFFAOYSA-N 1-(4-hexylsulfanyl-3,5-dimethylphenyl)-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound C1=C(C)C(SCCCCCC)=C(C)C=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 ZBDFHQYORKQJBC-UHFFFAOYSA-N 0.000 claims description 3
- FQBCNFWXCTYJTH-UHFFFAOYSA-N 1-[4-(2-cyclohexylethoxy)-3,5-dimethylphenyl]-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound CC1=C(O)C(C)=CC(C=CC(=O)C=2C=C(C)C(OCCC3CCCCC3)=C(C)C=2)=C1 FQBCNFWXCTYJTH-UHFFFAOYSA-N 0.000 claims description 3
- TUQRZMCSNAVOQZ-UHFFFAOYSA-N 1-[4-(2-cyclohexylethoxy)phenyl]-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound CC1=C(O)C(C)=CC(C=CC(=O)C=2C=CC(OCCC3CCCCC3)=CC=2)=C1 TUQRZMCSNAVOQZ-UHFFFAOYSA-N 0.000 claims description 3
- BUHOTSFBACRTCD-UHFFFAOYSA-N 1-[4-(2-cyclohexylsulfanylethoxy)-3,5-dimethylphenyl]-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound CC1=C(O)C(C)=CC(C=CC(=O)C=2C=C(C)C(OCCSC3CCCCC3)=C(C)C=2)=C1 BUHOTSFBACRTCD-UHFFFAOYSA-N 0.000 claims description 3
- KLZVVIYBKRTDBQ-UHFFFAOYSA-N 1-[4-(2-cyclohexylsulfanylethoxy)phenyl]-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound CC1=C(O)C(C)=CC(C=CC(=O)C=2C=CC(OCCSC3CCCCC3)=CC=2)=C1 KLZVVIYBKRTDBQ-UHFFFAOYSA-N 0.000 claims description 3
- WGANMSWMGHTEJI-UHFFFAOYSA-N 2,6-dimethyl-4-[3-oxo-3-(2,3,4,5,6-pentamethylphenyl)prop-1-enyl]-3-propan-2-yloxybenzoic acid Chemical compound CC1=C(C(=C(C(=C1C)C)C)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O WGANMSWMGHTEJI-UHFFFAOYSA-N 0.000 claims description 3
- VRLJEZHONSHEJI-UHFFFAOYSA-N 2,6-dimethyl-4-[3-oxo-3-(2,4,5-trimethylphenyl)prop-1-enyl]-3-propan-2-yloxybenzoic acid Chemical compound CC1=C(C=C(C(=C1)C)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O VRLJEZHONSHEJI-UHFFFAOYSA-N 0.000 claims description 3
- QKYXLSKXTQGCIA-UHFFFAOYSA-N 2,6-dimethyl-4-[3-oxo-3-(4-phenoxyphenyl)prop-1-enyl]-3-propan-2-yloxybenzoic acid Chemical compound C1(=CC=CC=C1)OC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O QKYXLSKXTQGCIA-UHFFFAOYSA-N 0.000 claims description 3
- RZHDVSWGAHATAI-UHFFFAOYSA-N 2,6-dimethyl-4-[3-oxo-3-[4-(2-pentylsulfanylethoxy)phenyl]prop-1-enyl]-3-propan-2-yloxybenzoic acid Chemical compound C(CCCC)SCCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O RZHDVSWGAHATAI-UHFFFAOYSA-N 0.000 claims description 3
- BIGVLJCQZYEIPT-UHFFFAOYSA-N 2-fluoro-3-methoxy-5,6-dimethyl-4-[3-(4-methylthiophen-2-yl)-3-oxoprop-1-enyl]benzoic acid Chemical compound COC1=C(F)C(C(O)=O)=C(C)C(C)=C1C=CC(=O)C1=CC(C)=CS1 BIGVLJCQZYEIPT-UHFFFAOYSA-N 0.000 claims description 3
- UQOHVOXLYGWBKV-UHFFFAOYSA-N 3-(3,5-dibromo-4-hydroxyphenyl)-1-(4-methylsulfanylphenyl)prop-2-en-1-one Chemical compound C1=CC(SC)=CC=C1C(=O)C=CC1=CC(Br)=C(O)C(Br)=C1 UQOHVOXLYGWBKV-UHFFFAOYSA-N 0.000 claims description 3
- JPNPMEFSDBMGGP-UHFFFAOYSA-N 3-(3-fluoro-4-hydroxyphenyl)-1-(4-methylsulfanylphenyl)prop-2-en-1-one Chemical compound C1=CC(SC)=CC=C1C(=O)C=CC1=CC=C(O)C(F)=C1 JPNPMEFSDBMGGP-UHFFFAOYSA-N 0.000 claims description 3
- ZVQMDIITJRBZSO-UHFFFAOYSA-N 3-(4-hydroxy-3,5-dimethylphenyl)-1-(2,3,4,5,6-pentamethylphenyl)prop-2-en-1-one Chemical compound CC1=C(O)C(C)=CC(C=CC(=O)C=2C(=C(C)C(C)=C(C)C=2C)C)=C1 ZVQMDIITJRBZSO-UHFFFAOYSA-N 0.000 claims description 3
- SEANRLLEWLBVSO-UHFFFAOYSA-N 3-(4-hydroxy-3,5-dimethylphenyl)-1-(2,4,5-trimethylphenyl)prop-2-en-1-one Chemical compound C1=C(C)C(C)=CC(C)=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 SEANRLLEWLBVSO-UHFFFAOYSA-N 0.000 claims description 3
- ISVRYVYIDJENEK-UHFFFAOYSA-N 3-(4-hydroxy-3,5-dimethylphenyl)-1-(4-methoxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound C1=C(C)C(OC)=C(C)C=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 ISVRYVYIDJENEK-UHFFFAOYSA-N 0.000 claims description 3
- ZTVFQCYMCVWXFN-UHFFFAOYSA-N 3-(4-hydroxy-3,5-dimethylphenyl)-1-(4-methoxy-3-methylphenyl)prop-2-en-1-one Chemical compound C1=C(C)C(OC)=CC=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 ZTVFQCYMCVWXFN-UHFFFAOYSA-N 0.000 claims description 3
- YYWUDJDVKGYMJI-UHFFFAOYSA-N 3-(4-hydroxy-3,5-dimethylphenyl)-1-(4-phenoxyphenyl)prop-2-en-1-one Chemical compound CC1=C(O)C(C)=CC(C=CC(=O)C=2C=CC(OC=3C=CC=CC=3)=CC=2)=C1 YYWUDJDVKGYMJI-UHFFFAOYSA-N 0.000 claims description 3
- LOHCARXQOPHEHX-UHFFFAOYSA-N 3-(4-hydroxy-3,5-dimethylphenyl)-1-[4-(2-pentylsulfanylethoxy)phenyl]prop-2-en-1-one Chemical compound C1=CC(OCCSCCCCC)=CC=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 LOHCARXQOPHEHX-UHFFFAOYSA-N 0.000 claims description 3
- CSAHGCSHBDPIFK-UHFFFAOYSA-N 3-(4-hydroxy-3,5-dimethylphenyl)-1-[4-methoxy-3-(trifluoromethyl)phenyl]prop-2-en-1-one Chemical compound C1=C(C(F)(F)F)C(OC)=CC=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 CSAHGCSHBDPIFK-UHFFFAOYSA-N 0.000 claims description 3
- SEQIYSPDTWOPHP-UHFFFAOYSA-N 4-[3-(3,5-dimethyl-4-methylsulfanylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound CSC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C SEQIYSPDTWOPHP-UHFFFAOYSA-N 0.000 claims description 3
- UOCURAROBOPCBI-UHFFFAOYSA-N 4-[3-(3,5-dimethyl-4-propoxyphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C(CC)OC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C UOCURAROBOPCBI-UHFFFAOYSA-N 0.000 claims description 3
- YOVCEOQWBFDKNI-UHFFFAOYSA-N 4-[3-(3-fluoro-4-methoxyphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound COC1=C(C=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)F YOVCEOQWBFDKNI-UHFFFAOYSA-N 0.000 claims description 3
- XKJCULKMXSGXEM-UHFFFAOYSA-N 4-[3-(4-bromophenyl)-3-oxoprop-1-enyl]-2,6-difluoro-3-propan-2-yloxybenzoic acid Chemical compound BrC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)F)C(=O)O)F)OC(C)C)=O XKJCULKMXSGXEM-UHFFFAOYSA-N 0.000 claims description 3
- YORBFUDUTSDBBV-UHFFFAOYSA-N 4-[3-(4-hexoxy-3,5-dimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C(CCCCC)OC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C YORBFUDUTSDBBV-UHFFFAOYSA-N 0.000 claims description 3
- DSFKLZVTSHKPSL-UHFFFAOYSA-N 4-[3-(4-hexylsulfanyl-3,5-dimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C(CCCCC)SC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C DSFKLZVTSHKPSL-UHFFFAOYSA-N 0.000 claims description 3
- LAERXLUDQDUJTC-UHFFFAOYSA-N 4-[3-(4-methoxy-3,5-dimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound COC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C LAERXLUDQDUJTC-UHFFFAOYSA-N 0.000 claims description 3
- ILGUAFCUMJUUJQ-UHFFFAOYSA-N 4-[3-(4-methoxy-3-methylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound COC1=C(C=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C ILGUAFCUMJUUJQ-UHFFFAOYSA-N 0.000 claims description 3
- PZYRDJYDJFZLAG-UHFFFAOYSA-N 4-[3-[3,5-dimethyl-4-(2-morpholin-4-ylethoxy)phenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound CC=1C=C(C=C(C=1OCCN1CCOCC1)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O PZYRDJYDJFZLAG-UHFFFAOYSA-N 0.000 claims description 3
- DUVKKJZMTVRDSZ-UHFFFAOYSA-N 4-[3-[4-(2-cyclohexylethoxy)phenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C1(CCCCC1)CCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O DUVKKJZMTVRDSZ-UHFFFAOYSA-N 0.000 claims description 3
- GQZBNUSQJKXGFQ-UHFFFAOYSA-N 4-[3-[4-(2-cyclohexylsulfanylethoxy)-3,5-dimethylphenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C1(CCCCC1)SCCOC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C GQZBNUSQJKXGFQ-UHFFFAOYSA-N 0.000 claims description 3
- ZFVXGPKTFCDLLA-UHFFFAOYSA-N 4-[3-[4-(2-cyclohexylsulfanylethoxy)phenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C1(CCCCC1)SCCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O ZFVXGPKTFCDLLA-UHFFFAOYSA-N 0.000 claims description 3
- ZZYKBBXKEDPZNK-UHFFFAOYSA-N 4-[3-[4-methoxy-3-(trifluoromethyl)phenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound COC1=C(C=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C(F)(F)F ZZYKBBXKEDPZNK-UHFFFAOYSA-N 0.000 claims description 3
- UKWGUNJZWVOVHD-UHFFFAOYSA-N CSC1=CC=C(C=C1)CC=CC1=C(C(=C(C(=C1)Br)C(=O)O)Br)OC(C)C Chemical compound CSC1=CC=C(C=C1)CC=CC1=C(C(=C(C(=C1)Br)C(=O)O)Br)OC(C)C UKWGUNJZWVOVHD-UHFFFAOYSA-N 0.000 claims description 3
- DCHZUJHLWKZEAO-UHFFFAOYSA-N CSC1=CC=C(C=C1)CC=CC1=C(C(=C(C(=C1)Br)C(=O)OC(C)(C)C)Br)OC(C)C Chemical compound CSC1=CC=C(C=C1)CC=CC1=C(C(=C(C(=C1)Br)C(=O)OC(C)(C)C)Br)OC(C)C DCHZUJHLWKZEAO-UHFFFAOYSA-N 0.000 claims description 3
- QZQAMBJPNMFNNK-UHFFFAOYSA-N Cl.CC=1C=C(C=C(C1OCCN1CCOCC1)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OCC)C)OC(C)C)=O Chemical compound Cl.CC=1C=C(C=C(C1OCCN1CCOCC1)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OCC)C)OC(C)C)=O QZQAMBJPNMFNNK-UHFFFAOYSA-N 0.000 claims description 3
- SXAKQEFXADCVHU-UHFFFAOYSA-N OC1=C(C=C(C=C1C)CC=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)C Chemical compound OC1=C(C=C(C=C1C)CC=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)C SXAKQEFXADCVHU-UHFFFAOYSA-N 0.000 claims description 3
- ZSSKJWHOUXDLHB-UHFFFAOYSA-N OC1=C(C=C(C=C1C)CC=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)C Chemical compound OC1=C(C=C(C=C1C)CC=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)C ZSSKJWHOUXDLHB-UHFFFAOYSA-N 0.000 claims description 3
- 239000013543 active substance Substances 0.000 claims description 3
- 125000003342 alkenyl group Chemical group 0.000 claims description 3
- 229910052760 oxygen Inorganic materials 0.000 claims description 3
- 239000001301 oxygen Substances 0.000 claims description 3
- XJBAEHOHLGGTFL-UHFFFAOYSA-N tert-butyl 2,6-dimethyl-4-[3-oxo-3-(2,3,4,5,6-pentamethylphenyl)prop-1-enyl]-3-propan-2-yloxybenzoate Chemical compound CC1=C(C(=C(C(=C1C)C)C)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O XJBAEHOHLGGTFL-UHFFFAOYSA-N 0.000 claims description 3
- GOQNQORJHRZGDQ-UHFFFAOYSA-N tert-butyl 2,6-dimethyl-4-[3-oxo-3-(2,4,5-trimethylphenyl)prop-1-enyl]-3-propan-2-yloxybenzoate Chemical compound CC1=C(C=C(C(=C1)C)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O GOQNQORJHRZGDQ-UHFFFAOYSA-N 0.000 claims description 3
- AGEZNSCDVHGFRZ-UHFFFAOYSA-N tert-butyl 2,6-dimethyl-4-[3-oxo-3-(4-phenoxyphenyl)prop-1-enyl]-3-propan-2-yloxybenzoate Chemical compound C1(=CC=CC=C1)OC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O AGEZNSCDVHGFRZ-UHFFFAOYSA-N 0.000 claims description 3
- KTTRJOMYYFSOAG-UHFFFAOYSA-N tert-butyl 2,6-dimethyl-4-[3-oxo-3-[4-(2-pentylsulfanylethoxy)phenyl]prop-1-enyl]-3-propan-2-yloxybenzoate Chemical compound C(CCCC)SCCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O KTTRJOMYYFSOAG-UHFFFAOYSA-N 0.000 claims description 3
- LVORARIMJQPAJK-UHFFFAOYSA-N tert-butyl 2-fluoro-3-methoxy-5,6-dimethyl-4-[3-(4-methylthiophen-2-yl)-3-oxoprop-1-enyl]benzoate Chemical compound COC1=C(F)C(C(=O)OC(C)(C)C)=C(C)C(C)=C1C=CC(=O)C1=CC(C)=CS1 LVORARIMJQPAJK-UHFFFAOYSA-N 0.000 claims description 3
- IZJNHAQNQVUGGL-UHFFFAOYSA-N tert-butyl 4-[3-(2,5-dimethoxyphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound COC1=C(C=C(C=C1)OC)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O IZJNHAQNQVUGGL-UHFFFAOYSA-N 0.000 claims description 3
- NCSVDKCQMKOCIZ-UHFFFAOYSA-N tert-butyl 4-[3-(3,5-dimethyl-4-methylsulfanylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound CSC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C NCSVDKCQMKOCIZ-UHFFFAOYSA-N 0.000 claims description 3
- IQDDZCWTVVLUDE-UHFFFAOYSA-N tert-butyl 4-[3-(3,5-dimethyl-4-propoxyphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound C(CC)OC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C IQDDZCWTVVLUDE-UHFFFAOYSA-N 0.000 claims description 3
- APZRCYQNMFRGHS-UHFFFAOYSA-N tert-butyl 4-[3-(3-fluoro-4-methoxyphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound COC1=C(C=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)F APZRCYQNMFRGHS-UHFFFAOYSA-N 0.000 claims description 3
- XNLMSJYHCPPVRZ-UHFFFAOYSA-N tert-butyl 4-[3-(4-bromophenyl)-3-oxoprop-1-enyl]-2,6-difluoro-3-propan-2-yloxybenzoate Chemical compound BrC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)F)C(=O)OC(C)(C)C)F)OC(C)C)=O XNLMSJYHCPPVRZ-UHFFFAOYSA-N 0.000 claims description 3
- FHVRJHDWWXGGLG-UHFFFAOYSA-N tert-butyl 4-[3-(4-hexoxy-3,5-dimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound C(CCCCC)OC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C FHVRJHDWWXGGLG-UHFFFAOYSA-N 0.000 claims description 3
- WOVLRQBTZQPGPD-UHFFFAOYSA-N tert-butyl 4-[3-(4-hexylsulfanyl-3,5-dimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound C(CCCCC)SC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C WOVLRQBTZQPGPD-UHFFFAOYSA-N 0.000 claims description 3
- XTODTFMCNIFADA-UHFFFAOYSA-N tert-butyl 4-[3-(4-methoxy-3,5-dimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound COC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C XTODTFMCNIFADA-UHFFFAOYSA-N 0.000 claims description 3
- KUPDWGRPVFZKTP-UHFFFAOYSA-N tert-butyl 4-[3-(4-methoxy-3-methylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound COC1=C(C=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C KUPDWGRPVFZKTP-UHFFFAOYSA-N 0.000 claims description 3
- XLACVUYLJSYURZ-UHFFFAOYSA-N tert-butyl 4-[3-[4-(2-cyclohexylethoxy)-3,5-dimethylphenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound C1(CCCCC1)CCOC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C XLACVUYLJSYURZ-UHFFFAOYSA-N 0.000 claims description 3
- APDIOXRLTUKUFW-UHFFFAOYSA-N tert-butyl 4-[3-[4-(2-cyclohexylethoxy)phenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound C1(CCCCC1)CCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O APDIOXRLTUKUFW-UHFFFAOYSA-N 0.000 claims description 3
- YKNSNPBQSPTECB-UHFFFAOYSA-N tert-butyl 4-[3-[4-(2-cyclohexylsulfanylethoxy)-3,5-dimethylphenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound C1(CCCCC1)SCCOC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C YKNSNPBQSPTECB-UHFFFAOYSA-N 0.000 claims description 3
- AHOZKQCGEXHOAV-UHFFFAOYSA-N tert-butyl 4-[3-[4-(2-cyclohexylsulfanylethoxy)phenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound C1(CCCCC1)SCCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O AHOZKQCGEXHOAV-UHFFFAOYSA-N 0.000 claims description 3
- BOPBPTCRNPKJSI-UHFFFAOYSA-N tert-butyl 4-[3-[4-methoxy-3-(trifluoromethyl)phenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound COC1=C(C=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)OC(C)(C)C)C)OC(C)C)=O)C(F)(F)F BOPBPTCRNPKJSI-UHFFFAOYSA-N 0.000 claims description 3
- FWWJTQRUGFNVQN-UHFFFAOYSA-N 2,6-dimethyl-4-[3-[4-(2-morpholin-4-ylethoxy)phenyl]-3-oxoprop-1-enyl]-3-propan-2-yloxybenzoic acid Chemical compound N1(CCOCC1)CCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O FWWJTQRUGFNVQN-UHFFFAOYSA-N 0.000 claims description 2
- ZIVPDLRSYMEFGX-UHFFFAOYSA-N 2,6-dimethyl-4-[3-oxo-3-[4-(2-phenylethoxy)phenyl]prop-1-enyl]-3-propan-2-yloxybenzoic acid Chemical compound C1(=CC=CC=C1)CCOC1=CC=C(C=C1)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O ZIVPDLRSYMEFGX-UHFFFAOYSA-N 0.000 claims description 2
- HPGBIPCQIAZBBS-UHFFFAOYSA-N 4-[3-(2,5-dihydroxy-3,4,6-trimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound OC1=C(C(=C(C(=C1C)C)O)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O HPGBIPCQIAZBBS-UHFFFAOYSA-N 0.000 claims description 2
- OLPHHMFCWNLPDM-UHFFFAOYSA-N 4-[3-(2,5-dihydroxyphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound OC1=C(C=C(C=C1)O)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O OLPHHMFCWNLPDM-UHFFFAOYSA-N 0.000 claims description 2
- DJEQRLAVSGJJPD-UHFFFAOYSA-N 4-[3-(2,5-dimethoxy-3,4,6-trimethylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound COC1=C(C(=C(C(=C1C)C)OC)C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O DJEQRLAVSGJJPD-UHFFFAOYSA-N 0.000 claims description 2
- PEARMUHAMCHBLA-UHFFFAOYSA-N 4-[3-(3,5-dimethyl-4-sulfanylphenyl)-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound SC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C PEARMUHAMCHBLA-UHFFFAOYSA-N 0.000 claims description 2
- QQSQIVQDGQYDOE-UHFFFAOYSA-N 4-[3-[4-(2-cyclohexylethoxy)-3,5-dimethylphenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C1(CCCCC1)CCOC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C QQSQIVQDGQYDOE-UHFFFAOYSA-N 0.000 claims description 2
- DLZBWJHPPWRVRO-UHFFFAOYSA-N 4-[3-[4-(2-cyclohexylethylsulfanyl)-3,5-dimethylphenyl]-3-oxoprop-1-enyl]-2,6-dimethyl-3-propan-2-yloxybenzoic acid Chemical compound C1(CCCCC1)CCSC1=C(C=C(C=C1C)C(C=CC1=C(C(=C(C(=C1)C)C(=O)O)C)OC(C)C)=O)C DLZBWJHPPWRVRO-UHFFFAOYSA-N 0.000 claims description 2
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 claims description 2
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 claims description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 2
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 2
- 125000006165 cyclic alkyl group Chemical group 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- 125000000565 sulfonamide group Chemical group 0.000 claims description 2
- 239000011593 sulfur Substances 0.000 claims description 2
- 125000003831 tetrazolyl group Chemical group 0.000 claims description 2
- 150000003573 thiols Chemical class 0.000 claims description 2
- KTYJYUOPXIKRAL-UHFFFAOYSA-N 1-[2-(3,5-dimethyl-4-methylsulfanylphenyl)phenyl]-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound C1=C(C)C(SC)=C(C)C=C1C1=CC=CC=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 KTYJYUOPXIKRAL-UHFFFAOYSA-N 0.000 claims 1
- 125000004429 atom Chemical group 0.000 claims 1
- 239000003814 drug Substances 0.000 abstract description 7
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 132
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 93
- 238000005160 1H NMR spectroscopy Methods 0.000 description 85
- 238000007429 general method Methods 0.000 description 83
- 230000006698 induction Effects 0.000 description 68
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 65
- 239000000741 silica gel Substances 0.000 description 65
- 229910002027 silica gel Inorganic materials 0.000 description 65
- 210000004027 cell Anatomy 0.000 description 64
- 238000004587 chromatography analysis Methods 0.000 description 64
- 238000010828 elution Methods 0.000 description 62
- 238000000746 purification Methods 0.000 description 62
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 59
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 57
- 230000003078 antioxidant effect Effects 0.000 description 49
- 239000007858 starting material Substances 0.000 description 46
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 43
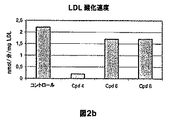
- 108010007622 LDL Lipoproteins Proteins 0.000 description 37
- 102000007330 LDL Lipoproteins Human genes 0.000 description 37
- UYGBSRJODQHNLQ-UHFFFAOYSA-N 4-hydroxy-3,5-dimethylbenzaldehyde Chemical compound CC1=CC(C=O)=CC(C)=C1O UYGBSRJODQHNLQ-UHFFFAOYSA-N 0.000 description 36
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 35
- 239000003963 antioxidant agent Substances 0.000 description 32
- 230000000694 effects Effects 0.000 description 31
- 108010001515 Galectin 4 Proteins 0.000 description 28
- 102100039556 Galectin-4 Human genes 0.000 description 28
- 241001465754 Metazoa Species 0.000 description 28
- 235000006708 antioxidants Nutrition 0.000 description 28
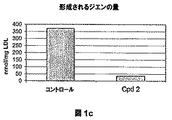
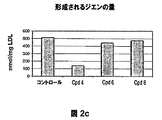
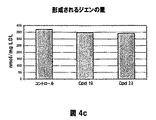
- 150000001993 dienes Chemical class 0.000 description 28
- 238000007254 oxidation reaction Methods 0.000 description 28
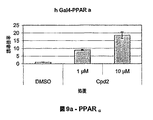
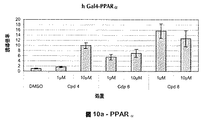
- 102000023984 PPAR alpha Human genes 0.000 description 27
- 230000003647 oxidation Effects 0.000 description 27
- 108091008725 peroxisome proliferator-activated receptors alpha Proteins 0.000 description 26
- 230000015572 biosynthetic process Effects 0.000 description 25
- 229940125782 compound 2 Drugs 0.000 description 23
- 210000004443 dendritic cell Anatomy 0.000 description 23
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 23
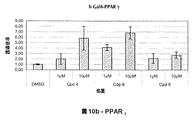
- 102000000536 PPAR gamma Human genes 0.000 description 21
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 21
- 108010016731 PPAR gamma Proteins 0.000 description 20
- 235000012000 cholesterol Nutrition 0.000 description 20
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 20
- 239000000243 solution Substances 0.000 description 20
- IGVNJALYNQVQIT-UHFFFAOYSA-N tert-butyl 2-bromo-2-methylpropanoate Chemical compound CC(C)(C)OC(=O)C(C)(C)Br IGVNJALYNQVQIT-UHFFFAOYSA-N 0.000 description 20
- 238000007738 vacuum evaporation Methods 0.000 description 20
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 19
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 17
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 17
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 16
- 229940127007 Compound 39 Drugs 0.000 description 16
- 230000014509 gene expression Effects 0.000 description 16
- 239000012071 phase Substances 0.000 description 16
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 16
- 102000003728 Peroxisome Proliferator-Activated Receptors Human genes 0.000 description 15
- 108090000029 Peroxisome Proliferator-Activated Receptors Proteins 0.000 description 15
- 239000012190 activator Substances 0.000 description 15
- 239000002158 endotoxin Substances 0.000 description 15
- 230000009467 reduction Effects 0.000 description 15
- 238000003786 synthesis reaction Methods 0.000 description 15
- 150000003626 triacylglycerols Chemical class 0.000 description 15
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 14
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 14
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 14
- 229940125877 compound 31 Drugs 0.000 description 14
- 230000001965 increasing effect Effects 0.000 description 14
- 229920006008 lipopolysaccharide Polymers 0.000 description 14
- 239000012429 reaction media Substances 0.000 description 14
- 239000002904 solvent Substances 0.000 description 14
- 206010008118 cerebral infarction Diseases 0.000 description 13
- 238000002474 experimental method Methods 0.000 description 13
- 108090000623 proteins and genes Proteins 0.000 description 13
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 13
- 229940126639 Compound 33 Drugs 0.000 description 12
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 12
- 230000007423 decrease Effects 0.000 description 12
- 150000002632 lipids Chemical class 0.000 description 12
- 239000002609 medium Substances 0.000 description 12
- 238000012360 testing method Methods 0.000 description 12
- 201000006474 Brain Ischemia Diseases 0.000 description 11
- 206010008120 Cerebral ischaemia Diseases 0.000 description 11
- 108090000790 Enzymes Proteins 0.000 description 11
- 239000000047 product Substances 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- 102000004190 Enzymes Human genes 0.000 description 10
- 206010061216 Infarction Diseases 0.000 description 10
- 230000007574 infarction Effects 0.000 description 10
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 9
- 239000005089 Luciferase Substances 0.000 description 9
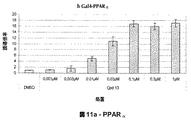
- 108010015181 PPAR delta Proteins 0.000 description 9
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 9
- 229910052802 copper Inorganic materials 0.000 description 9
- 239000010949 copper Substances 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- 238000009826 distribution Methods 0.000 description 9
- 230000002265 prevention Effects 0.000 description 9
- 150000003254 radicals Chemical class 0.000 description 9
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Natural products CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 8
- 108060001084 Luciferase Proteins 0.000 description 8
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 8
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 8
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 8
- 230000004913 activation Effects 0.000 description 8
- 210000004556 brain Anatomy 0.000 description 8
- 229940127204 compound 29 Drugs 0.000 description 8
- 238000011156 evaluation Methods 0.000 description 8
- 230000003859 lipid peroxidation Effects 0.000 description 8
- 230000004112 neuroprotection Effects 0.000 description 8
- 239000012074 organic phase Substances 0.000 description 8
- 229910000027 potassium carbonate Inorganic materials 0.000 description 8
- 235000011181 potassium carbonates Nutrition 0.000 description 8
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 7
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 7
- TVTJUIAKQFIXCE-HUKYDQBMSA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynyl-1H-purine-6,8-dione Chemical compound NC=1NC(C=2N(C(N(C=2N=1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C)=O TVTJUIAKQFIXCE-HUKYDQBMSA-N 0.000 description 7
- QBWKPGNFQQJGFY-QLFBSQMISA-N 3-[(1r)-1-[(2r,6s)-2,6-dimethylmorpholin-4-yl]ethyl]-n-[6-methyl-3-(1h-pyrazol-4-yl)imidazo[1,2-a]pyrazin-8-yl]-1,2-thiazol-5-amine Chemical compound N1([C@H](C)C2=NSC(NC=3C4=NC=C(N4C=C(C)N=3)C3=CNN=C3)=C2)C[C@H](C)O[C@H](C)C1 QBWKPGNFQQJGFY-QLFBSQMISA-N 0.000 description 7
- TXFPEBPIARQUIG-UHFFFAOYSA-N 4'-hydroxyacetophenone Chemical compound CC(=O)C1=CC=C(O)C=C1 TXFPEBPIARQUIG-UHFFFAOYSA-N 0.000 description 7
- 206010003210 Arteriosclerosis Diseases 0.000 description 7
- 102000004127 Cytokines Human genes 0.000 description 7
- 108090000695 Cytokines Proteins 0.000 description 7
- KGNDCEVUMONOKF-UGPLYTSKSA-N benzyl n-[(2r)-1-[(2s,4r)-2-[[(2s)-6-amino-1-(1,3-benzoxazol-2-yl)-1,1-dihydroxyhexan-2-yl]carbamoyl]-4-[(4-methylphenyl)methoxy]pyrrolidin-1-yl]-1-oxo-4-phenylbutan-2-yl]carbamate Chemical compound C1=CC(C)=CC=C1CO[C@H]1CN(C(=O)[C@@H](CCC=2C=CC=CC=2)NC(=O)OCC=2C=CC=CC=2)[C@H](C(=O)N[C@@H](CCCCN)C(O)(O)C=2OC3=CC=CC=C3N=2)C1 KGNDCEVUMONOKF-UGPLYTSKSA-N 0.000 description 7
- 230000024245 cell differentiation Effects 0.000 description 7
- 229940125833 compound 23 Drugs 0.000 description 7
- 229940125846 compound 25 Drugs 0.000 description 7
- 229940125851 compound 27 Drugs 0.000 description 7
- 229940125807 compound 37 Drugs 0.000 description 7
- 229940125753 fibrate Drugs 0.000 description 7
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 7
- 235000019341 magnesium sulphate Nutrition 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 230000004060 metabolic process Effects 0.000 description 7
- 238000001953 recrystallisation Methods 0.000 description 7
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 6
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 108010060219 Apolipoprotein E2 Proteins 0.000 description 6
- 229940126657 Compound 17 Drugs 0.000 description 6
- 241000699660 Mus musculus Species 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- 108010058846 Ovalbumin Proteins 0.000 description 6
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 6
- 150000001299 aldehydes Chemical class 0.000 description 6
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 230000003110 anti-inflammatory effect Effects 0.000 description 6
- 208000011775 arteriosclerosis disease Diseases 0.000 description 6
- 229940126214 compound 3 Drugs 0.000 description 6
- 230000004069 differentiation Effects 0.000 description 6
- 230000002526 effect on cardiovascular system Effects 0.000 description 6
- 238000000338 in vitro Methods 0.000 description 6
- 230000004054 inflammatory process Effects 0.000 description 6
- 230000037356 lipid metabolism Effects 0.000 description 6
- 210000001616 monocyte Anatomy 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- 235000019198 oils Nutrition 0.000 description 6
- 229940092253 ovalbumin Drugs 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 102000004169 proteins and genes Human genes 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- RMVRSNDYEFQCLF-UHFFFAOYSA-N thiophenol Chemical compound SC1=CC=CC=C1 RMVRSNDYEFQCLF-UHFFFAOYSA-N 0.000 description 6
- 238000011830 transgenic mouse model Methods 0.000 description 6
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 5
- 206010061218 Inflammation Diseases 0.000 description 5
- 210000001744 T-lymphocyte Anatomy 0.000 description 5
- 230000001154 acute effect Effects 0.000 description 5
- 239000008346 aqueous phase Substances 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 229940126540 compound 41 Drugs 0.000 description 5
- 230000004153 glucose metabolism Effects 0.000 description 5
- 239000001963 growth medium Substances 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 230000001939 inductive effect Effects 0.000 description 5
- 208000028867 ischemia Diseases 0.000 description 5
- 150000002576 ketones Chemical class 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- RENRQMCACQEWFC-UGKGYDQZSA-N lnp023 Chemical compound C1([C@H]2N(CC=3C=4C=CNC=4C(C)=CC=3OC)CC[C@@H](C2)OCC)=CC=C(C(O)=O)C=C1 RENRQMCACQEWFC-UGKGYDQZSA-N 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- IOMMMLWIABWRKL-WUTDNEBXSA-N nazartinib Chemical compound C1N(C(=O)/C=C/CN(C)C)CCCC[C@H]1N1C2=C(Cl)C=CC=C2N=C1NC(=O)C1=CC=NC(C)=C1 IOMMMLWIABWRKL-WUTDNEBXSA-N 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 5
- 239000011541 reaction mixture Substances 0.000 description 5
- 230000010410 reperfusion Effects 0.000 description 5
- 238000010898 silica gel chromatography Methods 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000003981 vehicle Substances 0.000 description 5
- GLGNXYJARSMNGJ-VKTIVEEGSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[(1-ethyl-6-methoxy-2-oxo-4,5-dihydro-3h-1-benzazepin-7-yl)amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound CCN1C(=O)CCCC2=C(OC)C(NC=3N=C(C(=CN=3)Cl)N[C@H]3[C@H]([C@@]4([H])C[C@@]3(C=C4)[H])C(N)=O)=CC=C21 GLGNXYJARSMNGJ-VKTIVEEGSA-N 0.000 description 4
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 4
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 4
- FQMZXMVHHKXGTM-UHFFFAOYSA-N 2-(1-adamantyl)-n-[2-[2-(2-hydroxyethylamino)ethylamino]quinolin-5-yl]acetamide Chemical compound C1C(C2)CC(C3)CC2CC13CC(=O)NC1=CC=CC2=NC(NCCNCCO)=CC=C21 FQMZXMVHHKXGTM-UHFFFAOYSA-N 0.000 description 4
- WOVKYSAHUYNSMH-RRKCRQDMSA-N 5-bromodeoxyuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-RRKCRQDMSA-N 0.000 description 4
- 208000037260 Atherosclerotic Plaque Diseases 0.000 description 4
- WOVKYSAHUYNSMH-UHFFFAOYSA-N BROMODEOXYURIDINE Natural products C1C(O)C(CO)OC1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-UHFFFAOYSA-N 0.000 description 4
- 102000016938 Catalase Human genes 0.000 description 4
- 102000006587 Glutathione peroxidase Human genes 0.000 description 4
- 108700016172 Glutathione peroxidases Proteins 0.000 description 4
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 4
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 4
- 239000004677 Nylon Substances 0.000 description 4
- 102000019197 Superoxide Dismutase Human genes 0.000 description 4
- 108010012715 Superoxide dismutase Proteins 0.000 description 4
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 229950004398 broxuridine Drugs 0.000 description 4
- 125000004432 carbon atom Chemical group C* 0.000 description 4
- 229940125904 compound 1 Drugs 0.000 description 4
- 229940125773 compound 10 Drugs 0.000 description 4
- 229940125797 compound 12 Drugs 0.000 description 4
- 229940126543 compound 14 Drugs 0.000 description 4
- 229940125758 compound 15 Drugs 0.000 description 4
- 229940126142 compound 16 Drugs 0.000 description 4
- 229940126086 compound 21 Drugs 0.000 description 4
- 229940125898 compound 5 Drugs 0.000 description 4
- 239000012043 crude product Substances 0.000 description 4
- 210000004748 cultured cell Anatomy 0.000 description 4
- 238000009795 derivation Methods 0.000 description 4
- 230000008482 dysregulation Effects 0.000 description 4
- 238000002270 exclusion chromatography Methods 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 230000002757 inflammatory effect Effects 0.000 description 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 4
- 230000000302 ischemic effect Effects 0.000 description 4
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 4
- 230000003902 lesion Effects 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- 238000004020 luminiscence type Methods 0.000 description 4
- 230000035800 maturation Effects 0.000 description 4
- 108020004999 messenger RNA Proteins 0.000 description 4
- 210000003657 middle cerebral artery Anatomy 0.000 description 4
- 230000005012 migration Effects 0.000 description 4
- 238000013508 migration Methods 0.000 description 4
- 238000007799 mixed lymphocyte reaction assay Methods 0.000 description 4
- 229920001778 nylon Polymers 0.000 description 4
- 238000003305 oral gavage Methods 0.000 description 4
- WEXRUCMBJFQVBZ-UHFFFAOYSA-N pentobarbital Chemical compound CCCC(C)C1(CC)C(=O)NC(=O)NC1=O WEXRUCMBJFQVBZ-UHFFFAOYSA-N 0.000 description 4
- 238000001556 precipitation Methods 0.000 description 4
- 230000004224 protection Effects 0.000 description 4
- 239000003642 reactive oxygen metabolite Substances 0.000 description 4
- 238000003757 reverse transcription PCR Methods 0.000 description 4
- 241000894007 species Species 0.000 description 4
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 3
- UDQTXCHQKHIQMH-KYGLGHNPSA-N (3ar,5s,6s,7r,7ar)-5-(difluoromethyl)-2-(ethylamino)-5,6,7,7a-tetrahydro-3ah-pyrano[3,2-d][1,3]thiazole-6,7-diol Chemical compound S1C(NCC)=N[C@H]2[C@@H]1O[C@H](C(F)F)[C@@H](O)[C@@H]2O UDQTXCHQKHIQMH-KYGLGHNPSA-N 0.000 description 3
- PAEBEUZTAPIOIO-UHFFFAOYSA-N 1-(4-chlorophenyl)-3-(1-methyl-3-oxo-2-phenyl-5-propan-2-ylpyrazol-4-yl)urea Chemical compound O=C1N(C=2C=CC=CC=2)N(C)C(C(C)C)=C1NC(=O)NC1=CC=C(Cl)C=C1 PAEBEUZTAPIOIO-UHFFFAOYSA-N 0.000 description 3
- RVBUGGBMJDPOST-UHFFFAOYSA-N 2-thiobarbituric acid Chemical compound O=C1CC(=O)NC(=S)N1 RVBUGGBMJDPOST-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- 108010071619 Apolipoproteins Proteins 0.000 description 3
- 102000007592 Apolipoproteins Human genes 0.000 description 3
- 201000001320 Atherosclerosis Diseases 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 208000031226 Hyperlipidaemia Diseases 0.000 description 3
- WSMYVTOQOOLQHP-UHFFFAOYSA-N Malondialdehyde Chemical compound O=CCC=O WSMYVTOQOOLQHP-UHFFFAOYSA-N 0.000 description 3
- 229940080774 Peroxisome proliferator-activated receptor gamma agonist Drugs 0.000 description 3
- 102000040945 Transcription factor Human genes 0.000 description 3
- 108091023040 Transcription factor Proteins 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- FXXACINHVKSMDR-UHFFFAOYSA-N acetyl bromide Chemical compound CC(Br)=O FXXACINHVKSMDR-UHFFFAOYSA-N 0.000 description 3
- 125000004414 alkyl thio group Chemical group 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 230000002490 cerebral effect Effects 0.000 description 3
- 208000026106 cerebrovascular disease Diseases 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 229940125936 compound 42 Drugs 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 230000002354 daily effect Effects 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 235000013305 food Nutrition 0.000 description 3
- 238000003304 gavage Methods 0.000 description 3
- 230000028709 inflammatory response Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 239000007928 intraperitoneal injection Substances 0.000 description 3
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 3
- 229940118019 malondialdehyde Drugs 0.000 description 3
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 108010071584 oxidized low density lipoprotein Proteins 0.000 description 3
- 239000003614 peroxisome proliferator Substances 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 210000005212 secondary lymphoid organ Anatomy 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 230000037303 wrinkles Effects 0.000 description 3
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 2
- ITOFPJRDSCGOSA-KZLRUDJFSA-N (2s)-2-[[(4r)-4-[(3r,5r,8r,9s,10s,13r,14s,17r)-3-hydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]pentanoyl]amino]-3-(1h-indol-3-yl)propanoic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H](CC[C@]13C)[C@@H]2[C@@H]3CC[C@@H]1[C@H](C)CCC(=O)N[C@H](C(O)=O)CC1=CNC2=CC=CC=C12 ITOFPJRDSCGOSA-KZLRUDJFSA-N 0.000 description 2
- WWTBZEKOSBFBEM-SPWPXUSOSA-N (2s)-2-[[2-benzyl-3-[hydroxy-[(1r)-2-phenyl-1-(phenylmethoxycarbonylamino)ethyl]phosphoryl]propanoyl]amino]-3-(1h-indol-3-yl)propanoic acid Chemical compound N([C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)O)C(=O)C(CP(O)(=O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1C=CC=CC=1)CC1=CC=CC=C1 WWTBZEKOSBFBEM-SPWPXUSOSA-N 0.000 description 2
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 2
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 2
- YQOLEILXOBUDMU-KRWDZBQOSA-N (4R)-5-[(6-bromo-3-methyl-2-pyrrolidin-1-ylquinoline-4-carbonyl)amino]-4-(2-chlorophenyl)pentanoic acid Chemical compound CC1=C(C2=C(C=CC(=C2)Br)N=C1N3CCCC3)C(=O)NC[C@H](CCC(=O)O)C4=CC=CC=C4Cl YQOLEILXOBUDMU-KRWDZBQOSA-N 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- 0 *c1cc(C=CC(c2c(*)c(*)c(*)c(*)c2*)=O)cc(*)c1* Chemical compound *c1cc(C=CC(c2c(*)c(*)c(*)c(*)c2*)=O)cc(*)c1* 0.000 description 2
- APQIUTYORBAGEZ-UHFFFAOYSA-N 1,1-dibromoethane Chemical compound CC(Br)Br APQIUTYORBAGEZ-UHFFFAOYSA-N 0.000 description 2
- SWUCMARWDGDVQF-UHFFFAOYSA-N 1-(3,5-dimethyl-4-methylsulfanylphenyl)-3-(4-hydroxy-3,5-dimethylphenyl)prop-2-en-1-one Chemical compound C1=C(C)C(SC)=C(C)C=C1C(=O)C=CC1=CC(C)=C(O)C(C)=C1 SWUCMARWDGDVQF-UHFFFAOYSA-N 0.000 description 2
- JECUZQLBQKNEMW-UHFFFAOYSA-N 1-(4-methylsulfanylphenyl)ethanone Chemical compound CSC1=CC=C(C(C)=O)C=C1 JECUZQLBQKNEMW-UHFFFAOYSA-N 0.000 description 2
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 2
- CTLKGHLSUDOHMM-UHFFFAOYSA-N 1-[4-(2-cyclohexylsulfanylethoxy)phenyl]ethanone Chemical compound C1=CC(C(=O)C)=CC=C1OCCSC1CCCCC1 CTLKGHLSUDOHMM-UHFFFAOYSA-N 0.000 description 2
- CEWHQMHIAJQGMH-UHFFFAOYSA-N 1-[4-(2-pentylsulfanylethoxy)phenyl]ethanone Chemical compound CCCCCSCCOC1=CC=C(C(C)=O)C=C1 CEWHQMHIAJQGMH-UHFFFAOYSA-N 0.000 description 2
- MNDIARAMWBIKFW-UHFFFAOYSA-N 1-bromohexane Chemical compound CCCCCCBr MNDIARAMWBIKFW-UHFFFAOYSA-N 0.000 description 2
- PYRKKGOKRMZEIT-UHFFFAOYSA-N 2-[6-(2-cyclopropylethoxy)-9-(2-hydroxy-2-methylpropyl)-1h-phenanthro[9,10-d]imidazol-2-yl]-5-fluorobenzene-1,3-dicarbonitrile Chemical compound C1=C2C3=CC(CC(C)(O)C)=CC=C3C=3NC(C=4C(=CC(F)=CC=4C#N)C#N)=NC=3C2=CC=C1OCCC1CC1 PYRKKGOKRMZEIT-UHFFFAOYSA-N 0.000 description 2
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 2
- QJQZRLXDLORINA-UHFFFAOYSA-N 2-cyclohexylethanol Chemical compound OCCC1CCCCC1 QJQZRLXDLORINA-UHFFFAOYSA-N 0.000 description 2
- SXRHGLQCOLNZPT-UHFFFAOYSA-N 3,5-dibromo-4-hydroxybenzaldehyde Chemical compound OC1=C(Br)C=C(C=O)C=C1Br SXRHGLQCOLNZPT-UHFFFAOYSA-N 0.000 description 2
- KWOLFJPFCHCOCG-UHFFFAOYSA-N Acetophenone Chemical compound CC(=O)C1=CC=CC=C1 KWOLFJPFCHCOCG-UHFFFAOYSA-N 0.000 description 2
- 102000007469 Actins Human genes 0.000 description 2
- 108010085238 Actins Proteins 0.000 description 2
- 208000024827 Alzheimer disease Diseases 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 2
- 102000005666 Apolipoprotein A-I Human genes 0.000 description 2
- 108010059886 Apolipoprotein A-I Proteins 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 206010048962 Brain oedema Diseases 0.000 description 2
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 2
- FCTKTOLGCAIUNO-ZHACJKMWSA-N CC(C)(C)OC(C(C)(C)Oc1c(C)cc(/C=C/C(c(cc2C)cc(C)c2O)=O)cc1C)=O Chemical compound CC(C)(C)OC(C(C)(C)Oc1c(C)cc(/C=C/C(c(cc2C)cc(C)c2O)=O)cc1C)=O FCTKTOLGCAIUNO-ZHACJKMWSA-N 0.000 description 2
- BQXUPNKLZNSUMC-YUQWMIPFSA-N CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 Chemical compound CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 BQXUPNKLZNSUMC-YUQWMIPFSA-N 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- 108010053835 Catalase Proteins 0.000 description 2
- 108030002440 Catalase peroxidases Proteins 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 108010068682 Cyclophilins Proteins 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 description 2
- 102000004877 Insulin Human genes 0.000 description 2
- 108090001061 Insulin Proteins 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 108010057466 NF-kappa B Proteins 0.000 description 2
- 102000003945 NF-kappa B Human genes 0.000 description 2
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 2
- 208000018737 Parkinson disease Diseases 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 101000650578 Salmonella phage P22 Regulatory protein C3 Proteins 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 101001040920 Triticum aestivum Alpha-amylase inhibitor 0.28 Proteins 0.000 description 2
- ZHAFUINZIZIXFC-UHFFFAOYSA-N [9-(dimethylamino)-10-methylbenzo[a]phenoxazin-5-ylidene]azanium;chloride Chemical compound [Cl-].O1C2=CC(=[NH2+])C3=CC=CC=C3C2=NC2=C1C=C(N(C)C)C(C)=C2 ZHAFUINZIZIXFC-UHFFFAOYSA-N 0.000 description 2
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 2
- 239000008186 active pharmaceutical agent Substances 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 201000009961 allergic asthma Diseases 0.000 description 2
- 230000000172 allergic effect Effects 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 230000033115 angiogenesis Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 210000001367 artery Anatomy 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 2
- 230000000386 athletic effect Effects 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 208000010668 atopic eczema Diseases 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000036772 blood pressure Effects 0.000 description 2
- 230000036760 body temperature Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 208000006752 brain edema Diseases 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical compound BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 230000009460 calcium influx Effects 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 210000001715 carotid artery Anatomy 0.000 description 2
- 210000001168 carotid artery common Anatomy 0.000 description 2
- 210000000269 carotid artery external Anatomy 0.000 description 2
- 210000004004 carotid artery internal Anatomy 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000011748 cell maturation Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- RNFNDJAIBTYOQL-UHFFFAOYSA-N chloral hydrate Chemical compound OC(O)C(Cl)(Cl)Cl RNFNDJAIBTYOQL-UHFFFAOYSA-N 0.000 description 2
- 229960002327 chloral hydrate Drugs 0.000 description 2
- 229940125810 compound 20 Drugs 0.000 description 2
- 229940126208 compound 22 Drugs 0.000 description 2
- 229940125961 compound 24 Drugs 0.000 description 2
- 229940125878 compound 36 Drugs 0.000 description 2
- 229940127573 compound 38 Drugs 0.000 description 2
- 229940125844 compound 46 Drugs 0.000 description 2
- 208000029078 coronary artery disease Diseases 0.000 description 2
- CMKBCTPCXZNQKX-UHFFFAOYSA-N cyclohexanethiol Chemical compound SC1CCCCC1 CMKBCTPCXZNQKX-UHFFFAOYSA-N 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000003511 endothelial effect Effects 0.000 description 2
- IIEWJVIFRVWJOD-UHFFFAOYSA-N ethyl cyclohexane Natural products CCC1CCCCC1 IIEWJVIFRVWJOD-UHFFFAOYSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 230000037406 food intake Effects 0.000 description 2
- 235000012631 food intake Nutrition 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 229930195712 glutamate Natural products 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- VKYKSIONXSXAKP-UHFFFAOYSA-N hexamethylenetetramine Chemical compound C1N(C2)CN3CN1CN2C3 VKYKSIONXSXAKP-UHFFFAOYSA-N 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- QWTDNUCVQCZILF-UHFFFAOYSA-N isopentane Chemical compound CCC(C)C QWTDNUCVQCZILF-UHFFFAOYSA-N 0.000 description 2
- 210000002510 keratinocyte Anatomy 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- CCERQOYLJJULMD-UHFFFAOYSA-M magnesium;carbanide;chloride Chemical compound [CH3-].[Mg+2].[Cl-] CCERQOYLJJULMD-UHFFFAOYSA-M 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- 230000016273 neuron death Effects 0.000 description 2
- 230000000324 neuroprotective effect Effects 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 102000006255 nuclear receptors Human genes 0.000 description 2
- 108020004017 nuclear receptors Proteins 0.000 description 2
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 229960001412 pentobarbital Drugs 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000003449 preventive effect Effects 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 238000002731 protein assay Methods 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 2
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 230000035882 stress Effects 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 239000013598 vector Substances 0.000 description 2
- QGJIFOZQMCBQIP-UHFFFAOYSA-N (2-hydroxy-2-phenylethyl) acetate Chemical compound CC(=O)OCC(O)C1=CC=CC=C1 QGJIFOZQMCBQIP-UHFFFAOYSA-N 0.000 description 1
- VQVUBYASAICPFU-UHFFFAOYSA-N (6'-acetyloxy-2',7'-dichloro-3-oxospiro[2-benzofuran-1,9'-xanthene]-3'-yl) acetate Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC(Cl)=C(OC(C)=O)C=C1OC1=C2C=C(Cl)C(OC(=O)C)=C1 VQVUBYASAICPFU-UHFFFAOYSA-N 0.000 description 1
- KVJHGPAAOUGYJX-UHFFFAOYSA-N 1,1,3,3-tetraethoxypropane Chemical compound CCOC(OCC)CC(OCC)OCC KVJHGPAAOUGYJX-UHFFFAOYSA-N 0.000 description 1
- ITVXUDPAZIIEKD-UHFFFAOYSA-N 1,3-dimethyl-2-methylsulfanylbenzene Chemical compound CSC1=C(C)C=CC=C1C ITVXUDPAZIIEKD-UHFFFAOYSA-N 0.000 description 1
- IMLSAISZLJGWPP-UHFFFAOYSA-N 1,3-dithiolane Chemical compound C1CSCS1 IMLSAISZLJGWPP-UHFFFAOYSA-N 0.000 description 1
- CTTYWXDVWGKHKJ-UHFFFAOYSA-N 1-(2,3,4,5,6-pentamethylphenyl)ethanone Chemical compound CC(=O)C1=C(C)C(C)=C(C)C(C)=C1C CTTYWXDVWGKHKJ-UHFFFAOYSA-N 0.000 description 1
- GENBEGZNCBFHSU-UHFFFAOYSA-N 1-(2,4,5-trimethylphenyl)ethanone Chemical compound CC(=O)C1=CC(C)=C(C)C=C1C GENBEGZNCBFHSU-UHFFFAOYSA-N 0.000 description 1
- FAXUIYJKGGUCBO-UHFFFAOYSA-N 1-(2,5-dimethoxyphenyl)ethanone Chemical compound COC1=CC=C(OC)C(C(C)=O)=C1 FAXUIYJKGGUCBO-UHFFFAOYSA-N 0.000 description 1
- MCNVMLWKEGGGQC-UHFFFAOYSA-N 1-(3,4,5-trimethylphenyl)ethanethione Chemical compound CC(=S)C1=CC(C)=C(C)C(C)=C1 MCNVMLWKEGGGQC-UHFFFAOYSA-N 0.000 description 1
- LQASUDVYVOFKNK-UHFFFAOYSA-N 1-(3-fluoro-4-methoxyphenyl)ethanone Chemical compound COC1=CC=C(C(C)=O)C=C1F LQASUDVYVOFKNK-UHFFFAOYSA-N 0.000 description 1
- WYECURVXVYPVAT-UHFFFAOYSA-N 1-(4-bromophenyl)ethanone Chemical compound CC(=O)C1=CC=C(Br)C=C1 WYECURVXVYPVAT-UHFFFAOYSA-N 0.000 description 1
- XHQSEAHNUKJGHJ-UHFFFAOYSA-N 1-(4-hexyl-3,5-dimethylphenyl)ethanethione Chemical compound CCCCCCC1=C(C)C=C(C(C)=S)C=C1C XHQSEAHNUKJGHJ-UHFFFAOYSA-N 0.000 description 1
- OZNRJDZKCCJUJO-UHFFFAOYSA-N 1-(4-methoxy-3,5-dimethylphenyl)ethanone Chemical compound COC1=C(C)C=C(C(C)=O)C=C1C OZNRJDZKCCJUJO-UHFFFAOYSA-N 0.000 description 1
- SRPCRBVBOIYYHS-UHFFFAOYSA-N 1-(4-methoxy-3-methylphenyl)ethanone Chemical compound COC1=CC=C(C(C)=O)C=C1C SRPCRBVBOIYYHS-UHFFFAOYSA-N 0.000 description 1
- DJNIFZYQFLFGDT-UHFFFAOYSA-N 1-(4-phenoxyphenyl)ethanone Chemical compound C1=CC(C(=O)C)=CC=C1OC1=CC=CC=C1 DJNIFZYQFLFGDT-UHFFFAOYSA-N 0.000 description 1
- PMBXCGGQNSVESQ-UHFFFAOYSA-N 1-Hexanethiol Chemical compound CCCCCCS PMBXCGGQNSVESQ-UHFFFAOYSA-N 0.000 description 1
- ZRKMQKLGEQPLNS-UHFFFAOYSA-N 1-Pentanethiol Chemical compound CCCCCS ZRKMQKLGEQPLNS-UHFFFAOYSA-N 0.000 description 1
- XHNCLRIHTUUFRG-UHFFFAOYSA-N 1-[3,5-dimethyl-4-(2-morpholin-4-ylethoxy)phenyl]ethanone Chemical compound CC1=CC(C(=O)C)=CC(C)=C1OCCN1CCOCC1 XHNCLRIHTUUFRG-UHFFFAOYSA-N 0.000 description 1
- WNOMHYGKLASBQN-UHFFFAOYSA-N 1-[4-(2-cyclohexylethyl)-3,5-dimethylphenyl]ethanone Chemical compound CC1=CC(C(=O)C)=CC(C)=C1CCC1CCCCC1 WNOMHYGKLASBQN-UHFFFAOYSA-N 0.000 description 1
- SXSIPUMTUOTJEK-UHFFFAOYSA-N 1-[4-(2-cyclohexylethyl)phenyl]ethanone Chemical compound C1=CC(C(=O)C)=CC=C1CCC1CCCCC1 SXSIPUMTUOTJEK-UHFFFAOYSA-N 0.000 description 1
- PWWFUYRZFHWBDT-UHFFFAOYSA-N 1-[4-(bromomethoxy)phenyl]ethanone Chemical compound CC(=O)C1=CC=C(OCBr)C=C1 PWWFUYRZFHWBDT-UHFFFAOYSA-N 0.000 description 1
- ABUSWLOUSQWWLA-UHFFFAOYSA-N 1-[4-methoxy-3-(trifluoromethyl)phenyl]ethanone Chemical compound COC1=CC=C(C(C)=O)C=C1C(F)(F)F ABUSWLOUSQWWLA-UHFFFAOYSA-N 0.000 description 1
- CYNYIHKIEHGYOZ-UHFFFAOYSA-N 1-bromopropane Chemical compound CCCBr CYNYIHKIEHGYOZ-UHFFFAOYSA-N 0.000 description 1
- QCLJODDRBGKIRW-UHFFFAOYSA-N 2,6-dimethylbenzenethiol Chemical compound CC1=CC=CC(C)=C1S QCLJODDRBGKIRW-UHFFFAOYSA-N 0.000 description 1
- QYBGWBOWUCZDAZ-UHFFFAOYSA-N 2-hexylsulfanyl-1,3-dimethylbenzene Chemical compound CCCCCCSC1=C(C)C=CC=C1C QYBGWBOWUCZDAZ-UHFFFAOYSA-N 0.000 description 1
- DSXKMMAQDSAZAC-UHFFFAOYSA-N 2-hydroxy-3,5-dimethylbenzaldehyde Chemical compound CC1=CC(C)=C(O)C(C=O)=C1 DSXKMMAQDSAZAC-UHFFFAOYSA-N 0.000 description 1
- QSBHJTCAPWOIIE-UHFFFAOYSA-N 3-fluoro-4-hydroxybenzaldehyde Chemical compound OC1=CC=C(C=O)C=C1F QSBHJTCAPWOIIE-UHFFFAOYSA-N 0.000 description 1
- ZKRFOXLVOKTUTA-KQYNXXCUSA-N 9-(5-phosphoribofuranosyl)-6-mercaptopurine Chemical compound O[C@@H]1[C@H](O)[C@@H](COP(O)(O)=O)O[C@H]1N1C(NC=NC2=S)=C2N=C1 ZKRFOXLVOKTUTA-KQYNXXCUSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- ZKHQWZAMYRWXGA-KQYNXXCUSA-N Adenosine triphosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-N 0.000 description 1
- 241000143060 Americamysis bahia Species 0.000 description 1
- 108010056301 Apolipoprotein C-III Proteins 0.000 description 1
- 102000030169 Apolipoprotein C-III Human genes 0.000 description 1
- 102000006410 Apoproteins Human genes 0.000 description 1
- 108010083590 Apoproteins Proteins 0.000 description 1
- 208000013165 Bowen disease Diseases 0.000 description 1
- 208000019337 Bowen disease of the skin Diseases 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- ZLECAJRLANWAEL-FPYGCLRLSA-N CC(C)(C(O)=O)Oc(c(F)cc(/C=C/C(c(cc1)ccc1Br)=O)c1)c1F Chemical compound CC(C)(C(O)=O)Oc(c(F)cc(/C=C/C(c(cc1)ccc1Br)=O)c1)c1F ZLECAJRLANWAEL-FPYGCLRLSA-N 0.000 description 1
- LZPMBUCSIQCZOJ-ONNFQVAWSA-N CC(C)(C(O)=O)Oc(ccc(/C=C/C(c(cc1)ccc1SC)=O)c1)c1F Chemical compound CC(C)(C(O)=O)Oc(ccc(/C=C/C(c(cc1)ccc1SC)=O)c1)c1F LZPMBUCSIQCZOJ-ONNFQVAWSA-N 0.000 description 1
- AMISKGFVZHOVOT-OUKQBFOZSA-N CC(C)(C(O)=O)Oc1c(C)cc(/C=C/C(c(cc2C)cc(C)c2OCCSC2CCCCC2)=O)cc1C Chemical compound CC(C)(C(O)=O)Oc1c(C)cc(/C=C/C(c(cc2C)cc(C)c2OCCSC2CCCCC2)=O)cc1C AMISKGFVZHOVOT-OUKQBFOZSA-N 0.000 description 1
- ZKPJBPNDVZDLPE-IZZDOVSWSA-N CC(C)(C)OC(C(C)(C)Oc(c(F)cc(/C=C/C(c(cc1)ccc1Br)O)c1)c1F)=O Chemical compound CC(C)(C)OC(C(C)(C)Oc(c(F)cc(/C=C/C(c(cc1)ccc1Br)O)c1)c1F)=O ZKPJBPNDVZDLPE-IZZDOVSWSA-N 0.000 description 1
- GKLMOAMWZNUXTB-NTUHNPAUSA-N CC(C)(C)OC(C(C)(C)Oc(ccc(/C=C/C(c(cc1)ccc1SC)=O)c1)c1F)=O Chemical compound CC(C)(C)OC(C(C)(C)Oc(ccc(/C=C/C(c(cc1)ccc1SC)=O)c1)c1F)=O GKLMOAMWZNUXTB-NTUHNPAUSA-N 0.000 description 1
- MWHAXDSBGVQNHS-ZRDIBKRKSA-N CC(C)(C)OC(C(C)(C)Oc1c(C)cc(/C=C/C(c(cc(cc2)OC)c2OC)=O)cc1C)=O Chemical compound CC(C)(C)OC(C(C)(C)Oc1c(C)cc(/C=C/C(c(cc(cc2)OC)c2OC)=O)cc1C)=O MWHAXDSBGVQNHS-ZRDIBKRKSA-N 0.000 description 1
- ZZPIFLXDERHOAP-UHFFFAOYSA-N CC(C)(C)OC(C(C)(C)Oc1c(C)cc(C=O)cc1C)=O Chemical compound CC(C)(C)OC(C(C)(C)Oc1c(C)cc(C=O)cc1C)=O ZZPIFLXDERHOAP-UHFFFAOYSA-N 0.000 description 1
- MUWPKXVVEOGKNO-UHFFFAOYSA-N CC(c(cc1C)cc(C)c1O)=O Chemical compound CC(c(cc1C)cc(C)c1O)=O MUWPKXVVEOGKNO-UHFFFAOYSA-N 0.000 description 1
- LTQJVQNIEHCMJJ-UHFFFAOYSA-N CC(c(cc1C)cc(C)c1OCCBr)=O Chemical compound CC(c(cc1C)cc(C)c1OCCBr)=O LTQJVQNIEHCMJJ-UHFFFAOYSA-N 0.000 description 1
- KGXRCWBMPPSOJT-UHFFFAOYSA-N CC(c(cc1C)cc(C)c1OCCSC1CCCCC1)=O Chemical compound CC(c(cc1C)cc(C)c1OCCSC1CCCCC1)=O KGXRCWBMPPSOJT-UHFFFAOYSA-N 0.000 description 1
- HVUVNYQJFVNPLB-UHFFFAOYSA-N CC=1C(=C(C=C(C=1C(=O)O)C)C(C=C)=O)OC(C)C Chemical compound CC=1C(=C(C=C(C=1C(=O)O)C)C(C=C)=O)OC(C)C HVUVNYQJFVNPLB-UHFFFAOYSA-N 0.000 description 1
- ZJWKCDMUYOINLH-NTEUORMPSA-N CCCCCSCCOc(cc1)ccc1C(/C=C/c(cc1C)cc(C)c1OC(C)(C)C(O)=O)=O Chemical compound CCCCCSCCOc(cc1)ccc1C(/C=C/c(cc1C)cc(C)c1OC(C)(C)C(O)=O)=O ZJWKCDMUYOINLH-NTEUORMPSA-N 0.000 description 1
- XGULARGABDGBLZ-MDZDMXLPSA-N CCOC(C(C)(C)Oc1c(C)cc(/C=C/C(c(cc2C)cc(C)c2OCCN2CCOCC2)=O)cc1C)=O Chemical compound CCOC(C(C)(C)Oc1c(C)cc(/C=C/C(c(cc2C)cc(C)c2OCCN2CCOCC2)=O)cc1C)=O XGULARGABDGBLZ-MDZDMXLPSA-N 0.000 description 1
- 108010017158 CCR7 Receptors Proteins 0.000 description 1
- 102000004428 CCR7 Receptors Human genes 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 102100027943 Carnitine O-palmitoyltransferase 1, liver isoform Human genes 0.000 description 1
- 101710120614 Carnitine O-palmitoyltransferase 1, liver isoform Proteins 0.000 description 1
- 101710108984 Carnitine O-palmitoyltransferase 1, muscle isoform Proteins 0.000 description 1
- SWUCMARWDGDVQF-VOTSOKGWSA-N Cc1cc(/C=C/C(c(cc2C)cc(C)c2SC)=O)cc(C)c1O Chemical compound Cc1cc(/C=C/C(c(cc2C)cc(C)c2SC)=O)cc(C)c1O SWUCMARWDGDVQF-VOTSOKGWSA-N 0.000 description 1
- 206010051290 Central nervous system lesion Diseases 0.000 description 1
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 208000002111 Eye Abnormalities Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 108010063907 Glutathione Reductase Proteins 0.000 description 1
- 102100036442 Glutathione reductase, mitochondrial Human genes 0.000 description 1
- 102000005720 Glutathione transferase Human genes 0.000 description 1
- 108010070675 Glutathione transferase Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 206010019196 Head injury Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000669513 Homo sapiens Metalloproteinase inhibitor 1 Proteins 0.000 description 1
- 101000741788 Homo sapiens Peroxisome proliferator-activated receptor alpha Proteins 0.000 description 1
- 101000741797 Homo sapiens Peroxisome proliferator-activated receptor delta Proteins 0.000 description 1
- 101000741790 Homo sapiens Peroxisome proliferator-activated receptor gamma Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 208000032382 Ischaemic stroke Diseases 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 102000016267 Leptin Human genes 0.000 description 1
- 108010092277 Leptin Proteins 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 108090000301 Membrane transport proteins Proteins 0.000 description 1
- 102000003939 Membrane transport proteins Human genes 0.000 description 1
- 102100039364 Metalloproteinase inhibitor 1 Human genes 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 102100029438 Nitric oxide synthase, inducible Human genes 0.000 description 1
- 101710089543 Nitric oxide synthase, inducible Proteins 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 238000010934 O-alkylation reaction Methods 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 229940126033 PPAR agonist Drugs 0.000 description 1
- 108010028924 PPAR alpha Proteins 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 208000005764 Peripheral Arterial Disease Diseases 0.000 description 1
- 208000030831 Peripheral arterial occlusive disease Diseases 0.000 description 1
- 229940122054 Peroxisome proliferator-activated receptor delta agonist Drugs 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- 235000005205 Pinus Nutrition 0.000 description 1
- 241000218602 Pinus <genus> Species 0.000 description 1
- 235000005105 Pinus pinaster Nutrition 0.000 description 1
- 241001236212 Pinus pinaster Species 0.000 description 1
- 102000004257 Potassium Channel Human genes 0.000 description 1
- 208000024777 Prion disease Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102000004005 Prostaglandin-endoperoxide synthases Human genes 0.000 description 1
- 108090000459 Prostaglandin-endoperoxide synthases Proteins 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- OUUQCZGPVNCOIJ-UHFFFAOYSA-M Superoxide Chemical compound [O-][O] OUUQCZGPVNCOIJ-UHFFFAOYSA-M 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 206010053648 Vascular occlusion Diseases 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 235000021068 Western diet Nutrition 0.000 description 1
- PSLUFJFHTBIXMW-WYEYVKMPSA-N [(3r,4ar,5s,6s,6as,10s,10ar,10bs)-3-ethenyl-10,10b-dihydroxy-3,4a,7,7,10a-pentamethyl-1-oxo-6-(2-pyridin-2-ylethylcarbamoyloxy)-5,6,6a,8,9,10-hexahydro-2h-benzo[f]chromen-5-yl] acetate Chemical compound O([C@@H]1[C@@H]([C@]2(O[C@](C)(CC(=O)[C@]2(O)[C@@]2(C)[C@@H](O)CCC(C)(C)[C@@H]21)C=C)C)OC(=O)C)C(=O)NCCC1=CC=CC=N1 PSLUFJFHTBIXMW-WYEYVKMPSA-N 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 230000002225 anti-radical effect Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 210000000702 aorta abdominal Anatomy 0.000 description 1
- 210000002376 aorta thoracic Anatomy 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 235000021466 carotenoid Nutrition 0.000 description 1
- 150000001747 carotenoids Chemical class 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000009087 cell motility Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000007398 colorimetric assay Methods 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000004041 dendritic cell maturation Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- WGLUMOCWFMKWIL-UHFFFAOYSA-N dichloromethane;methanol Chemical compound OC.ClCCl WGLUMOCWFMKWIL-UHFFFAOYSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- AFABGHUZZDYHJO-UHFFFAOYSA-N dimethyl butane Natural products CCCC(C)C AFABGHUZZDYHJO-UHFFFAOYSA-N 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 230000000487 effect on differentiation Effects 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 229930003935 flavonoid Natural products 0.000 description 1
- 150000002215 flavonoids Chemical class 0.000 description 1
- 235000017173 flavonoids Nutrition 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 230000014101 glucose homeostasis Effects 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- ZJYYHGLJYGJLLN-UHFFFAOYSA-N guanidinium thiocyanate Chemical compound SC#N.NC(N)=N ZJYYHGLJYGJLLN-UHFFFAOYSA-N 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 102000054223 human PPARA Human genes 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- TUJKJAMUKRIRHC-UHFFFAOYSA-N hydroxyl Chemical compound [OH] TUJKJAMUKRIRHC-UHFFFAOYSA-N 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 208000006575 hypertriglyceridemia Diseases 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 230000007654 ischemic lesion Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical compound O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 1
- 229940039781 leptin Drugs 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000028161 membrane depolarization Effects 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 210000000274 microglia Anatomy 0.000 description 1
- 230000006676 mitochondrial damage Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 230000004031 neuronal differentiation Effects 0.000 description 1
- 230000034420 neuronal signal transduction Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 125000000018 nitroso group Chemical group N(=O)* 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- 230000036407 pain Effects 0.000 description 1
- 230000001991 pathophysiological effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 208000030613 peripheral artery disease Diseases 0.000 description 1
- 210000002824 peroxisome Anatomy 0.000 description 1
- 239000002307 peroxisome proliferator activated receptor agonist Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 150000007965 phenolic acids Chemical class 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000004885 piperazines Chemical class 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- 235000015497 potassium bicarbonate Nutrition 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- 108020001213 potassium channel Proteins 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229940127293 prostanoid Drugs 0.000 description 1
- 150000003814 prostanoids Chemical class 0.000 description 1
- 230000006318 protein oxidation Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 210000005241 right ventricle Anatomy 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- YZECKICTZJALRP-UHFFFAOYSA-N tert-butyl 4-formyl-2,6-dimethyl-3-propan-2-yloxybenzoate Chemical compound CC(C)OC1=C(C)C(C(=O)OC(C)(C)C)=C(C)C=C1C=O YZECKICTZJALRP-UHFFFAOYSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- 208000021331 vascular occlusion disease Diseases 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/10—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and singly-bound oxygen atoms bound to the same carbon skeleton
- C07C323/11—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and singly-bound oxygen atoms bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/12—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and singly-bound oxygen atoms bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/10—Anti-acne agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/16—Emollients or protectives, e.g. against radiation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/22—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and doubly-bound oxygen atoms bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/61—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a ring other than a six-membered aromatic ring of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/76—Unsaturated compounds containing keto groups
- C07C59/90—Unsaturated compounds containing keto groups containing singly bound oxygen-containing groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D339/00—Heterocyclic compounds containing rings having two sulfur atoms as the only ring hetero atoms
- C07D339/02—Five-membered rings
- C07D339/04—Five-membered rings having the hetero atoms in positions 1 and 2, e.g. lipoic acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Dermatology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Pulmonology (AREA)
- Toxicology (AREA)
- Child & Adolescent Psychology (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Cosmetics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Compounds Containing Sulfur Atoms (AREA)
Abstract
本発明は、置換1,3−ジフェニルプロプ−2−エン−1−オン誘導体化合物、該化合物を含有する薬学的および/または化粧品組成物、ならびに治療薬および化粧品におけるその適用に関する。本発明はまた、前記誘導体を調製するための方法に関する。
Description
本発明は、置換1,3−ジフェニルプロプ−2−エン−1−オン誘導体、該化合物を含んでなる薬学的および/または化粧品組成物、ならびに治療薬および/または化粧品、特にヒトおよび動物の健康の分野におけるその適用に関する。本発明はまた、前記誘導体を調製する方法に関する。
本発明に従う化合物は、脂質および/またはグルコース代謝(高脂血症、糖尿病、肥満など)の調節障害に関連する病状を改善するための有利な治療ツールを提示し、特に、循環器系疾患(特に、冠動脈性心疾患、脳虚血および末梢動脈疾患)、異脂肪血症、X症候群に伴う病状、糖尿病、肥満、高血圧、炎症性疾患、皮膚疾患(乾癬、アトピー性皮膚炎、ニキビなど)、喘息、酸化ストレスに連結する障害、老化、一般に、例えば、特に、化粧品分野における皮膚老化(しわの出現など)の影響の防止または処置において使用することができる。本発明に従う化合物は、神経保護に関する予防活性を発揮し、また、循環器系疾患の主な合併症の1つである脳虚血事象の急性期における活性な神経保護を提供することが可能である。
いくつかの循環器系の危険因子に対して同時に作用することによって、本発明化合物は、全体的な循環器系の危険性の低下を可能にする。
冠動脈性心疾患、脳虚血および末梢動脈疾患は、(非特許文献1)に従えば、最も一般的な循環器系疾患である。
循環器系疾患は、現在、大部分の先進国およびいくつかの発展途上国における成人の死亡原因の上位の1つである。循環器系疾患のうち、脳血管疾患は、死亡率の原因の第3位であり、成人における身体的障害の原因の第1位である。これらの疾患の防止および/または処置のための有効なストラテジーの必要性は、世界的な急務となってきている。
異脂肪血症(高コレステロール血症、高トリグリセリド血症)、糖尿病および高血圧は、明確に確立された循環器系の危険因子(非特許文献1)のいくつかである。酸化に対するリポタンパク質の不十分な保護は、同定された危険因子であることも明らかである。
疫学研究により、これらの異なる因子間の相乗効果が明らかにされている。いくつかの因子が同時に存在すると、循環器系の危険性の劇的な増加がもたらされる。従って、循環器系疾患のグローバルリスクについて説明することが適切である。
従って、これらの異なる危険因子に対して同時に作用し、従って、循環器系疾患の危険性を減少するが、また、独立した様式で、それぞれの調節不全およびその結果(異脂肪血症、糖尿病、高血圧、脳虚血、X症候群に伴う病状、肥満など)を処置することができる製品が真に求められる。
本発明者らは、驚くべき様式で、本発明に従う化合物がPPAR(ペルオキシソーム増殖因子活性化受容体)活性化因子であり、従ってそれらは有利な治療ツールを提示することを明らかにした。
実際、PPARが脂質およびグルコース代謝に関連することは周知である。例えば、フィブラート系薬剤のようなPPAR活性化因子は、PPARαの活性化を介して血清コレステロールおよびトリグリセリド濃度を調節する(非特許文献2)。フィブラート療法は、肝臓における脂肪酸酸化の増加をもたらす。これらの化合物はまた、トリグリセリドの合成および発現のレベルを減少する(非特許文献3)。PPARα活性化因子もまた、高血糖およびインスリンレベルを補正することができる。フィブラート系薬剤はまた、食物摂取およびレプチン遺伝子発現とは独立した機構を介して脂肪組織塊を減少する(非特許文献4)。
PPARγアゴニストの治療重要性については、2型糖尿病において広範に研究されている(非特許文献5)。PPARγアゴニストは標的組織におけるインスリン感受性を回復させ、動物モデルおよびヒト2型糖尿病の両方において、血漿グルコース、脂質およびインスリンレベルを低下することが示されている(非特許文献6)。
リガンドによるPPAR活性化もまた、炎症、血管新生、細胞増殖および分化、アポトーシスならびにiNOS、MMPaseおよびTIMPの活性化のようなプロセスに酸化する遺伝子の発現を調節する役割を果たす。ケラチノサイトにおけるPPARαの活性は、それらの増殖の停止をもたらし、細胞分化に関与する遺伝子の発現を促進する(非特許文献7)。
PPAR活性化は、最も強力な抗原提示細胞である樹状細胞の分化、成熟、移動および免疫原性を干渉することも示されている((非特許文献8);(非特許文献9);(非特許文献10))。
PPARはNF−kBまたは転写活性化因子(STAT)およびAP−1のような他の転写因子に関与する転写機構においてネガティブな干渉を示すため、それらは抗炎症特性を有する(非特許文献11)。前記抗炎症および抗増殖特性により、PPARは血管閉塞症(動脈硬化など)、脳虚血、高血圧、血管新生に関連する疾患(糖尿病性網膜症など)、炎症性疾患(ボーエン病、乾癬など)、喘息および新生物疾患(発癌(cardcinogenesis)など)のような疾患の処置の治療標的を対象としている。
さらに、本発明に従う化合物は、抗酸化物質であるという利点を有する。
事実、フリーラジカルは、循環器系疾患(動脈硬化など)、脳虚血、遺伝および代謝障害(糖尿病など)を含む広範な病状、しかしまた感染性および変性疾患(アルツハイマー病、パーキンソン病、プリオン病など)、眼異常、老化、アレルギー、癌の発症および進行においても役割を果たす(非特許文献12)。
活性酸素種(ROS)は、正常な細胞が機能している間に産生される。ROSは、ヒドロキシルラジカル(OH)、スーパーオキシドアニオン(O2 −)、過酸化水素(H2O2)および一酸化窒素(NO)を含んでなる。前記種は極めて不安定であり、それらの高い化学反応性のため、脂質過酸化、所定の酵素の酸化およびその変性をもたらすタンパク質の極めて広範な酸化を誘導することによる細胞の生物学的機能への危険性を構成する。
ROSは、酵素成分(スーパーオキシドジスムターゼ、カタラーゼおよびグルタチオンペルオキシダーゼ(gluthatione peroxidase))ならびに非酵素成分、主に、カロテノイド、ビタミンCおよびビタミンEを含んでなる抗酸化系を介してプロセスされる(非特許文献13)。
さらに、多くのインビトロおよびインビボ研究が、酸化型LDL(低密度リポタンパク質)の動脈硬化への潜在的な参加について記載している。緩徐に発達するアテローム性動脈硬化斑は、繊維性皮膜によって囲まれたコレステロールリッチなコアを有する。斑の破裂は、繊維性皮膜の領域における慢性炎症の変更から生じるとますます考えられている。サイトカインのような炎症メディエーターは、繊維性皮膜内のいくつかの生物学的プロセスに影響を及ぼし、破裂に対するその耐性を低下させる。
インターロイキン1、腫瘍壊死因子(TNF−αおよびCD−40リガンドと称されるTNFαの表面相同物)を含むアテローム斑における炎症性サイトカインは、マクロファージおよび平滑筋細胞による細胞外マトリクスを弱めることができる酵素の産生をもたらす。繊維性皮膜の破裂は閉塞性血栓から生じ得る。
本発明化合物はまた、それらの薬理学的および特にそれらの抗炎症特性による脳虚血の処置および/または防止のための有利な治療ツールである。
脳虚血の初期の事象は最初の数時間で生じ、ニューロン脱分極および細胞浮腫をもたらすグルタミン酸の大量放出にある。細胞へのカルシウム流入は、フリーラジカルの放出およびニューロン膜の変性を促進する酵素の誘導をもたらすミトコンドリア損傷を誘導する。カルシウム流入およびフリーラジカル産生は、順に、NF−κBのような所定の転写因子を活性化する。前記活性化は、内皮接着タンパク質の誘導、虚血病巣の多核好中球浸潤、小膠細胞活性化、一酸化窒素(NO)シンターゼII型またはシクロオキシゲナーゼII型のような酵素の誘導のような炎症プロセスを誘導する。これらの炎症プロセスは、細胞に対して毒性であるNOまたはプロスタノイドの放出をもたらす。全体として、これらのプロセスは、不可逆的病変を誘導するアポトーシスの現象を生じる(非特許文献14)。
予防的な神経保護の概念は、虚血忍容性を実証する動物モデルの実験データに基づく。脳虚血忍容性の異なる機構が同定されている:サイトカイン、炎症経路、フリーラジカル、NO、ATP依存性カリウムチャンネル、アデノシン。従って、本発明化合物は、神経保護的役割を果たす利点を有する。
最後に、本発明に従う化合物は、炎症性障害の処置、特に、喘息の処置において特に興味深い。事実、アレルギー性障害、特に、喘息の流行は、先進国において着実に上昇しており、公衆の健康の大きな関心事となっている。原因の機構にかかわらず、アレルギー性障害の共通の特徴は、抗原提示樹状細胞によって開始される炎症反応である。本発明者らは、本発明化合物が前記樹状細胞の分化および成熟を干渉し、その二次リンパ器官への移動を阻害することを示した。また、本発明化合物は、ナイーブ(naive)なCD4+ T細胞の増殖のより弱い誘導物質であることが示されている。
従って、本発明に従う化合物は、免疫応答の開始を干渉し、従って、喘息の処置のための有利なツールを提示する。
International Atherosclerosis Society「Harmonized Clinical Guidelines on Prevention of Atherosclerotic Vascular Disease」2003年
ハートン,D(Hourton,D)、P.デレリベ(P.Delerive)ら(2001年)、「Oxidized low−density lipoprotein and peroxisome−proliferator−activated receptor alpha down−regulate platelet−activating−factor receptor expression in human macrophages.」Biochem J354(Pt1):225−32頁
スタエルス,B.(Staels,B.)およびJ.アウウェルクス(J.Auwerx)(1998年)、「Regulation of apo A−I gene expression by fibrates.」Atherosclerosis137補遺:S19−23頁
グエレ−ミロ,M(Guerre−Millo,M)、P.ゲルボイス(P.Gervois)ら(2000年)、「Peroxisome proliferator−activated receptor alpha activators improve insulin sensitivity and reduce adiposity.」J Biol Chem275(22):16638−42頁
シュピーゲルマンBM.(Spiegelman BM.)(1998年)「PPARgamma in monocytes: less pain, any gain?」Cell、93(2):153−5頁
ラムVJ.(Ram VJ.)(2003年)、「Therapeutic role of peroxisome proliferator−activated receptors in obesity, diabetes and inflammation.」Prog Drug Res60:93−132頁
コムベス,LG(Komuves,LG)、K.ハンレイ(K.Hanley)ら(2000年)、「Stimulation of PPARalpha promotes epidermal keratinocyte differentiation in vivo.」J Invest Dermatol115(3):353−60頁
ゴセット,P(Gosset,P)、チャーボニアーAS(Charbonnier AS)、デレリベP(Delerive P)、フォンタイネJ(Fontaine J)、スタエルスB(Staels B)、ペステルJ(Pestel J)、トンネルAB(Tonnel AB)、トロテインF(Trottein F)、(2001年)、「Peroxisome proliferator−activated receptor gamma activators affect the maturation of human monocyte−derived dendritic cells」Eur J Immunol10:2857−65頁
ネンシオニA(Nencioni A)、グルネバッハF(Grunebach F)、ゾビーウラスキーA(Zobywlaski A)、デンズリンガーC(Denzlinger C)、ブルガーW(Brugger W)、ブロサルトP(Brossart P)、(2002年)「Dendritic cell immunogenicity is regulated by peroxisome proliferator−activated receptor gamma」J Immunol169(3):1228−35頁
アンゲリV(Angeli V)、ハマンドH(Hammad H)、スタエルスB(Staels B)、カプロンM(Capron M)、ランブレヒトBN(Lambrecht BN)、トロテインF(Trottein F)、(2003年)「Peroxisome proliferator−activated receptor gamma inhibits the migration of dendritic cells:consequences for the immune response」J Immunol.170(10):5295−301頁
デスベルゲン,B.(Desvergne,B.)およびW.ホーリ(W.Wahli)(1999年)、「Peroxisome proliferator−activated receptors:nuclear control of metabolism.」Endocr Rev20(5):649−88頁
メイツ,JM(Mates,JM)、C.ペレズ−ゴメス(C.Perez−Gomez)ら(1999年)、「Antioxidant enzymes and human diseases.」Clin Biochem32(8):595−603頁
ギルグン−シェルキ,Y(Gilgun−Sherki,Y)、メラメドE.(Melamed E.)ら(2001年)、「Oxidative stress induced−neurodegenerative diseases:the need for antioxidants that penetrate the blood brain barrier.」Neuropharmacology40(8):959−75頁
ダーナグル,U.(Dirnagl,U.)、C.イアデコラ(C.Iadecola)ら(1999年)、「Pathobiology of ischaemic stroke:an integrated view.」Trends Neurosci22(9):391−7頁
本発明は、新規の置換1,3−ジフェニルプロプ−2−エン−1−オン誘導体、該化合物を含んでなる薬学的および/または化粧品組成物、特にヒトおよび動物の健康の分野におけるその治療薬および/または化粧品の使用に関する。本発明はまた、前記誘導体の調製の方法に関する。
本発明者らは、驚くべき様式で、本発明に従う化合物がPPARアゴニスト活性および抗酸化特性を示すことを示した。従って、本発明化合物は、特に、炎症:サイトカイン産生およびフリーラジカル産生において活性化される少なくとも2つのシグナル伝達経路を干渉することができる。相乗的に作用することによって、本発明化合物は、循環器系疾患、X症候群に伴う病状、異脂肪血症、糖尿病、肥満、高血圧、炎症性疾患、皮膚疾患(乾癬、アトピー性皮膚炎、ニキビなど)、喘息、酸化ストレスに連結する障害、老化一般、例えば、化粧品分野における皮膚老化(しわの出現など)の処置のための有利な治療および/または化粧手段を提示する。
さらに、本発明に従う化合物は、神経保護に関する予防活性を発揮し、また、脳虚血の急性期における活性な神経保護を提供することが可能である。
最終的に、本発明に従う化合物は、脂質および/またはグルコース代謝(高脂血症、糖尿病、肥満など)の調節不全に関連するいくつかの循環器系の危険因子の防止および/または処置のための有利な治療ツールを提示する。それらはグローバルリスクの減少を可能にする。
従って、本発明は改善された式および十分な治療効力を有する新規の置換1,3−ジフェニルプロプ−2−エン−1−オン誘導体を提供することが指向される。
これらおよび他の目的は、特に、以下の一般式(I)によって表される置換1,3−ジフェニルプロプ−2−エン−1−オン誘導体を対象物として有する本発明によって達成される:
式中:
X7は以下の式:G7−R7(式中、G7は酸素またはイオウ原子であり、R7はグループ1由来の置換基もしくはグループ2由来の置換基によって置換される以下に規定されるようなアルキル鎖であり、場合により、R7はアリール基によっても置換され得、
グループ1由来の置換基は式:−COORaを有するカルボキシ基、式:−CONRbRcを有するカルバモイル基またはテトラゾリル基よりなる群において選択され、
グループ2由来の置換基は、スルホン酸(−SO3H)および式:−SO2NRbRcを有するスルホンアミド基よりなる群において選択され、
ここで、Ra、RbおよびRcは同じであるかあるいは異なり、水素原子または置換されているかもしくは置換されていないアルキル基を表す)に対応する基を表し、
Xi基(ここで、i=1、2、3、4もしくは5)は同じであるかもしくは異なり、ハロゲン原子またはチオニトロソ基を表すかあるいはそれぞれ式(Gi−Ri)n−G’i−R’i(式中:
・nは値0または1を有し得、
・GiおよびG’iは同じであるかもしくは異なり、単結合、酸素原子またはイオウ原子を表し、
・RiおよびR’iは同じであるかもしくは異なり、アルキル、アルケニル、アリール基または複素環を表し、
・R’iはまた水素原子を表し得る)に対応し、
Xi基(ここで、i=6もしくはi=8)は同じであるかもしくは異なり、ハロゲン原子を表すかまたは式G’i−R’i(G’iおよびR’iは上記のように規定される)に対応し、X6およびX8は同時に水素原子を表さず、
Xi(ここで、i=1、2、3、4、5、6もしくは8)は1,3−ジフェニルプロプ−2−エン−1−オンの芳香環に直接結合する複素環を表すことができず、
但し、式中、同時に:
・基X1、X2、X3、X4もしくはX5のうち1つは水酸基であり、
・G7は酸素原子であり、
・そして基X6もしくはX8のうち1つは水素原子あるいはハロゲンあるいはヒドロキシルまたはアルキルオキシ基である、
式(I)によって表される化合物は例外であり、
但し、式中、同時に:
・X1、X2およびX4基は同時に水素原子を表し、
・X6およびX8基はG’iR’iを表し、
・X5基はチオニトロソ基またはG’iR’I基を表し、
・X3基はハロゲンまたはG’iR’i基を表し、
式中、G’iは酸素原子、イオウ原子または単結合を表し、R’iは飽和、直鎖、分岐または環式アルキル基(ハロゲン化されているかもしくはハロゲン化されていない)あるいは水素原子を表す、
式(I)によって表される化合物は例外である。
X7は以下の式:G7−R7(式中、G7は酸素またはイオウ原子であり、R7はグループ1由来の置換基もしくはグループ2由来の置換基によって置換される以下に規定されるようなアルキル鎖であり、場合により、R7はアリール基によっても置換され得、
グループ1由来の置換基は式:−COORaを有するカルボキシ基、式:−CONRbRcを有するカルバモイル基またはテトラゾリル基よりなる群において選択され、
グループ2由来の置換基は、スルホン酸(−SO3H)および式:−SO2NRbRcを有するスルホンアミド基よりなる群において選択され、
ここで、Ra、RbおよびRcは同じであるかあるいは異なり、水素原子または置換されているかもしくは置換されていないアルキル基を表す)に対応する基を表し、
Xi基(ここで、i=1、2、3、4もしくは5)は同じであるかもしくは異なり、ハロゲン原子またはチオニトロソ基を表すかあるいはそれぞれ式(Gi−Ri)n−G’i−R’i(式中:
・nは値0または1を有し得、
・GiおよびG’iは同じであるかもしくは異なり、単結合、酸素原子またはイオウ原子を表し、
・RiおよびR’iは同じであるかもしくは異なり、アルキル、アルケニル、アリール基または複素環を表し、
・R’iはまた水素原子を表し得る)に対応し、
Xi基(ここで、i=6もしくはi=8)は同じであるかもしくは異なり、ハロゲン原子を表すかまたは式G’i−R’i(G’iおよびR’iは上記のように規定される)に対応し、X6およびX8は同時に水素原子を表さず、
Xi(ここで、i=1、2、3、4、5、6もしくは8)は1,3−ジフェニルプロプ−2−エン−1−オンの芳香環に直接結合する複素環を表すことができず、
但し、式中、同時に:
・基X1、X2、X3、X4もしくはX5のうち1つは水酸基であり、
・G7は酸素原子であり、
・そして基X6もしくはX8のうち1つは水素原子あるいはハロゲンあるいはヒドロキシルまたはアルキルオキシ基である、
式(I)によって表される化合物は例外であり、
但し、式中、同時に:
・X1、X2およびX4基は同時に水素原子を表し、
・X6およびX8基はG’iR’iを表し、
・X5基はチオニトロソ基またはG’iR’I基を表し、
・X3基はハロゲンまたはG’iR’i基を表し、
式中、G’iは酸素原子、イオウ原子または単結合を表し、R’iは飽和、直鎖、分岐または環式アルキル基(ハロゲン化されているかもしくはハロゲン化されていない)あるいは水素原子を表す、
式(I)によって表される化合物は例外である。
特定の実施形態に従えば、式(I)によって表される化合物は上記において規定される通りであり、以下を同時に満たす式(I)によって表される化合物を含まない。
・X1、X2およびX4基は同時に水素原子を表し、
・そして、基X3またはX5のうちの1つは、水素原子もしくはハロゲンもしくはアルキル基もしくはアルキルオキシ基もしくはアルキルチオ基もしくはヒドロキシル基もしくはチオール基もしくはチオニトロソ基を表す。
・X1、X2およびX4基は同時に水素原子を表し、
・そして、基X3またはX5のうちの1つは、水素原子もしくはハロゲンもしくはアルキル基もしくはアルキルオキシ基もしくはアルキルチオ基もしくはヒドロキシル基もしくはチオール基もしくはチオニトロソ基を表す。
好適な様式では、本発明の特定の目的は、一般式(I)(式中、X1およびX5は水素原子である)を有する化合物に対応する一般式(Ia)によって表される化合物に関する。
好適な様式では、本発明の特定の目的は、一般式(I)(式中、X2およびX4はアルキル基であり、より有利には、X1およびX5は水素原子である)を有する化合物に対応する一般式(Ib)によって表される化合物に関する。
本発明の特定の目的は、一般式(I)(式中、X1、X3およびX4はアルキル基である)を有する化合物に対応する一般式(Ic)によって表される化合物に関する。
本発明の別の特定の目的は、一般式(I)(式中、X1、X2、X4およびX5は水素原子である)を有する化合物に対応する一般式(Id)によって表される化合物に関する。
本発明の別の特定の目的は、一般式(I)(式中、X6およびX8はアルキル基である)を有する化合物に対応する一般式(II)によって表される化合物に関する。
さらにより好ましくは、一般式(II)によって表される化合物は、式中X1およびX5が水素原子であり、有利には、式中、X2およびX4がアルキル基である化合物である。
本発明の別の特定の目的は、一般式(II)(式中、X1、X3、X4、X6およびX8はアルキル基である)によって表される化合物に関する。
本発明の別の特定の目的は、一般式(II)(式中、X6およびX8はアルキル基であり、X1、X2、X4およびX5は水素原子である)によって表される化合物に関する。
本発明の特定の態様に従えば、式(I)によって表される化合物は上記で規定される通りであり、ここで、X3はハロゲン原子またはチオニトロソ基を表すかあるいは先に規定されるような式(Gi−Ri)n−G’i−R’i(式中、G’iは酸素原子もしくはイオウ原子を表す)に対応する。
本発明はまた、本発明化合物の光学的および幾何異性体、ラセミ体、互変異性体、塩、水和物ならびに混合物を含む。
本発明はまた、被験体への投与後、本発明化合物および/または本発明化合物の代謝物に変換され、本発明化合物に類似の治療活性を示す本発明化合物のプロドラッグを包含する。
好適な様式では、GiまたはG’iのうちの少なくとも1つはイオウ原子を表し、ここで、iは値1、2、3、4、5、6、7もしくは8の1つである。
本発明の範囲において、上記で規定されるような本発明に従う誘導体は、シスまたはトランス配座を適応することができる。
本発明に従えば、用語「アルキル」は、メチル、エチル、プロピル、イソプロピル、n−ブチル、イソブチル、tert−ブチル、ペンチル、ネオペンチル、n−ヘキシルまたはシクロヘキシルのようなより詳細には1〜24個、好ましくは1〜10個の炭素原子を有する飽和炭化水素官能基(直鎖、分岐または環式、ハロゲン化されているかもしくはハロゲン化されていない)を示す。1もしくは2個の炭素原子を含有するかまたは2〜7個の炭素原子を含有する基が特に好適である。メチルおよびエチル基はかなり特に好適である。
本発明に従えば、用語「アルケニル」は、より詳細には1〜24個、好ましくは1〜10個の炭素原子を有する不飽和炭化水素官能基(直鎖、分岐または環式、ハロゲン化されているかもしくはハロゲン化されていない)を示す。
本発明に従えば、用語「アルキル」は、少なくとも1個のハロゲン原子、アルキル、ヒドロキシル、チオール、アルキルオキシ、アルキルチオ、オキシムもしくはチオニトロソ基によって置換されたまたは特に置換されていない芳香族炭化水素基を示す。フェニル基はかなり特に好適である。
本発明に従えば、用語「複素環」は、窒素、イオウおよび酸素のような1つもしくはそれ以上のヘテロ原子を含んでなる環式基(飽和または不飽和または芳香族)を示す。それらは、上記で規定したような少なくとも1つのアルキル基で有利に置換することができる。ジチオラン、ピリジン、フラン、チオフェンまたはモルホリンのような複素環が特に好ましい。本発明に関して、複素環のピペリジンおよびピペラジンは、上記で規定されるような少なくとも1つのアルキル基で有利に置換される。
チオニトロソという用語は、イオウ原子を介して芳香族環に結合したニトロソ基を指す。
アルキルオキシという用語は、酸素原子によって環に結合したアルキル鎖を示す。アルキル鎖については先に規定されている。
アルキルチオという用語は、イオウ原子によって芳香族環に結合したアルキル鎖(チオエーテル結合)を指す。アルキル鎖については先に規定されている。
ハロゲンという用語は、塩素、臭素、ヨウ素またはフッ素原子を表す。
本発明の特定の実施形態に従って、以下に、それらの対応する式で好適な化合物を示す:
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メルカプト−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルエチルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,5−ジヒドロキシ−3,4,6−トリメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,5−ジメトキシ−3,4,6−トリメチルフェニル)−3−(4−カルボキシジメチルメトキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,5−ジヒドロキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,5−ジメトキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−フェニルエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン:
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン:
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン:
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン:
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,4,5−トリメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,4,5−トリメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン:
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン:
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−フェニルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−フェニルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3−フルオロフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3−フルオロフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3−メチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3−メチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,5−ジメトキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(2,5−ジメトキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−エチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン塩酸塩:
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−ブロモフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン:
1−(4−ブロモフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン:
本発明はまた、式(I)によって表される化合物を調製するための方法を対象物として有する。
前記調製の方法は、多くの利点を有する。産業規模で行うことは簡単であり、式(I)によって表される高収率の化合物が提供される。
本発明に従う方法は、塩基媒体または酸性媒体において、式(A)によって表される少なくとも1つの化合物と式(B)によって表される少なくとも1つの化合物とを接触させることを含んでなり、式(A)および(B)は以下の通りである:
式中、X1、X2、X3、X4、X5、X6、X7およびX8は上記で規定された通りであり、X7はまたヒドロキシルまたはチオール基を表し得る。酸性または塩基性媒体において前記反応を行うための条件は、当業者の到達内であり、広範な変動が可能である。
前記2つの化合物は、化学量論的に比例して、有利に接触される。接触は、室温(約18℃〜25℃の間)で、大気圧において有利に行われる。
塩基性媒体では、反応は、水酸化ナトリウムのような水酸化アルカリ金属またはナトリウムエチラートのようなアルカリ金属アルコラートなどの強塩基の存在下で好適に行われる。
酸性媒体では、反応は、塩酸などの強酸の存在下で好適に行われる。
塩基性媒体における合成は、以下の様式で行うことができる:
1モル等量のケトン(化合物(A))および1モル等量のアルデヒド(化合物(B))を、20モル等量の水酸化ナトリウムのハイドロアルコール溶液に溶解する。混合物を、約18時間、室温(18℃〜25℃の間)で撹拌する。次いで、媒体を、詳細には塩酸で(詳細には、約2のpHに)酸性にする。
1モル等量のケトン(化合物(A))および1モル等量のアルデヒド(化合物(B))を、20モル等量の水酸化ナトリウムのハイドロアルコール溶液に溶解する。混合物を、約18時間、室温(18℃〜25℃の間)で撹拌する。次いで、媒体を、詳細には塩酸で(詳細には、約2のpHに)酸性にする。
反応媒体のエバポレーション後、沈殿または固相/液相抽出によって、予想される置換1,3−ジフェニルプロプ−2−エン−1−オンを得ることができる。次いで、それは、シリカゲルクロマトグラフィーまたは結晶化によって精製することができる。
酸性性媒体における合成は、以下の様式で行うことができる:
1モル等量のケトン(化合物(A))および1モル等量のアルデヒド(化合物(B))を、塩酸ガスで飽和したエタノール溶液に溶解する。混合物を室温で約6時間撹拌し、特に、減圧エバポレーションによって、溶媒を除去する。置換1,3−ジフェニルプロプ−2−エン−1−オンを、特に、シリカゲル上でのクロマトグラフィーによって精製する。
1モル等量のケトン(化合物(A))および1モル等量のアルデヒド(化合物(B))を、塩酸ガスで飽和したエタノール溶液に溶解する。混合物を室温で約6時間撹拌し、特に、減圧エバポレーションによって、溶媒を除去する。置換1,3−ジフェニルプロプ−2−エン−1−オンを、特に、シリカゲル上でのクロマトグラフィーによって精製する。
式(I)によって表される化合物を調製するための方法は、以下で中間体化合物と称される化合物の調製を可能にする。本発明はまた、所定の出発物質および得られる中間体化合物を対象物として有し、本発明において提供される。
前記中間体化合物は、以下よりなる群においてより好適に選択される:
・1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3,5−ジブロモフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(2,4,5−トリメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルチオエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3−フルオロフェニル)プロプ−2−エン−1−オン;
・1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−フェノキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3−フルオロフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3−メチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(2,5−ジメトキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−ブロモフェニル)−3−(4−ヒドロキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン。
・1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3,5−ジブロモフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(2,4,5−トリメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−(シクロヘキシルチオエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3−フルオロフェニル)プロプ−2−エン−1−オン;
・1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−フェノキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3−フルオロフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3−メチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(2,5−ジメトキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
・1−(4−ブロモフェニル)−3−(4−ヒドロキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン;
・1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン。
本発明はまた、医薬品として、上記のような一般式(I)によって表される化合物を対象物として有する。
本発明の別の目的は、薬学的に許容可能な担体中において、可能であれば別の治療および/または化粧品活性薬剤との組み合わせで、上記で規定されるような一般式(I)によって表される少なくとも1つの化合物を含んでなる薬学的および/または化粧品組成物に関する。
有利な様式において、それは、循環器系疾患、異脂肪血症、X症候群に伴う病状、糖尿病、肥満、高血圧、炎症性疾患、皮膚疾患(乾癬、アトピー性皮膚炎、ニキビなど)、喘息、酸化ストレスに連結する障害、老化一般、および例えば、特に、化粧品分野における皮膚老化(しわの出現など)の処置のための薬学的および/または化粧品組成物である。
さらに、本発明に従う薬学的および/または化粧品組成物は、神経保護に関する予防活性を発揮し、また、脳虚血の急性期における活性な神経保護を提供することができる。有利なことに、それは、グローバルリスクの低下を確実にすることによる脂質および/またはグルコース代謝の調節不全に関連するいくつかの循環器系の危険因子(高脂血症、糖尿病、肥満など)の出現の防止および/または処置のための薬学的および/または化粧品組成物である。
本発明はまた、ヒトもしくは動物身体の処置または予防の方法を実施するための薬学的および/または化粧品組成物を調製するための式(I)によって表される少なくとも1つの化合物の使用に関する。
本発明はまた、被験体、特にヒトに、上記で規定されるような有効用量の化合物または薬学的組成物を投与することを含んでなる、脂質および/またはグルコース代謝に関する病状を処置するための方法に関する。
本発明に従う薬学的組成物は、1つもしくはそれ以上の薬学的に許容可能な賦形剤またはビヒクルを有利に含んでなる。例として、薬学的使用に適合可能であり、当業者に公知である食塩、生理学的、等張、緩衝化溶液などが挙げられる。組成物は、分散剤、溶解剤、安定剤、保存剤などよりなる群において選択される1つもしくはそれ以上の薬剤またはビヒクルを含有することができる。処方(液体および/または注射用および/または固体)において使用することができる薬剤あるいはビヒクルは、特に、メチルセルロース、ハイドロキシメチルセルロース、カルボキシメチルセルロース、ポリソルベート80、マンニトール、ゼラチン、ラクトース、植物油、アラビアゴム(acacia)などである。組成物は、おそらく、持続性および/または徐放性放出を確実にする薬学的形態またはデバイスによって、注射用懸濁液、ゲル、オイル、錠剤、坐剤、散剤、カプセル、ソフトカプセルなどとして処方することができる。このタイプの処方のために、セルロース、炭酸塩またはデンプンのような薬剤が有利に使用される。
本発明に従う化合物または組成物は、異なる方法および異なる剤形で投与することができる。例えば、それらは、経口または例えば、静脈内、筋肉内、皮下、経皮、動脈内経路などによるような全身経路によって、投与することができる。注射のために、化合物は、例えば、シリンジを介するかまたは輸注によって注射することができる液体懸濁液として一般に処方することができる。注入速度および/または注入用量は、患者、病状、投与方法などに従って、当業者によって適応することができることが理解される。典型的に、化合物は、投与あたり1μg〜2g、好ましくは、投与あたり0.1mg〜1gの範囲の用量で投与される。投与は、場合により、連日行われるかまたは1日数回反復され得る。さらに、本発明に従う組成物は、他の有効成分または薬剤をさらに含んでなることができる。
本発明の他の態様および利点は、例示の目的のためであって、限定的方法によるものではない以下の実施例において理解されよう。
実施例1:本発明に従う化合物の合成
本発明に従う化合物は、以下に概略する一般的方法に従って調製した。
本発明に従う化合物は、以下に概略する一般的方法に従って調製した。
本発明の一般的合成方法の説明:
1,3−ジフェニルプロプ−2−エン−1−オンの合成:
一般的方法1:
酸性媒体における1,3−ジフェニルプロプ−2−エン−1−オンの合成:
ケトン(1eq)およびアルデヒド(1eq)を、塩酸ガスで飽和したエタノール溶液に溶解した。反応物を室温で6時間撹拌し、次いで、溶媒を減圧エバポレーションによって除去した。1,3−ジフェニルプロプ−2−エン−1−オンを、シリカゲル上でのクロマトグラフィーまたは再結晶によって精製した。
1,3−ジフェニルプロプ−2−エン−1−オンの合成:
一般的方法1:
酸性媒体における1,3−ジフェニルプロプ−2−エン−1−オンの合成:
ケトン(1eq)およびアルデヒド(1eq)を、塩酸ガスで飽和したエタノール溶液に溶解した。反応物を室温で6時間撹拌し、次いで、溶媒を減圧エバポレーションによって除去した。1,3−ジフェニルプロプ−2−エン−1−オンを、シリカゲル上でのクロマトグラフィーまたは再結晶によって精製した。
一般的方法2:
水酸化ナトリウムの存在下における1,3−ジフェニルプロプ−2−エン−1−オンの合成:
ケトン(1eq)およびアルデヒド(1eq)を、水酸化ナトリウム(20eq)のハイドロアルコール溶液に溶解した。混合物を室温で18時間、撹拌した。媒体は、塩酸でpH=2に酸性化した。
水酸化ナトリウムの存在下における1,3−ジフェニルプロプ−2−エン−1−オンの合成:
ケトン(1eq)およびアルデヒド(1eq)を、水酸化ナトリウム(20eq)のハイドロアルコール溶液に溶解した。混合物を室温で18時間、撹拌した。媒体は、塩酸でpH=2に酸性化した。
反応媒体のエバポレーション後、沈殿または固相/液相抽出によって、1,3−ジフェニルプロプ−2−エン−1−オンを得た。それを、シリカゲルクロマトグラフィーまたは再結晶によって精製した。
一般的方法3:
ナトリウムエチラートの存在下における置換1,3−ジフェニルプロプ−2−エン−1−オンの合成:
ナトリウム(1eq)を無水エタノールに溶解した。ケトン(1eq)およびアルデヒド(1eq)を添加した。反応混合物を、室温で12時間、撹拌し、次いで、2N水酸化ナトリウム(5eq)を添加した。混合物を100℃で12時間、保った。6N塩酸水溶液を添加することによって、反応媒体を酸性にした。溶媒を、減圧エバポレーションによって除去した。残渣を、シリカゲル上でのクロマトグラフィーまたは再結晶によって精製した。
ナトリウムエチラートの存在下における置換1,3−ジフェニルプロプ−2−エン−1−オンの合成:
ナトリウム(1eq)を無水エタノールに溶解した。ケトン(1eq)およびアルデヒド(1eq)を添加した。反応混合物を、室温で12時間、撹拌し、次いで、2N水酸化ナトリウム(5eq)を添加した。混合物を100℃で12時間、保った。6N塩酸水溶液を添加することによって、反応媒体を酸性にした。溶媒を、減圧エバポレーションによって除去した。残渣を、シリカゲル上でのクロマトグラフィーまたは再結晶によって精製した。
フェノールまたはチオフェノールのO−アルキル化:
一般的方法4:
フェノール(1eq)またはチオフェノール(1eq)をアセトニトリルに溶解し、ハロゲン化誘導体(1〜10eq)および炭酸カリウム(5eq)を添加した。反応媒体を、還流下、約10時間、激しく撹拌した。ろ過によって塩を除去し、溶媒および過剰の試薬を減圧エバポレーションによって除去し、予想される生成物をシリカゲルクロマトグラフィーによって精製した。
一般的方法4:
フェノール(1eq)またはチオフェノール(1eq)をアセトニトリルに溶解し、ハロゲン化誘導体(1〜10eq)および炭酸カリウム(5eq)を添加した。反応媒体を、還流下、約10時間、激しく撹拌した。ろ過によって塩を除去し、溶媒および過剰の試薬を減圧エバポレーションによって除去し、予想される生成物をシリカゲルクロマトグラフィーによって精製した。
一般的方法5:
アルコール(1eq)、フェノール(1eq)およびトリフェニルホスフィンをジクロロメタンに溶解した。アゾジカルボン酸ジイソプロピル(1eq)を添加し、混合物を12時間、室温で撹拌した。
アルコール(1eq)、フェノール(1eq)およびトリフェニルホスフィンをジクロロメタンに溶解した。アゾジカルボン酸ジイソプロピル(1eq)を添加し、混合物を12時間、室温で撹拌した。
反応媒体を水で洗浄し、硫酸マグネシウム上で乾燥させ、減圧エバポレートした。エバポレーション残渣をシリカゲルクロマトグラフィーにより精製した。
tert−ブチルエステルの酸加水分解:
一般的方法6:
tert−ブチルエステル(1eq)をジクロロメタンに溶解し、トリフルオロ酢酸(10eq)を添加し、混合物を室温で12時間、撹拌した。得られる生成物を、シリカゲル上でのクロマトグラフィーまたは再結晶によって精製した。
一般的方法6:
tert−ブチルエステル(1eq)をジクロロメタンに溶解し、トリフルオロ酢酸(10eq)を添加し、混合物を室温で12時間、撹拌した。得られる生成物を、シリカゲル上でのクロマトグラフィーまたは再結晶によって精製した。
本発明化合物を合成するために使用される出発物質の合成:
出発物質1:
4’−(ブロモメチルオキシ)アセトフェノン
この化合物は、先に記載の一般的方法4に従い、4’−ヒドロキシアセトフェノンおよびジブロモエタンから合成した。
出発物質1:
4’−(ブロモメチルオキシ)アセトフェノン
それを、シリカゲル上でのクロマトグラフィーにより精製した(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:2.55(s,3H)、3.66(t,2H,J=6.50Hz)、4.35(t,2H,J=6.50Hz)、6.94(d,2H,J=7.23Hz)、7.94(d,2H,J=7.23Hz)
出発物質1(1eq)およびペンタンチオール(penthanethiol)(1eq)をトリエチルアミン(2eq)の存在下でメタノールに溶解した。反応媒体を18時間、再還流し、溶媒を減圧エバポレーションにより除去した。オイルを酢酸エチル中に採取し、2N塩酸水溶液で洗浄した。4’−(ペンチルチオエチルオキシ)アセトフェノンを、シリカゲル上での精製後に得た(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:0.85(m,3H)、1.24−1.39(m,4H)、1.52−1.62(m,2H)、2.50(s,3H)、2.64(t,2H,J=7.2Hz)、2.94(t,2H,J=6.8Hz)、4.14(t,2H,J=6.8Hz)、6.88(d,2H,J=8.7Hz)、7.89(d,2H,J=8.7Hz)
出発物質3:
3,5−ジメチル−4−tert−ブチルオキシカルボニルジメチルメチルオキシベンズアルデヒド
この化合物は、一般的方法4に従い、4−ヒドロキシ−3,5−ジメチルベンズアルデヒドおよびブロモイソ酪酸tert−ブチルから合成した。
3,5−ジメチル−4−tert−ブチルオキシカルボニルジメチルメチルオキシベンズアルデヒド
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:1.43(s,6H)、1.49(s,9H)、2.28(s,6H)、7.53(s,2H)、9.88(s,1H)
出発物質4:
4’−ヒドロキシ−3’,5’−アセトフェノン
2,6−ジメチルフェノール(1eq)を塩化メチレンに溶解し、溶液を0℃に冷却した。次いで、塩化アルミニウム(3eq)および臭化アセチル(2eq)を添加した。混合物を、3時間、室温で撹拌し、次いで、氷上に注いだ。水相をジクロロメタンで抽出し、有機相を中性まで水で洗浄し、硫酸マグネシウム上で乾燥させ、溶媒を減圧エバポレーションにより除去した。得られた中間体エステルをシリカゲルクロマトグラフィー(溶出:シクロヘキサン/酢酸エチル9:1)によって精製し、次いで、2N水酸化ナトリウム水溶液(2.5eq)中に採取した。混合物を48時間、室温で撹拌し、次いで、希塩酸で酸性にした。沈殿物を、洗浄水が中性のpHに達するまで、水で洗浄した。
4’−ヒドロキシ−3’,5’−アセトフェノン
1H NMR CDCl3 δppm:2.30(s,6H)、2.54(s,3H)、7.65(s,2H)
出発物質5:
4’−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)アセトフェノン
この化合物は、先に記載の一般的方法5に従い、4’−ヒドロキシアセトフェノンおよび(R,S)−5−[1,2]ジチオラン−3−イルペンタノールから合成した。
4’−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)アセトフェノン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル95:5)。
1H NMR CDCl3 δppm:1.42−1.62(m,4H)、1.62−1.75(m,2H)、1.75−1.89(m,2H)、1.89−1.98(m,1H)、2.42−2.51(m,1H)、2.56(s,3H)、3.08−3.21(m,2H)、3.55−3.61(m,1H)、4.06(t,2H,J=6.2Hz)、6.92(d,2H,J=8.7Hz)、7.93(d,2H,J=8.7Hz)
出発物質6:
酢酸(R,S)−2−フェニル−2−(4−ホルミル−1,6−ジメチルフェニルオキシ)エチル
この化合物は、一般的方法5に従い、4−ヒドロキシ−3,5−ジメチルベンズアルデヒドおよび酢酸2−ヒドロキシ−2−フェニルエチルから合成した。
酢酸(R,S)−2−フェニル−2−(4−ホルミル−1,6−ジメチルフェニルオキシ)エチル
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:1.22(t,3H,J=7.35Hz)、2.20(s,6H)、4.16−4.28(m,2H)、5.3(s,1H)、7.38−7.51(m,7H)、9.87(s,1H)
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:0.90−1.80(m,13H)、2.56(s,3H)、4.07(t,2H,J=6.45Hz)、6.92(d,2H,J=8.80Hz)、7.93(d,2H,J=8.80Hz)
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:2.28(s,3H)、2.62(s,6H)、7.16(m,3H)
出発物質9:
3’,5’−ジメチル−4’−メチルチオアセトフェノン
出発物質8(1eq)を塩化メチレンに溶解し、溶液を0℃に冷却し、次いで、塩化アルミニウム(2.5eq)および臭化アセチル(2eq)を添加した。混合物を、72時間、室温で撹拌し、次いで、氷上に注いだ。水相をジクロロメタンで抽出し、有機相を中性まで水で洗浄し、硫酸マグネシウム上で乾燥させ、溶媒を減圧エバポレーションにより除去した。
3’,5’−ジメチル−4’−メチルチオアセトフェノン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:2.23(s,3H)、2.54(s,3H)、2.56(s,6H)、7.63(s,2H)
この化合物は、先に記載の一般的方法4に従い、出発物質4およびヨウ化メチルから合成した。
ろ過による炭酸カリウムの除去および減圧エバポレーションによる溶液の除去後に得られる粗生成物を、対応する中間体化合物の合成に使用した。
1H NMR CDCl3 δppm:2.31(s,6H)、2.54(s,3H)、3.74(s,3H)、7.63(s,2H)
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル85:15)。
1H NMR CDCl3 δppm:0.92−1.80(m,13H)、2.31(s,6H)、2.55(s,3H)、3.86(t,2H,J=7.05Hz)、7.63(s,2H)
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル85:15)。
1H NMR CDCl3 δppm :2.36(s,6H)、2.56(s,3H)、3.68(t,2H,J=6.21Hz)、4.14(t,2H,J=6.21Hz)、7.65(s,2H)
1H NMR CDCl3 δppm:1.08(m,5H)、1.40(m,1H)、1.56(m,2H)、1.80(m,2H)、2.30(s,3H)、2.53(m,1H)、2.69(t,2H,J=6.96Hz)、3.95(t,2H,J=6.96Hz)、6.68(d,2H,J=8.88Hz)、7.69(d,2H,J=8.88Hz)
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:1.26−1.42(m,5H)、1.59−1.65(m,1H)、1.80(m,2H)、2.00(m,2H)、2.35(s,6H)、2.56(s,3H)、2.75(m,1H)、2.95(t,2H,J=6.81Hz)、3.96(t,2H,J=6.81Hz)、7.64(s,2H)
ろ過による炭酸カリウムの除去および減圧エバポレーションによる溶液の除去後に得られる粗生成物を、対応する中間体化合物の合成に使用した。
1H NMR CDCl3 δppm:2.53(s,3H)、 2.56(s,3H)、3.90(s,3H)、6.85(d,1H,J=8.46Hz)、7.78(s,1H)、7.82(d,1H,J=8.46Hz)
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン)。
1H NMR CDCl3 δppm:0.90(t,3H,J=6.57Hz)、1.27−1.58(m,8H)、2.57(s,6H)、2.66(t,2H,J=7.11Hz)、7.12(m,3H)
出発物質17:
3’,5’−ジメチル−4’−ヘキシルチオアセトフェノン
出発物質16(1eq)を塩化メチレンに溶解し、溶液を0℃に冷却し、次いで、塩化アルミニウム(1eq)および臭化アセチル(1eq)を添加した。混合物を、2時間、室温で撹拌し、次いで、氷上に注いだ。水相をジクロロメタンで抽出し、有機相を中性まで水で洗浄し、硫酸マグネシウム上で乾燥させ、溶媒を減圧エバポレーションにより除去した。
3’,5’−ジメチル−4’−ヘキシルチオアセトフェノン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン)。
1H NMR CDCl3 δppm:0.87(t,3H,J=6.72Hz)、1.22−1.53(m,8H)、2.58(s,3H)、2.59(s,6H)、2.68(t,2H,J=7.23Hz)、7.66(s,2H)
出発物質18:
3’,5’−ジメチル−4’−(モルホリン−4−イルエチルオキシ)アセトフェノン
出発物質12(1eq)およびモルホリン(0.7eq)をアセトンに溶解し、炭酸カリウム(1eq)を添加した。混合物を72時間、再還流した。炭酸カリウムをろ過により除去し、溶媒を減圧エバポレーションにより除去した。残渣オイルを1N塩酸水溶液中に採取し、酢酸エチルで洗浄した。水相を、炭酸カリウムの添加により塩基性(pH9)にし、次いで、酢酸エチルで抽出した。有機相を硫酸マグネシウム上で乾燥させ、溶媒を減圧エバポレーションによって除去した。
3’,5’−ジメチル−4’−(モルホリン−4−イルエチルオキシ)アセトフェノン
1H NMR CDCl3 δppm:2.33(s,6H)、2.54(s,3H)、2.60(t,4H,J=4.70Hz)、2.81(t,2H,J=5.76Hz)、3.76(t,4H,J=4.70Hz)3.93(t,2H,J=5.76Hz)、7.62(s,2H)
出発物質19:
3,5−ジフルオロ−4−ヒドロキシベンズアルデヒド
2,6−ジフルオロフェノール(1eq)およびヘキサメチレンテトラアミン(2eq)を水/酢酸混合物(10:90)に溶解した。反応混合物を18時間、再還流し、次いで、室温に冷却した。
3,5−ジフルオロ−4−ヒドロキシベンズアルデヒド
反応混合物をジクロロメタンを抽出し、有機相をプールし、硫酸マグネシウム上で乾燥させ、溶媒を減圧エバポレーションにより除去した。
1H NMR CDCl3 δppm:7.35(dd,2H,J=6.57Hz,J=2.82Hz)、9.67(s,1H)
出発物質20:
4’−メトキシ−3’−トリフルオロメチルアセトフェノン
4−メトキシ−3−トリフルオロメチルベンゼゾニトリル(1eq)を、THF水溶液に溶解した。塩化メチルマグネシウムのTHF溶液(1eq)を添加し、反応混合物を16時間、室温で、次いで、さらに塩化メチルマグネシウム(1eq)添加した後、還流下で1時間、撹拌した。
4’−メトキシ−3’−トリフルオロメチルアセトフェノン
反応混合物を1N塩酸水溶液上に注ぎ、ジクロロメタンで抽出した。有機相を重炭酸カリウム水溶液で中和し、次いで、水で中和し、硫酸マグネシウム上で乾燥させた。溶媒を、減圧エバポレーションによって除去した。
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:2.60(s,3H)、3.99(s,3H)、7.07(d,1H,J=8.79Hz)、 8.14(d,1H,J=8.79Hz,J=1.77Hz)、8.19(s,1H)
本発明化合物を合成するために使用される中間体化合物の合成:
中間体化合物1:
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、出発物質2および4−ヒドロキシ−3,5−ジメチルベンズアルデヒドから合成した。
中間体化合物1:
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル85:15)。
1H NMR CDCl3 δppm:0.91(m,3H)、1.33−1.42(m,4H)、1.59−1.67(m,2H)、2.29(s,6H)、2.64(t,2H,J=7.60Hz)、2.96(t,2H,J=6.80Hz)、4.24(t,2H,J=6.80Hz)、6.97(d,2H,J=8.70Hz)、7.31(s,2H)、7.37(d,1H,J=15.54Hz)、7.72(d,1H,J=15.54Hz)、8.03(d,2H,J=8.70Hz)
中間体化合物2:
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、出発物質5および4−ヒドロキシ−3,5−ジメチルベンズアルデヒドから合成した。
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:1.45−1.65(m,4H)、1.65−1.77(m,2H)、1.77−1.87(m,2H)、1.87−2.0(m,1H)、2.30(s,6H)、2.43−2.51(m,1H)、3.09−3.22(m,2H)、3.56−3.62(m,1H)、4.04(t,2H,J=6.40Hz)、6.96(d,2H,J=8.50Hz)、7.31(s,2H)、7.41(d,1H,J=15.40Hz)、7.73(d,1H,J=15.40Hz)、8.04(d,2H,J=8.50Hz)
中間体化合物3:
1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3,5−ジブロモフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、4’−メチルチオアセトフェノンおよび3,5−ジブロモ−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3,5−ジブロモフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:2.55(s,3H)、6.19(s,1H)、7.32(d,2H,J=8.70Hz)、7.41(1H,J=15.40Hz)、7.63(d,1H,J=15.40Hz)、7.75(s,2H)、7.96(d,2H,J=8.70Hz)
中間体化合物4:
1−(4−(シクロヘキシルエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、出発物質7および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−(シクロヘキシルエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
生成物を反応媒体において結晶化し、排液し、予め0℃に冷却したタノールで洗浄し、減圧乾燥した。
1H NMR CDCl3 δppm:0.90−1.80(m,13H)、2.30(s,6H)、4.08(t,2H,J=6.54Hz)、6.97(d,2H,J=9.00Hz)、7.30(s,2H)、7.42(d,1H,J=15.50Hz)、7.73(d,1H,J=15.50Hz)、8.03(d,2H,J=9.00Hz)
中間体化合物5:
1−(4−メチルチオ−3,5−ジメチル−フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、出発物質9および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−メチルチオ−3,5−ジメチル−フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:2.28(s,3H)、2.30(s,6H)、2.64(s,6H)、7.32(s,2H)、7.36(d,1H,J=15.76Hz)、7.72(s,2H)、7.73(d,1H,J=15.76Hz)
中間体化合物6:
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、出発物質10および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
生成物を反応媒体において結晶化し、排液し、予め0℃に冷却したタノールで洗浄し、減圧乾燥した。
1H NMR CDCl3 δppm:2.28(s,6H)、2.35(s,6H)、3.77(s,3H)、7.30(s,2H)、7.35d,1H,J=15.63Hz)、 7.70(d,1H,J=15.63Hz)、7.72(s,2H)
中間体化合物7:
1−(4−(シクロヘキシルエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、出発物質11および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−(シクロヘキシルエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:0.94−1.05(m,2H)、1.16−1.31(m,4H)、1.57−1.82(m,7H)、2.30(s,6H)、2.35(s,6H)、3.86(t,2H,J=7.08Hz)、7.32(s,2H)、7.38(d,1H,J=15.81Hz)、7.71(s,2H)、7.72(d,1H,J=15.81Hz)
中間体化合物8:
1−(4−(シクロヘキシルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、上記の一般的方法1に従い、出発物質13および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−(シクロヘキシルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
生成物を反応媒体において結晶化し、排液し、予め0℃に冷却したタノールで洗浄した。
1H NMR CDCl3 δppm:1.23−1.42(m,5H)、1.63−1.65(m,1H)、1.79−1.81(m,2H)、2.01−2.08(m,2H)、2.29(s,6H)、2.73−2.81(m,1H)、2.96(t,2H,J=7.08Hz)、4.20(t,2H,J=7.08Hz)、6.97(d,2H,J=8.73Hz)、7.30(s,2H)、7.41(d,1H,J=15.53Hz)、7.73(d,1H,J=15.53Hz)、8.04(d,2H,J=8.73Hz)
中間体化合物9:
1−(2,4,5−トリメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、2’,4’,5’−トリメチルアセトフェノンおよび3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(2,4,5−トリメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル7:3)。
1H NMR CDCl3 δppm:2.27(s,9H)、2.29(s,3H)、2.38(s,3H)、7.00(d,1H,J=15.90Hz)、7.04(s,1H)、7.23(s,2H)、7.27(s,1H)、7.39(d,1H,J=15.90Hz)
中間体化合物10:
1−(4−(シクロヘキシルチオエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、出発物質14および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−(シクロヘキシルチオエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル7:3)。
1H NMR CDCl3 δppm:1.32(m,5H)、1.63(m,1H)、1.79(m,2H)、2.03(m,2H)、2.29(s,6H)、2.37(s,6H)、2.75(m,1H)、2.97(t,2H,J=7.05Hz)、3.97(t,2H,J=7.05Hz)、7.30(s,2H)7.37(d,1H,J=15.70Hz)、7.70(d,1H,J=15.70Hz)、7.71(s,2H)
中間体化合物11:
1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3−フルオロフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、4’−メチルチオアセトフェノンおよび3−フルオロ−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3−フルオロフェニル)プロプ−2−エン−1−オン
生成物を反応媒体において結晶化し、排液し、減圧乾燥した。
1H NMR CDCl3 δppm:2.55(s,3H)、7.04(t,1H,J=8.37Hz)、7.30−7.42(m,5H)、7.73(d,1H,J=15.54Hz)、7.95(d,2H,J=8.40Hz)
中間体化合物12:
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、ペンタメチルアセトフェノンおよび3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
生成物を反応媒体において結晶化し、排液し、エタノールにおける再結晶によって精製した。
1H NMR CDCl3 δppm:2.09(s,6H)、2.20(s,6H)、2.22(s,6H)、2.26(s,3H)、6.83(d,1H,J=16.11Hz)、7.05(d,1H,J=16.11Hz)、7.16(s,2H)
中間体化合物13:1−(4−フェノキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、4’−フェノキシアセトフェノンおよび3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル7:3)。
1H NMR CDCl3 δppm:2.30(s,6H)、7.05(d,2H,J=8.67Hz)、7.1(d,2H,J=8.47Hz)、7.21(t,1H,J=7.30Hz)、7.31(s,2H)、7.43−7.38(m,3H)、7.75(d,1H,J=15.36Hz)、8.05(d,2H,J=8.47Hz)
中間体化合物14:
1−(4−メトキシ−3−フルオロフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、4’−メトキシ−3’−フルオロアセトフェノンおよび’3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−メトキシ−3−フルオロフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
生成物を反応媒体において結晶化し、排液し、次いで、ヘプタンで洗浄した。
1H NMR CDCl3 δppm:2.30(s,6H)、3.98(s,3H)、7.04(t,1H,J=8.30Hz)、7.31(s,2H)、7.35(d,1H,J=15.69Hz)、7.74(d,1H,J=15.69Hz)、7.79−7.87(m,2H)
中間体化合物15:1−(4−メトキシ−3−メチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、出発物質15および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
生成物を反応媒体において結晶化し、排液し、次いで、ヘプタンで洗浄した。
この化合物は、先に記載の一般的方法1に従い、出発物質15および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1H NMR CDCl3 δppm:2.30(s,9H)、3.92(s,3H)、6.90(d,1H,J=8.45Hz)、7.31(s,2H)、7.43(d,1H,J=15.52Hz)、7.73(d,1H,J=15.52Hz)、7.88(s,1H)、7.93(d,1H,J=8.45Hz)
中間体化合物16:
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、出発物質17および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:0.88(t,3H,J=6.90Hz)、1.20−1.50(m,8H)、2.30(s,6H)、2.63(s,6H)、2.70(t,2H,J=6.9Hz)、7.32(s,2H)、7.36(d,1H,J=15.51Hz)、7.72(s,2H)、7.73(d,1H,J=15.51Hz)
中間体化合物17:
1−(2,5−ジメトキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、2’,5’−ジメトキシアセトフェノンおよび’3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(2,5−ジメトキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル7:3)。
1H NMR CDCl3 δppm:2.27(s,6H)、3.74(s,3H)、3.82(s,3H)、6.93(d,1H,J=8.73Hz)、7.02(dd,1H,J=8.73Hz,J=3.27Hz)、7.14(d,1H,J=3.27Hz)、7.22(d,1H,J=15.81Hz)、7.25(s,2H)、7.53(d,1H,J=15.81Hz)
中間体化合物18:
1−(4−ブロモフェニル)−3−(4−ヒドロキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、4’−ブロモアセトフェノンおよび出発物質19から合成した。
1−(4−ブロモフェニル)−3−(4−ヒドロキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン
エタノールを減圧エバポレーションにより除去し、固体を無水エタノールで洗浄した。
1H NMR CDCl3 δppm:5.97(s,1H)、7.18(d,2H,J=8.30Hz)、7.35(d,1H,J=15.36Hz)、7.65(m,3H)、7.89(d,2H,J=8.30Hz)
中間体化合物19:
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法1に従い、出発物質20および3,5−ジメチル−4−ヒドロキシベンズアルデヒドから合成した。
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
エタノールを減圧エバポレーションにより除去し、固体を無水エタノールで洗浄した。
1H NMR DMSOd6 δppm:2.22(s,6H)、4.01(s,3H)、7.41(d,1H,J=9.00Hz)、7.52(s,2H)、7.64(d,1H,J=15.40Hz)、8.96(s,1H)、7.76(d,1H,J=15.40Hz)、8.29(d,1H,J=1.60Hz)、8.49(dd,1H,J=9.00Hz,J=1.60Hz)
本発明化合物の合成:
本発明化合物1:
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物1およびブロモイソ酪酸tert−ブチルから合成した。
本発明化合物1:
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:0.91(t,3H,J=7.10Hz)、1.37−1.69(m,21H)2.27(s,6H)、2.63(t,2H,J=7.10Hz)、2.93(t,2H,J=7.10Hz)、4.21(t,2H,J=7.10Hz)、6.97(d,2H,J=8.70Hz)、7.28(s,2H)、7.44(d,1H,J=15.81Hz)、7.70(d,1H,J=15.81Hz)、8.03(d,2H,J=8.70Hz)
本発明化合物2:
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物1から合成した。
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン−メタノール:98:2)。
1H NMR CDCl3 δppm:0.84−0.89(m,3H)、1.39−1.24(m,4H)、1.39(s,6H)、1.50−1.57(m,2H)、2.22(s,6H)、2.61(t,2H,J=7.40Hz)、2.90(t,2H,J=6.20Hz)、4.26(t,2H,J=6.20Hz)、7.09(d,2H,J=8.50Hz)、7.57(s,2H)、7.59(d,1H,J=15.40Hz)、7.83(d,1H,J=15.40Hz)、8.15(d,2H,J=8.50Hz)、12.90(s,1H)
MS(ES−MS):483.2(m−1)
MP℃=85.2−89.8
MS(ES−MS):483.2(m−1)
MP℃=85.2−89.8
本発明化合物3:
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン
この化合物は、先に記載の一般的方法1に従い、出発物質3および出発物質4から合成した。
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン(dichloromethan)/メタノール:95:5)。
1H NMR CDCl3 δppm:1.46(s,6H)、1.53(s,9H)、2.27(s,6H)、2.33(s,6H)、7.28(s,2H)、7.43(d,1H,J=15.81Hz)、7.69(d,1H,J=15.81Hz)、7.74(s,2H)
本発明化合物4:
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物3から合成した。
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール:98:2)。
1H NMR CDCl3 δppm:1.39(s,6H)、2.22(s,6H)、2.25(s,6H)、7.33(s,2H)、7.45(d,1H,J=15.5Hz)、7.69(d,1H,J=15.5Hz)、7.75(s,2H)
MS(ES−MS):381.3(m−1)
MP℃=199.3−199.8
MS(ES−MS):381.3(m−1)
MP℃=199.3−199.8
本発明化合物5:
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物2およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル85:15)。
1H NMR CDCl3 δppm:1.43(s,6H)、1.53(m,13H)、1.65−1.75(m,2H)、1.75−1.85(m,2H)、1.85−1.97(m,1H)、2.28(s,6H)、1.46−1.52(m,1H)、3.12−3.21(m,2H)、3.58−3.63(m,1H)、4.05(t,2H,J=6.21Hz)、6.97(d,2H,J=8.30Hz)、7.29(s,2H)、7.45(d,1H,J=15.50Hz)、7.70(d,1H,J=15.50Hz)、8.03(d,2H,J=8.30Hz)
本発明化合物6:
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物5から合成した。
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール:98:2)。
1H NMR CDCl3 δppm:1.56(m,10H)、1.67−1.77(m,2H)、1.77−1.90(m,2H)、1.90−1.97(m,1H)、2.30(s,6H)、2.43−2.52(m,1H)、3.11−3.22(m,2H)、3.58−3.63(m,1H)、4.05(t,2H,J=6.20Hz)、6.98(d,2H,J=8.80Hz)、7.31(s,2H)、7.46(d,1H,J=15.80Hz)、7.71(d,1H,J=15.80Hz)、8.03(d,2H,J=8.80Hz)
MS(ES−MS):529.1(M+1)
MP℃:182.7−186.6℃
MS(ES−MS):529.1(M+1)
MP℃:182.7−186.6℃
本発明化合物7:
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物3およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出(eelution):シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:1.54(s,9H)、1.63(s,6H)、2.56(s,3H)、7.33(d,2H,J=8.50Hz)、7.44(d,1H,J=15.70Hz)、7.62(d,1H,J=15.70Hz)、7.78(s,2H)、7.96(d,2H,J=8.50Hz)
本発明化合物8:
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物7から合成した。
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール:98:2)。
1H NMR CDCl3 δppm:1.54(s,6H)、2.51(s,3H)、7.41(d,2H,J=8.5Hz)、7.64(d,1H,J=15.4Hz)、8.04(d,1H,J=15.4Hz)、8.15(d,2H,J=8.5Hz)、8.29(s,2H)、12.93(s,1H)
MS(ES−MS):513.2(m−1)
MS(ES−MS):513.2(m−1)
本発明化合物10:
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物4およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/シクロヘキサン:7:3)。
1H NMR CDCl3 δppm: 0.90−1.30(m,5H)、1.50(m,16H)、1.73(m,7H)、2.28(s,6H)、4.08(t,2H,J=6.54Hz)、6.97(d,2H,J=8.70Hz)、7.29(s,2H)、7.45(d,1H,J=15.75Hz)、7.70(d,1H,J=15.75Hz)、8.03(d,2H,J=8.70Hz)
本発明化合物11:
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物10から合成した。
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、ジクロロメタン/ヘプタンの混合物における沈殿により行った。
1H NMR CDCl3 δppm: 0.90−1.30(m,5H)、1.56(m,7H)、 1.70(m,7H)、2.30(s,6H)、4.09(t,2H,J=6.57Hz)、6.98(d,2H,J=9.09Hz)、7.32(s,2H)、7.4(d,1H,J=15.60Hz)、7.71(d,1H,J=15.60Hz)、8.04(d,2H,J=9.09Hz)
MS(ES−MS):465.3(m+1)
MP℃:134.8−135.3
MS(ES−MS):465.3(m+1)
MP℃:134.8−135.3
本発明化合物12:
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物5およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:1.50(s,6H)、1.51(s,3H)、1.53(s,9H)、2.28(s,6H)、2.63(s,6H)、7.30(s,2H)、7.39(d,1H,J=15.69Hz)、7.69(d,1H,J=15.69Hz)、7.72(s,2H)
本発明化合物13:
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物12から合成した。
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR DMSOd6 δppm:1.39(s,6H)、2.22(s,6H)、2.28(s,3H)、2.59(s,6H)、7.56(s,2H)、7.62(d,1H,J=15.37Hz)、7.79(d,1H,J=15.37Hz)、7.89(s,2H)、12.95(s,1H)
MS(ES−MS):412.9(m+1)
MP℃:177.0−179.0
MS(ES−MS):412.9(m+1)
MP℃:177.0−179.0
本発明化合物14:
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、化合物3および臭化プロピルから合成した。炭酸カリウムの除去および減圧エバポレーションによる溶液の除去後に得られる粗生成物を、化合物15の合成に使用した。
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
1H NMR CDCl3 δppm:1.09(t,3H,J=7.41Hz)、1.46(s,6H)、1.58(s,9H)、1.83(m,2H)、2.27(s,6H)、2.35(s,6H)、3.78(t,2H,J=6.09Hz)、7.29(s,2H)、7.41(d,1H,J=15.32Hz)、7.68(d,1H,J=15.32Hz)、7.70(s,2H)
本発明化合物15:
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物14から合成した。
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール95:5)。
1H NMR CDCl3 δppm:1.05(t,3H,J=7.29Hz)、1.39(s,6H)、1.78(m,2H)、2.23(s,6H)、2.32(s,6H)、3.78(m,2H)、7.56(s,2H)、7.58(d,1H,J=16.26Hz)、7.80(d,1H,J=16.26Hz)、7.86(s,2H)
MS(ES−MS):424.9(m+1)
MP℃:188.5−189.7
MS(ES−MS):424.9(m+1)
MP℃:188.5−189.7
本発明化合物16:
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物6およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル95:5)。
1H NMR CDCl3 δppm:1.47(s,9H)、1.53(s,6H)、2.29(s,6H)、2.31(s,6H)、3.79(s,3H)、7.30(s,2H)、7.40(d,1H,J=15.50Hz)、7.70(d,1H,J=15.50Hz)、7.71(s,2H)
本発明化合物17:
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物16から合成した。
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR CDCl3 δppm:1.57(s,6H)、2.31(s,6H)、2.38(s,6H)、 3.79(s,3H)、7.33(s,2H)、7.43(d,1H,J=15.81Hz)、7.71(d,1H,J=15.81Hz)、7.72(s,2H)
MS(ES−MS):396.9(m+1)
MP℃:166.6−168.8
MS(ES−MS):396.9(m+1)
MP℃:166.6−168.8
本発明化合物18:
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、化合物3および臭化ヘキシルから合成した。炭酸カリウムの除去および減圧エバポレーションによる溶液の除去後に得られる粗生成物を、化合物19の合成に使用した。
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
1H NMR CDCl3 δppm:0.93(t,3H,J=8.58Hz)、1.37(m,4H)、1.47(s,6H)、1.53(m,11H)、1.83(m,2H)、2.28(s,6H)、2.36(s,6H)、3.82(t,2H,J=6.54Hz)、7.29(s,2H)、7.40(d,1H,J=15.57Hz)、7.70(d,1H,J=15.57Hz)、7.71(s,2H)
本発明化合物19:
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物18から合成した。
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール95:5)。
1H NMR CDCl3 δppm:0.93(t,3H,J=7.02Hz)、1.37(m,4H)、1.50(m,2H)、1.56(s,6H)、1.83(m,2H)、2.30(s,6H)、2.34(s,6H)、3.82(t,2H,J=6.57Hz)、7.32(s,2H)、7.42(d,1H,J=15.48Hz)、7.69(d,1H,J=15.48Hz)、7.71(s,2H)
MS(ES−MS):466.9(m+1)
MP℃:171.0−172.0
MS(ES−MS):466.9(m+1)
MP℃:171.0−172.0
本発明化合物20:
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物7およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル85:15)。
1H NMR CDCl3 δppm:0.94−1.53(m,28H)、2.28(s,6H)、2.35(s,6H)、3.86(t,2H,J=6.75Hz)、7.29(s,2H)、7.41(d,1H,J=15.76Hz)、7.70(d,1H,J=15.76Hz)、7.71(s,2H)
本発明化合物21:
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物20から合成した。
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR CDCl3 δppm:0.97−1.04(m,2H)、1.16−1.34(m,4H)、1.56(s,6H)、1.63−1.82(m,7H)、2.30(s,6H)、2.35(s,6H)、3.86(t,2H,J=6.60Hz)、7.32(s,2H)、7.43(d,1H,J=15.81Hz)、7.70(d,1H,J=15.81Hz)、7.71(s,2H)
MS(ES−MS):492.9(m+1)
MP℃:166.4−167.7
MS(ES−MS):492.9(m+1)
MP℃:166.4−167.7
本発明化合物22:
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物8およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル7:3)。
1H NMR CDCl3 δppm:1.29(m,5H)、1.46(s,6H)、1.53(s,9H)、1.62(m,1H)、1.80(m,2H)、2.03(m,2H)、2.27(s,6H)、2.75(m,1H)、2.95(t,2H,J=6.81Hz)、4.20(t,2H,J=6.81Hz)、6.97(d,2H,J=9.24Hz)、7.28(s,2H)、7.43(d,1H,J=15.78Hz)、7.70(d,1H,J=15.78Hz)、8.03(d,2H,J=9.24Hz)
本発明化合物23:
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物22から合成した。
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR CDCl3 δppm:1.27−1.38(m,4H)、1.56(s,6H)、1.63−1.66(m,2H)、1.79−1.81(m,2H)、2.01−2.04(m,2H)、2.30(s,6H)、2.76−2.77(m,1H)、2.96(t,2H,J=7.08Hz)、4.21(t,2H,J=7.08Hz)、6.97(d,2H,J=8.61Hz)、7.31(s,2H)、7.41(d,1H,J=15.60Hz)、7.73(d,1H,J=15.60Hz)、8.04(d,2H,J=8.61Hz)
MS(Maldi−Tof):496.67(m+1)
MP℃:112.3−114
MS(Maldi−Tof):496.67(m+1)
MP℃:112.3−114
本発明化合物24:
1−(2,4,5−トリメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物9およびブロモイソ酪酸tert−ブチルから合成した。
1−(2,4,5−トリメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:1.40−1.65(m,15H)、2.22(s,6H)、2.25(s,3H)、2.28(s,3H)、2.35(s,3H)、7.00(s,1H)、7.01(d,1H,J=15.70Hz)、7.18(s,2H)、7.24(s,1H)、7.35(d,1H,15.70Hz)
本発明化合物25:
1−(2,4,5−トリメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物24から合成した。
1−(2,4,5−トリメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン(dichlroromethane)/メタノール98:2)。
1H NMR CDCl3 δppm:1.55(s,6H)、2.27(s,6H)、2.27−2.30(m,6H)、2.39(s,3H)、7.05(s,1H)、7.07(d,1H,J=15.24Hz)、7.24(s,2H)、7.28(s,1H)、7.4(d,1H,J=15.78Hz)
MS(ES−MS): 381.2(m+1)
MP℃:168.7−173.3
MS(ES−MS): 381.2(m+1)
MP℃:168.7−173.3
本発明化合物26:
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物10およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル95:5)。
1H NMR CDCl3 δppm:1.27−2.04(m,10H)、1.47(s,6H)、1.53(s,9H)、2.29(s,6H)、2.38(s,6H)、2.75(m,1H)、2.98(t,2H,J=6.84Hz)、3.98(t,2H,J=6.84Hz)、7.29(s,2H)、7.40(d,1H,J=15.63Hz)、7.70(d,1H,J=15.63Hz)、7.71(s,2H)
本発明化合物27:
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物26から合成した。
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR CDCl3 δppm:1.26−1.42(m,5H)、1.56(s,6H)、1.62−1.64(m,1H)、1.79−1.81(m,2H)、2.03−2.00(m,2H)、2.3(s,6H)、2.38(s,6H)、2.71−2.78(m,1H)、2.97(t,2H,J=7.00Hz)、3.98(t,2H,J=7.00Hz)、7.32(s,2H)、7.43(d,1H,J=15.78Hz)、7.7(d,1H,J=15.24Hz)、7.71(s,2H)
MS(MALDI−TOF):524.78(m+1)
MP℃:156.0−158.0
MS(MALDI−TOF):524.78(m+1)
MP℃:156.0−158.0
本発明化合物28:
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物11およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:1.43(s,9H)、1.62(s,6H)、2.53(s,3H)、6.95(t,1H,J=8.07Hz)、7.32(d,2H,J=8.64Hz)、7.39(m,3H)、7.72(d,1H,J=15.50Hz)、7.95(d,2H,J=8.64Hz)
本発明化合物29:
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物28から合成した。
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン
それは、ジクロロメタン/ヘプタンの70:30混合物における沈殿により精製した。
1H NMR CDCl3 δppm:1.67(s,6H)、2.56(s,3H)、7.09(t,1H,J=8.19Hz)、7.32(m,3H)、7.43(m,2H)、7.73(d,1H,J=15.24Hz)、8.73(d,2H,J=8.73Hz)
MS(ES−MS):375.1(m+1)
MP℃:142.2−144.6
MS(ES−MS):375.1(m+1)
MP℃:142.2−144.6
本発明化合物30:
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物12およびブロモイソ酪酸tert−ブチルから合成した。
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル95:5)。
1H NMR CDCl3 δppm:1.44(s,6H)、1.53(s,9H)、2.11(s,6H)、2.22(s,6H)、2.23(s,6H)、2.28(s,3H)、6.84(d,1H,J=16.26Hz)、7.06(d,1H,J=16.26Hz)、7.16(s,2H)
本発明化合物31:
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物30から合成した。
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR CDCl3 δppm:1.53(s,6H)、2.11(s,6H)、2.22(s,6H)、2.24(s,6H)、2.28(s,3H)、6.87(d,1H,J=16.20Hz)、7.08(d,1H,J=16.20Hz)、7.19(s,2H)
MS(ES−MS):409.1(m+1)
MP℃:192.8−194.2
MS(ES−MS):409.1(m+1)
MP℃:192.8−194.2
本発明化合物32:
1−(4−フェニルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物13およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−フェニルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル7:3)。
1H NMR CDCl3 δppm:1.47(s,6H)、1.53(s,9H)、2.28(s,6H)、7.02(d,2H,J=8.70Hz)、7.1(d,2H,J=7.92Hz)、7.21(t,1H,J=7.35Hz)、7.29(s,2H)、7.39−7.46(m,3H)、7.73(d,1H,J=16.20Hz)、8.04(d,2H,J=8.70Hz)
本発明化合物33:
1−(4−フェニルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物32から合成した。
1−(4−フェニルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR DMSOd6 δppm:1.39(s,6H)、2.22(s,6H)、7.08(d,2H,J=8.55Hz)、7.15(d,2H,J=8.01Hz)、7.25(t,1H,J=7.41Hz)、7.47(t,2H,J=7.44Hz)、7.55(s,2H)、7.62(d,1H,J=15.70Hz)、7.82(d,1H,J=15.70Hz)、8.19(d,2H,J=8.55Hz)
MS(ES−MS):430.9(m+1)
MP℃:154.0−156.0
MS(ES−MS):430.9(m+1)
MP℃:154.0−156.0
本発明化合物34:
1−(4−メトキシ−3−フルオロフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物14およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−メトキシ−3−フルオロフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル8:2)。
1H NMR CDCl3 δppm:1.50(s,6H)、1.53(s,9H)、2.28(s,6H)、3.98(s,3H)、7.04(t,1H,J=8.07Hz)、7.29(s,2H)、7.39(d,1H,J=15.70Hz)、7.73(d,1H,J=15.70Hz)、7.78−7.86(m,2H)
本発明化合物35:
1−(4−メトキシ−3−フルオロフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物34から合成した。
1−(4−メトキシ−3−フルオロフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR DMSOd6 δppm:1.39(s,6H)、2.22(s,6H)、3.95(s,3H)、7.31(t,1H,J=7.35Hz)、7.57(s,2H)、7.60(d,1H,J=15.78Hz)、7.83(d,1H,J=15.78Hz)、7.,99−8.06(m,2H)
MS(ES−MS):387.1(m+1)
MP℃:167.0−169.0
MS(ES−MS):387.1(m+1)
MP℃:167.0−169.0
本発明化合物36:
1−(4−メトキシ−3−メチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物15およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−メトキシ−3−メチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
1H NMR CDCl3 δppm:1.46(s,6H)、1.52(s,9H)、2.27(s,9H)、3.90(s,3H)、6.88(d,1H,J=8.73Hz)、7.28(s,2H)、7.45(d,1H,J=16.11Hz)、7.70(d,1H,J=16.11Hz)、7.87(s,1H)、7.92(dd,1H,J=8.73Hz,J=1.65Hz)
本発明化合物37:
1−(4−メトキシ−3−メチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物36から合成した。
1−(4−メトキシ−3−メチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィー(溶出:ジクロロメタン/メタノール98:2)、続いて、アセトニトリルにおける再結晶により行った。
1H NMR CDCl3 δppm:1.39(s,6H)、2.22(s,6H)、2.24(s,3H)、3.90(s,3H)、7.08(d,1H,J=8.55Hz)、7.56(s,2H)、7.58(d,1H,J=16.71Hz)、7.82(d,1H,J=15.51Hz)、7.99(s,1H)、8.06(d,1H,8.55)、12.95(s,1H)
MS(ES−MS):383.2(m+1)
MP℃:157.0−159.0
MS(ES−MS):383.2(m+1)
MP℃:157.0−159.0
本発明化合物38:
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物16およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:0.88(t,3H,J=6.84Hz)、1.25−1.62(m,8H)、1.47(s,6H)、1.53(s,9H)、2.29(s,6H)、2.62(s,6H)、2.70(t,2H,J=6.96Hz)、7.30(s,2H)、7.39(d,1H,J=15.90Hz)、7.70(d,1H,J=15.51Hz)、7.71(s,2H)
本発明化合物39:
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物38から合成した。
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR DMSOd6 δppm:0.84(m,3H)、1.22−1.40(m,8H)、2.08(s,6H)、2.22(s,6H)、2.58(s,6H)、2.73(t,2H,J=6.90Hz)、7.57(s,2H)、7.63(d,1H,J=15.35Hz)、7.8(d,1H,J=15.35Hz)、7.89(s,2H)MS(ES−MS):483.2(m+1)
MP℃:130.0−132.0
MP℃:130.0−132.0
本発明化合物40:
1−(2,5−ジメトキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物17およびブロモイソ酪酸tert−ブチルから合成した。
1−(2,5−ジメトキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル7:3)。
1H NMR CDCl3 δppm:1.45(s,6H)、1.52(s,9H)、2.25(s,6H)、3.81(s,3H)、3.86(s,3H)、6.93(d,1H,J=9.24Hz)、7.01(dd,1H,J=8.82Hz,J=2.7Hz)、7.14(d,1H,J=2.8Hz)、7.22(s,2H)、7.26(d,1H,J=15.60Hz)、7.52(d,1H,J=15.60Hz)
本発明化合物41:
1−(2,5−ジメトキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物40から合成した。
1−(2,5−ジメトキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:ジクロロメタン/メタノール98:2)。
1H NMR DMSOd6 δppm:1.38(s,6H)、2.19(s,6H)、3.75(s,3H)、3.8(s,3H)、7.00(d,1H,J=2.16Hz)、7.12(m,2H)、7.26(d,1H,J=16.2Hz)、7.37(d,1H,J= 13.5Hz)、7.4(s,2H)
MS(ES−MS):398.3(m−1)
MP℃:油状生成物
MS(ES−MS):398.3(m−1)
MP℃:油状生成物
本発明化合物42:
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−エチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン塩酸塩
この化合物は、先に記載の一般的方法1に従い、出発物質18および3から合成した。減圧エバポレーションによるエタノールの除去後、ジエチルエーテル中の残渣オイルの粉砕後に化合物42を得た。
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−エチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン塩酸塩
1H NMR CDCl3 δppm:1.36(t,3H,J=6.84Hz)、1.49(s,6H)、2.24(s,6H)、2.38(s,6H)、3.20(s,2H)、3.50(s,2H)、3.73(d,2H,J=11.04Hz)、4.03(d,2H,J=11.04Hz)、4.30−4.45(m,6H)、7.36(d,1H,J=15.75Hz)、7.28(s,2H)、7.66(m,3H)、13.39(s,1H,N.HCl,交換/D2O)
本発明化合物43:
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
化合物42をエタノールに溶解し、2M水酸化ナトリウムを添加した。混合物を、18時間、室温で撹拌し、次いで、水中に注いだ。水相を酢酸エチルで洗浄し、酢酸の添加により中和し、次いで、ジエチルエーテルで抽出した。エーテル相において形成される沈殿を排液し、無水エタノールにおいて再結晶した。
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
1H NMR CDCl3 δppm:1.50(s,6H)、2.28(s,6H)、2.36(s,6H)、2.89(m,4H)、3.06(t,2H,J=5.46Hz)、3.87(m,4H)、4.06(t,2H,J=5.46Hz)、6.50(s,1H)、7.40(d,1H,J=15.78Hz)、7.27(s,2H)、7.68(m,3H).
MS(MALDI−TOF):496(m+1)
MP℃:167−169
MP℃:167−169
本発明化合物44:
1−(4−ブロモフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物18およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−ブロモフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル95:5)。
1H NMR CDCl3 δppm:1.50(s,9H)、1.57(s,6H)、7.38(d,2H,J=8.50Hz)、7.65(d,1H,J=15.78Hz)、7.66(m,3H)、7.89(d,2H,J=8.50Hz)
本発明化合物45:
1−(4−ブロモフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物44から合成した。
1−(4−ブロモフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン
精製は、ジイソプロピルエーテルにおける再結晶により行った。
1H NMR CDCl3 δppm:1.65(s,6H)、7.24(d,2H,J=8.50Hz)、7.41(d,1H,J=15.84Hz)、7.66(m,3H)、7.89(d,2H,J=8.50Hz)
MS(ES−MS):425(m+1)
MP℃:142
MS(ES−MS):425(m+1)
MP℃:142
本発明化合物46:
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法4に従い、中間体化合物19およびブロモイソ酪酸tert−ブチルから合成した。
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
精製は、シリカゲル上でのクロマトグラフィーにより行った(溶出:シクロヘキサン/酢酸エチル9:1)。
1H NMR CDCl3 δppm:1.47(s,6H)、1.53(s,9H)、2.29(s,6H)、4.00(s,3H)、7.10(d,1H,J=8.65Hz)、7.30(s,2H)、7.40(d,1H,J=15.27Hz)、7.75(d,1H)、8.25(d,1H,J=8.65Hz)、8.28(s,1H)
本発明化合物47:
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
この化合物は、先に記載の一般的方法6に従い、化合物46から合成した。減圧エバポレーションによって溶媒を除去した後、純粋な状態の化合物47が得られた。
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
1H NMR DMSOd6 δppm:1.40(s,6H)、2.23(s,6H)、4.03(s,3H)、7.43(d,1H,J=8.7Hz)、7.60(s,2H)、7.65(d,1H,J=15.40Hz)、7.88(d,1H,J=15.40Hz)、8.31(s,1H)、8.51(d,1H,J=8.70Hz)、12.80(s,1H).
MS(ES−MS):437.3(m+1)
MP℃:182.5
MP℃:182.5
実施例2:本発明化合物の抗酸化特性の評価
銅によるLDL酸化に対する保護
試験した本発明化合物は、その調製が上記の実施例に記載されている化合物である。
銅によるLDL酸化に対する保護
試験した本発明化合物は、その調製が上記の実施例に記載されている化合物である。
LDL酸化は、重要な変更であり、動脈硬化の確立および発達において顕著な役割を果たしている(ジャーゲンス(Jurgens)、ホッフ(Hoff)ら、1987年)。以下のプロトコルにより、化合物の抗酸化特性を実証することが可能である。他で示さない限り、試薬はSigma(St Quentin、仏国)由来であった。
LDLは、レベアウ(Lebeau)ら(レベアウ(Lebeau)、ファーマン(Furman)ら、2000年)により記載された方法に従って調製した。
試験化合物の溶液を、重炭酸緩衝液(pH9)中10−2M濃度で調製し、PBSで希釈して、0.1〜100μMの範囲の最終濃度を得た。
酸化の前に、透析によって、LDL調整物からEDTAを取り出した。次いで、100μlの16.6μMCuSO4溶液を160μLのLDL(125μgタンパク質/ml)および20μlの試験化合物溶液に添加することによって、30℃で酸化を生じさせた。ジエン(観察対象の種)の形成に続いて、銅の存在または非存在下で化合物で処置したサンプルにおける232nmでの光学密度を測定した。232nmでの光学密度は、サーモスタット付分光光度計(Tecan Ultra 380)において10分間ごとに8時間測定した。分析は3回繰り返して実施した。化合物が、コントロールサンプルと比較して、より長い遅滞期を誘導し、酸化の速度および形成されるジエンの量を減少する場合、化合物は抗酸化活性を有するとみなした。本発明者らは、本発明化合物が少なくとも1つの上記の抗酸化特性を有すること実証するが、これは、本発明化合物が本質的な抗酸化活性を有することを示している。
酸化の前に、透析によって、LDL調整物からEDTAを取り出した。次いで、100μlの16.6μMCuSO4溶液を160μLのLDL(125μgタンパク質/ml)および20μlの試験化合物溶液に添加することによって、30℃で酸化を生じさせた。ジエン(観察対象の種)の形成に続いて、銅の存在または非存在下で化合物で処置したサンプルにおける232nmでの光学密度を測定した。232nmでの光学密度は、サーモスタット付分光光度計(Tecan Ultra 380)において10分間ごとに8時間測定した。分析は3回繰り返して実施した。化合物が、コントロールサンプルと比較して、より長い遅滞期を誘導し、酸化の速度および形成されるジエンの量を減少する場合、化合物は抗酸化活性を有するとみなした。本発明者らは、本発明化合物が少なくとも1つの上記の抗酸化特性を有すること実証するが、これは、本発明化合物が本質的な抗酸化活性を有することを示している。
典型的な結果を図1a、1b、1c、2a、2b、2c、3a、4a、4b、4c、5a、5b、5c、6a、6b、6c、7a、7b、7c、8a、8b、8cに示し、本発明に従う化合物の抗酸化特性を例示する。
実施例3:細胞培養物に対する本発明化合物の抗酸化特性の測定:
培養プロトコル:
ニューロン、神経芽細胞腫(ヒト)およびPC12細胞(ラット)は、このタイプの研究のために使用される細胞系統であった。PC12細胞はラット褐色細胞種から調製されたものであり、グリーネ(Greene)およびティシェラー(Tischler)(グリーネ(Greene)およびティシェラー、1976年)によって特徴付けられている。これらの細胞は、ニューロンの分化、シグナル伝達およびニューロン死の研究において一般に使用される。PC12細胞を、10%ウマ血清および5%ウシ胎児血清を補充した完全RPMI培地(Invitrogen)において、先に記載(ファリネリ(Farinelli)、パーク(Park)ら、1996年)の通りに増殖させた。
培養プロトコル:
ニューロン、神経芽細胞腫(ヒト)およびPC12細胞(ラット)は、このタイプの研究のために使用される細胞系統であった。PC12細胞はラット褐色細胞種から調製されたものであり、グリーネ(Greene)およびティシェラー(Tischler)(グリーネ(Greene)およびティシェラー、1976年)によって特徴付けられている。これらの細胞は、ニューロンの分化、シグナル伝達およびニューロン死の研究において一般に使用される。PC12細胞を、10%ウマ血清および5%ウシ胎児血清を補充した完全RPMI培地(Invitrogen)において、先に記載(ファリネリ(Farinelli)、パーク(Park)ら、1996年)の通りに増殖させた。
内皮および平滑筋細胞の(初代)培養物も使用した。細胞は、Promocell(Promocell GmBH、ハイデルベルグ)から入手し、供給者の指示に従って培養した。
細胞を、5〜300μMの範囲の異なる用量の化合物で、24時間、処置した。次いで、細胞を回収し、標的遺伝子の発現の増加を定量PCRによって評価した。
mRNA測定:
mRNAを、本発明化合物で処置したかまたは処置しなかった培養細胞から抽出した。抽出は、供給者による指示通りに、Absolutely RNA RT−PCRミニプレップキット(Stratagene、仏国)の試薬により行った。次いで、mRNAを分光光度計によってアッセイし、Light Cycler System(Roche、仏国)上にLight Cycler Fast Start DNA Master Sybr Green Iキット(Roche)を伴う定量RT−PCRによって、定量した。抗酸化酵素、スーパーオキシドジスムターゼ(SOD)、カタラーゼおよびグルタチオンペルオキシダーゼ(GPx)をコードする遺伝子に特異的なプライマー対をプローブとして使用した。β−アクチンおよびシクロフィリン遺伝子に特異的なプライマー対を、コントロールプローブとして使用した。
mRNAを、本発明化合物で処置したかまたは処置しなかった培養細胞から抽出した。抽出は、供給者による指示通りに、Absolutely RNA RT−PCRミニプレップキット(Stratagene、仏国)の試薬により行った。次いで、mRNAを分光光度計によってアッセイし、Light Cycler System(Roche、仏国)上にLight Cycler Fast Start DNA Master Sybr Green Iキット(Roche)を伴う定量RT−PCRによって、定量した。抗酸化酵素、スーパーオキシドジスムターゼ(SOD)、カタラーゼおよびグルタチオンペルオキシダーゼ(GPx)をコードする遺伝子に特異的なプライマー対をプローブとして使用した。β−アクチンおよびシクロフィリン遺伝子に特異的なプライマー対を、コントロールプローブとして使用した。
細胞を本発明化合物で処置する場合、定量RT−PCRによって測定される抗酸化酵素遺伝子のmRNA発現の増加を、使用した異なる細胞タイプにおいて実証した。
酸化ストレスのコントロール:
培養細胞における酸化性種の測定:
化合物の抗酸化特性もまた、蛍光タグ(その酸化に続いて、蛍光シグナルの出現が認められる)によって評価した。放射される蛍光シグナルの強度の減少は、以下の様式で化合物で処置された細胞において決定される:先に記載の通りに培養したPC12細胞(黒色96ウェルプレート、透明底、Falcon)を、無血清培地中増加用量のH2O2(0.25mM〜1mM)と共に、2および24時間、インキュベートした。インキュベーション後、培地を取り出し、細胞を、PBS中10μMジクロロジヒドロフルオレセイン二酢酸溶液(DCFDA、Molecular Probes,Eugene、米国)と共に、30分間、37℃、5%CO2雰囲気中でインキュベートした。次いで、細胞をPBSで濯いだ。酸化タグによって放射された蛍光を、蛍光計(Tecan Ultra 384)上、495nmの励起波長および535nmの発光波長で測定した。結果を酸化型コントロールに対する保護の百分率として表す。
培養細胞における酸化性種の測定:
化合物の抗酸化特性もまた、蛍光タグ(その酸化に続いて、蛍光シグナルの出現が認められる)によって評価した。放射される蛍光シグナルの強度の減少は、以下の様式で化合物で処置された細胞において決定される:先に記載の通りに培養したPC12細胞(黒色96ウェルプレート、透明底、Falcon)を、無血清培地中増加用量のH2O2(0.25mM〜1mM)と共に、2および24時間、インキュベートした。インキュベーション後、培地を取り出し、細胞を、PBS中10μMジクロロジヒドロフルオレセイン二酢酸溶液(DCFDA、Molecular Probes,Eugene、米国)と共に、30分間、37℃、5%CO2雰囲気中でインキュベートした。次いで、細胞をPBSで濯いだ。酸化タグによって放射された蛍光を、蛍光計(Tecan Ultra 384)上、495nmの励起波長および535nmの発光波長で測定した。結果を酸化型コントロールに対する保護の百分率として表す。
蛍光強度は、非処置の細胞よりも本発明化合物と共にインキュベートした細胞の方が低かった。これらの所見は、本発明化合物が、酸化ストレスに供された細胞における酸化種の産生の阻害を促進することを示す。先に記載の抗酸化特性もまた、培養細胞において抗ラジカル保護を誘導するのに有効である。
脂質過酸化の測定:
培養細胞(上記の細胞モデル)における脂質過酸化に対する化合物の保護効果を、以下の通りに決定した:異なる細胞系統および初代細胞培養物を先に記載の通りに処置し、細胞上清を処置後に取り出し、細胞を溶解し、タンパク質濃度の決定のために取り出した。脂質過酸化は以下の通りに検出した:
培養細胞(上記の細胞モデル)における脂質過酸化に対する化合物の保護効果を、以下の通りに決定した:異なる細胞系統および初代細胞培養物を先に記載の通りに処置し、細胞上清を処置後に取り出し、細胞を溶解し、タンパク質濃度の決定のために取り出した。脂質過酸化は以下の通りに検出した:
脂質過酸化は、マロンジアルデヒド(MDA)のようなアルデヒドの脂質過酸化と反応するチオバルビツール酸(TBA)を使用して測定した。処置後、細胞上清を回収し(900μl)、90μlのブチル化ヒドロキシトルエンを添加した(モルリーレ(Morliere)、モイサン(Moysan)ら、1991年)。15%トリクロロ酢酸を含有する0.25M HClにおける0.375%TBA溶液の1ミリリットルも反応媒体に添加した。混合物を80℃で15分間、加熱し、氷上で冷却し、有機相をブタノールで抽出した。有機相を、Shimazu1501分光蛍光計(Shimadzu Corporation、京都、日本)上での分光蛍光分析(λexc=515nmおよびλem=550nm)によって分析した。TBARSを、標準としてテトラ−エトキシプロパンを使用するMDA等価物として表す。結果を、タンパク質濃度について正規化した。
本発明化合物で処置した細胞において観察された脂質過酸化の減少から、先の結果が確認される。
本発明化合物は、酸化ストレスの効果を遅らせるおよび/または阻害することを可能にする本質的な抗酸化特性を有利に示す。本発明者らはまた、本発明化合物が抗酸化酵素をコードする遺伝子の発現を誘導することが可能であることを示す。本発明化合物のこれらの特定の特徴により、細胞は酸化ストレスに対してより効果的に攻撃し、従って、フリーラジカル誘導性損傷に対して保護される。
実施例4:本発明化合物によるインビトロでのPPAR活性化の評価
試験した本発明化合物は、その調製が上記の実施例に記載されているカルボン酸官能基を有する化合物である。
試験した本発明化合物は、その調製が上記の実施例に記載されているカルボン酸官能基を有する化合物である。
異脂肪血症および糖尿病の処置のために臨床において広範に使用される2つの主な製薬クラス(フィブラート系薬剤およびグリタゾン系薬剤)によって活性化されるPPARサブファミリーの核内受容体は、脂質およびグルコースホメオスタシスにおいて有用な役割を果たす。以下の実験データは、本発明化合物がPPARα、PPARγおよびPPARδをインビトロで活性化することを示す。
PPAR活性化を、酵母gal4転写因子のDNA結合ドメインおよび異なるPPARのリガンド結合ドメインからなるキメラの転写活性を測定することによって、RK13類上皮(epitheloid)またはCOS−7細胞系統において、インビトロで試験した。次いで、これらの後者の結果を、以下のプロトコルに従って、細胞系統において確認した。
RK13細胞およびCOS−7細胞についての実施例を示す。
RK13細胞およびCOS−7細胞についての実施例を示す。
培養プロトコル:
RK13細胞はECACC(Porton Down、英国)由来であり、COS−7細胞はATCC(American Type Culture Collection)由来であり、10%(V/V)ウシ胎児血清、100U/mlペニシリン(Gibco、Paisley、英国)および2mM Lグルタミン(Gibco、Paisley、英国)を補充したDMEM培地において増殖させた。培養培地を2日ごとに交換した。細胞を、37℃で、加湿された95%空気/5%CO2雰囲気中に保持した。
RK13細胞はECACC(Porton Down、英国)由来であり、COS−7細胞はATCC(American Type Culture Collection)由来であり、10%(V/V)ウシ胎児血清、100U/mlペニシリン(Gibco、Paisley、英国)および2mM Lグルタミン(Gibco、Paisley、英国)を補充したDMEM培地において増殖させた。培養培地を2日ごとに交換した。細胞を、37℃で、加湿された95%空気/5%CO2雰囲気中に保持した。
トランスフェクションのために使用されるプラスミドの説明
プラスミドpG5TkpGL3、pRL−CMV、pGal4−hPPARα、pGal4−hPPARγ、pGal4−hPPARδおよびpGal4−φについては、ラスペ(Raspe)、マドセン(Madsen)ら、(1999年)により記載されている。pGal4−mPPARα、pGal4−hPPARγおよびpGal4−hPPARδ構築物は、ヒトPPARα、PPARγおよびPPARδ核内受容体のDEFドメインに対応するPCR増幅DNAフラグメントのpGal4−φベクターにクローニングすることによって得た。
プラスミドpG5TkpGL3、pRL−CMV、pGal4−hPPARα、pGal4−hPPARγ、pGal4−hPPARδおよびpGal4−φについては、ラスペ(Raspe)、マドセン(Madsen)ら、(1999年)により記載されている。pGal4−mPPARα、pGal4−hPPARγおよびpGal4−hPPARδ構築物は、ヒトPPARα、PPARγおよびPPARδ核内受容体のDEFドメインに対応するPCR増幅DNAフラグメントのpGal4−φベクターにクローニングすることによって得た。
トランスフェクション
RK13細胞を24ウェル培養ディッシュに5×104細胞/ウェルで播種し、COS−7細胞を96ウェル培養ディッシュに5×104細胞/ウェルで播種し、レポータープラスミドpG5TkpGL3(50ng/ウェル)で2時間、トランスフェクトし、次いで、発現ベクターpGal4−φ、pGal4−mPPARα、pGal4−hPPARα、pGal4−hPPARγ、pGal4−hPPARδ(100ng/ウェル)および先に記載のプロトコル(ラスペ(Raspe)、マドセン(Madsen)ら、1999年)に従うトランスフェクション効率コントロールベクターpRL−CMV(1ng/ウェル)を、36時間、試験化合物と共にインキュベートした。実験の最後に、細胞を溶解し(Gibco、Paisley、英国)、先に記載のように供給者の指示に従って、RK13細胞についてはDual−LuciferaseTM Reporter Assay Systemキット(Promega、Madison、ウィスコンシン州、米国)で、COS−7細胞についてはSteady Glow Luciferase(Promega)で、ルシフェラーゼ活性を決定した。次いで、細胞抽出物のタンパク質含有量を、供給者により記載の通り、Bio−Rad Protein Assay(Bio−Rad、Munich、独国)により測定した。
RK13細胞を24ウェル培養ディッシュに5×104細胞/ウェルで播種し、COS−7細胞を96ウェル培養ディッシュに5×104細胞/ウェルで播種し、レポータープラスミドpG5TkpGL3(50ng/ウェル)で2時間、トランスフェクトし、次いで、発現ベクターpGal4−φ、pGal4−mPPARα、pGal4−hPPARα、pGal4−hPPARγ、pGal4−hPPARδ(100ng/ウェル)および先に記載のプロトコル(ラスペ(Raspe)、マドセン(Madsen)ら、1999年)に従うトランスフェクション効率コントロールベクターpRL−CMV(1ng/ウェル)を、36時間、試験化合物と共にインキュベートした。実験の最後に、細胞を溶解し(Gibco、Paisley、英国)、先に記載のように供給者の指示に従って、RK13細胞についてはDual−LuciferaseTM Reporter Assay Systemキット(Promega、Madison、ウィスコンシン州、米国)で、COS−7細胞についてはSteady Glow Luciferase(Promega)で、ルシフェラーゼ活性を決定した。次いで、細胞抽出物のタンパク質含有量を、供給者により記載の通り、Bio−Rad Protein Assay(Bio−Rad、Munich、独国)により測定した。
本発明者らは、本発明化合物で処置し、pGal4−hPPARαプラスミドでトランスフェクトした細胞のルシフェラーゼ活性の増加を実証する。ルシフェラーゼ活性の前記誘導は、本発明化合物がPPARαの活性化因子であることを示す。結果を図9a、10a、11a、12a、13a、14a、15a、16a、17aおよび18aに示し、本発明化合物のPPARα活性化因子特性を例示する。
本発明者らは、本発明化合物で処置し、pGal4−hPPARγプラスミドでトランスフェクトした細胞のルシフェラーゼ活性の増加を実証する。ルシフェラーゼ活性の前記誘導は、本発明化合物がPPARγの活性化因子であることを示す。結果を図9b、10b、11b、12b、14b、15bおよび18bに示し、本発明化合物のPPARγ活性化因子特性を例示する。
本発明者らは、本発明化合物で処置し、pGal4−hPPARδプラスミドでトランスフェクトした細胞のルシフェラーゼ活性の増加を実証する。ルシフェラーゼ活性の前記誘導は、本発明化合物がPPARδの活性化因子であることを示す。
結果を図11c、13b、14cおよび15cに示し、本発明化合物のPPARδ活性化因子特性を例示する。
実施例5:本発明化合物の抗炎症特性の評価
炎症反応は、多発性硬化症、アルツハイマー病およびパーキンソン病、脳虚血ならびに頭部外傷を含む多くの神経障害において観察され、炎症もまた、神経変性において重要な因子である。脳卒中では、グリア細胞の第1の反応の1つは、サイトカインおよびフリーラジカルを放出することである。サイトカインおよびフリーラジカルのこのような放出は、ニューロン死をもたらし得る脳における炎症反応を生じる(ロスウェル(Rothwell)、1997年)。
炎症反応は、多発性硬化症、アルツハイマー病およびパーキンソン病、脳虚血ならびに頭部外傷を含む多くの神経障害において観察され、炎症もまた、神経変性において重要な因子である。脳卒中では、グリア細胞の第1の反応の1つは、サイトカインおよびフリーラジカルを放出することである。サイトカインおよびフリーラジカルのこのような放出は、ニューロン死をもたらし得る脳における炎症反応を生じる(ロスウェル(Rothwell)、1997年)。
細胞系統および初代細胞を、上記のように培養した。
LPS(リポ多糖)細菌内毒素(大腸菌(Escherichia coli)0111:B4)(Sigma、仏国)を、蒸留水中で再構成し、4℃で保存した。細胞を、LPS1μg/mlで24時間、処置した。他の因子からの干渉を回避するために、培養培地を完全に交換した。
TNF−αは、ストレス(例えば、酸化ストレス)に対する炎症反応における重要な因子である。LPSの増加用量による刺激に対して応答するTNF−α分泌を評価するために、刺激された細胞の培養培地を取り出し、TNF−αをELISA−TNF−αキット(Immunotech、仏国)でアッセイした。サンプルを、標準曲線(チャン(Chang)、ハドソン(Hudson)ら、2000年)の範囲にあるように、50倍希釈した。
化合物の抗炎症特性を、以下のように特徴付けた:細胞培養培地を完全に交換し、細胞を試験化合物と共に、2時間、インキュベートし、その後、LPSを1μg/mlの最終濃度で培養培地に添加した。24時間のインキュベーション後、細胞上清を回収し、直接処置しない場合、−80℃で保存した。細胞を溶解し、供給者の指示に従って、Bio−Rad Protein Assayキット(Bio−Rad、Munich、独国)でタンパク質を定量した。
試験化合物による処置によって誘導されるTNF−α分泌における減少の測定は、g/ml/μgタンパク質およびコントロールに対する百分率として表される。これらの結果は、本発明化合物が抗炎症特性を有することを示す。
実施例6:インビボでの脂質代謝に対する効果の評価
試験した本発明化合物は、その調製が上記の実施例に記載されている化合物である。
試験した本発明化合物は、その調製が上記の実施例に記載されている化合物である。
動脈硬化(先進国における罹患率および死亡率の原因の上位の1つ)の発達に関与する異脂肪血症の処置のためのヒト医学において広範に使用されているフィブラート系薬剤は、PPARα核内受容体の強力な活性化因子である。後者は、輸送(Apo AI、ApoAIIおよびApoC−IIIのようなアポリポタンパク質、FATのような膜輸送体)または脂質の異化(ACO、CPT−IもしくはCPT−II)に関与する遺伝子の発現を調節する。従って、げっ歯類およびヒトでは、PPARα活性化因子による処置は、血漿コレステロールおよびトリグリセリドレベルの減少をもたらす。
循環トリグリセリドおよびコレステロールレベルの減少を実証し、また、循環器系疾患を防止するおよび/または処置するための本発明化合物の興味を強調するために、以下のプロトコルを設計した。
動物の処置
Apo E2/E2トランスジェニックマウスを、12時間の明/暗サイクル、20±3℃の一定温度で収容した。1週間の順応期間後、マウスを秤量し、体重の分布が均質となるように選択された6匹の動物からなる群に分けた。試験化合物をカルボキシメチルセルロースに懸濁し、胃洗浄により、示された用量を、7日間、1日1回投与した。動物は自由に食物および水を摂取した。実験の終了時に、動物を秤量し、麻酔下で屠殺した。血液をEDTA上に回収した。血漿を、3000rpmで20分間の遠心分離により単離した。肝臓サンプルを取り出し、後の分析のために液体窒素において凍結保存した。
Apo E2/E2トランスジェニックマウスを、12時間の明/暗サイクル、20±3℃の一定温度で収容した。1週間の順応期間後、マウスを秤量し、体重の分布が均質となるように選択された6匹の動物からなる群に分けた。試験化合物をカルボキシメチルセルロースに懸濁し、胃洗浄により、示された用量を、7日間、1日1回投与した。動物は自由に食物および水を摂取した。実験の終了時に、動物を秤量し、麻酔下で屠殺した。血液をEDTA上に回収した。血漿を、3000rpmで20分間の遠心分離により単離した。肝臓サンプルを取り出し、後の分析のために液体窒素において凍結保存した。
血清脂質およびアポリポタンパク質の決定
血漿中脂質濃度(総コレステロールおよび遊離コレステロール、トリグリセリドおよびリン脂質)を、供給者の指示に従い、比色アッセイ(Boehringer、Mannheim、独国)によって決定した。アポリポタンパク質AI、AIIおよびCIIIの血漿濃度を、先に記載(ラスペ(Raspe)ら、1999年、アセットG(Asset G)ら、Lipids、1999年)の通りに決定した。
血漿中脂質濃度(総コレステロールおよび遊離コレステロール、トリグリセリドおよびリン脂質)を、供給者の指示に従い、比色アッセイ(Boehringer、Mannheim、独国)によって決定した。アポリポタンパク質AI、AIIおよびCIIIの血漿濃度を、先に記載(ラスペ(Raspe)ら、1999年、アセットG(Asset G)ら、Lipids、1999年)の通りに決定した。
図19a、19b、19cおよび19dに結果の一例を示すが、ここで、トリグリセリドおよびコレステロール代謝に対する化合物2の活性を例示する。
図20a、20b、20cおよび20dは、トリグリセリドおよびコレステロール代謝に対する化合物13、33および39の活性を例示する。
RNA分析
先に記載(ラスペ(Raspe)ら、1999年)のように、全RNAを、チオシアン酸グアニジン/フェノール酸/クロロホルムの混合物での抽出により、肝臓断片から単離した。メッセンジャーRNAを、Light Cycler System (Hoffman−La Roche、Basel、瑞国)上のLight Cycler Fast Start DNA Master Sybr Green Iキット(Hoffman−La Roche、Basel、瑞国)を伴う半定量または定量RT−PCRによって、定量した。ACO、Apo CIIIおよびApoII遺伝子に特異的なプライマー対をプローブとして使用した。36B4、β−アクチンおよびシクロフィリン遺伝子に特異的なプライマー対を、コントロールプローブとして使用した。あるいは、先に記載のプロトコル(ラスペ(Raspe)ら、1999年)に従って、ノーザンブロットまたはドットブロットにより、全RNAを分析した。
先に記載(ラスペ(Raspe)ら、1999年)のように、全RNAを、チオシアン酸グアニジン/フェノール酸/クロロホルムの混合物での抽出により、肝臓断片から単離した。メッセンジャーRNAを、Light Cycler System (Hoffman−La Roche、Basel、瑞国)上のLight Cycler Fast Start DNA Master Sybr Green Iキット(Hoffman−La Roche、Basel、瑞国)を伴う半定量または定量RT−PCRによって、定量した。ACO、Apo CIIIおよびApoII遺伝子に特異的なプライマー対をプローブとして使用した。36B4、β−アクチンおよびシクロフィリン遺伝子に特異的なプライマー対を、コントロールプローブとして使用した。あるいは、先に記載のプロトコル(ラスペ(Raspe)ら、1999年)に従って、ノーザンブロットまたはドットブロットにより、全RNAを分析した。
実施例7:脳虚血−再潅流モデルにおける本発明化合物の神経保護効果の評価
予防モデル:
1.動物の処置
1.1 動物および化合物の投与
C57black/6マウス(野生型)をこの実験のために使用した。
予防モデル:
1.動物の処置
1.1 動物および化合物の投与
C57black/6マウス(野生型)をこの実験のために使用した。
動物を、12時間の明−暗サイクル、20℃±3℃の温度で維持した。水および食物は自由に摂取させた。食物摂取および増加重量を記録した。
中大脳動脈における虚血誘導前の14日間、強制経口により、本発明化合物またはビヒクル(0.5%カルボキシセルロース)を、動物に投与した。
1.2中大脳動脈の内管閉塞による虚血誘導−再潅流:
300mg/kg抱水クロラールの腹腔内注入により、動物を麻酔した。直腸プローブを挿入し、体温を37℃±0.5℃に維持した。血圧を、実験全体を通してモニターした。
300mg/kg抱水クロラールの腹腔内注入により、動物を麻酔した。直腸プローブを挿入し、体温を37℃±0.5℃に維持した。血圧を、実験全体を通してモニターした。
手術用顕微鏡下、頚部の正中切開によって右頚動脈を暴露した。翼口蓋動脈をその器官で結紮し、ナイロンモノフィラメントを挿入するために、外頚動脈において動脈開切部を形成し、該ナイロンフィラメントを緩徐に総頚動脈に進行させ、次いで、中大脳動脈の起点を閉塞するためにに内頚動脈に到達させた。フィラメントを1時間後に引き出して、再潅流を可能にした。
2.脳梗塞部容積の測定:
再潅流24時間後、化合物で予め処置したまたは処置しなかった動物をペントバルビタールの過剰投与で安楽死させた。
再潅流24時間後、化合物で予め処置したまたは処置しなかった動物をペントバルビタールの過剰投与で安楽死させた。
脳を迅速に凍結し、薄切りした。切片をクレシルバイオレットで染色した。脳切片の非染色域を、梗塞によって損傷を受けたものとみなした。脳浮腫について補正するために、面積を測定し、梗塞および2つの半球の容積を次の式:(修正された梗塞の容積=梗塞の容積−(右半球の容積−左半球の容積))によって算出した。
処置した動物由来の脳切片の分析から、非処置動物と比較して、梗塞容積の著しい減少が示された。本発明化合物を虚血前に動物に投与する場合(予防効果)、それらは神経保護を誘導することが可能である。
3/抗酸化活性の測定:
マウス脳を凍結し、粉砕し、粉体状にまで細かくし、次いで、食塩溶液に再懸濁した。次いで、異なる酵素活性を、以下の著者らに記載されるように、測定した:スーパーオキシドジスムターゼ(フローヘ(Flohe)およびオティング(Otting)1984年);グルタチオンペルオキシダーゼ(パグリア(Paglia)およびバレンタイン(Valentine)1967年);グルタチオンリダクターゼ(スポーナー(Spooner)、デリデス(Delides)ら、1981年);グルタチオン−S−トランスフェラーゼ(ハビック(Habig)およびジャコビー(Jakoby)1981年);カタラーゼ(アエビ(Aebi)1984年)。
マウス脳を凍結し、粉砕し、粉体状にまで細かくし、次いで、食塩溶液に再懸濁した。次いで、異なる酵素活性を、以下の著者らに記載されるように、測定した:スーパーオキシドジスムターゼ(フローヘ(Flohe)およびオティング(Otting)1984年);グルタチオンペルオキシダーゼ(パグリア(Paglia)およびバレンタイン(Valentine)1967年);グルタチオンリダクターゼ(スポーナー(Spooner)、デリデス(Delides)ら、1981年);グルタチオン−S−トランスフェラーゼ(ハビック(Habig)およびジャコビー(Jakoby)1981年);カタラーゼ(アエビ(Aebi)1984年)。
前記異なる酵素活性は、本発明化合物で処置した動物由来の脳調製物において増加した。
治療または急性期処置モデル
1/中大脳動脈の内管閉塞による虚血誘導/再潅流:
先に記載の動物のような動物をこの実験に使用した。300mg/kg抱水クロラールの腹腔内注入により、動物を麻酔した。直腸プローブを挿入し、体温を37℃±0.5℃に維持した。血圧を、実験全体を通してモニターした。
1/中大脳動脈の内管閉塞による虚血誘導/再潅流:
先に記載の動物のような動物をこの実験に使用した。300mg/kg抱水クロラールの腹腔内注入により、動物を麻酔した。直腸プローブを挿入し、体温を37℃±0.5℃に維持した。血圧を、実験全体を通してモニターした。
手術用顕微鏡下、頸部の正中切開によって右頚動脈を暴露した。翼口蓋動脈をその器官で結紮し、ナイロンモノフィラメントを挿入するために、外頚動脈において動脈開切部を形成し、該ナイロンフィラメントを緩徐に総頚動脈に進行させ、次いで、中大脳動脈の起点を閉塞するためにに内頚動脈に到達させた。フィラメントを1時間後に引き出して、再潅流を可能にした。
2.動物の処置:
最初に虚血−再潅流に供した動物を、経口経路(強制経口)により、24または72時間、1日2回、本発明化合物で処置した。
最初に虚血−再潅流に供した動物を、経口経路(強制経口)により、24または72時間、1日2回、本発明化合物で処置した。
3.脳梗塞部容積の測定
再潅流24または72時間後、化合物で予め処置したまたは処置しなかった動物を、ペントバルビタールの過剰投与で安楽死させた。
再潅流24または72時間後、化合物で予め処置したまたは処置しなかった動物を、ペントバルビタールの過剰投与で安楽死させた。
脳を迅速に凍結し、薄切りした。切片をクレシルバイオレットで染色した。脳切片の非染色域を、梗塞によって損傷を受けたものとみなした。脳浮腫について補正するために、面積を測定し、梗塞および2つの半球の容積を次の式:(修正された梗塞の容積=梗塞の容積−(右半球の容積−左半球の容積))によって算出した。
治療処置(急性期の処置)の場合、本発明化合物で処置した動物は、非処置動物よりも少ない脳病巣を有した。事実、虚血−再潅流後に本発明化合物を1回もしくはそれ以上投与した場合、梗塞部容積はより小さかった。
実施例8:動脈硬化の動物モデルにおける本発明化合物の保護効果の評価
それらのPPAR活性化因子および抗酸化特性により、本発明化合物は、アテローム斑の進行に対して有益な効果を有する。
それらのPPAR活性化因子および抗酸化特性により、本発明化合物は、アテローム斑の進行に対して有益な効果を有する。
1.動物の処置
約2箇月齢の雌性ApoE2/E2トランスジェニックマウスを、順応期間および実験全体を通して、12時間の明−暗サイクル、20℃±3℃の一定温度で維持した。
約2箇月齢の雌性ApoE2/E2トランスジェニックマウスを、順応期間および実験全体を通して、12時間の明−暗サイクル、20℃±3℃の一定温度で維持した。
1週間の順応期間後、マウスを秤量し、体重の分布が均質となるように選択された8匹の動物からなる群に分けた。
動物は自由に食物および水を摂取した。それらは、21%脂肪および0.15%コレステロールを含有する西欧スタイルの食餌を、処置前に2週間、摂取した。
この期間の後、試験化合物を示された用量で飼料に添加した。処置期間は6週間であった。
動物を秤量し、麻酔下、頚椎脱臼により屠殺した。
・心臓をインサイチュで潅流し、次いで、組織学的研究のために調製し、針を右心室に導入して、腹部大動脈を切開した。
・実験開始前、次いで、1週間に1回、実験終了時に血液サンプルを採取した。血液をEDTA上に回収した。血漿を、3000rpm、20分間の遠心分離により調製した(血漿コレステロールおよびトリグリセリドの決定)。
2/組織学的研究のためのスライスの調製
クレブスリンゲル溶液を10分間添加した。組織を、1晩、10mM PBS中4%PAFで、−4℃で固定化した。次いで、サンプルを100mM PBSで洗浄した。心臓を30%スクロース−Trisに1日間配置し、次いで、減圧下、30分間、OCT(Tissue Teck)に、次いで、OCTを含有するモールドに浸漬し、イソペンタンに浸漬し、液体窒素において冷却した。サンプルを−80℃で保存した。
クレブスリンゲル溶液を10分間添加した。組織を、1晩、10mM PBS中4%PAFで、−4℃で固定化した。次いで、サンプルを100mM PBSで洗浄した。心臓を30%スクロース−Trisに1日間配置し、次いで、減圧下、30分間、OCT(Tissue Teck)に、次いで、OCTを含有するモールドに浸漬し、イソペンタンに浸漬し、液体窒素において冷却した。サンプルを−80℃で保存した。
10μm厚の凍結切片を、大動脈弓から、弁が認められなくなるまで切断し、ゼラチン被覆スライド上に回収した。
3.組織学的分析
中膜と脈管内膜とを識別するために、スライドをレッドオイルおよびヘマトキシリンで染色した。異なる形態パラメータをOlympus顕微鏡および画像解析システムに具備されたカラーカメラの援助で決定した。損傷領域を、同じコンピュータシステムに具備された図示パネルで手動で定量した。
中膜と脈管内膜とを識別するために、スライドをレッドオイルおよびヘマトキシリンで染色した。異なる形態パラメータをOlympus顕微鏡および画像解析システムに具備されたカラーカメラの援助で決定した。損傷領域を、同じコンピュータシステムに具備された図示パネルで手動で定量した。
アテローム病巣の全体の面積を、μM2で表し、コントロールと比較した。試験した本発明化合物は、病巣面積の顕著な減少を誘導し、病巣進行の低下を反映した。
実施例9:樹状細胞分化および成熟に対するインビトロでの本発明化合物の効果
化合物39を、(樹状細胞表現型の獲得をモニターすることによって)単球由来樹状細胞の分化に対するその効果について試験した。
化合物39を、(樹状細胞表現型の獲得をモニターすることによって)単球由来樹状細胞の分化に対するその効果について試験した。
これらの実験のために、志願供与者由来の血液サンプル(Etablissement Francais du Sang)および単球を、抗CD14コンジュゲート磁気ビーズ(Miltenyi Biotec)を使用する標準的なプロトコルによって、単離した。次いで、この様式で単離される単球を、サイトカインGM−CSFおよびIL−4(各サイトカインについて20ng/ml)の混合物を含有する培養培地における6日間のインキュベーションによって、誘導して、分化させた。
化合物39をt=0で添加すると、樹状細胞表現型の獲得に続いて、細胞表面マーカーCD1aの発現が認められた。従って、本発明者らは、細胞表面でのCD1aの発現をほぼ全体的に阻害することによって、樹状細胞への分化を著しく干渉することを示す(図21)。共刺激分子CD80の発現も若干の程度減少した一方、CD86発現は僅かに増加した(データ示さず)。類似の結果が、本発明化合物13および31で得られた。これらの所見は、本発明化合物が樹状細胞の分化を干渉し、かつ異型の表現型の獲得に対して樹状細胞を刺激することを示唆する。
次いで、前記化合物の効果を、LPS(リポ多糖)によって誘導される樹状細胞成熟について研究した。これらの実験について、分化のD6で得られた単球由来樹状細胞を本発明化合物で4時間、プレ処置し、次いで、LPSで16時間、刺激した。この様式では、化合物は、CCR7受容体およびそのELCリガンドのLPS誘導性転写を顕著に干渉することが示された(図22)。図22はまた、炎症性サイトカインTNF−αのLPS誘導性分泌が顕著に減少したことを示す。
ELCおよびCCR7(樹状細胞運動性における重要な遺伝子)の発現の減少は、本発明化合物が樹状細胞の二次リンパ器官への移動を阻害し、従って、前記細胞によって誘発される免疫応答の開始を干渉することを示唆する。
従って、本発明者らは、化合物31で処置した単球由来樹状細胞は、混合リンパ球反応(MLR)によりナイーブ(naive)なCD4+ T細胞の増殖を誘導する能力がより低かったことを実証する(図23)。この実験のために、増加量の成熟樹状細胞(化合物で処置したまたは処置していない)を、別のドナー由来の固定量のナイーブ(naive)なCD4+ T細胞と共にインキュベートした。5日間のインキュベーション後、BrdU(ブロモデオキシウリジン)を24時間添加し、T細胞におけるその組み入れを、化学発光タグに結合した抗BrdU抗体を伴うELISAによって決定した。
実施例10:オボアルブミン(OVA)誘導性アレルギー性喘息のマウスモデルにおけるインビボでの本発明化合物の効果
次いで、オボアルブミン(OVA)誘導性アレルギー性喘息のマウスモデルにおいて、本発明化合物の効果をインビボで分析した。
次いで、オボアルブミン(OVA)誘導性アレルギー性喘息のマウスモデルにおいて、本発明化合物の効果をインビボで分析した。
これらの実験のために、マウスを、実験のD0およびD10に、水酸化アルミニウムの存在下で、オボアルブミンの腹腔内注入によって、感作した。D18からD22まで、強制経口により、連日、マウスに本発明化合物(50mg/kg〜200mg/kg)を与えた。エアゾル形態でのオボアルブミンの3連続投与を、D20、D21およびD22に与えた。化合物は、各投与の約1時間前に投与した。マウスをD24に屠殺し、気管支肺胞洗浄液(BAL)を回収して、細胞性(マクロファージ、好酸球、リンパ球、好中球)を決定し、サイトカインIL−5、IL−13、IL−4を測定した。
結果は、本発明化合物が樹状細胞の分化および成熟を干渉し、前記細胞の二次リンパ器官への移動を阻害したことを示す。さらに、本発明化合物は、ナイーブ(naive)なCD4+ T細胞の増殖を誘導する能力がより低かった。従って、本発明化合物は、免疫応答の開始を干渉し、従って、喘息の処置のための有利なツールを提示する。
参考文献
アエビ,H.(Aebi,H.)(1984年)、「Catalase in vitro.」Methods Enzymol105:121−6頁
アンゲリV(Angeli V)、ハマンドH(Hammad H)、スタエルスB(Staels B)、カプロンM(Capron M)、ランブレヒトBN(Lambrecht BN)、トロテインF(Trottein F)、(2003年)「Peroxisome proliferator−activated receptor gamma inhibits the migration of dendritic cells:consequences for the immune response」J Immunol.170(10):5295−301頁
アセットG(Asset G)、スタエルスB(Staels B)、ウォルフRL(Wolff RL)、バウゲE(Bauge E)、マジュZ(Madj Z)、フルチャートJC(Fruchart JC)、ダロンゲヴィレJ(Dallongeville J)、(1999年)、「Effects of Pinus pinaster and Pinus koraiensis seed oil supplementation on lipoprotein metabolism in the rat.」Lipids34(1):39−44頁
チャン,RC(Chang,RC)、P.ハドソン(P.Hudson)ら(2000年)、「Influence of neurons on lipopolysaccharide−stimulated production of nitric oxide and tumor necrosis factor−alpha by cultured glia.」Brain Res853(2):236−44頁
デスベルゲン,B.(Desvergne,B.)およびW.ホーリ(W.Wahli)(1999年)、「Peroxisome proliferator−activated receptors:nuclear control of metabolism.」Endocr Rev20(5):649−88頁
ダーナグル,U.(Dirnagl,U.)、C.イアデコラ(C.Iadecola)ら(1999年)、「Pathobiology of ischaemic stroke:an integrated view.」Trends Neurosci22(9):391−7頁
ファリネリ,SE(Farinelli,SE)、DSパーク(DS Park)ら(1996年)、「Nitric oxide delays the death of trophic factor−deprived PC12 cells and sympathetic neurons by a cGMP−mediated mechanism.」J Neurosci16(7):2325−34頁
フローヘ,L.(Flohe,L.)およびF.オティング(F.Otting)(1984年)、「Superoxide dismutase assays.」Methods Enzymol105:93−104頁
ギルグン−シェルキ,Y(Gilgun−Sherki,Y)、E.メラメド(E.Melamed)ら(2001年)、「Oxidative stress induced−neurodegenerative diseases:the need for antioxidants that penetrate the blood brain barrier.」Neuropharmacology40(8):959−75頁
ゴセット,P(Gosset,P)、チャーボニアーAS(Charbonnier AS)、デレリベP(Delerive P)、フォンタイネJ(Fontaine J)、スタエルスB(Staels B)、ペステルJ(Pestel J)、トンネルAB(Tonnel AB)、トロテインF(Trottein F)、(2001年)、「Peroxisome proliferator−activated receptor gamma activators affect the maturation of human monocyte−derived dendritic cells」Eur J Immunol10:2857−65頁
グリーネ,LA(Greene,LA)およびASティシェラー(AS Tischler)(1976年)、「Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor.」Proc Natl Acad Sci USA73(7):2424−8頁
グエレ−ミロ,M(Guerre−Millo,M)、P.ゲルボイス(P.Gervois)ら(2000年)、「Peroxisome proliferator−activated receptor alpha activators improve insulin sensitivity and reduce adiposity.」J Biol Chem275(22):16638−42頁
ハビック,WH(Habig,WH)およびWBジャコビー(WB Jakoby)(1981年)、「Assays for differentiation of glutathione S−transferases.」Methods Enzymol77:398−405頁
ハートン,D(Hourton,D)、P.デレリベ(P.Delerive)ら(2001年)、「Oxidized low−density lipoprotein and peroxisome−proliferator−activated receptor alpha down−regulate platelet−activating−factor receptor expression in human macrophages.」Biochem J354(Pt1):225−32頁
International Atherosclerosis Society「Harmonized Clinical Guidelines on Prevention of Atherosclerotic Vascular Disease」2003年
ジャーゲンス,G,(Jurgens,G)、HF.ホッフ(HF.Hoff)ら(1987年)、「Modification of human serum low density lipoprotein by oxidation−−characterization and pathophysiological implications.」Chem Phys Lipids45(2−4):315−36頁
コムベス,LG(Komuves,LG)、K.ハンレイ(K.Hanley)ら(2000年)、「Stimulation of PPARalpha promotes epidermal keratinocyte differentiation in vivo.」J Invest Dermatol115(3):353−60頁
レベアウ,J(Lebeau,J)、C.ファーマン(C.Furman)ら(2000年)、「Antioxidant properties of di−tert−butylhydroxylated flavonoids.」Free Radic Biol Med29(9):900−12頁
メイツ,JM(Mates,JM)、C.ペレズ−ゴメス(C.Perez−Gomez)ら(1999年)、「Antioxidant enzymes and human diseases.」Clin Biochem32(8):595−603頁
モルリーレ,P(Morliere,P)、A.モイサン(A.Moysan)ら(1991年)、「UVA−induced lipid peroxidation in cultured human fibroblasts.」Biochim Biophys Acta1084(3):261−8頁
ネンシオニA(Nencioni A)、グルネバッハF(Grunebach F)、ゾビーウラスキーA(Zobywlaski A)、デンズリンガーC(Denzlinger C)、ブルガーW(Brugger W)、ブロサルトP(Brossart P)、(2002年)「Dendritic cell immunogenicity is regulated by peroxisome proliferator−activated receptor gamma」J Immunol169(3):1228−35頁
パグリア,DE(Paglia,DE)およびWNバレンタイン(WN Valentine)(1967年)、「Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase.」J Lab Clin Med70(1):158−69頁
ラムVJ.(Ram VJ.)(2003年)、「Therapeutic role of peroxisome proliferator−activated receptors in obesity, diabetes and inflammation.」Prog Drug Res60:93−132頁
ラスペ,E(Raspe,E)、L.マドセン(L.Madsen)ら(1999年)、「Modulation of rat liver apolipoprotein gene expression and serum lipid levels by tetradecylthioacetic acid(TTA)via PPARalpha activation.」J Lipid Res40(11):2099−110頁
ロスウェル,NJ.(Rothwell,NJ.)(1997年)、「Cytokines and acute neurodegeneration.」Mol Psychiatry2(2):120−1頁
シュピーゲルマンBM.(Spiegelman BM.)(1998年)「PPARgamma in monocytes: less pain, any gain?」Cell,93(2):153−5頁
シュピーゲルマンBM.(Spiegelman BM.)(1998年)「PPAR−gamma: adipogenic regulator and thiazolidinedione receptor.」Diabetes47(4):507−14頁レビュー
スポーナー,RJ(Spooner,RJ)、A.デリデス(A.Delides)ら(1981年)、「Heat stability and kinetic properties of human serum glutathione reductase activity in various disease states.」Biochem Med26(2):239−48頁
スタエルス,B.(Staels,B.)およびJ.アウウェルクス(J.Auwerx)(1998年)、「Regulation of apo A−I gene expression by fibrates.」Atherosclerosis137補遺:S19−23頁
アエビ,H.(Aebi,H.)(1984年)、「Catalase in vitro.」Methods Enzymol105:121−6頁
アンゲリV(Angeli V)、ハマンドH(Hammad H)、スタエルスB(Staels B)、カプロンM(Capron M)、ランブレヒトBN(Lambrecht BN)、トロテインF(Trottein F)、(2003年)「Peroxisome proliferator−activated receptor gamma inhibits the migration of dendritic cells:consequences for the immune response」J Immunol.170(10):5295−301頁
アセットG(Asset G)、スタエルスB(Staels B)、ウォルフRL(Wolff RL)、バウゲE(Bauge E)、マジュZ(Madj Z)、フルチャートJC(Fruchart JC)、ダロンゲヴィレJ(Dallongeville J)、(1999年)、「Effects of Pinus pinaster and Pinus koraiensis seed oil supplementation on lipoprotein metabolism in the rat.」Lipids34(1):39−44頁
チャン,RC(Chang,RC)、P.ハドソン(P.Hudson)ら(2000年)、「Influence of neurons on lipopolysaccharide−stimulated production of nitric oxide and tumor necrosis factor−alpha by cultured glia.」Brain Res853(2):236−44頁
デスベルゲン,B.(Desvergne,B.)およびW.ホーリ(W.Wahli)(1999年)、「Peroxisome proliferator−activated receptors:nuclear control of metabolism.」Endocr Rev20(5):649−88頁
ダーナグル,U.(Dirnagl,U.)、C.イアデコラ(C.Iadecola)ら(1999年)、「Pathobiology of ischaemic stroke:an integrated view.」Trends Neurosci22(9):391−7頁
ファリネリ,SE(Farinelli,SE)、DSパーク(DS Park)ら(1996年)、「Nitric oxide delays the death of trophic factor−deprived PC12 cells and sympathetic neurons by a cGMP−mediated mechanism.」J Neurosci16(7):2325−34頁
フローヘ,L.(Flohe,L.)およびF.オティング(F.Otting)(1984年)、「Superoxide dismutase assays.」Methods Enzymol105:93−104頁
ギルグン−シェルキ,Y(Gilgun−Sherki,Y)、E.メラメド(E.Melamed)ら(2001年)、「Oxidative stress induced−neurodegenerative diseases:the need for antioxidants that penetrate the blood brain barrier.」Neuropharmacology40(8):959−75頁
ゴセット,P(Gosset,P)、チャーボニアーAS(Charbonnier AS)、デレリベP(Delerive P)、フォンタイネJ(Fontaine J)、スタエルスB(Staels B)、ペステルJ(Pestel J)、トンネルAB(Tonnel AB)、トロテインF(Trottein F)、(2001年)、「Peroxisome proliferator−activated receptor gamma activators affect the maturation of human monocyte−derived dendritic cells」Eur J Immunol10:2857−65頁
グリーネ,LA(Greene,LA)およびASティシェラー(AS Tischler)(1976年)、「Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor.」Proc Natl Acad Sci USA73(7):2424−8頁
グエレ−ミロ,M(Guerre−Millo,M)、P.ゲルボイス(P.Gervois)ら(2000年)、「Peroxisome proliferator−activated receptor alpha activators improve insulin sensitivity and reduce adiposity.」J Biol Chem275(22):16638−42頁
ハビック,WH(Habig,WH)およびWBジャコビー(WB Jakoby)(1981年)、「Assays for differentiation of glutathione S−transferases.」Methods Enzymol77:398−405頁
ハートン,D(Hourton,D)、P.デレリベ(P.Delerive)ら(2001年)、「Oxidized low−density lipoprotein and peroxisome−proliferator−activated receptor alpha down−regulate platelet−activating−factor receptor expression in human macrophages.」Biochem J354(Pt1):225−32頁
International Atherosclerosis Society「Harmonized Clinical Guidelines on Prevention of Atherosclerotic Vascular Disease」2003年
ジャーゲンス,G,(Jurgens,G)、HF.ホッフ(HF.Hoff)ら(1987年)、「Modification of human serum low density lipoprotein by oxidation−−characterization and pathophysiological implications.」Chem Phys Lipids45(2−4):315−36頁
コムベス,LG(Komuves,LG)、K.ハンレイ(K.Hanley)ら(2000年)、「Stimulation of PPARalpha promotes epidermal keratinocyte differentiation in vivo.」J Invest Dermatol115(3):353−60頁
レベアウ,J(Lebeau,J)、C.ファーマン(C.Furman)ら(2000年)、「Antioxidant properties of di−tert−butylhydroxylated flavonoids.」Free Radic Biol Med29(9):900−12頁
メイツ,JM(Mates,JM)、C.ペレズ−ゴメス(C.Perez−Gomez)ら(1999年)、「Antioxidant enzymes and human diseases.」Clin Biochem32(8):595−603頁
モルリーレ,P(Morliere,P)、A.モイサン(A.Moysan)ら(1991年)、「UVA−induced lipid peroxidation in cultured human fibroblasts.」Biochim Biophys Acta1084(3):261−8頁
ネンシオニA(Nencioni A)、グルネバッハF(Grunebach F)、ゾビーウラスキーA(Zobywlaski A)、デンズリンガーC(Denzlinger C)、ブルガーW(Brugger W)、ブロサルトP(Brossart P)、(2002年)「Dendritic cell immunogenicity is regulated by peroxisome proliferator−activated receptor gamma」J Immunol169(3):1228−35頁
パグリア,DE(Paglia,DE)およびWNバレンタイン(WN Valentine)(1967年)、「Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase.」J Lab Clin Med70(1):158−69頁
ラムVJ.(Ram VJ.)(2003年)、「Therapeutic role of peroxisome proliferator−activated receptors in obesity, diabetes and inflammation.」Prog Drug Res60:93−132頁
ラスペ,E(Raspe,E)、L.マドセン(L.Madsen)ら(1999年)、「Modulation of rat liver apolipoprotein gene expression and serum lipid levels by tetradecylthioacetic acid(TTA)via PPARalpha activation.」J Lipid Res40(11):2099−110頁
ロスウェル,NJ.(Rothwell,NJ.)(1997年)、「Cytokines and acute neurodegeneration.」Mol Psychiatry2(2):120−1頁
シュピーゲルマンBM.(Spiegelman BM.)(1998年)「PPARgamma in monocytes: less pain, any gain?」Cell,93(2):153−5頁
シュピーゲルマンBM.(Spiegelman BM.)(1998年)「PPAR−gamma: adipogenic regulator and thiazolidinedione receptor.」Diabetes47(4):507−14頁レビュー
スポーナー,RJ(Spooner,RJ)、A.デリデス(A.Delides)ら(1981年)、「Heat stability and kinetic properties of human serum glutathione reductase activity in various disease states.」Biochem Med26(2):239−48頁
スタエルス,B.(Staels,B.)およびJ.アウウェルクス(J.Auwerx)(1998年)、「Regulation of apo A−I gene expression by fibrates.」Atherosclerosis137補遺:S19−23頁
Claims (18)
- 以下の一般式(I)によって表される置換1,3−ジフェニルプロプ−2−エン−1−オンから誘導される化合物:
X7は次の式:G7−R7(式中、G7は酸素またはイオウ原子であり、R7はグループ1由来の置換基もしくはグループ2由来の置換基によって置換されるアルキル鎖であり、場合により、R7はアリール基によっても置換され得、
グループ1由来の置換基は、式:−COORaを有するカルボキシ基、式:−CONRbRcを有するカルバモイル基またはテトラゾリル基よりなる群において選択され、
グループ2由来の置換基は、スルホン酸(−SO3H)および式:−SO2NRbRcを有するスルホンアミド基よりなる群において選択され、
ここで、Ra、RbおよびRcは同じであるかあるいは異なり、水素原子または置換されているかもしくは置換されていないアルキル基を表す)に対応する基を表し、
Xi基(ここで、i=1、2、3、4もしくは5)は同じであるかもしくは異なり、ハロゲン原子またはチオニトロソ基を表すかあるいはそれぞれ式(Gi−Ri)n−G’i−R’i(式中:
・nは値0または1を有し得、
・GiおよびG’iは同じであるかもしくは異なり、単結合、酸素原子またはイオウ原子を表し、
・RiおよびR’iは同じであるかもしくは異なり、アルキル、アルケニル、アリールまたは複素環基を表し、
・R’iはまた水素原子を表し得る)に対応し、
Xi基(ここで、i=6もしくはi=8)は同じであるかもしくは異なり、ハロゲン原子を表すかまたは式G’i−R’i(G’iおよびR’iは上記のように規定される)に対応し、X6およびX8は同時に水素原子を表さず、
Xi(ここで、i=1、2、3、4、5、6もしくは8)は1,3−ジフェニルプロプ−2−エン−1−オンの芳香環に直接結合する複素環を表さず、
但し、式中、同時に:
・基X1、X2、X3、X4もしくはX5のうち1つはヒドロキシル基であり、
・G7は酸素原子であり、
・そして基X6もしくはX8のうち1つは水素原子あるいはハロゲンあるいはヒドロキシルまたはアルキルオキシ基である、
式(I)によって表される化合物は例外であり、
但し、式中、同時に:
・X1、X2およびX4基は同時に水素原子を表し、
・X6およびX8基はG’iR’iを表し、
・X5基はチオニトロソ基またはG’iR’I基を表し、
・X3基はハロゲンまたはG’iR’i基を表し、
式中、G’iは酸素原子、イオウ原子または単結合を表し、R’iは飽和、直鎖、分岐または環式アルキル基(ハロゲン化されているかもしくはハロゲン化されていない)あるいは水素原子を表す、
式(I)によって表される化合物は例外である、
化合物。 - X1およびX5は水素原子であることを特徴とする、請求項1に記載の化合物。
- X2およびX4はアルキル基であることを特徴とする請求項1または2に記載の化合物。
- X1、X3およびX4はアルキル基であることを特徴とする、請求項1に記載の化合物。
- X1、X2、X4およびX5は水素原子であることを特徴とする、請求項1に記載の化合物。
- X6およびX8はアルキル基であることを特徴とする、請求項1〜5のいずれか1項に記載の化合物。
- X1およびX5は水素原子であることを特徴とする、請求項1〜6のいずれか1項に記載の化合物。
- X2およびX4はアルキル基であることを特徴とする、請求項1〜7のいずれか1項に記載の化合物。
- X1、X3、X4、X6およびX8はアルキル基であることを特徴とする、請求項1に記載の化合物。
- X6およびX8はアルキル基であり、X1、X2、X4およびX5は水素原子であることを特徴とする、請求項1に記載の化合物。
- X3はハロゲン原子またはチオニトロソ基を表すかあるいは請求項1において規定されるような式(Gi−Ri)n−G’i−R’i(式中、G’iは酸素原子もしくはイオウ原子を表す)に対応することを特徴とする、請求項1〜10のいずれか1項に記載の化合物。
- GiまたはG’iのうちの少なくとも1つはイオウ原子を表し、ここで、iは値1、2、3、4、5、6、7もしくは8であることを特徴とする、請求項1〜11のいずれか1項に記載の化合物。
- 1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メルカプト−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルエチルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,5−ジヒドロキシ−3,4,6−トリメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,5−ジメトキシ−3,4,6−トリメチルフェニル)−3−(4−カルボキシジメチルメトキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,5−ジヒドロキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,5−ジメトキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−フェニルエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン;
1−(4−ヒドロキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン(ene)−1−オン;
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン;
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジブロモフェニル)プロプ−2−エン(ene)−1−オン;
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−プロピルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ヘキシルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルチオエチルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,4,5−トリメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,4,5−トリメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−シクロヘキシルチオエチルオキシ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオフェニル)−3−(4−カルボキシジメチルメチルオキシ−3−フルオロフェニル)プロプ−2−エン−1−オン;
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−フェニルオキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−フェニルオキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−フルオロフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−フルオロフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−メチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−メチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,5−ジメトキシフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,5−ジメトキシフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−エチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン塩酸塩;
1−(3,5−ジメチル−4−(モルホリン−4−イルエチルオキシ)フェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ブロモフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン;
1−(4−ブロモフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−tert−ブチルオキシカルボニルジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−カルボキシジメチルメチルオキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
よりなる群において選択されることを特徴とする、請求項1〜12のいずれか1項に記載の化合物。 - 1−(4−(ペンチルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−((R,S)−5−[1,2]ジチオラン−3−イルペンチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3,5−ジブロモフェニル)プロプ−2−エン−1−オン;
1−(4−(シクロヘキシルエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオ−3,5−ジメチルフェニルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−(シクロヘキシルエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−(シクロヘキシルチオエチルオキシ)フェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,4,5−トリメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−(シクロヘキシルチオエチルオキシ)−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メチルチオフェニル)−3−(4−ヒドロキシ−3−フルオロフェニル)プロプ−2−エン−1−オン;
1−(2,3,4,5,6−ペンタメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−フェノキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−フルオロフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−メチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ヘキシルチオ−3,5−ジメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(2,5−ジメトキシフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン;
1−(4−ブロモフェニル)−3−(4−ヒドロキシ−3,5−ジフルオロフェニル)プロプ−2−エン−1−オン;
1−(4−メトキシ−3−トリフルオロメチルフェニル)−3−(4−ヒドロキシ−3,5−ジメチルフェニル)プロプ−2−エン−1−オン
よりなる群において選択されることを特徴とする、中間体化合物。 - 医薬品としての請求項1〜13のいずれか1項に記載の化合物。
- 薬学的に許容可能な担体中において、場合により別の治療用および/または化粧品用の活性な薬剤と組み合わせて、請求項1〜13のいずれか1項おいて規定されるような一般式(I)によって表される少なくとも1つの化合物を含んでなる、薬学的または化粧品組成物。
- 循環器系疾患、異脂肪血症、X症候群に伴う病状、糖尿病、肥満、高血圧、炎症性疾患、皮膚疾患(乾癬、アトピー性皮膚炎、ニキビなど)、喘息、酸化ストレスに関連する障害の処置または老化、一般に、特に皮膚老化の処置を目的とする、請求項17に記載の薬学的または化粧品組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0400123A FR2864956B1 (fr) | 2004-01-08 | 2004-01-08 | Compose derive de 1,3-diphenylprop-2-en-1-one, preparation et utilisations |
| FR0409257 | 2004-09-01 | ||
| PCT/FR2005/000040 WO2005073184A1 (fr) | 2004-01-08 | 2005-01-07 | Composes derives de 1,3-diphenylprop-2-en-1-one, preparation et utilisations |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007517841A true JP2007517841A (ja) | 2007-07-05 |
| JP2007517841A5 JP2007517841A5 (ja) | 2008-03-06 |
Family
ID=34828644
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006548344A Pending JP2007517841A (ja) | 2004-01-08 | 2005-01-07 | 1,3−ジフェニルプロプ−2−エン−1−オン誘導体化合物、その調製方法およびその使用 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US7547729B2 (ja) |
| EP (1) | EP1701938B1 (ja) |
| JP (1) | JP2007517841A (ja) |
| KR (1) | KR20060132903A (ja) |
| AU (1) | AU2005209446A1 (ja) |
| BR (1) | BRPI0506718A (ja) |
| CA (1) | CA2550576A1 (ja) |
| EA (1) | EA011305B1 (ja) |
| IL (1) | IL176515A0 (ja) |
| NO (1) | NO20062824L (ja) |
| WO (1) | WO2005073184A1 (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013512228A (ja) * | 2009-11-26 | 2013-04-11 | ジェンフィ | 肝障害を処置するための1,3−ジフェニルプロパ−2−エン−1−オン誘導体の使用 |
| JP2015507627A (ja) * | 2011-12-28 | 2015-03-12 | ジェンフィットGenfit | 1,3−ジフェニルプロパン誘導体、その製造および使用 |
| JP2020528924A (ja) * | 2017-07-31 | 2020-10-01 | ▲広▼州必▲貝▼特医▲薬▼技▲術▼有限公司Guangzhou Bebetter Medicine Technology Co., Ltd. | 1,3−ジ置換ケテン類化合物及びその使用 |
| JP2021504298A (ja) * | 2017-11-30 | 2021-02-15 | シチュアン ケルン−バイオテック バイオファーマシューティカル カンパニー リミテッド | 芳香族化合物、薬学的組成物及びその使用 |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2841900B1 (fr) * | 2002-07-08 | 2007-03-02 | Genfit S A | Nouveaux derives de 1,3-diphenylprop-2-en-1-one substitues, preparation et utilisations |
| US7816385B2 (en) * | 2002-12-20 | 2010-10-19 | High Point Pharmaceuticals, Llc | Dimeric dicarboxylic acid derivatives, their preparation and use |
| FR2910892A1 (fr) * | 2006-12-29 | 2008-07-04 | Genfit Sa | Derives de 1,3-diphenylpropane substitues, preparations et utilisations. |
| FR2910894A1 (fr) * | 2006-12-29 | 2008-07-04 | Genfit Sa | Derives de 3-phenyl-1-(phenylthienyl)propan-1-one et de 3-phenyl-1-(phenylfuranyl)propan-1-one substitues, preparation et utilisation. |
| CN116875549A (zh) * | 2008-03-27 | 2023-10-13 | 阿斯特利亚斯生物治疗股份公司 | 使灵长类多能干细胞分化成为造血谱系细胞 |
| WO2011080276A1 (en) | 2009-12-29 | 2011-07-07 | Genfit | Pharmaceutical combinations comprising a dpp-4 inhibitor and a 1,3-diphenylprop-2-en-1-one derivative |
| EP2571843B1 (en) | 2010-05-17 | 2017-12-27 | Genfit | Improved preparation of chalcone derivatives |
| DE102011114780A1 (de) * | 2011-10-01 | 2013-04-04 | Merck Patent Gmbh | Verwendung von Propanol- und Propenolderivaten als Antioxidantien |
| KR101601685B1 (ko) * | 2015-08-24 | 2016-03-09 | 여명바이오켐 주식회사 | 항산화 효과가 우수한 택시폴린 유도체 및 이를 함유하는 화장료 조성물 |
| WO2018193007A1 (en) * | 2017-04-18 | 2018-10-25 | Genfit | Combination comprising a ppar agonist such as elafibranor and an acetyl-coa carboxylase (acc) inhibitor |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3994955A (en) * | 1975-01-20 | 1976-11-30 | G. D. Searle & Co. | Substituted phenoxydialkylacetic acids and esters |
| JPS53116356A (en) * | 1977-08-26 | 1978-10-11 | Biorex Laboratories Ltd | Derivative of chalcone and its preparation |
| JPS61100547A (ja) * | 1984-10-19 | 1986-05-19 | バイオレツクス・ラボラトリーズ・リミテツド | カルコン誘導体、その製造法及び医薬組成物 |
| US5523302A (en) * | 1993-11-24 | 1996-06-04 | The Du Pont Merck Pharmaceutical Company | Aromatic compounds containing basic and acidic termini useful as fibrinogen receptor antagonists |
| JP2004501147A (ja) * | 2000-06-20 | 2004-01-15 | アセロジエニクス・インコーポレイテツド | 1,3−ビス−(置換フェニル)−2−プロペン−1−オン類およびvcam−1媒介障害を治療するためのそれらの使用 |
| JP2005532385A (ja) * | 2002-07-08 | 2005-10-27 | ジェンフィ | 置換1,3−ジフェニルプロパ−2−エン−1−オン誘導体、その調製及び使用 |
| JP2005532386A (ja) * | 2002-07-08 | 2005-10-27 | ジェンフィ | 置換1,3−ジフェニルプロパ−2−エン−1−オン誘導体に基づく組成物、その調製及び使用 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4327365A1 (de) | 1993-08-14 | 1995-02-16 | Boehringer Mannheim Gmbh | Verwendung von Phenolen und Phenolderivaten als Arzneimittel mit fibrinogensenkender Wirkung |
| EP0659743A1 (en) * | 1993-12-27 | 1995-06-28 | Hoechst Aktiengesellschaft | Piperidine derivatives as inhibitors of platelet aggregation and their preparation |
| CN1599602A (zh) | 2001-10-11 | 2005-03-23 | 钟渊化学工业株式会社 | 过氧化物酶体增殖剂应答性受体配体剂及其制备方法 |
-
2005
- 2005-01-07 CA CA002550576A patent/CA2550576A1/fr not_active Abandoned
- 2005-01-07 US US10/585,329 patent/US7547729B2/en not_active Expired - Lifetime
- 2005-01-07 AU AU2005209446A patent/AU2005209446A1/en not_active Abandoned
- 2005-01-07 EA EA200601288A patent/EA011305B1/ru not_active IP Right Cessation
- 2005-01-07 BR BRPI0506718-9A patent/BRPI0506718A/pt not_active IP Right Cessation
- 2005-01-07 WO PCT/FR2005/000040 patent/WO2005073184A1/fr not_active Ceased
- 2005-01-07 JP JP2006548344A patent/JP2007517841A/ja active Pending
- 2005-01-07 EP EP05717386A patent/EP1701938B1/fr not_active Expired - Lifetime
- 2005-01-07 KR KR1020067015988A patent/KR20060132903A/ko not_active Withdrawn
-
2006
- 2006-06-16 NO NO20062824A patent/NO20062824L/no not_active Application Discontinuation
- 2006-06-22 IL IL176515A patent/IL176515A0/en unknown
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3994955A (en) * | 1975-01-20 | 1976-11-30 | G. D. Searle & Co. | Substituted phenoxydialkylacetic acids and esters |
| JPS53116356A (en) * | 1977-08-26 | 1978-10-11 | Biorex Laboratories Ltd | Derivative of chalcone and its preparation |
| JPS61100547A (ja) * | 1984-10-19 | 1986-05-19 | バイオレツクス・ラボラトリーズ・リミテツド | カルコン誘導体、その製造法及び医薬組成物 |
| US5523302A (en) * | 1993-11-24 | 1996-06-04 | The Du Pont Merck Pharmaceutical Company | Aromatic compounds containing basic and acidic termini useful as fibrinogen receptor antagonists |
| JP2004501147A (ja) * | 2000-06-20 | 2004-01-15 | アセロジエニクス・インコーポレイテツド | 1,3−ビス−(置換フェニル)−2−プロペン−1−オン類およびvcam−1媒介障害を治療するためのそれらの使用 |
| JP2005532385A (ja) * | 2002-07-08 | 2005-10-27 | ジェンフィ | 置換1,3−ジフェニルプロパ−2−エン−1−オン誘導体、その調製及び使用 |
| JP2005532386A (ja) * | 2002-07-08 | 2005-10-27 | ジェンフィ | 置換1,3−ジフェニルプロパ−2−エン−1−オン誘導体に基づく組成物、その調製及び使用 |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013512228A (ja) * | 2009-11-26 | 2013-04-11 | ジェンフィ | 肝障害を処置するための1,3−ジフェニルプロパ−2−エン−1−オン誘導体の使用 |
| JP2016074670A (ja) * | 2009-11-26 | 2016-05-12 | ジェンフィGenfit | 肝障害を処置するための1,3−ジフェニルプロパ−2−エン−1−オン誘導体の使用 |
| JP2018070642A (ja) * | 2009-11-26 | 2018-05-10 | ジェンフィGenfit | 肝障害を処置するための1,3−ジフェニルプロパ−2−エン−1−オン誘導体の使用 |
| JP2015507627A (ja) * | 2011-12-28 | 2015-03-12 | ジェンフィットGenfit | 1,3−ジフェニルプロパン誘導体、その製造および使用 |
| JP2020528924A (ja) * | 2017-07-31 | 2020-10-01 | ▲広▼州必▲貝▼特医▲薬▼技▲術▼有限公司Guangzhou Bebetter Medicine Technology Co., Ltd. | 1,3−ジ置換ケテン類化合物及びその使用 |
| US11306102B2 (en) | 2017-07-31 | 2022-04-19 | Bebetter Med Inc. | 1,3-di-substituted ketene compound and application thereof |
| JP7058045B2 (ja) | 2017-07-31 | 2022-04-21 | 廣州必貝特醫藥股▲ふん▼有限公司 | 1,3-ジ置換ケテン類化合物及びその使用 |
| JP2021504298A (ja) * | 2017-11-30 | 2021-02-15 | シチュアン ケルン−バイオテック バイオファーマシューティカル カンパニー リミテッド | 芳香族化合物、薬学的組成物及びその使用 |
| JP7259850B2 (ja) | 2017-11-30 | 2023-04-18 | シチュアン ケルン-バイオテック バイオファーマシューティカル カンパニー リミテッド | 芳香族化合物、薬学的組成物及びその使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20080058412A1 (en) | 2008-03-06 |
| BRPI0506718A (pt) | 2007-05-02 |
| IL176515A0 (en) | 2006-10-05 |
| US7547729B2 (en) | 2009-06-16 |
| WO2005073184A1 (fr) | 2005-08-11 |
| NO20062824L (no) | 2006-10-05 |
| EP1701938B1 (fr) | 2012-07-25 |
| KR20060132903A (ko) | 2006-12-22 |
| CA2550576A1 (fr) | 2005-08-11 |
| AU2005209446A1 (en) | 2005-08-11 |
| EA011305B1 (ru) | 2009-02-27 |
| EP1701938A1 (fr) | 2006-09-20 |
| EA200601288A1 (ru) | 2006-12-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7566737B2 (en) | Combinations of substituted 1,3-diphenylprop-2-en-1-one derivatives with other therapeutically active ingredients | |
| JP4907083B2 (ja) | 置換1,3−ジフェニルプロパ−2−エン−1−オン誘導体に基づく組成物、その調製及び使用 | |
| JP4425628B2 (ja) | 細胞保護化合物、薬学的処方物および美容用処方物、ならびに方法 | |
| JP5350230B2 (ja) | 置換された1,3−ジフェニルプロパン誘導体、その製造および使用 | |
| JP2007517841A (ja) | 1,3−ジフェニルプロプ−2−エン−1−オン誘導体化合物、その調製方法およびその使用 | |
| JP2003523975A (ja) | 特異構造を持つ抗癌化合物群及びその生産方法 | |
| FR2910892A1 (fr) | Derives de 1,3-diphenylpropane substitues, preparations et utilisations. | |
| ZA200507082B (en) | Diagnosis of autism | |
| US20060035977A1 (en) | Uses of acylated aminopropanediols and sulphur and nitrogen analogues of same f | |
| FR2864956A1 (fr) | Compose derive de 1,3-diphenylprop-2-en-1-one, preparation et utilisations | |
| JP5097043B2 (ja) | イオウ含有化合物、その調製方法および薬学的使用 | |
| MXPA06007867A (en) | 1,3-diphenylprop-2-en-1-one derivative compounds, preparation method thereof and uses of same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080107 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080107 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101019 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110322 |