JP2005298424A - エパルレスタット結晶の製造方法 - Google Patents
エパルレスタット結晶の製造方法 Download PDFInfo
- Publication number
- JP2005298424A JP2005298424A JP2004118296A JP2004118296A JP2005298424A JP 2005298424 A JP2005298424 A JP 2005298424A JP 2004118296 A JP2004118296 A JP 2004118296A JP 2004118296 A JP2004118296 A JP 2004118296A JP 2005298424 A JP2005298424 A JP 2005298424A
- Authority
- JP
- Japan
- Prior art keywords
- epalrestat
- crystals
- crystal
- type
- producing
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000013078 crystal Substances 0.000 title claims abstract description 108
- CHNUOJQWGUIOLD-NFZZJPOKSA-N epalrestat Chemical compound C=1C=CC=CC=1\C=C(/C)\C=C1/SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-NFZZJPOKSA-N 0.000 title claims abstract description 67
- 229950010170 epalrestat Drugs 0.000 title claims abstract description 67
- CHNUOJQWGUIOLD-UHFFFAOYSA-N epalrestate Natural products C=1C=CC=CC=1C=C(C)C=C1SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-UHFFFAOYSA-N 0.000 title claims abstract description 67
- 238000004519 manufacturing process Methods 0.000 title claims abstract description 22
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims abstract description 21
- 238000001816 cooling Methods 0.000 claims abstract description 3
- 239000007787 solid Substances 0.000 claims description 15
- 238000000634 powder X-ray diffraction Methods 0.000 claims description 11
- 238000002425 crystallisation Methods 0.000 claims description 10
- 230000008025 crystallization Effects 0.000 claims description 9
- 239000008194 pharmaceutical composition Substances 0.000 claims description 9
- 238000001228 spectrum Methods 0.000 claims description 5
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 14
- 239000000243 solution Substances 0.000 description 12
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 11
- 238000000034 method Methods 0.000 description 9
- 238000004128 high performance liquid chromatography Methods 0.000 description 8
- 238000003756 stirring Methods 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 238000001556 precipitation Methods 0.000 description 7
- 238000011088 calibration curve Methods 0.000 description 5
- 238000007865 diluting Methods 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 235000002597 Solanum melongena Nutrition 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000003288 aldose reductase inhibitor Substances 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 3
- 235000019796 monopotassium phosphate Nutrition 0.000 description 3
- 239000004570 mortar (masonry) Substances 0.000 description 3
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 3
- 229940118148 Aldose reductase inhibitor Drugs 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- MNQZXJOMYWMBOU-UHFFFAOYSA-N glyceraldehyde Chemical compound OCC(O)C=O MNQZXJOMYWMBOU-UHFFFAOYSA-N 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 239000012047 saturated solution Substances 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000000967 suction filtration Methods 0.000 description 2
- 238000010998 test method Methods 0.000 description 2
- 229910021642 ultra pure water Inorganic materials 0.000 description 2
- 239000012498 ultrapure water Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- KWPQEKVTWLNRII-SMTGYRLFSA-N C/C(/C=C(\C(N1CC(O)=O)=O)/S[IH]1=S)=C\c1ccccc1 Chemical compound C/C(/C=C(\C(N1CC(O)=O)=O)/S[IH]1=S)=C\c1ccccc1 KWPQEKVTWLNRII-SMTGYRLFSA-N 0.000 description 1
- 241000206601 Carnobacterium mobile Species 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 229920004459 Kel-F® PCTFE Polymers 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 229940090865 aldose reductase inhibitors used in diabetes Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000007942 carboxylates Chemical group 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- UUAGAQFQZIEFAH-UHFFFAOYSA-N chlorotrifluoroethylene Chemical compound FC(F)=C(F)Cl UUAGAQFQZIEFAH-UHFFFAOYSA-N 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000013256 coordination polymer Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 238000005388 cross polarization Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- IDGUHHHQCWSQLU-UHFFFAOYSA-N ethanol;hydrate Chemical compound O.CCO IDGUHHHQCWSQLU-UHFFFAOYSA-N 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000000449 magic angle spinning nuclear magnetic resonance spectrum Methods 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 1
- -1 patches Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 238000005064 physico chemical analysis method Methods 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 238000000371 solid-state nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000004481 total suppression of sideband Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000001622 two pulse phase modulation pulse sequence Methods 0.000 description 1
- 229910001928 zirconium oxide Inorganic materials 0.000 description 1
Images
Landscapes
- Thiazole And Isothizaole Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
【課題】溶解度の高い単一結晶形からなるエパルレスタットのB型結晶を、効率よく、簡便に製造し得る方法及び本発明の製造方法により得られた単一結晶形のエパルレスタット結晶を含有した医薬組成物を提供すること。
【解決手段】エパルレスタットをメタノールに溶解させた後、得られた溶液を冷却して晶析させることを特徴とするエパルレスタット結晶の製造方法、及び該製造方法によりえられるエパルレスタット結晶を含有してなる医薬組成物。
【選択図】なし
【解決手段】エパルレスタットをメタノールに溶解させた後、得られた溶液を冷却して晶析させることを特徴とするエパルレスタット結晶の製造方法、及び該製造方法によりえられるエパルレスタット結晶を含有してなる医薬組成物。
【選択図】なし
Description
本発明は、アルドース還元酵素阻害剤等として有用なエパルレスタット結晶の製造方法に関する。
エパルレスタットは、式(I):
で表される化合物であり、アルドース還元酵素阻害剤として有用な薬剤として知られている。この化合物は、特許文献1に記載されている方法で合成され、得られた化合物はエタノール又はエタノール−水を用いた再結晶法により結晶化され、エパルレスタット結晶、エパルレスタットのエタノール溶媒和物結晶が得られることが報告されている(特許文献1、非特許文献1、2参照)。
特公昭62−51955号公報(第18欄、37行〜最下行)
J. CHEM. SOC. PERKIN TRANS. 2, 1990, p.1085-1091
Tetrahedron Letters, 1989, Vol.30, No.8, p.959-962
しかしながら、上記文献には、エパルレスタットの多形結晶体の報告はなく、従ってその多形結晶体を単一な結晶形で製造する方法についても何ら言及されていない。従来公知の製造方法により得られたエパルレスタットを本発明者らが分析した結果、多形結晶体の存在が強く示唆された。そこで、種々の物理化学的分析手法により検討を進めた結果、エパルレスタット結晶に2種の多形が存在していたことを確認した。
第1のエパルレスタット結晶は、固体13C核磁気共鳴(NMR)スペクトルにおいて、168、148、146、142、121、118、18及び15ppmに特徴的なピークを有するものであり、本明細書では、かかる固体13CNMRスペクトルを有する結晶をA型結晶という。さらに、A型結晶は、粉末X線回折スペクトルにおいて、回折角度(2θ)が12.6、16.0、16.4、17.3、21.3、22.0、22.8、25.4、27.6、29.7、30.0、30.2、33.2、33.3及び34.1°に特徴的なピークを有する。
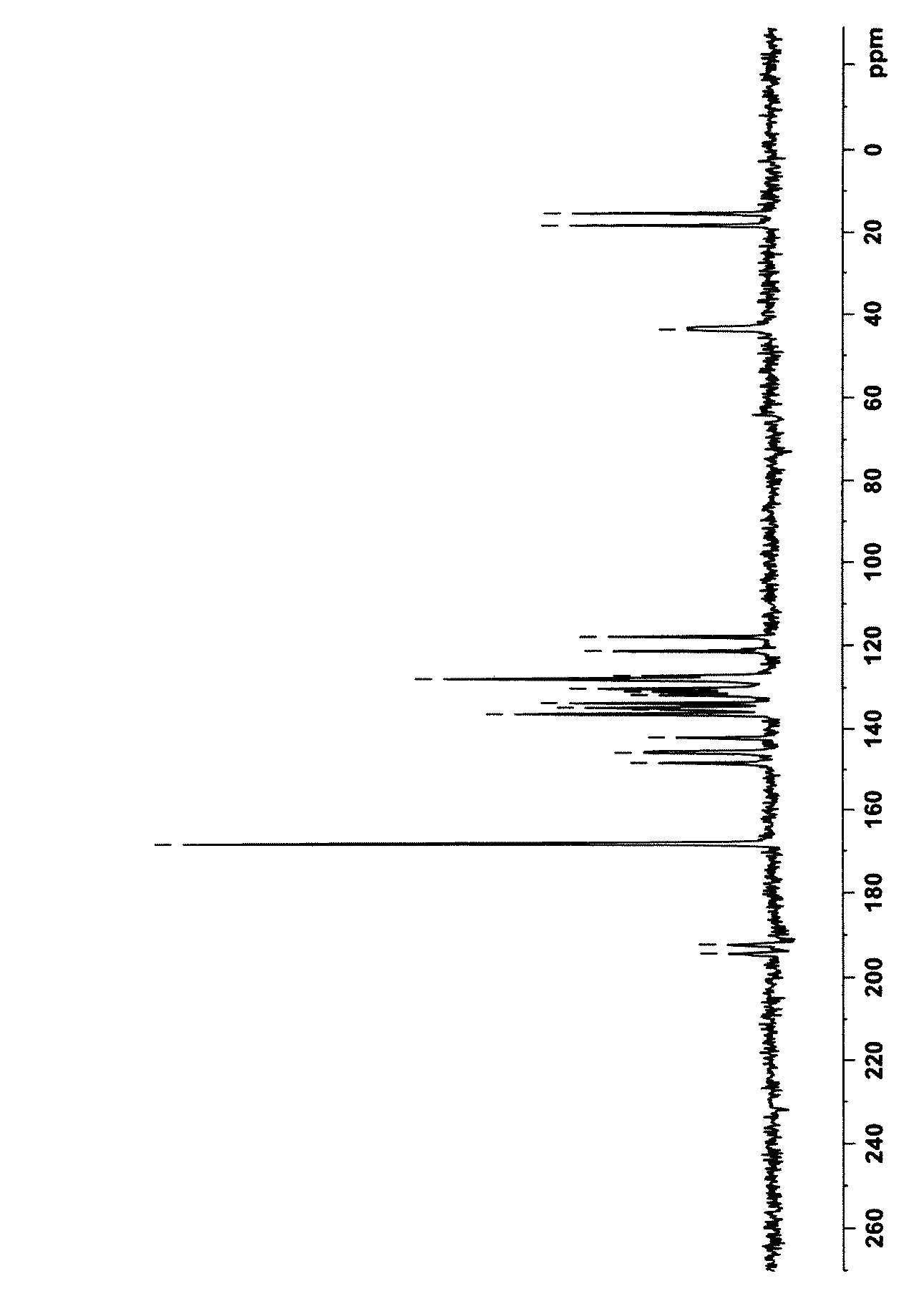
第2のエパルレスタット結晶は、固体13CNMRスペクトルにおいて、146、141、120及び17ppmに特徴的なピークを有するものであり、本明細書では、かかる固体13CNMRスペクトルを有する結晶をB型結晶という。さらに、B型結晶は、粉末X線回折スペクトルにおいて、回折角度(2θ)が7.4、11.6、11.8、12.6、13.1、13.7、14.4、14.8、16.0、16.1、17.8、19.4、19.7、21.6、21.9、22.8、23.7、24.1、25.4、26.3、27.1、29.2、29.9、31.3、34.0、34.3及び37.6°に特徴的なピークを有する。
第1のエパルレスタット結晶は、固体13C核磁気共鳴(NMR)スペクトルにおいて、168、148、146、142、121、118、18及び15ppmに特徴的なピークを有するものであり、本明細書では、かかる固体13CNMRスペクトルを有する結晶をA型結晶という。さらに、A型結晶は、粉末X線回折スペクトルにおいて、回折角度(2θ)が12.6、16.0、16.4、17.3、21.3、22.0、22.8、25.4、27.6、29.7、30.0、30.2、33.2、33.3及び34.1°に特徴的なピークを有する。
第2のエパルレスタット結晶は、固体13CNMRスペクトルにおいて、146、141、120及び17ppmに特徴的なピークを有するものであり、本明細書では、かかる固体13CNMRスペクトルを有する結晶をB型結晶という。さらに、B型結晶は、粉末X線回折スペクトルにおいて、回折角度(2θ)が7.4、11.6、11.8、12.6、13.1、13.7、14.4、14.8、16.0、16.1、17.8、19.4、19.7、21.6、21.9、22.8、23.7、24.1、25.4、26.3、27.1、29.2、29.9、31.3、34.0、34.3及び37.6°に特徴的なピークを有する。
従来公知の製造方法により得られた前記のエパルレスタット原体はA型結晶又はA型とB型の混合結晶であった。
医薬品において、多形結晶体が混在していることは、溶解度や安定性等に影響を及ぼす可能性があるため、多形結晶体を含まない所望の単一結晶性を有するエパルレスタットの製造方法が切望されている。そこで、本発明者らは様々な溶媒でエパルレスタットの結晶化を検討した結果、特定の溶媒において単一な各結晶形を効率よく、簡便に製造することに成功した。
本発明の目的は、溶解度の高い単一結晶形からなるエパルレスタットのB型結晶を、効率よく、簡便に製造し得る方法を提供することにある。さらに本発明の他の目的は本発明の製造方法により得られた単一結晶形のエパルレスタット結晶を含有した医薬組成物を提供することにある。
本発明の要旨は、
〔1〕 エパルレスタットをメタノールに溶解させた後、得られた溶液を冷却して晶析させることを特徴とするエパルレスタット結晶の製造方法、及び
〔2〕 前記〔1〕記載の製造方法によりえられるエパルレスタット結晶を含有してなる医薬組成物
に関する。
〔1〕 エパルレスタットをメタノールに溶解させた後、得られた溶液を冷却して晶析させることを特徴とするエパルレスタット結晶の製造方法、及び
〔2〕 前記〔1〕記載の製造方法によりえられるエパルレスタット結晶を含有してなる医薬組成物
に関する。
本発明により、溶解度の高い単一結晶形からなるエパルレスタットのB型結晶を、効率よく、簡便に製造することができる。また、溶解度の高い本発明の製造方法により得られたエパルレスタット結晶を含有した医薬組成物は、生物学的利用率が高く、生体内における吸収も高いという優れた効果を奏することが期待できる。
エパルレスタットに多形結晶体が存在することは本発明において見出された全く新規な知見であり、特定の溶媒を用いてエパルレスタット結晶を晶析させることにより、結晶形の異なるエパルレスタット結晶が得られることが分かった。
即ち、A型結晶は、エパルレスタットをエタノールに溶解させた後、得られた溶液を冷却して晶析させることにより、B型結晶は、エパルレスタットをメタノールに溶解させた後、得られた溶液を冷却して晶析させることにより、それぞれ得られる。
本発明において、晶析に供するエパルレスタットには、固体状、油状等の粗製エパルレスタットやA型とB型の混合結晶を用いることができ、また、A型結晶を得る場合にはエパルレスタットのB型結晶を、B型結晶を得る場合にはエパルレスタットのA型結晶を、それぞれ用いてもよい。
エパルレスタットは、例えば、特公昭62−51955号公報に記載の方法により、式(II):
で示される化合物と一般式(III):
で示される化合物との反応により、製造することができる。
結晶の製造にあたりエパルレスタットの使用量は、エタノール又はメタノールに溶解させる際の温度によって異なるため一概には決定できないが、溶解させる温度において、飽和溶液となるまで溶解させることが好ましい。または、エパルレスタットを過飽和になるまで溶解させ、熱濾過等により不溶分を除去し、飽和溶液としてもよい。
A型結晶を製造する場合に、エパルレスタットをエタノールに溶解させる温度は、幾何異性体(Z,Z異性体)の生成を防止する観点から、40〜78℃が好ましく、55〜75℃がより好ましい。また、溶液を冷却し、結晶を析出させる温度は特に限定されないが、エタノール溶媒和物の生成を防止する観点から、10〜40℃が好ましく、15〜30℃がより好ましい。
一方、B型結晶を製造する場合に、エパルレスタットをメタノールに溶解させる温度は、幾何異性体(Z,Z異性体)の生成を防止する観点から、40〜64℃が好ましく、55〜60℃がより好ましい。また、溶液を冷却し、結晶を析出させる温度は特に限定されないが、結晶多形の混合を防止する観点から、0〜40℃が好ましく、0〜25℃がより好ましい。
A型結晶及びB型結晶のいずれを製造する場合においても、結晶を析出させる際には、
安定な結晶形に転移させる観点から、温度を一定に保ち、溶液を攪拌することが好ましい。
安定な結晶形に転移させる観点から、温度を一定に保ち、溶液を攪拌することが好ましい。
一般的に、医薬品の場合、溶解度が生体内における吸収及び生物学的利用率に大きな影響を与えることが知られており、難溶性の医薬化合物においては、溶解度を向上させる方法が検討され、多数報告されている。従来、エパルレスタットは難溶性の化合物として知られており、溶解度の改善が望まれているが、驚くべきことに本発明により製造されるエパルレスタットのB型結晶は、従来の結晶化法により得られたエパルレスタットのA型結晶又はA型とB型の混合結晶よりも高い溶解度を有する。
従って、本発明ではさらに、本発明により製造されたエパルレスタットのB型結晶を含有した医薬組成物を提供する。前記の如く、溶解度の高い単一の結晶形からなるエパルレスタットのB型結晶を含有した本発明の医薬組成物は、生体内における吸収及び生物学的利用率が高いという優れた効果を奏することが期待される。
本発明の医薬組成物の形状は、錠剤、散剤、顆粒剤、坐剤、注射剤、点眼剤、液剤、カプセル剤、丸剤、懸濁剤、貼付剤、シロップ剤等のいずれであってもよく、医薬品に通常用いられる担体、賦形剤、希釈剤、崩壊剤、安定剤、保存剤、緩衝剤、乳化剤、芳香剤、着色剤、甘味剤等の添加剤を適宜含有してもよい。
医薬組成物は、本発明により製造されたエパルレスタットのB型結晶が用いられる以外は、その形状等に応じて、通常と同様に製造することができ、エパルレスタットのB型結晶の添加時期や添加方法についても特に限定されない。従って、医薬組成物中のエパルレスタット結晶の含有量も、その形状、目的等に応じて適宜選択することができる。
以下、実施例により本発明をさらに詳しく説明するが、本発明はこれらの実施例等によりなんら限定されるものではない。
参考例1〔A型結晶の製造〕
エパルレスタット214mgに、エタノール15mlを添加し、加熱還流下、攪拌しながら、エパルレスタットを溶解させた。その後、内温を徐々に表1に示す晶析温度に下げ、同温度を維持しながらさらに15時間攪拌した。攪拌後、析出した結晶を吸引濾取し、減圧乾燥して、表1に示す収率で、エパルレスタットのオレンジ結晶を得た。なお、本明細書において、晶析温度とは、結晶が析出を開始した温度ではなく、晶析中一定に保持した温度をいう。得られた結晶の固体13CNMRスペクトル及び粉末X線回折パターンを図1〜3に示す。なお、図2の粉末X線回折パターンについては、ピークの詳細を表2に示す。これらの結果から、得られた結晶はいずれもA型結晶であることが分かる。
エパルレスタット214mgに、エタノール15mlを添加し、加熱還流下、攪拌しながら、エパルレスタットを溶解させた。その後、内温を徐々に表1に示す晶析温度に下げ、同温度を維持しながらさらに15時間攪拌した。攪拌後、析出した結晶を吸引濾取し、減圧乾燥して、表1に示す収率で、エパルレスタットのオレンジ結晶を得た。なお、本明細書において、晶析温度とは、結晶が析出を開始した温度ではなく、晶析中一定に保持した温度をいう。得られた結晶の固体13CNMRスペクトル及び粉末X線回折パターンを図1〜3に示す。なお、図2の粉末X線回折パターンについては、ピークの詳細を表2に示す。これらの結果から、得られた結晶はいずれもA型結晶であることが分かる。
実施例1〔B型結晶の製造〕
エパルレスタット214mgに、メタノール15mlを添加し、加熱還流下、攪拌しながら、エパルレスタットを溶解させた。その後、内温を徐々に表1に示す晶析温度に下げ、同温度を維持しながらさらに15時間攪拌した。攪拌後、析出した結晶を吸引濾取し、減圧乾燥して、表1に示す収率で、エパルレスタットの黄色結晶を得た。得られた結晶の固体13CNMRスペクトル及び粉末X線回折パターンを図4〜7に示す。なお、図5の粉末X線回折パターンについては、ピークの詳細を表3に示す。これらの結果から、得られた結晶はいずれもB型結晶であることが分かる。
エパルレスタット214mgに、メタノール15mlを添加し、加熱還流下、攪拌しながら、エパルレスタットを溶解させた。その後、内温を徐々に表1に示す晶析温度に下げ、同温度を維持しながらさらに15時間攪拌した。攪拌後、析出した結晶を吸引濾取し、減圧乾燥して、表1に示す収率で、エパルレスタットの黄色結晶を得た。得られた結晶の固体13CNMRスペクトル及び粉末X線回折パターンを図4〜7に示す。なお、図5の粉末X線回折パターンについては、ピークの詳細を表3に示す。これらの結果から、得られた結晶はいずれもB型結晶であることが分かる。
なお、固体13CNMRスペクトル及び粉末X線回折パターンの測定方法は以下の通りである。
〔固体13CNMRスペクトル〕
各結晶形の固体NMRスペクトルを、プローブにMASVTN500SBを装備したBruker ADVANCE500 装置を用いて、125.76MHzで操作して記録する。Kel-Fキャップを備えた4mmの酸化ジルコニウムMASローターに固体を充填し、そのローターを約8kHzで回転させる。
傾斜的にパルスをかけるramp64法を用いて、Hartmann-Hahn条件下交差分極を行い(CP接触時間1.75ミリ秒、繰り返し時間4秒)、TOSS法によりスピニングサイドバンドを除いた13C MASスペクトルを獲得する。なお、プロトンチャネルのデカップリングはTPPM法を用いる。標準物質であるグリシン(アルドリッチ社製、Lot.No. 11923LA)のカルボキシレートシグナルを176.03ppmに設定し、外部基準として化学シフトを測定する。
各結晶形の固体NMRスペクトルを、プローブにMASVTN500SBを装備したBruker ADVANCE500 装置を用いて、125.76MHzで操作して記録する。Kel-Fキャップを備えた4mmの酸化ジルコニウムMASローターに固体を充填し、そのローターを約8kHzで回転させる。
傾斜的にパルスをかけるramp64法を用いて、Hartmann-Hahn条件下交差分極を行い(CP接触時間1.75ミリ秒、繰り返し時間4秒)、TOSS法によりスピニングサイドバンドを除いた13C MASスペクトルを獲得する。なお、プロトンチャネルのデカップリングはTPPM法を用いる。標準物質であるグリシン(アルドリッチ社製、Lot.No. 11923LA)のカルボキシレートシグナルを176.03ppmに設定し、外部基準として化学シフトを測定する。
〔粉末X線回折パターン〕
粉末X線回折分析装置(RINT2000;リガク製)を用いて測定する。システムには、Cu K−ALPHA1の放出を提供するために40kV及び40mAに維持した銅X線源と検出器を使用する。
発散スリット0.5°、散乱スリット0.5°及び0.15mm幅の受光スリットを使用してビームを制御する。0.02°/ポイントの段階走査で、5秒/ポイントの計算時間を用いて5°から40°の2θのデータを収集する。
粉末X線回折分析装置(RINT2000;リガク製)を用いて測定する。システムには、Cu K−ALPHA1の放出を提供するために40kV及び40mAに維持した銅X線源と検出器を使用する。
発散スリット0.5°、散乱スリット0.5°及び0.15mm幅の受光スリットを使用してビームを制御する。0.02°/ポイントの段階走査で、5秒/ポイントの計算時間を用いて5°から40°の2θのデータを収集する。
試験例〔溶解度試験〕
1.検量線の作成
エパルレスタット(A型とB型の混合結晶)10mgを精密に量り取り、後述のHPLC測定条件に記載の移動相に溶解させ、100μg/mlの溶液を得た。得られた溶液をそれぞれ、化合物の濃度が5、10、50、100μg/mlになるように移動相で希釈し、調製した。これにより下記のHPLC測定条件にしたがって標準の検量線を作成した。
1.検量線の作成
エパルレスタット(A型とB型の混合結晶)10mgを精密に量り取り、後述のHPLC測定条件に記載の移動相に溶解させ、100μg/mlの溶液を得た。得られた溶液をそれぞれ、化合物の濃度が5、10、50、100μg/mlになるように移動相で希釈し、調製した。これにより下記のHPLC測定条件にしたがって標準の検量線を作成した。
2.1 崩壊試験法第2液
エパルレスタットA型結晶、B型結晶及びA型とB型の混合結晶をそれぞれ乳鉢ですりつぶした後、20mgを精密に量り取り、50ml容の褐色ナスフラスコに移した。日本薬局方に従って調製した崩壊試験法の第2液25mLを添加し、20℃で60分間攪拌した。攪拌後、この懸濁液を濾過し、濾液を10倍に希釈した溶液を試料として、下記の測定条件で高速液体クロマトグラフィー(HPLC)のピーク面積を測定した。濃度は、ピーク面積及び先に作成した検量線を用いて算出した。結果を表4に示す。
エパルレスタットA型結晶、B型結晶及びA型とB型の混合結晶をそれぞれ乳鉢ですりつぶした後、20mgを精密に量り取り、50ml容の褐色ナスフラスコに移した。日本薬局方に従って調製した崩壊試験法の第2液25mLを添加し、20℃で60分間攪拌した。攪拌後、この懸濁液を濾過し、濾液を10倍に希釈した溶液を試料として、下記の測定条件で高速液体クロマトグラフィー(HPLC)のピーク面積を測定した。濃度は、ピーク面積及び先に作成した検量線を用いて算出した。結果を表4に示す。
2.2 リン酸二水素カリウム緩衝液(pH8.0)
エパルレスタットA型結晶、B型結晶及びA型とB型の混合結晶をそれぞれ乳鉢ですりつぶした後、20mgを精密に量り取り、50ml容の褐色ナスフラスコに移した。日本薬局方に従って調製したリン酸二水素カリウム緩衝液(pH8.0)25mLを添加し、20℃で60分間攪拌した。攪拌後、この懸濁液を濾過し、濾液を10倍に希釈した溶液を試料として、下記の測定条件でHPLCのピーク面積を測定した。濃度は、ピーク面積及び先に作成した検量線を用いて算出した。結果を表4に示す。
エパルレスタットA型結晶、B型結晶及びA型とB型の混合結晶をそれぞれ乳鉢ですりつぶした後、20mgを精密に量り取り、50ml容の褐色ナスフラスコに移した。日本薬局方に従って調製したリン酸二水素カリウム緩衝液(pH8.0)25mLを添加し、20℃で60分間攪拌した。攪拌後、この懸濁液を濾過し、濾液を10倍に希釈した溶液を試料として、下記の測定条件でHPLCのピーク面積を測定した。濃度は、ピーク面積及び先に作成した検量線を用いて算出した。結果を表4に示す。
2.3 水(HPLC用超純水)
エパルレスタットA型結晶、B型結晶及びA型とB型の混合結晶をそれぞれ乳鉢ですりつぶした後、20mgを精密に量り取り、50ml容の褐色ナスフラスコに移した。水(HPLC用超純水)25mLを添加し、20℃で60分間攪拌した。攪拌後、この懸濁液を濾過し、濾液を10倍に希釈した溶液を試料として、下記の測定条件でHPLCのピーク面積を測定した。濃度は、ピーク面積及び先に作成した検量線を用いて算出した。結果を表4に示す。
エパルレスタットA型結晶、B型結晶及びA型とB型の混合結晶をそれぞれ乳鉢ですりつぶした後、20mgを精密に量り取り、50ml容の褐色ナスフラスコに移した。水(HPLC用超純水)25mLを添加し、20℃で60分間攪拌した。攪拌後、この懸濁液を濾過し、濾液を10倍に希釈した溶液を試料として、下記の測定条件でHPLCのピーク面積を測定した。濃度は、ピーク面積及び先に作成した検量線を用いて算出した。結果を表4に示す。
〔HPLC測定条件〕
検出波長: 294 nm
カラム : Quicksorb 5μ(4.6mm×150mm)
カラム温度: 35℃付近
移動相 : 0.05mol/l リン酸二水素カリウム/アセトニトリル混液(13:7)
流量 : 1.0ml/min
注入量 : 10μl
検出波長: 294 nm
カラム : Quicksorb 5μ(4.6mm×150mm)
カラム温度: 35℃付近
移動相 : 0.05mol/l リン酸二水素カリウム/アセトニトリル混液(13:7)
流量 : 1.0ml/min
注入量 : 10μl
以上の結果より、エパルレスタットを特定の溶媒を用いて結晶化することにより、所望の単一結晶形からなるエパルレスタット結晶を簡便に得ることができ、また単一の結晶形からなるエパルレスタット結晶は混合結晶に比べて、またB型結晶はA型結晶に比べて、それぞれ高い溶解度を示していることが分かる。
本発明により得られるエパルレスタット結晶は、アルドース還元酵素阻害剤として、慢性糖尿病の合併症の予防及び治療等に好適に用いることができる。
Claims (4)
- エパルレスタットをメタノールに溶解させた後、得られた溶液を冷却して晶析させることを特徴とするエパルレスタット結晶の製造方法。
- 得られるエパルレスタット結晶が、固体13C核磁気共鳴スペクトルにおいて、146、141、120及び17ppmに特徴的なピークを有する請求項1記載の製造方法。
- 得られるエパルレスタット結晶が、粉末X線回折スペクトルにおいて、回折角度(2θ)が7.4、11.6、11.8、12.6、13.1、13.7、14.4、14.8、16.0、16.1、17.8、19.4、19.7、21.6、21.9、22.8、23.7、24.1、25.4、26.3、27.1、29.2、29.9、31.3、34.0、34.3及び37.6°に特徴的なピークを有する請求項1又は2記載の製造方法。
- 請求項1〜3いずれか記載の製造方法によりえられるエパルレスタット結晶を含有してなる医薬組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004118296A JP2005298424A (ja) | 2004-04-13 | 2004-04-13 | エパルレスタット結晶の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004118296A JP2005298424A (ja) | 2004-04-13 | 2004-04-13 | エパルレスタット結晶の製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005298424A true JP2005298424A (ja) | 2005-10-27 |
Family
ID=35330402
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004118296A Pending JP2005298424A (ja) | 2004-04-13 | 2004-04-13 | エパルレスタット結晶の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005298424A (ja) |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010028132A3 (en) * | 2008-09-06 | 2010-06-17 | Bionevia Pharmaceuticals, Inc. | Novel choline cocrystal of epalrestat |
| CN102977047A (zh) * | 2012-11-28 | 2013-03-20 | 开封明仁药业有限公司 | 依帕司他粗品的精制方法 |
| US8697735B2 (en) | 2008-07-25 | 2014-04-15 | Bionevia Pharmaceuticals, Inc. | Solid forms of epalrestat |
| CN103951634A (zh) * | 2014-05-07 | 2014-07-30 | 浙江东亚药业有限公司 | 一种依帕司他结晶盐水合物和羟基哌啶共晶物及其制备方法和应用 |
| CN105272934A (zh) * | 2015-10-09 | 2016-01-27 | 扬子江药业集团江苏海慈生物药业有限公司 | 一种依帕司他c晶型及其制备方法 |
| US9566269B2 (en) | 2011-01-20 | 2017-02-14 | Bionevia Pharmaceuticals Inc. | Modified release compositions of epalrestat or a derivative thereof and methods for using the same |
| CN107629021A (zh) * | 2017-10-19 | 2018-01-26 | 扬子江药业集团南京海陵药业有限公司 | 一种依帕司他晶型b的工业化制备方法 |
| CN108191788A (zh) * | 2018-01-24 | 2018-06-22 | 石家庄四药有限公司 | B晶型依帕司他及其制备方法 |
| CN114456125A (zh) * | 2022-03-10 | 2022-05-10 | 山东达因海洋生物制药股份有限公司 | 一种小粒度依帕司他结晶的制备方法 |
| CN114890964A (zh) * | 2022-06-21 | 2022-08-12 | 山东达因海洋生物制药股份有限公司 | 一种依帕司他晶型b的结晶制备方法 |
| CN114907286A (zh) * | 2022-06-21 | 2022-08-16 | 山东达因海洋生物制药股份有限公司 | 一种高纯度依帕司他结晶的制备方法 |
| CN115925650A (zh) * | 2022-12-13 | 2023-04-07 | 山东达因海洋生物制药股份有限公司 | 一种依帕司他共晶及其制备方法和应用 |
| JP7668713B2 (ja) | 2015-08-28 | 2025-04-25 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | エパルレスタットを調製する方法 |
-
2004
- 2004-04-13 JP JP2004118296A patent/JP2005298424A/ja active Pending
Cited By (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9447056B2 (en) | 2008-07-25 | 2016-09-20 | Bionevia Pharmaceuticals, Inc. | Solid forms of epalrestat |
| US8697735B2 (en) | 2008-07-25 | 2014-04-15 | Bionevia Pharmaceuticals, Inc. | Solid forms of epalrestat |
| GB2476202B (en) * | 2008-09-06 | 2012-04-11 | Bionevia Pharmaceuticals Inc | Novel choline cocrystal of epalrestat |
| EA016904B1 (ru) * | 2008-09-06 | 2012-08-30 | Бионевия Фармасьютикалс, Инк. | Новый холиновый сокристалл эпалрестата |
| WO2010028132A3 (en) * | 2008-09-06 | 2010-06-17 | Bionevia Pharmaceuticals, Inc. | Novel choline cocrystal of epalrestat |
| US8906948B2 (en) | 2008-09-06 | 2014-12-09 | Bionevia, LLC | Choline cocrystal of epalrestat |
| US10464912B2 (en) | 2008-09-06 | 2019-11-05 | Bionevia Pharmaceuticals, Inc. | Choline cocrystal of epalrestat |
| EA023435B1 (ru) * | 2008-09-06 | 2016-06-30 | Бионевия Фармасьютикалс, Инк. | Фармацевтическая композиция, включающая новый холиновый сокристалл эпалрестата |
| GB2476202A (en) * | 2008-09-06 | 2011-06-15 | Bionevia Pharmaceuticals Inc | Novel choline cocrystal of epalrestat |
| US9566269B2 (en) | 2011-01-20 | 2017-02-14 | Bionevia Pharmaceuticals Inc. | Modified release compositions of epalrestat or a derivative thereof and methods for using the same |
| CN102977047A (zh) * | 2012-11-28 | 2013-03-20 | 开封明仁药业有限公司 | 依帕司他粗品的精制方法 |
| CN103951634A (zh) * | 2014-05-07 | 2014-07-30 | 浙江东亚药业有限公司 | 一种依帕司他结晶盐水合物和羟基哌啶共晶物及其制备方法和应用 |
| JP7668713B2 (ja) | 2015-08-28 | 2025-04-25 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | エパルレスタットを調製する方法 |
| CN105272934A (zh) * | 2015-10-09 | 2016-01-27 | 扬子江药业集团江苏海慈生物药业有限公司 | 一种依帕司他c晶型及其制备方法 |
| CN107629021A (zh) * | 2017-10-19 | 2018-01-26 | 扬子江药业集团南京海陵药业有限公司 | 一种依帕司他晶型b的工业化制备方法 |
| CN108191788A (zh) * | 2018-01-24 | 2018-06-22 | 石家庄四药有限公司 | B晶型依帕司他及其制备方法 |
| CN108191788B (zh) * | 2018-01-24 | 2022-05-06 | 石家庄四药有限公司 | B晶型依帕司他及其制备方法 |
| CN114456125A (zh) * | 2022-03-10 | 2022-05-10 | 山东达因海洋生物制药股份有限公司 | 一种小粒度依帕司他结晶的制备方法 |
| CN114456125B (zh) * | 2022-03-10 | 2022-11-15 | 山东达因海洋生物制药股份有限公司 | 一种小粒度依帕司他结晶的制备方法 |
| CN114890964A (zh) * | 2022-06-21 | 2022-08-12 | 山东达因海洋生物制药股份有限公司 | 一种依帕司他晶型b的结晶制备方法 |
| CN114907286A (zh) * | 2022-06-21 | 2022-08-16 | 山东达因海洋生物制药股份有限公司 | 一种高纯度依帕司他结晶的制备方法 |
| CN115925650A (zh) * | 2022-12-13 | 2023-04-07 | 山东达因海洋生物制药股份有限公司 | 一种依帕司他共晶及其制备方法和应用 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101019451B1 (ko) | 이마티닙 메실레이트의 다형 및 신규한 결정형과 비결정형및 α형의 제조 방법 | |
| US10301287B2 (en) | Solid forms of cenicriviroc mesylate and processes of making solid forms of cenicriviroc mesylate | |
| KR101791724B1 (ko) | 결정질 날록솔-peg 접합체 | |
| EA034409B1 (ru) | Способы получения кристаллического фенилацетата l-орнитина | |
| JP2005298424A (ja) | エパルレスタット結晶の製造方法 | |
| JP5730986B2 (ja) | プラスグレル塩の結晶性形態 | |
| US9169262B2 (en) | Crystalline salts of Asenapine with organic di-acids and tri-acids | |
| JP2023509242A (ja) | 新規なエンパグリフロジンの共結晶 | |
| EP2524920A1 (en) | Novel Crystalline Asenapine Hydrochloride Salt Forms | |
| CN111574359A (zh) | 乐伐替尼-没食子酸共晶晶型及其应用 | |
| JP5744017B2 (ja) | チエノピリミジン誘導体の結晶 | |
| EP3604285B1 (en) | Highly stable crystalline form d1 of the eltrombopag monoethanolamine salt | |
| WO2007080362A1 (en) | Pharmaceutically acceptable co-crystalline forms of sildenafil | |
| US20120220655A1 (en) | Crystalline forms of fesoterodine fumarate and fesoterodine base | |
| KR101928987B1 (ko) | 신규한 고순도 미라베그론의 결정질 일수화물, 이의 제조방법 또는 용도 | |
| CA3108134C (en) | Crystalline eltrombopag monoethanolamine salt form d | |
| US20160122274A1 (en) | Salts of Sitagliptin, Process from the Preparation and Pharmaceutical Composition Therefore | |
| KR102150825B1 (ko) | 새로운 sglt-2 억제제의 신규한 공결정 | |
| KR102222784B1 (ko) | 신규한 에독사반 헤미에틸렌다이설퍼닉산 염 일수화물 | |
| KR100917593B1 (ko) | 덱시부프로펜염의 제조방법 | |
| US20250066346A1 (en) | Solid forms of a benzthiazole-piperazinyl-oxazole compound and methods of use thereof | |
| JP2024532601A (ja) | インドール化合物の固体形態、その調製方法及びその使用 | |
| KR101724301B1 (ko) | 바레니클린 살리실산염의 i형 결정 및 그 제조방법 | |
| HK40103083A (zh) | (3r)-n-[2-氰基-4-氟-3-(3-甲基-4-氧代-喹唑啉-6-基)氧基-苯基]-3-氟-吡咯烷-1-磺酰胺的新颖固体形式 | |
| CN114671826A (zh) | 一种莫沙必利有机酸晶体 |