JP2005278564A - 細胞培養装置 - Google Patents
細胞培養装置 Download PDFInfo
- Publication number
- JP2005278564A JP2005278564A JP2004100251A JP2004100251A JP2005278564A JP 2005278564 A JP2005278564 A JP 2005278564A JP 2004100251 A JP2004100251 A JP 2004100251A JP 2004100251 A JP2004100251 A JP 2004100251A JP 2005278564 A JP2005278564 A JP 2005278564A
- Authority
- JP
- Japan
- Prior art keywords
- cell
- cells
- separation chamber
- chamber
- culture
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000004113 cell culture Methods 0.000 title claims abstract description 69
- 238000000926 separation method Methods 0.000 claims abstract description 174
- 238000002347 injection Methods 0.000 claims abstract description 104
- 239000007924 injection Substances 0.000 claims abstract description 104
- 230000010261 cell growth Effects 0.000 claims abstract description 103
- 239000007788 liquid Substances 0.000 claims abstract description 51
- 239000000243 solution Substances 0.000 claims abstract description 44
- 238000012258 culturing Methods 0.000 claims abstract description 8
- 239000000463 material Substances 0.000 claims description 17
- 230000004956 cell adhesive effect Effects 0.000 claims description 8
- 230000021164 cell adhesion Effects 0.000 claims description 5
- 230000008859 change Effects 0.000 claims description 2
- 238000011109 contamination Methods 0.000 abstract description 14
- 210000004027 cell Anatomy 0.000 description 446
- 210000004271 bone marrow stromal cell Anatomy 0.000 description 22
- 239000011347 resin Substances 0.000 description 17
- 229920005989 resin Polymers 0.000 description 17
- 230000001464 adherent effect Effects 0.000 description 16
- 239000008280 blood Substances 0.000 description 16
- 210000004369 blood Anatomy 0.000 description 16
- 239000007853 buffer solution Substances 0.000 description 10
- 102000004142 Trypsin Human genes 0.000 description 9
- 108090000631 Trypsin Proteins 0.000 description 9
- 230000002062 proliferating effect Effects 0.000 description 9
- 239000012588 trypsin Substances 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 102000035195 Peptidases Human genes 0.000 description 6
- 108091005804 Peptidases Proteins 0.000 description 6
- 210000004102 animal cell Anatomy 0.000 description 6
- 238000009795 derivation Methods 0.000 description 6
- 238000010586 diagram Methods 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 239000001913 cellulose Substances 0.000 description 5
- 229920002678 cellulose Polymers 0.000 description 5
- 230000004069 differentiation Effects 0.000 description 5
- 239000001963 growth medium Substances 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 238000004381 surface treatment Methods 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- 239000002699 waste material Substances 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 238000003501 co-culture Methods 0.000 description 4
- 239000011248 coating agent Substances 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 239000003102 growth factor Substances 0.000 description 4
- 238000000034 method Methods 0.000 description 4
- 238000009832 plasma treatment Methods 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 210000001185 bone marrow Anatomy 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 238000007599 discharging Methods 0.000 description 3
- 210000001671 embryonic stem cell Anatomy 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 108010059892 Cellulase Proteins 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 229940106157 cellulase Drugs 0.000 description 2
- 238000012864 cross contamination Methods 0.000 description 2
- 230000006866 deterioration Effects 0.000 description 2
- 235000013601 eggs Nutrition 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 2
- 230000003472 neutralizing effect Effects 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 238000004388 gamma ray sterilization Methods 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- QNILTEGFHQSKFF-UHFFFAOYSA-N n-propan-2-ylprop-2-enamide Chemical compound CC(C)NC(=O)C=C QNILTEGFHQSKFF-UHFFFAOYSA-N 0.000 description 1
- 210000004681 ovum Anatomy 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000003466 welding Methods 0.000 description 1
Images
Landscapes
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
【課題】 異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養におけるコンタミネーションの発生を抑制できる細胞培養装置を提供する。
【解決手段】 異なる複数種の細胞を含む細胞含有液を収容し、細胞含有液に含まれる細胞から目的の細胞を分離する細胞分離室1、細胞分離室1で分離した目的の細胞を増殖させる培養を行なう細胞増殖室3、細胞分離室1で分離した目的の細胞を細胞増殖室3に移動させるための移動流路5、細胞分離室1に連結されて細胞分離室1内へ液体を注入する第1注入流路7及び細胞分離室1内の液体を導出する第1導出流路9、細胞増殖室3に連結されて細胞増殖室1内へ液体を注入する第2注入流路11及び細胞増殖室3内の液体を導出する第2導出流路13を備え、細胞分離室1は、収容した細胞含有液に含まれる細胞のうち、付着性を有するか、または、付着性が他の細胞よりも強い細胞を付着させる付着部15を有し、移動流路5は、移動流路5を開閉する移動流路開閉手段5aを有している構成とする。
【選択図】 図1
【解決手段】 異なる複数種の細胞を含む細胞含有液を収容し、細胞含有液に含まれる細胞から目的の細胞を分離する細胞分離室1、細胞分離室1で分離した目的の細胞を増殖させる培養を行なう細胞増殖室3、細胞分離室1で分離した目的の細胞を細胞増殖室3に移動させるための移動流路5、細胞分離室1に連結されて細胞分離室1内へ液体を注入する第1注入流路7及び細胞分離室1内の液体を導出する第1導出流路9、細胞増殖室3に連結されて細胞増殖室1内へ液体を注入する第2注入流路11及び細胞増殖室3内の液体を導出する第2導出流路13を備え、細胞分離室1は、収容した細胞含有液に含まれる細胞のうち、付着性を有するか、または、付着性が他の細胞よりも強い細胞を付着させる付着部15を有し、移動流路5は、移動流路5を開閉する移動流路開閉手段5aを有している構成とする。
【選択図】 図1
Description
本発明は、細胞培養装置に係り、特に、異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養装置に関する。
細胞培養により細胞を増殖させる際、異なる複数種の細胞を含む状態で培養を行い、その後、これら異なる種類の細胞を分離し、目的の細胞のみを増殖させるための培養を行なう必要が生じる場合がある。
例えば、主に哺乳類などの動物の骨髄液から付着性細胞である間葉系幹細胞(以下MSCと略称する)を分離して細胞株として得る場合、取り出した骨髄細胞を細胞培養液に希釈して培養後、目的の細胞となるMSCを分離してさらに培養を行なう。このため、目的の細胞となるMSCを他の細胞から分離する必要がある。また、胚性幹細胞などの細胞(以下ES細胞と略称する)の培養では、フィーダー細胞と共培養を行った後、分離したES細胞を受精卵や未受精卵へ移植したり、分化及び成長因子などを加えて細胞を分化させた後に他に移植したり、また、成長因子を加えてES細胞のまま単独で増殖させたりする場合がある。したがって、このような培養を行なう場合、フィーダー細胞と共培養を行った後、ES細胞単独で培養を行うため、ES細胞とフィーダー細胞とを分離する必要がある。
このように、異なる種類の細胞を分離し、目的の細胞のみを増殖させるための培養を行なう必要がある場合、例えばMSCなどでは、その付着性を利用し、付着性細胞以外の細胞を培養液または洗浄液などで洗い流して取り除く分離操作を行った後、培養液中で細胞を増殖させるために細胞を培地に植える操作などを行なっている。そして、これらの細胞の分離操作や、細胞を培地に植える操作などは、作業者がピペットなどを用いて手作業で行なっている。別の方法として、細胞の大きさや表面抗原などを尺度にセルソーターなどの機器により、目的の細胞を分離して増殖させる培養を行なうこともできる。このようにセルソーターを用いて分離を行なう場合でも、分離操作はセルソーターで行なうことができるが、分離した細胞を培地に植える操作などは作業者がピペットなどを用いて手作業で行なっている。
また、フィーダー細胞と共培養を行う必要があるES細胞などでは、ES細胞とフィーダー細胞の間には付着性に違いがあり、フィーダー細胞の付着性の方が強い。このことから、ES細胞とフィーダー細胞を分離してフィーダー細胞を除去する場合、ES細胞をフィーダー細胞と共培養した後、培養床に付着していないES細胞のみを取り出して培養を行なっているが、このような細胞の分離や培養の操作も、作業者がピペットなどを用いて手作業で行なっている。
このように従来の異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養では、異なる複数種の細胞からの目的の細胞の分離操作や、分離した目的の細胞を増殖させるため培地に植える操作などは、作業者がピペットなどを用いて手作業で行なっている。このため、コンタミネーションの発生が問題となっている。また、セルソーターなどの機器により、目的の細胞の分離操作が機器によって行なえたとしても、分離した目的の細胞を増殖させるため培地に植える操作などは、作業者がピペットなどを用いて手作業で行なっており、また、その機器が多検体を処理する際は検体間のクロスコンタミネーションが生じる可能性があるため、やはり、コンタミネーションの発生が問題となる。
これに対して、継代培養の操作における外部からのコンタミネーションを防ぐ目的で、作業者がピペットなどを用いて手作業で操作を行なわなくても、培地や培養細胞の供給、回収、排出などができる細胞培養装置として、継代培養を一体化された2つの培養床出行う装置が提案されている(例えば、特許文献1参照)。
特開平2001−275659号公報(第4−9頁、第1図)
ところが、特許文献1のような細胞培養装置は、継代培養の操作における外部からのコンタミネーションを防ぐ目的のものであり、異なる複数種の細胞からの目的の細胞の分離操作が必要な場合は、作業者がピペットなどを用いて手作業で行なう必要がある。また、特許文献1のような細胞培養装置では、異なる複数種の細胞からの目的の細胞の分離操作を装置内で行なうことは難しい。したがって、特許文献1のような細胞培養装置では、なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させる際のコンタミネーションの発生を抑制することは難しい。このため、異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させる際のコンタミネーションの発生を抑制できる細胞培養装置が必要とされている。
本発明の課題は、異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養におけるコンタミネーションの発生を抑制することにある。
本発明の細胞培養装置は、異なる複数種の細胞を含む細胞含有液を収容し、この細胞含有液に含まれる細胞から目的の細胞を分離する細胞分離室と、この細胞分離室で分離した目的の細胞を増殖させる培養を行なう細胞増殖室と、細胞分離室で分離した目的の細胞を細胞増殖室に移動させるための移動流路と、細胞分離室に連結されてこの細胞分離室内へ液体を注入する第1注入流路及びこの細胞分離室内の液体を導出する第1導出流路と、細胞増殖室に連結されてこの細胞増殖室内へ液体を注入する第2注入流路及びこの細胞増殖室内の液体を導出する第2導出流路とを備え、細胞分離室は、収容した細胞含有液に含まれる細胞のうち、付着性を有するか、または、付着性が他の細胞よりも強い細胞を付着させる付着部を有し、移動流路は、この移動流路を開閉する移動流路開閉手段を有している構成とすることにより上記課題を解決する。
このような構成とすることにより、細胞分離室内の付着部に、細胞含有液に含まれる細胞のうち付着性を有するか、または、付着性が他の細胞よりも強い細胞を付着させることにより、付着部に付着した細胞と付着部に付着していない細胞とを分離することができる。さらに、細胞分離室に連結された第1注入流路及び第1導出流路、細胞分離室と細胞増殖室を連通させる移動流路、細胞増殖室に連結された第2注入流路及び第2導出流路により、細胞分離室内への異なる複数種の細胞を含む細胞含有液や緩衝液などの注入、細胞分離室内からの不要な細胞や液体などの導出、細胞分離室で分離した細胞の細胞増殖室への移動、細胞増殖室内への培養液や緩衝液などの注入や、細胞増殖室内からの細胞の回収などを行なうことができる。このため、目的の細胞の分離操作や、分離した目的の細胞の培地への植付け操作などの操作を、作業者がピペットなどを用いて手作業で行なうことなく、外部から隔離された一貫した空間の中で行なうことができる。したがって、異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養におけるコンタミネーションの発生を抑制できる。
また、前記第1注入流路には、該第1注入流路を開閉する第1注入流路開閉手段が、前記第1導出流路には、該第1導出流路を開閉する第1導出流路開閉手段が各々設けられ、前記第2注入流路には、該第2注入流路を開閉する第2注入流路開閉手段が、前記第2導出流路には、該第2導出流路を開閉する第2導出流路開閉手段が各々設けられている構成とする。
このような構成とすれば、細胞分離室や細胞増殖室に液体を出し入れする流路が全て各流路開閉手段で閉塞でき、また、必要な流路のみを開いて液体の出し入れができるため、細胞分離室や細胞増殖室などの空間の滅菌状態を維持し易くなり、コンタミネーションの発生をより確実に抑制できる。
ところで、付着性の細胞を培養した場合、培養後に細胞を培養容器の内壁面などから剥離するため、トリプシンなどの蛋白質分解酵素を加えている。ところが、トリプシンなどの動物細胞由来の蛋白質分解酵素は、細胞の増殖能や分化能など細胞が有している能力を低下させてしまう場合がある。このため、細胞分離室の付着部に付着した細胞が目的の細胞であるとき、目的の細胞を付着部から剥離する必要があるが、この目的の細胞の剥離にトリプシンなどの動物細胞由来の蛋白質分解酵素を用いると、細胞が有している能力が低下することにより、その後の細胞増殖室での培養で要求される品質の細胞が得られなくなる場合がある。
これに対して、細胞分離室内の付着部は、温度変化に応じて細胞への接着性が変化し、細胞周囲の環境温度の変化によって細胞の付着及び剥離が制御できる細胞接着性材料で形成されている構成とする。また、細胞分離室内の付着部は、植物細胞特有の成分で、酵素分解可能な成分を含む細胞接着性材料で形成されている構成とする。これらの構成とすることにより、細胞分離室内の付着部からの細胞の剥離に、トリプシンなどの動物細胞由来の蛋白質分解酵素を用いる必要がなくなり、異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養において、細胞が有している能力の低下を抑制しながら、コンタミネーションの発生を抑制できる。
また、細胞分離室の付着部に付着していない細胞が目的の細胞であるとき、細胞分離室内の付着部は、該細胞分離室の内壁面の少なくとも一部に、細胞の付着を促進するための表面処理を施すことで形成されている構成とすれば、目的の細胞以外の細胞の付着部への付着が促進され、細胞分離室における目的の細胞の分離能力を向上できる。
本発明によれば、異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養におけるコンタミネーションの発生を抑制できる。
以下、本発明を適用してなる細胞培養装置の一実施形態について図1乃至図10を参照して説明する。なお、以下の説明において、ES細胞という表現には、胚性幹細胞のみならず、クローン胚や受精卵クローンから樹立された細胞なども含むものとする。
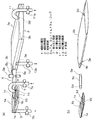
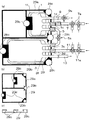
図1は、本発明を適用してなる細胞培養装置の概略構成を模式的に示す図であり、(a)は全体の構成を、(b)は細胞分離室、移動管路及び細胞増殖室を構成する袋やチューブを取り出して分解した状態で示す斜視図である。図2は、本発明を適用してなる細胞培養装置の細胞分離室での細胞の分離の原理を模式的に説明する図である。図3は、本発明を適用してなる細胞培養装置において、目的の細胞が付着性の細胞である場合の動作を模式的に示す図である。図4は、本発明を適用してなる細胞培養装置において、目的の細胞が付着性の細胞である場合の動作を示すフロー図である。図5は、本発明を適用してなる細胞培養装置において、目的の細胞が付着部に付着していない細胞である場合の動作を模式的に示す図である。図6は、本発明を適用してなる細胞培養装置において、目的の細胞が付着部に付着していない細胞の動作を示すフロー図である。図7乃至9は、本発明を適用してなる細胞培養装置の別の概略構成を模式的に示す図である。図10は、本発明を適用してなる細胞培養装置における培養操作を自動化した場合の概略構成を模式的に示す斜視図である。
本実施形態の細胞培養装置は、図1(a)に示すように、異なる複数種の細胞を含む細胞含有液から目的の細胞を分離するための細胞分離室1、細胞分離室1で分離した目的の細胞を増殖させる培養を行なう細胞増殖室3を備えている。また、細胞分離室1と細胞増殖室3とは、細胞分離室1で分離した目的の細胞を細胞分離室1から細胞増殖室3へ移動させるための移動管路5によって連結されており、移動管路5によって細胞分離室1と細胞増殖室3とは連通した状態となっている。なお、移動管路5には、移動管路5内の流路を開閉する移動流路開閉手段となるコック5aが設けられている。
細胞分離室1には、細胞分離室1内へ液体を注入する柔軟な樹脂製のチューブで形成された第1注入管路7、そして、細胞分離室1内の液体を導出する柔軟な樹脂製のチューブで形成された第1導出管路9が連結されている。第1注入管路7には、第1注入管路7内の流路を開閉する第1注入流路開閉手段となるコック7aが、第1導出管路9には、第1導出管路9を開閉する第1導出流路開閉手段となるコック9aが設けられている。同様に、細胞増殖室3には、細胞増殖室3内へ液体を注入する柔軟な樹脂製のチューブで形成された第2注入管路11、そして、細胞増殖室3内の液体を導出する柔軟な樹脂製のチューブで形成された第2導出管路13が連結されている。第2注入管路11には、第2注入管路11内の流路を開閉する第2注入流路開閉手段となるコック11aが、第2導出管路13には、第2導出管路13を開閉する第2導出流路開閉手段となるコック13aが設けられている。
なお、各流路開閉手段となるコック5a、7a、9a、11a、13aとしては、各流路内の液体の流量や通流及び遮断を制御できるものであればよく、外側からチューブを挟み込むピンチコックやローラ式コック、活栓などを適宜用いることができる。さらに、各流路開閉手段は、手動で操作するコックなどの他、動作を制御する制御手段と組み合わせることにより自動で流路を開閉できる電磁弁などを用いることもできる。
図1に示すような細胞培養装置では、図1(a)及び(b)に示すように、細胞分離室1は、透明な硬い樹脂製の箱1aの中に密封された透明な柔軟な樹脂製の袋1bを入れて形成している。同様に、細胞増殖室3は、透明な硬い樹脂製の箱3aの中に密封された透明な柔軟な樹脂製の袋3bを入れて形成している。移動管路5も、透明な硬い樹脂製の筒5bの中に密封された透明な柔軟な樹脂製のチューブ5cを入れて形成している。細胞分離室1の箱1a及び細胞増殖室3の箱3aは、適宜1面が着脱可能になっており、袋1bや袋3bを出し入れ可能になっている。移動管路5の筒5bは、両端が開放されているため、チューブ5cを出し入れ可能になっており、また、両端部は、細胞分離室1の箱1a及び細胞増殖室3の箱3aの対応する位置に着脱可能になっている。なお、図1(b)の移動管路5を形成するチューブ5cでは、コック5aは省略している。
細胞分離室1を形成する袋1bには、移動管路5を形成するチューブ5c、第1注入管路7及び第1導出管路9を連結するための連結部1c、1d、1eが設けられている。同様に、細胞増殖室3を形成する袋3bにも、移動管路5を形成するチューブ5c、第2注入管路11及び第2導出管路13を連結するための連結部3c、3d、3eが設けられている。また、移動管路5を形成するチューブ5cの両端部にも連結部5d、5eが設けられている。各連結部1c、1d、1e、3c、3d、3e、5d、5eは、細胞分離室1を形成する袋1b、細胞増殖室3を形成する袋3b、そして、移動管路5を形成するチューブ5cが図1(b)に示すような状態に分解されているときに各々の密封状態を維持できるものであり、例えば、連結したときにのみ流路が開くコネクタや注射針のような連結用の中空の針などを刺すことができる樹脂製の栓などで形成されている。
このため、細胞分離室1を形成する袋1bに連結される第1注入管路7及び第1導出管路9、そして、細胞増殖室3を形成する袋3bに連結される第2注入管路11及び第2導出管路13も、各々の端部が各連結部1c、1d、1e、3c、3d、3eに対応する構造の連結部になっている。
したがって、図1に示すような細胞培養装置では、例えば、細胞分離室1を形成する袋1b、細胞増殖室3を形成する袋3b、そして、移動管路5を形成するチューブ5cを分解した状態でオートクレーブ滅菌やγ線滅菌などによって滅菌し、滅菌後、細胞分離室1を形成する袋1bを箱1aに、細胞増殖室3を形成する袋3bを箱3aに、そして、移動管路5を形成するチューブ5cを筒5bに入れる。そして、連結部1c、3c、5d、5eの構造に応じてコネクタや中空の針を用いて連結する。
さらに、細胞分離室1を形成する袋1bに第1注入管路7及び第1導出管路9を、そして、細胞増殖室3を形成する袋3bに第2注入管路11及び第2導出管路13を、連結部1d、1e、3d、3eの構造に応じてコネクタや中空の針を用いて連結する。このとき、第1注入管路7及び第1導出管路9、そして、第2注入管路11及び第2導出管路13は、細胞分離室1を形成する袋1bまたは細胞増殖室3を形成する袋3bに連結された側と反対側の端部が、各々、図1では図示していない滅菌された細胞含有液供給タンク、培養液タンク、緩衝液タンク、廃液タンクなどに適宜連結されている。
ここで、細胞分離室1には、細胞分離室1内に収容される細胞含有液に含まれる細胞を付着させるための付着部15が設けられている。付着部15は、細胞分離室1を形成する袋1b内の底面に設けられており、分離する細胞の付着性に応じて、細胞接着性を有すると共に細胞の剥離が可能な細胞接着性材料を袋1b内の底面に設けるか、または、付着性を有する細胞の付着を促進する物質のコーティング処理やプラズマ処理などにより表面処理を行なうことによって形成されている。細胞接着性を有すると共に剥離可能な材料を袋1b内の底面に設けることで付着部15を形成した場合などでは、培養を行なう都度、細胞分離室1を形成する袋1b内に細胞付着性材料を設置することで装置の再利用が可能である。
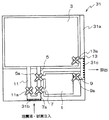
このような構成の細胞培養装置の細胞分離室1における細胞の分離の基本原理について説明する。前述のように、細胞分離室1を形成している袋1bの内面には、図2に示すように、付着部15が設けられている。図2(a)に示すように、細胞分離室1内に付着性が異なる複数種の細胞を含む細胞含有溶液が入れられ、所定の時間が経過すると、図2(b)に示すように、図2中に黒丸で示した付着性細胞17は付着部15に付着し、図2中に白丸で示した他の細胞つまり付着性細胞よりも付着性が弱いか、付着性を有していない細胞19は付着部15に付着しておらず、液中に浮遊した状態のままになっている。この状態で、細胞分離室1内に細胞を含まない培養液や緩衝液などを通流させると、液中に浮遊した細胞19が液と共に細胞分離室1から取り出され、図2(c)に示すように、付着部15に付着した付着性細胞17のみが細胞分離室1内に残される。
このように、細胞分離室1では付着部15を設けることにより、細胞が有する付着性の違いを利用して細胞の分離を行なうことができる。そして、細胞増殖室3で増殖させる細胞つまり目的の細胞が付着部15に付着した付着性細胞17である場合、図2中に白丸で示した液中に浮遊した細胞19を細胞分離室1から取り出し除去した後、図2(d)に示すように、付着部15を形成した材料が有する特性に応じて細胞の剥離を行い、細胞分離室1内に細胞を含まない培養液を注入することで、剥離した細胞17を培養液と共に細胞増殖室3に移動させる。
一方、細胞増殖室3で増殖させる細胞つまり目的の細胞が着部15に付着していない浮遊している細胞19である場合、付着性細胞17の剥離を行なわず、細胞分離室1内に細胞を含まない培養液を注入することで、液中に浮遊した細胞19を培養液と共に細胞増殖室3に移動させる。
なお、細胞増殖室3において、細胞増殖室3を形成する袋3b内面への目的の細胞の付着を促進する必要がある場合、一般的に用いられる培養容器などの場合と同様に、細胞増殖室3を形成する袋3bの内面への細胞の付着を促進する物質のコーティング処理やプラズマ処理などの表面処理が行なわれたものを適宜用いる。また、必要に応じ、細胞分離室1の付着部15の形成に用いた細胞接着性材料などを細胞増殖室3に設けることもできる。
ここで、目的とする細胞が付着性を有するか、または、付着性が他の細胞よりも強い場合の本実施形態の細胞培養装置の操作について、主に哺乳類などの動物の骨髄液から付着性細胞である間葉系幹細胞つまりMSCが目的とする細胞である場合を一例として説明する。この場合、細胞分離室1内には、図3に示すように、底面を温度感受性細胞培養シートで被覆することによって付着部15が形成されている。
付着部15を形成している温度感受性細胞培養シートは、細胞分離室1内の温度つまり温度感受性細胞培養シート周囲の環境温度が比較的高い温度、例えば37℃程度では、疎水性を示すためにMSCが付着した状態となり、比較的低い温度、例えば30℃程度では、親水性となるため、MSCが剥離可能な状態となる既知の高分子性の細胞接着性材料である。このような細胞接着性材料としては、温度応答性高分子ポリマーである、例えばN−PAMの略称で知られているN−イソプロピルアクリルアミドなどがある。
このような温度感受性細胞培養シートで細胞分離室1内の付着部15を形成することにより、細胞の増殖能や分化能など細胞が有している能力を低下させてしまう可能性があるトリプシンなどの蛋白質分解酵素を用いることなく付着部15に付着した細胞を剥離できる。すなわち、温度感受性細胞培養シートで付着部15を形成することで、細胞が有している増殖能や分化能などの能力の低下を抑制し、これにより、その後の細胞増殖室での培養でえられる細胞の品質の低下を抑制しながらMSCを剥離できる。
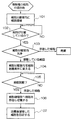
このような細胞分離室1内に、図3(a)−(b)及び図4に示すように、動物から採取した骨髄液が、直接または適切な培養液で薄めた状態で、異なる複数種の細胞を含む細胞含有液として、コック7aを開けることで、第1注入管路7より注入される(ステップ101)。このとき、図1における第1導出管路9のコック9a及び移動管路5のコック5aは閉じており、細胞含有液は、細胞分離室1内のみに注入される。
なお、図3において、移動管路5、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13は、各々の管路に設けられたコック5a、7a、9a、11a、13aを閉じている場合には、黒で示し、コック5a、7a、9a、11a、13aを閉じている場合には、白で示している。また、図3において、目的の細胞であるMSC21は黒丸で、他の細胞23は白丸で示している。
その後、図3(b)に示すように、第1注入管路7のコック7aを閉じ、MSC21を増殖させる際の培養条件と同じ条件下つまり約37℃の温度に細胞分離室1内の温度つまり細胞周囲の環境温度を維持して培養する。一般的な付着性細胞の場合、数時間から約24時間後に細胞分離室1内の付着部15に付着するが、付着性細胞以外の細胞は付着しない。したがって、図4に示すように、時間経過または培養状態を撮影して画像解析することなどにより、MSC21が細胞分離室1内の付着部15に付着したか否かを判断する(ステップ102)。
ステップ102で、細胞分離室1内の付着部15にMSC21が付着したと判断されると、図3(c)及び図4に示すように、第1注入管路7のコック7a及び第1導出管路9のコック9aを開き、培養液または緩衝液を第1注入管路7から注入し第1導出管路9から排出させ潅流させる細胞分離室1内の洗浄を行なう(ステップ103)。これにより、細胞分離室1内の付着部15に付着しなかった浮遊していた細胞を細胞分離室1内から排出でき、細胞分離室1内の付着部15に付着している目的の細胞であるMSC21と、その他の細胞23とを分離できる。
ステップ103において細胞分離室1内を洗浄した後、第1注入管路7のコック7a及び第1導出管路9のコック9aを閉じる。この状態で、MSC21を増殖される際の培養条件での温度よりも低い温度、例えば約30℃に細胞周囲の環境温度を下げる(ステップ104)。このとき、例えば、細胞分離室1が細胞増殖室3と共にインキュベータ内に入れられている場合、インキュベータの温度を調整することで細胞周囲の環境温度を下げることで細胞周囲の環境温度を下げることができ、また、細胞分離室1内に第1注入管路7から約30℃の培養液または緩衝液を注入することなどでも細胞周囲の環境温度を下げることができる。これにより、付着部15を形成している温度感受性細胞培養シートの相転移により、温度感受性細胞培養シートが親水性となり、MSC21は付着部15から剥離する。
ステップ104で細胞周囲の環境温度を下げた後、MSC21が付着部15から剥離しているのを確認した後(ステップ105)、図3(d)、(e)及び図4に示すように、第2注入管路11及び第2導出管路13のコック11a、13aを閉じた状態で、移動管路5のコック5a及び第1注入管路7のコック7aを開き、第1注入管路7から細胞分離室1内に培養液を注入することにより、培養液を細胞分離室1から細胞増殖室3に向けて潅流することで細胞増殖室3に目的の細胞であるMSC21を移動させる。そして、移動管路5のコック5aを閉じ、細胞増殖室3内の温度を細胞培養条件、例えば約37℃にすることで、MSC21を増殖させる(ステップ106)。このとき、必要に応じ第2注入管路11のコック11aを一時的に開き、第2注入管路11から細胞増殖室3内に培養液を加え、適切な条件にして細胞培養する。
また、ステップ106でMSC21を増殖させる培養を行なっているとき、MSC21が細胞増殖室3の培養床に付着後、必要に応じ、図3(e)に示すように、第2注入管路11及び第2導出管路13のコック11a、13aを開き、培養液を第2導出管路13から排出した後、第2導出管路13のコック13aを閉め、第2注入管路11から培養液を注入してコック11aを閉じることで培地交換を行う。
ステップ106でMSC21が増殖した後、図4に示すように、細胞増殖室3から増殖したMSC21の回収を行なう(ステップ107)。ステップ107では、図3(e)に示した操作と同様に、第2注入管路11及び第2導出管路13のコック11a、13aを開き、緩衝液を第2注入管路11から入れ第2導出管路13から排出することで細胞増殖室3内のMSC21を洗浄する。洗浄後、緩衝液を細胞増殖室3から除去し、図3(f)に示すように、第2導出管路13のコック13aを閉じ、第2注入管路11から、例えばトリプシンなどの蛋白質分解酵素を含む細胞剥離剤を注入する。
その後、図3(g)に示すように、第2注入管路11のコック11aを閉じ、細胞剥離反応を行う。細胞剥離反応後、図3(f)に示した操作と同様に、第2注入管路11のコック11aを開けて中和剤を入れた後、再び第2注入管路11のコック11aを閉じ、撹拌により細胞剥離反応を停止する。細胞剥離反応の停止後、図3(h)に示すように、第2導出管路13のコック13aのコックを開けMSC21を回収する。
ところで、上記の説明では、細胞分離室1内に設けた温度感受性細胞培養シートで付着部15を形成した場合を示した。しかし、トリプシンなどの蛋白質分解酵素を含む細胞剥離剤を用いずに細胞を剥離できる付着部15としては、温度感受性細胞培養シートの他に、動物細胞が有していない物質、すなわち、植物細胞由来の物質を用いて付着部15を形成することもできる。
例えば、植物細胞由来の物質であるセルロースと細胞接着性を有する蛋白質やペプチドとで付着部15を形成することができる。このように細胞分離室1内にセルロースと細胞接着性を有する蛋白質やペプチドとで形成した付着部15を設けた場合、前述の図4に示すステップ104の細胞分離室1内を細胞剥離条件に変える操作の代わりに、第1注入管路7のコック7aを一時的に開き、第1注入管路7からセルロースを分解するため、セルラーゼを含む細胞剥離用薬剤を注入し、付着部15を形成しているセルロースを分解させる操作を行なう。この操作により、付着部15が分解され、目的の細胞を剥離することができる。
セルラーゼは、動物細胞に影響を与え難いため、細胞増殖室での培養で得られた細胞の品質の低下を抑制しながら、細胞分離室1の付着部15から目的の細胞を剥離することができる。また、付着部15を形成する植物細胞由来の物質としては、セルロースの他、アルギン酸など、植物細胞特有の様々な物質を用いることができる。
一方、目的とする細胞が付着性を有していないか、または、付着性が他の細胞よりも弱い場合の本実施形態の細胞培養装置の操作について、フィーダー細胞と共培養後の胚性幹細胞などの細胞つまりES細胞からフィーダー細胞を分離し、ES細胞のみを増殖させる場合を一例として説明する。この場合、細胞分離室1を形成する袋1bの内側底面の付着部15は、細胞の付着を促進するため、一般的に用いられる培養容器などの場合と同様に、袋1bの内側底面への細胞の付着を促進する物質のコーティング処理やプラズマ処理などの表面処理を行なうことで形成したものである。また、細胞増殖室3を形成する袋3bの内面にも、細胞の付着を促進するため、一般的に用いられる培養容器などの場合と同様に、袋3bの内面への細胞の付着を促進する物質のコーティング処理やプラズマ処理などの表面処理が行なわれたものを適宜用いる。
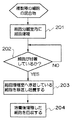
このような細胞分離室1内に、図5(a)−(b)及び図6に示すように、共培養後のES細胞25とフィーダー細胞27とを含む培養液が、直接または適切な培養液で薄めた状態で、異なる複数種の細胞を含む細胞含有液として、コック7aを開けることで、第1注入管路7より注入される(ステップ201)。このとき、図1における第1導出管路9のコック9a及び移動管路5のコック5aは閉じており、細胞含有液は、細胞分離室1内のみに注入される。
なお、図5において、移動管路5、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13は、図3の場合と同様に、各々の管路に設けられたコック5a、7a、9a、11a、13aを閉じている場合には、黒で示し、コック5a、7a、9a、11a、13aを閉じている場合には、白で示している。また、図5において、目的の細胞であるES細胞25は白丸で、フィーダー細胞27は黒丸で示しており、細胞分離室1内の付着部15は省略している。
その後、図5(b)に示すように、第1注入管路7のコック7aを閉じ、ES細胞25を増殖させる際の培養条件と同じ条件に維持して培養する。一般的なフィーダー細胞27の場合、数時間後には細胞分離室1内の付着部15に付着するが、フィーダー細胞よりも付着性が弱いES細胞は付着しない。したがって、図4に示すように、時間経過または培養状態を撮影して画像解析することなどにより、フィーダー細胞27のみが細胞分離室1内の付着部15に付着したか否かを判断する(ステップ202)。
ステップ202で、細胞分離室1内の付着部15にフィーダー細胞27が付着したと判断されると、図5(c)及び図6に示すように、第2注入管路11及び第2導出管路13のコック11a、13aを閉じた状態で、移動管路5のコック5a及び第1注入管路7のコック7aを開き、第1注入管路7から細胞分離室1内に培養液を注入することにより、培養液を細胞分離室1から細胞増殖室3に向けて潅流することで細胞増殖室3に目的の細胞であるES細胞25を移動させる。ES細胞25の移動後、移動管路5のコック5aを閉じ、細胞増殖室3内の温度を、ES細胞を増殖させるための培養温度にし、ES細胞25を増殖させるための培養を行なう(ステップ203)。このとき、必要に応じて第2注入管路11のコック11aを一時的に開き、第2注入管路11から細胞増殖室3内に培養液を加え、適切な条件にする。
このように、ステップ203で第1注入管路7から細胞分離室1内に培養液を注入することにより、培養液を細胞分離室1から細胞増殖室3に向けて潅流することで細胞増殖室3に目的の細胞であるES細胞25を移動させることにより、細胞分離室1内の付着部15に付着せずに浮遊していた目的の細胞であるES細胞25と、細胞分離室1内の付着部15に付着しているフィーダー細胞27とを分離できる。
また、ステップ203でES細胞25を増殖させる培養を行なっているとき、ES細胞25が細胞増殖室3の培養床に付着後、必要に応じ、図5(d)に示すように、第2注入管路11及び第2導出管路13のコック11a、13aを開き、培養液を第2導出管路13から排出した後、第2導出管路13のコック13aを閉め、第2注入管路11から培養液を注入してコック11aを閉じることで培地交換を行う。
ステップ203でES細胞25が増殖した後、図6に示すように、細胞増殖室3から増殖したES細胞25の回収を行なう(ステップ204)。ステップ204では、図5(e)に示したように、第2注入管路11及び第2導出管路13のコック11a、13aを開き、緩衝液を第2注入管路11から入れ第2導出管路13から排出することで細胞増殖室3内のES細胞25を洗浄する。洗浄後、緩衝液を細胞増殖室3から除去し、図5(f)に示すように、第2導出管路13のコック13aを閉じ、第2注入管路11から、例えばトリプシンなどの蛋白質分解酵素を含む細胞剥離剤を注入する。
その後、図5(g)に示すように、第2注入管路11のコック11aを閉じ、細胞剥離反応を行う。細胞剥離反応後、図5(f)に示した操作と同様に、第2注入管路11のコック11aを開けて中和剤を入れた後、再び第2注入管路11のコック11aを閉じ、撹拌により細胞剥離反応を停止する。細胞剥離反応の停止後、図5(h)に示すように、第2導出管路13のコック13aのコックを開けES細胞25を回収する。
本例では、フィーダー細胞を分離したES細胞を増殖させて回収する場合を例示したが、細胞増殖室3での培養において、何らかの分化及び成長因子を加え、ES細胞を他の細胞に分化させて細胞増殖室3から細胞を回収する場合もある。この場合、ステップ202までの操作は同じであるが、ステップ203において、培養液に適切な分化及び成長因子を加えて培養後、分化した細胞の種類や性質などに応じ、インキュベータなどから細胞増殖室3または細胞培養装置全体を取り出して細胞増殖室3から手作業で細胞を回収するか、または、ステップ204と同様の操作で細胞を回収する。
次に、このような本実施形態の細胞培養装置の構成の変形例について説明する。図1に示したような構成の細胞培養装置では、繰り返し用いることを前提としているが、繰り返しの使用におけるクロスコンタミネーションの低減のための洗浄や滅菌作業をなくす上では、細胞分離室1、細胞増殖室3及び各々に連結された移動管路5、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13などを使い捨て可能な構成とすることが望ましい場合もある。この場合、例えば、細胞分離室1及び細胞増殖室3は、図7に示すように、各々平たい方形の血液バックと同様の透明な樹脂製の容器で形成する。したがって、細胞分離室1及び細胞増殖室3は、2枚の樹脂シートを枠状に溶着することによって形成したものである。このとき、少なくとも細胞分離室1となる容器の内面の少なくとも底面側となる部分の1部に、適宜の付着部15を設ける処理を行なっておく。
細胞分離室1の一方の側面には、連結部1c、1d、1eが並べて設けられている。同様に、細胞増殖室3の一方の側面にも、連結部3c、3d、3eが並べて設けられている。そして、細胞分離室1の連結部1c、1d、1e、細胞増殖室3の連結部3c、3d、3eに、各々、シリコンチューブなどの樹脂製のチューブを、移動管路5、第1注入管路7、第1導出管路9、第2注入管路11または第2導出管路13として連結する。これらの移動管路5、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13には、樹脂製の活栓などからなるコック5a、7a、9a、11a、13aが各々設けられている。また、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13の、細胞分離室1または細胞増殖室3に連結された側と反対側の端部は、各々、例えば注射筒の先端部を挿入して連結可能な樹脂製で筒状の接続部7b、9b、11b、13bとなっている。
図7に示したような細胞分離室1及び細胞増殖室3は、血液バッグと同様の材料及び製造方法により本実施形態の構成の細胞培養装置の細胞分離室1及び細胞増殖室3用として専用に形成したものであるが、細胞分離室1及び細胞増殖室3は、図8に示すように、血液バッグそのものを利用して形成することもできる。この場合、例えば、2つの血液バッグを、各々、細胞分離室1及び細胞増殖室3として用いる。このとき、少なくとも細胞分離室1を形成する血液バッグの内面の少なくとも底面側となる部分の1部に、適宜の付着部15を設ける処理を行なっておく。
また、図8に示す構成では、血液バッグによって細胞分離室1及び細胞増殖室3を形成する場合、培養中に血液バッグを寝かせた状態に支持するため、また、取扱を容易にするため、細胞分離室1及び細胞増殖室3となる血液バッグを支持可能なフレーム29を用いている。フレーム29は、細胞分離室1を形成する血液バッグと細胞増殖室3を形成する血液バッグを各々支持するための支持枠部29a、29bを有している。支持枠部29a、29bには、細胞分離室1及び細胞増殖室3となる血液バッグの各々の周縁に形成されたリム部1f、3fの各々3箇所を挟み込んで細胞分離室1及び細胞増殖室3となる血液バッグをフレーム29に取り付けるための挟持部材29cが設けられている。
なお、図8では、細胞分離室1となる血液バッグと一体に形成された管路を第1導出管路9とし、細胞分離室1となる血液バッグに形成された2つの連結部1c、1dに各々移動管路5及び第1注入管路7を連結している。同様に、細胞増殖室3となる血液バッグと一体に形成された管路を第2導出管路13とし、細胞増殖室3となる血液バッグに形成された2つの連結部3c、3dに各々移動管路5及び第2注入管路11を連結している。また、図8では、第1注入管路7及び第2注入管路11には、各々、2つのコック7a、11aが設けられている場合を示し、第2導出管路13の設けられたコック13aは省略されている。
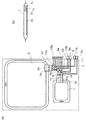
また、図1、図7及び図8では、別個に形成された細胞分離室1及び細胞増殖室3を用いた場合を示しているが、図9に示すように、細胞分離室1及び細胞増殖室3を1つの分離培養ユニット31として形成することもできる。この場合、例えば、図9に示すように、1つの透明な樹脂製の容器31a内に、細胞分離室1及び細胞増殖室3を形成し、さらに、移動管路5、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13を設けた構成とする。また、移動管路5、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13には、コック5a、7a、9a、11a、13aを設ける。
このとき、少なくとも細胞分離室1の内面の少なくとも底面側となる部分の1部に、適宜の付着部15を設ける処理を行なっておく。また、分離培養ユニット31では、第1注入管路7と第2注入管路11は、容器31aの側壁に形成された1つの注入口31bに連結されており、第1導出管路9と第2導出管路13は、容器31aの側壁に形成された1つの導出口31cに連結されている。分離培養ユニット31は、金型を用いた樹脂成形などにより、細胞分離室1、細胞増殖室3、移動管路5、第1注入管路7、第1導出管路9、第2注入管路11及び第2導出管路13などを一体的に形成することが可能である。
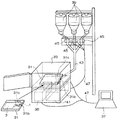
このような分離培養ユニット31を用い、また、分離培養ユニット31に設けたコック5a、7a、9a、11a、13aを機械的または電気的に動作を制御できるものとすれば、図3乃至図6に示したような分離培養操作の自動化が容易になる。分離培養ユニット31を用いて分離培養操作の自動化を行なう場合、細胞培養装置は、図10に示すように、分離培養ユニット31に加え、分離培養ユニット31を内部に収容して細胞の培養環境を制御可能なインキュベータ33、分離培養ユニット31に設けられたコック5a、7a、9a、11a、13aなどの動作を制御する制御部35、インキュベータ33の動作の制御や制御部35への指令及び各種設定値の入力などを行うためのコンピュータ37、培養液や緩衝液そして細胞剥離剤などを各々収容した複数の試薬ボトル39、分離培養ユニット31からの廃液を収容する廃液タンク41などを備えている。
複数の試薬ボトル39には、各々供給管路43が接続されており、各試薬ボトル39に接続された供給管路43は途中で1本の管路に合流し、分離培養ユニット31の注入口31bに接続されている。供給管路43の分岐した部分には、各々、各試薬ボトル39内の液の分離培養ユニット31への供給及び停止を制御するための電磁弁45が設けられている。電磁弁45は、制御部35と配線47を介して電気的に接続されており、制御部35によって動作が制御される。また、図示していないが制御部35は、配線を介して分離培養ユニット31に設けられたコック5a、7a、9a、11a、13aなどの駆動機構と電気的に接続されている。コンピュータ37は、配線47を介して制御部35及びインキュベータ33と電気的に接続されている。廃液タンク41は、廃液管路49を介して分離培養ユニット31の導出口31cに連結されている。
このような図10に示したような構成の細胞培養装置とすることにより、図3乃至図6に示したような分離培養操作にしたがって、コンピュータ37や制御部35がコック5a、7a、9a、11a、13a、インキュベータ33、電磁弁45などの動作を制御することにより、異なる複数種の細胞から目的の細胞を分離して増殖させる培養を自動的に行なうことができる。
このように、本実施形態の細胞培養装置では、細胞分離室1で、細胞含有液に含まれる細胞のうち付着性を有するか、または、付着性が他の細胞よりも強い細胞を付着部15に付着させることにより、付着部15に付着した細胞と付着部15に付着していない細胞とを分離することができる。さらに、第1注入管路7及び第1導出管路9、第2注入管路11及び第2導出管路13、そして、移動管路5により、細胞分離室1内への異なる複数種の細胞を含む細胞含有液や緩衝液などの注入、細胞分離室1内からの不要な細胞や液体などの導出、細胞分離室1で分離した細胞の細胞増殖室3への移動、細胞増殖室1内への培養液や緩衝液などの注入や、細胞増殖室1内からの細胞の回収などを行なうことができる。したがって、目的の細胞の分離操作、分離した目的の細胞の増殖のための培地への植付け操作などを、作業者がピペットなどを用いて手作業で行なうことなく、外部から隔離された一貫した空間の中で行なうことができる。このため、異なる複数種の細胞を含む細胞含有液から目的とする細胞を分離して増殖させるための細胞培養におけるコンタミネーションの発生を抑制できる。
さらに、目的の細胞の分離にセルソーターなどの高価な機器を用いる必要がないため、目的の細胞を分離して増殖できる細胞培養装置のコストを低減できる。
さらに、本実施形態の細胞培養装置では、第1注入管路7には、第1注入流路開閉手段となるコック7aが、第1導出管路9には、第1導出流路開閉手段となるコック9aが、第2注入管路11には、第2注入流路開閉手段となるコック11aが、第2導出管路13には、第2導出流路開閉手段となるコック13aが設けられている。このため、細胞分離室1や細胞増殖室3に液体を出し入れする流路が全て各コック5a、7a、9a、11a、13aで閉塞でき、また、必要な管路のみを開いて液体の出し入れができるため、細胞分離室1や細胞増殖室3などの滅菌状態を維持し易くなり、コンタミネーションの発生をより確実に抑制できる。加えて、細胞分離室1や細胞増殖室3などへの液体や細胞の出し入れや、細胞分離室1から細胞増殖室3への細胞の移動などの制御が容易になる。
さらに、移動管路5、第1注入管路7、第1導出管路9、第2注入管路11、第2導出管路13にコック5a、7a、9a、11a、13aが設けられていることにより、コック5a、7a、9a、11a、13aなどの各流路開閉手段を機械的または電気的に動作を制御できるものとすることで、目的の細胞の分離操作や分離した細胞の培地への植付け操作、増殖した細胞の回収操作などの目的の細胞を分離して増殖させるための一連の培養操作を容易に自動化できる。
さらに、本実施形態では、細胞分離室1内に設けられた付着部15は、細胞接着性材料、または、植物細胞特有の成分で、酵素分解可能な成分と、細胞に対する接着性を有する成分とで形成されている。このため、付着部15に付着した細胞が目的の細胞である場合、トリプシンなどの動物細胞由来の蛋白質分解酵素を用いて細胞を剥離する必要がなく、細胞の増殖能や分化能など細胞が有している能力の低下を抑制できる。したがって、細胞増殖室3で要求される品質の細胞を得易くなる。
加えて、本実施形態では、細胞分離室1の付着部15に付着していない細胞が目的の細胞である場合、細胞分離室1内の付着部15は、細胞の付着を促進するための表面処理を施すことで形成している。このため、目的の細胞以外の細胞の付着部15への付着が促進され、細胞分離室1における目的の細胞の分離能力を向上できる。
また、本発明は、本実施形態の構成の細胞培養装置に限らず、付着部を有する細胞分離室、移動流路を介して細胞培養室に連通する細胞増殖室などを備えていれば様々な構成にできる。
1 細胞分離室
3 細胞増殖室
5 移動管路
7 第1注入管路
9 第1導出管路
11 第2注入管路
13 第2導出管路
15 付着部
5a、7a、9a、11a、13a コック
3 細胞増殖室
5 移動管路
7 第1注入管路
9 第1導出管路
11 第2注入管路
13 第2導出管路
15 付着部
5a、7a、9a、11a、13a コック
Claims (3)
- 異なる複数種の細胞を含む細胞含有液を収容し、該細胞含有液に含まれる細胞から目的の細胞を分離する細胞分離室と、該細胞分離室で分離した目的の細胞を増殖させる培養を行なう細胞増殖室と、前記細胞分離室で分離した目的の細胞を前記細胞増殖室に移動させるための移動流路と、前記細胞分離室に連結されて該細胞分離室内へ液体を注入する第1注入流路及び該細胞分離室内の液体を導出する第1導出流路と、前記細胞増殖室に連結されて該細胞増殖室内へ液体を注入する第2注入流路及び該細胞増殖室内の液体を導出する第2導出流路とを備え、前記細胞分離室は、収容した細胞含有液に含まれる細胞のうち、付着性を有するか、または、付着性が他の細胞よりも強い細胞を付着させる付着部を有し、前記移動流路は、該移動流路を開閉する移動流路開閉手段を有している細胞培養装置。
- 前記第1注入流路には、該第1注入流路を開閉する第1注入流路開閉手段が、前記第1導出流路には、該第1導出流路を開閉する第1導出流路開閉手段が各々設けられ、前記第2注入流路には、該第2注入流路を開閉する第2注入流路開閉手段が、前記第2導出流路には、該第2導出流路を開閉する第2導出流路開閉手段が各々設けられていることを特徴とする請求項1に記載の細胞培養装置。
- 前記細胞分離室内の付着部は、温度変化に応じて細胞への接着性が変化し、細胞周囲の環境温度の変化によって細胞の付着及び剥離が制御できる温度感受性の細胞接着性材料で形成されていることを特徴とする請求項1または2に記載の細胞培養装置。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004100251A JP2005278564A (ja) | 2004-03-30 | 2004-03-30 | 細胞培養装置 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004100251A JP2005278564A (ja) | 2004-03-30 | 2004-03-30 | 細胞培養装置 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005278564A true JP2005278564A (ja) | 2005-10-13 |
Family
ID=35177617
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004100251A Pending JP2005278564A (ja) | 2004-03-30 | 2004-03-30 | 細胞培養装置 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005278564A (ja) |
Cited By (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007312668A (ja) * | 2006-05-25 | 2007-12-06 | Hitachi Medical Corp | 自動培養装置 |
| JP2013176377A (ja) * | 2007-03-05 | 2013-09-09 | Terumo Bct Inc | 細胞増殖システムおよび使用方法 |
| US9617506B2 (en) | 2013-11-16 | 2017-04-11 | Terumo Bct, Inc. | Expanding cells in a bioreactor |
| US9677042B2 (en) | 2010-10-08 | 2017-06-13 | Terumo Bct, Inc. | Customizable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US10077421B2 (en) | 2014-04-24 | 2018-09-18 | Terumo Bct, Inc. | Measuring flow rate |
| JP2019013191A (ja) * | 2017-07-07 | 2019-01-31 | オリンパス株式会社 | 培養細胞解析システム、培養細胞解析方法、及び、プログラム |
| US10577576B2 (en) | 2012-08-20 | 2020-03-03 | Terumo Bct, Inc. | System for expanding cells |
| US11008547B2 (en) | 2014-03-25 | 2021-05-18 | Terumo Bct, Inc. | Passive replacement of media |
| US11104874B2 (en) * | 2016-06-07 | 2021-08-31 | Terumo Bct, Inc. | Coating a bioreactor |
| US11608486B2 (en) | 2015-07-02 | 2023-03-21 | Terumo Bct, Inc. | Cell growth with mechanical stimuli |
| US11624046B2 (en) | 2017-03-31 | 2023-04-11 | Terumo Bct, Inc. | Cell expansion |
| US11629332B2 (en) | 2017-03-31 | 2023-04-18 | Terumo Bct, Inc. | Cell expansion |
| US11667881B2 (en) | 2014-09-26 | 2023-06-06 | Terumo Bct, Inc. | Scheduled feed |
| US11685883B2 (en) | 2016-06-07 | 2023-06-27 | Terumo Bct, Inc. | Methods and systems for coating a cell growth surface |
| US11965175B2 (en) | 2016-05-25 | 2024-04-23 | Terumo Bct, Inc. | Cell expansion |
| JP7489054B2 (ja) | 2017-10-03 | 2024-05-23 | 公立大学法人大阪 | 細胞の取得方法、および細胞の培養方法 |
-
2004
- 2004-03-30 JP JP2004100251A patent/JP2005278564A/ja active Pending
Cited By (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007312668A (ja) * | 2006-05-25 | 2007-12-06 | Hitachi Medical Corp | 自動培養装置 |
| JP2013176377A (ja) * | 2007-03-05 | 2013-09-09 | Terumo Bct Inc | 細胞増殖システムおよび使用方法 |
| US9260698B2 (en) | 2007-03-05 | 2016-02-16 | Terumo Bct, Inc. | Cell expansion system and methods of use |
| US11746319B2 (en) | 2010-10-08 | 2023-09-05 | Terumo Bct, Inc. | Customizable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US10669519B2 (en) | 2010-10-08 | 2020-06-02 | Terumo Bct, Inc. | Customizable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US9725689B2 (en) | 2010-10-08 | 2017-08-08 | Terumo Bct, Inc. | Configurable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US11613727B2 (en) | 2010-10-08 | 2023-03-28 | Terumo Bct, Inc. | Configurable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US11773363B2 (en) | 2010-10-08 | 2023-10-03 | Terumo Bct, Inc. | Configurable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US9677042B2 (en) | 2010-10-08 | 2017-06-13 | Terumo Bct, Inc. | Customizable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US10870827B2 (en) | 2010-10-08 | 2020-12-22 | Terumo Bct, Inc. | Configurable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| US10577576B2 (en) | 2012-08-20 | 2020-03-03 | Terumo Bct, Inc. | System for expanding cells |
| US10557112B2 (en) | 2013-11-16 | 2020-02-11 | Terumo Bct, Inc. | Expanding cells in a bioreactor |
| US10633625B2 (en) | 2013-11-16 | 2020-04-28 | Terumo Bct, Inc. | Expanding cells in a bioreactor |
| US9617506B2 (en) | 2013-11-16 | 2017-04-11 | Terumo Bct, Inc. | Expanding cells in a bioreactor |
| US11708554B2 (en) | 2013-11-16 | 2023-07-25 | Terumo Bct, Inc. | Expanding cells in a bioreactor |
| US11667876B2 (en) | 2013-11-16 | 2023-06-06 | Terumo Bct, Inc. | Expanding cells in a bioreactor |
| US11008547B2 (en) | 2014-03-25 | 2021-05-18 | Terumo Bct, Inc. | Passive replacement of media |
| US11795432B2 (en) | 2014-03-25 | 2023-10-24 | Terumo Bct, Inc. | Passive replacement of media |
| US10077421B2 (en) | 2014-04-24 | 2018-09-18 | Terumo Bct, Inc. | Measuring flow rate |
| US11667881B2 (en) | 2014-09-26 | 2023-06-06 | Terumo Bct, Inc. | Scheduled feed |
| US11608486B2 (en) | 2015-07-02 | 2023-03-21 | Terumo Bct, Inc. | Cell growth with mechanical stimuli |
| US11965175B2 (en) | 2016-05-25 | 2024-04-23 | Terumo Bct, Inc. | Cell expansion |
| US11634677B2 (en) | 2016-06-07 | 2023-04-25 | Terumo Bct, Inc. | Coating a bioreactor in a cell expansion system |
| US11685883B2 (en) | 2016-06-07 | 2023-06-27 | Terumo Bct, Inc. | Methods and systems for coating a cell growth surface |
| US11104874B2 (en) * | 2016-06-07 | 2021-08-31 | Terumo Bct, Inc. | Coating a bioreactor |
| US11999929B2 (en) | 2016-06-07 | 2024-06-04 | Terumo Bct, Inc. | Methods and systems for coating a cell growth surface |
| US11629332B2 (en) | 2017-03-31 | 2023-04-18 | Terumo Bct, Inc. | Cell expansion |
| US11702634B2 (en) | 2017-03-31 | 2023-07-18 | Terumo Bct, Inc. | Expanding cells in a bioreactor |
| US11624046B2 (en) | 2017-03-31 | 2023-04-11 | Terumo Bct, Inc. | Cell expansion |
| JP7079572B2 (ja) | 2017-07-07 | 2022-06-02 | オリンパス株式会社 | 培養細胞解析システム、培養細胞解析方法、及び、プログラム |
| JP2019013191A (ja) * | 2017-07-07 | 2019-01-31 | オリンパス株式会社 | 培養細胞解析システム、培養細胞解析方法、及び、プログラム |
| JP7489054B2 (ja) | 2017-10-03 | 2024-05-23 | 公立大学法人大阪 | 細胞の取得方法、および細胞の培養方法 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2005278564A (ja) | 細胞培養装置 | |
| JP6424447B2 (ja) | 細胞培養方法、及び細胞培養システム | |
| JP6719387B2 (ja) | 自動細胞培養及び回収装置 | |
| EP2623587B1 (en) | Apparatus and method for automated replacement of culture medium and performing toxicity assays on live cells | |
| JP6664692B2 (ja) | 接着系細胞用の閉鎖系培養容器 | |
| CN101370928A (zh) | 细胞培养方法以及使用该方法的自动培养装置 | |
| JP4586192B2 (ja) | 細胞培養チャンバー | |
| US11261416B2 (en) | Fixed-bed bioreactor with constant-flow pump / tubing system | |
| JP2015188391A (ja) | 細胞培養方法、及び細胞培養システム | |
| JP2008079554A (ja) | 閉鎖系の細胞回収装置及び細胞培養装置並びに細胞の回収方法及び培養方法 | |
| JP4928831B2 (ja) | 自動培養装置 | |
| JP5558560B2 (ja) | バイオリアクターシステム | |
| JP2010011747A (ja) | 細胞培養容器および細胞培養方法 | |
| EP2862922A1 (en) | Cell culturing vessel, and cell culturing method and automated cell culturing device using same | |
| WO2017056695A1 (ja) | 細胞培養装置 | |
| JP2023538404A (ja) | バイオリアクタベースのクリーンミート生産用処理システム | |
| JP7016371B2 (ja) | 接着細胞培養基質サンプリングデバイス | |
| US20220411739A1 (en) | Genetically modified cell production system | |
| JP2006204263A (ja) | 培養容器および培養方法 | |
| JP2017046592A (ja) | 細胞培養容器および細胞継代培養システム並びに細胞継代培養方法 | |
| JP2005295969A (ja) | 細胞分離装置 | |
| JP5101819B2 (ja) | 細胞培養装置 | |
| US20260022325A1 (en) | Cell manufacturing on an autonomous platform | |
| McCoy | Isolation of smooth muscle cells from bladder for generation of engineered urologic organs | |
| JPWO2018105078A1 (ja) | 細胞培養方法、培養容器及び細胞培養装置 |