JP2004538447A - 動力学アッセイ - Google Patents
動力学アッセイ Download PDFInfo
- Publication number
- JP2004538447A JP2004538447A JP2002589514A JP2002589514A JP2004538447A JP 2004538447 A JP2004538447 A JP 2004538447A JP 2002589514 A JP2002589514 A JP 2002589514A JP 2002589514 A JP2002589514 A JP 2002589514A JP 2004538447 A JP2004538447 A JP 2004538447A
- Authority
- JP
- Japan
- Prior art keywords
- hapten
- linker
- conjugate
- large group
- ligand
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 C*C(C(CC1)[C@](C)(CC2)C1C(CCC1C(C(CC3)=*)SCCC(NCCCCCC(NC4=CC=CCC=C4)O)O)C2C13C=C)=O Chemical compound C*C(C(CC1)[C@](C)(CC2)C1C(CCC1C(C(CC3)=*)SCCC(NCCCCCC(NC4=CC=CCC=C4)O)O)C2C13C=C)=O 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54393—Improving reaction conditions or stability, e.g. by coating or irradiation of surface, by reduction of non-specific binding, by promotion of specific binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07J—STEROIDS
- C07J33/00—Normal steroids having a sulfur-containing hetero ring spiro-condensed or not condensed with the cyclopenta(a)hydrophenanthrene skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07J—STEROIDS
- C07J43/00—Normal steroids having a nitrogen-containing hetero ring spiro-condensed or not condensed with the cyclopenta(a)hydrophenanthrene skeleton
Abstract
平衡に近づかない、動力学に基づいたアッセイである迅速アッセイで使用する、一般式X−W−Y−Zを有するハプテン−リンカー−大型グループのコンジュゲートである(式中、Xはハプテンであり、Wは任意選択でチオエーテルまたはエーテル基であり、Yは10個以上の原子長のリンカーであり、Zは、Yが存在しない場合にXのリガンドへの結合に対して立体障害を与えるのに十分なサイズの大型グループである)。また、このコンジュゲート、アッセイ方法およびキットを作成する方法も提供される。本発明のコンジュゲート[(5)−OVA]を利用した本発明のアッセイは、より短いリンカーを有するコンジュゲート[(2)−OVAおよび3−OVA]を用いた同じアッセイより優れた感度を提供する。
Description
【技術分野】
【0001】
(発明の分野)
本発明は、小さいサイズのハプテン、より詳細には固定したまたは可動な免疫反応物質としての他の大分子とのコンジュゲート、および迅速アッセイ、具体的には免疫アッセイ、特にラテラルフロー試験またはストリップ試験、フロースルー形式およびフロー免疫センサーにおけるその使用に関する。
【0002】
(背景技術)
迅速なラテラルフローストリップ試験またはフロー免疫センサーは、利用しやすい形式であること、通常のELISAアッセイに比べて試験結果を得るまでの処理時間が比較的短いこと、および長期安定性を含めた多くの利点を有する。またこれらは比較的安価で作成される。
【0003】
ステロイドや薬物など小さいサイズのハプテンの免疫アッセイには一般的にいわゆる競合技術が必要である。コーティング抗原として、ハプテンは通常、捕獲ドットまたはラインとしてストリップ膜などの固相にコーティングして、色素、酵素または粒子にコンジュゲートした抗体と反応させ;あるいは、色素もしくは他の発色性粒子で標識し、可動な免疫反応物質として使用して、有色ドットを形成し、または免疫複合体を固相上に固定した抗体と結合させる。どちらの構造でも、固相に固定したまたは可動な免疫反応物質としてコーティングした抗原は、限られた数の抗体結合部位において遊離の試料抗原と競合する。したがって、捕獲ライン中のハプテン/抗体結合能力は、検出可能なハプテンの濃度範囲を、したがって免疫アッセイの感度を決定する重要な判断基準である。
【0004】
小さなハプテンは、サイズが小さいため、ハプテン特異的抗体に対する結合親和性を保持させたままでストリップ膜や粒子など固相上に直接吸着させることは不可能である。したがって、小さなハプテンを固相に固定するためには、タンパク質にコンジュゲートさせなければならない。付着の中間体としても使用できるN−ビニルピロリドンコポリマー(米国特許第5,723,344号)や核酸断片(米国特許第5,849,480号)など他の物質もいくつか存在するが、最も広く使用されている固相上の小さいサイズのハプテンの固定化技術は依然として、従来のタンパク質コンジュゲーション、すなわちハプテン−タンパク質コンジュゲートの調製である(Clinica Chimica Acta、162、1987、199〜206)。
【0005】
反応性、すなわちハプテンに対する抗体の結合特異性に影響を与える最も重要な要素の1つが立体効果であることが一般的に受け入れられている。一部の文献は、伸長した柔軟なストレプトアビジン/ビオチン「架橋」によって(Immunology Letters、13、1986、313〜316およびJ. Immunological Methods、111、1988、271〜275)、あるいは長く伸長したリンカーによって(Bioconjugate Chem.、 7、1996、88〜95)、共有結合で固相にコンジュゲートさせた抗体の結合性が高くなることを報告している。異なるリンカーを介して大きなタンパク質抗原を固体の支持体に付着させた場合にも抗体の抗原捕獲能力が向上した(J. Immunological Methods、55、1982、1〜12)。ハプテン−スペーサー−タンパク質コンジュゲートの概念はいくつかの特許にも現れている。スペーサーすなわちリンカーアームを介してハプテンを免疫原性担体タンパク質に付着させることにより、抗体の調製において免疫応答が改善されるかもしれない(米国特許第5,776,713号および米国特許第5,843,682号)。ハプテンと標識の間に伸長したリンカーを使用して様々な酵素または他のトレーサーで標識したハプテンは、より容易に認識され、ハプテンに対する抗体によってより密接に結合され、また、酵素活性や他のトレーサーの特性をよく保持している(米国特許第5,298,403号、米国特許第5,578,457号および米国特許第5,834,206号)。コンジュゲートの合成におけるこのような目的のためにリンカーグループを有する二官能性試薬も使用した(米国特許第5,595,741号)。リンカーグループを有する薬物ハプテン−担体タンパク質コンジュゲートの構築は、抗体による認識が最適であり、したがって、従来の他の薬物とのより優れた同時療法的な用法を有している(米国特許第5,876,727号)。米国特許第5,876,727号はまた、担体またはタンパク質から十分な距離だけハプテンを移動させて、抗体によるハプテンの最適な認識を可能にする利点を教示している。
【0006】
従来、プロゲステロンおよび同じ環構造を有する他の類似のステロイドハプテンを、そのb環の6位および7位で他の分子に付着させていた(G.Hatzidakis、 A.StefanakisおよびE.Krambovitis、1993、「Comparison of Different Antibody-Conjugate Derivatives for the Development of Sensitivity and Specific Progesteron Assay」、Journal of Reproduction and Fertility、97、ページ557〜561)。
【0007】
本出願者らは今回、驚くべきことに、比較的短い時間のアッセイで、小さいサイズのハプテンを捕獲するリガンドの能力が、多くの迅速アッセイ、具体的にはラテラルフローストリップ試験やフローイムノセンサーなど免疫アッセイに対して感度を有するように高められることを発見した。これは、ハプテンと、タンパク質などハプテンが付着している大型グループ(large group)との間にリンカーを使用することによる従来のELISAには、特に適していない。
【0008】
本発明の目的は、ハプテン−リンカー−大型グループのコンジュゲートを利用する迅速アッセイを提供すること、あるいは少なくとも有用な選択肢を社会に提供することである。
【0009】
(発明の概要)
第1の態様では、本発明は平衡に近づかない動力学に基づいたアッセイである迅速アッセイで使用する、一般式X−W−Y−Zで表されるハプテン−リンカー−大型グループのコンジュゲートを提供する。
(式中、
Xは、ハプテンであり、
Wは、任意選択でチオエーテルまたはエーテル基であり、
Yは、10個以上の原子長のリンカーであり、
Zは、Yが存在しない場合にXのリガンドへの結合に対して立体障害を与えるのに十分なサイズの大型グループである)
好ましい実施形態では、Xは式IのA環構造を有する多環の融合環ハプテンである。
【0010】
【化1】
式中、RはH、CH3およびCH2OHを含む群から選択され、破線は隣接するB環構造の環員を示し、R1はリンカーYの付着点である。
【0011】
より好ましい実施形態では、Xは式IIのハプテンである。
【0012】
【化2】
式中、
Rは、H、CH3およびCH2OHを含む群から選択され、
R1は、リンカーYの付着点であり、
R2は、HまたはOHであり、
R3は、オキシ、C1〜C2アルキルまたはメチルカルボニルが任意選択でヒドロキシによって置換されている、オキシ、C1〜C2アルキル、ヒドロキシ、およびメチルカルボニルを含む群から選択され、
R4は、水素またはヒドロキシである。
【0013】
さらなる態様では、本発明は、
a)ハプテンを結合する能力があるリガンドを試験試料と接触させるステップと、
b)ステップa)のリガンドを、このリガンドに特異的な本発明のハプテン−リンカー−大型グループのコンジュゲートとさらに接触させるステップと、
c)リガンドに結合した、コンジュゲートしていないハプテンの量を決定するステップと
を含む、試料中のハプテンを検出するための、平衡に近づかない、動力学に基づいたアッセイである迅速アッセイ法を提供する。
【0014】
好ましくは、リガンドを接触させる第2ステップ(b)により、過剰の結合していないリガンドのほとんどが接触され結合される。
【0015】
好ましくは、ハプテン−リンカー−大型グループのコンジュゲートは固定されている。
【0016】
好ましい実施形態では、ステップa)の混合物をステップb)のハプテン−リンカー−大型グループのコンジュゲートの上に流す。
【0017】
さらなる態様では、本発明は、
a)本発明のハプテン−リンカー−大型グループのコンジュゲートを試験試料と混合するステップと、
b)生じた混合物をこのハプテンを結合する能力があるリガンドと接触させるステップと、
c)リガンドに結合したコンジュゲートしていないハプテンの量を決定するステップと
を含む、試料中のハプテンを検出するための、平衡に近づかない動力学に基づいたアッセイである迅速アッセイ法を提供する。
【0018】
好ましくは、リガンドは固定されている。
【0019】
好ましい実施形態では、生じた混合物を固定したリガンドと接触させるステップb)は、フローオーバーまたはフロースルーシステムによって行われる。
【0020】
さらなる態様では本発明は少なくとも
ハプテンに結合するリガンドと、
本発明のハプテン−リンカー−大型グループのコンジュゲートと
を含む、平衡に近づかない動力学に基づいたアッセイである迅速アッセイのキットを提供する。
【0021】
好ましくは、このキットは指示薬をさらに含む。一実施形態では、この指示薬はハプテン−リンカー−大型グループのコンジュゲートに結合している。代替実施形態では、この指示薬はリガンドに結合している。
【0022】
一般的にキットはフローオーバーまたはフロースルーアッセイキットであってよい。典型的なフロースルーキットは試験ストリップを含む。
【0023】
別の態様では、本発明のハプテン−リンカー−大型グループのコンジュゲートを、コンジュゲート内のハプテンと結合する能力があるリガンドと、反応が平衡に近づかない所定の時間接触させるステップを含む、本発明のハプテン−リンカー−大型グループのコンジュゲートをリガンドに結合させる方法を提供する。
【0024】
リガンドは固定されていることが好ましい。好ましい実施形態では、このリガンドはタンパク質−ハプテンのコンジュゲートと接触する前にはハプテンに結合していないことが好ましい。
【0025】
別の態様では本発明は少なくとも
a)極性有機溶媒に溶かした活性化されたステロイドハプテンを、1〜10モル等量の異種二官能性水溶性リンカーを含む水溶液と混合するステップと、
b)混合物を反応させるステップと、
c)ステップb)のハプテン−リンカー反応生成物の残りの遊離官能性リンカーグループに大型グループを付着させるステップと
を含む、本発明のハプテン−リンカー−大型グループのコンジュゲートを生成する方法を提供する。
【0026】
(図面の簡単な説明)
本発明は広くは上に定義したとおりであるが、それだけに限定されるものではなく、以下の説明によって例が提供される実施形態も含められることは、当業者には理解されよう。さらに、添付の図を参照することによって本発明をより良く理解することができる。
【0027】
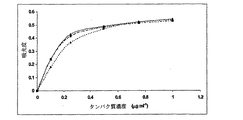
図1は、伸長した長さのリンカーを有する4−プロゲステロン誘導体の合成を示す。
【0028】
図2は、様々な長さのリンカー(4個、11個、または18個の原子のリンカー)を有する、1つの7α−プロゲステロン−OVAコンジュゲート[(2)−OVA]および3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVAおよび(7)−OVA]の構造を示す。
【0029】
図3は、類似の抗体(MoAb)結合曲線を有する、4−および7α−プロゲステロン−OVAコンジュゲート[(2)−OVAは下の曲線、(3)−OVAは上の曲線]のどちらもを示す。
【0030】
図4は、抗体(MoAb)と(3)−OVAコンジュゲート(上の曲線)および(2)−OVAコンジュゲート(下の曲線)との標準曲線を示す。
【0031】
図5は、類似の抗体(MoAb)結合性能を有する3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]を示す。
【0032】
図6は、抗体(MoAb)と3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVA、(7)−OVA]との、非常に類似した標準曲線を示す。
【0033】
図7は、免疫金にコンジュゲートした抗体(MoAb)とラテラルフロー試験ストリップ上にコーティングした3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)−OVAは中段のストリップ、(7)−OVAは下段のストリップ]との、様々な結合性能を示す。
【0034】
図8は、図7の走査計測分析(scannometric analysis)[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]の結果を示す。
【0035】
図9は、固定したモノクローナル抗体と、3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)−OVAは中段のストリップ、(7)−OVAは下段のストリップ]の免疫金複合体との、様々な結合性能を示す。
【0036】
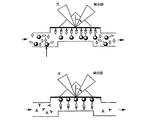
図10は、小さなハプテン用のバイオドットフロースルー免疫アッセイ形式の2ステップの設計を示す。
【0037】
図11は、金表面に固定した抗体または本発明のハプテン−リンカー大型グループのコンジュゲートを使用した、小さなハプテン用の表面プラズモン共鳴(SPR)フロー免疫センサーの2つの設計を示す。
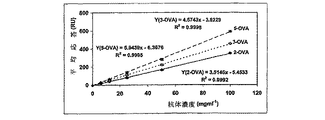
【0038】
図12は、4つのプロゲステロン−OVAコンジュゲート[(2)−OVA、〜12RU;(3)−OVA、〜50RU;(5)−OVA、〜150RU;(7)−OVA、〜225RU]と固定したモノクローナル抗プロゲステロン抗体(MoAb)との様々な結合性能を、SPRバイオセンサーによって示す。
【0039】
図13は、3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]を固定したバイオセンサー表面を使用した、抗体結合応答を示す。
【0040】
図14は、3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]バイオセンサー表面を使用した、プロゲステロンの競合免疫アッセイの標準曲線を示す。
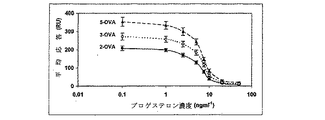
【0041】
図15は、競合SPRに基づいた免疫アッセイから得られたプロゲステロンの検出の直線範囲0.1〜10ng.ml-1を示す図である。
【0042】
図16は、18個の原子のリンカー有するテストステロン−4−OVAコンジュゲートの生成方法を示す。
【0043】
図17は、様々な長さのポリエチレングリコールリンカーを有するプロゲステロン−4−OVAコンジュゲートの生成の設計を示す。
【0044】
(発明の詳細な説明)
本発明の開示では、「迅速アッセイ」とは、アッセイ成分を混合した場合に、このアッセイから有意義な結果が得られる前に平衡状態に近づく必要がない反応を有するアッセイ成分によって、特徴付けられている。本発明は、アッセイを実行している期間中にアッセイ成分の反応が平衡に近づかない、迅速アッセイに特に適している。このような迅速アッセイは、非平衡の、動力学に基づいたアッセイである。通常、このアッセイは実施に20分未満、より適切には10分未満しかかからないはずである。
【0045】
「大型グループ」とは、10個の原子長未満のリンカーをリガンドとハプテンの間に挿入した場合に、付着したハプテンのリガンドへの結合に対して有意な立体障害を引き起こすのに十分なサイズのグループである。通常、本発明では、大型グループはタンパク質またはポリペプチドである。あるいは、この大型グループは、蛍光色素、たとえばビリルビンなどの指示薬である。
【0046】
一実施形態では、コンジュゲートの大型グループはタンパク質である。このタンパク質は、好ましくは安価であり、ハプテンとコンジュゲートするための多数のリジンを含む、容易に入手可能な任意のタンパク質である。当分野の適切なタンパク質の例には、ウシ血清アルブミン(BSA)、卵白アルブミン(OVA)、キーホールリンペットヘモシアニン(KLH)が含まれる。タンパク質には、酵素、分泌タンパク質、球状タンパク質が含まれ得る。本発明中で使用するための好ましいタンパク質は卵白アルブミン(OVA)である。タンパク質が酵素である場合、アルカリホスファターゼ、グルコースオキシダーゼ、西洋ワサビペルオキシダーゼ、アミンを富化した西洋ワサビペルオキシダーゼを含む群から選択されることが好ましい。
【0047】
「ハプテン」とは、検出するために選択される分子である。最も一般的には、このハプテンは、抗体と特異的に反応し、それ自体では免疫応答を誘発させる能力がないが抗原性の担体と複合体を形成すると免疫原性になる、低分子量有機化合物である。本発明で対象となるハプテンは、それだけには限定されないが、炭化水素、ポリヌクレオチド、ステロイド、ステロイド類似体、ポリペプチド(ペプチドホルモンなど)、薬物および毒素を含む群から選択される。
【0048】
ハプテンが、プロゲステロンまたはプロゲステロンに類似のA環構造を有する分子などステロイドである場合は、ハプテンの結合がA環構造の4位で起こることが好ましい。ステロイドプロゲステロンのC−4位でのタンパク質コンジュゲート部位が良好なアッセイ感度を有することが見出された。これまでに、文献では、プロゲステロン分子とタンパク質の一般的なコンジュゲート部位のほとんど(3、6β、7αおよび11α位)が調査され、最も感度の高いEIAアッセイの結果は、ステロイドの6βまたは7α位のどちらかを使用することによってしか得られなかった(Journal of Reproduction and Fertility、97、1993、557〜561)。4−プロゲステロン誘導体は、より簡単に合成され、6βや7α類似体に比べて立体異性体の問題がない。これにより、プロゲステロンの4位、またはプロゲステロンと同じA環構造を有する他のステロイドの4位が、6βや7α位に代わる、優れた代替タンパク質コンジュゲート部位となる。しかし他の結合部位の使用も除外されない。
【0049】
好ましい実施形態では、このハプテンは以下を含む群から選択される。
【0050】
【化3】
最も好ましくは、このハプテンはプロゲステロンである。
【0051】
本明細書中で使用する「リガンド」は、抗原を結合する能力を有する任意の分子でよい。好ましくは、これは標的に特異的に結合する能力のある免疫グロブリン分子である。このような抗原標的には上記のハプテンが含まれる。リガンドには、完全な抗体だけでなく、その断片、たとえばFab、(Fab)2、Fv、単鎖(ScFv)、それらの変異体、抗体部分を含む融合タンパク質、および必要な特異性の抗原認識部位を含む免疫グロブリン分子の他の任意の改変した構造が包含される。代替実施形態ではこのリガンドはT細胞受容体でよい。
【0052】
リンカーは、好ましくは10〜50個の原子長、より好ましくは11〜24個の原子長、最も好ましくは11〜18個の原子長の鎖を含む。当分野で周知の任意の適切なリンカーを使用することができる。リンカーは、ハプテンのリガンドへの結合に対する立体障害が最小限であることを保証するために、ハプテンに近位のかさ高くない基であるべきである。また、この鎖が炭素に基づいたものであることが好ましい。この炭素に基づいた鎖は、N、S、Oから選択された1つまたは複数の異種原子を含んでいてもよい。他の側鎖置換基を提供してもよい。
【0053】
好ましい鎖は、アミノ酸鎖、ポリエチレングリコール鎖、アルキル、アルケニル、核酸、および多糖を含む群から選択される。異種原子はアミノ基の一部でもよい。この鎖は、1つまたは複数、好ましくは3つ以下の不飽和部位を有することができる。アミノ酸断片を鎖に取り込んでもよい。ホモロゲーションによって複数のアミノ酸断片を提供してもよい。リンカーとしてハイブリッドペプチド−核酸断片を使用することも企図される。
【0054】
本発明者らは、立体障害を減らすための最適なリンカーの長さは約18個の原子であることを見出した。それ以降は、性能は最小限しか向上されないが、より長いリンカーを組み込むことによって混乱が生じる。明らかに、本発明の実施に18個の原子より長いリンカーを使用してもよいが、これは好ましくない。
【0055】
好ましい実施形態では本発明のコンジュゲートは式IIIまたは式IVによって表される。
【0056】
【化4】
【0057】
【化5】
(式中、XおよびZは上に定義したとおりである)
一実施形態では本発明のコンジュゲートは以下のものである。
【0058】
【化6】
別の実施形態では、本発明の好ましいコンジュゲートは図2に示す(5)−OVAおよび(7)−OVAである。
【0059】
当分野で周知の任意の手段によってこのリンカーをハプテンとタンパク質に付着させることができる。好ましい方法には、(たとえばタンパク質上のアミン、カルボキシルまたはスルフヒドリル基への)共有結合反応、核酸ハイブリダイゼーション、またはリガンド相互作用による方法が含まれる。
【0060】
ステロイドをリンクグループに共有結合させるためには、多くの場合、チオエーテルまたはエーテルの架橋基、好ましくはチオエーテル基を含むことが必要である。
【0061】
固相が必要な場合は、リガンドまたはハプテン−リンカー−大型グループのコンジュゲートを固相に固定することができる。リガンドとハプテン−リンカー−大型グループのコンジュゲートの量が事前に決定されていることが好ましい。また、リガンドに比べてタンパク質−コンジュゲートが過剰量あることが好ましい。
【0062】
リガンドおよびハプテン−リンカー−大型グループのコンジュゲートのどちらもが、ハプテンを定性分析および定量分析するためのコンジュゲートの迅速な検出を可能にするために、検出システムでの使用に適した指示薬をさらに含むことができる。
【0063】
本発明での使用に適した多くの検出システムが当分野に存在する。当分野の技術者は、周知の方法を使用してタンパク質の結合を検出することができる。様々な免疫アッセイ手順は、「Immunoassays for the 80's」、 A. Voller.他編、University Park, 1981に記載されている。これには、酵素検出システム、色素(蛍光マーカー、有色イオンや錯体など)、金属または非金属の有色粒子(免疫金や着色ラテックスビーズなど)、および取り込まれた放射性同位元素(たとえばシンチレーション計数によって検出される)が含まれる。
【0064】
好ましい実施形態では、安価で比較的安定であるので免疫金粒子が使用される。標識した抗体を検出するのに使用してもよい適切な酵素には、それだけには限定されないが、ブドウ球菌ヌクレアーゼ、δ−5−ステロイドイソメラーゼ、酵母菌アルコール脱水素酵素、α−グリセロリン酸脱水素酵素、トリオースリン酸イソメラーゼ、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ、アスパラギナーゼ、グルコースオキシダーゼ、β−ガラクトシダーゼ、リボヌクレアーゼ、ウレアーゼ、カタラーゼ、グルコース−6−リン酸脱水素酵素、グルコアミラーゼおよびアセチルコリンエステラーゼが含まれる。
【0065】
抗体を放射標識することにより、放射性免疫アッセイ(RIA)を使用してそれを検出することが可能になる(たとえば、Work, T.S.他、「Laboratory Techniques and Biochemistry in Molecular Biology」、North Holland Publishing Company、ニューヨーク、1978参照)。この放射性同位元素は、γ線計数器やシンチレーション計数器の使用、またはオートラジオグラフィーによる手段などによって検出することができる。本発明の目的に特に有用な同位元素は、3H、14C、35S、125Iおよび131Iである。
【0066】
蛍光標識は本発明の範囲内にある。蛍光標識した抗体を適切な波長の光に暴露させた場合、蛍光によってその存在を検出することができる。最も一般的に使用される蛍光標識化合物には、フルオレセインイソチオシアネート、ローダミン、フィコエリスリン、フィコシアニン、アロフィコシアニン、o−フタルアルデヒド、フルオレスカミン、ビリルビンがある。
【0067】
また、この抗体を152Euなどの蛍光放射金属またはランタニド系列の他のものを使用して検出可能に標識することもできる。ジエチレントリアミン五酢酸(DTPA)やエチレンジアミン四酢酸(EDTA)など金属キレート化グループを使用してこれらの金属を特定の抗体に付着させることができる。
【0068】
この抗体はまた化学発光化合物に結合させることによって検出可能に標識することができる。その後、化学反応の過程中に生じる発光の存在を検出することによって化学発光で標識した抗体の存在を決定する。特に有用な化学発光標識化合物の例は、ルミノール、イソルミノール、セロマチック(theromatic)アクリジニウムエステル、イミダゾール、アクリジニウム塩およびシュウ酸エステルである。
【0069】
同様に、生物発光化合物を使用して抗体を標識してもよい。生物発光とは、触媒タンパク質が化学発光反応の効率を高める、生物系内で見つかる化学発光の一種である。生物発光タンパク質の存在は、発光の存在を検出することによって決定される。標識の目的で重要な生物発光化合物は、ルシフェリン、ルシフェラーゼおよびエクオリンである。
【0070】
抗体の検出は、たとえば検出可能な標識が放射性γ線放射源である場合はシンチレーション計数器によって、あるいは、たとえば標識が蛍光物質である場合は蛍光光度計によって行うことができる。
【0071】
酵素標識の場合、酵素の基質を使用する比色法によって検出を行うことができる。また、基質の酵素反応の程度を同様に調製した標準と比較する目視比較によって、検出を行うこともできる。
【0072】
抗体の結合活性は、周知の方法に従って決定することができる。当分野の技術者は、日常的な実験を用いることによって、それぞれの測定(determination)に有効で最適なアッセイ条件を決定することができる。本発明で企図される方法は、動力学に基づくものである。平衡に基づくシステムは、本発明の目的では企図されない。
【0073】
試験化合物を加えない、陽性対照アッセイを実施してもよい。
【0074】
一実施形態では、このハプテン−リンカー−大型グループのコンジュゲートは、図2に示したとおりである。
【0075】
本発明のコンジュゲートは、多くの様々な迅速免疫アッセイでの使用に適している。
【0076】
したがって、さらなる態様では、本発明は、本発明のコンジュゲートを、コンジュゲート内のハプテンに特異的なリガンドに結合させる方法を提供する。この結合ステップは一般的に、迅速なフローオーバーまたはフロースルー方式で、固相の表面上で行われる。
【0077】
固相を使用する場合は、リガンドまたはハプテン−リンカー−大型グループのコンジュゲートのどちらかを固定することができる。好ましくは、ハプテン−リンカー−大型グループのコンジュゲートを固体の支持体に固定する。本発明の範囲内で使用できる固体の支持体は、それだけには限定されないが、主に、ポリスチレン、ポリプロピレン、ポリエステル、ポリアクリロニトリル、ポリ塩化ビニル、ポリビニリデン、ポリスルホン、ポリアクリルアミド、セルロース、硝酸セルロース、架橋デキストラン、フッ化樹脂、アガロース、架橋アガロース、および多糖からなる群から選択される不溶性の高分子物質を含む。
【0078】
しかし、さらに、ガラス、ガラス繊維、ガラスビーズ、金属、ナイロンメッシュ物質、ナイロン膜、金属、金属ストリップおよび金属ビーズなど他の物質を使用することも考えられる。好ましい固体の支持体は、膜、ビーズ、マイクロプレート固体支持体、試験管、マイクロタイタープレート、ディップスティック、ラテラルフロー装置、樹脂、PVC、ラテックスビーズおよびニトロセルロースから選択される。担体の性質は本発明の目的ではある程度可溶性または不溶性とすることができる。支持体の形状は、ビーズのように球状、試験管の内部のように円柱状、または棒の外部表面であってよい。あるいは、表面は、シート、試験ストリップなどのように平坦でもよい。当分野の技術者は、抗体や抗原を結合する多くの他の適切な担体を知っており、または日常的な実験を用いることによってこれを確認することができるであろう。
【0079】
この固体表面は膜であることがより好ましい。
【0080】
支持体が金属である場合は、これが、金やプラチナなどバイオセンサーの表面としての使用に適した金属であることが好ましい。
【0081】
固体の支持体への固定は、受動吸着、共有結合、またはアビジン/ビオチン複合体などリガンドの相互作用を介したものによる固定でよい(たとえば米国特許第4,467,031号、Galati他)。
【0082】
本出願者らは、予想外なことに、より長いリンカーを有するこれらのハプテン−リンカー−大型グループのコンジュゲートが、迅速アッセイにおいて、従来のハプテン−リンカー−大型グループのコンジュゲートに比べて相当の利点を有することを見出した。競合ELISAタイプのアッセイで使用した場合はこのコンジュゲートの性能は従来のコンジュゲートと同等であるので、これは特に驚くべきことである。
【0083】
特定の理論に拘泥するものではないが、迅速免疫アッセイにおける従来のタンパク質−ハプテンコンジュゲートの感度の低さは、固定した抗体との免疫複合体を形成する際の立体障害が原因であることが提唱された。したがって、迅速アッセイの感度を上げるためには、結合率に対する立体障害を最小限にするシステムが必要であると思われる。本発明のハプテン−リンカー−大型グループのコンジュゲートはこの目的を果たしていると思われる。
【0084】
特定の理論に拘泥するものではないが、本発明者らは、本発明の実施例で実証された、高められたハプテン抗体結合の動力学は、そこで提示する特定の実施形態の2つの主要な要素によって促進されることを提唱した。
【0085】
1.リンカーがステロイドA環の4位に結合すること;および
2.リンカーの長さが、ハプテンとタンパク質が互いに、迅速なリガンドによるハプテンの認識およびリガンドのハプテンへの結合に対して立体障害がないような長さであること。このハプテンとタンパク質は、互いに対して自由な運動が与えられており、したがって、リガンドのハプテンへの結合の迅速な認識が可能となっていると考えられる。
【0086】
本発明者らは、免疫アッセイのために、プロゲステロンの6βおよび7α以外の他のコンジュゲーション部位を調査した。本発明者らによって、プロゲステロンのC−4位がプロゲステロンの6β位に代わる、優れた代替コンジュゲーション部位であることが見出された。ELISAでは、プロゲステロン−4−OVA(1−OVA)およびプロゲステロン−7α−OVAコンジュゲート(2−OVA)のどちらも類似の抗体結合性能を有する。驚くべきことに、SPRなど動力学に基づいた免疫アッセイでは、プロゲステロン−4−OVAコンジュゲートはプロゲステロン−7α−OVAコンジュゲートより優れた抗体結合を示す。しかし、6β−および7α−プロゲステロン誘導体に比べて、C−4位のプロゲステロン誘導体の合成はより簡単であり、ステロイドの4,5−二重結合によってC−4位ではプロゲステロン誘導体の立体異性体が1つしか提供されないので、立体異性体の問題がない。
【0087】
最近、伸長した長さの異種二官能性リンカーを使用することによって捕獲抗体とアルカリホスファターゼ標識またはその微小粒子との間の距離が長くなれば抗体結合シグナルが増大することが見出された。この増大は一般的なバイオコンジュゲートの2成分(entity)間の距離が増加した結果と見なされている。本発明者らは、ELISAでコーティング抗原として使用した場合は、プロゲステロン−4−OVAコンジュゲート内のリンカーの長さ(4、11または18個の原子長)は、その抗体結合性能に有意な効果を及ぼさないことを見出した。短い時間(20分)の抗体結合実験では、長いリンカーを有するコンジュゲート(4−および6−OVA)は、短いリンカーを有するOVA−コンジュゲート(1−OVA)に比べてむしろ僅かに悪かった。したがって、異なる長さのリンカー(4〜18個の原子)を有する3つのプロゲステロン−4−OVAコンジュゲートは、ELISAでは同じプロゲステロンアッセイ感度を有している。
【0088】
以前の研究によりシグナルの増大が必ずしもリンカーの長さに比例するとは限らないことが示されている。たとえば、酵素−抗体コンジュゲート中のリンカーの長さを9個の原子から23個の原子に増加した場合はシグナルが64%増加し、30個の原子長のリンカーでは82%増加した。しかし、16個の原子のリンカーを有する同じ酵素−抗体コンジュゲートは、より長いリンカー(23個の原子)を有するコンジュゲートより僅かに優れた抗体結合性能を有していた。これらの結果は、シグナルを増大させるためには、抗体と他の成分との間のリンカーの理想的な長さは、関与する2つの成分のサイズおよびバイオコンジュゲートが形成される方法に依存することを示唆している。従来技術では、2つの大きな成分間で、すなわち抗体と酵素または微小粒子とでバイオコンジュゲートが構築される。リンカーは、抗体を標識する目的のみで使用され、抗体−抗原の結合部位と同じ側には直接関与していなかった。しかし本発明のプロゲステロン−OVAコンジュゲートは全く異なっている。これらは、大きなタンパク質(OVA)と非常に小さな成分、すなわちプロゲステロン分子(分子量314)を用いて構築される。この抗体/抗原結合部位にはリンカーも直接関与している。したがって、このバイオコンジュゲートは2つの異なるサイズの成分によって形成され、異なる方法で構築されているので、抗体結合性能に対するリンカーの長さの効果は、初期に報告された研究とは異なる可能性がある。本発明者らは、リンカーの長さも、様々なアッセイ形式、特に迅速アッセイにおける抗体結合に影響を与えることを発見した。
【0089】
本発明を実施するのに、いくつかの異なるアッセイタイプが有用であることが見出された。これらには、本明細書中に記載の試験ストリップアッセイ、ドットブロットアッセイ(ドット試験またはドット免疫結合アッセイとしても知られる)、SPRバイオセンサーなどフローイムノセンサーが含まれる。
【0090】
また本発明の免疫アッセイは、20分未満、より好ましくは10分未満、最も好ましくは5分未満で完了することが好ましい。
【0091】
好ましい試験ストリップイムノアッセイでは、長いリンカーを有する所定量のハプテン−リンカー−大型グループのコンジュゲートは、それを固定するための固体支持体の一部に固定されている。固体の支持体は通常、セルロースベースの膜、または少なくとも水ベースの溶媒の毛管移動が可能な支持体である。試験試料を膜支持体に施用し、標識した抗体と混合し、ハプテン−リンカー−大型グループのコンジュゲートによって固定された捕獲ラインに向かって迅速に移動させた。遊離試料ハプテンと結合した後、過剰の抗体は、捕獲ラインでハプテン−リンカー−大型グループのコンジュゲートと色バンドを形成する。リガンドとしての標識した抗体の量は、捕獲ラインの色強度によって定量的または定性的に決定される。本発明のハプテン−リンカー−大型グループのコンジュゲートと結合する標識した抗体リガンドが少ないほど、試験試料中に多くのハプテンが存在する。
【0092】
他の試験ストリップを形成することもできる。一実施形態では、試験試料を本発明の標識したタンパク質−ハプテンコンジュゲートと混合する。標識したハプテン−リンカー−大型グループのコンジュゲートおよび遊離ハプテンのどちらも、固定した抗体リガンド上の結合部位において競合するために捕獲ラインに向かって移動する。色強度、すなわちハプテン−リンカー−大型グループのコンジュゲートの量は、試験試料中のハプテンの量に反比例している。
【0093】
上で論じた任意の標識を使用することができるが、標識したコンジュゲートは肉眼で見えることが好ましい。したがって好ましい標識は可視色素である。
【0094】
上記のストリップアッセイのどちらでも、本発明のタンパク質コンジュゲートは、短いリンカーを有するコンジュゲートに比べて、捕獲ライン内ではるかに優れた抗体結合性を有する。したがって、長いリンカーを有するコンジュゲートは、捕獲ライン内で比較的低い濃度の抗体を検出し、それによって迅速なストリップアッセイの感度を高めることができる。
【0095】
本発明の別の実施形態はバイオドットのフロースルー免疫アッセイを提供する。このような免疫アッセイではまず抗体などのリガンドを膜上に固定する。微量濾過装置によって試料ハプテンを膜に貫流させた後、本発明の標識したハプテン−リンカー−大型グループのコンジュゲートは残った抗体と反応して膜上に有色ドットを形成する。ドットの色強度、すなわちハプテン−リンカー−大型グループのコンジュゲートの量も、試験試料中のハプテンの量に反比例する。
【0096】
表面プラズモン共鳴(SPR)バイオセンサー技術は、抗体−ハプテン相互作用の特徴付けに非常に有用なツールである。これは小さいサイズのハプテンの迅速免疫アッセイ用に設計することもできる。一般的に、ハプテン−リンカー−大型グループのコンジュゲートまたはSPRで使用するリガンドのいずれかを、バイオセンサー表面上に共有結合により固定する。最も一般的には微量流動フローセル中を用いて、遊離試料ハプテン(分析物)と抗体リガンドとの混合物またはハプテン−リンカー−大型グループのコンジュゲートとの混合物をバイオセンサー表面上に流して、バイオセンサー表面上の限られた数の抗体結合部位において競合させる。SPR検出器はハプテン−抗体複合体形成の会合および解離によって誘発された表面近辺の溶媒層の屈折率の変化をモニターする。SPR検出器の感度はその分子量に比例するセンサー表面上の抗体−ハプテン複合体の屈折率に依存している。したがって、抗体とハプテン−リンカー−大型グループのコンジュゲートとの結合は、このタンパク質の分子量が大きいために、抗体と小さいサイズのハプテンとの結合による屈折率よりもはるかに高い屈折率によるSPR応答を与える。
【0097】
本発明のハプテン−リンカー−大型グループのコンジュゲートは試験したすべてのアッセイで利点を示した。固体の支持体上にコーティングした抗原としてハプテン−リンカー−大型グループのコンジュゲートを使用した場合、より長いリンカーを有するコーティングしたコンジュゲートでは、免疫金にコンジュゲートした抗体によって、ハプテン−リンカー−大型グループのコンジュゲートをより低濃度で検出できる。同時に、抗体を固定した場合、より長いリンカーを有するコンジュゲートは、抗体の検出限界がより低濃度である。
【0098】
ストリップアッセイでは、どちらのアッセイ構造も免疫クロマトグラフィーストリップ試験の感度を高める。より長いリンカーを有するこれら新規のハプテン−リンカー−大型グループのコンジュゲートに基づいて、比較的短い時間内で低濃度(<10ng/ml)の小さなハプテンを検出できる高感度の免疫クロマトグラフィーストリップアッセイ形式が開発された。本発明の長いリンカーを有するハプテン−リンカー−大型グループのコンジュゲートは、抗体/ハプテンの結合を強く阻害する、乳など脂質の含有量が高い試験試料のストリップアッセイで特に有用である。本発明のプロゲステロン−OVAコンジュゲートを使用することで、乳中のプロゲステロンの最低検出限界(LDL)は、視覚検査によって判断されるように約10ng/mlであり、これは文献値30ng/mlより低いLDLである(Acta Chemica Scandinavica、50、1996、141〜145)。この文献中では、ストリップ試験には、ストリップ試験毎に、正確な、フレッシュな金標識したプロゲステロン−OVAコンジュゲートを使用しなければならない。
【0099】
迅速なSPR(BIAcore)アッセイでは、長いリンカー(18個の原子)を有するハプテン−リンカー−大型グループのコンジュゲート(225応答ユニット)は、より短いリンカー(4個の原子)を有するコンジュゲート(50応答ユニットのみ)よりはるかに高い抗体結合性能が得られた。プロゲステロン分子の4−位のコンジュゲート(50応答ユニット)も、ちょうど同じ長さのリンカー(4個の原子)を有するプロゲステロンの7α−位のコンジュゲート(12応答ユニットのみ)より優れた抗体結合を示した。
【0100】
したがって、本発明は、試験ストリップ、試験ストリップを有するキット、およびハプテン−リンカー−大型グループのコンジュゲートの反応物質にまで及ぶ。
【0101】
本発明のキットは、上記の固定したリガンドを有する固体の支持体、および本発明の標識したハプテン−リンカー−大型グループのコンジュゲートを含むバイアルまたは容器を含む。
【0102】
キットのさらなる実施形態では、キットは、固定した本発明のハプテン−リンカー−大型グループのコンジュゲートを有する固体の支持体、およびハプテン−リンカー−大型グループのコンジュゲートに対する標識したリガンドを含むバイアルまたは容器を含んでもよい。
【0103】
本発明のキットの別の実施形態では、このキットは、上記の固定したリガンドを有する固体の支持体、およびハプテンを本発明のハプテン−リンカー−大型グループのコンジュゲートに変換する変換キットを含む容器のバイアルを含んでもよい。
【0104】
最も一般的には、このキットは、試験試料および標識したコンジュゲートを固体の支持体上で移動させるための溶媒、好ましくは水性溶媒をさらに含む。標識したコンジュゲートが肉眼で見えない場合は、標識したコンジュゲートの存在を検出する手段をキット中に提供してもよい。このキットは通常、好ましくは所定の試料および/またはコンジュゲートおよび/またはリガンドの体積を固体の支持体に運ぶための、アプリケーターを含む。
【0105】
本発明のハプテン−リンカー−大型グループのコンジュゲートは、以下によって生成することができる。
【0106】
1.ハプテンを上に定義したリンカーに結合させること。好ましくは、この結合は化学的共有結合反応による、あるいは、リンカーが核酸である場合は、核酸ハイブリダイゼーションによる結合である。
【0107】
2.リンカーの遊離末端をタンパク質など大型グループに結合させること。リンカーをタンパク質に結合させる周知の方法は、標準の参考文献(「Bioconjugation: Protein Coupling Techniques for the Biomedical Sciences」、Mohammed AslamおよびAlastair Dent編)から選択することができる。
【0108】
あるいは、リンカーをまずタンパク質に結合させ、その後同じ方法でハプテンに結合させることも可能である。
【0109】
d)極性有機溶媒に溶かした活性化されたステロイドハプテンを、1〜10モル当量の異種二官能性水溶性リンカーを含む水溶液と混合するステップと、
e)混合物を反応させるステップと、
f)ステップb)のハプテン−リンカー反応生成物の残りの遊離官能性リンカーグループに大型グループを付着させるステップと
を少なくとも含む、本発明のハプテン−リンカー−大型グループのコンジュゲートを生成する方法が提供される。
【0110】
この方法は、任意選択でステップb)とc)の間にハプテン−リンカー−生成物を単離する単離ステップを含んでもよい。
【0111】
好ましくは、最終混合物は2〜30%、より好ましくは5〜15%、最も好ましくは約10%の含水率を有する。
【0112】
ステップb)の反応時間は、好ましくはほぼ24時間程度までの時間、より好ましくは12時間未満、最も好ましくは3時間である。b)の反応は通常室温で起こる。好ましい実施形態ではb)の反応は実質的に中性のpHで起こる。
【0113】
好ましくはステップa)の水溶液は2〜5モル当量の異種二官能性の水溶性リンカーを含む。
【0114】
一実施形態では、活性化されたステロイドはステロイドの活性化されたエステルである。最も好ましい実施形態ではこれはステロイドのスクシンイミドエステルである。
【0115】
好ましくは、この異種二官能性リンカーは、カルボキシル、アミノ、チオール、ヒドロキシ、アルデヒド、および反応性ハロゲンを含む群から選択された2つの異なる官能基を有する。好ましい実施形態ではこの異種二官能基はカルボキシルおよびアミノである。
【0116】
反応性でない任意の極性有機溶媒を反応で使用することができる。この極性有機溶媒は、DMF、DMSO、アセトンおよびTHFから都合良く選択することができる。
【0117】
(産業上の利用)
したがって、本発明によれば、試験試料中のハプテンを検出するアッセイが提供される。このコンジュゲートは、試験試料中のハプテンが低濃度であるかつ/または脂質含量が高く、従来の免疫アッセイでは十分に、または迅速に検出できない場合に特に有用である。このアッセイは、in situでの試験のために形成した場合に特に有用である。このような商業的な応用の1つは、ウシの妊娠診断および発情の検出に使用できる、ウシの低レベルの乳プロゲステロンを迅速にその場で検出することである。
【0118】
以降、本発明を以下の非限定的な実施例に則して例示する。
【0119】
(実施例1)
様々な長さのリンカーを有する4つのプロゲステロン−OVAコンジュゲートの合成
(a)プロゲステロン4−メルカプトプロピオン酸(1)−および7α−メルカプトプロピオン酸(示さず)。これらの化合物は、文献(Steroids、53、1989、727〜738)の、11α−ヒドロキシプロゲステロン4−および7αメルカプトプロピオン酸の調製手順に従って調製した。
【0120】
(b)スクシンイミジルプロゲステロン4−メルカプトプロピオネート(3)。プロゲステロン4−メルカプトプロピオン酸の無水DMF溶液3ml 1(434.8mg、1.04mmol)に、1.0mlのDMFのジシクロヘキシルジイミド(235.7mg、1.14mmol)溶液を加え、次いで、1.0mlのDMFのN−ヒドロキシスクシンイミド(131.5mg、1.14mmol)溶液を加えた。この溶液を室温で終夜攪拌した。フラッシュカラムクロマトグラフィーの後純粋な生成物(3)が得られた。
【0121】
(c)スクシンイミジルプロゲステロン4−メルカプトプロピオネート(5)の合成。プロゲステロン4−スクシンイミジルエステル3(300mg、0.58mmol)を4mlの無水DMFに溶かした。この溶液に、0.3mlの脱イオン水中のε−6−アミノカプロン酸(229mg、0.91mmol)を加え、この反応混合物を室温で終夜攪拌した。精製後、反応からTLCプレート上の単一スポットとして白色の固体生成物4(収率63.6%)が得られ、これは、さらに精製せずに、そのスクシンイミジルエステル5の調製に直接使用した。化合物5は3の調製に類似の方法で調製した。
【0122】
(d)スクシンイミジルプロゲステロン4−メルカプトプロピオネート(7)の合成。3から4を調製する方法と類似の方法で化合物6を調製した。化合物5(157.6mg、0.25mmol)およびε−6−アミノカプロン酸(98.7mg、0.39mmol)を出発物質として、カラムフラッシュクロマトグラフィーの後に化合物6(収率57%)が得られた。5の調製と類似の方法で化合物7も調製した。化合物6(92.1mg、0.14mmol)を出発物質として、カラムフラッシュクロマトグラフィーの後、透明な無色の油として生成物7が得られた。上記の合成したプロゲステロン誘導体(1〜7)すべてを、ES−MSおよびNMR分析によって確認した。
【0123】
(e)タンパク質コンジュゲーション。一連のプロゲステロン−卵白アルブミンコンジュゲートを、プロゲステロン遊離酸(1を含む)または単離したプロゲステロンスクシンイミジルエステル(3、5および7)のいずれかから、以下のように調製した。
【0124】
化合物1(29.5mg、0.07mmol)のDMF(0.5ml)溶液に、0.1mlのDMF中のジシクロヘキシルジイミド(16.02mg、0.078mmol)および0.1mlのDMF中のN−ヒドロキシスクシンイミド(8.94mg、0.078mmol)を加えた。この溶液を室温で90分間攪拌し、その後この溶液をOVA(63.5mg、0.0014mmol)のリン酸緩衝液(7ml、pH7.0)溶液に加えた。このコンジュゲーション反応物を4℃で終夜攪拌した。それから試料をNaHCO3水溶液、脱イオン水、およびPBS/Tに対して透析した。PD−10カラムを用いてさらに精製した後、これら精製試料中のBCAアッセイで決定されたタンパク質量が、それぞれプロゲステロン−4−OVAは4.11mg ml-1、プロゲステロン−7α−OVAは4.02mg ml-1であることが分かった。
【0125】
単離した純粋なプロゲステロンスクシンイミジルエステル(3、5、および7)も、タンパク質のコンジュゲーションに直接使用した。0.019mmolのプロゲステロン活性エステル(3、5または7)の、0.2mlのDMFまたはDMSO溶液を、卵白アルブミン(17.1mg、0.38×10-3mmol)のリン酸緩衝液(1.5ml、pH7.0)溶液に、ゆっくり攪拌しながら加えた。これら3つのタンパク質コンジュゲートの精製は、既に上記した手順と同じ手順で実施した。同様にBCAタンパク質アッセイで決定したこれらプロゲステロン−4−OVAコンジュゲート中のタンパク質量は、それぞれ1.09mg ml-1(4個の原子のリンカー)、3.56mg ml-1(11個の原子のリンカー)、および4.12mg ml-1(18個の原子のリンカー)であった。このプロゲステロン−OVAコンジュゲートの平均コンジュゲーション度、すなわちタンパク質あたりのハプテン数は、各コンジュゲートで平均4個であると概算され、これは、MALDI TOF質量分析によって直接決定された。これらプロゲステロン−OVAコンジュゲートの構造を図2に示す。
【0126】
(実施例2)
プロゲステロン−OVAコンジュゲートをコーティング抗原として使用した直接または競合ELISA
直接ELISAによって、プロゲステロン−OVAコンジュゲートのMAbに対する結合反応性が決定された。NaHCO3(50mM、pH9.6)中の一連の濃度のプロゲステロン−4−または−7α−OVAコンジュゲートで、マクロタイタープレートを事前にコーティングした。MAbのPBS/T溶液(5μg ml-1、各ウェル100μl)を加えた。プレートを3時間室温で振盪し、4℃で終夜放置した。その後、プレートにペルオキシダーゼで標識した抗ラットIgG溶液を加えた。最後に、200μlの基質溶液を各セルに加え、30分後に50μlの1M H2SO4を加えることによって酵素反応を停止した。その後、15分後に450nmでプレートを読み取り記録した。4−および7α−プロゲステロン−OVAコンジュゲートの抗体結合曲線を図3および5に示す。
【0127】
NaHCO3(50mM、pH9.6)中のプロゲステロン−OVAコンジュゲートをコーティング抗原として(1μg ml-1、各ウェル100μl)、標準曲線を作成した(図4および6参照)。競合ELISAでは、様々な標準プロゲステロン(0.001〜1000ng ml-1)のPBS/T溶液(各ウェル100μl)、およびMAb(1μg ml-1)のPBS/T溶液(各ウェル100μl)を同時にプレートに加えた。他のすべてのELISA手順は、直接ELISAと同じように実施した。
【0128】
本発明者らは、異なる長さのリンカーを有し、プロゲステロン上のコンジュゲート部位が異なる(4−または7α)プロゲステロン−OVAコンジュゲートは、従来のELISAによる抗体結合性能に有意な効果を及ぼさないことを見出した。
【0129】
(実施例3)
モノクローナル抗体 ( MoAb ) または4−プロゲステロン−OVAコンジュゲートを用いた、免疫金複合体の調製
(a)コロイド金粒子(G40)の調製。この調製は類似の文献(Analyst、123、1998、2437〜2441)に従って実施した。
【0130】
(b)モノクローナル抗体−、または4−プロゲステロン−OVAコンジュゲートでコーティングしたコロイド金の調製。コロイド金(G40)溶液をK2CO3(0.02M)でpH=7.7に滴定した後、激しく渦攪拌しながら、pHを調整したコロイド金の溶液(10ml)に抗体(120μg)または4−プロゲステロン−OVAコンジュゲート(60μg)溶液(0.2ml)を加えた。その後、この免疫金溶液を20%OVAのPBS溶液(0.15ml)で遮断した。2%OVAで繰り返し洗浄し、6,000rpmで遠心分離した後、この免疫金溶液を4℃で、0.1%NaN3を含むホウ酸(NaB7O4)緩衝液(2mM、pH=7.2)中で保存した。
【0131】
(実施例4)
4−プロゲステロン−OVAコンジュゲートをコーティング抗原として使用した、またはモノクローナル抗体を試験ストリップ上に固定した、免疫クロマトグラフィーストリップ試験
ポリエステルの補助支持体(GL-187、G&L Precision Die Cutting,Inc.、米国)でラミネートしたニトロセルロース膜(AE100、Schleicher&Schuell、ドイツ)を切断してストリップ(4または5mm幅)にした。0.01%Tween−20水溶液で10分間遮断し、その後40℃で2時間乾燥させた後、このストリップを、抗プロゲステロンMAb溶液(各ストリップあたり0.5μl)、または4−プロゲステロン−OVAコンジュゲート溶液(各ストリップあたり0.5μl)のいずれかでコーティングし、このストリップを再度40℃で2時間乾燥させた。このストリップは終夜シリカゲルの容器内で保存した。
【0132】
(a)様々な濃度のOVA−プロゲステロンコンジュゲート溶液でコーティングしたストリップでは、マイクロウェル中の半分のストリップの処理溶媒は以下のとおりである
15μlの、PBS中の1%Tween−20
15μlの、PBS中の2%ポリビニルピロリジン(PVP、分子量44000)
3μlの抗体−免疫金溶液(各ストリップ0.72μgのMAb)。
【0133】
(b)様々な濃度のモノクローナル抗体溶液でコーティングしたストリップでは、マイクロウェル中の処理溶媒は以下のとおりである
20μlの、PBS中の2.5%Tween−20
20μlの、PBS中の2%ポリビニルピロリジン(PVP、分子量44000)
5μlの、プロゲステロン−OVAでコーティングした免疫金(各ストリップ0.3μgのタンパク質)。
【0134】
上記の2つの異なる形状における抗体結合性能を、図7および図9に示す。
【0135】
(c)走査分析。ストリップを処理した後、以下の手順に従って、意図とは無関係な「Image Tool、バージョン2.00」を使用した走査分析によって図8の様々な試験ストリップの色強度を分析した
1.ストリップを走査ベッドの上に置いた
2.Image Toolを開き、file、acquire、TWAINを選択した
3.設定:スケール =36%
幅 =3.31cm
高さ =3.49cm
解像度 =400
4.Previewを押し、終わったらScanを押した
5.カラー画像をJPGファイルとして最高解像度で保存した
6.「Processing」および「Colour to Greyscale」を選択することによって画像を8bppの白黒画像に変換した
7.「Analysis」および「Line Profile」を選択し、線の端が白い面上に来るように、バンドの上に線を引いた(1つのバンドに3回繰り返し、平均値をとる)
8.「Image Tool」により、ストリップの色強度に関係するすべてのピーク高さの値を自動的に記録した。
【0136】
(実施例5)
モノクローナル抗体バイオセンサー表面を使用した抗体結合性能の評価
抗体溶液(HBS緩衝液中100μg/ml)によるバイオセンサー表面の固定化は、活性化させたCM−5センサーチップに抗体を標準アミン結合させることによって調製した。4つの異なるプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、(5)−OVA、および(7)−OVA](HBS緩衝液中1mg/mlの濃度)を連続的に、検量したバイオセンサー表面上に10μl/分で3分間流した。各コンジュゲートの結合応答(応答ユニットすなわちRU)を測定し、これを図12に示す。コンジュゲートの結合親和性の結果により、プロゲステロンの4−位のコンジュゲートが7α−プロゲステロン誘導体より優れており、また長いリンカーを有するコンジュゲートが短いリンカーを有するコンジュゲートよりはるかに優れた抗体結合を与えることが明示された。
【0137】
(実施例6)
プロゲステロン−OVAコンジュゲートバイオセンサー表面を使用した抗体結合性能の評価
上記3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVAおよび(5)−OVA]バイオセンサー表面を使用して、抗体結合の研究も評価した。具体的には、6つの濃度のMoAB(0から100μg.ml-1)を個別に、ブランクおよび固定したプロゲステロン−OVAコンジュゲートの表面上に注入した。またそれぞれのコンジュゲート表面からのデータを、ブランク表面からのセンサーグラムデータから減算することによって補正した。3つの同一の検量を実施し、それぞれの抗体濃度に有意な結合応答変化はなかった。したがって、1−、2−および4−OVAの3つの検量線はMoABのそれぞれの濃度の平均結合応答により得られ、抗体濃度に対してプロットした(図13)。リンカーの長さを4個の原子から11個の原子のリンカーに増やすと、プロゲステロン−4−OVAコンジュゲートの抗体結合シグナルが30%増加した。また、このシグナルの増大は、7α−コンジュゲート[(2)−OVA]に比べてプロゲステロン−4−OVAコンジュゲート[(3)−OVA]で31%向上した。
【0138】
(実施例7)
プロゲステロン−OVAコンジュゲートバイオセンサー表面を使用したSPRによる競合プロゲステロン免疫アッセイ
プロゲステロン用の競合SPR免疫アッセイの開発では、抗体を固定したバイオセンサー表面に比べてより優れた結合応答を与えるために、プロゲステロン−OVAコンジュゲートをバイオセンサー表面上に固定した。様々なプロゲステロン−OVAコンジュゲートを抗体バイオセンサー表面に使用したスクリーニング試験(図12)から、18個の原子のリンカーを有するコンジュゲート[(7)−OVA]が最も高い抗体結合シグナル(225RU)を有していた。これは、競合BIAcoreアッセイの設計における表面上のセンサープローブとして最も優れていると思われる。しかし、このコンジュゲート[(7)−OVA]はセンサー表面上に固定されず、本発明者らは、他のプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVAおよび(5)−OVA]のみしか、競合BIAcoreアッセイのセンサー表面上に固定できない。
【0139】
固定濃度のMoAB(200μg.ml-1)を、HBS緩衝液中の一連の濃度の遊離プロゲステロンと混合した後、次いで、各平衡混合物中の残存抗体をプロゲステロン−OVAコンジュゲートのバイオセンサー表面上に注入し、抗体結合応答を測定した。同じ実験を5回繰り返したが、それぞれの濃度のプロゲステロンの再現性は良好であった。抗体のチップ表面への結合は、溶液中の遊離プロゲステロンの量に反比例していた。遊離プロゲステロン濃度を抗体結合の平均応答(RU)に対してプロットすることにより、3つのプロゲステロン−OVAコンジュゲートの3つの標準競合曲線が得られた(図14)。このアッセイは、0から50ng.ml-1の範囲のプロゲステロン濃度で良好な感度を示した。免疫アッセイの感度は通常、検量線の勾配、すなわち単位濃度に対する応答によって決定される。したがって、[(5)−OVA]コンジュゲートは、[(2)−OVA]コンジュゲートより僅かに感度が高い[(3)−OVA]コンジュゲートより優れたアッセイ感度を示した。この結果は、SPRに基づいた免疫アッセイにおける、コンジュゲートのリンカー、およびステロイド分子のコンジュゲーション部位の効果を明示した。また、このSPRに基づいたアッセイは、0.1〜10ng.ml-1で直線的な検出範囲を示し、この範囲のR2値は、3つのプロゲステロン−OVAコンジュゲートすべてで0.99を超えることが見出された(図15)。このSPRに基づいた免疫アッセイは、従来のELISA技術に完全に匹敵し、はるかに迅速で簡単である。
【0140】
(実施例8)
長いリンカー (18 個の原子 ) を有する4−プロゲステロン−OVAコンジュゲートを使用した免疫クロマトグラフィーストリップ試験による、乳プロゲステロン濃度の決定
本発明の長いリンカー(18個の原子)を有する4−プロゲステロン−OVAコンジュゲートを様々な膜ストリップ上にコーティングすることができる。既に調製した抗体−金コンジュゲートを1〜5%のショ糖水溶液で希釈することができる。様々なコンジュゲートパッドを小さなサイズに切断し、金溶液をシートに染み込ませることによって上記の希釈した免疫金溶液(〜10μl)を各コンジュゲートパッドに施用することができる。この金コンジュゲートパッドを乾燥させ、保管する。
【0141】
試料パッドとして低ウィック(lower wick)材料またはガラス繊維を、終夜Tris緩衝液と水中の1〜5%Tween-20とに飽和させ、使用前に乾燥した。すべての試験材料(膜、金コンジュゲートパッド、試料パッドおよび溶媒吸収パッド)を補助プレートに貼り付け、プラスチックの枠(housing)にはめ込むことができる。このすぐに使用できるストリップ試験装置は、乾燥剤一袋の存在下で小袋に密封した場合、比較的安定である。
【0142】
この迅速ラテラルフローストリップ試験は、農場の乳プロゲステロン(P4)を測定するのにうまく応用することができる。このストリップは、従来のELISAの便利な代替法である。またこれは、ELISAに基づいた試験よりはるかに速い(10分以下)。これは、農業者がその場で使用するのに特に適している。この試験は、ウシの妊娠診断に使用することができる(プロゲステロン<10ng/mlでは、強い色バンドによって妊娠の陰性結果を表すが、プロゲステロン>10ng/mlでは、弱い色バンドまたは色バンドが現れないことによって妊娠の陽性結果を表す)。
【0143】
(実施例9)
伸長したリンカーを有するテストステロン−4−OVAコンジュゲートの合成
18個の原子のリンカーを有するテストステロン−4−OVAコンジュゲートの合成、およびそのOVAコンジュゲーションは、ステロイドハプテンとしてプロゲステロンを使用する代わりにテストステロンを使用して、実施例1に示す手順と同じ手順で実施する。テストステロン−4−OVAコンジュゲートを生成する方法を図16に示す。
【0144】
上記手順は、テストステロン、コルチコステロン、17α,20β−ジヒドロキシ−4−プレグネン−3−オン、11α−ヒドロキシプロゲステロン、17α−ヒドロキシプロゲステロン、21−ヒドロキシプロゲステロン、19−ヒドロキシ−4−アンドロステン−3,17−ジオンおよびヒドロコルチゾンなど、プロゲステロン分子と同じA環構造を有する他のステロイドに応用することができる。
【0145】
(実施例10)
様々な長さのポリエチレングリコール ( PEG ) リンカーを有するプロゲステロン−OVAコンジュゲートの合成
プロゲステロン−OVAコンジュゲートは、以下のステップで示すようにポリエチレングリコール(PEG)など様々な種類のリンカーを使用して合成することもできる(図17)。
【0146】
(a)異種二官能性PEGリンカー(H2N−PEG−CO2H)。アミンの1つが保護されたPEGアミン化合物は、市販のPEGジアミンをジ−tert−ブチルジカルボネートと反応させることによって調製することができる。生じたアミンの1つが保護された生成物を市販の無水ジカルボン酸と反応させ、次いでアミンの保護を外すと、長さが24個の原子であり、リンカーの端の一方にカルボキシル基を有し、他方にアミン基を有する異種二官能性PEGアミノ酸リンカーがもたらされる。
【0147】
(b)様々な長さのリンカーを有するプロゲステロン−PEG−OVAコンジュゲートの合成。実施例1と同じ手順によって、プロゲステロン−4−メルカプトプロピオン酸(1)を活性スクシンイミジルエステルに変換することができる。生じた活性化されたステロイド(3)を上記PEGアミノ酸リンカー(H2N−PEG−CO2H)と反応させて、より長いリンカー(44個の原子長)を有するプロゲステロンPEG誘導体を形成することができる。実施例1に示したものと類似のタンパク質コンジュゲーションによって、これらプロゲステロンPEG誘導体(24個および44個の原子のリンカー)をOVAタンパク質に結合させることができる。
【0148】
このプロゲステロン−PEG−OVAのコンジュゲートは、単純なアミノカプロン酸鎖を有するコンジュゲート[(3)−OVA、(5)−OVAおよび(7)−OVA]に比べてはるかに優れた水溶性を有する、長いリンカーを有するタンパク質コンジュゲートを構築するのに特に適している。
【0149】
(実施例11)
サイズ排除クロマトグラフィーによる迅速免疫アッセイ
この実施例は、サイズ排除ゲルカラムクロマトグラフィーによる迅速免疫アッセイを実施する方法を記載する。固相の固定化はない。上記実施例のようにタンパク質を使用する代わりに、伸長したリンカーによってプロゲステロンを蛍光色素とコンジュゲートさせ、式Vのプロゲステロン−リンカー−ビリルビンを形成する。
【0150】
この迅速免疫アッセイは、以下のように実施すべきである。
【0151】
ステップ1:固定量の式Vの上記プロゲステロン−リンカー−ビリルビンのコンジュゲートと、所定量の抗プロゲステロン抗体とを、プロゲステロン濃度を決定する試料溶液とよく混合すべきである。この混合物に、免疫複合体を形成させるべきである。
【0152】
ステップ2:上記の混合物は素早く短いサイズ排除カラム中を通り、これを、〜450nmのUV検出器を備えたHPLCでモニターする。HPLCクロマトグラムでは、2つの主要なピークが検出される。第1のピークは、そのはるかに大きい質量(>150,000)により早期に溶出される、抗体とプロゲステロン−リンカー−ビリルビンのコンジュゲートとの免疫複合体を表し、第2のピークは、はるかに低い質量(<1,000)を有し後に溶出されるプロゲステロン−リンカー−ビリルビンのコンジュゲートを表す。他の種には蛍光色素が付着していないので、クロマトグラム上に他の構成成分は表れない。
【0153】
第1のピークは、プロゲステロン−ビリルビンのコンジュゲートと抗体との免疫複合体の量を表す。第2のピークは、免疫複合体に結合していないプロゲステロン−ビリルビンのコンジュゲートの量を表す。
【0154】
与えられた試料中の遊離プロゲステロン濃度が高い場合は、限られた数の抗体がプロゲステロン−ビリルビンのコンジュゲートと形成する免疫複合体は、より少なくなる。これにより、第1のピークは第2のピークより小さくなる。対照的に、与えられた試料中の遊離プロゲステロン濃度が低い場合は、限られた抗体がプロゲステロン−ビリルビンのコンジュゲートと形成する免疫複合体は、より多くなる。これにより、第1のピークは第2のピークより大きくなる。したがって、第1のピークの面積、または第1ピークの面積と第2ピークの比は、試料プロゲステロンの濃度に反比例する。
【0155】
上記の開示を例としてのみ提供することを、当分野の技術者は理解されよう。本発明の多くの様々な変化を行うことができる。
【図面の簡単な説明】
【0156】
【図1】伸長した長さのリンカーを有する4−プロゲステロン誘導体の合成を示す図である。
【図2】様々な長さのリンカー(4個、11個、または18個の原子のリンカー)を有する、1つの7α−プロゲステロン−OVAコンジュゲート[(2)−OVA]および3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVAおよび(7)−OVA]の構造を示す図である。
【図3】類似の抗体(MoAb)結合曲線を有する、4−および7α−プロゲステロン−OVAコンジュゲート[(2)−OVAは下の曲線、(3)−OVAは上の曲線]のどちらもを示す図である。
【図4】抗体(MoAb)と(3)−OVAコンジュゲート(上の曲線)および(2)−OVAコンジュゲート(下の曲線)との標準曲線を示す図である。
【図5】類似の抗体(MoAb)結合性能を有する3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]を示す図である。
【図6】抗体(MoAb)と3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVA、(7)−OVA]との、非常に類似した標準曲線を示す図である。
【図7】免疫金にコンジュゲートした抗体(MoAb)とラテラルフロー試験ストリップ上にコーティングした3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)0OVAは中段のストリップ、(7)−OVAは下段のストリップ]との、様々な結合性能を示す図である。
【図8】図7の走査計測分析(scannometric analysis)[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]の結果を示す図である。
【図9】固定したモノクローナル抗体と、3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)0OVAは中段のストリップ、(7)−OVAは下段のストリップ]の免疫金複合体との、様々な結合性能を示す図である。
【図10】小さなハプテン用のバイオドットフロースルー免疫アッセイ形式の2ステップの設計を示す図である。
【図11】金表面に固定した抗体または本発明のハプテン−リンカー大型グループのコンジュゲートを使用した、小さなハプテン用の表面プラズモン共鳴(SPR)フロー免疫センサーの2つの設計を示す図である。
【図12】4つのプロゲステロン−OVAコンジュゲート[(2)−OVA、〜12RU;(3)−OVA、〜50RU;(5)−OVA、〜150RU;(7)−OVA、〜225RU]と固定したモノクローナル抗プロゲステロン抗体(MoAb)との様々な結合性能を、SPRバイオセンサーによって示す図である。
【図13】3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]を固定したバイオセンサー表面を使用した、抗体結合応答を示す図である。
【図14】3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]バイオセンサー表面を使用した、プロゲステロンの競合免疫アッセイの標準曲線を示す図である。
【図15】競合SPRに基づいた免疫アッセイから得られたプロゲステロンの検出の直線範囲0.1〜10ng.ml-1を示す図である。
【図16】18個の原子のリンカー有するテストステロン−4−OVAコンジュゲートの生成方法を示す図である。
【図17】様々な長さのポリエチレングリコールリンカーを有するプロゲステロン−4−OVAコンジュゲートの生成の設計を示す図である。
【0001】
(発明の分野)
本発明は、小さいサイズのハプテン、より詳細には固定したまたは可動な免疫反応物質としての他の大分子とのコンジュゲート、および迅速アッセイ、具体的には免疫アッセイ、特にラテラルフロー試験またはストリップ試験、フロースルー形式およびフロー免疫センサーにおけるその使用に関する。
【0002】
(背景技術)
迅速なラテラルフローストリップ試験またはフロー免疫センサーは、利用しやすい形式であること、通常のELISAアッセイに比べて試験結果を得るまでの処理時間が比較的短いこと、および長期安定性を含めた多くの利点を有する。またこれらは比較的安価で作成される。
【0003】
ステロイドや薬物など小さいサイズのハプテンの免疫アッセイには一般的にいわゆる競合技術が必要である。コーティング抗原として、ハプテンは通常、捕獲ドットまたはラインとしてストリップ膜などの固相にコーティングして、色素、酵素または粒子にコンジュゲートした抗体と反応させ;あるいは、色素もしくは他の発色性粒子で標識し、可動な免疫反応物質として使用して、有色ドットを形成し、または免疫複合体を固相上に固定した抗体と結合させる。どちらの構造でも、固相に固定したまたは可動な免疫反応物質としてコーティングした抗原は、限られた数の抗体結合部位において遊離の試料抗原と競合する。したがって、捕獲ライン中のハプテン/抗体結合能力は、検出可能なハプテンの濃度範囲を、したがって免疫アッセイの感度を決定する重要な判断基準である。
【0004】
小さなハプテンは、サイズが小さいため、ハプテン特異的抗体に対する結合親和性を保持させたままでストリップ膜や粒子など固相上に直接吸着させることは不可能である。したがって、小さなハプテンを固相に固定するためには、タンパク質にコンジュゲートさせなければならない。付着の中間体としても使用できるN−ビニルピロリドンコポリマー(米国特許第5,723,344号)や核酸断片(米国特許第5,849,480号)など他の物質もいくつか存在するが、最も広く使用されている固相上の小さいサイズのハプテンの固定化技術は依然として、従来のタンパク質コンジュゲーション、すなわちハプテン−タンパク質コンジュゲートの調製である(Clinica Chimica Acta、162、1987、199〜206)。
【0005】
反応性、すなわちハプテンに対する抗体の結合特異性に影響を与える最も重要な要素の1つが立体効果であることが一般的に受け入れられている。一部の文献は、伸長した柔軟なストレプトアビジン/ビオチン「架橋」によって(Immunology Letters、13、1986、313〜316およびJ. Immunological Methods、111、1988、271〜275)、あるいは長く伸長したリンカーによって(Bioconjugate Chem.、 7、1996、88〜95)、共有結合で固相にコンジュゲートさせた抗体の結合性が高くなることを報告している。異なるリンカーを介して大きなタンパク質抗原を固体の支持体に付着させた場合にも抗体の抗原捕獲能力が向上した(J. Immunological Methods、55、1982、1〜12)。ハプテン−スペーサー−タンパク質コンジュゲートの概念はいくつかの特許にも現れている。スペーサーすなわちリンカーアームを介してハプテンを免疫原性担体タンパク質に付着させることにより、抗体の調製において免疫応答が改善されるかもしれない(米国特許第5,776,713号および米国特許第5,843,682号)。ハプテンと標識の間に伸長したリンカーを使用して様々な酵素または他のトレーサーで標識したハプテンは、より容易に認識され、ハプテンに対する抗体によってより密接に結合され、また、酵素活性や他のトレーサーの特性をよく保持している(米国特許第5,298,403号、米国特許第5,578,457号および米国特許第5,834,206号)。コンジュゲートの合成におけるこのような目的のためにリンカーグループを有する二官能性試薬も使用した(米国特許第5,595,741号)。リンカーグループを有する薬物ハプテン−担体タンパク質コンジュゲートの構築は、抗体による認識が最適であり、したがって、従来の他の薬物とのより優れた同時療法的な用法を有している(米国特許第5,876,727号)。米国特許第5,876,727号はまた、担体またはタンパク質から十分な距離だけハプテンを移動させて、抗体によるハプテンの最適な認識を可能にする利点を教示している。
【0006】
従来、プロゲステロンおよび同じ環構造を有する他の類似のステロイドハプテンを、そのb環の6位および7位で他の分子に付着させていた(G.Hatzidakis、 A.StefanakisおよびE.Krambovitis、1993、「Comparison of Different Antibody-Conjugate Derivatives for the Development of Sensitivity and Specific Progesteron Assay」、Journal of Reproduction and Fertility、97、ページ557〜561)。
【0007】
本出願者らは今回、驚くべきことに、比較的短い時間のアッセイで、小さいサイズのハプテンを捕獲するリガンドの能力が、多くの迅速アッセイ、具体的にはラテラルフローストリップ試験やフローイムノセンサーなど免疫アッセイに対して感度を有するように高められることを発見した。これは、ハプテンと、タンパク質などハプテンが付着している大型グループ(large group)との間にリンカーを使用することによる従来のELISAには、特に適していない。
【0008】
本発明の目的は、ハプテン−リンカー−大型グループのコンジュゲートを利用する迅速アッセイを提供すること、あるいは少なくとも有用な選択肢を社会に提供することである。
【0009】
(発明の概要)
第1の態様では、本発明は平衡に近づかない動力学に基づいたアッセイである迅速アッセイで使用する、一般式X−W−Y−Zで表されるハプテン−リンカー−大型グループのコンジュゲートを提供する。
(式中、
Xは、ハプテンであり、
Wは、任意選択でチオエーテルまたはエーテル基であり、
Yは、10個以上の原子長のリンカーであり、
Zは、Yが存在しない場合にXのリガンドへの結合に対して立体障害を与えるのに十分なサイズの大型グループである)
好ましい実施形態では、Xは式IのA環構造を有する多環の融合環ハプテンである。
【0010】
【化1】
式中、RはH、CH3およびCH2OHを含む群から選択され、破線は隣接するB環構造の環員を示し、R1はリンカーYの付着点である。
【0011】
より好ましい実施形態では、Xは式IIのハプテンである。
【0012】
【化2】
式中、
Rは、H、CH3およびCH2OHを含む群から選択され、
R1は、リンカーYの付着点であり、
R2は、HまたはOHであり、
R3は、オキシ、C1〜C2アルキルまたはメチルカルボニルが任意選択でヒドロキシによって置換されている、オキシ、C1〜C2アルキル、ヒドロキシ、およびメチルカルボニルを含む群から選択され、
R4は、水素またはヒドロキシである。
【0013】
さらなる態様では、本発明は、
a)ハプテンを結合する能力があるリガンドを試験試料と接触させるステップと、
b)ステップa)のリガンドを、このリガンドに特異的な本発明のハプテン−リンカー−大型グループのコンジュゲートとさらに接触させるステップと、
c)リガンドに結合した、コンジュゲートしていないハプテンの量を決定するステップと
を含む、試料中のハプテンを検出するための、平衡に近づかない、動力学に基づいたアッセイである迅速アッセイ法を提供する。
【0014】
好ましくは、リガンドを接触させる第2ステップ(b)により、過剰の結合していないリガンドのほとんどが接触され結合される。
【0015】
好ましくは、ハプテン−リンカー−大型グループのコンジュゲートは固定されている。
【0016】
好ましい実施形態では、ステップa)の混合物をステップb)のハプテン−リンカー−大型グループのコンジュゲートの上に流す。
【0017】
さらなる態様では、本発明は、
a)本発明のハプテン−リンカー−大型グループのコンジュゲートを試験試料と混合するステップと、
b)生じた混合物をこのハプテンを結合する能力があるリガンドと接触させるステップと、
c)リガンドに結合したコンジュゲートしていないハプテンの量を決定するステップと
を含む、試料中のハプテンを検出するための、平衡に近づかない動力学に基づいたアッセイである迅速アッセイ法を提供する。
【0018】
好ましくは、リガンドは固定されている。
【0019】
好ましい実施形態では、生じた混合物を固定したリガンドと接触させるステップb)は、フローオーバーまたはフロースルーシステムによって行われる。
【0020】
さらなる態様では本発明は少なくとも
ハプテンに結合するリガンドと、
本発明のハプテン−リンカー−大型グループのコンジュゲートと
を含む、平衡に近づかない動力学に基づいたアッセイである迅速アッセイのキットを提供する。
【0021】
好ましくは、このキットは指示薬をさらに含む。一実施形態では、この指示薬はハプテン−リンカー−大型グループのコンジュゲートに結合している。代替実施形態では、この指示薬はリガンドに結合している。
【0022】
一般的にキットはフローオーバーまたはフロースルーアッセイキットであってよい。典型的なフロースルーキットは試験ストリップを含む。
【0023】
別の態様では、本発明のハプテン−リンカー−大型グループのコンジュゲートを、コンジュゲート内のハプテンと結合する能力があるリガンドと、反応が平衡に近づかない所定の時間接触させるステップを含む、本発明のハプテン−リンカー−大型グループのコンジュゲートをリガンドに結合させる方法を提供する。
【0024】
リガンドは固定されていることが好ましい。好ましい実施形態では、このリガンドはタンパク質−ハプテンのコンジュゲートと接触する前にはハプテンに結合していないことが好ましい。
【0025】
別の態様では本発明は少なくとも
a)極性有機溶媒に溶かした活性化されたステロイドハプテンを、1〜10モル等量の異種二官能性水溶性リンカーを含む水溶液と混合するステップと、
b)混合物を反応させるステップと、
c)ステップb)のハプテン−リンカー反応生成物の残りの遊離官能性リンカーグループに大型グループを付着させるステップと
を含む、本発明のハプテン−リンカー−大型グループのコンジュゲートを生成する方法を提供する。
【0026】
(図面の簡単な説明)
本発明は広くは上に定義したとおりであるが、それだけに限定されるものではなく、以下の説明によって例が提供される実施形態も含められることは、当業者には理解されよう。さらに、添付の図を参照することによって本発明をより良く理解することができる。
【0027】
図1は、伸長した長さのリンカーを有する4−プロゲステロン誘導体の合成を示す。
【0028】
図2は、様々な長さのリンカー(4個、11個、または18個の原子のリンカー)を有する、1つの7α−プロゲステロン−OVAコンジュゲート[(2)−OVA]および3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVAおよび(7)−OVA]の構造を示す。
【0029】
図3は、類似の抗体(MoAb)結合曲線を有する、4−および7α−プロゲステロン−OVAコンジュゲート[(2)−OVAは下の曲線、(3)−OVAは上の曲線]のどちらもを示す。
【0030】
図4は、抗体(MoAb)と(3)−OVAコンジュゲート(上の曲線)および(2)−OVAコンジュゲート(下の曲線)との標準曲線を示す。
【0031】
図5は、類似の抗体(MoAb)結合性能を有する3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]を示す。
【0032】
図6は、抗体(MoAb)と3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVA、(7)−OVA]との、非常に類似した標準曲線を示す。
【0033】
図7は、免疫金にコンジュゲートした抗体(MoAb)とラテラルフロー試験ストリップ上にコーティングした3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)−OVAは中段のストリップ、(7)−OVAは下段のストリップ]との、様々な結合性能を示す。
【0034】
図8は、図7の走査計測分析(scannometric analysis)[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]の結果を示す。
【0035】
図9は、固定したモノクローナル抗体と、3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)−OVAは中段のストリップ、(7)−OVAは下段のストリップ]の免疫金複合体との、様々な結合性能を示す。
【0036】
図10は、小さなハプテン用のバイオドットフロースルー免疫アッセイ形式の2ステップの設計を示す。
【0037】
図11は、金表面に固定した抗体または本発明のハプテン−リンカー大型グループのコンジュゲートを使用した、小さなハプテン用の表面プラズモン共鳴(SPR)フロー免疫センサーの2つの設計を示す。
【0038】
図12は、4つのプロゲステロン−OVAコンジュゲート[(2)−OVA、〜12RU;(3)−OVA、〜50RU;(5)−OVA、〜150RU;(7)−OVA、〜225RU]と固定したモノクローナル抗プロゲステロン抗体(MoAb)との様々な結合性能を、SPRバイオセンサーによって示す。
【0039】
図13は、3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]を固定したバイオセンサー表面を使用した、抗体結合応答を示す。
【0040】
図14は、3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]バイオセンサー表面を使用した、プロゲステロンの競合免疫アッセイの標準曲線を示す。
【0041】
図15は、競合SPRに基づいた免疫アッセイから得られたプロゲステロンの検出の直線範囲0.1〜10ng.ml-1を示す図である。
【0042】
図16は、18個の原子のリンカー有するテストステロン−4−OVAコンジュゲートの生成方法を示す。
【0043】
図17は、様々な長さのポリエチレングリコールリンカーを有するプロゲステロン−4−OVAコンジュゲートの生成の設計を示す。
【0044】
(発明の詳細な説明)
本発明の開示では、「迅速アッセイ」とは、アッセイ成分を混合した場合に、このアッセイから有意義な結果が得られる前に平衡状態に近づく必要がない反応を有するアッセイ成分によって、特徴付けられている。本発明は、アッセイを実行している期間中にアッセイ成分の反応が平衡に近づかない、迅速アッセイに特に適している。このような迅速アッセイは、非平衡の、動力学に基づいたアッセイである。通常、このアッセイは実施に20分未満、より適切には10分未満しかかからないはずである。
【0045】
「大型グループ」とは、10個の原子長未満のリンカーをリガンドとハプテンの間に挿入した場合に、付着したハプテンのリガンドへの結合に対して有意な立体障害を引き起こすのに十分なサイズのグループである。通常、本発明では、大型グループはタンパク質またはポリペプチドである。あるいは、この大型グループは、蛍光色素、たとえばビリルビンなどの指示薬である。
【0046】
一実施形態では、コンジュゲートの大型グループはタンパク質である。このタンパク質は、好ましくは安価であり、ハプテンとコンジュゲートするための多数のリジンを含む、容易に入手可能な任意のタンパク質である。当分野の適切なタンパク質の例には、ウシ血清アルブミン(BSA)、卵白アルブミン(OVA)、キーホールリンペットヘモシアニン(KLH)が含まれる。タンパク質には、酵素、分泌タンパク質、球状タンパク質が含まれ得る。本発明中で使用するための好ましいタンパク質は卵白アルブミン(OVA)である。タンパク質が酵素である場合、アルカリホスファターゼ、グルコースオキシダーゼ、西洋ワサビペルオキシダーゼ、アミンを富化した西洋ワサビペルオキシダーゼを含む群から選択されることが好ましい。
【0047】
「ハプテン」とは、検出するために選択される分子である。最も一般的には、このハプテンは、抗体と特異的に反応し、それ自体では免疫応答を誘発させる能力がないが抗原性の担体と複合体を形成すると免疫原性になる、低分子量有機化合物である。本発明で対象となるハプテンは、それだけには限定されないが、炭化水素、ポリヌクレオチド、ステロイド、ステロイド類似体、ポリペプチド(ペプチドホルモンなど)、薬物および毒素を含む群から選択される。
【0048】
ハプテンが、プロゲステロンまたはプロゲステロンに類似のA環構造を有する分子などステロイドである場合は、ハプテンの結合がA環構造の4位で起こることが好ましい。ステロイドプロゲステロンのC−4位でのタンパク質コンジュゲート部位が良好なアッセイ感度を有することが見出された。これまでに、文献では、プロゲステロン分子とタンパク質の一般的なコンジュゲート部位のほとんど(3、6β、7αおよび11α位)が調査され、最も感度の高いEIAアッセイの結果は、ステロイドの6βまたは7α位のどちらかを使用することによってしか得られなかった(Journal of Reproduction and Fertility、97、1993、557〜561)。4−プロゲステロン誘導体は、より簡単に合成され、6βや7α類似体に比べて立体異性体の問題がない。これにより、プロゲステロンの4位、またはプロゲステロンと同じA環構造を有する他のステロイドの4位が、6βや7α位に代わる、優れた代替タンパク質コンジュゲート部位となる。しかし他の結合部位の使用も除外されない。
【0049】
好ましい実施形態では、このハプテンは以下を含む群から選択される。
【0050】
【化3】
最も好ましくは、このハプテンはプロゲステロンである。
【0051】
本明細書中で使用する「リガンド」は、抗原を結合する能力を有する任意の分子でよい。好ましくは、これは標的に特異的に結合する能力のある免疫グロブリン分子である。このような抗原標的には上記のハプテンが含まれる。リガンドには、完全な抗体だけでなく、その断片、たとえばFab、(Fab)2、Fv、単鎖(ScFv)、それらの変異体、抗体部分を含む融合タンパク質、および必要な特異性の抗原認識部位を含む免疫グロブリン分子の他の任意の改変した構造が包含される。代替実施形態ではこのリガンドはT細胞受容体でよい。
【0052】
リンカーは、好ましくは10〜50個の原子長、より好ましくは11〜24個の原子長、最も好ましくは11〜18個の原子長の鎖を含む。当分野で周知の任意の適切なリンカーを使用することができる。リンカーは、ハプテンのリガンドへの結合に対する立体障害が最小限であることを保証するために、ハプテンに近位のかさ高くない基であるべきである。また、この鎖が炭素に基づいたものであることが好ましい。この炭素に基づいた鎖は、N、S、Oから選択された1つまたは複数の異種原子を含んでいてもよい。他の側鎖置換基を提供してもよい。
【0053】
好ましい鎖は、アミノ酸鎖、ポリエチレングリコール鎖、アルキル、アルケニル、核酸、および多糖を含む群から選択される。異種原子はアミノ基の一部でもよい。この鎖は、1つまたは複数、好ましくは3つ以下の不飽和部位を有することができる。アミノ酸断片を鎖に取り込んでもよい。ホモロゲーションによって複数のアミノ酸断片を提供してもよい。リンカーとしてハイブリッドペプチド−核酸断片を使用することも企図される。
【0054】
本発明者らは、立体障害を減らすための最適なリンカーの長さは約18個の原子であることを見出した。それ以降は、性能は最小限しか向上されないが、より長いリンカーを組み込むことによって混乱が生じる。明らかに、本発明の実施に18個の原子より長いリンカーを使用してもよいが、これは好ましくない。
【0055】
好ましい実施形態では本発明のコンジュゲートは式IIIまたは式IVによって表される。
【0056】
【化4】
【0057】
【化5】
(式中、XおよびZは上に定義したとおりである)
一実施形態では本発明のコンジュゲートは以下のものである。
【0058】
【化6】
別の実施形態では、本発明の好ましいコンジュゲートは図2に示す(5)−OVAおよび(7)−OVAである。
【0059】
当分野で周知の任意の手段によってこのリンカーをハプテンとタンパク質に付着させることができる。好ましい方法には、(たとえばタンパク質上のアミン、カルボキシルまたはスルフヒドリル基への)共有結合反応、核酸ハイブリダイゼーション、またはリガンド相互作用による方法が含まれる。
【0060】
ステロイドをリンクグループに共有結合させるためには、多くの場合、チオエーテルまたはエーテルの架橋基、好ましくはチオエーテル基を含むことが必要である。
【0061】
固相が必要な場合は、リガンドまたはハプテン−リンカー−大型グループのコンジュゲートを固相に固定することができる。リガンドとハプテン−リンカー−大型グループのコンジュゲートの量が事前に決定されていることが好ましい。また、リガンドに比べてタンパク質−コンジュゲートが過剰量あることが好ましい。
【0062】
リガンドおよびハプテン−リンカー−大型グループのコンジュゲートのどちらもが、ハプテンを定性分析および定量分析するためのコンジュゲートの迅速な検出を可能にするために、検出システムでの使用に適した指示薬をさらに含むことができる。
【0063】
本発明での使用に適した多くの検出システムが当分野に存在する。当分野の技術者は、周知の方法を使用してタンパク質の結合を検出することができる。様々な免疫アッセイ手順は、「Immunoassays for the 80's」、 A. Voller.他編、University Park, 1981に記載されている。これには、酵素検出システム、色素(蛍光マーカー、有色イオンや錯体など)、金属または非金属の有色粒子(免疫金や着色ラテックスビーズなど)、および取り込まれた放射性同位元素(たとえばシンチレーション計数によって検出される)が含まれる。
【0064】
好ましい実施形態では、安価で比較的安定であるので免疫金粒子が使用される。標識した抗体を検出するのに使用してもよい適切な酵素には、それだけには限定されないが、ブドウ球菌ヌクレアーゼ、δ−5−ステロイドイソメラーゼ、酵母菌アルコール脱水素酵素、α−グリセロリン酸脱水素酵素、トリオースリン酸イソメラーゼ、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ、アスパラギナーゼ、グルコースオキシダーゼ、β−ガラクトシダーゼ、リボヌクレアーゼ、ウレアーゼ、カタラーゼ、グルコース−6−リン酸脱水素酵素、グルコアミラーゼおよびアセチルコリンエステラーゼが含まれる。
【0065】
抗体を放射標識することにより、放射性免疫アッセイ(RIA)を使用してそれを検出することが可能になる(たとえば、Work, T.S.他、「Laboratory Techniques and Biochemistry in Molecular Biology」、North Holland Publishing Company、ニューヨーク、1978参照)。この放射性同位元素は、γ線計数器やシンチレーション計数器の使用、またはオートラジオグラフィーによる手段などによって検出することができる。本発明の目的に特に有用な同位元素は、3H、14C、35S、125Iおよび131Iである。
【0066】
蛍光標識は本発明の範囲内にある。蛍光標識した抗体を適切な波長の光に暴露させた場合、蛍光によってその存在を検出することができる。最も一般的に使用される蛍光標識化合物には、フルオレセインイソチオシアネート、ローダミン、フィコエリスリン、フィコシアニン、アロフィコシアニン、o−フタルアルデヒド、フルオレスカミン、ビリルビンがある。
【0067】
また、この抗体を152Euなどの蛍光放射金属またはランタニド系列の他のものを使用して検出可能に標識することもできる。ジエチレントリアミン五酢酸(DTPA)やエチレンジアミン四酢酸(EDTA)など金属キレート化グループを使用してこれらの金属を特定の抗体に付着させることができる。
【0068】
この抗体はまた化学発光化合物に結合させることによって検出可能に標識することができる。その後、化学反応の過程中に生じる発光の存在を検出することによって化学発光で標識した抗体の存在を決定する。特に有用な化学発光標識化合物の例は、ルミノール、イソルミノール、セロマチック(theromatic)アクリジニウムエステル、イミダゾール、アクリジニウム塩およびシュウ酸エステルである。
【0069】
同様に、生物発光化合物を使用して抗体を標識してもよい。生物発光とは、触媒タンパク質が化学発光反応の効率を高める、生物系内で見つかる化学発光の一種である。生物発光タンパク質の存在は、発光の存在を検出することによって決定される。標識の目的で重要な生物発光化合物は、ルシフェリン、ルシフェラーゼおよびエクオリンである。
【0070】
抗体の検出は、たとえば検出可能な標識が放射性γ線放射源である場合はシンチレーション計数器によって、あるいは、たとえば標識が蛍光物質である場合は蛍光光度計によって行うことができる。
【0071】
酵素標識の場合、酵素の基質を使用する比色法によって検出を行うことができる。また、基質の酵素反応の程度を同様に調製した標準と比較する目視比較によって、検出を行うこともできる。
【0072】
抗体の結合活性は、周知の方法に従って決定することができる。当分野の技術者は、日常的な実験を用いることによって、それぞれの測定(determination)に有効で最適なアッセイ条件を決定することができる。本発明で企図される方法は、動力学に基づくものである。平衡に基づくシステムは、本発明の目的では企図されない。
【0073】
試験化合物を加えない、陽性対照アッセイを実施してもよい。
【0074】
一実施形態では、このハプテン−リンカー−大型グループのコンジュゲートは、図2に示したとおりである。
【0075】
本発明のコンジュゲートは、多くの様々な迅速免疫アッセイでの使用に適している。
【0076】
したがって、さらなる態様では、本発明は、本発明のコンジュゲートを、コンジュゲート内のハプテンに特異的なリガンドに結合させる方法を提供する。この結合ステップは一般的に、迅速なフローオーバーまたはフロースルー方式で、固相の表面上で行われる。
【0077】
固相を使用する場合は、リガンドまたはハプテン−リンカー−大型グループのコンジュゲートのどちらかを固定することができる。好ましくは、ハプテン−リンカー−大型グループのコンジュゲートを固体の支持体に固定する。本発明の範囲内で使用できる固体の支持体は、それだけには限定されないが、主に、ポリスチレン、ポリプロピレン、ポリエステル、ポリアクリロニトリル、ポリ塩化ビニル、ポリビニリデン、ポリスルホン、ポリアクリルアミド、セルロース、硝酸セルロース、架橋デキストラン、フッ化樹脂、アガロース、架橋アガロース、および多糖からなる群から選択される不溶性の高分子物質を含む。
【0078】
しかし、さらに、ガラス、ガラス繊維、ガラスビーズ、金属、ナイロンメッシュ物質、ナイロン膜、金属、金属ストリップおよび金属ビーズなど他の物質を使用することも考えられる。好ましい固体の支持体は、膜、ビーズ、マイクロプレート固体支持体、試験管、マイクロタイタープレート、ディップスティック、ラテラルフロー装置、樹脂、PVC、ラテックスビーズおよびニトロセルロースから選択される。担体の性質は本発明の目的ではある程度可溶性または不溶性とすることができる。支持体の形状は、ビーズのように球状、試験管の内部のように円柱状、または棒の外部表面であってよい。あるいは、表面は、シート、試験ストリップなどのように平坦でもよい。当分野の技術者は、抗体や抗原を結合する多くの他の適切な担体を知っており、または日常的な実験を用いることによってこれを確認することができるであろう。
【0079】
この固体表面は膜であることがより好ましい。
【0080】
支持体が金属である場合は、これが、金やプラチナなどバイオセンサーの表面としての使用に適した金属であることが好ましい。
【0081】
固体の支持体への固定は、受動吸着、共有結合、またはアビジン/ビオチン複合体などリガンドの相互作用を介したものによる固定でよい(たとえば米国特許第4,467,031号、Galati他)。
【0082】
本出願者らは、予想外なことに、より長いリンカーを有するこれらのハプテン−リンカー−大型グループのコンジュゲートが、迅速アッセイにおいて、従来のハプテン−リンカー−大型グループのコンジュゲートに比べて相当の利点を有することを見出した。競合ELISAタイプのアッセイで使用した場合はこのコンジュゲートの性能は従来のコンジュゲートと同等であるので、これは特に驚くべきことである。
【0083】
特定の理論に拘泥するものではないが、迅速免疫アッセイにおける従来のタンパク質−ハプテンコンジュゲートの感度の低さは、固定した抗体との免疫複合体を形成する際の立体障害が原因であることが提唱された。したがって、迅速アッセイの感度を上げるためには、結合率に対する立体障害を最小限にするシステムが必要であると思われる。本発明のハプテン−リンカー−大型グループのコンジュゲートはこの目的を果たしていると思われる。
【0084】
特定の理論に拘泥するものではないが、本発明者らは、本発明の実施例で実証された、高められたハプテン抗体結合の動力学は、そこで提示する特定の実施形態の2つの主要な要素によって促進されることを提唱した。
【0085】
1.リンカーがステロイドA環の4位に結合すること;および
2.リンカーの長さが、ハプテンとタンパク質が互いに、迅速なリガンドによるハプテンの認識およびリガンドのハプテンへの結合に対して立体障害がないような長さであること。このハプテンとタンパク質は、互いに対して自由な運動が与えられており、したがって、リガンドのハプテンへの結合の迅速な認識が可能となっていると考えられる。
【0086】
本発明者らは、免疫アッセイのために、プロゲステロンの6βおよび7α以外の他のコンジュゲーション部位を調査した。本発明者らによって、プロゲステロンのC−4位がプロゲステロンの6β位に代わる、優れた代替コンジュゲーション部位であることが見出された。ELISAでは、プロゲステロン−4−OVA(1−OVA)およびプロゲステロン−7α−OVAコンジュゲート(2−OVA)のどちらも類似の抗体結合性能を有する。驚くべきことに、SPRなど動力学に基づいた免疫アッセイでは、プロゲステロン−4−OVAコンジュゲートはプロゲステロン−7α−OVAコンジュゲートより優れた抗体結合を示す。しかし、6β−および7α−プロゲステロン誘導体に比べて、C−4位のプロゲステロン誘導体の合成はより簡単であり、ステロイドの4,5−二重結合によってC−4位ではプロゲステロン誘導体の立体異性体が1つしか提供されないので、立体異性体の問題がない。
【0087】
最近、伸長した長さの異種二官能性リンカーを使用することによって捕獲抗体とアルカリホスファターゼ標識またはその微小粒子との間の距離が長くなれば抗体結合シグナルが増大することが見出された。この増大は一般的なバイオコンジュゲートの2成分(entity)間の距離が増加した結果と見なされている。本発明者らは、ELISAでコーティング抗原として使用した場合は、プロゲステロン−4−OVAコンジュゲート内のリンカーの長さ(4、11または18個の原子長)は、その抗体結合性能に有意な効果を及ぼさないことを見出した。短い時間(20分)の抗体結合実験では、長いリンカーを有するコンジュゲート(4−および6−OVA)は、短いリンカーを有するOVA−コンジュゲート(1−OVA)に比べてむしろ僅かに悪かった。したがって、異なる長さのリンカー(4〜18個の原子)を有する3つのプロゲステロン−4−OVAコンジュゲートは、ELISAでは同じプロゲステロンアッセイ感度を有している。
【0088】
以前の研究によりシグナルの増大が必ずしもリンカーの長さに比例するとは限らないことが示されている。たとえば、酵素−抗体コンジュゲート中のリンカーの長さを9個の原子から23個の原子に増加した場合はシグナルが64%増加し、30個の原子長のリンカーでは82%増加した。しかし、16個の原子のリンカーを有する同じ酵素−抗体コンジュゲートは、より長いリンカー(23個の原子)を有するコンジュゲートより僅かに優れた抗体結合性能を有していた。これらの結果は、シグナルを増大させるためには、抗体と他の成分との間のリンカーの理想的な長さは、関与する2つの成分のサイズおよびバイオコンジュゲートが形成される方法に依存することを示唆している。従来技術では、2つの大きな成分間で、すなわち抗体と酵素または微小粒子とでバイオコンジュゲートが構築される。リンカーは、抗体を標識する目的のみで使用され、抗体−抗原の結合部位と同じ側には直接関与していなかった。しかし本発明のプロゲステロン−OVAコンジュゲートは全く異なっている。これらは、大きなタンパク質(OVA)と非常に小さな成分、すなわちプロゲステロン分子(分子量314)を用いて構築される。この抗体/抗原結合部位にはリンカーも直接関与している。したがって、このバイオコンジュゲートは2つの異なるサイズの成分によって形成され、異なる方法で構築されているので、抗体結合性能に対するリンカーの長さの効果は、初期に報告された研究とは異なる可能性がある。本発明者らは、リンカーの長さも、様々なアッセイ形式、特に迅速アッセイにおける抗体結合に影響を与えることを発見した。
【0089】
本発明を実施するのに、いくつかの異なるアッセイタイプが有用であることが見出された。これらには、本明細書中に記載の試験ストリップアッセイ、ドットブロットアッセイ(ドット試験またはドット免疫結合アッセイとしても知られる)、SPRバイオセンサーなどフローイムノセンサーが含まれる。
【0090】
また本発明の免疫アッセイは、20分未満、より好ましくは10分未満、最も好ましくは5分未満で完了することが好ましい。
【0091】
好ましい試験ストリップイムノアッセイでは、長いリンカーを有する所定量のハプテン−リンカー−大型グループのコンジュゲートは、それを固定するための固体支持体の一部に固定されている。固体の支持体は通常、セルロースベースの膜、または少なくとも水ベースの溶媒の毛管移動が可能な支持体である。試験試料を膜支持体に施用し、標識した抗体と混合し、ハプテン−リンカー−大型グループのコンジュゲートによって固定された捕獲ラインに向かって迅速に移動させた。遊離試料ハプテンと結合した後、過剰の抗体は、捕獲ラインでハプテン−リンカー−大型グループのコンジュゲートと色バンドを形成する。リガンドとしての標識した抗体の量は、捕獲ラインの色強度によって定量的または定性的に決定される。本発明のハプテン−リンカー−大型グループのコンジュゲートと結合する標識した抗体リガンドが少ないほど、試験試料中に多くのハプテンが存在する。
【0092】
他の試験ストリップを形成することもできる。一実施形態では、試験試料を本発明の標識したタンパク質−ハプテンコンジュゲートと混合する。標識したハプテン−リンカー−大型グループのコンジュゲートおよび遊離ハプテンのどちらも、固定した抗体リガンド上の結合部位において競合するために捕獲ラインに向かって移動する。色強度、すなわちハプテン−リンカー−大型グループのコンジュゲートの量は、試験試料中のハプテンの量に反比例している。
【0093】
上で論じた任意の標識を使用することができるが、標識したコンジュゲートは肉眼で見えることが好ましい。したがって好ましい標識は可視色素である。
【0094】
上記のストリップアッセイのどちらでも、本発明のタンパク質コンジュゲートは、短いリンカーを有するコンジュゲートに比べて、捕獲ライン内ではるかに優れた抗体結合性を有する。したがって、長いリンカーを有するコンジュゲートは、捕獲ライン内で比較的低い濃度の抗体を検出し、それによって迅速なストリップアッセイの感度を高めることができる。
【0095】
本発明の別の実施形態はバイオドットのフロースルー免疫アッセイを提供する。このような免疫アッセイではまず抗体などのリガンドを膜上に固定する。微量濾過装置によって試料ハプテンを膜に貫流させた後、本発明の標識したハプテン−リンカー−大型グループのコンジュゲートは残った抗体と反応して膜上に有色ドットを形成する。ドットの色強度、すなわちハプテン−リンカー−大型グループのコンジュゲートの量も、試験試料中のハプテンの量に反比例する。
【0096】
表面プラズモン共鳴(SPR)バイオセンサー技術は、抗体−ハプテン相互作用の特徴付けに非常に有用なツールである。これは小さいサイズのハプテンの迅速免疫アッセイ用に設計することもできる。一般的に、ハプテン−リンカー−大型グループのコンジュゲートまたはSPRで使用するリガンドのいずれかを、バイオセンサー表面上に共有結合により固定する。最も一般的には微量流動フローセル中を用いて、遊離試料ハプテン(分析物)と抗体リガンドとの混合物またはハプテン−リンカー−大型グループのコンジュゲートとの混合物をバイオセンサー表面上に流して、バイオセンサー表面上の限られた数の抗体結合部位において競合させる。SPR検出器はハプテン−抗体複合体形成の会合および解離によって誘発された表面近辺の溶媒層の屈折率の変化をモニターする。SPR検出器の感度はその分子量に比例するセンサー表面上の抗体−ハプテン複合体の屈折率に依存している。したがって、抗体とハプテン−リンカー−大型グループのコンジュゲートとの結合は、このタンパク質の分子量が大きいために、抗体と小さいサイズのハプテンとの結合による屈折率よりもはるかに高い屈折率によるSPR応答を与える。
【0097】
本発明のハプテン−リンカー−大型グループのコンジュゲートは試験したすべてのアッセイで利点を示した。固体の支持体上にコーティングした抗原としてハプテン−リンカー−大型グループのコンジュゲートを使用した場合、より長いリンカーを有するコーティングしたコンジュゲートでは、免疫金にコンジュゲートした抗体によって、ハプテン−リンカー−大型グループのコンジュゲートをより低濃度で検出できる。同時に、抗体を固定した場合、より長いリンカーを有するコンジュゲートは、抗体の検出限界がより低濃度である。
【0098】
ストリップアッセイでは、どちらのアッセイ構造も免疫クロマトグラフィーストリップ試験の感度を高める。より長いリンカーを有するこれら新規のハプテン−リンカー−大型グループのコンジュゲートに基づいて、比較的短い時間内で低濃度(<10ng/ml)の小さなハプテンを検出できる高感度の免疫クロマトグラフィーストリップアッセイ形式が開発された。本発明の長いリンカーを有するハプテン−リンカー−大型グループのコンジュゲートは、抗体/ハプテンの結合を強く阻害する、乳など脂質の含有量が高い試験試料のストリップアッセイで特に有用である。本発明のプロゲステロン−OVAコンジュゲートを使用することで、乳中のプロゲステロンの最低検出限界(LDL)は、視覚検査によって判断されるように約10ng/mlであり、これは文献値30ng/mlより低いLDLである(Acta Chemica Scandinavica、50、1996、141〜145)。この文献中では、ストリップ試験には、ストリップ試験毎に、正確な、フレッシュな金標識したプロゲステロン−OVAコンジュゲートを使用しなければならない。
【0099】
迅速なSPR(BIAcore)アッセイでは、長いリンカー(18個の原子)を有するハプテン−リンカー−大型グループのコンジュゲート(225応答ユニット)は、より短いリンカー(4個の原子)を有するコンジュゲート(50応答ユニットのみ)よりはるかに高い抗体結合性能が得られた。プロゲステロン分子の4−位のコンジュゲート(50応答ユニット)も、ちょうど同じ長さのリンカー(4個の原子)を有するプロゲステロンの7α−位のコンジュゲート(12応答ユニットのみ)より優れた抗体結合を示した。
【0100】
したがって、本発明は、試験ストリップ、試験ストリップを有するキット、およびハプテン−リンカー−大型グループのコンジュゲートの反応物質にまで及ぶ。
【0101】
本発明のキットは、上記の固定したリガンドを有する固体の支持体、および本発明の標識したハプテン−リンカー−大型グループのコンジュゲートを含むバイアルまたは容器を含む。
【0102】
キットのさらなる実施形態では、キットは、固定した本発明のハプテン−リンカー−大型グループのコンジュゲートを有する固体の支持体、およびハプテン−リンカー−大型グループのコンジュゲートに対する標識したリガンドを含むバイアルまたは容器を含んでもよい。
【0103】
本発明のキットの別の実施形態では、このキットは、上記の固定したリガンドを有する固体の支持体、およびハプテンを本発明のハプテン−リンカー−大型グループのコンジュゲートに変換する変換キットを含む容器のバイアルを含んでもよい。
【0104】
最も一般的には、このキットは、試験試料および標識したコンジュゲートを固体の支持体上で移動させるための溶媒、好ましくは水性溶媒をさらに含む。標識したコンジュゲートが肉眼で見えない場合は、標識したコンジュゲートの存在を検出する手段をキット中に提供してもよい。このキットは通常、好ましくは所定の試料および/またはコンジュゲートおよび/またはリガンドの体積を固体の支持体に運ぶための、アプリケーターを含む。
【0105】
本発明のハプテン−リンカー−大型グループのコンジュゲートは、以下によって生成することができる。
【0106】
1.ハプテンを上に定義したリンカーに結合させること。好ましくは、この結合は化学的共有結合反応による、あるいは、リンカーが核酸である場合は、核酸ハイブリダイゼーションによる結合である。
【0107】
2.リンカーの遊離末端をタンパク質など大型グループに結合させること。リンカーをタンパク質に結合させる周知の方法は、標準の参考文献(「Bioconjugation: Protein Coupling Techniques for the Biomedical Sciences」、Mohammed AslamおよびAlastair Dent編)から選択することができる。
【0108】
あるいは、リンカーをまずタンパク質に結合させ、その後同じ方法でハプテンに結合させることも可能である。
【0109】
d)極性有機溶媒に溶かした活性化されたステロイドハプテンを、1〜10モル当量の異種二官能性水溶性リンカーを含む水溶液と混合するステップと、
e)混合物を反応させるステップと、
f)ステップb)のハプテン−リンカー反応生成物の残りの遊離官能性リンカーグループに大型グループを付着させるステップと
を少なくとも含む、本発明のハプテン−リンカー−大型グループのコンジュゲートを生成する方法が提供される。
【0110】
この方法は、任意選択でステップb)とc)の間にハプテン−リンカー−生成物を単離する単離ステップを含んでもよい。
【0111】
好ましくは、最終混合物は2〜30%、より好ましくは5〜15%、最も好ましくは約10%の含水率を有する。
【0112】
ステップb)の反応時間は、好ましくはほぼ24時間程度までの時間、より好ましくは12時間未満、最も好ましくは3時間である。b)の反応は通常室温で起こる。好ましい実施形態ではb)の反応は実質的に中性のpHで起こる。
【0113】
好ましくはステップa)の水溶液は2〜5モル当量の異種二官能性の水溶性リンカーを含む。
【0114】
一実施形態では、活性化されたステロイドはステロイドの活性化されたエステルである。最も好ましい実施形態ではこれはステロイドのスクシンイミドエステルである。
【0115】
好ましくは、この異種二官能性リンカーは、カルボキシル、アミノ、チオール、ヒドロキシ、アルデヒド、および反応性ハロゲンを含む群から選択された2つの異なる官能基を有する。好ましい実施形態ではこの異種二官能基はカルボキシルおよびアミノである。
【0116】
反応性でない任意の極性有機溶媒を反応で使用することができる。この極性有機溶媒は、DMF、DMSO、アセトンおよびTHFから都合良く選択することができる。
【0117】
(産業上の利用)
したがって、本発明によれば、試験試料中のハプテンを検出するアッセイが提供される。このコンジュゲートは、試験試料中のハプテンが低濃度であるかつ/または脂質含量が高く、従来の免疫アッセイでは十分に、または迅速に検出できない場合に特に有用である。このアッセイは、in situでの試験のために形成した場合に特に有用である。このような商業的な応用の1つは、ウシの妊娠診断および発情の検出に使用できる、ウシの低レベルの乳プロゲステロンを迅速にその場で検出することである。
【0118】
以降、本発明を以下の非限定的な実施例に則して例示する。
【0119】
(実施例1)
様々な長さのリンカーを有する4つのプロゲステロン−OVAコンジュゲートの合成
(a)プロゲステロン4−メルカプトプロピオン酸(1)−および7α−メルカプトプロピオン酸(示さず)。これらの化合物は、文献(Steroids、53、1989、727〜738)の、11α−ヒドロキシプロゲステロン4−および7αメルカプトプロピオン酸の調製手順に従って調製した。
【0120】
(b)スクシンイミジルプロゲステロン4−メルカプトプロピオネート(3)。プロゲステロン4−メルカプトプロピオン酸の無水DMF溶液3ml 1(434.8mg、1.04mmol)に、1.0mlのDMFのジシクロヘキシルジイミド(235.7mg、1.14mmol)溶液を加え、次いで、1.0mlのDMFのN−ヒドロキシスクシンイミド(131.5mg、1.14mmol)溶液を加えた。この溶液を室温で終夜攪拌した。フラッシュカラムクロマトグラフィーの後純粋な生成物(3)が得られた。
【0121】
(c)スクシンイミジルプロゲステロン4−メルカプトプロピオネート(5)の合成。プロゲステロン4−スクシンイミジルエステル3(300mg、0.58mmol)を4mlの無水DMFに溶かした。この溶液に、0.3mlの脱イオン水中のε−6−アミノカプロン酸(229mg、0.91mmol)を加え、この反応混合物を室温で終夜攪拌した。精製後、反応からTLCプレート上の単一スポットとして白色の固体生成物4(収率63.6%)が得られ、これは、さらに精製せずに、そのスクシンイミジルエステル5の調製に直接使用した。化合物5は3の調製に類似の方法で調製した。
【0122】
(d)スクシンイミジルプロゲステロン4−メルカプトプロピオネート(7)の合成。3から4を調製する方法と類似の方法で化合物6を調製した。化合物5(157.6mg、0.25mmol)およびε−6−アミノカプロン酸(98.7mg、0.39mmol)を出発物質として、カラムフラッシュクロマトグラフィーの後に化合物6(収率57%)が得られた。5の調製と類似の方法で化合物7も調製した。化合物6(92.1mg、0.14mmol)を出発物質として、カラムフラッシュクロマトグラフィーの後、透明な無色の油として生成物7が得られた。上記の合成したプロゲステロン誘導体(1〜7)すべてを、ES−MSおよびNMR分析によって確認した。
【0123】
(e)タンパク質コンジュゲーション。一連のプロゲステロン−卵白アルブミンコンジュゲートを、プロゲステロン遊離酸(1を含む)または単離したプロゲステロンスクシンイミジルエステル(3、5および7)のいずれかから、以下のように調製した。
【0124】
化合物1(29.5mg、0.07mmol)のDMF(0.5ml)溶液に、0.1mlのDMF中のジシクロヘキシルジイミド(16.02mg、0.078mmol)および0.1mlのDMF中のN−ヒドロキシスクシンイミド(8.94mg、0.078mmol)を加えた。この溶液を室温で90分間攪拌し、その後この溶液をOVA(63.5mg、0.0014mmol)のリン酸緩衝液(7ml、pH7.0)溶液に加えた。このコンジュゲーション反応物を4℃で終夜攪拌した。それから試料をNaHCO3水溶液、脱イオン水、およびPBS/Tに対して透析した。PD−10カラムを用いてさらに精製した後、これら精製試料中のBCAアッセイで決定されたタンパク質量が、それぞれプロゲステロン−4−OVAは4.11mg ml-1、プロゲステロン−7α−OVAは4.02mg ml-1であることが分かった。
【0125】
単離した純粋なプロゲステロンスクシンイミジルエステル(3、5、および7)も、タンパク質のコンジュゲーションに直接使用した。0.019mmolのプロゲステロン活性エステル(3、5または7)の、0.2mlのDMFまたはDMSO溶液を、卵白アルブミン(17.1mg、0.38×10-3mmol)のリン酸緩衝液(1.5ml、pH7.0)溶液に、ゆっくり攪拌しながら加えた。これら3つのタンパク質コンジュゲートの精製は、既に上記した手順と同じ手順で実施した。同様にBCAタンパク質アッセイで決定したこれらプロゲステロン−4−OVAコンジュゲート中のタンパク質量は、それぞれ1.09mg ml-1(4個の原子のリンカー)、3.56mg ml-1(11個の原子のリンカー)、および4.12mg ml-1(18個の原子のリンカー)であった。このプロゲステロン−OVAコンジュゲートの平均コンジュゲーション度、すなわちタンパク質あたりのハプテン数は、各コンジュゲートで平均4個であると概算され、これは、MALDI TOF質量分析によって直接決定された。これらプロゲステロン−OVAコンジュゲートの構造を図2に示す。
【0126】
(実施例2)
プロゲステロン−OVAコンジュゲートをコーティング抗原として使用した直接または競合ELISA
直接ELISAによって、プロゲステロン−OVAコンジュゲートのMAbに対する結合反応性が決定された。NaHCO3(50mM、pH9.6)中の一連の濃度のプロゲステロン−4−または−7α−OVAコンジュゲートで、マクロタイタープレートを事前にコーティングした。MAbのPBS/T溶液(5μg ml-1、各ウェル100μl)を加えた。プレートを3時間室温で振盪し、4℃で終夜放置した。その後、プレートにペルオキシダーゼで標識した抗ラットIgG溶液を加えた。最後に、200μlの基質溶液を各セルに加え、30分後に50μlの1M H2SO4を加えることによって酵素反応を停止した。その後、15分後に450nmでプレートを読み取り記録した。4−および7α−プロゲステロン−OVAコンジュゲートの抗体結合曲線を図3および5に示す。
【0127】
NaHCO3(50mM、pH9.6)中のプロゲステロン−OVAコンジュゲートをコーティング抗原として(1μg ml-1、各ウェル100μl)、標準曲線を作成した(図4および6参照)。競合ELISAでは、様々な標準プロゲステロン(0.001〜1000ng ml-1)のPBS/T溶液(各ウェル100μl)、およびMAb(1μg ml-1)のPBS/T溶液(各ウェル100μl)を同時にプレートに加えた。他のすべてのELISA手順は、直接ELISAと同じように実施した。
【0128】
本発明者らは、異なる長さのリンカーを有し、プロゲステロン上のコンジュゲート部位が異なる(4−または7α)プロゲステロン−OVAコンジュゲートは、従来のELISAによる抗体結合性能に有意な効果を及ぼさないことを見出した。
【0129】
(実施例3)
モノクローナル抗体 ( MoAb ) または4−プロゲステロン−OVAコンジュゲートを用いた、免疫金複合体の調製
(a)コロイド金粒子(G40)の調製。この調製は類似の文献(Analyst、123、1998、2437〜2441)に従って実施した。
【0130】
(b)モノクローナル抗体−、または4−プロゲステロン−OVAコンジュゲートでコーティングしたコロイド金の調製。コロイド金(G40)溶液をK2CO3(0.02M)でpH=7.7に滴定した後、激しく渦攪拌しながら、pHを調整したコロイド金の溶液(10ml)に抗体(120μg)または4−プロゲステロン−OVAコンジュゲート(60μg)溶液(0.2ml)を加えた。その後、この免疫金溶液を20%OVAのPBS溶液(0.15ml)で遮断した。2%OVAで繰り返し洗浄し、6,000rpmで遠心分離した後、この免疫金溶液を4℃で、0.1%NaN3を含むホウ酸(NaB7O4)緩衝液(2mM、pH=7.2)中で保存した。
【0131】
(実施例4)
4−プロゲステロン−OVAコンジュゲートをコーティング抗原として使用した、またはモノクローナル抗体を試験ストリップ上に固定した、免疫クロマトグラフィーストリップ試験
ポリエステルの補助支持体(GL-187、G&L Precision Die Cutting,Inc.、米国)でラミネートしたニトロセルロース膜(AE100、Schleicher&Schuell、ドイツ)を切断してストリップ(4または5mm幅)にした。0.01%Tween−20水溶液で10分間遮断し、その後40℃で2時間乾燥させた後、このストリップを、抗プロゲステロンMAb溶液(各ストリップあたり0.5μl)、または4−プロゲステロン−OVAコンジュゲート溶液(各ストリップあたり0.5μl)のいずれかでコーティングし、このストリップを再度40℃で2時間乾燥させた。このストリップは終夜シリカゲルの容器内で保存した。
【0132】
(a)様々な濃度のOVA−プロゲステロンコンジュゲート溶液でコーティングしたストリップでは、マイクロウェル中の半分のストリップの処理溶媒は以下のとおりである
15μlの、PBS中の1%Tween−20
15μlの、PBS中の2%ポリビニルピロリジン(PVP、分子量44000)
3μlの抗体−免疫金溶液(各ストリップ0.72μgのMAb)。
【0133】
(b)様々な濃度のモノクローナル抗体溶液でコーティングしたストリップでは、マイクロウェル中の処理溶媒は以下のとおりである
20μlの、PBS中の2.5%Tween−20
20μlの、PBS中の2%ポリビニルピロリジン(PVP、分子量44000)
5μlの、プロゲステロン−OVAでコーティングした免疫金(各ストリップ0.3μgのタンパク質)。
【0134】
上記の2つの異なる形状における抗体結合性能を、図7および図9に示す。
【0135】
(c)走査分析。ストリップを処理した後、以下の手順に従って、意図とは無関係な「Image Tool、バージョン2.00」を使用した走査分析によって図8の様々な試験ストリップの色強度を分析した
1.ストリップを走査ベッドの上に置いた
2.Image Toolを開き、file、acquire、TWAINを選択した
3.設定:スケール =36%
幅 =3.31cm
高さ =3.49cm
解像度 =400
4.Previewを押し、終わったらScanを押した
5.カラー画像をJPGファイルとして最高解像度で保存した
6.「Processing」および「Colour to Greyscale」を選択することによって画像を8bppの白黒画像に変換した
7.「Analysis」および「Line Profile」を選択し、線の端が白い面上に来るように、バンドの上に線を引いた(1つのバンドに3回繰り返し、平均値をとる)
8.「Image Tool」により、ストリップの色強度に関係するすべてのピーク高さの値を自動的に記録した。
【0136】
(実施例5)
モノクローナル抗体バイオセンサー表面を使用した抗体結合性能の評価
抗体溶液(HBS緩衝液中100μg/ml)によるバイオセンサー表面の固定化は、活性化させたCM−5センサーチップに抗体を標準アミン結合させることによって調製した。4つの異なるプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、(5)−OVA、および(7)−OVA](HBS緩衝液中1mg/mlの濃度)を連続的に、検量したバイオセンサー表面上に10μl/分で3分間流した。各コンジュゲートの結合応答(応答ユニットすなわちRU)を測定し、これを図12に示す。コンジュゲートの結合親和性の結果により、プロゲステロンの4−位のコンジュゲートが7α−プロゲステロン誘導体より優れており、また長いリンカーを有するコンジュゲートが短いリンカーを有するコンジュゲートよりはるかに優れた抗体結合を与えることが明示された。
【0137】
(実施例6)
プロゲステロン−OVAコンジュゲートバイオセンサー表面を使用した抗体結合性能の評価
上記3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVAおよび(5)−OVA]バイオセンサー表面を使用して、抗体結合の研究も評価した。具体的には、6つの濃度のMoAB(0から100μg.ml-1)を個別に、ブランクおよび固定したプロゲステロン−OVAコンジュゲートの表面上に注入した。またそれぞれのコンジュゲート表面からのデータを、ブランク表面からのセンサーグラムデータから減算することによって補正した。3つの同一の検量を実施し、それぞれの抗体濃度に有意な結合応答変化はなかった。したがって、1−、2−および4−OVAの3つの検量線はMoABのそれぞれの濃度の平均結合応答により得られ、抗体濃度に対してプロットした(図13)。リンカーの長さを4個の原子から11個の原子のリンカーに増やすと、プロゲステロン−4−OVAコンジュゲートの抗体結合シグナルが30%増加した。また、このシグナルの増大は、7α−コンジュゲート[(2)−OVA]に比べてプロゲステロン−4−OVAコンジュゲート[(3)−OVA]で31%向上した。
【0138】
(実施例7)
プロゲステロン−OVAコンジュゲートバイオセンサー表面を使用したSPRによる競合プロゲステロン免疫アッセイ
プロゲステロン用の競合SPR免疫アッセイの開発では、抗体を固定したバイオセンサー表面に比べてより優れた結合応答を与えるために、プロゲステロン−OVAコンジュゲートをバイオセンサー表面上に固定した。様々なプロゲステロン−OVAコンジュゲートを抗体バイオセンサー表面に使用したスクリーニング試験(図12)から、18個の原子のリンカーを有するコンジュゲート[(7)−OVA]が最も高い抗体結合シグナル(225RU)を有していた。これは、競合BIAcoreアッセイの設計における表面上のセンサープローブとして最も優れていると思われる。しかし、このコンジュゲート[(7)−OVA]はセンサー表面上に固定されず、本発明者らは、他のプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVAおよび(5)−OVA]のみしか、競合BIAcoreアッセイのセンサー表面上に固定できない。
【0139】
固定濃度のMoAB(200μg.ml-1)を、HBS緩衝液中の一連の濃度の遊離プロゲステロンと混合した後、次いで、各平衡混合物中の残存抗体をプロゲステロン−OVAコンジュゲートのバイオセンサー表面上に注入し、抗体結合応答を測定した。同じ実験を5回繰り返したが、それぞれの濃度のプロゲステロンの再現性は良好であった。抗体のチップ表面への結合は、溶液中の遊離プロゲステロンの量に反比例していた。遊離プロゲステロン濃度を抗体結合の平均応答(RU)に対してプロットすることにより、3つのプロゲステロン−OVAコンジュゲートの3つの標準競合曲線が得られた(図14)。このアッセイは、0から50ng.ml-1の範囲のプロゲステロン濃度で良好な感度を示した。免疫アッセイの感度は通常、検量線の勾配、すなわち単位濃度に対する応答によって決定される。したがって、[(5)−OVA]コンジュゲートは、[(2)−OVA]コンジュゲートより僅かに感度が高い[(3)−OVA]コンジュゲートより優れたアッセイ感度を示した。この結果は、SPRに基づいた免疫アッセイにおける、コンジュゲートのリンカー、およびステロイド分子のコンジュゲーション部位の効果を明示した。また、このSPRに基づいたアッセイは、0.1〜10ng.ml-1で直線的な検出範囲を示し、この範囲のR2値は、3つのプロゲステロン−OVAコンジュゲートすべてで0.99を超えることが見出された(図15)。このSPRに基づいた免疫アッセイは、従来のELISA技術に完全に匹敵し、はるかに迅速で簡単である。
【0140】
(実施例8)
長いリンカー (18 個の原子 ) を有する4−プロゲステロン−OVAコンジュゲートを使用した免疫クロマトグラフィーストリップ試験による、乳プロゲステロン濃度の決定
本発明の長いリンカー(18個の原子)を有する4−プロゲステロン−OVAコンジュゲートを様々な膜ストリップ上にコーティングすることができる。既に調製した抗体−金コンジュゲートを1〜5%のショ糖水溶液で希釈することができる。様々なコンジュゲートパッドを小さなサイズに切断し、金溶液をシートに染み込ませることによって上記の希釈した免疫金溶液(〜10μl)を各コンジュゲートパッドに施用することができる。この金コンジュゲートパッドを乾燥させ、保管する。
【0141】
試料パッドとして低ウィック(lower wick)材料またはガラス繊維を、終夜Tris緩衝液と水中の1〜5%Tween-20とに飽和させ、使用前に乾燥した。すべての試験材料(膜、金コンジュゲートパッド、試料パッドおよび溶媒吸収パッド)を補助プレートに貼り付け、プラスチックの枠(housing)にはめ込むことができる。このすぐに使用できるストリップ試験装置は、乾燥剤一袋の存在下で小袋に密封した場合、比較的安定である。
【0142】
この迅速ラテラルフローストリップ試験は、農場の乳プロゲステロン(P4)を測定するのにうまく応用することができる。このストリップは、従来のELISAの便利な代替法である。またこれは、ELISAに基づいた試験よりはるかに速い(10分以下)。これは、農業者がその場で使用するのに特に適している。この試験は、ウシの妊娠診断に使用することができる(プロゲステロン<10ng/mlでは、強い色バンドによって妊娠の陰性結果を表すが、プロゲステロン>10ng/mlでは、弱い色バンドまたは色バンドが現れないことによって妊娠の陽性結果を表す)。
【0143】
(実施例9)
伸長したリンカーを有するテストステロン−4−OVAコンジュゲートの合成
18個の原子のリンカーを有するテストステロン−4−OVAコンジュゲートの合成、およびそのOVAコンジュゲーションは、ステロイドハプテンとしてプロゲステロンを使用する代わりにテストステロンを使用して、実施例1に示す手順と同じ手順で実施する。テストステロン−4−OVAコンジュゲートを生成する方法を図16に示す。
【0144】
上記手順は、テストステロン、コルチコステロン、17α,20β−ジヒドロキシ−4−プレグネン−3−オン、11α−ヒドロキシプロゲステロン、17α−ヒドロキシプロゲステロン、21−ヒドロキシプロゲステロン、19−ヒドロキシ−4−アンドロステン−3,17−ジオンおよびヒドロコルチゾンなど、プロゲステロン分子と同じA環構造を有する他のステロイドに応用することができる。
【0145】
(実施例10)
様々な長さのポリエチレングリコール ( PEG ) リンカーを有するプロゲステロン−OVAコンジュゲートの合成
プロゲステロン−OVAコンジュゲートは、以下のステップで示すようにポリエチレングリコール(PEG)など様々な種類のリンカーを使用して合成することもできる(図17)。
【0146】
(a)異種二官能性PEGリンカー(H2N−PEG−CO2H)。アミンの1つが保護されたPEGアミン化合物は、市販のPEGジアミンをジ−tert−ブチルジカルボネートと反応させることによって調製することができる。生じたアミンの1つが保護された生成物を市販の無水ジカルボン酸と反応させ、次いでアミンの保護を外すと、長さが24個の原子であり、リンカーの端の一方にカルボキシル基を有し、他方にアミン基を有する異種二官能性PEGアミノ酸リンカーがもたらされる。
【0147】
(b)様々な長さのリンカーを有するプロゲステロン−PEG−OVAコンジュゲートの合成。実施例1と同じ手順によって、プロゲステロン−4−メルカプトプロピオン酸(1)を活性スクシンイミジルエステルに変換することができる。生じた活性化されたステロイド(3)を上記PEGアミノ酸リンカー(H2N−PEG−CO2H)と反応させて、より長いリンカー(44個の原子長)を有するプロゲステロンPEG誘導体を形成することができる。実施例1に示したものと類似のタンパク質コンジュゲーションによって、これらプロゲステロンPEG誘導体(24個および44個の原子のリンカー)をOVAタンパク質に結合させることができる。
【0148】
このプロゲステロン−PEG−OVAのコンジュゲートは、単純なアミノカプロン酸鎖を有するコンジュゲート[(3)−OVA、(5)−OVAおよび(7)−OVA]に比べてはるかに優れた水溶性を有する、長いリンカーを有するタンパク質コンジュゲートを構築するのに特に適している。
【0149】
(実施例11)
サイズ排除クロマトグラフィーによる迅速免疫アッセイ
この実施例は、サイズ排除ゲルカラムクロマトグラフィーによる迅速免疫アッセイを実施する方法を記載する。固相の固定化はない。上記実施例のようにタンパク質を使用する代わりに、伸長したリンカーによってプロゲステロンを蛍光色素とコンジュゲートさせ、式Vのプロゲステロン−リンカー−ビリルビンを形成する。
【0150】
この迅速免疫アッセイは、以下のように実施すべきである。
【0151】
ステップ1:固定量の式Vの上記プロゲステロン−リンカー−ビリルビンのコンジュゲートと、所定量の抗プロゲステロン抗体とを、プロゲステロン濃度を決定する試料溶液とよく混合すべきである。この混合物に、免疫複合体を形成させるべきである。
【0152】
ステップ2:上記の混合物は素早く短いサイズ排除カラム中を通り、これを、〜450nmのUV検出器を備えたHPLCでモニターする。HPLCクロマトグラムでは、2つの主要なピークが検出される。第1のピークは、そのはるかに大きい質量(>150,000)により早期に溶出される、抗体とプロゲステロン−リンカー−ビリルビンのコンジュゲートとの免疫複合体を表し、第2のピークは、はるかに低い質量(<1,000)を有し後に溶出されるプロゲステロン−リンカー−ビリルビンのコンジュゲートを表す。他の種には蛍光色素が付着していないので、クロマトグラム上に他の構成成分は表れない。
【0153】
第1のピークは、プロゲステロン−ビリルビンのコンジュゲートと抗体との免疫複合体の量を表す。第2のピークは、免疫複合体に結合していないプロゲステロン−ビリルビンのコンジュゲートの量を表す。
【0154】
与えられた試料中の遊離プロゲステロン濃度が高い場合は、限られた数の抗体がプロゲステロン−ビリルビンのコンジュゲートと形成する免疫複合体は、より少なくなる。これにより、第1のピークは第2のピークより小さくなる。対照的に、与えられた試料中の遊離プロゲステロン濃度が低い場合は、限られた抗体がプロゲステロン−ビリルビンのコンジュゲートと形成する免疫複合体は、より多くなる。これにより、第1のピークは第2のピークより大きくなる。したがって、第1のピークの面積、または第1ピークの面積と第2ピークの比は、試料プロゲステロンの濃度に反比例する。
【0155】
上記の開示を例としてのみ提供することを、当分野の技術者は理解されよう。本発明の多くの様々な変化を行うことができる。
【図面の簡単な説明】
【0156】
【図1】伸長した長さのリンカーを有する4−プロゲステロン誘導体の合成を示す図である。
【図2】様々な長さのリンカー(4個、11個、または18個の原子のリンカー)を有する、1つの7α−プロゲステロン−OVAコンジュゲート[(2)−OVA]および3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVAおよび(7)−OVA]の構造を示す図である。
【図3】類似の抗体(MoAb)結合曲線を有する、4−および7α−プロゲステロン−OVAコンジュゲート[(2)−OVAは下の曲線、(3)−OVAは上の曲線]のどちらもを示す図である。
【図4】抗体(MoAb)と(3)−OVAコンジュゲート(上の曲線)および(2)−OVAコンジュゲート(下の曲線)との標準曲線を示す図である。
【図5】類似の抗体(MoAb)結合性能を有する3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]を示す図である。
【図6】抗体(MoAb)と3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVA、(5)−OVA、(7)−OVA]との、非常に類似した標準曲線を示す図である。
【図7】免疫金にコンジュゲートした抗体(MoAb)とラテラルフロー試験ストリップ上にコーティングした3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)0OVAは中段のストリップ、(7)−OVAは下段のストリップ]との、様々な結合性能を示す図である。
【図8】図7の走査計測分析(scannometric analysis)[(3)−OVAは下の曲線、(5)−OVAは真中の曲線、(7)−OVAは上の曲線]の結果を示す図である。
【図9】固定したモノクローナル抗体と、3つの4−プロゲステロン−OVAコンジュゲート[(3)−OVAは上段のストリップ、(5)0OVAは中段のストリップ、(7)−OVAは下段のストリップ]の免疫金複合体との、様々な結合性能を示す図である。
【図10】小さなハプテン用のバイオドットフロースルー免疫アッセイ形式の2ステップの設計を示す図である。
【図11】金表面に固定した抗体または本発明のハプテン−リンカー大型グループのコンジュゲートを使用した、小さなハプテン用の表面プラズモン共鳴(SPR)フロー免疫センサーの2つの設計を示す図である。
【図12】4つのプロゲステロン−OVAコンジュゲート[(2)−OVA、〜12RU;(3)−OVA、〜50RU;(5)−OVA、〜150RU;(7)−OVA、〜225RU]と固定したモノクローナル抗プロゲステロン抗体(MoAb)との様々な結合性能を、SPRバイオセンサーによって示す図である。
【図13】3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]を固定したバイオセンサー表面を使用した、抗体結合応答を示す図である。
【図14】3つのプロゲステロン−OVAコンジュゲート[(2)−OVA、(3)−OVA、および(5)−OVA]バイオセンサー表面を使用した、プロゲステロンの競合免疫アッセイの標準曲線を示す図である。
【図15】競合SPRに基づいた免疫アッセイから得られたプロゲステロンの検出の直線範囲0.1〜10ng.ml-1を示す図である。
【図16】18個の原子のリンカー有するテストステロン−4−OVAコンジュゲートの生成方法を示す図である。
【図17】様々な長さのポリエチレングリコールリンカーを有するプロゲステロン−4−OVAコンジュゲートの生成の設計を示す図である。
Claims (56)
- Wがチオエーテル架橋である、請求項1のハプテン−リンカー−大型グループのコンジュゲート。
- Yが10個以上50個以下の原子長である、前記請求項のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- Yが11個以上24個以下の原子長である、前記請求項のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- Yが11個以上18個以下の原子長である、前記請求項のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- Zがタンパク質またはポリペプチドである、前記請求項のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- Zが卵白アルブミンである、前記請求項のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- Zが指示薬グループである、請求項1から6のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- Zがビリルビンである、請求項1から6および9のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- Xがプロゲステロンである、前記請求項のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- リガンドが免疫グロブリン分子である、前記請求項のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲート。
- リガンドが抗体または抗体断片である、請求項16に記載のハプテン−リンカー−大型グループのコンジュゲート。
- a)ハプテンを結合する能力があるリガンドを試験試料と接触させるステップと、
b)ステップa)のリガンドを一般式X−W−Y−Zのハプテン−リンカー−大型グループのコンジュゲート
(式中、
Xは、ハプテンであり、
Wは、任意選択でチオエーテルまたはエーテル基であり、
Yは、10個以上の原子長のリンカーであり、
Zは、Yが存在しない場合にXのリガンドへの結合に対して立体障害を与えるのに十分なサイズの大型グループである)
とさらに接触させるステップと、
c)反応が実質的に平衡に達する前にリガンドに結合したコンジュゲートしていないハプテンの量を決定するステップと
を含む、試料中のハプテンを検出するための迅速アッセイ法。 - リガンドを接触させる第2ステップ(b)により、過剰の結合していないリガンドのほとんどが接触され結合される、請求項19に記載の迅速アッセイ法。
- ハプテン−リンカー−大型グループのコンジュゲートが固定されている、請求項19または請求項20に記載の迅速アッセイ法。
- ステップa)の混合物をステップb)のハプテン−リンカー−大型グループのコンジュゲートの上に流す、請求項19から21のいずれか一項に記載の迅速アッセイ法。
- ハプテンがステロイドである、請求項19から22のいずれか一項に記載の迅速アッセイ法。
- ハプテンがプロゲステロンである、請求項19から22のいずれか一項に記載の迅速アッセイ法。
- リガンドが抗体である、請求項19から23のいずれか一項に記載の迅速アッセイ法。
- a)試験試料を一般式X−W−Y−Zのハプテン−リンカー−大型グループのコンジュゲートハプテン−リンカー−大型グループのコンジュゲート
(式中、
Xは、ハプテンであり、
Wは、任意選択でチオエーテルまたはエーテル基であり、
Yは、10個以上の原子長のリンカーであり、
Zは、Yが存在しない場合にXのリガンドへの結合に対して立体障害を与えるのに十分なサイズの大型グループである)
と混合するステップと、
b)生じた混合物を、このハプテンを結合する能力があるリガンドと接触させるステップと、
c)反応混合物が実質的に平衡に達する前にリガンドに結合したコンジュゲートしていないハプテンの量を決定するステップと
を含む、試料中のハプテンを検出するための迅速アッセイ。 - リガンドが固定されている、請求項26に記載の迅速アッセイ。
- 生じた混合物を固定したリガンドと接触させるステップb)が、フローオーバーまたはフロースルーシステムによって行われる、請求項26または請求項27に記載の迅速アッセイ。
- ハプテンがステロイドである、請求項26から28のいずれか一項に記載の迅速アッセイ法。
- ハプテンがプロゲステロンである、請求項26から29のいずれか一項に記載の迅速アッセイ法。
- リガンドが抗体である、請求項26から30のいずれか一項に記載の迅速アッセイ法。
- a)ハプテンに結合するリガンドと、
b)請求項1から18のいずれか一項に記載のハプテン−リンカー−大型グループのコンジュゲートと
を少なくとも含む、迅速アッセイのキット。 - キットがさらに指示薬を含む、請求項32に記載の迅速アッセイのキット。
- 指示薬がハプテン−リンカー−大型グループのコンジュゲートに結合している、請求項33に記載の迅速アッセイのキット。
- 指示薬がリガンドに結合している、請求項33に記載の迅速アッセイのキット。
- フローオーバーキットである、請求項32から35のいずれか一項に記載の迅速アッセイのキット。
- 試験ストリップである、請求項36に記載の迅速アッセイのキット。
- フロースルーキットである、請求項32から35のいずれか一項に記載の迅速アッセイのキット。
- コンジュゲートを、コンジュゲート内のハプテンを結合する能力があるリガンドと、反応が実質的に平衡に達しない所定の時間接触させるステップを含む、一般式X−W−Y−Zのハプテン−リンカー−大型グループのコンジュゲートハプテン−リンカー−大型グループのコンジュゲート
(式中、
Xは、ハプテンであり、
Wは、任意選択でチオエーテルまたはエーテル基であり、
Yは、10個以上の原子長のリンカーであり、
Zは、Yが存在しない場合にXのリガンドへの結合に対して立体障害を与えるのに十分なサイズの大型グループである)
を結合させる方法。 - リガンドが固定されている、請求項38に記載の方法。
- リガンドをハプテン−リンカー−大型グループのコンジュゲートと接触させる前にハプテンと接触させる、請求項38または請求項40に記載の方法。
- リガンドをハプテンと接触させる前にまたは同時にハプテン−リンカー−大型グループのコンジュゲートと接触させる、請求項38または請求項40に記載の方法。
- リガンドが免疫グロブリン分子である、前記請求項のいずれかに記載のハプテン−リンカー−大型グループのコンジュゲート。
- a)極性有機溶媒に溶かした活性化されたステロイドハプテンを、1〜10モル等量の異種二官能性水溶性リンカーを含む水溶液と混合するステップと、
b)混合物を反応させるステップと、
c)ステップb)のハプテン−リンカー反応生成物の残りの遊離官能性リンカーグループに大型グループを付着させるステップと
を少なくとも含む、請求項1から18に記載のいずれか一項のハプテン−リンカー−大型グループのコンジュゲートを生成する方法を提供する。 - ステップb)とc)の間にハプテン−リンカー生成物を単離する単離ステップを含む、請求項44に記載の方法。
- 最終混合物が2〜30%の含水率を有する、請求項44または請求項45に記載の方法。
- 最終混合物が5〜15%の含水率を有する、請求項44から46のいずれか一項に記載の方法。
- 最終混合物が約10%の含水率を有する、請求項44から47のいずれか一項に記載の方法。
- ステップb)の反応時間がほぼ24時間程度までの時間である、請求項44から48のいずれか一項に記載の方法。
- b)の反応が室温で起こる、請求項44から49のいずれか一項に記載の方法。
- b)の反応が実質的に中性のpHで起こる、請求項44から50のいずれか一項に記載の方法。
- ステップa)の水溶液が、活性化されたステロイドに比べて2〜5モル等量の異種二官能性の水溶性リンカーを含む、請求項44から51のいずれか一項に記載の方法。
- 活性化されたステロイドがステロイドの活性化されたエステルである、請求項44から52のいずれか一項に記載の方法。
- 活性化されたステロイドがステロイドのスクシンイミドエステルである、請求項44から53のいずれか一項に記載の方法。
- 異種二官能性リンカーの端の一方がカルボキシルであり、他方がアミノである、請求項44から54のいずれか一項に記載の方法。
- 極性有機溶媒が、DMF、DMSO、アセトンおよびTHFを含む群から選択される、請求項44から55のいずれか一項に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| NZ511705A NZ511705A (en) | 2001-05-14 | 2001-05-14 | Methods and rapid immunoassay device for detecting progesterone and other steroids |
| PCT/NZ2002/000092 WO2002092631A1 (en) | 2001-05-14 | 2002-05-14 | Kinetic assay |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004538447A true JP2004538447A (ja) | 2004-12-24 |
| JP2004538447A5 JP2004538447A5 (ja) | 2005-08-25 |
Family
ID=19928478
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002589514A Pending JP2004538447A (ja) | 2001-05-14 | 2002-05-14 | 動力学アッセイ |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20040171069A1 (ja) |
| EP (1) | EP1404717A4 (ja) |
| JP (1) | JP2004538447A (ja) |
| AU (1) | AU2002311701B2 (ja) |
| CA (1) | CA2447032A1 (ja) |
| NZ (1) | NZ511705A (ja) |
| WO (1) | WO2002092631A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013083631A (ja) * | 2011-09-26 | 2013-05-09 | Fujifilm Corp | 蛍光粒子を用いたコルチゾール免疫アッセイ |
| JP2015514766A (ja) * | 2012-04-18 | 2015-05-21 | シーメンス・ヘルスケア・ダイアグノスティックス・インコーポレーテッドSiemens Healthcare Diagnostics Inc. | コンジュゲート試薬を製造するための化合物および方法 |
| JP2016136150A (ja) * | 2006-11-01 | 2016-07-28 | ベンタナ・メデイカル・システムズ・インコーポレーテツド | ハプテン、ハプテンコンジュゲート、その組成物ならびにそれらの製造および使用の方法 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7416892B2 (en) * | 2003-01-21 | 2008-08-26 | Micronics, Inc. | Method and system for microfluidic manipulation, amplification and analysis of fluids, for example, bacteria assays and antiglobulin testing |
| NZ528323A (en) * | 2003-09-18 | 2006-05-26 | Horticulture & Food Res Inst | Immunoassay |
| GB0523366D0 (en) * | 2005-11-16 | 2005-12-28 | Univ Cardiff | Method |
| WO2008106149A1 (en) * | 2007-02-28 | 2008-09-04 | Children's Medical Center Corporation | Methods for predicting the onset of menarche |
| CN103399696B (zh) * | 2013-08-16 | 2018-10-09 | 上海合合信息科技发展有限公司 | 直线/线段吸附的方法及装置,构造多边形的方法及装置 |
| JP6353534B2 (ja) * | 2014-07-01 | 2018-07-04 | 新日鉄住金化学株式会社 | 標識物質、免疫学的測定法、免疫学的測定用試薬、アナライトの測定方法、アナライト測定用キット、及び、ラテラルフロー型クロマト用テストストリップ |
| CN105628924A (zh) * | 2015-12-31 | 2016-06-01 | 苏州科铭生物技术有限公司 | 一种皮质酮含量测定试剂盒及其方法 |
| CN111175499A (zh) * | 2020-02-28 | 2020-05-19 | 江南大学 | 一种用于检测睾酮素的elisa试剂盒的制备方法 |
Family Cites Families (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3880823A (en) * | 1966-09-16 | 1975-04-29 | Toyo Jozo Kk | Process for preparing peptides using N-hydroxy succinimide mono-and dichloroacetate esters |
| US4039385A (en) * | 1972-05-08 | 1977-08-02 | Syva Company | Cardiac glycoside enzyme conjugates |
| US4220565A (en) * | 1979-01-18 | 1980-09-02 | Scripps Clinic & Research Foundation | Immunochemical conjugates: method and composition |
| US4351760A (en) * | 1979-09-07 | 1982-09-28 | Syva Company | Novel alkyl substituted fluorescent compounds and polyamino acid conjugates |
| DE3224788A1 (de) * | 1981-07-17 | 1983-02-03 | South African Inventions Development Corp., Scientia, Pretoria,Transvaal | Traegergebundenes immunogenes material |
| DE3263249D1 (en) * | 1981-08-21 | 1985-05-30 | Hoffmann La Roche | Method for the determination of carcinoembryonic antigen (cea) and suitable antibody solution for the determination |
| FR2522967B1 (fr) * | 1982-03-15 | 1986-03-07 | Anvar | Conjugues d'haptenes et de muramyl-peptides, doues d'activite immunogene et compositions les contenant |
| JPS58194900A (ja) * | 1982-05-10 | 1983-11-12 | Shionogi & Co Ltd | 4−または6−置換アルドステロン類,その製法およびそのイムノアツセイにおける使用法 |
| US4687808A (en) * | 1982-08-12 | 1987-08-18 | Biospecific Technologies, Inc. | Activation of biocompatible polymers with biologicals whose binding complements are pathological effectors |
| EP0197521B1 (en) * | 1985-04-09 | 1989-08-02 | TERUMO KABUSHIKI KAISHA trading as TERUMO CORPORATION | Immunoglobulin adsorbent and adsorption apparatus |
| US4894348A (en) * | 1987-07-01 | 1990-01-16 | Ronald Robert C | Fluorescein-conjugated proteins with enhanced fluorescence |
| US5196351A (en) * | 1987-09-30 | 1993-03-23 | Beckman Instruments, Inc. | Bidentate conjugate and method of use thereof |
| DE3889063T2 (de) * | 1987-10-30 | 1994-12-01 | American Cyanamid Co | Dischwefel-Analoge von LL-E33288 Antitumor-Verbindungen. |
| US5776713A (en) * | 1988-02-02 | 1998-07-07 | Biocode Ltd. | Marking of products to establish identity and source |
| DE69008521T2 (de) * | 1989-03-07 | 1994-10-20 | Genentech Inc | Kovalente konjugate von lipiden und oligonukleotiden. |
| CA2016584C (en) * | 1989-05-17 | 1999-06-29 | Robert S. Greenfield | Anthracycline conjugates having a novel linker and methods for their production |
| DE3919915A1 (de) * | 1989-06-19 | 1990-12-20 | Boehringer Mannheim Gmbh | Aminoalkylmaleimide und davon abgeleitete hapten- und antigenderivate sowie konjugate mit peptiden oder proteinen |
| AU7759291A (en) * | 1990-03-29 | 1991-10-21 | Gilead Sciences, Inc. | Oligonucleotide-transport agent disulfide conjugates |
| US5191066A (en) * | 1990-12-07 | 1993-03-02 | Abbott Laboratories | Site-specific conjugation of immunoglobulins and detectable labels |
| DE4107570A1 (de) * | 1991-03-07 | 1992-11-19 | Diagnostikforschung Inst | Chelate, deren metallkomplexe sowie ihre verwendung in diagnostik und therapie |
| CA2062240A1 (en) * | 1991-06-07 | 1992-12-08 | Susan J. Danielson | Labeled hydantoin derivatives for immunoassays |
| US5578457A (en) * | 1992-08-07 | 1996-11-26 | Johnson & Johnson Clinical Diagnostics, Inc. | Immunoassays with novel labeled carbamazepine hapten analogues |
| DE4311021A1 (de) * | 1993-03-31 | 1994-10-27 | Diagnostikforschung Inst | Bifunktionelle Chelatbildner, deren Technetium- und Rhenium-Komplexe, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende radiopharmazeutische Mittel |
| FR2706618B1 (fr) * | 1993-06-11 | 1995-09-01 | Bio Merieux | Dispositif pour le dosage d'haptènes et son utilisation. |
| FR2707010B1 (ja) * | 1993-06-25 | 1995-09-29 | Bio Merieux | |
| US5773001A (en) * | 1994-06-03 | 1998-06-30 | American Cyanamid Company | Conjugates of methyltrithio antitumor agents and intermediates for their synthesis |
| DE4444002A1 (de) * | 1994-12-10 | 1996-06-13 | Behringwerke Ag | Immunoassays für Haptene und hierfür verwendbare Haptentracer-Antikörper-Komplexe sowie Verfahren zur Herstellung derselben |
| US5620890A (en) * | 1995-03-14 | 1997-04-15 | The United States Of America As Represented By The Secretary Of Agriculture | Monoclonal antibodies to hygromycin B and the method of making the same |
| US5876727A (en) * | 1995-03-31 | 1999-03-02 | Immulogic Pharmaceutical Corporation | Hapten-carrier conjugates for use in drug-abuse therapy and methods for preparation of same |
| WO1997015316A1 (en) * | 1995-10-27 | 1997-05-01 | Merck & Co., Inc. | Conjugates of gonadotropin releasing hormone |
| US5843682A (en) * | 1995-11-20 | 1998-12-01 | Boehringer Mannheim Corporation | N-1-carboxyalkyl derivatives of LSD |
| WO1997023243A1 (en) * | 1995-12-22 | 1997-07-03 | Bristol-Myers Squibb Company | Branched hydrazone linkers |
| US6022959A (en) * | 1996-08-20 | 2000-02-08 | Pharmacyclics, Inc. | Nucleic acids internally-derivatized with a texaphyrin metal complex and uses thereof |
| US6339069B1 (en) * | 1996-10-15 | 2002-01-15 | Elan Pharmaceuticalstechnologies, Inc. | Peptide-lipid conjugates, liposomes and lipsomal drug delivery |
| US5858653A (en) * | 1997-09-30 | 1999-01-12 | Surmodics, Inc. | Reagent and method for attaching target molecules to a surface |
| DE19814814C2 (de) * | 1998-04-02 | 2002-01-31 | Gerhard Steffan | Wasserlösliche, Iminophenazinderivate enthaltende pharmazeutische Zusammensetzungen, deren Herstellung und Verwendung |
| US6251382B1 (en) * | 1998-04-17 | 2001-06-26 | Enzon, Inc. | Biodegradable high molecular weight polymeric linkers and their conjugates |
| AU3826099A (en) * | 1998-05-04 | 1999-11-23 | Andreas Johannes Kesel | Monomeric, oligomeric and polymeric knoevenagel condensation products |
| US6262264B1 (en) * | 1998-06-01 | 2001-07-17 | Roche Diagnostics Corporation | Redox reversible imidazole osmium complex conjugates |
| US6703381B1 (en) * | 1998-08-14 | 2004-03-09 | Nobex Corporation | Methods for delivery therapeutic compounds across the blood-brain barrier |
| CA2283597C (en) * | 1998-10-02 | 2008-02-05 | Ortho-Clinical Diagnostics, Inc. | Reduced cortisol conjugates |
| ES2302699T3 (es) * | 1999-08-27 | 2008-08-01 | Novartis Vaccines And Diagnostics, Inc. | Oligonucleotidos quimericos antisentido y formulaciones de transfeccion celular de los mismos. |
| AU1172001A (en) * | 1999-11-02 | 2001-05-14 | Nst Neurosurvival Technologies Ltd. | Compounds and pharmaceutical compositions comprising same |
| US6372907B1 (en) * | 1999-11-03 | 2002-04-16 | Apptera Corporation | Water-soluble rhodamine dye peptide conjugates |
-
2001
- 2001-05-14 NZ NZ511705A patent/NZ511705A/xx unknown
-
2002
- 2002-05-14 AU AU2002311701A patent/AU2002311701B2/en not_active Ceased
- 2002-05-14 US US10/477,191 patent/US20040171069A1/en not_active Abandoned
- 2002-05-14 CA CA002447032A patent/CA2447032A1/en not_active Abandoned
- 2002-05-14 WO PCT/NZ2002/000092 patent/WO2002092631A1/en active Application Filing
- 2002-05-14 JP JP2002589514A patent/JP2004538447A/ja active Pending
- 2002-05-14 EP EP02738989A patent/EP1404717A4/en not_active Withdrawn
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016136150A (ja) * | 2006-11-01 | 2016-07-28 | ベンタナ・メデイカル・システムズ・インコーポレーテツド | ハプテン、ハプテンコンジュゲート、その組成物ならびにそれらの製造および使用の方法 |
| JP2018040813A (ja) * | 2006-11-01 | 2018-03-15 | ベンタナ・メデイカル・システムズ・インコーポレーテツド | ハプテン、ハプテンコンジュゲート、その組成物ならびにそれらの製造および使用の方法 |
| JP2020126057A (ja) * | 2006-11-01 | 2020-08-20 | ベンタナ・メデイカル・システムズ・インコーポレーテツド | ハプテン、ハプテンコンジュゲート、その組成物ならびにそれらの製造および使用の方法 |
| JP7000489B2 (ja) | 2006-11-01 | 2022-01-19 | ベンタナ・メデイカル・システムズ・インコーポレーテツド | ハプテン、ハプテンコンジュゲート、その組成物ならびにそれらの製造および使用の方法 |
| JP2013083631A (ja) * | 2011-09-26 | 2013-05-09 | Fujifilm Corp | 蛍光粒子を用いたコルチゾール免疫アッセイ |
| JP2015514766A (ja) * | 2012-04-18 | 2015-05-21 | シーメンス・ヘルスケア・ダイアグノスティックス・インコーポレーテッドSiemens Healthcare Diagnostics Inc. | コンジュゲート試薬を製造するための化合物および方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2447032A1 (en) | 2002-11-21 |
| US20040171069A1 (en) | 2004-09-02 |
| NZ511705A (en) | 2004-03-26 |
| EP1404717A4 (en) | 2006-03-08 |
| WO2002092631A1 (en) | 2002-11-21 |
| AU2002311701B2 (en) | 2008-10-09 |
| EP1404717A1 (en) | 2004-04-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0579676B1 (en) | Method for specific binding assays using a releasable ligand | |
| CA1255216A (en) | Immunoassay for the detection of ligands | |
| US5028535A (en) | Threshold ligand-receptor assay | |
| JP3340434B2 (ja) | ジビニルスルホンに由来する成分を含んで成る水溶性ポリマーベース試薬及び抱合体 | |
| JP4546462B2 (ja) | ポイントオブケア検査用メンブレンストリップバイオセンサーシステム | |
| JP2562194B2 (ja) | 数種の被検物質の環境内濃度の定量 | |
| FI80345C (fi) | Visualiseringsfoerfarande foer direkt eller indirekt detektering av ett agglomerat bildat av ett specifikt bindande aemne och en motsvarande acceptorsubstans vid blot overlay-bestaemningar och i dessa bestaemningar anvaendbar testfoerpackning | |
| JPS5923251A (ja) | 多価抗原の測定法及び測定試薬 | |
| JPH07260784A (ja) | 四級アンモニウム免疫原接合体およびイムノアッセイ試薬 | |
| JPH0814579B2 (ja) | 特異的結合性物質の測定法及び試薬 | |
| WO1995032428A1 (en) | Reagents and methods for the rapid and quantitative assay of pharmacological agents | |
| US20050042696A1 (en) | Systems and methods for detection of analytes in biological fluids | |
| JP2004538447A (ja) | 動力学アッセイ | |
| ES2318639T3 (es) | Un metodo para inmunotransferencia y kit para verde leucomalaquita y verde malaquita. | |
| AU2002311701A1 (en) | Kinetic assay | |
| JPH05249113A (ja) | 分離・分析方法及び装置 | |
| EP1540343B1 (en) | Method for the elimination of interferences in immunochromatographic assays | |
| US10539557B2 (en) | AH-7921 Detection | |
| JPH03503566A (ja) | 天然結合タンパク質に対するモノクローナル抗体を用いたイムノアツセイ | |
| JP2672151B2 (ja) | 磁性体を利用した酵素免疫測定法 | |
| JP3923076B2 (ja) | 特定位にとり込まれたマーカー基およびハプテンを有するオリゴマー担体分子 | |
| JP4302798B2 (ja) | リガンド結合表面の調製方法 | |
| JP3516526B2 (ja) | 安定化された酵素標識抗体 | |
| Diamandis et al. | MC-1 A new generation of time-resolved fluoroimmunoassays with europium chelates as labels | |
| JPH11264822A (ja) | 免疫分析試薬及びそれを用いた免疫分析方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050516 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080702 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20081203 |