JP2004536617A - 核酸増幅方法 - Google Patents
核酸増幅方法 Download PDFInfo
- Publication number
- JP2004536617A JP2004536617A JP2003517293A JP2003517293A JP2004536617A JP 2004536617 A JP2004536617 A JP 2004536617A JP 2003517293 A JP2003517293 A JP 2003517293A JP 2003517293 A JP2003517293 A JP 2003517293A JP 2004536617 A JP2004536617 A JP 2004536617A
- Authority
- JP
- Japan
- Prior art keywords
- probe
- amplification product
- product
- amplification
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/6848—Nucleic acid amplification reactions characterised by the means for preventing contamination or increasing the specificity or sensitivity of an amplification reaction
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
Description
【0001】
緒言
本発明は核酸の作製、増幅、検出及び定量に関するものである。特に、本発明は環状核酸の作製、増幅、検出及び定量に関するものである。
【背景技術】
【0002】
この20年の間に核酸の増幅は遺伝子異常、遺伝子変異の同定または感染性病原体の同定の一般的技術となった。
【0003】
核酸を増幅するための方法は多数存在する。それらは、ポリメラーゼ連鎖反応(PCR)、及びリガーゼ連鎖反応(LCR)、両者ともに加熱サイクルを必要とする、転写に基づく増幅系(TAS)、核酸配列に基づく増幅(NASBA)、ストランド置換増幅(SDA)、インベーダー検定、ローリングサークル増幅(RCA)、及びハイパー−ブランチドRCA(HRCA)などである。
【0004】
以下の記述において、本発明はローリングサークル増幅法(Lizardi et al.,1998)においてよく使用される参考文献,USP5854033,USP6124120,USP6143495,USP6183960,6210884を引用して記述される。しかし、本発明は他の核酸増幅方法、特に他の環状増幅方法においても同等の有用性を見出しうるので、それに限定することは意図していない。本発明に関係する環状核酸は、環状化プローブ、環状化標的核酸、環状レポーター核酸、プラスミド、あるいは環状標的核酸でありうる。本発明は、例えば遺伝子分類、突然変異探索、配列分析、感染性病原体の同定、分子診断、遺伝子分析及び法医学、に使用することができるが、そのほかにタンパクの検出、タンパク−タンパク相互作用、及び生体分子の相互作用の分析にも使用することができる。
【0005】
本発明は環化核酸を作製する新規方法、及び該環化核酸を増殖し、検出し、または分析することに関係している。分析の目的で環化核酸を作製する方法のいくつかは文献に既知である。南京錠プローブは標的核酸配列の認識の際に環化するオリゴヌクレオチドプローブである(Nilsson et al.,1994)。プロキシミティープローブリゲーションは、(Landegren,PCT WO99/49079)に記述されているように、標的分子認識の結果として環状化プローブを作製する鋳型となりうる。
【0006】
RCAは環化プローブの線状増幅を生じるので、感度が限定されている。典型的にRCAは1時間当たり各環化プローブの約1000コピーを生産する。
【0007】
この核酸増幅過程、特にRCA過程の感度の改善が本発明の目的である。
【0008】
(発明の開示)
発明の説明
例えばRCAプロセスのような増幅プロセスの感度を改善する一つの方法はこのプロセスの間に生じるシグナルを増加させることである。これは初代のRCA産物を鋳型にした続く増幅過程を行うことにより達成することができる。そのような続く増幅過程の一つは、初代のRCA産物をさらに続く増幅過程において増幅されるモノマーの新規作製に回すことによって行われる。したがって、最初の態様において、本発明は以下の段階を含む核酸産物増幅方法に関係している:
− 典型的にRCAにより、初代増幅産物を提供する、この産物は増幅する配列のコンカテマーを含んでいる;
− 増幅産物をモノマー化する;
− このようにして形成したモノマーをさらに増幅して、第二代増幅産物を形成する。
【0009】
続く環の増幅の後にモノマーは結合されて環を形成することが望ましいが、その場合に続く増幅はRCAが理想的である(図1)。増幅される配列はプローブ配列またはプローブ配列の部分でありうるし、あるいはcDNA,ゲノムDNAまたはRNA配列を含むことがありうる。
【0010】
本発明の一態様において、初代増幅産物のモノマー化は制限酵素及び初代増幅産物に相補的なオリゴヌクレオチドを使用して行われ、制限酵素は初代増幅産物/オリゴヌクレオチドのハイブリッドを切断する。
【0011】
その他に、増幅される配列は、初代増幅産物のモノマー化をすることができる触媒活性配列を含むことができる(Daubendiek&Kool,1997)。
【0012】
典型的に、初代増幅産物は初代増幅段階において生産され、その段階はポリメラーゼ酵素を使用するが、その方法はポリメラーゼ酵素の不活化段階を含んでいる。重合は等温条件下で行うことが理想的である。
【0013】
初代増幅産物のモノマー化がオリゴヌクレオチド及び制限酵素を使用して行われる場合には、オリゴヌクレオチドはRCA反応産物中に存在するモノマーの数よりも過剰に添加される。変性(及び酵素不活化)段階の後にモノマーとハイブリッド形成するオリゴヌクレオチドの大部分は切断されないであろう。したがって、このハイブリッド形成反応の分子内優先性のために二量体あるいは多量体形成よりも環形成が(実用的濃度において)優先するので、非切断オリゴヌクレオチドとのハイブリッド形成及びリガーゼ処理によりモノマーは優先的に環化するであろう。
【0014】
この新規に生じた環は次いで、例えば、リゲーションの鋳型となる同じオリゴヌクレオチドにより開始される後続RCA段階の鋳型となることができる。したがって、線状増幅と異なり、この方法では(X1xX2……xXn)倍の増幅を生じるであろう、そしてこの“X”は各RCAにおいて合成されるモノマーの数であり、“n”はRCAの消化及び環化の回数である。この方法は環状核酸の最初の複雑な組み合わせを維持するはずであるから、多数の異なる環状核酸の組み合わせをRCAにより増幅する場合に本方法は特別な価値を有するはずである。これは環化反応の分子内優先性によるものであり、そして同時に増幅される他の分子に妨害されることなく、環化された核酸の増幅の各回は連続しておりそして生産的(一つの環−→環の数千コピーを持つ一つの生成物)である故である。さらに、反応の各回は生成物抑制あるいはプライマー制限を受けることがなく、そして重合反応の間により多くのポリメラーゼを必要とすることもない。したがって、本方法は本質的に異なる増幅環の数には無関係であるはずである。この反応産物は一本鎖であり、これはハイブリッド形成プローブにより容易に検出することができる。RCA反応の直線性は標的分子の定量的測定に確実な定量性を保障するはずである。
【0015】
モノマー化は反応に存在する種々のプローブの各々に存在する共通した配列を使用して行うことができる。第二世代のRCAにおいて、切断/環化オリゴヌクレオチドを過剰に添加してあるためにすべてのモノマーは環化するので、生成物が二本鎖になるリスク(下記参照)は少ない。したがって、第二世代RCAにおいて配列は存在せず、そして第二世代RCA産物で合成を開始することができる。また、この多項増幅方法は完全に環状分子に特化しており、他の増幅方法に見られる偽の増幅生成物のリスクは少ない。
【0016】
分析する遺伝子発現が非常に複雑なパターンを示す場合には、例えば、マイクロアレイを使用してエンドポイント分析を行う必要がある。本発明を使用して、複合した方法において高度な分解能と正確度で遺伝子発現を監視することができる。それぞれ遺伝子産物またはフラグメントに特異的な、いわゆる南京錠プローブのいくつかはcDNAまたはRNAを鋳型としたリゲーションにより環化される。これらの南京錠プローブは、DNAマイクロアレイ上でRCA産物を分析するためにタグ配列をコードすることができる。増幅のその他の方法はPCRを使用するものである。しかし、PCRは、数回のPCRサイクルの後にDNA鎖の再アニーリングのためにそれ以上生成物を生じない定常状態に達する生成物阻害反応である。豊富にある転写物は複合増幅反応が終了する以前に増幅を止め、一方少ない転写物は増幅を続けるので、少ない転写物に対して豊富な転写物の定量性をゆがめるであろう。PCRを使用して定量的エンドポイント測定をする際の問題点はよく知られており、そのためにPCRのリアルタイム分析技術が開発され、少ない数の転写物(〜1−4転写物)を同時に分析することができる(Heid et al.,1996)。
【0017】
本発明を使用して環化した南京錠プローブを増幅することにより、そのようなゆがみは生じない、なぜなら、反応は生成物阻害を受けずにむしろ基質、すなわちデオキシヌクレオチド三燐酸によってのみ制限を受ける。これは一回の反応において非常に多数の転写物の定量を可能にする。
【0018】
環状配列の第一世代、第二世代そして多分それ以上の世代を複製する方法はプローブ及び標的核酸配列の両者に適用することができる。生成物は配列分析または、例えば以下に記述する方法のいずれかにより分析することができる。ゲノムまたはcDNA配列の増幅のための望ましい方式において、最初に標的DNAを、例えば制限酵素またはFLAPエンドヌクレアーゼを使用してフラグメントとし、次いで両端において増幅する標的DNAの末端と相補的な一本鎖配列からなる環化アダプターを使用して環化する。多数の異なるフラグメントを同一の反応において増幅する場合には、類似のサイズのフラグメントを増幅するのが有利であろう。例えばゲノムDNA検体中の類似サイズの配列をすべて制限フラグメントとして発生させる一つの制限酵素または制限酵素の組み合わせを発見することは不可能であろう。しかし、異なる制限酵素または制限酵素の組み合わせを使用して得られる多分10個の異なる制限消化産物の少なくとも一つの望むサイズの制限フラグメントに全ての配列が表示されることはありそうである。もっとも有利なのは、二本鎖となった標的に相補的でない部分が一本鎖部分の間に存在し、そしてそれが共通の制限オリゴヌクレオチド配列を含んでいる(図2)。共通の制限オリゴヌクレオチド配列を使用することにより、多数の異なる標的DNAフラグメントを異なる環化アダプターを使用して環化することができ、しかも次いで同じ共通制限オリゴヌクレオチド及び酵素を使用して増幅することができる。プローブ環化反応と同様に、この標的環化反応は、分子内環化反応が分子間結合反応に優先するので交差反応による産物を生じそうにない。したがって、PCRのような増幅方法と異なり、複数の異なる標的DNAフラグメントを平行して増幅することができる。多数の異なるフラグメントを同一反応で増幅する場合には、類似サイズのフラグメントを増幅することが有利である。例えばゲノムDNA検体中の類似サイズの配列をすべて制限フラグメントとして発生させる一つの制限酵素または制限酵素の組み合せを発見することは不可能であろう。しかし、異なる制限酵素または制限酵素の組み合わせを使用して得られる多分10個の異なる制限消化産物の少なくとも一つの望むサイズの制限フラグメントに全ての配列が表示されることはありそうである。もし1000種の異なるDNAが増幅されることになったとしたならば、制限酵素の10種の異なる組み合せを使用して消化したDNA検体を使用して多分10回の異なる反応により増幅することができるであろう。適当な制限消化産物及び対応する環化アダプターは利用可能な配列データベースから推定することができる。増幅したDNA配列は、限定はしないが、マイクロアレイハイブリッド形成、ミニ配列分析、または今日では複合的能力に限界があるPCRのためのハイスループットに限定されているマス−スペクトロメトリーを含む適当な方法により分析することができる。
【0019】
モノマー化増幅産物の環化と同じ機構を、プロキシミティー依存核酸相互作用に関係したオリゴヌクレオチドプローブの環状体の発生に使用することができる(Landegren,1995及びLandegren&Fredriksson,2000)。この検定において、標的分子、例えばタンパクへの二つ以上のプローブの結合は、増幅できそして検出できる結合タンパクの指標となる接着DNA鎖を連結反応によって連結することができる。望ましい態様において、過剰の制限オリゴヌクレオチドが、結合するオリゴヌクレオチドプローブの中にある制限酵素が認識する配列を含む二つの同じ配列にハイブリッド形成する。制限消化及び制限酵素の熱不活化の後、切断されたオリゴヌクレオチドは脱離し、優先的分子内ハイブリッド形成反応のために、完全な制限オリゴヌクレオチドがプローブオリゴヌクレオチドの結合及び消化の両端にハイブリッド形成できるようになる。DNAリガーゼの添加に際して、制限オリゴヌクレオチドはオリゴヌクレオチドの環化を誘導する連結鋳型として働く(図3)。生成した環は次いで本発明にしたがって増幅される。プロキシミティー依存核酸連結反応の効果として環状DNAを形成する機構はPCT WO99/49079に記述されているものとは異なる。プロキシミティープローブは添加したオリゴヌクレオチドの環化の鋳型となる、PCT WO99/49079に記述されている方法に対して、本発明においては、プロキシミティープローブの一部が環化する。
【0020】
一つの望ましい方式において、環化増幅産物は、反応に存在する種々の生成物のそれぞれに特異的な、固相支持体に接着した種々のプライマーにハイブリッド形成する。種々のプライマーは可能な限り類似しないように設計されていることが望ましく、すなわち、それらはいわゆる郵便番号配列またはタグ配列を示し、そしてそれらはアレイに整列することができる。このプライマーは局所RCAを開始するために使用される。最初の環状核酸よりも環化増幅産物をハイブリッド形成することにより、ハイブリッド形成速度及び感度は数段階改善される。さらに、もし局所RCAをリアルタイムで監視するならば、経時的シグナル蓄積を非常に広い範囲にわたって検出することができ、特に発現分析に適している。もし検体の複雑さがコピー数及び/または異なる配列の数の差に関して非常に大きいならば、異なるタグ配列との交差ハイブリッド形成を完全に避けることは困難であろう。したがって、オリゴヌクレオチドハイブリッド形成により達成されるよりも、固相支持体に接着したタグ配列プライマーに増幅モノマーの環化の鋳型となるよう要求することにより、郵便番号認識の特異性を増加させることに価値がある。もし異なる標的の数が非常に多いならば、モノマー化操作を多数の異なるタグ配列のそれぞれにおいて特異的切断をすることができるように工夫しなければならない。この目的のために、環化しうる核酸の複雑な混合物中の全ての配列に、独特なタグ配列に隣接してタイプII制限酵素認識配列を取り付けることができる。タグ配列モチーフ内の特異的切断は、全てのRCA産物に共通の配列を有するオリゴヌクレオチド及び/または制限切断のための二本鎖基質を形成する短いランダムオリゴヌクレオチド、例えば、ヘキサマーの集団と認識配列を二本鎖にすることにより行われる(図4)。制限消化の後に、モノマーは次いで半分のタグ末端配列を含む南京錠プローブに変換される。さらに、この方法は近接して結合した結合試薬の対を同定するために結合した検出試薬の対と半分のタグを結合させることができる。連結しうる末端が独特の塩基対の半タグ配列を構成する近接連結プローブを使用することにより可能である。このようにして、平滑−または付着末端連結により端を結合することができる(図3)。
【0021】
反復RCAは既にWO 92/01813及びUS5,714,320に提案されている。しかし、WO 92/01813において、予め作られた環を使用する続くRCA反応のための新規のプライマーを作るためにRCA産物はモノマーに切断されている。US5,714,320においては、単離環状オリゴヌクレオチド鋳型を提供することにより規定した末端を有する選ばれたオリゴヌクレオチドを作るための調製法が記述されている。しかしこの方法は一般的に分析目的または稀な環状DNAの増幅には適していない、何故ならば典型的に0.1μMから1mMの単離環状鋳型を必要とするからである。US5,714,320に記述されている方法において、プライマーは100未満の環状鋳型に対して1モル過剰に供給され、そしてデオキシヌクレオチド三燐酸は107未満の環状鋳型に対して1モル過剰に供給される。分析に適用するには、標的分子の量が少ないので、これらのモル比は効果的な開始及び重合のそれぞれを行うには低すぎる。例えば、ゲノムDNA配列の分析を環化ゲノムDNAまたは環化オリゴヌクレオチドプローブの増幅により行うためには、最初の環化核酸の濃度が低いので、対応するモル比は最初の増幅段階において少なくともそれぞれ100及び107、またはより望ましくはそれぞれ100000以上及び1010、理想的にはそれぞれ約107及び1012である。日本特許出願JP 4−304900は環化プローブの検出のためにRCAを使用することを記述している。この出願には、RCA産物を続くプローブ連結及びRCAの標的として使用する反復RCAが記述されている。これに対して、本発明においては、モノマー化RCA産物は続く連結及びRCAにおいてプローブとして使用される。この方法の利点は既に検討した。
【0022】
本発明のその他の態様において、RCA産物の直線的シグナル発生増幅を加えることによりRCAから得られるシグナルを増加させる方法を発明した。これにより時間の二乗に比例して増加する環化プローブからのシグナルの増幅を生じる。
【0023】
最初の方法は、RCA産物に相補的プローブの選択的、ハイブリッド形成に依存した分解に基づいている。プローブは分解が検出できるように設計されていることが望ましい。
【0024】
したがって、そのほかの態様において、本発明は増幅の程度を示すプローブを使用する核酸増幅方法を含んでおり、この方法は以下の段階を含んでいる:
− 信号プローブを提供する、そのプローブは増幅産物に相補的な配列を含む;
− 信号プローブを増幅産物と反応させる;
− 初代増幅産物にハイブリッド形成した信号プローブは選択的に分解する、その分解プローブは初代増幅産物から解離し、さらに別の信号プローブが産物とハイブリッド形成できるようになり、プローブのハイブリッド形成及び分解はプローブから発信される検出信号の変化として現れる。
【0025】
望ましくは、プローブはヘアピン−ループプローブ、いわゆる分子ビーコン(Tyagi&Kramer,1996)で構成され、これは検出しうる信号を選択的に発信する検出しうるマーカーリガンドをその中に含んでいる。マーカーは核酸配列の部分とすることができるし、またはヘアピン構造の中に含まれるリガンドとすることができる。望ましくは、リガンドは核酸の切断に際して核酸から放出される。
【0026】
プローブの一部が少なくとも部分的にRNAからなるRCA産物とハイブリッド形成する場合に、ハイブリッド形成の際に酵素RNアーゼHにより分解されるであろう(Duck et al,e.g.USP5011769,USP5660988,USP5403711及びUSP6121001)。
【0027】
同じ効果はRCAに使用するデオキシヌクレオチドの一つ以上をチオリン酸デオキシヌクレオチドに置換することにより得られ、それによりRCA産物をエンドヌクレアーゼ加水分解から保護する。この場合には分子ビーコンは通常のデオキシヌクレオチドから作られるので、二本鎖特異的エンドヌクレアーゼによる分解を受けるであろう。特に、制限酵素認識部位をビーコンのループ配列の中に設計することができる。チオリン酸化鎖にハイブリッド形成したときに、チオリン酸化されていない鎖を特異的に切断する制限酵素がいくつか知られている。RNアーゼH分解プローブに類似して、標的分子が存在するときにのみ切断、したがってプローブからの信号発信を生じるであろう。特異的なエンドヌクレアーゼの代わりに、非特異的二本鎖特異的エンドヌクレアーゼを使用することができ、それによってプローブ中に特異的配列が必要でなくなる。
【0028】
検出可能な切断産物を作る関連方法はRCA産物に相補的なプローブ及びRCA−オリゴヌクレオチド複合体中の配列を認識する制限酵素を添加することである。RCA−オリゴヌクレオチド複合体の切断の後に、切断されたプローブはモノマー化RCA産物から解離するであろう。次いで完全なオリゴヌクレオチドは切り離されたモノマーの一端にハイブリッド形成することができる、その後そのモノマーの他の端は、相互作用の分子内優先性から、同じオリゴヌクレオチドとハイブリッド形成することになろう。このようにして、制限酵素の新規基質が形成され、そして第二の信号発生切断が生じる。プローブの一端を蛍光分子で標識しそして他端を消去分子で標識することにより、切断及び続く解離の際に信号が発生するであろう。
【0029】
プローブのハイブリッド形成依存分解は二本鎖特異的エキソヌクレアーゼによっても行うことができる((Copley&Boot,1992),USP6121001)。この場合に、RCA産物とハイブリッド形成するプローブはエキソヌクレアーゼの基質となるであろうが、しかしRCA産物は二本鎖末端を持たないために影響を受けない。分解に際して複合体の融解温度は低下するであろうそしてプローブは完全に分解していなくても解離しやすくなる。こうして配列は他のプローブとハイブリッド形成し、そして分解される。
【0030】
信号を増強するこの方法はリボ−またはいわゆるDNA‐ザイム(R/D−ザイム)によっても行うことができる(例えば、(Herschlag&Cech,1990)&(Carmi et al.,1998)。環化核酸の中にR/D−ザイムの相補配列を組み込むことにより、RCA産物は活性R/D−ザイムを含むであろう。次いでこれを反応混合物中に加えられたプローブを切断するために使用することができる。切断に際して切断されたプローブはRCA産物から解離し、そして他の切断されていないプローブにハイブリッド形成し切断される場を提供する。R/D−ザイムはプローブの切断をしなくても、二つのオリゴヌクレオチドを連結する鋳型となりうるし、下記のように信号を発生することができる(Cuenoud&Szostak,1995)。
【0031】
RCA産物とハイブリッド形成したときに構造特異的酵素の基質に類似するようにプローブを設計することもできる。酵素は望ましくは、リゾルバーゼ、組換え酵素またはヌクレアーゼ、例えば、Ruv ABC,ホリディー連結リゾルバーゼ、Flip組換え酵素、FENヌクレアーゼまたはある種のポリメラーゼを含む群から選択される。本発明の一態様では、下流オリゴヌクレオチドが突出した5開始端を持つように縦列にハイブリッド形成する二つのオリゴヌクレオチドを使用する。この構造は数種の異なる酵素、例えば、FENヌクレアーゼ、Taqポリメラーゼ、TthポリメラーゼまたはMjaヌクレアーゼにより切断することができる(Lyamichev et al.,1999)。下流オリゴヌクレオチドは、融解温度が等温RCA反応の温度に近くなるように設計される。
【0032】
したがって、プローブはヘアピンループ構造によって分離された蛍光分子および消去分子を含むことができ、その消去分子は、プローブが結合していないとき及び蛍光分子からの信号を消去分子が消去している完全な立体配座をとっているときには蛍光分子からの信号を消去し、そして結合または分解したプローブは信号を発する(図5)。そのほかには、プローブは信号分子の対を含むことができ、その分子はプローブが完全なときはFRETによる信号を発生するが、プローブが分解したときには信号の発生を抑制する。
【0033】
有利なのは、プローブとハイブリッド形成に依存した検出分子の蓄積の組み合わせにより反応を定温で、しかも低温において行うことができることである。
【0034】
このように温度は60℃未満、そして望ましくは50℃未満でよい。これにより反応を高温に維持する必要性を除去することができるのは有利である。
【0035】
分解するプローブの代わりに、RCA産物の存在を示すプローブを、組み立てることができる。もし二つのオリゴヌクレオチドプローブがRCA産物上に互いに隣接してハイブリッド形成するように構築するならば、その後それらをリガーゼにより連結することができる。もし二つのオリゴヌクレオチドを、連結して標的から解離する際に安定なステム−ループ構造を形成するように設計するならば、5開始位置にあるドナー分子を他のオリゴヌクレオチドの3開始位置にあるアクセプター分子に非常に近接しておくことが可能である。そして信号を蛍光共鳴エネルギー転移(FRET)に基づいて発生させることができる。連結したプローブが等温で進行するRCA反応の温度に近い融解温度を持つように設計することにより、早い回転が可能になる。連結していないプローブは生成した連結プローブよりも大過剰に存在するであろう、そのために標的RCA産物とハイブリッド形成する速度が増加し、続いて連結、解離などが。こうして反応は等温で行うことが可能である。
【0036】
したがって、そのほかの態様において、増幅の程度を示すプローブを使用する核酸増幅の方法が提供されるが、この方法は一対の信号プローブを使用し、このプローブは増幅産物上の標的配列に互いに隣接してハイブリッド形成するように設計され、ハイブリッド形成したときにプローブは連結して連結産物を形成し、これは標的配列から解離し、標的配列から連結産物の解離により別の一対のプローブの標的配列へのハイブリッド形成が可能となり、そして標的配列から解離する際に連結産物が信号を発する。
【0037】
望ましくは、一対の信号プローブの一つはドナー分子を含み、そして他方はアクセプター分子を含み、そしてプローブは連結産物がヘアピン構造を形成し、その形成の際にドナーとアクセプターの分子間でエネルギー移転ができて信号を発するように設計されている。
【0038】
その他の態様において、本発明は改良分子ビーコン設計を使用するコンカテマー増幅産物の均一検出を含んでいる。本発明では通常の分子ビーコンは、ビーコン中のDNA残基の少なくとも一部がポリメラーゼの基質として受け入れられない核酸残基によって置換されていない限り、RCA産物が存在せずDNAポリメラーゼが存在するときに信号を発することを発見した、その理由は3’末端(通常は蛍光消去分子を担っている)がポリメラーゼの3’エキソヌクレアーゼ(プルーフリーディング)作用により分解されているからである。非特異的信号の発生は、DNA残基の代わりに2’−O−メチル−RNA残基を含む分子ビーコンを使用することにより完全に避けることができる(図6)。さらに発明者らは、RCA産物とハイブリッド形成している通常の分子ビーコンは消去されていることを発見した、何故なら近くに存在するビーコンは容易に相互にステムを形成し(分子間ステム)、消去分子とレポーター蛍光分子を接近させ、ハイブリッド形成していないビーコンの密接(消去)立体配座に極めて類似する(図7)。RCA産物にハイブリッド形成する際に、付近に存在するビーコンとステム様構造を取れないようにステムの一部が産物にハイブリッド形成するように南京錠プローブ配列の中にビーコンのステム配列の一つを含ませることにより、これを避けることができる(図7)。このような改良を行うことによりRCAをリアルタイムに監視することができる(図8)。その他には、この配列がループを作ってしまうのを避けるために分子ビーコンの間にあるRCA産物にハイブリッド形成する第二のプローブを検出反応に加えることができ、これにより分子間のステム形成を抑制する。分子間消去の程度は、図8に使用した2’−O−Me−RNAビーコンの部分的消去に対してDNA分子ビーコン版(図9)の完全消去に示されるように異なる分子ビーコン配列により変動しうる。
【0039】
鎖状化配列にハイブリッド形成し、隣接する分子ビーコンの間に形成する分子間ヘアピン構造は、鎖状化配列の一つのモノマー内にハイブリッド形成する二つの分子ビーコン間のFRETを発生するためにも使用することができる。この二つの分子ビーコンは同じステム配列を備えていなければならないが、蛍光団のドナーとアクセプターの位置は二つの分子ビーコンのうち一つでは切り替えられていなければならない。そのような分子ビーコンは一つ置きにハイブリッド形成するであろう、そして隣接同士で分子間ヘアピン構造を形成するが、一つ置きの一つのビーコンの蛍光団は隣の分子ビーコンの蛍光団に極めて接近した位置にあり、二つの蛍光団の間の効果的なFRETが可能になる。このようにして、接近した分子ビーコンからの背景蛍光を減少させ、検出感度を増加させることができる。
【0040】
さらに他の態様において、本発明は、溶液中に遊離している非結合信号プローブの濃度に比較して、増幅産物にハイブリッド形成した信号プローブの濃度を増加させることによりコンカテマー増幅産物の均一な検出を含んでいる。長いコンカテマー増幅産物は溶液中に遊離するとコイルとなりそしてマイクロメーターサイズの球を形成する。DNAのボールの中に信号プローブが濃縮されるので、産物にハイブリッド形成した信号プローブからの強い信号と結合していないプローブからの比較的拡散した、弱い信号とのコントラストのために、個別の環化プローブからの一つの増幅産物を顕微鏡観察で簡単に検出することができる(図12)。遺伝子発現を分析する検体の場合には、RCA産物のボールの数は直接遺伝子発現に対応する。そのような均一な検出系は、各計数されたRCA産物は検出された一つの転写分子に対応するので、非常に簡便でありまた正確である。
【0041】
多項均一分析は一般的に分光学的に分解できる蛍光団の数により制限される。例えばPCR反応に数種の蛍光標識プローブを添加した場合に、反応中の異なる蛍光団の合計が分析されるので、重複スペクトルが大きな問題となる。しかし、本発明においては、個々のRCA産物ボールが分析され、スペクトル干渉がないので、非常に類似したスペクトルを持つ蛍光団も分別することができるために、蛍光標識プローブによる個別のRCA産物の分析は高度な多項性をもって行うことができる。
【0042】
遺伝子発現分析または多項的遺伝子分類のために、種々の増幅プローブ中に種々の郵便番号を含めることにより、種々の増幅産物に比標識郵便番号オリゴヌクレオチドをハイブリッド形成させることによる増幅産物の同定を可能にするので、均一検出を多項的にすることができる。比標識は既知技術であり、そして限られた数の原色から多数の混合色を創り出すのに使用されてきた(Dauwerse et al.,1992,及びNederlof et al.,1992)。例えば、二つの原色色素A及びBを次のように混合する場合には:0% A及び100% B、20% A及び80% B,40% A及び60%,60% A及び40% B,80% A及び20% B,そして100% A及び0% B。6種類の混合色が創り出される。もし3原色の色素が同様な比率段階で混合されると、36種の混合色を区別することができる。郵便番号オリゴヌクレオチドは異なる比率の蛍光色素の混合のいずれかにより容易に標識され、そして種々の郵便番号オリゴヌクレオチドとそれらの混合を結合するか、または異なる色素で標識した郵便番号オリゴヌクレオチドを望む比率で混合する。この標識方法における多項の程度は標識スキームに加える原色の数(n)に依存し、そして標識の精度は比段階数(x)を決定し、これは区別しうる混合色の数x(n-1)を制限する。増幅産物は数千の反復単位で構成されうるので、比標識における精度は極めて高く、そしてわずかな交差ハイブリッド形成郵便番号オリゴヌクレオチドの影響は無視しうるであろう。多数の擬似色を創るために原色の二者択一(オール−オア−ノン)組み合わせを使用するコンビナトリアル標識方法に比較して比標識方法を使用する大きな利点は、色組み合わせに比較して色比を使用することにより多くの混合色を得ることができることである。
【0043】
本発明のある態様において、最初のRCAの以前に線状プローブを除去することは有利であろう、例えば、残留する非環化プローブはRCAにおいて非特異的信号を発生することが認められている。この問題を解決する試みがWO 00/36141に記述されており、その中で酵素またはいわゆる捕捉リガンドが残留する線状核酸プローブを除去するために使用されている。
【0044】
したがって、その他の態様において、本発明は環状プローブを使用する核酸増幅過程の間に(または後に)非環化プローブを除去または不活化する方法に関係している、その中において非環化プローブは連結部分に隔てられた第一及び第二部分を含んでおり、この第一及び第二部分は標的配列上の配列に相補的であり、そしてプローブはプローブの3’末端とプローブの連結部分にある配列との間にヘアピン構造を形成するように設計されており、そして理想的にはこのヘアピン構造のステムは熱安定性を有して、ループと標的配列の間のハイブリッド形成を阻害しないし、RCAによるプローブの複製も阻害しない。
【0045】
このステムは合成を開始するために十分安定であるので、非結合プローブを完全なヘアピンに変換し、RCA産物上における「第二鎖」の合成を開始することができない。
【0046】
さらに、ヘアピン形成プローブは、そのプローブ設計は通常に設計されたプローブよりもさらに特異的である点で有利である。通常のプローブ設計では、診断塩基はDNAリガーゼのミスマッチ識別能力の利点を十分に活かすためにプローブ配列の最後の3’位に位置していなければならない。本発明のヘアピンプローブにおいては、この診断塩基はヘアピン形成配列の一部であろう。この配列を、連結温度においてヘアピンと標的にハイブリッド形成する立体配座の間を行ったり来たりするように設計することができる。マッチした配列のプローブは、ミスマッチの配列のプローブよりも長時間標的ハイブリッド形成立体配座をとるであろう。このためにミスマッチプローブのミス連結よりもマッチしたプローブの連結が有利になるであろう。
【0047】
その他の態様において、本発明は環状プローブを使用する核酸増幅過程の間に(または後に)非環化プローブを除去または不活化する別の方法を提供する、その中において増幅反応の以前にプローブの3’末端に相補的なオリゴヌクレオチドを過剰に加えるが、このオリゴヌクレオチドは望ましくは5’配列延長を含み、それにより非環化プローブの3’末端は増幅過程の産物に対する相補性を失うであろう。
【0048】
プローブの3’末端に相補的なオリゴヌクレオチドの過剰を、他の試薬と同時にまたは反応を開始した直後に加えることもできるが、RCAを開始する以前に系に添加することが望ましい。
【0049】
本発明によれば、非連結プローブの3’末端はRCA産物に対する相補性を失っているであろう、そして第二鎖合成を開始することはできないであろう。このような3’除去化合物はRCAを開始するために使用することができる。
【0050】
その他に、非連結プローブの連結部分が複製される状況を避けるために、3’除去化合物はDNAポリメラーゼの3’エキソヌクレオチド分解活性により取り除くことができず、延長できない3’末端を取り付けることができる。これは特に、南京錠プローブの連結部分に対応するRCA産物を認識するオリゴヌクレオチドによりRCA産物を検出しようとする場合に重要である。この場合に一般的プライマーはRCAを開始するための環化プローブに加えることができるであろう。3’除去化合物の限定された長さのために、プライマーを延長するポリメラーゼにより置換されるであろうから、RCAを阻害しないであろう
【0051】
発明の詳細な説明
本発明の態様をこれから付属した図を参照して、例示に過ぎないが、詳細に記述する:
【0052】
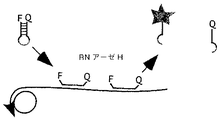
図1は、本発明による数世代のローリングサークル複製(RCA)の一般的方法を示したものである、1)南京錠プローブは特異的標的核酸鎖とハイブリッド形成する、2)南京錠プローブはDNAリガーゼを使用して環化する、3)環化プローブはRCAにおいて複製される、4)RCA産物のモノマーごとに一度存在する制限酵素認識配列に過剰のオリゴヌクレオチドがハイブリッド形成する、5)オリゴヌクレオチド/産物二本鎖を消化する制限酵素を使用してRCA産物をモノマー化する、6)制限酵素の不活化及びオリゴヌクレオチドフラグメントの変性を生じる加熱段階の後、大部分のモノマーはその両端で完全なオリゴヌクレオチドとハイブリッド形成する、7)このモノマーはDNAリガーゼを使用して環化し、そして次いで生成した環は次のサイクルの3−7段階にしたがって処理される;
【0053】
図2は、本発明にしたがって配列を環化しそして増幅するための環化アダプターを使用するゲノム−またはcDNAの増幅を示したものである、1)制限酵素を使用してDNA検体をフラグメントにする、2)フラグメント化したDNAを変性する、3)環化アダプターが特異的標的フラグメントとハイブリッド形成する、4)DNAリガーゼを使用して標的フラグメントを環化する、5)環化した標的フラグメントをRCAで複製する、6)RCA産物のモノマーごとに一回アダプター配列中に存在する制限酵素認識配列に過剰の一般的アダプターオリゴヌクレオチドがハイブリッド形成する、7)オリゴヌクレオチド/産物二本鎖を消化する制限酵素を使用してRCA産物をモノマー化する、8)制限酵素の不活化及びオリゴヌクレオチドフラグメントの変性を生じる加熱段階の後、大部分のモノマーはその両端で完全なオリゴヌクレオチドとハイブリッド形成する、9)そのモノマーはDNAリガーゼを使用して環化し、そして次いで生成した環は次のサイクルの5−9段階にしたがって処理される;
【0054】
図3はプロキシミティー依存連結による本発明にしたがって増幅可能な環化DNAへの変換を示したものである、1)一対のプロキシミティープローブ、例えば、オリゴヌクレオチドを付けた抗体が標的タンパクと結合する、2)二つのオリゴヌクレオチドがプロキミティー依存連結反応により結合する、例えば、近接して結合した一対の結合試薬を同定するための半タグ連結を可能にする平滑末端連結により、3)制限酵素認識配列を含みそして連結したオリゴヌクレオチド配列の両方に存在する同じ配列に過剰のオリゴヌクレオチドがハイブリッド形成する、5)オリゴヌクレオチド/産物二本鎖を消化する制限酵素を使用して連結産物を切断する、6)制限酵素の不活化及びオリゴヌクレオチドフラグメントの変性を生じる加熱段階の後、大部分のモノマーはその両端で完全なオリゴヌクレオチドとハイブリッド形成する、7)そのモノマーはDNAリガーゼを使用して環化し、そして次いで生成した環は図1の3−7段階にしたがって処理される;
【0055】
図4は、RCA産物の複雑な集合がII型制限酵素を使用して郵便番号モチーフの中でモノマー化しうるのか、またモノマー化したRCA産物が特異性とダイナミックレンジを増加させるための郵便番号オリゴヌクレオチドマイクロアレイ上でハイブリッド形成しそして環化するのかを示したものである、1)郵便番号オリゴヌクレオチドを同定する配列を含むRCA産物の集合が、例えば、多項南京錠プローブ遺伝子分類または発現分析実験から、または多項プロキミティー依存連結反応から発生した、2)II型制限酵素をランダムヘキサマー及びII型制限酵素認識配列を含む一般的オリゴヌクレオチドとともに加え、3)ヘキサマー及び制限オリゴヌクレオチドを任意に除去し、次いでモノマーは半郵便番号末端配列を持つ南京錠プローブに変換する、4)モノマーを郵便番号オリゴヌクレオチドマイクロアレイにハイブリッド形成する、5)DNAリガーゼを使用して郵便番号オリゴヌクレオチド上でモノマーを環化する、6)郵便番号オリゴヌクレオチドをブライマーとしてRCAにおいてモノマーを増幅する、そして重合は増加するダイナミックレンジ用の均一方式で任意に監視する;
【0056】
図5は、分子ビーコンが分解される本発明の増幅方法の図解である。
【0057】
図6は、分子ビーコンの全てのDNA残基を2’O−Me−RNA残基で置換することによる、DNAポリメラーゼの存在による非特異的蛍光の蓄積の除去を示すグラフであり、一つのDNA分子ビーコンはFAM蛍光(上段)で標識し、そして一つの2’O−Me−RNA分子ビーコンはHEX蛍光(下段)で標識されており、それらをΦ29DNAポリメラーゼの存在下(四角)または非存在下(丸)に同じ試験管に加えた;
【0058】
図7は、従来の分子ビーコン設計を使用した場合のRCA産物にハイブリッド形成した分子ビーコンの分子間消去を図解したものである;
【0059】
図8は、RCA産物の制限切断により分子間ビーコン消去が示され、そして分子ビーコンの改良設計によりRCAのリアルタイムの監視が可能になることを示すグラフである;
【0060】
図9は、図8と同様に行われたRCA反応の温度による影響を示すグラフである。RCA及びポリメラーゼの熱不活化の後に蛍光はDNA分子ビーコンから得られる;
【0061】
図10は、例1に記載の第3世代RCAのリアルタイムモニタリングを示す;
【0062】
図11は、例2に従って得られる第2世代RCA産物に相補的なオリゴヌクレオチドを含むマイクロアレイの地区において記録された蛍光を示す;
【0063】
図12は、蛍光標識オリゴヌクレオチドの均一ハイブリッド形成により溶液中に検出された個別のRCA産物を示し、産物とハイブリッド形成した蛍光標識オリゴヌクレオチドからの強い信号と非結合オリゴヌクレオチドからの比較的拡散した、弱い信号とのコントラストを示している。
【0064】
例
例1(改良分子ビーコンを使用する第3世代RCAのリアルタイムモニタリング)
2nM南京錠プローブ(P−
(P=5’リン酸)を10mM TrisAc(pH7.5),10mM MgAc2,50mM KAc,0.1% BSA,1mM ATP,200mM NaCl,及び20mU/μl T4 DNAリガーゼの中で、0,10,40または160zmolの標的オリゴヌクレオチド
の存在下に環化した。反応を15分間37℃でインキュベートし、次いで5分間65℃でリガーゼを不活化した。第一世代RCAは0.1μg/μl BSA,250μM dNTP,10mM DTT,1 pmolプライマー
、及び1ng/μlφ29 DNAポリメラーゼの中で45分間37℃で行った。重合成分を15μlのφ29 DNAポリメラーゼ緩衝液(10mM Tris−HCl(pH7.5),10mM MgCl2,及び20mM(NH4)2SO4)中で10μl連結反応に加えた。DNAポリメラーゼを10分間65℃で不活化した。5μl 0.1μg/μl BSA,3pmol RSAI
、及びφ29 DNAポリメラーゼ緩衝液中の10U RsaIを加えて第一世代RCA産物をモノマー化した。反応を60分37℃でインキュベートし、次いで10分間65℃で酵素を不活化した。5μl 0.1μg/μl BSA,1mM ATP,及び1U T4 DNAリガーゼをφ29ポリメラーゼ緩衝液中で加えてモノマー化RCA産物を環化した。15分間37℃でインキュベートして連結を行い、ついで5分間65℃で酵素を不活化した。第二世代RCAは15μl重合試薬を35μlの環化RCA産物に加えて、第一世代RCAと同じ条件を使用して行った。重合反応は45分間37℃で継続した。第二世代のRCA産物の半分に、0.1μg/μl BSAを含むφ29DNAポリメラーゼ緩衝液5μl中で6pmol RSAIcomp
及び10U RsaIを加えてモノマー化した。反応を60分間37℃でインキュベートし、次いで10分間65℃で酵素を不活化した。モノマー化した第二世代のRCA産物の環化は、モノマー化した第一世代のRCA産物の環化と同じ方法を使用して行った。第三世代のRCAは、0.1μM分子ビーコン
の存在下60分間行った以外は第二世代RCAと同様に行った。ABI 7700を使用して反応をリアルタイムに追跡した。
【0065】
例2.(第二世代RCA産物のDNAアレイ上での検出)
2nM南京錠プローブ(WD 1216G)を種々の量の標的オリゴヌクレオチド(T 1216G;0,25,250,または2500zmol)の存在下に上記のように環化した。第一世代RCAは1pmolのプライマーWDP−Fの存在下に上記と同様に100分間37℃で行った。15μlのφ29 DNAポリメラーゼ緩衝液中で10μl連結反応に重合成分を加えた。DNAポリメラーゼを10分間65℃で不活化した。φ29 DNAポリメラーゼ緩衝液中の5μl 0.1μg/μl BSA,3pmol Comp WDP−F,及び5U Fnu4H 1を加えることにより第一世代RCA産物をモノマー化した。反応を60分間37℃でインキュベートし、次いで10分間65℃で酵素を不活化した。5μl 0.1μg/μl BSA,1mM ATP,及び1U T4 DNAリガーゼをφ29DNAポリメラーゼ緩衝液中で加えてモノマー化RCA産物を環化した。15分間37℃でインキュベートして連結を行い、ついで5分間65℃で酵素を不活化した。第二世代RCAは15μl重合試薬を35μlの環化RCA産物に加えて、第一世代RCAと同じ条件を使用して行った。重合反応は100分間37℃で継続した。0.1μg/μl BSAを含むφ29 DNAポリメラーゼ緩衝液5μl中で4.5pmol D−RCRcut及び5U Fnu4HIを加えることにより第二世代のRCA産物の半分をモノマー化した。反応を60分間37℃でインキュベートし、次いで10分間65℃で酵素を不活化した。30μlモノマー化第二世代RCA産物を、4*SSC,0.525μM Comp WD Cy5,10μM EDTA中45℃で2時間DNAマイクロアレイとハイブリッド形成させ、0.1xSSC中45℃で洗い、水ですすぎ、そして最後に乾燥した。Cy5蛍光信号を蛍光レーザースキャナーで記録した。
【0066】
例1及び2に記述されているような数世代RCAの一般的方法の図解は図1に示されている。例1及び2の結果はそれぞれ図10及び11に示されている。最初に環状核酸はRCAにおいて複製される。次いで第一世代RCA産物は、例えば、RCA産物と相補的なオリゴヌクレオチドにより二本鎖となった認識部位で産物を切断する制限酵素を使用することによりモノマー化される。例えば、制限酵素の熱不活化の間にまたはその後に、完全な制限オリゴヌクレオチドは消化されたものを置換するであろう。完全な制限オリゴヌクレオチドがモノマー化RCA産物の一端にハイブリッド形成したときに、二番目のハイブリッド形成反応の分子内優先のために、モノマーの他端は同じ制限オリゴヌクレオチドとハイブリッド形成するであろう。次いでモノマーは末端を、例えば、DNAリガーゼを使用して連結することにより環化することができる。この方法は同じ手順を1回以上反復することができる。
図10は、例1に記述されている第三世代のRCAのリアルタイムモニタリングを示している。A)発生したときにRCA産物にハイブリッド形成した分子ビーコンから放射されたHEX蛍光のリアルタイムの測定。B)グラフは最初のプローブ環化反応に加えられた標的オリゴヌクレオチドの量との関係を示している、4回繰り返し、そしてこの連結反応の第三世代リアルタイムRCAの最大勾配。エラーバーは標準偏差を示す。
図11は、例2に従って得られた第二世代RCA産物に相補的なオリゴヌクレオチドを含むマイクロアレイ地区で記録された蛍光を示す。
【0067】
例3
オリゴヌクレオチド:使用した南京錠プローブはp90:
及びp93:
(P=5’リン酸)であった。南京錠プローブに対する連結鋳型はt40:
であった。DNA分子ビーコンはFAM−cgcctcAATGCTGCTGCTGTACTACgaggcg−DABCYL(ステム部分は小文字)であり、そして2’O−Me−RNA分子ビーコンはHEX−ccucAAUGCUGCUGCUGUACUACgagg−DABCYLであった。2’O−Me−RNA塩基対の高いハイブリッド安定性の故に2’O−Me−RNA分子ビーコンにおいてステムは2塩基対短い。制限消化に使用したオリゴヌクレオチドは Tsp451:
であった。
【0068】
例4
南京錠プローブの環化:10mM Tris−酢酸 pH7.5,10mM 酢酸Mg,50mM NaCl,1mM ATP,1μg/μl BSA,及び0.2単位/μl T4 DNAリガーゼ(Amersham Pharmacia Biotech)中で600nM 連結鋳型の存在下に200nM南京錠プローブを37℃で30分間連結した。
【0069】
例5
ローリングサークル増幅:重合反応を50mM Tris−HCl(pH7.5),10mM MgCl2,20mM(NH4)2SO4,10mMジチオトレイトール及び0.2μg/μl BSA,0.25mM dNTP,及び2ng/μl Φ29DNAポリメラーゼ(Dr.M.Salasから供与された)の中において37℃で行った。リアルタイムモニタリングのために、100nM分子ビーコン及び300nM ROX色素の存在下にRCAを行った。蛍光の値は分子ビーコン(FAMまたはHEX)及びROX対照色素から放射される蛍光の比から得た。温度依存性は温度を1℃上昇させ30秒間保った後蛍光を測定して得た。
【0070】
例6
制限消化:20μlの10mM Bis Trisプロパン−HCl(pH7.0),10mM MgCl2,1mMジチオトレイトール,0.1μg/μl BSA,1.5μM Tsp451,及び0.1U/μl Tsp 451(New England Biolabs)を40μl RCA産物に加え、そして65℃で4時間インキュベートした。
【0071】
図に戻って、図6で見ることができるようにDNAポリメラーゼの存在下に生じる蛍光の非特異的蓄積は分子ビーコンのDNA残基を全て2’O−Me−RNA残基で置換することにより除去される。FAM蛍光で標識したDNA分子ビーコン(上段)及びHEX蛍光団で標識した2’O−Me−RNA分子ビーコン(下段)をΦ29 DNAポリメラーゼの存在下(四角)及び非存在下(丸)に同じ試験管に加えた。グラフの左側部分は試験管内のリアルタイムに観察した蛍光を示し、右側の部分は60分後に存在する成分の温度依存性を示す。
【0072】
図7からは、従来の分子ビーコン設計をしようした場合のRCA産物にハイブリッド形成した分子ビーコンの分子間消去を見ることができる(上段)。この構造は改良設計を使用することにより避けることができる(下段)。
【0073】
図8:図7に示された分子間ビーコン消去はRCA産物の制限切断によって示されており、そして分子ビーコンの改良設計によりRCAのリアルタイム監視が可能である。RCAをp90(四角)またはp93(丸)南京錠プローブのいずれかを含み、リガーゼがある場合(黒)またはりガーゼが無い場合(グレイ)の連結反応により行った。グラフの左側部分は異なる反応における2’O−Me−RNA分子ビーコンからの蛍光をリアルタイム測定したものを示す。右側部分は90分RCAの終了時に存在する成分の温度依存性を示す(塗りつぶした記号)。制限消化後の異なる反応成分の温度依存性を重ねてある(中抜き記号)。
【0074】
RCA、そしてポリメラーゼの熱不活化後にDNA分子ビーコンを加えて蛍光を測定した場合の、図8と同様に行ったRCA反応の温度依存性を図9に示す。
【0075】
例7
100ngのPstI切断ゲノムDNAを95℃で12分間変性し、そしてサーマルサイクラー中で12℃に急速に冷却した。予めアニ―ルしたオリゴヌクレオチド
及び“gDNAadapter1°”
を最終濃度2nMになるように変性切断ゲノムDNAに加えた。一つの反応にはリガーゼを加え、もう一つの反応にはリガーゼを加えなかった。連結を1時間室温で、次いで30分間37℃で進行させ、次いで65℃で20分間リガーゼを熱不活化した。連結反応の5μlを50mM Tris−HCl,pH7.5,10mM MgCl2,20mM(NH4)2SO4,0.2μg/μl BSA,0.25mM dNTP,及び10ng Φ29ポリメラーゼ中37℃で3時間ローリングサークル増幅にかけた。RCA産物の量を定量するために、リアルタイムPCR反応を容量25μl中1xPCR GOLD緩衝液(ABI),1.6mM MgCl2,0.25mM dNTP,200nM
及び200nM
プライマー,0.625U Taq GOLDポリメラーゼ(ABI),300nM ROX色素及び0.15xSYBR Green(Molecular Probes)にRCA反応の2.5μlを加えて行った。プライマーはゲノムフラグメント及びRCA産物の両者をPCR増幅するように設計した。PCRプログラムは95℃で10分間、45サイクルの95℃ 15分間及び60℃ 60秒であった。PCR終了後、PCR増幅単位を解離曲線分析にかけた。Ct値として示された結果はカッコ内の標準偏差とともに表1に見ることができる。増幅単位の融解温度は82.6℃であり、これは増幅単位の推定Tm83℃によく近似した。Φ29 DNAポリメラーゼは一本鎖DNA(変性)に対して強いエキソヌクレアーゼ活性を示す;したがって4倍希釈を考慮した場合に、Φ29 DNAポリメラーゼ処理をしない検体に比較して非連結DNAは4分の1の少ない産物を示す。増幅されるDNAは545ntの長さであり、そして1500nt/minの速さであるから500倍の増幅が予想された。4倍希釈を考慮すると、非増幅検体に比較して120倍の結果になることが予想されるであろう。デルタCt値6.75は110倍の増幅に相当する。
表1
【0076】
例8
環化南京錠プローブp93のRCA産物の2pM及び産物に相補的な標的プローブRC1R(5’−ローダミン−
)の5nMの1xPBS溶液を幅50マイクロメーター及びチャンネル間空間40マイクロメーターの二本の微量流体チャンネルに注入した。南京錠プローブの環化及びRCAは例4及び5に従って行った。RCAを1時間行ったので、RCA産物は環化プローブの平均1500コピーを含む。チャンネル中の結合及び非結合蛍光標識プローブからの蛍光を、40xドライレンズを装着した表在蛍光顕微鏡を使用して画像化した。図12において、チャンネル中に数個の輝くDNAのボール、並びにやや弱く輝く焦点外の物体が非結合プローブの拡散した蛍光の背景上に認められる。
【0077】
本発明は、本発明の精神から離れることなく構造及び細部を変更することが可能であり、ここまでに記述した態様に限定されない。
文献
【図面の簡単な説明】
【0078】
【図1】本発明による数世代のローリングサークル複製(RCA)の一般的方法を示したものである。
【図2】本発明にしたがって配列を環化しそして増幅するための環化アダプターを使用するゲノム−またはcDNAの増幅を示したものである。
【図3】プロキシミティー依存連結による本発明にしたがって増幅可能な環化DNAへの変換を示したものである。
【図4】RCA産物の複雑な集合がII型制限酵素を使用して郵便番号モチーフの中でモノマー化しうるのか、またモノマー化したRCA産物が特異性とダイナミックレンジを増加させるための郵便番号オリゴヌクレオチドマイクロアレイ上でハイブリッド形成しそして環化するのかを示したものである。
【図5】分子ビーコンが分解される本発明の増幅方法の図解である。
【図6】分子ビーコンの全てのDNA残基を2’O−Me−RNA残基で置換することによる、DNAポリメラーゼの存在による非特異的蛍光の蓄積の除去を示すグラフである。
【図7】従来の分子ビーコン設計を使用した場合のRCA産物にハイブリッド形成した分子ビーコンの分子間消去を図解したものである。
【図8】RCA産物の制限切断により分子間ビーコン消去が示され、そして分子ビーコンの改良設計によりRCAのリアルタイムの監視が可能になることを示すグラフである。
【図9】図8と同様に行われたRCA反応の温度による影響を示すグラフである。RCA及びポリメラーゼの熱不活化の後に蛍光はDNA分子ビーコンから得られる。
【図10】例1に記載の第3世代RCAのリアルタイムモニタリングを示す。
【図11】例2に従って得られる第2世代RCA産物に相補的なオリゴヌクレオチドを含むマイクロアレイの地区において記録された蛍光を示す。
【図12】蛍光標識オリゴヌクレオチドの均一ハイブリッド形成により溶液中に検出された個別のRCA産物を示し、産物とハイブリッド形成した蛍光標識オリゴヌクレオチドからの強い信号と非結合オリゴヌクレオチドからの比較的拡散した、弱い信号とのコントラストを示している。
Claims (34)
- 方法が下記段階:
− a)単一または比−標識プローブを使用して均一ハイブリッド形成反応中の該増幅産物を直接検出する、そして該均一ハイブリッド形成検出が該増幅産物中に検出プローブが濃縮されることに基づき、及び/または改良分子ビーコン設計を使用することに基づいている;または
− b)少なくとも下記の一つを含む別の信号発生反応を行う:
I) 該増幅産物とハイブリッド形成した場合に選択的に分解する分解可能な信号プローブを提供し、その分解されたプローブが該増幅産物から解離することにより別の信号プローブが産物とハイブリッド形成することができ、そのプローブのハイブリッド形成及び分解がプローブから放射される信号に変化を生じる。
II) 増幅産物上の標的配列に互いに隣接してハイブリッド形成するように設計された連結可能な信号プローブを提供し、そのハイブリッド形成によりプローブは連結して標的配列から解離する連結産物を形成し、その連結産物の標的配列からの解離が別のプローブ対の標的配列へのハイブリッド形成を可能にし、その標的配列からの解離により連結産物が信号を放射する;または
− c)該増幅産物をモノマー化し、該モノマー化増幅産物を環化し、該環化モノマーをローリング−サークル増幅反応で増幅し、そして任意にこの手順を繰り返す;そして増幅産物を検出または分析する。
を含む該環化DNAを増幅し、その産物が分析する配列のコンカテマーを含む増幅産物を提供することにより環化核酸を分析する方法。 - 分析する環化核酸がプローブ配列である請求項1に記載の方法。
- 分析する環化核酸がcDNA,ゲノムDNAまたはRNA配列を含む請求項1に記載の方法。
- 請求項1Cに記載のモノマー化増幅産物がcDNA,ゲノムDNAまたはRNA配列を使用して環化したものである請求項1に記載の方法。
- 分析する環化DNAがプロキシミティー依存核酸相互作用により形成されている請求項1に記載の方法。
- 増幅産物のモノマー化が制限酵素及び増幅産物に相補的なオリゴヌクレオチドを使用し、その制限酵素が増幅産物/オリゴヌクレオチドハイブリッドを切断することにより行われる前記請求項のいずれかに記載の方法。
- 増幅産物中に含まれるモノマーの数よりも過剰にオリゴヌクレオチドが加えられる請求項6に記載の方法。
- 第一世代増幅産物がポリメラーゼ酵素を使用する第一世代増幅段階において生産され、そして続くポリメラーゼ酵素を不活化する段階を含む前記請求項のいずれかに記載の方法。
- モノマー化増幅産物が固体支持層に接着した局所RCAを開始するプライマーにハイブリッド形成しそしてそこで環化する前記請求項のいずれかに記載の方法。
- 環化増幅産物が固体支持層に接着した局所RCAを開始するプライマーにハイブリッド形成する前記請求項のいずれかに記載の方法。
- モノマー化増幅産物が固体支持層に接着したプライマーにハイブリッド形成し、そしてそこでモノマー化産物が検出される前記請求項のいずれかに記載の方法。
- プライマーが郵便番号またはタグ配列である請求項9−11に記載の方法。
- 下記段階:
− 増幅産物に相補的な配列を含む信号プローブを提供し;
− 信号プローブを増幅産物と反応させ;
− 第一世代増幅産物とハイブリッド形成した信号プローブを選択的に分解し、その分解プローブは第一世代増幅産物から解離し;
別の信号プローブが産物とハイブリッド形成し、そのプローブのハイブリッド形成及び分解がプローブから放射する信号の変化を生じる、
を含む増幅の程度を示すプローブを使用する前記請求項のいずれかに記載の核酸増幅方法。 - プローブが増幅産物とハイブリッド形成したときに分解を受けやすくなる配列を含む請求項13に記載の方法。
- 増幅産物に相補的であるプローブ、特にプローブの配列が、プローブが増幅産物とハイブリッド形成したときにRNアーゼHのような適当な酵素による分解を受けやすいRNA残渣配列を含む請求項13または14に記載の方法。
- プローブが増幅産物に結合したときにエンドヌクレアーゼにより分解され、その増幅産物はエンドヌクレアーゼによる分解に抵抗するように修飾されている請求項13または14に記載の方法。
- 増幅産物がデオキシヌクレオチドをチオホスホデオキシヌクレオチドで置換することにより修飾されている請求項16に記載の方法。
- 制限酵素認識部位が第一世代増幅産物とハイブリッド形成するプローブの配列中に含まれている請求項13、14、16または17に記載の方法。
- プローブの選択的分解が二本鎖選択的オキソヌクレオチドによって行われる請求項13または14に記載の方法。
- プローブの選択的分解がRNA−ザイムまたはDNA−ザイムによって行われ、そのRNA/DNA−ザイムが第一世代増幅産物中に含まれる請求項13または14に記載の方法。
- プローブが蛍光分子及び消去分子を含みそれらはヘアピンループ構造によって分離されており、非結合及び完全立体配座において消去分子は蛍光分子からの信号を消去し、そして結合または分解プローブは信号を放射する請求項13から20のいずれかに記載の方法。
- プローブのヘアピンループのステム配列の少なくとも一つが増幅産物とハイブリッド形成するように設計されている請求項21に記載の方法。
- プローブが完全なときにはFRETによる信号を発生し、プローブが分解したときには信号を抑制する一対の信号分子を含む請求項13から21のいずれかに記載の方法。
- DNAポリメラーゼの鋳型/基質として働かないようにプローブが設計されている請求項13から23のいずれかに記載の方法。
- 増幅産物が一本鎖線状RCA産物である請求項13から24のいずれかに記載の方法。
- 分解プローブの増幅産物からの解離が加熱サイクルによって行われる請求項13から25のいずれかに記載の方法。
- 信号プローブが核酸増幅の間またはその後に加えられる請求項13から26のいずれかに記載の方法。
- 信号プローブ対の一つはドナー分子を含みそして他の一つはアクセプター分子を含み、そして連結産物がヘアピン構造を形成し、その形成によりドナーとアクセプター分子の間のエネルギー転移により信号を発生することができるようにプローブが設計されている請求項1に記載の方法。
- 最初の段階として非環化プローブが除去されるかまたは不活化される前記請求項のいずれかに記載の方法。
- 非環化プローブがエキソヌクレアーゼを使用して除去される請求項29に記載の方法。
- 非環化プローブに対する適当なリガンドを持つ固体支持層上における捕捉により非環化プローブを除去する請求項30に記載の方法。
- リガンドが非環化プローブに対する親和性を有する核酸配列である請求項31に記載の方法。
- 非環化プローブが連結部分により分離された第一部分及び第二部分を含み、その第一及び第二部分は標的配列上の配列に相補的であり、そしてそのプローブはプローブの3’末端及びプローブの連結部分中の配列の間でヘアピンループを形成し、そのヘアピンループ構造のステムは理想的にはループと標的配列の間のハイブリッド形成を抑制しないしまたRCAによるプローブの複製も抑制しない熱安定性を有している請求項29に記載の方法。
- 増幅反応の前にプローブの3’末端に相補的なオリゴヌクレオチドの過剰を加え、オリゴヌクレオチドは望ましくは5’配列延長を含み、そのために非環化プローブの3’末端が増幅過程の産物に対する相補性を失う請求項29に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0118959A GB2378245A (en) | 2001-08-03 | 2001-08-03 | Nucleic acid amplification method |
| PCT/SE2002/001378 WO2003012119A2 (en) | 2001-08-03 | 2002-07-12 | Nucleic acid amplification method |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008316989A Division JP4559517B2 (ja) | 2001-08-03 | 2008-12-12 | 核酸増幅方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004536617A true JP2004536617A (ja) | 2004-12-09 |
Family
ID=9919749
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003517293A Pending JP2004536617A (ja) | 2001-08-03 | 2002-07-12 | 核酸増幅方法 |
| JP2008316989A Expired - Lifetime JP4559517B2 (ja) | 2001-08-03 | 2008-12-12 | 核酸増幅方法 |
| JP2009230088A Expired - Lifetime JP4675424B2 (ja) | 2001-08-03 | 2009-10-02 | 核酸増幅方法 |
| JP2010125694A Expired - Lifetime JP5313204B2 (ja) | 2001-08-03 | 2010-06-01 | 核酸増幅方法 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008316989A Expired - Lifetime JP4559517B2 (ja) | 2001-08-03 | 2008-12-12 | 核酸増幅方法 |
| JP2009230088A Expired - Lifetime JP4675424B2 (ja) | 2001-08-03 | 2009-10-02 | 核酸増幅方法 |
| JP2010125694A Expired - Lifetime JP5313204B2 (ja) | 2001-08-03 | 2010-06-01 | 核酸増幅方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (3) | US7320860B2 (ja) |
| EP (4) | EP2251439B1 (ja) |
| JP (4) | JP2004536617A (ja) |
| AU (1) | AU2002314693A1 (ja) |
| CA (1) | CA2455803A1 (ja) |
| GB (1) | GB2378245A (ja) |
| WO (1) | WO2003012119A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008522628A (ja) * | 2004-12-11 | 2008-07-03 | サイトジェニックス, インコーポレイテッド | 高品質核酸のセルフリー生合成及びその使用 |
| JP2009077735A (ja) * | 2001-08-03 | 2009-04-16 | Biocyclica Ab | 核酸増幅方法 |
| JP2011505161A (ja) * | 2007-12-04 | 2011-02-24 | ピエール、ファーブル、メディカマン | 抗体ライブラリーを作製およびスクリーニングするための新規な方法 |
Families Citing this family (104)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0304371D0 (en) * | 2003-02-26 | 2003-04-02 | Solexa Ltd | DNA Sequence analysis |
| US7385043B1 (en) * | 2003-04-30 | 2008-06-10 | The Public Health Research Institute Of The City Of New York, Inc. | Homogeneous multiplex screening assays and kits |
| SE0401270D0 (sv) | 2004-05-18 | 2004-05-18 | Fredrik Dahl | Method for amplifying specific nucleic acids in parallel |
| US7618780B2 (en) * | 2004-05-20 | 2009-11-17 | Trillion Genomics Limited | Use of mass labelled probes to detect target nucleic acids using mass spectrometry |
| CN101103357B (zh) * | 2004-08-13 | 2012-10-03 | 哈佛学院院长等 | 超高处理量光学-纳米孔dna读出平台 |
| US7601499B2 (en) | 2005-06-06 | 2009-10-13 | 454 Life Sciences Corporation | Paired end sequencing |
| JP5103398B2 (ja) * | 2005-06-06 | 2012-12-19 | 454 ライフ サイエンシーズ コーポレイション | 両末端配列決定(pairedendsequencing) |
| DK1907583T4 (da) | 2005-06-15 | 2020-01-27 | Complete Genomics Inc | Enkeltmolekyle-arrays til genetisk og kemisk analyse |
| US8137936B2 (en) * | 2005-11-29 | 2012-03-20 | Macevicz Stephen C | Selected amplification of polynucleotides |
| US8492098B2 (en) | 2006-02-21 | 2013-07-23 | The Trustees Of Tufts College | Methods and arrays for target analyte detection and determination of reaction components that affect a reaction |
| SG10201405158QA (en) | 2006-02-24 | 2014-10-30 | Callida Genomics Inc | High throughput genome sequencing on dna arrays |
| US7910354B2 (en) | 2006-10-27 | 2011-03-22 | Complete Genomics, Inc. | Efficient arrays of amplified polynucleotides |
| US20090075343A1 (en) | 2006-11-09 | 2009-03-19 | Complete Genomics, Inc. | Selection of dna adaptor orientation by nicking |
| US7862999B2 (en) * | 2007-01-17 | 2011-01-04 | Affymetrix, Inc. | Multiplex targeted amplification using flap nuclease |
| WO2008122960A2 (en) * | 2007-04-10 | 2008-10-16 | Microvacuum Ltd. | Label-free optical detection method |
| US20080293589A1 (en) * | 2007-05-24 | 2008-11-27 | Affymetrix, Inc. | Multiplex locus specific amplification |
| WO2009046445A1 (en) * | 2007-10-04 | 2009-04-09 | Halcyon Molecular | Sequencing nucleic acid polymers with electron microscopy |
| US8415099B2 (en) | 2007-11-05 | 2013-04-09 | Complete Genomics, Inc. | Efficient base determination in sequencing reactions |
| US8298768B2 (en) | 2007-11-29 | 2012-10-30 | Complete Genomics, Inc. | Efficient shotgun sequencing methods |
| US8592150B2 (en) | 2007-12-05 | 2013-11-26 | Complete Genomics, Inc. | Methods and compositions for long fragment read sequencing |
| WO2009097368A2 (en) | 2008-01-28 | 2009-08-06 | Complete Genomics, Inc. | Methods and compositions for efficient base calling in sequencing reactions |
| US20090233809A1 (en) * | 2008-03-04 | 2009-09-17 | Affymetrix, Inc. | Resequencing methods for identification of sequence variants |
| US8470542B2 (en) | 2008-12-01 | 2013-06-25 | Laboratory Corporation Of America Holdings | Methods and assays for measuring p95 and/or p95 complexes in a sample and antibodies specific for p95 |
| US20100233732A1 (en) * | 2009-01-15 | 2010-09-16 | Laboratory Corporation Of America Holdings | Methods of Determining Patient Response By Measurement of HER-2 Expression |
| SG10201408392PA (en) | 2009-01-15 | 2015-01-29 | Lab Corp America Holdings | Methods of determining patient response by measurement of her-3 |
| JP2012525147A (ja) | 2009-04-30 | 2012-10-22 | グッド スタート ジェネティクス, インコーポレイテッド | 遺伝マーカーを評価するための方法および組成物 |
| US9524369B2 (en) | 2009-06-15 | 2016-12-20 | Complete Genomics, Inc. | Processing and analysis of complex nucleic acid sequence data |
| WO2011066476A1 (en) * | 2009-11-25 | 2011-06-03 | Quantalife, Inc. | Methods and compositions for detecting genetic material |
| WO2011161549A2 (en) | 2010-06-24 | 2011-12-29 | Population Genetics Technologies Ltd. | Methods and compositions for polynucleotide library production, immortalization and region of interest extraction |
| WO2012049316A1 (en) | 2010-10-15 | 2012-04-19 | Olink Ab | Dynamic range methods |
| CN101974638B (zh) * | 2010-11-10 | 2012-10-03 | 华东医学生物技术研究所 | 连接反应偶联核酸侵入反应与切刻内切酶反应的核酸信号扩增检测方法 |
| US9163281B2 (en) | 2010-12-23 | 2015-10-20 | Good Start Genetics, Inc. | Methods for maintaining the integrity and identification of a nucleic acid template in a multiplex sequencing reaction |
| US9952237B2 (en) | 2011-01-28 | 2018-04-24 | Quanterix Corporation | Systems, devices, and methods for ultra-sensitive detection of molecules or particles |
| EP3940084A1 (en) | 2011-02-09 | 2022-01-19 | Bio-Rad Laboratories, Inc. | Analysis of nucleic acids |
| US8551708B2 (en) | 2011-02-15 | 2013-10-08 | Leica Biosystems Newcastle Ltd. | Methods for localized in situ detection of mRNA |
| US9556473B2 (en) | 2011-02-15 | 2017-01-31 | Leica Biosystems Newcastle Ltd | Methods for identifying nucleic acid sequences |
| US8759036B2 (en) | 2011-03-21 | 2014-06-24 | Affymetrix, Inc. | Methods for synthesizing pools of probes |
| GB201107863D0 (en) | 2011-05-11 | 2011-06-22 | Olink Ab | Method and product |
| US10597701B2 (en) | 2011-05-11 | 2020-03-24 | Navinci Diagnostics Ab | Unfolding proximity probes and methods for the use thereof |
| US9228233B2 (en) | 2011-10-17 | 2016-01-05 | Good Start Genetics, Inc. | Analysis methods |
| EP2820155B1 (en) | 2012-02-28 | 2017-07-26 | Population Genetics Technologies Ltd. | Method for attaching a counter sequence to a nucleic acid sample |
| US8209130B1 (en) | 2012-04-04 | 2012-06-26 | Good Start Genetics, Inc. | Sequence assembly |
| US8812422B2 (en) | 2012-04-09 | 2014-08-19 | Good Start Genetics, Inc. | Variant database |
| US10227635B2 (en) | 2012-04-16 | 2019-03-12 | Molecular Loop Biosolutions, Llc | Capture reactions |
| KR101922124B1 (ko) | 2012-08-27 | 2018-11-26 | 삼성전자주식회사 | 시료 중 rna로부터 dna를 증폭하는 방법 |
| US10174366B2 (en) | 2012-11-14 | 2019-01-08 | Olink Bioscience Ab | Localised RCA-based amplification method |
| WO2014076214A1 (en) | 2012-11-14 | 2014-05-22 | Olink Ab | Rca reporter probes and their use in detecting nucleic acid molecules |
| JP6112652B2 (ja) * | 2012-11-29 | 2017-04-12 | 国立大学法人広島大学 | 標的dnaの特異的増幅方法 |
| WO2014130388A1 (en) * | 2013-02-20 | 2014-08-28 | Emory University | Methods of sequencing nucleic acids in mixtures and compositions related thereto |
| CA2904181A1 (en) | 2013-03-13 | 2014-10-09 | Anahit Aghvanyan | Sandwich immunoassay comprising anchoring reagent |
| US10114015B2 (en) | 2013-03-13 | 2018-10-30 | Meso Scale Technologies, Llc. | Assay methods |
| WO2014152421A1 (en) | 2013-03-14 | 2014-09-25 | Good Start Genetics, Inc. | Methods for analyzing nucleic acids |
| US10202500B2 (en) | 2013-03-15 | 2019-02-12 | Lubrizol Advanced Materials, Inc. | Heavy metal free CPVC compounds |
| EP3005200A2 (en) | 2013-06-03 | 2016-04-13 | Good Start Genetics, Inc. | Methods and systems for storing sequence read data |
| US9944998B2 (en) | 2013-07-25 | 2018-04-17 | Bio-Rad Laboratories, Inc. | Genetic assays |
| US9217167B2 (en) | 2013-07-26 | 2015-12-22 | General Electric Company | Ligase-assisted nucleic acid circularization and amplification |
| US9644232B2 (en) | 2013-07-26 | 2017-05-09 | General Electric Company | Method and device for collection and amplification of circulating nucleic acids |
| US11041203B2 (en) | 2013-10-18 | 2021-06-22 | Molecular Loop Biosolutions, Inc. | Methods for assessing a genomic region of a subject |
| US10851414B2 (en) | 2013-10-18 | 2020-12-01 | Good Start Genetics, Inc. | Methods for determining carrier status |
| GB201320145D0 (en) | 2013-11-14 | 2014-01-01 | Olink Ab | Localised RCA-based amplification method using a padlock-probe |
| GB201321123D0 (en) * | 2013-11-29 | 2014-01-15 | Linea Ab Q | Amplification of circular molecules |
| GB2520765A (en) | 2013-12-02 | 2015-06-03 | Vanadis Diagnostics Ab | Multiplex detection of nucleic acids |
| US10112194B2 (en) | 2014-04-14 | 2018-10-30 | Q-Linea Ab | Detection of microscopic objects |
| WO2015175530A1 (en) | 2014-05-12 | 2015-11-19 | Gore Athurva | Methods for detecting aneuploidy |
| KR102497054B1 (ko) | 2014-05-15 | 2023-02-06 | 메소 스케일 테크놀러지즈, 엘엘시 | 개선된 분석 방법 |
| WO2015189390A1 (en) | 2014-06-13 | 2015-12-17 | Q-Linea Ab | Method for detecting and characterising a microorganism |
| GB201413718D0 (en) | 2014-08-01 | 2014-09-17 | Olink Ab | Method for selecting a target nucleic acid sequence |
| GB201413717D0 (en) | 2014-08-01 | 2014-09-17 | Olink Ab | Method for selecting a target nucleic acid sequence |
| US11408024B2 (en) | 2014-09-10 | 2022-08-09 | Molecular Loop Biosciences, Inc. | Methods for selectively suppressing non-target sequences |
| JP2017536087A (ja) | 2014-09-24 | 2017-12-07 | グッド スタート ジェネティクス, インコーポレイテッド | 遺伝子アッセイのロバストネスを増大させるためのプロセス制御 |
| EP4098753A1 (en) * | 2014-10-23 | 2022-12-07 | Ricardo Mancebo | Reagents and methods for isothermal chain reaction |
| EP3271480B8 (en) | 2015-01-06 | 2022-09-28 | Molecular Loop Biosciences, Inc. | Screening for structural variants |
| GB201507026D0 (en) | 2015-04-24 | 2015-06-10 | Linea Ab Q | Medical sample transportation container |
| EP3303377B1 (en) | 2015-06-05 | 2022-11-23 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for transient gene therapy with enhanced stability |
| EP3653728B1 (en) | 2015-06-09 | 2023-02-01 | Life Technologies Corporation | Methods, systems, compositions, kits, apparatus and computer-readable media for molecular tagging |
| GB201511129D0 (en) | 2015-06-24 | 2015-08-05 | Linea Ab Q | Method of determining antimicrobial susceptibility of a microorganism |
| WO2017020023A2 (en) | 2015-07-29 | 2017-02-02 | Progenity, Inc. | Nucleic acids and methods for detecting chromosomal abnormalities |
| GB201518655D0 (en) | 2015-10-21 | 2015-12-02 | Olink Ab | Method for generating proximity probes |
| US20170298427A1 (en) | 2015-11-16 | 2017-10-19 | Progenity, Inc. | Nucleic acids and methods for detecting methylation status |
| GB2554767A (en) | 2016-04-21 | 2018-04-11 | Q Linea Ab | Detecting and characterising a microorganism |
| US10655170B2 (en) | 2016-07-06 | 2020-05-19 | Takara Bio Usa, Inc. | Coupling adaptors to a target nucleic acid |
| GB201614023D0 (en) | 2016-08-16 | 2016-09-28 | Olink Bioscience Ab | Double-stranded circle probes |
| GB201621514D0 (en) | 2016-12-16 | 2017-02-01 | Q-Linea Ab | Padlock probe detection method |
| WO2018183607A1 (en) | 2017-03-30 | 2018-10-04 | Pioneer Hi-Bred International, Inc. | Methods of identifying and characterizing gene editing variations in nucleic acids |
| AU2018251187B2 (en) | 2017-04-14 | 2024-03-28 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for transient gene therapy with enhanced stability |
| JP7240733B2 (ja) * | 2017-05-23 | 2023-03-16 | ラトガース,ザ ステート ユニバーシティ オブ ニュー ジャージー | デュアル相互作用ヘアピンプローブを使用した標的媒介in situシグナル増幅 |
| EP3682025A1 (en) | 2017-09-14 | 2020-07-22 | H. Hoffnabb-La Roche Ag | Novel method for generating circular single-stranded dna libraries |
| EP3682027A1 (en) | 2017-09-15 | 2020-07-22 | H. Hoffnabb-La Roche Ag | Hybridization-extension-ligation strategy for generating circular single-stranded dna libraries |
| CA3078158A1 (en) * | 2017-10-06 | 2019-04-11 | Cartana Ab | Rna templated ligation |
| WO2019068797A1 (en) | 2017-10-06 | 2019-04-11 | F. Hoffmann-La Roche Ag | CIRCULARIZATION METHODS FOR THE PREPARATION OF SAMPLE SAMPLES OF UNIQUE MOLECULES |
| WO2019086531A1 (en) | 2017-11-03 | 2019-05-09 | F. Hoffmann-La Roche Ag | Linear consensus sequencing |
| EP3749782B1 (en) | 2018-02-05 | 2022-11-02 | F. Hoffmann-La Roche AG | Generation of single-stranded circular dna templates for single molecule sequencing |
| US11898204B2 (en) | 2018-03-02 | 2024-02-13 | Roche Sequencing Solutions, Inc. | Generation of single-stranded circular DNA templates for single molecule sequencing |
| CA3095292A1 (en) | 2018-04-02 | 2019-10-10 | Progenity, Inc. | Methods, systems, and compositions for counting nucleic acid molecules |
| CN109444102B (zh) * | 2018-12-18 | 2021-03-23 | 济南大学 | 一种检测赭曲霉毒素a的荧光生物传感器及其制备方法和应用 |
| WO2020180645A1 (en) | 2019-03-01 | 2020-09-10 | Meso Scale Technologies, Llc. | Electrochemiluminescent labeled probes for use in immunoassay methods, methods using such and kits comprising same |
| EP3947718A4 (en) | 2019-04-02 | 2022-12-21 | Enumera Molecular, Inc. | METHODS, SYSTEMS AND COMPOSITIONS FOR COUNTING NUCLEIC ACID MOLECULES |
| GB201919032D0 (en) | 2019-12-20 | 2020-02-05 | Cartana Ab | Method of detecting an analyte |
| GB201919029D0 (en) | 2019-12-20 | 2020-02-05 | Cartana Ab | Method of detecting an analyte |
| US11492662B2 (en) | 2020-08-06 | 2022-11-08 | Singular Genomics Systems, Inc. | Methods for in situ transcriptomics and proteomics |
| WO2022032195A2 (en) | 2020-08-06 | 2022-02-10 | Singular Genomics Systems, Inc. | Spatial sequencing |
| WO2022056078A1 (en) * | 2020-09-11 | 2022-03-17 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Rnase h-assisted detection assay for rna (radar) |
| WO2022061305A1 (en) | 2020-09-21 | 2022-03-24 | Progenity, Inc. | Compositions and methods for isolation of cell-free dna |
| GB202203185D0 (en) | 2022-03-08 | 2022-04-20 | Rarity Bioscience Ab | Method for detecting nucleic acid amplification products |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5011769A (en) | 1985-12-05 | 1991-04-30 | Meiogenics U.S. Limited Partnership | Methods for detecting nucleic acid sequences |
| US5403711A (en) | 1987-11-30 | 1995-04-04 | University Of Iowa Research Foundation | Nucleic acid hybridization and amplification method for detection of specific sequences in which a complementary labeled nucleic acid probe is cleaved |
| AU649066B2 (en) * | 1990-07-25 | 1994-05-12 | Syngene, Inc. | Circular extension for generating multiple nucleic acid complements |
| JP3085409B2 (ja) | 1991-03-29 | 2000-09-11 | 東洋紡績株式会社 | 標的核酸配列の検出方法およびそのための試薬キット |
| US6077668A (en) * | 1993-04-15 | 2000-06-20 | University Of Rochester | Highly sensitive multimeric nucleic acid probes |
| US5714320A (en) | 1993-04-15 | 1998-02-03 | University Of Rochester | Rolling circle synthesis of oligonucleotides and amplification of select randomized circular oligonucleotides |
| AU8102694A (en) | 1993-11-17 | 1995-06-06 | Id Biomedical Corporation | Cycling probe cleavage detection of nucleic acid sequences |
| EP1260593A3 (en) | 1994-12-23 | 2003-12-03 | Dade Behring Inc. | Detection of nucleic acids by nuclease-catalyzed product formation |
| SE504798C2 (sv) | 1995-06-16 | 1997-04-28 | Ulf Landegren | Immunanalys och testkit med två reagens som kan tvärbindas om de adsorberats till analyten |
| US5854033A (en) * | 1995-11-21 | 1998-12-29 | Yale University | Rolling circle replication reporter systems |
| DK0862656T3 (da) | 1995-11-21 | 2001-04-09 | Univ Yale | Unimolekylær segmentamplifikation og -detektering |
| ATE324464T1 (de) | 1995-12-05 | 2006-05-15 | Jorn Erland Koch | Eine in kaskaden verlaufende vervielfältigungsreaktion von nukleinsäuren |
| US6124120A (en) | 1997-10-08 | 2000-09-26 | Yale University | Multiple displacement amplification |
| JP4493844B2 (ja) | 1998-03-25 | 2010-06-30 | ランデグレン、ウルフ | 錠型(padlock)プローブのローリングサークル複製 |
| US6037130A (en) * | 1998-07-28 | 2000-03-14 | The Public Health Institute Of The City Of New York, Inc. | Wavelength-shifting probes and primers and their use in assays and kits |
| US6235502B1 (en) * | 1998-09-18 | 2001-05-22 | Molecular Staging Inc. | Methods for selectively isolating DNA using rolling circle amplification |
| US6150112A (en) | 1998-09-18 | 2000-11-21 | Yale University | Methods for identifying DNA sequences for use in comparison of DNA samples by their lack of polymorphism using Y shape adaptors |
| CA2394800A1 (en) | 1998-12-15 | 2000-06-22 | Molecular Staging Inc. | A method of amplification of a circularised nucleic acid probe |
| US6830884B1 (en) * | 1998-12-15 | 2004-12-14 | Molecular Staging Inc. | Method of amplification |
| US6274320B1 (en) * | 1999-09-16 | 2001-08-14 | Curagen Corporation | Method of sequencing a nucleic acid |
| CA2392474A1 (en) | 1999-11-26 | 2001-05-31 | Jonathan M. Rothberg | Nucleic acid probe arrays |
| JP2003532380A (ja) | 1999-12-02 | 2003-11-05 | モレキュラー ステージング,インコーポレイテッド | 線状自己アニーリングセグメントからの一本鎖環状dnaの産出 |
| US6221603B1 (en) * | 2000-02-04 | 2001-04-24 | Molecular Dynamics, Inc. | Rolling circle amplification assay for nucleic acid analysis |
| US6291187B1 (en) | 2000-05-12 | 2001-09-18 | Molecular Staging, Inc. | Poly-primed amplification of nucleic acid sequences |
| US6350580B1 (en) * | 2000-10-11 | 2002-02-26 | Stratagene | Methods for detection of a target nucleic acid using a probe comprising secondary structure |
| US6573051B2 (en) * | 2001-03-09 | 2003-06-03 | Molecular Staging, Inc. | Open circle probes with intramolecular stem structures |
| GB2378245A (en) * | 2001-08-03 | 2003-02-05 | Mats Nilsson | Nucleic acid amplification method |
| SE0401270D0 (sv) | 2004-05-18 | 2004-05-18 | Fredrik Dahl | Method for amplifying specific nucleic acids in parallel |
-
2001
- 2001-08-03 GB GB0118959A patent/GB2378245A/en not_active Withdrawn
-
2002
- 2002-07-12 EP EP10003586.4A patent/EP2251439B1/en not_active Expired - Lifetime
- 2002-07-12 CA CA002455803A patent/CA2455803A1/en not_active Abandoned
- 2002-07-12 EP EP10003679.7A patent/EP2236622B1/en not_active Expired - Lifetime
- 2002-07-12 JP JP2003517293A patent/JP2004536617A/ja active Pending
- 2002-07-12 US US10/483,900 patent/US7320860B2/en not_active Expired - Lifetime
- 2002-07-12 WO PCT/SE2002/001378 patent/WO2003012119A2/en active Application Filing
- 2002-07-12 AU AU2002314693A patent/AU2002314693A1/en not_active Abandoned
- 2002-07-12 EP EP02741612.2A patent/EP1423532B1/en not_active Expired - Lifetime
- 2002-07-12 EP EP10003678A patent/EP2224016A1/en not_active Withdrawn
-
2007
- 2007-11-28 US US11/946,706 patent/US7790388B2/en not_active Ceased
-
2008
- 2008-12-12 JP JP2008316989A patent/JP4559517B2/ja not_active Expired - Lifetime
-
2009
- 2009-10-02 JP JP2009230088A patent/JP4675424B2/ja not_active Expired - Lifetime
-
2010
- 2010-06-01 JP JP2010125694A patent/JP5313204B2/ja not_active Expired - Lifetime
-
2011
- 2011-12-19 US US13/329,998 patent/USRE44265E1/en not_active Expired - Lifetime
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009077735A (ja) * | 2001-08-03 | 2009-04-16 | Biocyclica Ab | 核酸増幅方法 |
| JP4559517B2 (ja) * | 2001-08-03 | 2010-10-06 | オーリンク エイビー | 核酸増幅方法 |
| JP2008522628A (ja) * | 2004-12-11 | 2008-07-03 | サイトジェニックス, インコーポレイテッド | 高品質核酸のセルフリー生合成及びその使用 |
| JP2011505161A (ja) * | 2007-12-04 | 2011-02-24 | ピエール、ファーブル、メディカマン | 抗体ライブラリーを作製およびスクリーニングするための新規な方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US7790388B2 (en) | 2010-09-07 |
| EP1423532A2 (en) | 2004-06-02 |
| JP4559517B2 (ja) | 2010-10-06 |
| JP2010183916A (ja) | 2010-08-26 |
| EP2251439A1 (en) | 2010-11-17 |
| EP2251439B1 (en) | 2013-09-11 |
| WO2003012119A2 (en) | 2003-02-13 |
| GB0118959D0 (en) | 2001-09-26 |
| AU2002314693A1 (en) | 2003-02-17 |
| EP2236622A2 (en) | 2010-10-06 |
| US7320860B2 (en) | 2008-01-22 |
| EP1423532B1 (en) | 2013-05-22 |
| EP2236622A3 (en) | 2010-11-03 |
| CA2455803A1 (en) | 2003-02-13 |
| US20050287526A1 (en) | 2005-12-29 |
| EP2236622B1 (en) | 2017-09-06 |
| WO2003012119A3 (en) | 2003-11-13 |
| GB2378245A (en) | 2003-02-05 |
| JP2009077735A (ja) | 2009-04-16 |
| USRE44265E1 (en) | 2013-06-04 |
| US20080131899A1 (en) | 2008-06-05 |
| JP4675424B2 (ja) | 2011-04-20 |
| EP2224016A1 (en) | 2010-09-01 |
| JP5313204B2 (ja) | 2013-10-09 |
| JP2009297045A (ja) | 2009-12-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4559517B2 (ja) | 核酸増幅方法 | |
| JP6571895B1 (ja) | 核酸プローブ及びゲノム断片検出方法 | |
| CA2979858C (en) | Detection of target nucleic acid sequences by pto cleavage and extension assay in a liquid phase | |
| AU2010290277B2 (en) | TD probe and its uses | |
| EP2516679B1 (en) | Tsg primer target detection | |
| CA2790153C (en) | Thd primer target detection | |
| JPH02268683A (ja) | 単一プライマーを用いる核酸の増幅 | |
| CN115176030A (zh) | 检测分析物的方法 | |
| JP3909010B2 (ja) | 高度ダイナミックレンジを有する定量的多重pcr | |
| KR20230063086A (ko) | 분할된 t7 프로모터를 이용한 중증 급성 호흡기 증후군 코로나바이러스 2 검출 및/또는 이의 돌연변이 검출용 등온 단일 반응 프로브 세트 및 이의 용도 | |
| NZ706144B2 (en) | Detection of target nucleic acid sequences by pto cleavage and extension assay |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050530 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080613 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080912 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080922 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081014 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081021 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081112 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081119 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081128 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20081128 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090106 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090403 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090410 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090424 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090522 |